一种大肠杆菌发酵培养基及发酵培养方法和应用与流程
本发明属于发酵技术领域,具体涉及一种大肠杆菌发酵培养基及发酵培养方法,尤其涉及一种大肠杆菌高密度发酵培养基及利用该培养基进行高密度发酵的培养方法和应用。
背景技术:
发酵工程是指采用工程技术手段,利用生物(主要是微生物)和有活性的离体酶的某些功能,为人类生产有用的生物产品,或直接用微生物参与控制某些工业生产过程的一种技术。人们熟知的利用酵母菌发酵制造啤酒、果酒、工业酒精,乳酸菌发酵制造奶酪和酸牛奶,利用真菌大规模生产青霉素等都是这方面的例子。随着科学技术的进步,发酵技术也有了很大的发展,并且已经进入能够人为控制和改造微生物,使这些微生物为人类生产产品的现代发酵工程阶段。现代发酵工程作为现代生物技术的一个重要组成部分,具有广阔的应用前景。例如,用基因工程的方法有目的地改造原有的菌种并且提高其产量;利用微生物发酵生产药品,如人的胰岛素、干扰素和生长激素等。
近几年,人们对高密度发酵进行研究并取得了较大的进展。实现高密度、高产率和高密度培养是目前发酵工业的目标和方向。对于大肠杆菌,尤其是重组大肠杆菌,实现高密度发酵不仅可相应减少反应物体积,降低生物量的分离费用,还可以缩短生产周期、减少设备投资,从而达到降低成本、提高生产效率的目的。
目前,大肠杆菌高密度发酵使用的培养基均为半合成培养基,其中含有蛋白胨及酵母提取物,由于动物源蛋白胨具有一些明显的缺陷,如存在潜在的病毒污染风险,成分不明确和不利于发酵产物的纯化等。因此,疫苗、抗体和干扰素等生物制药领域对动物源蛋白胨安全性上的顾虑逐渐增加,而采用植物来源的蛋白胨或者使用无机盐合成型进行发酵时,往往会出现高密度低表达的情况。
因此,提供一种大肠杆菌,尤其是重组大肠杆菌,且不含动物源蛋白胨的高密度发酵培养基对本领域而言具有重要的意义。
技术实现要素:
鉴于现有技术中存在的问题,本发明的目的在于提供一种大肠杆菌发酵培养基及发酵培养方法和应用。所述发酵培养基中不包含动物源蛋白胨,采用植物源蛋白胨作为发酵培养基中的氮源,为大肠杆菌的生长过程提供营养,并且不会出现高密度低表达的情况。
为达此目的,本发明采用以下技术方案:
第一方面,本发明提供一种大肠杆菌发酵培养基,包括如下组分:
本发明提供的大肠杆菌发酵培养基能够实现大肠杆菌的高密度培养与蛋白的高表达,即使用其发酵时,大肠杆菌尤其是重组大肠杆菌的密度较高,且并不会出现高密度低表达的情况,其发酵培养的效果与无机盐培养基相比效果较好,与动物源发酵培养基相比,菌体量和蛋白表达均与采用动物蛋白胨基本一致,效果相当;且植物源蛋白胨例如玉米浆干粉价格低廉,与动物来源的蛋白胨相比成本较低;同时,植物源蛋白胨无潜在的病毒污染风险。
本发明中,所述植物源蛋白胨的质量浓度为20g/l、25g/l、28g/l、30g/l、32g/l、35g/l、38g/l、40g/l、42g/l、45g/l、48g/l或50g/l等;所述甘油的质量浓度为20g/l、25g/l、28g/l、30g/l、32g/l、35g/l、38g/l、40g/l、42g/l、45g/l、48g/l或50g/l等;所述磷酸氢二钾的质量浓度为10g/l、12g/l、15g/l、18g/l、20g/l、22g/l或25g/l等;所述氯化钠的质量浓度为5g/l、6g/l、7g/l、8g/l、9g/l或10g/l等;所述七水硫酸镁的质量浓度为0.1g/l、0.2g/l、0.3g/l、0.5g/l、0.6g/l、0.8g/l或1g/l等。
作为本发明优选的技术方案,所述植物源蛋白胨可以以多种形式存在,包括干浆粉、浸粉或蛋白胨等,包括玉米干浆粉、玉米浸粉、马铃薯浸粉、豆粕提取物、大豆蛋白胨、小麦蛋白胨或棉籽蛋白胨中的任意一种或至少两种的组合,优选为玉米干浆粉。
优选地,所述碳源包括甘油和/或葡萄糖,优选为葡萄糖。
优选地,所述磷酸盐包括磷酸氢二钾和/或磷酸二氢钾。
优选地,所述钠盐包括氯化钠。
优选地,所述镁盐包括硫酸镁,优选为七水硫酸镁。
本发明中磷酸氢二钾、氯化钠、七水硫酸镁为最佳组合,利用该组合得到的发酵培养基发酵效果最好。
作为本发明优选的技术方案,所述大肠杆菌发酵培养基由如下组分组成:
第二方面,本发明提供一种大肠杆菌的发酵培养方法,所述发酵培养方法中使用如第一方面所述的培养基作为发酵培养基。
作为本发明优选的技术方案,所述发酵培养方法包括如下步骤:
(1)将大肠杆菌活化后接种于一级种子培养基中,振荡培养得到一级种子液;
(2)将所述一级种子液转接至二级种子培养基中,振荡培养得到二级种子液;
(3)将所述二级种子液转接至发酵培养基中,发酵,所述发酵过程中调节ph并加入补料培养基继续培养。
作为本发明优选的技术方案,所述一级种子培养基包括lb培养基。所述lb培养基为实验室常用的lb培养基,包括:酵母提取物5g/l、胰蛋白胨10g/l和氯化钠10g/l。
优选地,所述二级种子培养基包括:玉米浆干粉10~30g/l(例如可以是10g/l、12g/l、15g/l、20g/l、22g/l、25g/l、28g/l或30g/l等)、磷酸氢二钾10~25g/l(例如可以是10g/l、12g/l、15g/l、20g/l、22g/l、24g/l或25g/l等)、氯化钠5~10g/l(例如可以是5g/l、6g/l、7g/l、8g/l、9g/l或10g/l等)、七水硫酸镁0.1~1g/l(例如可以是0.1g/l、0.2g/l、0.4g/l、0.5g/l、0.6g/l、0.8g/l或1g/l等)和甘油5~20g/l(例如可以是5g/l、6g/l、8g/l、10g/l、12g/l、15g/l、18g/l或20g/l等)。
本发明中,所述二级种子培养基的成分与发酵培养基的成分保持一致,仅各成分的浓度作出了一定的调整,有利于减少发酵罐的培养时间;若使用lb培养基作为二级种子培养基,会使二级种子夜转移至发酵罐中前期的培养时间延长,造成发酵周期长。
优选地,所述补料培养基包括:甘油200~500g/l(例如可以是200g/l、220g/l、240g/l、250g/l、280g/l、300g/l、350g/l、400g/l、450g/l或500g/l等)和七水硫酸镁1~10g/l(例如可以是1g/l、2g/l、3g/l、4g/l、5g/l、6g/l、7g/l、8g/l、9g/l或10g/l等)
优选地,所述补料培养基还包括玉米浆干粉0~200g/l(例如可以是1g/l、10g/l、20g/l、40g/l、80g/l、100g/l、120g/l、150g/l、180g/l或200g/l等)。
本发明在补料中可以不添加玉米浆干粉,不影响菌株生长,但是od值和菌体湿重偏低。
本发明中,所述发酵培养基可以培养多种不同的大肠杆菌。作为本发明优选的技术方案,步骤(1)所述大肠杆菌包括表达烟酰胺磷酸核糖转移酶和/或烟酰胺单核苷酸腺苷转移酶的重组大肠杆菌。
本发明中,所述表达烟酰胺磷酸核糖转移酶的重组大肠杆菌可以是nampt-pet29a/bl21(de3),所述表达烟酰胺单核苷酸腺苷转移酶的重组大肠杆菌可以是nmnat-pet29a/bl21(de3)。
同时,此处并不对烟酰胺磷酸核糖转移酶以及烟酰胺单核苷酸腺苷转移酶的来源作出特定的限制,例如所述烟酰胺单核苷酸腺苷转移酶可以选自来源于海沼甲烷球菌(methanococcusmaripaludis),包括野生型及其突变体。
优选地,步骤(1)所述活化的温度为30~37℃(例如可以是31℃、32℃、33℃、34℃、35℃或36℃等),时间为16~24h(例如可以是17h、18h、19h、20h、21h、22h或23h等)。
优选地,步骤(1)所述振荡培养的温度为30~37℃(例如可以是31℃、32℃、33℃、34℃、35℃或36℃等),时间为6~12h(例如可以是7h、8h、9h、10h或11h等)。
优选地,步骤(1)所述振荡培养的转速为100~200rpm(例如可以是110rpm、120rpm、130rpm、140rpm、150rpm、160rpm、170rpm、180rpm或190rpm等)。
作为本发明优选的技术方案,步骤(2)所述转接的接种量为1%~1.5%(例如可以是1.1%、1.15%、1.2%、1.25%、1.3%、1.35%、1.4%或1.45%等)。
优选地,步骤(2)所述振荡培养的温度为30~37℃(例如可以是31℃、32℃、33℃、34℃、35℃或36℃等),时间为6~12h(例如可以是7h、8h、9h、10h或11h等)。
优选地,步骤(2)所述振荡培养的转速为100~200rpm(例如可以是110rpm、120rpm、130rpm、140rpm、150rpm、160rpm、170rpm、180rpm或190rpm等)。
作为本发明优选的技术方案,步骤(3)所述转接的接种量为10%~15%(例如可以是11%、11.5%、12%、12.5%、13%、13.5%、14%或14.5%等)。
优选地,步骤(3)所述发酵的温度为30~37℃(例如可以是31℃、32℃、33℃、34℃、35℃或36℃等)。
优选地,步骤(3)所述发酵的转速为300~700rpm(例如可以是320rpm、350rpm、400rpm、450rpm、500rpm、550rpm、600rpm、620rpm或650rpm等)。
优选地,步骤(3)所述发酵的通气量为0.8~1.2vvm(例如可以是0.85vvm、0.9vvm、0.95vvm、1vvm、1.05vvm、1.1vvm或1.15vvm等)。
优选地,步骤(3)所述发酵的溶氧量为30%~50%(例如可以是32%、34%、35%、36%、40%、42%、45%、48%或49%等)。
作为本发明优选的技术方案,所述发酵培养方法包括如下步骤:
(1)将大肠杆菌接种于lb平板上,30~37℃活化16~24h,而后接种于一级种子培养基中,所述一级种子培养基为lb培养基,100~200rpm、30~37℃下振荡培养为6~12h,得到一级种子液;
(2)将所述一级种子液以1%~1.5%的接种量转接至二级种子培养基中,所述二级种子培养基包括:玉米浆干粉10~30g/l、磷酸氢二钾10~25g/l、氯化钠5~10g/l、七水硫酸镁0.1~1g/l和甘油5~20g/l;
在100~200rpm、30~37℃的条件下振荡培养6~12h得到二级种子液;
(3)将所述二级种子液以10%~15%的接种量转接至发酵培养基中,所述发酵培养基包括:玉米干浆粉20~25g/l、甘油20~30g/l、磷酸氢二钾10~15g/l、氯化钠5~8g/l和七水硫酸镁0.3~0.6g/l;
在300~700rpm、30~37℃的条件下进行发酵,所述发酵过程中通气量为0.8~1.2vvm,溶氧量为30%~50%,使用稀硫酸或者氨水调节溶液的ph值为6.8~7.4,并以溶氧恒定方式加入补料培养基继续培养。
示例性的,本发明提供一种大肠杆菌高密度发酵培养方法,包括以下步骤:
(1)一级种子液的制备
取甘油管保存的菌液划线于lb培养基上,30~37℃培养箱培养16~24后,获得平板;从平板上挑取单克隆接种于lb一级种子培养基中,在30~37℃摇床100~200rpm振荡培养6~12h,得到一级lb种子液,其中所述lb培养基的配方为:酵母提取物5g/l,胰蛋白胨10g/l,氯化钠10g/l。
(2)二级种子液的制备
按1%(v/v)的比例将一级lb种子液接种于发300ml二级种子培养基的三角瓶中,30~37℃摇床100~200rpm振荡培养6~12h,得到二级种子液。
所述二级种子培养基的配方为:玉米浆干粉10~30g/l,磷酸氢二钾10~25g/l、氯化钠5~10g/l、七水硫酸镁0.1~1g/l,甘油5~20g/l。
(3)将二级种子液接种接入发酵培养基中,进行发酵培养
按10%(v/v)的比例将二级种子液接种至发酵培养基的50l发酵罐中,发酵罐起始装液量为30l,在30~37℃、通气量为1vvm,溶氧控制在30%以上,转速300~700rpm的条件下进行发酵培养,发酵过程中,使用10%稀硫酸或者氨水调节ph值至7.0,当培养基中的甘油耗尽后,以溶氧恒定方式进行补料,补料至od600为30左右,加入终浓度为0.2mmol/liptg诱导12小时后放罐。
需要说明的是,本发明中所述“高密度”是指菌体湿重超过100g/l。
第三方面,本发明还提供一种如第一方面所述的大肠杆菌发酵培养基在表达药用蛋白中的应用。
本发明中,所述大肠杆菌发酵培养基中以植物源蛋白胨作为氮源,相比动物源蛋白而言,无潜在的病毒污染风险,适用于药用蛋白的表达,具有较高的生物安全性。
所述药用蛋白包括可以使用大肠杆菌进行表达的蛋白,包括但不限于烟酰胺单核苷酸腺苷转移酶等,同时不限制所述蛋白的来源,也不对野生型和突变体进行限制;即所述大肠杆菌发酵培养基可以培养多种来源的目的蛋白及其突变体。
本发明所述的数值范围不仅包括上述列举的点值,还包括没有列举出的上述数值范围之间的任意的点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
与现有技术相比,本发明至少具有以下有益效果:
(1)本发明中仅以植物来源的蛋白胨作为大肠杆菌的高密度发酵培养基,在发酵过程中,克服了使用植物源蛋白胨培养基时出现的高密度低表达的情况,其菌体量和蛋白表达均与采用动物蛋白胨基本一致,而且使用玉米浆干粉价格低廉,无潜在的病毒污染风险,在疫苗、抗体和干扰素等生物制药领域具有广泛的应用前景;
(2)本发明提供的发酵培养方法利用植物源蛋白胨作为氮源的发酵培养基,对大肠杆菌进行高密度培养,所述发酵培养方法过程简单,大肠杆菌经活化、一级培养、二级培养、发酵和调节ph等过程后,所得菌体中蛋白表达量与动物源蛋白胨作为发酵培养基时的蛋白表达量相当,蛋白表达效果较好,在发酵19.5~22h后,菌体湿重为110~165g/l,最高可达165g/l。
附图说明
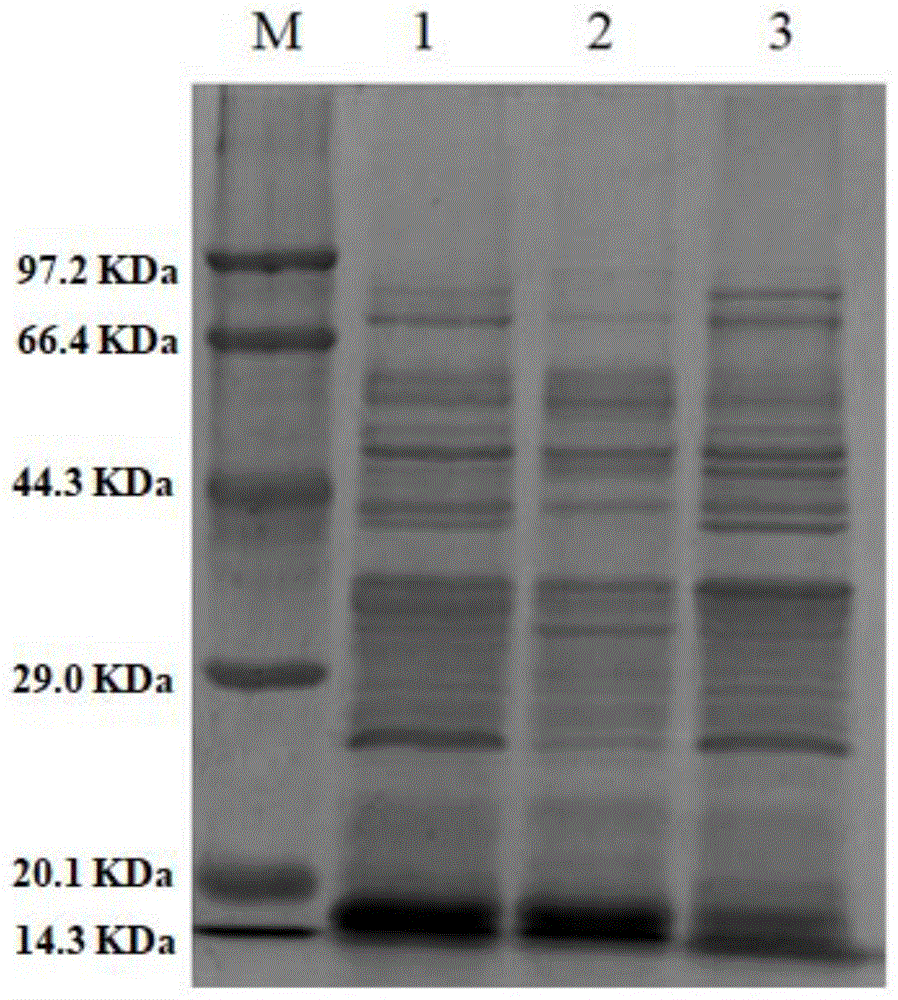
图1为应用例1、对比应用例1和对比应用例2发酵后所得菌体破碎后上清经蛋白凝胶电泳后得到的蛋白电泳图;
其中,泳道m表示蛋白marker,泳道1对应应用例1,泳道2对应对比应用例1,泳道3对应对比应用例2。
具体实施方式
下面结合附图并通过具体实施方式来进一步说明本发明的技术方案,但下述的实例仅仅是本发明的简易例子,并不代表或限制本发明的权利保护范围,本发明的保护范围以权利要求书为准。
实施例1
本实施例中提供一种大肠杆菌发酵培养基,具体由如下组分组成:
玉米浆干粉20g/l、甘油20g/l、磷酸氢二钾15g/l、氯化钠5g/l、七水硫酸镁0.5g/l;将上述组分按浓度混合制备后,灭菌,所述灭菌的温度为121℃,所述灭菌的时间为30min,灭菌完成后备用。
实施例2
本实施例中提供一种大肠杆菌发酵培养基,具体由如下组分组成:
玉米浆干粉50g/l、甘油50g/l、磷酸氢二钾10g/l、氯化钠5g/l、七水硫酸镁0.1g/l;将上述组分按浓度混合制备后,灭菌,所述灭菌的温度为121℃,所述灭菌的时间为30min,灭菌完成后备用。
实施例3
本实施例中提供一种大肠杆菌发酵培养基,具体由如下组分组成:
马铃薯浸粉20g/l、甘油20g/l、磷酸氢二钾25g/l、氯化钠10g/l、七水硫酸镁1g/l;将上述组分按浓度混合制备后,灭菌,所述灭菌的温度为121℃,所述灭菌的时间为30min,灭菌完成后备用。
实施例4
本实施例中提供一种大肠杆菌发酵培养基,与实施例1的区别在于,将玉米干浆粉替换为大豆蛋白胨,其余组分与实施例1保持一致。
实施例5
本实施例中提供一种大肠杆菌发酵培养基,与实施例1的区别在于,将甘油替换为葡萄糖,其余组分与实施例1保持一致。
实施例6
本实施例中提供一种大肠杆菌发酵培养基,与实施例1的区别在于,玉米浆干粉的浓度调整为15g/l,甘油的浓度调整为25g/l。
实施例7
本实施例中提供一种大肠杆菌发酵培养基,与实施例1的区别在于,玉米浆干粉的浓度调整为30g/l,甘油的浓度调整为10g/l。
实施例8
本实施例中提供一种大肠杆菌发酵培养基,与实施例1的区别在于,将磷酸氢二钾替换为磷酸氢二钠,其余组分与实施例1保持一致。
实施例9
本实施例中提供一种大肠杆菌发酵培养基,与实施例1的区别在于,将七水硫酸镁替换为氯化镁,其余组分与实施例1保持一致。
对比例1
本对比例中提供一种大肠杆菌发酵培养基,具体由如下组分组成:
酵母提取物24g/l、牛骨蛋白胨12g/l、磷酸氢二钾12.5g/l、磷酸二氢钾2.3g/l、七水硫酸镁0.5g/l和甘油10g/l;灭菌温度为121℃,灭菌时间为30min。
对比例2
本对比例中提供一种大肠杆菌发酵培养基,具体由如下组分组成:
磷酸氢二钠6g/l、磷酸二氢钾3g/l、七水硫酸镁0.246g/l、硫酸铵2.24g/l,氯化钠0.5g/l和葡萄糖20g/l;灭菌温度为121℃,灭菌时间为30min。
对比例3
本对比例中提供一种大肠杆菌发酵培养基,与实施例1的区别在于,将玉米干浆粉替换为酵母提取物,其余组分与实施例1保持一致。
对比例4
本对比例中提供一种大肠杆菌发酵培养基,与实施例1的区别在于,将玉米干浆粉替换为牛骨蛋白胨,其余组分与实施例1保持一致。
应用例1
本应用例中以50l发酵罐为例,利用实施例1中的发酵培养基提供一种高密度的大肠杆菌发酵培养方法。
以cn110373397a中实施例1构建的表达烟酰胺磷酸核糖转移酶(nampt)的重组大肠杆菌nampt-pet29a/bl21(de3)为发酵菌株,其发酵培养的具体操作步骤如下:
(1)将重组大肠杆菌接种至lb固体培养上进行培养,于37℃培养16小时;
(2)配置摇瓶lb作为一级种子培养基,lb一级种子培养基的组成:酵母提取物浓度为5g/l、蛋白胨浓度为10g/l、氯化钠浓度为10g/l;
培养基配置后,115℃灭菌20min后,挑取单克隆接种至一级种子培养基培养,于37℃振荡培养6小时,得到重组大肠杆菌一级种子液;
(3)配制二级种子培养基,包括:玉米浆干粉10g/l,磷酸氢二钾10g/l、氯化钠5g/l、七水硫酸镁0.5g/l,甘油10g/l;
培养基配置后,115℃灭菌20分钟,按1%(v/v)的比例将一级lb种子液接种于含有300ml二级种子培养基的三角瓶中,37℃下以200rpm的速度在摇床中振荡培养12小时,得到二级种子液;
(4)按10%(v/v)的比例将二级种子液接种至实施例1所述的发酵培养基中,发酵罐的起始装液量为30l,在37℃、通气量为1vvm、转速500rpm的条件下进行发酵培养,发酵过程中溶氧控制在30%以上,使用10%稀硫酸或氨水调节ph值至7.0,当培养基中的甘油耗尽后,以溶氧恒定方式进行补料,补料培养基的配方为:甘油300g/l,七水硫酸镁10g/l,玉米浆干粉100g/l;
补料后培养至od600为30左右,加入终浓度为0.2mmol/liptg诱导12小时后放罐。
应用例2~9
与应用例1的区别在于,将发酵培养基分别替换为实施例2(应用例2)、实施例3(应用例3)、实施例4(应用例4)、实施例5(应用例5)、实施例6(应用例6)、实施例7(应用例7)、实施例8(应用例9)、实施例9(应用例9)提供的发酵培养基。
对比应用例1
本对比应用例中以50l发酵罐为例,利用对比例1中的发酵培养基提供一种大肠杆菌发酵培养方法。
其与应用例1的区别在于:
将发酵培养基替换为对比例1提供的发酵培养基,二级种子培养基的成分与发酵培养基保持一致,且补料培养基中添加的也为动物源蛋白质。
其中,二级种子培养基包括:酵母提取物24g/l、牛骨蛋白胨12g/l、磷酸氢二钾12.5g/l、磷酸二氢钾2.3g/l和甘油5g/l;补料培养基的配方为:酵母粉100g/l、牛骨蛋白胨50g/l、甘油500g/l。
其余培养步骤与应用例1保持一致。
对比应用例2
本对比应用例中以50l发酵罐为例,利用对比例2中的发酵培养基提供一种高密度的大肠杆菌发酵培养方法。
其与应用例1的区别在于:
将发酵培养基替换为对比例1提供的发酵培养基;二级lb种子培养基的组成为:酵母提取物浓度为5g/l,蛋白胨浓度为10g/l,氯化钠浓度为10g/l;补料培养基的配方为:葡萄糖600g/l,七水硫酸镁10g/l。
其余培养步骤与应用例1保持一致。
对比应用例3
与应用例1的区别在于,将发酵培养基分别替换为对比例3提供的发酵培养基。
对比应用例4
与应用例1的区别在于,将发酵培养基分别替换为对比例4提供的发酵培养基。
对比应用例5
与应用例1的区别在于,将二级种子培养基替换为对比应用例1中使用的二级种子培养基,即所用的二级种子培养基与发酵培养基的成分不一致。
结果分析
应用例1、对比应用例1和对比应用例2发酵后的蛋白表达量如图1所示。
其中,泳道m表示蛋白marker,泳道1表示应用例1中所得菌体破碎后上清经蛋白凝胶电泳后得到的蛋白电泳图,泳道2对应对比应用例1,泳道3对应对比应用例2。
由图可知,应用例1与对比应用例1中均表达了大量的目的蛋白,目的蛋白的条带接近20.1kda,与其理论值19.8kda相同。因此,目的蛋白在本发明中提供的培养基中能够实现高表达,其表达量与含有动物源蛋白胨(对比应用例1)中的表达量相近,并且高于无机盐培养基(对比应用例2)中的表达量。
应用例1~9与对比应用例1~5的发酵数据见表1。
表1
结合上表及图1可知,本发明中提供的发酵培养基能够实现大肠杆菌的高密度培养。
由应用例1、对比应用例1和2比较可知,本发明中提供的发酵培养基中虽然不含动物源蛋白胨,但是发酵后其菌体湿重并不低于含有动物源蛋白胨的对比应用例1,且相比于对比应用例2,其菌体湿重明显大于仅含无机盐成分的培养基发酵得到的菌体湿重,且发酵周期较短;
由应用例1、对比应用例3和4比较可知,若将本发明中发酵培养基的玉米干浆粉替换为酵母提取物或牛骨蛋白胨,其发酵结果较为相近,然而,动物源蛋白胨的成本远高于植物源,因此,本发明提供的发酵培养基成本较低;
由应用例1和对比应用例5比较可知,在发酵过程中,应尽量保持二级种子培养基与发酵培养基的成分一致,否则会导致发酵时间明显延长;
由应用例1和应用例4和5比较可知,碳源与氮源的最优选应该为玉米干浆粉和葡萄糖;且由应用例1、应用例2和3以及应用例6和7比较可知,玉米浆干粉与甘油的浓度需要保持在合适的浓度范围,其中一种过高或者过低都可能会影响发酵结果;由应用例1、应用例8和9比较可知,若将本发明中发酵培养基的无机盐成分替换为其他的无机盐,其发酵效果会受到较为明显的影响;
综上所述,本发明提供的发酵培养基克服了使用植物源蛋白胨培养基时出现的高密度低表达的情况,其菌体量和蛋白表达均与采用动物蛋白胨基本一致,而且使用玉米浆干粉价格低廉,无潜在的病毒污染风险,在疫苗、抗体和干扰素等生物制药领域具有广泛的应用前景。
申请人声明,以上所述仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,所属技术领域的技术人员应该明了,任何属于本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!