一种检测鹅种蛋合格率的分子标记方法与流程
[0001]
本发明涉及一种检测鹅种蛋合格率的分子标记方法,主要涉及分子生物学领域。
背景技术:
[0002]
单核苷酸多态性(single nucleotide polymorphism,snp),主要指在基因组系列上有单个核苷酸的变异所引起的dna序列的多态性。是动植物基因组可遗传变异中最常见的一种变异,广泛存在基因组中。snp具有突变率低、准确性和稳定性高,被广泛应用于动植物的分子标记之一。在定位疾病靶基因、动植物育种过程中个体筛选、物种进化过程的分析和亲缘关系鉴定等方面广泛的应用。
[0003]
我国是养鹅最多的国家,但由于各种原因,养鹅业的发展速度较慢,尤其是规模化养鹅的效益较差,甚至出现亏损的现象,究其原因,繁殖性能低下是制约养鹅生产发展的重要因素之一。大多数鹅的繁殖具有季节性、就巢性等特点,这就导致母鹅产蛋量很低,增加了种鹅的繁殖成本,提高了商品鹅的生产成本,严重制约了产业的发展。鹅繁殖性状受环境因素影响较大,很难由表型选择得到正确的基因型,这就限制了传统数量遗传学在繁殖性状改良中的应用,使得传统选育进展甚微。分子遗传标记为解决这一棘手问题提供了良好的契机,是有效的展开高产新品种鹅分子育种的关键。
[0004]
四川白鹅是季节性繁殖水禽之一,具有抗逆性强、适应性好、耐粗饲、抗病性强和耐粗饲等特点,为广大消费者提供肉、蛋、羽绒、肥肝等。在中国各地被广泛饲养并被进一步用于其他品种的改良和创制。种蛋合格率性状是重要的经济性状,也是复杂的数量性状,且均受到遗传、营养、饲养方式、外界环境等影响。利用生物学等方法进行研究,鸭体尺、鸡蛋壳颜色等分子标记被发现及广泛应用到分子标记辅助选择,极大地推进了禽类种蛋合格率等方面的研究进展。四川白鹅繁殖具有季节性,每年九月份至次年五月份产蛋,其余时间休产。这种独特的习性导致母鹅产蛋量较低,增加了种鹅的繁殖成本,提高了商品鹅的生产成本,严重影响经济效益,制约了养鹅业的发展。而且由于种蛋合格率性状的选择是一个长时间人工选育的过程,收到选择性状、检测指标方法、成本、营养水平、性状检测技术手段以及环境等原因的作用,大大提高了对种蛋合格率性状选育的难度,同时也进一步限制了鹅产业进一步利用的可能。
[0005]
鹅种蛋合格率是评定鹅繁殖力的重要指标之一,是指母鹅在70周龄以内所产的符合本品种、品系要求的种蛋数占总产蛋数的百分比。种蛋合格率直接影响鹅的孵化率和雏鹅的质量,直接增加鹅产业的经济效益,显著降低饲养成本。种蛋合格率受到遗传、环境和疾病等多方面影响。但目前尚没有相应的检测手段判断鹅种蛋合格率的高低。传统的方法耗费大量的人力、物力检测种蛋合格率,成本较大;且针对鹅产蛋合格率对应到相应母鹅进行选育难度较大。
技术实现要素:
[0006]
针对以上现有技术的不足,本发明提出一种检测鹅种蛋合格率的分子标记方法,
利用分子标记的方法对种蛋合格率较高的母鹅进行选育,能够快速且精准的在雏鹅阶段对具有目标性状的个体进行选育,大大提高了选育的效率,并减少了饲养的成本。
[0007]
为达到上述目的,本发明的技术方案是:包括如下步骤:s1:以待检测鹅的全基因组重测序数据比对到参考基因组序列,结合待检测鹅种蛋合格率数据,通过全基因组关联分析,筛选获得待测鹅蛋合格率的候选的7个snp位点;s2:经过飞行时间质谱的技术检验7个snp位点(snp289,snp290,snp292,snp294,snp296,snp297和snp298)和1个单倍型模块(由snp290,snp292,snp294,snp296和snp297等5个snp构建)在四川白鹅个体中的分布频率,并与种蛋合格率性状做关联分析,结果表明上述snp位点和单倍型模块与种蛋合格率性状显著或极显著相关。
[0008]
优选地,d1:对产蛋前期的待检测鹅母鹅的翅静脉采血,并提取全基因组dna;d2:将步骤d1中的dna进行pcr反应,体系5μl:10*buffer 0.5μl,mg
2+
0.4μl,dntp 0.1μl,hotstar 0.2μl,上下游引物混合物1μl,三蒸水1.8μl,待检测dna样品1μl(20ng-50ng);pcr扩增程序:预变性95℃2min,45个循环(95℃变性30s,56℃退火30s,72℃延伸60s,)72℃延伸5min,25℃保存。
[0009]
优选地,d3:sap酶消化反应:按照下述顺序配制sap酶mix反应物总体积2*460μl,三蒸水1.53*460μl,sapbuffer 0.17*460μl,sapenzyme 0.3*460μl,按照下述程序,在pcr仪中进行sap酶消化:37℃40min,85℃5min,25℃保存。
[0010]
优选地,d4:单碱基延伸反应:按照下述顺序配制单碱基延伸反应mix:反应物体系2*460μl,三蒸水0.619*460μl,10*iplexbuffer 0.2*460μl,terminatormix 0.2*460μl,单碱基延伸探针0.94*460μl,单碱基延伸酶0.041*460μl;按照下述程序,在pcr仪中进行单碱基延伸反应:预变性94℃30s,94℃5s,52℃5s,80℃5s,72℃3min,25℃保存。
[0011]
优选地,d5:树脂纯化:将反应产物的384孔板中加入16μl三蒸水,在离心机中离心2000转离心3min;加入树脂,在反转摇匀仪上做树脂纯化反应35min,脱盐;反应完成后在离心机中离心2000转离心3min;将脱盐处理后的样品点在样品靶上,自然结晶。
[0012]
优选地,d6:质谱检测及数据分析:将d1-d5所得的反应结果在核酸飞行质谱仪进行检测,利用typer4.0软件检测质谱峰,并根据质谱峰图判读各样本目标位点基因型。
[0013]
优选地,检测7个snp分子标记引物对为:
[0014][0015]
本发明的技术原理及有益效果如下:本技术方案利用分子标记的方法对种蛋合格率较高的母鹅进行选育,能够快速且精准的在雏鹅阶段对具有目标性状的个体进行选育,大大提高了选育的效率,并减少了饲养的成本。
附图说明
[0016]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例描述
中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的其中11幅,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0017]
图1为本发明实施例的7个snp分子标记的飞行质谱引物图表;
[0018]
图2为本发明实施例的7个snp分子标记的及单倍型模块的频率图表;
[0019]
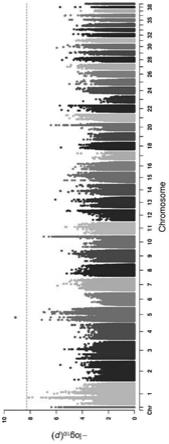
图3为本发明实施例的种蛋合格率性状与全基因组snp位点的全基因组关联分析结果;
[0020]
图4为本发明实施例的位于染色体1的紧密连锁的单倍型图;
[0021]
图5为本发明实施例的snp289飞行质谱的结果。注:no call:检测失败个体;c:cc基因型;t:tt基因型。
[0022]
图6为本发明实施例的snp290飞行质谱的结果。注:no call:检测失败个体;t:tt基因型;c:cc基因型。
[0023]
图7为本发明实施例的snp292飞行质谱的结果。注:no call:检测失败个体;t:tt基因型;c:cc基因型。
[0024]
图8为本发明实施例的snp294飞行质谱的结果。注:no call:检测失败个体;g:gg基因型;a:aa基因型。
[0025]
图9为本发明实施例的snp296飞行质谱的结果。注:no call:检测失败个体;g:gg基因型;a:aa基因型。
[0026]
图10为本发明实施例的snp297飞行质谱的结果。注:no call:检测失败个体;a:aa基因型;t:tt基因型。
[0027]
图11为本发明实施例的snp298飞行质谱的结果。注:no call:检测失败个体;g:gg基因型;t:tt基因型。
具体实施方式
[0028]
下面将结合附图,对本发明中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的较佳实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0029]
实施例
[0030]
如图1所示,本发明实施例包括以下步骤:
[0031]
四川白鹅的全基因组重测序数据比对到参考基因组序列,结合四川白鹅种蛋合格率数据,通过全基因组关联分析(gwas)的方法,筛选获得鹅种蛋合格率的候选的7个snp位点。经过飞行时间质谱的技术检验7个snp位点和5个snp位点(snp290,snp292,snp294,snp296和snp297)构建单倍型模块在四川白鹅个体中的分布频率并且做关联分析,上述snp位点和单倍型模块与种蛋合格率性状显著或极显著相关(p<0.05或p<0.01)。
[0032]
检测7个snp分子标记引物如图1所示:飞行质谱引物
[0033]
所述重测序为四川白鹅全基因组重测序序列,所述参考基因组为四川白鹅参考基因组序列。所述的方法包括以下步骤:
[0034]
d1:对产蛋前期的四川白鹅母鹅的翅静脉采血,并提取全基因组dna;
[0035]
d2:将步骤s1中的dna进行pcr反应,体系5μl:10*buffer 0.5μl,mg
2+
0.4μl,dntp 0.1μl,hotstar 0.2μl,上下游引物混合物1μl,三蒸水1.8μl,待检测dna样品1μl(20ng-50ng)。pcr扩增程序:预变性95℃2min,45个循环(95℃变性30s,56℃退火30s,72℃延伸60s)72℃延伸5min,25℃保存。
[0036]
d3:sap酶消化反应:按照下述顺序配制sap酶mix反应物总体积2*460μl,三蒸水1.53*460μl,sapbuffer0.17*460μl,sapenzyme0.3*460μl,按照下述程序,在pcr仪中进行sap酶消化:37℃40min,85℃5min,25℃保存。
[0037]
d4:单碱基延伸反应:按照下述顺序配制单碱基延伸反应mix:反应物体系2*460μl,三蒸水0.619*460μl,10*iplexbuffer 0.2*460μl,terminatormix0.2*460μl,单碱基延伸探针0.94*460μl,单碱基延伸酶0.041*460μl。按照下述程序,在pcr仪中进行单碱基延伸反应:预变性94℃30s,94℃5s,52℃5s,80℃5s,72℃3min,25℃保存。
[0038]
d5:树脂纯化:将反应产物的384孔板中加入16μl三蒸水,在离心机中离心2000转离心3min;加入树脂,在反转摇匀仪上做树脂纯化反应35min,脱盐;反应完成后在离心机中离心2000转离心3min;将脱盐处理后的样品点在样品靶上,自然结晶;
[0039]
d6:质谱检测及数据分析:将d1-d5所得的反应结果在核酸飞行质谱仪进行检测,利用typer4.0软件检测质谱峰,并根据质谱峰图判读各样本目标位点基因型。
[0040]
本项目以处于产蛋期(30-60周)四川白鹅母鹅为研究动物(209只),将母鹅在个体产蛋笼中进行饲养,并以1:4比例进行公鹅和母鹅进行配种,35周至60周期间,每天统计种蛋合格率。
[0041]
将上述209只鹅进行全基因组重测序(每个个体数据量大于11g,基因组覆盖率大于10),利用bwa软件将全基因组数据比对到鹅基因组上,并利用gatk的方法进行snp提取、过滤合并后,获得有9,279,339个snp和209个个体通过质控。
[0042]
本发明对上述209只鹅的种蛋合格率性状与全进行snp位点进行全基因组关联分析(gwas),并使用gemma软件基于混合线性模型(mixedlinearmodel,mlm)的方法完成该分析,混合线性模型如下:利用genna软件利用线性公式进行全基因组关联分析(gwas),y=wα+xβ+ε,其中α为协变量矩阵(w)相对应的系数向量,β为snp的效应大小,ε表示随机残差。gwas结果分别筛选到7个种蛋合格率性状相关snp分子标记,如图2。
[0043]
利用plink软件针对上述snp位点进行单倍型构建。利用飞行质谱的方法检验上述snp位点和单位型在鹅群体中进行基因分型。利用飞行时间质谱技术对上述7个snp在四川白鹅群体中基因型和频率的检测。值得注意的是,5个snp位点(snp290,snp292,snp294,snp296和snp297)构建到一个单倍型模块,如图3。
[0044]
检测snp的方式非常多,限制性内切酶、rlfp、kasp、直接测序以及飞行质谱等方法,本发明主要提供7个种蛋合格率的分子标记,具体的检测方式可以根据实际情况而掌握。
[0045]
除非特别说明,本发明所用试剂和材料均为市购。
[0046]
以下实施例中的四川白鹅样品均来自重庆市荣昌区安富水禽实验基地,且所有个体均为同一批次孵化,在相同环境下饲养。进入育成期后,采用单笼养殖,基于记录四川白鹅35周-60周种蛋合格率得到四川白鹅样本。
[0047]
实施例1:
[0048]
(1)种蛋合格率全基因组关联分析
[0049]
全基因组关联分析:
[0050]
四川白鹅20周龄时利用含有肝素钠的真空采血管采集翅静脉2ml血液,利用血液基因组提取试剂盒(北京天根公司,dp332)提取血液基因组dna,利用电泳实验和nanodrop2000分光光度计测量dna原液浓度和完整性,并将其溶解在te溶液中在-20℃保存备用。利用干冰运输的方式将基因组dna送往北京诺禾致源科技股份有限公司进行全基因组重测序。
[0051]
四川白鹅20周龄时利用含有肝素钠的真空采血管采集翅静脉2ml血液,利用血液基因组提取试剂盒(北京天根公司,dp332)提取血液基因组dna,利用电泳实验和nanodrop2000分光光度计测量dna原液浓度和完整性,并将其溶解在te溶液中在-20℃保存备用。利用干冰运输的方式将基因组dna送往北京诺禾致源科技股份有限公司进行全基因组重测序。
[0052]
将上述209只鹅进行全基因组重测序(每个个体数据量大于11g,基因组覆盖率大于10),利用bwa软件将全基因组数据比对到鹅基因组上,并利用gatk的方法进行snp提取、过滤合并后,获得有9,279,339个snp和209个个体通过质控。
[0053]
本发明对上述209只鹅的种蛋合格率性状与全基因组snp位点进行全基因组关联分析(gwas),并使用gemma软件基于混合线性模型(mixedlinearmodel,mlm)的方法完成该分析,混合线性模型如下:利用gemma软件利用线性公式进行全基因组关联分析(gwas),y=wα+xβ+ε,其中α为协变量矩阵(w)相对应的系数向量,β为snp的效应大小,ε表示随机残差。gwas结果分别筛选到7个种蛋合格率性状相关snp分子标记,如图2。
[0054]
(2)飞行时间质谱方法检测种蛋合格率候选snp在四川白鹅中分布频率
[0055]
选择上述209只鹅全基因组dna为实验材料,针对上述snp位点进行飞行时间质谱验证。
[0056]
1、引物设计:根据snp位点通过agena公司的assaydesign3.1软件进行引物设计,如图1所示。
[0057]
2、合成引物及质检:将引物合成公司合成的引物,通过基质辅助激光解吸电离飞行时间质谱仪(maldi-tof)进行质检,检测实际分子量与理论分子量是否一致,引物纯度是否达到实验要求。具体操作是:将合成的每条延伸引物吸取2ul配成mix,从延伸引物mix中吸取2ul加到40μl ddh2o中,进行质谱检测,所得峰图分子量应与理论值一致,无杂峰。
[0058]
3、样品提取及浓度纯度质检:通过琼脂糖凝胶电泳检测dna浓度、纯度及降解程度,检测结果判读标准:电泳检测胶图中基因组条带单一、清晰、无杂质、无弥散拖尾现象。
[0059]
4、将上述全基因组dna进行pcr反应,体系5μl:10*buffer 0.5μl,mg
2+
0.4μl,dntp 0.1μl,hotstar 0.2μl,上下游引物混合物1μl,三蒸水1.8μl,待检测dna样品1μl(20ng-50ng)。pcr扩增程序:预变性95℃2min,45个循环(95℃变性30s,56℃退火30s,72℃延伸60s,)72℃延伸5min,25℃保存。
[0060]
pcr产物进行sap酶消化反应:按照下述顺序配制sap酶mix反应物总体积2*460μl,三蒸水1.53*460μl,sapbuffer0.17*460μl,sapenzyme0.3*460μl,按照下述程序,在pcr仪中进行sap酶消化:37℃40min,85℃5min,25℃保存。
[0061]
产物随后进行单碱基延伸反应:按照下述顺序配制单碱基延伸反应mix:反应物体
系2*460μl,三蒸水0.619*460μl,10*iplexbuffer0.2*460μl,terminatormix0.2*460μl,单碱基延伸探针0.94*460μl,单碱基延伸酶0.041*460μl。按照下述程序,在pcr仪中进行单碱基延伸反应:预变性94℃30s,94℃5s,52℃5s,80℃5s,72℃3min,25℃保存。
[0062]
将反应产物进行树脂纯化,放入384孔板中加入16μl三蒸水,在离心机中离心2000转离心3min;加入树脂,在反转摇匀仪上做树脂纯化反应35min,脱盐;反应完成后在离心机中离心2000转离心3min;将脱盐处理后的样品点在样品靶上,自然结晶。
[0063]
质谱检测及数据分析:将上述所得的反应结果在核酸飞行质谱仪进行检测,利用typer4.0软件检测质谱峰,并根据质谱峰图判读各样本目标位点基因型。
[0064]
结果判读:
[0065]
如图2所示,snp289的cc基因型个体种蛋合格率显著高于其他基因型个体(p>0.05);snp290的tt基因型个体种蛋合格率最高,cc基因型个体种蛋合格率最低;snp292的cc基因型个体种蛋合格率最高;snp294的gg基因型个体种蛋合格率最高;snp296的aa基因型显著高于其他基因型;snp298的gt基因型个体种蛋合格率显著高于tt基因型。单倍型1(ttctagaaat)个体种蛋合格率最高,单倍型6(ccttaaggaa)个体种蛋合格率最低。可以根据实际情况和需求,对具有上述基因型或单倍型个体进行保留或被淘汰。
[0066]
以上所述仅为本发明针对四川白鹅的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1