一种用于检测多种猪源性病原的液相芯片的制作方法
本发明属于生物技术检测领域,具体涉及一种用于检测多种猪源性病原的液相芯片,能够同时特异性检测非洲猪瘟病毒(asfv)、尼帕病毒(niv)、猪水疱病毒(svdv)、水疱性口炎病毒(vsv)、塞尼卡谷病毒(svv)和口蹄疫病毒(fmdv)的液相芯片。
背景技术:
asfv、niv、svdv、vsv、svv和fmdv是严重危害养猪业的病毒性疫病,也是我国动物防疫部门重点防疫的疫病。2018年非洲猪瘟传入中国,尼帕和南非型口蹄疫我国还没有相关报道。猪源性外来病能够通过国际间贸易交流、野生动物携带及昆虫媒介传入我国,一旦传入将会给我国养猪业带来严重的损失,甚至是公共卫生问题。我国的养猪业在世界排名前列,而且越来越规模化和集约化。这种养殖方式使猪群之间的接触几率大大增加,若未做好防疫工作会发生疫病混合感染的情况。与传统散养和小规模养殖相比,集约化养殖更易受到猪群间传染病的冲击。
有效的检测方法是控制疫病的关键,检测技术还在不断的进步中,不断发展的分子生物学方法和基因检测技术,以及新的分析方法都将有益于检测技术的发展。随着分子生物学的快速发展,以pcr技术为基础的各种诊断技术成为动物疫病诊断领域主要的研究手段和病毒检测金标准。多重pcr高通量的优势是临床上检测混合病原感染的理想方法,但是在实验设计上较繁琐,要考虑电泳能够肉眼区分的pcr产物大小。
而qpcr通过检测pcr过程中的荧光信号实现对靶分子的定量分析,相比于传统的pcr方法省略了电泳检测,但是因为荧光种类和仪器的限制,最多只能做到5重检测。
液相芯片是一种具有高敏感性、高特异性、高通量优点的病原体检测技术平台,是在人类基因组计划完成后,开启后基因组时代的背景下研发出的新一代生物芯片检测技术。该技术的核心是将针对不同待测物的编码微球混合,再加入微量待测样本以及链霉亲和素-藻红蛋白(sape),在悬液中靶分子特异性的与微球表面的捕获分子结合,通过液相芯片仪发出的红、绿激光来识别微球编码并检测微球上报告分子的荧光强度。理想状态下最多能够在一个检测孔内分析100种不同的病原,新开发的luminex3d最多能检测病原多达500种。
对应用于液相芯片检测方法的引物组合要求是引物必须高度特异。多重pcr是在一个反应管内同时扩增多种病原,要保证每对引物不会与其他病原发生非特异性扩增;在进行引物设计时要尽量避免发卡结构和引物二聚体的产生,尤其要避免上游引物与任何一条下游引物超过连续4个碱基互补,否则会造成假阳性信号。
技术实现要素:
本发明提供一种用于对asfv、niv、svdv、vsv、svv和fmdv同时进行特异性检测的引物组和液相芯片检测方法,从而弥补现有技术的不足。
本发明首先提供用于asfv、niv、svdv、vsv、svv和fmdv的检测引物组,其中包含有如下的引物:
1)用于检测asfv的引物对,其序列信息如下:
正向引物asfv-f:5’-caatcttatcgataaatttccatc-3’(seqidno:1)、
反向引物asfv-r:5’-agcaaaggtaatcatcatcgc-3’(seqidno:2);
2)用于检测niv的引物对,其序列信息如下:
正向引物niv-f:5’-tcaagaaacatcagcaggaagg-3’(seqidno:3)、
niv-r:5’-gactgtcggccactctgttct-3’(seqidno:4);
3)用于检测vsv的引物对,其序列信息如下:
正向引物vsv-f:5’-cgagaagttgcagatgagatgg-3’(seqidno:5)、
vsv-r:5’-agaagtggaaggcagggtttt-3’(seqidno:6);
4)用于检测svv的引物对,其序列信息如下:
正向引物svv-f:5’-ttttgaatatccacggctcgat-3’(seqidno:7)、
svv-r:5’-ttacgtcttcaaaggtgccaga-3’(seqidno:8);
5)用于检测fmdv的引物对,其序列信息如下:
正向引物fmdv-f:5’-gacaaaggttttgttcttggtc-3’(seqidno:9)、
fmdv-r:5’-cawcgcaggtaaagtgatctg-3’(seqidno:10);
6)用于检测svdv的引物对,其序列信息如下:
正向引物svdv-f:5’-ccatcagacacaatgcaaact-3’(seqidno:11)、
svdv-r:5’-cacgtgtctcatatatagtgtc-3’(seqidno:12);
本发明的引物组用来制备用于检测多种猪源性病原的液相芯片,所述的动物病原为asfv、niv、svdv、vsv、svv和fmdv;
本发明还提供一种用于检测多种猪源性病原的液相芯片制品,所述的动物病原为asfv、niv、svdv、vsv、svv和fmdv;
所述的液相芯片制品中包含有上述的引物组,其中上游引物的5′端连接有与荧光微球上包被的anti-tag序列互补的tag序列;下游引物的5′端用生物素修饰。
作为实施例的一种具体记载,其中所述asfv、niv、svdv、vsv、svv和fmdv上游引物序列5’端连接的tag序列如下:
seqidno:13:5’-ctttcttaatacattacaacatac-3’、
seqidno:14:5’-ttaacaacttatacaaacacaaac-3’、
seqidno:15:5’-atctcaattacaataacacacaaa-3’、
seqidno:16:5’-atactttacaaacaaataacacac-3’、
seqidno:17:5’-ttaatacaattctctctttctcta-3’、
seqidno:18:5’-ttcttcattaacttctaatcttac-3’
所述的tag序列通过spacerc12连接到上游引物的5′端。
本发明还提供一种检测多种猪源性病原的液相芯片检测方法,是使用上述的修饰引物组进行多重pcr扩增。
其中pcr反应体系为如下:2xpcrmix25μl,引物各0.75μl,待检测的核酸模板1.5μl,dna/rna-freeh2o补足至50μl。
反应条件:98℃预变性30s;98℃变性10s,56℃退火30s,72℃延伸30s,35循环;72℃延伸10min
其一种具体步骤如下:
1)使用上述的修饰引物组对待检测样品的核酸样品进行多重pcr扩增,扩增产物与6种荧光编码微球结合;在37-45℃下反应25-45min,对液相芯片反应产物进行检测,通过获得的mfi值;
孵育温度和孵育时间分别为37℃和40min。
2)根据判定标准,阴性对照的mfi值<300时,实验成立;阳性样本mfi/阴性样本mfi值≥3,阴性对照的mfi值<300时,判为该样本为阳性样本,反之则为阴性。
本发明提供了一种高通量液相芯片检测技术,利用luminex液相芯片xtag技术专有的通用标签,对asfv、niv、svdv、vsv、svv和fmdv进行定性分析,利用不同编码的荧光磁性微球与pcr产物结合可实现同时对六种猪病病毒核酸的特异性检测,根据mfi值确定所检测样本的阴阳性。本发明可为猪源病毒的检测与鉴定提供一种高通量新方法,可用于病原体的快速检测。本方法操作简便、特异性强、灵敏度高、重复性好、缩短检测周期,节约样本资源。降低检测成本,在临床救治、流行病学调查、猪病溯源与口岸检测等多方面都发挥着重要作用,拥有广阔的应用前景。
附图说明
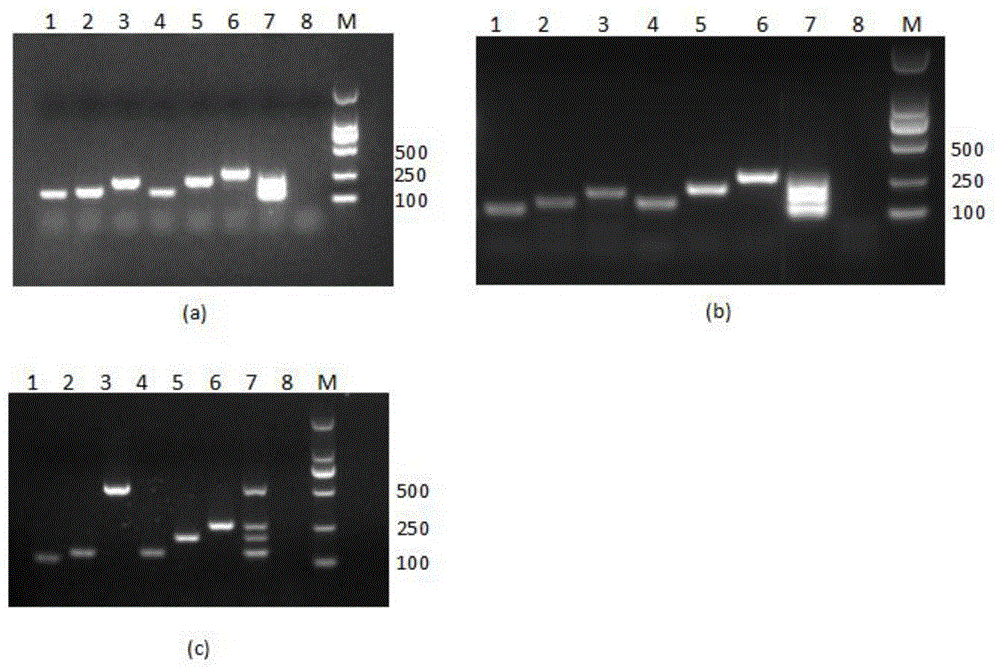
图1(a)为组合1引物组扩增产物电泳图,图1(b)为组合2引物组扩增产物电泳,图1(c)为组合3引物组扩增产物电泳,图1(a)(b)(c)的第1泳道模板为asfv,第2泳道模板为niv,第3泳道模板为svdv,第4泳道模板为vsv,第5泳道模板为svv,第6泳道模板为fmdv,第7泳道模板为6种病毒混合模板,第8泳道为空白对照。
图2为在54℃、56℃、58℃、60℃、62℃、64℃退火温度下同时对asfv、niv、svdv、vsv、svv和fmdv进行扩增得到的多重pcr产物的电泳图。
图3为液相芯片孵育温度优化实验结果图。
图4为液相芯片孵育时间优化实验结果图。
图5为本发明实施例5中电泳检测非洲猪瘟病毒敏感性结果图。
图6为本发明实施例5中电泳检测尼帕病毒敏感性结果图。
图7为本发明实施例5中电泳检测猪水疱病毒敏感性结果图。
图8为本发明实施例5中电泳检测水疱性口炎病毒敏感性结果图。
图9为本发明实施例5中电泳检测塞尼卡谷病毒敏感性结果图。
图10为本发明实施例5中电泳检测口蹄疫病毒敏感性结果图。
图11为本发明实施例5中电泳检测6种病毒敏感性结果图。
图12为本发明实施例5中luminex液相芯片检测非洲猪瘟病毒敏感性结果图。
图13为本发明实施例5中luminex液相芯片检测尼帕病毒敏感性结果图。
图14为本发明实施例5中luminex液相芯片检测猪水疱病毒敏感性结果图。
图15为本发明实施例5中luminex液相芯片检测水疱性口炎病毒敏感性结果图。
图16为本发明实施例5中luminex液相芯片检测塞尼卡谷病毒敏感性结果图。
图17为本发明实施例5中luminex液相芯片检测口蹄疫病毒敏感性结果图。
图18为本发明实施例5中luminex液相芯片同时检测6种病毒敏感性结果图。
图19为本发明实施例5中luminex液相芯片特异性实验结果图。
图20为本发明实施例6中luminex液相芯片检测临床样品结果图。
具体实施方式
实施例中描述到的各种生物材料的取得途径仅是提供一种实验获取的途径以达到具体公开的目的,不应成为对本发明生物材料来源的限制。事实上,所用到生物材料的来源是广泛的,任何不违反法律和道德伦理能够获取的生物材料都可以按照实施例中的提示替换使用。
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明中主要材料与试剂如下:
genemix梯度pcr仪,天能凝胶成像系统,核酸电泳仪,涡旋震荡混匀器,luminex200液相芯片仪。
pcr试剂购自thermoscientific公司;#19、#25、#52、#53、#54、#67号荧光磁性微球、鞘液、校正/验证试剂盒购自美国luminex公司;链霉亲和素-藻红蛋白(sape)购自invitrogen公司;nacl、tris、tritonx-100均为国产分析纯。
实施例所用其他试剂若无特殊说明,均为常规试剂。
实施例1:引物组的设计及筛选
通过查询oie、国标、行标和相关文献,确定asfv、niv、svdv、vsv、svv和fmdv的特异性基因片段。在genebank中收集已发表的asfvp72基因序列、nivn基因序列、svdvvp1基因序列、vsvn基因序列、svv3d基因、fmdv3d基因序列,利用dnaman分子生物学软件对所收集的序列进行分析比较,筛选asfvp72基因、nivn基因、svdvvp1基因、vsvn基因、svv3d基因、fmdv3d基因保守区域。参照基因组序列asfvp72基因(登录号:kf303314.1)、nivn基因(登录号:fj648082.1)、svdvvp1基因(登录号:ab716937.1)、vsvn基因(登录号:m15213.1)、svv3d基因(kx377924)和fmdv3d基因(kr401156.1),应用dnastar、primer5.0分别对其进行初步分析筛选,设计适用于液相芯片检测的特异性引物组合,并对引物进行在线blast确定引物特异性。以筛选获得的高度保守序列作为检测目的基因片段合成阳性质粒。委托大连宝生物公司合成dna质粒。
合成的asfv、niv、svdv、vsv、svv和fmdv质粒通过浓度进行拷贝数计算,分别按10倍的倍比稀释制备成标准品备用。
申请人首先根据保守序列设计并合成针对asfv、niv、vsv、svv和fmdv5种猪病的特异性引物组,经过对所设计的大量引物进行筛选后,发现seqidno:1-seqidno:10所示的引物组能在一起进行多重扩增。
seqidno:1:5’-caatcttatcgataaatttccatc-3’(asfv-f)、
seqidno:2:5’-agcaaaggtaatcatcatcgc-3’(asfv-r)
seqidno:3:5’-tcaagaaacatcagcaggaagg-3’(niv-f)
seqidno:4:5’-gactgtcggccactctgttct-3’(niv-r)
seqidno:5:5’-cgagaagttgcagatgagatgg-3’(vsv-f)
seqidno:6:5’-agaagtggaaggcagggtttt-3’(vsv-r)
seqidno:7:5’-ttttgaatatccacggctcgat-3’(svv-f)
seqidno:8:5’-ttacgtcttcaaaggtgccaga-3’(svv-r)
seqidno:19:5’-gacaaaggttttgttcttggtc-3’(fmdv-f)
seqidno:10:5’-cawcgcaggtaaagtgatctg-3’(fmdv-r)。
在上述引物组的基础上,申请人进行猪水疱病毒svdv扩增引物的筛选,从而能够与上述检测asfv、niv、vsv、svv和fmdv的引物组能够进行多重pcr扩增。
根据svdv的保守区域,设计了如下引物对:
将其他5种病毒引物分别与svdv的组合1、组合2、组合3构成3组引物组,通过多重pcr和液相芯片的mfi值筛选出最佳引物组。
在上游引物的5’端通过间隔臂连接有tag序列,本发明中使用的间隔臂是spacerc12;所述上游引物序列5’端的tag序列分别为:
seqidno:13:5’-ctttcttaatacattacaacatac-3’(asfv)
seqidno:14:5’-ttaacaacttatacaaacacaaac-3’(niv)
seqidno:15:5’-atctcaattacaataacacacaaa-3’(svdv)
seqidno:16:5’-atactttacaaacaaataacacac-3’(vsv)
seqidno:17:5’-ttaatacaattctctctttctcta-3’(svv)
seqidno:18:5’-ttcttcattaacttctaatcttac-3’(fmdv)
下游引物的5′端修饰生物素,所用的带有修饰的引物均由大连宝生物有限公司合成。
将上述六种病毒的引物以构建的阳性质粒为模板进行pcr扩增,经琼脂糖凝胶电泳,结果见图1。svdv3个组合中各对引物均能扩增清晰的目的条带。将3组引物作为液相芯片实验备用引物组。将3组多重引物组的扩增产物进行液相芯片检测,检测asfv-f、asfv-r、niv-f、niv-r、svdv-f1、svdv-r1(组合1)、vsv-f、vsv-r、svv-f、svv-r、fmdv-f、fmdv-r组合的产物空白对照中54号微球有很强的假阳性,经过实验验证,是带有tag序列的svv-f与svdv-r1形成了稳定的杂交体,该杂交体在琼脂糖凝胶电泳中较难发现;检测asfv-f、asfv-r、niv-f、niv-r、svdv-f2、svdv-r2(组合2)、vsv-f、vsv-r、svv-f、svv-r、fmdv-f、fmdv-r组合的产物时,以检测asfv单一模板为例:液相芯片空白对照成立,随着asfv质粒标准品浓度的降低,检测svdv的67号微球假阳性升高。最终确定asfv-f、asfv-r、niv-f、niv-r、svdv-f1、svdv-r2(组合3)、vsv-f、vsv-r、svv-f、svv-r、fmdv-f、fmdv-r组成的多重pcr引物组适用于液相芯片。因此,建立液相芯片检测体系不单单局限于构建良好的多重pcr反应,重点是将多重pcr与液相芯片结合起来,筛选最适合液相芯片的引物组合。
实施例2:检测多种猪源性外来病的液相芯片
使用实施例1中的引物组来制备多重液相芯片,6种不同编码的荧光染料微球,所述微球上带有anti-tag序列,能够与带有修饰的多重液相芯片检测引物上游引物连接的tag序列互补配对。asfv、niv、svdv、vsv、svv、fmdv具体对应的微球编码分别为mtag-a025、mtag-a53、mtag-a067、mtag-a019、mtag-a054、mtag-a052。还包含有nacl、tris、trison-100组分的1xtmhybridizationbuffer。以及链霉亲和素-藻红蛋白(sape)复合物和pcr扩增反应用其他试剂。
实施例3多重pcr的优化
将猪的6种病毒阳性质粒进行稀释后作为模板,用实施例1中的引物进行多重pcr扩增检测。
反应体系为2xpcrmix25μl,5’端带有tag序列的asfv-f、niv-f、svdv-f、vsv-f、svv-f、fmdv-f(10μm)各0.75μl,5’端带有生物素修饰的asfv-r、niv-r、svdv-r、vsv-r、svv-r、fmdv-r(10μm)各0.75μl,各病毒核酸模板1.5μl,dna/rna-freeh2o补足至50μl。
反应程序为:98℃预变性30s;98℃变性10s,54℃-64℃退火30s,72℃延伸30s,35循环;72℃延伸10min。
进一步,设定不同的退火温度(54℃、56℃、58℃、60℃、62℃、64℃)进行pcr,根据图2琼脂糖凝胶电泳结果,56℃为最佳退火温度。
实施例4液相芯片反应条件优化
将56℃下的多重pcr扩增产物与微球进行反应。具体步骤如下:
(1)将luminex液相芯片仪开机预热30min,并进行初始化和校正/验证。
(2)将多重pcr产物与微球工作液、sape工作液进行反应。带有anti-tag序列的6种微球,能够特异性的与asfv、niv、svdv、vsv、svv、fmdv上游引物的tag序列互补配对,6种病毒对应微球编号分别为25、53、67、19、54、52。
(3)实验用试剂均平衡至室温,将微球充分涡旋震荡。取出需要的微球个数,将六种微球混合,并用1xtmhybridizationbuffer稀释至每种微球125个/μl,sape稀释至10μg/ml,注意避光操作。
(4)配制液相芯片反应体系,每孔加入20μl125个/μl的微球,即每孔每种微球参加反应微球数为2500个。再加入5μlpcr产物,70μlsape,总体系95μl。在37-45℃反应25-45min。
(5)按照luminex200液相芯片自带软件xpoent操作规程,分析70μl上述液相芯片反应体系。
进一步,筛选孵育温度和孵育时间,参照luminex推荐孵育温度37-45℃,选取37℃、39℃、41℃、43℃、45℃五个孵育温度,根据所得mfi值确定最佳温度;参照luminex推荐孵育时间20-45min,选取25min、30min、35min、40min、45min五个孵育时间,根据所得mfi值确定最佳时间。
实验结果如图3、图4,37℃反应40min获得mfi值最高,因此,判定luminex检测最佳孵育条件为37℃反应40min。
实施例5用于检测多种猪源性外来病的液相芯片检测方法的建立
(1)将待测样本组织匀浆,按组织样品提取核酸方法提取核酸;如样本为全血、血清、血浆采用裂解、磁珠富集、洗涤、洗脱等步骤提取核酸;将提取的核酸进行反转录后-20℃保存备用。
(2)将asfv、niv、svdv、vsv、svv、fmdv的引物等比混合用于多重pcr扩增,多重pcr50μl反应体系为:2xpcrmix25μl,5’端带有tag序列的asfv-f、niv-f、svdv-f、vsv-f、svv-f、fmdv-f(10μm)各0.75μl,5’端带有生物素修饰的asfv-r、niv-r、svdv-r、vsv-r、svv-r、fmdv-r(10μm)各0.75μl,各病毒核酸模板1.5μl,dna/rna-freeh2o补足至50μl。设立阴性对照。
扩增的反应程序为:98℃预变性30s;98℃变性10s,56℃退火30s,72℃延伸30s,35循环;72℃延伸10min。
多重pcr产物经琼脂糖凝胶电泳分析,在同时扩增6种质粒时除svdv外其余5种病毒的扩增产物大小接近,较难分辨。
(3)将luminex液相芯片仪开机预热30min,并进行初始化和校正/验证。金属加热器加热至孵育温度。
(4)将多重pcr产物与微球工作液、sape工作液进行反应。带有anti-tag序列的6种微球,能够特异性的与asfv、niv、svdv、vsv、svv、fmdv上游引物的tag序列互补配对,6种病毒对应微球编号分别为25、53、67、19、54、52。
(5)实验用试剂均平衡至室温,将微球充分涡旋震荡。取出需要的微球个数,将六种微球混合,并用1xtmhybridizationbuffer稀释至每种微球125个/μl,sape稀释至10μg/ml,注意避光操作。
(6)配制液相芯片反应体系,每孔加入20μl125个/μl的微球,即每孔每种微球参加反应微球数为2500个。再加入5μlpcr产物,70μlsape,总体系95μl。充分混匀后在金属加热器中37℃孵育40min。
(7)按照luminex200液相芯片自带软件xpoent操作规程,分析70μl上述液相芯片反应体系,电泳不易分辨的扩增产物经luminex200液相芯片检测可以明显分辨各病毒。
(8)液相芯片判定标准:根据判定标准,阴性对照的mfi值<300时实验成立;阳性样本mfi/阴性样本mfi值≥3,阴性对照的mfi值<300时,判为该样本为阳性样本,反之则为阴性。
1、所建的方法的检测敏感性
制备质粒工作标准品:将asfv、niv、svdv、vsv、svv和fmdv质粒进行10倍倍比稀释作为标准品备用。
制备asfv质粒工作标准品分别为:
asfv工作标准品1:含有3.9x105copies/μlasfv质粒非传染性dna片段。
asfv工作标准品2:含有3.9x104copies/μlasfv质粒非传染性dna片段。
asfv工作标准品3:含有3.9x103copies/μlasfv质粒非传染性dna片段。
asfv工作标准品4:含有3.9x102copies/μlasfv质粒非传染性dna片段。
asfv工作标准品5:含有3.9x101copies/μlasfv质粒非传染性dna片段。
asfv工作标准品6:含有3.9x100copies/μlasfv质粒非传染性dna片段。
asfv工作标准品7:含有3.9x10-1copies/μlasfv质粒非传染性dna片段。
制备niv质粒工作标准品分别为:
niv工作标准品1:含有4.6x105copies/μlniv质粒非传染性dna片段。
niv工作标准品2:含有4.6x104copies/μlniv质粒非传染性dna片段。
niv工作标准品3:含有4.6x103copies/μlniv质粒非传染性dna片段。
niv工作标准品4:含有4.6x102copies/μlniv质粒非传染性dna片段。
niv工作标准品5:含有4.6x101copies/μlniv质粒非传染性dna片段。
niv工作标准品6:含有4.6x100copies/μlniv质粒非传染性dna片段。
niv工作标准品7:含有4.6x10-1copies/μlniv质粒非传染性dna片段。
制备svdv质粒工作标准品分别为:
svdv工作标准品1:含有3.7x105copies/μlsvdv质粒非传染性dna片段。
svdv工作标准品2:含有3.7x104copies/μlsvdv质粒非传染性dna片段。
svdv工作标准品3:含有3.7x103copies/μlsvdv质粒非传染性dna片段。
svdv工作标准品4:含有3.7x102copies/μlsvdv质粒非传染性dna片段。
svdv工作标准品5:含有3.7x101copies/μlsvdv质粒非传染性dna片段。
svdv工作标准品6:含有3.7x100copies/μlsvdv质粒非传染性dna片段。
svdv工作标准品7:含有3.7x10-1copies/μlsvdv质粒非传染性dna片段。
制备vsv质粒工作标准品分别为:
vsv工作标准品1:含有2.9x105copies/μlvsv质粒非传染性dna片段。
vsv工作标准品2:含有2.9x104copies/μlvsv质粒非传染性dna片段。
vsv工作标准品3:含有2.9x103copies/μlvsv质粒非传染性dna片段。
vsv工作标准品4:含有2.9x102copies/μlvsv质粒非传染性dna片段。
vsv工作标准品5:含有2.9x101copies/μlvsv质粒非传染性dna片段。
vsv工作标准品6:含有2.9x100copies/μlvsv质粒非传染性dna片段。
vsv工作标准品7:含有2.9x10-1copies/μlvsv质粒非传染性dna片段。
制备svv质粒工作标准品分别为:
svv工作标准品1:含有3.68x105copies/μlsvv质粒非传染性dna片段。
svv工作标准品2:含有3.68x104copies/μlsvv质粒非传染性dna片段。
svv工作标准品3:含有3.68x103copies/μlsvv质粒非传染性dna片段。
svv工作标准品4:含有3.68x102copies/μlsvv质粒非传染性dna片段。
svv工作标准品5:含有3.68x101copies/μlsvv质粒非传染性dna片段。
svv工作标准品6:含有3.68x100copies/μlsvv质粒非传染性dna片段。
svv工作标准品7:含有3.68x10-1copies/μlsvv质粒非传染性dna片段。
制备fmdv质粒工作标准品分别为:
fmdv工作标准品1:含有2.09x105copies/μlfmdv质粒非传染性dna片段。
fmdv工作标准品2:含有2.09x104copies/μlfmdv质粒非传染性dna片段。
fmdv工作标准品3:含有2.09x103copies/μlfmdv质粒非传染性dna片段。
fmdv工作标准品4:含有2.09x102copies/μlfmdv质粒非传染性dna片段。
fmdv工作标准品5:含有2.09x101copies/μlfmdv质粒非传染性dna片段。
fmdv工作标准品6:含有2.09x100copies/μlfmdv质粒非传染性dna片段。
fmdv工作标准品7:含有2.09x10-1copies/μlfmdv质粒非传染性dna片段。
用上述6种病毒质粒的10倍倍比稀释标准品作为模板,在实施例3的体系条件下进行pcr扩增,扩增完成后进行琼脂糖凝胶电泳,取剩余产物5μl在实施例4的步骤及最佳反应条件下进行液相芯片检测。
由图5至图10以及质粒拷贝数计算方法可得普通pcr检测asfv、niv、svdv、vsv、svv和fmdv单一模板敏感性检测限分别为3.9x102copies/μl、4.6x100copies/μl、3.7x100copies/μl、2.9x102copies/μl、3.68x101copies/μl、2.09x101copies/μl。
图11为普通pcr检测asfv、niv、svdv、vsv、svv和fmdv混合模板敏感性。
由图12至图18以及质粒拷贝数计算方法可得本发明液相芯片检测方法检测asfv、niv、svdv、vsv、svv和fmdv单一模板敏感性结果为3.9x101copies/μl、4.6x100copies/μl、3.7x100copies/μl、2.9x101copies/μl、3.68x101copies/μl、2.09x101copies/μl。检测6种病毒混合模板敏感性结果为3.9x101copies/μl、4.6x100copies/μl、3.7x100copies/μl、2.9x101copies/μl、3.68x101copies/μl、2.09x101copies/μl。
以上数据表明本发明建立的asfv、niv、svdv、vsv、svv和fmdv多重液相芯片检测方法相比较于普通pcr敏感性明显提高。检测低拷贝数模板电泳条带模糊不清或没有时,液相芯片能够获得较高的mfi值并准确判定为阳性。
2、特异性实验
特异性实验中pcv、ppv、prv、pedv、csfv、jev核酸样品由国家外来动物疫病诊断中心提供。
特异性实验实施方法:以pcv、ppv、prv、pedv、csfv、jev核酸样品作为模板,并做阳性对照。在实施例3的体系条件下进行扩增,取产物5μl在实施例4的步骤及最佳孵育条件下进行液相芯片检测,液相芯片检测结果如图19所示。
液相芯片能够特异性的检测出各自相应病毒,对其他病毒没有非特异性信号。本发明建立的引物及液相芯片检测方法特异性好。
3、稳定性实验
稳定性实验实施方法:将敏感性实验中各病毒工作标准品4用本发明建立的液相芯片检测方法在实施例3的体系条件下进行扩增,实施例4的步骤及最佳孵育条件下进行3次批间重复和批内重复,以验证该方法的稳定性。
检测结果如表1所示,批间重复实验和批内重复实验三次实验结果误差在10%内,表明本发明建立的液相芯片检测方法重复性好。
表1批间重复实验和批内重复实验结果
实施例6实际样本检测
用本发明建立的方法对50份猪源临床样品进行检测,临床样品由国家外来动物疫病研究中心提供。已知临床样品中含27份非洲猪瘟阳性样品,23份非洲猪瘟阴性样品;并且50份实际样本为niv、svdv、vsv、svv和fmdv阴性样品。
(1)将待测样本组织匀浆,按组织样品提取核酸方法提取核酸;如样本为全血、血清、血浆采用裂解、磁珠富集、洗涤、洗脱等步骤提取核酸;将提取的核酸进行反转录后-20℃保存备用。
(2)将asfv、niv、svdv、vsv、svv、fmdv的引物等比混合用于多重pcr扩增,多重pcr50μl反应体系为:2xpcrmix25μl,5’端带有tag序列的asfv-f、niv-f、svdv-f、vsv-f、svv-f、fmdv-f(10μm)各0.75μl,5’端带有生物素修饰的asfv-r、niv-r、svdv-r、vsv-r、svv-r、fmdv-r(10μm)各0.75μl,各病毒核酸模板1.5μl,dna/rna-freeh2o补足至50μl。设立阴性对照。
扩增的反应程序为:98℃预变性30s;98℃变性10s,56℃退火30s,72℃延伸30s,35循环;72℃延伸10min。
(3)将luminex液相芯片仪开机预热30min,并进行初始化和校正/验证。金属加热器加热至37℃温度。
(4)实验用试剂均平衡至室温,将微球充分涡旋震荡。取出需要的微球个数,将六种微球混合,并用1xtmhybridizationbuffer稀释至每种微球125个/μl,sape稀释至10μg/ml,注意避光操作。
(5)配制液相芯片反应体系,每孔加入20μl125个/μl的微球,即每孔每种微球参加反应微球数为2500个。再加入5μlpcr产物,70μlsape,总体系95μl。充分混匀后在金属加热器中37℃孵育40min。
(6)按照luminex200液相芯片自带软件xpoent操作规程,分析70μl上述液相芯片反应体系。
(7)液相芯片判定标准:根据判定标准,阴性对照的mfi值<300时实验成立;阳性样本mfi/阴性样本mfi值≥3,阴性对照的mfi值<300时,判为该样本为阳性样本,反之则为阴性。
实验结果如图20所示,阳性对照结果有很高的mfi值,除27份asfv阳性样品检测到信号外,其余样品和阴性均无信号。
综上所述,本发明成功建立了一种用于多种猪源性外来病的液相芯片检测方法,可以用于临床样品检测。同时本发明也为其他病原高通量快速检测提供检测思路。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
序列表
<110>中国动物卫生与流行病学中心
<120>一种用于检测多种猪源性病原的液相芯片
<160>18
<170>siposequencelisting1.0
<210>1
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>1
caatcttatcgataaatttccatc24
<210>2
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>2
agcaaaggtaatcatcatcgc21
<210>3
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>3
tcaagaaacatcagcaggaagg22
<210>4
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>4
gactgtcggccactctgttct21
<210>5
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>5
cgagaagttgcagatgagatgg22
<210>6
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>6
agaagtggaaggcagggtttt21
<210>7
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>7
ttttgaatatccacggctcgat22
<210>8
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>8
ttacgtcttcaaaggtgccaga22
<210>9
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>9
gacaaaggttttgttcttggtc22
<210>10
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>10
cawcgcaggtaaagtgatctg21
<210>11
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>11
ccatcagacacaatgcaaact21
<210>12
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>12
cacgtgtctcatatatagtgtc22
<210>13
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>13
ctttcttaatacattacaacatac24
<210>14
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>14
ttaacaacttatacaaacacaaac24
<210>15
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>15
atctcaattacaataacacacaaa24
<210>16
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>16
atactttacaaacaaataacacac24
<210>17
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>17
ttaatacaattctctctttctcta24
<210>18
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>18
ttcttcattaacttctaatcttac24
- 还没有人留言评论。精彩留言会获得点赞!