一种用ZmPHT1;7蛋白或其编码基因培育抗旱植物的方法
一种用zmpht1;7蛋白或其编码基因培育抗旱植物的方法
技术领域
1.本发明属于生物技术领域,尤其涉及一种用zmpht1;7蛋白或其编码基因培育抗旱 植物的方法。
背景技术:
2.干旱是全球范围内最严重的非生物胁迫之一,干旱胁迫使植物生长发育受阻,植 株矮小,作物产量和品质下降,给农业生产带来严重危害,是影响农业生产的世界性 难题。因此,寻找参与植物干旱响应的基因,利用转基因过表达或基因编辑等技术突 变这些基因,可以为分子育种和种质改良、提高作物抗逆性,提供候选基因资源。尤 其近几年蓬勃发展的crispr/cas9技术更是提供了一种高效、便捷、精准的基因编 辑方式,利用先进技术进行抗逆新品种培育,可以提高育种效率,缩短杂交和筛选时 间,且育种方向确定,是改良作物性状的有效方法之一。
3.磷是植物生长发育所必需的重要大量营养元素之一,植物磷转运体是植物磷营养 中的重要蛋白,该家族成员在植物根系中主要负责磷营养的吸收和转运。研究磷元素 的高效利用对于作物增产具有重要的理论价值与实践意义。尽管在营养吸收方面,磷 转运体的研究进展快速且取得了非常多的成果,但是在抗逆方面的研究却有待深入。 将磷营养高效利用与抗逆性能相结合,实现植物生长发育与抗逆的协调统一,对于实 现作物高产、稳产、保产具有重要意义。
4.玉米(zea mays)是三大粮食作物之一,也是重要的饲料作物,属于禾本科玉蜀黍 属。随着b73和mo17等玉米自交系基因组测序的完成,玉米的遗传背景更加清楚。同 时,易于遗传转化的自交系不断被测序和开发,使转基因过表达和基因编辑技术的效 率大大提高,例如b73自交系。该自交系转化效率高于目前已知的绝大多数自交系, 易于通过转化获得转基因过表达或基因编辑植株,这些为利用分子育种进行遗传性状 改良提供了技术支持,对减轻干旱等非生物胁迫造成的玉米减产具有应用价值。
5.目前植物中已有一些关于磷转运体参与植物营养高效的研究,但磷转运体在单子叶 作物玉米中的抗旱相关功能还未见报道。
技术实现要素:
6.本发明一个目的是提供一种培育抗旱转基因植物的方法。
7.本发明提供的方法为如下1)或2)或3):
8.1)所示的方法为包括如下步骤:降低目的植物中dna分子编码蛋白质活性或含 量,得到抗旱性高于所述目的植物的转基因植物;
9.2)所示的方法为包括如下步骤:抑制目的植物中所述dna分子的表达,得到抗 旱性高于所述目的植物的转基因植物;
10.3)所示的方法为包括如下步骤:对目的植物中所述dna分子进行基因编辑,使 所述蛋白质翻译提前终止,得到抗旱性高于所述目的植物的转基因植物。
11.所述dna分子,是如下(b1)或(b2)或(b3)或(b4)的dna分子:
12.(b1)编码区如序列表中序列1所示的dna分子;
13.(b2)编码区如序列表中序列3所示的dna分子;
14.(b3)在严格条件下与(b1)或(b2)限定的dna分子杂交且编码所述蛋白质的 dna分子;
15.(b4)来源于玉米且与(b1)或(b2)限定的dna分子至少具有70%、至少具有 75%、至少具有80%、至少具有85%、至少具有90%、至少具有95%、至少具有96%、至 少具有97%、至少具有98%或至少具有99%同源性且编码所述蛋白质的dna分子。
16.上述方法中,所述降低目的植物中dna分子编码蛋白质活性或含量、所述抑制目 的植物中上述dna分子表达或所述对目的植物中上述dna分子进行基因编辑,均通过 如下实现:将上述所述crispr/cas9系统导入所述目的植物中。
17.所述crispr/cas9系统,其包括如下1)或2):
18.1)sgrna,所述sgrna为sgrna1和/或sgrna2;
19.所述sgrna1的靶点为序列1第809-830位;
20.所述sgrna2的靶点为序列1第904-925位;
21.2)表达所述sgrna的crispr/cas9载体。
22.上述中,所述植物为单子叶植物或双子叶植物。
23.本发明另一个目的是提供一种一种dna分子。
24.本发明提供的dna分子,为zmpht1;7基因,是如下(b1)或(b2)或(b3)或(b4) 的dna分子:
25.(b1)编码区如序列表中序列1所示的dna分子;
26.(b2)编码区如序列表中序列3所示的dna分子;
27.(b3)在严格条件下与(b1)或(b2)限定的dna分子杂交且编码所述蛋白质的 dna分子;
28.(b4)来源于玉米且与(b1)或(b2)限定的dna分子至少具有70%、至少具有 75%、至少具有80%、至少具有85%、至少具有90%、至少具有95%、至少具有96%、至 少具有97%、至少具有98%或至少具有99%同源性且编码所述蛋白质的dna分子。
29.上述dna分子编码的蛋白质也是本发明保护的范围。
30.上述蛋白质,是如下(a1)或(a2)或(a3)或(a4):
31.(a1)序列表中序列2所示的蛋白质;
32.(a2)将序列表中序列2所示的蛋白质经过一个或几个氨基酸残基的取代和/或缺 失和/或添加且与植物抗旱性相关的由其衍生的蛋白质;
33.(a3)在(a1)所述蛋白质的n端或/和c端连接标签得到的融合蛋白;
34.(a4)来源于玉米且与(a1)具有98%以上同一性且与植物抗旱性相关的蛋白质。
35.标签具体如表1所示。
36.表1为标签的序列
37.标签残基序列poly-arg5-6(通常为5个)rrrrrpoly-his2-10(通常为6个)hhhhhh
flag8dykddddkstrep-tag ii8wshpqfekc-myc10eqkliseedlha9ypydvpdya
38.上述玉米zmpht1;7基因由2904个碱基(序列1)组成,t01转录本的读码框为序 列3,编码的蛋白为序列2所示。该转录本由2个外显子组成,其中编码外显子2个, 读码框第1位到第783位碱基,第1018位到第1620位碱基,其余为其内含子序列。 基因来源于b73型玉米,由于玉米同一dna段序列可产生不同转录本,翻译出不同蛋 白质,该dna段序列产生的不同转录本以及翻译出的不同具有抗旱功能的蛋白质均在 本发明保护范围内。
39.含有上述dna分子的重组载体、表达盒或重组菌也是本发明保护的范围。
40.上述dna分子或上述的蛋白质在调控植物抗旱型中的应用也是本发明保护的范 围。
41.降低上述蛋白质活性或含量的物质在提高植物抗旱性或培育抗旱植物中的应用 也是本发明保护的范围。
42.或,抑制上述dna分子表达的物质在提高植物抗旱性或培育抗旱植物中的应用也 是本发明保护的范围。
43.上述应用中,所述物质为crispr/cas9系统;
44.所述crispr/cas9系统包括如下1)或2):
45.1)sgrna,所述sgrna为sgrna1和/或sgrna2;
46.所述sgrna1的靶点为序列1第809-830位;
47.所述sgrna2的靶点为序列1第904-925位;
48.2)表达所述sgrna的crispr/cas9载体。
49.zmpht1;7基因的核苷酸序列如序列1所示,根据本发明公开的核苷酸序列,通过 crispr/cas9基因编辑技术,取代、缺失和/或增加一个或多个核苷酸,得到影响 zmpht1;7蛋白功能的突变序列。具体地说,本发明的技术方案包括:利用网站设计 zmpht1;7基因的编辑靶点,根据靶点设计引物,通过pcr、酶切、连接等一系列过程, 构建crispr/cas9的载体,将载体转入农杆菌,用农杆菌侵染玉米幼胚的方式得到转 化苗,用除草剂和pcr鉴定筛选阳性植株,提取突变体植株dna进行测序,获得具有 突变位点的突变体。突变体经自交繁种后进行旱处理实验。zmpht1;7基因可进行编辑 的靶点不止一个,经过编辑后的突变基因可能会产生一个或多个核苷酸增加或缺失, 导致蛋白部分缺失或提前终止,其中有些突变会影响蛋白质的生物学功能。表达无功 能蛋白的突变体植株可能会产生响应干旱胁迫的表型,均属于本发明要求保护的范围。 获得突变体后,检测zmpht1;7突变体在干旱处理下的表型。
50.本发明提供的zmpht1;7基因突变后,干旱处理条件下突变体生长明显强于野生 型,说明该基因为干旱胁迫响应的负调控因子,突变之后能够显著增强植物抗旱性。 本发明实例中采用crispr/cas9技术获得了抗旱的zmpht1;7突变体,通过自交去掉 cas9背景后遗传稳定性更强,能够在不同世代间稳定遗传,为培育和改良抗旱新品种 提供了基因资源,为阐明植物干旱逆境信号应答的分子机制提供了理论依据。
51.本发明的有益效果在于:
52.(1)本发明中zmpht1;7基因突变植株的具有明显抗旱表型,在干旱条件下,生 长状况较好,其叶片萎蔫程度明显低于未突变的野生型植株,可利用该基因的负调控 作用挖掘其抗旱性能。
53.(2)本发明提供的抗旱植株选育的方法,与传统育种方式相比,具有育种时间 短,目的性强等优势,显著缩短育种的周期,提高了旱响应育种的效率。
附图说明
54.图1为野生型玉米(对照)和zmpht1;7crispr-cas9突变株系干旱处理后植株生 长情况照片。
具体实施方式
55.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
56.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
57.以下实施例用于说明本发明,但不限制本发明的范围。
58.以下实施例中所用转录本为t01,仅作为一个例子,不限制应用中的编辑位点。如 未特别指明,实例均按照常规实验条件或产品说明书条件进行。
59.玉米生态型为b73,记载在如下文献中:schnable,p.s.et al.the b73 maize genome:complexity,diversity,and dynamics.science 326,1112
–
1115(2009)
60.农杆菌菌株是eha105。
61.crispr/cas9载体pbue411,记载在如下文献中:xing hl,dong l,wang zp,zhanghy,han cy,liu b,wang xc,chen qj bmc plant biol.2014nov 29;14(1):327; a crispr/cas9 toolkit for multiplex genome editing in plants。
62.主要试剂包括:neb、toyobo等生物公司的限制性内切酶、dna聚合酶、t4连接酶 等;thermo公司的反转录试剂盒;magen公司的rna提取试剂盒;takara公司的定量pcr 试剂;质粒提取试剂盒以及dna回收试剂盒购自天根公司;ms培养基、琼脂粉、琼脂糖、 氨苄青霉素、卡那霉素、硫酸庆大霉素、利福平等抗生素等试剂购自sigma;实施例中 所使用的各种其它化学试剂均为进口或国产分析纯试剂;引物合成和测序由英俊公司 完成。
63.实施例1、zmpht1;7基因的获得及crispr/cas9基因编辑载体的构建和检测
64.一、zmpht1;7基因的获得
65.为研究pht家族蛋白在植物抗旱中的分子机制,利用crispr/cas9技术从玉米(zeamays l.)b73基因组中定向突变了zmpht1;7基因。
66.玉米zmpht1;7基因由2904个碱基(序列1)组成,t01转录本的读码框为序列3, 编码的蛋白为序列2所示。该转录本由3个外显子组成,读码框第584位到第2136 位碱基,第2755位到第2895位碱基,第3978位到第4924位碱基,其余为其内含子 序列。基因来源于b73型玉米,由于玉米同一dna段序列可产生不同转录本,翻译出 不同蛋白质,该dna段序列产生的不同转录本以及翻译出的不同具有抗旱功能的蛋白 质均在本发明保护范围内。
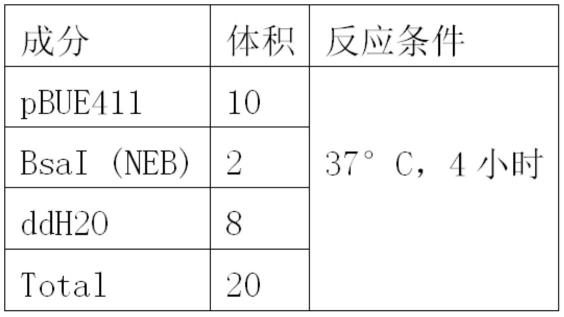
67.二、用于基因编辑zmpht1;7基因的crispr/cas9基因编辑载体的构建 选取zmpht1;7基因中acgtcgcggcggcggtcaacgg(序列1第809-830位)和 gtgtacgggatgacgctcatgg(序列1第904-925位)作为该基因的两个靶点,设计包含 两个靶
点信息的引物:
68.根据靶点设计出的序列分别合成单链寡核苷酸,合成方法如下:
69.mt1t2-f:aataatggtctcaggcgacgtcgcggcggcggtcaa
70.mt1t2-f0:gacgtcgcggcggcggtcaagttttagagctagaaatagc
71.mt1t2-r0:tgagcgtcatcccgtacaccgcttcttggtgcc
72.mt1t2-r:attattggtctctaaactgagcgtcatcccgtacac
73.(1)pcr扩增:以稀释100倍的pcbc-mt1t2(记载在如下文献中:xing,hl., dong,l.,wang,zp.et al.a crispr/cas9 toolkit for multiplex genome editing in plants.bmc plant biol 14,327(2014).)为模板进行四引物pcr扩增。 mt1t2-f/-r为正常引物浓度;mt1t2-f0/-r0稀释20倍。
74.得到pcr产物;再将pcr产物进行酶切,得到酶切后产物。
75.(2)pbue411载体(该载体含有3
×
flag-nls-zcas9-nls表达系统和用于插入靶 序列的grna支架)用bsai(neb)酶切,得到酶切后pbue411;
76.表2为酶切体系
[0077][0078]
(3)连接体系
[0079]
将上述(1)的酶切后产物和上述(2)得到的酶切后pbue411连接,得到连接产 物,即为重组crispr载体pbcxun-zmpht1;7crispr-cas9,该载体表达sgrna1和sgrna2, sgrna1识别区的编码序列为序列1第809-830位,sgrna2识别区的编码序列为序列1 第904-925位。
[0080]
上述连接体系如表3所示:
[0081]
表3为连接体系
[0082][0083]
(4)鉴定
[0084]
取5μl步骤(3)得到的连接产物,转化大肠杆菌感受态。在含有50μg/ml卡 那霉素的lb平板上筛选。
[0085]
采用osu3-fd3和tau3-rd进行菌落pcr鉴定,得到831bp为阳性菌。
[0086]
采用osu3-fd3和tau3-fd2测序确认。
[0087]
osu3-fd3:gacaggcgtcttctactggtgctac
[0088]
tau3-rd:ctcacaaattatcagcacgctagtc
[0089]
tau3-fd2:ttgactagcgtgctgataatttgtg
[0090]
测序结果显示,阳性克隆的质粒为重组crispr载体pbcxun-zmpht1;7 crispr-cas9,该载体表达sgrna1和sgrna2,sgrna1识别区的编码序列为序列1第 809-830位,sgrna2识别区的编码序列为序列1第904-925位。
[0091]
实施例2、zmpht1;7基因crispr-cas9植物的构建和鉴定
[0092]
1、重组菌的制备
[0093]
将实施例1中构建的crispr/cas9基因编辑载体pbcxun-zmpht1;7crispr-cas9 突变质粒通过热激法转化到感受态农杆菌eha105菌株中,菌落pcr鉴定出阳性克隆, 命名为eha105/pbcxun-zmpht1;7crispr-cas9。
[0094]
2、zmpht1;7基因crispr-cas9植物的构建
[0095]
将鉴定正确的农杆菌eha105/pbcxun-zmpht1;7crispr-cas9单菌落接种于2-3 ml含有100μg/ml卡那霉素和50μg/ml利福平的液体培养基中,28℃振荡培养过 夜,第二天转接大量含有抗生素的液体培养基中震荡培养,转接几次后收集菌体,重 新悬浮至od
600
在0.8-1.0之间。
[0096]
将重组菌eha105/pbcxun-zmpht1;7crispr-cas9采用农杆菌介导法转入硬秆自 交系b73以下也称为野生型玉米),b73的幼胚进行根癌农杆菌eha105侵染,将被根 癌农杆菌eha105侵袭的幼胚放在选择培养基上进行多次筛选,获得抗性愈伤组织,将 抗性愈伤组织再生成苗,得到t0代转化苗。构建方法参考:zhang et al.the geneticarchitecture of nodal root number in maize.plant journal,93(6): 1032-1044,2018。
[0097]
3、检测
[0098]
提取t0代转化苗的dna作为模板进行pcr扩增并测序,以b73玉米为对照。
[0099]
采用osu3-fd3和tau3-rd进行pcr扩增,得到831bp为阳性。
[0100]
采用osu3-fd3和tau3-fd2测序确认。
[0101]
osu3-fd3:gacaggcgtcttctactggtgctac
[0102]
tau3-rd:ctcacaaattatcagcacgctagtc
[0103]
tau3-fd2:ttgactagcgtgctgataatttgtg
[0104]
测序引物:osu3-fd3:gacaggcgtcttctactggtgctac
[0105]
测序结果表明,与野生型玉米b73相比,t0代转化苗的zmpht1;7基因中大片段 缺失突变(95bp,对应序列1第825-919位)造成移码,导致蛋白序列改变,停止翻 译,蛋白功能被破坏。
[0106]
将含有该突变形式的转化苗命名为阳性t0代crispr-cas9突变玉米。
[0107]
阳性t0代crispr-cas9突变玉米培育获得t2代crispr-cas9突变玉米。
[0108]
实施例3、zmpht1;7基因crispr-cas9突变玉米旱处理表型检测
[0109]
1、在装有营养土的小盆中播种t2代crispr-cas9突变玉米株系zmpht1;7-1种子、 t2代crispr-cas9突变玉米株系zmpht1;7-2种子和野生型玉米b73种子,覆盖50cm2土,吸满水后将托盘中剩余的水倒掉,培育7天后出苗,得到t2代crispr-cas9突变 玉米zmpht1;7-1苗、t2代crispr-cas9突变玉米zmpht1;7-2苗和野生型玉米苗;
[0110]
2、将长势齐的t2代crispr-cas9突变玉米zmpht1;7-1苗、t2代crispr-cas9 突变玉米zmpht1;7-2苗和野生型玉米b73苗分别移栽到新的装有营养土的盆中,每盆 3株,正常浇水并培养7天。设置三次重复试验,各株系每次重复各3盆。
[0111]
3、完成步骤2后,持续不浇水14天(干旱处理),拍照记录表型。
[0112]
结果如图1所示,可以看出,不浇水14天后对照植株(wt,野生型玉米b73)的生 长状况弱于zmpht1;7crispr-cas9突变植株(zmpht1;7-1和zmpht1;7-2),叶片萎蔫 程度对照(wt)高于突变体植株(zmpht1;7-1&zmpht1;7-2),突变体植株与未突变的 对照植株相比更加耐旱。
[0113]
因此,抑制zmpht1;7蛋白表达或者敲除zmpht1;7基因能够提高玉米耐旱性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1