一种小鼠三阴型原发胶质母细胞瘤细胞株及其应用
1.本发明涉及一种细胞株,尤其涉及一种胶质母细胞瘤细胞株,具体涉及一种小鼠三阴型原发胶质母细胞瘤细胞株及其应用。
背景技术:
2.胶质母细胞瘤(glioblastoma,gbm)是恶性程度最高的脑原发肿瘤,gbm的一个重要恶性病理特征是向周围扩散呈浸润性增长,与周围正常组织界限不清,手术难以完全切除
1.。胶质瘤术后替莫唑胺(temozolomide,tmz)同步放化疗并联合6个月替莫唑胺辅助化疗(radiotherapy,rt),是目前新诊断胶质母细胞瘤的标准治疗方案
2.。经常规手术、放化疗综合治疗后,预后差,患者的中位生存期从12个月仅延长至约15个月,即治疗有效但很有限。因此,延长胶质瘤患者生存,是当前迫切的临床需要。很多治疗胶质瘤的药物已经做了临床前药效评价工作,但是还未见报道能完成临床转化的药物。其中的一个重要原因是临床前药效评价模型与患者体内胶质瘤的生物学治疗特点有很大差异,使得实验治疗结果难以与临床疗效匹配。因此,建立一种稳定且符合恶性胶质瘤生物学行为及临床常规治疗反应特征的临床前药效评价模型是开发新药的重要因素。即模型须符合胶质瘤呈高度侵袭性,组织学倾向原发性胶质母细胞瘤。
3.致癌物诱导的自发小鼠肿瘤的同种异体原位移植模型因为在遗传组成、异质性维持、免疫环境和血脑屏障等方面的优势,使其成为更为经济、临床相似度更高的临床前药物模型。gl261和ct-2a是当前最常用的化学致癌物诱导小鼠胶质瘤模型,常用于胶质瘤的免疫治疗研究。其中,gl261原位脑肿瘤h&e染色显示肿瘤边缘界限清晰,未见浸润式生长
3.,不符合胶质瘤高侵袭性的生物学行为特点。该细胞常通过体外培养扩增后再接种至小鼠颅内
[4,5]
,因当前的培养技术通常会促进细胞的同质化,这不能更好的维持其异质性
[6]
。经过免疫相关治疗,gl261原位荷瘤小鼠更易获得长期存活,且更易获得免疫记忆
[4,5]
。gl261原位模型最主要的缺点在于其具备中等免疫原性,与临床gbm组织的免疫细胞浸润特征及pd-1治疗无效不符
[7]
。
[0004]
ct-2a模型较gl261模型具有更好的肿瘤异质性、侵袭性和治疗的抵抗性,但其免疫原性还不清楚,模型和荷瘤小鼠生存时间差异
[8]
。liu等人
[9]
报道当ct-2a细胞的颅内注射数量下降为5
×
104个时,荷瘤小鼠25日内全部死亡,中位生存期反而缩短至17.5日,显示较宽的生存时间范围,是一种不稳定的表现;ramachandran等人
[10]
报道,同样的颅内接种数量(5
×
104个),ct-2a荷瘤小鼠全部死亡时间却推迟至40日左右;martikainen等人
[11]
报道,同样的颅内接种数量(5
×
104个),中位生存期为35日左右,接种14只小鼠中有2只出现长期存活的现象。以上数据显示,ct-2a颅内接种的稳定性存在很大的波动性,存活时间窗过长。因此在ct-2a模型中使用存活时间来判断药物疗效可能有很大的不确定性。
技术实现要素:
[0005]
鉴于上述现有技术及gl261和ct-2a模型的应用之局限性和不足,本发明的任务是
提供一种小鼠三阴型原发胶质母细胞瘤细胞株及其应用,并提供一种建立胶质母细胞瘤动物模型的方法。
[0006]
实现本发明的技术方案是:本发明提供的小鼠三阴型原发胶质母细胞瘤细胞株命名为:小鼠三阴型原发胶质母细胞瘤g422
tn-gbm,于2020年12月17日保藏于中国典型培养物保藏中心(简称cctcc,地址:武汉市武昌区珞珈山武汉大学),保藏编号为cctcc no:c2020267。
[0007]
本发明经脑内纯化g422肿瘤细胞,使其侵袭性更高,纯化后的肿瘤细胞全基因组dna测序,发现其基因型为:idh1/2wtchromosome1/19intacttert-promoterwtatrxmutanttrp53mutant,符合人源三阴型(triple negative,tn)原发胶质母细胞瘤亚型分型标准,命名为小鼠三阴型原发胶质母细胞瘤细胞株g422
tn-gbm。
[0008]
本发明提供的小鼠三阴型原发胶质母细胞瘤细胞株之应用,包括a.筛选治疗胶质母细胞瘤的药物;b.建立胶质母细胞瘤动物模型;c.筛选胶质母细胞瘤相关生物标志物;d.研究胶质母细胞瘤发病机制。
[0009]
本发明提供的建立胶质母细胞瘤动物模型的方法,包含将本发明提供的小鼠三阴型原发胶质母细胞瘤细胞株注射到动物脑纹状体内的步骤,所述的动物为非人的哺乳动物,所述的动物可以为小鼠、大鼠、兔、狗、羊、猪或猴。
[0010]
本发明用本发明提供的小鼠三阴型原发胶质母细胞瘤细胞株g422
tn-gbm建立了一种更加稳定可靠的小鼠三阴型原发胶质母细胞瘤的动物模型,即小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型,使该种荷瘤小鼠存活时间稳定在14-23天,中位生存期稳定在16-19天,远优于现有的gl261和ct-2a同类胶质瘤模型。g422
tn-gbm的肿瘤组织免疫组化特征为:gfap
+
vimentin
+
cd3-,早期即具有高侵袭性。相较于目前常用的gl261和ct-2a模型,本发明建立的g422
tn-gbm动物模型有以下优势:1、基因型和病理分子、特异免疫反应特征确定;2、体内传代更好地维系肿瘤异质性;3、脑内接种,提供血脑屏障以及肿瘤与脑基质相互作用的微环境,并在具有完善免疫系统的宿主中表现出非免疫原性;4、具备高侵袭性,呈浸润式生长,血管丰富;5、荷瘤小鼠生存期稳定且高度可复制;6、具备同临床gbm相似的治疗反应。
[0011]
目前现有技术提供的胶质瘤模型,对单独放疗或替莫唑胺单药即能获得极佳的治疗效果,替莫唑胺同步放化疗很容易获得长期存活。这显然不符合gbm难治性的临床治疗反应特征。因此,在这种治疗反应特征的模型中,获得的单药或联合治疗很大程度上不能准确的反应其治疗的有效性。许多临床前研究在接种肿瘤的早期,甚至在刚接种就给予药物治疗,这掩盖临床大多数胶质瘤患者确诊即中晚期的事实,不能良好地反映临床gbm的病程和病理特征。到目前为止没有其它胶质瘤模型概括了难治性人胶质母细胞瘤的所有这些治疗特征,且鲜有不同时间点的给药干预用于胶质瘤临床前药物治疗模型,不能模拟胶质瘤早中晚不同进展阶段的治疗。基于此,我们利用h&e染色展现不同时间点小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型的形态特征(图3a,3b,3c),利用活体成像记录肿瘤在小鼠颅内的演进过程(图3d),并选择不同时间点开始给药,分别模拟胶质瘤早中晚不同进展阶段的治疗(图4d)。在小鼠原位g422
tn-gbm模型,不同时间窗的放疗、替莫唑胺、替莫唑胺同步放化疗的治疗效果与临床胶质母细胞瘤治疗效果相似,即单独放疗无效、替莫唑胺单药有效且效果最佳、替莫唑胺同步放化疗优于替莫唑胺单药;替莫唑胺单药或同步放化疗在荷瘤小鼠早期(第5天)治疗效果优于晚期(第9天);替莫唑胺单药和(或)同步放化疗治疗有效但不能
治愈(》100天,较无治疗生成中位时间延长500%以上)。
[0012]
能量代谢异常作为恶性实体瘤(包括胶质瘤)的一个重要特征,其主要表现为对葡萄糖需求量大和氧耐受。因此,抑制肿瘤细胞的葡萄糖代谢已成为多种肿瘤的一个重要靶向治疗策略。最近研究报道,甘露糖(mannose,man)单独使用或联合化疗药物通过干扰葡萄糖代谢,对多种实体瘤动物模型有显著治疗作用,提示甘露糖具有潜在胶质瘤治疗价值。
[0013]
小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型可应用于胶质母细胞瘤肿瘤药物筛选和新疗法的临床前疗效评估。我们利用前期建立的小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型进行同步放化疗方案治疗,分别于接种小鼠三阴型原发胶质母细胞瘤g422
tn-gbm细胞后第5、7、9天开始行甘露糖联合替莫唑胺同步放化疗,系统评价甘露糖联合治疗效果。在g422
tn-gbm颅内进展相对早中期阶段(肿瘤细胞接种后第5,7天开始治疗),甘露糖联合替莫唑胺同步放化疗可达到治愈胶质瘤的作用(小鼠存活》100天),但肿瘤进展晚期(肿瘤细胞接种后第9天开始治疗)则难以达到理想的治疗效果。上述不同时间点的治疗效果与临床上癌症的早发现早治疗原则高度一致,且符合临床胶质母细胞瘤的治疗反应特点。
[0014]
利用小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型进行同步放化疗方案治疗,我们相继证明甘露糖联合同步放化疗可以治愈肿瘤,而二甲双胍(metformin,met)或双硫仑(disulfiram,dsf)/葡萄糖酸铜(copper gluconate,cuglu)联合同步放化疗无治愈效果。因此,本模型的有效治疗标准更高,可以提供动物临床前筛选药物的转化效率。运用上述三种药物联合替莫唑胺同步放化疗在该小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型用于药物的筛选,既验证了该模型的有效性,又开发了一种新的治疗胶质瘤的有效策略,可以为胶质母细胞瘤的联合治疗方案提供重要的临床前评估资料。
[0015]
本发明提供了一种稳定的、高度可复制的小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型,可以真实的概括临床gbm的病理学和治疗反应特征,该模型可以模拟gbm的不同进展阶段治疗反应,该模型可以通过增强gbm的标准放化疗来进行抗肿瘤药物筛选或抗肿瘤新疗法的临床前评估。
[0016]
本发明提供的小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型,具体建立方法如下:将经脑内纯化10代的g422肿瘤细胞(侵袭性更高,计数活细胞个数(100万个/200微升))接种到昆明小鼠右前肢肩部皮下,皮下接种后第9天,取肿瘤组织,送诺和致源生物有限公司提取肿瘤细胞基因组dna,进行全基因组测序,确定选送的肿瘤细胞的基因型为:idh1/2
wt
chromosome1/19
intact
tert-promoter
wt
atrx
mutant
trp53
mutant
(图1a)(https://trace.ncbi.nlm.nih.gov/traces/sra/?run=srr12423793),符合人源三阴型(triple negative,tn)原发胶质母细胞瘤亚型分型标准,命名为小鼠三阴型原发胶质母细胞瘤g422
tn-gbm。
[0017]
我们建立了一个“皮下接种
→
体外24小时培养(无增殖)
→
纹状体接种”的优化g422
tn-gbm模型系统(图1b示流程)。皮下接种一百万g422
tn-gbm细胞,皮下肿瘤生长曲线(图1c)显示其在0-5天内缓慢生长,随后进入快速生长期,并在7-9天生长至1cm3左右。此时的肿瘤组织未见大量出血坏死等现象,可用于细胞悬液的制备。细胞悬液制备过程如图1b所示,具体过程如下:取7-9天的皮下新鲜肿瘤组织,经胰酶消化分离成单细胞,在正常培养条件下孵育24h(在此期间,g422
tn-gbm细胞不增殖),将准确计数后的g422
tn-gbm细胞用于小鼠纹状体接种。我们测试了颅内接种不同数量g422
tn-gbm细胞对小鼠生存期的影响(图
1d),统计结果显示接种10万细胞数量组的生存期(中位存活时间16天)显著短于接种1万细胞数量组(中位存活时间19天)(p=0.0220),而接种10万细胞数量组的生存期(中位存活时间16天)较接种5万细胞数量组(中位存活时间18天)相比,无统计学差异(p=0.0556)。所有接种1万、5万或10万g422
tn-gbm细胞数量的小鼠,于接种后两周左右开始出现死亡,至23日内全部死亡,将该模型命名为小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型(以下简称g422
tn-gbm模型)。基于成瘤稳定性考虑,确定g422
tn-gbm模型的颅内细胞接种数量为5万个。
[0018]
本发明提供的可模拟临床胶质母细胞瘤(gbm)的不同进展阶段治疗反应的动物模型,可通过临床上gbm的标准放化疗治疗方案来进行抗肿瘤药物的筛选。gbm进展早、中、晚期标准治疗方案在小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型的运用如下:在小鼠颅内接种g422
tn-gbm细胞5万后,在肿瘤的不同进展阶段(即接种后第5、7、9天)采取替莫唑胺同步放化疗的治疗方案。生存分析(图4d)显示不同时间点的给药方案均可以显著改善小鼠生存期,且治疗效果与起始治疗时间密切相关。接种后第5天(早期)开始行同步放化疗干预,治疗效果相对较好,中位生存期为29天;接种后第7天(中期)干预时,中位生存期缩短至26天;接种后第9天(晚期)干预时,中位生存期进一步缩短至24.5天,且显著短于第5天开始治疗的中位生存期(p=0.0147)。所有组别小鼠全部出现死亡,且没有小鼠存活超过35天。综上,传统放化疗尽管可以适当延长荷瘤小鼠生存期,但并不能治愈该肿瘤,且肿瘤进展早期治疗效果相对晚期更好。该模型表现出与人脑恶性胶质瘤相似的治疗反应特征,强烈提示恶性胶质瘤早诊早治的益处。
[0019]
本发明提供的一种稳定可靠的高侵袭性的小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型,可应用于恶性胶质瘤新疗法的临床前疗效评估以及肿瘤药物筛选。我们验证了甘露糖联合替莫唑胺同步放化疗在该动物模型的治疗反应,既验证了该动物模型用于肿瘤药物筛选的有效性,又开发了一种新的治疗胶质瘤的有效策略,可以为胶质母细胞瘤的联合治疗方案提供重要的临床前评估资料。具体实施方案如下:我们利用前期建立的小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型,分别于接种g422
tn-gbm细胞后第5、7、9天开始行甘露糖联合替莫唑胺同步放化疗(图5a),系统评价联合治疗效果。荷瘤小鼠生存曲线结果(图5b,c,d)提示:甘露糖联合替莫唑胺同步放化疗,在肿瘤进展早中期可以得到比较好的治疗效果,有一定比例小鼠获得长期无瘤生存。而肿瘤进展至晚期,则难以达到理想的治疗效果。上述不同时间点的甘露糖联合同步放化疗治疗效果与临床上癌症的早发现早治疗原则高度一致,且符合临床胶质母细胞瘤的治疗反应特点。后来,我们在该模型上继续验证了二甲双胍或双硫仑/葡萄糖酸铜联合同步放化疗治疗效果,二甲双胍或双硫仑/葡萄糖酸铜并没有明显增强同步放化疗的治疗效果。总之,我们建立一种稳定可靠的小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型,可以真实地概括人类胶质瘤的病理学和治疗反应特征,同时可用于抗肿瘤新疗法在不同时间点干预的临床前评估以及肿瘤药物筛选。
附图说明
[0020]
图1:小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型的建立结果图。a:小鼠三阴型原发胶质母细胞瘤g422
tn-gbm分子特征。wt,wild type.b:g422
tn-gbm细胞悬液制备过程示意图。肿瘤基因组测序证明本株细胞的基因型为idh1-野生型、idh-野生型、染色体1/19-完整、tert启动子-野生型、atrx和trp53-突变。b:小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模
型建立流程示意图。通过几个优化步骤使原位模型的生存时间高度一致。提高了药物疗效结果判定的可靠性。c:小鼠三阴型原发胶质母细胞瘤g422
tn-gbm细胞接种至小鼠皮下生长曲线(n=6),黑色箭头指示细胞悬液皮下接种时间。通过选择7-9天,直径约1.0cm大小的肿瘤,提高了颅内肿瘤接种的生成时间稳定性。d:颅内接种不同浓度g422
tn-gbm细胞的小鼠生存曲线(每组n=6,*p《0.05)。ns,not significant.结果证明本方案建立的模型生存时间很稳定。颅内接种1,000至100,000细胞使小鼠生死亡时间稳定在30天以内,且荷瘤小鼠死亡快慢与肿瘤细胞接种量呈正相关。
[0021]
图2:小鼠三阴型原发胶质母细胞瘤g422
tn-gbm分子病理特征结果图。a:g422
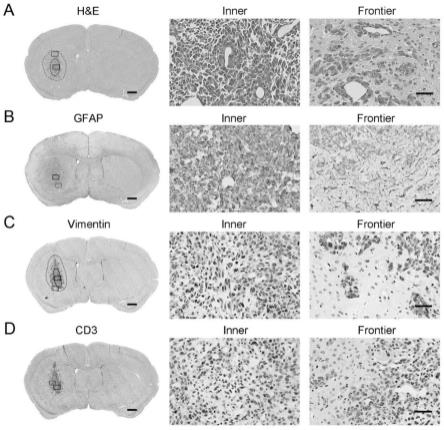
tn-gbm细胞接种后第5日荷瘤小鼠脑组织切片h&e染色图,左图显示全脑(黑色虚线划定肿瘤实质边界,蓝色虚线划定肿瘤浸润边界),中图(inner,肿瘤实质)选取于全脑图中黑色方框位置,右图(frontier,肿瘤侵袭前沿)选取于全脑图中白色方框位置。b:gfap代表性免疫组化染色图片。左图显示全脑,中图显示肿瘤实质(inner)的gfap表达情况,右图显示肿瘤边界(frontier)的gfap表达情况。c:vimentin代表性免疫组化染色图片。左图显示全脑,中图显示肿瘤实质(inner)的vimentin表达情况,右图显示肿瘤边界(frontier)的vimentin表达情况。d:肿瘤区域cd3呈阴性表达。比例尺代表50微米。结果证明本肿瘤的病理特征是高侵袭性(符合胶质母细胞瘤的最重要的病理特征)、gfap-阳性(符合星形胶质细胞来源的肿瘤)、vimentin-阳性(符合其高侵袭的病理分子特征)、cd3-阴性(符合胶质母细胞瘤的免疫治疗无反应特征)。因此,本肿瘤具有模拟临床胶质母细胞瘤的难治性病理和免疫无反应特征。
[0022]
图3:小鼠三阴型原发胶质母细胞瘤g422
tn-gbm呈高度浸润式生长的结果图。a:g422
tn-gbm细胞接种后第5日荷瘤小鼠脑组织h&e染色图,左图显示全脑(黑色虚线划定肿瘤实质边界,白色虚线划定肿瘤浸润边界),中图(inner,肿瘤实质)选取于全脑图中黑色方框位置(黑色箭头指示血管位置),右图(frontier,肿瘤侵袭前沿)选取于全脑图中白色方框位置。组化结果证明本株肿瘤早期即广泛侵袭。b:g422
tn-gbm细胞接种后第7日荷瘤小鼠脑组织h&e染色图。证明本株肿瘤生长极快,并伴广泛侵袭。c:g422
tn-gbm细胞接种后第9日荷瘤小鼠脑组织h&e染色图。比例尺代表50微米。证明本株肿瘤的生长和侵袭呈进行性。符合临床高侵袭、高度恶性的特征。d:g422
tn-gbm细胞颅内接种后第5、7、9天分别行活体光学成像结果图(n=6,配对t检验,**p《0.01,***p《0.001,****p《0.0001)。roi,region of interest.活体成像结果证明肿瘤在接种后短期即第5、7、9天呈进行性生长,与病理组化结果一致。
[0023]
图4:替莫唑胺、手术、替莫唑胺同步放化疗改善荷瘤小鼠生存时间和体重变化结果图。a:接种肿瘤第7日开始放化疗给药方案示意图。即肿瘤细胞接种后第7天予x-射线照射一次,照射后当日即之后每日予替莫唑胺口服一次/天,每5剂间隔2天,共10剂。b:接种肿瘤第7日开始放疗、替莫唑胺化疗、同步联合放化疗的小鼠生存时间和体重变化结果图(每组n=7,*p《0.05,***p《0.001)。单独放疗相较于对照组并不能显著延长小鼠生存时间(p=0.1332)。单独使用替莫唑胺可以显著提高延长小鼠生存时间(p=0.0001)。与单独使用替莫唑胺相比,替莫唑胺同步放化疗可进一步延长小鼠生存时间(p=0.0166)。结果证明替莫唑胺治疗有效,莫唑胺联合放疗效果更佳,但无长期存活。这种效果予临床胶质母细胞瘤治疗效果接近。c:第7日开始手术切除肿瘤、术后予替莫唑胺单药(共10剂)或替莫唑胺联合放
化疗(rt/tmz:放疗+替莫唑胺(共10剂)),小鼠生存时间和体重变化结果图(每组n=8,***p《0.001)。结果证明单独手术切除肿瘤显著提高荷瘤小鼠生存时间,但无长期存活,与临床手术治疗效果相符。手术叠加术后替莫唑胺联合放化疗(rt/tmz)与替莫唑胺联合放化疗相比,荷瘤小鼠在手术联合放化疗方案中存活并未明显获益(p=0.5770)。临床标准治疗方案即手术叠加术后同步放化疗也仅提高胶质母细胞瘤患者生成时间月2-3个月。本模型模拟临床标准治疗方案的治疗效果与临床胶质母细胞瘤相似。d:不同时间点放化疗的小鼠生存曲线和体重变化曲线(每组n=8,*p《0.05,***p《0.001,****p《0.0001)。surgery,手术;rt,radiotherapy;tmz,temozolomide。rt/tmz,替莫唑胺同步放化疗。首次治疗时间依次为接种后第5、7、9天,替莫唑胺联合放化疗(rt/tmz)在这些时间段均有效,再次证明莫唑胺联合放化疗是临床上胶质瘤细胞瘤的最有效治疗方法。本模型中莫唑胺联合放化疗的治疗效果与治疗起始时间正相关,与临床早发现、早治疗的预期一致。再次证明本模型与难治性胶质母细胞瘤的临床治疗特征高度相符。
[0024]
图5:为甘露糖联合同步放化疗对肿瘤进展不同时间点(即早、中、晚期)的治疗效果。即分别于g422
tn-gbm细胞接种后第5、7、9天,予甘露糖,同时予替莫唑胺同步放化疗,分别记录不同给药组小鼠的存活时间和体重,并绘制生存曲线和体重变化曲线。甘露糖联合替莫唑胺同步放化疗,在肿瘤进展早、中期可以得到比较好的治疗效果,有一定比例小鼠获得长期无瘤生存。而肿瘤进展晚期,则无长期存活的治疗效果。上述不同时间点的甘露糖联合同步放化疗治疗效果与临床上癌症的早发现早治疗原则高度一致,且符合临床胶质母细胞瘤的治疗反应特点,可用于恶性胶质瘤新疗法的临床前疗效评估以及肿瘤药物筛选。
[0025]
a:第5日甘露糖联合同步放化疗给药方案示意图,第7、9天给药方案与之相同,只是给药时间较第5天推迟2、4天。b:第5日给药方案下,不同治疗组小鼠的生存时间和体重变化结果图(rt组:n=7;rt/man组:n=7;其他每组:n=8)。甘露糖联合替莫唑胺同步放化疗组的小鼠有50%(4/8只)能获得长期存活。man,mannose;rt/man,甘露糖+放疗;tmz/man,甘露糖+替莫唑胺;rt/tmz/man,甘露糖+替莫唑胺同步放化疗放疗。c:第7日给药方案下,不同治疗组小鼠的生存时间和体重变化结果图(每组:n=8)。甘露糖联合替莫唑胺同步放化疗组的小鼠有25%(2/8只)能获得长期存活。d:第9日给药方案下,不同治疗组小鼠的生存时间和体重变化结果图(每组:n=7)。无小鼠能获得长期存活*p《0.05,**p《0.01。
[0026]
图6:为二甲双胍或双硫仑/葡萄糖酸铜联合替莫唑胺同步放化疗影响荷瘤小鼠生存时间和体重的结果图。结果显示二甲双胍或双硫仑/葡萄糖酸铜联合替莫唑胺同步放化疗对提升单独放化疗的治疗效果不明显,且验证了该小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型可用于恶性胶质瘤新疗法的临床前疗效评估以及肿瘤药物筛选的应用。
[0027]
a:第7日二甲双胍或双硫仑/葡萄糖酸铜联合同步放化疗给药方案示意图。met,metformin;dsf/cu,disulfiram/copper gluconate;rt/tmz/met,二甲双胍+替莫唑胺同步放化疗;rt/tmz/dsf/cu,双硫仑/葡萄糖酸铜+替莫唑胺同步放化疗。b:第7日给药方案下,不同治疗组的小鼠生存时间结果图(n=7-8/组,ns,无统计学意义)。c:b中相同组第7日给药方案下,不同治疗组小鼠的体重变化结果图。与单独替莫唑胺联合同步放化疗组相比,二甲双胍或双硫仑/葡萄糖酸铜联合替莫唑胺同步放化疗均未明显延长小鼠的生存期,统计学不存在差异。
[0028]
本发明提供的小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型能在胶质瘤不同进展
阶段系统评估单药、联合治疗方案疗效,用于评估恶性胶质瘤进展早、中、晚期的治疗效果。本发明提供的小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型能用于恶性胶质瘤新疗法的临床前疗效评估以及肿瘤药物筛选的应用。
具体实施方式
[0029]
本发明提供的细胞株已于2020年12月17日保藏于中国典型培养物保藏中心(简称cctcc,地址:中国武汉市武昌区珞珈山武汉大学,430072),保藏编号为cctcc no:c2020267,培养物名称(分类命名):小鼠三阴型原发胶质母细胞瘤g422
tn-gbm。
[0030]
实施例1:将本发明提供的小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型应用于恶性胶质瘤新疗法的临床前疗效评估以及肿瘤药物筛选的应用,具体实施如下:
[0031]
实验细胞:小鼠三阴型原发胶质母细胞瘤g422
tn-gbm细胞。该细胞不可体外培养,使用皮下或颅内接种交替传代,以便更好的维持其生物学特性。冻存条件为:80%rpmi 1640基础培养基/10%二甲基亚砜/10%胎牛血清。将g422
tn-gbm细胞(100万细胞/0.2ml pbs)接种于成年昆明雄性小鼠右前肢肩部皮下,待皮下瘤生长至7-9天时,取皮下瘤用胰酶消化成单细胞悬液,正常条件下孵育24小时后收集细胞并计数,取一定数量的活细胞接种至小鼠大脑右侧纹状体内。
[0032]
实验动物:本发明中实验用的昆明小鼠(雄性,18-22g)购于北京斯贝福生物技术有限公司,许可证号为:scxk(京)2019-0010。所有小鼠均按昼夜12小时交替方式饲养于同济医学院实验动物管理中心,自由进食与饮水,并依据华中科技大学同济医学院伦理委员会发布条例进行相关实验动物操作。
[0033]
试剂:(1)实验药物:替莫唑胺(temozolomide,tmz)、葡萄糖(glucose)、甘露糖(mannose,man)二甲双胍(metformin,met)、双硫仑(disulfiram,dsf)/葡萄糖酸铜(copper gluconate,cuglu)购于abmole,molidustat(inhibitor of the hypoxia-inducible factor,mol)购于selleck chemicals,d-luciferin(potassium salt)购于cayman chemical company。15mg/mld-荧光素钾:150mg d-荧光素钾避光条件下溶解于10ml无菌pbs,现配现用。
[0034]
(2)细胞培养试剂:胎牛血清购于gemini公司,rpmi 1640基础培养基、0.25%胰酶、pbs(ph=7.4)购于gibco公司,0.4%台盼蓝染液、二甲基亚砜购于sigma公司,青霉素-链霉素溶液购于hyclone公司。
[0035]
仪器:脑立体定位仪(美国stoelting);二氧化碳培养箱(forma,美国);体视显微镜(77020,深圳市瑞沃德生命科技有限公司);动物活体光学成像(lago x);小鼠x射线辐照仪(rs2000pro);inliview 3000b animal pet/spect/ct system(北京永新医疗设备有限公司)。
[0036]
实验步骤:
[0037]
(1)g422
tn-gbm细胞的建立:g422细胞皮下瘤购自中国医学科学院基础医学研究所。a,将g422皮下瘤制成单细胞悬液(磷酸盐缓冲液,pbs)。b,接种1微升含50万个细胞的悬液到昆明小鼠右侧大脑纹状体内。c,接种后第10天,处死小鼠取新鲜脑组织,剔除肿瘤坏死及明显的肿瘤组织,选取肿瘤不明显的浸润区组织,制备成单细胞悬液,在含10%胎牛血清的rpmi 1640培养基中(含双抗)于正常条件下置于细胞培养箱孵育24小时,重新收集细胞
并计数。d,接种1微升含50万个细胞的悬液至昆明小鼠纹状体。e,重复上述c-d步骤,连续进行颅内肿瘤传代10次,肿瘤组织无明显坏死,浸润明显。f,将上述连续10轮纯化的g422细胞(100万个/200微升)接种到昆明小鼠右前肢肩部皮下。g,皮下接种后第9天,取肿瘤组织,送诺和致源生物有限公司提取肿瘤细胞基因组dna,进行全基因组测序,确定选送的肿瘤细胞的基因型为:idh1/2
wt
chromosome1/19
intact
tert-promoter
wt
atrx
mutant
trp53
mutant
,符合人源三阴型(triple negative,tn)原发胶质母细胞瘤亚型分型标准,将得到的胶质母细胞瘤细胞株命名为小鼠三阴型原发胶质母细胞瘤g422
tn-gbm,并于2020年12月17日保藏于中国典型培养物保藏中心(简称cctcc,地址:武汉市武昌区珞珈山武汉大学),保藏编号为cctcc no:c2020267。
[0038]
(2)小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型的建立:
[0039]
a,选取18-22g雄性昆明小鼠,术前12h禁食禁水。用7%水合氯醛(350mg/kg)腹腔注射麻醉小鼠后备皮,小鼠右前肢肩部皮下注射1
×
106个g422
tn-gbm细胞(n=6),隔天使用游标卡尺测量皮下瘤体积。根据公式:1/2
×
(l
×
w2)计算肿瘤体积(l代表肿瘤长径,w代表肿瘤短径),绘制皮下瘤生长曲线。b,接种后第7-9天,处死小鼠,取皮下肿瘤组织,制备成单细胞悬液,在含10%胎牛血清的rpmi 1640培养基中(含双抗)于正常条件下置于细胞培养箱孵育24小时,重新收集细胞并计数。c,选取18-22g雄性昆明小鼠,术前12h禁食禁水。用7%水合氯醛(350mg/kg)腹腔注射麻醉小鼠后备皮,通过调节耳杆将小鼠头部固定于小鼠适配器,并置于脑立体定位仪(美国stoelting co.620wheat lane型立体定位仪)。沿矢状缝作纵行切口,钝性分离表面筋膜,暴露颅骨。用记号笔标记出前后囟位置,矫正脑平面,使其前后、左右分别调平。根据小鼠脑图谱及体重确定注射坐标位置(0.5mm,2mm,3.5mm),使用颅骨钻在该坐标位置打孔后扎破硬脑膜。用汉密尔顿微量进样针(10μl,1701rn,33g)进针至上述坐标位置,以1μl/min的速度将g422
tn-gbm细胞缓慢注射至纹状体内,注射完成后停针8min,然后缓慢退针,防止漏出。颅骨钻孔位置使用骨蜡封闭,缝合头皮后用碘伏消毒创口,注意保暖,待小鼠苏醒后置于饲养笼正常饲养。将荷瘤小鼠随机分组后,予不同治疗方式处理,隔天记录小鼠体重,每日观察动物状态并记录小鼠死亡时间,绘制生存曲线。
[0040]
(3)小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型的治疗方案:
[0041]
1)放射治疗:放射治疗选择小鼠x射线辐照仪(rs2000pro),照射参数设定为:160kv,25ma,1gy/48.4sec。全脑照射和全身照射前先将小鼠经7%水合氯醛腹腔麻醉,小鼠俯卧位固定于照射床板上(shelf 1)。全脑照射过程中选择使用3mm铅板挡住小鼠身体部位,只留头部在照射野内。照射过程中选择使用reflector,提高辐照的均一性。
[0042]
2)手术治疗:将g422
tn-gbm细胞(5万细胞/1微升)接种到昆明小鼠的右侧纹状体,注射坐标为:前囟前0.5mm,中线侧旁开2mm,颅骨下2.5mm(颅骨下纹状体表浅位置,便于显微镜下手术切除)。待肿瘤生长至第7天时,麻醉行动物活体光学成像后于10倍显微镜下行手术切除,保证小鼠手术过程中一直处于麻醉状态。沿矢状缝作纵行切口,钝性分离表面筋膜,暴露颅骨。使用颅骨钻,以原注射位点为中心,钻取并剥离直径为5mm左右的颅骨盖充分暴露肿瘤生长位置。使用组织显微镊剔除肉眼可见肿瘤,术中可使用凝胶海绵止血,直到手术视野肉眼可见全部白色正常脑组织,每只小鼠手术时间约为20min。术前术后分别行动物活体成像,以评估手术切除效率。术后隔天记录小鼠体重变化并每日记录小鼠死亡时间。
[0043]
3)药物治疗:对照组口服给予0.5%羧甲基纤维素钠(0.1ml/10g体重)。替莫唑胺
经灌胃口服,给药剂量为50mg/kg,连续给药5日后休息2日,再连续给药5日,共计10次。配药方法:将5mg羧甲基纤维素钠置于1ml生理盐水表面,静置1天,待其充分溶胀,然后加入5mg替莫唑胺粉末后超声30min形成稳定固体分散体,终浓度为5mg/ml,使用时需现配现用。全脑放射治疗(wbrt)与替莫唑胺同步进行,即替莫唑胺第一次给药当天行放疗照射。葡萄糖和甘露糖口服给药,将正常饮用水换成200ml 20%甘露糖和20%葡萄糖,每周更换一次,保证小鼠可持续饮用;另外每周每只小鼠额外接受3次200μl灌胃口服治疗,替莫唑胺停药时,换为正常饮用水。通过灌胃法每天给予二甲双胍400μg/g体重。dsf溶解在由ddh2o/氢化蓖麻油/dmso/乙醇(7.5/1.5/0.5/0.5,v/v/v/v)组成的溶剂中,最终浓度为10mg/ml。每天通过灌胃法给药,剂量为100μg/g体重。每天通过灌胃法给予cuglu,剂量为2μg/g体重。
[0044]
实验结果:(1)小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型的分子特征:
[0045]
2016版世界卫生组织中枢神经系统肿瘤分类中首次在组织学基础上引入了分子分型的概念,这极大的增加了诊断的准确性。依据idh1/2、1p/19q联合缺失、tert启动子、atrx、tp53的遗传改变状态将神经胶质瘤定义为不同的亚型,与组织病理学相结合更能准确定义神经胶质瘤的生物学和临床行为。
[0046]
为确定g422
tn-gbm细胞所模拟的人类胶质瘤分子分型,我们将g422细胞经颅内纯化10代后,接种至小鼠皮下,待皮下瘤生长至合适大小后,取肿瘤组织送诺禾致源生物有限公司进行全基因组测序(详见实验步骤1),并对相关基因进行了插入缺失变异检测(indel)和单核苷酸多态性(snp)检测(图1a)(https://trace.ncbi.nlm.nih.gov/traces/sra/?run=srr12423793),分析结果显示:1号染色体idh1基因第3外显子区域发生同义突变(c.g207c:p.v69v)。7号染色体idh2基因外显子区域未见突变发生。13号染色体tert启动子区域未见突变发生。x染色体atrx基因第25外显子区域发生错义突变(c.g5857a:p.v1953m)。11号染色体trp53基因第9外显子发生同义突变(c.c930t:p.s310s),第5、8、11外显子区域发生错义突变(exon5:c.g395a:p.c132y;exon8:c.g809c:p.r270p;exon11:c.g1112a:p.g371d)。基因组结构性变异分析(sv)显示1号染色体和19号染色体(chr1/19)完整,未见基因大片段删除。综上信息,确定选送的肿瘤细胞的基因型为:idh1/2
wt
chromosome1/19
intact
tert-promoter
wt
atrx
mutant
trp53
mutant
,符合人源三阴型(triple negative,tn)原发胶质母细胞瘤亚型分型标准,命名为小鼠三阴型原发胶质母细胞瘤g422
tn-gbm细胞,并于2020年12月17日保藏于中国典型培养物保藏中心(简称cctcc,地址:武汉市武昌区珞珈山武汉大学),保藏编号为cctcc no:c2020267。
[0047]
(2)小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型的建立:为获得可靠的动物模型应用于临床前药物的疗效评估,我们建立了稳定的小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型。通过皮下注射100万个g422
tn-gbm细胞,肿瘤生长曲线(图1c)显示其在0-5天内缓慢生长,随后进入快速生长期,并在7-9天生长至1cm3左右。此时的肿瘤组织未见大量出血坏死等现象,可用于细胞悬液的制备。细胞悬液制备过程如图1b所示,具体过程如下:取7-9天的皮下新鲜肿瘤组织,经胰酶消化分离成单细胞,在正常培养条件下孵育24h(在此期间,g422
tn-gbm细胞不增殖),将准确计数后的g422
tn-gbm细胞用于小鼠纹状体接种。我们测试了颅内接种不同数量g422
tn-gbm细胞对小鼠生存期的影响(图1d),统计结果显示接种10万细胞数量组的生存期(中位存活时间16天)显著短于接种1万细胞数量组(中位存活时间19天)(p=0.0220),而接种10万细胞数量组的生存期(中位存活时间16天)较接种5万细胞数
量组(中位存活时间18天)相比,无统计学差异(p=0.0556)。所有接种1万、5万或10万g422
tn-gbm细胞数量的小鼠,于接种后两周左右开始出现死亡,至23日内全部死亡。基于成瘤稳定性考虑,确定后续实验中小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型的颅内细胞接种数量为5万个。
[0048]
(3)小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型的病理特征:h&e染色结果显示g422
tn-gbm细胞接种后第5日(代表肿瘤早期),肿瘤实质内细胞密集,形态不规则,呈圆形或卵圆形;胞浆少胞核体积大,核膜清楚,核仁不明显,核分裂多见;瘤组织内可见中等数量血管,血管内皮细胞增生,散在变性坏死区。远离肿瘤实质,肿瘤边缘可见明显的成团细胞聚集,组成肿瘤侵袭前沿(图2a)。我们采用免疫组化染色揭示小鼠三阴型原发胶质母细胞瘤g422
tn-gbm分子病理学特征。免疫组化结果显示肿瘤区域胶质纤维酸性蛋白(gfap)呈阳性表达(图2b,inner),肿瘤周围可见gfap阳性的反应型星形胶质细胞(图2b,frontier),证实其胶质细胞来源。波形蛋白vimentin作为上皮间质细胞的标志物,与胶质瘤侵袭转移行为密切相关,在肿瘤边缘呈强阳性表达(图2c,frontier),提示小鼠三阴型原发胶质母细胞瘤g422
tn-gbm具备高度侵袭特性。肿瘤实质内与边缘区域均未见cd3阳性t细胞浸润(图2d),这表明小鼠三阴型原发胶质母细胞瘤g422
tn-gbm具备一定的非免疫原性。综上,小鼠三阴型原发胶质母细胞瘤g422
tn-gbm组织分子病理特征为gfap
+
vimentin
+
cd3-。
[0049]
(4)不同时间点小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型演进过程:将g422
tn-gbm细胞(5万/1微升)接种到昆明小鼠的右侧纹状体(n=6),分别在植入后第5、7和9天灌流固定取脑组织,进行h&e染色。不同时间点h&e染色结果显示g422
tn-gbm细胞接种后第5日(代表肿瘤早期),肿瘤实质内细胞密集,形态不规则,呈圆形或卵圆形;胞浆少胞核体积大,核膜清楚,核仁不明显,核分裂多见;瘤组织内可见中等数量血管,血管内皮细胞增生,散在变性坏死区。远离肿瘤实质,肿瘤边缘可见明显的成团细胞聚集,组成肿瘤侵袭前沿(图3a);当肿瘤生长至第7日(代表肿瘤中期),胶质瘤实质部分进一步增大,浸润前沿也相应地扩大(图3b);当肿瘤生长至第9日(代表肿瘤晚期),肿瘤实质部分占据大半个大脑半球截面,实质边缘仍可见大量成团细胞聚集(图3c)。以上结果显示小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型恶性程度高,且呈高度浸润式生长。
[0050]
将g422
tn-gbm细胞(5万/1μl)接种到昆明小鼠的右侧纹状体(n=6),分别在植入后第5、7和9天连续行小动物活体成像,记录5-9天内肿瘤在小鼠颅内的演进过程(图3d)。统计分析表明,荷瘤小鼠第5日平均光密度值(6.76
±
1.99,1
×
106,photons/sec)显著低于第7日(25.35
±
5.64,1
×
106,photons/sec)(p=0.0047)。第7日平均光密度值显著低于第9日(89.48
±
8.24,1
×
106,photons/sec)(p《0.0001)。以上结果揭示小鼠三阴型原发胶质母细胞瘤g422
tn-gbm在小鼠颅内呈进行式增大。
[0051]
(5)常规手术、放化疗在小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型上的治疗反应:为了评估临床上gbm标准疗法(常规手术联合放化疗综合治疗)在该治疗模型的治疗反应,我们首先选择在接种g422
tn-gbm细胞后第7天开始治疗(治疗方案见图4a),即肿瘤进展中期评估单独放疗、单独化疗以及同步放化疗对小鼠生存期的影响。生存曲线显示(图4b)单独放疗相较于对照组并不能显著延长小鼠生存时间(p=0.1332)。单独使用替莫唑胺可以显著提高延长小鼠生存时间(p=0.0001)。与单独使用替莫唑胺相比,替莫唑胺同步放化疗可进一步延长小鼠生存时间(p=0.0166)。体重变化曲线显示第10天左右对照组小鼠体
重开始出现急剧下降。这是由于肿瘤进展后期,肿瘤负荷变大,小鼠呈现恶病质状态,饮食量明显减少。放化疗组小鼠体重在药期间均有不同程度的下降,但能维持在25g左右,毒性反应可以耐受。
[0052]
紧接着,我们比较了肿瘤接种后第7日手术联合放化疗方案与放化疗的治疗效果。与放化疗相比,荷瘤小鼠在手术联合放化疗方案中存活并未明显获益(p=0.5770)(图4c)。体重变化曲线显示手术联合放化疗组相比放化疗组,体重变化未见明显差异。由于同步放化疗在该模型中已达到最大疗效,因此后续的治疗研究中我们将替莫唑胺同步放化疗作为基础疗法。
[0053]
接下来,我们测试了小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型在不同进展阶段(即接种后第5、7、9天)对替莫唑胺同步放化疗的治疗反应。生存分析(图4d)显示不同时间点的给药方案均可以显著改善小鼠生存期,且治疗效果与起始治疗时间密切相关。接种后第5天(早期)开始行同步放化疗干预,治疗效果相对较好,中位生存期为29天;接种后第7天(中期)干预时,中位生存期缩短至26天;接种后第9天(晚期)干预时,中位生存期进一步缩短至24.5天,且显著短于第5天开始治疗的中位生存期(p=0.0147)。所有组别小鼠全部出现死亡,且没有小鼠存活超过35天。综上,传统放化疗尽管可以适当延长荷瘤小鼠生存期,但并不能治愈该肿瘤,且肿瘤进展早期治疗效果相对晚期更好。小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型表现出与人脑恶性胶质瘤相似的治疗反应,强烈提示恶性胶质瘤早诊早治的益处。
[0054]
(6)在胶质瘤不同进展阶段系统评估甘露糖、联合治疗方案疗效,甘露糖联合替莫唑胺同步放化疗改善原位荷瘤小鼠生存:利用前期建立的小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型采取替莫唑胺同步放化疗治疗方案,分别于接种后第5、7、9天开始行甘露糖联合替莫唑胺同步放化疗,系统评价联合治疗效果。第5日开始给药方案示意图见图5a,定义为d5-therapy,第7日和第9日给药方案往后顺延,分别定义为d7-therapy和d9-therapy。肿瘤接种后第5天(肿瘤早期),我们整体评价了甘露糖联合放疗、化疗和同步放化疗的治疗效果。统计分析(图5b)显示:与对照组(中位生存期为18天)比较,甘露糖单药的中位生存期为20.5天,统计学存在差异(p=00225)。单独接受放射治疗的小鼠中位生存期为19天,统计学无明显差异(p=0.1710)。甘露糖联合放疗可将中位生存期显著延长至22天,小鼠生命延长22.2%(p=0.0032)(从此处开始,所有生存时间的增加均以对照组的中位生存期为基准)。替莫唑胺作为临床一线用药,在小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型,本身具有生存优势(中位生存期为25天;生命延长38.9%)。而将甘露糖联合替莫唑胺后,可进一步提高生存率(中位生存期为27.5天;生命延长52.8%)。作为胶质母细胞瘤术后标准治疗的替莫唑胺同步放化疗组,其中位生存期为30.5天,延长了69.4%的生命。当我们将甘露糖联合替莫唑胺同步放化疗后,中位生存期延长至68天,显著提高了治疗效果,几乎是对照组中位生存期的三倍。值得注意的是,甘露糖联合替莫唑胺同步放化疗组有50%(4/8)的小鼠获得了长期生存。
[0055]
体重变化曲线显示对照组小鼠在植入肿瘤后体重先进入上升期,第10天左右小鼠体重出现急剧下降。前期由于肿瘤负荷相对较小,未能影响小鼠正常饮食,肿瘤进展后期,小鼠呈现恶病质状态,饮食明显减少,故出现小鼠体重明显下降。实验中放疗组,替莫唑胺组在给药前期体重均未有增加,这是由于放疗和化疗的毒性所致。在治疗结束后,甘露糖联
合替莫唑胺组以及甘露糖联合同步放化疗组,体重仍然维持在相对高的水平,这与肿瘤得到有效控制有关。
[0056]
在许多胶质瘤的临床前研究中,治疗是在肿瘤植入后立即开始的。这些研究治疗效果尤为突出,但并不一定代表临床实际情况。在多数情况下,大部分患者都是在肿瘤晚期才得以诊断和治疗。于是我们将起始治疗时间延后至肿瘤植入后的第7天(肿瘤中期)和第9天(肿瘤晚期),再次评估甘露糖联合放化疗的有效性。g422
tn-gbm细胞植入后第7天给药干预,统计分析(图5c)显示甘露糖单药组的中位生存期为18天,与对照组(中位生存期:18.5天)比较无显著差异(p=0.9214)。替莫唑胺同步放化疗组仍能显著改善中位生存期(27天),当与甘露糖联合使用后生存期进一步显著延长至33天(p=0.0259),尽管不如第5日治疗效果突出,但仍有25%(2/8)的小鼠获得长期生存。当给药方案延迟至第9天开始,统计分析(图5d)显示甘露糖单药组中位生存期为19天,与对照组(中位生存期:18天)比较无显著差异(p=0.5060)。替莫唑胺同步放化疗组仍能显著改善中位生存期(25天),与甘露糖联合使用后生存期可延长至27天,生存期有延长的趋势,但未见统计学差异(p=0.2615)。综上,在胶质瘤颅内进展相对早期阶段,甘露糖联合替莫唑胺同步放化疗可达到治愈胶质瘤的作用,该数据与临床上癌症的早发现早治疗原则高度一致。
[0057]
(7)在小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型上评估二甲双胍或双硫仑/葡萄糖酸铜联合替莫唑胺同步放化疗方案疗效:利用前期建立的小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型采用同步放化疗治疗方案,于接种后第7天开始行二甲双胍或双硫仑/葡萄糖酸铜联合替莫唑胺同步放化疗,系统评价联合治疗效果。第7日开始给药方案示意图见图6a。生存曲线统计分析(图6b)显示:与对照组(中位生存期为18天)比较,单独替莫唑胺联合同步放化疗、二甲双胍联合替莫唑胺同步放化疗或双硫仑/葡萄糖酸铜联合替莫唑胺同步放化疗,均可延长小鼠的中位生存期,统计学存在差异。但与单独替莫唑胺联合同步放化疗组相比,二甲双胍或双硫仑/葡萄糖酸铜联合替莫唑胺同步放化疗均未明显延长小鼠的生存期,统计学不存在差异。这不仅提示甲双胍或双硫仑/葡萄糖酸铜联合替莫唑胺同步放化疗对提升单独放化疗的治疗效果不明显,又验证了本发明提及的小鼠三阴型原发胶质母细胞瘤g422
tn-gbm模型可用于恶性胶质瘤新疗法的临床前疗效评估以及肿瘤药物筛选的应用。参考文献:
[0058]
[1]claes a,idema aj,wesseling p.diffuse glioma growth:a guerilla war.acta neuropathol,2007,114(5):443-58.
[0059]
[2]stupp r,mason wp,van den bent mj,et al.radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma.n engl j med,2005,352(10):987-96.
[0060]
[3]dejaegher j,verschuere t,vercalsteren e,et al.characterization of pd-1upregulation on tumor-infiltrating lymphocytes in human and murine gliomas and preclinical therapeutic blockade.int j cancer,2017,141(9):1891-900.
[0061]
[4]hung al,maxwell r,theodros d,et al.tigit and pd-1dual checkpoint blockade enhances antitumor immunity and survival in gbm.oncoimmunology,2018,7(8):e1466769.
[0062]
[5]jiang h,rivera-molina y,gomez-manzano c,et al.oncolytic adenovirus and tumor-targeting immune modulatory therapy improve autologous cancer vaccination.cancer res,2017,77(14):3894-907.
[0063]
[6]caragher s,chalmers aj,gomez-roman n.glioblastoma's next top model:novel culture systems for brain cancer radiotherapy research.cancers(basel),2019,11(1).
[0064]
[7]szatmari t,lumniczky k,desaknai s,et al.detailed characterization of the mouse glioma 261tumor model for experimental glioblastoma therapy.cancer sci,2006,97(6):546-53.
[0065]
[8]martinez-murillo r,martinez a.standardization of an orthotopic mouse brain tumor model following transplantation of ct-2a astrocytoma cells.histol histopathol,2007,22(12):1309-26.
[0066]
[9]liu cj,schaettler m,blaha dt,et al.treatment of an aggressive orthotopic murine glioblastoma model with combination checkpoint blockade and a multivalent neoantigen vaccine.neuro oncol,2020.
[0067]
[10]ramachandran m,yu d,dyczynski m,et al.safe and effective treatment of experimental neuroblastoma and glioblastoma using systemically delivered triple microrna-detargeted oncolytic semliki forest virus.clin cancer res,2017,23(6):1519-30.
[0068]
[11]martikainen m,niittykoski m,von und zu fraunberg m,et al.microrna-attenuated clone of virulent semliki forest virus overcomes antiviral type i interferon in resistant mouse ct-2a glioma.j virol,2015,89(20):10637-47。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1