抗胶霉毒素自我保护基因GliK在协助宿主细胞抵抗胶霉毒素中的应用的制作方法
抗胶霉毒素自我保护基因glik在协助宿主细胞抵抗胶霉毒素中的应用
技术领域
1.本发明属于基因工程领域,具体涉及一种抗胶霉毒素自我保护基因glik在协助宿主细胞抵抗胶霉毒素中的应用。
背景技术:
2.前期本课题组从深海真菌geosmithia pallida fs140中分离得到了20多个胶霉毒素类化合物,包括结构罕见的胶霉毒素类二聚体化合物,其中大部分胶霉毒素类化合物具有明显的抗肿瘤活性。
3.胶霉毒素(gliotoxin,gt)是一类二酮哌嗪类化合物(epipolythiodioxopiperazine,etp),etp作为重要的毒力因子,其通过不同途经对各种细胞产生特异性毒性,在侵袭性曲霉病中发挥重要协同作用。etp发挥毒副作用主要通过二硫键,巯基与靶蛋白的交联进而灭活该蛋白活性,并能通过氧化还原循环产生具有毒害的活性氧(reactiveoxygenspecies,ros),ros生成机制被认为是gt产生细胞毒性的一种机制。目前对gt的研究局限于作为etp家族成员之一或烟曲霉毒素代谢物,因此胶霉毒素的很多毒性(如免疫抑制毒性)研究只集中于其作为初次级代谢产物而发挥毒性,而其本身毒性如细胞毒性、dna损伤以及对宿主的其他毒性机制尚无定论,有待进一步研究。
4.胶霉毒素对宿主的毒性主要包括:诱导细胞凋亡;导致氧化还原反应失衡;抑制蛋白酶体活性,导致nf
‑
κb活性被抑制,降低免疫活性等。它不仅对动植物细胞,而且对宿主菌也有毒性(kamei k,watanabe a.aspergillus mycotoxins and their effect on the host.medical mycology,2005,43:s95
–
s99.)。已有报道宿主菌体内存在某种机制抵抗胶霉毒素对它的毒性,而这种机制的引入对提高工业化生产菌株对毒素的耐受极为关键。
技术实现要素:
5.本发明的目的是提供抗胶霉毒素自我保护基因glik在协助宿主细胞抵抗胶霉毒素中的应用,所述的深海真菌geosmithiapallida fs140抗胶霉毒素自我保护基因glik,其核苷酸序列如seq id no.1所示。
6.本发明的深海真菌geosmithiapallida fs140抗胶霉毒素自我保护基因glik通过以下方法获得的:通过转录组测序结果预测编码抗胶霉毒素自我保护基因glik的序列,在其上下游设计特异性引物,其引物序列为glik
‑
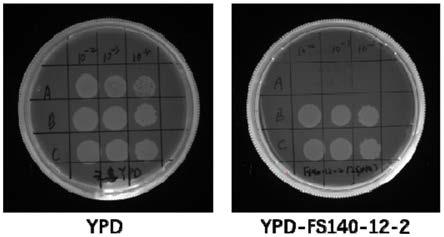
f:5'
‑
atgaccatacaactccctcacac
‑
3';glik
‑
r:5'
‑
agcggagggctgggcgtagc
‑
3',以由深海真菌fs140转录组反转录而得的cdna文库为模板,通过pcr扩增获得产物并纯化回收片段,获得抗胶霉毒素自我保护基因glik,其核苷酸序列如seq id no.1所示。
7.本发明利用同源重组法将glik基因插入到酵母载体yep352
‑
tef1
‑
cyc1的表达盒内部。首先设计含有同源臂的glik基因的上下游引物,其引物序列为yep352
‑
glik
‑
f:5'
‑
agcaatctaatctaagtctagaatgaccatacaactccctcacac
‑
3';yep352
‑
glik
‑
r:5'
‑
ttacatgatgc
ggcccgtcgacagcggagggctgggcgtagc
‑
3'(下划线序列为同源臂片段),通过pcr扩增获得产物并纯化回收片段。对已构建的yep352
‑
tef1
‑
cyc1载体采用内切酶sal i和xba i双酶切,然后使用clonexpress ii one step cloning kit c112(vazyme)将片段和酶切载体重组连接并转化至大肠杆菌感受态细胞,涂布于氨苄青霉素抗性平板筛选出阳性克隆。经过此轮分子克隆,目的基因glik(其核苷酸序列如seq id no.1所示)插入到启动子tef1和终止子cyc1之间,构建得到yep352
‑
tef1
‑
glik载体,将其电转入酿酒酵母bj5464
‑
d细胞中,利用尿嘧啶缺陷型的sd培养基平板进行筛选和验证。与转入yep352
‑
tef1
‑
cyc1质粒(阴性对照)的酿酒酵母bj5464
‑
d相比,含有重组载体yep352
‑
tef1
‑
glik的酿酒酵母生长速度明显加快,相同培养时间内菌落密度更高,证明功能基因glik能有效协助酿酒酵母抵抗外源胶霉毒素,为在酿酒酵母内重构胶霉毒素生物合成通路奠定基础。
8.本发明提供上述的深海真菌geosmithiapallida fs140抗胶霉毒素自我保护基因glik在协助宿主细胞抵抗胶霉毒素中的应用。
9.所述的宿主细胞优选为深海真菌geosmithia pallida fs140抗胶霉毒素或酿酒酵母saccha romyces cerevisiae bj5464。
10.与现有技术相比,本发明具有以下有益效果:
11.本发明所涉及的深海真菌geosmithiapallida fs140分离自南海沉积物,本课题组前期对该菌株进行了转录组测序并对胶霉毒素生物合成相关基因进行了注释。鉴于目前关于深海真菌geosmithiapallida fs140抗胶霉毒素自我保护基因的研究较少。因此本发明从深海真菌fs140的cdna文库中获得了抗胶霉毒素自我保护基因glik序列,并成功导入到酿酒酵母s.cerevisiae bj5464中进行了抗毒功能验证,从而为后期提高酿酒酵母抗胶霉毒素的能力,提升胶霉毒素的异源表达水平并获得新型胶霉毒素奠定分子生物学基础。
12.本发明的深海真菌geosmithiapallida fs140,其公开于文献:zhang
‑
hua sun,jiangyong gu,wei ye,liang
‑
xi wen,qi
‑
bin lin,sai
‑
ni li,yu
‑
chan chen,hao
‑
hua li,wei
‑
min zhang.geospallins a
–
c:new thiodiketopiperazines with inhibitory activity against angiotensin
‑
converting enzyme from a deep
‑
sea
‑
derived fungus geosmithia pallida fs140.marine drugs,2018,16(12),464.https://doi.org/10.3390/md16120464。该菌种本申请人也持有,保证自发明的申请日起20年内向公众提供。
附图说明
13.图1为实验所使用胶霉毒素7
‑
deoxy
‑
6,7
‑
didehydrogliotoxin(fs140
‑
12
‑
2)的结构式;
14.图2为深海真菌fs140 glik基因序列的获得:以fs140 cdna文库为模板,基因glik扩增产物的电泳图;
15.图3为重组载体yep352
‑
tef1
‑
glik的构建;其中a为yep352
‑
tef1
‑
cyc1载体图谱;b为yep352
‑
tef1
‑
glik载体图谱;c为基因glik的菌落pcr扩增产物的电泳图;
16.图4为三种酿酒酵母在ypd平板和ypd
‑
fs140
‑
12
‑
2平板(2.5μm)培养30h的效果图。a、酿酒酵母bj5464
‑
d(yep352
‑
tef1
‑
cyc1);b,酿酒酵母bj5464
‑
d(yep352
‑
tef1
‑
glik);c、正常酿酒酵母bj5464;10
‑2、10
‑3、10
‑4分别代表od
600
约为0.01、0.001、0.0001的5μl菌液样品。
具体实施方式
17.以下实施例是对本发明的进一步说明,而不是对本发明的限制。
18.本实施例中所用的sd固体培养基的配方为:每升含有葡萄糖20g、do supplement 0.62g(
‑
leu/
‑
trp/
‑
ura,clontech)、无氨基酵母氮源ynb 6.7g(普博欣)、亮氨酸0.06g、色氨酸0.04g和琼脂粉20g,余量为蒸馏水,其配制方法是将各成分混合均匀,灭菌制得。胶霉毒素fs140
‑
12
‑
2为本课题组分离自深海真菌geosmithiapallida fs140。
19.本实施例中所用的ypd固体培养基的配方为:每升含有酵母粉10g、蛋白胨20g、葡萄糖20g和琼脂粉20g,余量为蒸馏水,其配制方法是将各成分混合均匀,灭菌制得。
20.实施例1深海真菌geosmithiapallida fs140抗胶霉毒素自我保护基因序列的获得
21.基因glik的扩增:将深海真菌geosmithiapallida fs140接种于ypd培养基平板,于37℃培养72h,挑取新鲜的菌丝体,利用真菌rna提取试剂盒提取rna,再用all
‑
in
‑
one rtmaster kit逆转录获得cdna。根据转录组测序结果预测编码抗单端孢霉烯自我保护基因glik序列,在其上下游设计特异性引物,其引物序列为glik
‑
f:5'
‑
atgaccatacaactccctcacac
‑
3';glik
‑
r:5'
‑
agcggagggctgggcgtagc
‑
3',以cdna文库为模板扩增,获得pcr产物(图2)。回收产物并用peasy
‑
t1试剂盒进行ta克隆,转化至大肠杆菌感受态细胞,涂布于氨苄青霉素抗性平板筛选出阳性克隆,以通用引物m13
‑
f(5
′‑
gtaaaacgacggccagt
‑3′
)和m13
‑
r(5
′‑
caggaaacagctatgac
‑3′
)进行菌液pcr验证阳性克隆并测序,获得目的基因glik序列(其核苷酸序列如seq id no.1所示,atgaccatacaactccctcacacacctgacagagaagaaggccctggtgcttctcctgcatgcaagttcaatgcaatccagacattccggtggttatgggacctagtcatcccaactagcgaccttactcaagaaaccggtcgatatcctccgaagacgacgatcgagagacggcgcgcatcaaccacagatagatcgctcgataaggacgaatacctagctgagaaggtcgcaggtcatcaggtcgaagaacatgtccccccggagaagaccgtcctctacctcgcgtacggctcgaatctggccgcggagaccttcctgggcaagcgaggcattaggcctctatcccagatcaacgttgtcgttcccggcctacgactaactttcgaccttcctgggttaccatacgttgagccatgcttcgcagcgactcggcactggactcatacaccaagagtaacacaaacagaaggaaatggaagtaatgaaggggtcgatgcagaagtgttggagaattcgtccctcgtgccacaggagaagaacgacatgcctctcgtcggcgtcgtgtatgaggtcactgtcgccgattatgccaagataatagccacagagggtggtgggcgcggataccgagacgtcgttgtcgattgctatccttttcccaaatcatacagtcccaccgatccggtccctgagtgccccgaaaccaaacccttcaagtcccacaccctcctctctccagccgacgacgcagtctcgggtctcctggccgcagggaagtcataccgacccgtccgacccaatcctggctacgcccagccctccgcttga)。
22.实施例2抗胶霉毒素自我保护基因glik的功能验证
23.利用同源重组法将基因glik插入到酵母载体yep352
‑
tef1
‑
cyc1中(yep352
‑
tef1
‑
cyc1为早期构建质粒,携带有组成型启动子tef1和终止子cyc1,载体图谱见图3a,为现有技术中的已知产品:xiaodan ouyang,yaping cha,wen li,chaoyi zhu,muzi zhu,shuang li,min zhuo,shaobin huang and jianjun li.stepwise engineering of saccharomyces cerevisiae to produce(+)
‑
valencene and its related sesquiterpenes,rsc adv.,2019,9,30171,doi:10.1039/c9ra05558d)。首先设计针对基因glik(seq id no.1)扩增的上下游引物yep352
‑
glik
‑
f和yep352
‑
glik
‑
r,其引物序列为yep352
‑
glik
‑
f:5'
‑
agcaatctaatctaagtctagaatgaccatacaactccctcacac
‑
3';yep352
‑
glik
‑
r:5'
‑
ttacatgatgcggcccgtcgacagcggagggctgggcgtagc
‑
3'(下划线序列为同源臂片段),以cdna文库为模板扩增,通过pcr扩增获得产物。对载体yep352
‑
tef1
‑
cyc1采用sal i和xba i双酶切并回收产物,然后使用clonexpress ii one step cloning kit c112(vazyme)将两个产物重组连接并转化至dh5α中筛选阳性克隆。采用引物yep352
‑
glik
‑
f和yep352
‑
glik
‑
r进行菌落pcr验证,结果表明基因glik成功插入yep352
‑
tef1
‑
cyc1载体中(图3c),并通过测序予以确认,得到yep352
‑
tef1
‑
glik载体(载体图谱见图3b)。
24.制备毒素敏感型酿酒酵母saccharomyces cerevisiae bj5464
‑
d(relevant genotype:δpdr5δpdr10δpdr15)的感受态细胞(为现有技术中的已知产品,该菌株对毒性化合物更加敏感:wolfgang schweiger,jayanand boddu,sanghyun shin,brigitte poppenberger,franz berthiller,marc lemmens,gary j.muehlbauer,and gerhard adam.validation of a candidate deoxynivalenol
‑
inactivating udp
‑
glucosyltransferase from barley by heterologous expression in yeast,mpmi,2010,vol.23,no.7,doi:10.1094/mpmi
‑
23
‑7‑
0977)。将yep352
‑
tef1
‑
glik质粒载体以及yep352
‑
tef1
‑
cyc1质粒载体(阴性对照)分别电转入酿酒酵母bj5464
‑
d细胞中(1500v,5ms),均匀涂布于尿嘧啶缺陷型的sd平板中,在30℃培养2d,利用菌落pcr筛选阳性克隆,获得分别含有yep352
‑
tef1
‑
glik质粒以及yep352
‑
tef1
‑
cyc1质粒的酿酒酵母bj5464
‑
d细胞。
25.分别将酿酒酵母bj5464
‑
d(yep352
‑
tef1
‑
cyc1)、酿酒酵母bj5464
‑
d(yep352
‑
tef1
‑
glik)接种于相应缺陷型的sd培养基中,在30℃培养2d。用分光光度计测量各菌液od
600
,将各菌液用无菌水稀释到od
600
≈1.0作为原液,再以100μl的原液加900μl的无菌水的方式稀释成10
‑1,以同样的方式稀释成10
‑2、10
‑3、10
‑4。各取5μl不同菌株的10
‑2、10
‑3、10
‑4的稀释液分别在ypd平板和ypd
‑
fs140
‑
12
‑
2平板(含有2.5μm fs140
‑
12
‑
2胶霉毒素,图1)点板,在30℃培养并实时观察,以正常酿酒酵母bj5464作为对照。培养36h的平板结果显示(图4),酿酒酵母bj5464
‑
d(yep352
‑
tef1
‑
cyc1)、酿酒酵母bj5464
‑
d(yep352
‑
tef1
‑
glik)在不添加任何毒素的ypd平板上生长状况近乎一致,但在含有2.5μm fs140
‑
12
‑
2胶霉毒素的ypd平板上,阴性对照bj5464
‑
d(yep352
‑
tef1
‑
cyc1)明显生长受阻,几乎都不能长。而导入glik功能基因的酿酒酵母则生长良好,其不同稀释度下的菌体密度与正常酿酒酵母相当,说明来源于深海真菌geosmithiapallida fs140的glik功能基因部分或全部恢复了酿酒酵母bj5464
‑
d对外源添加毒素的耐受性,有效帮助酿酒酵母在含有毒素的环境下正常生长。
26.以上仅是本发明的优选实施方式,应当指出的是,上述优选实施方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本技术领域的普通技术人员来说,在不脱离本发明的精神和范围内,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1