一种利用NAD(P)-依赖型醇脱氢酶催化生产D-阿洛酮糖的方法与流程
本发明属于稀有糖生物转化技术领域,具体涉及一种利用nad(p)-依赖型醇脱氢酶催化生产d-阿洛酮糖的方法。
背景技术:
国际稀有糖协会(internationalsocietyofraresugars,isrs)定义稀有糖为自然界中存在但含量极少的一类单糖及其衍生物。稀有糖具有低热量、低吸收等特点,并且具有多种多样的生理功能,在膳食、保健、医药等领域发挥重要作用。
d-阿洛酮糖是d-果糖的c-3位差向异构体,是一种超低热量稀有糖,其甜度是蔗糖的70%,且几乎不被消化道吸收,因此d-阿洛酮糖可能会成为一种有利于减肥的理想的蔗糖替代甜味剂。另外,d-阿洛酮糖还具有降低血糖、抗氧化、神经保护以及治疗心血管疾病等作用。d-阿洛酮糖也被美国食品和药物管理局(fda)批准为“一般认为是安全的”(gras),编号为grnno.400,允许用作食品和膳食补充剂的成分。
当前,d-阿洛酮糖的生产主要是通过生物转化的方式。据报道,d-阿洛酮糖3-差向异构酶(d-psicose3-epimerase,dpe)、d-塔格糖3-差向异构酶(d-tagatose3-epimerase,dte)或l-核酮糖3-差向异构酶(l-ribulose3-epimerases,lre)皆可催化d-果糖为d-阿洛酮糖。其中,d-阿洛酮糖3-差向异构酶对d-阿洛酮糖具有较高的底物特异性,具有重要研究价值。但是,利用差向异构酶催化d-果糖生产d-阿洛酮糖会受到热力学平衡的制约,导致d-阿洛酮糖的转化率低,生产能力弱。另外,菌株bacilluspallidusy25和enterobacteraerogenesik7的静息细胞反应可以实现由阿洛醇直接生产d-阿洛酮糖,但微生物转化法制备d-阿洛酮糖,虽不涉及热力学平衡问题,且工艺步骤简单,但微生物存在生产周期长、反应条件各异,产物提取工艺复杂等问题,也会导致总成本偏高,不适合工业化生产。
酶催化转化法具有催化反应条件温和、转化率高、产物易分离等优点,但目前并未见有关于任何酶催化阿洛醇产生d-阿洛酮糖的专利和报道。
技术实现要素:
为了解决上述的技术问题,本发明的目的是提供一种利用nad(p)-依赖型醇脱氢酶催化生产d-阿洛酮糖的方法,该方法通过酶催化将阿洛醇转化为d-阿洛酮糖,其操作简单,成本低,可以实现d-阿洛酮糖的规模化生产。
为了实现上述的目的,本发明采用了以下的技术方案:
本发明提供了一种利用nad(p)-依赖型醇脱氢酶催化生产d-阿洛酮糖的方法,包括以下步骤:
(1)重组质粒pet22b-adh的构建:将nad(p)-依赖型醇脱氢酶基因合成无his标签的重组质粒petduet-1-adh,并以此为模板,以引物对adh-pet22b-ndei-u:5’-gggaattccatatggcccaggccctggtgctggaaaag-3’;adh-pet22b-xhoi-d:5’-ccgctcgagcagaacaatctgcagtttaacatc-3’为上下游引物进行pcr扩增,获得的目的基因adh片段,产物回收后利用限制性内切酶ndei和xhoi分别对质粒pet22b和pcr扩增产物进行双酶切,双酶切产物回收后利用t4连接酶进行连接,得到重组质粒pet22b-adh;
(2)重组菌株的构建:将重组质粒pet22b-adh通过热激转化法转入表达感受态细胞中,再于lb液体培养基上复苏,复苏后,再涂布于含有氨苄青霉素抗性的lb固体平板上,静置培养过夜;挑取单菌落转接至添加氨苄青霉素的lb培养基中,继续培养得到重组菌株;
(3)粗酶液的制备:将重组菌株按照1%的接种量接种到含有amp的lbg培养基中,37℃摇床培养至od600在0.8时添加iptg,然后将温度降低到20℃,继续诱导培养;培养完成后,将菌液低温离心,收集菌体后重悬,再利用超声波破碎仪对重悬菌液进行超声破碎,振幅设置为60,破5s,停10s直到菌液透明,低温离心收集上清液,上清液即为粗酶液;
(4)纯酶液的制备:选择镍柱作为分离纯化柱,将粗酶液过镍柱,先用bindingbuffer冲洗镍柱,再用elutionbuffer淋洗蛋白,得到的淋洗液再利用10kda超滤管浓缩纯化至蛋白浓度为20mg/ml,得到纯酶液;
(5)d-阿洛酮糖的制备:将体积比为10%的纯酶液或粗酶液与体积比为70%的20mmna2hpo4-nah2po4缓冲液,10%的500mm阿洛醇溶液、10%的20mmnad+溶液组成反应体系,将反应体系内的溶液混合均匀后置于50℃,摇床反应4h,得到d-阿洛酮糖。
进一步的,所述nad(p)-依赖型醇脱氢酶来源于gluconobacterfrateurii。
进一步的,所述nad(p)-依赖型醇脱氢酶基因是根据nad(p)-依赖型醇脱氢酶的氨基酸序列,按照大肠杆菌密码子分析用表对原始序列进行密码子优化后合成获得的。
进一步的,所述nad(p)-依赖型醇脱氢酶基因具有下列核苷酸序列之一:
(1)seqidno.2所示的核苷酸序列;
(2)与seqidno.2所示的核苷酸序列具有95%以上同源性且编码与seqidno.1所示的氨基酸序列具有相同功能氨基酸序列的核苷酸序列。
进一步的,所述步骤(5)中的另一反应体系包括体积比为10%的500mm阿洛醇溶液和90%的粗酶液。
进一步的,所述bindingbuffer包括20mmnah2po4,500mmnacl,30mm咪唑,ph7.4。
进一步的,所述elutionbuffer包括20mmnah2po4,500mmnacl,200mm咪唑,ph7.4。
进一步的,所述lbg培养基包括10g/l蛋白胨、5g/l酵母粉、10g/l氯化钠和5g/l葡萄糖。
与现有技术相比,本发明的技术方案具有以下优点:
本发明是首次利用来源于gluconobacterfrateurii的nad(p)-依赖型醇脱氢酶(adh)作为生物催化剂,催化阿洛醇转化生产d-阿洛酮糖。本发明方法简单、快速,既可以利用粗酶液也可以利用纯酶液生产d-阿洛酮糖,还能够在不额外添加价格昂贵的辅酶nad+的情况下生产d-阿洛酮糖;本发明反应条件温和、转化率高、转化时间短、副产物少,尤其是纯酶液副产物极少,转化效果极好;并且该方法得到的产物易分离,成本低,不仅拓展了d-阿洛酮糖的生产方法,还可用于大规模的分离纯化d-阿洛酮糖,适合d-阿洛酮糖的工业化生产,因此该方法具有较高的实际应用价值。
附图说明
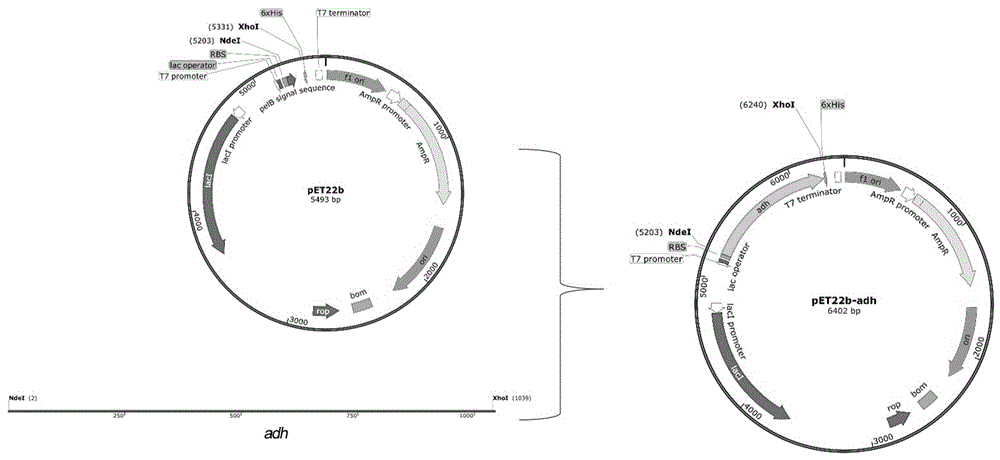
图1:重组质粒pet22b-adh构建图。
图2:重组质粒pet22b-adh菌落pcr验证(a)和双酶切验证图(b);其中m:marker;c1:以petduet-1-adh为模板的阳性对照pcr产物;c2:以无菌双蒸水为模板的阴性对照pcr产物;1-10:以重组菌株e.colidh5a-pet22b-adh单菌落为模板的pcr产物;11:ndei和xhoi双酶切产物。
图3:sds-page重组蛋白分析图;其中m:proteinmarker;1:重组菌株e.colibl21star(de3)-pet22b全蛋白;2:重组菌株e.colibl21star(de3)-pet22b-adh全蛋白;3:重组菌株e.colibl21star(de3)-pet22b-adh上清液;4:重组菌e.colibl21star(de3)-pet22b-adh沉淀。
图4:adh纯化图;其中m:marker;1:adh粗酶液;2:200mm咪唑淋洗液。
图5:adh纯酶液催化阿洛醇为d-阿洛酮糖的液相图;其中1:阿洛醇标准品;2:d-阿洛酮糖标准品;3:反应液。
图6:在添加辅酶nad+的条件下adh粗酶液催化阿洛醇为d-阿洛酮糖的液相图;其中1:阿洛醇标准品;2:d-阿洛酮糖标准品;3:反应液。
图7:在不添加辅酶nad+的条件下adh粗酶液催化阿洛醇为d-阿洛酮糖的液相图;其中1:阿洛醇标准品;2:d-阿洛酮糖标准品;3:反应液;4:副产物。
具体实施方式
以下结合具体实施例对本发明的技术方案做进一步详细的说明。
实施例1
nad(p)-依赖型醇脱氢酶(adh)来源于gluconobacterfrateuriinbrc3264(nz_bewn01000006.1),该酶的id号码为wp_099183078.1,其氨基酸序列如seqidno.1所示。
nad(p)-依赖型醇脱氢酶基因adh是根据nad(p)-依赖型醇脱氢酶(adh)的氨基酸序列,按照大肠杆菌密码子分析用表对原始序列进行密码子优化后合成的,优化后的nad(p)-依赖型醇脱氢酶基因adh的核苷酸序列如seqidno.2所示。
一种利用nad(p)-依赖型醇脱氢酶催化生产d-阿洛酮糖的方法,具体如下:
一、重组质粒pet22b-adh的构建以及验证
重组质粒pet22b-adh构建谱图如图1所示。
1、pcr扩增目的基因adh:将优化后的nad(p)-依赖型醇脱氢酶基因adh通过生物公司合成的无his标签的重组质粒petduet-1-adh,以此为模板,以引物对adh-pet22b-ndei-u:5’-gggaattccatatggcccaggccctggtgctggaaaag-3’(seqidno.3)和adh-pet22b-xhoi-d:5’-ccgctcgagcagaacaatctgcagtttaacatc-3’(seqidno.4)为上下游引物扩增目的基因adh,并对pcr扩增产物进行回收。
2、双酶切质粒pet22b和pcr扩增产物adh:利用限制性内切酶ndei和xhoi分别对质粒pet22b和pcr扩增产物adh进行双酶切,并对双酶切产物进行回收。
3、连接:利用t4连接酶连接双酶切产物pet22b和adh,得到连接液。
4、构建重组菌e.colidh5a-pet22b-adh:取50μl克隆感受态细胞e.colidh5α,加入10μl上述制得的连接液,冰浴30min;然后在42℃水浴中热击45s,再立即冰浴2min;而后加入500ml无菌无抗生素的lb液体培养基,37℃、200rpm复苏1h,取100ml转化液涂布于含有amp抗性的lb固体平板,37℃静置培养过夜。
5、菌落pcr验证:从上述的lb固体平板上挑取10个单菌落依次混入含有10μl无菌双蒸水的无菌pcr管中,所得细菌溶液作为pcr扩增模板。另外,设置以重组质粒petduet-1-adh为模板的阳性对照c1,设置以无菌双蒸水为模板的阴性对照c2。pcr反应结束后经琼脂糖凝胶电泳进行验证,验证结果如图2a所示,所挑取的10个单菌落皆为阳性,验证成功。
6、双酶切验证:取菌落pcr验证成功的单菌落溶液接种到含有100μg/mlamp的lb液体培养基中,37℃、200rpm培养12h后提取质粒,利用限制性内切酶ndei和xhoi对质粒进行双酶切,酶切结束后利用琼脂糖凝胶电泳验证adh是否连接成功,所得验证结果如图2b所示,双酶切验证成功。
7、公司测序:对经菌落pcr验证和双酶切验证成功后的重组质粒送测序公司进行测序验证,测序所得序列与已知序列一致,验证成功,最终成功得到重组质粒pet22b-adh。
二、e.colibl21star(de3)-pet22b-adh的构建及sds-page蛋白表达验证
1、重组菌株e.colibl21star(de3)-pet22b-adh的构建和其诱导培养
(1)取50μl表达感受态细胞e.colibl21star(de3),加入5μl测序成功的重组质粒pet22b-adh,冰浴30min,然后在42℃水浴中热击45s,再立即冰浴2min,而后加入500μl无菌无抗生素的lb液体培养基,37℃,200rpm复苏1h后取100μl转化液涂布于含有氨苄青霉素抗性的lb固体平板上,37℃静置培养过夜。次日,从lb固体平板上挑取单菌落转接至含有10mllb培养基的50ml锥形瓶中,并添加氨苄青霉素至浓度为100μg/ml,37℃,200rpm培养12h。
(2)按照1%的接种量将重组菌株e.colibl21star(de3)-pet22b-adh接种到含有10mllbg培养基的50ml锥形瓶中,37℃,200rpm培养约3h至od600在0.8左右时添加0.2mmiptg,然后将温度降低到20℃,转速降低至100rpm,继续诱导培养12h。其中,lbg培养基包括10g/l蛋白胨、5g/l酵母粉、10g/l氯化钠和5g/l葡萄糖。
2、对照菌株e.colibl21star(de3)-pet22b的构建和其诱导培养
(1)取50μl表达感受态细胞e.colibl21star(de3),加入5μl空质粒pet22b,冰浴30min,然后在42℃水浴中热击45s,再立即冰浴2min,而后加入500μl无菌无抗生素的lb液体培养基,37℃,200rpm复苏1h后取100μl转化液涂布于含有氨苄青霉素抗性的lb固体平板上,37℃静置培养过夜。次日,从lb固体平板上挑取单菌落转接至含有10mllb培养基的50ml锥形瓶中,并添加氨苄青霉素至浓度为100μg/ml,37℃,200rpm培养12h。
(2)按照1%的接种量将重组菌e.colibl21star(de3)-pet22b接种到含有10mllbg培养基的50ml锥形瓶中,37℃,200rpm培养约3h至od600在0.8左右时添加0.2mmiptg,然后将温度降低到20℃,转速降低至100rpm,继续诱导培养12h。
3、重组菌株e.colibl21star(de3)-pet22b-adh的蛋白表达验证
各取1ml上述诱导培养所得菌液,14000rpm离心1min,除去培养基上清,得到菌体。用无菌双蒸水重悬洗涤菌体两次,14000rpm离心1min,除去上清,得到菌体,再加入400μl无菌双蒸水重悬菌体;然后用超声破碎仪破碎菌体,振幅设置为60,破5s,停10s直到菌液透明。取30μl用于全蛋白检测,剩余370μl14000rpm离心5min取30μl上清作为可溶性蛋白检测,所得沉淀用无菌双蒸水重悬洗涤菌体两次后再加入无菌双蒸水重悬沉淀,取30μl重悬液作为不可溶蛋白检测。在上述30μl蛋白样品中各加入6μl上样缓冲液,充分混匀后利用pcr仪100℃裂解10min变性。最后,进行sds-page蛋白电泳验证,所得结果如图3所示,目的蛋白adh表达,而且主要存在于上清中,是可溶性蛋白。
三、nad(p)-依赖型醇脱氢酶(adh)的纯化
按照1%的接种量将重组菌株e.colibl21star(de3)-pet22b和e.colibl21star(de3)-pet22b-adh接种于含有100μg/mlamp的lbg液体培养基中,37℃,200rpm培养约3h至od600在0.8左右时添加0.2mmiptg,然后将温度降低到20℃,转速降低至100rpm,继续诱导培养12h。培养完成后,菌液10000rpm,4℃离心5min收集菌体,然后按照每1g菌体添加5mlbindingbuffer(ph7.4,20mmnah2po4,500mmnacl,30mm咪唑)的比例添加bindingbuffer进行重悬;然后使用超声波破碎仪破碎菌体,振幅设置为60,破5s,停10s直到菌液透明,再10000rpm,4℃离心15min收集上清液,此上清液即为粗酶液。利用bradford法对蛋白浓度进行定量,所得粗酶液中蛋白的浓度为20mg/ml。
选择5ml镍柱作为分离纯化柱,上清液过镍柱,然后用bindingbuffer冲洗镍柱,再用elutionbuffer(ph7.4,20mmnah2po4,500mmnacl,200mm咪唑)淋洗蛋白,得到淋洗液,上述操作均在冰上进行。利用sds-page对所得淋洗液进行纯度验证,所得结果如图4所示,含有200mm咪唑的elutionbuffer可以将adh蛋白洗脱下来,从而得到纯化的adh蛋白。然后,用10kda超滤管浓缩纯化所得adh蛋白至浓度为20mg/ml,用于后续反应。
四、nad(p)-依赖型醇脱氢酶(adh)纯酶液催化阿洛醇为d-阿洛酮糖的验证
以双蒸水配制500mm阿洛醇底物溶液,以双蒸水配制20mmnad+溶液,以双蒸水配制20mmna2hpo4-nah2po4缓冲液(ph7.0),以纯化所得adh纯酶液作为生物催化剂。1ml反应体系内含有700μl20mmna2hpo4-nah2po4缓冲液(ph7.0)、100μl500mm阿洛醇底物溶液、100μl20mmnad+溶液和100μladh纯酶液。将上述溶液混合后,置于50℃,200rpm摇床中反应4h,利用hplc对反应液进行检测分析。所用仪器为日本岛津液相色谱仪,检测器为示差折光检测器(rid),色谱柱为赛分科技有限公司的carbomixpb-np10:8%(7.8×300mm,10μm)分析柱,流动相为双蒸水,柱温78℃,流速0.5ml/min,进样量为10μl。所得hplc谱图如图5所示,经验证adh纯酶液可催化阿洛醇为d-阿洛酮糖。
实施例2
1、利用nad(p)-依赖型醇脱氢酶(adh)粗酶液在添加辅酶nad+的条件下催化阿洛醇为d-阿洛酮糖
以双蒸水配制500mm阿洛醇底物溶液,以双蒸水配制20mmnad+溶液,以双蒸水配制20mmna2hpo4-nah2po4缓冲液(ph7.0),以实施例1所得adh粗酶液作为生物催化剂。1ml反应体系内含有700μl20mmna2hpo4-nah2po4缓冲液(ph7.0),100μl500mm阿洛醇底物溶液,100μl20mmnad+溶液和100μladh粗酶液。将反应混合液置于50℃,200rpm摇床中反应6h,利用hplc对反应液进行检测分析,所得d-阿洛酮糖的浓度约为3.5g/l。所得hplc谱图如图6所示,adh粗酶液可催化阿洛醇为d-阿洛酮糖。
2、利用nad(p)-依赖型醇脱氢酶(adh)粗酶液在不添加辅酶nad+的条件下催化阿洛醇为d-阿洛酮糖
以双蒸水配制500mm阿洛醇底物溶液,以实施例1所得的adh粗酶液作为生物催化剂。1ml反应体系内含有100μl500mm阿洛醇底物溶液和900μladh粗酶液。将反应混合液置于50℃,200rpm摇床中反应6h,利用hplc对反应液进行检测分析,所得d-阿洛酮糖的浓度约为2.8g/l。所得hplc谱图如图7所示,虽然adh粗酶液在不额外添加辅酶nad+的条件下也可以催化阿洛醇为d-阿洛酮糖,但是与添加辅酶nad+相比,d-阿洛酮糖的产量低,粗酶液用量较大,而且容易生成副产物。
以上实施例仅用以说明本发明的技术方案,而非对其进行限制;尽管参照前述实施例对本发明进行了详细的说明,对于本领域的普通技术人员来说,依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或替换,并不使相应技术方案的本质脱离本发明所要求保护的技术方案的精神和范围。
序列表
<110>青岛龙鼎生物技术有限公司
<120>一种利用nad(p)-依赖型醇脱氢酶催化生产d-阿洛酮糖的方法
<160>4
<170>siposequencelisting1.0
<210>1
<211>345
<212>prt
<213>gluconobacterfrateurii
<400>1
metalaglnalaleuvalleuglulyslysglygluleuserleuarg
151015
gluilealaleuprosergluleuglyproasnaspvalargileala
202530
ilehisthrvalglyilecysglyseraspvalhistyrtyrthrhis
354045
glyalaileglyprophevalvalarggluprometvalleuglyhis
505560
glualaserglythrilethrgluileglyserasnvalargserleu
65707580
lysvalglyaspargvalcysmetgluproglyileproaspprogln
859095
serargalathrleumetglyglntyrasnvalaspproalavalarg
100105110
phetrpalathrproproilehisglycysleuthrproservalval
115120125
hisproalaalaphethrphelysleuproaspasnvalserpheala
130135140
gluglyalametilegluproleualavalglyvalhisalaserval
145150155160
lysalaalailelysproglyaspilecysleuvalthrglycysgly
165170175
proileglyilemetthralaleualaalaleualaserglyalagly
180185190
glnvalpheilethraspleualaproalalysleualailealagly
195200205
glntyraspglyileargproileasnvalargaspglulysproarg
210215220
aspvalvalaspalathrcysglyserasptrpglyvalaspvalval
225230235240
pheglualaserglyphealaglyalatyraspaspalaleualacys
245250255
valargproglyglythrilevalphevalglymetproileglnlys
260265270
valpropheaspilevalalaalaglnalalysgluileargmetglu
275280285
thrvalpheargtyralaasnvaltyraspargalaileargleuile
290295300
seralaglylysileaspleulysproleuvalsergluthrphepro
305310315320
pheaspglnglyilealaalaphegluargalaalaglualaargpro
325330335
seraspvallysleuglnilevalleu
340345
<210>2
<211>1038
<212>dna
<213>人工序列(artificialsequence)
<400>2
atggcccaggccctggtgctggaaaagaaaggcgaactgagtctgcgcgaaattgccctg60
ccgagcgaactgggtccgaatgatgttcgtattgcaattcataccgtgggcatttgtggc120
agcgatgtgcattattatacccatggtgccattggtccgtttgttgttcgcgaaccgatg180
gttctgggccatgaagcaagtggcaccattaccgaaattggtagtaatgtgcgcagtctg240
aaagttggcgatcgtgtttgcatggaaccgggcattccggatccgcagagtcgcgcaacc300
ctgatgggtcagtataatgtggatccggccgtgcgcttttgggcaaccccgcctattcat360
ggttgcctgaccccgagtgtggtgcatccggcagcattcacttttaaactgccggataat420
gttagttttgccgaaggcgccatgattgaaccgctggcagtgggtgtgcatgcaagcgtg480
aaagcagccattaagccgggtgacatttgtctggtgaccggctgcggtccgattggtatt540
atgaccgccctggcagccctggccagtggcgcaggtcaggtgtttattaccgatctggcc600
ccggcaaaactggcaattgcaggtcagtatgatggtattcgcccgattaatgttcgtgat660
gaaaaaccgcgtgatgtggttgatgcaacctgtggcagcgactggggtgtggatgttgtg720
tttgaagcaagcggttttgccggcgcatacgatgatgccctggcctgcgtgcgtccgggc780
ggtaccattgtgtttgtgggtatgccgattcagaaagtgccgtttgatattgtggccgcc840
caggcaaaagaaattcgtatggaaaccgtgtttcgctatgccaatgtttatgatcgtgca900
attcgcctgattagtgcaggcaaaattgatctgaaaccgctggtgagcgaaacctttccg960
tttgatcagggtattgccgcatttgaacgtgccgcagaagcacgcccgagcgatgttaaa1020
ctgcagattgttctgtaa1038
<210>3
<211>38
<212>dna
<213>人工序列(artificialsequence)
<400>3
gggaattccatatggcccaggccctggtgctggaaaag38
<210>5
<211>33
<212>dna
<213>人工序列(artificialsequence)
<400>5
ccgctcgagcagaacaatctgcagtttaacatc33
- 还没有人留言评论。精彩留言会获得点赞!