微流控芯片的制作方法
1.本公开涉及微流控芯片,具体涉及进行细胞筛选和捕获的微流控芯片。
背景技术:
2.在各种生物检测场景中,需要利用细胞筛选装置从试剂中将目标细胞分离出来,以对目标细胞进行进一步的操作,例如观测或者检验等。如在辐射暴露等条件下机体神经与免疫功能可能发生改变,此时需要检测不同阶段下的免疫细胞(immune cells)的状态,又如在实体肿瘤在生长过程中产生进入人体外周血的循环肿瘤细胞(ctc,circulating tumor cells),在适宜条件下这些细胞将进一步繁殖形成继发性肿瘤,严重影响病人病情的发展,因此需及时分离病人血液以检测ctc含量和观测ctc状态。目前,以ctc为代表的液体活检技术已经在肿瘤筛查、预后检测、药效评价等多方面开展应用。通常,健康人的血液中是没有ctc的,一般患者的血液中,10ml血液中含有的ctc数目也只有1~10个。目前的规则是在7.5ml血液中,如果检测到的ctc数目大于5个,则病人预后较差;ctc数目小于等于5个,则病人预后较好。为了尽早地发现ctc,需要将ctc从人外周血中分离出来进行ctc数量的监测,为癌症病人的治疗及预后评估提供依据。然而,在1ml血液中约含有五百万个单核细胞,在此背景条件下获得ctc细胞犹如大海捞针,同时ctc浓度含量较低,筛选出单一的ctc需要装置具有极高的灵敏度和精确度。
3.目前对于筛选目标细胞的筛选方法主要有两类:基于抗原抗体的免疫亲和捕获法和物理特性筛选法,这里以ctc为例对两种方法进行简单介绍。基于抗原抗体的免疫亲和捕获法是利用ctc与血液中其他细胞表面标志物的差异以达到筛选的目的,基于ctc表面的特异性抗原,通过固定在基底表面或磁性颗粒上的针对ctc表面特异性抗原的抗体或核酸适配体,实现循环肿瘤细胞的特异性捕获并与血液中其他细胞实现分离。但这种方法具有较大的缺陷:由于ctc的个体异质性较高,基于抗体的免疫亲和捕获法只能捕获上皮来源肿瘤细胞,具有较高的假阴性,容易漏检其他不同来源的肿瘤细胞,如间质来源、干细胞来源等肿瘤细胞。
4.物理特性筛选法是利用ctc与血液中其他细胞物理性质的差异,如密度、大小、力学差异,实现ctc与其他细胞的分离。例如从大小上比较:ctc的直径约为10
‑
20μm,而血细胞中红细胞直径约为6
‑
9μm,血小板直径约为1
‑
4μm,白细胞直径约为7
‑
20μm。从密度上比较:ctc的密度较白细胞和红细胞的密度小。从力学特性上比较:ctc的可变形性不及血细胞。此时可根据上述物理差异设计小于ctc直径的微孔、微过滤网、微柱等筛选结构,当含有ctc的样品流经筛选结构时,ctc由于直径大不易变形而被卡在结构内,尺寸小的血细胞则随缓冲液一起流出,较大的白细胞被结构捕获时,由于白细胞比ctc硬度更小、变形性更大,加大缓冲液流速时,白细胞被冲走,ctc则留在筛选结构内,从而达到ctc分离目的。
5.但现有物理特性筛选法中,目标细胞在进入容置腔后,该容置腔对应的筛选通道还能继续分流,试样中小细胞和其他目标细胞还会进入该容置腔试图从筛选通道中漏出,这会导致持续对先进入的目标细胞产生推力,导致可能会把先进入的目标细胞挤入或挤出
筛选通道进入出口通道,或者反冲脱离容置腔回到入口通道,不利于目标细胞的捕获,使得微流控芯片的捕获效率大大降低。
技术实现要素:
6.本公开的目的在于提供一种微流控芯片,可以有效防止目标细胞从筛选通道中脱离,提高单个容置腔的捕获效果。
7.为实现上述目的的微流控芯片,包括进样口、筛选管道和出样口,所述筛选管道包括入口通道、出口通道和筛选单元,所述筛选单元设置在所述入口通道和所述出口通道之间,所述筛选单元包括容置腔和筛选通道。所述筛选通道的顶部构造成阻挡部,所述阻挡部限定所述筛选通道的高度,所述高度容许卡入所述容置腔的目标细胞能封闭所述筛选通道。
8.所述容置腔的宽度沿所述入口通道的导流方向设置成至少部分不同。
9.沿所述入口通道的导流方向,靠近所述进样口或/和所述出样口一侧的所述容置腔的宽度设置得较窄,位于所述筛选管道中间段的所述容置腔的宽度设置得较宽。
10.所述筛选单元还包括外凹槽,所述外凹槽在所述筛选通道靠近所述出口通道的一侧向内凹陷设置。
11.所述筛选单元的一个所述容置腔对应邻接多个筛选通道。
12.所述筛选单元的导流方向相对所述入口通道的导流方向倾斜。
13.优选的,导流方向倾斜角度为45度。
14.沿所述入口通道的导流方向,位于所述入口通道两侧的所述筛选单元的入口彼此错开设置。
15.所述入口通道的宽度沿所述入口通道的导流方向呈逐渐收缩后逐渐扩张的形状。
16.连接所述进样口和所述筛选管道的入液分流管道或/和连接所述出样口和所述筛选管道的出液分流管道为多级分流管道,所述多级分流管道的每级设置为两股分流,且相对于上一级,管道尺寸减半。
17.通过在筛选通道顶部增加阻挡部,可以减小筛选通道入口的高度,在目标细胞卡入该筛选单元的容置腔后,以目标细胞堵住筛选通道入口,实现该筛选通道的堵塞,不再用于分流或减少该筛选通道的流量。目标细胞可能也无法完全封堵住入口,但目标细胞进入容置腔后也能缩小筛选通道的入口尺寸,大大减小该筛选通道的流量,从而结束或减轻该筛选单元的细胞捕获任务,同时也可以防止已捕获的目标细胞因流体冲击而脱离容置腔。通过增加阻挡部,一个容置腔可只捕获一个目标细胞,实现了最优的截留效果,同时也有利于后续光学检测的目标细胞数量识别,提高上述微流控芯片的捕获效率。
附图说明
18.图1是增设阻挡部的微流控芯片示意图。
19.图2是增设阻挡部的筛选通道的放大图。
20.图3是具有不同容置腔宽度的筛选单元的示意图。
21.图4是倾斜设置的筛选单元的示意图。
22.图5是交错设置的筛选单元的示意图。
23.图6是具有外凹槽的筛选单元的示意图。
24.图7是外凹槽的放大图。
25.图8是单容置腔对应两个筛选通道的示意图。
26.图9是单容置腔对应三个筛选通道的示意图。
27.图10是入口通道宽度呈逐渐收缩后逐渐扩张形状的示意图。
28.图11是具有多级分流管道的微流控芯片示意图。
29.符号说明
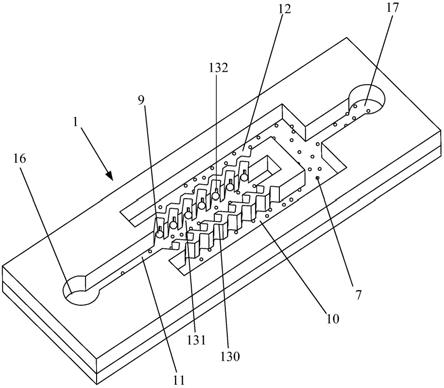
30.1微流控芯片
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
23阻挡部
31.7非目标细胞
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
130筛选单元
32.9目标细胞
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
131容置腔
33.10筛选管道
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
132筛选通道
34.11入口通道
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
134第二通道
35.12出口通道
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
135第三通道
36.16进样口
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
136第一分叉部
37.17出样口
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
137第二分叉部
38.20入液分流管道
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
138外凹槽
39.21出液分流管道
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
141两侧壁面
具体实施方式
40.下面结合具体实施例和附图对本实用新型作进一步说明,在以下的描述中阐述了更多的细节以便于充分理解本实用新型,但是本实用新型显然能够以多种不同于此描述的其它方式来实施,本领域技术人员可以在不违背本实用新型内涵的情况下根据实际应用情况作类似推广、演绎,因此不应以此具体实施例的内容限制本实用新型的保护范围。
41.需要注意的是,这些以及后续其他的附图均仅作为示例,其并非是按照等比例的条件绘制的,并且不应该以此作为对本实用新型实际要求的保护范围构成限制。
42.如图1所示的微流控芯片,包括进样口16、出样口17和筛选管道10。进样口16用以提供试样,进样口16与换向阀连通,以向微流控芯片1输入来自进样泵的预设液,例如实现芯片内通道的清洗的缓冲液、对微流控芯片1中富集的目标细胞9进行染色的染色液等。出样口17与废液收集部连通,将微流控芯片1筛选细胞后的废液进行收集。
43.在进样口16和出样口17之间设置筛选管道10,筛选管道10内设置有入口通道11和出口通道12,筛选单元130设置在入口通道11和出口通道12之间,筛选单元130包括容置腔131和筛选通道132,入口通道11通过筛选单元130中的容置腔131、筛选通道132与出口通道12连通。
44.筛选通道132的宽度小于目标细胞9的最小宽度,容置腔131的宽度大于目标细胞9的宽度。例如目标细胞9以为ctc为例,则筛选通道132的宽度优选为8μm,容置腔131的宽度优选大于8μm。
45.携带目标细胞9和非目标细胞7的血液样本从进样口16流入入口通道11,携带的目标细胞9因尺寸较大等原因无法通过狭窄的筛选通道132而被截留在筛选单元130的容置腔131或入口通道11中,血液样本中的液体和尺寸较小的非目标细胞7可以从筛选通道132“挤
进”或“漏进”出口通道12,最后汇聚于出样口17并排出到废液收集部。
46.如图2所示,筛选通道132的顶部构造成阻挡部23,阻挡部23可减小筛选通道132的高度,即限定筛选通道132的高度,以使在目标细胞9在卡入容置腔131后,封闭或者说堵塞筛选通道132。在不设置阻挡部23的筛选通道,由于目标细胞9在进入容置腔131后,容置腔131对应的筛选通道132还能继续分流,试样中非目标细胞7和其它目标细胞9还会继续进入该容置腔131,试图从筛选通道132中漏出,这会导致持续对先进入的目标细胞9产生推力,导致可能会把先进入的目标细胞9挤入筛选通道132而进入出口通道12,或者反冲脱离容置腔131而回到入口通道11。通过设置阻挡部23,可以减小筛选通道132入口的高度,在目标细胞9卡入该筛选单元130的容置腔131后,以目标细胞9堵住筛选通道132入口,实现该筛选通道132的堵塞,不再用于分流或减少该筛选通道132的流量。目标细胞9可能也无法完全封堵住筛选通道132的入口,但目标细胞9进入容置腔131后能缩小筛选通道132的入口尺寸,可大大减小该筛选通道132的流量,从而结束或减轻该筛选单元130的细胞捕获任务。同时,也可以防止已捕获的目标细胞9因血液样本的继续冲击而脱离已在的容置腔131。此时一个容置腔131可以只捕获一个目标细胞9,有利于后续光学检测的目标细胞9的数量识别。
47.一种可选的实施方式为,带有阻挡部23的筛选单元130可以仅设置在入口通道11靠近进样口16的入口处,减小入口高度。在实验中,目标细胞9容易集中卡在筛选管道10的入口,通过在入口处的筛选单元130中增加阻挡部23,可以有效避免目标细胞9在入口处的筛选单元130内的容置腔131中堆叠,也有利于后续血液样本的流通。
48.另一种可选的实施方式为,整个筛选管道10的全部筛选单元都是带有阻挡部23的筛选单元130,减小筛选管道10中全部筛选通道132的高度,以提高每个筛选单元130的筛选效果,使一个容置腔131可以只捕获一个目标细胞9,便于后续光学识别。
49.考虑到容置腔131用以截留目标细胞9,因此围成容置腔131的壁面不一定垂直于微流控芯片1的底面。如图2所示,容置腔131由左右两边的两侧壁面141和具有阻挡部23的壁面所围成,两侧壁面141和阻挡部23的壁面可以与微流控芯片1的底面成一定角度。可选的,两侧壁面141与出口通道11的底面的夹角可以设置成大于90
°
,此时该容置腔131则可容纳更多血液样本,可以提高非目标细胞7流过筛选通道132的数量。
50.在上述实施例的基础之上,沿入口通道11的导流方向,各筛选单元130内容置腔131的宽度设置成至少部分不同。可选的,沿入口通道11的导流方向,靠近进样口16或/和出样口17一侧的容置腔131的宽度设置得较窄,位于筛选管道10中间段的容置腔131的宽度设置得较宽。由于目标细胞9的大小存在差异,通过设置多种宽度的容置腔131,可以捕获不同尺寸的目标细胞9。如图3所示,位于筛选管道10中部的容置腔131的宽度l2大于靠近出样口17侧的容置腔131的宽度l1和靠近进样口16的容置腔131的宽度l3,呈现出两端窄、中间宽的趋势变化。可选的,容置腔131的宽度也可以是渐变的,即容置腔131的宽度沿所述入口通道11的导流方向逐渐增加。通过设置不同宽度的容置腔131,可以增加目标细胞9的捕获数量,提高微流控芯片1的筛选效果。
51.此外,由于实验中目标细胞9主要集中卡在筛选管道10的开头和尾部即靠近进样口16和出样口17的一侧,为了避免多个目标细胞9在同一个容置腔131中堆叠,将靠近进样口16和出样口17的容置腔131宽度设置小一些,位于筛选管道10中间段容置腔131宽度设置大一些,可以提高单个容置腔131的单个细胞捕获效果。
52.一种可选的实施方式如图4所示,筛选单元130的导流方向相对入口通道11的导流方向设置为倾斜角度。筛选单元130的导流方向以倾斜双点划线表示,入口通道11中血液样本流动方向以点划线表示,该导流方向与入口通道11中血液样本流动方向形成的夹角a为锐角,优选的为45
°
夹角。相比于夹角a为90
°
的垂直进入,成锐角的倾斜导流有利于血样样本中细胞进入筛选单元130后被截留,减少目标细胞9因受到形变从而被挤出筛选通道132的可能性,最终提高目标细胞9的截留率。
53.一种可选的实施方式如图5所示,沿入口通道11的导流方向,位于入口通道11两侧的筛选单元130的入口彼此错开设置。通过交错分布的筛选单元130可以错开液体的分流位置,使入口通道11全程分流,避免了对称结构中间隔出现两侧相对壁的问题,提高了分流效率,均衡分压,最终提供了对目标细胞9的截留率,减少目标细胞9的漏出。另外,管道中血液样本的流动通常为层流,靠近管道中心的流体的流速更大,靠近管壁的流体的流速更小,交错分布的筛选单元130中的筛选通道132从侧向分流可提供侧向流速,因此通过设置交错分布通道可以降低血液样本中的细胞错过两侧容置腔131的概率,提高筛选效果。
54.一种可选的实施方式如图6和图7所示,图7为图6中f处的放大图。筛选单元130还包括外凹槽138,外凹槽138在筛选通道10靠近出口通道12的一侧向内凹陷设置,优选的,外凹槽138的宽度大于筛选通道132的宽度。由于图4和图5所示的实施方式中,筛选单元130的导流方向与入口通道11中血液样本流动方向倾斜布置,使得筛选通道132的长度增加,非目标细胞7流经狭窄且长的筛选通道132时容易发生拥堵,影响流速。因此,增加外凹槽138可有效缩短非目标细胞7流经筛选通道132的距离,避免非目标细胞7在过长的筛选通道132中堵塞淤积,提高血液样本的流速,提高检测效率。细胞外凹槽138的另一个好处是缓解出口通道12中液体的反冲压力,从另一方面避免筛选通道132的淤积。
55.一种可选的实施方式如图8和图9所示,一个容置腔131对应邻接多个筛选通道。图8中筛选通道132增设第一分叉部136,而增加了第二通道134。筛选通道132和第二通道134均接通容置腔131和出口通道12。相比单个容置腔131对应单个筛选通道132的方案,第一分叉部136的设置增加了血液样本的流通路径,有利于分压分流,同时也可以达到提高流速的效果。增加的第二通道134可以是与入口通道11中心线垂直,也可以是设置在筛选通道132的锐角区域内。第二通道134的出液方向与出口通道12中液体流向成锐角,可减小相互作用力,出口通道12中液体流带走筛选通道132出来的液体,提高流速。反之,如果第二通道134的出液方向与出口通道12中液体流向夹角大于90度,会形成逆向冲击,不利于筛选通道132内试样流出,出口通道12中液体易对容置腔131中捕获的目标细胞9造成反向冲击,导致目标细胞9脱离容置腔131。
56.进一步的,如图9所示,在筛选通道132处继续增加第二分叉部137。第二分叉部137和第一分叉部136在筛选通道132的基础上增加第二通道134和第三通道135。筛选通道132、第二通道134和第三通道135均接通出口通道12和容置腔131。容易想到的是,增加流通路径的数目可以增强分压分流的效果,优化流体的流动,进一步减小血液样本中的细胞在筛选通道132中出现堵塞的可能。
57.图8和图9所示的实施方式可以共同应用于一个微流控芯片,如图9所示,也可以单独应用,只要起到有效分离目标细胞9的作用即可。
58.如图10所示的一种可选的实施方式,入口通道11的宽度沿入口通道11的导流方向
呈逐渐收缩后逐渐扩张的形状。由于液体倾向于走流速快的管道,因此入口通道11在延伸方向上的截面宽度设置为逐渐收缩后逐渐扩张的形状。图10中的c区域代表筛选管道10的中间段,d区域和d’区域代表筛选管道10靠近进样口16和出样口17的两端。入口通道11的形状由两侧并列分布的筛选单元130的位置来界定,沿入口通道11的导流方向,c区域中筛选单元130的位置相比于d区域和d’区域内的筛选单元130更靠近筛选管道10的中心线,其所围成的入口通道11的宽度小于d区域和d’区域中入口通道11的宽度。通过将入口通道11设置为逐渐收缩后逐渐扩张的形状,可以增加入口通道11中间段即c区域的压力,迫使血液样本通过中间段c区域中的两侧筛选单元130,提高筛选管道10中间段筛选单元130的截留率,减少两端d和d’区域中细胞的堆积。
59.如图11所示,在上述实施例的基础上,连接进样口16和筛选管道10的入液分流管道20或/和连接出样口17和筛选管道10的出液分流管道21为多级分流管道,所述多级分流管道的每级设置为两股分流,且相对于上一级,管道尺寸减半。可以理解到的是,图11中筛选管道10可以设置成前述任一筛选管道10的结构。
60.图11中入液分流管道20或/和出液分流管道21为多级分流管道,如第一级入液分流管道20连接进样口16,血液样本由进样口16流入后进入第一级入液分流管道20,随后第一级入液分流管道20分为两股分流,血液样本进入第二级入液分流管道20’,两条第二级入液分流管道20’位于第一级入液分流管道20对称的上下两侧且管道尺寸减半,将血液样本进行分流。随后第三级入液分流管道20”继续将第二级入液分流管道20’分流为两股,并且管道尺寸减半,最终将血液样本送入筛选管道10的入口通道11。经过入液分流管道20的多次均匀分流,可均衡流入各筛选管道10的各入口通道11的流量,提高均匀性,提高进样口16的初始速度。
61.由于筛选管道10的数目加倍,因此出液分流管道21也可以设置为与第三级入液分流管道20”相同数目的第三级出液分流管道21”,出液分流管道21按入液分流管道20相同的分级布置完成对出口通道12内液体的排出。可选的,出液分流管道21也可不需要分级设置,一条出液分流管道21可直接接收来自各个筛选管道10中出口通道12内的废液,并将其输送到出样口17,完成废液的收集。
62.本实用新型虽然以较佳实施例公开如上,但其并不是用来限定本实用新型,任何本领域技术人员在不脱离本实用新型的精神和范围内,都可以做出可能的变动和修改,例如前述不同实施方式的筛选单元的特征可以进行自由组合,以进一步提高单个容置腔的捕获效果。因此,凡是未脱离本实用新型技术方案的内容,依据本实用新型的技术实质对以上实施例所作的任何修改、等同变化及修饰,均落入本实用新型权利要求所界定的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1