寡核苷酸的制造方法与流程
1.本发明涉及寡核苷酸的制造方法。
背景技术:
2.作为寡核苷酸的制造方法,目前广泛采用亚磷酰胺法和h
‑
膦酸酯法,除此之外,还已知二卤代膦法和氧氮磷杂环戊烷法。寡核苷酸的制造需要多级反应,所以即使每次碱基延伸的反应工序中作为副产物生成1%以下的微量杂质,作为目标物的寡核苷酸延伸体也会有大量杂质。因此,为了获得高纯度的寡核苷酸,重要的是抑制各反应每个工序的副产物杂质。然而,缩合反应工序中,不仅反应不完全、目标寡核苷酸的收率下降,而且作为副产物生成1碱基缺失体(n
‑
1mer)等杂质,还存在这些杂质难以除去的问题。作为寡核苷酸的制造方法,有固相合成(固相法)和液相法,并且为了消除固相法和液相法的缺点,还开发有使用拟固相保护基(pseudo solidphaseprotectinggroup)的液相法(专利文献1~9)。
3.现有技术文献专利文献专利文献1:国际公开第2012/157723号专利文献2:国际公开第2013/122236号专利文献3:国际公开第2017/104836号专利文献4:国际公开第2005/070859号专利文献5:国际公开第2013/179412号专利文献6:国际公开第2014/077292号专利文献7:国际公开第2017/086397号专利文献8:国际公开第2018/203574号专利文献9:国际公开第2018/212236号。
技术实现要素:
4.发明所要解决的技术问题本发明鉴于如上所述的情况而进行,其所要解决的课题是提供可使核苷、核苷酸或寡核苷酸的缩合反应完全(完成)的寡核苷酸的制造方法。
5.解决技术问题所采用的技术方案本发明人等为了解决上述的课题而认真研究,分析原因后发现,作为缩合反应的前一工序的采用酸(羧酸)的脱保护工序中,脱保护后的5'位羟基被酸(羧酸)酰基化,缩合反应无法完全进行,导致作为副产物生成缺失化杂质。另外,在本发现的基础上,发现通过新引入对上述o
‑
酰基化的寡核苷酸进行溶剂分解而脱酰基化的工序,所述课题得到解决,从而完成了本发明。即,本发明具有以下的特征。
6.[1]一种寡核苷酸的制造方法,其中,包括以下的工序:向具有硫代磷酸酯(ps)、磷酸酯(po)或h
‑
膦酸酯部位的保护寡核苷酸中添加酸而除去5'位羟基的临时保护基后,对5'
位羟基被酰基化的副产物进行溶剂分解而脱酰基化;[2]一种寡核苷酸的制造方法,其中,包括以下的工序(1)~(4):(1)使核苷、核苷酸或寡核苷酸(a)与核苷、核苷酸或寡核苷酸(b)缩合,得到亚磷酸酯体或亚磷酸二酯(c)的工序,所述核苷、核苷酸或寡核苷酸(a)中,5'位羟基未被保护,且其他基团可被用于核酸合成的保护基保护、或可结合于固相载体,所述核苷、核苷酸或寡核苷酸(b)中,3'位羟基或3'位氨基通过选自亚磷酰胺(phosphoramidite)法、h
‑
膦酸酯(h
‑
phosphonate)法、二卤代膦(dihalophosphine)法和氧氮磷杂环戊烷(oxazaphospholidine)法中的方法被修饰,5'位羟基被在酸性条件下可除去的临时保护基保护,且其他基团可被用于核酸合成的保护基保护,所述亚磷酸酯体或亚磷酸二酯(c)中,5'位羟基被在酸性条件下可除去的临时保护基保护;(2):(2
‑
1)向亚磷酸酯体或亚磷酸二酯(c)中添加硫化剂而进行硫化,得到5'位羟基被在酸性条件下可除去的临时保护基保护的具有硫代磷酸酯化部位的寡核苷酸(d
‑
1)的工序,或者(2
‑
2)向亚磷酸酯体或亚磷酸二酯(c)中添加氧化剂而进行氧化,得到5'位羟基被在酸性条件下可除去的临时保护基保护的具有磷酸酯化部位的寡核苷酸(d
‑
2)的工序;(3):(3
‑
1)向具有硫代磷酸酯化部位的寡核苷酸(d
‑
1)中添加酸而除去5'位羟基的临时保护基,得到5'位羟基未被保护的具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)粗产物的工序,或者(3
‑
2)向具有磷酸酯化部位的寡核苷酸(d
‑
2)中添加酸而除去5'位羟基的临时保护基,得到5'位羟基未被保护的具有磷酸酯化部位的寡核苷酸(e
‑
2)粗产物的工序;以及(4):(4
‑
1)对具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)粗产物中所含的5'位羟基被酰基化的寡核苷酸进行溶剂分解而脱酰基化的工序,或者(4
‑
2)对具有磷酸酯化部位的寡核苷酸(e
‑
2)粗产物中所含的5'位羟基被酰基化的寡核苷酸进行溶剂分解而脱酰基化的工序;[3]根据[2]所述的制造方法,其中,还包括以下的工序:将具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)或具有磷酸酯化部位的寡核苷酸(e
‑
2)的保护基全部除去后,分离未被保护的具有硫代磷酸酯化部位的寡核苷酸或未被保护的具有磷酸酯化部位的寡核苷酸的工序;[4]一种寡核苷酸的制造方法,其中,包括以下的工序(1a)、(3a)和(4a):(1a)使核苷、核苷酸或寡核苷酸(a)与核苷、核苷酸或寡核苷酸(b)缩合,得到亚磷酸酯体或亚磷酸二酯(c)的工序,所述核苷、核苷酸或寡核苷酸(a)中,5'位羟基未被保护,且其他基团可被用于核酸合成的保护基保护、或可结合于固相载体,所述核苷、核苷酸或寡核苷酸(b)中,3'位羟基或3'位氨基通过h
‑
膦酸酯法被修饰,5'位羟基被在酸性条件下可除去的临时保护基保护,且其他基团可被用于核酸合成的保护基保护,所述亚磷酸酯体或亚磷酸二酯(c)中,5'位羟基被在酸性条件下可除去的临时保护基保护;(3a)向亚磷酸酯体或亚磷酸二酯(c)中添加酸而除去5'位羟基的临时保护基,得到5'位羟基未被保护的亚磷酸酯体或亚磷酸二酯(c)粗产物的工序;以及(4a)对亚磷酸酯体或亚磷酸二酯(c)粗产物中所含的5'位羟基被酰基化的寡核苷
酸进行溶剂分解而脱酰基化的工序;[5]根据[2]或[3]所述的制造方法,其中,工序(1)为以下的工序:使核苷、核苷酸或寡核苷酸(a)、或者核苷、核苷酸或寡核苷酸(a1)与核苷、核苷酸或寡核苷酸(b)缩合,得到亚磷酸酯体或亚磷酸二酯(c)的工序,所述核苷、核苷酸或寡核苷酸(a)中,5'位羟基未被保护,选自核酸碱基的氨基和亚氨基、核糖残基的2'位羟基、3'位羟基和3'位氨基、以及脱氧核糖残基的3'位羟基和3'位氨基中的至少一个基团被在酸性条件下不可除去但在碱性条件下可除去的保护基保护,且其他基团可进一步被用于核酸合成的保护基保护,所述核苷、核苷酸或寡核苷酸(a1)中,5'位羟基未被保护,3'位末端的磷酸基的一个oh被
‑
ol
n1
‑
oh置换,
‑
ol
n1
‑
oh的羟基被在酸性条件下不可除去但在碱性条件下可除去的保护基保护,且其他基团可进一步被用于核酸合成的保护基保护,所述式中l
n1
表示有机基团,所述核苷、核苷酸或寡核苷酸(b)中,3'位羟基或3'位氨基通过选自亚磷酰胺法、h
‑
膦酸酯法、二卤代膦法和氧氮磷杂环戊烷法中的方法被修饰,5'位羟基被在酸性条件下可除去的临时保护基保护,且其他基团可进一步被选自在酸性条件下不可除去但在碱性条件下可除去的保护基、及用于核酸合成的保护基中的保护基保护,所述亚磷酸酯体或亚磷酸二酯(c)中,5'位羟基被在酸性条件下可除去的临时保护基保护;[6]根据[1]~[5]中任一项所述的制造方法,其中,5'位羟基的临时保护基的除去中使用的酸包括羧酸、磺酸、膦酸、或磷酸;[7]根据[6]所述的制造方法,其中,酸为三氟乙酸、二氯乙酸、三氯乙酸、乙酸、三氟甲磺酸、甲磺酸、对甲苯磺酸、膦酸、或磷酸;[8]根据[1]~[7]中任一项所述的制造方法,其中,溶剂分解中使用的溶剂为碱与亲核物质的混合物;[9]根据[8]所述的制造方法,其中,碱为选自非亲核性碱和含氮原子的杂环化合物中的至少一种,亲核物质为选自水和醇衍生物中的至少一种;[10]根据[9]所述的制造方法,其中,非亲核性碱的pk
a
为3~10;[11]根据[9]或[10]所述的制造方法,其中,含氮原子的杂环化合物为吡啶衍生物;[12]根据[8]~[11]中任一项所述的制造方法,其中,在亲核物质包含水的情况下,其ph为3.0~8.0;[13]根据[8]~[12]中任一项所述的制造方法,其中,碱为选自吡啶、三甲基吡啶、二甲基吡啶和甲基吡啶中的至少一种;[14]根据[8]~[13]中任一项所述的制造方法,其中,亲核物质为选自水、甲醇、乙醇、异丙醇、丁醇、苄醇和四氢糠醇中的至少一种;[14a]根据[8]~[14]中任一项所述的制造方法,其中,碱与亲核物质的混合物为吡啶与水的混合物、吡啶与甲醇的混合物、或者吡啶与乙醇的混合物;[15]一种寡核苷酸的制造方法,其中,包括以下的工序:向具有硫代磷酸酯(ps)、磷酸酯(po)或h
‑
膦酸酯部位的保护寡核苷酸中添加酸而除去3'位羟基或3'位氨基的临时保护基后,对3'位羟基或3'位氨基被酰基化的副产物进行溶剂分解而脱酰基化;
[16]一种寡核苷酸的制造方法,其中,包括以下的工序(1')~(4'):(1')使核苷、核苷酸或寡核苷酸(a')与核苷、核苷酸或寡核苷酸(b')缩合,得到亚磷酸酯体或亚磷酸二酯(c')的工序,所述核苷、核苷酸或寡核苷酸(a')中,3'位羟基或3'位氨基未被保护,且其他基团可被用于核酸合成的保护基保护、或可结合于固相载体,所述核苷、核苷酸或寡核苷酸(b')中,5'位羟基通过选自亚磷酰胺法、h
‑
膦酸酯法、二卤代膦法和氧氮磷杂环戊烷法中的方法被修饰,3'位羟基或3'位氨基被在酸性条件下可除去的临时保护基保护,且其他基团可被用于核酸合成的保护基保护,所述亚磷酸酯体或亚磷酸二酯(c')中,3'位羟基或3'位氨基被在酸性条件下可除去的临时保护基保护;(2'):(2'
‑
1)向亚磷酸酯体或亚磷酸二酯(c')中添加硫化剂而进行硫化,得到3'位羟基或3'位氨基被在酸性条件下可除去的临时保护基保护的具有硫代磷酸酯化部位的寡核苷酸(d'
‑
1)的工序,或者(2'
‑
2)向亚磷酸酯体或亚磷酸二酯(c')中添加氧化剂而进行氧化,得到3'位羟基或3'位氨基被在酸性条件下可除去的临时保护基保护的具有磷酸酯化部位的寡核苷酸(d'
‑
2)的工序;(3'):(3'
‑
1)向具有硫代磷酸酯化部位的寡核苷酸(d'
‑
1)中添加酸而除去3'位羟基或3'位氨基的临时保护基,得到3'位羟基或3'位氨基未被保护的具有硫代磷酸酯化部位的寡核苷酸(e'
‑
1)粗产物的工序,或者(3'
‑
2)向具有磷酸酯化部位的寡核苷酸(d'
‑
2)中添加酸而除去3'位羟基或3'位氨基的临时保护基,得到3'位羟基或3'位氨基未被保护的具有磷酸酯化部位的寡核苷酸(e'
‑
2)粗产物的工序;以及(4'):(4'
‑
1)对具有硫代磷酸酯化部位的寡核苷酸(e'
‑
1)粗产物中所含的3'位羟基或3'位氨基被酰基化的具有硫代磷酸酯化部位的寡核苷酸进行溶剂分解而脱酰基化的工序,或者(4'
‑
2)对具有磷酸酯化部位的寡核苷酸(e'
‑
2)粗产物中所含的3'位羟基或3'位氨基被酰基化的具有磷酸酯化部位的寡核苷酸进行溶剂分解而脱酰基化的工序。
[0007]
发明的效果如果采用本发明的寡核苷酸的制造方法,可使缩合反应完全进行而提高缩合收率,显著减少1碱基缺失体(n
‑
1mer)等杂质。
具体实施方式
[0008]
[术语]只要在文中没有特别说明,本说明书中使用的所有技术术语和科学术语具有本发明所属技术领域的技术人员通常的理解同样的含义。与本说明书所记载的同样或同等的任意的方法和材料可在本发明的实施或试验中使用,下文中记载优选的方法和材料。对于本说明书中提及的所有刊物和专利,例如,可为了记载和揭示的目的而将能够与所记载的发明相关地使用的刊物中记载的构建物和方法论作为参照纳入本说明书中。
[0009]
本说明书中,作为寡核苷酸的构成单元的“核苷”是指核酸碱基通过n
‑
糖苷化(glycosidation)结合于糖(例如,2
‑
脱氧核糖、核糖、2位碳原子和4位碳原子通过2价有机
基团结合而成的2
‑
脱氧核糖或核糖等)的1位而成的化合物。本说明书中的“糖”还包括羟基替换为氨基的氨基糖、和2位羟基替换为卤素原子的核糖。
[0010]
作为2位碳原子和4位碳原子通过2价有机基团结合而成的2
‑
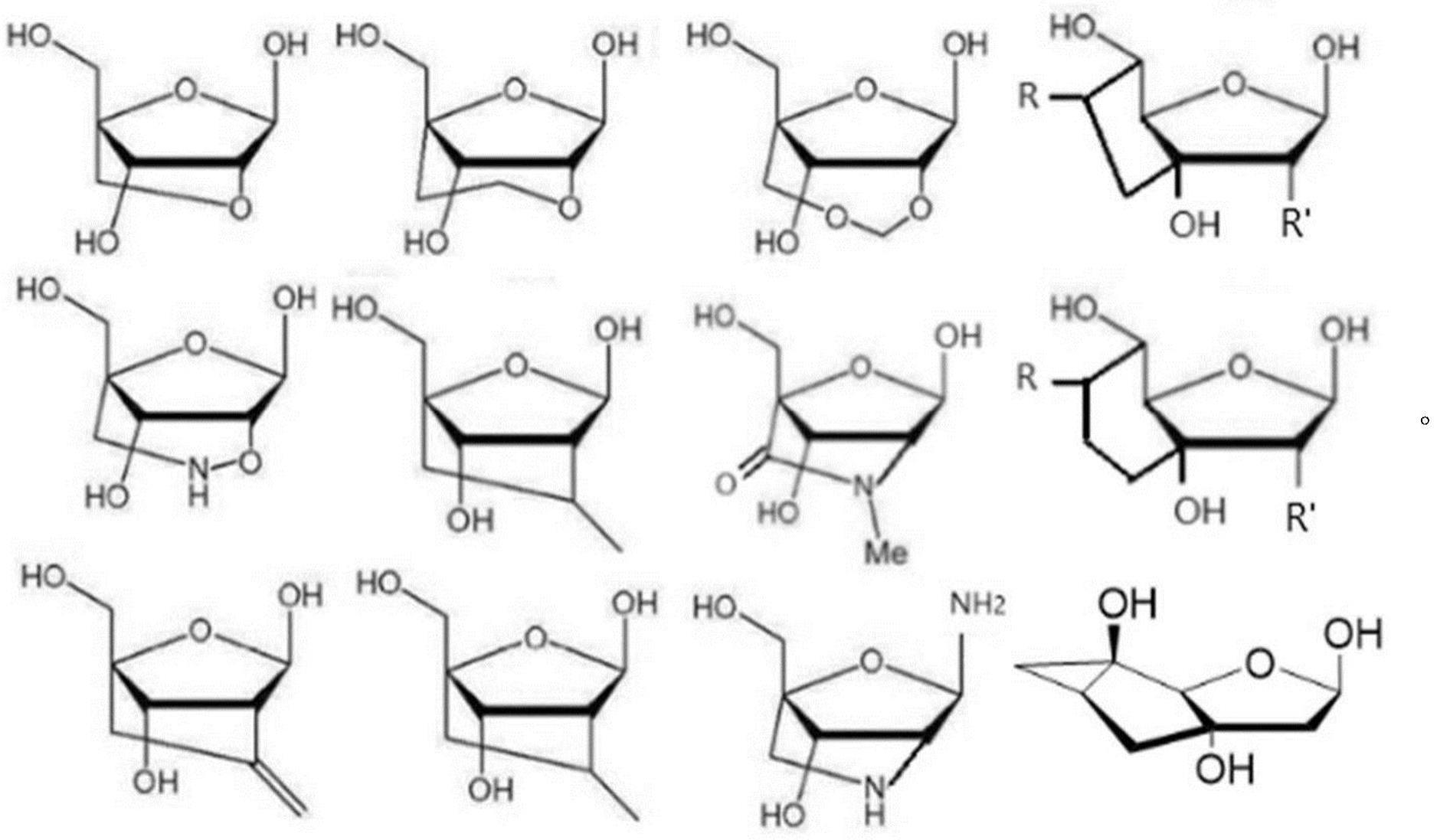
脱氧核糖或核糖,可列举例如以下的化合物。下述式中,r表示氢原子、取代或未取代的烃基、取代或未取代的羟基、取代或未取代的氨基中的任一种,r'表示氢原子、羟基中的任一种。
[0011]
[化学式1]
[0012]
作为氨基糖,可列举例如如下所示的3位羟基替换为氨基的2
‑
脱氧核糖、3位羟基替换为氨基的核糖、和3位羟基替换为氨基且2位羟基替换为卤素的核糖;下述式中,x
s
表示卤素原子。
[0013]
[化学式2]
[0014]
本说明书中,“磷酸基”不仅包括
‑
o
‑
p(o)(oh)2,还包括氧原子替换为硫原子或nh而成的基团(例如,
‑
o
‑
p(s)(oh)2、
‑
nh
‑
p(o)(oh)2、
‑
nh
‑
p(s)(oh)2)。此外,磷酸基中的羟基(
‑
oh)置换为
‑
or
p
(式中,r
p
表示磷酸基的保护基等有机基团)而成的基团(例如被保护的磷酸基)也包括在“磷酸基”内。
[0015]
本说明书中,“核苷酸”是指核苷结合磷酸基而得的化合物。作为3'位羟基或5'位羟基替换为磷酸基的核苷酸,可列举下述式所示的化合物;下述式中,r
m1
和r
m2
分别独立地表示氢原子或有机基团(但核苷残基除外),x
m
表示氢原子、羟基或卤素原子,r1和r2表示氢原子或烷基,r1和r2可结合而形成五或六元环,r3和r4表示氢原子或苯基,base为碱基(下文中同样)。
[0016]
[化学式3]
[0017]
[化学式4]
[0018]
本说明书中,“寡核苷酸”是指核苷连接1个以上的核苷酸而得的化合物。应予说明,“寡核苷酸”中还包括:磷酸基的氧原子替换为硫原子的硫代磷酸酯型的寡核苷酸、磷酸基的
‑
o
‑
替换为
‑
nh
‑
的寡核苷酸、磷酸基中的羟基(
‑
oh)置换为
‑
or
p
(式中,r
p
表示有机基团)的寡核苷酸。本发明中的寡核苷酸的核苷的数目无特别限定,较好是3~50,更好是5~30。
[0019]
本说明书中,“固相载体”只要是该领域中用于核酸的固相合成的载体则无特别限定,可列举例如玻璃珠、树脂珠等。作为固相载体使用的固相支承体或树脂可以是适合于固相合成中使用的本技术领域中已知的任何支承体或树脂。本说明书中,术语“固相”包括核苷、核苷酸或寡核苷酸介以惯用的功能性连接体(linker)或柄状基团(handle group,
ハンドル
基)结合或连接于上述的固相支承体或树脂,本文(上下文)中提及“固相”时也涵盖这样的连接体的意思。关于固相的例子,例如:聚苯乙烯支持体(例如可通过对甲基二苯甲胺(p
‑
methylbenzyl
‑
hydrylamine)进一步功能化)、或者包封有硅藻土的聚二甲基丙烯酰胺
烷基)。作为优选的具体例子,可列举苄基、1
‑
苯基乙基、2
‑
苯基乙基、1
‑
苯基丙基、萘基甲基、1
‑
萘基乙基、1
‑
萘基丙基等,特别好是苄基。
[0029]
本说明书中,“烷氧基”可以是直链状或支链状中的任一种。作为“烷氧基”,可列举碳数1以上的烷氧基,对碳数范围无特别限定的情况下,较好是c1‑
10
烷氧基,更好是c1‑6烷氧基。作为碳数范围无限定的情况下的优选的具体例子,可列举甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、异丁氧基、仲丁氧基、叔丁氧基、戊氧基、己氧基等,特别好是甲氧基、乙氧基。
[0030]
本说明书中,“酰基”可以是直链状或支链状中的任一种。作为“酰基”,可列举例如c1‑6烷酰基、c7‑
13
芳酰基等。具体来说,可列举例如甲酰基、乙酰基、正丙酰基、异丙酰基、正丁酰基、异丁酰基、新戊酰基、戊酰基、己酰基、苯甲酰基、萘甲酰基、乙酰丙酰基(levulinyl)等,这些基团分别可被取代。
[0031]
本说明书中,“烯基”可以是直链状或支链状中的任一种。作为“烯基”,可列举例如c2‑6烯基等。具体来说,可列举例如乙烯基、1
‑
丙烯基、烯丙基、异丙烯基、丁烯基、异丁烯基等。其中,较好是c2‑4烯基。
[0032]
本说明书中,“炔基”可以是直链状或支链状中的任一种。作为“炔基”,可列举例如c2‑6炔基等。具体来说,可列举例如乙炔基、1
‑
丙炔基、2
‑
丙炔基、1
‑
丁炔基、2
‑
丁炔基、3
‑
丁炔基、1
‑
戊炔基、2
‑
戊炔基、3
‑
戊炔基、4
‑
戊炔基、1
‑
己炔基、2
‑
己炔基、3
‑
己炔基、4
‑
己炔基、5
‑
己炔基等。其中,较好是c2‑4炔基。
[0033]
本说明书中,“环烷基”表示环状烷基,可列举例如环丙基、环丁基、环戊基、环己基、环庚基、环辛基等。其中,较好是环丙基、环丁基、环戊基、环己基等c3‑6环烷基,特别好是环己基。
[0034]
本说明书中,“芳基”表示显示芳香性的单环或多环(稠合)的烃基,具体可列举例如苯基、1
‑
萘基、2
‑
萘基、联苯基、2
‑
蒽基等的c6‑
14
芳基。其中,更好是c6‑
10
芳基,特别好是苯基。
[0035]
本说明书中,作为“烃基”,可列举例如脂肪族烃基、芳香脂肪族烃基、单环饱和烃基和芳香族烃基等,具体为例如烷基、烯基、炔基、环烷基、芳基、芳烷基等1价基团及由它们衍生的2价基团。
[0036]
本说明书中,作为“c6‑
14
烃环”,可列举例如c6‑
10
环烷烃、c6‑
10
环烯烃、c6‑
14
芳香族烃环。作为该“c6‑
10
环烷烃”,可列举例如环己烷、环庚烷、环辛烷。作为该“c6‑
10
环烯烃”,可列举例如环己烯、环庚烯、环辛烯。作为该“c6‑
14
芳香族烃环”,可列举例如苯、萘。
[0037]
本说明书中,“亚烷基”可以是直链状或支链状中的任一种。作为“亚烷基”,可列举碳数1以上的亚烷基,对碳数范围无特别限定的情况下,较好是c1‑
10
亚烷基,更好是c1‑6亚烷基。作为优选的具体例子,可列举亚甲基、亚乙基、亚丙基、亚丁基、亚戊基、亚己基,特别好是亚甲基、亚乙基。本说明书中,作为“连接体”,可列举例如
‑
o
‑
、
‑
c(=o)
‑
、
‑
c(=o)o
‑
、
‑
oc(=o)
‑
、
‑
c(=o)nh
‑
、
‑
nhc(=o)
‑
、
‑
s
‑
、
‑
so
‑
、
‑
so2‑
、
‑
si(r')(r”)o
‑
、
‑
si(r')(r”)
‑
等;r'、r”分别独立表示氢原子或c1‑
22
烃基。
[0038]
本说明书中,“可被取代”中的“取代基”中,除包括所述的卤素原子、烷基、芳烷基、烷氧基、酰基、烯基、炔基、环烷基、芳基之外,还包括羟基、硝基、氰基、胍基、羧基、烷氧基羰基(烷氧基部分与所述烷氧基相同)、磺基(sulfo group)、磷酰基(phospho group)、烷基硫基(烷基部分与所述烷基相同)、烷基亚磺酰基(烷基部分与所述烷基相同)、烷基磺酰基(烷
基部分与所述烷基相同)、氨基、单烷基氨基(烷基部分与所述烷基相同)、二烷基氨基(烷基部分与所述烷基相同)、氧代基等。
[0039]
[寡核苷酸的制造方法]本发明的制造方法可适用于液相法(包括使用拟固相保护基的液相法)和固相法中的任一种,较好是适用于液相法(包括使用拟固相保护基的液相法)。本发明的制造方法包括沿从3'末端至5'末端的方向进行寡核苷酸链的延伸的形态(以下有时简称为“3'
‑
5'合成”)和沿从5'末端至3'末端的方向进行寡核苷酸链的延伸的形态(以下有时简称为“5'
‑
3'合成”)这两者。首先,从作为3'
‑
5'合成的本发明的制造方法开始进行说明。寡核苷酸可以是手性的。
[0040]
3'
‑
5'合成作为3'
‑
5'合成的本发明的制造方法包括以下的工序:向具有硫代磷酸酯(ps)、磷酸酯(po)或h
‑
膦酸酯部位的保护寡核苷酸中添加酸而除去5'位羟基的临时保护基后,对5'位羟基被酰基化的副产物进行溶剂分解而脱酰基化。对于该制造方法通过以下的工序(3):脱保护和工序(4):溶剂分解进行说明。
[0041]
作为3'
‑
5'合成的本发明的制造方法还包括以下的工序(1)~(4):(1)使核苷、核苷酸或寡核苷酸(a)与核苷、核苷酸或寡核苷酸(b)缩合,得到亚磷酸酯体或亚磷酸二酯(c)的工序,所述核苷、核苷酸或寡核苷酸(a)中,5'位羟基未被保护,且其他基团可被用于核酸合成的保护基保护、或可结合于固相载体,所述核苷、核苷酸或寡核苷酸(b)中,3'位羟基或3'位氨基通过选自亚磷酰胺法、h
‑
膦酸酯法、二卤代膦法和氧氮磷杂环戊烷法中的方法被修饰,5'位羟基被在酸性条件下可除去的临时保护基保护,且其他基团可被用于核酸合成的保护基保护,所述亚磷酸酯体或亚磷酸二酯(c)中,5'位羟基被在酸性条件下可除去的临时保护基保护;(2):(2
‑
1)向亚磷酸酯体或亚磷酸二酯(c)中添加硫化剂而进行硫化,得到5'位羟基被在酸性条件下可除去的临时保护基保护的具有硫代磷酸酯化部位的寡核苷酸(d
‑
1)的工序,或者(2
‑
2)向亚磷酸酯体或亚磷酸二酯(c)中添加氧化剂而进行氧化,得到5'位羟基被在酸性条件下可除去的临时保护基保护的具有磷酸酯化部位的寡核苷酸(d
‑
2)的工序;(3):(3
‑
1)向具有硫代磷酸酯化部位的寡核苷酸(d
‑
1)中添加酸而除去5'位羟基的临时保护基,得到5'位羟基未被保护的具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)粗产物的工序,或者(3
‑
2)向具有磷酸酯化部位的寡核苷酸(d
‑
2)中添加酸而除去5'位羟基的临时保护基,得到5'位羟基未被保护的具有磷酸酯化部位的寡核苷酸(e
‑
2)粗产物的工序;以及(4):(4
‑
1)对具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)粗产物中所含的5'位羟基被酰基化的寡核苷酸进行溶剂分解而脱酰基化的工序,或者(4
‑
2)对具有磷酸酯化部位的寡核苷酸(e
‑
2)粗产物中所含的5'位羟基被酰基化的寡核苷酸进行溶剂分解而脱酰基化的工序。
[0042]
通过重复工序(1)~(4)的循环,可使寡核苷酸链延伸。
[0043]
工序(1)(缩合)
本工序是使“核苷、核苷酸或寡核苷酸(a)”与“核苷、核苷酸或寡核苷酸(b)”缩合,得到“亚磷酸酯体或亚磷酸二酯(c)”的工序;所述核苷、核苷酸或寡核苷酸(a)中,5'位羟基未被保护,且其他基团可被用于核酸合成的保护基保护、或可结合于固相载体;所述核苷、核苷酸或寡核苷酸(b)中,3'位羟基或3'位氨基通过选自亚磷酰胺法、h
‑
膦酸酯法、二卤代膦法和氧氮磷杂环戊烷法中的方法被修饰,5'位羟基被在酸性条件下可除去的临时保护基保护,且其他基团可被用于核酸合成的保护基保护;所述亚磷酸酯体或亚磷酸二酯(c)中,5'位羟基被在酸性条件下可除去的临时保护基保护。
[0044]
本发明的制造方法为固相法的情况下,核苷、核苷酸或寡核苷酸(a)例如其3'位介以该领域中通常所使用的连接体而结合于固相载体。
[0045]
本工序的优选方式中,使用下述的“核苷、核苷酸或寡核苷酸(a)、或者核苷、核苷酸或寡核苷酸(a1)”和“核苷、核苷酸或寡核苷酸(b)”;所述核苷、核苷酸或寡核苷酸(a)中,5'位羟基未被保护,选自核酸碱基的氨基和亚氨基、核糖残基的2'位羟基、3'位羟基和3'位氨基、以及脱氧核糖残基的3'位羟基和3'位氨基中的至少一个基团被在酸性条件下不可除去但在碱性条件下可除去的保护基保护,且其他基团可进一步被用于核酸合成的保护基保护;所述核苷、核苷酸或寡核苷酸(a1)中,5'位羟基未被保护,3'位末端的磷酸基的一个oh被
‑
ol
n1
‑
oh置换,
‑
ol
n1
‑
oh的羟基被在酸性条件下不可除去但在碱性条件下可除去的保护基保护,且其他基团可进一步被用于核酸合成的保护基保护,所述式中l
n1
表示有机基团;所述核苷、核苷酸或寡核苷酸(b)中,3'位羟基或3'位氨基通过选自亚磷酰胺法、h
‑
膦酸酯法、二卤代膦法和氧氮磷杂环戊烷法中的方法被修饰,5'位羟基被在酸性条件下可除去的临时保护基保护,且其他基团可进一步被选自在酸性条件下不可除去但在碱性条件下可除去的保护基、及用于核酸合成的保护基中的保护基保护;核苷、核苷酸或寡核苷酸(a)可以是2'位被卤化(例如氟化)。
[0046]
l
n1
的有机基团是指烃基、或烃基中的碳原子被杂原子替代的基团。作为杂原子,可列举例如氧原子、氮原子、硫原子等。此外,有机基团可具有羟基、氨基、氧代基(=o)等取代基。有机基团可具有的羟基和氨基较好是被保护基保护。有机基团的形状可以是链状(直链状或支链状)、环状或它们的组合中的任一种。
[0047]
有机基团可具有对细胞具功能性的基团。对细胞具功能性的基团较好是结合于有机基团的主链或侧链的末端。作为对细胞具功能性的基团,可列举例如:“通过使化合物的脂溶性提高而提高化合物的细胞膜渗透性的基团”、“介以细胞膜受体使化合物向细胞内的摄入提高的基团”等。作为“通过使化合物的脂溶性提高而提高化合物的细胞膜渗透性的基团”,可列举例如胆固醇残基、生育酚残基等。作为“介以细胞膜受体使化合物向细胞内的摄入提高的基团”,可列举例如n
‑
乙酰半乳糖胺残基等。这些对细胞具功能性的基团在wo2017/104836号公报中有记载。
[0048]
作为
‑
ol
n1
‑
oh的具体例子,可以列举以下的例子(下述式中的*表示与磷原子的结合位置,ac表示乙酰基)。
[0049]
[化学式5]
[0050]
l
n1
较好是c2‑6亚烷基,更好是亚乙基。
[0051]
本工序的更优选方式中,使用下述的“核苷或寡核苷酸(a)”和“核苷或寡核苷酸(b)”;所述核苷或寡核苷酸(a)中,5'位羟基未被保护,选自核酸碱基的氨基和亚氨基、核糖残基的2'位羟基和3'位羟基、以及脱氧核糖残基的3'位羟基中的至少一个基团被在酸性条件下不可除去但在碱性条件下可除去的保护基保护,且其他基团可进一步被用于核酸合成的保护基保护;所述核苷或寡核苷酸(b)中,3'位羟基通过选自亚磷酰胺法、h
‑
膦酸酯法、二卤代膦法和氧氮磷杂环戊烷法中的方法被修饰,5'位羟基被在酸性条件下可除去的临时保护基保护,且其他基团可进一步被用于核酸合成的保护基保护。
[0052]
在液相法的情况下,关于本工序中使用的核苷、核苷酸或寡核苷酸(a)、或者核苷
酸或寡核苷酸(a1)的溶液中的浓度,只要它们溶解于溶剂则无特别限定,较好是1~30重量%。
[0053]
核苷、核苷酸或寡核苷酸(a)、核苷酸或寡核苷酸(a1)、以及核苷、核苷酸或寡核苷酸(b)的氨基,较好是被上述的保护基保护。作为该保护基,较好是乙酰基、苯氧乙酰基、4
‑
异丙基苯氧乙酰基、苯甲酰基、异丁酰基、(2
‑
己基)癸酰基、二甲基甲脒基、和1
‑
(二甲基氨基)亚乙基。核苷、核苷酸或寡核苷酸(a)以及核苷、核苷酸或寡核苷酸(b)具有多个氨基的情况下,氨基酸的保护基可以是仅1种,也可以是2种以上。
[0054]
对于核苷、核苷酸或寡核苷酸(a)而言,选自核酸碱基的氨基和亚氨基、核糖残基的2'位羟基、3'位羟基和3'位氨基、以及脱氧核糖残基的3'位羟基和3'位氨基中的至少一个基团被在酸性条件下不可除去但在碱性条件下可除去的保护基保护。对于核苷、核苷酸或寡核苷酸(a)而言,较好是选自核酸碱基的氨基和亚氨基、核糖残基的3'位羟基、以及脱氧核糖残基的3'位羟基中的至少一个基团被所述保护基保护,更好是核糖残基的3'位羟基或脱氧核糖残基的3'位羟基被所述保护基保护。
[0055]
对于核苷酸或寡核苷酸(a1)而言,
‑
ol
n1
‑
oh的羟基被在酸性条件下不可除去但在碱性条件下可除去的保护基保护。
[0056]
核苷、核苷酸或寡核苷酸(a)和核苷酸或寡核苷酸(a1)所具有的“在酸性条件下不可除去但在碱性条件下可除去的保护基”、以及核苷、核苷酸或寡核苷酸(b)可具有的“在酸性条件下不可除去但在碱性条件下可除去的保护基”分别独立地优选为:为了有效地进行固液分离或萃取,具有碳数10以上的直链状的脂肪族烃基的保护基、或者具有有机基团的保护基(以下有时简称为“拟固相保护基”),所述有机基团具有至少一个含1条以上的支链的脂肪族烃基、且总碳数为14以上300以下。
[0057]
拟固相保护基对核苷、核苷酸或寡核苷酸(a)和核苷酸或寡核苷酸(a1)(根据情况包括核苷、核苷酸或寡核苷酸(b))赋予疏水性,提高在非极性溶剂中的溶解性。此外,还可降低在极性溶剂中的溶解性。被这样的拟固相保护基保护的核苷、核苷酸或寡核苷酸(a)和核苷酸或寡核苷酸(a1),可在非极性溶剂的液相中进行缩合反应,通过在其后的固液分离或萃取中向反应液添加极性溶剂,从而被拟固相保护基保护的寡核苷酸(e)沉淀,可进行其固液分离。或者,可通过在固液分离或萃取中向反应液添加极性溶剂,在极性溶剂
‑
非极性溶剂间分层,使寡核苷酸(e)移动至非极性溶剂,从而进行其萃取。作为这样的拟固相保护基,可使用例如国际公开第2012/157723号公报、国际公开第2013/122236号、国际公开第2017/104836号、国际公开第2013/179412号、国际公开第2014/077292号、国际公开第2017/086397号、国际公开第2018/203574号、国际公开第2018/212236号中所记载的基团。
[0058]“用于核酸合成的保护基”只要是核酸合成领域中通常所使用的基团则无特别限定,也包括上述的低分子量的保护基,但在通过固液分离进行纯化的情况下,拟固相保护基较好是具有碳数10以上的直链状的脂肪族烃基的保护基,在通过萃取进行纯化的情况下,拟固相保护基较好是具有有机基团的保护基(所述有机基团具有至少一个含1条以上的支链的脂肪族烃基且总碳数为14以上300以下)。
[0059]
首先,对适合用于固液分离的拟固相保护基进行说明。作为适合用于固液分离的拟固相保护基,可列举例如:具有“碳数10以上的直链状的脂肪族烃基介以单键或连接体结合的烃基介以连接体结合的c6‑
14
烃环”的保护基。
[0060]
所述碳数10以上的直链状的脂肪族烃基较好是选自直链状的c
10
‑
40
烷基和直链状的c
10
‑
40
烯基中的基团,更好是直链状的c
10
‑
40
烷基,进一步更好是直链状的c
10
‑
30
烷基,特别好是直链状的c
12
‑
28
烷基,最好是直链状的c
14
‑
26
烷基。
[0061]
所述连接体较好是选自
‑
o
‑
、
‑
c(=o)
‑
、
‑
c(=o)o
‑
、
‑
oc(=o)
‑
、
‑
c(=o)nh
‑
、
‑
nhc(=o)
‑
、
‑
s
‑
、
‑
so
‑
、
‑
so2‑
、和
‑
si(r')(r”)o
‑
、
‑
si(r')(r”)
‑
(r'、r”分别独立表示氢原子或c1‑
22
烃基),更好是选自
‑
o
‑
、
‑
c(=o)
‑
、
‑
c(=o)o
‑
、
‑
oc(=o)
‑
、
‑
c(=o)nh
‑
和
‑
nhc(=o)
‑
,进一步更好是
‑
o
‑
。
[0062]
所述c6‑
14
烃环较好是选自苯环、萘环和环己烷环,更好是选自苯环和环己烷环,进一步更好是苯环。
[0063]
适合用于固液分离的拟固相保护基较好是具有“直链状的c
10
‑
40
烷基介以单键或
‑
o
‑
结合的烃基介以
‑
o
‑
结合的苯环”的保护基。
[0064]
接着,对适合用于萃取的拟固相保护基进行说明。作为“具有至少一个含1条以上的支链的脂肪族烃基、且总碳数为14以上300以下的有机基团”中的支链,为直链状或支链状的饱和脂肪族烃基,较好是c1‑6烷基,更好是c1‑4烷基,进一步更好是甲基或乙基。此外,该“支链”可被1个以上的卤素原子取代。
[0065]“具有至少一个含1条以上的支链的脂肪族烃基、且总碳数为14以上300以下的有机基团”中的“脂肪族烃基”是指直链状的饱和或不饱和的脂肪族烃基,为c2‑
300
烷基(较好是c3‑
100
烷基,更好是c3‑
60
烷基)、c2‑
300
烯基(较好是c3‑
100
烯基,更好是c3‑
60
烯基)或c2‑
300
炔基(较好是c3‑
100
炔基,更好是c3‑
60
炔基)。
[0066]“具有至少一个含1条以上的支链的脂肪族烃基、且总碳数为14以上300以下的有机基团”中的“含1条以上的支链的脂肪族烃基”的部位无特别限定,可存在于末端(1价基团),也可存在于除此以外的部位(例如2价基团)。
[0067]
作为“含1条以上的支链的脂肪族烃基”,可列举例如:作为丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、十一烷基、十二烷基(月桂基)、十三烷基、肉豆蔻基、鲸蜡基、硬脂基、二十烷基、山萮基、油基、亚油基、二十四烷基等的分支异构体的含1条以上的支链的1价基团及由它们衍生的2价基团。“含1条以上的支链的脂肪族烃基”较好是3,7,11
‑
三甲基十二烷基、3,7,11,15
‑
四甲基十六烷基(以下也称2,3
‑
二氢植基)、2,2,4,8,10,10
‑
六甲基十一烷
‑5‑
基等。
[0068]
在“具有至少一个含1条以上的支链的脂肪族烃基、且总碳数为14以上300以下的有机基团”中存在多个“含1条以上的支链的脂肪族烃基”的情况下,这些基团分别可相同或不同。
[0069]“具有至少一个含1条以上的支链的脂肪族烃基、且总碳数为14以上300以下的有机基团”中的除“含1条以上的支链的脂肪族烃基”以外的部位可任意设定。例如,可具有
‑
o
‑
、
‑
s
‑
、
‑
co
‑
、
‑
nh
‑
、
‑
coo
‑
、
‑
oconh
‑
、
‑
conh
‑
、
‑
nhco
‑
、烃基(1价基团或2价基团)等部位。作为“烃基”,可列举例如脂肪族烃基、芳香脂肪族烃基、单环饱和烃基和芳香族烃基等,具体可使用例如烷基、烯基、炔基、环烷基、芳基、芳烷基等1价基团及由它们衍生的2价基团。作为“烷基”,较好是c1‑6烷基,可列举例如甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、己基等。作为“烯基”,较好是c2‑6烯基,可列举例如乙烯基、1
‑
丙烯基、烯丙基、异丙烯基、丁烯基、异丁烯基等。作为“炔基”,较好是c2‑6炔基,可列举例如乙炔基、炔丙基、1
‑
丙炔基等。作为“环烷基”,较好是c3‑6环烷基,可列举例如环丙基、环丁基、环戊基、环己基。“芳基”较好是c6‑
14
芳基,可列举例如苯基、1
‑
萘基、2
‑
萘基、联苯基、2
‑
蒽基等。其中,更好是c6‑
10
芳基,特别好是苯基。作为“芳烷基”,较好是c7‑
20
芳烷基,可列举例如苄基、1
‑
苯基乙基、2
‑
苯基乙基、1
‑
苯基丙基、萘基甲基、1
‑
萘基乙基、1
‑
萘基丙基等。其中,更好是c7‑
16
芳烷基(c6‑
10
芳基
‑
c1‑6烷基),特别好是苄基。该“烃基”可被选自卤素原子(氯原子、溴原子、氟原子、碘原子)、氧代基等中的取代基取代。
[0070]“具有至少一个含1条以上的支链的脂肪族烃基、且总碳数为14以上300以下的有机基团”中的“总碳数”为14以上,较好是16以上,更好是18以上,为300以下,较好是200以下,更好是160以下。此外,“具有至少一个含1条以上的支链的脂肪族烃基、且总碳数为14以上300以下的有机基团”中的支链的数量无特别限定,较好是2条以上,更好是3条以上,进一步更好是4条以上,再进一步更好是8条以上,又再进一步更好是10条以上。该支链的数量越多,则即使寡核苷酸链为长链的情况下,被具备“具有至少一个含1条以上的支链的脂肪族烃基、且总碳数为14以上300以下的有机基团”的拟固相保护基保护的核苷或寡核苷酸在有机溶剂(特别是非极性溶剂)中也良好地溶解。
[0071]
作为“具有至少一个含1条以上的支链的脂肪族烃基、且总碳数为14以上300以下的有机基团”,较好是具有以式(a)表示的相同或不同的2价基团的基团。
[0072]
[化学式6]
[0073]
式中,*表示与邻接原子的结合位置,r
14
和r
15
分别独立表示氢原子或c1‑4烷基,且x1表示单键或c1‑4亚烷基,但是r
14
和r
15
不同时为氢原子。
[0074]
作为具有以式(a)表示的2价基团的基团,可列举例如以下述式(b)~(d)中的任一个表示的基团。应注意,式(b)~(d)中的各符号的定义中的碳数、重复单元的数量(m1、n0~n2)等是为了方便而示出的,可按照总碳数为14以上(较好是16以上,更好是18以上)且300以下(较好是200以下,更好是160以下)的条件在上述的定义的范围内适当变更。以下,对式(b)~(d)依次进行说明。
[0075]
式(b)如下所示。
[0076]
[化学式7]
[0077]
式中,*表示与邻接原子的结合位置,r
16
和r
17
表示氢原子,或者一起表示=o,n0表示2~40的整数,n0个的r
18
和r
19
分别独立表示氢原子或c1‑4烷基,n0个的x2分别独立表示单键或c1‑4亚烷基,r
20
表示氢原子或c1‑4烷基,且r
21
表示c1‑4烷基,但是r
18
和r
19
不同时为氢原子,且n0为2时,r
20
表示c1‑4烷基。
[0078]
作为式(b)的基团,优选如下的基团:r
16
和r
17
均为氢原子,n0为2~40的整数,n0个的r
18
和r
19
分别独立为氢原子、甲基或乙基,n0个的x2分别独立为单键、亚甲基或亚乙基,且r
20
为氢原子、甲基或乙基,但是r
18
和r
19
不同时为氢原子,且n0为2时,r
20
表示甲基或乙基。
[0079]
更优选的式(b)的基团为肉豆蔻基、鲸蜡基、硬脂基、二十烷基、山萮基等的碳数14~160的分支异构体,其中,特别好是2,3
‑
二氢植基、3,7,11
‑
三甲基十二烷基、2,2,4,8,10,10
‑
六甲基
‑5‑
十二烷酰基。
[0080]
式(c)如下所示。
[0081]
[化学式8]
[0082]
式中,*表示与邻接原子的结合位置,m1个的or
22
分别独立表示被以式(b)表示的基团取代的羟基,且m1表示1~3的整数;应注意,式(c)中的“以式(b)表示的基团”,除其*表示与o(即邻接原子)的结合位置以外,如上所述。
[0083]
式(c)的基团中,r
22
更好是作为肉豆蔻基、鲸蜡基、硬脂基、二十烷基、山萮基等的碳数14~30的分支异构体的基团,其中,特别好是2,3
‑
二氢植基、3,7,11
‑
三甲基十二烷基。
[0084]
式(d)如下所示。
[0085]
[化学式9]
[0086]
式中,*表示与q的结合位置,n1表示1~10的整数,n2表示1~10的整数,n1个的r
26
和r
27
分别独立表示氢原子或c1‑4烷基,n1个的x3分别独立表示单键或c1‑4亚烷基,n2个的r
28
和r
29
分别独立表示氢原子或c1‑4烷基,n2个的x5分别独立表示单键或c1‑4亚烷基,x4表示单键或c1‑4亚烷基,且r
23
、r
24
、r
25
、r
30
、r
31
和r
32
分别独立表示氢原子或c1‑4烷基,但是r
26
和r
27
、以及/或者r
28
和r
29
不同时为氢原子,且n1+n2为2时,r
23
、r
24
和r
25
的2个以上分别独立表示c1‑4烷基,或者r
30
、r
31
和r
32
的2个以上分别独立表示c1‑4烷基。
[0087]
作为式(d)的基团,更优选如下的基团:n1为1~5的整数,n2为1~5的整数,n1个的r
26
和r
27
分别独立为氢原子、甲基或乙基,n1个的x3分别独立为单键、亚甲基或亚乙基,n2个的r
28
和r
29
分别独立为氢原子、甲基或乙基,n2个的x5分别独立为单键、亚甲基或亚乙基,x4为单键、亚甲基或亚乙基,且r
23
、r
24
、r
25
、r
30
、r
31
和r
32
分别独立为氢原子或c1‑4烷基,但是r
26
和r
27
、以及/或者r
28
和r
29
不同时为氢原子,且n1+n2为2时,r
23
、r
24
和r
25
的2个以上分别独立表示c1‑4烷基,或者r
30
、r
31
和r
32
的2个以上分别独立表示c1‑4烷基。
[0088]
作为特别优选的式(d)的基团,可列举如下的基团:n1为1~5的整数,n2为1~5的整数,n1个的r
26
和r
27
分别独立为氢原子或甲基,n1个的x3分别独立为单键或亚甲基,n2个的r
28
和r
29
分别独立为氢原子或甲基,n2个的x5分别独立为单键或亚甲基,x4为单键或亚甲基,且r
23
、r
24
、r
25
、r
30
、r
31
和r
32
分别独立为甲基,但是r
26
和r
27
、以及/或者r
28
和r
29
不同时为氢原子。
[0089]
作为“具有至少一个含1条以上的支链的脂肪族烃基、且总碳数为14以上300以下
的有机基团”的具体例子,可列举以下的基团。各基团中的*表示结合位置,式中的n3表示3以上的整数,n4可按照该基团的总碳数为14以上300以下的条件适当设定。
[0090]
[化学式10]
[0091]
作为“具有至少一个含1条以上的支链的脂肪族烃基、且总碳数为14以上300以下的有机基团”的优选的具体例子,可列举以下的基团:3,7,11,15
‑
四甲基十六烷基(别名:2,3
‑
二氢植基)、3,7,11
‑
三甲基十二烷基、2,2,4,8,10,10
‑
六甲基
‑5‑
十二烷酰基、3,4,5
‑
三(3',7',11',15'
‑
四甲基十六烷氧基)苄基、和3,5
‑
二(3',7',11',15'
‑
四甲基十六烷氧基)苄基。
[0092]
拟固相保护基更好是以下述式(g
‑
i)表示的基团(以下有时简称为“拟固相保护基(g
‑
i)”):**l
‑
y
‑
z
ꢀꢀꢀ
(g
‑
i)[式中,**表示与被保护的基团的结合位置;l表示单键、或者以式(a1)或(a1')表示的基团。
[0093]
[化学式11]
[0094]
(式中,*表示与y的结合位置,**与上述同义,r1和r2分别独立表示c1‑
22
烃基,l1表示可被取代的2价的c1‑
22
烃基,l2表示单键,或者表示以***c(=o)n(r3)
‑
r4‑
n(r5)****表示的基团(式中,***表示与l1的结合位置,****表示与c=o的结合位置,r4表示c1‑
22
亚烷基,r3和r5分别独立表示氢原子或c1‑
22
烷基,或者r3和r5可一起形成环));y表示单键、氧原子、或nr(r表示氢原子、烷基或芳烷基);且z表示以式(a2)、式(a2')或式(a2”)表示的基团。
[0095]
[化学式12]
[0096]
[式中,*表示结合位置,r6为氢原子,或者在r
b
为以下述式(a3)表示的基团的情况下,环a或环b的r6可与r8一起表示单键或
‑
o
‑
,与环a或环b以及环c一起形成稠环,k表示1~4的整数,k个的q分别独立表示
‑
o
‑
、
‑
c(=o)
‑
、
‑
c(=o)o
‑
、
‑
oc(=o)
‑
、
‑
c(=o)nh
‑
或
‑
nhc(=o)
‑
,k个的r7分别独立表示碳数10以上的直链状的脂肪族烃基介以单键或连接体结合的烃基、或者表示具有至少一个含1条以上的支链的脂肪族烃基且总碳数为14以上300以下的有机基团,环a和环b除具有k个的qr7之外,可分别独立进而具有选自卤素原子、可被卤素原子取代的c1‑6烷基、和可被卤素原子取代的c1‑6烷氧基中的取代基,r
a
表示氢原子,且r
b
表示氢原子、或以式(a3)表示的基团。
[0097]
[化学式13]
[0098]
(式中,*表示结合位置,
j表示0~4的整数,j个的q分别独立与上述同义,j个的r9分别独立表示碳数10以上的直链状的脂肪族烃基介以单键或连接体结合的烃基、或者表示具有至少一个含1条以上的支链的脂肪族烃基且总碳数为14以上300以下的有机基团,r8表示氢原子,或者可与环a或环b的r6一起表示单键或
‑
o
‑
、与环a或环b以及环c一起形成稠环,且环c除具有j个的qr9之外,可进而具有选自卤素原子、可被卤素原子取代的c1‑6烷基、和可被卤素原子取代的c1‑6烷氧基中的取代基),或者r
a
和r
b
一起形成氧代基。]]。
[0099]
式(a2)、式(a2')和式(a2”)中的r7、以及式(a3)中的r9所具有的碳数10以上的直链状的脂肪族烃基分别独立较好是选自直链状的c
10
‑
40
烷基和直链状的c
10
‑
40
烯基中的基团,更好是直链状的c
10
‑
40
烷基,进一步更好是直链状的c
10
‑
30
烷基,特别好是直链状的c
12
‑
28
烷基,最好是直链状的c
14
‑
26
烷基;式(a2)、式(a2')和式(a2”)中的r7、以及式(a3)中的r9所具有的连接体分别独立较好是
‑
o
‑
、
‑
c(=o)
‑
、
‑
c(=o)o
‑
、
‑
oc(=o)
‑
、
‑
c(=o)nh
‑
或
‑
nhc(=o)
‑
,更好是
‑
o
‑
。
[0100]
式(a2)、式(a2')和式(a2”)中的r7、以及式(a3)中的r9的“碳数10以上的直链状的脂肪族烃基介以单键或连接体结合的烃基”较好是直链状的c
10
‑
40
烷基、1~3个直链状的c
10
‑
40
烷基介以
‑
o
‑
结合的苄基、或1~3个直链状的c
10
‑
40
烷基介以
‑
o
‑
结合的环己基甲基。
[0101]
作为式(a2)、式(a2')和式(a2”)中的r7、以及式(a3)中的r9的一种形态的“具有至少一个含1条以上的支链的脂肪族烃基、且总碳数为14以上300以下的有机基团”分别独立较好是具有以上述式(a)表示的2价基团的基团,更好是以上述式(b)~(d)中的任一个表示的基团,进一步更好是以上述式(b)表示的基团,特别好是2,3
‑
二氢植基、3,7,11
‑
三甲基十二烷基、或2,2,4,8,10,10
‑
六甲基
‑5‑
十二烷酰基。
[0102]
式(a2)、式(a2')、式(a2”)和式(a3)中的q较好是
‑
o
‑
、
‑
c(=o)nh
‑
或
‑
nhc(=o)
‑
,更好是
‑
o
‑
。
[0103]
式(g
‑
i)中,以式(a1)表示的l的优选形态为如下的基团:l1为2价的c1‑
22
烃基、或ch2‑
o
‑
1,4
‑
亚苯基
‑
o
‑
ch2,且l2为单键,或者以***c(=o)n(r3)
‑
r4‑
n(r5)****表示的基团(式中,***表示与l1的结合位置,****表示与c=o的结合位置,r4表示c1‑6亚烷基,r3和r5分别独立表示氢原子或可被取代的c1‑6烷基,或者r3和r5可一起形成可被取代的c1‑6亚烷基)。
[0104]
以式(a1)表示的l的另一优选形态为如下的基团:l1为2价的c1‑
22
烃基,且l2为单键。
[0105]
以式(a1)表示的l的另一优选形态为如下的基团:l1为亚乙基,且l2为以***c(=o)n(r3)
‑
r4‑
n(r5)****表示的基团(式中,***表示与l1的结合位置,****表示与c=o的结合位置,r4表示c1‑
22
亚烷基,r3和r5分别独立表示氢原子或c1‑
22
烷基,或者r3和r5可一起形成环)。
[0106]
以式(a1)表示的l的另一优选形态为如下的基团:l1为亚乙基,且l2为以***c(=o)n(r3)
‑
r4‑
n(r5)****表示的基团(式中,***表示与l1的结合位置,****表示与c=o的结合位置,n(r3)
‑
r4‑
n(r5)部分形成1,4
‑
哌嗪二基)。
[0107]
以式(a1)表示的l的另一优选形态为如下的基团:l1为亚乙基,且l2为以***c(=o)n(r3)
‑
r4‑
n(r5)****表示的基团(式中,***表示与l1的结合位置,****表示与c=o的结合位置,r4表示亚戊基或亚己基,r3和r5分别独立表示氢原子或甲基)。
[0108]
以式(a1)表示的l的特别优选的形态为容易获得且廉价的琥珀酰基。
[0109]
接着,对式(g
‑
i)中以式(a1')表示的l进行说明;式(a1')中的l1较好是2价的c6‑
10
芳香族烃基,更好是亚苯基;式(a1')中的l2较好是单键;作为式(a1')中的l1和l2的优选组合,是l1为2价的c6‑
10
芳香族烃基、l2为单键的组合。作为式(a1')中的l1和l2的更优选组合,是l1为亚苯基、l2为单键的组合;式(a1')中的r1和r2分别独立较好是c1‑
22
烷基,更好是c1‑
10
烷基。
[0110]
以式(a1')表示的l的优选形态为如下的基团:r1和r2分别独立为c1‑
22
烷基,l1为2价的c6‑
10
芳香族烃基,且l2为单键。
[0111]
以式(a1')表示的l的另一优选形态为如下的基团:r1和r2分别独立为c1‑
10
烷基,l1为亚苯基,且l2为单键。
[0112]
式(g
‑
i)中的y为nr的情况下,所述r较好是氢原子、c1‑6烷基或c7‑
16
芳烷基,更好是氢原子、甲基、乙基或苄基,进一步更好是氢原子。y较好是单键、氧原子或nr,更好是单键或氧原子。
[0113]
式(g
‑
i)中的z较好是以式(a2)或式(a2”)表示的基团,更好是以式(a2”)表示的基团。与具有以式(a2)表示的z(即,苄基的结构)的拟固相保护基相比,通过使用具有以式(a2”)表示的z(即,环己基甲基的结构)的拟固相保护基,可使核苷、核苷酸或寡核苷酸(a)等在非极性溶剂中的溶解性飞跃性地提高。由此,可在更高浓度下实施本发明的制造方法,生产性大幅提升。
[0114]
式(a2)中,r6较好是氢原子。此外,式(a2)中,r
a
和r
b
较好是氢原子,或者一起形成氧代基。
[0115]
以式(a2)表示的z的用于固液分离时优选的形态为如下的基团:r
a
和r
b
为氢原子,r6为氢原子,k为1~3的整数,
k个的q为
‑
o
‑
,且k个的r7分别独立为直链状的c
10
‑
40
烷基。
[0116]
以式(a2)表示的z的用于固液分离时优选的另一形态为如下的基团:r
a
和r
b
为氢原子,r6为氢原子,k为1~3的整数,k个的q为
‑
o
‑
,k个的r7分别独立为1~3个直链状的c
10
‑
40
烷基介以
‑
o
‑
结合的苄基、或1~3个直链状的c
10
‑
40
烷基介以
‑
o
‑
结合的环己基甲基,且环a除具有k个的qr7之外,可进而具有选自卤素原子、可被卤素原子取代的c1‑6烷基、和可被卤素原子取代的c1‑6烷氧基中的取代基。
[0117]
以式(a2)表示的z的用于固液分离时优选的另一形态为如下的基团:r
a
为氢原子,且r
b
为以式(a3)表示的基团(式中,*为结合位置,j为0~3的整数,j个的q为
‑
o
‑
,j个的r9分别独立为直链状的c
10
‑
40
烷基,r6和r8均为氢原子)。
[0118]
以式(a2)表示的z的用于固液分离时优选的另一形态为如下的基团:r
a
为氢原子,且r
b
为以式(a3)表示的基团(式中,*为结合位置,j为0~3的整数,j个的q为
‑
o
‑
,j个的r9分别独立为直链状的c
10
‑
40
烷基,r8与r6一起表示单键或
‑
o
‑
,与环a和环c一起形成稠环)。
[0119]
以式(a2)表示的z的用于固液分离时优选的另一形态为如下的基团:r
a
和r
b
一起形成氧代基,r6为氢原子,k为1~3的整数,k个的q为
‑
o
‑
,且k个的r7分别独立为直链状的c
10
‑
40
烷基。
[0120]
以式(a2)表示的z的用于固液分离时优选的另一形态为如下的基团:r
a
和r
b
一起形成氧代基,r6为氢原子,k为1~3的整数,k个的q为
‑
o
‑
,k个的r7分别独立为1~3个直链状的c
10
‑
40
烷基介以
‑
o
‑
结合的苄基、或1~3个直链状的c
10
‑
40
烷基介以
‑
o
‑
结合的环己基甲基,且环a除具有k个的qr7之外,可进而具有选自卤素原子、可被卤素原子取代的c1‑6烷基、和可被卤素原子取代的c1‑6烷氧基中的取代基。
[0121]
式(a2”)中,r6较好是氢原子。此外,式(a2”)中,r
a
和r
b
较好是氢原子,或者一起形成氧代基。
[0122]
以式(a2”)表示的z的用于固液分离时优选的形态为如下的基团:r
a
和r
b
为氢原子,r6为氢原子,k为1~3的整数,k个的q为
‑
o
‑
,且k个的r7分别独立为直链状的c
10
‑
40
烷基。
[0123]
以式(a2”)表示的z的用于固液分离时优选的另一形态为如下的基团:r
a
和r
b
为氢原子,r6为氢原子,k为1~3的整数,k个的q为
‑
o
‑
,k个的r7分别独立为1~3个直链状的c
10
‑
40
烷基介以
‑
o
‑
结合的苄基、或1~3个直链状的c
10
‑
40
烷基介以
‑
o
‑
结合的环己基甲基,且环b除具有k个的qr7之外,可进而具有选自卤素原子、可被卤素原子取代的c1‑6烷基、和可被卤素原子取代的c1‑6烷氧基中的取代基。
[0124]
以式(a2”)表示的z的用于固液分离时优选的另一形态为如下的基团:r
a
为氢原子,r
b
为以式(a3)表示的基团(式中,*为结合位置,j为0~3的整数,j个的q为
‑
o
‑
,j个的r9分别独立为c
10
‑
40
烷基,r6和r8均为氢原子)。
[0125]
以式(a2”)表示的z的用于固液分离时优选的另一形态为如下的基团:r
a
为氢原子,r
b
为以式(a3)表示的基团(式中,*为结合位置,j为0~3的整数,j个的q为
‑
o
‑
,j个的r9分别独立为直链状的c
10
‑
40
烷基,r8与r6一起表示单键或
‑
o
‑
,与环b和环c一起形成稠环)。
[0126]
以式(a2”)表示的z的用于固液分离时优选的另一形态为如下的基团:r
a
和r
b
一起形成氧代基,r6为氢原子,k为1~3的整数,k个的q为
‑
o
‑
,且k个的r7分别独立为直链状的c
10
‑
40
烷基。
[0127]
以式(a2”)表示的z的用于固液分离时优选的另一形态为如下的基团:r
a
和r
b
一起形成氧代基,r6为氢原子,k为1~3的整数,k个的q为
‑
o
‑
,k个的r7分别独立为1~3个直链状的c
10
‑
40
烷基介以
‑
o
‑
结合的苄基、或1~3个直链状的c
10
‑
40
烷基介以
‑
o
‑
结合的环己基甲基,且
环b除具有k个的qr7之外,可进而具有选自卤素原子、可被卤素原子取代的c1‑6烷基、和可被卤素原子取代的c1‑6烷氧基中的取代基。
[0128]
用于固液分离时优选的拟固相保护基(g
‑
i)较好是下述的基团:l为琥珀酰基,或者为以式(a1')表示的基团(式(a1')中,r1和r2分别独立为c1‑
10
烷基,l1为2价的亚苯基,l2为单键),且y
‑
z为3,4,5
‑
三(十八烷氧基)苄氧基、3,5
‑
双(二十二烷氧基)苄氧基、3,5
‑
双[3',4',5'
‑
三(十八烷氧基)苄氧基]苄氧基、3,4,5
‑
三[3',4',5'
‑
三(十八烷氧基)苄氧基]苄氧基、3,4,5
‑
三(十八烷氧基)苄基氨基、2,4
‑
双(二十二烷氧基)苄基氨基、3,5
‑
双(二十二烷氧基)苄基氨基、双(4
‑
二十二烷氧基苯基)甲基氨基、4
‑
甲氧基
‑2‑
[3',4',5'
‑
三(十八烷氧基)苄氧基]苄基氨基、4
‑
甲氧基
‑2‑
[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]苄基氨基、2,4
‑
双(十二烷氧基)苄基氨基、苯基(2,3,4
‑
三(十八烷氧基)苯基)甲基氨基、双[4
‑
(12
‑
二十二烷氧基十二烷氧基)苯基]甲基氨基、3,5
‑
双[3',4',5'
‑
三(十八烷氧基)苄氧基]苄基氨基、3,4,5
‑
三[3',4',5'
‑
三(十八烷氧基)苄氧基]苄基氨基、3,4,5
‑
三(十八烷氧基)环己基甲氧基、3,5
‑
双(二十二烷氧基)环己基甲氧基、3,5
‑
双[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲氧基、3,4,5
‑
三[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲氧基、3,4,5
‑
三(十八烷氧基)环己基甲基氨基、2,4
‑
双(二十二烷氧基)环己基甲基氨基、3,5
‑
双(二十二烷氧基)环己基甲基氨基、双(4
‑
二十二烷氧基环己基)甲基氨基、4
‑
甲氧基
‑2‑
[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲基氨基、4
‑
甲氧基
‑2‑
[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲基氨基、2,4
‑
双(十二烷氧基)环己基甲基氨基、苯基(2,3,4
‑
三(十八烷氧基)环己基)甲基氨基、双[4
‑
(12
‑
二十二烷氧基十二烷氧基)环己基]甲基氨基、3,5
‑
双[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲基氨基、或3,4,5
‑
三[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲基氨基;或者,是下述的基团:l
‑
y为单键或琥珀酰基
‑
1,4
‑
哌嗪二基,且z为3,4,5
‑
三(十八烷氧基)苯甲酰基、3,5
‑
双(二十二烷氧基)苯甲酰基、3,5
‑
双[3',4',5'
‑
三(十八烷氧基)苄氧基]苯甲酰基、或3,4,5
‑
三[3',4',5'
‑
三(十八烷氧基)苄氧基]苯甲酰基。
[0129]
用于固液分离时优选的拟固相保护基(g
‑
i)更好是下述的基团:l为琥珀酰基,且y
‑
z为3,4,5
‑
三(十八烷氧基)苄氧基、3,5
‑
双(二十二烷氧基)苄氧基、3,5
‑
双[3',4',5'
‑
三(十八烷氧基)苄氧基]苄氧基、3,4,5
‑
三[3',4',5'
‑
三(十八烷氧基)苄氧基]苄氧基、3,4,5
‑
三(十八烷氧基)苄基氨基、2,4
‑
双(二十二烷氧基)苄基氨基、3,5
‑
双(二十二烷氧基)苄基氨基、双(4
‑
二十二烷氧基苯基)甲基氨基、4
‑
甲氧基
‑2‑
[3',4',5'
‑
三(十八烷氧基)苄氧基]苄基氨基、4
‑
甲氧基
‑2‑
[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]苄基氨基、2,4
‑
双(十二烷氧基)苄基氨基、苯基(2,3,4
‑
三(十八烷氧基)苯基)甲基氨基、双[4
‑
(12
‑
二十二烷氧基十二烷氧基)苯基]甲基氨基、3,5
‑
双[3',4',5'
‑
三(十八烷氧基)苄氧基]苄基氨基、3,4,5
‑
三[3',4',5'
‑
三(十八烷氧基)苄氧基]苄基氨基、3,4,5
‑
三(十八烷氧基)环己基甲氧基、3,5
‑
双(二十二烷氧基)环己基甲氧基、3,5
‑
双[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲氧基、3,4,5
‑
三[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲氧
基、3,4,5
‑
三(十八烷氧基)环己基甲基氨基、2,4
‑
双(二十二烷氧基)环己基甲基氨基、3,5
‑
双(二十二烷氧基)环己基甲基氨基、双(4
‑
二十二烷氧基环己基)甲基氨基、4
‑
甲氧基
‑2‑
[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲基氨基、4
‑
甲氧基
‑2‑
[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲基氨基、2,4
‑
双(十二烷氧基)环己基甲基氨基、苯基(2,3,4
‑
三(十八烷氧基)环己基)甲基氨基、双[4
‑
(12
‑
二十二烷氧基十二烷氧基)环己基]甲基氨基、3,5
‑
双[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲基氨基、或3,4,5
‑
三[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲基氨基;或者,是下述的基团:l
‑
y为单键或琥珀酰基
‑
1,4
‑
哌嗪二基,且z为3,4,5
‑
三(十八烷氧基)苯甲酰基、3,5
‑
双(二十二烷氧基)苯甲酰基、3,5
‑
双[3',4',5'
‑
三(十八烷氧基)苄氧基]苯甲酰基、或3,4,5
‑
三[3',4',5'
‑
三(十八烷氧基)苄氧基]苯甲酰基。
[0130]
用于固液分离时优选的拟固相保护基(g
‑
i)进一步更好是下述的基团:l为琥珀酰基,且y
‑
z为3,4,5
‑
三(十八烷氧基)苄氧基、3,4,5
‑
三(十八烷氧基)环己基甲氧基、3,5
‑
双(二十二烷氧基)环己基甲氧基、3,5
‑
双[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲氧基、3,4,5
‑
三[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲氧基、3,4,5
‑
三(十八烷氧基)环己基甲基氨基、2,4
‑
双(二十二烷氧基)环己基甲基氨基、3,5
‑
双(二十二烷氧基)环己基甲基氨基、4
‑
甲氧基
‑2‑
[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲基氨基、4
‑
甲氧基
‑2‑
[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲基氨基、2,4
‑
双(十二烷氧基)环己基甲基氨基、3,5
‑
双[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲基氨基、或3,4,5
‑
三[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲基氨基,或者,是下述的基团:l
‑
y为单键或琥珀酰基
‑
1,4
‑
哌嗪二基,且z为3,4,5
‑
三(十八烷氧基)苯甲酰基。
[0131]
用于固液分离时优选的拟固相保护基(g
‑
i)特别好是下述的基团:l为琥珀酰基,且y
‑
z为3,4,5
‑
三(十八烷氧基)苄氧基、3,4,5
‑
三(十八烷氧基)环己基甲氧基或苯基(2,3,4
‑
三(十八烷氧基)苯基)甲基氨基;或者,是下述的基团:l
‑
y为琥珀酰基
‑
1,4
‑
哌嗪二基,且z为3,4,5
‑
三(十八烷氧基)苯甲酰基。
[0132]
用于固液分离时优选的拟固相保护基(g
‑
i)最好是下述的基团:l为琥珀酰基,且y
‑
z为3,4,5
‑
三(十八烷氧基)苄氧基、或3,4,5
‑
三(十八烷氧基)环己基甲氧基;或者,是下述的基团:l
‑
y为琥珀酰基
‑
1,4
‑
哌嗪二基,且z为3,4,5
‑
三(十八烷氧基)苯甲酰基。
[0133]
用于萃取时优选的拟固相保护基(g
‑
i)较好是2
‑
{2,4
‑
二(2',3'
‑
二氢植基氧基)
苄基氨基羰基}乙基羰基、3,5
‑
二(2',3'
‑
二氢植基氧基)苄氧基琥珀酰基、4
‑
(2',3'
‑
二氢植基氧基)苄氧基琥珀酰基、2
‑
{1
‑
[(2
‑
氯
‑5‑
(2',3'
‑
二氢植基氧基)苯基)]苄基氨基羰基}乙基羰基、3,4,5
‑
三(2',3'
‑
二氢植基氧基)苄氧基琥珀酰基、2
‑
{3,4,5
‑
三(2',3'
‑
二氢植基氧基)苄基氨基羰基}乙基羰基、2
‑
{4
‑
(2',3'
‑
二氢植基氧基)苄基氨基羰基}乙基羰基、2
‑
{2
‑
[3',4',5'
‑
三(2”,3
”‑
二氢植基氧基)苄氧基]
‑4‑
甲氧基苄基氨基羰基}乙基羰基、2
‑
{4
‑
(2',3'
‑
二氢植基氧基)
‑2‑
甲氧基苄基氨基羰基}乙基羰基、4
‑
(2',3'
‑
二氢植基氧基)
‑2‑
甲基苄氧基琥珀酰基、2
‑
{4
‑
(2',3'
‑
二氢植基氧基)
‑2‑
甲基苄基氨基羰基}乙基羰基、4
‑
[2,2,4,8,10,10
‑
六甲基
‑5‑
十二烷酰基氨基]苄氧基琥珀酰基、2
‑
{4
‑
[2,2,4,8,10,10
‑
六甲基
‑5‑
十二烷酰基氨基]苄基氨基羰基}乙基羰基、4
‑
(3,7,11
‑
三甲基十二烷氧基)苄氧基琥珀酰基、2
‑
{4
‑
(3,7,11
‑
三甲基十二烷氧基)苄基氨基羰基}乙基羰基、2
‑
{3,5
‑
二(2',3'
‑
二氢植基氧基)苄基氨基羰基}乙基羰基、2
‑
{1
‑
[2,3,4
‑
三(2',3'
‑
二氢植基氧基)苯基]苄基氨基羰基}乙基羰基、2
‑
{1
‑
[4
‑
(2',3'
‑
二氢植基氧基)苯基]
‑
4'
‑
(2',3'
‑
二氢植基氧基)苄基氨基羰基}乙基羰基、3,4,5
‑
三[3,4,5
‑
三(2',3'
‑
二氢植基氧基)苄基]苄氧基琥珀酰基、或2
‑
{3,4,5
‑
三[3,4,5
‑
三(2',3'
‑
二氢植基氧基)苄基]苄基氨基羰基}乙基羰基。
[0134]
用于形成拟固相保护基的以式:z
‑
y
‑
h表示的醇化合物或胺化合物可通过例如国际公开第2017/104836号的第[0186]~[0221]段记载的工序或基于其的工序进行制造。
[0135]
作为本工序中使用的核苷、核苷酸或寡核苷酸(a),可列举例如以下述式(a
‑
i)表示的化合物(即,核苷或寡核苷酸)。
[0136]
[化学式14]
[0137]
[式中,m表示0以上的整数,m+1个的base分别独立表示可被保护的核酸碱基,m+1个的x分别独立表示氢原子、卤素原子、可被保护的羟基、或与2位碳原子和4位碳原子结合的2价有机基团,m+1个的x
n1
分别独立表示氧原子或nh,m个的r
10
分别独立表示氧原子或硫原子,m个的r
p1
分别独立表示磷酸基的保护基,
l、y和z与上述同义]。
[0138]
以下,有时将以式(a
‑
i)表示的化合物简称为“化合物(a
‑
i)”。以其他式表示的化合物有时也同样地简称。
[0139]
核酸碱基的氨基较好是被保护基保护。作为该保护基,较好是乙酰基、苯氧乙酰基、4
‑
异丙基苯氧乙酰基、苯甲酰基、异丁酰基、(2
‑
己基)癸酰基、二甲基甲脒基、和=nc(r
11
)
‑
n(r
12
)(r
13
)基(式中,r
11
表示甲基,r
12
和r
13
分别独立表示c1‑5烷基,或者r
11
和r
12
可一起与它们结合的碳原子和氮原子共同形成五元或六元含氮烃环)。应予说明,作为所述=nc(r
11
)
‑
n(r
12
)(r
13
)基,可列举例如1
‑
(二甲基氨基)亚乙基。化合物(a
‑
i)有多个氨基的情况下,氨基酸的保护基可以是仅1种,也可以是2种以上。
[0140]
m为0的情况下,化合物(a
‑
i)为核苷;m为1以上的情况下,化合物(a
‑
i)为寡核苷酸。m较好是49以下,更好是29以下,进一步更好是19以下,特别好是4以下,最好是2以下。
[0141]
作为x的卤素原子,较好是氟原子、氯原子,更好是氟原子。
[0142]
作为x的可被保护的羟基的保护基,无特别限定,可列举例如《有机合成中的保护基(protective groups in organic synthesis)》、第3版、约翰威立父子出版公司(john willy&sons)出版(1999年)等中所记载的任意的保护基。具体来说,可列举甲基、苄基、对甲氧基苄基、叔丁基、甲氧基甲基、甲氧基乙基、2
‑
四氢吡喃基、乙氧基乙基、氰基乙基、氰基乙氧基甲基、苯基氨甲酰基、1,1
‑
二氧代硫代吗啉
‑4‑
硫代氨甲酰基、乙酰基、新戊酰基、苯甲酰基、三甲基甲硅烷基、三乙基甲硅烷基、三异丙基甲硅烷基、叔丁基二甲基甲硅烷基、[(三异丙基甲硅烷基)氧基]甲基(tom)、1
‑
(4
‑
氯苯基)
‑4‑
乙氧基哌啶
‑4‑
基(cpep)等。可被保护的羟基的保护基较好是三乙基甲硅烷基、三异丙基甲硅烷基、或叔丁基二甲基甲硅烷基,从经济性和获取的容易性的观点来看,特别好是叔丁基二甲基甲硅烷基。
[0143]
作为x的“与2位碳原子和4位碳原子结合的2价有机基团”,只要与核苷的2位碳原子和4位碳原子结合则无特别限定。作为该2价有机基团,可列举例如:可被取代的c2‑7亚烷基、以及由选自
‑
o
‑
、
‑
nr
33
‑
(r
33
表示氢原子或c1‑6烷基)、
‑
s
‑
、
‑
co
‑
、
‑
coo
‑
、
‑
oconr
34
‑
(r
34
表示氢原子或c1‑6烷基)和
‑
conr
35
‑
(r
35
表示氢原子或c1‑6烷基)中的2价连接体与可被取代的c1‑7亚烷基所构成的2价有机基团等。作为c1‑7亚烷基和c2‑7亚烷基可具有的取代基,可列举例如亚甲基(ch2=)。
[0144]
作为“与2位碳原子和4位碳原子结合的2价有机基团”,较好是可被取代的c2‑7亚烷基、
‑
or
i
‑
(r
i
表示与4位碳原子结合的c1‑6亚烷基)、
‑
o
‑
nr
33
‑
r
j
‑
(r
j
表示与4位碳原子结合的c1‑6亚烷基,r
33
表示与上述同样的含义)、
‑
o
‑
r
k
‑
o
‑
r
l
‑
(r
k
表示c1‑6亚烷基,r
l
表示与4位碳原子交联结合的c1‑6亚烷基),更好是
‑
or
i
‑
(r
i
表示与上述同样的含义)、
‑
o
‑
nr
33
‑
r
j
‑
(r
j
和r
33
表示与上述同样的含义)、
‑
o
‑
r
k
‑
o
‑
r
l
‑
(r
k
和r
l
表示与上述同样的含义)。作为以r
i
、r
j
、r
k
和r
l
表示的c1‑6亚烷基,分别独立较好是亚甲基或亚乙基。
[0145]
作为“与2位碳原子和4位碳原子结合的2价有机基团”,更好是
‑
o
‑
ch2‑
、
‑
o
‑
ch2‑
ch2‑
、
‑
o
‑
nr
33
‑
ch2‑
(r
33
表示与上述同样的含义)、
‑
o
‑
ch2‑
o
‑
ch2‑
,进一步更好是
‑
o
‑
ch2‑
、
‑
o
‑
ch2‑
ch2‑
、
‑
o
‑
nh
‑
ch2‑
、
‑
o
‑
n(ch3)
‑
ch2‑
、
‑
o
‑
ch2‑
o
‑
ch2‑
(分别是左侧与2位碳原子结合,右侧与4位碳原子结合)。
[0146]
m+1个的x分别独立较好是氢原子、卤素原子、或可被保护的羟基,更好是氢原子或可被保护的羟基。
[0147]
作为r
p1
的磷酸基的保护基,只要是在碱性条件下可除去且能用作磷酸基的保护基的基团,则无特别限定,较好是以
‑
ch2ch2wg表示的基团,wg表示吸电子基团。作为wg的吸电子基团,可列举例如氰基、硝基等,较好是氰基。
[0148]
m个的r
p1
较好是分别独立为以
‑
ch2ch2wg表示的基团。m+1个的x
n1
较好是氧原子。l、y和z的说明如上所述。
[0149]
化合物(a
‑
i)较好是以下述式(a
‑
i)表示的化合物(下述式中的符号的定义和说明如上所述)。
[0150]
[化学式15]
[0151]
化合物(a
‑
i)可通过本身公知的方法或基于其的方法制造。例如,m为0、x
n1
为氧原子、l为琥珀酰基的化合物(a
‑
i)例如可如下式所示那样进行制造:首先,在碱的存在下使5'位羟基被临时保护基q”保护的核苷(i)与琥珀酸酐反应,合成核苷(ii),接着,在缩合剂的存在下,使所得的核苷(ii)与化合物z
‑
y
‑
h缩合,合成3'位和5'位羟基被保护的核苷后,用酸除去临时保护基q”。
[0152]
[化学式16]
[0153]
从核苷(i)向核苷(ii)的转化反应在对反应惰性的溶剂中进行较有利。作为这样的溶剂,只要反应进行则无特别限定,较好是二氯甲烷、1,2
‑
二氯乙烷、氯仿、四氯化碳等卤素类溶剂,苯、甲苯、二甲苯等芳香族类溶剂,或者戊烷、己烷、庚烷、辛烷等脂肪族类溶剂,或者二乙醚、四氢呋喃、环戊基甲基醚等醚类溶剂,以及它们的混合溶剂。其中,特别好是二氯甲烷、或氯仿。
[0154]
作为用于核苷(ii)的合成的碱,无特别限定,较好是有机碱,更好是三乙胺。
[0155]
用于合成核苷(iii)的缩合反应在对反应惰性的溶剂中进行较有利。作为这样的溶剂,只要反应进行则无特别限定,较好是二氯甲烷、1,2
‑
二氯乙烷、氯仿、四氯化碳等卤素类溶剂,苯、甲苯、二甲苯等芳香族类溶剂,戊烷、己烷、庚烷、辛烷等脂肪族类溶剂,或者它们的组合。其中,特别好是二氯甲烷、氯仿。
[0156]
作为用于核苷(ii)与z
‑
y
‑
h的缩合反应的缩合剂,可列举:二环己基碳二亚胺(dcc)、二异丙基碳二亚胺(dic)、n
‑
乙基
‑
n'
‑
(3
‑
二甲基氨基丙基)碳二亚胺及其盐酸盐(edc
·
hcl)、六氟磷酸(苯并三唑
‑1‑
基氧基)三吡咯烷基鏻(pybop)、o
‑
(苯并三唑
‑1‑
基)
‑
n,n,n',n'
‑
四甲基脲四氟硼酸盐(tbtu)、1
‑
[双(二甲基氨基)亚甲基]
‑5‑
氯
‑
1h
‑
苯并三唑鎓
‑3‑
氧化物六氟磷酸盐(hctu)、o
‑
苯并三唑
‑
n,n,n',n'
‑
四甲基脲六氟磷酸盐(hbtu)等。其中,较好是hbtu、hctu、n
‑
乙基
‑
n'
‑
(3
‑
二甲基氨基丙基)碳二亚胺及其盐酸盐(edc
·
hcl)。
[0157]
缩合剂的使用量相对于1摩尔核苷(ii)例如为1~10摩尔,较好是1~5摩尔。此外,z
‑
y
‑
h的使用量相对于1摩尔核苷(ii)例如为1~10摩尔,较好是1~5摩尔。反应温度只要反应进行则无特别限定,较好是
‑
10℃~50℃,更好是0℃~30℃。反应时间例如为30分钟~70小时。
[0158]
核苷(iii)的临时保护基q的除去(脱保护)可与本发明的工序(4)同样地进行。
[0159]
l不为琥珀酰基的化合物(a
‑
i)也可通过使用对应的酸酐、对应的二羧酸卤化物、对应的二羧酸的活性酯等代替上述合成法中的琥珀酸酐,进行同样的反应来合成。此外,x
n1
为nh的化合物(a
‑
i)也可通过使用3'位羟基为氨基的核苷代替上述合成法中的核苷(i),进行同样的反应来合成。此外,m为1以上的化合物(a
‑
i)可通过使用m为0的化合物(a
‑
i)作为起始原料反复进行5'末端伸长工艺来合成。
[0160]
化合物(a
‑
i)中,较好是以式(a
‑
ii)表示的化合物(即,核苷或寡核苷酸)。
[0161]
[化学式17]
[0162]
[式中,m、m个的base、m+1个的x、m个的r
10
、m个的r
p1
、l、y和z分别独立与上述同义,r
11
表示甲基,r
12
和r
13
分别独立表示c1‑5烷基,或者r
11
和r
12
可一起与它们结合的碳原子和氮原子共同形成五元或六元含氮烃环]。
[0163]
式(a
‑
ii)中,m个的r
p1
分别独立较好是以
‑
ch2ch2wg表示的基团;式(a
‑
ii)中,m较好是0。即,化合物(a
‑
ii)中,较好是以式(a
‑
iii)表示的化合物(即,核苷),下述式中的符号的定义和说明如上所述。
[0164]
[化学式18]
[0165]
式(a
‑
ii)和式(a
‑
iii)中,r
11
为甲基,r
12
和r
13
分别独立较好是c1‑5烷基,r
11
、r
12
和r
13
更好是甲基;式(a
‑
ii)和式(a
‑
iii)中的其他符号的说明如上所述。
[0166]
本发明中,在制造最初的残基具有腺嘌呤作为核酸碱基的寡核苷酸的情况下,通过将化合物(a
‑
ii)(特别是化合物(a
‑
iii))用作作为起始物质的核苷、核苷酸或寡核苷酸
(a),可抑制分支体的生成等。在此,分支体是指目标化合物的核酸碱基中的氨基的保护基脱落,该氨基与单体结合而生成的副产物。
[0167]
此外,化合物(a
‑
i)中,较好是以式(a
‑
iv)表示的化合物(即,核苷或寡核苷酸)。
[0168]
[化学式19]
[0169]
[式中,m、m+1个的碱基(base)、m+1个的x、m个的r
10
、m个的r
p1
、l和y分别独立与上述同义,z'表示以式(a2”)表示的基团。
[0170]
[化学式20]
[0171]
[式中,*表示结合位置,r6为氢原子,或者在r
b
为以下述式(a3)表示的基团的情况下,r6可与r8一起表示单键或
‑
o
‑
,与环b和环c一起形成稠环,k表示1~4的整数;k个的q分别独立表示
‑
o
‑
、
‑
c(=o)
‑
、
‑
c(=o)o
‑
、
‑
oc(=o)
‑
、
‑
c(=o)nh
‑
或
‑
nhc(=o)
‑
,k个的r7分别独立表示碳数10以上的直链状的脂肪族烃基介以单键或连接体结合的烃基,或者表示具有至少一个含1条以上的支链的脂肪族烃基且总碳数为14以上300以下
的有机基团,环b除具有k个的qr7之外,可进而具有选自卤素原子、可被卤素原子取代的c1‑6烷基、和可被卤素原子取代的c1‑6烷氧基中的取代基;r
a
表示氢原子,且r
b
表示氢原子、或以式(a3)表示的基团。
[0172]
[化学式21]
[0173]
(式中,*表示结合位置,j表示0~4的整数,j个的q分别独立与上述同义,j个的r9分别独立表示碳数10以上的直链状的脂肪族烃基介以单键或连接体结合的烃基,或者表示具有至少一个含1条以上的支链的脂肪族烃基且总碳数为14以上300以下的有机基团,r8表示氢原子,或者可与r6一起表示单键或
‑
o
‑
,与环b和环c一起形成稠环,且环c除具有j个的qr9之外,可进而具有选自卤素原子、可被卤素原子取代的c1‑6烷基、和可被卤素原子取代的c1‑6烷氧基中的取代基),或者r
a
和r
b
一起形成氧代基。]]。
[0174]
式(a
‑
iv)中,m个的r
p1
分别独立较好是以
‑
ch2ch2wg表示的基团;式(a
‑
iv)中,m较好是0;式(a
‑
iv)中的其他符号的说明如上所述;化合物(a
‑
iv)中,较好是以下述式(a
‑
v)表示的化合物(即,核苷),下述式中的符号的定义和说明如上所述。
[0175]
[化学式22]
[0176]
化合物(a
‑
i)中,拟固相保护基中具有以式(a2”)表示的z'(即,环己基甲基的结构)的化合物(a
‑
iv)(特别是化合物(a
‑
v))与拟固相保护基中具有以式(a2)表示的z(即,苄基的结构)的其他化合物(a
‑
i)相比,在非极性溶剂中的溶解性更高。因此,通过使用化合物(a
‑
iv)(特别是化合物(a
‑
v)),可在更高浓度下实施本发明的制造方法,生产性大幅提升。以式(a2”)表示的z'的说明与上述的以式(a2”)表示的z的说明相同。
[0177]
式(a
‑
iv)和(a
‑
v)中,为了固液分离,较好是如下的组合:l为琥珀酰基,或者为以式(a1')表示的基团(式(a1')中,r1和r2分别独立为c1‑
10
烷基,l1为2价的亚苯基,l2为单键);且y
‑
z'为3,4,5
‑
三(十八烷氧基)环己基甲氧基、3,5
‑
双(二十二烷氧基)环己基甲氧基、3,5
‑
双[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲氧基、3,4,5
‑
三[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲氧基、3,4,5
‑
三(十八烷氧基)环己基甲基氨基、2,4
‑
双(二十二烷氧基)环己基甲基氨基、3,5
‑
双(二十二烷氧基)环己基甲基氨基、4
‑
甲氧基
‑2‑
[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲基氨基、4
‑
甲氧基
‑2‑
[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲基氨基、2,4
‑
双(十二烷氧基)环己基甲基氨基、3,5
‑
双[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲基氨基、或3,4,5
‑
三[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲基氨基。
[0178]
式(a
‑
iv)和(a
‑
v)中,为了固液分离,更好是如下的组合:l为琥珀酰基,且y
‑
z'为3,4,5
‑
三(十八烷氧基)环己基甲氧基、3,5
‑
双(二十二烷氧基)环己基甲氧基、3,5
‑
双[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲氧基、3,4,5
‑
三[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲氧基、3,4,5
‑
三(十八烷氧基)环己基甲基氨基、2,4
‑
双(二十二烷氧基)环己基甲基氨基、3,5
‑
双(二十二烷氧基)环己基甲基氨基、4
‑
甲氧基
‑2‑
[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲基氨基、4
‑
甲氧基
‑2‑
[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲基氨基、2,4
‑
双(十二烷氧基)环己基甲基氨基、3,5
‑
双[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲基氨基、或3,4,5
‑
三[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲基氨基。
[0179]
式(a
‑
iv)和(a
‑
v)中,为了固液分离,进一步更好是如下的组合:l为琥珀酰基,且y
‑
z'为3,4,5
‑
三(十八烷氧基)环己基甲氧基、3,5
‑
双(二十二烷氧基)环己基甲氧基、3,5
‑
双[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲氧基、或3,4,5
‑
三[3',4',5'
‑
三(十八烷氧基)环己基甲氧基]环己基甲氧基。
[0180]
式(a
‑
iv)和(a
‑
v)中,为了固液分离,特别好是如下的组合:l为琥珀酰基,且y
‑
z'为3,4,5
‑
三(十八烷氧基)环己基甲氧基。
[0181]
此外,作为核苷、核苷酸或寡核苷酸(a),可列举例如以下述式(a
‑
vi)表示的化合物(即,核苷或寡核苷酸)。
[0182]
[化学式23]
[0183]
[式中,m+1个的base1的至少一个表示被
‑
l
‑
y
‑
z保护的核酸碱基,其余表示可被保护的核酸碱基,m个的x
n1
分别独立表示氧原子或nh,x
n2
表示被保护的羟基或氨基,m、m+1个的x、m个的r
10
、m个的r
p1
、l、y和z分别独立与上述同义]。
[0184]
式(a
‑
vi)中,m+1个的base1的至少一个为被
‑
l
‑
y
‑
z保护的核酸碱基。核酸碱基和
‑
l
‑
y
‑
z的说明如上所述。此外,可被保护的核酸碱基的说明也如上所述。
[0185]
作为被保护的羟基(x
n2
)的保护基,无特别限定,可列举例如《有机合成中的保护基(protective groups in organic synthesis)》、第3版、约翰威立父子出版公司(john willy&sons)出版(1999年)等中所记载的任意的保护基。具体来说,可列举甲基、苄基、对甲氧基苄基、叔丁基、甲氧基乙基、乙氧基乙基、氰基乙基、氰基乙氧基甲基、苯基氨甲酰基、1,1
‑
二氧代硫代吗啉
‑4‑
硫代氨甲酰基、乙酰基、新戊酰基、苯甲酰基、三乙基甲硅烷基、三异丙基甲硅烷基、叔丁基二甲基甲硅烷基、[(三异丙基甲硅烷基)氧基]甲基(tom)、1
‑
(4
‑
氯苯基)
‑4‑
乙氧基哌啶
‑4‑
基(cpep)等。羟基的保护基较好是三乙基甲硅烷基、三异丙基甲硅烷基或叔丁基二甲基甲硅烷基,从经济性和获取的容易性的观点来看,更好是叔丁基二甲基甲硅烷基。应注意,羟基的保护和脱保护是周知的,可通过例如上述的《有机合成中的保护基(protective groups in organic synthesis)》中记载的方法进行。
[0186]
作为被保护的氨基(x
n2
)的保护基,无特别限定,可列举例如《有机合成中的保护基(greene's protective groups in organic synthesis)》、第4版、威立国际科学(wiley
‑
interscience)出版(2006年)等中所记载的保护基。作为各保护基的具体例子,可列举:新戊酰基、新戊酰氧甲基、乙酰基、三氟乙酰基、苯氧乙酰基、4
‑
异丙基苯氧乙酰基、4
‑
叔丁基苯氧乙酰基、苯甲酰基、异丁酰基、(2
‑
己基)癸酰基、二甲基甲脒基、1
‑
(二甲基氨基)亚乙基、9
‑
芴基甲氧羰基。氨基的保护基较好是乙酰基、苯氧乙酰基、4
‑
异丙基苯氧乙酰基、苯甲酰基、异丁酰基、(2
‑
己基)癸酰基、二甲基甲脒基、或1
‑
(二甲基氨基)亚乙基。应注意,氨基的保护和脱保护是周知的,可通过例如上述的《有机合成中的保护基(protective groups in organic synthesis)》中记载的方法进行。
[0187]
式(a
‑
vi)中的m个的x
n1
较好是氧原子;式(a
‑
vi)中的x
n2
较好是被保护的羟基;式(a
‑
vi)中的m个的r
p1
较好是分别独立为以
‑
ch2ch2wg表示的基团;式(a
‑
vi)中的其他符号的说明如上所述,化合物(a
‑
vi)较好是以下述式(a
‑
vi)表示的化合物。
[0188]
[化学式24]
[0189]
[式中,r
n4
表示羟基的保护基,m、m+1个的base1、m+1个的x、m个的r
10
、m个的r
p1
、l、y和z分别独立与上述同义]。
[0190]
式(a
‑
vi)中的r
n4
的说明与x
n2
中的羟基的保护基的说明相同。式(a
‑
vi)中的其他符号的说明如上所述。
[0191]
此外,作为核苷酸或寡核苷酸(a1),可列举例如以下述式(a
‑
vii)表示的化合物。
[0192]
[化学式25]
[0193]
[式中,
m+1个的x
n1
分别独立表示氧原子或nh,l
n1
表示有机基团,m、m+1个的base、m+1个的x、m+1个的r
10
、m+1个的r
p1
、l、y和z分别独立与上述同义]。
[0194]
式(a
‑
vii)中的l
n1
较好是c2‑6亚烷基,更好是亚乙基;式(a
‑
vii)中的m+1个的x
n1
较好是氧原子;式(a
‑
vii)中的m+1个的r
p1
较好是分别独立为以
‑
ch2ch2wg表示的基团;式(a
‑
vii)中的其他符号的说明如上所述,化合物(a
‑
vii)较好是以下述式(a
‑
vii)表示的化合物(下述式中的符号的定义和说明如上所述)。
[0195]
[化学式26]
[0196]
化合物(a
‑
vii)可通过本身公知的方法或基于其的方法制造。m为0、x
n1
为氧原子、l为琥珀酰基的化合物(a
‑
vii)例如可通过以下的工序制造:(i)使化合物z
‑
y
‑
h与琥珀酸酐缩合,制造z
‑
y
‑
co(ch2)2cooh;(ii)在缩合剂的存在下,使所得的z
‑
y
‑
co(ch2)2cooh与以式:ho
‑
l
n1
‑
oq”表示的化合物缩合后,脱保护,制造z
‑
y
‑
co(ch2)2co
‑
o
‑
l
n1
‑
oh,所述式中,q”表示临时保护基,l
n1
表示有机基团;(iii)使亚磷酰胺化的核苷与所得的z
‑
y
‑
co(ch2)2co
‑
o
‑
l
n1
‑
oh反应,制造m为0、x
n1
为氧原子、l为琥珀酰基的化合物(a
‑
vii),如上所述的缩合反应和脱保护反应对于本领域技术人员而言是周知的,本领域技术人员可适当设定条件进行。
[0197]
l不为琥珀酰基的化合物(a
‑
vii)也可通过使用对应的酸酐、对应的二羧酸卤化物、对应的二羧酸的活性酯等代替琥珀酸酐,进行同样的反应来制造。此外,x
n1
为nh的化合物(a
‑
vii)可通过使用3'位氨基被亚磷酰胺化的核苷,进行同样的反应来制造。此外,m为1以上的化合物(a
‑
vii)可通过使用m为0的化合物(a
‑
vii)作为起始原料反复进行伸长工艺来制造。
[0198]
本工序中使用的核苷、核苷酸或寡核苷酸(a)或者核苷酸或寡核苷酸(a1)较好是化合物(a
‑
i)、化合物(a
‑
vi)或化合物(a
‑
vii),更好是化合物(a
‑
i)、化合物(a
‑
vi)或化合物(a
‑
vii),进一步更好是化合物(a
‑
i)或化合物(a
‑
vi),又更好是化合物(a
‑
i),再进一步更好是化合物(a
‑
ii)或化合物(a
‑
iv),特别好是化合物(a
‑
iii)或化合物(a
‑
v)。
[0199]
本工序中使用的核苷、核苷酸或寡核苷酸(b)的5'位羟基被临时保护基保护。作为羟基的临时保护基,只要在酸性条件下可脱保护且能用作羟基的保护基则无特别限定,可列举例如:三苯甲基、9
‑
(9
‑
苯基)呫吨基、9
‑
苯基硫代呫吨基、1,1
‑
双(4
‑
甲氧基苯基)
‑1‑
苯基甲基(二甲氧基三苯甲基)等的双(c1‑6烷氧基)三苯甲基、1
‑
(4
‑
甲氧基苯基)
‑
1,1
‑
二苯基甲基(单甲氧基三苯甲基)等的单(c1‑
18
烷氧基)三苯甲基等。其中,从脱保护的容易性、获取的容易性的观点来看,羟基的临时保护基较好是单甲氧基三苯甲基或二甲氧基三苯甲基,更好是二甲氧基三苯甲基。
[0200]
核苷、核苷酸或寡核苷酸(b)可按照亚磷酰胺法、h
‑
膦酸酯法、二卤代膦法或氧氮磷杂环戊烷法的公知方法进行合成;关于亚磷酰胺法,可参照例如m.h.caruthers等,method in enzymology 1987,154,287
‑
313;s.l.beaucage和m.h.caruthers,tetrahedron letters 1981,22,1859
‑
1862;日本化学会编第5版实验化学讲座16有机化合物iv 2010年377~381页等进行实施;例如,亚磷酰胺法中使用的亚磷酰胺化试剂在市场上有售,可容易地获得。例如,通过在二氯甲烷等卤素类溶剂中,使具有3'位氨基的核苷、核苷酸或寡核苷酸(b)与2
‑
氰基乙基
‑
n,n
‑
二异丙基氯亚磷酰胺反应,可合成3'位氨基被亚磷酰胺化的核苷、核苷酸或寡核苷酸(b);关于h
‑
膦酸酯法,可参照例如b.f.froehler,《寡核苷酸及类似物的实验方案(protocols for oligonucleotides and analogs)》(第4章)1993年,63
‑
80页;日本化学会编第5版实验化学讲座16有机化合物iv 2010年381~384页等进行实施;关于二卤代膦法,可参照例如日本化学会编第4版实验化学讲座22金属络合物过渡金属簇1999年426~431页等进行实施;关于使用氧氮磷杂环戊烷法的修饰,可参照例如n.oka等,j.am.chem.soc.,2008年,130,16031
‑
16037页;n.oka等,organic letters.,2009年,vol.11,no.4,967
‑
970页;wo2011/08682等进行实施。
[0201]
作为核苷、核苷酸或寡核苷酸(b)的制造方法的一例,下文中对由具有3'位羟基的亚磷酰胺化的核苷、核苷酸或寡核苷酸(b)(以下有时简称为“化合物(b)”)制造3'位羟基被亚磷酰胺化的核苷、核苷酸或寡核苷酸(b)(以下有时简称为“被亚磷酰胺化的化合物(b)”)的方法进行说明。
[0202]
该制造方法包括下述反应:将3价磷上具有2个氮取代基的亚磷酰化(phosphitylation)剂前体单选择性地活化而形成亚磷酰化剂,使用该亚磷酰化剂,在碱的存在下,将化合物(b)的3'位羟基亚磷酰化。即,该制造方法是包括以下的工序(p1)和工序(p2)的被亚磷酰胺化的化合物(b)的制造方法。
[0203]
(p1)在溶剂中,使活化剂作用于以下述式(p1)表示的亚磷酰化剂前体,制备以下述式(p2)表示的亚磷酰化剂的工序。
[0204]
[化学式27]
[0205]
[化学式28]
[0206]
[式(p1)中,x
p1
表示氧原子或硫原子,r
p2
表示芳香环、羟基的保护基或巯基的保护基,r
p3
和r
p4
分别独立表示烷基,该烷基可与邻接的氮原子一起形成环];[式(p2)中,za表示来源于活化剂的基团,其他符号与上述同义];以及(p2)在溶剂中,在碱的存在下,使工序(p1)中得到的亚磷酰化剂作用于化合物(b),将化合物(b)的3'位羟基亚磷酰化的工序。
[0207]
工序(p1)式(p1)中,作为r
p2
的芳香环,可列举苯基、4
‑
硝基苯基、2,4
‑
二硝基苯基、五氟苯基、五氯苯基、2
‑
溴苯基、4
‑
溴苯基、2
‑
甲基苯基、2,6
‑
二甲基苯基等,较好是4
‑
硝基苯基。
[0208]
式(p1)中,作为r
p2
中的羟基的保护基或巯基的保护基,可列举例如:c1‑6烷基(例如,甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基、异戊基)、氰基化c1‑6烷基(例如,2
‑
氰基乙基、2
‑
氰基
‑
1,1
‑
二甲基乙基)、被取代甲硅烷基取代的乙基(例如,2
‑
甲基二苯基甲硅烷基乙基、2
‑
三甲基甲硅烷基乙基、2
‑
三苯基甲硅烷基乙基)、卤代c1‑6烷基(例如,2,2,2
‑
三氯乙基、2,2,2
‑
三溴乙基、2,2,2
‑
三氟乙基)、c2‑6烯基(例如,乙烯基、1
‑
丙烯基、2
‑
丙烯基、1
‑
甲基
‑2‑
丙烯基、1
‑
甲基
‑1‑
丙烯基)、c3‑6环烷基(例如,环丙基、环丁基、环戊基、环己基)、氰基化c1‑6烯基(例如,2
‑
氰基丁烯基)、c7‑
11
芳烷基(例如,苄基、α
‑
萘基甲基、β
‑
萘基甲基)、c6‑
10
芳基(例如,苯基、茚基、萘基),更好是氰基化c1‑6烷基,特别好是2
‑
氰基乙基。
[0209]
式(p1)中,r
p3
和r
p4
分别独立表示烷基,但该烷基可与邻接的氮原子一起形成环(例如吡咯烷)。r
p3
和r
p4
较好是均为异丙基。
[0210]
作为亚磷酰化剂前体,特别好是下述化合物,[化学式29]
[0211]
通过使活化剂作用于亚磷酰化剂前体,可获得亚磷酰化剂。活化剂为可取代亚磷酰胺上的胺并赋予与羟基等的反应性取代基的酸。具体是选自pka为5以上的弱酸性活化剂、更好是pka为5以上的唑类化合物及其c上取代体中的至少一种。作为唑类化合物,可列举四唑、三唑、咪唑等,作为c上取代体,可使用二氰基咪唑、双(三氟甲基)咪唑、二氯咪唑等被卤素原子二取代的化合物。特别好是二氰基咪唑和二氯咪唑。
[0212]
式(p2)中,za为来源于活化剂的基团,例如为从活化剂除去1个氢原子后的基团,使用二氰基咪唑作为活化剂的情况下,za为二氰基咪唑基,使用二氯咪唑作为活化剂的情况下,za为二氯咪唑基。
[0213]
本工序中使用的溶剂只要溶解亚磷酰化剂前体且对活化剂呈难溶性则无特别限定,通常不具有酸性或碱性的官能团。在此,“难溶性”以溶剂中的活化剂的浓度在6μm以下为基准。具体来说,可列举甲苯、苯、邻二甲苯、间二甲苯、对二甲苯、乙苯、戊烷、己烷、庚烷、辛烷、环戊烷、环己烷、二乙醚、二异丙醚、叔丁基甲基醚、环戊基甲基醚、四氯化碳等,较好是甲苯、环己烷,特别好是甲苯。
[0214]
本工序的反应温度和反应时间只要不析出底物和产物则无特别限定,分别通常为40℃以下,较好是0~30℃,更好是5~15℃,特别好是10℃左右,通常为0.5~24小时,较好是1~12小时,更好是1~6小时。
[0215]
活化剂与亚磷酰化剂前体的使用量只要亚磷酰化剂前体被活化即可,无特别限定,相对于亚磷酰化剂前体,活化剂通常过量,较好是以1.5~10摩尔当量使用。通过使过量的活化剂在溶剂中作用于亚磷酰化剂前体,在将亚磷酰化剂前体活化的同时,使亚磷酰化时作为副产物生成的二异丙胺形成与活化剂的盐而沉淀。因此,根据需要,可在工序(p1)与下述工序(p2)之间,实施分离沉淀等不溶物的工序,且较好是实施。
[0216]
工序(p2)本工序中,在溶剂中,在碱的存在下,使工序(p1)中得到的亚磷酰化剂作用于化合物(b),将化合物(b)的3'位羟基亚磷酰化,制造被亚磷酰胺化的化合物(b)。
[0217]
作为本工序中使用的溶剂,可使用与工序(p1)中使用的溶剂同样的溶剂(例如甲苯)。此外,作为本工序中使用的溶剂,可列举例如二氯甲烷、氯仿等。较好是甲苯与二氯甲烷的混合溶剂。
[0218]
本工序中使用的碱可选择具有足以中和由反应产生的酸(活化剂)的碱性、且不会引发磷酸上的脱氰基乙基、不形成p
‑
n键的碱。作为这样的碱,具体可使用pka为5~8的碱,较好是三甲基吡啶、n
‑
甲基吗啉、二乙基苯胺等。如果使用pka高于8的碱,则脱氰基化变得显著;如果使用pka低于5的碱,则伴随反应的进行再生的活化剂的捕获变得不充分,产生副产物。
[0219]
工序(p2)中,可添加亚磷酰化剂前体,也可不添加亚磷酰化剂前体,但较好是添加。
[0220]
作为核苷、核苷酸或寡核苷酸(b),可列举例如以下述式(b
‑
i)表示的化合物(即,核苷或寡核苷酸)。
[0221]
[化学式30]
[0222]
[式中,q表示0以上的整数,q+1个的base2分别独立表示可被选自
‑
l
‑
x
‑
z和用于核酸合成的保护基中的保护基保护的核酸碱基,q+1个的x、q+1个的r
p1
、q个的r
10
、l、x和z分别独立与上述同义,q+1个的x
n1
分别独立表示氧原子或nh,q”为在酸性条件下可除去的羟基的临时保护基,r
36
和r
37
分别独立表示烷基,或者表示与邻接的氮原子一起形成的五或六元的饱和环状氨基,所述饱和环状氨基除具有氮原子之外还可具有1个氧原子或硫原子作为成环原子]。
[0223]
r
36
和r
37
分别独立较好是c1‑
10
烷基,或者是与邻接的氮原子一起形成的五或六元的饱和环状氨基,更好是c1‑
10
烷基,进一步更好是c1‑6烷基。
[0224]
在酸性条件下可除去的羟基的临时保护基的说明如上所述。q”较好是单甲氧基三苯甲基或二甲氧基三苯甲基,更好是二甲氧基三苯甲基。
[0225]
式(b
‑
i)中的核酸碱基的氨基较好是被保护基保护。作为该保护基,可列举选自
‑
l
‑
x
‑
z和用于核酸合成的保护基中的保护基。l、x和z的说明如上所述。作为用于核酸合成的保护基,较好是乙酰基、苯氧乙酰基、4
‑
异丙基苯氧乙酰基、苯甲酰基、异丁酰基、(2
‑
己基)癸酰基、二甲基甲脒基、和=nc(r
11
)
‑
n(r
12
)(r
13
)基(式中,r
11
表示甲基,r
12
和r
13
分别独立表示c1‑5烷基,或者r
11
和r
12
可一起与它们结合的碳原子和氮原子共同形成五元或六元含氮烃环)。应予说明,作为所述=nc(r
11
)
‑
n(r
12
)(r
13
)基,可列举例如1
‑
(二甲基氨基)亚乙基。化合物(b
‑
i)有多个氨基的情况下,氨基的保护基可以是仅1种,也可以是2种以上。
[0226]
q为0的情况下,化合物(b
‑
i)为核苷;q为1以上的情况下,化合物(b
‑
i)为寡核苷酸。本工序中使用的化合物(b
‑
i)中,q较好是49以下,更好是29以下,进一步更好是19以下,特别好是4以下,最好是2以下。
[0227]
q+1个的x分别独立较好是氢原子、卤素原子、或可被保护的羟基,更好是氢原子或可被保护的羟基;base2分别独立较好是可被选自用于核酸合成的保护基中的保护基保护的核酸碱基;q+1个的r
p1
分别独立较好是以ch2ch2wg表示的基团;q+1个的x
n1
较好是氧原子;l、x和z的说明如上所述。
[0228]
化合物(b
‑
i)较好是以下述式(b
‑
i)表示的化合物,[化学式31]
[0229]
[式中,q+1个的base3分别独立表示可被用于核酸合成的保护基保护的核酸碱基,q、q+1个的x、q+1个的r
p1
、q个的r
10
、q”、r
36
和r
37
分别独立与上述同义]。
[0230]
式(b
‑
i)中,用于核酸合成的保护基、q、q+1个的x、q+1个的r
p1
、q个的r
10
、q”、r
36
和r
37
的说明如上所述。
[0231]
本工序中使用的核苷、核苷酸或寡核苷酸(a)或者核苷酸或寡核苷酸(a1)与核苷、核苷酸或寡核苷酸(b)的组合较好是化合物(a
‑
i)、化合物(a
‑
vi)或化合物(a
‑
vii)与化合物(b
‑
i)的组合,更好是化合物(a
‑
i)、化合物(a
‑
vi)或化合物(a
‑
vii)与化合物(b
‑
i)的组合,进一步更好是化合物(a
‑
i)或化合物(a
‑
vi)与化合物(b
‑
i)的组合,又更好是化合物(a
‑
i)与化合物(b
‑
i)的组合,再进一步更好是化合物(a
‑
ii)或化合物(a
‑
iv)与化合物(b
‑
i)的组合,特别好是化合物(a
‑
iii)或化合物(a
‑
v)与化合物(b
‑
i)的组合。
[0232]
本工序的缩合反应进行较慢的情况下,可添加缩合剂,例如三氟乙酸吡啶盐、四唑、5
‑
苄硫基
‑
1h
‑
四唑、4,5
‑
二氰基咪唑等。
[0233]
液相法的情况下,本工序在非极性溶剂中进行。作为非极性溶剂,可列举例如:氯仿、二氯甲烷、1,2
‑
二氯乙烷等卤素类溶剂;苯、甲苯、二甲苯、均三甲苯等芳香族类溶剂;乙
酸乙酯、乙酸异丙酯等酯类溶剂;己烷、戊烷、庚烷、辛烷、壬烷、环己烷等脂肪族类溶剂;二乙醚、环戊基甲基醚、叔丁基甲基醚等非极性醚类溶剂。非极性溶剂可仅使用1种,也可将2种以上并用。作为非极性溶剂,较好是卤素类溶剂、芳香族类溶剂、酯类溶剂、脂肪族类溶剂、及它们的组合,更好是二氯甲烷、氯仿、1,2
‑
二氯乙烷、苯、甲苯、二甲苯、均三甲苯、己烷、戊烷、庚烷、壬烷、环己烷、乙酸乙酯、乙酸异丙酯及它们的组合,进一步更好是氯仿、二氯甲烷、甲苯、及它们的组合。本工序以后的工序中所用的非极性溶剂也同样。
[0234]
液相法的情况下,相对于本工序中的核苷、核苷酸或寡核苷酸(a)或者核苷酸或寡核苷酸(a1)的使用量1摩尔,本工序中的核苷、核苷酸或寡核苷酸(b)的使用量例如为1~10摩尔,较好是1~5摩尔;固相法的情况下,相对于本工序中的核苷、核苷酸或寡核苷酸(a)的使用量1摩尔,本工序中的核苷、核苷酸或寡核苷酸(b)的使用量例如为1~20摩尔,较好是1~10摩尔。
[0235]
关于本工序中的反应温度,只要反应能进行即可,无特别限定,液相法的情况下,较好是0℃~100℃,更好是20℃~50℃,固相法的情况下,较好是10℃~40℃,更好是20℃~30℃。反应时间根据使用的原料的种类、反应温度等而不同,液相法的情况下,例如为5分钟~24小时,固相法的情况下,例如为1分钟~30分钟。
[0236]
(3'位羟基或3'位氨基通过选自亚磷酰胺法、h
‑
膦酸酯法、二卤代膦法和氧氮磷杂环戊烷法中的方法被修饰的核苷、核苷酸或寡核苷酸(b)的淬灭)本发明中,在工序(1)(缩合)之后,进行工序(2)((2
‑
1)(硫化)或(2
‑
2)(氧化))和工序(3)(脱保护)。因此,液相法的情况下,为了抑制工序(2)和(3)时的副产物的生成,较好是在工序(2)之前,对核苷、核苷酸或寡核苷酸(b)进行淬灭。因此,本发明的制造方法较好是包括向缩合后的反应液中添加淬灭剂的工序。
[0237]
寡核苷酸制法的领域中,可将作为3'位羟基或3'位氨基通过选自亚磷酰胺法、h
‑
膦酸酯法、二卤代膦法和氧氮磷杂环戊烷法中的方法被修饰的核苷或寡核苷酸(b)的淬灭剂公知的试剂用作本工序中的淬灭剂。淬灭剂可仅使用1种,也可将2种以上并用。作为淬灭剂,可列举例如醇类、酚类和胺类。
[0238]
作为可用作淬灭剂的醇类,可列举例如甲醇、2
‑
丙醇、叔丁醇、2,2,2
‑
三氟乙醇、四氢糠醇、糠醇、2,3
‑
o
‑
异亚丙基
‑
d
‑
呋喃核糖、3'
‑
o
‑
三异丙基甲硅烷基胸苷等可卤代的一元醇,乙二醇、二乙二醇等可卤代的多元醇。
[0239]
作为可用作淬灭剂的酚类,可列举例如4
‑
硝基苯酚和五氟苯酚。作为可用作淬灭剂的胺类,可列举例如吗啉。
[0240]
淬灭剂较好是选自醇类和胺类中的至少一种,更好是选自甲醇、2
‑
丙醇、叔丁醇、2,2,2
‑
三氟乙醇、四氢糠醇和吗啉中的至少一种。工序(3)(脱保护)的脱保护时,为了防止寡核苷酸(e)的核酸碱基中的氨基的保护基的脱落,淬灭剂进一步更好是选自2
‑
丙醇、叔丁醇和2,2,2
‑
三氟乙醇中的至少一种。
[0241]
相对于工序(1)中的核苷、核苷酸或寡核苷酸(b)的使用量1摩尔,本工序中的淬灭剂的使用量较好是1~20摩尔,更好是1~10摩尔,进一步更好是1~5摩尔。
[0242]
添加淬灭剂后的反应液的温度只要可淬灭核苷、核苷酸或寡核苷酸(b)即可,无特别限定,较好是5℃~40℃,更好是15℃~30℃。添加淬灭剂后的反应液的搅拌时间根据使用的淬灭剂的种类、温度等而不同,例如为10分钟~3小时。
[0243]
工序(2):(2
‑
1)(硫化)本工序是如下的工序:通过使硫化剂与5'位羟基被在酸性条件下可除去的临时保护基保护的亚磷酸酯体或亚磷酸二酯(c)反应,使其亚磷酸酯键或亚磷酸二酯键转化为硫代磷酸酯键,获得5'位羟基被在酸性条件下可除去的临时保护基保护的具有硫代磷酸酯化部位的寡核苷酸(d)。硫化剂可仅使用其1种,也可将2种以上并用。
[0244]
作为本工序中使用的硫化剂,只要具有可将亚磷酸酯键或亚磷酸二酯键转化为硫代磷酸酯键的能力即可,无特别限定,较好是5
‑
[(n,n
‑
二甲基氨基亚甲基)氨基]
‑
3h
‑
1,2,4
‑
二噻唑
‑3‑
硫酮(ddtt)、3h
‑
1,2
‑
苯并二硫醇
‑3‑
酮
‑
1,1
‑
二氧化物(beaucage试剂)、3h
‑
1,2
‑
苯并二硫醇
‑3‑
酮、苯乙酰二硫化物(pads)、二硫化四乙基秋兰姆(tetd)、四硫化双五亚甲基秋兰姆、5
‑
苯基
‑
3h
‑
1,2,4
‑
二噻唑
‑3‑
酮(pos)、3
‑
氨基
‑
1,2,4
‑
二噻唑
‑5‑
硫酮(adtt,氢化黄原素)、硫。
[0245]
从可进行良好的反应的观点来看,更好是5
‑
[(n,n
‑
二甲基氨基亚甲基)氨基]
‑
3h
‑
1,2,4
‑
二噻唑
‑3‑
硫酮(ddtt)、3h
‑
1,2
‑
苯并二硫醇
‑3‑
酮
‑
1,1
‑
二氧化物(beaucage试剂)、3h
‑
1,2
‑
苯并二硫醇
‑3‑
酮、苯乙酰二硫化物(pads)、5
‑
苯基
‑
3h
‑
1,2,4
‑
二噻唑
‑3‑
酮(pos),进一步更好是5
‑
[(n,n
‑
二甲基氨基亚甲基)氨基]
‑
3h
‑
1,2,4
‑
二噻唑
‑3‑
硫酮(ddtt)、3h
‑
1,2
‑
苯并二硫醇
‑3‑
酮
‑
1,1
‑
二氧化物(beaucage试剂)、5
‑
苯基
‑
3h
‑
1,2,4
‑
二噻唑
‑3‑
酮(pos),特别好是5
‑
[(n,n
‑
二甲基氨基亚甲基)氨基]
‑
3h
‑
1,2,4
‑
二噻唑
‑3‑
硫酮(ddtt)、5
‑
苯基
‑
3h
‑
1,2,4
‑
二噻唑
‑3‑
酮(pos)。所述硫化剂可用合适的溶剂稀释至0.05~2m的浓度后使用。作为所述稀释溶剂,只要是对反应惰性的溶剂即可,无特别限定,可列举例如二氯甲烷、乙腈、吡啶或它们的任意的混合溶剂。
[0246]
相对于亚磷酸酯体或亚磷酸二酯(c)1摩尔,液相法的情况下,硫化剂的使用量例如为1~50摩尔,较好是1~10摩尔,固相法的情况下,硫化剂的使用量例如为1~100摩尔,较好是1~20摩尔。
[0247]
关于反应温度,只要反应能进行即可,无特别限定,液相法的情况下,较好是0℃~100℃,更好是20℃~50℃,固相法的情况下,较好是10℃~40℃,更好是20℃~30℃。反应时间根据亚磷酸酯体或亚磷酸二酯(c)的种类、使用的硫化剂的种类、反应温度等而不同,液相法的情况下,例如为1分钟~3小时,固相法的情况下,例如为1分钟~30分钟。
[0248]
工序(2):(2
‑
2)(氧化)本工序是如下的工序:通过使氧化剂与5'位羟基被在酸性条件下可除去的临时保护基保护的亚磷酸酯体或亚磷酸二酯(c)反应,使其亚磷酸酯键或亚磷酸二酯键转化为磷酸酯(包括磷酸二酯和磷酸三酯)键,获得5'位羟基被在酸性条件下可除去的临时保护基保护的具有磷酸酯化部位的寡核苷酸(d
‑
2)。氧化剂可仅使用其1种,也可将2种以上并用。
[0249]
作为本工序中使用的氧化剂,只要具有可将亚磷酸酯键或亚磷酸二酯键转化为磷酸酯键的能力即可,无特别限定,从良好地进行反应的观点来看,较好是碘。
[0250]
所述氧化剂可用合适的溶剂稀释后使用。作为所述稀释溶剂,只要是对反应惰性的溶剂即可,无特别限定,可列举例如吡啶、水或它们的任意的混合溶剂,较好是吡啶与水的混合溶剂。相对于1摩尔氧化剂,吡啶为3~10摩尔,较好是4~6摩尔;相对于1摩尔氧化剂,水为1~5摩尔,较好是2~4摩尔。
[0251]
相对于亚磷酸酯体或亚磷酸二酯(c)1摩尔,液相法的情况下,氧化剂的使用量例
如为1~50摩尔,较好是1~10摩尔,固相法的情况下,氧化剂的使用量例如为1~100摩尔,较好是1~20摩尔。
[0252]
关于反应温度而言,只要反应能进行即可,无特别限定,液相法的情况下,较好是0℃~100℃,更好是20℃~50℃,固相法的情况下,较好是10℃~40℃,更好是20℃~30℃。关于反应时间而言,根据亚磷酸酯体或亚磷酸二酯(c)的种类、使用的氧化剂的种类、反应温度等而不同,液相法的情况下,例如为1分钟~3小时,固相法的情况下,例如为1分钟~30分钟。
[0253]
工序(3):(3
‑
1)(具有硫代磷酸酯化部位的寡核苷酸的临时保护基的脱保护)、或(3
‑
2)(具有磷酸酯化部位的寡核苷酸的临时保护基的脱保护)本工序是如下的工序:通过酸除去具有硫代磷酸酯化部位的寡核苷酸(d
‑
1)的临时保护基,获得5'位羟基未被保护的具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)粗产物。此外,本工序还是如下的工序:通过酸除去具有磷酸酯化部位的寡核苷酸(d
‑
2)的临时保护基,获得5'位羟基未被保护的具有磷酸酯化部位的寡核苷酸(e
‑
2)粗产物。酸可仅使用其1种,也可将2种以上并用。
[0254]
作为本工序中使用的酸,只要可实现良好的脱保护即可,无特别限定,可列举三氟乙酸、二氯乙酸、三氯乙酸、乙酸等羧酸,三氟甲磺酸、甲磺酸、对甲苯磺酸等磺酸,膦酸,磷酸等,从本发明是用于解决脱保护工序中脱保护后的5'位羟基被酰基化的问题的发明这一观点来看,较好是至少包含可将羟基酰基化的羧酸,更好是至少包含三氟乙酸、二氯乙酸或三氯乙酸。这些酸可用所述非极性溶剂稀释。此外,使用所述酸时,可组合特定的碱,适当调节酸性度来使用。相对于1摩尔具有硫代磷酸酯化部位的寡核苷酸(d
‑
1)或1摩尔具有磷酸酯化部位的寡核苷酸(d
‑
2),液相法的情况下,本工序中的酸的使用量例如为1~100摩尔,较好是1~40摩尔,固相法的情况下,本工序中的酸的使用量例如为1~200摩尔,较好是1~80摩尔。
[0255]
关于本工序的反应温度,只要反应能进行即可,无特别限定,液相法的情况下,较好是
‑
10℃~50℃,更好是0℃~40℃,固相法的情况下,较好是10℃~50℃,更好是20℃~30℃。反应时间根据使用的具有硫代磷酸酯化部位的寡核苷酸(d
‑
1)或具有磷酸酯化部位的寡核苷酸(d
‑
2)的种类、酸的种类和非极性溶剂的种类、反应温度等而不同,液相法的情况下,例如为5分钟~5小时,固相法的情况下,例如为1分钟~30分钟。
[0256]
本工序中,较好是在具有硫代磷酸酯化部位的寡核苷酸(d
‑
1)或具有磷酸酯化部位的寡核苷酸(d
‑
2)的5'位羟基的临时保护基的除去反应中,或者除去反应后,使用阳离子捕获剂。即,较好是在阳离子捕获剂的存在下进行临时保护基的除去反应,或者在临时保护基的除去反应后,向反应体系中添加阳离子捕获剂。阳离子捕获剂可仅使用1种,也可将2种以上并用。
[0257]
作为阳离子捕获剂,只要不发生基于被除去的临时保护基的再保护(返回至原料)和对于被脱保护的官能团的副反应即可,无特别限定,可使用吡咯、2
‑
甲基吡咯、3
‑
甲基吡咯、2,3
‑
二甲基吡咯、2,4
‑
二甲基吡咯等吡咯衍生物;吲哚、3
‑
甲基吲哚、4
‑
甲基吲哚、5
‑
甲基吲哚、6
‑
甲基吲哚、7
‑
甲基吲哚、5,6
‑
二甲基吲哚、6,7
‑
二甲基吲哚等吲哚衍生物;2
‑
甲基呋喃、2,3
‑
二甲基呋喃、2
‑
甲基
‑3‑
(甲硫基)呋喃、薄荷呋喃等呋喃衍生物。从可获得良好的阳离子捕获效果的观点来看,较好是吡咯、2
‑
甲基吡咯、3
‑
甲基吡咯、2,3
‑
二甲基吡咯、2,4
‑
二甲基吡咯、吲哚、3
‑
甲基吲哚、4
‑
甲基吲哚、5
‑
甲基吲哚、6
‑
甲基吲哚、7
‑
甲基吲哚、5,6
‑
二甲基吲哚、6,7
‑
二甲基吲哚、2
‑
甲基呋喃、2,3
‑
二甲基呋喃、2
‑
甲基
‑3‑
(甲硫基)呋喃、薄荷呋喃,更好是吡咯、3
‑
甲基吡咯、2,4
‑
二甲基吡咯、吲哚、4
‑
甲基吲哚、5
‑
甲基吲哚、6
‑
甲基吲哚、7
‑
甲基吲哚、5,6
‑
二甲基吲哚、6,7
‑
二甲基吲哚,进一步更好是吡咯、3
‑
甲基吡咯、吲哚,再进一步更好是吡咯、吲哚,特别好是吡咯。相对于1摩尔具有硫代磷酸酯化部位的寡核苷酸(d
‑
1)或1摩尔具有磷酸酯化部位的寡核苷酸(d
‑
2),液相法的情况下,本工序中的阳离子捕获剂的使用量例如为1~50摩尔,较好是5~20摩尔。
[0258]
(中和)在液相法的情况下,工序(3)(脱保护)之后,为了中和工序(3)中使用的酸,可向反应体系中添加碱。但是,本发明的制造方法中,工序(4)之后,可根据需要通过进行固液分离或萃取以及清洗,将工序(3)中使用的酸从具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)粗产物或具有磷酸酯化部位的寡核苷酸(e
‑
2)除去。因此,中和工序并非必需。
[0259]
本工序中,碱可仅使用1种,也可将2种以上并用。作为使用的碱,较好是有机碱。作为有机碱,较好是吡啶、2,4,6
‑
三甲基吡啶、苯并咪唑、1,2,4
‑
三唑、n
‑
苯基咪唑、2
‑
氨基
‑
4,6
‑
二甲基嘧啶、1,10
‑
菲咯啉、咪唑、n
‑
甲基咪唑、2
‑
氯苯并咪唑、2
‑
溴苯并咪唑、2
‑
甲基咪唑、2
‑
苯基苯并咪唑、n
‑
苯基苯并咪唑、5
‑
硝基苯并咪唑,更好是吡啶、2,4,6
‑
三甲基吡啶、苯并咪唑、1,2,4
‑
三唑、n
‑
苯基咪唑、n
‑
甲基咪唑、2
‑
氨基
‑
4,6
‑
二甲基嘧啶、1,10
‑
菲咯啉,进一步更好是吡啶、2,4,6
‑
三甲基吡啶、苯并咪唑、1,2,4
‑
三唑、n
‑
苯基咪唑,特别好是吡啶、2,4,6
‑
三甲基吡啶、苯并咪唑、1,2,4
‑
三唑,最好是吡啶、2,4,6
‑
三甲基吡啶、苯并咪唑。
[0260]
相对于工序(3)中的酸的使用量1摩尔,本工序中的碱的使用量例如为1~10摩尔,较好是1~3摩尔。
[0261]
工序(4):(4
‑
1)(具有硫代磷酸酯化部位的寡核苷酸的溶剂分解)、或(4
‑
2)(具有磷酸酯化部位的寡核苷酸的溶剂分解)本工序是如下的工序:对具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)粗产物中所含的5'位羟基被酰基化的具有硫代磷酸酯化部位的寡核苷酸进行溶剂分解而脱酰基化。此外,本工序还是如下的工序:对具有磷酸酯化部位的寡核苷酸(e
‑
2)粗产物中所含的5'位羟基被酰基化的具有磷酸酯化部位的寡核苷酸进行溶剂分解而脱酰基化;本工序中的“酰基化”是指前面的工序(3
‑
1)或(3
‑
2)中为了除去5'位羟基的临时保护基而添加的酸与5'位羟基反应,其结果是,在酸为羧酸的情况下,r
‑
c(=o)
‑
与5'位的氧原子结合,在酸为磺酸的情况下,r
‑
s(=o)2‑
与5'位的氧原子结合,在酸为膦酸的情况下,h
‑
p(=o)(oh)
‑
与5'位的氧原子结合,在酸为磷酸的情况下,h
‑
p(=o)2‑
与5'位的氧原子结合。另一方面,本工序中的“脱酰基化”是指本工序中生成的酰基化物通过溶剂分解而变成5'位羟基;本工序较好是在不会使与硫代磷酸酯化部位或磷酸酯化部位的氧原子或硫原子结合的氰基烷基(例如氰基乙基)、烷氧基羰基烷基(例如乙氧羰基乙基)、卤代苯基(例如2
‑
氯苯基)等脱落的弱酸性至弱碱性条件下进行。特别是在对碱性不稳定的氰基烷基(例如氰基乙基)的情况下,理想的是使氰基烷基(例如氰基乙基)不会脱落,并且必须选择对乙酰基和苯甲酰基等的碱基上的侧链保护基的脱落情况给予关注而使用的碱或亲核物质、以及根据需要必须选择碱(非亲核性碱)的碱性度和亲核物质的pka。
[0262]
作为本工序中使用的溶剂,只要可使5'位羟基被酰基化的具有硫代磷酸酯化部位的寡核苷酸脱酰基化即可,无特别限定。此外,作为本工序中使用的溶剂,只要可使5'位羟基被酰基化的具有磷酸酯化部位的寡核苷酸脱酰基化即可,无特别限定。较好是碱与亲核物质的混合物。碱也可在承载于固相载体的状态下使用。作为碱,较好是有机碱,可列举例如叔胺(例如n,n
‑
二甲基氨基乙腈、n,n
‑
二乙基氨基乙腈、n,n
‑
二异丙基氨基乙腈、1
‑
吡咯烷乙腈、1
‑
哌啶乙腈、n,n
‑
二甲基苯胺)、叔胺与酸性抗衡物质(counter)的中和盐(例如三乙胺盐酸盐)、用酸调节了碱性度的叔胺(例如二异丙基乙基胺:甲酸=5:3的混合物)等非亲核性碱、具有氮原子的杂环化合物(例如吡啶、三甲基吡啶、二甲基吡啶、甲基吡啶等吡啶衍生物,n
‑
甲基咪唑等咪唑类化合物)等,较好是吡啶衍生物。作为亲核物质,较好是水和醇衍生物,可列举例如水、甲醇、乙醇、异丙醇、丁醇、苄醇、四氢糠醇等,较好是水、甲醇。作为碱与亲核物质的混合物,较好是选自非亲核性碱和吡啶衍生物中的至少一种碱与选自水和醇衍生物中的至少一种亲核物质的混合物,更好是选自吡啶、三甲基吡啶、二甲基吡啶和甲基吡啶中的至少一种碱与选自水、甲醇、乙醇、异丙醇、丁醇、苄醇和四氢糠醇中的至少一种亲核物质的混合物,进一步更好是吡啶与水的混合物、吡啶与甲醇的混合物、吡啶与乙醇的混合物、三甲基吡啶与水的混合物、三甲基吡啶与甲醇的混合物、三甲基吡啶与乙醇的混合物、二甲基吡啶与水的混合物、二甲基吡啶与甲醇的混合物、二甲基吡啶与乙醇的混合物,特别好是吡啶与水的混合物、吡啶与甲醇的混合物、吡啶与乙醇的混合物。
[0263]
本发明的一个实施方式中,从抑制氰基乙基或核酸碱基侧链保护基的脱落的观点来看,非亲核性碱的pka较好是3~10,更好是4~9,进一步更好是4~7。本发明的另一个实施方式中,亲核物质至少包括水的情况下,也可用无机盐(例如,碳酸钠水溶液、碳酸氢钠水溶液、缓冲溶液等)对其碱性(ph)进行调节。例如,对于第一个残基的脱三苯甲基化后的溶剂分解,由于还未连接有氰基乙基,因此可使用较强的碱性条件。此外,因为如果不先使脱dmtr化中使用的tfa中和,则无法呈现碱性,所以也可最初用较强的碱中和后,用较弱的碱进行调节。其ph较好是3.0~8.0,更好是4.0~7.0,进一步更好是4.5~6.0。
[0264]
本工序中的碱的使用量根据使用的碱的种类而不同,液相法的情况下,脱保护工序后,不经纯化以一锅(one
‑
pot)实施本工序时,以及固相法的情况下,脱保护中使用的酸残留于反应液中,因此需要更多的碱。由此,液相法(一锅法)和固相法中,相对于使用的酸的量,需要1~10当量、较好是3~5当量的碱。另一方面,除上述固相法以外和除液相法(一锅法)以外的情况下,相对于1摩尔具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)粗产物或1摩尔具有磷酸酯化部位的寡核苷酸(e
‑
2)粗产物,需要1~5摩尔,较好是1~3摩尔;本工序的反应温度只要反应能进行即可,无特别限定,液相法的情况下,较好是0℃~50℃,更好是5℃~30℃,固相法的情况下,较好是5℃~40℃,更好是10℃~30℃。反应时间根据使用的具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)粗产物或具有磷酸酯化部位的寡核苷酸(e
‑
2)粗产物及溶剂的种类、反应温度等而不同,液相法的情况下,例如为10分钟~24小时,固相法的情况下,例如为1分钟~30分钟。
[0265]
(固液分离或萃取)本发明的制造方法可包括如下的工序:液相法的情况下,向包含工序(4
‑
1)中得到的具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)或工序(4
‑
2)中得到的具有磷酸酯化部位的寡核苷酸(e
‑
2)的反应液中添加极性溶剂,使具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)或具有
磷酸酯化部位的寡核苷酸(e
‑
2)沉淀来进行纯化(固液分离)的工序;或者向反应液中添加极性溶剂,使在极性溶剂
‑
非极性溶剂间分层,使具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)或具有磷酸酯化部位的寡核苷酸(e
‑
2)移动至非极性溶剂层来进行纯化(萃取)的工序。固液分离和萃取中的任一种的情况下,极性溶剂可仅使用1种,也可将2种以上并用。
[0266]
首先,从固液分离开始进行说明。作为固液分离中使用的极性溶剂,可列举例如甲醇、乙醇、异丙醇等醇类溶剂;乙腈、丙腈等腈类溶剂;丙酮、2
‑
丁酮等酮类溶剂;1,4
‑
二噁烷、四氢呋喃等极性醚类溶剂;二甲基甲酰胺、二甲基乙酰胺、n
‑
甲基哌啶酮等酰胺类溶剂;二甲亚砜等亚砜类溶剂;水等,以及它们的混合溶剂。其中,较好是腈类溶剂,更好是乙腈。
[0267]
为了提高具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)或具有磷酸酯化部位的寡核苷酸(e
‑
2)的回收率,相对于反应液中所含的非极性溶剂1ml,固液分离中的极性溶剂的添加量较好是1~20ml,更好是1~10ml,进一步更好是1~5ml。
[0268]
为了使具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)或具有磷酸酯化部位的寡核苷酸(e
‑
2)在极性溶剂中的损失达到最低限度,极性溶剂可包含水。该情况下,极性溶剂中的水含量较好是1~10%(v/v),更好是3~8%(v/v)。水含量过低时,则具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)或具有磷酸酯化部位的寡核苷酸(e
‑
2)在极性溶剂中的损失可能会增加;水含量过高时,存在杂质向极性溶剂中的除去不充分的倾向。
[0269]
为了提高具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)或具有磷酸酯化部位的寡核苷酸(e
‑
2)的回收率,可使用如wo2016/117663中所记载的沉淀促进剂(例如3,4,5
‑
三(十八烷氧基)苄基
‑
2,2
‑
二甲基丙酸酯)。
[0270]
接着,对萃取进行说明。萃取的操作无特别限定,较好是如下进行:向包含具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)或具有磷酸酯化部位的寡核苷酸(e
‑
2)的反应液中添加极性溶剂,使在极性溶剂
‑
非极性溶剂间分层,使具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)或具有磷酸酯化部位的寡核苷酸(e
‑
2)移动至非极性溶剂层。通过该萃取,可使残余的原料、副产物等杂质移动至极性溶剂层,将其除去。
[0271]
作为萃取中使用的极性溶剂,可列举例如甲醇、乙醇、异丙醇等醇类溶剂,乙腈、丙腈等腈类溶剂,丙酮、2
‑
丁酮等酮类溶剂,1,4
‑
二噁烷、四氢呋喃等极性醚类溶剂,n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、n
‑
甲基哌啶酮等酰胺类溶剂,二甲亚砜等亚砜类溶剂,水等,以及它们中的2种以上的混合溶剂。其中,较好是酰胺类溶剂、腈类溶剂、以及它们的组合,更好是使用乙腈、n,n
‑
二甲基甲酰胺、n
‑
甲基哌啶酮、以及它们的组合。其中,较好是腈类溶剂,更好是乙腈。
[0272]
为了使与非极性溶剂的分层性提高,萃取中使用的极性溶剂可包含水。该情况下,极性溶剂中的水含量较好是1~10%(v/v),更好是3~8%(v/v)。水含量过低时,分层性可能并不会提高太多;水含量过高时,杂质在极性溶剂中的溶解度下降,存在其除去效率降低的倾向。
[0273]
为了萃取,可根据需要与极性溶剂一起将非极性溶剂添加至反应液中。非极性溶剂可仅使用1种,也可将2种以上并用。作为根据需要添加的非极性溶剂,可列举氯仿、二氯甲烷、1,2
‑
二氯乙烷等卤素类溶剂;苯、甲苯、二甲苯、均三甲苯等芳香族类溶剂;乙酸乙酯、乙酸异丙酯等酯类溶剂;己烷、戊烷、庚烷、辛烷、壬烷、环己烷等脂肪族类溶剂;二乙醚、环戊基甲基醚、叔丁基甲基醚等非极性醚类溶剂。其中,较好是芳香族类溶剂、脂肪族类溶剂、
或它们的组合,较好是苯、甲苯、己烷、戊烷、庚烷、壬烷、环己烷或者它们的组合等,更好是甲苯、庚烷、壬烷或者它们的组合等,进一步更好是甲苯、庚烷或者它们的组合,特别好是庚烷。
[0274]
在极性溶剂
‑
非极性溶剂间分层后,通过除去极性溶剂层的操作,可除去杂质。通过向除去极性溶剂层后的非极性溶剂层中进而添加极性溶剂,搅拌、分层后,进行除去极性溶剂的操作,可进一步减少杂质的量。
[0275]
相对于1ml非极性溶剂,用于1次萃取操作的极性溶剂的量较好是0.1~10ml,更好是0.2~5ml,进一步更好是0.2~1ml。
[0276]
通过对所得的非极性溶剂层进行浓缩,可分离具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)或具有磷酸酯化部位的寡核苷酸(e
‑
2)。
[0277]
(脱保护和分离)关于本发明的制造方法,液相法的情况下,可在固液分离或萃取之后包括如下的工序:将所得的具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)或具有磷酸酯化部位的寡核苷酸(e
‑
2)的保护基全部除去后,分离未被保护的具有硫代磷酸酯化部位的寡核苷酸或未被保护的具有磷酸酯化部位的寡核苷酸。作为脱保护的方法,可按照例如《有机合成中的保护基(protective groups in organic synthesis)》、第3版、约翰威立父子出版公司(john willy&sons)出版(1999年)等中所记载的脱保护方法,进行除去寡核苷酸的全部保护基的工序。具体来说,拟固相保护基以及作为核酸碱基的保护基的苯氧乙酰基、乙酰基等、保护磷酸骨架的氰基乙基等可通过用氨水、氨水/乙醇溶液、或者氨水与甲胺水溶液的混合液进行处理来全部除去。此外,5'羟基的保护基可通过用工序(3)中使用的酸或将其适当稀释后的溶液进行处理来除去。未被保护(即不具有保护基)的寡核苷酸容易被酶分解,因此较好是在空气洁净度管理下,分离未被保护的寡核苷酸。
[0278]
此外,关于本发明的制造方法,固相法的情况下,还可在工序(4)之后包括如下的工序:将固相用溶剂清洗,将所得的具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)或具有磷酸酯化部位的寡核苷酸(e
‑
2)从固相切离(切割),将其保护基全部除去,分离未被保护的具有硫代磷酸酯化部位的寡核苷酸或未被保护的具有磷酸酯化部位的寡核苷酸。清洗和从固相的切离可使用该领域中公知的方法进行。此外,关于脱保护,可与上述的液相法的情况同样地进行。
[0279]
液相法的情况下,上述各工序中的反应进程的确认,均可适用与一般的液相有机合成反应同样的方法。即,可使用薄层硅胶层析、高效液相色谱等来追踪反应。
[0280]
5'
‑
3'合成作为5'
‑
3'合成的本发明的制造方法包括以下的工序:向具有硫代磷酸酯(ps)、磷酸酯(po)或h
‑
膦酸酯部位的保护寡核苷酸中添加酸而除去3'位羟基或3'位氨基的临时保护基后,对3'位羟基或3'位氨基被酰基化的副产物进行溶剂分解而脱酰基化。该制造方法通过以下的工序(3'):脱保护和工序(4'):溶剂分解来进行说明。
[0281]
作为5'
‑
3'合成的本发明的制造方法还包括以下的工序(1')~(4'):(1')使核苷、核苷酸或寡核苷酸(a')与核苷、核苷酸或寡核苷酸(b')缩合,得到亚磷酸酯体或亚磷酸二酯(c')的工序,所述核苷、核苷酸或寡核苷酸(a')中,3'位羟基或3'位氨基未被保护,且其他基团
可被用于核酸合成的保护基保护、或可结合于固相载体,所述核苷、核苷酸或寡核苷酸(b')中,5'位羟基通过选自亚磷酰胺法、h
‑
膦酸酯法、二卤代膦法和氧氮磷杂环戊烷法中的方法被修饰,3'位羟基或3'位氨基被在酸性条件下可除去的临时保护基保护,且其他基团可被用于核酸合成的保护基保护,所述亚磷酸酯体或亚磷酸二酯(c')中,3'位羟基或3'位氨基被在酸性条件下可除去的临时保护基保护;(2'):(2'
‑
1)向亚磷酸酯体或亚磷酸二酯(c')中添加硫化剂而进行硫化,得到3'位羟基或3'位氨基被在酸性条件下可除去的临时保护基保护的具有硫代磷酸酯化部位的寡核苷酸(d'
‑
1)的工序,或者(2'
‑
2)向亚磷酸酯体或亚磷酸二酯(c')中添加氧化剂而进行氧化,得到3'位羟基或3'位氨基被在酸性条件下可除去的临时保护基保护的具有磷酸酯化部位的寡核苷酸(d'
‑
2)的工序;(3'):(3'
‑
1)向具有硫代磷酸酯化部位的寡核苷酸(d'
‑
1)中添加酸而除去3'位羟基或3'位氨基的临时保护基,得到3'位羟基或3'位氨基未被保护的具有硫代磷酸酯化部位的寡核苷酸(e'
‑
1)粗产物的工序,或者(3'
‑
2)向具有磷酸酯化部位的寡核苷酸(d'
‑
2)中添加酸而除去3'位羟基或3'位氨基的临时保护基,得到3'位羟基或3'位氨基未被保护的具有磷酸酯化部位的寡核苷酸(e'
‑
2)粗产物的工序;以及(4'):(4'
‑
1)对具有硫代磷酸酯化部位的寡核苷酸(e'
‑
1)粗产物中所含的3'位羟基或3'位氨基被酰基化的具有硫代磷酸酯化部位的寡核苷酸进行溶剂分解而脱酰基化的工序,或者(4'
‑
2)对具有磷酸酯化部位的寡核苷酸(e'
‑
2)粗产物中所含的3'位羟基或3'位氨基被酰基化的寡核苷酸进行溶剂分解而脱酰基化的工序。
[0282]
通过重复工序(1')~(4')的循环,可使寡核苷酸链延伸。
[0283]
关于作为5'
‑
3'合成的本发明的制造方法的说明,除了使用“3'位羟基或3'位氨基未被保护、且其他基团可被用于核酸合成的保护基保护、或可结合于固相载体的核苷、核苷酸或寡核苷酸(a')”和“5'位羟基通过选自亚磷酰胺法、h
‑
膦酸酯法、二卤代膦法和氧氮磷杂环戊烷法中的方法被修饰、3'位羟基或3'位氨基被在酸性条件下可除去的临时保护基保护、且其他基团可被用于核酸合成的保护基保护的核苷、核苷酸或寡核苷酸(b')”来制造“3'位羟基或3'位氨基未被保护的具有硫代磷酸酯化部位的寡核苷酸(e'
‑
1)或具有磷酸酯化部位的寡核苷酸(e'
‑
2)”以外,与上述的作为3'
‑
5'合成的本发明的制造方法的说明基本相同。换言之,除了3'位羟基或3'位氨基以及5'位羟基的保护等形态互换以外,工序(1')~(4')、“核苷、核苷酸或寡核苷酸(a')”、“核苷、核苷酸或寡核苷酸(b')”、“亚磷酸酯体或亚磷酸二酯(c')”、具有硫代磷酸酯化部位的寡核苷酸(d'
‑
1)或具有磷酸酯化部位的寡核苷酸(d'
‑
2)、以及具有硫代磷酸酯化部位的寡核苷酸(e'
‑
1)或具有磷酸酯化部位的寡核苷酸(e'
‑
2)的说明,与上述的工序(1)~(4)、“核苷、核苷酸或寡核苷酸(a)”、“核苷、核苷酸或寡核苷酸(b)”、“亚磷酸酯体或亚磷酸二酯(c)”、具有硫代磷酸酯化部位的寡核苷酸(d
‑
1)或具有磷酸酯化部位的寡核苷酸(d
‑
2)、以及具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)或具有磷酸酯化部位的寡核苷酸(e
‑
2)的说明基本相同。关于5'
‑
3'合成,以下对其与3'
‑
5'合成的不同点进行说明。
[0284]
工序(1')(缩合)本工序中使用的核苷、核苷酸或寡核苷酸(b')中,5'位羟基通过选自亚磷酰胺法、h
‑
膦酸酯法、二卤代膦法和氧氮磷杂环戊烷法中的方法被修饰,3'位羟基或3'位氨基被在酸性条件下可除去的临时保护基保护,且其他基团可被用于核酸合成的保护基保护。羟基的临时保护基的说明与工序(1)中的说明相同。
[0285]
作为氨基的临时保护基,可列举例如三苯甲基、单甲氧基三苯甲基、二甲氧基三苯甲基等。其中,较好是三苯甲基和单甲氧基三苯甲基。
[0286]
本工序的优选形态中,采用3'位羟基未被保护,选自核酸碱基的氨基和亚氨基、核糖残基的2'位羟基和5'位羟基、以及脱氧核糖残基的5'位羟基中的至少一个基团被在酸性条件下不可除去但在碱性条件下可除去的保护基保护,且其他基团可进一步被用于核酸合成的保护基保护的核苷、核苷酸或寡核苷酸(a'),或者3'位羟基未被保护,5'位末端的磷酸基的一个oh替换为
‑
ol
n1
‑
oh(式中,l
n1
表示有机基团),
‑
ol
n1
‑
oh的羟基被在酸性条件下不可除去但在碱性条件下可除去的保护基保护,且其他基团可进一步被用于核酸合成的保护基保护的取代核苷酸或寡核苷酸(a1');以及5'位羟基通过选自亚磷酰胺法、h
‑
膦酸酯法、二卤代膦法和氧氮磷杂环戊烷法中的方法被修饰,3'位羟基被在酸性条件下可除去的临时保护基保护,且其他基团可进一步被选自在酸性条件下不可除去但在碱性条件下可除去的保护基和用于核酸合成的保护基中的保护基保护的核苷、核苷酸或寡核苷酸(b')。
[0287]
本工序的更优选形态中,采用3'位羟基未被保护,5'位末端的磷酸基的一个oh替换为
‑
ol
n1
‑
oh(式中,l
n1
表示有机基团),
‑
ol
n1
‑
oh的羟基被在酸性条件下不可除去但在碱性条件下可除去的保护基保护,且其他基团可进一步被用于核酸合成的保护基保护的核苷酸或寡核苷酸(a1');以及5'位羟基通过选自亚磷酰胺法、h
‑
膦酸酯法、二卤代膦法和氧氮磷杂环戊烷法中的方法被修饰,3'位羟基被在酸性条件下可除去的临时保护基保护,且其他基团可进一步被选自在酸性条件下不可除去但在碱性条件下可除去的保护基和用于核酸合成的保护基中的保护基保护的核苷或寡核苷酸(b')。
[0288]
本工序的更优选的另一形态中,采用3'位羟基未被保护,选自核酸碱基的氨基和亚氨基、核糖残基的2'位羟基和5'位羟基、以及脱氧核糖残基的5'位羟基中的至少一个基团被在酸性条件下不可除去但在碱性条件下可除去的保护基保护,且其他基团可进一步被用于核酸合成的保护基保护的核苷或寡核苷酸(a');以及5'位羟基通过选自亚磷酰胺法、h
‑
膦酸酯法、二卤代膦法和氧氮磷杂环戊烷法中的方法被修饰,3'位羟基被在酸性条件下可除去的临时保护基保护,且其他基团可进一步被用于核酸合成的保护基保护的核苷或寡核苷酸(b')。
[0289]“核苷、核苷酸或寡核苷酸(a')”或者“核苷酸或寡核苷酸(a1')”所具有的3'位羟基与“核苷、核苷酸或寡核苷酸(b')”所具有的通过选自亚磷酰胺法、h
‑
膦酸酯法、二卤代膦法和氧氮磷杂环戊烷法中的方法被修饰的5'位羟基的缩合,可与工序(1)同样地进行。因
此,关于工序(1')的缩合的说明,除了将“核苷、核苷酸或寡核苷酸(a)或者核苷酸或寡核苷酸(a1)”替换为“核苷、核苷酸或寡核苷酸(a')或者核苷酸或寡核苷酸(a1')”,并将“核苷、核苷酸或寡核苷酸(b)”替换为“核苷、核苷酸或寡核苷酸(b')”以外,与工序(1)的说明相同。
[0290]“核苷、核苷酸或寡核苷酸(a')或者核苷酸或寡核苷酸(a1')”所具有的3'位氨基与“核苷、核苷酸或寡核苷酸(b')”所具有的通过选自亚磷酰胺法、h
‑
膦酸酯法、二卤代膦法和氧氮磷杂环戊烷法中的方法被修饰的5'位羟基的缩合,也可与工序(1)的缩合同样地进行。因此,除了将“核苷、核苷酸或寡核苷酸(a)或者核苷酸或寡核苷酸(a1)”替换为“核苷、核苷酸或寡核苷酸(a')或者核苷酸或寡核苷酸(a1')”,并将“核苷、核苷酸或寡核苷酸(b)”替换为“核苷、核苷酸或寡核苷酸(b')”以外,工序(1')的缩合的说明与工序(1)的说明相同。
[0291]
作为核苷、核苷酸或寡核苷酸(a'),可列举例如以下述式(a
‑
i')表示的化合物(即,核苷或寡核苷酸)。
[0292]
[化学式32]
[0293]
[式中,m、m+1个的base、m+1个的x、m个的r
10
、m个的r
p1
、l、y和z分别独立与上述同义,m个的x
n1
分别独立表示氧原子或nh,x
n3
表示羟基或氨基]。
[0294]
式(a
‑
i')中的m个的x
n1
较好是氧原子;式(a
‑
i')中的x
n3
较好是羟基;式(a
‑
i')中的m个的r
p1
较好是分别独立为以
‑
ch2ch2wg表示的基团;式(a
‑
i')中的其他符号的说明如上所述。
[0295]
化合物(a
‑
i')较好是以下述式(a
‑
i')表示的化合物(下述式中的符号的定义和说明如上所述);[化学式33]
[0296]
即,化合物(a
‑
i')中,较好是以式(a
‑
ii')表示的化合物(即,核苷或寡核苷酸)(下述式中的符号的定义和说明如上所述)。
[0297]
[化学式34]
[0298]
式(a
‑
ii')中,m个的r
p1
分别独立较好是以
‑
ch2ch2wg表示的基团;式(a
‑
ii')中,m较好是0;式(a
‑
ii')中的其他符号的说明如上所述。
[0299]
化合物(a
‑
ii')中,较好是以下述式(a
‑
iii')表示的化合物(即,核苷)(下述式中的符号的定义和说明如上所述),[化学式35]
[0300]
此外,化合物(a
‑
i')中,较好是以下述式(a
‑
iv')表示的化合物(即,核苷或寡核苷酸)(下述式中的符号的定义和说明如上所述)。
[0301]
[化学式36]
[0302]
式(a
‑
iv')中,m个的r
p1
分别独立较好是以
‑
ch2ch2wg表示的基团;式(a
‑
iv')中,m较好是0;式(a
‑
iv')中的其他符号的说明如上所述。
[0303]
化合物(a
‑
iv')中,较好是以下述式(a
‑
v')表示的化合物(即,核苷)(下述式中的符号的定义和说明如上所述),[化学式37]
[0304]
此外,作为核苷、核苷酸或寡核苷酸(a'),可列举例如以下述式(a
‑
vi')表示的化合物(即,核苷或寡核苷酸)。
[0305]
[化学式38]
[0306]
[式中,
m+1个的base1的至少一个表示被
‑
l
‑
y
‑
z保护的核酸碱基,其余的表示可被保护的核酸碱基,m个的x
n1
分别独立表示氧原子或nh,x
n3
表示羟基或氨基,r
n4
表示羟基的保护基,m、m+1个的x、m个的r
10
、m个的r
p1
、l、y和z分别独立与上述同义]。
[0307]
式(a
‑
vi')中的m个的x
n1
较好是氧原子;式(a
‑
vi')中的x
n3
较好是羟基;式(a
‑
vi')中的m个的r
p1
较好是分别独立为以
‑
ch2ch2wg表示的基团;式(a
‑
vi')中的其他符号的说明如上所述。
[0308]
化合物(a
‑
vi')较好是以下述式(a
‑
vi')表示的化合物(下述式中的符号的定义和说明如上所述),[化学式39]
[0309]
此外,作为核苷酸或寡核苷酸(a1'),可列举例如以下述式(a
‑
vii')表示的化合物。
[0310]
[化学式40]
[0311]
[式中,
m个的x
n1
分别独立表示氧原子或nh,x
n3
表示羟基或氨基,l
n1
表示有机基团,m、m+1个的base、m+1个的x、m+1个的r
10
、m+1个的r
p1
、l、y和z分别独立与上述同义]。
[0312]
式(a
‑
vii')中的x
n3
较好是羟基;式(a
‑
vii')中的m+1个的r
p1
较好是分别独立为以
‑
ch2ch2wg表示的基团;式(a
‑
vii')中的其他符号的说明如上所述。
[0313]
化合物(a
‑
vii')较好是以下述式(a
‑
vii')表示的化合物(下述式中的符号的定义和说明如上所述),[化学式41]
[0314]
本工序中使用的“核苷、核苷酸或寡核苷酸(a')”或者“核苷酸或寡核苷酸(a1')”较好是化合物(a
‑
i')、化合物(a
‑
vi')或化合物(a
‑
vii'),更好是化合物(a
‑
i')、化合物(a
‑
vi')或化合物(a
‑
vii'),进一步更好是化合物(a
‑
i')或化合物(a
‑
vii'),特别好是化合物(a
‑
vii')。
[0315]
作为核苷、核苷酸或寡核苷酸(b'),可列举例如以下述式(b
‑
i')表示的化合物(即,核苷或寡核苷酸)。
[0316]
[化学式42]
[0317]
[式中,q+1个的base2分别独立表示可被选自
‑
l
‑
x
‑
z和用于核酸合成的保护基中的保护基保护的核酸碱基,q个的x
n1
分别独立表示氧原子或nh,x
n4
表示被在酸性条件下可除去的临时保护基保护的羟基或氨基,q、q+1个的x、q+1个的r
p1
、q个的r
10
、r
36
和r
37
分别独立与上述同义]。
[0318]
式(b
‑
i')中的羟基的临时保护基和氨基的临时保护基的说明如上所述。x
n4
较好是被在酸性条件下可除去的临时保护基保护的羟基;式(b
‑
i')中的q+1个的r
p1
较好是分别独立为以
‑
ch2ch2wg表示的基团;式(b
‑
i')中的其他符号的说明如上所述。
[0319]
化合物(b
‑
i')较好是以下述式(b
‑
i')表示的化合物(下述式中的符号的定义和说明如上所述),[化学式43]
[0320]
除了3'位羟基和5'位羟基的保护等形态互换以外,上述的化合物(a
‑
i')~化合物(a
‑
vii')以及化合物(b
‑
i')和化合物(b
‑
i')的说明与上述的化合物(a
‑
i)~化合物(a
‑
vii)以及化合物(b
‑
i)和化合物(b
‑
i)的说明基本相同。
[0321]
本工序中使用的“核苷、核苷酸或寡核苷酸(a')或者核苷酸或寡核苷酸(a1')”与“核苷、核苷酸或寡核苷酸(b')”的组合较好是化合物(a
‑
i')、化合物(a
‑
vi')或化合物(a
‑
vii')与化合物(b
‑
i')的组合,更好是化合物(a
‑
i')、化合物(a
‑
vi')或化合物(a
‑
vii')与化合物(b
‑
i')的组合,进一步更好是化合物(a
‑
i')或化合物(a
‑
vii')与化合物(b
‑
i')的组合,特别好是化合物(a
‑
vii')与化合物(b
‑
i')的组合。
[0322]
液相法的情况下,相对于本工序中的核苷、核苷酸或寡核苷酸(a')的使用量1摩尔,本工序中的核苷、核苷酸或寡核苷酸(b')的使用量例如为1~10摩尔,较好是1~5摩尔;固相法的情况下,相对于本工序中的核苷、核苷酸或寡核苷酸(a')的使用量1摩尔,本工序中的核苷、核苷酸或寡核苷酸(b')的使用量例如为1~20摩尔,较好是1~10摩尔。
[0323]
本工序中的反应温度只要反应能进行即可,无特别限定,液相法的情况下,较好是0℃~100℃,更好是20℃~50℃,固相法的情况下,较好是10℃~40℃,更好是20℃~30℃。反应时间根据使用的原料的种类、反应温度等而不同,液相法的情况下,例如为5分钟~24小时,固相法的情况下,例如为1分钟~30分钟。
[0324]
工序(2'):(2'
‑
1)(硫化)本工序是如下的工序:通过使硫化剂与3'位羟基或3'位氨基被在酸性条件下可除去的临时保护基保护的亚磷酸酯体或亚磷酸二酯(c')反应,使其亚磷酸酯键或亚磷酸二酯键转化为硫代磷酸酯键,获得3'位羟基或3'位氨基被在酸性条件下可除去的临时保护基保护的具有硫代磷酸酯化部位的寡核苷酸(d'
‑
1)。硫化剂可仅使用其1种,也可将2种以上并用。
[0325]
作为本工序中使用的硫化剂,只要具有可将亚磷酸酯键或亚磷酸二酯键转化为硫代磷酸酯键的能力即可,无特别限定,较好是5
‑
[(n,n
‑
二甲基氨基亚甲基)氨基]
‑
3h
‑
1,2,4
‑
二噻唑
‑3‑
硫酮(ddtt)、3h
‑
1,2
‑
苯并二硫醇
‑3‑
酮
‑
1,1
‑
二氧化物(beaucage试剂)、3h
‑
1,2
‑
苯并二硫醇
‑3‑
酮、苯乙酰二硫化物(pads)、二硫化四乙基秋兰姆(tetd)、四硫化双五亚甲基秋兰姆、5
‑
苯基
‑
3h
‑
1,2,4
‑
二噻唑
‑3‑
酮(pos)、3
‑
氨基
‑
1,2,4
‑
二噻唑
‑5‑
硫酮(adtt,氢化黄原素)、硫。
[0326]
从可进行良好的反应的观点来看,更好是5
‑
[(n,n
‑
二甲基氨基亚甲基)氨基]
‑
3h
‑
1,2,4
‑
二噻唑
‑3‑
硫酮(ddtt)、3h
‑
1,2
‑
苯并二硫醇
‑3‑
酮
‑
1,1
‑
二氧化物(beaucage试剂)、3h
‑
1,2
‑
苯并二硫醇
‑3‑
酮、苯乙酰二硫化物(pads)、5
‑
苯基
‑
3h
‑
1,2,4
‑
二噻唑
‑3‑
酮(pos),进一步更好是5
‑
[(n,n
‑
二甲基氨基亚甲基)氨基]
‑
3h
‑
1,2,4
‑
二噻唑
‑3‑
硫酮(ddtt)、3h
‑
1,2
‑
苯并二硫醇
‑3‑
酮
‑
1,1
‑
二氧化物(beaucage试剂)、5
‑
苯基
‑
3h
‑
1,2,4
‑
二噻唑
‑3‑
酮(pos),特别好是5
‑
[(n,n
‑
二甲基氨基亚甲基)氨基]
‑
3h
‑
1,2,4
‑
二噻唑
‑3‑
硫酮(ddtt)、5
‑
苯基
‑
3h
‑
1,2,4
‑
二噻唑
‑3‑
酮(pos)。所述硫化剂可用合适的溶剂稀释至0.05~2m的浓度后使用。作为所述稀释溶剂,只要是对反应惰性的溶剂即可,无特别限定,可列举例如二氯甲烷、乙腈、吡啶或它们的任意的混合溶剂。
[0327]
相对于亚磷酸酯体或亚磷酸二酯(c')1摩尔,液相法的情况下,硫化剂的使用量例
如为1~50摩尔,较好是1~10摩尔,固相法的情况下,硫化剂的使用量例如为1~100摩尔,较好是1~20摩尔。
[0328]
反应温度只要反应能进行即可,无特别限定,液相法的情况下,较好是0℃~100℃,更好是20℃~50℃,固相法的情况下,较好是10℃~40℃,更好是20℃~30℃。反应时间根据亚磷酸酯体或亚磷酸二酯(c')的种类、使用的硫化剂的种类、反应温度等而不同,液相法的情况下,例如为1分钟~3小时,固相法的情况下,例如为1分钟~30分钟。
[0329]
工序(2'):(2'
‑
2)(氧化)本工序是如下的工序:通过使氧化剂与3'位羟基或3'位氨基被在酸性条件下可除去的临时保护基保护的亚磷酸酯体或亚磷酸二酯(c')反应,使其亚磷酸酯键或亚磷酸二酯键转化为磷酸酯键,获得3'位羟基或3'位氨基被在酸性条件下可除去的临时保护基保护的具有磷酸酯化部位的寡核苷酸(d'
‑
2)。氧化剂可仅使用其1种,也可将2种以上并用。
[0330]
作为本工序中使用的氧化剂,只要具有可将亚磷酸酯键或亚磷酸二酯键转化为磷酸酯键的能力即可,无特别限定,从可良好地进行反应的观点来看,较好是碘。
[0331]
所述氧化剂可用合适的溶剂稀释后使用。作为所述稀释溶剂,只要是对反应惰性的溶剂即可,无特别限定,可列举例如吡啶、水或它们的任意的混合溶剂,较好是吡啶与水的混合溶剂。相对于1摩尔氧化剂,吡啶为3~10摩尔,较好是4~6摩尔;相对于1摩尔氧化剂,水为1~5摩尔,较好是2~4摩尔。
[0332]
相对于亚磷酸酯体或亚磷酸二酯(c')1摩尔,液相法的情况下,氧化剂的使用量例如为1~50摩尔,较好是1~10摩尔,固相法的情况下,氧化剂的使用量例如为1~100摩尔,较好是1~20摩尔。
[0333]
关于反应温度,只要反应能进行即可,无特别限定,液相法的情况下,较好是0℃~100℃,更好是20℃~50℃,固相法的情况下,较好是10℃~40℃,更好是20℃~30℃。反应时间根据亚磷酸酯体或亚磷酸二酯(c')的种类、使用的氧化剂的种类、反应温度等而不同,液相法的情况下,例如为1分钟~3小时,固相法的情况下,例如为1分钟~30分钟。
[0334]
工序(3'):(3'
‑
1)(具有硫代磷酸酯化部位的寡核苷酸的临时保护基的脱保护)、或(3'
‑
2)(具有磷酸酯化部位的寡核苷酸的临时保护基的脱保护)本工序是如下的工序:通过酸除去具有硫代磷酸酯化部位的寡核苷酸(d'
‑
1)的3'位羟基或3'位氨基的临时保护基,获得3'位羟基或3'位氨基未被保护的具有硫代磷酸酯化部位的寡核苷酸(e'
‑
1)粗产物。此外,本工序是如下的工序:通过酸除去具有磷酸酯化部位的寡核苷酸(d'
‑
2)的临时保护基,获得3'位羟基或3'位氨基未被保护的具有磷酸酯化部位的寡核苷酸(e'
‑
2)粗产物。酸可仅使用1种,也可将2种以上并用。
[0335]
羟基的临时保护基的除去的说明与工序(1)中的说明相同。作为用于除去氨基的临时保护基的酸,只要可实现良好的脱保护即可,无特别限定,可列举三氟乙酸、二氯乙酸、三氯乙酸、乙酸等羧酸、三氟甲磺酸、甲磺酸、对甲苯磺酸等磺酸、膦酸、磷酸等,从解决脱保护工序中脱保护后的3'位羟基或3'位氨基被酰基化的问题的观点来看,较好是至少包含可将羟基酰基化的羧酸,更好是至少包含三氟乙酸、二氯乙酸或三氯乙酸。这些酸可用所述非极性溶剂稀释。相对于1摩尔具有硫代磷酸酯化部位的寡核苷酸(d'
‑
1)或1摩尔具有磷酸酯化部位的寡核苷酸(d'
‑
2),液相法的情况下,氨基的临时保护基的除去中的酸的使用量例如为1~100摩尔,较好是1~40摩尔,固相法的情况下,氨基的临时保护基的除去中的酸的
使用量例如为1~200摩尔,较好是1~80摩尔。
[0336]
关于用于除去氨基的临时保护基的反应温度,只要反应能进行即可,无特别限定,液相法的情况下,较好是
‑
10℃~50℃,更好是0℃~40℃,固相法的情况下,较好是10℃~50℃,更好是20℃~30℃。氨基的临时保护基的反应时间根据使用的具有硫代磷酸酯化部位的寡核苷酸(d'
‑
1)或具有磷酸酯化部位的寡核苷酸(d'
‑
2)的种类、酸的种类和非极性溶剂的种类、反应温度等而不同,液相法的情况下,例如为5分钟~5小时,固相法的情况下,例如为1分钟~30分钟。
[0337]
工序(4'):(4'
‑
1)(具有硫代磷酸酯化部位的寡核苷酸的溶剂分解)、或(4'
‑
2)(具有磷酸酯化部位的寡核苷酸的溶剂分解)本工序是如下的工序:对具有硫代磷酸酯化部位的寡核苷酸(e'
‑
1)粗产物中所含的3'位羟基或3'位氨基被酰基化的具有硫代磷酸酯化部位的寡核苷酸进行溶剂分解而脱酰基化。此外,本工序是如下的工序:对具有磷酸酯化部位的寡核苷酸(e'
‑
2)粗产物中所含的3'位羟基或3'位氨基被酰基化的具有磷酸酯化部位的寡核苷酸进行溶剂分解而脱酰基化;本工序中的“酰基化”是指前面的工序(3'
‑
1)或(3'
‑
2)中为了除去3'位羟基或3'位氨基的临时保护基而添加的酸与3'位羟基或3'位氨基反应,其结果是,酸为羧酸的情况下,r
‑
c(=o)
‑
与3'位的氧原子或氮原子结合,磺酸的情况下,r
‑
s(=o)2‑
与3'位的氧原子或氮原子结合,膦酸的情况下,h
‑
p(=o)(oh)
‑
与3'位的氧原子或氮原子结合,磷酸的情况下,h
‑
p(=o)2‑
与3'位的氧原子或氮原子结合。另一方面,本工序中的“脱酰基化”是指本工序中生成的酰基化物通过溶剂分解而变成3'位羟基或3'位氨基;本工序较好是在不会使与硫代磷酸酯化部位或磷酸酯化部位的氧原子结合的氰基烷基(例如氰基乙基)、烷氧基羰基烷基(例如乙氧羰基乙基)、卤代苯基(2
‑
氯苯基)等脱落的碱性条件下进行。其原因在于,特别是在对碱性不稳定的氰基烷基(例如氰基乙基)的情况下,理想的是使氰基烷基(例如氰基乙基)不会脱落。
[0338]
作为本工序中使用的溶剂,只要可使3'位羟基或3'位氨基被酰基化的具有硫代磷酸酯化部位的寡核苷酸脱酰基化即可,无特别限定。此外,作为本工序中使用的溶剂,只要可使3'位羟基或3'位氨基被酰基化的具有磷酸酯化部位的寡核苷酸脱酰基化即可,无特别限定。较好是碱与亲核物质的混合物。作为碱,较好是有机碱,可列举例如吡啶、三甲基吡啶、二甲基吡啶等,较好是吡啶。作为亲核物质,较好是水和醇类,可列举例如水、甲醇、乙醇等,较好是水、甲醇。作为碱与亲核物质的混合物,较好是吡啶与水的混合物、吡啶与甲醇的混合物、吡啶与乙醇的混合物、三甲基吡啶与水的混合物、三甲基吡啶与甲醇的混合物、三甲基吡啶与乙醇的混合物、二甲基吡啶与水的混合物、二甲基吡啶与甲醇的混合物、二甲基吡啶与乙醇的混合物,更好是吡啶与水的混合物、吡啶与甲醇的混合物、吡啶与乙醇的混合物。
[0339]
本工序中的碱的使用量根据使用的碱的种类而不同,液相法的情况下,脱保护工序后,不经纯化以一锅实施本工序时,以及固相法的情况下,脱保护中使用的酸残留于反应液中,因此需要更多的碱。由此,液相法(一锅法)和固相法中,相对于使用的酸的量,需要1~10当量、较好是3~5当量的碱。另一方面,除上述固相法以外和除液相法(一锅法)以外的情况下,相对于1摩尔具有硫代磷酸酯化部位的寡核苷酸(e'
‑
1)粗产物或1摩尔具有磷酸酯
化部位的寡核苷酸(e'
‑
2)粗产物,需要1~5摩尔,较好是1~3摩尔;关于本工序的反应温度,只要反应能进行即可,无特别限定,液相法的情况下,较好是0℃~50℃,更好是5℃~30℃,固相法的情况下,较好是5℃~40℃,更好是10℃~30℃。反应时间根据使用的具有硫代磷酸酯化部位的寡核苷酸(e'
‑
1)粗产物或具有磷酸酯化部位的寡核苷酸(e'
‑
2)粗产物及溶剂的种类、反应温度等而不同,液相法的情况下,例如为10分钟~24小时,固相法的情况下,例如为1分钟~30分钟。
[0340]
寡核苷酸通过固液分离或萃取得到的具有硫代磷酸酯化部位的寡核苷酸(e
‑
1)或(e'
‑
1)、具有磷酸酯化部位的寡核苷酸(e
‑
2)或(e'
‑
2)、或者通过脱保护和分离得到的未被保护的具有硫代磷酸酯化部位的寡核苷酸或具有磷酸酯化部位的寡核苷酸,还可通过进一步实施有机合成反应,衍生出所期望的衍生物。通过本发明的制造方法得到的具有硫代磷酸酯化部位的寡核苷酸或具有磷酸酯化部位的寡核苷酸可用于人体用或动物用的药品(rna、dna、寡聚核酸药物等)、功能性食品、特定保健用食品、食品、化工产品、生物体用或工业用的高分子材料等各种用途。实施例
[0341]
以下,按照实施例对本发明进行更详细的说明,但这些实施例不对本发明的范围造成任何限定。此外,只要未特别提及,本发明中使用的试剂和装置、材料可通过商业途径获得。此外,本说明书中,以缩写符号表示氨基酸等的情况下,各表示形式基于iupac
‑
iub生物化学命名委员会(iupac
‑
iub commission on biochemical nomenclature)所规定的缩写符号或本领域中的惯用缩写符号。
[0342]
后述的实施例等中使用的缩写符号的含义如下。此外,以下也将后述的实施例等中使用的2'
‑
ome
‑
c
‑
ce亚磷酰胺等统称为亚磷酰胺单体;suc:琥珀酰基tob:3,4,5
‑
三(十八烷氧基)苄氧基piv
‑
tob:3,4,5
‑
三(十八烷氧基)苄基新戊酸酯ddtt:5
‑
[(n,n
‑
二甲基氨基亚甲基)氨基]
‑
3h
‑
1,2,4
‑
二噻唑
‑3‑
硫酮pos:5
‑
苯基
‑
3h
‑
1,2,4
‑
二噻唑
‑3‑
酮pads:苯乙酰二硫化物dmtr:4,4'
‑
二甲氧基三苯甲基lc
‑
tof ms:液相色谱
‑
飞行时间型质谱分析仪dbu:1,8
‑
二氮杂双环[5.4.0]
‑7‑
十一烯pivcl:新戊酰氯2'
‑
ome
‑
c
‑
ce亚磷酰胺:5'
‑
o
‑
(4,4'
‑
二甲氧基三苯甲基)
‑
n4‑
苯甲酰
‑
2'
‑
o
‑
甲基
‑
胞苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)
‑
(n,n
‑
二异丙基)]
‑
亚磷酰胺2'
‑
ome
‑
g
‑
ce亚磷酰胺:5'
‑
o
‑
(4,4'
‑
二甲氧基三苯甲基)
‑
n2‑
异丁酰
‑
2'
‑
o
‑
甲基
‑
鸟苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)
‑
(n,n
‑
二异丙基)]
‑
亚磷酰胺5
‑
me
‑
dc(bz)
‑
ce亚磷酰胺:5'
‑
o
‑
(4,4'
‑
二甲氧基三苯甲基)
‑
n4‑
苯甲酰
‑
2'
‑
脱氧
‑5‑
甲基胞苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)
‑
(n,n
‑
二异丙基)]
‑
亚磷酰胺dg
‑
ce亚磷酰胺:5'
‑
o
‑
(4,4'
‑
二甲氧基三苯甲基)
‑
n2‑
异丁酰
‑
脱氧鸟苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)
‑
(n,n
‑
二异丙基)]
‑
亚磷酰胺2'
‑
o
‑
tbdms
‑
c(ac)
‑
ce亚磷酰胺:5'
‑
o
‑
(4,4'
‑
二甲氧基三苯甲基)
‑
n4‑
乙酰
‑
2'
‑
o
‑
(叔丁基二甲基甲硅烷基)
‑
胞苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)
‑
(n,n
‑
二异丙基)]
‑
亚磷酰胺lna
‑
a(bz)
‑
ce亚磷酰胺:5'
‑
o
‑
(4,4'
‑
二甲氧基三苯甲基)
‑
n6‑
苯甲酰
‑
2'
‑
o,4'
‑
c
‑
亚甲基
‑
腺苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)
‑
(n,n
‑
二异丙基)]
‑
亚磷酰胺2'
‑
f
‑
c(bz)
‑
ce亚磷酰胺:5'
‑
o
‑
(4,4'
‑
二甲氧基三苯甲基)
‑
n4‑
苯甲酰
‑
2'
‑
氟
‑
胞苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)
‑
(n,n
‑
二异丙基)]
‑
亚磷酰胺dt
‑
h
‑
膦酸酯tea盐:5'
‑
o
‑
(4,4'
‑
二甲氧基三苯甲基)
‑
脱氧胸苷
‑
3'
‑
h
‑
膦酸酯,三乙胺盐ho
‑
dt
‑
suc
‑
tob:脱氧胸苷3'
‑
基3,4,5
‑
三(十八烷氧基)苄基琥珀酸酯ho
‑
t
‑
suc
‑
tob:脱氧胸苷
‑
3'
‑
基3,4,5
‑
三(十八烷氧基)苄基琥珀酸酯ho
‑
cmt
‑
suc
‑
tob:n4‑
苯甲酰
‑
2'
‑
o
‑
甲基
‑
胞苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)]硫代磷酰基(phosphorothionyl)脱氧胸苷
‑
3'
‑
基
‑
[3,4,5
‑
三(十八烷氧基)苄基]琥珀酸酯ho
‑
gmcmt
‑
suc
‑
tob:n2‑
异丁酰
‑
2'
‑
o
‑
甲基
‑
鸟苷3'
‑
[o
‑
(2
‑
氰基乙基)]磷酰基n4‑
苯甲酰
‑
2'
‑
o
‑
甲基
‑
胞苷3'
‑
[o
‑
(2
‑
氰基乙基)]硫代磷酰基脱氧胸苷
‑
3'
‑
基
‑
[3,4,5
‑
三(十八烷氧基)苄基]琥珀酸酯ho
‑
2'
‑
ome
‑
u
‑
suc
‑
tob:2'
‑
o
‑
甲基
‑
尿苷
‑
3'
‑
基3,4,5
‑
三(十八烷氧基)苄基琥珀酸酯ho
‑
um
‑
suc
‑
tob:2'
‑
o
‑
甲基
‑
尿苷
‑
3'
‑
基3,4,5
‑
三(十八烷氧基)苄基琥珀酸酯ho
‑
cmum
‑
suc
‑
tob:n4‑
苯甲酰
‑
2'
‑
o
‑
甲基
‑
胞苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)]硫代磷酰基2'
‑
o
‑
甲基
‑
尿苷
‑
3'
‑
基
‑
[3,4,5
‑
三(十八烷氧基)苄基]琥珀酸酯ho
‑
gum
‑
suc
‑
tob:n2‑
异丁酰
‑
脱氧鸟苷3'
‑
[o
‑
(2
‑
氰基乙基)]硫代磷酰基2'
‑
o
‑
甲基
‑
尿苷
‑
3'
‑
基
‑
[3,4,5
‑
三(十八烷氧基)苄基]琥珀酸酯ho
‑
a
l
t
‑
suc
‑
tob:n6‑
苯甲酰
‑
2'
‑
o,4'
‑
c
‑
亚甲基
‑
腺苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)]硫代磷酰基脱氧胸苷
‑
3'
‑
基
‑
[3,4,5
‑
三(十八烷氧基)苄基]琥珀酸酯ho
‑
c
f
a
l
t
‑
suc
‑
tob:n4‑
苯甲酰
‑
2'
‑
氟
‑
胞苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)]硫代磷酰基n6‑
苯甲酰
‑
2'
‑
o,4'
‑
c
‑
亚甲基
‑
腺苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)]硫代磷酰基脱氧胸苷
‑
3'
‑
基
‑
[3,4,5
‑
三(十八烷氧基)苄基]琥珀酸酯ho
‑
rcc
f
a
l
t
‑
suc
‑
tob:n4‑
乙酰
‑
2'
‑
o
‑
(叔丁基二甲基甲硅烷基)
‑
胞苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)]硫代磷酰基n4‑
苯甲酰
‑
2'
‑
氟
‑
胞苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)]硫代磷酰基n6‑
苯甲酰
‑
2'
‑
o,4'
‑
c
‑
亚甲基
‑
腺苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)]硫代磷酰基脱氧胸苷
‑
3'
‑
基
‑
[3,4,5
‑
三(十八烷氧基)苄基]琥珀酸酯ho
‑
(ch2)2‑
suc
‑
tob:3,4,5
‑
三(十八烷氧基)苄基2
‑
羟基乙基琥珀酸酯ho
‑
a
l
(ch2)2‑
suc
‑
tob:n6‑
苯甲酰
‑
2'
‑
o,4'
‑
c
‑
亚甲基
‑
腺苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)]硫代磷酰基乙氧基
‑
[3,4,5
‑
三(十八烷氧基)苄基]琥珀酸酯ho
‑
c
f
a
l
(ch2)2‑
suc
‑
tob:n4‑
苯甲酰
‑
2'
‑
氟
‑
胞苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)]硫代磷酰基n6‑
苯甲酰
‑
2'
‑
o,4'
‑
c
‑
亚甲基
‑
腺苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)]硫代磷酰基乙氧基
‑
[3,4,5
‑
三(十八烷氧基)苄基]琥珀酸酯ho
‑
rcc
f
a
l
(ch2)2‑
suc
‑
tob:n4‑
乙酰
‑
2'
‑
o
‑
(叔丁基二甲基甲硅烷基)
‑
胞苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)]硫代磷酰基n4‑
苯甲酰
‑
2'
‑
氟
‑
胞苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)]硫代磷酰基n6‑
苯甲酰
‑
2'
‑
o,4'
‑
c
‑
亚甲基
‑
腺苷
‑
3'
‑
[o
‑
(2
‑
氰基乙基)]硫代磷酰基乙氧基
‑
[3,4,5
‑
三(十八烷氧基)苄基]琥珀酸酯ho
‑
t
h
t
‑
suc
‑
tob:脱氧胸苷
‑
3'
‑
膦酸酯(phosphonate)脱氧胸苷
‑
3'
‑
基
‑
[3,4,5
‑
三(十八烷氧基)苄基]琥珀酸酯ho
‑
t
oh
t
‑
suc
‑
tob:脱氧胸苷
‑
3'
‑
硫代磷酰基脱氧胸苷
‑
3'
‑
基
‑
[3,4,5
‑
三(十八烷氧基)苄基]琥珀酸酯。
[0343]
以下,tob加成化合物通过国际公开第2012/157723号中所记载的方法合成。
[0344]
参考例1:氩气气氛下,向20ml的二口烧瓶中加入ho
‑
2'
‑
ome
‑
u
‑
suc
‑
tob(251mg,200μmol)和piv
‑
tob(251mg,251μmol),加入脱水二氯甲烷(10.0ml)和脱水乙腈(1.0ml)使其溶解。然后,依次加入2'
‑
ome
‑
c
‑
ce亚磷酰胺(518mg,600μmol)和5
‑
苄硫基
‑
1h
‑
四唑(78.1mg,600μmol),室温下搅拌1.0小时。接着,向反应溶液中加入2,2,2
‑
三氟乙醇(219μl,3.0mmol),室温下搅拌30分钟后,依次加入2,6
‑
二甲基苯胺(351μl,2.9mmol)和ddtt(129mg,630μmol),室温下搅拌1小时。然后,依次加入2,3
‑
二甲基呋喃(316μl,3.0mmol)和三氟乙酸(459μl,6.0mmol),室温下搅拌1.5小时。对该脱dmtr工序完成时的反应溶液进行了分析,其结果是,含有0.97%被三氟乙酰化的寡聚核酸。将该反应溶液分成2份用于下文记载的实施例1和比较例1。
[0345]
实施例1:采用ddtt的硫化反应后,脱dmtr化,溶剂分解向含有上述参考例1中合成的延伸寡聚核酸(38μmol)的脱dmtr工序溶液中依次加入三甲基吡啶(318μl,2.4mmol)和水(23.8μl),室温下搅拌2小时。对反应溶液进行了分析,其结果是,被三氟乙酰化的寡聚核酸残余量为0.004%。然后,添加乙腈(5.7ml),将析出的固体用桐山漏斗抽滤后,进行干燥,作为白色固体获得二聚体ho
‑
cmum
‑
suc
‑
tob;m/z(tof
‑
ms):计算值1745.06,实测值1746.07[m+h]
+
向所得的二聚体ho
‑
cmum
‑
suc
‑
tob(26.2mg,15μmol)中加入脱水二氯甲烷(0.8ml)和脱水乙腈(0.10ml)使其溶解。然后,依次加入2'
‑
ome
‑
g
‑
ce亚磷酰胺(39.1mg,45μmol)和5
‑
苄硫基
‑
1h
‑
四唑(8.7mg,45μmol),室温下搅拌1.0小时。接着,向反应溶液中加入2,2,2
‑
三氟乙醇(16.4μl,225μmol),室温下搅拌30分钟后,依次加入2,6
‑
二甲基苯胺(26.3μl,214μmol)和ddtt(9.7mg,47μmol),室温下搅拌1小时。对反应溶液进行了分析,其结果是,残余原料为0.07%。
[0346]
比较例1:采用ddtt的硫化反应后,脱dmtr化,溶剂分解未完成向含有上述参考例1中合成的延伸寡聚核酸(38μmol)的脱dmtr工序溶液中依次加入三甲基吡啶(159μl,1.2mmol)和水(24μl,192μmol),室温下搅拌2小时。对反应溶液进行了分析,其结果是,被三氟乙酰化的寡聚核酸残余量为0.21%。然后,添加乙腈(5.7ml),将析出的固体用桐山漏斗抽滤后,进行干燥,作为白色固体获得二聚体ho
‑
cmum
‑
suc
‑
tob;m/z(tof
‑
ms):计算值1745.06,实测值1746.07[m+h]
+
向所得的二聚体ho
‑
cmum
‑
suc
‑
tob(26.2mg,15μmol)中加入脱水二氯甲烷(0.8ml)和脱水乙腈(0.10ml)使其溶解。然后,依次加入2'
‑
ome
‑
g
‑
ce亚磷酰胺(39.1mg,45μmol)和5
‑
苄硫基
‑
1h
‑
四唑(8.7mg,45μmol),室温下搅拌1.0小时。接着,向反应溶液中加入2,2,2
‑
三氟乙醇(16.4μl,225μmol),室温下搅拌30分钟后,依次加入2,6
‑
二甲基苯胺(26.3μl,214μmol)和ddtt(9.7mg,47μmol),室温下搅拌1小时。对反应溶液进行了分析,其结果是,残余原料为0.26%。
[0347]
实施例2:采用pos的硫化反应后,脱dmtr化,溶剂分解将实施例1的硫化剂由ddtt变更为pos,并同样地操作,进行使5
‑
me
‑
dc(bz)
‑
ce亚磷酰胺在ho
‑
dt
‑
suc
‑
tob(81μmol)上延伸的一锅寡聚核酸合成,对该脱dmtr工序完成时的反应溶液进行了分析,其结果是,含有7%被三氟乙酰化的寡聚核酸。然后,将反应溶液分成3份,分别记作a溶液、b溶液和c溶液。
[0348]
a溶液:采用吡啶和甲醇的溶剂分解向含有经延伸的寡聚核酸(20μmol)的脱dmtr工序溶液中依次加入吡啶(603μl,7.5mmol)和甲醇(6.7μl),室温下搅拌1小时。对反应液进行了分析,其结果是,被三氟乙酰化的寡聚核酸含量为0.01%。
[0349]
b溶液:采用三甲基吡啶和水的溶剂分解向含有经延伸的寡聚核酸(19μmol)的脱dmtr工序溶液中依次加入三甲基吡啶(252μl,1.9mmol)和水(6.1μl),室温下搅拌1小时。对反应液进行了分析,其结果是,被三氟乙酰化的寡聚核酸含量为0.02%。
[0350]
c溶液:采用三甲基吡啶和甲醇的溶剂分解向含有经延伸的寡聚核酸(16μmol)的脱dmtr工序溶液中依次加入三甲基吡啶(207μl,1.6mmol)和甲醇(5.0μl),室温下搅拌1小时。对反应液进行了分析,其结果是,被三氟乙酰化的寡聚核酸含量为0.01%。
[0351]
实施例3:氧化反应后,脱dmtr化,溶剂分解氩气气氛下,向20ml的二口烧瓶中,使用ho
‑
t
‑
suc
‑
tob代替参考例1中的ho
‑
2'
‑
ome
‑
u
‑
suc
‑
tob,加入与参考例1和实施例1同样操作而合成的ho
‑
cmt
‑
suc
‑
tob(101mg,60μmol),加入脱水二氯甲烷(2.9ml)和脱水乙腈(0.9ml)使其溶解。然后,依次加入2'
‑
ome
‑
g
‑
ce亚磷酰胺(151mg,173μmol)和5
‑
乙硫基
‑
1h
‑
四唑(22.6mg,173μmol),室温下搅拌1小时。接着,向反应溶液中加入四氢糠醇(19.5μl,866μmol),室温下搅拌30分钟后,依次加入水(78μl)和吡啶(70μl,867μmol)、碘(89.3mg,352μmol),室温下搅拌1小时。然后,依次加入2,3
‑
二甲基呋喃(91.6μl,869μmol)和三氟乙酸(199μl,2.6mmol),室温下搅拌1小时。对反应溶液进行了分析,其结果是,被三氟乙酰化的寡聚核酸量为11%。向反应液中依次加入三甲基吡啶(692μl,5.2mmol)和水(19μl,1.1μmol),室温下搅拌2小时。对反应溶液进行了分析,其结果是,被三氟乙酰化的寡聚核酸残余量为0.07%。然后,添加乙腈(15ml),将析出的固体用桐山漏斗抽滤后,进行干燥,作为白色固体获得三聚体ho
‑
gmcmt
‑
suc
‑
tob(103.2mg);m/z(tof
‑
ms):计算值2211.20,实测值2212.23[m+h]
+
。
[0352]
实施例4:四聚体(ho
‑
rcc
f
a
l
t
‑
suc
‑
tob)的合成和脱保护氩气气氛下,向200ml的二口烧瓶中加入ho
‑
t
‑
suc
‑
tob(300mg,242μmol)和piv
‑
tob(450mg,451μmol),加入脱水二氯甲烷(12.1ml)和脱水乙腈(3.6ml)使其溶解。然后,依次加入lna
‑
a(bz)
‑
ce亚磷酰胺(644mg,727μmol)和5
‑
乙硫基
‑
1h
‑
四唑(94.6mg,727μmol),室温下搅拌1.0小时。接着,向反应溶液中加入2,2,2
‑
三氟乙醇(265μl,3.6mmol),室温下搅拌30分钟后,依次加入2,6
‑
二甲基苯胺(506μl,4.1mmol)和ddtt(174mg,848μmol),室温下搅拌1.7小时。然后,依次加入吲哚(424mg,3.6mmol)和三氟乙酸(1.1ml,14.4mmol),室温下搅拌1.0小时。对dmtr工序完成时的反应溶液进行了分析,其结果是,含有1.23%被三氟乙酰化的寡聚核酸。接着,向反应溶液中依次加入吡啶(3.5ml,43.0mmol)和水(180μl),室温
下搅拌1.0小时。对反应溶液进行了分析,其结果是,被三氟乙酰化的寡聚核酸残余量为0.017%。然后,添加乙腈(112ml),将析出的固体用桐山漏斗抽滤后,进行干燥,作为白色固体获得二聚体ho
‑
a
l
t
‑
suc
‑
tob(829.9mg,95%);m/z:计算值1751.07,实测值1753.09[m+h]
+
。
[0353]
氩气气氛下,200ml的二口烧瓶中,向所得的白色固体(829.9mg)中加入脱水二氯甲烷(11.5ml)和脱水乙腈(3.4ml)使其溶解。然后,依次加入2'
‑
f
‑
c(bz)
‑
ce亚磷酰胺(591mg,694μmol)和4,5
‑
二氰基咪唑(83.5mg,707μmol),室温下搅拌1.0小时。接着,向反应溶液中加入2,2,2
‑
三氟乙醇(251μl,3.5mmol),室温下搅拌30分钟后,依次加入2,6
‑
二甲基苯胺(480μl,3.9mmol)和ddtt(165mg,805μmol),室温下搅拌2.0小时。然后,依次加入吲哚(402mg,3.43mmol)和三氟乙酸(1.0ml,13.6mmol),室温下搅拌1.0小时。对dmtr工序完成时的反应溶液进行了分析,其结果是,含有2.74%被三氟乙酰化的寡聚核酸。接着,向反应溶液中依次加入吡啶(3.3ml,40.8mmol)和水(170μl),室温下搅拌1.0小时。对反应溶液进行了分析,其结果是,被三氟乙酰化的寡聚核酸残余量为0.084%。然后,添加乙腈(110ml),将析出的固体用桐山漏斗抽滤后,进行干燥,作为白色固体获得三聚体ho
‑
c
f
a
l
t
‑
suc
‑
tob(780.1mg,83%);m/z:计算值2231.13,实测值1117.07[m+2h]
2+
。
[0354]
氩气气氛下,200ml的二口烧瓶中,向所得的白色固体(718mg)中加入脱水二氯甲烷(8.8ml)和脱水乙腈(2.6ml)使其溶解。然后,依次加入2'
‑
o
‑
tbdms
‑
c(ac)
‑
ce亚磷酰胺(475mg,527μmol)和5
‑
乙硫基
‑
1h
‑
四唑(68.9mg,528μmol),室温下搅拌1.0小时。接着,向反应溶液中加入2,2,2
‑
三氟乙醇(192μl,2.6mmol),室温下搅拌30分钟后,依次加入2,6
‑
二甲基苯胺(366μl,3.0mmol)和ddtt(127mg,619μmol),室温下搅拌1.0小时。然后,依次加入吲哚(307mg,2.6mmol)和三氟乙酸(796μl,10.4mmol),室温下搅拌1.0小时。对dmtr工序完成时的反应溶液进行了分析,其结果是,含有2.73%被三氟乙酰化的寡聚核酸。接着,向反应溶液中依次加入吡啶(2.5ml,31.2mmol)和水(130μl),室温下搅拌1.0小时。对反应溶液进行了分析,其结果是,被三氟乙酰化的寡聚核酸残余量为0.070%。然后,添加乙腈(100ml),将析出的固体用桐山漏斗抽滤后,进行干燥,作为白色固体获得四聚体ho
‑
rcc
f
a
l
t
‑
suc
‑
tob(758.5mg,94%);m/z:计算值2761.27,实测值1382.15[m+2h]
2+
。
[0355]
脱保护将上述中得到的白色固体(10mg)与30重量%氨水(5.0ml)的混合物加入高压釜,在65℃加热4小时后,冷却至室温。利用针头式过滤器(syringe filter)除去反应液中的不溶物后,通过离心蒸发器减压浓缩。然后,将浓缩液冷冻干燥,获得作为目标物的2'
‑
o
‑
(叔丁基二甲基甲硅烷基)
‑
胞苷
‑
3'
‑
硫代磷酰基
‑
2'
‑
氟
‑
胞苷
‑
3'
‑
硫代磷酰基
‑
2'
‑
o,4'
‑
c
‑
亚甲基
‑
腺苷
‑
3'
‑
硫代磷酰基
‑
脱氧胸苷;m/z:计算值1357.24,实测值1356.23[m
‑
h]
‑
。
[0356]
实施例5:三聚体(ho
‑
rcc
f
a
l
(ch2)2‑
suc
‑
tob)的合成和脱保护氩气气氛下,向200ml的二口烧瓶中加入ho
‑
(ch2)2‑
suc
‑
tob(256mg,242μmol)和piv
‑
tob(385mg,386μmol),加入脱水二氯甲烷(12.1ml)和脱水乙腈(3.6ml)使其溶解。然后,依次加入lna
‑
a(bz)
‑
ce亚磷酰胺(644mg,727μmol)和5
‑
乙硫基
‑
1h
‑
四唑(94.7mg,727μmol),室温下搅拌1.0小时。接
着,向反应溶液中加入2,2,2
‑
三氟乙醇(265μl,3.6mmol),室温下搅拌30分钟后,依次加入2,6
‑
二甲基苯胺(506μl,4.1mmol)和ddtt(174mg,848μmol),室温下搅拌1.7小时。然后,依次加入吲哚(424mg,3.6mmol)和三氟乙酸(1.1ml,14.4mmol),室温下搅拌1.0小时。对dmtr工序完成时的反应溶液进行了分析,其结果是,含有1.76%被三氟乙酰化的寡聚核酸。接着,向反应溶液中依次加入吡啶(3.5ml,43.1mmol)和水(180μl),室温下搅拌1.0小时。对反应溶液进行了分析,其结果是,被三氟乙酰化的寡聚核酸残余量为0.015%。然后,添加乙腈(120ml),将析出的固体用桐山漏斗抽滤后,进行干燥,作为白色固体获得ho
‑
a
l
(ch2)2‑
suc
‑
tob(762mg,定量);m/z:计算值1571.01,实测值1572.04[m+h]
+
。
[0357]
氩气气氛下,向200ml的二口烧瓶中加入所得的白色固体(762mg),加入脱水二氯甲烷(12.1ml)和脱水乙腈(3.6ml)使其溶解。然后,依次加入2'
‑
f
‑
c(bz)
‑
ce亚磷酰胺(615mg,724μmol)和4,5
‑
二氰基咪唑(86.2mg,730μmol),室温下搅拌1.0小时。接着,向反应溶液中加入2,2,2
‑
三氟乙醇(264μl,3.6mmol),室温下搅拌30分钟后,依次加入2,6
‑
二甲基苯胺(503μl,4.1mmol)和ddtt(173mg,844μmol),室温下搅拌2.0小时。然后,依次加入吲哚(422mg,3.6mmol)和三氟乙酸(1.1ml,14.3mmol),室温下搅拌1.0小时。对dmtr工序完成时的反应溶液进行了分析,其结果是,含有2.95%被三氟乙酰化的寡聚核酸。接着,向反应溶液中依次加入吡啶(3.5ml,42.8mmol)和水(179μl),室温下搅拌1.0小时。对反应溶液进行了分析,其结果是,被三氟乙酰化的寡聚核酸残余量为0.076%。然后,添加乙腈(120ml),将析出的固体用桐山漏斗抽滤后,进行干燥,作为白色固体获得二聚体ho
‑
c
f
a
l
(ch2)2‑
suc
‑
tob(817.7mg,94%);m/z:计算值2051.0789,实测值1027.05[m+2h]
2+
。
[0358]
氩气气氛下,200ml的二口烧瓶中,向所得的白色固体(640mg)中加入脱水二氯甲烷(8.8ml)和脱水乙腈(2.6ml)使其溶解。然后,依次加入2'
‑
o
‑
tbdms
‑
c(ac)
‑
ce亚磷酰胺(476mg,528μmol)和5
‑
乙硫基
‑
1h
‑
四唑(68.5mg,527μmol),室温下搅拌1.0小时。接着,向反应溶液中加入2,2,2
‑
三氟乙醇(192μl,2.6mmol),室温下搅拌30分钟后,依次加入2,6
‑
二甲基苯胺(367μl,2.9mmol)和ddtt(126mg,613μmol),室温下搅拌1小时。然后,依次加入吲哚(308mg,2.6mmol)和三氟乙酸(797μl,10.4mmol),室温下搅拌1.0小时。对dmtr工序完成时的反应溶液进行了分析,其结果是,含有2.79%被三氟乙酰化的寡聚核酸。接着,向反应溶液中依次加入吡啶(2.5ml,31.2mmol)和水(130μl),室温下搅拌1.0小时。对反应溶液进行了分析,其结果是,被三氟乙酰化的寡聚核酸残余量为0.051%。然后,添加乙腈(100ml),将析出的固体用桐山漏斗抽滤后,进行干燥,作为白色固体获得三聚体ho
‑
rcc
f
a
l
(ch2)2‑
suc
‑
tob(690.6mg,95%);m/z:计算值2581.22,实测值1292.11[m+2h]
2+
。
[0359]
脱保护将上述中得到的白色固体(10mg)与30重量%氨水(5.0ml)的混合物加入高压釜,在65℃加热4小时后,冷却至室温。利用针头式过滤器(syringe filter)除去反应液中的不溶物后,通过离心蒸发器减压浓缩。然后,将浓缩液冷冻干燥,获得作为目标物的2'
‑
o
‑
(叔丁基二甲基甲硅烷基)
‑
胞苷
‑
3'
‑
硫代磷酰基
‑
2'
‑
氟
‑
胞苷
‑
3'
‑
硫代磷酰基
‑
2'
‑
o,4'
‑
c
‑
亚甲基
‑
腺苷
‑
3'
‑
硫代磷酰基
‑
乙醇;m/z:计算值1177.18,实测值1176.18[m
‑
h]
‑
。
[0360]
实施例6:使用h
‑
膦酸酯的二聚体的合成氩气气氛下,向50ml的二口烧瓶中加入ho
‑
t
‑
suc
‑
tob(100mg,80.8μmol)和dt
‑
h
‑
膦酸酯tea盐(115.7mg,163μmol),加入脱水二氯甲烷(2.0ml)和脱水吡啶(2.0ml)使其溶解。然后,加入pivcl(29.5μl,242μmol),室温下搅拌2.0小时。然后,添加乙腈(30ml),将析出的固体用桐山漏斗抽滤后,进行干燥,获得白色固体(133mg)。氩气气氛下,将所得的固体加入50ml的二口烧瓶中,加入脱水二氯甲烷(3.6ml)和脱水乙腈(1.1ml)使其溶解。然后,依次加入吲哚(42.5mg,363μmol)和三氟乙酸(66.7μl,871μmol),室温下搅拌1.0小时。接着,向反应溶液中依次加入吡啶(211μl,2.6mmol)和水(47μl),室温下搅拌1.0小时。然后,添加乙腈(30ml),将析出的固体用桐山漏斗抽滤后,进行干燥,作为白色固体获得二聚体ho
‑
t
h
t
‑
suc
‑
tob(82.2mg,74%);m/z:计算值1525.03,实测值1526.05[m+h]
+
。
[0361]
氩气气氛下,向50ml的二口烧瓶中加入ho
‑
t
‑
suc
‑
tob(99.1mg,80.0μmol)和dt
‑
h
‑
膦酸酯tea盐(115.1mg,162μmol),加入脱水二氯甲烷(2.0ml)和脱水吡啶(2.0ml)使其溶解。然后,加入pivcl(29.5μl,242μmol),室温下搅拌1.0小时。接着,向反应溶液中加入dbu(48.4μl,324μmol)和ddtt(33.3mg,162μmol),室温下搅拌40小时。然后,添加乙腈(30ml),将析出的固体用桐山漏斗抽滤后,进行干燥,获得白色固体。氩气气氛下,将所得的固体加入50ml的二口烧瓶中,加入脱水二氯甲烷(3.9ml)和脱水乙腈(1.2ml)使其溶解。然后,依次加入吲哚(45.6mg,389μmol)和三氟乙酸(71.6μl,910μmol),室温下搅拌1.0小时。接着,向反应溶液中依次加入吡啶(226μl,2.8mmol)和水(51μl),室温下搅拌1.0小时。然后,添加乙腈(30ml),将析出的固体用桐山漏斗抽滤后,进行干燥,作为白色固体获得二聚体ho
‑
t
oh
t
‑
suc
‑
tob(107.3mg,89%);m/z:计算值1541.03,实测值1542.04[m+h]
+
。
[0362]
实施例7:采用三氯乙酸的实验氩气气氛下,向50ml的二口烧瓶中加入ho
‑
um
‑
suc
‑
tob(102.4mg,81.7μmol)和piv
‑
tob(105mg,105μmol),加入脱水二氯甲烷(4.0ml)和脱水乙腈(1.2ml)使其溶解。然后,依次加入dg
‑
ce亚磷酰胺(135.1mg,161μmol)和5
‑
乙硫基
‑
1h
‑
四唑(21.4mg,164μmol),室温下搅拌1.0小时。接着,向反应溶液中加入2,2,2
‑
三氟乙醇(58.1μl,797μmol),室温下搅拌30分钟后,依次加入2,6
‑
二甲基苯胺(118μl,955μmol)和ddtt(40.9mg,199μmol),室温下搅拌1.0小时。然后,依次加入吲哚(93.6mg,799μmol)和三氟乙酸(698mg,4.27mmol),室温下搅拌1.0小时。接着,向反应溶液中依次加入吡啶(1.01ml,12.6mmol)和水(66μl),室温下搅拌1.0小时。然后,添加乙腈(42ml),将析出的固体用桐山漏斗抽滤后,进行干燥,作为白色固体获得二聚体ho
‑
gum
‑
suc
‑
tob(241.5mg);m/z:计算值1721.07,实测值1723.10[m+h]
+
。
[0363]
实施例8:采用二氯乙酸的实验氩气气氛下,向50ml的二口烧瓶中加入ho
‑
um
‑
suc
‑
tob(99.6mg,79.4μmol)和piv
‑
tob(97.9mg,98.0μmol),加入脱水二氯甲烷(4.0ml)和脱水乙腈(1.2ml)使其溶解。然后,依次加入dg
‑
ce亚磷酰胺(134.2mg,160μmol)和5
‑
乙硫基
‑
1h
‑
四唑(20.9mg,161μmol),室温下搅拌1.0小时。接着,向反应溶液中加入2,2,2
‑
三氟乙醇(58.1μl,797μmol),室温下搅拌30分钟后,依次加入2,6
‑
二甲基苯胺(118μl,955μmol)和ddtt(40.9mg,199μmol),室温下搅拌
1.0小时。然后,依次加入吲哚(93.2mg,796μmol)和二氯乙酸(478μl,5.78mmol),室温下搅拌1.0小时。接着,向反应溶液中依次加入吡啶(1.40ml,17.4mmol)和水(61μl),室温下搅拌1.0小时。然后,添加乙腈(40ml),将析出的固体用桐山漏斗抽滤后,进行干燥,作为白色固体获得二聚体ho
‑
gum
‑
suc
‑
tob(228.7mg,96%);m/z:计算值1721.07,实测值1723.10[m+h]
+
。
[0364]
工业上的可利用性根据本发明的寡核苷酸的制造方法,可使缩合反应完全进行而提高缩合收率,显著减少1碱基缺失体(n
‑
1mer)等杂质。利用本发明的制造方法得到的寡核苷酸可用于人体用或动物用的药品(rna、dna、寡聚核酸药物等)、功能性食品、特定保健用食品、食品、化工产品、生物体用或工业用的高分子材料等各种用途。
[0365]
本技术以在日本提出申请的日本特愿2019
‑
025605为基础,引用其全部内容纳入本说明书中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1