肽化合物的制造方法、保护基形成用试药及稠合多环芳香族烃化合物与流程
1.本发明涉及一种肽化合物的制造方法、保护基形成用试药及稠合多环芳香族烃化合物。
背景技术:
2.作为肽的制造方法,迄今为止大致分为固相法和液相法。
3.固相法在仅通过清洗树脂来进行反应后的单离及纯化的方面而言较为有利。但是,固相法本质上为非均相的反应,且存在为了弥补低反应性而需要过量使用反应试剂或试药,或者在追踪反应及载于载体的状态下难以分析反应产物等问题点。
4.另一方面,液相法具有反应性也良好且在稠合反应之后通过抽取清洗、单离等来进行中间体肽的纯化等优点。但是,液相法存在如下问题,即,在偶联反应及脱保护的各工序中,为了去除残留试药及副产物,需要进行基于非极性有机溶剂及酸性或碱性水溶液的抽取清洗工序或者结晶化等单离纯化工序等制造工序复杂的问题。
5.并且,作为以往的保护基形成用试药,已知有专利文献1中所记载的烷氧基取代苯甲醇化合物。
6.专利文献1:国际公开第2007/034812号
技术实现要素:
7.发明要解决的技术课题
8.本发明的一实施方式所要解决的课题为提供一种产率优异的肽化合物的制造方法。
9.并且,本发明的另一实施方式所要解决的课题为提供一种产率优异的保护基形成用试药。
10.并且,本发明的又一实施方式所要解决的课题为提供一种新颖的稠合多环芳香族烃化合物。
11.用于解决技术课题的手段
12.用于解决上述课题的方法包含以下方式。
13.<1>一种肽化合物的制造方法,其包括使用下述式(1)所表示的稠合多环芳香族烃化合物的工序。
14.[化学式1]
[0015][0016]
式(1)中,环a表示稠合多环芳香族烃环,y
a
分别独立地表示
‑
ch2oh、
‑
ch2nhr、
‑
ch2sh或
‑
ch2x0,r表示氢原子、烷基或芳烷基,x0表示cl、br或i,k表示1~5的整数,n表示1或
2,r
a
分别独立地为脂肪族烃基或具有脂肪族烃基的有机基团,至少一个r
a
所具有的至少一个脂肪族烃基的碳原子数为12以上,环a除了y
a
及r
a
以外还可以具有取代基。
[0017]
<2>如<1>所述的肽化合物的制造方法,其中,使用上述式(1)所表示的稠合多环芳香族烃化合物的工序为通过上述式(1)所表示的稠合多环芳香族烃化合物来保护氨基酸化合物或肽化合物的羧基或酰胺基的c末端保护工序。
[0018]
<3>如<2>所述的肽化合物的制造方法,其中,上述c末端保护工序中的氨基酸化合物或肽化合物为n末端被保护的氨基酸化合物或n末端被保护的肽化合物。
[0019]
<4>如<3>所述的肽化合物的制造方法,其还包括:
[0020]
n末端脱保护工序,对在上述c末端保护工序中所获得的n末端被保护且c末端被保护的氨基酸化合物或n末端被保护且c末端被保护的肽化合物的n末端进行脱保护;及
[0021]
肽链延伸工序,使n末端被保护的氨基酸化合物或n末端被保护的肽化合物稠合至在上述n末端脱保护工序中所获得的c末端被保护的氨基酸化合物或c末端被保护的肽化合物的n末端中。
[0022]
<5>如<4>所述的肽化合物的制造方法,其还包括沉淀工序,使在上述肽链延伸工序中所获得的n末端被保护且c末端被保护的肽化合物沉淀。
[0023]
<6>如<5>所述的肽化合物的制造方法,其在上述沉淀工序之后,依次还包括1次以上的如下工序:
[0024]
对所获得的n末端被保护且c末端被保护的肽化合物的n末端进行脱保护的工序;
[0025]
使n末端被保护的氨基酸化合物或n末端被保护的肽化合物稠合至所获得的c末端被保护的肽化合物的n末端中的工序;及
[0026]
沉淀所获得的n末端被保护且c末端被保护的肽化合物的工序。
[0027]
<7>如<1>~<6>中任一项所述的肽化合物的制造方法,其还包括对c末端保护基进行脱保护的c末端脱保护工序。
[0028]
<8>如<1>~<7>中任一项所述的肽化合物的制造方法,其中,上述环a为萘环。
[0029]
<9>如<1>~<8>中任一项所述的肽化合物的制造方法,其中,所有r
a
所具有的所有脂肪族烃基的总碳原子数为36~80。
[0030]
<10>如<1>~<9>中任一项所述的肽化合物的制造方法,其中,上述式(1)所表示的稠合多环芳香族烃化合物为下述式(10)~式(30)中的任一个所表示的化合物。
[0031]
[化学式2]
[0032]
[0033]
式(10)、式(20)及式(30)中,y
a
分别独立地表示
‑
ch2oh、
‑
ch2nhr、
‑
ch2sh或
‑
ch2x0,r表示氢原子、烷基或芳烷基,x0表示cl、br或i,r
a
分别独立地为脂肪族烃基或具有脂肪族烃基的有机基团,至少一个r
a
所具有的至少一个脂肪族烃基的碳原子数为12以上,r
s
分别独立地表示取代基,n10表示0~6的整数,n20、n21及n30分别独立地表示0~5的整数。
[0034]
<11>如<10>所述的肽化合物的制造方法,其中,上述式(10)、式(20)或式(30)中的r
a
分别独立地为下述式(f1)或式(a1)所表示的基团。
[0035]
[化学式3]
[0036][0037]
式(f1)中,波浪线部分表示与萘环的键合位置,m9表示1~3的整数,x9分别独立地表示单键、
‑
o
‑
、
‑
s
‑
、
‑
coo
‑
、
‑
oco
‑
、
‑
oconh
‑
、
‑
nhconh
‑
、
‑
nhco
‑
或
‑
conh
‑
,r9分别独立地表示二价的脂肪族烃基,ar1表示(m10+1)价的芳香族基或(m10+1)价的杂芳族基团,m10表示1~3的整数,x
10
分别独立地表示单键、
‑
o
‑
、
‑
s
‑
、
‑
coo
‑
、
‑
oco
‑
、
‑
oconh
‑
、
‑
nhconh
‑
、
‑
nhco
‑
或
‑
conh
‑
,r
10
分别独立地表示碳原子数5以上的一价的脂肪族烃基。
[0038]
[化学式4]
[0039][0040]
式(a1)中,波浪线部分表示与萘环的键合位置,m20表示1~10的整数,x
20
分别独立地表示单键、
‑
o
‑
、
‑
s
‑
、
‑
coo
‑
、
‑
oco
‑
、
‑
oconh
‑
、
‑
nhconh
‑
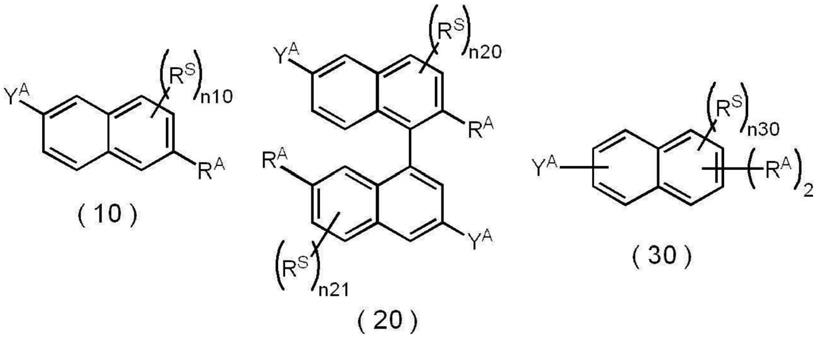
、
‑
nhco
‑
或
‑
conh
‑
,r
20
分别独立地表示二价的脂肪族烃基。
[0041]
<12>如<11>所述的肽化合物的制造方法,其中,上述式(f1)所表示的基团为下述式(f2)所表示的基团。
[0042]
[化学式5]
[0043][0044]
式(f2)中,波浪线部分表示与萘环的键合位置,m10表示1~3的整数,m11表示1~3的整数,x
10
分别独立地表示单键、
‑
o
‑
、
‑
s
‑
、
‑
coo
‑
、
‑
oco
‑
、
‑
oconh
‑
、
‑
nhconh
‑
、
‑
nhco
‑
或
‑
conh
‑
,r
10
分别独立地表示碳原子数5以上的一价的脂肪族烃基。
[0045]
<13>如<11>所述的肽化合物的制造方法,其中,上述式(a1)中的与萘环键合的x
20
为
‑
o
‑
。
[0046]
<14>一种保护基形成用试药,其包含下述式(1)所表示的稠合多环芳香族烃化合物。
[0047]
[化学式6]
[0048]
[0049]
式(1)中,环a表示稠合多环芳香族烃环,y
a
分别独立地表示
‑
ch2oh、
‑
ch2nhr、
‑
ch2sh或
‑
ch2x0,r表示氢原子、烷基或芳烷基,x0表示cl、br或i,k表示1~5的整数,n表示1或2,r
a
分别独立地为脂肪族烃基或具有脂肪族烃基的有机基团,至少一个r
a
所具有的至少一个脂肪族烃基的碳原子数为12以上,环a除了y
a
及r
a
以外还可以具有取代基。
[0050]
<15>如<14>所述的保护基形成用试药,其中,上述保护基形成用试药为用于形成羧基或酰胺基的保护基的试药。
[0051]
<16>如<14>或<15>所述的保护基形成用试药,其中,上述保护基形成用试药为用于形成氨基酸化合物或肽化合物的c末端保护基的试药。
[0052]
<17>一种稠合多环芳香族烃化合物,其由下述式(1a)表示。
[0053]
[化学式7]
[0054][0055]
式(1a)中,环a表示稠合多环芳香族烃环,y
a
分别独立地表示
‑
ch2oh、
‑
ch2nhr、
‑
ch2sh或
‑
ch2x0,r表示氢原子、烷基或芳烷基,x0表示cl、br或i,k表示1~5的整数,n表示1或2,r
a
分别独立地为脂肪族烃基或具有脂肪族烃基的有机基团,至少一个r
a
所具有的至少一个脂肪族烃基的碳原子数为18以上,环a除了y
a
及r
a
以外还可以具有取代基。
[0056]
<18>如<17>所述的稠合多环芳香族烃化合物,其中,上述环a为萘环。
[0057]
<19>如<17>或<18>所述的稠合多环芳香族烃化合物,其中,所有r
a
所具有的所有脂肪族烃基的总碳原子数为36~80。
[0058]
<20>如<17>~<19>中任一项所述的稠合多环芳香族烃化合物,其中,上述式(1a)所表示的稠合多环芳香族烃化合物为下述式(10a)~式(30a)中的任一个所表示的化合物。
[0059]
[化学式8]
[0060][0061]
式(10a)、式(20a)及式(30a)中,y
a
分别独立地表示
‑
ch2oh、
‑
ch2nhr、
‑
ch2sh或
‑
ch2x0,r表示氢原子、烷基或芳烷基,x0表示cl、br或i,r
a
分别独立地为脂肪族烃基或具有脂肪族烃基的有机基团,至少一个r
a
所具有的至少一个脂肪族烃基的碳原子数为18以上,r
s
分别独立地表示取代基,n10表示0~6的整数,n20、n21及n30分别独立地表示0~5的整数。
[0062]
<21>如<20>所述的稠合多环芳香族烃化合物,其中,上述式(10a)、式(20a)或式
(30a)中的r
a
分别独立地为下述式(f1)或式(a1)所表示的基团。
[0063]
[化学式9]
[0064][0065]
式(f1)中,波浪线部分表示与萘环的键合位置,m9表示1~3的整数,x9分别独立地表示单键、
‑
o
‑
、
‑
s
‑
、
‑
coo
‑
、
‑
oco
‑
、
‑
oconh
‑
、
‑
nhconh
‑
、
‑
nhco
‑
或
‑
conh
‑
,r9分别独立地表示二价的脂肪族烃基,ar1表示(m10+1)价的芳香族基或(m10+1)价的杂芳族基团,m10表示1~3的整数,x
10
分别独立地表示单键、
‑
o
‑
、
‑
s
‑
、
‑
coo
‑
、
‑
oco
‑
、
‑
oconh
‑
、
‑
nhconh
‑
、
‑
nhco
‑
或
‑
conh
‑
,r
10
分别独立地表示碳原子数5以上的一价的脂肪族烃基。
[0066]
[化学式10]
[0067][0068]
式(a1)中,波浪线部分表示与萘环的键合位置,m20表示1~10的整数,x
20
分别独立地表示单键、
‑
o
‑
、
‑
s
‑
、
‑
coo
‑
、
‑
oco
‑
、
‑
oconh
‑
、
‑
nhconh
‑
、
‑
nhco
‑
或
‑
conh
‑
,r
20
分别独立地表示二价的脂肪族烃基。
[0069]
<22>如<21>所述的稠合多环芳香族烃化合物,其中,上述式(f1)所表示的基团为下述式(f2)所表示的基团。
[0070]
[化学式11]
[0071][0072]
式(f2)中,波浪线部分表示与萘环的键合位置,m10表示1~3的整数,m11表示1~3的整数,x
10
分别独立地表示单键、
‑
o
‑
、
‑
s
‑
、
‑
coo
‑
、
‑
oco
‑
、
‑
oconh
‑
、
‑
nhconh
‑
、
‑
nhco
‑
或
‑
conh
‑
,r
10
分别独立地表示碳原子数5以上的一价的脂肪族烃基。
[0073]
<23>如<21>所述的稠合多环芳香族烃化合物,其中,上述式(a1)中的与萘环键合的x
20
为
‑
o
‑
。
[0074]
发明效果
[0075]
根据本发明的一实施方式,能够提供一种产率优异的肽化合物的制造方法。
[0076]
并且,根据本发明的另一实施方式,能够提供一种产率优异的保护基形成用试药。
[0077]
并且,根据本发明的又一实施方式,能够提供一种新颖的稠合多环芳香族烃化合物。
具体实施方式
[0078]
以下,对本发明的内容进行详细地说明。以下所记载的构成要件的说明有时基于本发明的代表性实施方式来进行,但是本发明并不限定于这些实施方式。
[0079]
并且,在本说明书中,使用“~”所表示的数值范围是指将“~”前后所记载的数值作为下限值及上限值而包含的范围。
[0080]
在本说明书中阶段性记载的数值范围中,一个数值范围内所记载的上限值或下限值可以替换成其他阶段性记载的数值范围内的上限值或下限值。并且,在本说明书中所记载的数值范围中,其数值范围的上限值或下限值可以替换成实施例中所示的值。
[0081]
在本说明书中“工序”的术语不仅为独立的工序,而且即使在无法与其他工序明确区分的情况下,只要实现工序的所期望的目的,则也包含在本术语中。
[0082]
在本说明书中的基团(原子团)的标记中,未标有经取代及未经取代的标记包含不具有取代基的基团,并且还包含具有取代基的基团。例如,“烷基”不仅包含不具有取代基的烷基(未经取代烷基),还包含具有取代基的烷基(取代烷基)。
[0083]
并且,本说明书中的化学结构式有时记载为省略了氢原子的简化结构式。
[0084]
在本发明中,“质量%”与“重量%”的含义相同,且“质量份”与“重量份”的含义相同。
[0085]
并且,在本发明中,2个以上的优选方式的组合为更优选方式。
[0086]
(肽化合物的制造方法)
[0087]
本发明所涉及的肽化合物的制造方法包括使用下述式(1)所表示的稠合多环芳香族烃化合物(以下,也称为式(1)所表示的化合物。)的工序。
[0088]
[化学式12]
[0089][0090]
式(1)中,环a表示稠合多环芳香族烃环,y
a
分别独立地表示
‑
ch2oh、
‑
ch2nhr、
‑
ch2sh或
‑
ch2x0,r表示氢原子、烷基或芳烷基,x0表示cl、br或i,k表示1~5的整数,n表示1或2,r
a
分别独立地为脂肪族烃基或具有脂肪族烃基的有机基团,至少一个r
a
所具有的至少一个脂肪族烃基的碳原子数为12以上,环a除了y
a
及r
a
以外还可以具有取代基。
[0091]
关于本发明所涉及的式(1)所表示的化合物,至少一个r
a
所具有的至少一个脂肪族烃基的碳原子数为12以上,因此被式(1)保护的化合物在疏水性的溶剂溶解性方面优异。而且,对于亲水性溶剂,各r
a
中的脂肪族烃基彼此凝聚或通过具有稠合多环芳香族烃环而产生基于稠合多环芳香族烃环彼此的π
‑
π相互作用(π
‑
π堆叠),从而结晶性优异且纯化及可分离性也优异。换言之,在将被式(1)保护的化合物提供给反应的情况下,对作为反应溶剂的疏水性溶剂的溶剂溶解性优异,因此反应迅速进行且通过在纯化时添加作为不良溶剂的极性溶剂而目标物有效地被结晶纯化,因此推测所获得的化合物(肽化合物等)的产率优异。
[0092]
上述效果在至少一个r
a
所具有的至少一个脂肪族烃基的碳原子数为18以上时发挥更加优异的效果。推测其原因是因为,由于碳原子数增加而使疏水性在分子整体中所占的贡献率变大,从而变得容易溶解于疏水性溶剂中,并且对于亲水性溶剂,通过碳原子数增加而凝聚力进一步增加,从而变得容易进行结晶。
[0093]
并且,通过具有与稠合多环芳香族烃环键合的y
a
,本发明所涉及的式(1)所表示的化合物的脱保护速度比以往的苯甲醇型保护基形成用试药更优异。推测这是因为,稠合多环芳香族烃环的电子供应性比苯甲醇更优异。根据本发明所涉及的式(1)所表示的化合物,
在保留氨基酸侧链的保护基的状态下,仅对c末端保护基进行选择性地脱保护、即变得能够与各氨基酸的侧链保护基进行分离。也能够利用于使长链肽的片段与被脱保护的c末端进行稠合反应等后续反应中。并且,在为对强酸不稳定的肽的情况下,能够抑制肽链的分解,且也有助于提高产率。并且,通过在酸中的脱保护速度优异,从而适合于对酸不稳定的肽的合成。
[0094]
以下,对本发明所涉及的肽化合物的制造方法进行详细地说明。
[0095]
在本发明所涉及的肽化合物的制造方法中,式(1)所表示的稠合多环芳香族烃化合物不仅用于保护基的形成,而且也能够用于肽化合物的改性、对水或有机溶剂等的溶解度的调整、结晶化性的改良及多聚体化等。
[0096]
其中,式(1)所表示的稠合多环芳香族烃化合物优选用于保护基的形成,更优选用于氨基酸化合物或肽化合物中的c末端保护基的形成。
[0097]
<式(1)所表示的稠合多环芳香族烃化合物>
[0098]
将本发明所涉及的式(1)所表示的稠合多环芳香族烃化合物示于以下。
[0099]
[化学式13]
[0100][0101]
式(1)中,环a、y
a
、r
a
、n及k与上述含义相同。
[0102]
式(1)中的环a表示2环以上的芳香族烃环稠合而成的稠合多环芳香族烃环,并且环a除了y
a
及r
a
以外还可以具有取代基。
[0103]
从脱保护速度、结晶性及产率的观点考虑,环a优选2环~4环的稠合多环芳香族烃环,更优选2环或3环的稠合多环芳香族烃环,尤其优选2环的稠合多环芳香族烃环。
[0104]
其中,从脱保护速度、结晶性及产率的观点考虑,环a优选萘环、蒽环、菲环、并四苯环、三亚苯环、芘环或环,更优选萘环、蒽环或菲环,尤其优选萘环。
[0105]
并且,从产率的观点考虑,环a优选至少具有苯环的2环稠合而获得的结构(萘环结构)的环。
[0106]
而且,环a可以具有取代基,如后述,也可以2个以上的取代基键合而形成环结构,还可以为使脂肪族烃环、脂肪族杂环及杂芳香环等进一步与环a稠合而获得的结构。
[0107]
从脱保护速度、溶剂溶解性及产率的观点考虑,式(1)中的y
a
分别独立地优选
‑
ch2oh、
‑
ch2nhr或
‑
ch2sh,更优选
‑
ch2oh或
‑
ch2nhr,尤其优选
‑
ch2oh。并且,从设为温和的反应条件的观点考虑,y
a
优选
‑
ch2oh或
‑
ch2sh,更优选
‑
ch2oh。
[0108]
并且,在式(1)中,在具有两个y
a
的情况下,优选两个y
a
为相同的基团。
[0109]
式(1)中的n优选1。
[0110]
作为r中的烷基,可以举出碳原子数1~30的烷基,优选碳原子数1~10的烷基,更优选碳原子数1~6的烷基。作为优选的具体例,可以举出甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、戊基及己基等,可以更优选地举出甲基及乙基。
[0111]
作为r中的芳烷基(也称为“芳基烷基”。),可以举出碳原子数7~30的芳烷基,优选碳原子数7~20的芳烷基,可以更优选地举出碳原子数7~16的芳烷基(例如,使碳原子数1
~6的亚烷基与碳原子数6~10的芳基键合而成的基团)。作为优选的具体例,可以举出苄基、1
‑
苯基乙基、2
‑
苯基乙基、1
‑
苯基丙基、萘基甲基、1
‑
萘基乙基及1
‑
萘基丙基等,可以更优选地举出苄基。
[0112]
其中,r优选氢原子、碳原子数1~6的烷基或碳原子数7~16的芳烷基,更优选氢原子、甲基、乙基或苄基,进一步优选氢原子。
[0113]
并且,作为在环a上所具有的上述取代基或r
a
,式(1)所表示的化合物可以具备具有环a、y
a
及r
a
的基团或具有环a及y
a
的基团。即,式(1)所表示的化合物可以为二聚体等多聚体。从合成容易度的观点考虑,作为多聚体,优选二聚体~六聚体,更优选二聚体~四聚体,尤其优选二聚体。
[0114]
从脱保护速度、溶剂溶解性及产率的观点考虑,作为式(1)中的环a上的r
a
的取代数的k优选1~4的整数,更优选1~3的整数,尤其优选1或2。
[0115]
r
a
分别独立地为脂肪族烃基或具有脂肪族烃基的有机基团,至少一个r
a
所具有的至少一个脂肪族烃基的碳原子数为12以上。
[0116]“脂肪族烃基”为直链、支链状或环状饱和或不饱和的脂肪族烃基,优选碳原子数5以上的脂肪族烃基,更优选碳原子数5~60的脂肪族烃基,进一步优选碳原子数5~30的脂肪族烃基,尤其优选碳原子数10~30的脂肪族烃基。
[0117]
本说明书中,r
a
中的“具有脂肪族烃基的有机基团”为在其分子结构中具有脂肪族烃基的一价(具有一个与环a键合的键合键)的有机基团。
[0118]“具有脂肪族烃基的有机基团”中的“脂肪族烃基”的部位并无特别限定,可以存在于末端(1价基团),也可以存在于除此以外的部位(例如,二价基团)。
[0119]
作为“脂肪族烃基”,可以举出烷基、环烷基、烯基及炔基等,
[0120]
具体而言,可以举出甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、己基、辛基、癸基、月桂基、十三烷基、肉豆蔻基、鲸蜡基、硬脂基、芳烷基、二十二烷基、油烯基及异硬脂基等一价的基团及从它们衍生的二价的基团(从上述一价的基团去除一个氢原子而获得的二价的基团)或从各种甾基(steroid)去除羟基等而获得的基团等。
[0121]
作为“烷基”,例如,优选碳原子数1~6的烷基等,例如可以举出甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基及己基等。
[0122]
作为“环烷基”,例如,优选碳原子数3~6的环烷基等,例如可以举出环丙基、环丁基、环戊基及环己基。并且,这些可以重复连结。
[0123]
作为“烯基”,例如,优选碳原子数2~6的烯基等,例如可以举出乙烯基、1
‑
丙烯基、烯丙基、异丙烯基、丁烯基及异丁烯基等。
[0124]
作为“炔基”,例如,优选碳原子数2~6的炔基等,例如可以举出乙炔基、炔丙基及1
‑
丙炔基等。
[0125]
作为“甾基”,例如,优选胆固醇或雌二醇等。
[0126]
上述取代基可以进一步经具有甲硅烷基、硅烷氧基结构的烃基及具有全氟烷基结构的有机基团取代。
[0127]
作为上述甲硅烷基,优选三烷基甲硅烷基,更优选具有三个碳原子数1~3的烷基的甲硅烷基。
[0128]
作为上述具有硅烷氧基结构的烃基中的硅烷氧基结构,优选三烷基硅烷氧基结
构,更优选具有三个碳原子数1~3的烷基的硅烷氧基结构。
[0129]
并且,上述具有硅烷氧基结构的烃基优选具有1~3个硅烷氧基结构。
[0130]
而且,上述具有硅烷氧基结构的烃基的碳原子数优选10以上,更优选10~100,尤其优选16~50。
[0131]
作为上述具有硅烷氧基结构的烃基,可以优选地举出下述式(si)所表示的基团。
[0132]
[化学式14]
[0133][0134]
式(si)中,r
si1
表示单键或碳原子数1~3的亚烷基,r
si2
表示碳原子数1~3的亚烷基,r
si3
及r
si4
分别独立地表示氢原子、碳原子数1~6的烷基或
‑
osir
si5
r
si6
r
si7
,r
si5
~r
si7
分别独立地表示碳原子数1~6的烷基或芳基。
[0135]
式(si)中的r
si5
~r
si7
分别独立地优选碳原子数1~6的烷基或苯基,更优选碳原子数1~6的烷基,尤其为优选碳原子数1~4的直链或支链烷基。
[0136]
上述具有全氟烷基结构的有机基团中的全氟烷基结构优选碳原子数1~20的全氟烷基结构,更优选碳原子数5~20的全氟烷基结构,尤其优选碳原子数7~16的全氟烷基结构。并且,上述全氟烷基结构可以为直链状,也可以具有支链,还可以具有环结构。
[0137]
上述具有全氟烷基结构的有机基团优选全氟烷基、具有全氟烷基结构的烷基或在全氟烷基结构及烷链中具有酰胺键的烷基。
[0138]
上述具有全氟烷基结构的有机基团的碳原子数优选5以上,更优选10以上,进一步优选10~100,尤其优选16~50。
[0139]
作为上述具有全氟烷基结构的有机基团,例如可以优选地举出下述所示的基团。
[0140]
[化学式15]
[0141][0142]“具有脂肪族烃基的有机基团”中的除了“脂肪族烃基”以外的部位能够任意地设定。例如可以具有
‑
o
‑
、
‑
s
‑
、
‑
coo
‑
、
‑
oconh
‑
、
‑
conh
‑
及除了“脂肪族烃基”以外的烃基(一价
的基团或二价的基团)等部位。
[0143]
作为除了“脂肪族烃基”以外的“烃基”,例如可以举出芳香族烃基等,具体而言,例如可以使用芳基等一价的基团及从它们衍生的二价的基团。
[0144]“芳基”例如优选碳原子数6~14的芳基等,例如可以举出苯基、1
‑
萘基、2
‑
萘基、联苯基及2
‑
蒽基(anthryl)等。其中,更优选碳原子数6~10的芳基,尤其优选苯基。
[0145]
并且,上述脂肪族烃基及除了上述脂肪族烃基以外的烃基可以经选自卤素原子(氯原子、溴原子、氟原子、碘原子)、氧代基等的取代基取代。
[0146]“具有脂肪族烃基的有机基团”与环a的键合(取代)可以经由存在于上述r
a
中的“脂肪族烃基”或上述“烃基”即直接碳
‑
碳键合,也可以经由存在于上述r
a
中的
‑
o
‑
、
‑
s
‑
、
‑
coo
‑
、
‑
oconh
‑
、
‑
conh
‑
等部位。优选,从化合物的合成容易度的观点考虑,优选经由
‑
o
‑
、
‑
s
‑
、
‑
coo
‑
或
‑
conh
‑
,尤其优选经由
‑
o
‑
。
[0147]
在本发明所涉及的式(1)所表示的化合物中,从溶剂溶解性、结晶性及产率的观点考虑,所有r
a
所具有的所有脂肪族烃基的总碳原子数优选24以上,更优选24~200,进一步优选32~100,尤其优选34~80,最优选36~80。
[0148]
并且,本发明所涉及的式(1)所表示的化合物为在至少一个r
a
中具有至少一个碳原子数12以上的脂肪族烃基的化合物,从溶剂溶解性、结晶性及产率的观点考虑,在至少一个r
a
中优选具有至少一个碳原子数12~100的脂肪族烃基的化合物,更优选具有至少一个碳原子数18~40的脂肪族烃基的化合物,进一步优选具有至少一个碳原子数20~36的脂肪族烃基的化合物。
[0149]
而且,从结晶性及产率的观点考虑,上述脂肪族烃基优选烷基,更优选直链烷基。
[0150]
并且,从溶剂溶解性、结晶性及产率的观点考虑,一个r
a
的碳原子数分别独立地优选12~200,更优选18~150,进一步优选18~100,尤其优选20~80。
[0151]
在式(1)中,从溶剂溶解性、结晶性及产率的观点考虑,至少一个r
a
优选下述式(f1)、式(a1)、式(b1)或式(e1)中的任一个所表示的基团,更优选下述式(f1)或式(a1)所表示的基团,尤其优选下述式(f1)所表示的基团。
[0152]
[化学式16]
[0153][0154]
式(f1)中,波浪线部分表示与萘环的键合位置,m9表示1~3的整数,x9分别独立地表示单键、
‑
o
‑
、
‑
s
‑
、
‑
coo
‑
、
‑
oco
‑
、
‑
oconh
‑
、
‑
nhconh
‑
、
‑
nhco
‑
或
‑
conh
‑
,r9分别独立地表示二价的脂肪族烃基,ar1表示(m10+1)价的芳香族基或(m10+1)价的杂芳族基团,m10表示1~3的整数,x
10
分别独立地表示单键、
‑
o
‑
、
‑
s
‑
、
‑
coo
‑
、
‑
oco
‑
、
‑
oconh
‑
、
‑
nhconh
‑
、
‑
nhco
‑
或
‑
conh
‑
,r
10
分别独立地表示碳原子数5以上的一价的脂肪族烃基。
[0155]
[化学式17]
[0156][0157]
式(a1)中,波浪线部分表示与萘环的键合位置,m20表示1~10的整数,x
20
分别独立地表示单键、
‑
o
‑
、
‑
s
‑
、
‑
coo
‑
、
‑
oco
‑
、
‑
oconh
‑
、
‑
nhconh
‑
、
‑
nhco
‑
或
‑
conh
‑
,r
20
分别独立地表示二价的脂肪族烃基。
[0158]
[化学式18]
[0159][0160]
式(b1)中,波浪线部分表示与环a的键合位置,mb表示1或2,b1~b4分别独立地表示0~2的整数,x
b1
~x
b4
分别独立地表示单键、
‑
o
‑
、
‑
s
‑
、
‑
coo
‑
、
‑
oconh
‑
或
‑
conh
‑
,r
b2
及r
b4
分别独立地表示氢原子、甲基或碳原子数5以上的脂肪族烃基,r
b3
表示碳原子数5以上的脂肪族烃基。
[0161]
[化学式19]
[0162][0163]
式(e1)中,波浪线部分表示与环a的键合位置,x
e1
表示单键、
‑
o
‑
、
‑
s
‑
、
‑
nhco
‑
或
‑
conh
‑
,me表示0~15的整数,e1表示0~11的整数,e2表示0~5的整数,x
e2
分别独立地表示单键、
‑
o
‑
、
‑
s
‑
、
‑
coo
‑
、
‑
oconh
‑
、
‑
nhco
‑
或
‑
conh
‑
,r
e2
分别独立地表示氢原子、甲基、具有碳原子数5以上的脂肪族烃基的有机基团。
[0164]
式(f1)中的m9优选1或2,更优选1。
[0165]
式(f1)中的x9及x
10
分别独立地优选
‑
o
‑
、
‑
s
‑
、
‑
coo
‑
、
‑
oconh
‑
或
‑
conh
‑
,更优选
‑
o
‑
。
[0166]
式(f1)中的r9分别独立地优选碳原子数1~10的亚烷基,更优选碳原子数1~4的亚烷基,尤其优选亚甲基。
[0167]
式(f1)中的r
10
分别独立地优选碳原子数5~60的一价的脂肪族烃基,更优选碳原子数12~50的一价的脂肪族烃基,进一步优选碳原子数18~40的一价的脂肪族烃基,尤其优选碳原子数20~32的一价的脂肪族烃基。并且,r
10
分别独立地优选直链烷基或支链烷基,更优选直链烷基。
[0168]
式(f1)中的m10优选2或3,更优选2。
[0169]
式(f1)中的ar1优选(m10+1)价的芳香族基,更优选从苯去除(m10+1)个氢原子而获得的基团或从萘去除(m10+1)个氢原子而获得的基团,尤其优选从苯去除(m10+1)个氢原子而获得的基团。
[0170]
并且,从溶剂溶解性、结晶性及产率的观点考虑,上述式(f1)所表示的基团优选下述式(f2)所表示的基团。
[0171]
[化学式20]
[0172][0173]
式(f2)中,波浪线部分表示与萘环的键合位置,m10表示1~3的整数,m11表示1~3的整数,x
10
分别独立地表示单键、
‑
o
‑
、
‑
s
‑
、
‑
coo
‑
、
‑
oco
‑
、
‑
oconh
‑
、
‑
nhconh
‑
、
‑
nhco
‑
或
‑
conh
‑
,r
10
分别独立地表示碳原子数5以上的一价的脂肪族烃基。
[0174]
式(f2)中的m10、x
10
及r
10
分别与式(f1)中的m10、x
10
及r
10
的含义相同,优选方式也相同。
[0175]
式(f2)中的m11优选1或2,更优选1。
[0176]
式(a1)中的m20优选1或2,更优选1。
[0177]
式(a1)中的x
20
分别独立地优选
‑
o
‑
、
‑
s
‑
、
‑
coo
‑
、
‑
oconh
‑
或
‑
conh
‑
,更优选
‑
o
‑
。
[0178]
式(a1)中的r
20
优选碳原子数5以上的二价的脂肪族烃基,更优选碳原子数5~60的二价的脂肪族烃基,进一步优选碳原子数8~40的二价的脂肪族烃基,尤其优选碳原子数12~32的二价的脂肪族烃基。并且,r
20
优选直链亚烷基。
[0179]
式(b1)中的mb优选1。
[0180]
式(b1)中的b1~b4分别独立地优选1或2,更优选1。
[0181]
式(b1)中的x
b1
~x
b4
分别独立地优选
‑
o
‑
、
‑
s
‑
、
‑
coo
‑
、
‑
oconh
‑
或
‑
conh
‑
,更优选
‑
o
‑
。
[0182]
式(b1)中的r
b2
及r
b4
分别独立地优选氢原子、甲基或碳原子数5~60的脂肪族烃基,优选氢原子、甲基或碳原子数8~40的烷基,尤其优选氢原子、甲基或碳原子数12~32的烷基。
[0183]
式(b1)中的r
b3
优选碳原子数5~60的一价的脂肪族烃基,更优选碳原子数5~60的一价的脂肪族烃基,进一步优选碳原子数8~40的一价的脂肪族烃基,尤其优选碳原子数12~32的一价的脂肪族烃基。并且,r
b3
优选直链烷基。
[0184]
并且,关于本发明所涉及的式(1)所表示的化合物,从溶剂溶解性及产率的观点考虑,作为r
a
中的脂肪族烃基,可以优选地举出具有支链的脂肪族烃基,可以更优选地举出以下所示的基团。另外,波浪线部分表示与其他结构的键合位置,nt2表示3以上的整数,nt3表示设定成下述基团的总碳原子数成为14~300的整数。
[0185]
[化学式21]
[0186][0187]
作为式(1)所表示的化合物在环a上可以具有的取代基,并无特别限制,但是可以举出烷氧基、芳氧基、卤素原子、烷基、卤化烷基、芳基、酰基、酰氧基、烷氧基羰基、芳氧基羰基、烷硫基、芳硫基、r
st
‑
co
‑
nr
st
‑
、
‑
con(r
st
)2、二烷基氨基、烷基芳基氨基、二芳基氨基及将这些组合2个以上而获得的基团等。另外,r
st
表示氢原子、烷基或芳基。
[0188]
并且,在式(1)所表示的化合物为多聚体的情况下,作为在环a上可以具有的取代基,可以优选地举出下述式(m)所表示的基团。
[0189]
[化学式22]
[0190][0191]
式(m)中,波浪线部分表示与式(1)中的环a的键合位置,环b表示稠合多环芳香族烃环,y
b
分别独立地表示
‑
ch2oh、
‑
ch2nhr
b
、
‑
ch2sh或
‑
ch2x0,r表示氢原子、烷基或芳烷基,x0表示cl、br、i,kb表示1~5的整数,nb表示1或2,r
b
分别独立地为脂肪族烃基或具有脂肪族烃基的有机基团,至少一个r
b
中的至少一个脂肪族烃基的碳原子数为12以上,环b除了y
b
及r
b
以外还可以具有取代基。
[0192]
式(m)中的环b、y
b
、r
b
、kb、nb及r
b
分别与式(1)中的环a、y
a
、r、k、n及r
a
的含义相同,优选方式也相同。
[0193]
并且,在具有式(m)所表示的基团作为取代基的情况下,式(1)所表示的化合物优
选后述的式(20)所表示的化合物。
[0194]
从脱保护速度、结晶性、溶剂溶解性及产率的观点考虑,上述式(1)所表示的稠合多环芳香族烃化合物优选下述式(10)~式(30)中的任一个所表示的化合物,更优选下述式(10)或式(20)所表示的化合物,尤其优选下述式(10)所表示的化合物。
[0195]
[化学式23]
[0196][0197]
式(10)、式(20)及式(30)中,y
a
分别独立地表示
‑
ch2oh、
‑
ch2nhr、
‑
ch2sh或
‑
ch2x0,r表示氢原子、烷基或芳烷基,x0表示cl、br及i,r
a
分别独立地为脂肪族烃基或具有脂肪族烃基的有机基团,至少一个r
a
中的至少一个脂肪族烃基的碳原子数为12以上,r
s
分别独立地表示取代基,n10表示0~6的整数,n20、n21及n30分别独立地表示0~5的整数。
[0198]
式(10)、式(20)或式(30)中的y
a
及r
a
分别与式(1)中的y
a
及r
a
的含义相同,优选方式也相同。
[0199]
式(10)中的n10优选0~2的整数,更优选0或1,尤其优选0。
[0200]
式(20)中的n20及n21分别独立地优选0~2的整数,更优选0或1,尤其优选0。
[0201]
式(20)中的两个y
a
优选相同的基团。
[0202]
并且,式(20)中的两个r
a
优选相同的基团。
[0203]
式(30)中的n30优选0~2的整数,更优选0或1,尤其优选0。
[0204]
式(30)中的两个r
a
优选相同的基团。
[0205]
式(10)、式(20)或式(30)中的r
s
分别独立地优选烷氧基、芳氧基、卤素原子、烷基、卤化烷基、芳基、酰基、酰氧基、烷氧基羰基、芳氧基羰基、烷硫基、芳硫基、r
st
‑
co
‑
nr
st
‑
、
‑
con(r
st
)2、二烷基氨基、烷基芳基氨基、二芳基氨基或将这些组合2个以上而获得的基团,更优选烷氧基、芳氧基、卤素原子、烷基、卤化烷基或芳基,进一步优选烷氧基或烷基。
[0206]
从溶剂溶解性、结晶性及产率的观点考虑,式(10)中的r
a
优选上述式(f1)、式(a1)、式(b1)或式(e1)中的任一个所表示的基团,更优选上述式(f1)或式(a1)中的任一个所表示的基团,进一步优选上述式(f1)所表示的基团,尤其优选上述式(f2)所表示的基团。
[0207]
从溶剂溶解性、结晶性及产率的观点考虑,式(20)中的r
a
分别独立地优选上述式(f1)、式(a1)、式(b1)或式(e1)中的任一个所表示的基团,更优选上述式(f1)或式(a1)中的任一个所表示的基团。
[0208]
从溶剂溶解性、结晶性及产率的观点考虑,式(30)中的r
a
分别独立地优选上述式(f1)、式(a1)、式(b1)或式(e1)中的任一个所表示的基团,更优选上述式(f1)或式(a1)中的任一个所表示的基团。
[0209]
式(1)所表示的化合物的分子量并无特别限制,但是从脱保护速度、结晶性、溶剂溶解性及产率的观点考虑,优选340~3,000,更优选400~2,000,进一步优选500~1,500,尤其优选800~1,300。并且,若分子量为3,000以下,则式(1)在目标物中所占的比例适当,且对式(1)进行脱保护而获得的化合物的比例不会变少,因此生产性优异。
[0210]
作为式(1)所表示的化合物的具体例,可以优选地举出下述所示的化合物,但是并不限定于这些。另外,r
g
表示碳原子数12以上的脂肪族烃基,优选碳原子数12~100的脂肪族烃基,更优选碳原子数18~40的脂肪族烃基,尤其优选碳原子数20~32的脂肪族烃基。并且,上述脂肪族烃基优选直链烷基、支链烷基或环状烷基,更优选直链烷基。
[0211]
[化学式24]
[0212][0213]
[化学式25]
[0214][0215]
[化学式26]
[0216][0217]
[化学式27]
[0218][0219]
[化学式28]
[0220][0221]
<式(1)所表示的稠合多环芳香族烃化合物的制造方法>
[0222]
作为本发明所涉及的式(1)所表示的稠合多环芳香族烃化合物的制造方法,并无特别限定,但是能够参考公知的方法来进行制造。
[0223]
关于用于制造的原料化合物,除非另有说明,则可以使用市售的化合物,也能够按照本身公知的方法或基于这些的方法来进行制造。
[0224]
并且,根据需要,可以通过公知的纯化方法来纯化所制造的式(1)所表示的稠合多环芳香族烃化合物。例如,能够进行通过再结晶、柱色谱法等来进行单离及纯化的方法及通过改变溶液温度的方法或改变溶液组成的方法等来进行再沉淀纯化的方法等。
[0225]
关于本发明所涉及的式(1)所表示的稠合多环芳香族烃化合物的合成方法,例如,能够按照以下的方案来进行合成。并且,也能够参考国际公开第2010/113939号中所记载的合成方法来进行合成。
[0226]
[化学式29]
[0227][0228]
r
100
表示氢原子或or
101
,r
101
表示烷基,x
100
表示cl、br或i,r
102
表示氢原子或烷基。
[0229]
在本发明所涉及的肽化合物的制造方法中,使用上述式(1)所表示的稠合多环稠环芳香族烃化合物的工序优选通过上述式(1)所表示的稠合多环芳香族烃化合物来保护氨基酸化合物或肽化合物的羧基或酰胺基的c末端保护工序。
[0230]
并且,从肽化合物的合成容易性及产率的观点考虑,本发明所涉及的肽化合物的制造方法除了通过上述式(1)所表示的稠合多环芳香族烃化合物来保护氨基酸化合物或肽化合物的羧基或酰胺基的c末端保护工序以外,更优选还包括对在上述c末端保护工序中所获得的n末端被保护且c末端被保护的氨基酸化合物或n末端被保护且c末端被保护的肽化合物的n末端进行脱保护的n末端脱保护工序及使n末端被保护的氨基酸化合物或n末端被保护的肽化合物稠合至在上述n末端脱保护工序中所获得的c末端被保护的氨基酸化合物或c末端被保护的肽化合物的n末端中的肽链延伸工序,进一步优选还包括使在上述肽链延伸工序中所获得的n末端被保护且c末端被保护的肽化合物沉淀的沉淀工序,尤其优选在上述沉淀工序之后依次还包括1次以上的如下工序,即,对所获得的n末端被保护且c末端被保护的肽化合物的n末端进行脱保护的工序、使n末端被保护的氨基酸化合物或n末端被保护的肽化合物稠合至所获得的c末端被保护的肽化合物的n末端中的工序及沉淀所获得的n末端被保护且c末端被保护的肽化合物的工序。
[0231]
并且,本发明所涉及的肽化合物的制造方法优选还包括对c末端保护基进行脱保护的c末端脱保护工序。
[0232]
而且,本发明所涉及的肽化合物的制造方法优选在上述c末端保护工序之前还包括将上述式(1)所表示的稠合多环芳香族烃化合物溶解于溶剂中的溶解工序。
[0233]
以下,对上述各工序等进行详细地说明。
[0234]
<溶解工序>
[0235]
本发明所涉及的肽化合物的制造方法优选在上述c末端保护工序之前包括将上述式(1)所表示的稠合多环芳香族烃化合物溶解于溶剂中的溶解工序。
[0236]
作为溶剂,能够将通常的有机溶剂用于反应中,但是上述溶剂中的溶解度越高,能够期待越优异的反应性,因此优选选择式(1)所表示的稠合多环芳香族烃化合物的溶解度高的溶剂。具体而言,可以举出氯仿、二氯甲烷等卤化烃类;1,4
‑
二噁烷、四氢呋喃及环戊基甲醚等非极性有机溶剂等。这些溶剂可以以适当比例混合2种以上并进行使用。并且,在上述卤化碳类或非极性有机溶剂中,只要式(1)所表示的稠合多环芳香族烃化合物能够溶解,
则可以以适当比例混合并使用苯、甲苯、二甲苯等芳香族烃类;乙腈、丙腈等腈类;丙酮、2
‑
丁酮等酮类;n,n
‑
二甲基甲酰胺、n
‑
甲基吡咯烷酮等酰胺类;二甲基亚砜等亚砜类。
[0237]
并且,可以使用organic process research&development、2017、21、3、365
‑
369所述的溶剂。
[0238]
<c末端保护工序>
[0239]
本发明所涉及的肽化合物的制造方法优选包括通过上述式(1)所表示的稠合多环芳香族烃化合物来保护氨基酸化合物或肽化合物的羧基或酰胺基的c末端保护工序。
[0240]
作为在上述c末端保护工序中所使用的氨基酸化合物或肽化合物,并无特别限制,能够使用公知的化合物,但是优选n末端被保护的氨基酸化合物或n末端被保护的肽化合物,更优选fmoc保护氨基酸化合物或fmoc保护肽化合物。
[0241]
并且,除了在上述c末端保护工序中所使用的氨基酸化合物或肽化合物中的c末端部分以外的羟基、氨基、羰基、酰胺基、咪唑基、吲哚基、胍基、巯基等优选通过后述的保护基等公知的保护基进行保护。
[0242]
作为反应基质的氨基酸化合物或肽化合物的使用量相对于上述式(1)所表示的稠合多环芳香族烃化合物的1摩尔当量优选1摩尔当量~10摩尔当量,更优选1摩尔当量~5摩尔当量,进一步优选1摩尔当量~2摩尔当量,尤其优选1~1.5。
[0243]
在使用式(1)中的y
a
为
‑
ch2oh或
‑
ch2sh的上述式(1)所表示的稠合多环芳香族烃化合物的情况下,可以优选地举出在不影响反应的溶剂中在催化剂的存在下添加稠合剂或者使其在酸催化剂中进行反应。
[0244]
在使用式(1)中的y
a
为
‑
ch2nhr的上述式(1)所表示的稠合多环芳香族烃化合物的情况下,可以优选地举出在稠合添加剂(稠合促进剂)的存在下添加稠合剂。
[0245]
稠合添加剂的使用量相对于上述式(1)所表示的稠合多环芳香族烃化合物的1摩尔当量优选0.05摩尔当量~1.5摩尔当量。
[0246]
作为稠合剂,在肽合成中通常使用的稠合剂在本发明中也能够不受限制地使用,且并不限定于此,但是例如可以举出4
‑
(4,6
‑
二甲氧基
‑
1,3,5
‑
三嗪
‑2‑
基)
‑4‑
甲基吗啉氯化物(dmtmm)、o
‑
(苯并三唑
‑1‑
基)
‑
1,1,3,3
‑
四甲基脲鎓六氟磷酸酯(hbtu)、o
‑
(7
‑
氮杂苯并三唑
‑1‑
基)
‑
1,1,3,3
‑
四甲基脲鎓六氟磷酸酯(hatu)、o
‑
(6
‑
氯苯并三唑
‑1‑
基)
‑
1,1,3,3
‑
四甲基脲鎓六氟磷酸酯(hbtu(6
‑
cl))、o
‑
(苯并三唑
‑1‑
基)
‑
1,1,3,3
‑
四甲基脲四氟硼酸盐(tbtu)、o
‑
(6
‑
氯苯并三唑
‑1‑
基)
‑
1,1,3,3
‑
四甲基脲四氟硼酸盐(tctu)、(1
‑
氰基
‑2‑
乙氧基
‑2‑
氧代基亚乙基氨氧基)二甲基氨基吗啉代碳鎓六氟磷酸盐(comu)、二环己碳二酰亚胺(dcc)、二异丙基碳二酰亚胺(dic)、1
‑
乙基
‑3‑
(3
‑
二甲基氨基丙基)碳二亚胺(edc)、其盐酸盐(edc
·
hcl)及六氟磷酸(苯并三唑
‑1‑
基氧基)三吡咯烷基鏻(pybop)等。
[0247]
其中,优选dic、edc、edc
·
hcl、dmt
‑
mm、hbtu、hatu或comu。
[0248]
稠合剂的使用量相对于上述式(1)所表示的稠合多环芳香族烃化合物的1摩尔当量优选1摩尔当量~10摩尔当量,更优选1摩尔当量~5摩尔当量。
[0249]
作为用于稠合反应的催化剂,能够不受限制地使用在肽合成中通常使用的活化剂。
[0250]
催化剂的使用量相对于上述式(1)所表示的稠合多环芳香族烃化合物的1摩尔当量优选超过0摩尔当量且4.0摩尔当量,更优选0.05摩尔当量~1.5摩尔当量,进一步优选
0.1摩尔当量~0.3摩尔当量。
[0251]
作为用于稠合反应的酸催化剂,能够不受限制地使用在肽合成中通常使用的酸催化剂,例如可以举出甲磺酸、三氟甲磺酸及对甲苯磺酸等。
[0252]
其中,优选甲磺酸、对甲苯磺酸。
[0253]
酸催化剂的使用量相对于上述式(1)所表示的稠合多环芳香族烃化合物的1摩尔当量优选超过0摩尔当量且4.0摩尔当量,更优选0.05摩尔当量~1.5摩尔当量,进一步优选0.1摩尔当量~0.3摩尔当量。
[0254]
在上述c末端保护工序中,为了促进反应且抑制消旋反应(racemization)等副反应,优选添加活化剂。
[0255]
本发明中的活化剂在与稠合剂共存下将氨基酸引导至相对应的活性酯、对称酸酐等中来使其易于形成肽键(酰胺键)的试药。
[0256]
作为活化剂,能够不受限制地使用在肽合成中通常使用的活化剂,例如可以举出4
‑
二甲基氨基吡啶、n
‑
甲基咪唑、硼酸衍生物、1
‑
羟基苯并三唑(hobt)、乙基1
‑
羟基三唑
‑4‑
羧酸酯(hoct)、1
‑
羟基
‑7‑
氮杂苯并三唑(hoat)、3
‑
羟基
‑
1,2,3
‑
苯并三嗪
‑
4(3h)
‑
酮(hoobt)、n
‑
羟基丁二酰亚胺(hosu)、n
‑
羟基琥珀酰亚胺(hopht)、n
‑
羟基
‑5‑
降冰片烯
‑
2,3
‑
二羧基酰亚胺(honb)、五氟苯酚及乙基(羟亚氨基)氰基乙酸酯(oxyma)等。其中,优选4
‑
二甲基氨基吡啶、hobt、hoct、hoat、hoobt、hosu、honb或oxyma。
[0257]
活化剂的使用量相对于氨基酸化合物或肽化合物优选超过0摩尔当量且4.0摩尔当量,更优选0.1摩尔当量~1.5摩尔当量。
[0258]
作为溶剂,能够优选地使用在上述溶解工序中所述的溶剂。
[0259]
反应温度并无特别限制,但是优选
‑
10℃~50℃,更优选0℃~40℃。反应时间并无特别限制,但是优选1小时~30小时。
[0260]
关于反应的进行的确认,能够适用与通常的液相有机合成反应相同的方法。即,能够使用薄层硅胶色谱法、高效液相色谱法及nmr等来追踪反应。
[0261]
并且,通过上述c末端保护工序所获得的n末端被保护且c末端被保护的氨基酸化合物或n末端被保护且c末端被保护的肽化合物可以进行纯化。
[0262]
例如,为了使所获得的n末端被保护且c末端被保护的氨基酸化合物或n末端被保护且c末端被保护的肽化合物溶解于溶剂中,并在进行所期望的有机合成反应之后对所获得的产物进行单离,可以优选地举出使溶解有n末端被保护且c末端被保护的氨基酸化合物或n末端被保护且c末端被保护的肽化合物的溶剂改变(例,溶剂组成的变更、溶剂种类的变更)并使其再沉淀的方法。
[0263]
具体而言,例如,在如n末端被保护且c末端被保护的氨基酸化合物或n末端被保护且c末端被保护的肽化合物溶解的条件下进行反应,并在反应后蒸馏去除溶剂之后进行溶剂置换,或者在反应后不蒸馏去除溶剂而向反应系统添加极性溶剂,由此沉淀凝聚物并去除杂质。作为置换溶剂,单独或混合使用甲醇、乙腈、水等极性有机溶剂。即,在如n末端被保护且c末端被保护的氨基酸化合物或n末端被保护且c末端被保护的肽化合物溶解的条件下进行反应,并在反应后作为溶剂置换,例如对于溶解使用卤化溶剂、thf等而对于沉淀化使用甲醇、乙腈或水等极性有机溶剂。
[0264]
<n末端脱保护工序>
[0265]
本发明所涉及的肽化合物的制造方法优选包括对在上述c末端保护工序中所获得的n末端被保护且c末端被保护的氨基酸化合物或n末端被保护且c末端被保护的肽化合物的n末端进行脱保护的n末端脱保护工序。
[0266]
作为n末端的保护基,能够使用肽化学等技术领域中通常使用的后述氨基的保护基,但是在本发明中,可以优选地使用叔丁氧基羰基(以下,也称为boc基。)、苄氧基羰基(以下,也称为cbz基或z基。)或9
‑
芴基甲氧基羰基(以下,也称为fmoc基。)。
[0267]
脱保护条件通过该临时保护基的种类进行适当选择,但是优选能够通过与源自上述式(1)所表示的稠合多环芳香族烃化合物的保护基的去除不同的条件进行脱保护的基团。例如,在为fmoc基的情况下,通过碱处理来进行,且在为boc基的情况下,通过酸处理来进行。该反应在不影响反应的溶剂中进行。
[0268]
作为碱,可以举出二甲胺、二乙胺等仲胺或1,8
‑
二氮杂双环[5.4.0]
‑7‑
十一碳烯(dbu)、1,4
‑
二氮杂双环[2.2.2]辛烷(dabco)、1,5
‑
二氮杂双环[4.3.0]
‑5‑
壬烯(dbn)等没有亲核性的有机碱等。
[0269]
作为溶剂,能够优选地使用在上述溶解工序中所述的溶剂。
[0270]
<肽链延伸工序>
[0271]
本发明所涉及的肽化合物的制造方法优选包括使n末端被保护的氨基酸化合物或n末端被保护的肽化合物稠合至在上述n末端脱保护工序中所获得的c末端被保护的氨基酸化合物或c末端被保护的肽化合物的n末端中的肽链延伸工序。
[0272]
在上述肽链延伸工序中使用上述稠合剂、稠合添加剂等,且在肽化学领域中通常使用的肽合成条件下优选地进行。
[0273]
作为n末端被保护的氨基酸化合物或n末端被保护的肽化合物,并无特别限制,能够使用所期望的化合物,但是能够优选地使用fmoc保护氨基酸化合物或fmoc保护肽化合物。
[0274]
并且,除了n末端被保护的氨基酸化合物或n末端被保护的肽化合物中的c末端部分以外的羟基、氨基、羰基、酰胺基、咪唑基、吲哚基、胍基、巯基等优选通过后述的保护基等公知的保护基进行保护。
[0275]
<沉淀工序>
[0276]
本发明所涉及的肽化合物的制造方法优选包括使在上述肽链延伸工序中所获得的n末端被保护且c末端被保护的肽化合物沉淀的沉淀工序。
[0277]
上述沉淀工序能够以与上述的可以在上述c末端保护工序之后进行的纯化中的沉淀方法相同的方式进行。
[0278]
<链延伸>
[0279]
本发明所涉及的肽化合物的制造方法优选在上述沉淀工序之后依次还包括1次以上的如下工序,即,对所获得的n末端被保护且c末端被保护的肽化合物的n末端进行脱保护的工序、使n末端被保护的氨基酸化合物或n末端被保护的肽化合物稠合至所获得的c末端被保护的肽化合物的n末端中的工序及沉淀所获得的n末端被保护且c末端被保护的肽化合物的工序。
[0280]
通过重复进行上述3工序,能够容易地进行所获得的肽化合物的链延伸。
[0281]
上述3工序中的各工序能够以与上述相对应的各工序相同的方式进行。
[0282]
<c末端脱保护工序>
[0283]
本发明所涉及的肽化合物的制造方法优选还包含对c末端保护基进行脱保护的c末端脱保护工序。
[0284]
在上述c末端脱保护工序中,去除具有所期望的氨基酸残基数的c末端被保护的肽化合物中的通过上述式(1)所表示的稠合多环芳香族烃化合物所形成的c末端保护基,从而能够获得作为最终目标物的肽化合物。
[0285]
作为c末端保护基的去除方法,可以优选地举出使用了酸性化合物的脱保护方法。
[0286]
例如,可以举出使用了酸催化剂的方法或使用金属催化剂并添加氢的方法。作为酸催化剂,可以举出三氟乙酸(tfa)、盐酸等,优选tfa。关于tfa的浓度,能够按照保护基及脱保护条件来进行适当选择,且相对于所使用的溶剂的总质量优选0.01质量%~100质量%,更优选1质量%~100质量%。
[0287]
并且,tfa的浓度优选70质量%以下,更优选50质量%以下,进一步优选30质量%以下,更进一步优选10质量%以下,尤其优选1质量%以下。在本发明中,即使在弱酸条件下也能够进行c末端保护基的脱保护,且能够抑制所获得的肽的副反应。
[0288]
脱保护时间优选5小时以下,更优选3小时以下,进一步优选1小时以下。
[0289]
关于通过本发明所涉及的肽化合物的制造方法所获得的作为最终目标物的肽化合物,能够按照肽化学中常用的方法来进行单离纯化。例如,通过对反应混合物进行抽取清洗、结晶、色谱等,能够对作为最终目标物的肽化合物进行单离纯化。
[0290]
通过本发明所涉及的肽化合物的制造方法所制造的肽的种类并无特别限定,但是肽化合物的氨基酸残基数例如优选数十以下左右。与现有的或未知的合成肽或天然肽相同地,通过本发明所涉及的肽化合物的制造方法所获得的肽能够利用于各种各样的领域,例如能够利用于药剂、食品、化妆品、电子材料及生物传感器等领域,但是并不限定于此。
[0291]
本发明所涉及的肽化合物的制造方法也能够在不影响下一工序的反应的范围内适当省略上述沉淀工序。
[0292]
在本发明所涉及的肽化合物的制造方法中所使用的氨基酸化合物及肽化合物具有羟基、氨基、羧基、羰基、胍基及巯基等的情况下,在这些基团中可以导入有如在肽化学等中通常使用的保护基,并在反应后根据需要去除保护基,由此能够获得目标化合物。
[0293]
作为羟基的保护基,例如可以举出碳原子数1~6的烷基(例,甲基、乙基、丙基、异丙基、丁基、叔丁基)、苯基、三苯甲基、碳原子数7~10的芳烷基(例,苄基)、甲酰基、碳原子数1~6的酰基(例,乙酰基、丙酰基)、苯甲酰基、碳原子数7~10的芳烷基
‑
羰基(例,苄基羰基)、2
‑
四氢吡喃基、2
‑
四氢呋喃基、甲硅烷基(例,三甲基硅烷基、三乙基硅烷基、二甲苯基硅烷基、叔丁基二甲基硅烷基、叔丁基二乙基硅烷基)、碳原子数2~6的烯基(例,1
‑
丙烯基)等。
[0294]
这些基团可以经选自包括卤素原子(例,氟原子、氯原子、溴原子、碘原子)、碳原子数1~6的烷基(例,甲基、乙基、丙基)、碳原子数1~6的烷氧基(例,甲氧基、乙氧基、丙氧基)及硝基的组中的1个~3个取代基取代。
[0295]
作为氨基的保护基,例如可以举出甲酰基、碳原子数1~6的酰基(例,乙酰基、丙酰基)、碳原子数1~6的烷氧基羰基(例,甲氧基羰基、乙氧基羰基、boc基)、苯甲酰基、碳原子数7~10的芳烷基
‑
羰基(例,苄基羰基)、碳原子数7~14的芳烷氧基羰基(例,苄氧基羰基、
fmoc基)、三苯甲基、单甲氧基三苯甲基、1
‑
(4,4
‑
dimethyl
‑
2,6
‑
dioxocyclohex
‑1‑
ylidene)
‑3‑
methylbutyl基(1
‑
(4,4
‑
二甲基
‑
2,6
‑
二侧氧基环己
‑1‑
亚基)
‑3‑
甲基丁基)、酞酰基、n,n
‑
二甲氨基亚甲基、甲硅烷基(例,三甲基硅烷基、三乙基硅烷基、二甲苯基硅烷基、叔丁基二甲基硅烷基、叔丁基二乙基硅烷基)及碳原子数2~6的烯基(例,1
‑
丙烯基)等。这些基团可以经选自包括卤素原子(例,氟原子、氯原子、溴原子、碘原子)、碳原子数1~6的烷氧基(例,甲氧基、乙氧基、丙氧基)及硝基的组中的1个~3个取代基取代。
[0296]
作为羧基的保护基,例如可以举出碳原子数1~6的烷基(例,甲基、乙基、丙基、异丙基、丁基、叔丁基)、碳原子数7~10的芳烷基(例,苄基)、苯基、三苯甲基、甲硅烷基(例,三甲基硅烷基、三乙基硅烷基、二甲苯基硅烷基、叔丁基二甲基硅烷基、叔丁基二乙基硅烷基、叔丁基二苯基硅烷基)及碳原子数2~6的烯基(例,1
‑
烯丙基)等。这些基团可以经选自包括卤素原子(例,氟原子、氯原子、溴原子、碘原子)、碳原子数1~6的烷氧基(例,甲氧基、乙氧基、丙氧基)及硝基的组中的1个~3个取代基取代。
[0297]
作为羰基的保护基,例如可以举出环状缩醛(例,1,3
‑
二噁烷)及非环状缩醛(例,二(碳原子数1~6的烷基)缩醛)等。
[0298]
作为胍基的保护基,例如可以举出2,2,4,6,7
‑
五甲基二氢苯并呋喃
‑5‑
磺酰基、2,3,4,5,6
‑
五甲基苯磺酰基、甲苯磺酰基及硝基等。
[0299]
作为巯基(硫醇基)的保护基,例如可以举出三苯甲基、4
‑
甲基苄基、乙酰氨基甲基、叔丁基及叔丁硫基等。
[0300]
并且,这些保护基的去除方法只要基于本身公知的方法、例如,protective groups in organic synthesis,john wiley andsons刊(1980)中所记载的方法等进行即可。例如,可以利用使用酸、碱、紫外光、肼、苯基肼、n
‑
甲基二硫胺甲酸钠、四丁基氟化铵、乙酸钯、三烷基硅烷基卤化物(例如,三甲基硅烷基碘化物、三甲基硅烷基溴化物等)等的方法、还原法等。
[0301]
(保护基形成用试药)
[0302]
本发明所涉及的保护基形成用试药包含下述式(1)所表示的稠合多环芳香族烃化合物。
[0303]
[化学式30]
[0304][0305]
式(1)中,环a表示稠合多环芳香族烃环,y
a
分别独立地表示
‑
ch2oh、
‑
ch2nhr、
‑
ch2sh或
‑
ch2x0,r表示氢原子、烷基或芳烷基,x0表示cl、br或i,k表示1~5的整数,n表示1或2,r
a
分别独立地为脂肪族烃基或具有脂肪族烃基的有机基团,至少一个r
a
所具有的至少一个脂肪族烃基的碳原子数为12以上,环a除了y
a
及r
a
以外还可以具有取代基。
[0306]
本发明所涉及的保护基形成用试药优选羧基或酰胺基的保护基形成用试药,更优选氨基酸化合物或肽化合物的c末端保护基形成用试药。
[0307]
本发明所涉及的保护基形成用试药中的式(1)所表示的稠合多环芳香族烃化合物的优选方式与上述本发明所涉及的式(1)所表示的稠合多环芳香族烃化合物的优选方式相同。
[0308]
本发明所涉及的保护基形成用试药可以为固体状试药,也可以为液体状试药。
[0309]
本发明所涉及的保护基形成用试药中的式(1)所表示的稠合多环芳香族烃化合物的含量并无特别限制,但是相对于保护基形成用试药的总质量优选0.1质量%~100质量%,更优选1质量%~100质量%,进一步优选3质量%~100质量%。
[0310]
本发明所涉及的保护基形成用试药可以包含除了式(1)所表示的稠合多环芳香族烃化合物以外的其他成分。
[0311]
作为其他成分,能够包含公知的成分。例如可以举出水、有机溶剂、抗氧化剂及ph调节剂等。
[0312]
(式(1a)所表示的稠合多环芳香族烃化合物)
[0313]
本发明所涉及的化合物为下述式(1a)所表示的稠合多环芳香族烃化合物。
[0314]
[化学式31]
[0315][0316]
式(1a)中,环a表示稠合多环芳香族烃环,y
a
分别独立地表示
‑
ch2oh、
‑
ch2nhr、
‑
ch2sh或
‑
ch2x0,r表示氢原子、烷基或芳烷基,x0表示cl、br或i,k表示1~5的整数,n表示1或2,r
a
分别独立地为脂肪族烃基或具有脂肪族烃基的有机基团,至少一个r
a
所具有的至少一个脂肪族烃基的碳原子数为18以上,环a除了y
a
及r
a
以外还可以具有取代基。
[0317]
作为本发明所涉及的化合物的式(1a)所表示的稠合多环芳香族烃化合物为新颖的化合物,且能够优选地用于肽化合物的制造中。其中,能够优选地用作保护基形成用试药,能够更优选地用作羧基或酰胺基的保护基形成用试药,能够尤其优选地用作氨基酸化合物或肽化合物的c末端保护基形成用试药。
[0318]
关于本发明所涉及的化合物中的式(1a)所表示的稠合多环芳香族烃化合物,至少一个r
a
所具有的至少一个脂肪族烃基的碳原子数为18以上,除此以外,与在上述本发明所涉及的肽化合物的制造方法中上述式(1)所表示的稠合多环芳香族烃化合物相同,且除了后述的优选方式以外的优选方式也相同。
[0319]
上述式(1a)所表示的稠合多环芳香族烃化合物为在至少一个r
a
中具有至少一个碳原子数18以上的脂肪族烃基的化合物,从溶剂溶解性、结晶性及产率的观点考虑,优选在至少一个r
a
中具有至少一个碳原子数18~100的脂肪族烃基的化合物,更优选具有至少一个碳原子数18~40的脂肪族烃基的化合物,进一步优选具有至少一个碳原子数20~36的脂肪族烃基的化合物。
[0320]
从脱保护速度、结晶性、溶剂溶解性及产率的观点考虑,上述式(1a)所表示的稠合多环芳香族烃化合物优选下述式(10a)~式(30a)中的任一个所表示的化合物,更优选下述式(10a)或式(20a)所表示的化合物,尤其优选下述式(10a)所表示的化合物。
[0321]
[化学式32]
[0322][0323]
式(10a)、式(20a)及式(30a)中,y
a
分别独立地表示
‑
ch2oh、
‑
ch2nhr、
‑
ch2sh或
‑
ch2x0,r表示氢原子、烷基或芳烷基,x0表示cl、br或i,r
a
分别独立地为脂肪族烃基或具有脂肪族烃基的有机基团,至少一个r
a
所具有的至少一个脂肪族烃基的碳原子数为18以上,r
s
分别独立地表示取代基,n10表示0~6的整数,n20、n21及n30分别独立地表示0~5的整数。
[0324]
关于上述式(10a)~式(30a)中的任一个所表示的化合物,至少一个r
a
所具有的至少一个脂肪族烃基的碳原子数为18以上,除此以外,与在上述本发明所涉及的肽化合物的制造方法中上述式(10)~式(30)中的任一个所表示的化合物相同,且除了后述的优选方式以外的优选方式也相同。
[0325]
上述式(10a)~式(30a)中的任一个所表示的化合物中的r
a
与上述式(1a)所表示的稠合多环芳香族烃化合物中的r
a
的含义相同,优选方式也相同。
[0326]
并且,上述式(1a)所表示的稠合多环芳香族烃化合物能够以与上述式(1)所表示的稠合多环芳香族烃化合物相同的方式进行合成。
[0327]
实施例
[0328]
以下,举出实施例对本发明的实施方式进行进一步具体地说明。关于以下的实施例所示的材料、使用量、比例、处理内容及处理顺序等,只要不脱离本发明的实施方式的宗旨,则能够进行适当地变更。从而,本发明的实施方式的范围并不限定于以下所示的具体例。另外,除非另有说明,则“份”、“%”为质量基准。
[0329]
除非另有说明,则基于柱色谱法的纯化使用自动纯化装置isolera(biotage公司制)或中压液相色谱法yflc
‑
wprep2xy.n(yamazen corporation.制)。
[0330]
除非另有说明,则硅胶柱色谱法中的载体使用snapkp
‑
sil cartridge(biotage公司制)、hi
‑
flash columns w001、w002、w003、w004或w005(yamazen corporation.制)。
[0331]
用于柱色谱法的洗脱液中的混合比为体积比。例如,“己烷∶乙酸乙酯的梯度洗脱=50∶50~0∶100”是指使50%己烷/50%乙酸乙酯的洗脱液最终变成0%己烷/100%乙酸乙酯的洗脱液。
[0332]
并且,例如,“己烷∶乙酸乙酯的梯度洗脱=50∶50~0∶100、甲醇∶乙酸乙酯的梯度洗脱=0∶100~20∶80”是指使50%己烷/50%乙酸乙酯的洗脱液变成0%己烷/100%乙酸乙酯的洗脱液之后,将洗脱液替换成0%甲醇/100%乙酸乙酯的洗脱液,最终变成20%甲醇/80%乙酸乙酯的洗脱液。
[0333]
关于ms光谱,使用acquity sqd lc/ms system(waters corporation.制、离子化法:esi(electrospray ionization、电喷雾离子化)法)进行了测定。
[0334]
关于nmr光谱,使用四甲硅烷作为内部基准,且使用bruker av300(bruker公司制、300mhz)或bruker av400(bruker公司制、400mhz)进行测定,并将所有δ值均以ppm表示。
[0335]
<保护基形成用试药(化合物(1
‑
1))的合成>
[0336]
[化学式33]
[0337][0338]
关于中间体(1
‑
1),通过欧洲专利申请公开第2518041号说明书中所记载的方法进行了合成。
[0339]
将中间体(1
‑
1)(12.00g、15.5mmol)、6
‑
羟基
‑2‑
萘甲酸甲基(6.26g、30.9mmol)、碳酸钾(8.55g、61.9mmol)、n
‑
甲基吡咯烷酮(nmp、155ml)进行混合,并在氮气气氛下以100℃搅拌了4小时。将反应溶液降温至室温,并通过环戊基甲醚、水进行了抽取。将通过向所获得的有机层中添加甲醇而析出的固体进行过滤并使其减压干燥,从而获得了中间体(1
‑
2)(13.8g、产率95%)。
[0340]
在氮气气氛下,将中间体(1
‑
2)(4.00g、4.25mmol)、四氢呋喃(66ml)进行混合,并以30℃进行搅拌之后,滴加了氢化双(2
‑
甲氧基乙氧基)铝钠甲苯溶液(3.6m(=3.6mol/l))(3.5ml、12.8mmol)。将反应溶液以30℃搅拌2小时且缓慢地滴加酒石酸钾钠饱和水溶液(50ml)之后进行分液,将通过向所获得的有机层中添加甲醇而析出的固体进行过滤并使其干燥,从而获得了化合物(1
‑
1)(3.87g、产率99%)。
[0341]1h
‑
nmr(cdcl3,400mhz)δ=0.88(6h,t),1.19
‑
1.82(80h,m),3.94(4h,t),4.82(2h,d),5.10(2h,s),6.42(1h,t),6.61(2h,d),7.20(1h,t),7.24(1h,dd),7.45(1h,dd),7.69
‑
7.78(3h,m).
[0342]
<保护基形成用试药(化合物(1
‑
2))的合成>
[0343]
[化学式34]
[0344][0345]
以与化合物(1
‑
1)相同的方式进行合成,从而获得了化合物(1
‑
2)。
[0346]1h
‑
nmr(cdc13,300mhz)δ=0.88(9h,t),1.19
‑
1.85(96h,m),3.93
‑
4.01(6h,m),4.83(2h,d),5.06(2h,s),6.42(1h,t),6.67(2h,d),7.22
‑
7.26(2h,m),7.46(1h,dd),7.72
‑
7.77(3h,m).
[0347]
<保护基形成用试药(化合物(1
‑
3))的合成>
[0348]
[化学式35]
[0349][0350]
以与化合物(1
‑
1)相同的方式进行合成,从而获得了化合物(1
‑
3)。
[0351]1h
‑
nmr(cdcl3,400mhz)δ=0.88(6h,t),1.24
‑
1.58(64h,m),2.04(4h,m),3.41(4h,t),3.58(4h,t),4.05(4h,t),4.83(2h,d),5.10(2h,s),6.44(1h,t),6.63(2h,d),7.20
‑
7.26(2h,m),7.45(1h,dd),7.72
‑
7.76(3h,m).
[0352]
<保护基形成用试药(化合物(1
‑
4))的合成>
[0353]
[化学式36]
[0354][0355]
将中间体(1
‑
1)(3.00g、3.87mmol)、2
‑
羟基
‑1‑
萘甲醛(1.00g、3.87mmol)、碳酸钾(1.07g、7.73mmol)、n,n
‑
二甲基乙酰胺(dmac、30ml)进行混合,并在氮气气氛下以100℃搅拌了3小时。将反应溶液降温至室温,且将通过添加甲醇而析出的固体进行过滤并使其减压干燥,从而获得了中间体(1
‑
3)(4.46g)。
[0356]
在氮气气氛下,将中间体(1
‑
3)(3.52g、3.86mmol)、四氢呋喃(154ml)、甲醇(7.7ml)进行混合,并在室温下进行搅拌之后,加入了硼氢化钠(0.292g、7.72mmol)。将反应溶液以40℃搅拌30分钟,且在确认到原料的消失之后,向反应溶液一点一点加入硅胶(50g)并终止了反应。将硅胶进行过滤且使滤液在减压下浓缩之后,将所获得的残渣溶解于thf(15ml)中,将通过添加甲醇(100ml)而析出的固体进行过滤并使其干燥,从而获得了化合物(1
‑
4)(3.44g、产率98%)。
[0357]1h
‑
nmr(cdcl3,400mhz)δ=0.88(6h,t),1.19
‑
1.80(80h,m),3.92(4h,t),5.17(2h,s),5.22(2h,d),6.40(1h,s),6.58(2h,d),7.29(1h,t),7.37(1h,t),7.53(1h,t),7.80(2h,dd),8.14(1h,d).
[0358]
<保护基形成用试药(化合物(1
‑
5))的合成>
[0359]
[化学式37]
[0360][0361]
以与化合物(1
‑
4)相同的方式进行合成,从而获得了化合物(1
‑
5)。
[0362]1h
‑
nmr(cdcl3,400mhz)δ=0.88(6h,t),1.19
‑
1.85(80h,m),3.95(4h,t),5.06(2h,d),5.18(2h,s),6.42(1h,t),6.63(2h,d),6.82(1h,d),7.38(1h,d),7.48
‑
7.65(2h,m),8.12(1h,d),8.41(1h,d).
[0363]
<保护基形成用试药(化合物(2
‑
1))的合成>
[0364]
[化学式38]
[0365][0366]
关于中间体(2
‑
1),通过文献j.am.chem.soc.,2010,132,14625
‑
14637中所记载的方法进行了合成。
[0367]
将中间体(2
‑
1)(346mg、1.00mmol)、1
‑
溴二十二烷(1166mg、3.00mmol)、碳酸钾(897mg、6.5mmol)、n,n
‑
二甲基甲酰胺(dmf、10ml)进行混合,并在氮气气氛下以80℃搅拌了2小时。将反应溶液降温至室温,通过二氯甲烷、水进行抽取并对有机相进行了减压浓缩。通过将所获得的粗产物提供给硅胶色谱法(溶出液∶己烷/乙酸乙酯=1/9~3/7(体积比))来进行纯化,而且通过乙腈进行再结晶,过滤并使其干燥,从而获得了化合物(2
‑
1)(200mg、产率21%)。
[0368]1h
‑
nmr(cdcl3,400mhz)δ=0.83
‑
1.63(86h,m),3.86
‑
3.92(4h,m),4.79(4h,d),7.12(2h,d),7.20(2h,dd),7.40(2h,d),7.82(2h,d),7.91(2h,d).
[0369]
<保护基形成用试药(化合物(2
‑
2))的合成>
[0370]
[化学式39]
[0371][0372]
变更了所使用的溴化物中的烷基的长度,除此以外,以与化合物(2
‑
1)相同的方式进行合成,从而获得了化合物(2
‑
2)。
[0373]
<用于比较的保护基形成用试药(比较化合物(2
‑
1))的合成>
[0374]
[化学式40]
[0375][0376]
变更了所使用的溴化物中的烷基的长度,除此以外,以与化合物(2
‑
1)相同的方式进行合成,从而获得了比较化合物(2
‑
1)。
[0377]
<保护基形成用试药(化合物(3
‑
1))的合成>
[0378]
[化学式41]
[0379][0380]
关于中间体(3
‑
1),通过journal of organic chemistry,2009,74,2,520
‑
529中所记载的方法进行了合成。
[0381]
将中间体(3
‑
1)(132mg、0.7mmol)、1
‑
溴二十二烷(601mg、1.54mmol)、碳酸钾(388mg、2.8mmol)、n,n
‑
二甲基乙酰胺(dmac、3.5ml)、四氢呋喃(3.5ml)进行混合,并在氮气气氛下以90℃搅拌了5小时。将反应溶液降温至室温,过滤收集通过添加甲醇而析出的固体,并分别通过水、甲醇进行清洗之后,使其减压干燥,从而获得了中间体(3
‑
2)(480mg、85%)。
[0382]
在氮气气氛下,将中间体(3
‑
2)(480mg、0.6mmol)、四氢呋喃(90ml)、甲醇(4.5ml)进行混合之后,添加了硼氢化钠(68mg、1.8mmol)。将反应溶液升温至40℃并搅拌了2小时之后,通过加入硅胶来猝灭了反应。将反应溶液进行过滤且对有机相进行减压浓缩,并通过将所获得的粗产物提供给硅胶色谱法(溶出液∶己烷/二氯甲烷=7/3~1/1(体积比))来进行纯化,从而获得了化合物(3
‑
1)(427mg、产率89%)。
[0383]1h
‑
nmr(cdcl3,400mhz)δ=0.88(6h,t),1.25
‑
1.53(76h,m),1.80
‑
1.87(4h,m),4.05(2h,t),4.11(2h,t),5.16(2h,d),7.10(1h,d),7.19
‑
7.25(2h,m),7.68(1h,d),8.01(1h,d).
[0384]
(实施例1)
[0385]
<保护氨基酸化合物(n末端被保护且c末端被保护的氨基酸(1))的合成>
[0386]
[化学式42]
[0387][0388]
在室温下,将化合物(1
‑
1)(914mg、1.00mmol)、n
‑
[(9h
‑
芴
‑9‑
基甲氧基)羰基]
‑
l
‑
亮氨酸(530mg、1.50mmol)、四氢呋喃(10ml)进行混合,并添加了4
‑
二甲基氨基吡啶(24.4mg、0.20mmol)、二异丙基碳二酰亚胺(232μl、1.50mmol)。将反应溶液在氮气下搅拌了1小时之后,将通过添加甲醇(50ml)而析出的固体进行过滤并使其减压干燥,从而获得了n
‑
保护c
‑
保护氨基酸(1)(1250mg、100%)。
[0389]
另外,fmoc表示9
‑
芴基甲氧基羰基,leu表示亮氨酸残基。
[0390]
(实施例2~实施例8及比较例1)
[0391]
与获得n
‑
保护c
‑
保护氨基酸(1)的方法相同地,使化合物(1
‑
2)、化合物(1
‑
3)、化合物(1
‑
4)、化合物(1
‑
5)、化合物(2
‑
1)、化合物(2
‑
2)、化合物(3
‑
1)、比较化合物(2
‑
1)与n
‑
[(9h
‑
芴
‑9‑
基甲氧基)羰基]
‑
l
‑
亮氨酸进行稠合,从而合成了相对应的n
‑
保护c
‑
保护氨基酸。将所获得的产率示于表1中。
[0392]
[表1]
[0393][0394]
如表1所示,式(1)中的各r
a
中的脂肪族烃基的碳原子数为12以上的实施例1~实施例8的化合物的产率为85%以上具有良好的产率,相对于此,在使用了式(1)中的各r
a
中的脂肪族烃基的碳原子数小于12的比较例1的化合物时的产率小于80%而产率下降。
[0395]
<保护肽(7残基肽:fmoc
‑
trp(boc)
‑
ser(tbu)
‑
tyr(tbu)
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
保护基)的合成>
[0396]
另外,将除了上述以外的各缩写的详细内容示于以下。
[0397]
trp(boc):boc保护色氨酸残基
[0398]
boc:叔丁氧基羰基
[0399]
ser(tbu):tbu保护丝氨酸残基
[0400]
tbu:叔丁基
[0401]
tyr(tbu):tbu保护酪氨酸残基
[0402]
dleu:d
‑
亮氨酸残基
[0403]
arg(pbf):pbf保护精氨酸残基
[0404]
pbf:2,2,4,6,7
‑
五甲基二氢苯并呋喃
‑5‑
磺酰基
[0405]
pro:脯氨酸残基
[0406]
(实施例9:fmoc
‑
pro
‑
o
‑
naphtag(1)的合成)
[0407]
使6
‑
(3,5
‑
双(二十二酰氧基苄氧基)萘
‑2‑
基甲醇(相当于上述化合物(1
‑
1)。也标记为“naphtag(1)”。)(2.74g、3.0mmol)和fmoc
‑
pro
‑
oh(2.0摩尔当量)溶解于氯仿(6.0ml)中,且添加4
‑
二甲基氨基吡啶(0.1摩尔当量)和二异丙基碳二酰亚胺(2.0摩尔当量)并进行了搅拌。在稠合反应结束后,加入甲醇(meoh、70ml)并进行搅拌,将沉淀物进行过滤并通过甲醇与乙腈的混合溶剂(以体积比为1∶1)进行清洗之后使其减压干燥,从而获得了fmoc
‑
pro
‑
o
‑
naphtag(1)(3.78g、产率99.0%)。
[0408]
电喷雾离子化质谱(esi
‑
ms)(+)=1,231.9
[0409]
(实施例10:fmoc
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
naphtag(1)的合成)
[0410]
使fmoc
‑
pro
‑
o
‑
naphtag(1)(2.0g、1.62mmol)溶解于氯仿(4.0ml)中,且加入二氮杂双环十一碳烯(dbu、2.0摩尔当量)并进行了搅拌。在脱保护反应结束后,加入了包含甲磺酸(2.1摩尔当量)和n
‑
甲基吗啉(2.1摩尔当量)的氯仿溶液之后,添加fmoc
‑
leu
‑
arg(pbf)
‑
oh(1.25摩尔当量)、(1
‑
氰基
‑2‑
乙氧基
‑2‑
氧代基亚乙基氨氧基)二甲基氨基吗啉代碳鎓六氟磷酸盐(comu、1.25摩尔当量)并进行了搅拌。在稠合反应结束后,加入meoh(140ml)并进行搅拌,将沉淀物进行过滤并通过甲醇与乙腈的混合溶剂(以体积比为1∶1)进行清洗之后使其减压干燥,从而获得了fmoc
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
naphtag(1)(2.72g、产率95.6%)。
[0411]
esi
‑
ms(+)=1,752.2
[0412]
(实施例11:fmoc
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
naphtag(1)的合成)
[0413]
使fmoc
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
naphtag(1)(2.5g、1.40mmol)溶解于氯仿(3.5ml)中,且加入dbu(2.0摩尔当量)并进行了搅拌。在脱保护反应结束后,加入了包含甲磺酸(2.1摩尔当量)和n
‑
甲基吗啉(2.1摩尔当量)的氯仿溶液之后,添加fmoc
‑
dleu
‑
oh(1.25摩尔当量)、comu(1.25摩尔当量)并进行了搅拌。在稠合反应结束后,加入meoh(85ml)并进行搅拌,将沉淀物进行过滤并通过甲醇与乙腈的混合溶剂(以体积比为1∶1)进行清洗之后使其减压干燥,从而获得了fmoc
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
naphtag(1)(2.56g、产率97.1%)。
[0414]
esi
‑
ms(+)=1,865.3
[0415]
(实施例12:fmoc
‑
tyr(tbu)
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
naphtag(1)的合成)
[0416]
使fmoc
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
naphtag(1)(2.19g、1.17mmol)溶解于氯仿(3.0ml)中,且加入dbu(2.0摩尔当量)并进行了搅拌。在脱保护反应结束后,加入了包含甲磺酸(2.1摩尔当量)和n
‑
甲基吗啉(2.1摩尔当量)的氯仿溶液之后,添加fmoc
‑
tyr(tbu)
‑
oh(1.25摩尔当量)、comu(1.25摩尔当量)并进行了搅拌。在稠合反应结束后,加入meoh(75ml)并进行搅拌,将沉淀物进行过滤并通过甲醇与乙腈的混合溶剂(以体积比为1∶1)进行清洗之后使其减压干燥,从而获得了fmoc
‑
tyr(tbu)
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
naphtag(1)(2.44g、产率97.1%)。
[0417]
esi
‑
ms(+)=2,084.4
[0418]
(实施例13:fmoc
‑
ser(tbu)
‑
tyr(tbu)
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
naphtag(1)的合成)
[0419]
使fmoc
‑
tyr(tbu)
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
naphtag(1)(1.63g、0.78mmol)溶解于氯仿(2.0ml)中,且加入dbu(2.0摩尔当量)并进行了搅拌。在脱保护反应结束后,加入了包含甲磺酸(2.1摩尔当量)和n
‑
甲基吗啉(2.1摩尔当量)的氯仿溶液之后,添加fmoc
‑
ser(tbu)
‑
oh(1.25摩尔当量)、comu(1.25摩尔当量)并进行了搅拌。在稠合反应结束后,加入meoh(55ml)并进行搅拌,将沉淀物进行过滤并通过甲醇与乙腈的混合溶剂(以体积比为1∶1)进行清洗之后使其减压干燥,从而获得了fmoc
‑
ser(tbu)
‑
tyr(tbu)
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
naphtag(1)(1.68g、产率96.6%)。
[0420]
esi
‑
ms(+)=2,227.5
[0421]
(实施例14:fmoc
‑
trp(boc)
‑
ser(tbu)
‑
tyr(tbu)
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
naphtag(1)的合成)
[0422]
使fmoc
‑
ser(tbu)
‑
tyr(tbu)
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
naphtag(1)(1.07g、0.48mmol)溶解于氯仿(1.2ml)中,且加入dbu(2.0摩尔当量)并进行了搅拌。在脱保护反应结束后,加入了包含甲磺酸(2.1摩尔当量)和n
‑
甲基吗啉(2.1摩尔当量)的氯仿溶液之后,添加fmoc
‑
trp(boc)
‑
oh(1.25摩尔当量)、comu(1.25摩尔当量)并进行了搅拌。在稠合反应结束后,加入meoh(38ml)并进行搅拌,将沉淀物进行过滤并通过甲醇与乙腈的混合溶剂(以体积比为1∶1)进行清洗之后使其减压干燥,从而获得了fmoc
‑
trp(boc)
‑
ser(tbu)
‑
tyr(tbu)
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
naphtag(1)(1.13g、产率93.5%)。
[0423]
esi
‑
ms(+)=2,513.6
[0424]
(比较例2:fmoc
‑
pro
‑
o
‑
tag(1)的合成)
[0425]
使3,5
‑
双(二十二酰氧基)苯甲醇(也标记为“tag(1)”。)(2.27g、3.0mmol)和fmoc
‑
pro
‑
oh(2.0摩尔当量)溶解于氯仿(6.0ml)中,且添加4
‑
二甲基氨基吡啶(0.1摩尔当量)和二异丙基碳二酰亚胺(2.0摩尔当量)并进行了搅拌。在稠合反应结束后,加入meoh(70ml)并进行搅拌,将沉淀物进行过滤并通过甲醇与乙腈的混合溶剂(以体积比为1∶1)进行清洗之后使其减压干燥,从而获得了fmoc
‑
pro
‑
o
‑
naphtag(1)(3.04g、产率94.0%)。
[0426]
esi
‑
ms(+)=1,074.9
[0427]
(比较例3:fmoc
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
tag(1)的合成)
[0428]
使fmoc
‑
pro
‑
o
‑
tag(1)(2.0g、1.86mmol)溶解于氯仿(4.6ml)中,且加入dbu(2.0摩尔当量)并进行了搅拌。在脱保护反应结束后,加入了包含甲磺酸(2.1摩尔当量)和n
‑
甲基吗啉(2.1摩尔当量)的氯仿溶液之后,添加fmoc
‑
leu
‑
arg(pbf)
‑
oh(1.25摩尔当量)、comu(1.25摩尔当量)并进行了搅拌。在稠合反应结束后,加入meoh(140ml)并进行搅拌,将沉淀物进行过滤并通过甲醇与乙腈的混合溶剂(以体积比为1∶1)进行清洗之后使其减压干燥,从而获得了fmoc
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
tag(1)(2.73g,产率90.1%)。
[0429]
esi
‑
ms(+)=1,610.1
[0430]
(比较例4:fmoc
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
tag(1)的合成)
[0431]
使fmoc
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
tag(1)(2.23g、1.40mmol)溶解于氯仿(3.5ml)中,且加入dbu(2.0摩尔当量)并进行了搅拌。在脱保护反应结束后,加入了包含甲磺酸(2.1当量)和n
‑
甲基吗啉(2.1摩尔当量)的氯仿溶液之后,添加fmoc
‑
dleu
‑
oh(1.25摩尔当量)、comu(1.25摩尔当量)并进行了搅拌。在稠合反应结束后,加入meoh(80ml)并进行搅拌,将沉淀物进行过滤并通过甲醇与乙腈的混合溶剂(以体积比为1∶1)进行清洗之后使其减压干
燥,从而获得了fmoc
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
tag(1)(2.23g、产率92.3%)。
[0432]
esi
‑
ms(+)=1,709.2
[0433]
(比较例5:fmoc
‑
tyr(tbu)
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
tag(1)的合成)
[0434]
使fmoc
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
tag(1)(2.00g、1.17mmol)溶解于氯仿(3.0ml)中,且加入dbu(2.0摩尔当量)并进行了搅拌。在脱保护反应结束后,加入了包含甲磺酸(2.1摩尔当量)和n
‑
甲基吗啉(2.1摩尔当量)的氯仿溶液之后,添加fmoc
‑
tyr(tbu)
‑
oh(1.25摩尔当量)、comu(1.25摩尔当量)并进行了搅拌。在稠合反应结束后,加入meoh(75ml)并进行搅拌,将沉淀物进行过滤并通过甲醇与乙腈的混合溶剂(以体积比为1∶1)进行清洗之后使其减压干燥,从而获得了fmoc
‑
tyr(tbu)
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
naphtag(1)(1.98g、产率87.8%)。
[0435]
esi
‑
ms(+)=1,928.3
[0436]
(比较例6:fmoc
‑
ser(tbu)
‑
tyr(tbu)
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
tag(1)的合成)
[0437]
使fmoc
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
tag(1)(1.63g、0.78mmol)溶解于氯仿(2.0ml)中,且加入dbu(2.0摩尔当量)并进行了搅拌。在脱保护反应结束后,加入了包含甲磺酸(2.1摩尔当量)和n
‑
甲基吗啉(2.1摩尔当量)的氯仿溶液之后,添加fmoc
‑
ser(tbu)
‑
oh(1.25摩尔当量)、comu(1.25摩尔当量)并进行了搅拌。在稠合反应结束后,加入meoh(55ml)并进行搅拌,将沉淀物进行过滤并通过甲醇与乙腈的混合溶剂(以体积比为1∶1)进行清洗之后使其减压干燥,从而获得了fmoc
‑
ser(tbu)
‑
tyr(tbu)
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
tag(1)(1.26g、产率78.2%)。
[0438]
esi
‑
ms(+)=2,071.4
[0439]
(比较例7:fmoc
‑
trp(boc)
‑
ser(tbu)
‑
tyr(tbu)
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
tag(1)的合成)
[0440]
使fmoc
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
tag(1)(1.07g、0.48mmol)溶解于氯仿(1.2ml)中,且加入dbu(2.0摩尔当量)并进行了搅拌。在脱保护反应结束后,加入了包含甲磺酸(2.1摩尔当量)和n
‑
甲基吗啉(2.1摩尔当量)的氯仿溶液之后,添加fmoc
‑
trp(boc)
‑
oh(1.25摩尔当量)、comu(1.25当量)并进行了搅拌。在稠合反应结束后,加入meoh(38ml)并进行搅拌,将沉淀物进行过滤并通过甲醇与乙腈的混合溶剂(以体积比为1∶1)进行清洗之后使其减压干燥,从而获得了fmoc
‑
trp(boc)
‑
ser(tbu)
‑
tyr(tbu)
‑
dleu
‑
leu
‑
arg(pbf)
‑
pro
‑
o
‑
tag(1)(0.44g、产率38.7%)。
[0441]
esi
‑
ms(+)=2,357.56
[0442]
将结果总结示于表2中。
[0443][0444]
如表2所示,关于实施例9~实施例14中所使用的式(1)所表示的稠合多环芳香族烃化合物,与比较例2~比较例7中所使用的化合物相比,所获得的肽化合物的产率优异。
[0445]
并且,如表2所示,可知即使是总产率,式(1)所表示的稠合多环芳香族烃化合物的产率也优异。
[0446]
2019年2月28日所申请的日本专利申请第2019
‑
035853号的公开的其整体被作为参考而编入本说明书中。
[0447]
本说明书中所记载的所有文献、专利申请及技术规格与具体且单独记载每个文献、专利申请及技术规格被作为参考而编入的情况相同程度地,作为参考而编入本说明书中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1