用于在包含发夹环的多核苷酸模板的末端上产生非对称接头并从其测序的方法与流程
用于在包含发夹环的多核苷酸模板的末端上产生非对称接头并从其测序的方法
1.相关申请的交叉引用
2.本技术按照美国法典第35卷第119条要求2019年10月25日提交的美国临时申请62/926,360的优先权,其公开内容以引用方式并入本文以用于所有目的。
技术领域
3.本公开整体涉及用于在包含发夹环的多核苷酸的末端上产生非对称接头并从其测序的方法。
4.以引用方式并入序列表
5.本技术随附的是于2020年10月19日创建的名称为“序列表_st25.txt”的序列表,其具有784字节的数据,在ibm-pc,ms-windows操作系统上进行机器格式化。该序列表据此全文以引用方式并入以用于所有目的。
背景技术:
6.采用封闭端双链模板的测序平台理想地需要在测序模板的末端处的两种不同接头序列。此类末端非对称性使得单个测序引物和聚合酶仅结合到封闭端模板的一端,并且每个模板分子仅产生一个序列读数。目前这在标准文库构建的情况下是不可能的,其中相同的序列附加到模板的两端,因此将泊松伪影引入测序中,即,一些模板不具有结合的引物/聚合酶,一些具有一个结合的引物/聚合酶,而一些必须有结合的引物/聚合酶(每一端各一个)。
技术实现要素:
7.本公开提供了用于在包含发夹环的多核苷酸模板的末端上产生非对称接头的方法。通过启用非对称接头,可避免由标准方法发送的泊松伪影,从而提高测序文库的转化收率。此外,本文所公开的方法简化了文库准备工作流程,并允许在测序平台上进行文库准备的一些步骤。
8.在一个实施方案中,本发明提供了一种由具有游离5’端和3'端的双链核酸模板产生非对称封闭端双链核酸模板的方法,该方法包括:(a)将第一基于核酸的发夹或哑铃接头附接到包含游离5’端和3'端的双链核酸模板的3'端;(b)使用进行性聚合酶从所述核酸发夹的每个3'端延伸与双链核酸模板互补的序列,以产生两个长发夹双链体模板,其中该双链体模板的一端包含封闭发夹(“发夹端”),并且该双链体的另一端包含游离3'-链端和游离5'-链端(“自由端”);(c)通过以下步骤封闭每个长发夹双链体模板的自由端以形成非对称封闭端双链核酸模板:(i)将第二基于核酸的发夹或哑铃接头连接到双链体模板的自由端;或者(ii)使用teln原核端粒酶封闭该双链体模板的自由端,其中该双链体模板的自由端被设计成包括teln识别序列。在本文所示实施方案的另一个实施方案中,双链核酸模板是双链dna模板。在本文所示实施方案的另一个实施方案中,双链核酸模板的5’端和3'端被
去磷酸化并进行末端修复。在本文所示实施方案的另一个实施方案中,双链核酸模板具有齐平5’端和3'端。在本文所示实施方案的另一个实施方案中,双链核酸模板具有带a尾的3'端。在本文所示实施方案的另一个实施方案中,使用连接酶将第一基于核酸的发夹或哑铃接头连接到双链核酸模板的3'端。在本文所示实施方案的另一个实施方案中,连接酶为t4 dna连接酶或t3dna连接酶。在本文所示实施方案的另一个实施方案中,第一基于核酸的发夹或哑铃接头包含齐平端或t尾端。在本文所示实施方案的另一个实施方案中,第一基于核酸的发夹接头包括y形接头。在本文所示实施方案的某个实施方案中,由彼此结合的两个第一基于核酸的发夹或哑铃接头形成的二聚体通过使用尺寸选择或尺寸排阻技术去除。在本文所示实施方案的另一实施方案中,进行性聚合酶为phi29聚合酶。在本文所示实施方案的另一个实施方案中,第二基于核酸的发夹或哑铃接头包含齐平端或t尾端。在本文所示实施方案的另一个实施方案中,在步骤(c)之前,用产生5’悬端的限制性酶消化所述长发夹双链体模板。在本文所示实施方案的另一个实施方案中,在步骤(c)之前,用产生3’悬端的限制性酶消化所述长发夹双链体模板。在本文所示实施方案的另一个实施方案中,第二基于核酸的发夹或哑铃接头包含悬端序列,所述悬端序列与经消化的长发夹双链体模板的悬端序列互补。在本文所示实施方案的另一个实施方案中,使用多核苷酸激酶和连接酶将第二基于核酸的发夹或哑铃接头连接到双链体模板的自由端。在本文所示实施方案的另一个实施方案中,由彼此结合的两个第二基于核酸的发夹或哑铃接头形成的二聚体通过使用尺寸选择或尺寸排阻技术去除。在本文所示实施方案的另一个实施方案中,teln原核端粒酶来自噬菌体n15,并且teln原核端粒酶在teln识别序列处切割该长发夹双链体模板,并且在该切割位点处留下共价封闭端。在本文所示实施方案的另一个实施方案中,本文所公开的方法还包括以下步骤:(c')使用滚环复制产生包含多顺反子扩增的非对称封闭端双链核酸模板的纳米球复合物。在本文所示实施方案的另一个实施方案中,本文所公开的方法还包括以下步骤:(d)使用测序引物和聚合酶对非对称封闭端双链核酸模板或纳米球复合物进行测序。在本文所示实施方案的另一个实施方案中,步骤(b)、步骤(c)(ii)和步骤(d)可作为一锅反应组合在一起。在本文所示实施方案的另一个实施方案中,步骤(b)、步骤(c)(ii)和步骤(d)在自动测序平台的孔中进行。
9.在某个实施方案中,本公开还提供了一种由包含互补发夹环的标记dna产生非对称双链核酸模板的方法,该方法包括:(i)产生在每条链的5'端处包含互补发夹环的标记dna,其中所述发夹环包含碱基配对转座酶识别序列,并且其中在所述标记dna的5'端和3'端之间存在单链序列的空位;(ii)使用空位-填充-连接反应填充标记dna的5'端和3'端之间的空位以形成封闭端标记dna;(iii)在封闭端标记dna的每个发夹区域处在顶链中产生切口;(iv)使用进行性聚合酶从每个切口延伸与双链核酸模板互补的序列以产生两个长发夹双链体模板,其中该双链体模板的一端包含封闭发夹(“发夹端”),并且该双链体的另一端包含3'链端和5'链端(“自由端”);(v)通过以下步骤封闭每个长发夹双链体模板的自由端以形成非对称封闭端双链核酸模板:(a)将基于核酸的发夹或哑铃接头连接到双链体模板的自由端;或者(b)使用teln原核端粒酶封闭该双链体模板的自由端,其中该双链体模板的自由端被设计成包括teln识别序列。在本文所示实施方案的另一个实施方案中,转座酶识别序列为19-bp mosaic末端序列。在本文所示实施方案的另一个实施方案中,空位的长度为9个碱基对。在本文所示实施方案的另一个实施方案中,空位-填充-连接反应包含
klenow片段。在本文所示实施方案的另一个实施方案中,空位-填充-连接反应包含t4 dna聚合酶和ampligase。在本文所示实施方案的某个实施方案中,切口通过使用位点特异性核酸内切酶产生。在本文所示实施方案的另一个实施方案中,所述进行性聚合酶为phi29聚合酶。在本文所示实施方案的另一个实施方案中,基于核酸的发夹或哑铃接头包含齐平端或t尾端。在本文所示实施方案的另一个实施方案中,在步骤(v)之前,用产生5’悬端的限制性酶消化所述长发夹双链体模板。在本文所示实施方案的另一个实施方案中,在步骤(v)之前,用产生3’悬端的限制性酶消化所述长发夹双链体模板。在本文所示实施方案的另一个实施方案中,基于核酸的发夹或哑铃接头包含悬端序列,所述悬端序列与经消化的长发夹双链体模板的悬端序列互补。在本文所示实施方案的另一个实施方案中,使用多核苷酸激酶和连接酶将该基于核酸的发夹或哑铃接头连接到该双链体模板的自由端。在本文所示实施方案的另一个实施方案中,由彼此结合的两个基于核酸的发夹或哑铃接头形成的二聚体通过使用尺寸选择或尺寸排阻技术去除。在本文所示实施方案的另一个实施方案中,teln原核端粒酶来自噬菌体n15,并且teln原核端粒酶在teln识别序列处切割该长发夹双链体模板,并且在该切割位点处留下共价封闭端。在本文所示实施方案的另一个实施方案中,该方法还包括以下步骤:(v')使用滚环复制产生包含多顺反子扩增的非对称封闭端双链核酸模板的纳米球复合物。在本文所示实施方案的另一个实施方案中,该方法还包括以下步骤:(vi)使用测序引物和聚合酶对所述非对称封闭端双链核酸模板或纳米球复合物进行测序。在本文所示实施方案的另一个实施方案中,步骤(v)(ii)和步骤(vi)可一起组合成单个步骤。在本文所示实施方案的另一个实施方案中,步骤(v)(ii)和步骤(vii)在自动测序平台的孔中进行。
10.在一个具体实施方案中,本公开还提供了一种对包含互补发夹环的标记dna进行测序的方法,该方法包括:(i)产生在每条链的5'端包含互补发夹环的标记dna,其中所述发夹环包含碱基配对转座酶识别序列,并且其中在所述标记dna的5'端和3'端之间存在单链序列的空位;(ii)通过使用聚合酶在标记dna的每条延伸链的5’端和3'端处形成包含转座酶识别序列和互补转座酶识别序列的标记dna的两条延伸链;(iii)将标记dna的延伸链分离,并且在所述标记dna的每个延伸链的末端处使所述转座酶识别序列和互补转座酶识别序列再杂交,以形成互补发夹环;以及(iv)通过使用测序聚合酶对包含互补发夹环的该标记dna的延伸链进行测序。在本文所示实施方案的另一个实施方案中,步骤(iv)在自动测序平台的孔中进行。在本文所示实施方案的另一个实施方案中,在步骤(iv)的测序之前:(iii')产生包含标记dna的多顺反子扩增延伸链的纳米球复合物。
附图说明
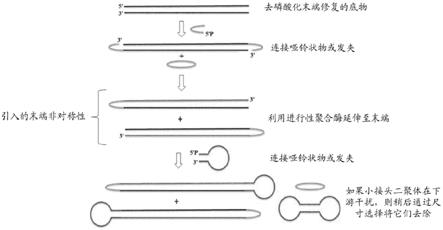
11.图1提供了示出通过将发夹的5'连接到双链多核苷酸模板的3'端并使用进行性聚合酶延伸发夹的3'端而形成发夹端和自由端来产生模板末端非对称性的方法的示意图。可将附加的发夹或哑铃状物连接到非对称模板的自由端以提供包含非对称区域的封闭端模板。可使用尺寸选择或尺寸排阻技术去除小接头二聚体。
12.图2提供了示出通过将y形接头的5'连接到双链多核苷酸模板的3'端并使用进行性聚合酶延伸该y形接头的3'端而形成发夹端和自由端来产生模板末端非对称性的方法的示意图。
13.图3提供了示出哑铃接头或简单发夹接头与非对称模板的“自由端”的齐平端连接的示意图。
14.图4提供了示出具有互补悬端序列的哑铃接头或简单发夹接头与具有5’悬端或3’悬端的经限制消化非对称模板的齐平端连接的示意图。
15.图5提供了示出在非对称模板序列中包含teln原核端粒酶位点,之后进行环化(seq id no:1和2)的示意图。
16.图6提供了示出一种方法的示意图,其中可使用自动测序平台对包含非对称区域的封闭端模板进行测序,由此可在测序平台的孔中原位执行如图所示的步骤中的至少一些。
17.图7提供了示出通过使用空位填充反应和在顶链中产生切口由标记dna制备非对称末端的方法的示意图。顶链中的切口可通过使用多种方法产生,包括使用位点特异性核酸内切酶、user消化、rna碱基和rna酶、二醇等。
18.图8提供了示出使用基于聚合酶冲洗的方法由标记dna产生3'端发夹环的示意图。
19.图9提供了示出用于由标记dna在仪器上产生模板和测序的方法。
具体实施方式
20.如本文所用,术语“包括”(“includes”、“including”、“includes”“including”)、“包含”(“contains”、“containing”)、“具有”(“have”、“having”)以及它们的任何变型旨在涵盖非排他性的包括,使得工艺、方法、方法限定的产品,或者包括、包含或含有元素或元素列表的物质组合物不仅包括那些元素,而且可包括未明确列出的或此类工艺、方法、方法限定的产品或物质组合物固有的其他元素。类似地,“包括”、“包含”、“具有”和“含有”是可互换的,并非旨在进行限制。
21.还应当理解,在各种实施方案的描述使用术语“包括”的情况下,本领域的技术人员将理解,在一些特定实例中,实施方案可替代地使用语言“基本上由...组成”或“由...组成”来描述。
22.如本文所用,除非上下文另有明确指示,否则单数形式“一个”、“一种”和“该”包括复数指代。因此,例如,提及“蛋白质”包括两种或更多种蛋白质的混合物等。
23.另外,除非另有说明,否则使用“或”表示“和/或”。
24.除了在操作实施例中,或在另外指明的情况下,本文所用的所有表示成分或反应条件的量的数字应理解为在所有情况下均用术语“约”修饰。当用于描述本公开的实施方案时,与百分比相关的术语“约”意指
±
1%、
±
2%、
±
3%、
±
4%、
±
5%。如本文所用,术语“约”可意指在如本领域普通技术人员所确定的特定值的可接受误差范围内,这可部分地取决于该值的测量或确定方式,例如,测量系统的限制。另选地,“约”可意指给定值的
±
20%、
±
10%、
±
5%或
±
1%的范围。另选地,具体地讲相对于生物系统或方法,该术语可意指在值的数量级内、在值的5倍内或在值的2倍内。在本技术和权利要求书中描述特定值的情况下,除非另外指明,否则可假设术语“约”的含义在该特定值的可接受误差范围内。另外,在提供值的范围和/或子范围的情况下,范围和/或子范围可包括该范围和/或子范围的端点。在一些情况下,变化可包括特定量的20%、10%、5%、1%、0.5%或甚至0.1%的量或浓度。
25.对于本文的数值范围的表述而言,明确设想了其间具有相同精确度的每个居间数
字。例如,对于6-9的范围而言,除了6和9之外,还设想了数字7和8,并且对于6.0-7.0的范围而言,明确地设想了数字6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9和7.0。
26.为了描述和公开可与本文的描述结合使用的方法,本文提及的所有出版物全文以引用方式并入本文。此外,关于在一个或多个出版物中呈现的与本公开中明确定义的术语相似或相同的任何术语,在所有方面都将以本公开中明确提供的术语定义为准。
27.应当理解,本公开不限于本文所述的具体方法、方案和试剂等,因为这些可有所变化。本文所用的术语仅出于描述具体实施方案或方面的目的,并非旨在限制本公开的范围。
28.如本文所用,术语“接头”是可连接到其他核酸的末端的单链或双链核酸分子。出于本公开的目的,除非另有说明,否则“接头”包括发夹或哑铃环。在一个具体实施方案中,本公开的接头是在5’端和/或3'端处包含单链核苷酸悬端的双链核酸(例如寡核苷酸)。在另一个实施方案中,单链悬端为1、2、3、4、5、6、7、8、9、10至20个核苷酸。
29.如本文所用,当结合多核苷酸使用时,术语“互补的”旨在表示包含核苷酸序列的多核苷酸,所述核苷酸序列能够在某些条件下选择性地退火为靶多核苷酸的鉴定区域。如本文所用,术语“基本上互补的”和语法上的等同物旨在表示包含核苷酸序列的多核苷酸,所述核苷酸序列包括能够在某些条件下特异性地退火为靶多核苷酸的鉴定区域。退火是指一个核酸与另一个核酸的核苷酸碱基配对相互作用,其导致双链体、三链体或其他更高有序结构的形成。主要相互作用通常通过watson-crick和hoogsteen型氢键具有核苷酸碱基特异性,例如,a:t、a:u和g:c。在某些实施方案中,碱基堆积和疏水相互作用也可有助于双链体稳定性。多核苷酸退火为靶核酸的互补或基本上互补的区域的条件是本领域熟知的,例如,如nucleic acid hybridization,a practical method,hames和higgins编辑,irl press,washington,d.c.(1985),以及weturine和davidson,mol.biol.31:349(1968)中所述。退火条件将取决于具体应用,并且可由本领域技术人员常规地确定,而无需过度实验。
30.如本文所用,术语“dntp”是指脱氧核苷三磷酸。ntp是指核糖核苷酸三磷酸。嘌呤碱基(pu)包括腺嘌呤(a)、鸟嘌呤(g)及它们的衍生物和类似物。嘧啶碱基(py)包括胞嘧啶(c)、胸腺嘧啶(t)、尿嘧啶(u)以及它们的衍生物和类似物。通过举例说明而非限制的方式,此类衍生物或类似物的示例为用报告基团修饰、生物素酰化、胺修饰、放射标记、烷基化等的那些,并且还包括硫代磷酸酯、亚磷酸酯、环原子修饰的衍生物等。报告基团可为荧光基团(诸如荧光素)、化学发光基团(诸如鲁米诺)、铽螯合剂(诸如能够通过延迟荧光进行检测的n-(羟乙基)乙二胺三乙酸)等等。
31.如本文所用,术语“杂交”是指其中两个单链多核苷酸非共价结合以形成稳定双链多核苷酸的过程。所得的双链多核苷酸是“杂交体”或“双链体”。杂交条件将通常包括小于约1m,更通常小于约500mm并且可小于约200mm的盐浓度。杂交缓冲液包括缓冲盐溶液,诸如5%sspe,或本领域已知的其他此类缓冲液。杂交温度可低至5℃,但通常大于22℃,并且更通常大于约30℃,并且通常超过37℃。杂交通常在严格条件下进行,即探针将与其靶子序列杂交但将不与其他非互补序列杂交的条件。严格条件是序列依赖性的并且在不同的情况下是不同的,并且可由本领域的技术人员常规地确定。
32.如本文所用,术语“标记”是指一种方法,其中组分例如接头被修饰,例如结合到另一个分子,以便有利于所述组分及其相关联的元素的分离。
33.如本文所用,术语“连接”、“连接的”及其语法上的等同物旨在表示通常在模板驱
动的反应中,在两个或更多个核酸(例如寡核苷酸和/或多核苷酸)的末端之间形成共价键或连接。键或连接的性质可广泛变化,并且连接可通过酶促或化学方式进行。如本文所用,连接通常通过酶促方式进行以在一个寡核苷酸的5'碳末端核苷酸与另一个核苷酸的3'碳之间形成磷酸二酯键。模板驱动的连接反应描述于以下参考文献中:美国专利4,883,750;5,476,930;5,593,826;和5,871,921,这些专利全文以引用方式并入本文。术语“连接”还涵盖磷酸二酯键的非酶促形成,以及寡核苷酸末端之间的非磷酸二酯共价键(诸如硫代磷酸酯键、二硫键等)的形成。
34.如本文所用,术语“核酸”意指核苷酸单体的单链和双链聚合物,包括通过核苷酸间磷酸二酯键或核苷酸间类似物,以及相关的抗衡离子(例如,h
+
、nh
4+
、三烷基铵、四烷基铵、mg
2+
、na
+
等)连接的2'-脱氧核糖核苷酸(dna)和核糖核苷酸(rna)。核酸可以是多核苷酸或寡核苷酸。核酸可完全由脱氧核糖核苷酸组成、完全由核糖核苷酸组成或由它们的嵌合混合物组成。核苷酸单体单元可包含本文所述的任何核苷酸,其包括但不限于天然存在的核苷酸和核苷酸类似物。核酸的大小通常在几个单体单元(例如5-40个)至数千个单体核苷酸单元的范围内。核酸包括但不限于基因组dna、edna、hnrna、mrna、rrna、trna、片段核酸、从亚细胞细胞器诸如线粒体或叶绿体获得的核酸、以及从可存在于生物样品之上或之中的微生物或dna或rna病毒获得的核酸。
35.如本文所用,术语“核苷酸类似物”是指具有修饰的核苷酸碱基部分、修饰的戊糖部分和/或修饰的磷酸酯部分,以及在多核苷酸的情况下修饰的核苷酸间键的合成类似物,如通常在别处所述(例如,scheit,nucleotide analogs,john wiley,new york,1980;englisch,angew.chem.int.ed.engl.30:613-29,1991;agarwal,protocols for polynucleotides and analogs,humana press,1994;以及s.verma和f.eckstein,ann.rev.biochem.67:99-134,1998)。示例性磷酸酯类似物包括但不限于硫代磷酸酯、二硫代磷酸酯、磷酸硒酸酯、磷酸二硒酸酯、苯胺磷酸硫醇酯、苯胺磷酸酯、氨基磷酸酯、硼酸磷酸盐,包括相关的抗衡离子,例如h
+
、nh
4+
、na
+
(如果存在此类抗衡离子)。示例性修饰的核苷酸碱基部分包括但不限于5-甲基胞嘧啶(5mc);c-5-丙炔基类似物,包括但不限于c-5丙炔基-c和c-5丙炔基-u;2,6-二氨基嘌呤,也称为2-氨基腺嘌呤或2-氨基-da);次黄嘌呤、假尿苷、2-硫代嘧啶、异胞嘧啶(isoc)、5-甲基isoc和异鸟嘌呤(isog;参见,例如美国专利5,432,272)。示例性修饰的戊糖部分包括但不限于锁定核酸(lna)类似物,包括但不限于bz-a-lna、5-me-bz-c-lna、dmf-g-lna和t-lna(参见,例如,the glen report,16(2):5,2003;koshkin等人,tetrahedron54:3607-30,1998),以及2'-或3'-修饰,其中2'-或3'-位为氢、羟基、烷氧基(例如甲氧基、乙氧基、烯丙氧基、异丙氧基、丁氧基、异丁氧基和苯氧基)、叠氮基、氨基、烷基氨基、氟、氯或溴。修饰的核苷酸间键包括磷酸酯类似物、具有非手性和不带电荷的亚基间连接的类似物(例如sterchak,e.p.等人,organic chern.,52:4202,1987)和具有非手性亚基间连接的不带电荷的吗啉基聚合物(参见,例如,美国专利5,034,506)。一些核苷酸间键类似物包括吗啉酸酯、缩醛和聚酰胺连接的杂环。
36.在“多核苷酸”的语境中,如本文所用,术语“变体”和“衍生物”是指包含已通过引入核苷酸置换、缺失或添加而改变的多核苷酸的核苷酸序列或多核苷酸的片段的多核苷酸。多核苷酸的变体或衍生物可以为包含多核苷酸的核苷酸序列的一部分的融合多核苷酸。如本文所用,术语“变体”或“衍生物”也指已经经化学修饰的多核苷酸或其片段,例如通
top microbiol immunol,204:125-43),p因子(gloor,2004,methods moi biol,260:97-114),tnj(ichikawa和ohtsubo,1990,j biol chem.265:18829-32)、细菌插入序列(ohtsubo和sekine,1996,curr.top.microbiol.immunol.204:1-26),逆转录病毒(brown等人,1989,proc natl acad sci usa,86:2525-9),以及酵母的逆转录转座子(boeke和corces,1989,annu rev microbiol.43:403-34)。用于将转座子末端插入靶序列中的方法可使用任何合适的转座子体系在体外进行,对于所述转座子体系,合适的体外转座体系是可用的或可基于本领域的知识开发。一般来讲,适用于本文提供的方法的体外转座体系至少需要足够纯度、足够浓度和足够体外转座活性的转座酶以及转座子末端,转座酶与所述转座子末端形成功能性复合物,所述功能性复合物具有能够催化转座反应的相应转座酶。可用于本发明的合适的转座酶转座子末端序列包括但不限于野生型、衍生型或突变型转座子末端序列,其与选自野生型、衍生型或突变型转座酶的转座酶形成复合物。
40.如本文所用,术语“转座体复合物”是指非共价结合到双链核酸的转座酶。例如,复合物可以是在支持非共价复合物形成的条件下与双链转座子dna一起预温育的转座酶。双链转座子dna可包括但不限于tn5 dna、tn5 dna的一部分、转座子末端组合物、转座子末端组合物的混合物或能够与转座酶(诸如高活性tn5转座酶)相互作用的其他双链dna。
41.术语“转座子末端”(te)是指双链核酸,例如双链dna,其仅表现出与在体外转座反应中起作用的转座酶或整合酶形成复合物所必需的核苷酸序列(“转座子末端序列”)。在一些实施方案中,转座子末端能够在转座反应中与转座酶形成功能性复合物。作为非限制性示例,转座子末端可包括由野生型或突变型tn5转座酶识别的19-bp外端(“oe”)转座子末端、内端(“ie”)转座子末端、或“嵌合末端”(“me”)转座子末端、或r1和r2转座子末端,如美国专利公布2010/0120098的公开内容中所示的,该专利文献的内容全文以引用方式并入本文。转座子末端可包括适用于在体外转座反应中与转座酶或整合酶形成功能性复合物的任何核酸或核酸类似物。例如,转座子末端可包含dna、rna、修饰碱基、非天然碱基、修饰主链,并且可以在一条链或两条链中包含切口。尽管术语“dna”有时在本公开中与转座子末端的组合物结合使用,但应当理解,任何合适的核酸或核酸类似物均可用于转座子末端。
42.采用封闭端双链测序模板的测序平台通常需要在测序模板的末端处的两种不同的接头序列。此类末端非对称性使得单个测序聚合物和聚合酶仅结合至封闭端测序模板的一端,并且每个模板分子仅产生一个序列读数。然而,此类末端非对称性目前不被此类测序平台用于文库构建。相反,这些测序平台具有对称的末端,其中测序引物可在测序模板的任一端结合,因此将泊松伪影引入至测序。换句话讲,一些测序模板将不具有结合的引物/聚合酶,一些测序模板将具有一个结合的引物,并且一些测序模板将具有在测序模板的任一端结合的两个引物。通过使用具有非对称末端的封闭端测序模板,可避免这些泊松伪影。因此,本公开的方法通过显著增加测序文库的转化收率来提供具有非对称末端的封闭端双链模板的产生,从而提供优于现有技术状态的显著改善。另外,本公开的方法还提供可在测序平台的孔中原位进行的步骤,从而允许在测序平台上进行文库构建。
43.如图1所示,基于核酸的发夹或哑铃接头附接到具有游离5’端和3'端的双链核酸模板。双链核酸模板可以为dsdna、dsrna,或形成双链分子的dna和rna的嵌合混合物。核酸的核苷酸可由通过磷酸二酯键而接合在一起的天然存在的核苷酸(例如a、g、c、t和u)构成。另选地,核酸的一个或多个核苷酸可以一些方式修饰(例如,核苷酸类似物)。核苷酸类似物
的示例包括已在核糖或脱氧核糖的2'位进行修饰以包含下列的核苷酸或核糖核苷酸:-甲氧基-乙基基团;-o-甲基基团;氟基团;2-氨基嘌呤;5-溴du;脱氧尿苷;2,6-二氨基嘌呤;脱氧肌苷;羟甲基dc;5-甲基dc;5-硝基吲哚;5-羟丁基-2'-脱氧尿苷;和8-氮杂-7-脱氮鸟苷。此外,核苷酸可通过除磷酸二酯键之外的硫代磷酸酯键连接在一起。双链核酸模板的游离5’端和3'端可以是齐平,或者具有一个或多个不匹配的碱基的悬端(例如3’悬端或5'悬端)。在某个实施方案中,双链核酸模板的游离5’端和/或3'端包含一个或多个腺嘌呤碱基的3'悬端。在另一个实施方案中,双链核酸模板的5’端和/或3'端已被去磷酸化并进行末端修复。
44.基于核酸的发夹或哑铃接头包含环回到其自身上的序列,使得末端可附接到双链核酸模板。基于核酸的发夹或哑铃接头可具有任何序列,或者可被设计成包含靶序列。靶序列的示例包括但不限于通用引物序列、通用测序引物序列、条形码序列、限制性酶序列、teln识别序列或上述序列的任何组合。基于核酸的发夹或哑铃接头可通过使用连接酶附接到双链核酸模板。连接酶的示例包括但不限于dna连接酶,如t4 dna连接酶、大肠杆菌dna连接酶、ampligase dna连接酶、t3 dna连接酶、t7 dna连接酶和taq dna连接酶;以及rna连接酶,如t4 rna连接酶1、t4 rna连接酶2、rtcb连接酶和嗜热自养甲烷杆菌连接酶。必要时,磷酸化或去磷酸化步骤可在将基于核酸的发夹或哑铃接头附接到双链核酸模板或标记dna之前进行。出于本公开的目的,可通过遗传工程技术对任何前述酶进行进一步修饰,以便增加酶的一个或多个功能,如持续性、热稳定性、保真度等。基于核酸的发夹或哑铃接头还可包括标签,以便允许检测和/或纯化包含序列的接头,诸如附接到核酸模板的接头。基于核酸的发夹或哑铃接头包含环回到其自身上的序列,使得末端可附接到双链模板序列或标记dna。出于本公开的目的,基于核酸的发夹或哑铃接头可为y形接头,所述y形接头包含其形成发夹环的序列的一部分。如图2所示,y形接头可用于由具有游离5’端和3'端的双链核酸模板产生非对称封闭端双链核酸模板。此外,通过将两个基于核酸的发夹或哑铃接头连接在一起而形成的任何二聚体可使用尺寸选择或尺寸排阻技术去除,如果此类二聚体干扰下游反应的话。
45.本公开还提供使用进行性聚合酶和游离核苷酸(例如,dntp或ntp),从核酸发夹的每个3'端延伸与双链核酸模板或标记dna互补的序列,以产生两个长发夹双链体模板,其中双链体模板的一端包含封闭发夹(“发夹端”),并且双链体的另一端包含游离3'-链端和游离5'-链端(“自由端”)。进行性聚合酶的示例包括但不限于phi29聚合酶、sp6 rna聚合酶和t7 rna聚合酶。
46.如图3和图4所示,本公开还提供了通过将第二基于核酸的发夹或哑铃接头附接到双链体模板来封闭长发夹双链体模板的“自由端”以形成非对称封闭端双链核酸模板。第二基于核酸的发夹或哑铃接头包含环回到其自身上的序列,使得末端可附接到双链体模板。如图3所示,双链体模板的第二基于核酸的发夹或哑铃接头可具有齐平端,并且可附接到也具有齐平端的双链体模板。如图4所示,第二基于核酸的发夹或哑铃接头可具有5'悬端或3'悬端,并且附接到具有互补悬端的双链体模板。双链体模板上的悬端可通过用限制性酶消化,并将第二基于核酸的发夹或哑铃接头设计成具有互补悬端来产生。第二基于核酸的发夹或哑铃接头可具有任何序列,或者可被设计成包含靶序列。靶序列的示例包括但不限于通用引物序列、通用测序引物序列、条形码序列、限制性酶序列、teln识别序列或上述序列
的任何组合。附接到模板的第二基于核酸的发夹或哑铃接头可包含与附接到双链核酸模板或标记dna的基于核酸的发夹或哑铃接头具有小于50%、大于50%、大于70%、大于80%、大于90%、大于95%、大于98%或100%同一性的序列。可通过使用连接酶将第二基于核酸的发夹或哑铃接头附接到双链体模板。连接酶的示例包括但不限于dna连接酶,如t4 dna连接酶、大肠杆菌dna连接酶、ampligase dna连接酶、t3 dna连接酶、t7 dna连接酶和taq dna连接酶;以及rna连接酶,如t4 rna连接酶1、t4 rna连接酶2、rtcb连接酶和嗜热自养甲烷杆菌连接酶。必要时,磷酸化或去磷酸化步骤可在将基于核酸的发夹或哑铃接头附接到双链体模板之前进行。出于本公开的目的,可通过遗传工程技术对任何前述酶进行进一步修饰,以便增加酶的一个或多个功能,如持续性、热稳定性、保真度等。第二基于核酸的发夹或哑铃接头还可包括标签,以便允许检测和/或纯化包含序列的接头,诸如附接到双链体模板的接头。通过将两个第二基于核酸的发夹或哑铃接头连接在一起而形成的任何二聚体可使用尺寸选择或尺寸排阻技术去除,如果此类二聚体干扰下游反应的话。然后可通过滚环扩增来扩增所得的非对称封闭端双链核酸模板以形成纳米球。将纳米球加载到自动测序平台的孔中;并且由其进行测序。纳米球结构可具有足够的尺寸以排除除一个模板纳米球之外的所有模板纳米球进入测序孔,从而避免来自各个孔的多个干扰测序反应。此外,纳米球工作流程步骤可在溶液或管中制备。
47.图5中示出了用于封闭双链体模板的另选实施方案。双链体模板包含teln识别序列,双链体模板可通过使用teln原核端粒酶(例如噬菌体n15原核端粒酶)“封闭”。在一个具体实施方案中,teln识别序列包含下列的56bp序列:
[0048]5’‑
tatcagcacacaattgcccattatacgcgcgtataatggactattgtgtgctgata-3’(seq id no:1)
[0049]5’‑
atagtcgtgtgttaacgggtaatatgcgcgcatattacctgataacacacgactat-3’(seq id no:2)
[0050]
如图6所示,本文所公开的方法的许多步骤可在序列平台的孔(如零模式波导(zmw)孔)内进行。例如,可用双链核酸模板加载zmw孔,所述双链核酸模板包含附接的发夹或哑铃接头、聚合酶、teln原核端粒酶、一种或多种测序引物、以及包含dntps或ntps的反应缓冲液。在第一次读取中,核酸发夹或哑铃序列的3'端延伸,从而产生包含封闭发夹的双链体模板(“发夹端”),并且双链体的另一端包含游离3'-链端和游离5'-链端(“自由端”)。这样做时,产生了由teln酶作用的teln识别序列,从而形成由测序引物结合的封闭端双链核酸模板,然后在后续读取中在自动化平台中进行测序。
[0051]
如图7-9所示,基于核酸的发夹或哑铃接头经由转座酶介导的标签化或转座反应附接到双链核酸模板。此类反应的示例在美国专利公布2010/0120098中有所描述,该文献全文以引用方式并入本文。转座体具有游离dna末端并且在“剪切和粘贴”反应中随机插入到dna中。因为dna末端是游离的,这有效地将dna片段化,同时添加到基于核酸的发夹或哑铃接头上。适用于本文提供的方法的示例性转座复合物包括但不限于由高活性tn5转座酶和tn5型转座子末端,或由mua转座酶和包含rl和r2末端序列的mu转座子末端,转座酶tn3和sleeping beauty转座酶形成的那些(参见例如,goryshin和reznikoff,j.biol.chem.273:7367,1998;和mizuuchi,cell 35:785,1983;savilahti等人,embo j.14:4893,1995;这些文献全文以引用方式并入本文)。然而,能够以足够的效率插入转座子末端以将基于核酸的
发夹或哑铃接头附接到双链核酸模板的5'端的任何转座体系。可用于所提供的方法的已知转座体系的其他示例包括但不限于,金黄色葡萄球菌tn552、tyl、转座子tn7、tn/o和is10、mariner转座酶、tel、p因子、tn3、细菌插入序列、逆转录病毒和酵母的逆转录酶(参见例如,colegio等人,2001,j.bacteriol.183:2384-8;kirby等人,2002,mol.microbiol.43:173-86;devine和boeke,1994,nucleic acids res.,22:3765-72;国际专利申请wo 95/23875;craig,1996,science 271:1512;craig,1996,review in:curr top microbiol immunol.204:27-48;kleckner等人,1996,curr top microbiol immunol.204:49-82;lampe等人,1996,embo j.15:5470-9;plasterk,1996,curr top microbiol immunol 204:125-43;gloor,2004,methods mol.biol.260:97-114;ichikawa和ohtsubo,1990,j biol.chem.265:18829-32;ohtsubo和sekine,1996,curr.top.microbiol.immunol.204:1-26;brown等人,1989,proc natl acad sci usa 86:2525-9;boeke和corces,1989,annu rev microbiol.43:403-34;这些文献全文以引用方式并入本文)。在一个具体实施方案中,标记模板包含嵌合末端(me)序列,并且转座酶是tn5转座酶。
[0052]
转座酶反应后,在每条链的5'端处包含互补发夹环的所得标记dna包含单链空位(例如,9bp空位),其可通过使用空位填充反应使用klenow片段、t4 dna聚合酶和/或ampligase进行填充(参见图7)。然后使用多种技术使所得的封闭端标记dna在顶链中产生切口,所述技术包括使用位点特异性核酸内切酶、user消化、掺入rna碱基且然后掺入rna酶、二元醇等。在具体实施方案中,位点特异性核酸内切酶用于在顶链中产生切口。可使用进行性聚合酶使具有切口的标记模板从每个切口延伸与双链核酸模板互补的序列以产生两个长发夹双链体模板,其中该双链体模板的一端包含封闭发夹(“发夹端”),并且该双链体的另一端包含3'链端和5'链端(“自由端”)。可使用上述相同方法“封闭”双链体模板,包括在双链体模板被设计成包含teln识别序列时使用teln原核端粒酶。
[0053]
另选地,在转座酶反应后可使用聚合酶冲洗(参见图8)。首先产生在每条链的5'端处包含互补发夹环的标记dna。此后,使用聚合酶合成在标记dna的每条延伸链的5’端和3'端处包含转座酶识别序列和互补转座酶识别序列的标记dna的两条延伸链。然后分离延伸链,并且将标记dna末端处的转座酶识别序列和互补转座酶识别序列再形成为发夹环。然后可将包含发夹环的延伸链加载到自动测序平台的孔中并使用测序聚合酶进行测序(参见图9)。
[0054]
在一些实施方案中,非对称封闭端双链核酸模板的测序包括使用合成测序、桥式pcr、链终止测序、杂交测序、纳米孔测序和连接测序中的一种或多种。
[0055]
在一些实施方案中,在本文提供的方法中使用的测序方法是合成测序(sbs)。在sbs中,监测核酸引物沿核酸模板(例如,靶核酸或其扩增子)的延伸,以确定模板中核苷酸的序列。基础化学过程可以是聚合(例如,由聚合酶催化)。在特定的基于聚合酶的sbs实施方案中,以模板依赖性方式将荧光标记的核苷酸添加到引物(从而使引物延伸),使得对添加到引物中的核苷酸的顺序和类型的检测可以用于确定模板的序列。
[0056]
可以使用利用循环反应的其他测序程序,诸如焦磷酸测序。焦磷酸测序检测当特定核苷酸掺入新生核酸链中时无机焦磷酸盐(ppi)的释放(ronaghi等人,analytical biochemistry 242(1),84-9(1996);ronaghi,genome res.11(1),3-11(2001);ronaghi等人,science 281(5375),363(1998);us 6,210,891;us 6,258,568和us.6,274,320,这些文
献中的每一篇以引用方式并入本文)。在焦磷酸测序中,所释放的ppi可通过atp硫酸化酶立即转化成三磷酸腺苷(atp)来检测,并且所产生atp的水平可经由荧光素酶产生的光子来检测。因此,可经由发光检测系统来监测测序反应。用于基于荧光的检测系统的激发辐射源不是焦磷酸测序程序所必需的。可适于对根据本公开产生的扩增子应用焦磷酸测序的可用流体系统、检测器和程序在例如wipo专利申请序列pct/us11/57111、美国专利公布2005/0191698a1、美国专利7,595,883和美国专利7,244,559中有所描述,所述专利文献中的每一者均以引用方式并入本文。
[0057]
一些实施方案可利用涉及dna聚合酶活性的实时监测的方法。例如,可以通过带有荧光团的聚合酶与γ-磷酸标记的核苷酸之间的荧光共振能量转移(fret)相互作用或者利用零模式波导(zmw)来检测核苷酸掺入。用于基于fret的测序的技术和试剂在例如以下文献中描述:levene等人,science,299,682
–
686(2003);lundquist等人,opt.lett.33,1026
–
1028(2008);korlach等人,proc.natl.acad.sci.usa 105,1176
–
1181(2008),这些文献的公开内容以引用方式并入本文。
[0058]
一些sbs实施方案包括检测在核苷酸掺入延伸产物时释放的质子。例如,基于释放质子的检测的测序可使用可从ion torrent公司(guilford,ct,life technologies子公司)商购获得的电检测器和相关技术或在美国专利公布2009/0026082 a1;美国专利公布2009/0127589a1;美国专利公布2010/0137143 a1;或美国专利公布2010/0282617 a1中所述的测序方法和系统,这些专利文献中的每一者均以引用方式并入本文。本文阐述的使用动力学排阻来扩增靶核酸的方法可以容易地应用于用于检测质子的基板。更具体地,本文阐述的方法可以用于产生用于检测质子的扩增子克隆群体。
[0059]
另一种有用的测序技术是纳米孔测序(参见例如,deamer等人,trends biotechnol.18,147-151(2000);deamer等人,acc.chem.res.35:817-825(2002);li等人,nat.mater.2:611-615(2003),这些文献的公开内容以引用方式并入本文)。在一些纳米孔实施方案中,靶核酸或从靶核酸除去的单独核苷酸穿过纳米孔。当核酸或核苷酸穿过纳米孔时,可通过测量孔的电导率的波动来识别每种核苷酸类型。(美国专利7,001,792;soni等人,clin.chem.53,1996
–
2001(2007);healy,nanomed.2,459
–
481(2007);cockroft等人,j.am.chem.soc.130,818
–
820(2008),这些文献的公开内容以引用方式并入本文)。
[0060]
根据前面的描述,将显而易见的是,可对本文所述的发明进行变型和修改以将其用于各种用途和条件。因此,此类实施方案也在以下权利要求书的范围内。
[0061]
本文中对变量的任何定义中的要素列表的表述包括将该变量定义为所列要素的任何单个要素或组合(或子组合)。本文对实施方案的表述包括作为任何单个实施方案或与任何其他实施方案或其部分组合的那个实施方案。
[0062]
本说明书中提及的所有专利和出版物均以引用方式并入本文,其程度如同每个独立的专利和出版物被具体且单独地指出以引用方式并入那样。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1