消除Sirt2的嵌合T细胞的制作方法
消除sirt2的嵌合t细胞
1.相关申请的交叉引用
2.本技术通过引用整体并入本文,要求于2019年2月8日递交的美国临时申请第62/803,101号和于2019年6月5日递交的美国临时申请第62/857,586号的优先权。
3.关于联邦资助研究或开发的声明
4.本发明是在国家卫生研究院授予的基金号ca194273下,在政府支持下完成的。政府对本发明享有一定权利。
5.序列表
6.本技术包含以电子形式提交的的序列表,该序列表为于2020年2月5日创建的,标题为“320803
‑
2330sequence listing_st25”的ascii.txt文件。序列表的内容以其整体并入本发明。
背景技术:
7.靶向免疫突触内免疫检查点的免疫疗法已成为一种范例转移方法,显示出前所未有的成功(pardoll,d.m.,nat rev cancer,2012.12(4):252
‑
64)。尽管有这种突破,许多癌症仍然是不可治愈的,并且增强肿瘤免疫的替代策略也是至关重要的(wei,s.c.,et al.cancer discov,2018.8(9):1069
‑
1086;gide,t.n.,et al.clin cancer res,2018.24(6):1260
‑
1270)。
8.越来越多的共识是免疫细胞的代谢适应性对于其效应功能是至关重要的,并且改变的代谢框架有助于免疫逃避,特别是在代谢挑战性肿瘤微环境内(chang,c.h.,et al.cell,2015.162(6):1229
‑
41;o'neill,l.a.,et al.nat rev immunol,2016.16(9):553
‑
65;shevchenko,i.,et al.front immunol,2018.9:1816)。因此,t细胞与癌细胞最佳竞争的代谢操作是刺激产生性抗肿瘤应答的有吸引力的策略。
技术实现要素:
9.初始t细胞在代谢上是静止的,并依赖于氧化磷酸化(oxphos),一种从葡萄糖产生atp的高效途径,来从葡萄糖中生成atp(chang,c.h.,et al.cell,2013.153(6):1239
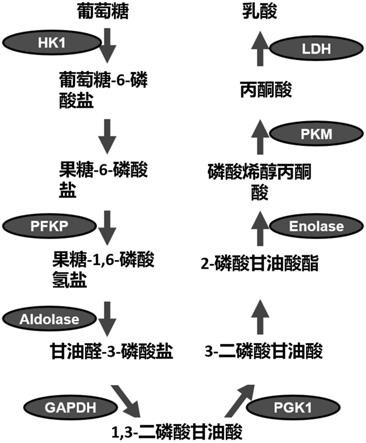
‑
51)。在激活后,尽管有氧气可用,但仍会发生有氧糖酵解的转换;这种现象称为warburg效应(warburg,o.,science,1956.124(3215):269
‑
70)。激活的t细胞经历显著的代谢重编程以维持它们增涨了的增殖和效应功能的能量需求。糖酵解似乎非常低效,因为atp/葡萄糖比例低;然而,它允许atp的快速产生,并产生更多数目的用于合成代谢的结构单元(lunt,s.y.,et al.annu rev cell dev biol,2011.27:441
‑
64)。与非增殖细胞的代谢一致,t记忆细胞(tm)恢复静止的oxphos代谢(pearce,e.l.,et al.science,2013.342(6155):1242454)。
10.组蛋白脱乙酰酶(hdac)和组蛋白乙酰转移酶(hat)是多种生物学过程的关键表观遗传调节剂(seto,e.,et al.cold spring harb perspect biol,2014.6(4):a018713)。先前的研究已经证明hdac在免疫应答中的直接作用和hdac抑制剂的潜在免疫调节活性
(dubovsky,j.a.,et al.curr pharm des,2010.16(3):268
‑
76;ellmeier,w.,et al.nat rev immunol,2018.18(10):617
‑
634)。最近,蛋白质乙酰化已经成为细胞代谢中的关键翻译后修饰,几乎糖酵解和三羧酸(tca)循环的每种酶都是乙酰化的(zhao,s.,et al.science,2010.327(5968):1000
‑
4),但其在免疫系统代谢中的相关性尚未被探究。
11.hdac iii类,也称为去乙酰化酶(sirtuin),是烟酰胺腺嘌呤二核苷酸(nad
+
)依赖性蛋白脱乙酰酶。去乙酰化酶家族由七个成员组成,它们在亚细胞定位和底物方面有所不同(guarente,l.,et al.n engl j med,2011.364(23):2235
‑
44;houtkooper,r.h.,et al.nat rev mol cell biol,2012.13(4):225
‑
238)。sirt2主要为胞质成员,但在有丝分裂期间可瞬时迁移至细胞核中以脱去乙酰组蛋白h4(vaquero,a.,et al.genes dev,2006.
12.20(10):1256
‑
61)。sirt2涉及抗衰老过程,并在对热量限制和氧化应激的应答中被诱导(gomes,p.,et al.trends pharmacol sci,2015.36(11):756
‑
768)。sirt2稳定糖异生酶磷酸烯醇丙酮酸羧激酶(pepck)并促进糖异生(jiang,w.,et al.mol cell,2011.43(1):33
‑
44)。
13.免疫学上,sirt2通过其对p65,nf
‑
κb亚基的负调节与抗炎表型相关(rothgiesser,k.m.,et al.j cell sci,2010.123(pt 24):4251
‑
8)。事实上,sirt2敲除小鼠对tnf
‑
α诱导的全身性炎症反应更敏感,并通过促炎巨噬细胞极化发展为严重形式的右旋葡聚糖硫酸钠(dss)诱导的结肠炎(lo sasso,g.,et al.plos one,2014.9(7):e103573;newton,k.,et al.nature,2014.506(7489):e4
‑
6)。然而,sirt2在t细胞稳态和肿瘤免疫中的作用仍然不清楚。鉴于sirt2与抗炎作用有关;推测sirt2抑制可能通过促进肿瘤特异性免疫应答而对癌症挑战具有保护作用。
14.如本发明所公开的,小鼠sirt2缺陷可改善t细胞对肿瘤的排斥反应。令人惊奇的是,糖酵解是t细胞中sirt2的关键靶标。在机理上,发现sirt2缺陷在代谢过程中重编t细胞,以增强在激活期间的有氧糖酵解,这最终导致针对肿瘤的过反应性(hyper
‑
reactive)t细胞效应功能。
15.因此,本发明公开了用于过继性细胞移植的,具有化学或遗传抑制的sirt2表达的淋巴细胞,例如肿瘤浸润淋巴细胞(til)。还公开了在体外抑制或消除诸如til的淋巴细胞中sirt2表达的方法,以及使用这些细胞治疗患有癌症的受试者的方法。
16.在一些情况下,用有效量的sirt2抑制剂在体外处理淋巴细胞以降低或消除sirt2的表达或活性。化学sirt2抑制剂是本领域已知的,包括agk2、ak
‑
1、sirreal2、tenovin
‑
6和thiomyristoyl(tm)、aem1和aem2。在一些实施方式中,sirt2抑制剂是寡核苷酸,例如反义寡核苷酸、sirna或grna。在一些情况下,sirt2抑制剂是对sirt2基因特异性的适配体或抗体。
17.在一些情况下,淋巴细胞通过体外基因工程以抑制或消除sirt2表达。遗传操作基因表达和活性的方法是本领域已知的,包括基因编辑和dna重组。
18.在一些情况下,淋巴细胞还表达嵌合受体。在一些实施方式中,嵌合受体包含嵌合抗原受体(car)多肽。car通常将抗原识别结构域与参与淋巴细胞激活的跨膜信号传导基序组合。例如抗原识别结构域可以是单克隆抗体(mab)的单链可变片段(scfv)或结合靶受体的天然配体的片段。car通常由三个结构域组成:胞外域、跨膜结构域和胞内域。胞外域包含抗原识别域。它还任选地含有信号肽(sp),使得car可以被糖基化并锚定在免疫效应细胞的
细胞膜中。跨膜结构域(td),顾名思义,将胞外域连接到胞内域,并且在细胞表达时位于细胞膜内。胞内域是car起作用的末端(business end),其在抗原识别后将激活信号传递至免疫效应细胞。例如,所述胞内域可以包含胞内信号传导结构域(isd)和任选的共刺激信号传导区(csr)。
19.在一些情况下,通过将编码嵌合受体的基因插入细胞的sirt2基因位点(gene loci)中来破坏sirt2基因。因此,本发明公开了一种表达嵌合受体的嵌合细胞,其中所述嵌合受体由转基因编码,并且其中所述转基因插入细胞基因组中破坏内源性sirt2蛋白的表达或活性的位置。例如转基因的位点特异性插入可以通过基因编辑技术如crispr或talen来完成。在一些情况下,使用两种不同的基因编辑系统:一种用于整合转基因,另一种用于有效去除所有sirt2变体(例如,通常对于它们来说,以外显子10为靶点)。
20.还公开了编码所述多肽的分离核酸序列、包含这些分离核酸的载体和含有这些载体的细胞。本发明公开的淋巴细胞可以是免疫效应细胞,选自α
‑
βt细胞、γ
‑
δt细胞、自然杀伤(nk)细胞、自然杀伤t(nkt)细胞、b细胞、先天淋巴样细胞(ilc)、细胞因子诱导的杀伤(cik)细胞、细胞毒性t淋巴细胞(ctl)、淋巴因子激活的杀伤细胞(lak)和调节性t细胞组成的组中。在一些实施方式中,淋巴细胞是til。
21.还公开了在受试者中提供抗癌免疫的方法,包括向受试者施用有效量的本发明公开的嵌合细胞,从而在受试者中提供抗肿瘤免疫。因此,公开了治疗受试者癌症的方法,包括从受试者收集淋巴细胞,例如肿瘤浸润淋巴细胞(til),在体外处理淋巴细胞以抑制sirt2表达,和将修饰的淋巴细胞移植回受试者体内。
22.在附图和下面的描述中阐述了本发明的一个或多个实施方式的细节。本发明的其它特征、目的和优点将从说明书和附图以及权利要求书中显现出来。
附图说明
23.图1a
‑
1g显示sirt2缺乏在体内增强t细胞介导的肿瘤排斥。图1a显示了注射b16f10细胞后wt和sirt2ko小鼠中肺转移结节的数量(n=5)。图1b显示wt和sirt2ko小鼠的皮下b16f10肿瘤生长曲线(n=5)。图1c显示在b16f10静脉注射前,用同型对照、抗cd4+或抗cd8+单克隆抗体处理的wt和sirt2ko小鼠中肺转移结节的数量(n=5)。图1d显示将从wt pmel和sirt2ko pmel小鼠的脾脏分离的cd8+t细胞过继转移到nsg小鼠中,并用b16f10细胞静脉注射。测定肺中转移结节的数量(n=8)。图1e
‑
1f显示从wt和sirt2ko小鼠皮下肿瘤分离的til。图1e显示通过cd44和cd62l表达分析了原初的效应器(teff)、效应器记忆(tem)和中枢记忆(tcm)cd8+t细胞亚群。象限中的数字表示细胞的百分比。右侧,til中每个子集的频率(n=3
‑
4)。图1f显示wt和sirt2ko til中pd
‑
1表达的表征。右侧,示出了pd1+cd8+til的频率(n=3
‑
4)。图1g显示wt和sirt2ko小鼠中肺转移结节的数目,所述小鼠用b16f10细胞静脉内激发,并用载体或抗pd
‑
1mab处理(n=6)。数据代表一个(图1f)、两个(图1c
‑
1e)、三个(图1b)和四个(图1a)独立实验。数据是平均值
±
s.e.m。p值通过双尾student's t检验(图1a
‑
1c,1f)、单向方差分析(图1d)或双向方差分析(图1e)测定。ns代表不显著、*p<0.05、**p<0.01、***p<0.001。
24.图2a
‑
2h显示sirt2ko t细胞在体外对抗原刺激过度反应。图2a显示了gp100刺激或不刺激用cfse标记的wt和sirt2kopmel脾细胞,并在激活后3天和4天通过cfse稀释测量
增殖情况。(n=7)。图2b
‑
2f显示wt和sirt2ko pmel脾细胞用gp100刺激或不刺激48小时的功能表征。图2b显示wt和sirt2ko pmel cd8+t细胞上的细胞内粒酶b的流式细胞术分析结果(n=7)。图2c显示了48小时的ifn
‑
γelispot分析(n=4)。图2d显示wt和sirt2ko pmel cd8+t细胞中细胞因子tnf
‑
α和inf
‑
γ表达的流式细胞术分析结果。象限中的数字表示细胞的百分比。图2e显示tnf
‑
α+ifn
‑
γ+cd8+pmel t细胞的频率(n=7)。图2f显示了在所示效应器:靶标比例下,在b16f10靶上共培养后,通过ldh释放测定对gp100刺激的wt和sirt2ko cd8+t细胞测定的细胞毒性活性(n=3)。图2g
‑
2h显示了分离自wt或sirt2ko小鼠b16f10肿瘤结节的cd3+til的功能表征。图2g显示用载体再攻击或在体外辐射b16f10细胞后,在cd3+til上进行ifn
‑
γelispot分析(n=3)。图2h显示在所示效应器:靶标比例下与b16f10共培养后,通过ldh释放测定对cd3+til测定的细胞毒性活性(n=3)。数据代表两个(图2g
‑
2h)、三个(图2a
‑
2e)和五个(图2f)独立实验。数据是平均
±
s。电子邮件p值通过双因素方差分析测定(图2c,2e
‑
2h)。*p<0.05、**p<0.01.01、***p<0.001、****p<0.0001。
25.图3a
‑
3f显示sirt2直接与糖酵解酶相互作用并调节它们的酶活性。图3a显示了通过ip
‑
lc
‑
ms/ms分析鉴定与sirt2相互作用的糖酵解酶的示意图。图3b显示糖酵解酶通过抗sirt2在激活的wt cd3
+
t细胞蛋白质提取物上的共免疫沉淀,随后用抗hk1、抗pfkp、抗pkm1/2、抗eno、抗pgk1、抗aldo、抗ldh、抗gapdh和抗sirt2抗体进行免疫印迹。图3c显示了通过抗hk1、抗pkm1/2、抗pgk1、抗ldh或抗gapdh对激活的wt cd3
+
t细胞蛋白提取物进行sirt2的共免疫沉淀,然后用抗sirt2或相应的特异性抗体进行免疫印迹。图3d显示通过在激活的wt和sirt2ko cd3
+
t细胞蛋白提取物上免疫沉淀pfkp、gapdh或乙酰化的赖氨酸,然后用抗
‑
乙酰基
‑
赖氨酸(抗
‑
ack)或相应的特异性抗体免疫印迹,测定gapdh和pfkp的乙酰化水平。图3b
‑
3d显示了使用等量总蛋白提取物的每个靶标的western印迹,显示为相同浓度的ip的对照(输入,input)。图3e显示来自ip
‑
lc
‑
ms/ms分析的sirt2下游脱乙酰靶的富集分析。使用错误发现率q值<0.01作为截止值。图3f显示了从激活的wt和sirt2ko cd3+t细胞提取物中评价醛缩酶(n=5)、enolase(n=4)、gapdh(n=5)、pfk(n=5)、己糖激酶(n=6)的糖酵解酶活性。数据是平均
±
s.e.m。p值通过双向anova测定。*p<0.05;**p<0.01;***p<0.001。数据代表至少一个(图3b
‑
3c)、两个(图3e
‑
3f)和四个(图3d)独立实验。
26.图4a
‑
4g显示sirt2ko t细胞中增加的糖酵解和阻断糖酵解逆转它们的高反应性。图4a显示了cd3刺激的wt的糖酵解通量,使用seahorse xf分析仪测量sirt2ko cd3
+
t细胞的细胞外酸化速率(ecar)。在所示的点注射葡萄糖、寡霉素(oligo)和2
‑
脱氧葡萄糖(2
‑
dg)。右:计算基础糖酵解速率、糖酵解能力和糖酵解储备(n=3)。图4b显示了分离自wt或sirt2ko小鼠的b16f10肿瘤小结的cd3
+
til的糖酵解通量,以ecar测定。右:计算基础糖酵解速率、糖酵解能力和糖酵解储备(wt;n=13,sirt2ko;n=7)。图4c显示了通过cd3刺激的wt和sirt2ko cd3+t细胞的胞外乳酸产生,使用ysi 2900biochemistry analyzer进行测量(n=3)。图4d显示了使用生物发光分析法从cd3刺激的wt和sirt2ko cd3
+
t细胞提取物(n=3)测量atp/adp比率。图4e显示了在未刺激的或gp100刺激的wt和sirt2ko pmel t细胞上用所示浓度的2
‑
dg进行ifn
‑
γelispot测定(n=3)。图4f显示了在b16f10靶标上共培养后,通过ldh释放测定在gp100刺激的wt和sirt2ko cd8+pmel t细胞上测定细胞毒性活性,所述靶标在所示的效应物:与赋形剂或10mm 2
‑
dg的目标比率(n=3)。图4g显示了在用载体或以所示浓度的2
‑
dg重新激发b16f10细胞后,在wt和sirt2ko cd3
+
til上进行ifn
‑
γelispot分析(n
=3)。数据代表两个(图4g)、三个(图4a
‑
4b、4e
‑
4f)和四个(图4c
‑
4d)独立实验。数据是平均
±
s.e.m。p值通过双尾t检验(a
‑
d)或双向anova(图4e
‑
4f)测定,*p<0.05.05,**p<0.01,***p<0.001,****p<0.0001。
27.图5a
‑
5c显示激活的sirt2ko t细胞中代谢重编。wt(n=5)和sirt2ko(n=4)用抗cd3在体外刺激cd8
+
t细胞72小时。从t细胞裂解物样品提取细胞内代谢物,并使用高分辨率lc
‑
ms/ms进行分析。图5a是显示差异表达的代谢物和无监督的分级聚类的相对丰度的热图。图5b显示了糖酵解、tca循环和谷氨酸途径中涉及的代谢物的相对水平。如虚线所示,将样品对wt t细胞标准化。数据是平均
±
s.e.m。p值由双尾student t
‑
检验测定,*p<0.05;**p<0.01。图5c显示与wt t细胞相比sirt2ko中上调代谢途径的代谢物组富集。使用错误发现率q值<0.15作为截止值。数据代表两个独立实验。
28.图6a
‑
6e显示sirt2的药理学抑制增强了人nsclc til中的糖酵解和效应器功能。用抗cd3与sirt2抑制剂agk2相对于媒介物的组合刺激从nsclc患者的肿瘤活组织检查样品分离的人til样品48小时。图6a表示使用seahorse xf分析仪以ecar测定的糖酵解通量。在指示的点b注射葡萄糖、寡霉素和2
‑
dg,由图6a计算基础糖酵解速率、糖酵解能力和糖酵解储备,n=4
‑
7。图6c显示用递增浓度的agk2对媒介物在cd3刺激的til上进行ifn
‑
γelispot测定另外48小时(n=5)。图6a
‑
6c显示了一个人til样品代表5个测试样品。图6d显示了五种人til样品的基础糖酵解速率和糖酵解能力,将其标准化为媒介物并如所示绘图。图6e显示五种人til样品的ifn
‑
γ斑点数目对载体标准化并如图所示作图。数据是平均
±
s.e.m。p值通过单侧anova(b
‑
c,e)或kruskal
‑
wallis检验(d)来确定,*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
29.图7a
‑
7d显示sirt2缺陷保护小鼠免受b16f10细胞攻击。图7a显示注射后18天收集的来自wt和sirt2ko小鼠用b16f10细胞静脉内攻击的肺。图7b显示从wt和sirt2ko小鼠解剖的皮下肿瘤,在注射后21天用b16f10细胞s.c.攻击。一只wt小鼠在第21天时间点之前达到肿瘤大小终点,因此未示出。图7c显示在注射后18天收集的,在b16f10静脉注射攻击前,用同种型对照、抗
‑
cd4+或抗
‑
cd8+单克隆抗体处理的wt和sirt2ko小鼠的肺。图7d显示来自nsg小鼠的肺,所述nsg小鼠用b16f10静脉注射攻击,并用媒介物、wt pmel cd8
+
t细胞或sirt2ko pmel cd8+t细胞处理,在注射后18天收集。数据代表两个(图7c
‑
7d)、三个(图7b)和四个(图7a)独立实验。
30.图8a
‑
8d显示b16f10激发小鼠的脾和淋巴结中的t细胞区室。图8a和8c显示了野生型和sirt2ko小鼠静脉内接受b16f10细胞攻击的脾细胞(图8a)和淋巴结t细胞(图8c)的代表性流式细胞术分析,对照为原初、效应记忆(em)和中枢记忆(cm)cd8+和cd4+t细胞亚群。象限中的数字表示细胞的百分比。图8b和8d显示了来自脾(图8b)和淋巴结(图8d)的每个亚组的频率(上)和绝对数目(下)。每组中n=5(图8b)和n=4(图8d)。数据是平均
±
s.e.m。p值通过双尾student's t
‑
检验测定。*p<0.05、**p<0.01、***p<0.001、****p<0.0001。数据代表两个?独立实验。
31.图9a至9h显示ip
‑
ms下拉衍生自蛋白质的肽的关键糖酵解途径酶碰撞诱导解离(cid)谱:己糖激酶
‑
1(图9a)、磷酸果糖激酶(图9c)、磷酸甘油酸激酶1(图9e)、烯醇化酶1(图9g)、丙酮酸激酶同工酶m1/m2(图9b)、乳酸脱氢酶(图9d)、甘油醛
‑3‑
磷酸脱氢酶(图9f)和醛缩酶(图9h)通过sirt2在激活的wt cd3+t细胞蛋白质提取物上的免疫沉淀,然后进行
lc
‑
ms/ms分析来检测。数据代表两个独立实验。
32.图10a
‑
10f显示糖酵解酶在sirt2ko t细胞中是高度乙酰化的。使用抗
‑
乙酰基
‑
赖氨酸抗体对wt和sirt2 cd3+t细胞蛋白提取物进行乙酰化蛋白的免疫沉淀,然后进行lc
‑
ms/ms分析。图10a至10f,左:ms/ms光谱与以下相匹配:(图10a)醛缩酶1的肽gilaadestgsiakr(seq id no:1)和y1,y 2片段表示乙酰化位点;(图10b)来自enolase的肽scnclllkvnqigsvteslqack(seq id no:2)和b7,b8片段表示乙酰化位点;(图10c)来自乳酸脱氢酶和y6,y7片段的肽fiipnivkysphck(seq id no:3)表示乙酰化位点;(图10d)来自磷酸甘油酸激酶1的肽svvlmshlgrpdgvpmpdkyslepvaaelk(seq id no:4)和y11片段表示乙酰化位点;(图10e)来自甘油醛
‑3‑
磷酸脱氢酶的肽wgeagaeyvvestgvfttmekagahlk(seq id no:5)和y6,y7片段指示乙酰化位点;和(图10f)来自丙酮酸激酶m的肽ccsgaiivltksgr(seq id no:6)和y3,y5片段指示乙酰化位点。图10a至10f,右侧:提取的离子色谱(eic)图显示sirt2ko样品相对于每种靶的wt的增加的强度。数据代表两个独立实验。
33.图11a
‑
11f显示sirt2ko相对于wt t细胞中增加的糖酵解。图11a至11b,左:糖酵解通量使用seahorse xf分析仪以ecar形式测量:(图11a)cd3刺激的wt(n=4)和sirt2ko(n=4)cd8+t细胞,以及(图11b)gp100刺激的wt(n=4)和sirt2ko(n=5)pmel cd8+t细胞。在所示的位点注射葡萄糖、寡霉素和2
‑
dg。右:由相应的曲线计算基础糖酵解速率、糖酵解能力和糖酵解储备量。图11c至11f,上部:糖酵解速率使用seahorsxf分析仪测量为质子流出速率(per),在:(图11c)cd3刺激的wt(n=4)和sirt2ko(n=4)cd3+t细胞,(图11d)从来自wt(n=11)或sirt2ko小鼠(n=6)(图11e)cd3
‑
刺激的wt(n=5)和sirt2ko(n=5)cd8+t细胞的b16f10肿瘤结节新鲜分离的cd3+til,以及(图11f)gp100
‑
刺激的wt(n=8)和sirt2ko(n=5)pmel cd8+t细胞。在所示的点注射抗霉素/鱼藤酮(anti/rot)和2
‑
dg。图11c至11f,下方:由相应的曲线计算基础糖酵解速率和补偿糖酵解。数据代表两个(图11a、11f)、三个(图11b、11d)和四个(图11c、11e)独立实验。数据是平均
±
s.e.m。p值通过双尾student's t
‑
检验测定。*p<0.05、**p<0.01、***p<0.001、****p<0.0001。
34.图12a
‑
12f显示用agk2阻断sirt2增加人t细胞的糖酵解和效应器功能。用抗cd3与sirt2抑制剂agk2(图12a
‑
12b,12e)或thiomyristoyl(tm)(图12c
‑
12d,12f)相对于媒介物的组合刺激从自我报告健康供体的外周血分离的人cd3+t细胞48小时。图12a和12c,上部:糖酵解通量使用seahorse xf分析仪以ecar测量:(图12a)agk2处理的cd3+t细胞(n=7
‑
8)和(图12c)tm处理的cd3+t细胞(n=4
‑
8)。在所示的位点注入葡萄糖、oligo和2
‑
dg。图12a和12c,下:由相应的曲线计算基础糖酵解速率、糖酵解能力和糖酵解储备量。图12b和12b,上部:糖酵解速率,使用seahorse xf分析仪测量per,在:(图12b)agk2处理的cd3+t细胞(n=2
‑
8)和(图12d)tm处理的cd3+t细胞(n=3
‑
5)。在所示的位置注射抗霉素/鱼藤酮和2
‑
dg。下:由相应的曲线计算基础糖酵解速率和补偿糖酵解。图12e至12f显示ifn
‑
γelispot分析在以下上进行:(图12e)agk2处理的人cd3+t细胞(n=6)和(图12f)tm处理的人cd3+t细胞(n=3
‑
6)与载体的比较48小时。数据是平均
±
s.e.m。p值由单路anova检验测定。*p<0.05、**p<0.01、***p<0.001、****p<0.0001。
35.图13a
‑
13c显示用agk2阻断sirt2增加了来自nsclc患者的人til的糖酵解和效应器功能。用抗cd3与sirt2抑制剂agk2相对于媒介物的组合刺激从nsclc患者的肿瘤活组织检查样品分离的人til样品48小时。图13a表示使用seahorse xf分析仪以ecar测定的糖酵
解通量。图13b表示由图13a算出的基础糖酵解速度、糖酵解能力和糖酵解储备量。患者1:n=3,患者2:n=3,患者3:n=4
‑
6,患者4:n=3。图13c显示用递增浓度的agk2对载体对cd3刺激的til进行ifn
‑
γelispot分析另外48小时。患者5:n=3,患者6:n=6,患者7:n=6,患者8:n=3
‑
6.数据是平均
±
s.e.m。p值由单路anova来决定。*p<0.05、**p<0.01、***p<0.001、****p<0.0001。
36.图14a
‑
14f显示t细胞中sirt2表达在激活后被诱导。图14a
‑
14c显示通过对wt和sirt2ko(图14a)、脾细胞和淋巴结(ln)t细胞(图14b)、富含cd3+的t细胞和(图14c)富含cd4+的t细胞、幼稚型(第0天)和刺激1
‑
3天的cd3的western印迹测定sirt2表达水平。肌动蛋白水平用作对照上样。图14d显示了通过流式细胞术在未刺激和cd3刺激的wt cd8+t细胞上测定sirt2表达水平,(n=2)。fmo,荧光minus one control。图14e显示通过流式细胞术(n=3)比较从wt小鼠皮下b16f10肿瘤结节分离的cd8+til的sirt2表达水平与脾cd8+t细胞。图14f显示通过流式细胞术确定来自til的cd8+t细胞的幼稚、效应器(teff)、效应器记忆(tem)和中央记忆(tcm)亚群中sirt2表达水平(n=3)。数据代表至少一个(图14a)、两个(图14c
‑
14f)和三个(图14b)独立实验。
37.图15a至15c显示了下列酶的糖酵解酶表达水平:通过对wt和sirt2ko cd3+富集的t细胞原初(第0天)和cd3刺激1
‑
3天的western印迹测定hk1、pfkp、pkm1/2、enolase、pgk1、醛缩酶、gapdh和ldh。肌动蛋白水平用作对照上样。图15b
‑
15c显示用指定浓度的agk2(图15b)或硫代肉豆蔻酰(tm)(图15c)培养人cd3+富集的t细胞48小时。微管蛋白的乙酰化水平通过蛋白质印迹在蛋白质提取物上测定。总α
‑
微管蛋白水平用作对照负荷。数据代表至少两个(图15a)、三个(图15c)和六个(图15b)独立实验。
38.图16a
‑
16o显示sirt2表达在tme中诱导,sirt2
‑
/
‑
t细胞对在体外抗原刺激反应过度。图16a显示通过流式细胞术比较人cd45 ra
‑
cd8+til与相应的pbmc cd45ra
‑
cd8+t细胞中的sirt2表达水平。fmo,荧光minus one control。显示了一个人类样品,代表11个患者样品。图16b显示了sirt2在cd45 ra
‑
cd8+中的表达水平,将通过流式细胞术分析的til相对于相应的pbmc cd45 ra
‑
cd8+t细胞标准化,并如所示绘图。图16c显示sirt2在人til中的表达水平与对免疫疗法的临床反应相关。pd,进行性疾病;pr,部分响应;n
‑
e,不可评估响应。图16d显示通过流式细胞术(n=3)比较了从wt小鼠皮下b16f10肿瘤小结分离的cd44hi cd8+til中sirt2表达水平与脾cd44hi cd8+t细胞。图16e和16f显示了通过对来自脾和淋巴结(ln)(图16e)的wt和sirt2
‑
/
‑
t细胞以及cd4+富集的t细胞(图16f)、原初(第0天)和cd3刺激1
‑
3天的western印迹测定sirt2表达水平。肌动蛋白水平用作上样对照。图16g显示了通过流式细胞术在未刺激和cd3刺激的wt cd8+t细胞(n=2)上测定sirt2表达水平。fmo,荧光minus one control。图16h显示了cfse标记的wt和sirt2
‑
/
‑
pmel脾细胞用gp100肽刺激或保持未刺激,通过流式细胞术测量激活后3和4天的cd8+t细胞增殖(n=7)。图16i
‑
16m显示wt和sirt2
‑
/
‑
pmel脾细胞的功能表征,所述脾细胞用gp100肽刺激或保持未刺激48小时。图16i显示进行ifn
‑
γelispot分析(n=4)。图16j显示了wt和sirt2
‑
/
‑
pmel cd8+t细胞上的细胞内粒酶b的流式细胞术分析(n=7)。图16k显示wt和sirt2
‑
/
‑
pmel cd8+t细胞中细胞因子tnf
‑
α和inf
‑
γ表达的流式细胞术分析。象限中的数字表示细胞的百分比。图16l显示tnf
‑
α+ifn
‑
γ+cd8+pmel t细胞的频率(n=7)。图16m显示在所示效应器下与b16f10靶细胞共培养后,通过ldh释放测定对gp100刺激的wt和sirt2
‑
/
‑
pmel cd8+t细胞测定细胞毒性活
性:目标比率(n=3)。图16n和16o显示了分离自wt或sirt2
‑
/
‑
小鼠的b16f10肿瘤结节的cd3+til的功能表征。图16n显示了用载体再攻击或在体外照射b16f10细胞后,对cd3+til进行ifn
‑
γelispot分析(n=3)。图16o显示在所示效应器下与b16f10靶细胞共培养后,通过ldh释放测定对cd3+til测定的细胞毒性活性:目标比率(n=3)。数据代表至少一个(图16a
‑
16c和16e)、两个(图16g、16d、16n和16o)和三个(图16f、16h
‑
16l)和五个(图16m)独立实验。数据为平均值
±
sem。p值通过配对双尾student's t
‑
检验(图16b)、非配对双尾student's t
‑
检验(图16c)和双向anova(图16i,16l
‑
16o)测定。*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
39.图17a
‑
17j显示sirt2与糖酵解酶和tca循环酶直接相互作用并削弱它们的酶活性。图17a和17b是糖酵解途径(图17a)和tca循环(图17b)的示意图。通过ip
‑
ms/ms分析鉴定的与sirt2相互作用的酶以红色表示。图17c和17d显示了通过抗sirt2抗体对来自激活wt cd3+t细胞的蛋白提取物进行的来自糖酵解途径的hk1、pfkp、pkm1/2、eno、pgk1、aldo、ldh、gapdh和来自tca循环的ogdh、aco2、sdha、suclg1(图17d)的共免疫沉淀,然后用抗sirt2和相应的特异性抗体进行免疫印迹。图17e和17f显示sirt2通过抗hk1、抗pkm1/2、抗pgk1、抗ldh、来自糖酵解途径的抗gapdh(图17e)和来自tca循环的抗ogdh、抗aco2、抗sdha、抗suclg1(图17f)在来自激活wt cd3+t细胞的蛋白质提取物上共免疫沉淀,然后用抗sirt2或相应的特异性抗体免疫印迹。图17g和17h显示了通过乙酰化赖氨酸(ack)、pfkp、gapdh或aco2在激活的wt和sirt2
‑
/
‑
cd3+t细胞蛋白提取物上的免疫沉淀,然后用抗ack或相应的特异性抗体免疫印迹,测定糖酵解途径的gapdh、pfkp(图17g)和tca循环的ogdh、aco2、sdha、suclg1(图17h)的乙酰化水平。使用等量总蛋白提取物的每个靶的蛋白质印迹显示为相同浓度的ip的对照(输入)。图17i和17j显示了从激活的wt和sirt2
‑
/
‑
cd3+t细胞提取物评估的醛缩酶(n=5)、烯醇化酶(n=4)、gapdh(n=5)、pfk(n=5)、来自糖酵解途径的己糖激酶(n=6)(图17i)和顺乌头酸酶(n=3)、suclg(n=6)、sdh(n=8)、来自tca循环的ogdh(n=6)(图17j)的酶活性。数据的平均值为
±ꢀ
sem。p值通过双尾student's t
‑
检验测定。*p<0.05、***p<0.001、****p<0.0001。
40.图18a
‑
18h显示sirt2与fao和谷氨酰胺分解酶直接相互作用。图18a和18d是fao(图18a)和谷氨酰胺分解(图18d)途径的示意图。通过ip
‑
ms/ms分析鉴定的与sirt2相互作用的酶以红色表示。图18b和18e显示了hadha、来自fao途径的hadha(图18b)和来自谷氨酰胺分解途径的asct2、gls(图18e)的共免疫沉淀,其通过抗sirt2抗体对来自激活wt cd3+t细胞的蛋白质提取物进行,然后用抗sirt2和相应的特异性抗体进行免疫印迹。图18c和18f显示了通过乙酰化的赖氨酸(ack)在激活的wt和sirt2
‑
/
‑
cd3+t细胞蛋白提取物上的免疫沉淀,然后用相应的特异性抗体免疫印迹,测定fao途径的hadha和hadha的乙酰化水平(图18c),以及谷氨酰胺分解途径的asct2和gls的乙酰化水平(图18f)。图18b
‑
18c和18e
‑
18f是使用等量总蛋白提取物的每个靶的western印迹,显示为ip的输入对照。图18g和18h显示了使用ysi 2900biochemistry分析仪从激活的wt和sirt2
‑
/
‑
cd3+t细胞培养基(n=3)测量谷氨酰胺消耗(图18g)和谷氨酸产生(图18h)。数据的平均值为
±
sem。p值通过双尾student's t
‑
检验测定。*p<0.05,**p<0.01。
41.图19a至19k显示sirt2
‑
/
‑
t细胞中增加的糖酵解和oxphos。图19a和19d显示了(左)使用seahorse xf分析仪测量的作为细胞外酸化(ecar)的糖酵解通量:cd3刺激的wt(n
=3)和sirt2
‑
/
‑
(n=3)cd3+t细胞(图19a);和从wt(n=13)或sirt2
‑
/
‑
小鼠(n=7)的b16f10肿瘤结节新鲜分离的cd3+til(图19d)。在所示的点注射葡萄糖、寡霉素(oligo)和2
‑
脱氧葡萄糖(2
‑
dg)。右,由相应的曲线计算基础糖酵解速率、糖酵解能力和糖酵解储备。图19b和19e(左)显示使用seahorse xf分析仪测量的糖酵解速率,以质子流出速率(per)表示:cd3刺激的wt(n=4)和sirt2
‑
/
‑
(n=4)cd3+t细胞(图19b);和从wt(n=11)或sirt2
‑
/
‑
小鼠(n=6)的b16f10肿瘤结节新鲜分离的cd3+til(图19e)。在所示的位点注射抗霉素a/鱼藤酮(anti/rot)和2
‑
dg。图19b和19e(右)显示了由相应曲线计算的基础糖酵解速率和补偿糖酵解。图19c和19f(左)显示了使用seahorse xf分析仪对cd3刺激的wt和sirt2
‑
/
‑
cd3+脾t细胞测量为耗氧率(ocr)的线粒体活性(图19c,n=3每组);和从wt小鼠(图19f,n=11)和sirt2
‑
/
‑
(n=8)小鼠的b16f10肿瘤结节新鲜分离的cd3+til。寡霉素(oligo)、fccp和抗霉素a/罗替宁(anti/rot)在所示的点注射。图19c和19f(右)显示了基础呼吸,最大呼吸和备用呼吸能力从相应的曲线计算。图19g显示了在用线粒体丙酮酸载体(uk5099)或gls(bptes)或cpt1a(依托泊苷)抑制剂处理的刺激的t细胞中测量氧消耗,以测定糖酵解、谷氨酰胺分解和fao作为线粒体呼吸燃料的相对贡献。图19h显示了使用seahorse xf分析仪对cd3刺激的wt(上图)和sirt2
‑
/(下图)cd3+脾t细胞(n=10
‑
12)的线粒体活性,以耗氧速率(ocr)测量。在所示的时间点注射bptes/etomoxir/uk5099、寡霉素(oligo)、fccp和抗霉素a/罗替宁(anti/rot)。图19i显示了使用seahorse xf分析仪对新鲜分离自wt(上图)和sirt2
‑
/(下图)小鼠(n=4
‑
7)的b16f10肿瘤结节的til测量的作为耗氧速率(ocr)的线粒体活性。在指定的时间点注射载体/依托莫韦、寡霉素(oligo)、fccp和抗霉素a/罗替宁(anti/rot)。图19j显示wt对sirt2
‑
/
‑
cd3+t细胞,其在完全培养基中激活3天并转移到底物限制的培养基中过夜。在测定前立即加入棕榈酸盐或bsa底物。在基础条件下和响应于载体或依托莫韦然后寡霉素、fccp和鱼藤酮/抗霉素的顺序注射测量ocr.wt对sirt2
‑
/
‑
cd3+t细胞的外源(棕色)和内源(黄色)fa消耗如方法部分(n=4
‑
6)中所述计算。图19k显示wt对sirt2
‑
/
‑
ot
‑
ii脾细胞用ova肽激活3天,随后在il
‑
15存在下再培养4天以产生tm细胞。左侧,ot
‑
ii cd4+t细胞通过cd3和cd4表达进行分析。象限中的数字表示排除死细胞后ot
‑
ii cd4+t细胞的百分比。右边,相对于wt ot
‑
ii tm细胞(n=4)的活sirt2
‑
/
‑
ot
‑
ii tm细胞的频率的图形表示。数据代表两个(图19e、19f、19j、19k)、三个(图19a、19c、19d、19i)和四个(图19b、19h)独立实验。数据为平均值
±
sem。p值通过双尾student's t检验测定(图19a
‑
19f,19j,19k)。*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
42.图20a
‑
20h显示了激活的sirt2
‑
/
‑
t细胞中的代谢重编程。图20a和20b显示了用抗cd3在体外刺激wt(n=5)和sirt2
‑
/
‑
(n=4)小鼠的cd8+富集的t细胞72小时。从t细胞裂解物中提取细胞内代谢物,并使用高分辨率lc
‑
ms/ms进行分析。图20a包含热图,其中无监督的分级聚类显示差异表达的代谢物的相对丰度。图20b显示了糖酵解、tca循环和谷氨酰胺分解中涉及的代谢物的相对水平。使用ysi 2900biochemistry分析仪测定胞外乳酸或乳酸盐的产生。如虚线所示,将样品对wt t细胞标准化。图20c显示了从图20a进行的sirt2
‑
/
‑
cd8+t细胞中与wt相比上调的代谢途径的代谢物组富集分析。使用错误发现率q值<0.15作为截止值。图20d显示了用抗cd3刺激或保持未刺激的wt(n=3)和sirt2
‑
/
‑
(n=3)小鼠脾细胞。在第3天,通过流式细胞术在cd8+t细胞上评估2
‑
nbdg摄取(左图)和glut1表达(右图)。图20e显示了用抗cd3在体外刺激wt(n=5)和sirt2
‑
/
‑
(n=6)小鼠的cd8+富集的t细胞72小
时。从t细胞裂解物中提取细胞内代谢物,并使用靶向高分辨率lc
‑
ms/ms进行分析。图20a显示游离肉碱、酰基coa和乙酰coa的相对水平。将样品对wt t细胞进行标准化,虚线表示1的比例,饼形图表示不同酰基肉碱(c2
‑
c18)的相对丰度。总数表示组合的酰基肉碱的量。图20f显示了通过对激活的wt和sirt2
‑
/
‑
cd4+t细胞rna提取物进行rna测序分析,测定相对cpt1a mrna表达水平。将样品对wt t细胞标准化(n=3)。图20g显示通过在激活的wt和sirt2
‑
/
‑
cd3+t细胞蛋白提取物上进行的western印迹测定cpt1a蛋白表达水平。gapdh水平用作上样对照。图20h显示了cd3刺激的wt中atp/adp比率,sirt2
‑
/
‑
cd3+t细胞提取物使用生物发光测定法测量(n=3)。数据代表至少一个(图20e和20f)、两个(图20a
‑
20c)、三个(图20d)和四个(图20g,20h)独立实验。数据为平均值
±
sem。p值通过双尾student's t
‑
检验测定(图20b、20e、20f、20h)。*p<0.05,**p<0.01。
43.图21a
‑
21g显示sirt2缺乏在体内增加t细胞介导的肿瘤排斥。图21a显示wt和sirt2
‑
/
‑
小鼠用b16f10细胞静脉内攻击的肺转移性结节的数目(n=5)。图21b显示wt和sirt2
‑
/
‑
小鼠的皮下b16f10肿瘤生长曲线(n=5)。图21c和21d显示了从wt和sirt2
‑
/
‑
小鼠皮下肿瘤分离的til。图21c显示饼图,其显示til中幼稚(tn)、效应细胞(teff)、效应记忆(tem)和中央记忆(tcm)cd8+t细胞亚群的平均百分比(n=3
‑
4)。图21d(左)显示通过流式细胞术对wt和sirt2
‑
/
‑
til中pd
‑
1表达的表征。图21d(右)显示pd1+的频率,显示cd8+til(n=3
‑
4)。图21e显示在b16f10静脉内攻击前用同种型对照、抗cd4或抗cd8单克隆抗体处理的wt和sirt2
‑
/
‑
小鼠中肺转移瘤的数目(n=5)。图21f显示将从wt pmel和sirt2
‑
/
‑
pmel小鼠的脾分离的cd8+t细胞过继转移到nsg小鼠中,并用b16f10细胞静脉内攻击。测定肺中转移性结节的数量(n=8)。图21g显示wt和sirt2
‑
/
‑
小鼠中肺转移性结节的数目,所述小鼠用b16f10细胞静脉内攻击,并用载体或抗pd
‑
1mab处理(n=6)。数据代表一次(图21g)、两次(图21c
‑
21f)、三次(图21b)和四次(图21a)独立实验。数据为平均值
±
sem。p值通过双尾student's t检验(图21a
‑
21b,21d
‑
21e,21g)或单向anova(图21f)测定。ns意为无显著性、*p<0.05、**p<0.01、***p<0.001。
44.图22a
‑
22f显示sirt2的药理学抑制增强了人nsclc til的代谢适合度和效应器功能。用抗cd3与sirt2抑制剂agk2的组合,相对于载体,刺激从nsclc患者的肿瘤活组织检查样品中分离的人til48小时。图22a (左)表示使用seahorse xf分析仪以ecar测定的糖酵解通量。在指定的时间点注射葡萄糖、寡霉素(oligo)和2
‑
dg。图22a(右)显示了由相应曲线计算的基础糖酵解速率、糖酵解能力和糖酵解储备。图22b显示了使用seahorse xf分析仪测量的耗氧速率(ocr)。图22a和22b:患者1:n=4
‑
7,患者2:n=4
‑
8;患者3:n=4
‑
7;患者4:n=3
‑
6;患者5:n=3。图22c显示用递增浓度的agk2对媒介物对cd3刺激的til进行ifn
‑
γelispot测定,另外48小时。患者1:n=5;患者2:n=3;患者3:n=6;患者4:n=3;患者5:n=3.图22d至22f显示五个人til样品的基础糖酵解速率、糖酵解能力(图22d)、ocr(图22e)和ifn
‑
γ斑点数目(图22f),将其相对于载体标准化并如所示绘图。数据为平均值
±
sem。p值通过单向anova确定(图22a
‑
22f)。*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
45.图23a和23b显示了在tme中诱导的sirt2表达。图23a是联合nivolumab和til治疗的用于晚期nsclc患者的i期临床试验的流程图。对来自11名患者的成对pbmc和til样品进行测试。3名患者获得部分应答(pr),5名患者在进行性疾病(pd)的til治疗中失败,3名患者不可评价(n
‑
e)。图23b显示了通过流式细胞术在11名患者中与相应的pbmc cd45 ra
‑
cd8+t
细胞相比,人cd45 ra
‑
cd8+til中的sirt2表达水平。fmo,荧光minus one control。
46.图24a和24b显示ip
‑
ms/ms分析鉴定关键糖酵解和tca
‑
循环酶为sirt2结合配偶体。sirt2对激活的wt cd3+t细胞蛋白质提取物的免疫沉淀,接着lc
‑
ms/ms分析。图24a显示了衍生自糖酵解酶的所选肽的碰撞诱导解离(cid)谱:检测己糖激酶1、磷酸果糖激酶p、醛缩酶a、甘油醛
‑3‑
磷酸脱氢酶、磷酸甘油酸激酶1、丙酮酸激酶m、烯醇化酶1和乳酸脱氢酶。图24b显示了从tca循环酶衍生的所选肽的cid谱:检测到顺乌头酸酶2,酮戊二酸脱氢酶,琥珀酰
‑
coa连接酶α亚基和琥珀酸脱氢酶α亚基。数据代表两个独立实验。
47.图25a
‑
25d显示sirt2与糖酵解酶和tca循环酶直接相互作用。图25a
‑
25d显示使用等量总蛋白提取物的每个靶的蛋白质印迹显示为对于共
‑
ip sirt2(图25a和25b)和反向共
‑
ip sirt2(图25c和25d)的相同浓度的对照(输入)。
48.图26a至26f显示糖酵解酶在sirt2
‑
/
‑
t细胞中高度乙酰化。使用抗
‑
乙酰基
‑
赖氨酸抗体对wt和sirt2
‑
/
‑
cd3+t细胞蛋白提取物进行乙酰化蛋白的免疫沉淀,然后进行lc
‑
ms/ms分析。图26a至26f(左)显示ms/ms光谱与以下相匹配:来自醛缩酶a的肽gilaadestgsiakr(seq id no:1)和y 1,y2片段指示乙酰化位点k42(图26a);来自甘油醛
‑3‑
磷酸脱氢酶的肽wgeagaeyvvestgvfttmekagahlk(seq id no:5)和y6,y7片段指示乙酰化位点k105(图26b);来自磷酸甘油酸激酶1的肽svvlmshlgrpdgvpmpdkyslepvaaelk(seq id no:4)和y 11片段指示乙酰化位点k75(图26c);来自烯醇化酶1的肽scnclllkvnqigsvteslqack(seq id no:2)和b7,b8片段表示乙酰化位点k343(图26d);来自丙酮酸激酶m的肽ccsgaiivltksgr(seq id no:6)和y3,y5片段指示乙酰化位点k433(图26e);和来自乳酸脱氢酶的肽fiipnivkysphck(seq id no:3)和y6,y7片段表示乙酰化位点k126(图26f)。图26a至26f(右)显示提取的离子色谱(eic)图,显示sirt2
‑
/
‑
样品中增加的乙酰化强度对每种靶的wt。数据代表两个独立实验。
49.图27a至27e显示了在sirt2
‑
/
‑
t细胞中tca循环酶是高度乙酰化的。使用抗
‑
乙酰基
‑
赖氨酸抗体对wt和sirt2
‑
/
‑
cd3+t细胞蛋白提取物进行乙酰化蛋白的免疫沉淀,然后进行lc
‑
ms/ms分析。图27a至27e(左)显示ms/ms光谱与以下相匹配:来自乌头酸酶2和y 13片段的肽nftgrndanpethafvtspeivtalaiagtlkfnpetdfltgkdgk(seq id no:7)表示乙酰化位点k506(图27a);来自异柠檬酸脱氢酶的肽nilggtvfrepiicknipr(seq id no:8)和y6片段表明乙酰化位点k155(图27b);来自琥珀酰
‑
coa连接酶的肽ssdeayaiakk(seq id no:9)和y 1和y2片段指示乙酰化位点k125(图27c);来自琥珀酸脱氢酶α亚基的肽isqlygdlkhlk(seq id no:10)和y3和y4片段指示乙酰化位点k544(图27d);和来自苹果酸脱氢酶的肽etectyfstplllgkk(seq id no:11)和y2片段指示乙酰化位点k296(图27e)。图27a至27e(右)显示提取的离子色谱(eic)图,显示sirt2
‑
/
‑
样品中乙酰化强度增加对每个靶的wt。数据代表两个独立实验。
50.图28a和28b显示t细胞中糖酵解酶和tca循环酶的表达水平。图28a和28b显示糖酵解酶的表达水平(图28a):hk1、pfkp、pkm1/2、eno1、pgk1、aldoa、ldh、gapdh和tca循环酶(图28b):通过在wt和sirt2
‑
/
‑
cd3+富集的原初t细胞(第0天)和cd3刺激的1
‑
3天上western印迹测定ogdh、aco2、sdha、suclg1。gapdh(图28a)和肌动蛋白(图28b)水平用作上样对照。数据代表至少两个独立实验。
51.图29a
‑
29g显示sirt2与fao和谷氨酰胺分解酶相互作用。图a和d,sirt2对激活的
天测定的c
‑
myc表达水平。gapdh水平用作上样对照。
54.图32a
‑
32c显示sirt2缺陷保护小鼠免于b16f10肿瘤攻击。图32a显示了注射后18天收集的来自wt和sirt2
‑
/
‑
小鼠用b16f10细胞i.v.攻击的肺。图32b显示从wt和sirt2
‑
/
‑
小鼠解剖的皮下肿瘤,所述小鼠在注射后21天用b16f10细胞s.c.攻击。一只wt小鼠在第21天时间点之前达到肿瘤大小终点,因此未示出。图32c显示从wt和sirt2
‑
/
‑
小鼠的b16f10皮下肿瘤分离的til。图32c显示通过cd44和cd62l表达分析了原初效应器(teff)、效应记忆(tem)和中枢记忆(tcm)cd8+t细胞亚群。象限中的数字表示细胞的百分比。图32示出了til之间的每个子集的频率被指示(n=3
‑
4)。数据代表两个(图32c)、三个(图32b)和四个(图32a)独立实验。数据为平均值
±
sem。p值通过双向anova测定(图32c)。*p<0.05,**p<0.01,***p<0.001。
55.图33a和33b显示b16f10激发的wt和sirt2
‑
/
‑
小鼠的脾和淋巴结中的t细胞区室。图33a和33c显示了wt和sirt2
‑
/
‑
小鼠经静脉注射用b16f10细胞攻击的脾细胞(图33a)和淋巴结t细胞(图33c)的代表性流式细胞术分析,对照为如cd44和cd62l所定义的原初、效应记忆(em)和中央记忆(cm)cd8+和cd4+t细胞亚群。象限中的数字表示细胞的百分比。图33b和33d显示了脾(图33b)和淋巴结(图33d)的每个亚组的频率(左)和绝对数目(右)。每组中n=5(图33b)和n=4(图33d)。数据代表两个独立实验。数据为平均值
±
sem。p值通过双尾student's t
‑
检验测定。*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
56.图34a和34b显示了b16f10激发的wt和sirt2
‑
/
‑
小鼠的脾中的免疫细胞区室。图33a和33b显示了在wt和sirt2
‑
/
‑
未接种的小鼠(图34a)和静脉内b16f10攻击的小鼠(图34b)的脾中通过流式细胞术分析cd4+、cd8+、不变的天然杀伤t(inkt)、调节性t细胞(treg)、天然杀伤t细胞(nk)、b细胞(b)、骨髓衍生的抑制细胞(mdsc)、单核细胞性树突细胞(modc)、常规dc 1,2(cdc 1,cdc2)和粒细胞(g)的频率;(n=4
‑
5)。数据代表两个独立实验。数据为平均值
±
sem。p值通过双尾student's t
‑
检验测定。*p<0.05,**p<0.01。
57.图35a和35b显示了cd27在来自b16f10攻击的小鼠的淋巴结的t细胞中表达的表征。用b16f10细胞静脉内攻击或不攻击wt和sirt2
‑
/
‑
小鼠18天。图35a,左图,含有直方图,显示了来自淋巴结的cd4+和cd8+t细胞亚群中cd27的表面表达。fmo,荧光减一。每组中测试的代表n=4
‑
5只小鼠的一只小鼠。图35a,右侧,显示了cd27
‑
t细胞在每个亚组中的频率。图35b显示来自淋巴结的幼稚(tn)、效应细胞(teff)、效应记忆(tem)和中枢记忆(tcm)cd8+和cd4+t细胞亚群中cd27表达的表征。fmo,荧光减一。每组中代表n=4只测试小鼠的一只小鼠。数据代表两个独立实验。数据为平均值
±
sem。p值通过双尾student's t
‑
检验测定。*p<0.05,**p<0.01。
58.图36a和36b显示t细胞在sirt2
‑
/
‑
小鼠中b16f10肿瘤排斥中起主要作用。图36a显示了在注射后18天收集的,在b16f10静脉内攻击前,用同种型对照、抗cd4或抗cd8单克隆抗体处理的wt和sirt2
‑
/
‑
小鼠的肺。图36b显示来自nsg小鼠的肺,所述nsg小鼠用b16f10 i.v.攻击,并用媒介物、wt pmel cd8+t细胞或sirt2/
‑
pmel cd8+t细胞处理,在注射后18天收集。在多聚甲醛中固定肺后拍摄该实验的照片。数据代表两个独立实验。
59.图37a
‑
37h显示用sirt2抑制剂agk2和tm处理增加了来自健康供体的人t细胞的代谢适应性和效应器功能。用抗cd3与agk2(图37a、37b、37e和37g)或硫代肉豆蔻酰(tm)(图37c、37d、37f和37h)的组合(相对于媒介物)刺激从健康供体的外周血分离的人cd3+t细胞
48小时。图37a和37c,左,显示了使用seahorse xf分析仪测量的细胞外酸化速率(ecar):agk2处理的cd3+t细胞(图37a,n=7
‑
8)和tm处理的cd3+t细胞(图37c,n=4
‑
8)。在所示的位点注射葡萄糖、寡霉素和2
‑
dg。右,由相应的曲线计算基础糖酵解速率、糖酵解能力和糖酵解储备。图37b和37d,左,显示了使用seahorse xf分析仪测量的质子流出速率(per):agk2处理的cd3+t细胞(图37b,n=2
‑
8)和tm处理的cd3+t细胞(图37d,n=3
‑
5)。在所示的位点注射抗霉素a/鱼藤酮和2
‑
dg。右侧,由相应的曲线计算基础糖酵解速率和补偿糖酵解。e和f,ifn
‑
γelispot分析在以下样品上进行:agk2处理的人cd3+t细胞(图37e,n=6)和tm处理的人cd3+t细胞(图37f,n=3
‑
6)与载体的比较48小时。图37g和37h显示用指定浓度的agk2(图37g)或tm(图37h)培养48小时的人cd3+富集的t细胞。微管蛋白的乙酰化水平通过蛋白质印迹在蛋白质提取物上测定。总α
‑
微管蛋白水平用作上样对照。数据代表两个独立实验。数据的平均值为
±
sem。p值通过单向anova测定。*p<=0.05、**p<0.01、***p<0.001、****p<0.0001。
具体实施方式
60.在更详细地描述本公开之前,应当理解,本发明不限于所描述的特定实施例,并且因此当然可以变化。还应理解,本文所用的术语仅用于描述特定实施方式的目的,而不旨在限制,因为本公开的范围将仅由所附权利要求书限制。
61.在提供数值范围的情况下,应理解,除非上下文另外明确规定,否则在所述范围的上限与下限之间的到下限单位的十分之一的每一中间值和在所述范围内的任何其它陈述的或中间值包含在本公开内。这些较小范围的上限和下限可独立地包括在较小范围中,并且也包含在本公开内,服从于所述范围中的任何具体排除的限制。在所述范围包括一个或两个限值的情况下,排除那些所包括的限值中的任一个或两个的范围也包括在本发明中。
62.除非另外定义,否则本文所用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的相同的含义。尽管与本文所述的那些类似或等同的任何方法和材料也可用于本公开的实践或测试,但现在描述优选的方法和材料。
63.本说明书中引用的所有出版物和专利均通过引用并入本文,就像每个单独的出版物或专利具体地和单独地指明通过引用并入本文,并且通过引用并入本文以公开和描述与所引用的出版物相关的方法和/或材料。任何出版物的引用是因为其公开早于申请日,并且不应被解释为承认本公开无权由于在先公开而先于这样的出版物。此外,所提供的出版日期可能与实际出版日期不同,实际出版日期可能需要独立确认。
64.如本领域技术人员在阅读本公开后将显而易见的,本文描述和示出的每个单独实施例具有离散的部件和特征,其可容易地与其它若干实施例中的任一个的特征分离或组合,而不脱离本公开的范围或精神。任何列举的方法可以以列举的事件的顺序或以逻辑上可能的任何其它顺序来执行。
65.除非另有说明,本公开的实施方式将采用化学、生物学等技术,这些技术在本领域的技术范围内。
66.提出以下实施方式以便为本领域普通技术人员提供如何进行本发明公开和要求保护的方法和使用本发明公开和要求保护的探针的完整公开和描述。已经努力确保关于数字(例如,量、温度等)的准确性,但是应当考虑一些误差和偏差。除非另有说明,份数是重量
份数,温度是℃并且压力是大气压或接近大气压。标准温度和压力定义为20℃和1个大气压。
67.在详细描述本公开的实施方式之前,应当理解,除非另有说明,本发明不限于特定材料、试剂、反应材料、制造工艺等,因为它们可以变化。还应理解,本发明所用的术语仅是为了描述具体实施方式的目的,而不是为了限制。在本发明中,在逻辑上可能的情况下,还可以以不同的顺序执行步骤。
68.必须注意的是,如在说明书和所附权利要求中所使用的,单数形式“一”、“一个”和“该”包括复数指代物,除非上下文另外清楚地指明。
69.术语“受试者”是指作为施用或治疗目标的任何个体。受试者可以是脊椎动物,例如哺乳动物。因此,受试者可以是人或兽医患者。术语“患者”是指在临床医生例如医师治疗下的受试者。
70.术语“治疗有效”是指所用组合物的量足以改善疾病或病症的一种或多种原因或症状。这种改善仅需要减少或改变,而不必消除。
71.术语“药学上可接受的”是指在合理的医学判断范围内,适用于与人类和动物的组织接触而没有过度的毒性、刺激、过敏反应或其它问题或并发症,与合理的效益/风险比相称的那些化合物、材料、组合物和/或剂型。
72.术语“治疗”是指旨在治愈、改善、稳定或预防疾病、病理状况或病症的患者的医学管理。该术语包括积极治疗(active treatment),即,具体针对疾病、病理状况或病症的改善的治疗,并且还包括病因治疗(causal treatment),即,针对去除相关疾病、病理状况或病症的病因的治疗。此外,该术语包括姑息治疗(palliative treatment),即设计用于缓解症状而不是治愈疾病、病理状况或病症的治疗;预防性治疗(preventative treatment),即,旨在最小化或部分或完全抑制相关疾病、病理状况或病症的发展的治疗;和支持性治疗(supportive treatment),即,用于补充针对相关疾病、病理状况或病症的改善的另一种特定疗法的治疗。
73.sirt2抑制
74.在一些情况下,用有效量的sirt2抑制剂在体外处理t细胞以降低或消除sirt2表达或活性。sirt2抑制剂公开于例如us20170128459a1中,其通过引用并入本文以教导这些抑制剂。sirt2抑制剂包括agk2、ak
‑
1、sirreal2、tenovin
‑
6和thiomyristoyl(tm)、aem1和aem2。
75.下面所示的agk2是强效的选择性sirt2抑制剂,其ic50为3.5μm,在10倍更高水平下对sirt1或sirt3影响最小。
[0076][0077]
下面所示的ak
‑
1是sirt的抑制剂,其对sirt2的选择性好于对sirt1和sirt3的选择性(对于sirt1、sirt2和sirt3,ic50值分别>50μm、12.5μm和>50μm。
[0078][0079]
下面所示的sirreal2是强效的和选择性的sirt2抑制剂,ic50为140nm。
[0080][0081]
下文所示的tenovin
‑
6在体外抑制纯化的人sirt1、sirt2和sirt3的蛋白质脱乙酰酶活性,ic50值分别为21、10和67μm。
[0082][0083]
以下所示的thiomyristoyl(tm)抑制sirt2,ic50值为0.028μm。
[0084][0085]
aem1和aem2(如下所示)是sirt2的选择性抑制剂,ic50值分别为18.5和3.8μm。
[0086][0087][0088]
在一些实施方式中,sirt2抑制剂是对sirt2基因特异性的反义寡核苷酸、sirna、适配体或抗体。
[0089]
sirt2破坏
[0090]
在一些实施方式中,淋巴细胞被基因工程改造以抑制或消除sirt2表达。
[0091]
如本文所用,术语“抑制”和“消除”意味着内源基因编码的sirt2多肽的表达和/或功能部分或完全降低。因此,sirt2基因产物的表达或功能在所选细胞组(例如组织或器官)或整个动物中可完全或部分破坏或降低(例如50%、75%、80%、90%、95%或更多,例如100%)。
[0092]
还公开了在体外破坏t细胞中sirt2表达同时有效表达嵌合受体的方法。因此,本发明公开了表达嵌合受体的嵌合细胞,其中所述嵌合受体由转基因编码,并且其中所述转基因插入细胞基因组中破坏内源性sirt2蛋白的表达或活性的位置。
[0093]
在一些实施方式中,转基因插入sirt2基因座,从而破坏基因转录。转基因可以插入sirt2基因内任何会破坏基因转录的基因座。
[0094]
转基因的位点特异性插入可以通过例如基因编辑技术如crispr进行。
[0095]
嵌合抗原受体(car)
[0096]
在一些情况下,淋巴细胞还表达嵌合受体。在一些实施方式中,嵌合受体包含嵌合抗原受体(car)多肽。
[0097]
car通常掺入来自单克隆抗体(mab)的单链可变片段(scfv)的抗原识别结构域,所述单克隆抗体具有参与淋巴细胞激活的跨膜信号基序(sadelain m,et al.nat rev cancer 2003 3:35
–
45)。所公开的car通常由三个结构域组成:胞外域、跨膜结构域和胞内域。胞外域包含识别域。它还任选地含有信号肽(sp),使得car可以被糖基化并锚定在免疫效应细胞的细胞膜中。跨膜结构域(td),顾名思义,将胞外域连接到胞内域,并且在细胞表达时位于细胞膜内。胞内域是car起作用的末端,其在抗原识别后将激活信号传递至免疫效应细胞。例如,所述胞内域可以包含胞内信号传导结构域(isd)和任选的共刺激信号传导区
(csr)。
[0098]“信号传导结构域(sd)”通常含有免疫受体基于酪氨酸的激活基序(itam),当itam被磷酸化时,itam激活信号传导级联。术语“共刺激信号传导区(csr)”是指来自共刺激蛋白受体,如cd28、41bb和icos的细胞内信号传导结构域,其能够通过t细胞受体增强t细胞激活。
[0099]
在一些实施方式中,胞内域包含sd或csr,但不同时包含两者。在这些实施方式中,含有所公开的car的免疫效应细胞仅在含有缺失结构域的另一car(或t细胞受体)也结合其各自的抗原时被激活。
[0100]
其它car构建体描述于例如fresnak ad,et al.engineered t cells:the promise和challenges of cancer immunotherapy.nat rev cancer.2016aug 23;16(9):566
‑
81中的任一个,其全部内容通过引用结合于此,以教导这些car模型。
[0101]
例如,car可以是truck、通用car、自驱动car、装甲car、自毁car、条件car、标记car、tencar、双重car或scar。
[0102]
trucks(重定向用于通用细胞因子杀伤的t细胞)共表达嵌合抗原受体(car)和抗肿瘤细胞因子。细胞因子表达可以是组成型的或由t细胞激活诱导。以car特异性为目标,促炎细胞因子的局部产生将内源性免疫细胞募集至肿瘤部位,并且可以增强抗肿瘤应答。
[0103]
通用的同种异体car t细胞被改造以不再表达内源性t细胞受体(tcr)和/或主要组织相容性复合体(mhc)分子,从而分别预防移植物抗宿主病(gvhd)或排斥。
[0104]
自驱动car共表达car和结合肿瘤配体的趋化因子受体,从而增强肿瘤归巢。
[0105]
经过改造的具有免疫抑制抗性的car t细胞(装甲car)可能不再表达各种免疫检查点分子(例如,细胞毒性t淋巴细胞相关抗原4(ctla4)或程序性细胞死亡蛋白1(pd1)),其与免疫检查点开关受体,或可与阻断免疫检查点信号传导的单克隆抗体一起施用。
[0106]
可以使用通过电穿孔递送的rna来设计编码自毁car。或者,t细胞的可诱导的细胞凋亡可基于更昔洛韦(ganciclovir)与基因修饰的淋巴细胞中的胸苷激酶结合或最近描述的通过小分子二聚体形成器激活人半胱天冬酶9(caspase 9)的系统来实现。
[0107]
条件car t细胞默认为无反应的,或“关闭”,直到加入小分子以完成回路,使得信号1和信号2两者能够完全转导,从而激活car t细胞。或者,t细胞可以被改造以表达对随后施用的针对靶抗原的第二抗体具有亲和力的衔接子特异性受体。
[0108]
标记car t细胞表达car加上与现有单克隆抗体试剂结合的肿瘤表位。在无法忍受的副作用的情况下,施用单克隆抗体清除car t细胞并减轻症状,而没有另外的肿瘤外效应。
[0109]
串联car(tancar)t细胞表达由两个连接的单链可变片段(scfv)组成的单个car,所述单链可变片段具有融合至细胞内共刺激结构域和cd3δ结构域的不同亲和力。仅当靶细胞共表达两种靶标时,才能实现tancar t细胞的激活。
[0110]
双重car t细胞表达具有不同配体结合靶标的两个独立的car;一个car仅包含cd3δ结构域,另一个car仅包含共刺激结构域。双重car t细胞激活需要两种靶标在肿瘤上共表达。
[0111]
安全性car(scar)由胞外scfv融合胞内抑制结构域组成。共表达标准car的scar t细胞仅在遇到具有标准car靶标但缺乏scar靶标的靶细胞时才被激活。
[0112]
所公开的car的抗原识别结构域通常是scfv。然而,存在许多替代方案。已经描述了来自天然t细胞受体(tcr)α和β单链的抗原识别结构域,如具有简单的胞外域(例如识别感染hiv的细胞的cd4胞外域)和更多的外来的识别组分,例如连接的细胞因子(其导致识别携带细胞因子受体的细胞)。事实上,几乎任何以高亲和力结合给定靶标的物质都可用作抗原识别区。
[0113]
胞内域是car起作用的末端(business end),其在抗原识别后将信号传递至免疫效应细胞,激活免疫效应细胞的至少一种正常效应器功能。t细胞的效应器功能例如可以是细胞溶解活性或包括细胞因子分泌的辅助活性(helper activity)。因此,所述胞内域可以包含t细胞受体(tcr)和任选的共受体的“胞内信号传导域”。虽然通常可以使用完整的细胞内信号传导结构域,但是在许多情况下,不必使用整个(完整)链。就使用细胞内信号传导结构域的截短部分而言,只要它转导效应器功能信号,可以使用这样的截短部分代替完整链。
[0114]
调节以刺激方式作用的tcr复合物的初级激活的胞质信号序列可能含有被称为基于免疫受体酪氨酸的激活基序(itam)的信号基序。含有胞质信号序列的itam的例子包括源自cd8、cd3δ、cd3δ、cd3γ、cd3ε、cd32(fcγriia)、dap10、dap12、cd79a、cd79b、fcγriγ、fcγriiiγ、fcεriβ(fcerib)和fcεriγ(fcerig)的itam。
[0115]
在具体的实施方式中,胞内信号传导结构域源自cd3 zeta(cd3δ)(tcrδ,genbank accno.bag36664.1)。t细胞表面糖蛋白cd3 zeta(cd3δ)链,也称为t细胞受体t3δ链或cd247(分化簇247),是在人体中由cd247基因编码的蛋白质。
[0116]
第一代car通常具有来自cd3δ链的胞内结构域,其是来自内源性tcr的信号的主要递质。第二代car将来自各种共刺激蛋白受体(例如,cd28、41bb、icos)的胞内信号域添加到car的胞内域,以向t细胞提供额外的信号。临床前研究表明,第二代car设计改善了t细胞的抗肿瘤活性。最近,第三代car组合多个信号域以进一步增加效价强度。移植这些car的t细胞显示出不依赖于共刺激受体/配体相互作用而提高的扩增、激活、持续性和肿瘤根除效率(imai c,et al.leukemia 2004 18:676
–
84;maher j,et al.nat biotechnol 2002 20:70
–
5)。
[0117]
例如,car的胞内域可被设计为包含cd3δ信号域本身或与在本发明car的上下文中有用的任何其他期望的胞质域组合。例如,car的胞质结构域可包含cd3δ链部分和共刺激信号域(costimulatory signaling region)。共刺激信号域是指car的包含共刺激分子的胞内域部分。共刺激分子是淋巴细胞对抗原有效应答所需的除抗原受体或其配体之外的细胞表面分子。这种分子的实例包括cd27、cd28、4
‑
1bb(cd137)、ox40、cd30、cd40、icos、淋巴细胞功能相关抗原
‑
1(lfa
‑
1)、cd2、cd7、light、nkg2c、b7
‑
h3,以及与cd83、cd8、cd4、b2c、cd80、cd86、dap10、dap12、myd88、btnl3和nkg2d特异性结合的配体。因此,尽管car主要以cd28作为共刺激信号元件举例说明,但其它共刺激元件可单独使用或与其它共刺激信号传导元件组合使用。
[0118]
在一些实施方式中,car包含铰链序列。铰链序列是促进抗体柔性的短氨基酸序列(参见,例如,woof et al.,nat.rev.immunol.,4(2):89
‑
99(2004))。铰链序列可以位于抗原识别部分(例如,抗cd123 scfv)和跨膜结构域之间。铰链序列可以是从任何合适的分子衍生或获得的任何合适的序列。在一些实施方式中,例如,铰链序列衍生自cd8a分子或cd28分子。
[0119]
跨膜结构域可以源自天然来源或合成来源。当是天然来源时,结构域可以衍生自任何膜结合或跨膜蛋白。例如,跨膜域可以源自(即至少包含跨膜域的)t细胞受体的α、β或δ链、cd28、cd3ε、cd45、cd4、cd5、cd8(例如,cd8α、cd8β)、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137或cd154、kirds2、ox40、cd2、cd27、lfa
‑
1(cd11a、cd18)、icos(cd278)、4
‑
1bb(cd137)、gitr、cd40、baffr、hvem(lightr)、slamf7、nkp80(klrf1)、cd160、cd19、il2rβ、il2rγ、il7rα、itga1、vla1、cd49a、itga4、ia4、cd49d、itga6、vla
‑
6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa
‑
1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa
‑
1、itbg7、tnfr2、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、slamf6(ntb
‑
a、ly108)、slam(slamf1、cd150、ipo
‑
3)、blame(slamf8)、selplg(cd162)、ltbr、以及pag/cbp。或者,跨膜结构域可以是合成的,在这种情况下,它将主要包含疏水残基,例如亮氨酸和缬氨酸。在一些情况下,在合成跨膜结构域的每个末端具有苯丙氨酸、色氨酸和缬氨酸的三联体。短的低聚或多肽接头,例如长度为2
‑
10个氨基酸,可以形成car的跨膜结构域和内质结构域之间的连接。
[0120]
在一些实施方式中,car具有一个以上跨膜结构域,其可以是相同跨膜结构域的重复,或可以是不同的跨膜结构域。
[0121]
在一些实施方式中,car是多链car,如wo2015/039523中所述,其通过引用并入本文以用于该教导。多链car可以在不同的跨膜多肽中包含单独的细胞外配体结合域和信号域。信号域可被设计成在近膜位置组装,形成赋予最佳的信号转导的更接近天然受体的灵活结构。例如,多链car可包括部分fceriα链和部分fceriβ链,使得fceri链自发地二聚化在一起形成car。
[0122]
在一些实施方式中,识别域是单链可变片段(scfv)抗体。scfv的亲和性/特异性大部分由重链(v
h
)和轻链(v
l
)中互补决定区(cdr)内的特定序列驱动。每个v
h
和v
l
序列具有三个cdr(cdr1、cdr2、cdr3)。
[0123]
在一些实施方式中,识别结构域源自天然抗体,例如单克隆抗体。在一些情况下,抗体是人源的。在一些情况下,当施用给人时,抗体已经经历改变以使其免疫原性降低。例如,所述改变包括选自嵌合、人源化、cdr嫁接(cdr
‑
grafting)、去免疫和框架氨基酸突变的一种或多种技术,以对应于最接近的人种系序列。
[0124]
本发明还公开了靶向两种不同抗原的双特异性car。还公开了设计为仅与结合不同抗原(例如肿瘤抗原)的另一种car结合工作的car。例如,在这些实施方式中,所公开的car的胞内域可以仅包含信号域(sd)或共刺激信号域(csr),但不同时包含两者。如果第二car(或内源t细胞)被激活,则其提供缺失的信号。例如,如果所公开的car含有sd而不是csr,则含有该car的免疫效应细胞仅在含有csr的另一car(或t细胞)结合其各自的抗原时才被激活。同样,如果所公开的car含有csr而不是sd,则含有该car的免疫效应细胞仅在含有sd的另一car(或t细胞)结合其相应抗原时被激活。
[0125]
肿瘤抗原是由肿瘤细胞产生的引发免疫应答的蛋白质,尤其是t细胞介导的免疫应答。另外的抗原结合结构域可以是抗体或肿瘤抗原的天然配体。额外抗原结合结构域的选择将取决于待治疗的癌症的特定类型。肿瘤抗原是本领域公知的,包括例如神经胶质瘤相关抗原、癌胚抗原(cea)、egfrviii、il
‑
llra、il
‑
13ra、egfr、fap、b7h3、kit、ca lx、cs
‑
1、
muc1、bcma、bcr
‑
abl、her2、β
‑
人绒毛膜促性腺激素、α胎甲球蛋白(afp)、alk、cd19、tim3、细胞周期蛋白bl、凝集素反应性afp、fos
‑
相关抗原1、adrb3、甲状腺球蛋白、epha2、rage
‑
1、rul、ru2、ssx2、akap
‑
4、lck、oy
‑
tesi、pax5、sart3、cll
‑
1、岩藻糖基gm1(fucosyl gm1)、globoh、mn
‑
ca ix、epcam、evt6
‑
aml、人端粒酶逆转录酶、plysialic酸、plac1、rul、ru2(as)、肠道羧基酯酶、lewisy、sle、ly6k、mut hsp70
‑
2、m
‑
csf、rhoc、trp
‑
2、cypibi、boris、prostase、前列腺特异性抗原(psa)、pax3、pap、、ny
‑
eso
‑
1、lage
‑
la、lmp2、ncam、p53、p53突变体、ras突变体、gploo、prostein、or51e2、panx3、psma、psca、her2/neu、htert、hmwmaa、havcr1、vegfr2、pdgfr
‑
β、存活蛋白和端粒酶、豆荚蛋白、hpv e6、e7、精子蛋白17、ssea
‑
4、酪氨酸酶、tarp、wt1、前列腺癌肿瘤抗原
‑
1(pcta
‑
1)、ml
‑
iap、mage、mage
‑
a1、mad
‑
ct
‑
1、mad
‑
ct
‑
2、melana/mart 1、xage1、elf2m、erg(tmprss2 ets融合基因)、na17、嗜中性粒细胞弹性蛋白酶、肉瘤易位断点、ny
‑
br
‑
1、ephnnb2、cd20、cd22、cd24、cd30、tim3、cd38、cd44v6、cd97、cd171、cd179a、雄激素受体、fap、胰岛素生长因子(igf)
‑
i、igfii、igf
‑
i受体、gd2、o
‑
乙酰
‑
gd2、gd3、gm3、gprc5d、gpr20、cxorf61、叶酸受体(fra)、叶酸受体β、ror1、flt3、tag72、tn ag、tie2、tem1、trm7r、cldn6、tshr、upk2以及间皮素。在一个优选的实施方式中,肿瘤抗原选自叶酸受体(fra)、间皮素、egfrviii、il
‑
13ra、cd123、cd19、tim3、bcma、gd2、cll
‑
1、ca
‑
ix、mucl、her2及其任意组合组成的组中。
[0126]
肿瘤抗原的非限制性实例包括以下:分化抗原,如酪氨酸酶、trp
‑
1、trp
‑
2和肿瘤特异性多谱系抗原,如mage
‑
1、mage
‑
3、bage、gage
‑
1、gage
‑
2、pi 5;过表达的胚胎抗原,如cea;过表达的致癌基因和突变的肿瘤抑制基因,例如p53、ras、her
‑
2/neu;由染色体易位产生的独特肿瘤抗原;例如bcr
‑
abl、e2a
‑
prl、h4
‑
ret、igh
‑
igk、myl
‑
rar;和病毒抗原,例如epstein barr病毒抗原ebva和人乳头瘤病毒(hpv)抗原e6和e7。其它大的基于蛋白质的抗原包括tsp
‑
180、mage
‑
4、mage
‑
5、mage
‑
6、rage、ny
‑
eso、pl85erbb2、pl80erbb
‑
3、c
‑
met、nm
‑
23h1、psa、ca 19
‑
9、ca 72
‑
4、cam 17.1、numa、k
‑
ras、β
‑
联蛋白、cdk4、mum
‑
1、p15、p16、43
‑
9f、5t4、791tgp72、α
‑
胎蛋白、β
‑
hcg、bca225、btaa、ca 125、ca 15
‑
3\ca 27.29\bcaa、ca 195、ca 242、ca
‑
50、cam43、cd68\p1、co
‑
029、fgf
‑
5、g250、ga733\epcam、htgp
‑
175、m344、ma
‑
50、mg7
‑
ag、mov18、nb/70k、ny
‑
co
‑
1、rcasl、sdccag16、ta
‑
90\mac
‑
2结合蛋白\cyclophilm c联合蛋白、taal6、tag72、tkp、tps、gpc3、muc16、lmp1、ebma
‑
1、barf
‑
1、cs1、cd319、her1、b7h6、l1cam、il6和met。
[0127]
核酸和载体
[0128]
本发明还公开了编码所公开的嵌合受体的多核苷酸和多核苷酸载体。还公开了用于将嵌合受体插入t细胞基因组中破坏sirt2表达或活性的位点的寡核苷酸。
[0129]
编码所公开的嵌合受体及其区域的核酸序列可以使用本领域已知的重组方法获得,例如通过从表达基因的细胞筛选文库,通过从已知包括其的载体衍生基因,或通过使用标准技术直接从含有其的细胞和组织分离。或者,目标基因可以合成产生,而不是克隆。
[0130]
免疫效应细胞
[0131]
本发明还公开了经改造以表达所公开的嵌合受体的免疫效应细胞。这些细胞优选从待治疗的受试者获得(即是自体的)。然而,在一些实施方式中,使用免疫效应细胞系或供体效应细胞(同种异体的)。免疫效应细胞可获自多种来源,包括外周血单核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、来自感染部位的组织、腹水、胸腔积液、脾组织和肿瘤。免疫效
应细胞可以使用本领域技术人员已知的任何技术从收集自受试者的血液中获得,例如ficoll
tm
分离。例如,来自个体循环血液的细胞可以通过单采血液成分术获得。在一些实施方式中,通过裂解红细胞并耗尽单核细胞获得免疫效应细胞,例如通过percoll
tm
梯度离心或通过逆流离心淘析,从外周血淋巴细胞分离获得免疫效应细胞。免疫效应细胞的特定亚群可以通过阳性或阴性选择技术进一步分离。例如,可以使用针对阳性选择细胞独特的表面标志物的抗体的组合来分离免疫效应细胞,例如,通过与抗体偶联珠(antibody
‑
conjugated beads)孵育足够时间以阳性选择所需免疫效应细胞。或者,免疫效应细胞群体的富集可以通过使用针对阴性选择的细胞独特的表面标志物的抗体的组合的阴性选择来实现。
[0132]
在一些实施方式中,免疫效应细胞包括参与保护身体抵抗传染病和外来物质的任何白细胞。例如,免疫效应细胞可以包括淋巴细胞、单核细胞、巨噬细胞、树突细胞、肥大细胞、嗜中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞或其任何组合。例如,免疫效应细胞可以包括t淋巴细胞。
[0133]
通过在细胞表面存在t细胞受体(tcr),可将t细胞或t淋巴细胞可以与其它淋巴细胞,如b细胞和自然杀伤细胞(nk细胞)区分开。它们被称为t细胞,因为它们在胸腺中成熟(尽管一些也在扁桃体中成熟)。t细胞有几个亚群,每个亚群具有不同的功能。
[0134]
t辅助细胞(t
h
细胞)在免疫过程中辅助其它白细胞,包括b细胞成熟为浆细胞和记忆b细胞,以及细胞毒性t细胞和巨噬细胞的激活。这些细胞也称为cd4+t细胞,因为它们在其表面表达cd4糖蛋白。辅助t细胞在通过mhc ii类分子与肽抗原一起呈递时被激活,所述mhc ii类分子在抗原呈递细胞(apc)的表面上表达。一旦被激活,它们迅速分裂并分泌称为细胞因子的小蛋白,所述细胞因子调节或辅助主动免疫应答。这些细胞可分化为几种亚型之一,包括t
h
1、t
h
2、t
h
3、t
h
17、t
h
9或t
fh
,其分泌不同的细胞因子以促进不同类型的免疫应答。
[0135]
细胞毒性t细胞(t
c
细胞或ctl)破坏病毒感染的细胞和肿瘤细胞,并且还涉及移植排斥。这些细胞也称为cd8
+
t细胞,因为它们在其表面表达cd8糖蛋白。这些细胞通过结合与mhc i类分子相关的抗原来识别它们的靶标,所述抗原存在于所有有核细胞的表面上。通过调节性t细胞分泌的il
‑
10、腺苷和其它分子,cd8
+
细胞可被灭活至无反应性状态,从而预防自身免疫性疾病。
[0136]
记忆t细胞是抗原特异性t细胞的子集,其在感染已经消退后长期持续。它们在重新暴露于其同源抗原后迅速扩增为大量的效应t细胞,从而为免疫系统提供针对过去感染的“记忆”。记忆细胞可以是cd4
+
或cd8
+
。记忆t细胞通常表达细胞表面蛋白cd45ro。
[0137]
调节性t细胞(t
reg
细胞),以前称为抑制性t细胞,对于维持免疫耐受性是至关重要的。它们的主要作用是关闭t细胞介导的免疫以达到免疫反应的终点,并抑制逃脱胸腺中阴性选择过程的自身反应性t细胞。已经描述了两种主要类型的cd4
+
t
reg
细胞——天然存在的t
reg
细胞和适应性t
reg
细胞。
[0138]
自然杀伤t(nkt)细胞(不要与自然杀伤(nk)细胞混淆)将适应性免疫系统与先天免疫系统桥接。与识别由主要组织相容性复合物(mhc)分子呈递的肽抗原的常规t细胞不同,nkt细胞识别被称为cd1d的分子呈递的糖脂抗原。
[0139]
在一些实施方式中,t细胞包括cd4
+
细胞的混合物。在其它实施方式中,基于细胞
表面表达富集t细胞的一个或多个亚群。例如,在一些情况下,t细胞包括细胞毒性cd8
+
t淋巴细胞。在一些实施方式中,t细胞包括γδt细胞,其具有独特的具有一个γ链和一个δ链而不是α和β链的t细胞受体(tcr)。
[0140]
自然杀伤(nk)细胞是cd56
+
cd3
‑
大颗粒淋巴细胞,其可杀死病毒感染和转化的细胞,并构成先天性免疫系统的关键细胞亚群(godfrey j,et al.leuk lymphoma 2012 53:1666
–
1676)。与细胞毒性cd8
+
t淋巴细胞不同,nk细胞对肿瘤细胞产生细胞毒性而不需要预先致敏,并且还可以根除mhc
‑
i
‑
阴性细胞(narni
‑
mancinelli e,et al.int immunol 2011 23:427
–
431)。nk细胞是更安全的效应细胞,因为它们可以避免细胞因子风暴(morgan ra,et al.mol ther 2010 18:843
–
851)、肿瘤裂解综合征(porter dl,et al.n engl j med 2011 365:725
–
733)和靶向、以及靶标开启、肿瘤关闭效应(on
‑
target,off
‑
tumor effect)。尽管nk细胞具有作为癌细胞杀伤剂的众所周知的作用,并且已经广泛地证明nk细胞损伤对于mm的进展是至关重要的(godfrey j,et al.leuk lymphoma 2012 53:1666
–
1676;fauriat c,et al.leukemia 2006 20:732
–
733),在公开cars之前,如何增强nk细胞介导的抗mm活性在很大程度上尚未探索。
[0141]
治疗方法
[0142]
表达本发明所公开的嵌合受体的免疫效应细胞可引发针对癌细胞的抗肿瘤免疫应答。由公开的嵌合细胞引发的抗肿瘤免疫应答可以是主动或被动免疫应答。此外,免疫应答可以是过继免疫治疗方法的一部分,其中嵌合细胞诱导特异于靶抗原的免疫应答。
[0143]
表达嵌合受体的免疫效应细胞的过继转移是有希望的抗癌治疗法。在收集患者的免疫效应细胞后,可将细胞基因改造以表达本发明所公开的嵌合受体,同时根据所公开的方法消除sirt2,然后输注回患者中。
[0144]
所公开的嵌合效应细胞可以单独施用,或作为药物组合物与稀释剂和/或与其他组分如il
‑
2、il
‑
15或其他细胞因子或细胞群组合施用。简言之,药物组合物可包含如本发明所述的靶细胞群,以及一种或多种药学上或生理学上可接受的载体、稀释剂或赋形剂。这样的组合物可以包含缓冲液,例如中性缓冲盐水、磷酸盐缓冲盐水等;碳水化合物,例如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露醇;蛋白质;多肽或氨基酸,例如甘氨酸;抗氧化剂;螯合剂,例如edta或谷胱甘肽;佐剂(例如,氢氧化铝);和防腐剂。在一些实施方式中,用于所公开的方法的组合物被配制用于静脉注射施用。药物组合物可以以任何适当的方式给药以治疗肿瘤。给药的量和频率将由诸如患者的状况和患者疾病的严重程度的因素决定,尽管适当的剂量可以通过临床试验来决定。
[0145]
当指出“免疫有效量”、“抗肿瘤有效量”、“肿瘤抑制有效量”或“治疗量”时,待施用的本发明组合物的精确量可由医师考虑患者(受试者)的年龄、体重、肿瘤大小、感染或转移程度和状况的个体差异来确定。通常可以说,包含本发明所述t细胞的药物组合物可以104至109个细胞/kg体重,例如105至106个细胞/kg体重的剂量施用,包括在那些范围内的所有整数值。t细胞组合物也可以以这些剂量多次施用。细胞可以通过使用免疫疗法中公知的输注技术施用(参见,例如rosenberg et al.,new eng.j.of med.319:1676,1988)。对于特定患者的最佳剂量和治疗方案可以由医学领域的技术人员通过监测患者的疾病征象并相应地调整治疗而容易地确定。
[0146]
在某些实施方式中,可能需要给受试者施用激活的t细胞,然后重新抽血(或进行
单采血液成分术),根据所公开的方法激活其中的t细胞,并用这些激活和扩增的t细胞重新给患者输入血液。该过程可以每几个星期进行多次。在某些实施方式中,t细胞可以从抽取的10cc至400cc血液中激活。在某些实施方式中,从抽取的20cc、30cc、40cc、50cc、60cc、70cc、80cc、90cc或100cc的血液中激活t细胞。使用这种多次抽血/多次再输注方案可以用于选出某些t细胞群。
[0147]
所公开的组合物的施用可以以任何方便的方式进行,包括通过注射、输注或移植。本文所述的组合物可皮下、皮内、肿瘤内、结节内、髓内、肌内、静脉内注射或腹膜内施用给患者。在一些实施方式中,通过皮内或皮下注射将所公开的组合物施用给患者。在一些实施方式中,所公开的组合物通过静脉注射施用。该组合物也可直接注射到肿瘤、淋巴结或感染部位。
[0148]
在某些实施方式中,所公开的嵌合细胞与任何数量的相关治疗方式联合(例如,之前、同时或之后)施用给患者,所述治疗方式包括但不限于沙利度胺(thalidomide)、地塞米松(dexamethasone)、硼替佐米(bortezomib)和来那度胺(lenalidomide)。在进一步的实施方式中,嵌合细胞可以与化疗、放疗、免疫抑制剂如环孢菌素(cyclosporin)、硫唑嘌呤(azathioprine)、甲氨蝶呤(methotrexate)、霉酚酸(mycophenolate)和fk506、抗体或其它免疫清除剂如cam path、抗cd3抗体或其它抗体疗法、细胞毒素、氟达立滨(fludaribine)、环孢菌素、fk506、雷帕霉素(rapamycin)、霉酚酸(mycophenolic acid)、类固醇、fr901228、细胞因子和放射线组合使用。在一些实施方式中,将car修饰的免疫效应细胞(例如,在此之前、同时或之后)与骨髓移植、使用化疗剂如氟达立滨、外束放射疗法(xrt)、环磷酰胺(cyclophosphamide)或抗体如okt3或campath的t细胞消融疗法联合施用于患者。在另一个实施方式中,本发明的细胞组合物在b细胞消融疗法(例如与cd20反应的试剂,例如rituxan)后施用。例如,在一些实施方式中,受试者可经历高剂量化疗的标准治疗,随后进行外周血干细胞移植。在某些实施方式中,在移植后,受试者接受本发明的扩增的免疫细胞的输注。在另外的实施方式中,在手术之前或之后施用扩增的细胞。
[0149]
本发明所公开的方法的癌症可以是经历不受调控的生长、侵袭或转移的受试者中的任何细胞。在一些方面,癌症可以是目前使用放射疗法的任何赘生物或肿瘤。或者,癌症可以是对使用标准方法的放射疗法不够敏感的赘生物或肿瘤。因此,癌症可以是肉瘤、淋巴瘤、白血病、癌、胚细胞瘤或生殖细胞肿瘤。可以用所公开的组合物治疗的癌症的代表性但非限制性的列表包括淋巴瘤、b细胞淋巴瘤、t细胞淋巴瘤、蕈样真菌病、霍奇金病、髓细胞性白血病、膀胱癌、脑癌、神经系统癌、头颈癌、头颈部鳞状细胞癌、肾癌、肺癌如小细胞肺癌和非小细胞肺癌、成神经细胞瘤/成胶质细胞瘤、卵巢癌、胰腺癌、前列腺癌、皮肤癌、肝癌、黑素瘤、口腔、咽喉、喉和肺的鳞状细胞癌、子宫内膜癌、宫颈癌、乳腺癌、上皮癌、肾癌、泌尿生殖癌、肺癌、食道癌、头颈部癌、大肠癌、造血系统癌;睾丸癌;结肠癌和直肠癌、前列腺癌和胰腺癌。
[0150]
本发明所公开的嵌合细胞可与具有细胞毒性或细胞抑制作用的任何化合物、部分(moiety)或基团组合使用。药物部分包括化疗剂,且特别是用于癌症治疗的那些化疗剂,其可以具有微管蛋白抑制剂、有丝分裂抑制剂、拓扑异构酶抑制剂或dna嵌入剂的作用。
[0151]
本发明所公开的嵌合细胞可与检查点抑制剂组合使用。两种已知的抑制性检查点通路涉及通过细胞毒性t淋巴细胞抗原
‑
4(ctla
‑
4)和程序性死亡1(pd
‑
1)受体的信号传导。
这些蛋白是共信号分子(cosignaling molecules)的cd28
‑
b7家族的成员,其在t细胞功能的所有阶段发挥重要作用。pd
‑
1受体(也称为cd279)在激活的t细胞表面表达。其配体pd
‑
l1(b7
‑
h1;cd274)和pd
‑
l2(b7
‑
dc;cd273)在apc如树突细胞或巨噬细胞的表面上表达。pd
‑
l1是主要配体,而pd
‑
l2具有更受限制的表达模式。当配体与pd
‑
1结合时,抑制信号被传递到t细胞中,这减少了细胞因子的产生并抑制了t细胞增殖。检查点抑制剂包括但不限于阻断pd
‑
1的抗体(nivolumab(bms
‑
936558或mdx1106)、ct
‑
011、mk
‑
3475)、pd
‑
l1(mdx
‑
1105(bms
‑
936559)、mpdl3280a、msb0010718c)、pd
‑
l2(rhigm12b7)、ctla
‑
4(iplimumab(mdx
‑
010)、tremelimumab(cp
‑
675,206))、ido、b7
‑
h3(mga271)、b7
‑
h4、tim3、lag
‑
3(bms
‑
986016)。
[0152]
程序性死亡1(pd
‑
1)的人单克隆抗体和单独使用抗pd
‑
1抗体或与其它免疫治疗剂联合使用治疗癌症的方法描述于美国专利no.8,008,449中,其通过引用并入本文以获得这些抗体。抗pd
‑
l1抗体及其用途描述于美国专利no,8,552,154中,将其通过引用并入本文以获得这些抗体。包含抗pd
‑
1抗体或抗pd
‑
l1抗体的抗癌剂描述于美国专利no.8,617,546中,将其通过引用并入本文以获得这些抗体。
[0153]
在一些实施方式中,pdl1抑制剂包括特异性结合pdl1的抗体,例如bms
‑
936559(bristol
‑
myers squibb)或mpdl3280a(roche)。在一些实施方式中,pd1抑制剂包括特异性结合pd1的抗体,例如lambrolizumab(merck)、nivolumab(bristol
‑
myers squibb)或medi4736(astrazeneca)。抗pd
‑
1的人单克隆抗体和单独使用抗pd
‑
1抗体或与其它免疫治疗剂联合使用治疗癌症的方法描述于美国专利no.8,008,449中,其通过引用并入本文以获得这些抗体。抗pd
‑
l1抗体及其用途描述于美国专利no.8,552,154中,将其通过引用并入本文以获得这些抗体。包含抗pd
‑
1抗体或抗pd
‑
l1抗体的抗癌剂描述于美国专利no.8,617,546中,将其通过引用并入本文以获得这些抗体。
[0154]
本发明所公开的嵌合细胞可以与其他癌症免疫疗法组合使用。有两种不同类型的免疫疗法:被动免疫疗法使用免疫系统的组分来引导针对癌细胞的靶向细胞毒性活性,而不必在患者中引发免疫应答,而主动免疫疗法主动触发内源性免疫应答。被动策略包括使用由b细胞响应于特定抗原而产生的单克隆抗体(mab)。1970年代杂交瘤技术的发展和肿瘤特异性抗原的鉴定允许mab的药物开发,所述mab可以特异性靶向肿瘤细胞以被免疫系统破坏。迄今为止,mab一直是免疫治疗的最大成功经历;2012年,头三种最畅销的抗癌药物都是mab。其中有利妥昔单抗(rituximab)(rituxan,genentech),其结合在b细胞恶性肿瘤如非霍奇金淋巴瘤(nhl)表面上高度表达的cd20蛋白。fda批准利妥昔单抗用于与化疗联合治疗nhl和慢性淋巴细胞性白血病(cll)。另一种重要的mab是曲妥珠单抗(trastuzumab)(herceptin;genentech),其通过靶向her2(人表皮生长因子受体2)的表达而改革了her2阳性乳腺癌的治疗。
[0155]
产生最佳“杀伤”cd8t细胞应答还需要t细胞受体激活加共刺激,这可以通过连接肿瘤坏死因子受体家族成员包括ox40(cd134)和4
‑
1bb(cd137)来提供。ox40特别令人感兴趣的是用激活(激动剂)抗ox40 mab处理增强t细胞分化和细胞溶解功能,导致针对多种肿瘤的抗肿瘤免疫增强。
[0156]
在一些实施方式中,这样的其他治疗剂可以选自抗代谢药,例如甲氨蝶呤、6
‑
巯嘌呤(6
‑
mercaptopurine)、6
‑
硫鸟嘌呤(6
‑
thioguanine)、阿糖胞苷(cytarabine)、氟达立滨、5
‑
氟尿嘧啶(5
‑
fluorouracil)、去卡巴嗪(decarbazine)、羟基脲(hydroxyurea)、天冬酰胺
酶(asparaginase)、吉西他滨(gemcitabine)或克拉屈滨(cladribine)。
[0157]
在一些实施方式中,这样的其他治疗剂可以选自烷化剂,例如氮芥(mechlorethamine)、硫代epa(thioepa)、苯丁酸氮芥(chlorambucil)、美法仑(melphalan)、卡莫司汀(carmustine)(bsnu)、洛莫司汀(lomustine)(ccnu)、环磷酰胺、白消安(busulfan)、二溴甘露醇(dibromomannitol)、链脲霉素(streptozotocin)、达卡巴嗪(dacarbazine)(dtic)、丙卡巴肼(procarbazine)、丝裂霉素c、顺铂(cisplatin)和其它铂衍生物,例如卡铂(carboplatin)。
[0158]
在一些实施方式中,这样的其他治疗剂是靶向剂,例如依鲁替尼(ibrutinib)或艾德拉里斯(idelalisib)。
[0159]
在一些实施方式中,这样的其他治疗剂是表观遗传修饰剂,例如azacitdine或vidaza。
[0160]
在一些实施方式中,这种其他治疗剂可选自抗有丝分裂剂,诸如紫杉烷类(taxanes),例如多西他赛(docetaxe)和紫杉醇(paclitaxel),以及长春花生物碱类(vinca alkaloids),例如长春地辛(vindesine)、长春新碱(vincristine)、长春碱(vinblastine)和长春瑞滨(vinorelbine)。
[0161]
在一些实施方式中,这样的其他治疗剂可以选自拓扑异构酶抑制剂,例如托泊替康(topotecan)或伊立替康(irinotecan),或细胞生长抑制药物,例如依托泊苷(etoposide)和替尼泊苷(teniposide)。
[0162]
在一些实施方式中,这种其他治疗剂可以选自生长因子抑制剂,例如erbb(egfr)抑制剂(例如egfr抗体,例如zalutumumab、西妥昔单抗(cetuximab)、帕尼单抗(panitumumab)或尼妥珠单抗(nimotuzumab)或其它egfr抑制剂,例如吉非替尼(gefitinib)或厄洛替尼(erlotinib)),另一种erbb2抑制剂(her2/neu)(例如her2抗体,例如曲妥珠单抗、曲妥珠单抗
‑
dm l或帕妥珠单抗(pertuzumab))或egfr和her2两者抑制剂,例如拉帕替尼(lapatinib))。
[0163]
在一些实施方式中,这样的其他治疗剂可以选自酪氨酸激酶抑制剂,例如伊马替尼(imatinib)(glivec,gleevec sti571)或拉帕替尼。
[0164]
因此,在一些实施方式中,所公开的抗体与奥法木单抗(ofatumumab)、杂诺利木单抗(zanolimumab)、达雷木单抗(daratumumab)、兰尼单抗(ranibizumab)、尼妥珠单抗(nimotuzumab)、帕尼单抗(panitumumab)、hu806、达克珠单抗(daclizumab,zenapax)、巴利昔单抗(basiliximab,simulect)、英利昔单抗(infliximab,remicade)、阿达木单抗(adalimumab,humira)、那他珠单抗(natalizumab,tysabri)、奥马珠单抗(omalizumab,xolair)、依法利珠单抗(efalizumab,raptiva)和/或利妥昔单抗联合使用。
[0165]
在一些实施方式中,与嵌合细胞组合使用以治疗上述病症的治疗剂可以是抗癌细胞因子、趋化因子或其组合。合适的细胞因子和生长因子的例子包括ifnγ、il
‑
2、il
‑
4、il
‑
6、il
‑
7、il
‑
10、il
‑
12、il
‑
13、il
‑
15、il
‑
18、il
‑
23、il
‑
24、il
‑
27、il
‑
28a、il
‑
28b、il
‑
29、kgf、ifna(例如infa2b)、ifn、gm
‑
csf、cd40l、flt3配体、干细胞因子、ancestim和tnfa。合适的趋化因子可以包括glu
‑
leu
‑
arg(elr)
‑
阴性趋化因子,如来自人的cxc和c
‑
c趋化因子家族的ip
‑
10、mcp
‑
3、mig和sdf
‑
la。合适的细胞因子包括细胞因子衍生物、细胞因子变体、细胞因子片段和细胞因子融合蛋白。
[0166]
在一些实施方式中,与嵌合细胞组合使用以治疗上述病症的治疗剂可以是细胞周期控制/凋亡调节因子(或“调节剂”)。细胞周期控制/细胞凋亡调节因子可以包括靶向和调节细胞周期控制/细胞凋亡调节剂的分子,例如(i)cdc
‑
25(例如nsc 663284),(ii)过度刺激细胞周期的细胞周期蛋白依赖性激酶(例如flavopiridol(l868275,hmr1275),7
‑
羟基金孢子素(7
‑
hydroxystaurosporine)(ucn
‑
01,kw
‑
2401),和roscovitine(r
‑
roscovitine,cyc202)),和(iii)端粒酶调节因子(例如bibr1532,sot
‑
095,grn163和例如us 6,440,735和us 6,713,055中所述的组合物)。干扰凋亡途径的分子的非限制性实例包括tnf相关的凋亡诱导配体(trail)/凋亡
‑
2配体(apo
‑
2l)、激活trail受体的抗体、ifn和反义bcl
‑
2。
[0167]
在一些实施方式中,与嵌合细胞组合使用以治疗上述病症的治疗剂可以是激素调节剂,例如用于抗雄激素和抗雌激素治疗的药剂。这种激素调节剂的实例是他莫昔芬(tamoxifen)、艾多昔芬(idoxifene)、氟维司群(fulvestrant)、屈洛昔芬(droloxifene)、托瑞米芬(toremifene)、雷洛昔芬(raloxifene)、己烯雌酚(diethylstilbestrol)、乙炔雌二醇(ethinyl estradiol)/炔雌醇(estinyl)、抗雄激素(例如氟胺(flutaminde)/艾美新辛(eulexin))、孕激素(例如己酸羟孕酮(hydroxyprogesterone caproat)、甲羟孕酮(medroxy
‑
progesterone)/甲孕酮(provera)、醋雌二醇甲地孕酮(megestrol acepate)/美可治(megace))、肾上腺皮质类固醇(例如氢化可的松(hydrocortisone)、泼尼松(prednisone))、黄体生成素释放激素(及其类似物和其它lhrh激动剂例如布舍瑞林(buserelin)和戈舍瑞林(goserelin))、芳香酶抑制剂(例如阿那曲唑(anastrazole)/阿立米德(arimidex)、氨鲁米特(aminoglutethimide)/胞苷(cytraden)、依西美坦(exemestane))或激素抑制剂(例如奥曲肽(octreotide)/沙司他丁(sandostatin))。
[0168]
在一些实施方式中,与嵌合细胞组合使用以治疗上述病症的治疗剂可以是抗癌核酸或抗癌抑制性rna分子。
[0169]
如上所述,联合给药可以是同时、分开或顺序的。对于同时给药,所述药剂可以作为一种组合物或作为单独的组合物以适当的形式给药。
[0170]
在一些实施方式中,所公开的嵌合细胞与放射治疗联合施用。放射治疗可以包括放射线或者提供患者放射性相关的给药。放射源可以在被治疗的患者的体内或体外(放射物治疗可以是例如外部射束放射疗法(ebrt)或近距离放射疗法(bt)的形式)。可用于实施这些方法的放射性元素包括例如镭、铯
‑
137、铱
‑
192、镅
‑
241、金
‑
198、钴
‑
57、铜
‑
67、锝
‑
99、碘化物
‑
123、碘化物
‑
131和铟
‑
111。
[0171]
在一些实施方式中,本发明所公开的嵌合细胞与手术联合施用。
[0172]
以上已经描述了本发明的多个实施方式。然而,应当理解的是,在不背离本发明的精神和范围的情况下,可以对其进行各种修改。因此,其它实施方式也在所附权利要求的范围内。
[0173]
实施例
[0174]
实施例1:靶向sirt2重编t细胞代谢以获得最佳免疫应答
[0175]
越来越多的证据表明代谢是t细胞功能的关键驱动因素。从氧化磷酸化到有氧糖酵解的转换是t细胞激活的标志,并且是满足增殖和效应器功能的代谢需求所必需的。然而,t细胞中代谢转换的机制仍不清楚。sirt2在本发明中显示为协调t细胞的代谢和功能适应性的关键免疫检查点。sirt2在t细胞激活时被诱导,并在成熟晚期增加。sirt2通过靶向
关键糖酵解酶来负调节糖酵解。值得注意的是,sirt2敲除t细胞显示需氧糖酵解的深度上调,具有增强的增殖和效应器功能,因此有效地排斥体内肿瘤攻击。此外,sirt2在人肿瘤浸润淋巴细胞中的药理学抑制也表现出相似的表型。总之,这些结果证明sirt2作为可用作靶标重编t细胞代谢以增强免疫疗法。
[0176]
方法
[0177]
小鼠
[0178]
c57 bl/6j,具有gp100反应性转基因t细胞受体的pmel小鼠,sirt2敲除粉碎(sirt2ko)b6.129
‑
sirt2
tm1.1fwa
/j和免疫缺陷nod scid gamma(nsg)小鼠购自jackson laboratories。将pmel tcr转基因小鼠与sirt2ko小鼠杂交以产生pmel/sirt2ko小鼠。所有小鼠在moffitt cancer center的动物设施中在无特定病原体条件下饲养和维持。所有动物方案均得到动物护理和使用委员会的批准。小鼠在7
‑
8周龄使用,其年龄和性别与对照匹配。
[0179]
小鼠t细胞培养
[0180]
从wt、sirt2ko、pmel/wt、pmel/sirt2ko小鼠收集脾和/或淋巴结(ln),并加工成单细胞悬浮液。cd3
+
、cd4
+
和cd8
+
t细胞用小鼠pan t细胞、cd4
+
t细胞和cd8
+
t细胞分离试剂盒
tm
根据制造商的说明分别进行负富集。分离的细胞的纯度通过流式细胞术证实(>95%)。在补充了10%(体积/体积)胎牛血清(fbs,biowest)和1%(体积/体积)青霉素/链霉素(p/s,thomas scientific inc)的完全rpmi 1640培养基(thermofisher scientific)中培养纯化的t细胞。wt和sirt2ko t细胞在指定的时间点用平板结合的抗cd3抗体(5μg/ml;145
‑
2c11,bioxcell)激活。pmel/wt和pmel/sirt2ko t细胞在指定的时间点用gp100(1μg/ml,anaspec)刺激。
[0181]
人pbmc
[0182]
人外周血单核细胞(pbmc)从健康供体通过使用ficoll
‑
paque
tm plus培养基(ge healthcare)的密度梯度离心获得。使用人pan t细胞分离试剂盒
tm
(miltenyi biotec)负富集cd3
+
淋巴细胞。富集的cd3
+
t细胞在完全rpmi培养基中培养,并在dmso(载体)或存在的情况下,用板结合的抗cd3抗体(5μg/ml;okt
‑
3,bioxcell)或sirt2抑制剂之一:所示浓度的agk2和thiomyristoyl(selleck chemicals)激活。
[0183]
人til
[0184]
人肿瘤浸润淋巴细胞(htil)样品分离自患非小细胞肺癌(nsclc)患者的肿瘤活组织检查,由dr.antonia lab(moffitt cancer center)慷慨提供。所有人样本保持完全未鉴定,不需要机构审查委员会(irb)批准。
[0185]
将htil维持在rpmi 1640培养基中,该培养基补充有10%人ab血清(valley biomedical,inc.)、1mm hepes(sigma
‑
aldrich)、1%p/s(thomas scientific inc)、50μg/ml庆大霉素(thermofisher scientific)、50μmβ
‑
巯基乙醇(thermofisher scientific)和6000u/ml重组人il
‑
2(peprotech)。对于代谢和功能测定,在存在指定浓度的载体或agk2(selleck chemicals)的情况下,在完全rpmi培养基(不含il
‑
2)中,在平板结合的抗cd3抗体(5μg/ml;okt
‑
3,bioxcell)上培养htil。
[0186]
用于肿瘤模型的细胞系
[0187]
b16f10黑素瘤细胞从美国典型培养物保藏中心获得。将细胞最低程度传代并维持
在含有10%fbs(biowest)和1%p/s(thomas scientific inc)的完全dulbecco's改良eagle培养基dmem/f12(thermofisher scientific)中。
[0188]
肺转移模型
[0189]
2.5
×
105b16f10肿瘤细胞用100μl无菌磷酸盐缓冲盐水(pbs,sigma)静脉内注射到小鼠的侧尾静脉。对于抗pd
‑
1给药,每3天给小鼠腹膜内注射200μg抗pd
‑
1抗体(rmp1
‑
14,bioxcell),总共三次注射。肿瘤细胞注射后十八天,从安乐死的小鼠中取出肺。使用放大镜目测计数肺表面上可见的黑色转移性小结的数目。
[0190]
皮下肿瘤模型
[0191]
将200μl无菌pbs中的2.5
×
105b16f10肿瘤细胞皮下注射入麻醉小鼠的后肢。在3周期间每周两次监测肿瘤体积,使用椭圆体体积=长
×
宽
×
高
×
π/6的方程计算。
[0192]
小鼠til的分离
[0193]
通过将组织切成小块并在含有4型胶原酶(2mg/ml,worthington biochemical)和dnase i(0.25mg/ml,sigma)的pbs中酶消化45分钟,偶尔在37℃振荡,然后将细胞悬浮液通过100μm和40μm细胞过滤器(thermofisher scientific)过滤两次至单细胞悬浮液,接着用pbs洗涤并使用rbc裂解缓冲液(biolegen)裂解红细胞。最后,使用percoll(ge healthcare)通过密度梯度离心分离tils,并根据生产商的说明使用cd3εmicrobeads kit tm
(miltenyi biotec)进一步纯化。t细胞纯度大于90%(数据未显示)。新鲜til直接用于表型和代谢分析或在完全rpmi培养基中培养用于功能测定。
[0194]
体内t细胞消耗
[0195]
通过每周两次腹膜内注射100μg纯化的单克隆抗cd4(gk1.5,bioxcell)或抗cd8抗体(2.43,bioxcell)进行cd4
+
或cd8
+
t淋巴细胞亚群的体内消耗。对照(未消耗的)小鼠用腹膜内注射100μg非免疫igg同种型对照(ltf
‑
2,bioxcell)处理。消耗的和对照的小鼠静脉注射2.5
×
105b16f10细胞(n=5/组)。
[0196]
pmel t细胞的过继移植
[0197]
使用cd8
+
t细胞分离试剂盒
tm
(miltenyi biotec)从pmel/wt和pmel/sirt2ko供体小鼠的脾中纯化初始cd8
+
t细胞。nsg小鼠(n=8/组)静脉内注射1
×
105b16f10黑素瘤细胞。同时将5
×
105初始cd8
+
pmel/wt或pmel/sirt2ko t细胞过继移植到受体小鼠中。对照小鼠仅接受b16f10肿瘤细胞。
[0198]
流式细胞术
[0199]
为了分析表面标志物,在含有5%fbs(体积/体积,facs缓冲液)的pbs中用以下物质染色细胞:bd biosciences的cd3(buv395)、cd4(buv805)、pd
‑
1(bv605),biolegence的cd8(alexa fluor 700)、cd44(alexa fluor 488)和cd62l(pe
‑
cy7),在4℃下孵育1小时,然后用facs缓冲液洗涤两次,最后固定在含有1%多聚甲醛的pbs中。按照制造商的方案,用zombie violet
tm
可固定的细胞活力试剂盒(biomeding)排除死细胞。
[0200]
对于sirt2细胞内染色,首先用表面标记物cd4(buv 805)、cd8(alexa fluor 700)、cd44(alexa fluor 488)、cd62l(pe
‑
cy7)标记细胞,然后用cytofix/cytoperm缓冲液(bd biosciences)固定和透化。然后根据制造商的说明书,使用与山羊抗兔igg二抗(alexa647,thermofisher)组合的特异性sirt2抗体(sigma,#9441)进行sirt2的细胞内标记。
[0201]
对于胞内细胞因子染色,首先用佛波醇12
‑
肉豆蔻酸13
‑
乙酸酯(pma,10ng/ml,sigma)和离子霉素(1μm/ml,sigma)刺激细胞1小时,然后用golgiplug
tm
(1
‰
,bd biosciences)处理6小时,然后用tnf
‑
α(fitc,biolegend)、ifn
‑
γ(bv711,bd biosciences)和抗粒酶b抗体(alexa647,bioscience)染色。在bd facssymphony a5和lsr ii(becton dickinson)上获得细胞,并用flowjo软件版本10.0软件分析数据。
[0202]
cfse增殖试验
[0203]
首先在室温用5μm羧基荧光素琥珀酰亚胺酯(cfse,celltrace
tm
,thermofisher scientific)标记初始pmel t细胞30分钟,然后用gp100刺激或不刺激3
‑
4天。通过cfse稀释和细胞分裂的流式细胞术测定细胞增殖。
[0204]
酶联免疫斑点(elispot)测定
[0205]
在elispot试验中评价产生ifn
‑
γ的细胞的数目。简言之,将小鼠til以1
×
105个细胞铺板,并与1
×
103照射的b16f10肿瘤细胞(50gray)在所示浓度的2
‑
dg(sigma)存在下共培养,在预先包被有抗小鼠ifn
‑
γ抗体(an
‑
18,thermofisher scientific)的96孔硝酸纤维素平底(elispot板,millipore)中,并在37℃下孵育48小时以得到pmel t细胞,首先在所示浓度的2
‑
dg(sigma)存在下用gp100刺激脾细胞48小时,然后转移到预先包被有抗小鼠ifn
‑
γ抗体(an
‑
18,thermofisher scientific)的elispot板中再孵育48小时。对于人cd3
+
t细胞和htil,首先在所示浓度的载体或agk2或tm的存在下用平板包被的抗cd3刺激细胞48小时,然后转移到用抗人ifnγ抗体(1
‑
d1k,mabtech,inc.)预包被的elispot平板上。pma(10ng/ml,sigma)用作阳性测定对照。洗涤步骤和生物素化的抗ifn
‑
γ抗体(r4
‑
6a2,thermofisher scientific)+链霉抗生物素蛋白
‑
hrp(bd bioscience)标记后,使用aec底物试剂盒(bd biosciences)检测斑点,并使用aid elispot reader system(autoimmun diagnostika gmbh)计数。
[0206]
ldh释放测定
[0207]
按照制造商的说明书,使用pierce
tm ldh细胞毒性测定试剂盒(thermofisher scientific)进行功能细胞毒性活性的评价。b16f10细胞用作靶标。从皮下b16f10肿瘤结节分离的小鼠cd3
+
til和来自gp100刺激的pmel脾细胞的cd8+富集的t细胞用作效应细胞。简言之,在96孔圆底微孔板中,在指定效应器:靶标比例下,将靶b16f10肿瘤细胞与效应细胞共培养。6小时后,根据下式计算特定ldh释放的百分比:%细胞裂解=(实验值
‑
效应细胞自发释放
‑
靶细胞自发释放)
×
100/(靶细胞最大释放
‑
靶细胞自发释放),其中“实验”对应于实验信号值,“效应细胞自发”对应于从效应细胞单独自发释放ldh,“靶自发”对应于从靶细胞单独自发释放ldh,“最大释放”对应于在含有1%triton x
‑
100的培养基中从靶细胞最大释放ldh。
[0208]
细胞外通量分析
[0209]
使用seahorse xf分析仪(agilent)测量细胞外酸化速率(ecar)。糖酵解应激试验(gst)和糖酵解速率试验(gra)按照试剂盒制造商的说明书进行。
[0210]
在试验当天,将2
×
105个激活的t细胞通过离心接种到含xf培养基(xf rpmi培养基,ph 7.4,含有2mm l
‑
谷氨酰胺仅用于gst,或补充10mm葡萄糖、2mm l
‑
谷氨酰胺和1mm丙酮酸钠用于gra测试,均购自agilent technologies)的cell
‑
tak(corning)包被的xf96平板中,以确保细胞附着。在开始测定前,将细胞在非co2培养箱中平衡1小时。
[0211]
对于gst,在基底条件下,对10mm葡萄糖、1μm寡霉素和50mm 2
‑
dg的反应依次测量ecar,以计算基底糖酵解速率、糖酵解能力(对寡霉素的反应)和糖酵解储备量(糖酵解能力
‑
基底速率)。对于gra,在基底条件并且响应于0.5μm鱼藤酮(rotenone)+0.5μm抗霉素a和50mm 2
‑
dg的条件下,相继测量ecar,以计算基底糖酵解和补偿糖酵解(响应于鱼藤酮+抗霉素a)。将结果归一化至使用pierce
tm bca蛋白测定试剂盒(thermofisher scientific)定量的总蛋白。
[0212]
酶活性测定
[0213]
wt和sirt2ko cd3
+
富集的t细胞在抗cd3包被板上激活3天。根据制造商的说明书,使用酶比色法测定试剂盒(全部来自biovision)从激活的t细胞裂解物中测量醛缩酶、烯醇酶、gapdh、己糖激酶和磷酸果糖激酶的酶活性。
[0214]
乳酸测定
[0215]
使用ysi 2900biochemistry analyzer(ysi掺入)测定细胞外乳酸浓度。简言之,在三个分开的2ml新鲜培养基中在抗cd3结合孔上培养2
×
106个富含cd3
+
的t细胞。激活后三天,收获细胞培养上清液用于乳酸定量。所有的分析都是一式三份进行的,结果用l
‑
乳酸校准标准品(ysi掺入)标准化。
[0216]
adp/atp比率测定
[0217]
使用adp/atp比率测定试剂盒(sigma),基于生物发光检测反应,根据生产商的说明书,测量细胞内atp/adp水平。将富含cd3
+
的t细胞铺板在结合抗cd3的96孔微孔板中。激活后三天,将细胞在核苷酸释放缓冲液中裂解。通过在不存在和存在adp转化酶的情况下连续使用多模式酶标仪(synergy htx,biotek)测量生物发光强度来测定atp和adp水平。
[0218]
免疫沉淀
[0219]
对于免疫沉淀测定(ip),激活的cd3
+
t细胞在ip裂解缓冲液[20mm hepes,ph 7.9,180mm kcl,0.2mm edta,1.5mm mgcl2,20%(体积/体积)甘油,0.1%nonidet p
‑
40,含有蛋白酶抑制剂的混合物]中裂解。细胞裂解物在4℃下与针对sirt2(sigma,#9441;1:50)、pkm1/2(cell signaling technology,#3106;1:50)、己糖激酶(novus biologicals,#nbp2
‑
67503;1:50)、pgk1(novus biologicals,#nbp2
‑
67534;1:50)、ldh(abcam,#52488;1:30)、pfkp(abcam,#204131;1:80)或gapdh(abcam,#ab602;1:60)的特异性抗体孵育过夜。兔mab igg(cell signaling technology,#3900)用作同种型对照。加入抗兔ig琼脂糖珠(trueblot,rockland)后,样品在4℃温育2小时。用ip裂解缓冲液洗涤珠子五次,通过在3x sds样品上样缓冲液中煮沸的方式从珠子上释放蛋白质,并上样到10%sds
‑
page凝胶中进行蛋白质印迹分析。
[0220]
蛋白质印迹分析
[0221]
使用补充有complete
tm
蛋白酶抑制剂混合物和phosstop磷酸酶抑制剂(roche applied science)的裂解缓冲液(pierce ripa缓冲液,thermofisher scientific)制备全细胞裂解物。
[0222]
将细胞裂解物(20μg)或ip样品上样到10%sds
‑
page上,通过电泳分离,然后使用trans
‑
blot turbo转移系统(bio
‑
rad)半干转移至聚偏二氟乙烯膜(immun
‑
blot pvdf膜,bio
‑
rad)中。转移后,在室温下用含有0.05%tween
‑
20(tbst)和5%(w/v)牛奶的tris缓冲盐水(tbs)封闭该膜1小时,然后在4℃下与特异性一抗(如下所示)一起温育过夜。用tbst洗
膜三次,然后与辣根过氧化物酶(hrp)结合的山羊抗小鼠igg h&l(abcam,#ab97051,1:3,000)一起孵育1小时,用于常规的蛋白质印迹分析,或与hrp结合的小鼠抗兔igg轻链特异性(cell signaling technology,#93702,1:1,000)一起孵育ip样品。用tbst洗涤3次后,用pierce ecl western印迹底物和super signal west femto maximum sensity底物试剂盒(thermofisher scientific)通过化学发光检测结合的抗体。图像采集用amersham imager600系统(ge healthcare bio
‑
sciences)进行。
[0223]
使用针对以下各项的一抗进行免疫印迹:来自abcam的乙酰基
‑
赖氨酸(#9441,1:1,000)、烯醇酶(#3810,1:1,000)、乙酰化微管蛋白(#5335,1:1,000)、α
‑
微管蛋白(#2144,1:1,000)、醛缩酶a (#8060,1:1,000)、来自cell signaling的pkm1/2(#3106,1:1,000)、β
‑
肌动蛋白(#ab8227,1:5,000)、sirt2(#ab67299,1:200)、gapdh(#ab181602,1:10,000)、ldh(#ab488 52,1:5,000)、pfkp(#ab204131,1:2,000)、己糖激酶(#ab150423,1:1,000)和来自novus biologicals的pgk1(#nbp2
‑
67534,1:1,000)。
[0224]
液相色谱质谱联用(lc
‑
ms/ms)
[0225]
在moffitt cancer center的蛋白质组学和代谢组学核心设施进行lc
‑
ms/ms分析。
[0226]
为了鉴定sirt2相互作用的靶标,在抗cd3包被板上培养来自wt小鼠脾的cd3
+
纯化t细胞。激活后一天,收集细胞,用pbs洗涤,并在ip裂解缓冲液中裂解。如前所述,使用抗sirt2(sigma)对照同种型对照(细胞信号传导)进行免疫沉淀测定。将免疫沉淀的蛋白质上样到10%sds
‑
page上并通过电泳分离。切下凝胶带,用三(2
‑
羧基
‑
乙基)膦盐酸盐(tcep)还原蛋白质,然后用碘乙酰胺烷基化。在37℃进行胰蛋白酶凝胶内消化过夜。使用ziptip c18对胰蛋白酶肽脱盐。
[0227]
为了鉴定乙酰化的蛋白,将来自wt和sirt2ko小鼠脾脏的cd3
+
纯化t细胞在抗cd3包被的平板上培养。激活后三天,收集细胞,用pbs洗涤,并在变性裂解缓冲液中裂解,所述变性裂解缓冲液含有8m尿素、20mm hepes(ph 8)、1mm原钒酸钠、2.5mm焦磷酸钠和1mmβ
‑
甘油磷酸盐。进行bradford分析以确定蛋白质浓度。将等量的重和轻蛋白质混合在一起。用4.5mm dtt还原混合的蛋白质,并用10mm碘乙酰胺烷基化。胰蛋白酶消化在室温下进行过夜,然后胰蛋白酶肽用1%三氟乙酸(tfa)酸化,并根据制造商的方法用c18 sep
‑
pak柱脱盐。
[0228]
冻干后,将干燥的肽沉淀重新溶解在iap缓冲液中,所述iap缓冲液含有50mm mops ph 7.2、10mm磷酸钠和50mm氯化钠。用固定化珠偶联的抗
‑
乙酰基
‑
赖氨酸(cell signaling,#13416)免疫沉淀含磷酪氨酸的肽。孵育2小时后,用iap缓冲液洗涤抗体珠3次,然后用h2o洗涤2次。磷酸酪氨酸肽用0.15%tfa洗脱两次,通过真空离心将体积减少到20μl。使用pierce高ph反相肽分级试剂盒(thermofisher scientific)将洗脱的肽分级。
[0229]
将与电喷射工作台顶部轨道阱质谱仪(q
‑
exactiveplus,thermofisher scientific)连接的nanoflow超高效液相色谱(rslc,dionex)用于串联质谱肽测序实验。样品首先装载到预柱(2cm
×
100μm id,用c18反相树脂填充,5μm,100a)上,并用2%乙腈和0.04%三氟乙酸水溶液洗涤8分钟。将捕获的肽洗脱到分析柱(c18,75μm id
×
25cm,2μm,100a,dionex)上。90分钟梯度编程为:95%溶剂a(2%乙腈+0.1%甲酸)8分钟,在60分钟内溶剂b(90%乙腈+0.1%甲酸)从5%至38.5%,然后在7分钟内溶剂b从50%至90%,并在
90%下保持5分钟,接着在1分钟内溶剂b从90%至5%,且再平衡10分钟。分析柱上的流速为300nl/min。在每次调查扫描之后以数据依赖性方式收集十六个串联质谱。ms和ms/ms扫描都在orbitrap中进行,以获得精确的质量测量,其中对先前取样的肽峰使用15秒排除。
[0230]
为了进行数据分析,mascot(perkins,d.n.,et al.electrophoresis,1999.20(18):3551
‑
67)和sequest(eng,j.k.,et al.j am soc mass spectrom,1994.5(11):976
‑
89)搜索算法都被用来从ip样品中鉴定蛋白质。结果总结在scaffold中。maxquant(cox,j.,et al.nat biotechnol,2008.26(12):1367
‑
72)(1.2.2.5版本)用于鉴定和定量含乙酰基
‑
赖氨酸的肽的相对强度。
[0231]
代谢组学分析
[0232]
在moffitt cancer center的蛋白质组学和代谢组学核心设施进行代谢组学分析。
[0233]
用平板包被的抗cd3刺激wt(n=5)和sirt2ko(n=4)小鼠脾脏的cd8+纯化的t细胞72小时,然后用pbs充分洗涤。
[0234]
使用80%甲醇(在
‑
80℃预先冷却至少1小时)从细胞提取代谢物,其含有相应的内标:葡萄糖(2,3,4,5,6
‑
13c5)、d
‑
葡萄糖
‑6‑
磷酸(u
‑
13c6)、d
‑
果糖
‑
1,6
‑
二磷酸(u
‑
13c6)、l
‑
丝氨酸(13c3)、甘氨酸(1,2
‑
13c2)、l
‑
半胱氨酸(3,3
‑
d2)、磷酸烯醇丙酮酸(2,3
‑
13c2)、乳酸(3,3,3
‑
d3)、丙酮酸(d3)、乙酰基
‑
1,2
‑
13c2 coa、柠檬酸(2,2,4,4
‑
d4)、α
‑
酮戊二酸(1,2,3,4
‑
13c4)、琥珀酸(d4)、富马酸(d4)、dl
‑
苹果酸(2,3,3
‑
d3)、d果糖
‑6‑
磷酸(u
‑
13c6),都购自cambridge labs。在
‑
80℃下孵育30分钟后,将样品离心(10分钟,18,800g,4℃),收集上清液,干燥并重悬于80%甲醇中。蛋白质沉淀用于蛋白质定量。
[0235]
uhplc
‑
ms使用vanquish lc(thermofisher scientific)与q exactive hf质谱仪(thermo fisher scientific)接口进行。在sequant zic
‑
philic lc柱(150
×
4.6mm,5μm粒度,millipore)上进行色谱分离。为了保持稳定的柱压和进一步过滤溶剂,将sequant zic
‑
philic保护柱(20
×
4.6mm,5μm粒度,millipore sigma)连接到lc柱。流动相a是在lc
‑
ms级水(vwr)中的10mm碳酸铵(sigma)和0.05%氢氧化铵(sigma),流动相b是100%乙腈(vwr)。总运行时间为20分钟。柱温设定为30℃,注射体积为2μl。ms分析分别以正离子和负离子模式进行,质量扫描范围为60
‑
900m/z。除了ms1之外,还获得了糖酵解和tca循环中涉及的重要中间体的prm。使用mzmine 2.33与内部保留时间文库的偶联来鉴定和定量代谢物。将结果相对于总蛋白标准化。
[0236]
富集分析
[0237]
与sirt2相互作用的基因列表通过metacore映射到genego数据库用于途径富集分析(bessarabova,m.,et al.bmc bioinformatics,2012.13suppl 16:s13)。p值的统计显著性表示随机获得两个数据集之间的特定大小的交集遵循超几何分布的概率。fdr<0.01的通路被认为是显着富集的。
[0238]
基于网络的工具msea(代谢物组富集分析)被引入metaboanalyst 4.0平台(xia,j.,et al.nucleic acids res,2010.38(web server issue):w71
‑
7),用于进行代谢物富集。sirt2ko t细胞中增加的代谢物的数据提交给msea。选择过代表性分析为富集分析方法。使用超几何测试实现与途径相关代谢物组文库的重叠。在调整后提供单尾p值用于多次测试。使用fdr<0.15作为截止值。
[0239]
统计分析
[0240]
统计参数可以在图例中找到。除非另有说明,p值通过双尾未配对student's t
‑
检验、kruskal
‑
wallis检验、单向anova或双向anova计算,如使用graphpad prism 7.0所示。在所有情况下,当p<0.05时,都认为统计学显著。图中显示平均值,误差棒代表sem。p值表示如下:*p<0.05;**p<0.01;***p<0.001,****p<0.0001。
[0241]
结果
[0242]
sirt2敲除t细胞是过反应的
[0243]
体外表征sirt2ko t细胞功能。在用gp100肽进行抗原攻击后,pmel/sirt2ko t细胞通过cfse稀释测定(图2a)显示增殖增加,通过elispot显示ifn
‑
γ产生(图2c)。此外,细胞内染色显示,与刺激后的pmel/wt相比,pmel/sirt2ko中ifn
‑
γ和粒酶b增加(图2b,2d
‑
2e)。pmel/sirt2ko t细胞在体外的这种过反应表型导致针对b16f10细胞的细胞毒性增强(图2f)。更重要的是,当在体外用b16f10细胞再激发从来自wt和sirt2ko小鼠的皮下b16f10肿瘤结节分离的cd3
+
til时,sirt2ko til与wt til相比显示优越的效应器功能,如通过ifn
‑
γ释放(图2g)和细胞毒性(图2h)所测量的结果所示。
[0244]
接下来阐述sirt2在激活和成熟时的表达模式。有趣的是,sirt2表达在体外刺激脾细胞、ln、富集cd3
+
和富集cd4
+
t细胞后有所提高(图15a
‑
15d)。sirt2在cd8
+
til中也相较在脾cd8
+
t细胞中高度表达(图15e)。有趣的是,我们发现til亚组中sirt2表达以t
cm
(中央记忆)>t
em
>t
eff
>初始的强度顺序增加(图15f)。
[0245]
总之,这些结果证明sirt2缺失由于增强的t细胞增殖和效应器功能而对癌症攻击具有保护作用。
[0246]
sirt2靶向糖酵解途径
[0247]
为了理解sirt2ko t细胞的高反应性的分子机制,人们努力鉴定调节t细胞功能的潜在sirt2相互作用配偶体。为此,进行2个不同的共免疫沉淀(共ip)实验,随后进行液相色谱质谱(lc
‑
ms/ms)分析。
[0248]
首先,为了鉴定直接sirt2结合配偶体,使用sirt2抗体相对于同种型对照ab进行co
‑
ip,然后对激活的wt cd3
+
t细胞进行lc
‑
ms/ms分析。鉴定了超过800种相互作用的蛋白质。为了排除非特异性靶标,选择用sirt2抗体鉴定的蛋白质,其强度高于同种型对照ab。有趣的是,10种糖酵解酶中有8种被鉴定并示于图3a:己糖激酶1(hk1)、磷酸果糖激酶(pfk)、醛缩酶a(aldoa)、甘油醛
‑3‑
磷酸脱氢酶(gapdh)、磷酸甘油酸激酶1(pgk1)、烯醇酶1(eno1)、丙酮酸激酶(pkm)和乳酸脱氢酶(ldh)。图8显示了从这些糖酵解蛋白衍生的肽的碰撞诱导解离(cid)谱图。gapdh和烯醇酶由于非特异性同种型对照ab结合而被排除在分析之外。
[0249]
其次,为了鉴定在sirt2不存在时的超乙酰化蛋白质,使用乙酰赖氨酸抗体进行ip,随后在初始的和激活的wt与sirt2ko cd3
+
t细胞进行lc
‑
ms/ms分析。与wt相比,在初始和/或激活的sirt2ko t细胞中发现了超过250个蛋白,重要的是,该分析揭示了sirt2ko t细胞中10种糖酵解酶中有6种是过度乙酰化的,包括醛缩酶、gapdh、pgk1、烯醇化酶、pkm和ldh。鉴定的衍生自这些糖酵解蛋白的肽的cid谱图以及提取离子色谱(eic)图显示了sirt2ko与相应乙酰化肽的wt相比强度增加,如图9所示。
[0250]
最后,为了鉴定与sirt2相互作用的潜在途径,使用genego metacore软件对两个
ip
‑
ms/ms列表之间的交集进行途径富集分析。选择四十三种蛋白作为结合sirt2和sirt2缺陷时的超乙酰化。基于genego分析的前10个富集途径揭示了第四位的糖酵解(图3e)。
[0251]
因此,通过共ip/免疫印迹验证了sirt2与hk1、pfkp、pkm、烯醇酶、pgk1、醛缩酶、gapdh和ldh的结合(图3b)。hk1、pfkp、pkm、pgk1、gapdh和ldh的反向共ip/免疫印迹验证了其相互作用(图3c)。sirt2ko中pfk和gapdh对wt t细胞的过度乙酰化也通过ip和反向ip/免疫印迹证实(图3d),而它们的总蛋白没有改变(参见输入;图3d)。
[0252]
为了说明糖酵解酶的乙酰化水平是否影响它们的活性,对wt和sirt2ko t细胞进行hk、pfk、醛缩酶、gapdh和烯醇化酶的酶活性测定。如所预期的,所有测试的酶活性随着sirt2缺失而增加(图3f),而相应酶的总蛋白在wt和sirt2ko t细胞之间没有变化(图15a)。
[0253]
因为sirt2与糖酵解酶相互作用而改变它们的乙酰化状态和酶活性,所以在seahorse analyzer上使用2种不同的分析通过测量细胞外酸化速率(ecar)研究sirt2ko t细胞在激活期间是否显示改变的糖酵解通量:糖酵解应激试验和糖酵解速率测定。
[0254]
实际上,sirt2缺陷增加了sirt2ko cd3
+
t细胞的激活(图4a,11c)以及sirt2ko cd8
+
t细胞的激活(图11a,11e)和pmel/sirt2ko cd8
+
t细胞(图11b,11f)中的基础、最大和补偿糖酵解,与pmel/wt相比,全部糖酵解储备不受影响。
[0255]
接下来探究了受刺激的鼠til是否显示与体外刺激的t细胞相同的代谢谱图。与之前的结果一致,来自sirt2ko小鼠皮下结节的cd3
+
til与wt相比之下显示出糖酵解通量的增加(图4b,11d)。与这些发现一致,发现糖酵解的关键代谢物和导致细胞外酸化的代谢物细胞外乳酸在sirt2ko中升高(图4c)。此外,与高能量状态一致,sirt2ko t细胞显示更高的atp/adp比例(图4d)。
[0256]
sirt2ko超活性是糖酵解依赖性的
[0257]
仍然需要解决的是,sirt2ko t细胞效应器功能增强是否对增加的糖酵解是特异性的。因此,接下来研究的是糖酵解的直接抑制是否会逆转sirt2ko t细胞过反应性。葡萄糖类似物2
‑
脱氧葡萄糖(2
‑
dg)在用gp100进行抗原攻击时,显著抑制了inf
‑
γ释放(图4e)和pmel/sirt2ko t细胞对pmel/wt t细胞的细胞毒性(图4f)。类似地,用2
‑
dg处理抑制了由分离自sirt2ko与wt小鼠皮下b16f10肿瘤结节的鼠cd3
+
til的inf
‑
γ释放(图4g)。这些结果提供了sirt2对糖酵解的调节和t细胞效应器功能之间的直接联系。
[0258]
sirt2协调t细胞代谢
[0259]
还检测了激活的wt对sirt2ko cd8
+
t细胞的细胞内代谢物水平,以研究sirt2是否调节其它代谢途径。通过超高效lc
‑
ms的无偏代谢组学分析证实了与t细胞功能相关的关键代谢物的显著改变(图5)。最显著地,sirt2ko t细胞中存在葡萄糖水平的下降,这与糖酵解对其利用的增加一致,因为sirt2ko t细胞没有表现出葡萄糖摄取或glut1表达与wt相比的任何变化。sirt2ko t细胞也显示了较高的胞外乳酸水平,证实丙酮酸优先转化为乳酸。尽管丙酮酸转化为乳酸,sirt2ko t细胞具有较高水平的来自α
‑
酮戊二酸的晚期tca循环中间体,这表明sirt2ko t细胞优先将谷氨酰胺氧化供能给tca循环(图5b)。
[0260]
使用metabodalyst工具的代谢物组富集分析(msea)表明sirt2ko t细胞中多种代谢途径的上调,最显著的是warburg效应、脂质、谷氨酸和氨基酸代谢。酰基肉碱、谷氨酸盐和氨基酸是反映可获得的线粒体燃料的中间体(图5e)。除了半胱氨酸水平的减少,在sirt2ko t细胞中没有观察到减少的代谢物的清晰模式,这表明其响应于增加的增殖用于
核酸代谢。(图5a)综上,这些数据表明sirt2是激活t细胞中糖酵解和其它关键代谢途径的主要代谢调节物。
[0261]
sirt2是人t细胞中的可操作靶标
[0262]
最后,为了将观察结果扩展到小鼠模型之外,使用2种不同的sirt2抑制剂分析sirt2抑制对人t细胞的作用:agk2和thiomyristoyl(tm)。通过监测乙酰化的α
‑
微管蛋白水平,一种已知的sirt2底物证实了它们阻断sirt2脱乙酰酶活性的能力(north,b.j.,et al.mol cell,2003.11(2):437
‑
44)(图15b
‑
15c)。与使用鼠敲除模型sirt2抑制剂agk2和tm的这些发现一致,增加了来自正常供体血液的人cd3
+
t细胞有氧糖酵解和inf
‑
γ产生(图12)。
[0263]
为了进一步转化应用sirt2阻断,从非小细胞肺癌(nsclc)患者研究agk2对人til的作用。数据显示了在5个患者til样品中的一致结果,显示出有氧糖酵解和inf
‑
γ产生有所增加(图6,13)。
[0264]
讨论
[0265]
靶向免疫检查点的新免疫疗法已经重新定义了癌症的治疗,然而,几种癌症仍然是具有耐受性的,并且迫切需要新的策略。重新激发抗肿瘤免疫应答的诱人替代策略来自新兴的免疫代谢领域(chang,c.h.,et al.cell,2015.162(6):1229
‑
41;o'neill,l.a.,et al.nat rev immunol,2016.16(9):553
‑
65;shevchenko,i.,et al.front immunol,2018.9:1816)。sirt2在本文中被鉴定为协调t细胞代谢和功能适应性的关键免疫检查点。
[0266]
重要的是,sirt2ko t细胞显示具有增加的增殖和效应器功能的高反应性表型,因此在体内有效排斥肿瘤攻击。有趣的是,sirt2ko til以及外周中t
em
增加,这似乎在肿瘤特异性免疫应答中起关键作用(mami
‑
chouaib,f.,et al.j immunother cancer,2018.6(1):87)。实际上,肿瘤中高频率的t
em
与癌症患者中有利的疾病进展相关(pages,f.,et al.n engl j med,2005.353(25):2654
‑
66)。与这种体内表型一致,在体外sirt2ko til对肿瘤细胞更具细胞毒性。此外,在sirt2ko til中pd
‑
1表达增加,且其阻断进一步增强了sirt2缺陷对抗肿瘤的保护作用。事实上,pd
‑
1,主要的抑制性检查点,是黑素瘤中激活的肿瘤反应性cd8
+
t细胞的自相矛盾的标志,并且具有pd
‑
1阻断的肿瘤消退需要预先存在的pd
‑1+
/cd8
+
t细胞(simon,s.,et al.oncoimmunology,2017.7(1):e1364828;inozume,t.,et al.j immunother,2010.33(9):956
‑
64;tumeh,p.c.,et al.ature,2014.515(7528):568
‑
71)。尽管以前没有报道,这些对sirt2ko t细胞高反应性和增强的肿瘤特异性免疫应答的观察结果,与sirt2的抗炎作用的现有报道一致(rothgiesser,k.m.,et al.j cell sci,2010.123(pt24):4251
‑
8;lo sasso,g.,et al.plos one,2014.9(7):e103573;newton,k.,et al.nature,2014.506(7489):e4
‑
6;pais,t.f.,et al.embo j,2013.32(19):2603
‑
16;lin,j.,et al.biochem biophys res commun,2013.441(4):897
‑
903)。
[0267]
对sirt2ko t细胞高反应性的潜在机制的公开研究揭示sirt2作为t细胞代谢的主要调节物的惊人作用。使用ip
‑
ms和乙酰组学分析对sirt2影响的分子途径进行无偏倚的筛选提示糖酵解途径是sirt2的主要靶标。尽管令人惊讶,但在最近关于sirt2在诱导的人多能干细胞(ihpsc)的代谢重编程中的作用的报道中也观察到糖酵解酶活性和糖酵解通量随sirt2缺失的显著增加(cha,y.,et al.nat cell biol,2017.19(5):445
‑
456)。实际上,5种在ihpsc模型中鉴定为sirt2底物的糖酵解酶和6种在hela细胞中鉴定为sirt2靶标的糖酵
解酶包括在8种我们在t细胞中鉴定为sirt2靶标的糖酵解酶中(cha,y.,et al.nat cell biol,2017.19(5):445
‑
456;park,s.h.,et al.cancer res,2016.76(13):3802
‑
12)。
[0268]
在激活的t细胞中,为了它们的增殖和效应器功能,需要转换到糖酵解表型(pearce,e.l.,et al.science,2013.342(6155):1242454)。已经充分确定,使用葡萄糖的结构类似物2
‑
dg阻断糖酵解可抑制t细胞增殖和效应器功能(cham,c.m.,et al.eur j immunol,2008.38(9):2438
‑
50)。2
‑
dg处理逆转sirt2ko t细胞的增强效应器功能,证实sirt2ko t细胞高反应性与增加的糖酵解有关。
[0269]
随后回到对oxphos的依赖和糖酵解的脱离对于t
m
分化尤其是t
cm
是必需的(pearce,e.l.,et al.science,2013.342(6155):1242454;zhang,l.,et al.trends mol med,2018.24(1):30
‑
48)。有趣的是,sirt2表达从t细胞激活到成熟晚期逐渐增加,而糖酵解则是脱离。事实上,sirt2表达在t
m
中比t
eff
更高,在t
cm
中比t
em
更高。令人惊讶的是,sirt2ko小鼠在til中能够产生比t
cm
更多的t
em
。sirt2ko til显示较高糖酵解通量的事实可解释t
em
而不是t
cm
的持久性。与这些结果一致,最近对vhl缺陷小鼠中糖酵解的组成性激活的研究也促进t
em
而不是t
cm
的形成,并具有增强的抗病毒免疫应答(phan,a.t.,et al.immunity,2016.45(5):1024
‑
1037)。
[0270]
代谢组学数据进一步证实了关于有氧糖酵解的发现。sirt2ko t细胞中降低的葡萄糖水平以及糖酵解的终产物(包括乳酸盐和丝氨酸)增加证实了用海马实验观察到的糖酵解通量增加。此外,代谢组学图谱证实了支持sirt2ko t细胞代谢适应度的其它关键代谢物的上调。值得注意的是,在sirt2ko t细胞中谷氨酰胺和丝氨酸代谢显著增加。谷氨酰胺对t细胞功能至关重要,并主要在葡萄糖限制条件下支持其代谢(carr,e.l.,et al.j immunol,2010.185(2):1037
‑
44;wang,r.,et al.immunity,2011.35(6):871
‑
82;johnson,m.o.,et al.cell,2018.175(7):1780
‑
1795e19)。在发展后,癌细胞变得对谷氨酰胺十分依赖,谷氨酰胺限制t细胞燃料并影响肿瘤微环境内的t细胞功能(cluntun,a.a.,et al.trends cancer,2017.3(3):169
‑
180)。丝氨酸在t
eff
细胞中也具有重要作用,其为增殖t细胞中的核苷酸从头合成提供甘氨酸。丝氨酸是从糖酵解中间体3
‑
磷酸甘油酸新合成的(ma,e.h.,et al.cell metab,2017.25(2):345
‑
357)。显然,许多代谢途径随着sirt2缺乏而上调,并且一起促进t细胞在代谢挑战性微环境中的代谢适应性。
[0271]
最近的研究揭示,许多熟知的代谢标志物,例如pep和gapdh,也作为免疫稳态和抗肿瘤应答中的关键检查点(shevchenko,i.,et al.front immunol,2018.9:1816;chang,c.h.,et al.cell,2013.153(6):1239
‑
51;ho,p.c.,et al.cell,2015.162(6):1217
‑
28)。转录因子c
‑
myc和hif
‑
1α对于t细胞代谢重编也是至关重要的,以在t细胞激活时发起糖酵解(wang,r.,et al.immunity,2011.35(6):871
‑
82;doedens,a.l.,et al.nat immunol,2013.14(11):1173
‑
82)。因此,操作这些代谢检查点以增强t细胞代谢可能是有吸引力的策略。然而,由于难以产生选择性药物,或由于靶向具有关键细胞功能的普遍存在的途径而引起的非预期毒性,此类代谢干预仍然是罕见至不可能的。
[0272]
在这方面,sirt2阻断提供了操纵t细胞代谢以增强免疫治疗的独特机会。在小鼠中的表型和机制研究进一步在人t细胞中使用2种选择性sirt2抑制剂:agk2和tm证实(jing,h.,et al.cancer cell,2016.29(5):767
‑
768),强调sirt2确实是癌症免疫疗法的可行治疗靶标。
[0273]
sirt2阻断的治疗效果依赖于增强til最佳参与有氧糖酵解以维持效应器功能同时与癌细胞竞争肿瘤微环境内的有限资源的能力。实际上,肿瘤改变t细胞功能命运的关键机制之一是微环境中营养素利用度的改变(chang,c.h.,et al.cell,2015.162(6):1229
‑
41)。然后,响应热量限制诱导sirt2表达,并引发糖异生过程,同时阻断糖酵解(gomes,p.,et al.trends pharmacol sci,2015.36(11):756
‑
768;jiang,w.,et al.mol cell,2011.43(1):33
‑
440)。例如,抑制braf和kras癌基因刺激肿瘤中t细胞浸润和inf
‑
γ的产生。这些观察结果是由于它们对肿瘤有氧糖酵解的抑制,恢复了微环境中的葡萄糖水平(ho,p.c.,et al.cancer res,2014.74(12):3205
‑
17;ying,h.,et al.cell,2012.149(3):656
‑
70)。当til适应严酷的肿瘤微环境时,它们逐渐经历伴随几种抑制性刺激的上调的功能衰竭过程。最显著地,t细胞中的pd
‑
1信号传导抑制akt
‑
mtor通路,从而抑制有氧糖酵解(bengsch,b.,et al.immunity,2016.45(2):358
‑
73),而肿瘤细胞中伴随的pd
‑
l1信号传导,通过激活akt
‑
mtor途径促进糖酵解(chang,c.h.,et al.cell,2015.162(6):1229
‑
41)。在这方面,对肿瘤细胞代谢的代谢干预,例如mtor抑制剂的使用,可能长期效力较差,因为它们对til的代谢适应性的非预期影响(chaoul,n.,et al.cancer res,2015.75(16):3279
‑
91)。
[0274]
因此,代谢性重编til的sirt2阻断可能是与现有免疫检查点抑制剂协同的有效策略。有趣的是,sirt2缺陷增强pd
‑
1阻断突出了该组合策略的潜在益处。另外值得注意的是,靶向sirt2还可有效增加基于细胞的免疫治疗的代谢适应性并改善其治疗结果。在这种情况下,除了药理学干预之外,可通过在til或嵌合抗原受体(car)
‑
t细胞在体外产生期间进行基因编辑来实现sirt2的操作(rosenberg,s.a.,et al.science,2015.348(6230):62
‑
8;lim,w.a.,et al.cell,2017.168(4):724
‑
740)。
[0275]
总之,sirt2缺失通过促进小鼠和人的代谢重编程朝向有氧糖酵解而增强肿瘤特异性t细胞应答。sirt2因此是具有不同机制的可作用靶标,以进一步增强现有癌症免疫治疗,包括免疫检查点抑制剂或基于细胞的治疗。
[0276]
实施例2sirt2抑制重编t细胞代谢以赋予优良的抗肿瘤免疫
[0277]
方法
[0278]
小鼠
[0279]
c57 bl/6j小鼠,具有gp100反应性转基因t细胞受体(tcr)的pmel小鼠:b6.cg
‑
thy1
a
/cy tg(tcratcrb)8rest/j,主要组织相容性复合体ii类限制性ova特异性tcr(ot
‑
ii)转基因小鼠:b6.cg
‑
tg(tcratcrb)425cbn/j,sirt2
‑
/
‑
小鼠:b6.129
‑
sirt2
tm1.1fwa
/j和免疫缺陷nod scid gamma(nsg)小鼠:nod。cg
‑
prkdscid il2rg
tm1wjl
/szj购自jackson laboratory。将pmel tcr转基因小鼠和ot
‑
ii tcr转基因小鼠与sirt2
‑
/
‑
小鼠杂交,以分别产生sirt2
‑
/
‑
pmel小鼠和sirt2
‑
/
‑
ot
‑
ii小鼠。小鼠在7
‑
8周龄与年龄和性别匹配的对照一起使用。
[0280]
小鼠t细胞培养
[0281]
从wt、sirt2
‑
/
‑
、wt pmel和sirt2
‑
/
‑
pmel小鼠收集脾和/或淋巴结(ln),并加工成单细胞悬浮液。分别使用小鼠pan t细胞、cd4
+
t细胞和cd8
+
t细胞分离试剂盒,根据制造商的说明书,负富集cd3
+
、cd4
+
和cd8
+
t细胞。通过流式细胞术验证分离的细胞的纯度(>95%,未显示)。纯化的t细胞在完全rpmi 1640培养基(thermo fisher scientific)中培养,该培养基
补充有10%(体积/体积)胎牛血清(fbs,biowest)和1%(体积/体积)青霉素/链霉素(p/s,thomas scientific公司)。wt和sirt2
‑
/
‑
t细胞用平板结合的抗cd3抗体(5μg/ml,145
‑
2c11,bioxcell)激活指定的时间段。wt pmel和sirt2
‑
/
‑
pmel t细胞用gp100(1μg/ml,anaspec)刺激指定的时间段。
[0282]
储存的区分(memory differentiation)
[0283]
ot
‑
ii脾细胞用10μg/ml ova肽(anaspec)激活3天,随后在10ng/ml il
‑
15(r&d)存在下培养4天以产生t
m
细胞。
[0284]
人pbmc
[0285]
人外周血单核细胞(pbmc)从健康供体通过使用ficoll
‑
paque plus培养基(ge healthcare)的密度梯度离心获得。使用人pan t细胞分离试剂盒(miltenyi biotec)负富集cd3
+
淋巴细胞。富集的cd3
+
t细胞在完全rpmi培养基中培养,并在dmso(载体)或所示浓度的sirt2抑制剂agk2和thiomyristoyl(selleck chemicals)之一的存在下,用板结合的抗cd3抗体(5μg/ml,okt
‑
3,bioxcell)激活。
[0286]
人til
[0287]
从非小细胞肺癌(nsclc)患者的肿瘤活检分离的人肿瘤浸润淋巴细胞(til)。提供的所有人样品保持未鉴定。对于人til和相应pbmc的sirt2染色,包括12位患者的群组特征如前所述(creelan,b.,et al.(2018).journal of thoracic oncology 13)。
[0288]
对于til扩增,将til培养在完全rpmi 1640培养基中,该培养基补充有10%人ab血清(valley biomedical,inc.)、1mm hepes(sigma
‑
aldrich)、1%p/s(thomas scientific,50μg/ml庆大霉素(thermo fisher scientific)、50μmβ
‑
巯基乙醇(thermo fisher scientific)和6,000u/ml重组人rhil
‑
2(peprotech)。对于代谢和功能测定,在载体或所示浓度的agk2、sirt2抑制剂(selleck chemicals)存在下,在完全rpmi培养基(不含il
‑
2)中,在平板结合的抗cd3抗体(5μg/ml,okt
‑
3,bioxcell)上培养til。
[0289]
肿瘤细胞
[0290]
b16f10黑素瘤细胞从美国典型培养物保藏中心获得。将细胞最低限度传代,并维持在含有10%fbs(biowest)和1%p/s(thomas scientific inc)的完全dulbecco's改良eagle培养基dmem/f12(thermo fisher scientific)中。
[0291]
黑素瘤肺转移模型
[0292]
将100μl无菌磷酸盐缓冲盐水(pbs,sigma
‑
aldrich)中的b16f10肿瘤细胞(n=2.5
×
105)静脉内注射到小鼠的侧尾静脉中。对于抗pd
‑
1给药,每3天给小鼠腹膜内注射200μg抗pd
‑
1抗体(rmp1
‑
14,bioxcell),总共注射三次。肿瘤细胞注射后十八天,从安乐死的小鼠中取出肺。计数肺表面上可见的黑色转移性结节的数目。
[0293]
皮下肿瘤模型
[0294]
将200μl无菌pbs中的2.5
×
105b16f10肿瘤细胞皮下注射入麻醉小鼠的后肢。在3周内每周两次监测肿瘤体积,并使用椭圆体体积=长度
×
宽度
×
高度
×
π/6的方程进行计算。
[0295]
小鼠til的分离
[0296]
通过将组织切块,然后在含有4型胶原酶(2mg/ml,worthington biochemical)和dnase i(0.25mg/ml,sigma
‑
aldrich)的pbs中酶消化45分钟,偶尔在37℃振荡,分离来自皮
scientific)标记初始pmel t细胞30分钟,然后用gp100刺激或不刺激3
‑
4天。通过cfse稀释和细胞分裂的流式细胞术测定细胞增殖。
[0305]
酶联免疫斑点(elispot)测定
[0306]
在elispot试验中评价产生ifn
‑
γ的细胞的数目。简言之,将小鼠til以1
×
105个细胞铺板,并与1
×
103照射的b16f10肿瘤细胞(50gray)在存在指定浓度的2
‑
dg(sigma
‑
aldrich)的存在下共培养,在预先包被有抗小鼠ifn
‑
γ抗体(an
‑
18,mabtech,inc.)的96孔硝酸纤维素平底板(elispot板,millipore)中,并在37℃下孵育48小时以获得pmel t细胞,首先在指定浓度的2
‑
dg(sigma
‑
aldrich)存在下用gp100(1μg/ml,anaspec)刺激脾细胞48小时,然后转移到预先包被有抗小鼠ifn
‑
γ抗体(an
‑
18,mabtech,inc.)的elispot板中再孵育48小时。对于人cd3
+
t细胞和til,首先在所示浓度的载体或agk2或tm的存在下,用平板包被的抗cd3刺激细胞48小时,然后转移到用抗人ifn
‑
γ抗体(1
‑
d1k,mabtech,inc.)预包被的elispot平板上。pma(10ng/ml,sigma
‑
aldrich)用作阳性测定对照。洗涤步骤和连续的生物素化抗
‑
ifn
‑
γ抗体(r4
‑
6a2,mabtech,inc.)和链霉抗生物素蛋白
‑
hrp(bd bioscience)标记后,使用aec底物试剂盒(bd biosciences)检测斑点,并使用aid elispot reader system(autoimmun diagnostika gmbh)计数。
[0307]
乳酸脱氢酶(ldh)释放测定
[0308]
按照生产商的方案,使用pierce
tm ldh细胞毒性测定试剂盒(thermo fisher scientific)进行功能细胞毒性活性的评价。简言之,b16f10细胞用作靶标,从皮下b16f10肿瘤结节分离的小鼠cd3
+
til或从gp100刺激的pmel脾细胞分离的cd8
+
富集的t细胞用作效应细胞。在96孔圆底微孔板中,在指定效应器:靶标比例下,将靶b16f10肿瘤细胞与效应细胞共培养。6小时后,根据下式计算特定ldh释放的百分比:%细胞裂解=(实验值
‑
效应细胞自发释放
‑
靶细胞自发释放)
×
100/(靶细胞最大释放
‑
靶细胞自发释放),其中“实验”对应于实验信号值,“效应细胞自发”对应于从效应细胞单独自发释放ldh,“靶自发”对应于从靶细胞单独自发释放ldh,“最大释放”对应于在含有1%triton x
‑
100的培养基中从靶细胞最大释放ldh。
[0309]
细胞外通量分析
[0310]
使用seahorse xf分析仪(agilent technologies)测量细胞外酸化速率(ecar)和耗氧速率(ocr)。糖酵解应激试验(gst)、糖酵解速率试验(gra)和线粒体应激试验(mst)按照购自agilent technologies的试剂盒制造商的说明书进行。
[0311]
在试验当天,将2
×
105激活的t细胞通过离心接种在含xf培养基(xf rpmi培养基,ph 7.4,含有2mm l
‑
谷氨酰胺仅用于gst,或补充10mm葡萄糖、2mm l
‑
谷氨酰胺和1mm丙酮酸钠用于gra和mst,均购自agilent technologies)的cell
‑
tak(corning)包被的xf96平板中,以确保细胞附着。在开始测定前,将细胞在非co2培养箱中平衡1小时。
[0312]
对于gst,在基底条件下和对10mm葡萄糖、1μm寡霉素和50mm 2
‑
dg的反应下依次测量ecar和ocr,以计算基底糖酵解速率、糖酵解能力(对寡霉素的反应)和糖酵解储备量(糖酵解能力
‑
基底速率)。
[0313]
对于gra,在基底条件并且响应于0.5μm鱼藤酮/抗霉素a和50mm 2
‑
dg的条件下,相继测量ecar和ocr,以计算基底糖酵解和补偿糖酵解(响应于鱼藤酮/抗霉素a)。
[0314]
对于mst,在基底条件和响应于1μm寡霉素、1μm fccp(羰基氰4
‑
三氟甲氧基苯腙)
和0.5μm鱼藤酮/抗霉素a按顺序注射的条件下,测量ocr和ecar,以计算基础呼吸速率(基线ocr
‑
鱼藤酮/抗霉素aocr)、最大呼吸(fccp ocr
‑
鱼藤酮/抗霉素a ocr)和氧化储备(最大呼吸速率
‑
基础呼吸速率)。
[0315]
为了测量糖酵解、谷氨酰胺分解和fao作为线粒体代谢的燃料的贡献,在基础条件并且响应于媒介物、uk5099(2μm)、bptes(3μm)或乙氧嘧啶(4μm)抑制剂以及然后1μm寡霉素、1μm fccp(羰基氰化物4
‑
三氟甲氧基苯腙)和0.5μm鱼藤酮/抗霉素a按顺序注射的条件下,测量ocr和ecar。
[0316]
为了测量外源和内源fa的氧化,将t细胞在完全rpmi培养基中激活3天,并转移到底物限制的培养基中过夜。底物限制培养基含有0.5mm葡萄糖、1mm谷氨酰胺、0.5mm肉碱(均来自sigma)和1%fbs(biowest)。在测定前立即加入棕榈酸盐或bsa底物。在基础条件并响应于依次注射载体或依托莫昔(4μm)然后注射1μm寡霉素、1μm fccp(羰基氰4
‑
三氟甲氧基苯腙)和0.5μm鱼藤酮/抗霉素a的条件下,测量ocr。
[0317]
fao对ocr的相对贡献计算如下:由外源fa氧化引起的最大呼吸=最大棕榈酸+运载体ocr速率
‑
由游离fa解偶联引起的最大bsa+运载体ocr速率
‑
ocr。通过游离fa=,棕榈酸酯+注射寡霉素后的载体ocr速率
‑
注射寡霉素后的bsa+载体ocr速率的解偶联。由于内源性fa消耗的最大ocr=最大bsa +运载体ocr速率
‑
最大bsa+etomoxir ocr速率。
[0318]
将结果使用pierce bca蛋白测定试剂盒(thermo fisher scientific)定量的总蛋白归一化处理。
[0319]
酶活性测定
[0320]
wt和sirt2
‑
/
‑
cd3
+
富集的t细胞在抗cd3抗体包被的平板上激活3天。根据制造商的说明书,使用酶比色测定试剂盒(全部来自biovision)从激活的t细胞裂解物中测量醛缩酶、烯醇化酶、gapdh、己糖激酶、磷酸果糖激酶、顺乌头酸酶、酮戊二酸脱氢酶、琥珀酸脱氢酶、琥珀酰
‑
coa连接酶的酶活性。
[0321]
乳酸盐、谷氨酰胺和谷氨酸盐的测定
[0322]
使用ysi 2900biochemistry analyzer(ysi掺入)测定细胞外乳酸、谷氨酰胺和谷氨酸的浓度。简言之,在三个分开的2ml新鲜培养基中,在抗cd3抗体结合孔上培养2
×
106个cd3
+
富集的t细胞。激活后三天,收获细胞培养上清液用于代谢物定量。所有测定均一式三份进行,结果归一化为校准标准(ysi掺入)并与新鲜培养基比较。
[0323]
adp/atp比率测定
[0324]
使用adp/atp比率测定试剂盒(sigma
‑
aldrich)基于生物发光检测反应,根据制造商的说明书测量细胞内atp/adp水平。将富含cd3
+
的t细胞铺板在结合抗cd3的96孔微孔板中。激活后三天,将细胞在核苷酸释放缓冲液中裂解。通过在adp转化酶不存在和存在下连续使用多模式酶标仪(synergy htx,biotek)测量生物发光强度来测定atp和adp水平。
[0325]
免疫沉淀
[0326]
对于免疫沉淀(ip)测定,激活的cd3
+
t细胞在ip裂解缓冲液[20mm hepes,ph 7.9,180mm kcl,0.2mm edta,1.5mm mgcl2,20%(体积/体积)甘油,0.1%nonidet p
‑
40,含有蛋白酶抑制剂的混合物]中裂解。细胞裂解物在4℃下与针对购自sigma
‑
aldrich的sirt2(#9441,1:50)、乙酰基
‑
赖氨酸(#9441,1:50)、eno1(#3810,1:50)、aldoa(#8060,1:50)、pkm1/2(#3106,1:50)、ogdh(#26865,1:50)、aco2(#6571,1:50)、购自cell signaling的sdha (#
11998,1:50)和suclg1(#8071,1:50)、gapdh(#ab602,1:60)、ldh(#ab52488,1:30)、pfkp(#ab204131,1:80)或购自novus biologicals的pgk1
‑
67534,1:3650)的特异性抗体孵育过夜。兔mab igg(cell signaling,#3900)用作同种型对照mab。加入抗兔ig琼脂糖珠(trueblot,rockland)后,样品在4℃温育2小时。用ip裂解缓冲液洗涤珠子五次,通过在3x sds样品上样缓冲液中煮沸的方式从珠子上释放蛋白质,并上样到10%sds
‑
page凝胶中进行蛋白质印迹分析。
[0327]
蛋白质印迹分析
[0328]
使用补充有complete
tm
蛋白酶抑制剂混合物和phosstop磷酸酶抑制剂混合物(roche applied science)的裂解缓冲液(pierce ripa缓冲液,thermo fisher scientific)制备全细胞裂解物。
[0329]
将细胞裂解物(20μg)或ip样品上样到10%sds
‑
page上,通过电泳分离,然后使用trans
‑
blot turbo转移系统(bio
‑
rad)半干转移至聚偏二氟乙烯膜(immun
‑
blot pvdf膜,bio
‑
rad)中。转移后,在室温下用含有0.05%tween
‑
20(tbst)和5%(w/v)脱脂奶粉的tris缓冲盐水(tbs)封闭1小时,然后在4℃下与特异性一抗(如下所示)孵育过夜。用tbst洗膜三次,然后与辣根过氧化物酶(hrp)结合的山羊抗小鼠igg h&l(abcam,#97051,1:3,000)一起孵育1小时,用于常规的蛋白质印迹分析,或与hrp结合的小鼠抗兔igg轻链特异性(cell signaling,#93702,1:1,000)一起温育ip样品。用tbst洗涤3次后,使用pierce ecl western印迹底物和super signal west femto maximum sensity底物试剂盒(thermo fisher scientific),通过化学发光检测结合的抗体。图像采集用amersham imager600系统(ge healthcare bio
‑
sciences)进行。
[0330]
使用针对以下各项的一抗进行免疫印迹:cell signaling的乙酰
‑
赖氨酸(#9441,1:1,000)、烯醇酶(#3810,1:1,000)、乙酰化微管蛋白(#5335,1:1,000)、α微管蛋白(#2144,1:1,000)、醛缩酶a (#8060,1:1,000),pkm1/2(#3106,1:1,000)、ogdh(#26865,1:1,000)、aco2(#6571,1:1,000)、sdha(#11998,1:1,000)、suclg1(#8071,1:1,000)、asct2 5345,1:1,000)和c
‑
myc(#9402,1:1,000),novus biologicals的β
‑
肌动蛋白(#8227,1:5,000)、sirt267299,1:200)、gapdh(#18118,000)、ldh ab(#602,1:5,488,pfep131,000)、hdab(#1:1,128)、hdab114,000)、hap1:1,128000、npk3939、npk150000)、pgk150k1,128000和pgk3939,1:1,128000。
[0331]
rna测序分析
[0332]
用抗cd3平板包被的培养皿刺激wt和sirt2
‑
/
‑
小鼠脾的cd4
+
纯化的t细胞24小时,或保持未刺激(每组n=3)。使用rneasy mini试剂盒(qiagen;cat.#74106)提取rna,并使用nugen ovation小鼠rna
‑
seq system(nugen公司,san carlos,ca)进行rna测序。简言之,按照制造商的方案,用100ng rna产生cdna和链特异性文库。进行质量控制步骤,包括tapestation文库评估和用于文库定量的定量rt
‑
pcr。在illumina nextseq 500测序仪上用2
×
75
‑
碱基配对末端高输出运行对文库进行测序,以便产生每个样品30百万个读对。
[0333]
液相色谱
‑
串联质谱(lc
‑
ms/ms)
[0334]
为了鉴定sirt2相互作用的靶标,在抗cd3包被的平板上培养来自wt小鼠脾的cd3
+
纯化的t细胞。激活后一天,收集细胞,用pbs洗涤,并在ip裂解缓冲液中裂解。如前所述,使用抗sirt2 ab(sigma
‑
aldrich)对比同种型对照ab(细胞信号传导)进行免疫沉淀测定。将
免疫沉淀的蛋白质上样到10%sds
‑
page上并通过电泳分离。切下凝胶带,用三(2
‑
羧基
‑
乙基)膦盐酸盐(tcep)还原蛋白质,然后用碘乙酰胺烷基化。在37℃下用胰蛋白酶进行凝胶内消化过夜。使用ziptip c18微量移液管柱对胰蛋白酶肽脱盐。
[0335]
为了鉴定乙酰化的蛋白,将来自wt和sirt2
‑
/
‑
小鼠脾脏的cd3
+
纯化的t细胞在抗cd3包被的平板上培养。激活后三天,收集细胞,用pbs洗涤,并在变性裂解缓冲液中裂解,所述变性裂解缓冲液含有8m尿素、20mm hepes(ph 8)、1mm原钒酸钠、2.5mm焦磷酸钠和1mmβ
‑
甘油磷酸盐。进行bradford分析以确定蛋白质浓度。对每个样品分析等量的总蛋白质。用4.5mm dtt还原混合的蛋白质,并用10mm碘乙酰胺烷基化。胰蛋白酶消化在室温下进行过夜,然后胰蛋白酶肽用1%三氟乙酸(tfa)酸化,并根据制造商的方法用c18 sep
‑
pak柱脱盐。
[0336]
冻干后,将干燥的肽沉淀重新溶解在iap缓冲液中,所述iap缓冲液含有50mm mops ph 7.2、10mm磷酸钠和50mm氯化钠。用固定化珠偶联的抗乙酰赖氨酸(cell signaling,#13416)免疫沉淀含乙酰赖氨酸的肽。孵育2小时后,用iap缓冲液洗涤抗体
‑
珠3次,接着用h2o洗涤2次。用0.15%tfa洗脱乙酰基
‑
赖氨酸肽两次,并通过真空离心将体积减少至20μl。使用pierce高ph反相肽分级试剂盒(thermo fisher scientific)将洗脱的肽分级。
[0337]
将与电喷射工作台顶部orbitrap质谱仪(q exactiveplus,thermo fisher scientific)连接的nanoflow超高效液相色谱(rslc,dionex)用于串联质谱肽测序实验。将样品首先上样到预柱(100μm id
×
2cm长,用c18反相树脂填充,5μm粒度,100a)上,用2%乙腈和0.04%三氟乙酸水溶液洗涤8分钟。将捕获的肽洗脱到分析柱上(c18,75μm id
×
25cm长,2μm粒度,100a,dionex)。90分钟梯度编程为:95%溶剂a(2%乙腈+0.1%甲酸)8分钟,在60分钟内溶剂b(90%乙腈+0.1%甲酸)从5%至38.5%,然后在7分钟内溶剂b从50%至90%,并在90%下保持5分钟,接着在1分钟内溶剂b从90%至5%,且再平衡10分钟。分析柱上的流速为300nl/min。在每次调查扫描后,使用对先前取样的肽峰的15秒排除,以数据依赖性方式收集十六个串联质谱。
[0338]
为了进行数据分析,使用mascot(perkins,d.n.,et al.1999.)和sequest(eng et al.,1994)搜索算法从ip样品中鉴定蛋白质。结果总结在scaffold中。maxquant(cox,j.,et al.nat biotechnol,2008.26(12):1367
‑
72)(1.2.2.5版本)用于鉴定和定量含乙酰基
‑
赖氨酸的肽的相对强度。
[0339]
代谢动力学分析
[0340]
用抗cd3平板包被的小鼠脾刺激来自wt(n=5)和sirt2
‑
/
‑
(n=4)的cd8+纯化的t细胞72小时,然后用pbs充分洗涤。使用80%甲醇(在
‑
80℃预先冷却至少1小时)从细胞提取代谢物,其含有相应的内标:葡萄糖(2,3,4,5,6
‑
13c5)、d
‑
葡萄糖
‑6‑
磷酸(u
‑
13c6)、d
‑
果糖
‑
1,6
‑
二磷酸(u
‑
13c6)、l
‑
丝氨酸(13c3)、甘氨酸(1,2
‑
13c2)、l
‑
半胱氨酸(3,3
‑
d2)、磷酸烯醇丙酮酸(2,3
‑
13c2)、乳酸(3,3,3
‑
d3)、丙酮酸(d3)、乙酰基
‑
1,2
‑
13c2 coa、柠檬酸(2,2,4,4
‑
d4)、α
‑
酮戊二酸(1,2,3,4
‑
13c4)、琥珀酸(d4)、富马酸(d4)、dl
‑
苹果酸(2,3,3
‑
d3)、d果糖
‑6‑
磷酸(u
‑
13c6),所有都购自cambridge labs。在
‑
80℃下孵育30分钟后,将样品离心(10分钟,18,800x g,4℃),收集上清液,干燥并重悬于80%甲醇中。蛋白质沉淀用于蛋白质定量以用作样品质量控制度量。
[0341]
uhplc
‑
ms使用vanquish lc(thermo fisher scientific)与q exactive hf质谱
仪(thermo fisher scientific)接口进行。在sequant zic
‑
philic lc柱(4.6mm id
×
150,长度66150mm,粒径5μm,millipore)上进行色谱分离。为了保持稳定的柱压和进一步过滤溶剂,在lc柱之前连接sequant zic
‑
philic保护柱(4.6mm
×
20,6620mm长,5μm粒度,millipore)。流动相a是使用lc
‑
ms级水(vwr)的10mm碳酸铵(sigma
‑
aldrich)和0.05%氢氧化铵(sigma
‑
aldrich),流动相b是100%乙腈(vwr)。总运行时间为20分钟。柱温设定为30℃,注射体积为2μl。使用m/z 60至m/z 900的质量扫描范围,以正离子和负离子模式进行单独的uhplc
‑
ms分析。除了ms1,还对于糖酵解和tca循环中涉及的重要中间体,获得了使用平行反应监测(prm)的靶向串联质谱。使用mzmine 2.33与内部保留时间文库的偶联来鉴定和定量代谢物。将结果相对于总蛋白标准化。
[0342]
通过lc
‑
ms/ms分析酰基
‑
肉碱、酰基
‑
coa和乙酰
‑
coa
[0343]
用抗cd3平板包被的小鼠脾刺激来自wt(n=5)和sirt2
‑
/
‑
(n=6)的cd8
+
纯化的t细胞72小时,然后用pbs充分洗涤。使用80%甲醇(在
‑
80℃预先冷却至少1小时)从细胞提取代谢物,其含有相应的内标:l
‑
肉毒碱(三甲基
‑
d9)、o
‑
乙酰基
‑
l
‑
肉毒碱(n
‑
甲基
‑
d3)、o
‑
丁酰基
‑
l
‑
肉毒碱(n
‑
甲基
‑
d3)、o
‑
己酰基
‑
l
‑
肉毒碱(n
‑
甲基
‑
d3)、o
‑
辛酰基
‑
l
‑
肉毒碱(n
‑
甲基
‑
d3)、o
‑
癸酰基
‑
l
‑
肉毒碱(n
‑
甲基
‑
d3)、o
‑
月桂酰基
‑
l
‑
肉毒碱(n,n,n
‑
三甲基
‑
d3)、o
‑
肉豆蔻酰基
‑
l
‑
肉毒碱(n,n,n
‑
三甲基
‑
d3)、o
‑
棕榈酰基
‑
l
‑
肉毒碱(n
‑
甲基
‑
d3)、o
‑
硬脂酰基
‑
l
‑
肉毒碱(n
‑
甲基
‑
d3)、乙酰基
‑
辅酶a(1,2
‑
13c2),均购自cambridge labs。在
‑
80℃下孵育30分钟后,将样品离心(10分钟,18,800x g,4℃),收集上清液,干燥并重悬于80%甲醇中。使用bradford分析将蛋白质沉淀用于蛋白质定量以用作样品质量控制度量。
[0344]
uhplc
‑
ms使用与q exactive focus质谱仪(thermo fisher scientific)接口的vanquish lc(thermo fisher scientific)进行。
[0345]
对于酰基
‑
肉碱:在acquity uplc beh酰胺柱(2.1mm
×
150mm,1.7μm粒度,waters,milford,ma)上进行色谱分离;流动相a是10mm碳酸铵(sigma
‑
aldrich)和0.05%氢氧化铵(sigma
‑
aldrich),流动相b是100%乙腈;总运行时间为15分钟;在正模式下执行选定离子监测(sim)。
[0346]
对于酰基
‑
coa:使用accucore vanquish c18+(2.1mm
×
100mm,1.5μm粒度,thermo fisher scientific,san jose,ca)进行lc分离;流动相a是10:90乙腈:含有15mm氢氧化铵的水,流动相b是含有15mm氢氧化铵的100%乙腈;总运行时间为15分钟;以阳性模式进行平行反应监测(prm)。
[0347]
对于乙酰
‑
coa:使用accucore c18柱(2.1mm
×
100mm,2.6μm粒度,thermo fisher scientific,san jose,ca);流动相a是5mm二丁基乙酸铵(sigma
‑
aldrich)和乙酸铵ph=9.0(sigma
‑
aldrich),流动相b是含有0.1%甲酸的100%甲醇;总运行时间为9分钟;完全ms1以负模式进行。对于所有分析,柱温设定为30℃,注射体积为2μl。峰高使用skyline(19.1版)测定。对于酰基肉碱和乙酰coa,使用每个分子与其各自内标的峰高比计算量(以μg计)。对于酰基coa,由于在分析期间内标物的不可用性,仅报道了从skyline获得的峰高。
[0348]
富集分析
[0349]
对于基因集富集分析,sirt2
‑
/
‑
t细胞相对于wt t细胞中上调的基因列表被上载到msigdb(subramanian,a.,et al.(2005).proc natl acad sci u s a102:15545
‑
15550)。使用<0.001的错误发现率q值作为截止值。
[0350]
使用基于网络的工具msea(代谢物组富集分析)进行代谢物富集,该工具并入metaboanalyst 4.0平台(xia and wishart,2010)(https://www.metaboanalyst.ca/)。sirt2
‑
/
‑
t细胞中增加的代谢物的数据提交到msea。选用过代表性分析为富集分析方法。使用超几何测试实现与途径相关代谢物组文库的重叠。在调整后提供单尾p值用于多次测试。使用错误发现率q值<0.15作为截止值。
[0351]
统计分析
[0352]
统计参数可以在图例中找到。p值通过双尾未配对或配对student's t检验、单向anova或双向anova计算,如使用graphpad prism 7.0所示。在所有情况下,当p<0.05时,都认为统计学显著。图中显示平均值,误差棒代表平均值的标准误差(sem)。p值表示如下:p<0.05、**p<0.01、***p<0.001、****p<0.0001。
[0353]
数据和软件
[0354]
质谱蛋白质组学数据已经通过pride储存在proteomexchange联盟,(vizcaino,j.a.,et al.(2014).nat biotechnol 32:223
‑
226)的数据集标识符pxd012811用于sirt2相互作用蛋白和pxd012796赖氨酸乙酰化。代谢物组学数据处于提交至代谢物组学工作台的过程中(sud,m.,t al.(2016).nucleic acids res 44:d463
‑
470)。在该研究中产生的rna测序数据集处于提交基因表达omnibus的过程中。
[0355]
结果
[0356]
在til中诱导sirt2表达
[0357]
因为已知sirt2表达响应热量限制而受到刺激(gomes,p.,et al.(2015).trends pharmacol sci 36:756
‑
768;jiang,w.,et al.(2011).mol cell 43:33
‑
44)。在此背景下,将来自参加晚期nsclc(creelan,b等,(2018)journal of thord oncology 13)的nivoluab和til疗法的i期临床试验的11名患者的匹配的til和外周血单核细胞(pbmc)人样品通过流式细胞术分析sirt2表达(图23a)。当与相应的外周t细胞比较时,大多数til显示sirt2表达的显着增加(图16a、16b和23b)。引人注目的是,在对til治疗实现部分反应的3名患者中未观察到sirt2相对于pbmc在cd8
+
til中上调。相反,til治疗失败的6名患者显示til的sirt2水平显著增加。在其余3名患者中临床反应不可评价(图16c和23b)。
[0358]
下一个目标是在小鼠模型中证实这些发现。sirt2表达在分离自皮下b16f10结节的cd8
+
til中相对于脾cd8
+
t细胞有所增加(图16d)。在体外sirt2表达也在刺激来自脾和ln的t细胞以及来自c57bl/6小鼠的富集cd4+t细胞或cd8+t细胞后上升(图16e
‑
16g)。因此,sirt2表达在t细胞激活期间通过tme动态调节。
[0359]
缺乏sirt2的t细胞是高反应性的
[0360]
由于sirt2表达在t细胞中在抗原刺激后诱导,下一个问题是sirt2是否有助于t细胞功能。为了在体外表征sirt2缺陷对t细胞功能的影响,用黑素细胞特异性gp100肽抗原在体外刺激sirt2野生型(wt)与sirt2敲除(sirt2
‑
/
‑
)pmel黑素细胞抗原特异性t细胞受体(tcr)转基因t细胞。这些研究揭示,与wt pmel t细胞相比,sirt2
‑
/
‑
pmel t细胞在抗原攻击后具有增加的增殖和干扰素
‑
γ(ifn
‑
γ)释放(图16h和16i)。此外,细胞内染色显示在gp100刺激后,相比于wt pmel t细胞,粒酶b和ifn
‑
γ在sirt2
‑
/
‑
pmel t细胞中的表达增加(图16j
‑
16l)。sirt2
‑
/
‑
pmel t细胞的这种高反应性表型导致针对b16f10细胞在体外攻击的细胞毒性活性增强(图16m)。更重要的是,当用b16f10细胞在体外再攻击从wt和sirt2
‑
/
‑
小鼠的皮下b16f10结节分离的til时,sirt2
‑
/
‑
til与wt til相比显示出更好的效应器功能,如通过ifn
‑
γ释放和细胞毒活性所测量的(图16n和16o)。
[0361]
sirt2靶向t细胞中的糖酵解和tca途径
[0362]
为了深入了解sirt2
‑
/
‑
t细胞高反应性的分子机制,我们试图鉴定调节t细胞功能的潜在sirt2相互作用配偶体。为此,进行两个独立的免疫沉淀(ip)实验,随后进行液相色谱
‑
串联质谱(lc
‑
ms/ms)分析。
[0363]
首先,为了鉴定sirt2
‑
结合配偶体,对来自激活的wt cd3
+
t细胞蛋白质提取物的sirt2免疫沉淀的蛋白质进行lc
‑
ms/ms分析。该分析揭示596蛋白可能与sirt2相互作用。有趣的是,10种糖酵解酶中有8种(图17a):己糖激酶1(hk1)、磷酸果糖激酶p(pfkp)、醛缩酶a(aldoa)、甘油醛
‑3‑
磷酸脱氢酶(gapdh)、磷酸甘油酸激酶1(pgk1)、烯醇化酶1(eno1)、丙酮酸激酶m(pkm)和乳酸脱氢酶(ldh);和8种tca中的4种循环酶(图17b):顺乌头酸酶2(aco2)、酮戊二酸脱氢酶(ogdh)、琥珀酸
‑
coa连接酶α亚基(suclg1)和琥珀酸脱氢酶α亚基(sdha)被鉴定为sirt2相互作用蛋白。从这些蛋白衍生的选择肽的碰撞诱导解离(cid)谱示于图24,这些相互作用通过共ip/免疫印迹(共ip/ib)(图17c和17d)和反向共ip/ib(图17e和2f)证实。参见图25中的输入(input)。
[0364]
其次,为了鉴定sirt2
‑
/
‑
t细胞中的超乙酰化蛋白质,对来自wt对sirt2
‑
/
‑
cd3
+
t细胞的乙酰
‑
赖氨酸
‑
免疫沉淀的蛋白质进行lc
‑
ms/ms分析。基于乙酰化肽的提取离子色谱图(eic),与wt t细胞相比,在sirt2‑
/
‑
t细胞中鉴定了超过250种超乙酰化蛋白质,包括醛缩酶、gapdh、pgk1、eno1、pkm、来自糖酵解途径的ldh(图26)和来自tca循环的aco2、异柠檬酸脱氢酶、suclg、sdha和苹果酸脱氢酶(图27)。
[0365]
ip/ib和/或反向ip/ib进一步证实了sirt2
‑
/
‑
与wt t细胞相比,pfk、gapdh、aco2、ogdh、sdha和suclg1乙酰化增加,而其总蛋白(输入)未改变(图17g和17h)。总之,这些结果证明关键的糖酵解途径和tca
‑
循环酶是sirt2脱乙酰酶活性的靶标。
[0366]
因此,接下来研究sirt2缺陷t细胞中糖酵解和tca循环酶乙酰化状态的改变是否影响它们的活性。实际上,己糖激酶、pfk、醛缩酶、gapdh、烯醇化酶、aco2、ogdh、sdh和suclg的酶活性在激活的sirt2
‑
/
‑
t细胞中与在wt t细胞中相比都有所升高(图17i和17j),尽管这些酶的总蛋白水平没有明显差异(图28),证实了sirt2对它们活性的翻译后控制。
[0367]
sirt2靶向t细胞中的fao和谷氨酰胺分解
[0368]
β
‑
氧化是分解fa分子以产生能量的代谢途径。重复四个酶促步骤,直到脂酰辅酶a中的所有碳都被分解代谢成乙酰辅酶a,然后进入tca循环。线粒体三官能蛋白(tfp)催化fao的最后三个反应(图18a)。tfp具有两个亚基:羟酰基辅酶a脱氢酶三功能多酶复合物α亚基(hadha)和羟酰基辅酶a脱氢酶三功能多酶复合物亚基β(hadhb)。hadha包含2,3
‑
烯酰
‑
coa水合酶和3
‑
羟酰
‑
coa脱氢酶活性,hadhb介导硫解酶活性。有趣的是,我们的lc
‑
ms/ms分析揭示hadha和hadhb是sirt2相互作用配偶体(图29a),在sirt2
‑
/
‑
t细胞中hadhb过度乙酰化(图29b)。这些相互作用通过共ip/ib证实(图18b)。ip/ib还表明与wt t细胞相比,hadha和hadhb亚基在sirt2
‑
/
‑
t细胞中高度乙酰化(图18c),而它们的总蛋白没有变化(图29c)。
[0369]
谷氨酰胺分解是t
eff
细胞的重要能量来源。谷氨酰胺利用丙氨酸、丝氨酸、半胱氨酸优先的转运蛋白2(asct2)进入细胞,并且它通过谷氨酰胺酶(gls)转化为谷氨酸,并通过谷氨酸脱氢酶(gdh)转化为α
‑
酮戊二酸(α
‑
kg),谷氨酸脱氢酶进入tca循环(图18d)。此外,
lc
‑
ms/ms分析揭示asct2结合sirt2(图29d)和在sirt2
‑
/
‑
t细胞中gls和gdh乙酰化增加(图29e和29f)。因此,sirt2与asct2和gls的相互作用通过共ip/ib得到证实(图18e)。ip/ib也证明了sirt2
‑
/
‑
t细胞中的acs2和gls与wt t细胞相比过度乙酰化,而它们的总蛋白(输入)没有改变(图18f)。为了说明这些酶的乙酰化水平是否影响它们的活性,在激活的wt对比在体外sirt2
‑
/
‑
cd3
+
t细胞中测量谷氨酰胺消耗和谷氨酸产生。事实上,sirt2
‑
/
‑
t细胞显示谷氨酰胺摄取和谷氨酸产生的显著增加(图18f),而在wt和sirt2
‑
/
‑
t细胞之间没有观察到asct2和gls蛋白水平的差异(图29g),证实了它们活性的翻译后控制。
[0370]
总之,sirt2通过靶向这些重要代谢途径的关键酶并使其脱乙酰来调节激活t细胞中的fao和谷氨酰胺裂解。
[0371]
缺乏sirt2的t细胞是高代谢的
[0372]
考虑到sirt2与多种代谢酶相互作用并改变了其乙酰化状态,通过在seahorse analyzer上使用3种不同的分析方法测量糖酵解和线粒体活性来评估sirt2
‑
/
‑
t细胞在激活期间是否显示改变的代谢状态:糖酵解应激试验、糖酵解速率测定和线粒体应激试验。实际上,当与wt对照比较时,sirt2缺陷增加的糖酵解通量通过在激活的sirt2
‑
/
‑
cd3
+
、cd8
+
和pmel cd8
+
t细胞中增加的基础、最大和补偿糖酵解来证明(图19a、19b和30a
‑
30d)。同样,激活的sirt2/
‑
cd3+和cd8+t细胞表现出增加的线粒体活性,这通过基础呼吸、最大呼吸和备用呼吸能力增加得到证明(图19c和s8e)。
[0373]
为了探索sirt2缺陷是否对代谢激发t
me
中的til的代谢状态具有相似的影响,从wt和sirt2‑
/
‑
小鼠的皮下b16f10结节中分离cd3
+
til,并评价它们的代谢概况。值得注意的是,sirt2
‑
/
‑
cd3
+
til与wt相比显示增加的糖酵解通量和oxphos(图19d
‑
19f)。
[0374]
为了研究sirt2
‑
/
‑
t细胞高反应性是否依赖于它们增加的糖酵解速率和oxphos,用糖酵解抑制剂2
‑
脱氧葡萄糖(2
‑
dg)或oxphos抑制剂寡霉素处理sirt2
‑
/
‑
和wt t细胞(图30f)。如所预测的,2
‑
dg处理分别在gp100
‑
抗原刺激和b16f10激发后深度抑制了sirt2
‑
/
‑
pmel t细胞的ifn
‑
γ释放(图30g)和细胞毒性(图30h)。类似地,2
‑
dg处理抑制了由cd3
+
til引起的ifn
‑
γ释放,所述til分离自sirt2
‑
/
‑
与wt小鼠相比的皮下b16f10结节,随后用辐射过的b16f10细胞在体外再激发(图30i)。此外,寡霉素对oxphos的抑制将sirt2
‑
/
‑
pmel t细胞释放的ifn
‑
γ抑制到wt pmel t细胞所显示的水平(图19j)。这些结果与先前的研究一致,先前的研究证明有氧糖酵解和oxphos在t细胞激活期间的关键作用(pearce,e.l.,et al.(2013).science 342:1242454),并且表明高反应性sirt2
‑
/
‑
t细胞与它们的高代谢表型相关。
[0375]
氧磷酸通过丙酮酸,一种糖酵解中间体,乙酰
‑
coa,fao的终产物,或由谷氨酰胺分解产生的α
‑
kg提供燃料。为了确定sirt2
‑
/
‑
t细胞中介导增加的oxphos的主要线粒体燃料,测量经受选择性代谢途径抑制剂的激活t细胞的线粒体活性:uk5099,一种线粒体丙酮酸载体抑制剂,bptes,gls的变构抑制剂,和etoxori,肉碱棕榈酰转移酶1a(cpt1a)的特异性抑制剂,它将长链fa转运到线粒体中(图19g)。在激活的wt cd3
+
t细胞中,所有三种抑制剂(uk5099>bptes>etomoxir)都显着抑制了最大呼吸(响应fccp),表明增殖中的t细胞使用所有三种营养物来为优选丙酮酸的oxphos提供燃料。这与激活的t细胞依赖糖酵解作为主要代谢程序的概念一致(图19h,上图)。令人惊讶的是,sirt2
‑
/
‑
t细胞对抑制剂不敏感(图19h,下图)。实际上,uk5099、bptes和乙氧化嘧啶都不足以破坏sirt2
‑
/
‑
t细胞中的最大呼
吸。这种对代谢抑制剂的抗性与sirt2
‑
/
‑
t细胞中增强的糖酵解、谷氨酰胺分解和fao一致。
[0376]
在代谢攻击的t
me
中,由于葡萄糖和谷氨酰胺与肿瘤细胞的营养竞争,til依赖于脂肪酸分解代谢以部分保留其效应器功能。因此,研究了fa在线粒体呼吸中对分离自b16f10肿瘤结节的wt相对于sirt2
‑
/
‑
til的贡献。有趣的是,etomoxir降低wt til的最大呼吸,而sirt2
‑
/
‑
til保持对etomoxir抑制的抗性(图19i)。
[0377]
最近,长寿命的t
m
细胞已显示合成内源性fa底物以支持fao和oxphos(o'sullivan,d.,et al.(2014).immunity 41:75
‑
88)。因此,研究了sirt2
‑
/
‑
t细胞中增强的fao是依赖于外源fa还是依赖于内源fa。令人惊讶的是,用限制性培养基攻击的sirt2
‑
/
‑
t细胞不能获得用于呼吸的外源fa。相反,与wt t细胞相比,它们表现出内源fa氧化的显着增加(图19j)。尽管t
me
中资源稀少,但利用内源产生的fao底物可以使sirt2
‑
/
‑
t细胞满足能量需求。
[0378]
t
m
细胞依赖于fao来存活。为了评估sirt2
‑
/
‑
t细胞中增强的fao是否影响tm细胞的生存力,通过用鸡卵清蛋白323
‑
339肽(ova
‑
肽)激活ot
‑
ii细胞3天,然后用il
‑
15刺激另外4天,在体外产生记忆t细胞(图19j)。与sirt2缺陷fao增强一致,sirt2‑
/
‑
ot
‑
ii t
m
细胞与wt ot
‑
ii t
m
细胞相比显示出更好的存活(图19k)。
[0379]
sirt2缺陷t细胞的高代谢表型不依赖于c
‑
myc
[0380]
c
‑
myc是t细胞代谢的重要驱动因子(wang等,2011)。为了研究sirt2
‑
/
‑
t细胞的高代谢表型是否由c
‑
myc介导,我们对初始的和激活的wt对sirt2
‑
/
‑
cd4
+
t细胞进行了rna测序分析。本研究揭示了超过800个显着的差异表达的基因(图31a)。与sirt2
‑
/
‑
t细胞的高反应性表型一致,使用基因集富集分析(gsea)平台的途径富集分析揭示sirt2
‑
/
‑
t细胞中与t细胞效应器功能和增殖相关的途径上调,inf
‑
γ应答和il
‑
2信号传导最显著(图31b)。然而,基因表达谱没有显示wt和sirt2
‑
/
‑
t细胞之间c
‑
myc依赖性总体代谢转录组的任何显着增加(图31c)。此外,在wt和sirt2
‑
/
‑
t细胞之间没有观察到c
‑
myc蛋白表达水平的显着差异(图31d)。
[0381]
sirt2是t细胞代谢的主要组织因子
[0382]
为了进一步确证用细胞外流量分析观察到的sirt2
‑
/
‑
t细胞的超代谢表型,进行了激活的wt对sirt2
‑
/
‑
cd8
+
t细胞的细胞内代谢物水平的非靶向代谢组学lc/ms分析(图20a和20b)。使用metabodalyst工具对差异表达的代谢物进行的代谢物组富集分析(msea)表明sirt2
‑
/
‑
t细胞中多种代谢途径的上调,最显著的是warburg效应,fa和谷氨酰胺代谢与现有的细胞外通量和分子数据一致(图20c)。
[0383]
实际上,代谢组学分析表明sirt2
‑
/
‑
t细胞中葡萄糖的显著下降和葡萄糖
‑6‑
磷酸盐水平的增加(图20b),这与糖酵解的葡萄糖分解代谢增加一致,而原初和激活t细胞中葡萄糖摄取和葡萄糖转运蛋白(glut1)表达不受sirt2缺陷的影响(图20d)。同时,sirt2
‑
/
‑
t细胞显示早期糖酵解中间体水平增加,这似乎促进丝氨酸的产生。sirt2
‑
/
‑
t细胞还显示细胞外乳酸水平增加,证实丙酮酸优先转化为乳酸。
[0384]
尽管丙酮酸向乳酸的转化增加,sirt2
‑
/
‑
t细胞显示晚期tca循环中间物的水平增加,这与sirt2
‑
/
‑
t细胞中谷氨酰胺解作用增加和fao促进tca循环一致。事实上,sirt2
‑
/
‑
t细胞显示酰基
‑
肉碱、谷氨酸和谷氨酰胺的水平增加(图20a和5b)。在sirt2
‑
/
‑
t细胞中没有观察到减少的代谢物的清楚模式,除了半胱氨酸水平的减少,这可以反映其响应于增加的增
殖用于核酸代谢。
[0385]
接下来,在激活的wt对sirt2
‑
/
‑
cd8
+
t细胞中进行fao中间体的靶向lc
‑
ms/ms分析,以证实sirt2缺陷对fa代谢的影响。如所预测的,sirt2
‑
/
‑
t细胞显示较高水平的酰基肉碱(c14
‑
c4),同时增加了fao的终产物乙酰coa,这与sirt2
‑
/
‑
t细胞中增强的fa分解代谢一致(图20e)。
[0386]
cpt1a是fao途径的限速因子,其催化酰基肉碱的形成并将它们转运到线粒体中。sirt2
‑
/
‑
t细胞中总酰基
‑
肉碱水平(图20e,饼图)和线粒体对依托莫韦(cpt1a抑制剂)的抗性的增加表明cpt1a表达水平的增加。实际上,在sirt2
‑
/
‑
t细胞中cpt1a的mrna和蛋白质表达水平均被上调(图20f和20g)。因此,除了sirt2与tfp相互作用外,激活sirt2
‑
/
‑
t中的cpt1a上调可支持fao速率增加。
[0387]
最后,sirt2
‑
/
‑
t细胞显示更高的atp/adp比率,反映了它们更高的能量状态(图20h)。
[0388]
总之,sirt2似乎是激活t细胞中关键代谢途径的主要调节物,sirt2缺陷显着改变t细胞代谢。
[0389]
sirt2缺乏在体内延缓肿瘤进展
[0390]
由于在体外sirt2缺陷赋予t细胞优良的代谢适应性和增强的效应器功能,进行了sirt2缺陷对抗肿瘤免疫应答的体内作用的研究。用b16f10黑素瘤细胞静脉内或皮下接种wt和sirt2
‑
/
‑
小鼠。静脉内移植b16f10黑素瘤细胞的sirt2
‑
/
‑
受体小鼠与wt受体小鼠相比具有显著减少的肺转移数目(图21a,图32a)。sirt2
‑
/
‑
小鼠与wt小鼠相比,皮下移植的b16f10肿瘤的生长也有显着的延迟(图21b,图32b)。
[0391]
从wt和sirt2
‑
/
‑
小鼠皮下b16f10结节分离的til的表型特征显示sirt2
‑
/
‑
til与wt til相比,具有cd8
+
效应记忆t细胞(tem)水平增加(图21c和33)和pd
‑
1(程序性细胞死亡
‑
1受体)表达水平增加(图21d)。类似地,静脉内肿瘤攻击后sirt2
‑
/
‑
小鼠次级淋巴器官中t
eff
、t
em
和inkt细胞显着增加,而在未攻击的wt和sirt2
‑
/
‑
对照小鼠之间未观察到定性或定量的表型差异(图34,35)。有趣的是,静脉注射b16f10肿瘤攻击后,sirt2
‑
/
‑
小鼠中观察到cd27
‑
teff和tem显著增加(图36)。cd27在大多数t细胞中组成型表达。值得注意的是,报道了cd27敲除小鼠中肿瘤生长的减少,并使用抗cd27 mab靶向cd27增强了cd8
+
t细胞应答和抗肿瘤活性(wasiuk,a.,et al.(2017).j immunol 199:4110
‑
4123)。
[0392]
因为主要在t细胞亚群(抗肿瘤的主要效应物)中观察到免疫表型变化,下一个目标是证实sirt2
‑
/
‑
小鼠中抗肿瘤活性的增强是否依赖于t细胞。cd8
+
或cd4
+
t细胞的消耗废除了sirt2
‑
/
‑
小鼠中的优异肿瘤控制,表明sirt2缺陷的保护作用依赖于两种t细胞亚群(图21e,图37a)。值得注意的是,相对于wt pmel cd8
+
t细胞的过继移植,sirt2
‑
/
‑
pmel cd8
+
t细胞过继移植到免疫缺陷nod scidγ(nsg)小鼠中,显著减少静脉注射b16f10肿瘤攻击后的肺转移(图6f,图37b)。在人体实施方案中,为了模拟过继细胞疗法(act)之前的淋巴细胞耗竭性化疗治疗,使用nsg小鼠模型(dudley,m.e.,et al.(2013).j clin oncol 31:2152
‑
2159)。因此,sirt2缺乏在act模型中赋予t细胞优良的抗肿瘤表型。
[0393]
pd
‑
1/pd
‑
l1(程序性细胞死亡配体
‑
1)阻断代表了迄今为止最有效的癌症免疫疗法,并形成了大多数联合免疫疗法策略的主干。wt和sirt2
‑
/
‑
小鼠用b16f10细胞静脉内攻击,然后用抗pd
‑
1mab处理,而不是用同种型对照mab处理,以确定sirt2缺乏是否增强pd
‑
1/
pd
‑
l1阻断的效力。值得注意的是,这些研究揭示了sirt2
‑
/
‑
受体小鼠中优异的抗pd
‑
1治疗反应(图21g)。因此,sirt2缺陷也增强了抗pd
‑
1免疫检查点治疗。
[0394]
sirt2是增加人t细胞抗肿瘤活性的可操作靶点
[0395]
为了将这些发现扩展到小鼠模型之外,使用2种不同的sirt2抑制剂在人t细胞中检测sirt2抑制的作用:agk2和thiomyristoyl tm(jing,h.,et al.(2016).cancer cell29:767
‑
768;newton,k.,et al.(2014).nature 506:e4
‑
6)。与鼠研究一致,人cd3
+
t细胞(从健康供体的pbmc获得)的agk2和tm处理提高了有氧糖酵解、氧磷和ifn
‑
γ的产生(图37)。通过监测乙酰化α
‑
微管蛋白水平(图37e和37j),一种已知的sirt2底物(north,b.j.,et al.(2003).mol cell 11:437
‑
444),来验证sirt2抑制剂。为了评估sirt2阻断的翻译潜能,研究了agk2对分离自nsclc患者肿瘤样品的人til的作用。明显地,来自5名用agk2治疗的nsclc患者的til显示需氧糖酵解、oxphos和inf
‑
γ产生的提高(图22)。
[0396]
讨论
[0397]
尽管靶向免疫检查点的癌症免疫疗法已重新定义了癌症治疗,但若干癌症仍然具有抗性,并且迫切需要新的策略(gide,t.n.,et al.(2018).clin cancer res 24:1260
‑
1270;pardoll,d.m.(2012).nature reviews 12:252
‑
264;wei,s.c.,et al.(2018)。一种增加抗肿瘤免疫应答的有吸引力的策略来自新兴的免疫代谢领域(chang,c.h.,et al.(2015).cell 162:1229
‑
1241;shevchenko,i.,and bazhin,a.v.(2018).frontiers in immunology 9:1816)。尽管越来越多的共识是免疫细胞的代谢状态驱动它们的关键功能和成熟,但是实施代谢变化的可行动的靶标是难以捉摸的。nad
+
依赖性组蛋白脱乙酰酶sirt2由于其双重肿瘤抑制和致癌作用的冲突报道而长期以来一直是争论的主题(jing,h.,et al.(2016).cancer cell 29:767
‑
768;mcglynn,l.m.,et al.(2014).eur j cancer 50:290
‑
301)。在此我们发现sirt2是易于治疗靶向的代谢免疫检查点。引人注目的是,我们的结果揭示sirt2是t细胞代谢的主要调节剂。其广泛参与调节对t细胞效应器功能至关重要的多种代谢途径,这可以通过sirt2
‑
/
‑
t细胞的高代谢表型得到证明。
[0398]
从机理上讲,t细胞代谢的sirt2调节不依赖于c
‑
myc,c
‑
myc是通过不同代谢基因的转录控制的t细胞代谢的全局调节剂(wang,r.,et al.(2011).immunity 35:871
‑
882)。相反,sirt2直接影响糖酵解、tca
‑
循环、fao和谷氨酰胺分解的关键代谢酶的乙酰化状态和活性。虽然先前在免疫系统中尚未描述过糖酵解酶的sirt2调节,但先前在诱导的人多能干细胞中的研究也证实了sirt2与我们的研究中的糖酵解酶之间的相互作用(cha,y.,et al.(2017).nat cell biol 19:445
‑
456)and hela cells(park,s.h.,et al.(2016).cancer res76:3802
‑
3812)。有趣的是,sirt2与tca循环、fao和谷氨酰胺裂解酶的相互作用以前没有报道。
[0399]
在鉴定为sirt2脱乙酰酶靶标的糖酵解靶标中,gapdh和eno1直接涉及t细胞功能(balmer,m.l.,et al.(2016).immunity 44:1312
‑
1324;chang,c.h.,et al.(2013).cell 153:1239
‑
1251;gemta,l.f.,et al.(2019).science immunology 4)。已知gapdh直接结合ifn
‑
γmrna并阻断其翻译(chang,c.h.,et al.(2013).cell 153:1239
‑
1251)。有趣的是,最近的研究表明gapdh乙酰化增加了其酶活性并降低了其与ifn
‑
γmrna的结合,这增强了糖酵解通量和ifn
‑
γ产生(balmer,m.l.,et al.(2016).immunity 44:1312
‑
1324),这与sirt2缺陷的作用一致。值得注意的是,先前的研究证实了eno1活性在人和鼠黑素瘤til中
的下调导致代谢受损的til,其效应器功能受到抑制,而mrna和蛋白质表达水平没有伴随的变化。尽管没有确定准确的机制,作者推断eno1的酶活性可能在til中被翻译后调节(gemta,l.f.,et al.(2019).science immunology 4)。因为sirt2在til中被深度上调,所以eno1在til中的缺陷活性可归因于sirt2脱乙酰酶活性。
[0400]
til通常经受葡萄糖匮乏和低氧,同时与tme内的癌细胞竞争可利用的营养物(chang,c.h.,et al.(2015).cell 162:1229
‑
1241;ho,p.c.,et al.(2014).cancer res 74:3205
‑
3217;ying,h.,et al.(2012).cell 149:656
‑
670)。尽管sirt2上调til的精确机制仍然是难以捉摸的,sirt2可能由热量限制诱导(gomes,p.,et al.(2015).trends pharmacol sci 36:756
‑
768;jiang,w.,et al.(2011).mol cell 43:33
‑
44)。引人注目的是,在nsclc的i期临床试验中,til中sirt2的上调与对免疫疗法的不良临床反应有关。sirt2因此可以作为代谢免疫检查点起作用,其促进t细胞中阻抑的代谢表型以适应代谢受限的tme。
[0401]
由于其超代谢表型,sirt2
‑
/
‑
t细胞显示增加的增殖和效应器功能,因此在体内有效排斥可移植肿瘤。与这些发现一致,sirt2
‑
/
‑
t细胞的基因表达谱揭示t细胞效应器功能和增殖,最主要是inf
‑
γ应答和il
‑
2信号传导中涉及的关键途径的上调。值得注意的是,肿瘤攻击后sirt2
‑
/
‑
til中tem细胞以及sirt2
‑
/
‑
小鼠外周淋巴器官的增加与sirt2
‑
/
‑
小鼠中观察到的优异抗肿瘤免疫一致。tem细胞在肿瘤特异性免疫应答中发挥重要作用(mami
‑
chouaib,f.,et al.(2018).j immunother cancer 6:87),并且它们在肿瘤中的高频率与癌症患者中的有利预后相关(pages,f.,et al.(2005).the new england journal of medicine 353:2654
‑
2666)。此外,在sirt2
‑
/
‑
til中pd
‑
1表达增加,并且其阻断进一步增强了sirt2缺陷针对肿瘤攻击的保护作用。pd
‑
1,主要的抑制性免疫检查点,自相矛盾地是黑素瘤中激活的肿瘤反应性cd8
+
t细胞的标志,并且具有pd
‑
1阻断的肿瘤消退需要预先存在的pd
‑1+
cd8
+
t细胞(tumeh,p.c.,et al.(2014).nature 515:568
‑
571)。总之,提出sirt2
‑
/
‑
t细胞的超代谢表型至少部分地负责tme中针对肿瘤攻击的优异效应器功能。
[0402]
sirt2
‑
/
‑
t细胞中增强的糖酵解允许在富含葡萄糖的环境中的最佳效应器功能。有趣的是,观察到激活的sirt2
‑
/
‑
t细胞中丝氨酸代谢增加,这可能反映糖酵解通量增加,因为丝氨酸是从糖酵解中间体3
‑
磷酸甘油酸新合成的(ma et al.,2017)。丝氨酸通过为核苷酸的从头合成提供甘氨酸而在增殖t细胞中起重要作用。
[0403]
然而,癌细胞的过量糖酵解活性通常耗尽tme内的葡萄糖,因此损害cd8
+
til功能(chang,c.h.,et al.(2015).cell 162:1229
‑
1241;ying,h.,et al.(2012).cell 149:656
‑
670)。在这种情况下,til需要替代燃料源以通过氧膦满足其代谢需求。在该研究中,sirt2不仅对糖酵解起作用,而且对其它关键代谢途径起作用,特别是谷氨酰胺分解和fao。因此,sirt2
‑
/
‑
til的优良效应器功能可能是谷氨酰胺分解和fa分解代谢增强的结果,因此通过oxphos赋予对tme内营养限制的抗性。尽管tme中存在相对缺氧,肿瘤中氧含量的异质性允许til使用oxphos来保持其效应器功能(zhang,y.,et al.(2017).cancer cell 32:77
‑
391e379)。
[0404]
更具体地说,谷氨酰胺对于t效应器功能是关键的,并在葡萄糖限制条件下支持它们的代谢(carr,e.l.,et al.(2010).j immunol 185:1037
‑
1044;cluntun,a.a.,et al.(2017).trends cancer 3:169
‑
180;johnson,m.o.,et al.(2018).cell 175:1780
‑
1795e1719)。然而,在进展时,癌细胞变得对谷氨酰胺极其依赖,因此除了葡萄糖匮乏,t细胞在tme中受到谷氨酰胺竞争,限制了它们的抗肿瘤功能(cluntun,a.a.,et al.(2017).trends cancer 3:169
‑
180)。因此,sirt2
‑
/
‑
t细胞中谷氨酰胺摄取和谷氨酰胺裂解的增加可赋予tme中对谷氨酰胺减少的抗性。
[0405]
值得注意的是,已经表明cd8
+
til在低血糖tme中关键依赖于fao,促进fa分解代谢改善了cd8+til效应器功能(zhang,y.,et al.(2017).cancer cell 32:77
‑
391e379)。有趣的是,大多数til采用t
m
表型,其使用fao持续并介导保护性免疫(van der windt,g.j.,et al.(2013).proc natl acad sci u s a 110:14336
‑
14341)。因此,fao增强的sirt2
‑
/
‑
tm细胞存活的提高可能有助于在sirt2
‑
/
‑
小鼠中观察到的优异抗肿瘤免疫。有趣的是,sirt2
‑
/
‑
t细胞在激活期间显示增加的内源fao,因此采用了主要依赖于fa内源来源的tm细胞的代谢表型(o'sullivan,d.,et al.(2014).immunity 41:75
‑
88)。尽管这种独特表型的机制还不是很清楚,t
m
细胞利用立即可用的内源fa可能与其快速回忆应答的能力以及其在tme中的存活相关,其中外源fa可能不容易获得。
[0406]
除了有助于能量产生之外,增强的fa分解代谢sirt2
‑
/
‑
t细胞还可以通过提供乙酰辅酶a用于乙酰化关键糖酵解酶和tca循环酶而与其它代谢途径相互作用并增加其,从而增强它们的活性(balmer,m.l.,et al.(2016).immunity 44:1312
‑
1324)(balmer et al.,2016)。
[0407]
几种代谢调节物、转录因子、酶和代谢物,如c
‑
myc、hif
‑
1α、lkb1/stk11、gapdh、eno1和磷酸烯醇丙酮酸,被描述为免疫稳态和抗肿瘤免疫中的关键代谢关卡((chang,c.h.,et al.(2013).cell 153:1239
‑
1251;doedens,a.l.,et al.(2013).nature immunology14:1173
‑
1182;gemta,l.f.,et al.(2019).science immunology 4;he,n.,et al.(2017).proc natl acad sci u s a 114:12542
‑
12547;ho,p.c.,et al.(2015).cell 162:1217
‑
1228;wang,r.,et al.(2011).immunity 35:871
‑
882)。因此,操纵这些代谢调节剂以增强t细胞代谢是改善免疫疗法的有吸引力的策略。然而,由于在产生选择性药物中的障碍或不期望的毒性,已经证明靶向这些代谢检查点是困难的。在这方面,使用选择性抑制剂的sirt2阻断提供了操纵t细胞代谢和增强癌症免疫治疗的独特机会。
[0408]
值得注意的是,sirt2阻断代谢再编til似乎是与pd
‑
1阻断协同的有效策略。因此,sirt2与pd
‑
1阻断剂组合的药理学抑制可能是有效的组合免疫治疗策略。然而,sirt2抑制剂可能具有促进肿瘤代谢的非预期结果。有趣的是,与原代细胞相反,在c
‑
myc依赖性肿瘤中,sirt2抑制已显示具有通过降解c
‑
myc的抗肿瘤活性(jing,h.,et al.(2016).cancer cell 29:767
‑
768;mcglynn,l.m.,et al.(2014).eur j cancer 50:290
‑
301)。由于c
‑
myc是肿瘤代谢的正调节物,通过sirt2抑制促进肿瘤代谢可通过仔细的患者选择来避免。
[0409]
或者,可通过til扩增或嵌合抗原受体(car)t细胞在体外产生期间的基因编辑来实现对sirt2的操纵,从而选择性靶向t细胞(lim,w.a.,and june,c.h.(2017).cell168:724
‑
740;rosenberg,s.a.,and restifo,n.p.(2015).science 348:62
‑
68)。在til中sirt2水平升高的nsclc患者中观察到的对til治疗的不良临床反应强调了sirt2阻断可以通过改善til或car t细胞的代谢适应性来增加它们的效力和持久性。
[0410]
总之,sirt2抑制通过促进代谢重编程为在鼠和人t细胞中具有增强的有氧糖酵解、谷氨酰胺分解和fao能力的深度超代谢状态而增强肿瘤特异性t细胞应答,因此揭示
sirt2作为代谢免疫检查点的惊人作用。重要的是,sirt2是通过药理学或遗传策略的可行靶标,指向易处理的方法以改善广谱癌症免疫疗法。
[0411]
除非另有定义,本文所用的所有技术和科学术语具有与所公开的发明所属领域的技术人员通常理解的相同的含义。本文引用的出版物和它们所引用的材料具体引入作为参考。
[0412]
本领域技术人员将认识到或能够使用不超过常规实验确定本文所述的本发明的具体实施方式的许多等同方案。这些等同物旨在被包括在所附权利要求中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1