Ras抑制肽的制作方法
ras抑制肽
交叉引用
1.本技术要求基于在日本于2019年5月14日提出申请的日本特愿2019
‑
091419号的优先权,该申请记载的内容全部通过参照直接援引于本说明书中。此外,本技术引用的全部专利、专利申请和文献记载的内容全部通过参照直接援引于本说明书中。
技术领域
2.本发明涉及抑制ras活性的肽等,详细而言,本发明涉及具有特定氨基酸序列和环状结构的环状肽等。
背景技术:
3.ras蛋白(是指ras亚家族,以下简称为ras)是在细胞内表达的gtpase(gtp酶),通过与gdp或gtp结合,作为掌控细胞增殖信号转导的关(去活化)/开(活化)的分子开关发挥功能。gdp结合型是关的状态,gtp结合型是开的状态。通过来自细胞表面受体的信号而诱导产生的鸟嘌呤核苷酸交换因子(gef)将ras从gdp结合型转化为gtp结合型,gtp结合型ras与下游的蛋白即raf、pi3k等相互作用,由此进一步转导信号。与ras结合的gtp借助ras本身的酶活性和gtpase活化蛋白(gap),从gtp水解为gdp。
4.ras包含188~189个氨基酸序列,通过任意的氨基酸突变,显著抑制本身的gtpase活性和基于gap的gtp的水解能力,偏重于gtp结合型。其结果,延长细胞增殖信号。
5.人肿瘤的约30%表达发生氨基酸突变的突变型ras,成为肿瘤增殖的驱动力(非专利文献1)。ras中,作为创新药靶点而受到关注的成员中,可举出k
‑
ras、n
‑
ras、h
‑
ras。其中,已知k
‑
ras的氨基酸突变以人肿瘤的约20%这一最高频率发生(非专利文献1)。
6.报告k
‑
ras中的氨基酸突变的位置的大部分为12位甘氨酸,继而为13位甘氨酸、61位谷氨酰胺、以及其它位置。在12位甘氨酸的突变的内容中观察到最高频率的是天冬氨酸(约30%),继而为缬氨酸(约20%)、半胱氨酸(约10%)、丙氨酸(约5%)、丝氨酸(约5%)、精氨酸(约3%)、以及其它氨基酸(非专利文献2)。
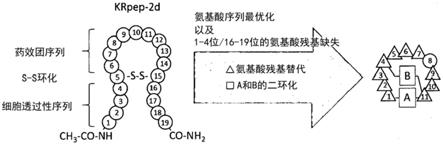
7.据此可知,12位甘氨酸突变为天冬氨酸的k
‑
ras即k
‑
ras(g12d)是癌治疗中的最重要的创新药靶点。2017年,本发明人报告了,在无细胞试验中发现:与野生型k
‑
ras相比,与k
‑
ras(g12d)选择性结合,抑制将gdp结合型k
‑
ras(g12d)转化为gtp结合型k
‑
ras(g12d)的环状肽krpep
‑
2d:ac
‑
arg
‑
arg
‑
arg
‑
arg
‑
c(cys
‑
pro
‑
leu
‑
tyr
‑
ile
‑
ser
‑
tyr
‑
asp
‑
pro
‑
val
‑
cys)
‑
arg
‑
arg
‑
arg
‑
arg
‑
nh2(seq id no:22)(非专利文献3)。显示krpep
‑
2d在细胞试验中显著且选择性抑制表达k
‑
ras(g12d)的a427细胞的增殖。此外,本发明人分析krpep
‑
2d与k
‑
ras(g12d)的复合体的晶体结构,报告了其结合的机制(非专利文献4)。现有技术文献非专利文献
8.非专利文献1:takashima a and faller dv.expert opin ther targets.2013,17(5):507
‑
531.
非专利文献2:pender a,garcia
‑
murillas i,rana s,cutts rj,kelly g,fenwick k,kozarewa i,gonzalez de castro d,bhosle j,o’brien m,turner nc,popat s,and downward j.plos one.2015,10(9):e0139074.非专利文献3:sakamoto k,kamada y,sameshima t,yaguchi m,niid,sasaki s,miwa m,ohkubo s,sakamoto ji,kamaura m,cho n,and tani a.biochem biophys res commun.2017,484(3):605
‑
611.非专利文献4:sogabe s,kamada y,miwa m,niid,sameshima t,kamaura m,yonemori k,sasaki s,sakamoto ji,and sakamoto k.acs med chem lett.2017,8(7):732
‑
736.非专利文献5:niida a,sasaki s,yonemori k,sameshima t,yaguchi m,asami t,sakamoto k,and kamaura m.bioorg med chem lett.2017,27(12):2757
‑
2761.非专利文献6:fairlie dp and dantas de araujo.biopolymers 2016,106(6):843
‑
852.非专利文献7:lau yh,de andrade p,wu y,and spring dr.chem soc rev.2015,44(1)91
‑
102.
技术实现要素:
发明要解决的课题
9.根据本发明人的分析,在使用krpep
‑
2d作为医药品、诊断药和/或研究试剂时,存在以下所示的若干课题。(1)仅由天然氨基酸构成的krpep
‑
2d有可能对蛋白酶分解的耐性低。(2)通过序列包含的二个半胱氨酸(cys)的侧链间的二硫键而环状化,因此在细胞内的还原性条件下二硫键裂解,无法维持肽的环状结构,对ras的结合活性和抑制活性有可能减弱。实际上,本发明人发现,在包含二硫苏糖醇(dtt)的还原性条件下的无细胞试验中,krpep
‑
2d对从k
‑
ras(g12d)的gdp结合型向gtp结合型的交换反应的抑制活性与非还原性条件下的抑制活性相比,减弱50倍以上(非专利文献3和非专利文献5)。(3)krpep
‑
2d的细胞试验中的显著的增殖抑制活性为数~数十μm(非专利文献3和非专利文献5),作为医药品、诊断药和/或研究试剂使用时,存在改善的余地。
10.本发明鉴于所述课题而完成的,其目的在于,提供能够改善至少1个上述课题的新型ras抑制肽,其中,使用ras抑制肽作为医药品、诊断药和/或研究试剂。用于解决问题的手段
11.在实施krpep
‑
2d的最优化研究的过程中,本发明人发现新型ras抑制肽组。为了解决krpep
‑
2d的课题,基于非专利文献4记载的krpep
‑
2d与k
‑
ras(g12d)的复合体的结构信息,预想了提高krpep
‑
2d的ras结合活性、蛋白酶分解耐性、细胞增殖抑制活性这类功能的氨基酸替代。krpep
‑
2d具有以下特征,(1)通过5位cys与15位cys的侧链间的二硫键而环状化;(2)从6位至14位的氨基酸作为药效团,主要与k
‑
ras(g12d)发生相互作用;(3)从1位至4位以及从16位至19位的氨基酸主要有助于肽的细胞内迁移性,但如果缺失则对ras的结合活性和抑制活性大幅减弱(非专利文献4和非专利文献5),因此也有助于肽的立体结构控制。因此,尝试了以下分子结构的设计:(1)以在细胞内的还原性条件下也能够维持ras结合活性的方式,替代为在还原性条件下也不容易裂解5位cys与15位cys的侧链间的二硫键的
结合形态;(2)为了增强与ras的相互作用,从6位至14位导入非天然氨基酸结构;(3)为了减少分子量使从1位至4位以及从16位至19位的氨基酸缺失,也具有ras结合活性。在实施上述krpep
‑
2d的最优化研究的过程中,发现具有ras结合活性、蛋白酶分解耐性、以及细胞增殖抑制活性的新型ras抑制肽的序列组,从而完成本发明。
12.即,本发明的一个方式是包含下述式(1)表示的氨基酸序列的环状肽或其药理学可接受的盐:c[x1‑
x2‑
x3‑
c(x4‑
x5‑
x6‑
x7‑
x8‑
x9‑
x
10
‑
x
11
)]
ꢀꢀꢀ
(1)在此,上述式(1)中,x1、x4和x
11
各自独立地表示具有氨基、羧基、硫醇基、烯丙基、炔基、叠氮基或卤素原子的氨基酸残基、或它们的衍生物。x3、x5和x7各自独立地是包含可以具有取代基的烃基的氨基酸残基、包含可以具有取代基的芳族碳环基的氨基酸残基、包含可以具有取代基的芳族杂环基的氨基酸残基、或它们的衍生物。x8是天冬氨酸残基、或其衍生物,x2、x6、x9、x
10
是任意的氨基酸残基。
[0013]
此外,x1与x
11
以及x4与x
11
在各自之间独立地形成直接的共价键或介由连接基团的间接的共价键,由此式(1)的肽在分子内具有2个环状结构。x1与x
11
之间的共价键可以是它们的主链
‑
主链间、主链
‑
侧链间、侧链
‑
主链间或侧链
‑
侧链间中的任一键,此外,x4与x
11
之间的共价键可以是它们的侧链
‑
主链间或侧链
‑
侧链间中的任一键。
[0014]
上述式(1)的肽中的从x1至x
11
的各氨基酸残基的优选的方式在以下的实施方式中详细说明,各自优选的实施方式可相互独立地任意组合。发明效果
[0015]
根据本发明,提供一种新型环状肽,其中,使用ras抑制肽作为医药品、诊断药和/或研究试剂是有用的。
附图说明
[0016]
图1表示与krpep
‑
2d的ras结合活性(药效团)、环状结构限制(s
‑
s键)、细胞内迁移性(cell penetrating peptide:cpp)的功能相关的氨基酸序列。此外,表示对krpep
‑
2d进行修饰得到的本发明肽的结构的概要。图2表示供于krpep
‑
2d的各氨基酸位置处的氨基酸残基的替代研究的氨基酸的示例。图3表示为了对替代氨基酸残基而得到的肽对k
‑
ras(g12d)的结合活性与krpep
‑
2d进行比较而使用的基于elisa法的竞争结合试验的概要。图中,sa表示链霉亲和素,b表示生物素,hrp表示辣根过氧化物酶。图4表示n末端生物素修饰krpep
‑
2d(生物素
‑
krpep
‑
2d)对k
‑
ras(g12d)的肽浓度依赖性结合活性。图5表示本发明肽的代表例的生物素修饰物对野生型k
‑
ras、k
‑
ras(g12d)、k
‑
ras(g12v)、k
‑
ras(g12c)、k
‑
ras(g13d)、野生型n
‑
ras、n
‑
ras(q61k)、野生型h
‑
ras、h
‑
ras(g12v)和h
‑
ras(q61l)的肽浓度依赖性结合活性。图6表示将krpep
‑
2d和本发明肽的代表例与大鼠血浆混合,比较对蛋白酶分解的耐性的结果。图7a表示通过atp的定量来评价krpep
‑
2d和本发明肽的代表例对表达k
‑
ras
(g12d)的a427细胞的增殖抑制活性的结果。图7b表示通过atp的定量来评价序列17的肽对表达k
‑
ras(g12d)的panc
‑
1细胞的增殖抑制活性的结果。图8表示对皮下荷瘤小鼠进行尾静脉给药来评价本发明肽的代表例的抗癌活性的结果。图9表示对原位移植模型小鼠进行尾静脉给药来评价本发明肽的代表例的抗癌活性的结果。图10表示实施例使用的本发明肽的代表例的结构式。
具体实施方式
[0017]
接着,参照附图对本发明的优选的实施方式进行说明。应予说明,以下说明的实施方式不限定权利要求书涉及的发明,此外,实施方式中说明的各要素及其组合未必全部是本发明的解决手段必要的。此外,本说明书中引用的全部专利文献和非专利文献的公开内容以整体作为参照援引入本说明书中。
[0018]
(定义)本说明书中肽是指2个以上的氨基酸通过酰胺键(肽键)键合而得到的物质,例如可以是2~20氨基酸进行酰胺键合而得到的物质。此外,按照肽标记的惯例,左端为n末端(氨基末端),右端为c末端(羧基末端)。与形成肽键的羰基相邻的第1个碳原子称为cα碳。
[0019]
本说明书中“任意的氨基酸或其衍生物”以其最广义的含义使用,除天然氨基酸以外,还包括具有非天然结构的人工氨基酸、具有氨基酸的特征即本领域公知特性的化学合成的化合物、以及具有官能团的羧酸。作为非天然氨基酸的示例,可举出d型氨基酸、主链的结构与天然型不同的α/α
‑
二取代氨基酸(2
‑
氨基异丁酸这类α
‑
甲基化氨基酸等)、n
‑
烷基
‑
氨基酸(n
‑
甲基化氨基酸等)、n
‑
取代甘氨酸(拟肽(peptoid))、主链延长的氨基酸(β高氨基酸、γ高氨基酸)、侧链的结构与天然型不同的氨基酸(环己基丙氨酸、烯丙基甘氨酸、2
‑
(2
‑
吡啶基)
‑
甘氨酸、3
‑
(1h
‑
苯并咪唑
‑2‑
基)
‑
丙氨酸等)、侧链的一部分被取代的氨基酸(正亮氨酸、二氨基丙酸、3
‑
(2
‑
吡啶基)
‑
丙氨酸等)、侧链具有多余官能团的氨基酸;侧链具有多余c、烷基、甲基的氨基酸(高正亮氨酸(homonorleucine)、γ
‑
甲基亮氨酸等)、侧链具有卤素原子(f、cl、br、i)的氨基酸(3
‑
氯
‑
丙氨酸等)、侧链具有卤素原子(f、cl、br、i)的羧酸(3
‑
氯丙酸等)、侧链具有官能团的羧酸(3
‑
丁烯酸等)、侧链具有多余n、氨基的氨基酸(β
‑
叠氮基丙氨酸、鸟氨酸等)、侧链具有多余o、甲氧基的氨基酸(o
‑
甲基
‑
丝氨酸、o
‑
甲基
‑
苏氨酸等)、侧链具有多余羟基的氨基酸(3
‑
羟基
‑
苯丙氨酸等)、侧链具有多余羧基(
‑
cooh)的氨基酸(3
‑
羧基
‑
苯丙氨酸等)、侧链具有多余s的氨基酸(乙硫氨酸等)、侧链中的羧酸官能团被酯保护的氨基酸(天冬氨酸
‑4‑
甲基酯等)、侧链的硫基(
‑
s
‑
)被氧化而转化为亚磺酰基(
‑
s(=o)
‑
)、磺酰基(
‑
s(=o)2‑
)的氨基酸(甲硫氨酸亚砜)等,但不限于此。
[0020]
本说明书中,可以具有取代基的烃基是指,例如甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、异戊基、新戊基、1
‑
乙基丙基、己基、异己基、1,1
‑
二甲基丁基、2,2
‑
二甲基丁基、3,3
‑
二甲基丁基、2
‑
乙基丁基等c1‑
10
烷基、乙烯基、1
‑
丙烯基、2
‑
丙烯基、2
‑
甲基
‑1‑
丙烯基、1
‑
丁烯基、2
‑
丁烯基、3
‑
丁烯基、3
‑
甲基
‑2‑
丁烯基、1
‑
戊烯基、2
‑
戊烯基、3
‑
戊烯基、4
‑
戊烯基、4
‑
甲基
‑3‑
戊烯基、1
‑
己烯基、3
‑
己烯基、5
‑
己烯基等c2‑
10
烯基、乙炔
基、1
‑
丙炔基、2
‑
丙炔基、1
‑
丁炔基、2
‑
丁炔基、3
‑
丁炔基、1
‑
戊炔基、2
‑
戊炔基、3
‑
戊炔基、4
‑
戊炔基、1
‑
己炔基、2
‑
己炔基、3
‑
己炔基、4
‑
己炔基、5
‑
己炔基、4
‑
甲基
‑2‑
戊炔基等c2‑
10
炔基、环丙基、环丁基、环戊基、环己基、环庚基、环辛基、双环[2.2.1]庚基、双环[2.2.2]辛基、双环[3.2.1]辛基、金刚烷基等c3‑
10
环烷基、环丙烯基、环丁烯基、环戊烯基、环己烯基、环庚烯基、环辛烯基等c3‑
10
环烯基,可以具有取代基的芳族碳环基是指,例如苯基、萘基等,可以具有取代基的芳族杂环基是指,例如吡啶基、噻吩基、呋喃基、吡咯基、咪唑基、吡唑基、噻唑基、异噻唑基、噁唑基、异噁唑基、吡嗪基、嘧啶基、哒嗪基、1,2,4
‑
噁二唑基、1,3,4
‑
噁二唑基、1,2,4
‑
噻二唑基、1,3,4
‑
噻二唑基、三唑基、四唑基、三嗪基等5至6元单环式芳族杂环基、以及苯并呋喃基、苯并噻吩基、苯并咪唑基、苯并噁唑基、苯并异噁唑基、苯并噻唑基、苯并异噻唑基、苯并三唑基、咪唑并吡啶基、噻吩并吡啶基、呋喃并吡啶基、吡咯并吡啶基、吡唑并吡啶基、噁唑并吡啶基、噻唑并吡啶基、咪唑并吡嗪基、咪唑并嘧啶基、噻吩并嘧啶基、呋喃并嘧啶基、吡咯并嘧啶基、吡唑并嘧啶基、噁唑并嘧啶基、噻唑并嘧啶基、吡唑并三嗪基、萘并[2,3
‑
b]噻吩基、吩噻嗪基、吲哚基、异吲哚基、1h
‑
吲唑基、嘌呤基、异喹啉基、喹啉基、酞嗪基、萘啶基、喹喔啉基、喹唑啉基、噌啉基、咔唑基、β
‑
咔啉基、菲啶基、吖啶基、吩嗪基、吩噻嗪基、吩噁嗪基等8至14元稠合多环式(优选为2或3环式)芳族杂环基,但不限于此。
[0021]
本说明书中,“ras”是指小鼠、大鼠、狗、猴、人等哺乳类的k
‑
ras、n
‑
ras、h
‑
ras这类ras亚家族的野生型蛋白和氨基酸突变型蛋白整体,包括gdp结合型和gtp结合型中的任一者。
[0022]
本说明书中,“具有ras抑制活性”的情况是指,在体外试验中,本发明的肽(1)抑制已报告的ras抑制肽krpep
‑
2d的生物素标签化物与ras蛋白的结合;(2)与ras蛋白浓度依赖性结合;(3)抑制ras表达细胞内的erk的磷酸化;(4)抑制ras表达细胞的增殖等,在上述效果中显示任一者的情况下,称为“具有ras抑制活性”。ras抑制活性的有无可由本领域技术人员按照公知的方法确认。作为确认抑制活性的方法,例如可举出:评价ras蛋白上的gdp交换为gtp的反应的方法(非专利文献3);将ras表达细胞与肽共培养,研究ras下游的信号即erk的磷酸化的有无的方法(非专利文献3);将ras表达细胞与肽共培养,研究该细胞的增殖的有无、速度的方法(非专利文献3);对荷瘤小鼠等疾病模型动物给与肽,研究癌细胞的增殖的有无、速度的方法等,但不限于此。
[0023]
(环状肽)基于图1说明本发明的一个实施方式涉及的环状肽的结构。图1示意性表示作为环状肽设计基础的krpep
‑
2d的ras结合活性涉及的特征(药效团)、环状结构限制(s
‑
s键)、细胞内迁移性(cell penetrating peptide:cpp)等功能相关的结构与修饰其得到的本实施方式的环状肽的关系。krpep
‑
2d中,形成ras结合部位的第6~14位氨基酸残基在本实施方式的环状肽中对应于第2~10位氨基酸残基。此外,krpep
‑
2d中的第5位和第15位半胱氨酸残基间的环状化在本实施方式的环状肽中形成第1位和第11位氨基酸残基间的键a与第4位和第11位氨基酸残基间的键b的环状结构,进一步稳定化。此外,供于krpep
‑
2d的各氨基酸位置处的氨基酸残基的替代的氨基酸的示例示于图2。
[0024]
因此,本发明的1个优选的实施方式中的环状肽可表示为下述式(1)所示。c[x1‑
x2‑
x3‑
c(x4‑
x5‑
x6‑
x7‑
x8‑
x9‑
x
10
‑
x
11
)]
ꢀꢀꢀ
(1)在此,x1至x
11
的各氨基酸残基如以下所示。
[1]x1、x4和x
11
各自独立地表示具有氨基、羧基、硫醇基、烯丙基、炔基、叠氮基或卤素原子的氨基酸残基、或它们的衍生物。x3、x5和x7各自独立地是包含可以具有取代基的烃基的氨基酸残基、包含可以具有取代基的芳族碳环基的氨基酸残基、或包含可以具有取代基的芳族杂环基的氨基酸残基、或它们的衍生物。x8是天冬氨酸残基或其衍生物,x2、x6、x9、x
10
是任意的氨基酸残基。“具有氨基或羧基的氨基酸残基”中的氨基和羧基可以指主链的形成酰胺键的基团。
[0025]
此外,x1与x
11
以及x4与x
11
在各自之间独立地形成直接的共价键或介由连接基团的间接的共价键,由此式(1)的肽在分子内具有2个环状结构。x1与x
11
之间的共价键可以是它们的主链
‑
主链间、主链
‑
侧链间、侧链
‑
主链间或侧链
‑
侧链间中的任一键,此外,x4与x
11
之间的共价键可以是它们的侧链
‑
主链间或侧链
‑
侧链间中的任一键。
[0026]
[2]x1与x
11
的cα碳原子间的结合包括下述式(2)表示的结构:cα1‑
(ch2)
a
‑
x
‑
(ch2)
b
‑
cα
11
ꢀꢀꢀ
(2)在此,上述式(2)中,a与b各自独立地表示0~2中的任一整数,a和b的总和是1~4中的任一整数,x表示s
‑
s、ch2‑
ch2、s
‑
ch2、ch2‑
s、o
‑
ch2、ch2‑
o、ch=ch、nh
‑
c(=o)、n(ch3)
‑
c(=o)、nh
‑
c(=s)、n(ch3)
‑
c(=s)、o
‑
c(=o)、c(=o)
‑
nh、c(=o)
‑
n(ch3)、c(=s)
‑
nh、c(=s)
‑
n(ch3)、c(=o)
‑
o、ch2‑
ch2‑
ch2、s
‑
ch2‑
ch2、ch2‑
ch2‑
s、ch2‑
s
‑
ch2、o
‑
ch2‑
ch2、ch2‑
ch2‑
o、ch2‑
o
‑
ch2、s
‑
ch2‑
s、s
‑
c(=ch2)
‑
s、s
‑
(ch2)2‑
s、s
‑
(ch2)3‑
s、s
‑
(ch2)4‑
s、s
‑
ch2‑
ch=ch
‑
ch2‑
s、s
‑
ch2‑
c6h4‑
ch2‑
s(亚甲基与亚苯基环的键合部位可以是邻位、间位和对位中的任一者)、s
‑
ch2‑
c(=o)
‑
ch2‑
s、或s
‑
ch2‑
c(=ch2)
‑
ch2‑
s。
[0027]
其中,x优选表示nh
‑
c(=o)、ch2‑
s
‑
ch2、ch=ch、ch2‑
ch2,进一步优选为x表示nh
‑
c(=o)的情况。x表示nh
‑
c(=o)的情况,例如包括x1的n末端氨基与x
11
的c末端羧基之间形成的酰胺键。x表示ch2‑
s
‑
ch2的情况,例如可举出1位的3
‑
氯丙酸的主链氯基与11位半胱氨酸的侧链硫醇基间形成的硫醚键;1位的3
‑
丁烯酸的主链烯丙基与11位半胱氨酸的侧链硫醇基间的硫醇
‑
烯反应而形成的硫醚键。此外,x表示ch=ch的情况,例如可举出通过1位的3
‑
丁烯酸的主链烯丙基与11位的β
‑
高
‑
l
‑
烯丙基甘氨酸的侧链烯丙基间的烯烃复分解反应而形成的ch=ch键。在该ch=ch键被还原的情况下,x表示ch2‑
ch2。
[0028]
[3]x4与x
11
的cα碳原子间的键包括下述式(3)表示的结构:cα4‑
(ch2)
a
‑
y
‑
(ch2)
b
‑
cα
11
ꢀꢀꢀ
(3)在此,式(3)中,a与b各自独立地表示0~4中的任一整数,a和b的总和是2~4中的任一整数,y表示s
‑
s、ch2‑
ch2、s
‑
ch2、ch2‑
s、o
‑
ch2、ch2‑
o、ch=ch、nh
‑
c(=o)、n(ch3)
‑
c(=o)、nh
‑
c(=s)、n(ch3)
‑
c(=s)、o
‑
c(=o)、c(=o)
‑
nh、c(=o)
‑
n(ch3)、c(=s)
‑
nh、c(=s)
‑
n(ch3)、c(=o)
‑
o、ch2‑
ch2‑
ch2、s
‑
ch2‑
ch2、ch2‑
ch2‑
s、ch2‑
s
‑
ch2、o
‑
ch2‑
ch2、ch2‑
ch2‑
o、ch2‑
o
‑
ch2、s
‑
ch2‑
s、s
‑
c(=ch2)
‑
s、s
‑
(ch2)2‑
s、s
‑
(ch2)3‑
s、s
‑
(ch2)4‑
s、s
‑
ch2‑
ch=ch
‑
ch2‑
s、s
‑
ch2‑
c6h4‑
ch2‑
s(亚甲基与亚苯基环的键合部位可以是邻位、间位和对位中的任一者)、s
‑
ch2‑
c(=o)
‑
ch2‑
s、s
‑
ch2‑
c(=ch2)
‑
ch2‑
s、三唑或二硫代四氟苯。
[0029]
其中,y优选表示s
‑
s、s
‑
ch2‑
s、s
‑
c(=ch2)
‑
s、s
‑
(ch2)2‑
s、s
‑
(ch2)3‑
s、s
‑
ch2‑
c(=ch2)
‑
ch2‑
s、s
‑
(ch2)4‑
s、s
‑
ch2‑
ch=ch
‑
ch2‑
s、nh
‑
c(=o),进一步优选为y表示s
‑
ch2‑
s、s
‑
(ch2)2‑
s、s
‑
(ch2)3‑
s、或s
‑
(ch2)4‑
s的情况。y表示s
‑
ch2‑
s的情况,例如可举出x4和x
11
同时为半胱氨酸时,在4位的侧链硫醇基、二碘甲烷(dim)连接基团与11位的侧链硫醇基间形成
的
‑
s
‑
ch2‑
s
‑
键。y表示s
‑
(ch2)3‑
s的情况,例如可举出4位半胱氨酸的侧链硫醇基、1,3
‑
二碘丙烷(dip)连接基团与11位半胱氨酸的侧链硫醇基间形成的
‑
s
‑
(ch2)3‑
s
‑
键。y表示三唑的情况,例如可举出4位丁烯基
‑
l
‑
甘氨酸与11位β
‑
叠氮基
‑
l
‑
丙氨酸的侧链间介由通过点击反应(click reaction)形成的三唑的键。此外,可以是4位烯丙基甘氨酸与11位高半胱氨酸间的基于硫醇
‑
烯反应的硫醚键、4位烯丙基甘氨酸与11位β高烯丙基甘氨酸间的基于烯烃复分解反应的ch=ch键。在该ch=ch键被还原的情况下,y表示ch2‑
ch2。
[0030]
[4]x3与x5各自独立地是下述式(4)~(7)中任一项表示的氨基酸残基。式(4)的氨基酸残基表示如下:【化学式1】(式(4)中,波浪线表示与形成主链的酰胺键的羰基或氮原子的附着点,r1、r2和r6各自独立地表示氢原子或甲基,r3、r4、r5各自独立地表示氢原子、甲基或卤素原子(f、cl、br、i),n表示0~10中的任一整数)。其中,优选为亮氨酸、正亮氨酸、异亮氨酸、缬氨酸、2
‑
氨基庚酸、2
‑
氨基辛酸、2
‑
氨基壬酸、2
‑
氨基癸酸、γ
‑
甲基
‑
亮氨酸和5,5'
‑
二甲基正亮氨酸等。
[0031]
式(5)的氨基酸残基表示如下:【化学式2】(式(5)中,z表示c或n,r6表示氢原子或甲基,n表示1~6中的任一整数)。其中,优选为环丁基甘氨酸、环戊基甘氨酸和环己基甘氨酸等。
[0032]
式(6)的氨基酸残基表示如下:【化学式3】
(式(6)中,r7、r8、r9、r
10
和r
11
各自独立地表示氢原子或卤素原子(f、cl、br、i),r6表示氢原子或甲基)。其中,优选为苯基甘氨酸、3
‑
氯苯基甘氨酸、2
‑
氯苯基甘氨酸、4
‑
氯苯基甘氨酸、3
‑
氟苯基甘氨酸、2
‑
氟苯基甘氨酸和4
‑
氟苯基甘氨酸等。
[0033]
式(7)的氨基酸残基表示如下:【化学式4】(式(7)中,r
12
表示2
‑
噻吩基、3
‑
噻吩基、2
‑
吡啶基、3
‑
吡啶基、4
‑
吡啶基、2
‑
噻唑基、4
‑
噻唑基、2
‑
噁唑基、4
‑
噁唑基、1
‑
吡唑基、1
‑
咪唑基、1,2,3
‑
三唑
‑1‑
基或1,2,4
‑
三唑
‑1‑
基,r6表示氢原子或甲基)所示。上述式(4)~(7)中任一项表示的氨基酸残基可以为其衍生物。
[0034]
[5]x7是下述式(8)~(11)中任一项表示的氨基残基。式(8)的氨基酸残基表示如下:【化学式5】(式(8)中,波浪线表示与形成主链的酰胺键的羰基或氮原子的附着点,r7、r8、r9、r
10
、r
11
各自独立地表示氢原子、羟基、甲氧基、甲基、叔丁基、卤代甲基或卤素原子(f、cl、br、i),r6表示氢原子或甲基)。其中,优选为4
‑
氟苯丙氨酸、4
‑
甲基苯丙氨酸、4
‑
氯苯丙氨酸、4
‑
三氟甲基
‑
苯丙氨酸、4
‑
溴苯丙氨酸和4
‑
碘苯丙氨酸等。
[0035]
式(9)的氨基酸残基表示如下:
【化学式6】(式(9)中,r
13
、r
14
、r
15
、r
16
各自独立地表示氢原子、羟基、甲氧基、甲基、叔丁基、卤代甲基或卤素原子(f、cl、br、i),r6表示氢原子或甲基)。其中,优选为色氨酸、6
‑
氯色氨酸和5
‑
氯色氨酸等。
[0036]
式(10)的氨基酸残基表示如下:【化学式7】(式(10)中,波浪线表示与形成主链的酰胺键的羰基或氮原子的键合部位,z表示c或n,r6表示氢原子或甲基,n表示1~6中的任一整数)。其中,优选为环己基丙氨酸等。
[0037]
式(11)的氨基酸残基表示如下:【化学式8】(式(11)中,r
17
表示2
‑
噻吩基、3
‑
噻吩基、2
‑
吡啶基、3
‑
吡啶基、4
‑
吡啶基、2
‑
噻唑基、4
‑
噻唑基、2
‑
噁唑基、4
‑
噁唑基、1
‑
吡唑基、1
‑
咪唑基、1,2,3
‑
三唑
‑1‑
基、1,2,4
‑
三唑
‑1‑
基、1h
‑
苯并咪唑
‑1‑
基、1h
‑
苯并咪唑
‑2‑
基、1,3
‑
苯并噻唑
‑2‑
基、1,3
‑
苯并噁唑
‑2‑
基、2
‑
喹啉基、8
‑
喹啉基、1
‑
萘基或2
‑
萘基,r6表示氢原子或甲基)。其中,优选为2
‑
萘基丙氨酸等。
[0038]
[6]x6是下述式(12)表示的氨基酸残基:【化学式9】
式(12)中,波浪线表示与形成主链的酰胺键的羰基或氮原子的附着点,r
18
、r
19
、r
20
各自独立地表示氢原子、羟基、甲氧基、氨基、单甲基化氨基、二甲基化氨基、三甲基化氨基、甲基、乙基、异丙基、叔丁基、卤代甲基或卤素原子(f、cl、br、i),r6表示氢或甲基,n表示0或1。其中,优选为缬氨酸、亮氨酸、丝氨酸、苏氨酸和2,3
‑
二氨基丙酸等。
[0039]
[7]x2与x9各自独立地表示包含可以具有取代基的烃基的氨基酸、n
‑
甲基化甘氨酸、2
‑
氮杂环丁烷
‑2‑
甲酸、脯氨酸、硫代脯氨酸、3,4
‑
脱氢脯氨酸、哌可酸或它们的衍生物。
[0040]
[8]x
10
表示缬氨酸、正缬氨酸、亮氨酸、正亮氨酸、异亮氨酸、甲硫氨酸、环丙基甘氨酸、环丁基甘氨酸、苯丙氨酸、4
‑
氟
‑
苯丙氨酸、2
‑
噻吩基丙氨酸、3
‑
噻吩基丙氨酸、2
‑
吡啶基丙氨酸、3
‑
吡啶基丙氨酸、4
‑
吡啶基丙氨酸、2
‑
噻唑基丙氨酸、4
‑
噻唑基丙氨酸、2
‑
噁唑基丙氨酸、4
‑
噁唑基丙氨酸、1
‑
吡唑基丙氨酸、1
‑
咪唑基丙氨酸、3
‑
(1,2,3
‑
三唑
‑1‑
基)
‑
丙氨酸、3
‑
(1,2,4
‑
三唑
‑1‑
基)
‑
丙氨酸、3
‑
(1h
‑
苯并咪唑
‑1‑
基)
‑
丙氨酸、3
‑
(1h
‑
苯并咪唑
‑2‑
基)
‑
丙氨酸、3
‑
(1,3
‑
苯并噻唑
‑2‑
基)
‑
丙氨酸、3
‑
(1,3
‑
苯并噁唑
‑2‑
基)
‑
丙氨酸、2
‑
喹啉基丙氨酸、8
‑
喹啉基丙氨酸、色氨酸、1
‑
萘基丙氨酸、2
‑
萘基丙氨酸或它们的n
‑
甲基化氨基酸残基、或它们的衍生物。
[0041]
[9]本发明的1个实施方式中的环状肽包含下述式(13)表示的氨基酸序列:c[x1‑
pro
‑
x3‑
c(cys
‑
x5‑
ser
‑
4ff
‑
asp
‑
pro
‑
x
10
‑
x
11
)]
ꢀꢀꢀ
(13)。式(13)中,x1表示β
‑
丙氨酸或γ
‑
氨基丁酸残基,x3表示亮氨酸、正亮氨酸、环己基甘氨酸、苯基甘氨酸、2
‑
氨基庚酸、2
‑
氨基辛酸、2
‑
氨基壬酸或2
‑
氨基癸酸残基,x5表示异亮氨酸、正亮氨酸、环己基甘氨酸、苯基甘氨酸、2
‑
氨基庚酸、2
‑
氨基辛酸、2
‑
氨基壬酸或2
‑
氨基癸酸残基,x
10
表示缬氨酸、苯丙氨酸、色氨酸、1
‑
萘基丙氨酸或它们的n
‑
甲基化氨基酸残基,x
11
表示d型或l型半胱氨酸残基。此外,x1与x
11
在主链的氨基与羧基之间形成酰胺键,x4与x
11
在各自的侧链
‑
sh基之间介由作为连接基团的亚甲基、亚乙基、亚丙基或亚丁基而形成共价键,由此式(13)的肽在分子内具有2个环状结构。
[0042]
[10]进一步优选实施方式的环状肽包含下述式(14)表示的氨基酸序列:c[βala
‑
pro
‑
x3‑
c(cys
‑
x5‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]
ꢀꢀꢀ
(14)。式(14)中,x3表示亮氨酸、正亮氨酸、环己基甘氨酸、苯基甘氨酸、2
‑
氨基庚酸、2
‑
氨基辛酸、2
‑
氨基壬酸或2
‑
氨基癸酸残基,x5表示异亮氨酸、正亮氨酸、环己基甘氨酸、苯基甘氨酸、2
‑
氨基庚酸、2
‑
氨基辛酸、2
‑
氨基壬酸或2
‑
氨基癸酸残基。此外,1位和11位的残基在主链的氨基与羧基之间形成酰胺键,4位和11位的2个半胱氨酸残基在各自的侧链
‑
sh基之间介由作为连接基团的亚丙基而形成共价键,由此式(14)的肽在分子内具有2个环状结构。
[0043]
作为上述式(13)或式(14)包含的各个环状肽,例如可举出以下示例。
c[βala
‑
pro
‑
nle
‑
c(cys
‑
ile
‑
ser
‑
4ff
‑
asp
‑
pro
‑
val
‑
cys)](序列编号1~3)c[βala
‑
pro
‑
nle
‑
c(cys
‑
ile
‑
ser
‑
4ff
‑
asp
‑
pro
‑
val
‑
d
cys)](序列编号4~6)c[γaba
‑
pro
‑
nle
‑
c(cys
‑
ile
‑
ser
‑
4ff
‑
asp
‑
pro
‑
val
‑
cys)](序列编号7~9)c[γaba
‑
pro
‑
nle
‑
c(cys
‑
ile
‑
ser
‑
4ff
‑
asp
‑
pro
‑
val
‑
d
cys)](序列编号10~12)c[βala
‑
pro
‑
nle
‑
c(cys
‑
phg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
val
‑
d
cys)](序列编号13)c[βala
‑
pro
‑
nle
‑
c(cys
‑
aoc
‑
ser
‑
4ff
‑
asp
‑
pro
‑
val
‑
d
cys)](序列编号14)c[βala
‑
pro
‑
nle
‑
c(cys
‑
anon
‑
ser
‑
4ff
‑
asp
‑
pro
‑
val
‑
d
cys)](序列编号15)c[βala
‑
pro
‑
nle
‑
c(cys
‑
anon
‑
ser
‑
4ff
‑
asp
‑
pro
‑
phe
‑
d
cys)](序列编号16)c[βala
‑
pro
‑
nle
‑
c(cys
‑
anon
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)](序列编号17)c[βala
‑
pro
‑
nle
‑
c(cys
‑
anon
‑
ser
‑
4ff
‑
asp
‑
pro
‑
1napha
‑
d
cys)](序列编号18)c[βala
‑
pro
‑
anon
‑
c(cys
‑
anon
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)](序列编号19)c[βala
‑
pro
‑
nle
‑
c(cys
‑
aoc
‑
ser
‑
4ff
‑
asp
‑
pro
‑
m
val
‑
d
cys)](序列编号20~21)
[0044]
c[βala
‑
pro
‑
leu
‑
c(cys
‑
ile
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
leu
‑
c(cys
‑
nle
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
leu
‑
c(cys
‑
chg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
leu
‑
c(cys
‑
phg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
leu
‑
c(cys
‑
ahep
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
leu
‑
c(cys
‑
aoc
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
leu
‑
c(cys
‑
anon
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
leu
‑
c(cys
‑
adec
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
nle
‑
c(cys
‑
ile
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
nle
‑
c(cys
‑
nle
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
nle
‑
c(cys
‑
chg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
nle
‑
c(cys
‑
phg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
nle
‑
c(cys
‑
ahep
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
nle
‑
c(cys
‑
aoc
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
nle
‑
c(cys
‑
adec
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
chg
‑
c(cys
‑
ile
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
chg
‑
c(cys
‑
nle
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
chg
‑
c(cys
‑
chg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
chg
‑
c(cys
‑
phg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
chg
‑
c(cys
‑
ahep
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
chg
‑
c(cys
‑
aoc
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
chg
‑
c(cys
‑
anon
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
chg
‑
c(cys
‑
adec
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
phg
‑
c(cys
‑
ile
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
phg
‑
c(cys
‑
nle
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
phg
‑
c(cys
‑
chg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
phg
‑
c(cys
‑
phg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]
c[βala
‑
pro
‑
phg
‑
c(cys
‑
ahep
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
phg
‑
c(cys
‑
aoc
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
phg
‑
c(cys
‑
anon
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
phg
‑
c(cys
‑
adec
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
ahep
‑
c(cys
‑
ile
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
ahep
‑
c(cys
‑
nle
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
ahep
‑
c(cys
‑
chg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
ahep
‑
c(cys
‑
phg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
ahep
‑
c(cys
‑
ahep
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
ahep
‑
c(cys
‑
aoc
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
ahep
‑
c(cys
‑
anon
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
ahep
‑
c(cys
‑
adec
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
aoc
‑
c(cys
‑
ile
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
aoc
‑
c(cys
‑
nle
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
aoc
‑
c(cys
‑
chg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
aoc
‑
c(cys
‑
phg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
aoc
‑
c(cys
‑
ahep
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
aoc
‑
c(cys
‑
aoc
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
aoc
‑
c(cys
‑
anon
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
aoc
‑
c(cys
‑
adec
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
anon
‑
c(cys
‑
ile
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
anon
‑
c(cys
‑
nle
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
anon
‑
c(cys
‑
chg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
anon
‑
c(cys
‑
phg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
anon
‑
c(cys
‑
ahep
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
anon
‑
c(cys
‑
aoc
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
anon
‑
c(cys
‑
adec
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
adec
‑
c(cys
‑
ile
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
adec
‑
c(cys
‑
nle
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
adec
‑
c(cys
‑
chg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
adec
‑
c(cys
‑
phg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
adec
‑
c(cys
‑
ahep
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
adec
‑
c(cys
‑
aoc
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
adec
‑
c(cys
‑
anon
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]c[βala
‑
pro
‑
adec
‑
c(cys
‑
adec
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
d
cys)]
[0045]
c[βala
‑
pro
‑
leu
‑
c(cys
‑
ile
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
leu
‑
c(cys
‑
nle
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
leu
‑
c(cys
‑
chg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
leu
‑
c(cys
‑
phg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]
c[βala
‑
pro
‑
leu
‑
c(cys
‑
ahep
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
leu
‑
c(cys
‑
aoc
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
leu
‑
c(cys
‑
anon
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
leu
‑
c(cys
‑
adec
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
nle
‑
c(cys
‑
ile
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
nle
‑
c(cys
‑
nle
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
nle
‑
c(cys
‑
chg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
nle
‑
c(cys
‑
phg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
nle
‑
c(cys
‑
ahep
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
nle
‑
c(cys
‑
aoc
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
nle
‑
c(cys
‑
anon
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
nle
‑
c(cys
‑
adec
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
chg
‑
c(cys
‑
ile
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
chg
‑
c(cys
‑
nle
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
chg
‑
c(cys
‑
chg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
chg
‑
c(cys
‑
phg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
chg
‑
c(cys
‑
ahep
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
chg
‑
c(cys
‑
aoc
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
chg
‑
c(cys
‑
anon
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
chg
‑
c(cys
‑
adec
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
phg
‑
c(cys
‑
ile
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
phg
‑
c(cys
‑
nle
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
phg
‑
c(cys
‑
chg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
phg
‑
c(cys
‑
phg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
phg
‑
c(cys
‑
ahep
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
phg
‑
c(cys
‑
aoc
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
phg
‑
c(cys
‑
anon
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
phg
‑
c(cys
‑
adec
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
ahep
‑
c(cys
‑
ile
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
ahep
‑
c(cys
‑
nle
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
ahep
‑
c(cys
‑
chg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
ahep
‑
c(cys
‑
phg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
ahep
‑
c(cys
‑
ahep
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
ahep
‑
c(cys
‑
aoc
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
ahep
‑
c(cys
‑
anon
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
ahep
‑
c(cys
‑
adec
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
aoc
‑
c(cys
‑
ile
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
aoc
‑
c(cys
‑
nle
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
aoc
‑
c(cys
‑
chg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]
c[βala
‑
pro
‑
aoc
‑
c(cys
‑
phg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
aoc
‑
c(cys
‑
ahep
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
aoc
‑
c(cys
‑
aoc
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
aoc
‑
c(cys
‑
anon
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
aoc
‑
c(cys
‑
adec
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
anon
‑
c(cys
‑
ile
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
anon
‑
c(cys
‑
nle
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
anon
‑
c(cys
‑
chg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
anon
‑
c(cys
‑
phg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
anon
‑
c(cys
‑
ahep
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
anon
‑
c(cys
‑
aoc
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
anon
‑
c(cys
‑
anon
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
anon
‑
c(cys
‑
adec
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
adec
‑
c(cys
‑
ile
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
adec
‑
c(cys
‑
nle
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
adec
‑
c(cys
‑
chg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
adec
‑
c(cys
‑
phg
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
adec
‑
c(cys
‑
ahep
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
adec
‑
c(cys
‑
aoc
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
adec
‑
c(cys
‑
anon
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]c[βala
‑
pro
‑
adec
‑
c(cys
‑
adec
‑
ser
‑
4ff
‑
asp
‑
pro
‑
trp
‑
cys)]
[0046]
[11]本发明涉及的肽包括在上述[1]~[10]所示的氨基酸序列中,即使是缺失、添加和/或替代1~数个氨基酸的具有同源性的肽,也包括具有与ras的结合活性的物质。本说明书中,在“缺失、添加和/或替代1~数个氨基酸的肽”的情况下,上述氨基酸的个数只要该肽具有ras结合活性,则没有特别限定,优选为1~5个,进一步优选为1个或2个。缺失、添加和/或替代的部位可以是肽的末端,也可以是中间,可以是1个部位,也可以是2个部位以上。
[0047]
作为这样的在上述氨基酸序列中缺失、添加和/或替代1~数个氨基酸的氨基酸序列,可举出使用blast(basic local alignment search tool at the national center for biological information(美国国立生物学信息中心的基本局部比对搜索工具))等(例如使用默认,即初始设定的参数)计算时,与前述氨基酸序列具有至少50%以上,优选为70%以上,进一步优选为80%以上,特别优选为90%以上的同源性的物质。
[0048]
此外,已知即使一级结构的同源性低,也存在立体结构高度类似的肽、蛋白结构域。因此,与上述氨基酸序列至少具有50%以上,优选为70%以上,进一步优选为80%以上,特别优选为90%以上的立体结构同源性,且具有ras结合活性的肽也包括在本实施方式中。上述肽彼此的立体结构的同源性可使用同源模建法等,由立体结构未知的肽的氨基酸序列,按照以下方式预测其立体结构。例如,在给出具有与本实施方式的环状肽(参照肽)类似的序列的任意的氨基酸序列(目标序列)时,给出目标序列与参照序列之间的比对(将序列并排放置)。如果使用通过fasta、psi
‑
blast、libra等算出的比对,则确定目标序列与参照序列间的每个氨基酸的对应关系,因此基于该关系,根据参照肽的三维坐标,制作目标序列
上的每个氨基酸的三维坐标。三维坐标的构建中,有时在氨基酸残基间结构上产生不适当的间隙、冲突、应变,因此通过能量极小化计算,消除上述结构性应变。通过建模软件,顺利消除上述结构性应变,因此并非同时对肽的全部原子进行,而是阶段性进行。即,首先对形成肽骨架的α碳原子进行,接着,对包含α碳原子的主链原子进行,最后对包含侧链原子的肽整体进行。如果如此得到针对目标序列的比对,则能够预测构建其立体结构。立体结构同源性的指标可使用最佳重叠时的xyz坐标之差,即rmsd(root mean square deviation)等进行比较。
[0049]
本发明的肽只要解决本发明的课题,则也包括其各种衍生物和/或修饰物。作为涉及的衍生物,可举出肽的饱和脂肪链被替代为不饱和脂肪链的衍生物、肽的原子中的一部分被替代为包含放射性或非放射性的同位素原子的其它原子的衍生物、肽的酰胺键被替代为硫代酰胺键(
‑
nh
‑
c(=s)
‑
)的衍生物、肽的酰胺键被替代为烯烃(
‑
c=c
‑
)的衍生物、肽的酰胺键被替代为烷基(
‑
c
‑
c
‑
)的衍生物、肽的酰胺键被替代为羟基亚乙基(
‑
c(
‑
oh)
‑
c
‑
)的衍生物、肽的酰胺键被替代为酯(
‑
o
‑
c(=o)
‑
)的物质、肽的酰胺键被替代为烯烃(
‑
c=c
‑
)的衍生物、肽的酰胺键被替代为(
‑
c
‑
nh
‑
)的衍生物或肽的酰胺键被替代为(
‑
c(=o)
‑
c
‑
)的衍生物,作为涉及的修饰物,可以举出肽的α位碳被二取代的修饰物、肽的酰胺键被n
‑
烷基化的修饰物、肽的官能团中的一部分经过卤化、氰基化、硝基化、氧代化、羟基化、氨基化、脱氨基化、脱氢化、酰胺化、乙酰基化、甲氧基化、异戊烯基化、烷基化等修饰的修饰物(例如,肽的氨基中的一部分被乙酰基化、烷基化、脱氨基化的修饰物,肽的羧基中的一部分形成酰胺、酯的修饰物等)、肽的s形成亚砜s(=o)或砜s(=o)2的修饰物、肽介由化学连接基团而多聚物化的修饰物、肽被生物素标签化的修饰物、肽被荧光标签化的修饰物、肽被发光标签化的修饰物、以及使烷基链、聚乙二醇、抗体、凝集素类、糖链、酶、膜透过肽、低分子化合物、或诱导蛋白的泛素化的分子等与肽融合的修饰物等,但不限于此。
[0050]
本发明的肽也包括肽的盐。作为肽的盐,可使用与生理学接受的碱、酸的盐,例如可举出无机酸(盐酸、氢溴酸、氢碘酸、硫酸、磷酸等)的加成盐、有机酸(对甲苯磺酸、甲磺酸、草酸、对溴苯磺酸、羧酸、琥珀酸、柠檬酸、苯甲酸、乙酸等)的加成盐、无机碱(氢氧化铵、或碱金属或碱土金属氢氧化物、碳酸盐、碳酸氢盐等)、氨基酸的加成盐等。
[0051]
本发明的肽可以是前药。前药是指在生物体内的生理条件下通过基于酶、胃酸等的反应而转化为本发明的肽的化合物,即引起酶促氧化、还原、水解等而变化为本发明的肽的化合物、通过胃酸等引起水解等而变化为本发明的肽的化合物。
[0052]
作为本发明的肽的前药,可举出本发明的肽的氨基被酰基化、烷基化或磷酸化而得到的化合物(例如,本发明的肽的氨基被二十烷酰基化、丙氨酰基化、戊基氨基羰基化、(5
‑
甲基
‑2‑
氧代
‑
1,3
‑
二氧杂环戊烯
‑4‑
基)甲氧基羰基化、四氢呋喃基化、吡咯烷基甲基化、特戊酰氧基甲基化或叔丁基化而得到的化合物)、本发明的肽的羟基被酰基化、烷基化、磷酸化或硼酸化而得到的化合物(例如,本发明的肽的羟基被乙酰基化、棕榈酰基化、丙酰基化、特戊酰基化、丁二酰基化、富马酰基化、丙氨酰基化或二甲基氨基甲基羰基化而得到的化合物)、本发明的肽的羟基、羧基被酯化或酰胺化而得到的化合物(例如,本发明的肽的羟基、羧基被c1‑6烷基酯化、苯基酯化、羧基甲基酯化、二甲基氨基甲基酯化、特戊酰氧基甲基酯化、乙氧羰氧基乙基酯化、邻苯二甲酸酯化、(5
‑
甲基
‑2‑
氧代
‑
1,3
‑
二氧杂环戊烯
‑4‑
基)甲基酯化、环己氧基羰基乙基酯化或甲基酰胺化而得到的化合物)等,但不限于此。上述
化合物可通过本身公知的方法而由本发明的肽制造。
[0053]
本发明的肽的前药可以在广川书店1990年刊“医药品的开发”第7卷分子设计163~198页记载的生理条件下修饰为本发明的肽。
[0054]
本说明书中,前药可以形成盐,作为涉及的盐,可举出作为本发明的肽的盐而例示的物质。
[0055]
本发明的肽可以是晶体,单独晶型或晶型混合物均包含于本发明的肽。晶体可通过应用本身公知的结晶化法进行结晶化而制造。
[0056]
本发明的肽可以是药学可接受的共结晶、共结晶盐。在此,共结晶或共结晶盐是指,具有各自不同的物理特性(例如,结构、熔点、熔化热、吸湿性、溶解性和稳定性等)的在室温由二种或其以上的独特固体构成的结晶性物质。共结晶或共结晶盐可按照本身公知的共结晶化法制造。
[0057]
(环状肽的作用效果)如后述的实施例所示,本实施方式表示的氨基酸序列组的代表例即序列17、序列20(lo2)和序列21(lo3)具有对蛋白酶分解的耐性和对k
‑
ras(g12d)表达细胞的增殖抑制活性。本实施方式表示的氨基酸序列组具有与上述代表例类似的氨基酸序列和立体结构的特征,因此认为其也具有对蛋白酶分解的耐性和细胞增殖抑制活性的可能性非常高。
[0058]
krpep
‑
2d不仅与k
‑
ras(g12d)结合,也与k
‑
ras(g12c)、野生型k
‑
ras结合,确认到其结合活性对gdp结合型ras和gtp结合型ras中的任一者几乎相同(非专利文献3和非专利文献4)。此外,ras的氨基酸序列无论有无突变,均高度保守。如后述实施例所示,本实施方式表示的氨基酸序列组的代表例的生物素修饰物(生物素
‑
bc
‑
1)与野生型k
‑
ras、k
‑
ras(g12d)、k
‑
ras(g12v)、k
‑
ras(g12c)、k
‑
ras(g13d)、野生型n
‑
ras、n
‑
ras(q61k)、野生型h
‑
ras、h
‑
ras(g12v)、以及h
‑
ras(q61l)结合。本实施方式表示的氨基酸序列组具有krpep
‑
2d的药效团、以及与生物素
‑
bc
‑
1类似的氨基酸序列和立体结构的特征,因此可认为与突变型k
‑
ras、突变型n
‑
ras、突变型h
‑
ras这类ras整体结合,与gdp结合型ras和gtp结合型ras中的任一者也存在该结合活性,通过结合而抑制ras整体的功能的可能性非常高。
[0059]
将非专利文献5记载的krpep
‑
2d修饰肽的k
‑
ras(g12d)抑制活性、以及后述实施例所示的2d
‑
5/15
‑
dap/asp的k
‑
ras(g12d)结合活性、生物素
‑
bc
‑
1的k
‑
ras(g12d)结合活性、序列1~21对k
‑
ras(g12d)表达细胞的增殖抑制活性示于以下。本发明的二环肽中,(1)1位
‑
11位间的共价键从s
‑
s键这类柔软的结构至酰胺键这类具有平面性的较为刚性的结构,接受宽范围的形状的结构。(2)1位
‑
11位间的共价键接受c
α
碳间的原子数为3~7为止的宽范围的距离;(3)4位
‑
11位间的共价键接受c
α
碳间的原子数为4~8为止的宽范围距离。
[0060]
也如非专利文献5所示,通常环状肽的靶标结合活性,以最优环状尺寸作为顶点描绘为钟型,因此本发明的二环肽的4
‑
11位间的共价键以c
α
碳间的原子数4~8作为顶点,进一步如果增加1~2原子数左右,则接受的可能性非常高。即,可认为4位
‑
11位间的共价键接受c
α
碳间的原子数为4~10为止的宽范围距离。此外,4
‑
11位间的共价键有助于肽的二环结构限制,但未直接有助于ras键合,因此可认为接受酰胺键、二硫键、硫醚键、c=c键、c
‑
c键、介由三唑的键、介由二硫代四氟苯的键等宽范围形状的结构。
[0061]
ras整体的氨基酸序列在哺乳类中高度保守,因此包含本实施方式表示的氨基酸序列的肽组也与小鼠、大鼠、狗、猴等除了人之外的哺乳类的突变型k
‑
ras、突变型n
‑
ras和/
或突变型h
‑
ras结合,可认为抑制其功能的可能性非常高。
[0062]
(环状肽的制造方法)本实施方式的肽可通过液相法、固相法、或组合液相法和固相法的杂化法等化学合成法等公知的肽的制造方法等来制造。
[0063]
固相法中,可使用市售的自动合成机。例如,使具有羟基的树脂的羟基与α位氨基被fmoc基这类保护基保护的第一氨基酸(通常为目标肽的c末端氨基酸)的羧基进行酯化反应。作为酯化催化剂,可使用1
‑
均三甲苯砜基
‑3‑
硝基
‑
1,2,4
‑
三唑(msnt)、二环己基碳二亚胺(dcc)、二异丙基碳二亚胺(dipcdi)等公知脱水缩合剂。接着,使第一氨基酸的α位氨基的保护基脱离,同时添加除主链的羧基以外的全部官能团被保护的第二氨基酸,使该羧基活化,使第一和第二氨基酸键合。此外,使第二氨基酸的α位氨基脱保护,添加除主链的羧基以外的全部官能团被保护的第三氨基酸,使该羧基活化,使第二和第三氨基酸键合。反复上述操作,合成目标长度的肽。将直链肽从树脂切断,纯化后,使用于使肽环状化的官能团脱保护,按照常规方法,使肽环状化。
[0064]
作为固相合成的树脂,可举出merrifield树脂、mbha树脂、cl
‑
trt树脂、sasrin树脂、wang树脂、rink酰胺树脂、hmfs树脂、氨基
‑
pega树脂(merck公司)、hmpa
‑
pega树脂(merck公司)等。上述树脂可以在利用溶剂(二甲基甲酰胺(dmf)、2
‑
丙醇、二氯甲烷等)清洗后使用。作为α位氨基的保护基,可举出苄氧羰基(cbz)、叔丁氧羰基(boc)、芴基甲氧羰基(fmoc)、苯甲基、烯丙基、烯丙氧羰基(alloc)等。cbz基可通过氢氟酸、氢化等脱保护,boc基可通过三氟乙酸(tfa)脱保护,fmoc基可通过利用哌啶的处理而脱保护。α位羧基的保护可使用甲酯、乙酯、苯甲酯、叔丁酯、环己酯等。作为氨基酸的其它官能团,丝氨酸、苏氨酸等的羟基可利用苄基、叔丁基保护,酪氨酸等的羟基可利用2
‑
溴苄氧羰基、叔丁基保护。赖氨酸等侧链的氨基、谷氨酰胺酸、天冬氨酸等的羧基可与α位氨基、α位羧基同样进行保护。
[0065]
羧基的活化可使用缩合剂进行。作为缩合剂,例如可举出二环己基碳二亚胺(dcc)、二异丙基碳二亚胺(dipcdi)、1
‑
乙基
‑3‑
(3
‑
二甲基氨基丙基)碳二亚胺(edc或者wsc)、(1h
‑
苯并三唑
‑1‑
基氧基)三(二甲基氨基)磷鎓六氟磷酸盐(bop)、1
‑
[双(二甲基氨基)甲基]
‑
1h
‑
苯并三唑鎓
‑3‑
基氧基二(六氟磷酸)盐(hbtu)等。肽链从树脂的裂解可以通过用tfa、氟化氢(hf)等酸进行处理而进行。
[0066]
本实施方式的肽,作为一个方式被环状化。本说明书中环状化是指在1个肽内,距离1个氨基酸以上的2个以上的氨基酸直接共价键合,或者介由连接基团间接共价键合,在分子内制作1个以上的环状结构。环状化可按照非专利文献3、非专利文献6、非专利文献7记载的方法来实施。例如,可通过以下方式形成:氨基与羧基间的酰胺键、硫醇基与硫醇基间的二硫键、硫醇基与卤素基间的硫醚键、硫醇基与烯丙基间的基于硫醇
‑
烯反应的硫醚键、烯丙基与烯丙基间的基于烯烃复分解反应的c=c键(该c=c键可以通过还原反应而转化为c
‑
c键)、炔基与叠氮基间的介由基于点击反应(click reaction)的三唑的键、具有卤素基的连接基团与二个硫醇基间的硫醚键等,但不限于此。用于环状化的直接共价键或介由连接基团的间接共价键可以是主链
‑
主链间、主链
‑
侧链间、侧链
‑
主链间、侧链
‑
侧链间中的任一者。
[0067]
本发明的肽的环状化中,例如(1)可将具有硫醇基的半胱氨酸、d型半胱氨酸、高半胱氨酸、d型高半胱氨酸各自独立地作为氨基酸1和氨基酸2,使用在上述硫醇基间形成的二
硫键;(2)可将具有亲核基团即卤素原子(氯、溴或碘)的氨基酸(例如3
‑
氯丙氨酸)、或具有卤素原子(氯、溴或碘)的羧酸(例如3
‑
氯丙酸)作为氨基酸1,使用在具有硫醇基的氨基酸2之间形成的硫醚键;(3)可使用在具有硫醇基的氨基酸1和氨基酸2、以及具有亲核基团即卤素原子(氯、溴或碘)的连接基团(例如二碘甲烷(dim)、1,2
‑
二碘乙烷(die)、1,3
‑
二碘丙烷(dip)、1,4
‑
二碘丁烷(dib)、六氟苯等)之间形成的硫醚键;(4)可将具有叠氮基的β叠氮基丙氨酸作为氨基酸1,将具有炔基的2
‑
氨基
‑5‑
己炔酸作为氨基酸2,可使用介由通过其间的点击反应(click reaction)形成的三唑的共价键;(5)可将具有烯丙基的氨基酸(例如烯丙基甘氨酸、d型烯丙基甘氨酸、高烯丙基甘氨酸、d型高烯丙基甘氨酸等)、或具有烯丙基的羧酸(例如3
‑
丁烯酸)作为氨基酸1,使用通过具有硫醇基的氨基酸2之间的硫醇
‑
烯反应而形成的硫醚键;(6)可将具有烯丙基的氨基酸或具有烯丙基的羧酸各自独立地作为氨基酸1和氨基酸2,使用通过上述烯丙基间的烯烃复分解反应形成的c=c键;(7)可使用将通过烯烃复分解反应形成的c=c键还原而形成的c
‑
c;(8)可使用具有氨基的氨基酸1(例如2,3
‑
二氨基丙酸、2,4
‑
二氨基丁酸、鸟氨酸、赖氨酸、它们的d型氨基酸、β丙氨酸等)与具有羧基的氨基酸2(天冬氨酸、谷氨酸、它们的d型氨基酸等)或c末端羧基之间的酰胺键;(9)可使用n末端氨基与具有羧基的氨基酸或c末端羧基之间的酰胺键。氨基酸1与氨基酸2中的任一者可以形成n末端侧。
[0068]
(包含环状肽的医药、诊断药、研究用试剂)本发明涉及的医药组合物包含肽作为有效成分,上述肽包含上述氨基酸序列,肽与ras结合,通过抑制其活性,可抑制恶性肿瘤等的增殖。上述医药组合物的给药方式没有特别限定,可以为口服给药或非口服给药。作为非口服给药,例如可举出肌肉内注射、静脉内注射、皮下注射等注射给药、经皮给药、经粘膜给药(经鼻、经口腔、经眼、经肺、经阴道或经直肠给药)等。鉴于医药组合物中的肽的容易代谢和排泄的性质,可进行各种修饰。例如,通过在肽中添加烷基链、聚乙二醇或糖链等,可延长血中滞留时间,降低抗原性。此外,可使用聚乳酸
‑
羟基乙酸(plga)等生物体内降解性高分子化合物、多孔性羟基磷灰石、脂质体、表面修饰脂质体、利用不饱和脂肪酸制备的乳液、纳米颗粒、纳米球等作为缓释基剂,在其中包封肽。在经皮给药的情况下,还可使弱电流流过皮肤表面而透过角质层(离子电渗透法)。
[0069]
上述的医药组合物可以直接使用有效成分,也可以添加药学可接受的载体、赋形剂、添加剂等而制剂化。作为剂型,例如可举出液剂(注射剂等)、分散剂、混悬剂、片剂、丸剂、粉末剂、栓剂、散剂、细粒剂、颗粒剂、胶囊剂、糖浆剂、锭剂、吸入剂、软膏剂、滴眼剂、滴鼻剂、滴耳剂、巴布剂等。上述制剂可以为速释性制剂或缓释性制剂等控释制剂(缓释性微囊等)。制剂化,例如可适当使用赋形剂、结合剂、崩解剂、润滑剂、溶解剂、助溶剂、着色剂、矫味矫臭剂、稳定化剂、乳化剂、吸收促进剂、表面活性剂、ph调整剂、防腐剂、抗氧化剂等,通过常规方法进行。作为制剂化中使用的成分的示例,可举出精制水、食盐水、磷酸缓冲液、右旋糖、甘油、乙醇等药学可接受的有机溶剂、动植物油、乳糖、甘露醇、葡萄糖、山梨糖醇、结晶纤维素、羟丙基纤维素、淀粉、玉米淀粉、无水硅酸、硅酸铝镁、胶原蛋白、聚乙烯醇、聚乙烯基吡咯烷酮、羧基乙烯基聚合物、羧甲基纤维素钠、聚丙烯酸钠、海藻酸钠、水溶性葡聚糖、羧甲基淀粉钠、果胶、甲基纤维素、乙基纤维素、黄原胶、阿拉伯胶、黄蓍胶、酪蛋白、琼脂、聚乙二醇、二甘油、甘油、丙二醇、凡士林、石蜡、肉豆蔻酸辛基十二烷基酯、肉豆蔻酸异
丙酯、高级醇、硬脂醇、硬脂酸、人血清白蛋白等,但不限于此。在肽难以经粘膜吸收的情况下,作为改善难吸收性药物的吸收的吸收促进剂,可以使用聚氧乙烯月桂醚类、月桂基硫酸钠、皂苷等表面活性剂;甘氨胆酸、脱氧胆酸、牛磺胆酸等胆酸盐;edta、水杨酸类等螯合剂;己酸、癸酸、月桂酸、油酸、亚油酸、混合胶束等脂肪酸类;烯胺衍生物、n
‑
酰基胶原肽、n
‑
酰基氨基酸、环糊精类、壳聚糖类、一氧化氮供体等。
[0070]
丸剂或片剂也可被糖衣、胃溶性、肠溶性物质包覆。注射剂可包含注射用蒸馏水、生理食盐水、丙二醇、聚乙二醇、植物油、醇类等。此外,可添加润湿剂、乳化剂、分散剂、稳定化剂、溶解剂、助溶剂、防腐剂等。根据需要,还可适当适量使用通常的防腐剂、抗氧化剂、着色剂、甜味剂、吸附剂、润湿剂等添加物。
[0071]
本发明的医药组合物通过抑制ras的功能,对于被认为涉及表达ras的恶性肿瘤的各种疾病的治疗或预防是有效的。例如,可举出胰腺癌(例如,胰腺管癌等)、大肠癌(例如,家族性大肠癌、遗传性非息肉性大肠癌、消化道间质瘤等)、小肠癌(例如,非霍奇金淋巴瘤、消化道间质瘤等)、乳腺癌(例如,浸润性乳腺导管癌、非浸润性乳腺导管癌、炎症性乳腺癌等)、前列腺癌(例如,激素依赖性前列腺癌、激素非依赖性前列腺癌等)、胃癌(例如,乳头腺癌、粘液腺癌、腺扁平上皮癌等)、肺癌(例如,非小细胞肺癌、小细胞肺癌、恶性间皮瘤等)、结肠癌(例如,消化道间质瘤等)、直肠癌(例如,消化道间质瘤等)、食道癌、十二指肠癌、舌癌、咽喉癌(例如,上咽喉癌、中咽喉癌、下咽喉癌等)、唾液腺癌、脑肿瘤(例如,松果体星形细胞肿瘤、纤维性细胞性星形细胞瘤、弥漫性星形细胞瘤、间变性星形细胞瘤等)、神经鞘瘤、肝癌(例如,原发性肝癌、肝外胆管癌等)、肾脏癌(例如,肾细胞癌、肾盂和尿道的转移上皮癌等)、胆管癌、子宫内膜癌、宫颈癌、卵巢癌(例如,上皮性卵巢癌、性腺外胚细胞肿瘤、卵巢性胚细胞肿瘤、卵巢低恶性度肿瘤等)、膀胱癌、尿道癌、皮肤癌(例如,眼内(眼)黑素瘤、merkel细胞癌等)、血管瘤、恶性淋巴瘤、恶性黑素瘤、甲状腺癌(例如,甲状腺髄样癌等)、副甲状腺癌、鼻腔癌、副鼻腔癌、骨肿瘤(例如,骨肉瘤、尤文肿瘤、子宫肌瘤、软部组织肉瘤等)、血管纤维瘤、网膜肉瘤、阴茎癌、睾丸肿瘤、儿童实体瘤(例如,wilms瘤、儿童肾肿瘤等)、卡波西肉瘤、aids引起的卡波西肉瘤、上颚窦肿瘤、纤维性组织细胞瘤、平滑肌肉瘤、横纹肌肉瘤、白血病(例如,急性骨髄性白血病、急性淋巴母细胞性白血病等)等,但不限于此。
[0072]
本发明的医药组合物可以与对上述疾病有用的其它医药、治疗方法并用给药。例如,如果是恶性肿瘤,则可以与各种化疗、外科治疗、放疗法组合。
[0073]
在对哺乳类(例如人、小鼠、大鼠、豚鼠、兔、狗、马、猴、猪等),特别是人给与本发明的医药组合物时的给药量因症状、患者的年龄、性别、体重、敏感性差异、给药方法、给药间隔、有效成分的种类、制剂的种类而不同,没有特别限定,例如可1次或分为多次给与30μg~1000mg、100μg~500mg、100μg~100mg。
[0074]
以下示出的实施例仅是例示,其目的在于,仅与上述实施方式一同详细说明本发明,不限定本发明。本领域技术人员在不脱离本发明的含义的情况下能够以各种各样的方式变更本发明,涉及的变更也包含于本发明的范围内。实施例
[0075]
本说明书中使用的缩写表示以下含义。k
‑
ras:v
‑
ki
‑
ras2 kirsten大鼠肉瘤病毒致癌基因同源物n
‑
ras:神经母细胞瘤ras致癌基因同源物
h
‑
ras:harvery大鼠肉瘤病毒致癌基因同源物gdp:二磷酸鸟苷gtp:三磷酸鸟苷gef:鸟嘌呤核苷酸交换因子gap:gtpase加速蛋白bsa:牛血清白蛋白rp
‑
hplc:反相高效液相色谱hrp:辣根过氧化物酶sa:链霉亲和素dtt:二硫苏糖醇pbs:磷酸缓冲的盐水elisa:酶联免疫吸附测定atp:三磷酸腺苷ac:乙酰基arg:l
‑
精氨酸cys:l
‑
半胱氨酸gly:甘氨酸ala:l
‑
丙氨酸βala:β
‑
丙氨酸(β
‑
高甘氨酸)γaba:γ
‑
氨基丁酸aze:l
‑
氮杂环丁烷甲酸pro:l
‑
脯氨酸t4fp:反式
‑4‑
氟
‑
l
‑
脯氨酸pip:l
‑
哌可酸val:l
‑
缬氨酸leu:l
‑
亮氨酸ile:l
‑
异亮氨酸γml:γ
‑
甲基
‑
l
‑
亮氨酸(3
‑
叔丁基
‑
l
‑
丙氨酸)nle:l
‑
正亮氨酸dmnl:5,5
‑
二甲基
‑
l
‑
正亮氨酸ahep:(s)
‑2‑
氨基庚酸aoc:(s)
‑2‑
氨基辛酸anon:(s)
‑2‑
氨基壬酸adec:(s)
‑2‑
氨基癸酸cprg:l
‑
环丙基甘氨酸cbug:l
‑
环丁基甘氨酸cpeng:l
‑
环戊基甘氨酸chg:l
‑
环己基甘氨酸cha:l
‑
环己基丙氨酸phg:l
‑
苯基甘氨酸
phe:l
‑
苯丙氨酸3cpg:3
‑
氯
‑
l
‑
苯基甘氨酸2cpg:2
‑
氯
‑
l
‑
苯基甘氨酸4fpg:4
‑
氟
‑
l
‑
苯基甘氨酸tyr:l
‑
酪氨酸3hf:3
‑
羟基
‑
l
‑
苯丙氨酸trp:l
‑
色氨酸5hw:5
‑
羟基
‑
l
‑
色氨酸6cw:6
‑
氯
‑
l
‑
色氨酸1napha:l
‑1‑
萘基丙氨酸2napha:l
‑2‑
萘基丙氨酸dap:(s)
‑
2,3
‑
二氨基丙酸lys:l
‑
赖氨酸s(ome):o
‑
甲基
‑
l
‑
丝氨酸hms(ome):o
‑
甲基
‑
l
‑
高丝氨酸thr:l
‑
苏氨酸asp:l
‑
天冬氨酸4ff:4
‑
氟
‑
l
‑
苯丙氨酸4mf:4
‑
甲基
‑
l
‑
苯丙氨酸4cf:4
‑
氯
‑
l
‑
苯丙氨酸4tfmf:4
‑
三氟甲基
‑
l
‑
苯丙氨酸4bf:4
‑
溴
‑
l
‑
苯丙氨酸4if:4
‑
碘
‑
l
‑
苯丙氨酸2pyrda:3
‑
(2
‑
吡啶基)
‑
l
‑
丙氨酸tic:(s)
‑
1,2,3,4
‑
四氢异喹啉
‑3‑
甲酸die:1,2
‑
二碘乙烷dip:1,3
‑
二碘丙烷dib:1,4
‑
二碘丁烷
m
x:n
‑
甲基化的氨基酸x
d
x:d
‑
氨基酸xc[xy],c(xy):氨基酸x至氨基酸y之间的环状化
[0076]
(肽合成)本实施例使用的全部肽的化学合成委托株式会社scrum(东京、日本),通过自动合成机syroii(biotage公司制造)实施使用9
‑
芴基甲氧羰基(fmoc基)作为α氨基的保护基的标准固相合成法。将位于c末端的侧链保护氨基酸
‑
树脂添加于合成柱,安装装置。接着,在利用fmoc基保护的下一氨基酸中,添加1
‑
[双(二甲基氨基)亚甲基]
‑
1h
‑
1,2,3
‑
三唑并[4,5
‑
b]吡啶鎓3
‑
氧化物六氟磷酸盐(hatu)/二异丙基乙基胺(diea)而使其活化,加入柱中进行反应。反应结束后进行清洗,使用20%哌啶,使fmoc基脱保护。通过反复进行该工序,使肽链伸长,使最终氨基酸的fmoc基脱保护后,从装置提取肽树脂。在肽树脂中添加30%六氟
‑
2
‑
丙醇(hfip)/二氯甲烷(dcm),从树脂切出直链的侧链保护肽,通过醚沉淀,回收侧链保护肽。通过使用sunfire c18柱(10
×
150mm)(waters公司制造)的rt
‑
hplc,纯化侧链保护肽后,冻结干燥。
[0077]
肽的环状化以非专利文献3、非专利文献6、非专利文献7记载的方法作为参考。作为示例,将序列21(lo3)的环状化示于以下。将直链的侧链保护肽溶解于dcm中,添加溶解于二甲基甲酰胺(dmf)中的1
‑
羟基苯并三唑(hoat)与乙基(二甲氨基丙基)碳二亚胺(edc)盐酸盐,使c末端羧基活化。在冰上反应1小时后,进一步在室温反应过夜,通过n末端氨基与c末端羧基间的酰胺键,使侧链保护肽环状化。利用蒸馏水洗涤3次,馏去dcm干燥后,使侧链保护基脱保护,通过醚沉淀,得到单环肽。通过使用sunfire c18柱(10
×
150mm)(waters公司制造)的rt
‑
hplc,纯化单环肽后,冻结干燥。使单环肽溶解于二甲基亚砜(dmso)中,添加至溶解于dmf中的1,4
‑
二碘丁烷(dib)、包含10mm三(2
‑
羧乙基)膦(tcep)的0.1m的nahco3和乙腈的混合液中,在80℃反应,由此通过硫醇基与卤代烷基连接基团之间的硫醚键,使肽环状化。通过使用sunfire c18柱(10
×
150mm)(waters公司制造)的rt
‑
hplc,纯化二环肽lo3后,冻结干燥。最终得到的肽的分子量使用microflex(bruker公司)进行测定,鉴定目标物。将本实施例中合成的肽的理论分子量、实测分子量、纯度、环状化类型、氨基酸序列示于表2。此外,其中,将生物素
‑
bc
‑
1、序列1~21(seq
‑
1~21)的结构式示于图10。应予说明,表2中,没有d型表述的氨基酸残基表示l型。
[0078]
(利用elisa法的竞争结合试验的构建)为了比较氨基酸替代得到的肽对ras的结合活性和krpep
‑
2d对ras的结合活性,构建图3所示的利用elisa法的竞争结合试验。以下,简单说明该elisa法。首先,对,使用10mm的mgcl2/10μm的gdp/pbs,以12.5ng/50μl/孔将ras的重组蛋白添加至96孔maxi
‑
soap板(目录号no.439454,nunc公司制造),在4℃覆盖过夜后,进一步以300μl/孔添加0.1%bsa/10mm的mgcl2/10μm的gdp/pbs,在室温封闭30分钟。利用0.1%tween20/pbs清洗板后,使用0.025%bsa/0.05%tween20/10mm的mgcl2/10μm的gdp/pbs,制备生物素
‑
krpep
‑
2d(100nm)与任意浓度的氨基酸替代肽或比较对象即krpep
‑
2d的混合液,以50μl/孔添加。在室温反应30分钟后,利用0.1%tween20/pbs清洗板。利用sa
‑
hrp(目录号no.ab7403,abcam公司制造)检测与覆盖于板的ras结合的生物素
‑
krpep
‑
2d。hrp的定量使用tmb
‑
elisa底物溶液(目录号no.34028,thermo fisher公司制造),测定吸光度450nm。生物素
‑
krpep
‑
2d与ras的结合和溶液共存的氨基酸替代肽、krpep
‑
2d与ras的结合发生竞争,因此浓度依赖性地抑制氨基酸替代肽、krpep
‑
2d。即,氨基酸替代肽、krpep
‑
2d与ras的结合活性被检测为与生物素
‑
krpep
‑
2d的结合的竞争性抑制活性。将生物素
‑
krpep
‑
2d与未覆盖ras的孔的的结合值作为抑制活性100%,生物素
‑
krpep
‑
2d与对未添加氨基酸替代肽、krpep
‑
2d的孔的的结合值作为抑制活性0%,算出氨基酸替代肽和krpep
‑
2d的50%抑制活性值。接着,将krpep
‑
2d的50%抑制活性值作为1,算出氨基酸替代肽的抑制活性值的相对值。
[0079]
该竞争试验中使用的生物素
‑
krpep
‑
2d与k
‑
ras(g12d)(目录号no.12259
‑
h07e1
‑
200,sino biological公司制造)的肽浓度依赖性结合示于图4。从在覆盖k
‑
ras(g12d)的孔中添加生物素
‑
krpep
‑
2d时得到的吸光度,减去在仅利用bsa封闭的孔中添加生物素
‑
krpep
‑
2d时得到的吸光度,估计特异性结合活性。其结果,生物素
‑
krpep
‑
2d与k
‑
ras(g12d)显示肽的添加浓度依赖性结合。另一方面,对于阴性对照的蛋白,未示出结合活性。
[0080]
(氨基酸替代肽与k
‑
ras(g12d)的结合活性的评价)将以n=4实施与k
‑
ras(g12d)的竞争结合试验的结果示于表1。在krpep
‑
2d中导入1个氨基酸替代或2个氨基酸替代而得到的肽序列大多数都显示与krpep
‑
2d同等的结合活性或比krpep
‑
2d强的结合活性,因此显示上述氨基酸替代在提高与k
‑
ras(g12d)的肽结合活性方面是有效的。
[0081]
将5位cys与15位cys各自替代为dap和asp,通过酰胺键环化得到的2d
‑
5/15
‑
dap/asp略微减弱至krpep
‑
2d的0.6倍,但是显示k
‑
ras(g12d)结合活性。
[0082]
【表1
‑
1】
[0083]
【表1
‑
2】
[0084]
(本发明肽与ras的结合活性的评价)在krpep
‑
2d中导入非天然氨基酸,进而去除连续的精氨酸序列,将通过1位
‑
11位间和4位
‑
11位间的共价键而二环化的本发明肽的代表例即生物素修饰物与生物素
‑
bc
‑
1的野生型k
‑
ras、k
‑
ras(g12d)、k
‑
ras(g12v)、k
‑
ras(g12c)、k
‑
ras(g13d)、野生型n
‑
ras、n
‑
ras(q61k)、野生型h
‑
ras、h
‑
ras(g12v)和h
‑
ras(q61l)的肽浓度依赖性结合示于图5。从在覆盖ras的孔中添加生物素
‑
bc
‑
1时得到的吸光度,减去仅利用bsa封闭的孔中添加生物素
‑
bc
‑
1时得到的吸光度,估计特异性结合活性。
[0085]
如图5所示,通过1位
‑
11位间与4位
‑
11位间的共价键而二环化的生物素修饰肽对任一ras均显示肽的添加浓度依赖性结合。另一方面,对阴性对照的蛋白,未显示结合活性。通过还原条件,将4位
‑
11位间的共价键裂解,仅通过1位
‑
11位间的共价键而形成单环的生物素修饰肽对任一ras,其结合活性均大幅减弱。
[0086]
(本发明肽对蛋白酶分解的耐性的评价)本发明肽与krpep
‑
2d相比,确认到具有对蛋白酶分解的耐性,因此在大鼠血浆中混合krpep
‑
2d或本实施例合成的肽(序列17、序列20(lo2)和序列21(lo3)),培养一定时间后,通过rp
‑
hplc的峰的有无评价肽的残留。在各10mm的肽1μl中,添加大鼠血浆20μl,在37℃培养任意的时间(0或24小时)。其后,在krpep
‑
2d中添加80%甲醇200μl,在合成肽(序列17、序列20、序列21)中添加乙腈200μl,充分混合后,在冰上静置10分钟,在4℃以15000rpm的速度离心10分钟,由此去除血浆蛋白。回收上清液,通过使用sunfire c18柱(5μm 4.6
×
150mm)的rp
‑
hplc(a液:0.1%tfa/水,b液:0.1%tfa/乙腈,以1ml/min梯度洗脱80%a液
→
10%a液20分钟),检测肽的余量。
[0087]
将其结果示于图6。如图6所示,源自krpep
‑
2d的峰在培养24小时后消失,提示序列中的某一部分受到蛋白酶分解。另一方面,源自合成肽(序列17、序列20、序列21)的峰即使在24小时后,与培养时间0小时相比,几乎维持为同等,显示具有对蛋白酶分解的耐性。
[0088]
(本发明肽对突变型k
‑
ras表达细胞的增殖抑制活性的评价)本发明肽抑制细胞内的ras的信号转导,其结果确认到抑制细胞增殖,因此以n=4进行细胞增殖试验。以下,简单说明细胞增殖试验,也可以按照非专利文献3进行。以1
×
103细胞/孔在96孔板上播种表达k
‑
ras(g12d)的a427细胞(目录号no.htb
‑
53,atcc公司制造)或panc
‑
1细胞(目录号no.crl
‑
1469,atcc公司制造),在co2培养机内在37℃培养过夜。将利用血清培养基稀释的肽(终浓度30μm)添加至孔中,培养24小时后,全部去除培养基,接着,将新的利用血清培养基稀释的肽(终浓度30μm)添加至孔中,培养24小时。总计实施3次培养的去除和添加肽的步骤后,利用celltiter
‑
glo(目录号no.g7570,promega公司制造)定量孔中的细胞数。将肽添加前的细胞数作为增殖抑制率100%,经过全部工序的未添加肽的孔内的细胞数作为增殖抑制率0%,算出任意的浓度的肽的增殖抑制活性。
[0089]
将其结果示于图7(a)和图7(b)。如图7(a)所示,实施例合成的肽(序列1~21)抑制a427细胞的增殖。另一方面,单环肽即mc1~12对a427细胞的增殖抑制活性与二环化肽相比大幅减弱。此外,如图7(b)所示,序列17的肽不仅抑制a427细胞,而且抑制表达k
‑
ras(g12d)的panc
‑
1细胞的增殖。
[0090]
(本发明肽在皮下荷瘤小鼠中的抗癌活性的评价)评价本发明肽是否在体内显示抗癌活性。以1
×
107细胞在crlj:sho
‑
prkdc
scid
hr
hr
小鼠(雌,7周龄)(日本charles river)的左腹股沟皮下移植表达k
‑
ras(g12d)的panc
‑
1细胞(目录号no.crl
‑
1469,atcc公司制造),在肿瘤体积达到约50mm3的时刻,供于试验。肿瘤体积从皮肤表面开始,利用卡尺测量肿瘤块的长径(mm)和与其正交的短径(mm),通过长径
×
短径2×
0.5的式求出,单位为mm3。将本发明肽的代表例(序列17)溶解于dmso后,利用生理食盐水稀释10倍,以40mg/kg两天一次从尾静脉给药,经日测定小鼠的体重和肿瘤体积(肽给药组:n=10,溶媒组:n=4)。应予说明,溶媒组是指移植了癌细胞且给与生理食盐水(10%dmso)的组。
[0091]
将结果示于图8。给药本发明肽的代表例(序列17)的小鼠中,源自panc
‑
1细胞的增殖的肿瘤体积的增大被显著抑制,通过student t检验算出的p值为0.005以下。另一方面,未观察到小鼠的体重减少。
[0092]
(本发明肽的原位移植模型小鼠中的抗癌活性的评价)评价本发明肽在体内是否显示抗癌活性。以2.5
×
106细胞在balb/cajcl
‑
nu/nu小鼠(雄,8周龄)(日本clare株式会社)的胰腺尾部覆膜下移植表达k
‑
ras(g12d)的panc
‑
1细胞(目录号no.crl
‑
1469,atcc公司制造),1周后,供于试验。将本发明肽的代表例(序列17)溶解于dmso后,利用生理食盐水稀释10倍,以40mg/kg两天一次从尾静脉给药(假手术组、肽给药组、溶媒组:各n=7)。应予说明,假手术组是指利用不包含癌细胞的细胞培养基实施移植手术且给药生理食盐水(10%dmso)的组,溶媒组是指移植癌细胞且给药生理食盐水(10%dmso)的组。测定从给药开始起4周后的小鼠的体重与脏器(胰腺、肝脏、肾脏)的重量。
[0093]
将其结果示于图9。给药本发明肽的代表例(序列17)的小鼠中,源自panc
‑
1细胞的增殖的胰腺的重量的增加被显著抑制,通过student t检验算出的p值为0.05以下。另一方面,肝脏、肾脏的重量未观察到显著的差异。此外,未观察到小鼠的体重减少。
[0094]
【表2
‑
1】
[0095]
【表2
‑
2】
[0096]
【表2
‑
3】
工业实用性
[0097]
本发明涉及的肽具有蛋白酶分解耐性,通过肽与ras结合,抑制ras的分子开关功
能的关/开的循环,抑制以ras为增殖驱动力的癌细胞的增殖。因此,可以认为本发明涉及的肽对表达ras的癌细胞参与的疾病,例如大肠癌、胰腺癌、肺癌等的预防、治疗是有用的。
[0098]
本发明涉及的肽不仅可使用其本身作为抗癌剂,而且也可作为与抗体、凝集素、糖链、脂质体、纳米颗粒等这类针对癌组织的运输分子组合的药效分子。此外,可将蛋白泛素化,与诱导分解的分子组合,由此也能够作为选择性分解细胞内ras的功能性分子使用。
[0099]
此外可认为:如果本发明涉及的肽与免疫检查点抑制剂、中子补充疗法等具有其它作用机制的医药品、疗法并用,则能够更强地抑制癌细胞的增殖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1