水溶性佐剂的制作方法
1.本发明涉及作为疫苗(癌疫苗或感染疫苗)的疫苗佐剂有用的化合物、其制造工艺、包含该化合物的药物组合物、以及该化合物作为疫苗(癌疫苗或感染疫苗)的疫苗佐剂的用途。
背景技术:
2.通常,癌疫苗疗法通过使用获自肿瘤抗原的蛋白或肽来活化肿瘤特异性的免疫细胞。在该疗法中,将肿瘤抗原肽用作抗原的疗法被称作癌症肽疫苗疗法。通常,仅使用肿瘤抗原肽的疗法带来低免疫原性。因此,为了诱导对抗肿瘤免疫重要的细胞毒性t淋巴细胞(ctl),疫苗佐剂被一起使用。例如,w/o乳液由于在内相中具有水相,因此可以容易地将抗原肽保持在其内相中。因此,据报道使用w/o乳液作为疫苗佐剂显示有效的ctl诱导(专利文献1)。
3.待用作肿瘤抗原肽的疫苗佐剂的w/o乳液包括稀释用乳液组合物 (专利文献1)、以及不完全弗氏佐剂(ifa)和montanide
tm (非专利文献1和2)。此外,还已知通过将灭活的结核分枝杆菌添加至w/o乳液而制备的完全弗氏佐剂(cfa)。但是,cfa由于其毒性因而尚未被允许用于人体(非专利文献2)。
4.以往,通过将灭活的菌体本身添加至如cfa的佐剂中而制备的佐剂组合物已被用于增强目标活性,但最近已开发出包含作用机制已知的化合物的疫苗佐剂。其中,据报道toll样受体7(tlr7)激活th1细胞而增强抗肿瘤活性所需的细胞免疫(非专利文献3)。关于tlr7,已知一些小分子作为配体起作用,并且已经报道了市售的咪喹莫特以及具有嘧啶结构的化合物作为tlr7激动剂起作用(专利文献2)。
5.已经进行了一些尝试来改善tlr7激动剂以发现具有适于佐剂的物理性质的新化合物。例如,据报道具有缀合的磷酸基结构的tlr7激动剂与不溶性金属颗粒如明矾佐剂结合(专利文献3、非专利文献4和5)。
现有技术
6.专利文献专利文献1:wo 2006/078059专利文献2:wo2009/067081专利文献3:wo2012/031140非专利文献非专利文献1:j immunother cancer.2016 sep 20; 4: 56非专利文献2:semin immunol.2010 jun; 22(3): 155-61.非专利文献3:vaccine.2011 apr 12; 29(17): 3341-55.非专利文献4:sci transl med.2014 nov 19; 6(263): 263ra160非专利文献5:j. med.chem., 2016, 59 (12), pp 5868-5878。
技术实现要素:
7.技术问题本发明的目的可以是提供用于增强佐剂活性的缀合的tlr7激动剂。
8.问题的解决方案本发明人进行了深入研究以发现用于增强佐剂活性的tlr7激动剂,然后发现通过将具有嘧啶结构的tlr7激动剂与聚乙二醇(peg)缀合而添加了水溶性的tlr7激动剂具有优异的佐剂活性。基于该发现,完成了本发明。根据本发明,提供下述式(1)的嘧啶衍生物(以下,也称作“本发明化合物”)。
9.本发明如下所述。
10.(项目1)式(1)的化合物:或其制药学上可接受的盐,其中x为亚甲基、氧原子、硫原子、so、so2或nr5,其中r5为氢原子或c
1-6
烷基,r1为可被1~5个取代基取代的c
1-6
烷基,该取代基独立地选自卤素、羟基和c
1-6
烷氧基,r2和r3独立地为氢原子或可被1~5个取代基取代的c
1-6
烷基,该取代基独立地选自卤素、羟基和c
1-6
烷氧基,r4为氢原子、卤素、羟基、c
1-6
烷基(其可被1~3个相同或不同的卤素取代)、c
1-6
烷氧基(其可被1~3个相同或不同的卤素取代)或氰基,l为连接基,和y1为-(ch2ch2o)
m-r6,其中r6为氢原子或c
1-6
烷基,且m为3~100的整数。
11.(项目2)根据项目1所述的化合物或其制药学上可接受的盐,其中 x为亚甲基。
12.(项目3)根据项目1或2所述的化合物或其制药学上可接受的盐,其中r1为可被1~3个相同或不同的卤素取代的c
1-3
烷基。
13.(项目4)根据项目3所述的化合物或其制药学上可接受的盐,其中r1为甲基。
14.(项目5)根据项目1~4中任一项所述的化合物或其制药学上可接受的盐,其中r4为氢原
子、羟基、c
1-3
烷基或c
1-3
烷氧基。
15.(项目6)根据项目5所述的化合物或其制药学上可接受的盐,其中r4为氢原子、羟基或甲氧基。
16.(项目7)根据项目1~6中任一项所述的化合物或其制药学上可接受的盐,其中r2为c
1-6
烷基。
17.(项目8)根据项目1~7中任一项所述的化合物或其制药学上可接受的盐,其中r3为氢原子或可被1~3个羟基取代的c
1-3
烷基。
18.(项目9)根据项目1~8中任一项所述的化合物或其制药学上可接受的盐,其中l为-o-、-nr
y-、-c(o)-、-c(o)o-、-oc(o)-、-c(o)nr
y-、-nryc(o)-、-ch2nr
y-、-ch2o-、-oc(o)o-、-nr7c(o)o-、-oc(o)nr
y-、-nr7c(o)nr
y-、-oc(s)nr
y-或-nr7c(s)nr
y-,其中r7为氢原子或c
1-6
烷基,且ry为氢原子、c
1-6
烷基或y2;其中y2为
ꢀ‑
(ch2ch2o)
n-r8,其中r8为氢原子或c
1-6
烷基,且n为3~100的整数。
19.(项目10)根据项目9所述的化合物或其制药学上可接受的盐,其中l为-c(o)nr
y-、-ch2nr
y-、-c(o)o-或-ch2o-。
20.(项目11)根据项目9所述的化合物或其制药学上可接受的盐,其中 l为-c(o)nr
y-或-ch2nr
y-。
21.(项目12)根据项目9所述的化合物或其制药学上可接受的盐,其中l为-ch2nr
y-,和ry为氢原子、c
1-6
烷基或y2。
22.(项目13)根据项目9所述的化合物或其制药学上可接受的盐,其中l为-ch2nr
y-,和ry为氢原子或c
1-6
烷基。
23.(项目14)根据项目1~13中任一项所述的化合物或其制药学上可接受的盐,其中y1为-(ch2ch2o)
m-r6,r6为氢原子或c
1-6
烷基,和m为3~40的整数。
24.(项目15)根据项目14所述的化合物或其制药学上可接受的盐,其中y1为-(ch2ch2o)
m-r6,r6为氢原子或c
1-6
烷基,和
m为3~20的整数。
25.(项目16)根据项目1所述的化合物或其制药学上可接受的盐,其中所述化合物为式(2)的化合物:或式(3)的化合物:其中r2为c
1-6
烷基,r3为氢原子或可被1~3个羟基取代的c
1-3
烷基,r4为氢原子、羟基或甲氧基,l为-ch2nr
y-、-c(o)nr
y-、-c(o)o-或-ch2o-,ry为氢原子、c
1-6
烷基或y2,y1为-(ch2ch2o)
m-r6,y2为-(ch2ch2o)
n-r8,r6为氢原子或c
1-6
烷基,r8为氢原子或c
1-6
烷基,和m和n独立地为3~40的整数。
26.(项目17)根据项目1所述的化合物或其制药学上可接受的盐,其中所述化合物为式(2)的化合物:
或式(3)的化合物:其中r2为c
1-6
烷基,r3为氢原子或可被1~3个羟基取代的c
1-3
烷基,r4为氢原子、羟基或甲氧基,l为-ch2nr
y-,ry为氢原子或c
1-6
烷基,y1为-(ch2ch2o)
m-r6,r6为氢原子或c
1-6
烷基,和m为3~20的整数。
27.(项目18)根据项目1所述的化合物或其制药学上可接受的盐,其中所述化合物为式(2)的化合物:其中r2为c
1-6
烷基,
甲氧基苯基}-2-甲基-5,8,11,14-四氧杂-2-氮杂十六烷-16-醇 (实施例2)、1-(3-{[2-氨基-4-甲基-6-(戊基氨基)嘧啶-5-基]甲基}-4-甲氧基苯基)-2-甲基-5,8,11,14-四氧杂-2-氮杂十六烷-16-醇 (实施例3)、和1-(3-{[2-氨基-4-甲基-6-(戊基氨基)嘧啶-5-基]甲基}-4-羟基苯基)-2-甲基-5,8,11,14-四氧杂-2-氮杂十六烷-16-醇 (实施例4)。
[0030]
(项目21)药物组合物,其包含项目1~20中任一项所述的化合物或其制药学上可接受的盐。
[0031]
(项目22)根据项目21所述的药物组合物,其为乳液制剂、油基悬浮液、水凝胶制剂或脂质制剂。
[0032]
(项目23)根据项目21所述的药物组合物,其为乳液制剂。
[0033]
(项目24)根据项目23所述的药物组合物,其中所述乳液制剂为油包水型乳液。
[0034]
(项目25)根据项目24所述的药物组合物,其中所述乳液制剂包含:(1) 油酸乙酯、肉豆蔻酸辛基十二烷基酯、失水山梨醇单油酸酯、甘油单油酸酯、聚氧乙烯氢化蓖麻油20、甘油和磷酸二氢钠,或(2) montanide isa 51vg。
[0035]
(项目26)根据项目21所述的药物组合物,其为脂质制剂。
[0036]
(项目27)根据项目26所述的药物组合物,其中所述脂质制剂是包含磷脂的脂质体制剂。
[0037]
(项目28)根据项目26或27所述的药物组合物,其中所述脂质制剂为包含甾醇的脂质体制剂。
[0038]
(项目29)根据项目28所述的药物组合物,其中其中所述甾醇为胆固醇。
[0039]
(项目30)根据项目27~29中任一项所述的药物组合物,其中所述脂质体制剂包含至少一种添加剂,该添加剂选自无机酸、无机酸盐、有机酸、有机酸盐、糖、缓冲剂、抗氧化剂和聚合物。
[0040]
(项目31)根据项目21~30中任一项所述的药物组合物,其进一步包含抗原。
[0041]
(项目32)根据项目31所述的药物组合物,其中所述抗原为来自病原体的抗原或肿瘤抗原。
[0042]
(项目33)根据项目31所述的药物组合物,其中所述抗原为肿瘤抗原。
[0043]
(项目34)根据项目33所述的药物组合物,其中所述肿瘤抗原为肿瘤抗原肽。
[0044]
(项目35)根据项目34所述的药物组合物,其中所述肿瘤抗原肽包含选自下述氨基酸序列中的至少一种肽或其制药学上可接受的盐:rmfpnapyl (seq id no: 1)、allpavpsl (seq id no: 8)、slgeqqysv (seq id no: 9)、rvpgvaptl (seq id no: 10)、vldfappga (seq id no: 4)、cmtwnqmnl (seq id no: 11)、cytwnqmnl (seq id no: 2)、tyagclsqif (seq id no: 18)、式(4):其中c-c间的键为二硫键,和式(5):其中c-c间的键为二硫键;以及选自下述氨基酸序列中的至少一种肽或其制药学上可接受的盐:wapvldfappgasaygsl (seq id no: 3)、cwapvldfappgasaygsl (seq id no: 12)、wapvldfappgasaygslc (seq id no: 13)、cnkryfklshlqmhsrkhtg (seq id no: 14)、cnkryfklshlqmhsrkh (seq id no: 15)、cnkryfklshlqmhsrk (seq id no: 16)、和kryfklshlqmhsrkh (seq id no: 17)。
[0045]
(项目36)根据项目34所述的药物组合物,其中所述肿瘤抗原肽包含选自下述氨基酸序列中的至少一种肽或其制药学上可接受的盐:rmfpnapyl (seq id no: 1)、allpavpsl (seq id no: 8)、slgeqqysv (seq id no: 9)、rvpgvaptl (seq id no: 10)、vldfappga (seq id no: 4)、cmtwnqmnl (seq id no: 11)、
cytwnqmnl (seq id no: 2)、和式(4):其中c-c间的键为二硫键,和选自下述氨基酸序列中的至少一种肽或其制药学上可接受的盐:wapvldfappgasaygsl (seq id no: 3)、cwapvldfappgasaygsl (seq id no: 12)、wapvldfappgasaygslc (seq id no: 13)、cnkryfklshlqmhsrkhtg (seq id no: 14)、cnkryfklshlqmhsrkh (seq id no: 15)、cnkryfklshlqmhsrk (seq id no: 16)、和kryfklshlqmhsrkh (seq id no: 17)。
[0046]
(项目37)根据项目34所述的药物组合物,其中所述肿瘤抗原肽为式(4):的氨基酸序列所示的肽或其制药学上可接受的盐、与seq id no: 3: wapvldfappgasaygsl的氨基酸序列所示的肽或其制药学上可接受的盐的组合;其中c-c之间的键为二硫键。
[0047]
(项目38)疫苗佐剂,其包含项目1~20中任一项所述的化合物或其制药学上可接受的盐。
[0048]
(项目39)根据项目38所述的疫苗佐剂,其为癌疫苗的疫苗佐剂。
[0049]
(项目40)根据项目1~20中任一项所述的化合物或其制药学上可接受的盐,其用作疫苗佐剂。
[0050]
(项目41)根据项目1~20中任一项所述的化合物或其制药学上可接受的盐,其用作癌疫苗的疫苗佐剂。
[0051]
(项目42)ctl诱导剂,其包含项目1~20中任一项所述的化合物或其制药学上可接受的盐。
[0052]
(项目43)免疫刺激剂,其包含项目1~20中任一项所述的化合物或其制药学上可接受的盐。
[0053]
(项目44)诱导哺乳动物中的ctl的方法,其包括对哺乳动物给予项目1~20中任一项所述的
化合物或其制药学上可接受的盐。
[0054]
(项目45)增强哺乳动物中的ctl诱导的方法,其包括对哺乳动物给予项目1~20中任一项所述的化合物或其制药学上可接受的盐。
[0055]
(项目46)增强哺乳动物中的对抗原的特异性免疫应答的方法,其包括对哺乳动物给予项目1~20中任一项所述的化合物或其制药学上可接受的盐。
[0056]
(项目47)项目1~20中任一项所述的化合物或其制药学上可接受的盐在制备疫苗佐剂中的用途。
[0057]
(项目48)项目1~20中任一项所述的化合物或其制药学上可接受的盐在制备癌疫苗的疫苗佐剂中的用途。
[0058]
(项目49)试剂盒,其包含:a) 项目1~20中任一项所述的化合物或其制药学上可接受的盐,或者包含项目1~20中任一项所述的化合物其制药学上可接受的盐的药物组合物;和b) 抗原或包含抗原的药物组合物。
[0059]
(项目50)试剂盒,其包含:a) 项目1所述的化合物或其制药学上可接受的盐,或包含项目1所述的化合物或其制药学上可接受的盐的药物组合物;和b) 肿瘤抗原或包含肿瘤抗原的药物组合物。
[0060]
(项目51)试剂盒,其包含:a) 项目1所述的化合物或其制药学上可接受的盐,或包含项目1所述的化合物或其制药学上可接受的盐的药物组合物;和b) 来自病原体的抗原或包含来自病原体的抗原的药物组合物。
[0061]
附图简述图1示出试验3的结果,即,通过将式4的化合物和肽seq id no: 3与montanide isa 51 vg混合而制备鸡尾酒疫苗,将实施例1或参考例12中制备的化合物添加至该鸡尾酒疫苗而制备疫苗,并且用hla-a
*
24:02转基因小鼠在ifnγ elispot测定中试验该制备的疫苗对seq id no: 2的体内ctl诱导。结果示于图1。
[0062]
图2示出试验5的结果,即,通过将实施例1中制备的化合物添加至包含式4的化合物和肽seq id no: 3与montanide isa 51 vg的鸡尾酒疫苗中而制备疫苗,将该疫苗对小鼠给药;在mca-a24/kb-wt1肿瘤细胞对hla-a
*
24:02转基因小鼠的肿瘤移植7天前和移植7天后,将该疫苗对小鼠给药;并在移植27天后测量肿瘤体积。结果示于图2。
[0063]
图3示出试验6的结果,即,通过将实施例1中制备的化合物添加至包含肽seq id no: 6和montanide isa 51 vg的疫苗中而制备疫苗;并且用hla-a
*
02:01转基因小鼠通过
ifnγ elispot测定试验该疫苗对seq id no: 6的体内ctl诱导。结果示于图3。
[0064]
图4示出试验7的结果,即,通过将实施例1中制备的化合物添加至包含肽seq id no: 5和montanide isa 51 vg的疫苗中而制备疫苗;并且用hla-a
*
02:01转基因小鼠通过ifnγ elispot测定试验该疫苗对seq id no: 5的体内ctl诱导。结果示于图4。
[0065]
图5示出试验8的结果,即,通过将实施例1中制备的化合物添加至包含肽seq id no: 18和montanide isa 51 vg的疫苗而制备疫苗;并且用hla-a
*
24:02转基因小鼠通过ifnγ elispot测定试验该疫苗对seq id no: 18的体内ctl诱导。结果示于图5。
[0066]
图6示出试验9的结果,即,通过将实施例8、9或10中制备的化合物或参考例12中制备的化合物添加至包含式4的化合物和肽seq id no: 3与montanide isa 51 vg的鸡尾酒疫苗中而制备疫苗;并且用hla-a
*
02:01转基因小鼠通过ifnγ elispot测定试验各疫苗对seq id no: 1的体内ctl诱导。结果示于图6。
[0067]
图7示出试验9的结果,即,通过将实施例8、9或10中制备的化合物或参考例12中制备的化合物添加至包含式4的化合物和肽seq id no: 3与montanide isa 51 vg的鸡尾酒疫苗中而制备疫苗;并且用hla-a
*
02:01转基因小鼠通过ifnγ elispot测定试验各疫苗对seq id no: 4的体内ctl诱导。结果示于图7。
[0068]
图8示出试验10的结果,即,通过将实施例11中制备的化合物添加至包含式4的化合物和肽seq id no: 3与montanide isa 51 vg的鸡尾酒疫苗中而制备疫苗;并且用hla-a
*
02:01转基因小鼠通过ifnγ elispot测定试验该疫苗对seq id no: 1的体内ctl诱导。结果示于图8。
[0069]
图9示出试验10的结果,即,通过将实施例11中制备的化合物添加至包含式4的化合物和肽seq id no: 3与montanide isa 51 vg的鸡尾酒疫苗中而制备疫苗;并且用hla-a
*
02:01转基因小鼠通过ifnγ elispot测定试验该疫苗对seq id no: 4的体内ctl诱导。结果示于图9。
[0070]
图10示出试验11的结果,即,通过将实施例1中制备的化合物添加至包含式4的化合物和肽seq id no: 3的鸡尾酒疫苗(乳化组合物1)中而制备疫苗;并且用hla-a
*
02:01转基因小鼠通过ifnγ elispot测定试验该疫苗对seq id no: 1的体内ctl诱导。结果示于图10。
[0071]
图11示出试验11的结果,即,通过将实施例1中制备的化合物添加至包含式4的化合物和肽seq id no: 3的鸡尾酒疫苗(乳化组合物1)中而制备疫苗;并且用hla-a
*
02:01转基因小鼠通过ifnγ elispot测定试验该疫苗对seq id no: 4的体内ctl诱导。结果示于图11。
[0072]
图12示出试验12的结果,即,通过将实施例1中制备的化合物添加至包含式4的化合物和肽seq id no: 3的鸡尾酒疫苗(乳化组合物2)中而制备疫苗;并且用hla-a
*
02:01转基因小鼠通过ifnγ elispot测定试验该疫苗对seq id no: 1的体内ctl诱导。结果示于图12。
[0073]
图13示出试验12的结果,即,通过将实施例1中制备的化合物添加至包含式4的化合物和肽seq id no: 3的鸡尾酒疫苗(乳化组合物2)中而制备疫苗;并且用hla-a
*
02:01转基因小鼠通过ifnγ elispot测定试验该疫苗对seq id no: 4的体内ctl诱导。结果示于图13。
[0074]
图14示出试验13的结果,即,通过将实施例1中制备的化合物添加至包含式4的化合物和肽seq id no: 3的鸡尾酒疫苗(乳化组合物3)中而制备疫苗;并且用hla-a
*
02:01转基因小鼠通过ifnγ elispot测定试验该疫苗对seq id no: 1的体内ctl诱导。结果示于图14。
[0075]
图15示出试验14的结果,即,通过将实施例1中制备的化合物添加至包含式4的化合物和肽seq id no: 3的鸡尾酒疫苗(油悬浮液制剂)中而制备疫苗;并且用hla-a
*
02:01转基因小鼠通过ifnγ elispot测定试验该疫苗对seq id no: 1的体内ctl诱导。结果示于图15。
[0076]
图16示出试验14的结果,即,通过将实施例1中制备的化合物添加至包含式4的化合物和肽seq id no: 3的鸡尾酒疫苗(油悬浮液制剂)中而制备疫苗;并且用hla-a
*
02:01转基因小鼠通过ifnγ elispot测定试验该疫苗对seq id no: 4的体内ctl诱导。结果示于图16。
[0077]
图17示出试验15的结果,即,通过将实施例1中制备的化合物添加至包含式4的化合物和肽seq id no: 3的鸡尾酒疫苗(水凝胶制剂)中而制备疫苗;并且用hla-a
*
02:01转基因小鼠通过ifnγ elispot测定试验该疫苗对seq id no: 1的体内ctl诱导。结果示于图17。
[0078]
图18示出试验15的结果,即,通过将实施例1中制备的化合物添加至包含式4的化合物和肽seq id no: 3的鸡尾酒疫苗(水凝胶制剂)中而制备疫苗;并且用hla-a
*
02:01转基因小鼠通过ifnγ elispot测定试验该疫苗对seq id no: 4的体内ctl诱导。结果示于图18。
[0079]
图19示出试验16的结果,即,通过将实施例1中制备的化合物添加至包含式4的化合物和肽seq id no: 3的鸡尾酒疫苗(脂质体制剂1)中而制备疫苗;并且用hla-a
*
02:01转基因小鼠通过ifnγ elispot测定试验该疫苗对seq id no: 1的体内ctl诱导。结果示于图19。
[0080]
图20示出试验17的结果,即,通过将实施例1中制备的化合物添加至包含式4的化合物和肽seq id no: 3的鸡尾酒疫苗(脂质体制剂2)中而制备疫苗;并且用hla-a
*
02:01转基因小鼠通过ifnγ elispot测定试验该疫苗对seq id no: 1的体内ctl诱导。结果示于图20。
[0081]
图21示出试验17的结果,即,通过将实施例1中制备的化合物添加至包含式4的化合物和肽seq id no: 3的鸡尾酒疫苗(脂质体制剂2)中而制备疫苗;并且用hla-a
*
02:01转基因小鼠通过ifnγ elispot测定试验该疫苗对seq id no: 4的体内ctl诱导。结果示于图21。
[0082]
图22示出试验18的结果,即,通过将实施例1中制备的化合物添加至包含式4的化合物和肽seq id no: 3的鸡尾酒疫苗(脂质体制剂3)中而制备疫苗;并且用hla-a
*
02:01转基因小鼠通过ifnγ elispot测定试验该疫苗对seq id no: 1的体内ctl诱导。结果示于图22。
[0083]
图23示出试验19的结果,即,通过将实施例1中制备的化合物添加至包含肽seq id no: 1和肽seq id no: 17与预乳化组合物的鸡尾酒疫苗中而制备疫苗;并且用hla-a
*
02:01/hla-drb1
*
01:01转基因小鼠通过ifnγ elispot测定试验该疫苗对seq id no: 1的体
内ctl诱导。结果示于图23。
[0084]
图24示出试验19的结果,即,通过将实施例1中制备的化合物添加至包含肽seq id no: 1和肽seq id no: 17与预乳化组合物的鸡尾酒疫苗中而制备疫苗;并且用hla-a
*
02:01/hla-drb1
*
01:01转基因小鼠通过ifnγ elispot测定试验该疫苗对seq id no: 17的体内辅助性t细胞诱导。结果示于图24。
[0085]
图25示出试验20的结果,即,通过将实施例1中制备的化合物添加至包含式5的化合物和预乳化组合物的疫苗中而制备疫苗;并且用hla-a
*
24:02转基因小鼠通过ifnγ elispot测定试验该疫苗对seq id no: 2的体内ctl诱导。结果示于图25。
[0086]
图26示出试验11~13的结果,即,将包含式4的化合物和肽seq id no: 3的组合物乳化以制备鸡尾酒疫苗;将实施例1中制备的化合物添加至该鸡尾酒疫苗而制备疫苗;将该疫苗对小鼠给药;并且对小鼠的脾脏进行称重。结果示于图26。
[0087]
图27示出试验14和15的结果,即,将包含式4的化合物和肽seq id no: 3的组合物进行油基悬浮化或水凝胶制剂化以制备各鸡尾酒疫苗;将实施例1中制备的化合物添加至该鸡尾酒疫苗以制备各疫苗;将该疫苗对小鼠给药;并且对小鼠的脾脏进行称重。结果示于图27。
[0088]
图28示出试验16~18的结果,即,将包含式4的化合物和肽seq id no: 3的组合物进行脂质体制剂化以制备鸡尾酒疫苗;将实施例1中制备的化合物添加至该鸡尾酒疫苗而制备疫苗;将该疫苗对小鼠给药;并且对小鼠的脾脏进行称重。结果示于图28。
具体实施方式
[0089]
以下,本文中使用的术语说明如下。
[0090]
定义于“任选取代的”或“取代的”之后的取代基的数目只要其能够被取代则不应被限制。除非另有说明,否则各取代基的定义还延伸至部分包括该取代基的情况或该取代基存在于其它取代基之上的情况。
[0091]
本文中使用的“卤素”包括例如氟、氯、溴和碘。优选为氟或氯,更优选为氟。
[0092]“c
1-6
烷基”意指具有1-6个碳原子的直链或支链饱和烃基。c
1-6
烷基优选包括“c
1-4
烷基”,更优选包括“c
1-3
烷基”。“c
1-6
烷基”包括例如甲基、乙基、丙基、1-甲基乙基、丁基、2-甲基丙基、1-甲基丙基、1,1-二甲基乙基、戊基、3-甲基丁基、2-甲基丁基、2,2-二甲基丙基、1-乙基丙基、1,1-二甲基丙基、己基、4-甲基戊基、3-甲基戊基、2-甲基戊基、和1-甲基戊基,“c
1-4
烷基”包括“c
1-6
烷基”的实例,条件是碳原子数为1~4。“c
1-3
烷基”包括“c
1-6
烷基”的实例,条件是碳原子数为1~3。
[0093]“c
1-6
烷氧基”意指“c
1-6
烷基氧基”,并且该“c
1-6
烷基”部分如所述“c
1-6
烷基”中所定义。“c
1-6
烷氧基”优选包括“c
1-4
烷氧基”,更优选包括“c
1-3
烷氧基”。“c
1-6
烷氧基”包括例如甲氧基、乙氧基、丙氧基、1-甲基乙氧基、丁氧基、2-甲基丙氧基、1-甲基丙氧基、1,1-二甲基乙氧基、苯基氧基、3-甲基丁氧基、2-甲基丁氧基、2,2-二甲基丙氧基、1-乙基丙氧基、1,1-二甲基丙氧基、己基氧基、4-甲基苯基氧基、3-甲基苯基氧基、2-甲基苯基氧基、1-甲基苯基氧基、3,3-二甲基丁氧基、2,2-二甲基丁氧基、1,1-二甲基丁氧基、和1,2-二甲基丁氧基,“c
1-4
烷氧基”包括“c
1-6
烷氧基”的实例,条件是碳原子数为1~4。“c
1-3
烷氧基”包括“c
1-6
烷氧基”的实例,条件是碳原子数为1~3。
[0094]“连接基”意指在官能团中具有两个结合位点的二价基团。二价基团包括例如c
1-6
亚烷基、c
2-7
亚烯基、c
2-7
亚炔基、c
3-10
亚环烷基、c
6-10
亚芳基、c
5-10
亚杂芳基、醚、胺、羰基、酯、酰胺基、碳酸酯、氨基甲酸酯、硫代氨基甲酸酯和硫脲。并且,通过将这些例示的二价基团任选组合而制备的二价基团也可以用于本文中。连接基优选包括-o-、-nr
y-、-c(o)-、-c(o)o-、-oc(o)-、-c(o)nr
y-、-nryc(o)-、-ch2nr
y-、-ch2o-、-oc(o)o-、-nr7c(o)o-、-oc(o)nr
y-、-nr7c(o)nr
y-、-oc(s)nr
y-和-nr7c(s)nr
y-,其中ry和r7如项目9中所定义,并且更优选包括-c(o)nr
y-和-ch2nr
y-,进一步更优选包括-ch2nr
y-。对于这些例示的连接基中的两个键合位点,左边的键合位点与式(1)的化合物中的苯环连接,右边的键合位点与式(1)的化合物中的y1连接。具体地,当连接基l为
“‑
ch2nry‑”
时,式(1)的化合物由下述结构表示。
[0095]“c
1-6
亚烷基”意指具有1-6个碳原子的直链或支链饱和烃基。“c
1-6
亚烷基”包括例如:亚甲基、亚乙基、亚丙基、1-甲基亚乙基、亚丁基、2-甲基亚丙基、1-甲基亚丙基、1,1-二甲基亚乙基、亚戊基、3-甲基亚丁基、2-甲基亚丁基、2,2-二甲基亚丙基、1-乙基亚丙基、1,1-二甲基亚丙基、亚己基、4-甲基亚戊基和3-甲基亚戊基;并且优选包括亚甲基和亚乙基。
[0096]“c
2-7
亚烯基”意指具有2-7个碳原子和1-3个双键的直链或支链不饱和烃基。“c
2-7
亚烯基”包括例如,亚乙烯基、亚丙烯基、甲基亚丙烯基、亚丁烯基、甲基亚丁烯基、亚戊烯基、亚己烯基和亚庚烯基,优选包括亚乙烯基和亚丙烯基。
[0097]“c
2-7
亚炔基”意指具有2-7个碳原子和一个三键的直链或支链不饱和烃基。“c
2-7
亚炔基”包括例如,亚乙炔基、亚丙炔基、甲基亚丙炔基、亚丁炔基、甲基亚丁炔基、亚戊炔基、亚己炔基和亚庚炔基,优选包括亚乙炔基和亚丙炔基。
[0098]“c
3-10
亚环烷基”意指具有3-10个碳原子的环状亚烷基,其可具有桥接结构。“c
3-10
亚环烷基”包括例如,亚环丙基、亚环丁基、亚环戊基、亚环己基、亚环庚基、亚环辛基和亚金刚烷基,优选包括亚环丙基和亚环丁基。
[0099]“c
6-10
亚芳基”意指具有6-10个碳原子的芳香族烃基。“c
6-10
亚芳基”包括例如,亚苯基、1-亚萘基和2-亚萘基,优选包括亚苯基。
[0100]“c
5-10
亚杂芳基”意指具有选自氮原子、氧原子和硫原子中的1-4个原子的单环状5~7元芳香族杂环或双环状8~10元芳香族杂环。“c
5-10
亚杂芳基”包括例如,亚吡啶基、亚哒嗪基、亚异噻唑基、亚吡咯基、亚呋喃基、亚噻吩基、亚噻唑基、亚咪唑基、亚嘧啶基、亚噻二唑基、亚吡唑基、亚噁唑基、亚异噁唑基、亚吡嗪基、亚三嗪基、亚三唑基、亚咪唑烷基、亚噁二唑基、亚三唑基、亚四唑基、亚吲哚基、亚吲唑基、亚喹啉基、亚异喹啉基、亚苯并呋喃基、亚苯并噻吩基、亚苯并噁唑基、亚苯并噻唑基、亚苯并异噁唑基、亚苯并异噻唑基、亚苯并三
唑基、亚苯并咪唑基和亚6,11-二氢二苯并[b,e]噻吩基。优选地,其包括亚吡啶基、亚嘧啶基、亚喹啉基和亚异喹啉基,更优选亚吡啶基、亚呋喃基和亚噻吩基。
[0101]
在式 (1)的本发明的化合物中,优选为x、y1、y2、r1、r2、r3、r4、r5、r6、r7、r8、ry、l、m和n如下所述,但本发明的技术范围并不限于以下列举的化合物的范围。
[0102]
x优选包括亚甲基、氧原子和nr5,其中r5为氢原子或c
1-6
烷基,且更优选亚甲基。
[0103]
y1包括-(ch2ch2o)
m-r6。
[0104]
y2包括-(ch2ch2o)
n-r8。
[0105]
r1优选包括可被1~3个相同或不同的卤素取代的c
1-6
烷基。更优选地,其包括c
1-6
烷基如甲基、乙基、丙基、1-甲基乙基、丁基、2-甲基丙基、1-甲基丙基和1,1-二甲基乙基,进一步更优选甲基。
[0106]
r2优选包括:(1) 氢原子,和(2) 可被独立地选自卤素和羟基中的1~3个取代基取代的c
1-6
烷基。更优选地,其包括氢原子和c
1-6
烷基,进一步优选c
1-6
烷基,进一步更优选c
3-4
烷基。
[0107]
r3优选包括:(1) 氢原子,和(2) 可被独立地选自卤素和羟基中的1~3个取代基取代的c
1-6
烷基。
[0108]
r3更优选包括(1) 氢原子,和(2) 可被1~3个羟基取代的c
1-3
烷基。
[0109]
r3进一步更优选包括(1) 氢原子,和(2) 可被1个羟基取代的c
1-3
烷基。
[0110]
r3进一步更优选包括(1) 氢原子,和(2) 可被1个羟基取代的c
1-2
烷基。
[0111]
r4优选包括:(1) 氢原子、(2) 卤素、(3) 羟基、(4) 可被1~3个相同或不同的卤素取代的c
1-6
烷基、(5) 可被1~3个相同或不同的卤素取代的c
1-6
烷氧基、和(6) 氰基。
[0112]
r4更优选包括(1) 氢原子、(2) 卤素、(3) 羟基、(4) 可被1~3个相同或不同的卤素取代的c
1-6
烷基、和(5) 可被1~3个相同或不同的卤素取代的c
1-6
烷氧基。
[0113]
r4进一步更优选包括氢原子、羟基、c
1-3
烷基和c
1-3
烷氧基。
[0114]
r4进一步更优选包括氢原子、羟基和甲氧基,进一步更优选羟基和甲氧基,最优选氢原子和甲氧基。
[0115]
r5优选包括氢原子和c
1-3
烷基。更优选地,其包括氢原子、甲基、乙基和丙基。
[0116]
r6和r8优选独立地包括氢原子和c
1-3
烷基,更优选独立地包括氢原子、甲基、乙基和丙基,进一步更优选包括氢原子和甲基。
[0117]
r7优选包括氢原子和c
1-3
烷基。更优选地,其包括氢原子、甲基、乙基和丙基。
[0118]
l优选包括:(1)
ꢀ‑
o-、(2)
ꢀ‑
nr
y-、(3)
ꢀ‑
c(o)-、(4)
ꢀ‑
c(o)o-、(5)
ꢀ‑
oc(o)-、(6)
ꢀ‑
c(o)nr
y-、(7)
ꢀ‑
nryc(o)-、(8)
ꢀ‑
ch2nr
y-、(9)
ꢀ‑
ch2o-、(10)
ꢀ‑
oc(o)o-、(11)
ꢀ‑
nr7c(o)o-、(12)
ꢀ‑
oc(o)nr
y-、(13)
ꢀ‑
nr7c(o)nr
y-、(14)
ꢀ‑
oc(s)nr
y-、和(15)
ꢀ‑
nr7c(s)nr
y-。
[0119]
l更优选包括:(1)
ꢀ‑
o-、(2)
ꢀ‑
nr
y-、(3)
ꢀ‑
c(o)-、(4)
ꢀ‑
c(o)o-、(5)
ꢀ‑
oc(o)-、(6)
ꢀ‑
c(o)nr
y-、(7)
ꢀ‑
nryc(o)-、(8)
ꢀ‑
ch2nr
y-、和(9)
ꢀ‑
ch2o-。
[0120]
l进一步更优选包括(1)
ꢀ‑
c(o)nr
y-、(2)
ꢀ‑
ch2nr
y-、(3)
ꢀ‑
c(o)o-、和(4)
ꢀ‑
ch2o-。
[0121]
l进一步更优选包括
(1)
ꢀ‑
c(o)nr
y-、和(2)
ꢀ‑
ch2nr
y-。
[0122]
l最优选包括-ch2nr
y-。
[0123]
苯环上的x、l和r4的取代位置可优选为下述(1a)或(1aa)。
[0124]ry
优选包括氢原子、c
1-6
烷基和y2,更优选包括氢原子和c
1-6
烷基,进一步更优选包括氢原子、甲基、乙基和丙基。
[0125]
在另一个实施方案中,ry优选包括氢原子、c
1-6
烷基和y2,更优选包括氢原子、甲基和y2。
[0126]
m和n优选独立地包括3~40的整数,更优选包括4~40的整数,进一步更优选包括4~36的整数。
[0127]
在另一个实施方案中,m和n独立地包括3~40的整数,优选包括3~20的整数,更优选包括5~20的整数。
[0128]
优选的式(1)的化合物包括下述化合物或其制药学上可接受的盐。
[0129]
在优选的实施方案中,式 (1)的本发明的化合物包括下述(a)。
[0130]
(a)式(1)的化合物或其制药学上可接受的盐,其中x为亚甲基、氧原子、硫原子、so、so2或nr5,r1为可被1~5个取代基取代的c
1-6
烷基,该取代基独立地选自卤素、羟基和c
1-6
烷氧基,r2和r3独立地为(1) 氢原子、或(2) 可被1~5个取代基取代的c
1-6
烷基,该取代基独立地选自卤素、羟基和c
1-6
烷氧基,r4为(1) 氢原子、(2) 卤素、(3) 羟基、(4) 可被1~3个相同或不同的卤素取代的c
1-6
烷基、(5) 可被1~3个相同或不同的卤素取代的c
1-6
烷氧基、或(6) 氰基,r5为
(1) 氢原子、或(2) c
1-6
烷基、r6和r8独立地为(1) 氢原子、或(2) c
1-6
烷基,r7为(1) 氢原子、或(2) c
1-6
烷基、l为(1)
ꢀ‑
o-、(2)
ꢀ‑
nr
y-、(3)
ꢀ‑
c(o)-、(4)
ꢀ‑
c(o)o-、(5)
ꢀ‑
oc(o)-、(6)
ꢀ‑
c(o)nr
y-、(7)
ꢀ‑
nryc(o)-、(8)
ꢀ‑
ch2nr
y-、(9)
ꢀ‑
ch2o-、(10)
ꢀ‑
oc(o)o-、(11)
ꢀ‑
nr7c(o)o-、(12)
ꢀ‑
oc(o)nr
y-、(13)
ꢀ‑
nr7c(o)nr
y-、(14)
ꢀ‑
oc(s)nr
y-、或(15)
ꢀ‑
nr7c(s)nr
y-,ry为(1) 氢原子、(2) c
1-6
烷基、或(3) y2,y1为-(ch2ch2o)
m-r6,y2为-(ch2ch2o)
n-r8,和m和n独立地为3~100的整数。
[0131]
在优选的实施方案中,式 (1)的本发明的化合物包括下述(b)。
[0132]
(b)式(1)的化合物或其制药学上可接受的盐,其中x为亚甲基、氧原子或nr5,r1为可被1~3个相同或不同的卤素取代的c
1-6
烷基,r2为(1) 氢原子、或(2) c
1-6
烷基,
r3为(1) 氢原子、或(2) 可被1~3个羟基取代的c
1-6
烷基,r4为(1) 氢原子、(2) 卤素、(3) 羟基、(4) 可被1~3个相同或不同的卤素取代的c
1-6
烷基、或(5) 可被1~3个相同或不同的卤素取代的c
1-6
烷氧基,r5为(1) 氢原子、或(2) c
1-3
烷基,r6和r8独立地为(1) 氢原子、或(2) c
1-3
烷基,l为(1)
ꢀ‑
o-、(2)
ꢀ‑
nr
y-、(3)
ꢀ‑
c(o)-、(4)
ꢀ‑
c(o)o-、(5)
ꢀ‑
oc(o)-、(6)
ꢀ‑
c(o)nr
y-、(7)
ꢀ‑
nryc(o)-、(8)
ꢀ‑
ch2nr
y-、或(9)
ꢀ‑
ch2o-,ry为(1) 氢原子、(2) c
1-6
烷基、或(3) y2,y1为-(ch2ch2o)
m-r6,y2为-(ch2ch2o)
n-r8,和m和n独立地为3~40的整数。
[0133]
在优选的实施方案中,式 (1)的本发明的化合物包括下述(c)。
[0134]
(c)式(1)的化合物或其制药学上可接受的盐,其中x为亚甲基,r1为甲基、乙基、丙基、1-甲基乙基、丁基、2-甲基丙基、1-甲基丙基或1,1-二甲基乙基,r2为c
1-6
烷基,
r3为(1) 氢原子、或(2) 可被1个羟基取代的c
1-3
烷基,r4为(1) 氢原子(2) 羟基(3) c
1-3
烷基、或(4) c
1-3
烷氧基,r6和r8独立地为氢原子、甲基、乙基或丙基,l为(1)
ꢀ‑
c(o)nr
y-、(2)
ꢀ‑
ch2nr
y-、(3)
ꢀ‑
c(o)o-、或(4)
ꢀ‑
ch2o-,ry为氢原子、甲基、乙基、丙基、或y2,y1为-(ch2ch2o)
m-r6,y2为-(ch2ch2o)
n-r8,和m和n独立地为3~40的整数。
[0135]
在优选的实施方案中,式 (1)的本发明的化合物包括下述(d)。
[0136]
(d)式 (2)或(3)的化合物或其制药学上可接受的盐,其中r2为c
1-6
烷基,r3为氢原子或可被1~3个羟基取代的c
1-3
烷基,r4为氢原子、羟基或甲氧基,l为-ch2nr
y-、-c(o)nr
y-、-c(o)o-或-ch2o-,ry为氢原子、甲基、乙基、丙基、或y2,y1为-(ch2ch2o)
m-r6,y2为-(ch2ch2o)
n-r8,r6和r8独立地为氢原子、甲基、乙基或丙基,和m和n独立地为3~40的整数。
y1反应而得到。离去基团优选包括但不限于氟、氯、溴、碘、甲磺酸根、乙磺酸根和对甲苯磺酸根,更优选包括氯、溴和甲磺酸根。亲核试剂优选包括但不限于可被项目9中定义的ry取代的胺、醇和硫醇,更优选包括可被项目9中定义的ry取代的胺和醇。本文中使用的碱可以选自以下例示的碱中,优选其包括氢化钠和氢化钾。本文中使用的溶剂可以选自以下例示的溶剂中,优选其包括dmf。反应时间通常为约5分钟至约48小时,优选为约10分钟至约24小时。反应温度通常为约-78℃至约100℃,优选为约0℃至约100℃。
[0143]
工艺a-2在式 (1)所述的化合物或其制药学上可接受的盐中,具有连接基-o-、-nr
y-、-c(o)o-、-ch2nr
y-或-ch2o-的化合物(a2-2)可以通过下述工艺制备。
[0144]
其中r1、r2、r3、r4、r5、x和y1如项目1中所定义,lg
a2
为离去基团,nu
a2
为亲核试剂,l
a2
为本工艺中制备的连接基。
[0145]
本工艺是用亲核试剂nu
a2
取代离去基团lg
a2
的取代反应。在本工艺中,化合物(a2-2) 可以通过在适当的碱的存在或不存在下、在适当的溶剂中使化合物(a2-1)与lg
a2-y1反应而得到。lg
a2
、nu
a2
和l
a2
分别与工艺a-1中提及的离去基团、亲核试剂和连接基相同。本工艺的各反应条件与工艺a-1一致。
[0146]
制备本发明化合物的工艺如下所示。例如,式 (1)的化合物或其制药学上可接受的盐可以通过以下工艺制造。
[0147]
工艺b-1在式 (1)所述的化合物或其制药学上可接受的盐中,具有连接基-ch2nr
y-的化合物(b1-2)可以通过下述工艺制备。
[0148]
其中r1、r2、r3、r4、r5、x和y1如项目1中所定义,ry如项目9所定义,l
b1
为本工艺中制备的连接基。
[0149]
本工艺是利用醛和胺的的还原胺化。在本工艺中,化合物(b1-2)可以通过在适当的还原剂的存在下、在适当的溶剂中使化合物(b1-1)与r
y-nh-y1反应而得到。本文中使用的还原剂优选包括但不限于硼氢化钠、三乙酰氧基硼氢化钠和甲基吡啶硼烷。本文中使用的溶剂可以选自以下例示的溶剂中,优选其包括thf和氯仿。反应时间通常为约5分钟至约48小时,优选为约10分钟至约24小时。反应温度通常为约-78℃至约100℃,优选为约0℃至约100℃。
[0150]
工艺b-2在式 (1)所述的化合物或其制药学上可接受的盐中,具有连接基-nr
y-或-ch2nr
y-的化合物(b2-2)可以通过下述工艺制备。
[0151]
其中r1、r2、r3、r4、r5、x和y1如项目1中所定义,ry如项目9中所定义,nb为0或1,l
b2
为本工艺中制备的连接基。
[0152]
本工艺是利用醛和胺的的还原胺化。在本工艺中,化合物(b2-2)可以通过在适当的还原剂的存在下、在适当的溶剂中使化合物(b2-1)与y
1-cho反应而得到。本工艺的各反应条件与工艺b-1一致。
[0153]
制备本发明化合物的工艺如下所示。例如,式 (1)的化合物或其制药学上可接受的盐可以通过以下工艺制造。
[0154]
工艺c-1在式 (1)所述的化合物或其制药学上可接受的盐中,具有连接基-o-、-nr
y-或-nryc(o)-的化合物(c1-2)可以通过下述工艺制备。
[0155]
其中r1、r2、r3、r4、r5、x和y1如项目1中所定义,lg
c1
为离去基团,nu
c1
为亲核试剂,l
c1
为本工艺中制备的连接基。
[0156]
本工艺是利用离去基团(lg
c1
)和亲核试剂 (nu
c1-y1)的偶联反应。在本工艺中,化合物(c1-2)可以通过在适当的催化剂的存在下,在适当的碱的存在或不存在下,在适当的溶剂中使化合物(c1-1)与亲核试剂 (nu
c1-y1)反应而得到。本文中使用的催化剂包括过渡金属,如钯或其盐、含有其的络合物、以及载体担载(例如,聚合物担载)的那些。离去基团优选包括但不限于,硼酸、硼酸酯、卤素和三氟甲磺酸根,更优选包括硼酸、硼酸酯、溴、碘和三氟甲磺酸根。亲核试剂包括但不限于,可被项目9中定义的ry取代的胺、醇、烷基镁、烷基锌和烷基锂,更优选包括可被c
1-6
烷基取代的胺和醇。本文中使用的溶剂可以选自以下例示的溶剂中,优选其包括二噁烷-水混合物。反应时间通常为约5分钟至约48小时,优选为约10分钟至约24小时。反应温度通常为约-78℃至约100℃,优选为约0℃至约100℃。
[0157]
制备本发明化合物的工艺如下所示。例如,式 (1)的化合物或其制药学上可接受的盐可以通过以下工艺制造。
[0158]
工艺d-1在式 (1)所述的化合物或其制药学上可接受的盐中,具有连接基-c(o)o-或-c(o)nr
y-连接基的化合物(d1-2)可以通过下述工艺制备。
[0159]
其中r1、r2、r3、r4、r5、x和y1如项目1中所定义,nu
d1
为亲核试剂,l
d1
为本工艺中制备的连接基。
[0160]
本工艺是利用具有羧酸的化合物(d1-1)与nu
d1-y1的缩合反应。在本工艺中,化合
物(d1-2)可以通过在适当的缩合剂的存在下,在适当的碱的存在或不存在下,在适当的溶剂中使化合物(d1-1)与亲核试剂 (nu
d1-y1)反应而得到。亲核试剂优选包括但不限于,可被项目9中定义的ry取代的胺、醇和硫醇,更优选胺包括可被1个c
1-6
烷基取代的胺和醇。本文中使用的缩合剂可以选自常规方式中使用的缩合剂中,优选其包括hbtu、hatu和1-乙基-3-(3-二甲基氨基丙基)碳二亚胺 (包括其盐酸盐)。本文中使用的碱可以选自以下例示的碱中,优选其包括叔烷基胺,更优选包括dipea和三乙基胺。本文中使用的溶剂可以选自以下例示的溶剂中,优选其包括dmf、二氯甲烷、氯仿和thf。反应时间通常为约5分钟至约48小时,优选为约10分钟至约24小时。反应温度通常为约-78℃至约100℃,优选为约0℃至约100℃。
[0161]
工艺d-2在式 (1)所述的化合物或其制药学上可接受的盐中,具有连接基-oc(o)-或-nryc(o)-的化合物(d2-2)可以通过下述工艺制备。
[0162]
其中r1、r2、r3、r4、r5、x和y1如项目1中所定义,nu
d2
为亲核试剂,l
d2
为本工艺中制备的连接基。
[0163]
本工艺是具有羧酸y
1-cooh的化合物与具有亲核试剂(nu
d2
)的化合物(d2-1)的缩合反应。在本工艺中,化合物(d2-2)可以通过在适当的缩合剂的存在下,在适当的碱的存在或不存在下,在适当的溶剂中使具有亲核试剂的化合物(d2-1)与亲电试剂(y
1-cooh)反应而得到。本工艺的各反应条件与工艺d-1一致。
[0164]
工艺a至d中使用的起始原料(a1-1、a2-1、b1-1、b2-1、c1-1、d1-1和d2-1)可以依照例如wo 2009/067081中公开的工艺来制备。
[0165]
例如,式(1)所述的本发明的化合物可以通过下述工艺制备。
[0166]
工艺e-1
其中r1、r2、r3、r4、r5、l和y1如项目1中所定义,lg
e1
和lg
e2
为离去基团,re为c
1-6
烷基。
[0167]
作为步骤e-1的起始原料的化合物(e1-1)可以作为商业产品得到,或者可以根据工艺a至d用相应的起始化合物制备。
[0168]
步骤e-1至步骤e-4是例如wo 2009/067081中公开的类似工艺。
[0169]
上述工艺的各步骤中使用的碱应当根据反应、起始化合物等适宜选择,其包括碱性碳酸氢盐,如碳酸氢钠和碳酸氢钾;碱性碳酸盐,如碳酸钠和碳酸钾;金属氢化物,如氢化钠和氢化钾;碱金属氢氧化物,如氢氧化钠和氢氧化钾;碱金属醇盐,如甲醇钠和叔丁醇钠;有机金属碱类,如丁基锂和二异丙基氨基锂;以及有机碱类,如三乙基胺、二异丙基乙基胺、吡啶、4-二甲基氨基吡啶(dmap)和1,8-二氮杂双环[5.4.0]十一碳-7-烯 (dbu)。
[0170]
缩合剂可以是实验化学讲座(日本化学会编,丸善)第22卷中所记载的缩合剂,其包括例如,磷酸酯类,如氰基磷酸二乙酯和二苯基磷酰叠氮化物;碳二亚胺类,如1-乙基-3-(3-二甲基氨基丙基)-碳二亚胺盐酸盐(wsc
·
hcl)和二环己基碳二亚胺 (dcc);二硫化物如2,2
’‑
二吡啶基二硫化物与膦如三苯基膦的组合;卤化磷类如 n,n
’‑
双(2-氧代-3-噁唑烷基)次膦酰氯 (bopcl);偶氮二羧酸二酯如偶氮二羧酸二乙酯与膦如三苯基膦的组合;2-卤素-1-低级烷基吡啶鎓卤化物如2-氯-1-甲基吡啶鎓碘化物;1,1
’‑
羰基二咪唑 (cdi);二
苯基磷酰叠氮化物 (dppa);二乙基磷酰基氰化物 (depc);四氟硼酸盐如2-(1h-苯并三唑-1-基)-1,1,3,3-四甲基脲四氟硼酸盐 (tbtu)和2-氯-1,3-二甲基咪唑烷鎓四氟硼酸盐(cib);磷酸盐如2-(1h-苯并三唑-1-基)-1,1,3,3-四甲基脲六氟磷酸盐(hbtu)、苯并三唑-1-基氧基三(二甲基氨基)鏻六氟磷酸盐(bop)、苯并三唑-1-基氧基三(吡咯烷基)鏻六氟磷酸盐(pybop)和2-(7-氮杂-1h-苯并三唑-1-基)-1,1,3,3-四甲基脲六氟磷酸盐(hatu)。
[0171]
上述工艺的各步骤中使用的溶剂应当根据反应、起始化合物等适宜选择,其包括例如,醇溶剂如甲醇、乙醇和异丙醇;酮溶剂如丙酮和甲基酮;卤代烃溶剂如二氯甲烷和氯仿;醚溶剂如四氢呋喃 (thf)和二噁烷;芳香族烃溶剂如甲苯和苯;脂肪族烃溶剂如己烷和庚烷;酯溶剂如乙酸乙酯和乙酸丙酯;酰胺溶剂如n,n-二甲基甲酰胺(dmf)和n-甲基-2-吡咯烷酮;亚砜溶剂如二甲基亚砜(dmso);腈溶剂如乙腈;以及水。本文中使用的溶剂可以是这些溶剂中的一种或者是选自这些溶剂中的两种或更多种溶剂的混合物。并且,如果反应中可能,则有机碱可以用作本文中使用的溶剂。
[0172]“制药学上可接受的盐”包括酸加成盐和碱加成盐。例如,酸加成盐包括无机酸盐如盐酸盐、氢溴酸盐、硫酸盐、氢碘酸盐、硝酸盐和磷酸盐; 以及有机酸盐如柠檬酸盐、草酸盐、邻苯二甲酸盐、富马酸盐、马来酸盐、琥珀酸盐、苹果酸盐、乙酸盐、甲酸盐、丙酸盐、苯甲酸盐、三氟乙酸盐、甲磺酸盐、苯磺酸盐、对甲苯磺酸盐和樟脑磺酸盐; 并且碱加成盐包括无机碱盐如钠盐、钾盐、钙盐、镁盐、钡盐和铝盐;以及有机碱盐如三甲基胺、三乙基胺、吡啶、甲基吡啶、2,6-二甲基吡啶、乙醇胺、二乙醇胺、三乙醇胺、氨基丁三醇[三(羟基甲基)甲基胺]、叔丁基胺、环己基胺、二环己基胺和n,n-二苄基乙基胺。此外,它们还包括碱性或酸性氨基酸盐如精氨酸、赖氨酸、鸟氨酸、天冬氨酸和谷氨酸。
[0173]
起始化合物或目标化合物的适当的盐以及制药学上可接受的盐是常规的无毒盐,其包括酸加成盐如有机酸盐 (例如乙酸盐、三氟乙酸盐、马来酸盐、富马酸盐、柠檬酸盐、酒石酸盐、甲磺酸盐、苯磺酸盐、甲酸盐、对甲苯磺酸盐等) 以及无机酸盐 (例如盐酸盐、氢溴酸盐、氢碘酸盐、硫酸盐、硝酸盐、磷酸盐等); 与氨基酸 (例如精氨酸、天冬氨酸、谷氨酸等)的盐;金属盐如碱金属盐 (例如钠盐、钾盐等) 和碱土金属盐 (例如钙盐、镁盐等); 铵盐;以及有机碱盐 (例如三甲基胺盐、三乙基胺盐、吡啶盐、甲基吡啶盐、二环己基胺盐、n,n
’‑
二苄基乙二胺盐等);以及本领域技术人员适宜选择的那些。
[0174]
如果希望将本发明的化合物固定成盐,当本发明的化合物以盐的形式获得时,可以不经进一步反应而将其纯化,当以游离形式获得时,可以将其溶解或悬浮在合适的有机溶剂中,并且可以以通常的方式向其中加入酸或碱以形成盐。
[0175]
本发明的化合物或其制药学上可接受的盐有时可以以与水或各种溶剂的溶剂化物的形式存在。这样的溶剂化物也包括在本发明中。
[0176]
其中任意一个或更多个1h原子被2h(d)原子替代了的式(1)的化合物也在式 (1)的本发明的范围中。
[0177]
本发明包括式(1)的化合物或其制药学上可接受的盐。此外,本发明包括其水合物和其溶剂化物如其乙醇化物。此外,本发明包括其所有互变异构体、立体异构体和晶型。
[0178]
本发明化合物(1)还包括基于手性中心的光学异构体、基于由分子内旋转阻碍产生的轴性或平面手性的阻转异构体、其它立体异构体、互变异构体和几何异构体,其所有可能的异构体及其混合物都包括在本发明中。
[0179]
本发明化合物的旋光异构体混合物可以以常规方式制备。具有不对称结构的化合物例如可以通过使用具有不对称中心的原料或通过在该方法的任何位置引入不对称结构而制备。例如,在旋光异构体的情况下,旋光异构体可以通过使用旋光活性起始原料或在适当的步骤拆分旋光异构体的混合物来获得。在式(1)的化合物或其中间体具有碱性官能团时,其旋光拆分包括例如非对映异构体法,其中通过与旋光活性酸(例如,单羧酸如扁桃酸、n-苄氧基丙氨酸和乳酸;二羧酸如酒石酸、邻二异亚丙基酒石酸和苹果酸;或磺酸如樟脑磺酸和溴代樟脑磺酸)在惰性溶剂(例如,醇如甲醇、乙醇和2-丙醇;醚溶剂如二乙基醚;酯溶剂如乙酸乙酯;烃溶剂如甲苯;非质子溶剂如乙腈;或其混合溶剂)中反应而将化合物转化为盐。在式(1)的化合物或其中间体具有酸性官能团如羧基时,化合物也可以在与旋光活性胺(例如,有机胺如1-苯基乙基胺、激肽、奎尼丁、辛可尼丁、辛可宁和士的宁)形成其盐之后进行旋光拆分。
[0180]
式 (1)的本发明化合物和它们的中间体可以以本领域技术人员已知的方式分离和纯化。其包括例如,萃取、分配、再沉淀、柱色谱(例如硅胶柱色谱、离子交换柱色谱和制备液相色谱)、以及重结晶。
[0181]
本文中使用的用于重结晶的溶剂包括例如,醇溶剂如甲醇、乙醇和2-丙醇;醚溶剂如二乙基醚;酯溶剂如乙酸乙酯;芳香族烃溶剂如苯和甲苯;酮溶剂如丙酮;卤化溶剂如二氯甲烷和氯仿;烃溶剂如己烷;非质子溶剂如二甲基甲酰胺和乙腈;水;及其混合溶剂。作为其它纯化方法,例如,可以使用实验化学讲座(日本化学会编,丸善) 第1卷中所记载的方法。并且,参考各起始化合物的结构,本发明化合物的结构鉴定可以通过光谱分析法如核磁共振法、红外吸收技术和圆二色光谱分析、以及质谱法而容易地进行。
[0182]
此外,上述制备工艺中的各中间体或各终产物也可以通过适当地修饰其官能团,特别是从氨基、羟基、羰基、卤素等延伸各种侧链;和根据需要任选地进行上述保护和脱保护,从而转化为本发明的另一种化合物。官能团的修饰和侧链的延伸可以通过常规方法(例如,参见comprehensive organic transformations, r. c. larock, john wiley & sons inc. (1999)等)来进行。
[0183]
形成盐的温度选自通常-50℃至本文中所用的溶剂的沸点的范围,优选为0℃至沸点的范围,更优选为室温至沸点的范围。为了提高光学纯度,理想的是将温度升高到本文所用溶剂的沸点附近。在过滤器上收集沉淀的晶体时,任选的冷却可以使产率提高。本文中使用的旋光活性酸或胺的量相对于物质化合物适宜为约0.5~约2.0 当量,优选为约一当量。如果合适,所得晶体可以在惰性溶剂(例如,醇如甲醇、乙醇和2-丙醇;醚溶剂如二乙基醚;酯溶剂如乙酸乙酯;烃溶剂如甲苯;非质子溶剂如乙腈;或其混合溶剂)中重结晶以获得其高纯度盐。并且,如果合适,也可以用酸或碱处理光学拆分盐来获得其游离形式。
[0184]
在上述各制备工艺中的起始原料和中间体中,在各工艺中没有记载的化合物是可商购的,或者能够由本领域技术人员用可商购的材料以已知的方式或其类似方式来制备。
[0185]
本发明提供可用作疫苗佐剂、优选用作癌疫苗的疫苗佐剂的上述定义的式 (1)的化合物或其制药学上可接受的盐。
[0186]
此外,本发明提供药物组合物,其包含上述定义的式 (1)的化合物或其制药学上可接受的盐以及制药学上可接受的稀释剂或载体(以下,称为本发明的药物组合物)。
[0187]
本发明的化合物或其制药学上可接受的盐可以用作佐剂,用于维持或增强具有免
疫刺激活性的活性成分的免疫刺激。
[0188]
即,本发明的化合物或其制药学上可接受的盐具有诱导或增强抗原特异性抗体、特别是抗原特异性igg、更详细地为th1型抗原特异性igg (例如igg2c)的活性。
[0189]
并且,本发明的化合物或其制药学上可接受的盐具有增加细胞毒性t淋巴细胞(ctl)的活性。或者,本发明的化合物或其制药学上可接受的盐具有诱导哺乳动物中的ctl或增强哺乳动物中的ctl诱导的活性。
[0190]
并且,本发明的化合物或其制药学上可接受的盐具有增强cd4阳性(即,mhc ii类限制性)和/或cd8阳性(即,mhc i类限制性)t细胞的活性。
[0191]
并且,本发明的化合物或其制药学上可接受的盐具有增加抗原特异性t细胞的活性。
[0192]
并且,本发明的化合物或其制药学上可接受的盐具有增加记忆t细胞、特别是cd8阳性效应记忆t细胞的活性。
[0193]
并且,本发明的化合物或其制药学上可接受的盐具有在给予哺乳动物时,与相同摩尔数的不具有peg结构的化合物相比,提高ctl更高的特征。
[0194]
并且,本发明的化合物或其制药学上可接受的盐具有激活免疫活性细胞的活性。
[0195]
本发明的药物组合物可以包含肿瘤抗原。作为肿瘤抗原,可以使用肿瘤抗原蛋白或来源于该肿瘤抗原蛋白的肿瘤抗原肽。本文中使用的肿瘤抗原肽优选包括以下提及的抗原肽,更优选来源于ny-eso-1、mage-3、wt1、or7c1和her2/neu的肿瘤抗原肽,进一步更优选来源于wt1的肿瘤抗原肽。进而,来源于由肿瘤遗传异常导致的新抗原的肽也可以与本发明的化合物或其制药学上可接受的盐一起使用。
[0196]
此外,包含本发明的化合物或其制药学上可接受的盐和肿瘤抗原的药物组合物具有抑制表达该抗原的肿瘤的生长或表达该抗原的肿瘤的发生的作用。
[0197]
因此,本发明的化合物或其制药学上可接受的盐通过与下述肿瘤抗原一起作为药物组合物使用,可以用作治疗或预防癌症的药物本文中使用的肿瘤抗原肽不应限于特定的肽,而是可以选自wo 2014/157692或wo 2014/157704 a1公开的肽等中。
[0198]
在肿瘤抗原肽的一个实施方案中,其包括例如下述氨基酸序列的肽或其制药学上可接受的盐:rmfpnapyl (seq id no: 1)、allpavpsl (seq id no: 8)、slgeqqysv (seq id no: 9)、rvpgvaptl (seq id no: 10)、vldfappga (seq id no: 4)、cmtwnqmnl (seq id no: 11)、cytwnqmnl (seq id no: 2)、wapvldfappgasaygsl (seq id no: 3)、cwapvldfappgasaygsl (seq id no: 12)、wapvldfappgasaygslc (seq id no: 13)、cnkryfklshlqmhsrkhtg (seq id no: 14)、
cnkryfklshlqmhsrkh (seq id no: 15)、cnkryfklshlqmhsrk (seq id no: 16)、kryfklshlqmhsrkh (seq id no: 17) 和tyagclsqif (seq id no: 18)。
[0199]
并且,下述氨基酸序列的肽或其制药学上可接受的盐也可以用作本发明中的肿瘤抗原肽,式(4):其中c-c间的键为二硫键,和式(5):其中c-c间的键为二硫键。
[0200]
肿瘤抗原肽可以以肽化学领域中使用的一般方式制备。合成方法包括文献(peptide synthesis, interscience, new york, 1966; the proteins, vol. 2, academic press inc., new york, 1976)等所公开的方法。
[0201]
在另一个实施方案中,本发明的药物组合物可以含有抗原。抗原包括来自病原体的抗原,例如,来源于病毒或细菌的蛋白或其部分蛋白。并且,抗原和载体的复合体等也包括在本发明中的抗原的范围内。该复合体包括经由本领域技术人员熟知的连接基与作为载体的蛋白桥接的抗原 (包括蛋白和肽,但不限定于此) 、以及病毒样颗粒(vlp)中所含的抗原。因此,本发明的化合物或其制药学上可接受的盐通过与上述抗原组合使用,可以用作治疗或预防病毒或细菌感染的药物。
[0202]
本发明的药物组合物的给药途径的实例包括肠胃外给药,特别是血管内(例如,静脉内)、皮下、皮内、肌内、肿瘤内、淋巴结和经皮给药。
[0203]
在一个实施方案中,本发明的药物组合物可以包含式 (1)的化合物或其制药学上可接受的盐以及制药学上可接受的稀释剂或载体。
[0204]
本发明的药物组合物的药物制剂包括液体制剂。
[0205]
本发明的液体制剂包括水溶液制剂/水悬浮液制剂、油溶液制剂/油悬浮液制剂, 水凝胶制剂、脂质制剂和乳液制剂。
[0206]
水溶液制剂或水悬浮液制剂包括例如,通过将抗原 (肿瘤抗原或来自病原体的抗原)和/或式(1)的化合物或其制药学上可接受的盐溶解或分散于水中而制备的制剂。
[0207]
油溶液制剂或油悬浮液制剂包括例如,通过将抗原 (肿瘤抗原或来自病原体的抗原)和/或式(1)的化合物或其制药学上可接受的盐溶解或分散于油性成分中而制备的制剂。
[0208]
水凝胶制剂包括例如,通过将抗原 (肿瘤抗原或来自病原体的抗原)和/或式(1)
的化合物或其制药学上可接受的盐溶解或分散于水中并对制剂赋予粘稠性而制备的制剂。
[0209]
脂质制剂包括例如,包含抗原 (肿瘤抗原或来自病原体的抗原)和/或式(1)的化合物或其制药学上可接受的盐的脂质体制剂。
[0210]
乳液制剂包括例如,含有包含抗原 (肿瘤抗原或来自病原体的抗原)和/或式(1)的化合物或其制药学上可接受的盐的水溶液和油组合物的制剂。
[0211]
在本发明的液体制剂的另一实施方案中,本发明的液体制剂包括,通过将肿瘤抗原和/或式(1)的化合物或其制药学上可接受的盐溶解或分散于水中而制备的水溶液制剂或水悬浮液制剂;通过将肿瘤抗原和/或式 (1)的化合物或其制药学上可接受的盐溶解或分散于油性成分中而制备的油溶液制剂或油悬浮液制剂;以及包含水溶液和油组合物的乳液制剂。
[0212]
本发明的水溶液制剂或水悬浮液制剂中使用的添加剂包括例如,纯水、注射用水、缓冲剂、ph调节剂、稳定剂、等渗剂、增溶剂和助溶剂。
[0213]
本发明的油溶液制剂或油悬浮液制剂中使用的添加剂包括例如,缓冲剂、ph调节剂、稳定剂、等渗剂、动植物油脂、烃类、脂肪酸、脂肪酸酯类、增溶剂和助溶剂。
[0214]
本发明的水凝胶制剂中使用的添加剂包括例如,纯水、注射用水、缓冲剂、ph调节剂、稳定剂、等渗剂、增溶剂、助溶剂和增稠剂。
[0215]
本发明的脂质体制剂中使用的添加剂包括例如,纯水、注射用水、缓冲剂、ph调节剂、稳定剂、等渗剂、增溶剂、助溶剂和脂质类。
[0216]
本文中使用的本发明的乳液制剂包括水包油乳液 (也称为o/w 乳液)、油包水乳液 (也称为w/o 乳液)、水包油包水乳液 (也称为w/o/w 乳液)、以及油包水包油乳液 (也称为o/w/o 乳液)。本发明的乳液制剂优选包括油包水乳液 (w/o 乳液)。本发明的乳液制剂可以通过以一般方式将水相和油相乳化而制备。抗原 (肿瘤抗原或来自病原体的抗原)和/或式(1)的化合物或其制药学上可接受的盐可以包含在油相和/或水相中。
[0217]
本发明的乳液制剂中使用的添加剂包括例如,水、缓冲剂、ph调节剂、稳定剂、等渗剂、动植物油脂、烃类、脂肪酸、脂肪酸酯类、甘油脂肪酸酯类、亲水性表面活性剂和亲脂性表面活性剂,其中水包括纯水和注射用水,缓冲剂包括磷酸盐和有机酸盐,ph调节剂包括盐酸和氢氧化钠,稳定剂包括甘油、丙二醇和亚硫酸盐,等渗剂包括氯化钠、葡萄糖、蔗糖和甘露醇,动植物油脂包括橄榄油、大豆油和肝油,烃包括液体石蜡、角鲨烯和角鲨烷,脂肪酸包括油酸和肉豆蔻酸,脂肪酸酯包括油酸乙酯、肉豆蔻酸辛基十二烷基酯、2-乙基己酸十六烷基酯和肉豆蔻酸异丙酯,甘油脂肪酸酯包括中链甘油三酯、中链甘油二酯和中链甘油单酯,亲水性表面活性剂包括聚氧乙烯蓖麻油、聚氧乙烯氢化蓖麻油、聚氧乙烯失水山梨糖醇脂肪酸酯和聚山梨醇酯,和
亲脂性表面活性剂包括甘油单油酸酯、甘油二油酸酯、失水山梨醇单油酸酯 (span
tm 80)、失水山梨糖醇倍半油酸酯、失水山梨糖醇二油酸酯、失水山梨糖醇三油酸酯(span
tm 85)、peg-30 二多羟基硬脂酸酯和来源于植物的表面活性剂(皂苷等)。
[0218]
本文中使用的本发明的乳液制剂中的添加剂的具体组成包括但不限于,wo 2006/078059中公开的稀释用乳化组合物、montanide isa 51 vg (seppic)、montanide isa 720 vg (seppic)、以及不完全弗氏佐剂(ifa)。
[0219]
本发明的w/o 乳液制剂包括:包含式(1)的化合物或其制药学上可接受的盐、油酸乙酯、肉豆蔻酸辛基十二烷基酯、失水山梨醇单油酸酯、甘油单油酸酯、聚氧乙烯氢化蓖麻油 20、甘油和磷酸二氢钠的制剂;以及包含式(1)的化合物或其制药学上可接受的盐和montanide isa 51 vg的制剂。
[0220]
在本发明的脂质体制剂中,脂质体意指由两亲性脂质分子的双层膜(脂质双层)等脂质多层构成的微囊泡,其具有内相。优选的脂质多层是脂质双层。
[0221]
本发明的脂质体制剂包括两亲性脂质分子。两亲性脂质分子优选包括一种或更多种“磷脂”。“磷脂”包括例如,磷脂酰胆碱、磷脂酰甘油、磷脂酸、磷脂酰乙醇胺、磷脂酰丝氨酸、磷脂酰肌醇和鞘磷脂。“磷脂”优选包括磷脂酰胆碱、磷脂酰甘油、磷脂酰乙醇胺、鞘磷脂和磷脂酰丝氨酸。“磷脂”更优选包括磷脂酰胆碱、鞘磷脂和磷脂酰丝氨酸。
[0222]“磷脂”的脂肪酸残基包括但不限于c
14-18 饱和或不饱和脂肪酸残基,例如,来源于脂肪酸如肉豆蔻酸、棕榈酸、硬脂酸、油酸和亚油酸的酰基。并且,本文中还可以使用天然来源的磷脂如蛋黄卵磷脂和大豆卵磷脂,以及其不饱和脂肪酸残基被氢化了的磷脂如氢化蛋黄卵磷脂和氢化大豆卵磷脂(也称为氢化大豆磷脂或氢化大豆磷脂酰胆碱)。
[0223]
相对于脂质体膜成分整体的磷脂的含量 (摩尔分数)优选包括但不限于30~80 %,更优选40~70 %。
[0224]
内含本发明化合物的脂质体可以包含甾醇。
[0225]
甾醇包括胆固醇、β-谷甾醇、豆甾醇、菜油甾醇、菜籽甾醇、麦角甾醇和岩藻甾醇,优选胆固醇。相对于脂质体膜成分整体的甾醇的含量 (摩尔分数)优选包括但不限于0
ꢀ‑ꢀ
60 %,更优选10~50 %,进一步更优选30~50 %。
[0226]
内含本发明化合物的脂质体可以包含聚合物修饰的脂质。聚合物修饰的脂质意指用聚合物修饰的脂质。聚合物修饰的脂质由“脂质-聚合物”表示。聚合物修饰的脂质中的聚合物部分优选为亲水性聚合物,更优选为未键合到脂质的聚合物末端被烷氧基化的亲水性聚合物。聚合物修饰的脂质中的聚合物部分更优选为未键合到脂质的聚合物末端被甲氧基化、乙氧基化或丙氧基化的亲水性聚合物。聚合物修饰的脂质中的聚合物部分最优选为未键合到脂质的聚合物末端被甲氧基化的亲水性聚合物。聚合物修饰的脂质中的聚合物部分包括但不限于例如,聚乙二醇、聚丙二醇、聚乙烯醇、聚乙烯基吡咯烷酮、甲氧基聚乙二醇、甲氧基聚丙二醇、甲氧基聚乙烯醇、甲氧基聚乙烯基吡咯烷酮、乙氧基聚乙二醇、乙氧基聚丙二醇、乙氧基聚乙烯醇、乙氧基聚乙烯基吡咯烷酮、丙氧基聚乙二醇、丙氧基聚丙二醇、丙氧基聚乙烯醇和丙氧基聚乙烯基吡咯烷酮。聚合物修饰的脂质中的聚合物部分优选包括聚乙二醇、甲氧基聚乙二醇、甲氧基聚丙二醇、乙氧基聚乙二醇、乙氧基聚丙二醇、丙氧基聚乙二醇和丙氧基聚丙二醇。聚合物修饰的脂质中的聚合物部分更优选包括聚乙二醇、甲氧基聚乙二醇、乙氧基聚乙二醇、乙氧基聚丙二醇和丙氧基聚乙二醇。聚合物修饰的脂质中的聚
合物部分进一步更优选包括聚乙二醇和甲氧基聚乙二醇。聚合物修饰的脂质中的聚合物部分最优选包括甲氧基聚乙二醇。聚合物修饰的脂质中的聚合物部分的分子量包括但不限于例如,100~10000 道尔顿,优选500~8000 道尔顿,更优选1000~7000 道尔顿,进一步更优选1500~5000 道尔顿,最优选1500~3000 道尔顿。聚合物修饰的脂质的脂质部分包括但不限于例如,磷脂酰乙醇胺和二酰基甘油。聚合物修饰的脂质的脂质部分优选包括具有c
14-18 饱和或不饱和脂肪酸残基的磷脂酰乙醇胺和具有c
14-18 饱和或不饱和脂肪酸残基的二酰基甘油,更优选为具有c
14-18 饱和脂肪酸残基的磷脂酰乙醇胺和具有c
14-18 饱和脂肪酸残基的二酰基甘油,进一步更优选为具有棕榈酰基或硬脂酰基的磷脂酰乙醇胺和具有棕榈酰基或硬脂酰基的二酰基甘油。聚合物修饰的脂质的脂质部分最优选包括二硬脂酰磷脂酰乙醇胺。相对于脂质体膜成分整体的聚合物修饰的脂质的含量(摩尔分数)优选包括但不限于0~20 %,更优选1~10 %,进一步更优选2~6 %。
[0227]
内含本发明的化合物的脂质体可以包含制药学上可接受的添加剂。添加剂包括例如,无机酸、无机酸盐、有机酸、有机酸盐、糖、缓冲剂、抗氧化剂和聚合物。无机酸包括例如,磷酸、盐酸和硫酸。无机酸盐包括例如,磷酸氢二钠、氯化钠、硫酸铵和硫酸镁。有机酸包括例如,柠檬酸、乙酸、琥珀酸和酒石酸。有机酸盐包括例如,柠檬酸钠、乙酸钠、琥珀酸二钠和酒石酸钠。糖包括例如,葡萄糖、蔗糖、甘露醇、山梨糖醇和海藻糖。缓冲剂包括例如,l-精氨酸、l-组氨酸、氨丁三醇 (三羟基甲基氨基甲烷,tris)及其盐。抗氧化剂包括例如,亚硫酸钠、l-半胱氨酸、巯基乙酸钠、硫代硫酸钠、抗坏血酸和生育酚。聚合物包括例如,聚乙烯醇、聚乙烯基吡咯烷酮、羧基乙烯基聚合物和羧甲基纤维素钠。
[0228]
在本发明的油悬浮液制剂中,抗原 (肿瘤抗原或来自病原体的抗原)和/或式(1)的化合物或其制药学上可接受的盐可以以溶液状态或分散状态、或以两种状态包含在油性成分中。本发明的油悬浮液制剂中使用的添加剂包括例如,缓冲剂、ph调节剂、稳定剂、等渗剂、动植物油脂、烃类、脂肪酸、脂肪酸酯类、增溶剂和助溶剂,其中缓冲剂包括磷酸盐和有机酸盐,ph调节剂包括盐酸和氢氧化钠,稳定剂包括甘油、丙二醇和亚硫酸盐,等渗剂包括氯化钠、葡萄糖、蔗糖和甘露醇,动植物油脂包括橄榄油、大豆油和肝油,烃类包括液体石蜡、角鲨烯和角鲨烷,脂肪酸包括油酸和肉豆蔻酸,脂肪酸酯类包括油酸乙酯、肉豆蔻酸辛基十二烷基酯、2-乙基己酸十六烷基酯、肉豆蔻酸异丙酯、蔗糖脂肪酸酯、甘油脂肪酸酯、失水山梨糖醇脂肪酸酯和丙二醇脂肪酸酯,增溶剂或助溶剂包括甘油、丙二醇、聚乙二醇(macrogol)和乙醇。
[0229]
本发明的水凝胶制剂包括例如,通过将抗原 (肿瘤抗原或来自病原体的抗原)和/或式(1)的化合物或其制药学上可接受的盐溶解或分散于水中并对制剂赋予粘稠性而制备的制剂。本发明的水凝胶制剂中使用的添加剂包括例如,纯水、注射用水、缓冲剂、ph调节剂、稳定剂、等渗剂、增溶剂、助溶剂和增稠剂,其中缓冲剂包括磷酸盐和有机酸盐,ph调节剂包括盐酸和氢氧化钠,
稳定剂包括甘油、丙二醇和亚硫酸盐,等渗剂包括氯化钠、葡萄糖、蔗糖和甘露醇,增溶剂或助溶剂包括甘油、丙二醇、聚乙二醇(macrogol)和乙醇,增稠剂包括羧甲基纤维素钠、泊洛沙姆和聚维酮。
[0230]
除上述肿瘤抗原之外,本发明的式(1)的化合物或其制药学上可接受的盐或药物组合物可以与其它药物(也称为组合药物)组合使用。
[0231]
在一个实施方案中,除上述肿瘤抗原之外,本发明的式(1)的化合物或其制药学上可接受的盐或药物组合物可以与“免疫调节剂”组合给药。本文中使用的术语“免疫调节剂”意指通过和参与共刺激信号的传递且存在于抗原呈递细胞和/或t细胞上的分子相互作用而控制由抗原呈递细胞在t细胞活化过程中产生的共刺激信号的传递的任何试剂,以及在免疫系统中直接或间接地控制参与建立免疫耐受(免疫抑制)的分子的功能的任何试剂。由于肿瘤抗原肽对于增加肿瘤中的肿瘤反应性ctl有效,因此其可能用作与免疫调节剂共同给药的药剂,用于降低免疫调节剂的所需剂量或减少免疫调节剂所致的不良事件。因此,本公开通过将wt1抗原肽与免疫调节剂组合使用,从而向患者提供具有改善的效果和安全性的疗法。
[0232]“免疫调节剂”可以是抗体、核酸、蛋白、肽或小分子形式的药剂,但并不限定于此。作为“免疫调节剂”的“抗体”包括抗体片段。抗体片段的实例包括抗体的重链和轻链可变区(vh和vl)、f(ab')2、fab'、fab、fv、fd、sdfv和scfv。作为“免疫调节剂”的“蛋白”意指任何非抗体蛋白。“免疫调节剂”的实例包括例如,免疫检查点抑制剂、共刺激分子激动剂、免疫激活剂和小分子抑制剂。
[0233]“免疫检查点抑制剂”抑制由癌细胞或抗原呈递细胞诱导的免疫抑制效果。免疫检查点抑制剂的实例包括但不限于针对选自以下的分子的药剂:(1) ctla-4 (例如,伊匹单抗和曲美木单抗);(2) pd-1 (例如,纳武单抗、派姆单抗、amp-224、amp-514 (medi0680)和匹地利珠单抗 (ct-011));(3) lag-3 (例如,imp-321和bms-986016);(4) btla;(5) kir (例如,iph2101);(6) tim-3 (例如,ly3321367和ca-327);(7) pd-l1 (例如,度伐单抗 (medi4736)、mpdl3280a、bms-936559、阿维鲁单抗 (msb0010718c)、bms-1001、bms-1116和ca-170、ca-327);(8) pd-l2;(9) b7-h3 (例如,mga-271);(10) b7-h4;(11) hvem;(12) gal9;(13) cd160;(14) vista (例如,奥瓦利单抗 (jnj―61610588)、hmbd-002和ca-170);(15) btnl2;(16) tigit;(17) pvr;(18) btn1a1;(19) btn2a2;(20) btn3a2 (nat rev drug discov. 2013; 12: 130-146; nikkei medical cancer review 2014; 9; nat rev immunol. 2014; 14: 559-69);(21) csf1-r;(22) vsig-3;(23) cd112;(24) cd112r;和(25) cd96。
[0234]“共刺激分子激动剂”通过经由t细胞和/或抗原呈递细胞上的共刺激分子的辅助信号传递而增强t细胞活化,并且减弱癌细胞或抗原呈递细胞的免疫抑制效果。共刺激分子激动剂的实例包括但不限于针对选自以下的分子的药剂:(1) 4-1bb; (2) 4-1bb-l; (3) ox40; (4) ox40-l; (5) gitr; (6) cd28; (7) cd40; (8) cd40-l; (9) icos; (10) icos-l; (11) light; (12) cd27; 和(13) dnam-1。
[0235]“免疫激活剂”通过直接或间接地激活免疫细胞如t细胞和树突细胞而有效激活淋巴结中的杀伤性t细胞。免疫激活剂的实例包括但不限于toll 样受体 (tlr) 激动剂、干扰
素基因刺激因子(sting)激动剂、细胞因子和抗热休克蛋白(hsp)的试剂。
[0236]“toll样受体(tlr)激动剂”包括但不限于tlr1/2激动剂、tlr2激动剂、tlr3激动剂(例如,polyi:c)、tlr4激动剂(例如,s型脂多糖、紫杉醇、脂质a和单磷酰脂质a)、tlr5激动剂(例如,鞭毛蛋白)、tlr6/2激动剂(例如,malp-2)、tlr7激动剂、tlr7/8激动剂(例如,加地喹莫特、咪喹莫特、洛索立滨和瑞喹莫特(r848))、tlr7/9激动剂(例如,硫酸羟氯喹), tlr8激动剂(例如,莫托莫德(vtx-2337))、tlr9激动剂(例如,cpg-odn)和tlr11激动剂(例如,抑制蛋白)。
[0237]“细胞因子”的实例包括但不限于il-1α、il-1β、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9、il-10、il-11、il-12、il-13、il-14、il-15、il-16、il-17、il-18、干扰素 (inf)-α、inf-β、inf-γ、scf、gm-csf、g-csf、m-csf、促红细胞生成素、血小板生成素、巨噬细胞炎症蛋白(mip)和单核细胞趋化蛋白 (mcp)。
[0238]“热休克蛋白 (hsp)”的实例包括但不限于 hsp70、hsp90、hsp90α、hsp90β、hsp105、hsp72和hsp40。针对热休克蛋白的试剂包括hsp抑制剂。针对hsp90的抑制剂的实例包括但不限于塔尼霉素 (17-aag)、luminespib (auy-922、nvp-auy922)、阿螺旋霉素(17-dmag)盐酸盐、加特司匹 (sta-9090)、biib021、onalespib (at13387)、格尔德霉素、nvp-bep800、snx-2112 (pf-04928473)、pf-4929113 (snx-5422)、kw-2478、xl888、ver155008、ver-50589、ch5138303、ver-49009、nms-e973、pu-h71、hsp990 (nvp-hsp990)和knk437。
[0239]“小分子抑制剂”的实例包括但不限于组蛋白脱乙酰酶抑制剂、组蛋白去甲基化酶抑制剂、组蛋白乙酰转移酶抑制剂、组蛋白甲基转移酶抑制剂、dna甲基转移酶抑制剂、蒽环类抗生素、铂试剂、mapk抑制剂、β-联蛋白抑制剂、stat3抑制剂、nf-kb抑制剂、jak抑制剂、mtor抑制剂、ido抑制剂、cox-2抑制剂、cxcr4抑制剂和精氨酸酶抑制剂。
[0240]“组蛋白脱乙酰酶抑制剂”的实例包括但不限于伏立诺他(saha、mk0683)、恩替诺特(ms-275)、帕比司他(lbh589)、曲古抑菌素a (tsa)、mocetinostat (mgcd0103)、bg45、brd73954、贝利司他(pxd101)、罗米地辛(fk228、缩酚酸肽)、4sc-202、hpob、lmk-235、cay10603、他喹莫德、tmp269、nexturastat a、罗西司他 (acy-1215)、rgfp966、rg2833 (rgfp109)、scriptaid、妥巴他汀 a、pracinostat (sb939)、cudc-101、m344、pci-34051、达西司特 (laq824)、妥巴他汀 a盐酸盐、艾贝司他 (pci-24781)、cudc-907、ar-42、苯基丁酸钠、雷米司他、妥巴辛(tubacin)、奎西诺司他(jnj-26481585) 二盐酸盐、mc1568、吉维司他(itf2357)、右雄司他、西达本胺(c s055、hbi-8000)、chr-2485、chr-3996、dac-060、frm-0334 (evp-0334)、mgcd-290、cxd-101 (azd-9468)、cg200745、精氨酸丁酸盐、萝卜硫素、shp-141、cudc-907、ym753 (obp-801)、丙戊酸钠、apicidin和ci994 (泰克地那林)。
[0241]“组蛋白去甲基化酶抑制剂”的实例包括但不限于gsk j4 hcl、og-l002、jib-04、iox1、sp2509、ory-1001 (rg-6016)、gsk j1、ml324和gsk-lsd1 2hcl。
[0242]“组蛋白乙酰转移酶抑制剂”的实例包括但不限于 c646、mg149、重塑蛋白(remodelin)和漆树酸。
[0243]“组蛋白甲基转移酶抑制剂”的实例包括但不限于匹诺司他 (epz5676)、epz005678、gsk343、bix01294、他泽莫司他 (epz6438)、3-去氮腺嘌呤a (dznep) hcl、unc1999、mm-102、sgc0946、恩他卡朋、epz015666、unc0379、ei1、mi-2 (menin-mll抑制剂)、mi-3 (menin-mll抑制剂)、pfi-2、gsk126、epz04777、brd4770、gsk-2816126和unc0631。
[0244]“dna甲基转移酶抑制剂”的实例包括但不限于地西他滨、氮杂环丁烷、rg108、硫鸟嘌呤、折布拉林、sgi-110、cc-486、sgi-1027、洛美呱曲和盐酸普鲁卡因胺。
[0245]“蒽环类抗生素”被间插在dna链之间以抑制dna松弛。蒽环类抗生素的实例包括但不限于多柔比星、多柔比星脂质体、道诺霉素、吡柔比星、表柔比星、伊达比星、阿柔比星、氨柔比星、芦荟素和米托蒽醌。
[0246]“铂试剂”的实例包括但不限于 顺铂、卡铂、米铂、奈达铂、沙铂(jm-126)、奥沙利铂 (eloxatin)、四硝酸三铂和其dds制剂。
[0247]“mapk抑制剂”的实例包括但不限于sb203580、达马莫德(birb796)、sb202190 (fhpi)、ly2228820、vx-702、sb239063、培美替尼 (arry-614)、ph-797804、vx-745和tak-715。
[0248]“β-联蛋白抑制剂”的实例包括但不限于 xav-939、icg-001、iwr-1-endo、wnt-c59 (c59)、lgk-974、ky02111、iwp-2、iwp-l6、wiki4和fh535。
[0249]“stat3抑制剂”的实例包括但不限于s3i-201、stattic、氯硝柳胺、硝呋齐特、纳布卡辛 (bbi608)、隐丹参酮、ho-3867、whi-p154、flll32、sta-21、wp1066和sh-4-54。
[0250]“nf-kb抑制剂”的实例包括但不限于qnz (evp4593)、4-氨基水杨酸钠、jsh-23、咖啡酸苯乙酯、水杨酸钠、穿心莲内酯和sc75741。
[0251]“jak抑制剂”的实例包括但不限于鲁索替尼 (incb018424)、托法替尼(cp-690550)柠檬酸盐、azd1480、菲卓替尼(sar302503、tg101348)、at9283、酪氨酸磷酸化抑制剂b42 (ag-490)、莫洛替尼 (cyt387)、托法替尼(cp-690550、tasocitinib)、wp1066、tg101209、甘多替尼 (ly2784544)、nvp-bsk805 2hcl、巴瑞替尼(ly3009104、incb02850)、az960、cep-33779、帕克替尼(sb1518)、whi-p154、xl019、s-鲁索替尼(incb018424)、zm39923 hcl、得克替尼 (vx-509)、赛度替尼(prt062070、prt2070)、非戈替尼(glpg0634)、flll32、培非替尼 (asp015k、jnj-54781532)、glpg0634类似物、go6976和姜黄醇。
[0252]“mtor抑制剂”的实例包括但不限于西罗莫司(雷帕霉素)、地磷莫司 (ap23573、mk-8669)、依维莫司(rad-001)、替西罗莫司(cci-779、nsc683864)、佐他莫司(abt-578)、优美莫司a9 (乌米莫司)、azd8055、ku-0063794、沃他利司(xl765、sar245409)、mhy1485、达克利司 (bez235、nvp-bez235)、pi-103和拓克尼布(torkinib) (pp242)。
[0253]“ido抑制剂”的实例包括但不限于nlg919、incb024360类似物、吲哚莫德 (nlg-8189)和依多司他(incb024360)。
[0254]“cox-2抑制剂”的实例包括但不限于伐地考昔、罗非考昔、卡洛芬、塞来昔布、罗美昔布、托芬那酸、尼美舒利、尼氟酸、阿那达林、氯诺昔康、甲氯芬那酸钠、氨芬酸钠、双氯芬酸钠、酮洛芬、酮咯酸、萘普生钠、吲哚美辛、布洛芬、阿司匹林、甲芬那酸、溴芬酸钠、奥沙普秦、扎托布洛芬和奈帕芬胺。
[0255]“cxcr4抑制剂”的实例包括但不限于wz811、普乐沙福(amd3100)和普乐沙福8hcl (amd3100 8hcl)。
[0256]
本文中记载的式(1)的化合物、或其制药学上可接受的盐或组合物还可以与选自以下的一种或更多种药物组合:“激素治疗剂”、“免疫治疗剂”、“生物制剂"、“细胞生长因子”、“细胞生长因子抑制剂”、“细胞生长因子受体抑制剂”、“放射治疗剂”、“辅助剂”和“化学治疗剂”。例如,可以将本文中记载的肽或式(1)的化合物、或其制药学上可接受的盐或其
组合与选自上述的一种至五种药物、一种至三种药物或一种药物组合使用。
[0257]“激素治疗剂”的实例包括肾上腺皮质激素药剂 (例如,甾体抗炎剂、雌激素制剂、孕酮制剂和雄激素制剂)、抗雌激素药剂、雌激素控制药剂、雌激素合成抑制剂、抗雄激素药剂、雄激素控制药剂、雄激素合成抑制剂、lh-rh激动剂制剂、lh-rh拮抗剂制剂、芳香酶抑制剂、类固醇内酯酶抑制剂、避孕药、类维生素a和延缓类维生素a代谢的药剂。
[0258]“激素治疗剂”的实例包括磷雌酚、己烯雌酚、氟甲睾酚、氯烯雌醚、甲基睾酮、醋酸甲羟孕酮、醋酸甲地孕酮、醋酸氯地孕酮、醋酸环丙孕酮、达那唑、烯丙雌醇、孕三烯酮、美帕曲星、雷洛昔芬、奥美昔芬、左美洛昔芬、柠檬酸他莫昔芬、柠檬酸托瑞米芬、碘氧昔芬、丸制剂、美雄烷、睾丸内酯、氨鲁米特、醋酸戈舍瑞林、布舍瑞林、抑那通、亮丙瑞林、屈洛昔芬、表雄甾醇、乙炔雌二醇磺酸盐、雌莫司汀、盐酸法倔唑、阿那曲唑、terorazole、酮康唑、来曲唑、依西美坦、伏罗唑、福美司坦、氟他胺、比卡鲁胺、尼鲁米特、恩杂鲁胺、米非司酮、非那雄胺、地塞米松、泼尼松龙、倍他米松、曲安西龙、阿比特龙、利罗唑、贝沙罗汀和dn101。
[0259]“免疫治疗剂”的实例包括毕西巴尼、云芝多糖k、西索非兰、香菇多糖、乌苯美司、干扰素(il)-α、干扰素(il)-β、干扰素(il)-γ、白介素、巨噬细胞集落刺激因子、粒细胞集落刺激因子、促红细胞生成素、淋巴毒素、bcg疫苗、短小棒状杆菌、左旋咪唑、多糖k、丙考达唑、抗ctla4 抗体、抗pd-1抗体和tlr 激动剂(例如,tlr7激动剂、tlr8激动剂、tlr9激动剂)。
[0260]“生物制剂”的实例包括但不限于白介素-2 (阿地白介素)、干扰素-α、干扰素-β、干扰素-γ、促红细胞生成素 (epo)、粒细胞集落刺激因子(非格司亭)、粒细胞-巨噬细胞集落刺激因子(沙格司亭)、il13-pe38qqr、卡介苗、左旋咪唑、奥曲肽、cpg7909、provenge、gvax、myvax、favld、来那度胺、曲妥珠单抗、利妥昔单抗、吉妥珠单抗奥唑米星、阿仑单抗、内皮抑素、替坦异贝莫单抗、托西莫单抗、西妥昔单抗、扎木单抗、奥法木单抗、hgs-etr1、帕妥珠单抗、m200、sgn-30、马妥珠单抗、阿德木单抗、地诺单抗、扎芦木单抗、mdx-060、尼妥珠单抗、morab-003、vitaxin、mdx-101、mdx-010、dpc4抗体、nf-1抗体、nf-2抗体、rb抗体、p53抗体、wt1抗体、brca1抗体、brca2抗体、神经节苷脂(gm2)、前列腺特异性抗原(psa)、α-胎蛋白 (afp)、癌胚抗原(cea)、黑色素瘤相关抗原(mart-1、gap100、mage 1,3 酪氨酸)、乳头状瘤病毒e6和e7片段、及其dds制剂。
[0261]
关于“细胞生长因子”、“细胞生长因子抑制剂”和“细胞生长因子受体抑制剂”,细胞生长因子可以是促进细胞增殖的任意试剂。例如,细胞生长因子可以是具有不大于20,000的分子量的肽,其能够与受体结合以在低浓度下发挥功能。
[0262]“细胞生长因子”的实例包括但不限于表皮生长因子(egf)、胰岛素样生长因子(igf (例如,胰岛素、igf-1和igf-2))、转化生长因子(tgf (例如,tgf-α和tgf-β))、神经生长因子(ngf)、脑源性神经营养因子(bdnf)、血管内皮生长因子(vegf)、集落刺激因子(csf (例如,粒细胞集落刺激因子(g-csf))、粒细胞-巨噬细胞集落刺激因子(gm-csf))、血小板衍生生长因子(pdgf)、促红细胞生成素 (epo)、成纤维细胞生长因子(fgf (例如,酸性fgf、碱性fgf、角质形成细胞生长因子(kgk)和fgf-10))、肝细胞生长因子(hgf)、调蛋白和血管生成素。术语“细胞生长因子”与术语“生长因子”含义相同。
[0263]“细胞生长因子抑制剂”的实例包括但不限于表皮生长因子抑制剂(egf抑制剂)、胰岛素样生长因子抑制剂(igf抑制剂)、神经生长因子抑制剂(ngf抑制剂)、脑源性神经营
养因子抑制剂 (bdnf抑制剂)、血管内皮生长因子抑制剂(vegf抑制剂)、集落刺激因子抑制剂 (csf抑制剂)、血小板衍生生长因子抑制剂 (pdgf抑制剂)、促红细胞生成素抑制剂 (epo抑制剂)、成纤维细胞生长因子抑制剂(fgf抑制剂)、肝细胞生长因子抑制剂(hgf抑制剂)、调蛋白抑制剂和血管生成素抑制剂。术语“细胞生长因子抑制剂”与术语“生长因子抑制剂”含义相同。
[0264]“细胞生长因子受体抑制剂”的实例包括但不限于表皮生长因子受体抑制剂(egfr抑制剂)、胰岛素样生长因子受体抑制剂 (igfr抑制剂)、神经生长因子受体抑制剂(ngfr抑制剂)、脑源性神经营养因子受体抑制剂 (bdnfr抑制剂)、血管内皮细胞生长因子受体抑制剂 (vegfr抑制剂)、集落刺激因子抑制剂 (csf抑制剂)、血小板衍生生长因子受体抑制剂 (pdgfr抑制剂)、促红细胞生成素受体抑制剂 (epor抑制剂)、成纤维细胞生长因子受体抑制剂 (fgfr抑制剂)、肝细胞生长因子受体抑制剂 (hgfr抑制剂)、调蛋白受体抑制剂和血管生成素受体抑制剂。术语“细胞生长因子受体抑制剂”与术语“生长因子受体抑制剂”含义相同。
[0265]“放射治疗剂”的实例包括但不限于放射性材料和放射增敏剂。
[0266]“辅助剂”是与抗癌剂一起使用以抑制抗癌剂引起的副作用或呕吐的试剂。“辅助剂”的实例包括但不限于 阿瑞匹坦、昂丹司琼、劳拉西泮、地塞米松、苯海拉明、雷尼替丁、西咪替丁、雷尼替丁、法莫替丁、西咪替丁、普罗克瑞、依泊汀α、非格司亭、奥普瑞白介素、亚叶酸和粒细胞-巨噬细胞集落刺激因子(gm-csf)。
[0267]“化学治疗剂”的实例包括但不限于烷化剂、铂试剂、抗代谢物、拓扑异构酶抑制剂、dna嵌入剂、抗有丝分裂剂、抗肿瘤抗生素、植物来源的抗癌剂、表观遗传药物、免疫调节剂、分子靶向药物、血管生成抑制剂和其它化学治疗剂。下面列出化学治疗剂的一些典型实例。
[0268]“烷化剂”的实例包括但不限于氮芥、氮芥n-氧化物盐酸盐、苯丁酸氮芥、环磷酰胺、异环磷酰胺、噻替派、卡波醌、英丙舒凡甲苯磺酸盐、白消安、盐酸尼莫司汀、二溴甘露醇、美法仑、达卡巴嗪、丙卡巴肼、雷莫司汀、雌莫司汀磷酸钠、曲他胺、卡莫司汀、洛莫司汀、链脲霉素、哌泊溴烷、依托格鲁、六甲蜜胺、氨莫司汀、二溴螺氯铵、福莫司汀、泼尼莫司汀、苯达莫司汀、乌拉莫司汀、司莫司汀、嘌嘧替派、ribomustin、替莫唑胺、曲奥舒凡、曲洛磷胺、净司他丁斯酯、阿多来新、半胱胺亚硝脲、比折来新、二氯甲基二乙胺、尿嘧啶氮芥、链脲菌素、曲贝替定、becaterin、盐酸氮芥、甘露舒凡、三亚胺醌、丙卡巴肼、坎磷酰胺、亚硝基脲类及其dds制剂。
[0269]“铂试剂”的实例包括但不限于顺铂、卡铂、米铂、奈达铂、沙铂、奥沙利铂 、四硝酸三铂和其dds制剂。
[0270]“抗代谢物”的实例包括但不限于抗叶酸剂、嘧啶代谢抑制剂、嘌呤代谢抑制剂、核糖核苷酸还原酶抑制剂和核苷酸类似物。
[0271]“抗代谢物”的实例包括但不限于巯基嘌呤、6-巯基嘌呤核苷、硫代肌苷、甲氨蝶呤、培美曲塞、伊希他滨(eoshitabin)、依诺他滨、阿糖胞苷、阿糖胞苷十八烷基磷酸酯、盐酸安西他滨、5-fu试剂(例如,氟尿嘧啶、carzonal、bennan、lunachol、lunapon、替加氟、替加氟-尿嘧啶、替加氟-吉美嘧啶-氧嗪酸钾(ts-1)、uft、去氧氟尿苷、卡莫氟、加洛他滨、乙嘧替氟和卡培他滨)、氨喋呤、奈拉滨、亚叶酸钙、tabloid、丁卡因、亚叶酸钙、左亚叶酸钙、
克拉屈滨、乙嘧替氟、氟达拉滨、吉西他滨、羟基脲、喷司他丁、吡曲克辛、碘苷、米托胍腙、噻唑呋林、氨莫司汀、苯达莫司汀、氟尿苷、奈拉滨、亚叶酸、羟基脲、硫鸟嘌呤、天冬酰胺酶、硼替佐米、雷替曲塞、氯法拉滨、依诺他滨、沙巴他滨、氮杂胞苷、磺胺嘧啶、磺胺甲噁唑、甲氧苄氨嘧啶、liproxstatin-1、d4476、黄腐酚、epacadostat (incb024360)、vidofludimus、p7c3、gmx1778 (chs828)、nct-501、sw033291、ro61-8048及其dds制剂。
[0272]“拓扑异构酶抑制剂”的实例包括但不限于阿霉素、道诺霉素、表柔比星、伊达比星、蒽二酮、米托蒽醌、丝裂霉素c、博来霉素、更生霉素、plicatomycin、依立替康、喜树碱、鲁比替康、贝洛替康、依托泊苷、替尼泊苷、拓扑替康、安吖啶及其dds制剂。
[0273]“dna嵌入剂”的实例包括但不限于原黄素、阿霉素(亚德里亚霉素)、道诺霉素、更生霉素、沙利度胺及其dds制剂。
[0274]“抗有丝分裂剂”的实例包括但不限于紫杉醇、紫杉醇衍生物(例如,dha紫杉醇、聚谷氨酸紫杉醇、nab-紫杉醇、胶束紫杉醇、7α-葡糖基氧基乙酰基紫杉醇和bms-275183)、多西他赛、长春瑞滨、长春新碱、长春花碱、长春地辛、长春利定、依托泊苷、替尼泊苷、伊沙匹隆、拉洛他赛、奥塔他赛、替他塞尔、伊斯平斯、秋水仙碱、长春氟宁及其dds制剂。
[0275]“抗肿瘤抗生素”的实例包括但不限于放线菌素d、放线菌素c、丝裂霉素c、色霉素a3、光神霉素a、盐酸博来霉素、硫酸博来霉素、硫酸培洛霉素、盐酸道诺霉素、盐酸阿霉素、盐酸阿柔比星、盐酸吡柔比星、盐酸表柔比星、盐酸氨柔比星、新制癌菌素、净司他丁斯酯、光神霉素、肉瘤霉素、嗜癌菌素、米托坦、盐酸佐柔比星、盐酸米托蒽醌、盐酸伊达比星、脂质体多柔比星及其dds制剂。
[0276]“植物来源的抗癌剂”的实例包括但不限于依立替康、nogitecan、依托泊苷、磷酸依托泊苷、艾日布林、索布佐生、硫酸长春碱、硫酸长春新碱、硫酸长春地辛、替尼泊苷、紫杉醇、紫杉醇注射液、多西他赛、dj-927、长春瑞滨、拓扑替康及其dds制剂。
[0277]“表观遗传药物”的实例包括但不限于dna甲基化抑制剂、组蛋白脱乙酰酶 (hdac)抑制剂、dna甲基转移酶(dnmt)抑制剂、组蛋白脱乙酰酶活化剂、组蛋白去甲基化酶抑制剂和甲基化核苷酸。
[0278]“表观遗传药物”的实例包括但不限于伏立诺他、贝林司他、莫替司他(mgcd0103)、恩替司他(sndx-275)、罗米地辛、氮胞苷、地西他滨、gsk2879552 2hl、sgc707、ory-1001 (rg-6016)、pfi-4、sirreal2、gsk2801、cpi-360、gsk503、ami-1、cpi-169及其dds制剂。
[0279]“免疫调节剂”的实例包括但不限于沙利度胺、来那度胺、泊马度胺及其dds制剂。
[0280]“分子靶向药物”可以是小分子或抗体。“分子靶向治疗剂”的实例包括但不限于激酶抑制剂、蛋白酶抑制剂、单克隆抗体、mtor抑制剂、tnf抑制剂和t细胞抑制剂。
[0281]“激酶抑制剂”的实例包括但不限于酪氨酸激酶抑制剂、丝氨酸/苏氨酸激酶抑制剂、raf激酶抑制剂、细胞周期蛋白依赖性激酶(cdk)抑制剂和促分裂原活化蛋白激酶(mek)抑制剂。
[0282]“激酶抑制剂”的具体实例包括但不限于伊马替尼、吉非替尼、埃罗替尼、阿法替尼、达沙替尼、波舒替尼、凡德他尼、舒尼替尼、阿西替尼、帕唑帕尼、乐伐替尼、拉帕替尼、尼达尼布、尼罗替尼、克里唑替尼、色瑞替尼、艾乐替尼、鲁索替尼、托法替尼、依鲁替尼、索拉非尼、维罗菲尼、达拉菲尼、帕博西尼、曲美替尼、瑞戈非尼、西地瓦尼(cedivanib)、来他替尼、班德替尼、瓦他拉尼、塞来西布、替凡替尼(tivantinib)、卡奈替尼、培利替尼、替伐替尼
mg的活性成分,并且有效以每天1 ng至50 mg/kg活性成分的剂量使用。但是,每日剂量可能根据接受处置的宿主、给药途径和受处置疾病的严重程度。因此,最佳剂量可由处置个体患者或温血动物的实践者确定。
[0293]
本文中使用的术语“治疗”意指全部或部分减轻疾病的一些或全部症状,或预防或延迟疾病的进展。
[0294]
本文中使用的术语“预防”是指疾病的一级预防(预防疾病发作)或疾病的二级预防(预防其在疾病发作后症状已减轻或疾病已治愈的患者再恶化,预防复发)。
[0295]
由于本发明的化合物或其制药学上可接受的盐在体外或体内具有免疫佐剂活性,因此其可以用作维持或增强抗原(肿瘤抗原或来自病原体的抗原)的免疫原性的疫苗佐剂。
[0296]
本发明的化合物或其制药学上可接受的盐在体外或体内具有用于细胞免疫的佐剂活性,因此其可用作维持或增强肿瘤抗原的免疫原性的疫苗佐剂。
[0297]
本发明的化合物或其制药学上可接受的盐可以用于维持或增强治疗或预防疾病的免疫刺激剂,即,作为诱导抗原 (肿瘤抗原或来自病原体的抗原)特异性免疫反应的物质的效果。
[0298]
包含本发明的化合物或其制药学上可接受的盐、以及增强对肿瘤抗原或病原体 (也称为肿瘤抗原或来自病原体的抗原)的特异性免疫应答的物质的药物组合物也包括在本发明的一个实施方案中。肿瘤抗原包括但不限于抗原蛋白或来源于所述抗原蛋白的抗原肽 (部分肽)、肿瘤抗原蛋白或来源于所述肿瘤抗原蛋白的肿瘤抗原肽 (部分肽)、或其与载体的复合物。
[0299]
在本发明的一个具体实施方案中,本发明的化合物或其制药学上可接受的盐可以通过与用于癌免疫疗法的肿瘤抗原蛋白或肿瘤抗原肽组合给药以治疗或预防癌症。癌症包括例如白血病、骨髓增生异常综合征、多发性骨髓瘤、恶性淋巴瘤、胃癌、结肠癌、肺癌、乳腺癌、生殖细胞癌、肝癌、皮肤癌、膀胱癌、前列腺癌、子宫癌、宫颈癌、卵巢癌、脑肿瘤、骨癌、胰腺癌、头颈癌、皮肤或眶内恶性黑色素瘤、直肠癌、肛门癌、睾丸癌、输卵管癌、子宫内膜癌、子宫颈癌、阴道癌、外阴癌、霍奇金病、非霍奇金淋巴瘤、食道癌、小肠癌、内分泌系统癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、急性粒细胞白血病、慢性粒细胞白血病、急性淋巴细胞白血病、包括慢性淋巴细胞白血病病的慢性或急性白血病、儿童实体癌、淋巴细胞淋巴瘤、肾/输尿管癌、肾盂癌、中枢神经系统 (cns) 肿瘤、原发性cns淋巴瘤、肿瘤血管生成、脊柱肿瘤、脑桥胶质瘤、垂体腺瘤、卡波西肉瘤、鳞状细胞癌、平细胞癌、t细胞淋巴瘤、多型胶质母细胞瘤、恶性黑色素瘤、非小细胞肺癌、肾细胞癌和石棉诱发的癌症。癌症的治疗或预防包括预防转移性疾病和肿瘤复发、以及预防和治疗副肿瘤综合征。
[0300]
在具体的实施方案中,本发明的化合物或其制药学上可接受的盐,通过与预防感染症的疫苗的活性成分组合给药,可以预防各种感染症如尖锐湿疣、寻常疣、跖疣、乙型肝炎、丙型肝炎、单纯疱疹病毒、传染性软疣、天花、人类免疫缺陷病毒(hiv)、人乳头瘤病毒(hpv)、rs 病毒、诺如病毒、巨细胞病毒(cmv)、水痘带状疱疹病毒(vzv)、鼻病毒、腺病毒、冠状病毒、流感和副流感;细菌性疾病如结核、鸟型分枝杆菌和汉森氏病;感染如真菌病、衣原体、念珠菌、曲霉、隐球菌脑膜炎、卡氏肺孢子虫、隐孢子虫病、组织胞浆菌病、弓形虫病、疟疾、锥虫感染和利什曼病。用于预防感染的疫苗的活性成分的实例包括但不限于来源于引起感染症的微生物/病原体的物质,该微生物/病原体包括细菌、真菌、原生动物和病毒,所
述物质例如为抗原蛋白、来自所述抗原蛋白的抗原肽(部分肽)、多糖、脂质及其组合、或来源于所述微生物/病原体的物质与载体的组合。
[0301]
来源于病毒抗原的病毒抗原肽的实例包括但不限于流感基质蛋白肽58-66 (jager e et al., int. j. cancer 67: 54 (1996))、hpv16 e7肽86-93 (van driel wj et al., eur. j. cancer 35:946 (1999))、hpv e7肽12-20 (scheibenbogen c et al., j. immunother 23: 275 (2000))、hpv16 e7肽11-20 (smith jwi et al., j. clin. oncol. 21: 1562 (2003))、hsv2 gd (berman pw et al., science 227: 1490 (1985))、cmv gb (frey se et al., infect dis. 180: 1700 (1999), gonczol e. et al., exp. opin. biol. ther. 1: 401 (2001))、以及cmv pp65 (rosa cl et al., blood 100: 3681 (2002), gonczol e. et al., exp. opin. biol. ther. 1: 401 (2001))。
[0302]
本文中使用的载体是与抗原蛋白或抗原肽化学地和/或物理地结合的物质如蛋白和脂质,实例包括但不限于crm 197 (vaccine. 2013 oct 1; 31(42):4827-33)、klh (cancer immunol immunother. 2003 oct; 52(10):608-16)、病毒样颗粒 (plos one 5(3): e9809)和脂质体(j liposome res. 2004; 14(3-4):175-89)。
[0303]
抗原蛋白可以根据教科书如molecular cloning 2nd ed., cold spring harbor laboratory press (1989),通过克隆编码抗原蛋白的cdna并在宿主细胞中表达来制备。
[0304]
抗原肽的合成可以根据肽化学中常用的方法来进行,该方法例如如文献(peptide synthesis, interscience, new york, 1966; the proteins, vol. 2, academic press inc., new york, 1976)中所记载。
[0305]
在一个实施方案中,本发明进一步提供试剂盒,其包含:a)式(1)的化合物或其制药学上可接受的盐,或包含式(1)的化合物或其制药学上可接受的盐的药物组合物;和b)抗原(肿瘤抗原或来自病原体的抗原)或包含抗原(肿瘤抗原或来自病原体的抗原)的药物组合物。
[0306]
抗原并无限定,只要其是可以用作疫苗的活性成分的抗原即可,其包括如上所述的抗原蛋白、来源于该抗原蛋白的抗原肽(部分肽)、及其与载体的复合物。
[0307]
在一个实施方案中,本发明提供试剂盒,其包含:a)式(1)的化合物或其制药学上可接受的盐,或包含式(1)的化合物或其制药学上可接受的盐的药物组合物;和b) 肿瘤抗原或包含肿瘤抗原的药物组合物。
[0308]
本文中使用的肿瘤抗原不应被限制,只要该肿瘤抗原可以用作癌疫苗的活性成分即可,其包括上述肿瘤抗原蛋白或来源于 所述抗原蛋白的肿瘤抗原肽(部分肽)、以及其与载体的复合物。
[0309]
在一个实施方案中,本发明提供试剂盒,其包含:a)式(1)的化合物或其制药学上可接受的盐,或包含式(1)的化合物或其制药学上可接受的盐的药物组合物;和b) 来自病原体的抗原或包含来自病原体的抗原的药物组合物。
[0310]
本文中来自病原体的抗原不应被限制,只要该来自病原体的抗原可以用作感染性疫苗的活性成分即可,其包括上述来自病原体的抗原蛋白或来源于所述来自病原体的抗原
蛋白的来自病原体的抗原肽(部分肽)、及其与载体的复合物。
[0311]
在本发明的一个实施方案中,本发明提供式(1)的化合物或其制药学上可接受的盐在制备疫苗佐剂中的用途。
[0312]
进一步在本发明的一个实施方案中,本发明提供式(1)的化合物或其制药学上可接受的盐作为疫苗佐剂在制备治疗癌症或感染的疫苗中的用途。
[0313]
在本发明的一个实施方案中,本发明提供式(1)的化合物或其制药学上可接受的盐在制备癌疫苗的疫苗佐剂中的用途。
[0314]
进一步在本发明的一个实施方案中,本发明提供式(1)的化合物或其制药学上可接受的盐作为疫苗佐剂在制备治疗癌症的癌疫苗中的用途。
[0315]
在本发明的一个实施方案中,提供式(1)的化合物或其制药学上可接受的盐的用途,其用于制备感染疫苗的疫苗佐剂。
[0316]
在本发明的一个实施方案中,提供上述定义的式(i)的化合物或其制药学上可接受的盐作为疫苗佐剂在制备用于治疗感染的感染疫苗中的用途。
[0317]
进一步,本发明的一个实施方案提供治疗或预防癌症或感染、或预防其进展的方法,其包括将上述定义的式(i)的化合物或其制药学上可接受的盐与抗原(肿瘤抗原或来自病原体的抗原)一起对患者给药的步骤。
[0318]
本发明的一个实施方案提供治疗或预防癌症、或预防其进展的方法,其包括将上述定义的式(i)的化合物或其制药学上可接受的盐与肿瘤抗原一起对患者给药的步骤。
[0319]
本发明的一个实施方案提供治疗或预防感染、或预防其进展的方法,其包括将上述定义的式(i)的化合物或其制药学上可接受的盐与来自病原体的抗原一起对患者给药的步骤。
实施例
[0320]
本发明将参考以下实施例进一步说明,但这些实施例不应被视为是在任何方面进行限制。
[0321]
fmoc: 9-芴基甲氧基羰基boc: 叔丁氧基羰基alko: 对烷氧基苄醇peg: 聚乙二醇tbu: 叔丁基hbtu: o-(苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸盐dipea: n,n-二异丙基乙基胺dmf: n,n-二甲基甲酰胺tfa: 三氟乙酸tis: 三异丙基硅烷thf:四氢呋喃tbs: 叔丁基二甲基甲硅烷基tbdps: 叔丁基二苯基甲硅烷基高效液相色谱-质谱(lcms)的分析条件如下所示。
[0322]
lcms 条件ams检测器: lcms-it-tofhplc: shimadzu nexera x2 lc 30ad柱: kinetex 1.7 μ c18 100a new column 50
ꢀ×ꢀ
2.1 mm流速: 1.2 ml/min波长: 254/220 nm流动相:a: 0.1 % 甲酸/水
ꢀꢀꢀꢀꢀꢀꢀ
b: 乙腈时间程序:步骤
ꢀꢀꢀꢀꢀ
时间 (min)1
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.01-1.40
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
a:b = 90:10~5:952
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1.40-1.60
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
a:b = 5:953
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1.61-2.00
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
a:b = 99:1。
[0323]
lcms 条件bms检测器: acquity
tm sq detecter(waters)hplc: acquity
tm system柱: waters acquity
tm uplc beh c18 (1.7 μm, 2.1 mm
ꢀ×ꢀ
30 mm)流速: 0.8 ml/min波长: 254/220 nm流动相: a: 0.06 % 甲酸/乙腈
ꢀꢀꢀꢀꢀꢀꢀꢀ
b: 0.06 % 甲酸/水时间程序: 0.0-1.30 a:b = 2:98~96:4柱温: 25℃。
[0324]
参考例1由氨基酸序列: rmfpnapyl (arg-met-phe-pro-asn-ala-pro-tyr-leu)(seq id no: 1)组成的肽的合成以1.00 g的(fmoc-lys(boc)-alko-peg树脂) (watanabe chemical industries, ltd.; 0.23 mmol/g, 0.23 mmol)作为起始原料,通过fmoc/tbu法的固相合成延长肽链。固相合成用cs336x 肽合成仪(csbio)完成,fmoc基团通过在dmf中用20 %哌啶处理5分钟或20分钟来脱保护。通过用1.05 mmol受保护的氨基酸、1 mmol的hbtu和2 mmol的dipea在dmf中的溶液使树脂组合物反应1小时,将受保护的氨基酸偶联到该树脂组合物上。所得树脂用dmf和醚洗涤并真空干燥,得到肽树脂。向该肽树脂添加10 ml的tfa/水/tis(体积比: 94/2.5/2.5)混合物,将该混合物在室温下振摇2小时。通过过滤除去树脂,然后在减压下浓缩反应溶液。将反应溶液在冰温下冷却,向其中添加二乙基醚(50 ml)。在过滤器上收集所得的沉淀,用醚洗涤并真空干燥,得到粗肽。将所得粗肽溶解于20 %乙酸/水和乙腈(体积比: 1/1)的混合物中,按照如下所示的条件进行纯化,得到rmfpnapyl (arg-met-phe-pro-asn-ala-pro-tyr-leu)(seq id no: 1)的三氟乙酸盐(0.16 g)。将所得三氟乙酸盐以常规方式转化为其乙酸盐,将其用于评价。
[0325]
质谱: m/z = 554.73 [m+2h]
+2
, 保留时间: 0.82 min (lcms 条件a)。
[0326]
纯化条件hplc系统: 高通量 hplc 制备系统(gilson)柱: ymc ods-a 3 cmφ
ꢀ×ꢀ
25 cm, 10 μm洗脱液 1: 0.1 % tfa/水洗脱液 2: 0.035 % tfa/乙腈流速: 20 ml/min梯度法:时间(min)洗脱液2的浓度(%)0102550
[0327]
根据参考例1中记载的方法,由各相应的起始原料将表1中所示的肽制备为它们的三氟乙酸盐。因为它们不在本发明的化合物的范围内,所以将这些化合物作为参考例处理。将参考例3以常规方式转化为其乙酸盐,其评价如下。
[0328]
根据wo 2014/157692中记载的方法,将表2中所示的化合物制备为其三氟乙酸盐(其中c-c间的键为二硫键)。由于其不在本发明化合物的范围内,因此该化合物作为参考例处理。
[0329]
参考例9n-2,2,3,3-五甲基-4,7,10,13,16-五氧杂-3-硅杂十八烷-18-胺的制备步骤1
向作为已知化合物的14-氨基-3,6,9,12-四氧杂十四烷-1-醇(1.60 g)的thf (25 ml)溶液中添加三乙基胺 (4.7 ml)和三氟乙酸乙酯 (2.4 ml),将该溶液在室温搅拌2小时。减压下浓缩反应溶液,将所得粗产物通过硅胶色谱(流动相: 氯仿/甲醇)纯化,得到2,2,2-三氟-n-(14-羟基-3,6,9,12-四氧杂十四烷-1-基)乙酰胺 (1.00 g)。
[0330]
m/z = 334 [m+h]
+
, rt = 0.507 (lcms 条件b)。
[0331]
步骤 2向参考例9 (步骤 1)中制备的化合物(3.91 g)的dmf (20 ml)溶液中添加三乙基胺 (4.90 ml)和叔丁基二甲基氯硅烷 (3.54 g),将该溶液在室温搅拌2小时。将反应溶液用乙酸乙酯稀释,用水和盐水洗涤,经硫酸钠干燥,过滤,在减压下浓缩。将所得粗产物通过硅胶色谱(流动相: 己烷/乙酸乙酯)纯化,得到2,2,2-三氟-n-(2,2,3,3-四甲基-4,7,10,13,16-五氧杂-3-硅杂十八烷-18-基)乙酰胺 (3.70 g)。
[0332]
m/z = 448 [m+h]
+
, rt = 1.153 (lcms 条件b)。
[0333]
步骤 3向参考例9 (步骤 2)中制备的化合物(4.44 g)的dmf (20 ml)溶液中添加碳酸铯(6.46 g)和甲基碘 (1.6 g),将该溶液在室温搅拌2小时。将反应溶液用乙酸乙酯稀释,用水和盐水洗涤,经硫酸钠干燥,过滤,在减压下浓缩。将所得粗产物通过硅胶色谱(流动相: 己烷/乙酸乙酯)纯化,得到 2,2,2-三氟-n-甲基-n-(2,2,3,3-四甲基-4,7,10,13,16-五氧杂-3-硅杂十八烷-18-基)乙酰胺 (3.31 g)。
[0334]
m/z = 463 [m+h]
+
, rt = 1.210 (lcms 条件b)。
[0335]
步骤 4向参考例9 (步骤 3)中制备的化合物(117 mg)的甲醇 (5 ml)溶液中添加碳酸钾 (70 mg),将该溶液在室温搅拌5小时。浓缩反应溶液,将所得粗产物通过硅胶色谱(流动相: 氯仿/甲醇)纯化,得到n-2,2,3,3-五甲基-4,7,10,13,16-五氧杂-3-硅杂十八烷-18-胺 (67 mg)。
[0336]
m/z = 366 [m+h
+
], rt = 0.718 (lcms 条件b)。
[0337]
参考例10n,2,2-三甲基-3,3-二苯基-4,7,10,13,16-五氧杂-3-硅杂十八烷-18-胺的制备根据参考例9的工艺制备标题化合物。
[0338]
m/z = 490 [m+h]
+
, rt = 0.953 (lcms 条件b)。
[0339]
参考例11(3s)-3-{[2-氨基-5-({2-甲氧基-4-[(甲基氨基)甲基]苯基}甲基)-6-甲基嘧啶-4-基]氨基}己烷-1-醇的制备根据wo 2012/066336中公开的工艺制备标题化合物。
[0340]
m/z = 194 [m+2h]
+2
, rt = 0.552 (lcms 条件b)。
[0341]
参考例125-({2-甲氧基-4-[(甲基氨基)甲基]苯基}甲基)-6-甲基-n
4-戊基嘧啶-2,4-二胺的制备根据与实施例1的程序类似的反应和处理,由作为已知化合物的5-{[4-(氯甲基)-2-甲氧基苯基]甲基}-6-甲基-n
4-戊基嘧啶-2,4-二胺制备标题化合物。
[0342]
m/z = 179 [m+2h]
+2
, rt = 0.475 (lcms 条件b)。
[0343]
参考例133-{[2-氨基-4-甲基-6-(戊基氨基)嘧啶-5-基]甲基}-4-甲氧基苯甲醛的制备
根据与wo 2017/061532中公开的程序类似的反应和处理,由作为已知化合物的3-{[2-氨基-4-甲基-6-(戊基氨基)嘧啶-5-基]甲基}-4-甲氧基苯甲酸甲酯制备标题化合物。
[0344]
m/z = 179 [m+2h]
+2
, rt = 0.475 (lcms 条件b)。
[0345]
参考例143-{[2-氨基-4-甲基-6-(戊基氨基)嘧啶-5-基]甲基}-4-羟基苯甲醛的制备在冰冷下向参考例13(104 mg)的二氯甲烷(5 ml)溶液中添加三溴化硼的二氯甲烷(1.0 m, 0.8 ml)溶液,将该溶液在室温搅拌6小时。向反应溶液中添加饱和碳酸氢钠水溶液。将混合物用氯仿提取,将有机层经硫酸钠干燥,进行过滤和浓缩。将所得粗产物通过硅胶色谱(流动相: 氯仿/甲醇)纯化,得到标题化合物(54 mg)。
[0346]
m/z = 329 [m+h]
+
, rt = 0.748 (lcms 条件b)。
[0347]
参考例155-({2-甲氧基-5-[(甲基氨基)甲基]苯基}甲基)-6-甲基-n
4-戊基嘧啶-2,4-二胺的制备
根据与实施例3的程序类似的反应和处理,由参考例13制备标题化合物。
[0348]
m/z = 179 [m+2h]
+2
, rt = 0.599 (lcms 条件b)。
[0349]
参考例162-{[2-氨基-4-甲基-6-(戊基氨基)嘧啶-5-基]甲基}-4-[(甲基氨基)甲基]苯酚的制备根据与实施例3的程序类似的反应和处理,由参考例14制备标题化合物。
[0350]
m/z = 173 [m+2h]
+2
, rt = 0.562 (lcms 条件b)。
[0351]
参考例17n,2,2,3,3-五甲基-4,7,10,13,16,19,22,25,28,31-十氧杂-3-硅杂三十三烷-33-胺根据参考例9的工艺制备标题化合物。
[0352]
m/z = 587 [m+h]
+
, rt = 0.865 (lcms 条件b)。
[0353]
参考例18n,2,2,3,3-五甲基-4,7,10,13,16,19,22,25,28,31,34,37,40,43,46,49,52,55,58,61,64,67,70,73-二十四氧杂-3-硅杂七十五烷-75-胺
根据参考例9的工艺制备标题化合物。
[0354]
m/z = 402 [m+3h]
+3
, rt = 0.946 (lcms 条件b)。
[0355]
参考例19n,2,2,3,3-五甲基-4,7,10,13,16,19,22,25,28,31,34,37,40,43,46,49,52,55,58,61,64,67,70,73,76,79,82, 85,88,91,94,97,100,103,106,109-三十六氧杂-3-硅杂一百十一烷-111-胺根据参考例9的工艺制备标题化合物。
[0356]
m/z = 866 [m+2h]
+2
, rt = 0.948 (lcms 条件b)。
[0357]
实施例11-(4-{[2-氨基-4-甲基-6-(戊基氨基)嘧啶-5-基]甲基}-3-甲氧基苯基)-2-甲基-5,8,11,14-四氧杂-2-氮杂十六烷-16-醇
·
三氟乙酸盐的制备向作为已知化合物的5-{[4-(氯甲基)-2-甲氧基苯基]甲基}-6-甲基-n
4-戊基嘧啶-2,4-二胺 (75 mg)的乙腈 (3 ml)溶液中,添加参考例9 (76 mg)、碳酸钾(65 mg)和碘化钾(67 mg),将该溶液在60℃下搅拌8小时。浓缩反应溶液,如参考例1的情况那样通过反相hplc纯化,得到标题化合物(96 mg)。
[0358]
m/z = 290 [m+2h]
+2
, rt = 0.623 (lcms 条件b)1h-nmr (cdcl3): δ 7.34 (s, 1h), 6.92 (d, j = 8.0 hz, 1h), 6.96 (d, j = 8.0 hz, 1h), 6.08 (t, j = 5.6 hz, 1h), 3.96 (s, 3h), 3.88 (m, 2h), 3.70 (m, 2h), 3.64-3.55 (m, 18h), 3.47 (s, 1h), 3.34 (dd, j = 6.8, 12 hz, 2h), 2.81 (s, 3h), 2.47 (s, 3h), 1.49-1.42 (m, 2h), 1.30-1.23 (m, 2h), 1.21-1.13 (m, 2h), 0.85 (t, j = 7.2 hz, 3h)。
[0359]
实施例21-{4-[(2-氨基-4-{[(3s)-1-羟基己烷-3-基]氨基}-6-甲基嘧啶-5-基)甲基]-3-甲氧基苯基}-2-甲基-5,8,11,14-四氧杂-2-氮杂十六烷-16-醇
·
三氟乙酸盐的制备
根据与实施例1的程序类似的反应和处理,由作为已知化合物的(3s)-3-[(2-氨基-5-{[4-(氯甲基)-2-甲氧基苯基]甲基}-6-甲基嘧啶-4-基)氨基]己烷-1-醇制备标题化合物。
[0360]
m/z = 305 [m+2h]
+2
, rt = 0.527 (lcms 条件b)。
[0361]
实施例31-(3-{[2-氨基-4-甲基-6-(戊基氨基)嘧啶-5-基]甲基}-4-甲氧基苯基)-2-甲基-5,8,11,14-四氧杂-2-氮杂十六烷-16-醇
·
三氟乙酸盐的制备向参考例13(64.3 mg)的thf(5 ml)溶液中添加参考例9 (101 mg)、乙酸 (5.4 μl)和三乙酰氧基硼氢化钠(199 mg),将该溶液在室温搅拌24小时。向反应溶液中添加水,向其中添加饱和碳酸氢钠水溶液以中和该溶液。将混合物用乙酸乙酯提取。将有机层用盐水洗涤,经硫酸钠干燥,进行过滤、浓缩。将所得粗产物通过hplc纯化,得到tbdps保护的目标化合物。将所得保护的化合物溶解于甲醇中,将该溶液在室温搅拌 12小时。浓缩反应溶液,通过反相hplc纯化,得到 标题化合物(26 mg)。
[0362]
m/z = 290 [m+2h]
+2
, rt = 0.661 (lcms 条件b)1h-nmr (cdcl3): δ 7.32 (dd, j = 1.6, 8.4 hz, 1h), 7.13 (d, j = 1.6 hz, 1h), 6.87 (d, j = 8.4 hz, 1h), 6.24 (t, j = 4.8 hz, 1h), 4.26 (m, 2h), 3.86 (s, 3h), 3.81 (m, 2h), 3.64-3.49 (m, 18h), 3.29 (dd, j = 6.8, 12.8 hz, 2h), 2.70 (s, 3h), 2.43 (s, 3h), 1.44-1.36 (m, 2h), 1.24-1.17 (m, 2h), 1.13-1.07 (m, 2h), 0.80 (t, j = 7.2 hz, 3h)。
[0363]
实施例41-(3-{[2-氨基-4-甲基-6-(戊基氨基)嘧啶-5-基]甲基}-4-羟基苯基)-2-甲基-5,8,11,14-四氧杂-2-氮杂十六烷-16-醇
·
三氟乙酸盐的制备
s),6.95 (1h, d, j = 7.9 hz), 4.77 (1h, d, j = 6.7 hz), 4.68 (2h, s), 4.01-3.92 (1h, m), 3.94 (3h, s), 3.75-3.68 (4h, m), 3.67-3.51 (26h, m), 3.42-3.35 (1h, m), 2.28 (3h, s), 1.45-1.36 (1h, m), 1.29-1.20 (1h, m), 1.16-1.06 (2h, m), 0.80 (3h, t, j = 7.3 hz)。
[0367]
实施例62,5,8,11-四氧杂十三烷-13-基 4-[(2-氨基-4-{[(2s)-1-羟基戊烷-2-基]氨基}-6-甲基嘧啶-5-基)甲基]-3-甲氧基苯甲酸酯的制备向作为已知化合物的4-[(2-氨基-4-{[(2s)-羟基戊烷-2-基]氨基}-6-甲基嘧啶-5-基)甲基]-3-甲氧基苯甲酸 (30 mg)的thf(1.5 ml)溶液中,添加2,5,8,11-四氧杂十三烷-13-醇 (501 mg)、二异丙基乙基胺 (36.2 mg)和1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(46.1 mg),将该溶液在60℃下搅拌10小时。将反应溶液通过硅胶柱色谱(流动相: 氯仿/甲醇)纯化,得到标题化合物(16.2 mg)。
[0368]
m/z = 565 [m+h]
+
, rt = 0.665 (lcms 条件b)1h-nmr (cdcl3): δ 7.56 (1h, d, j = 7.9 hz), 7.51 (1h, s), 6.99 (1h, d, j = 7.9 hz), 6.12 (1h, d, j = 7.9 hz), 4.41 (2h, t, j = 4.6 hz), 4.20-4.10 (1h, m), 3.93 (3h, s), 3.86-3.41 (18h, m), 3.29 (3h, s), 3.02 (1h, q, j = 7.5 hz), 2.44 (3h, s), 1.50-1.22 (2h, m), 1.12-0.91 (2h, m), 0.74 (3h, t, j = 7.0 hz)。
[0369]
实施例75-{[2-甲氧基-4-(2,5,8,11,14-五氧杂十五烷-1-基)苯基]甲基}-6-甲基-n
4-戊基嘧啶-2,4-二胺的制备向2,5,8,11-四氧杂十三烷-13-醇中添加氢化钠(7.2 mg, 含量 》55 %),将混合物在室温下搅拌1小时。向其中添加作为已知化合物的5-{[4-(氯甲基)-2-甲氧基苯基]甲基}-6-甲基-n
4-戊基嘧啶-2,4-二胺 (20 mg),将该混合物在60℃下搅拌3小时。向反应溶
液中添加水,将混合物用氯仿提取,经硫酸镁干燥,进行过滤、浓缩。将所得粗产物通过硅胶柱色谱(流动相: 氯仿/甲醇)纯化,得到标题化合物(6.7 mg)。
[0370]
m/z = 536 [m+h]
+
, rt = 0.850 (lcms 条件b)1h-nmr (cdcl3): δ 6.88 (1h, s), 6.84 (1h, d, j = 7.3 hz), 6.78 (1h, d, j = 7.3 hz), 5.80-5.40 (2h, br), 4.46 (2h, s), 3.86 (3h, s), 3.67-3.46 (19h, m), 3.30 (3h, s), 3.24 (2h, td, j = 7.0, 5.5 hz), 2.35 (3h, s), 1.36 (2h, m), 1.23-1.05 (4h, m), 0.78 (3h, t, j = 7.0 hz)。
[0371]
实施例81-(4-{[2-氨基-4-甲基-6-(戊基氨基)嘧啶-5-基]甲基}-3-甲氧基苯基)-2-甲基-5,8,11,14,17,20,23,26,29-九氧杂-2-氮杂三十一烷-31-醇的制备向作为已知化合物的5-{[4-(氯甲基)-2-甲氧基苯基]甲基}-6-甲基-n
4-戊基嘧啶-2,4-二胺 (40 mg)、参考例17 (64.6 mg)、碘化钾(36.6 mg)和碳酸钾(30.5 mg)的混合物中添加乙腈 (1 ml),将该混合物在80℃下搅拌2小时。将反应溶液用氯仿稀释,过滤除去不溶物,进行浓缩。向残渣添加氯仿(1 ml)和tfa(0.1 ml),将混合物在室温下搅拌1小时。将反应溶液用碳酸钠水溶液中和,用氯仿提取,经硫酸镁干燥,进行过滤、浓缩。将所得粗产物通过氨基硅胶柱色谱(流动相: 氯仿/甲醇)纯化,得到标题化合物(28.4 mg)。
[0372]
m/z = 400 [m+2h]
+2
, rt = 0.583 (lcms 条件b)1h-nmr (cdcl3): δ 6.86 (1h, s), 6.81 (1h, d, j = 7.9 hz), 6.73 (1h, d, j = 7.9 hz), 6.00-5.00 (2h, br), 3.85 (3h, s), 3.68 (2h, t, j = 4.6 hz), 3.63-3.50 (40h, m), 3.44 (2h, s), 3.24 (2h, q, j = 6.5 hz), 2.54 (2h, t, j = 6.1 hz), 2.32 (3h, s), 2.19 (3h, s), 1.41-1.34 (2h, m), 1.23-1.16 (2h, m), 1.13-1.05 (2h, m), 0.78 (3h, t, j = 7.3 hz)。
[0373]
实施例91-(4-{[2-氨基-4-甲基-6-(戊基氨基)嘧啶-5-基]甲基}-3-甲氧基苯基)-2-甲基-5,8,11,14,17,20,23,26,29,32,35,38,41,44,47,50,53,56,59,62,65,68,71-二十三氧杂-2-氮杂七十三烷-73-醇的制备
根据与实施例8的程序类似的反应,由参考例18 (83 mg)制备标题化合物(31.6 mg)。
[0374]
m/z = 708 [m+2h]
+2
, rt = 0.672 (lcms 条件b)1h-nmr (cdcl3): δ 6.83 (1h, s), 6.79 (1h, d, j = 7.9 hz), 6.69 (1h, d, j = 7.3 hz), 4.79 (1h, s), 4.56 (2h, s), 3.83 (3h, s), 3.76-3.40 (99h, m), 3.21 (2h, dd, j = 12.5, 7.0 hz), 2.53 (2h, t, j = 6.1 hz), 2.24 (3h, s), 2.18 (3h, s), 1.39-1.32 (2h, m), 1.22-1.14 (2h, m), 1.12-1.04 (2h, m), 0.77 (3h, t, j = 7.0 hz)。
[0375]
实施例101-(4-{[2-氨基-4-甲基-6-(戊基氨基)嘧啶-5-基]甲基}-3-甲氧基苯基)-2-甲基-5,8,11,14,17,20,23,26,29,32,35,38,41,44,47,50,53,56,59,62,65,68,71,74,77,80,83,86,89,92,95,98,101,104,107-三十五氧杂-2-氮杂一百零九烷-109-醇的制备根据与实施例8的程序类似的反应,由参考例19 (95 mg)制备标题化合物(26.3 mg)。
[0376]
m/z = 487 [m+4h]
+4
, rt = 0.693 (lcms 条件b)1h-nmr (cdcl3): δ 6.83 (1h, s), 6.79 (1h, d, j = 7.9 hz), 6.69 (1h, d, j = 9.2 hz), 4.81 (1h, s), 4.60 (2h, s), 3.83 (3h, s), 3.76-3.38 (147h, m), 3.21 (2h, dd, j = 12.5, 7.0 hz), 2.53 (2h, t, j = 5.8 hz), 2.24 (3h, s), 2.18 (3h, s), 1.39-1.32 (2h, m), 1.21-1.14 (2h, m), 1.12-1.06 (2h, m), 0.77 (3h, t, j = 7.3 hz)。
[0377]
实施例1112-[(4-{[2-氨基-4-甲基-6-(戊基氨基)嘧啶-5-基]甲基}-3-甲氧基苯基)甲基]-3,6,9,15,18,21-六氧杂-12-氮杂二十三烷-1,23-二醇的制备
根据与实施例1的程序类似的反应,由3,6,9,15,18,21-六氧杂-12-氮杂二十三烷-1,23-二醇(40.7 mg)制备标题化合物(13.1 mg)。
[0378]
m/z = 349 [m+2h]
+2
, rt = 0.554 (lcms 条件b)1h-nmr (cdcl3): δ 6.85 (1h, s), 6.79 (1h, d, j = 7.9 hz), 6.73 (1h, d, j = 7.9 hz), 4.85 (1h, t, j = 5.5 hz), 4.57 (2h, s), 3.83 (3h, s), 3.68-3.42 (34h, m), 3.21 (2h, td, j = 7.2, 5.3 hz), 2.67 (4h, t, j = 6.1 hz), 2.24 (3h, s), 1.41-1.33 (2h, m), 1.23-1.09 (4h, m), 0.78 (3h, t, j = 7.0 hz)。
[0379]
试验 1人tlr7报告基因测定tlr7/nf-κb/seaporter
tm hek293细胞系(imgenex corporation)是稳定共转染细胞系,其在nf-κb应答元件的转录调控下表达全长人tlr7和分泌型碱性磷酸酶(seap)报告基因。该细胞系的tlr7表达已经通过流式细胞术进行了试验。使用抗生素杀稻瘟菌素和遗传霉素选择具有稳定表达的转染子。tlr信号传导导致nf-κb的易位,启动子的活化导致seap基因的表达。通过测定将细胞在37℃下与实施例和参考例中制备的各化合物在0.1 % (v/v)二甲基亚砜(dmso)的存在下孵育24小时后产生的seap水平来评价tlr7特异性活化。通过人tlr7报告基因测定来评估本发明的化合物的人tlr7活性,将结果以产生seap诱导的最大水平的一半(ec
50
)的化合物浓度的方式示于表3和4。)的化合物浓度的方式示于表3和4。
[0380]
试验2小鼠tlr7报告基因测定hek-blue
tm mtlr7细胞系(invivogen)是稳定共转染细胞系,其在nf-κb应答元件的转录调控下表达全长小鼠tlr7和分泌型seap报告基因。该细胞系的tlr7表达已经通过rt-pcr进行了试验。使用抗生素杀稻瘟菌素和吉欧霉素选择具有稳定表达的转染子。tlr信号传导导致nf-κb的易位,启动子的活化导致seap基因的表达。通过测定将细胞在37℃下与
实施例和参考例中制备的各化合物在0.1 % (v/v)dmso的存在下孵育20-24小时后产生的seap水平来评价tlr7特异性活化。通过小鼠tlr7报告基因测定来评估本发明的化合物的小鼠tlr7活性,将结果以产生seap诱导的最大水平的一半(ec
50
)的化合物浓度的方式示于表5和6。和6。
[0381]
试验1和2中的结果表明,本发明的实施例化合物和参考例化合物可以作为人和小鼠tlr7激动剂两者发挥作用。
[0382]
试验3hla-a
*
24:02转基因小鼠中的体内ctl诱导的评价实施例1的化合物和参考例12的化合物的体内佐剂活性在下述步骤中进行评价。向包含参考例8中制备的式4的化合物和参考例3中制备的肽seq id no: 3与montanide isa 51 v的鸡尾酒疫苗(以下,称为“鸡尾酒疫苗b”)中分别添加实施例1中制备的化合物或参考例12中制备的化合物,制备疫苗。将该疫苗对hla-a
*
24:02转基因小鼠给药,通过试验抗原特异性细胞毒性t淋巴细胞(ctl)诱导的方法评价各疫苗的佐剂活性。
[0383]
式4的化合物中的cytwnqmnl(seq id no: 2)对应于来源于hla-a
*
24:02-限制性wt1 蛋白的抗原肽。
[0384]
hla-a
*
24:02转基因小鼠(c57bl/6crhla-a2402/kb)表达人mhc(hla-a
*
24:02)和小鼠mhc(h-2kb)的嵌合hla。该小鼠可以用肽诱导ctl,该肽能够在hla-a
*
24:02-阳性人中诱导ctl(int j cancer. 2002;100: 565-70)。
[0385]
鸡尾酒疫苗b诱导对肽(seq id no: 2)特异性的ctl的特性是通过测量用肽(seq id no: 2)刺激来自小鼠的脾细胞时是否能够产生ifnγ来评价。此外,实施例1中的化合物或参考例12中的化合物在体内发挥佐剂活性的特性是通过比较由鸡尾酒疫苗b诱导的ctl的数量和由通过将实施例1中制备的化合物或参考例12中的化合物添加至鸡尾酒疫苗b而制备的疫苗诱导的ctl的数量,并检查有无数量的增加来进行评价。
[0386]
具体地,将式4的化合物和肽seq id no: 3溶解于dmso中,然后用注射用水稀释至6 mg/ml式4的化合物和4.5 mg/ml肽seq id no: 3的浓度。混合稀释的肽溶液并用等体积的montanide isa 51 vg乳化而制备鸡尾酒疫苗b。将鸡尾酒疫苗b以每只300 μg式4的化合物和每只225 μg肽seq id no: 3的给药量在尾根区域对小鼠进行皮内注射。或者,在制备鸡尾酒疫苗b的步骤中,将实施例1中制备的化合物添加至稀释的肽溶液中以制备疫苗,将该制备的疫苗以每只300 μg式4的化合物、每只225 μg肽seq id no: 3和每只100 ng实施例1中制备的化合物的给药量在尾根区域对小鼠进行皮内注射。或者,在制备鸡尾酒疫苗b
的步骤中,将参考例12中制备的化合物添加至稀释的肽溶液中以制备疫苗,将该制备的疫苗以每只300 μg式4的化合物、每只225 μg肽seq id no: 3和每只69 ng参考例12中制备的化合物的给药量在尾根区域对小鼠进行皮内注射。给药是以一周间隔进行两次。最终给药一周后,将小鼠用co2气体处死。从取自小鼠的脾脏中收获脾细胞。为了检测产生ifnγ的脾细胞,使用了ifnγ elispot测定试剂盒。具体地,在制备脾细胞样品的前一天,用抗小鼠ifnγ抗体处理elispot板。在后一天,将板通过用具有10%胎牛血清(fbs)的rpmi 1640培养基处理来进行封闭。向封闭的elispot板中,以2.5
ꢀ×ꢀ
10
5 细胞/孔添加来自hla-a
*
24:02转基因小鼠的脾细胞样品。将肽 (seq id no: 2)在0.1 % (v/v) dmso的存在下以10 μg/ml的终浓度添加至含有脾细胞的孔中。将添加了肽的脾细胞在37℃下在5% co2的气氛下孵育过夜,以体外再刺激该肽。然后,从孔中除去上清后,在immunospot analyzer (c.t.l.)上对elispot板上的染色的斑点进行计数。
[0387]
图1示出使用hla-a
*
24:02转基因小鼠的ifnγ elispot测定的结果。图1的图的纵轴上的刻度表示响应于添加细胞的刺激而产生ifnγ的细胞的数量。给药至小鼠的疫苗表示于横轴上。图1中的黑色柱和白色柱分别表示来自hla-a
*
24:02转基因小鼠的脾细胞在肽seq id no: 2的存在或不存在下孵育的结果。因此,黑色柱和白色柱的差异表示对肽seq id no: 2特异性的产生ifnγ的细胞的计数即ctl计数,该肽seq id no: 1通过疫苗的给药而在小鼠体内诱导。图1中的白色柱的计数几乎无法确认。这表明在目标肽的不存在下,小鼠的脾细胞几乎不反应。本试验的结果表明鸡尾酒疫苗b在hla-a
*
24:02转基因小鼠中诱导了响应于肽seq id no: 2的ctl。并且,通过向鸡尾酒疫苗b添加实施例1中制备的化合物或参考例12中制备的化合物,响应于肽seq id no: 2的ctl计数增加。此外,与参考例12中制备的化合物的情况相比,在将实施例1中制备的化合物添加至鸡尾酒疫苗b的情况中,ctl计数的提高更多。
[0388]
上述结果表明诱导的ctl计数通过对疫苗添加实施例1中制备的化合物而增加,并且强烈暗示实施例1中制备的化合物具有体内佐剂活性。此外,结果还表明与参考例12中制备的不具有peg结构的化合物相比,实施例1中制备的化合物增加ctl的效果更高。
[0389]
试验4hla-a
*
02:01转基因小鼠中的体内佐剂活性的评价实施例1的化合物和参考例12的化合物的体内佐剂活性在下述步骤中进行评价。向包含参考例8中制备的式4的化合物和参考例3中制备的肽seq id no: 3与预乳化组合物的鸡尾酒疫苗(以下,称为“疫苗a”)中分别添加实施例1中制备的化合物或参考例12中制备的化合物,制备各疫苗。将疫苗对hla-a
*
02:01转基因小鼠给药,通过试验抗原特异性ctl诱导来评价各疫苗的佐剂活性。
[0390]
式4的化合物:其中c-c间的键为二硫键。
[0391]
式4的化合物中的rmfpnapyl(seq id no: 1)和肽seq id no:3中的vldfappga(seq id no: 4)对应于来源于hla-a
*
02:01-限制性wt1蛋白的抗原肽。
[0392]
hla-a
*
02:01转基因小鼠(c57bl/6crhla-a2.1dr1)缺乏小鼠mhc,而是表达人mhc (hla-a
*
02:01)和小鼠mhc(h-2db)的嵌合hla以及hla-drb1
*
01:01。该小鼠可以用肽诱导ctl,该肽可以在hla-a
*
02:01-阳性人中诱导ctl(eur j immunol. 2, 004; 34: 3, 060-9)。
[0393]
鸡尾酒疫苗a诱导对抗原肽 (seq id no: 1或seq id no: 4)特异性的ctl的特性通过测量用相应的肽刺激来自小鼠的脾细胞时是否能够产生ifnγ来评价。此外,实施例1中的化合物或参考例12中的化合物在体内发挥佐剂活性的特性是通过比较由鸡尾酒疫苗a诱导的ctl的数量和由通过将实施例1中制备的化合物或参考例12中的化合物添加至鸡尾酒疫苗a而制备的疫苗诱导的ctl的数量,并检查有无数量的增加来进行评价。
[0394]
具体地,如下所述评价体内佐剂活性。
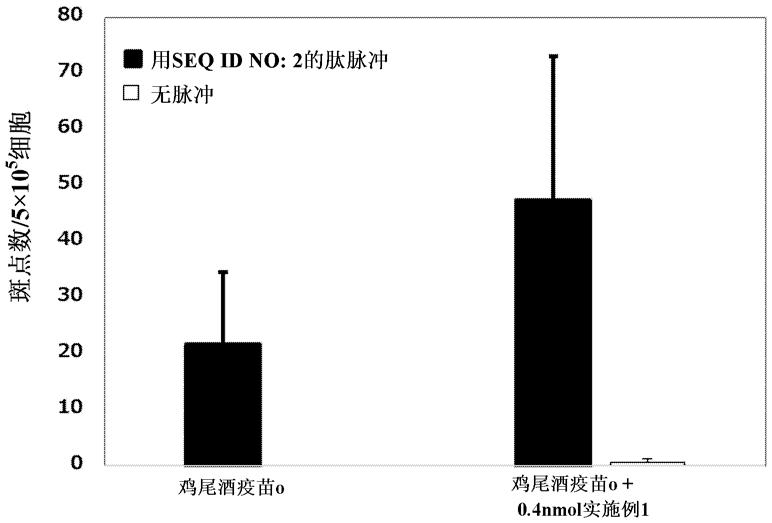
[0395]
将0.312 g磷酸二氢钠二水合物溶解于80 g注射用水中。混合14.0 g油酸乙酯、14.0 g肉豆蔻酸辛基十二烷基酯、2.0 g失水山梨醇单油酸酯、2.8 g甘油单油酸酯、200.4 g聚氧乙烯氢化蓖麻油和0.4 g甘油。将2.354 ml混合物(相当于2.077 g)放入试管,将0.396 ml磷酸二氢钠水溶液 (相当于0.396 g)逐渐添加至试管中,同时用混合器(ultra-turrax t10, ika或touch mixer mt-51, yamato scientific)进行搅拌,以将试管中的混合物乳化。所得乳液称为预乳化组合物。制剂的量根据需要进行调节。
[0396]
将式4的化合物和肽seq id no: 3溶解于dmso中,然后用注射用水稀释至3 mg/ml的式4的化合物和2.25 mg/ml的seq id no: 3的肽的浓度。混合稀释的肽溶液并用等体积的上述预乳化组合物乳化而制备鸡尾酒疫苗a。以每只300 μg式4的化合物和每只225 μg肽seq id no: 3的给药量在尾根区域对小鼠皮内注射鸡尾酒疫苗a。或者,在制备鸡尾酒疫苗a的步骤中,将实施例1中制备的化合物添加至稀释的肽溶液中以制备疫苗,将该制备的疫苗以每只300 μg式4的化合物、每只225 μg肽seq id no: 3和每只32.5 ng实施例1中制备的化合物的给药量在尾根区域对小鼠进行皮内注射。或者,在制备鸡尾酒疫苗a的步骤中,将参考例12中制备的化合物添加至稀释的肽溶液以制备疫苗,并以每只300 μg式4的化合物、每只225 μg肽seq id no: 3和每只22.5 ng参考例12中制备的化合物的给药量在尾根区域对小鼠皮内注射该制备的疫苗。 1周后,将小鼠用co2气体处死。从取自小鼠的脾脏中收获脾细胞。为了检测产生ifnγ的脾细胞,使用了ifnγ elispot测定试剂盒。具体地,在制备脾细胞样品的前一天,用抗小鼠ifnγ抗体处理elispot板。在后一天,将板通过用具有10 % fbs的rpmi 1640培养基处理来进行封闭。向该封闭的elispot板,以1.25
ꢀ×ꢀ
105细胞/孔添加制备的脾细胞样品。在0.1 % (v/v) dmso的存在下将肽(seq id no: 1或seq id no: 4)添加至含有脾细胞的孔中,以10 μg/ml终浓度.将添加了肽的脾细胞在37℃下在5 % co2的气氛下孵育过夜,以体外再刺激该肽。然后,在从孔中除去上清后,将elispot板依照制造商的方案进行细胞染色处理。染色斑点在immunospot analyzer上计数。
[0397]
结果表明包含式4的化合物和肽seq id no: 3的鸡尾酒疫苗a在hla-a
*
02:01转基因小鼠中诱导了响应于肽seq id no: 1或seq id no: 4的ctl。并且,如试验3的结果那样,与未添加参考例12中制备的化合物的情况相比,在将实施例1中制备的化合物添加至鸡尾酒疫苗a的情况中,响应于肽seq id no: 1或seq id no: 4的ctl计数更多。
[0398]
上述结果表明诱导的ctl计数通过对疫苗添加实施例1中制备的化合物而增加,并且强烈暗示实施例1中制备的化合物具有体内佐剂活性。此外,结果还表明与参考例12中制
备的不具有peg结构的化合物相比,实施例1中制备的化合物增加ctl的效果更高。
[0399]
试验5增强疫苗对肿瘤生长的体内抑制效果的效果将3-甲基胆蒽在玉米油中的悬浮液对hla-a
*
24:02转基因小鼠进行腹侧区皮内给药。从在给药部位产生的肿瘤获得hla-a
*
2402/kb表达肿瘤细胞。将通过在该细胞中稳定表达wt1抗原肽(seq id no: 2)而建立的细胞系(本位中也称为mca-a24/kb-wt1肿瘤细胞)悬浮于hanks’平衡盐溶液中,并皮内移植到hla-a
*
24:02转基因小鼠的腹侧区(5
ꢀ×ꢀ
10
5 细胞/小鼠)。将接受介质(a组)、疫苗 (b组)或含有实施例1中制备的化合物的疫苗(c组)的小鼠分类。每组使用6只小鼠。在肿瘤移植7天前和肿瘤移植7天后,对于a组小鼠,将包含注射用水的组合物用等体积的montanide isa 51 vg乳化,并将乳液在尾根区域进行皮内给药(每只小鼠每次给药0.1 ml)。对于b组小鼠,将包含式4的化合物和肽seq id no: 3的组合物用等体积的montanide isa 51 vg乳化,并将乳液在尾根区域进行皮内给药(每次给药,每只300 μg式4的化合物和每只225 μg肽seq id no: 3)。对于c组小鼠,将包含式4的化合物、肽seq id no: 3和实施例1中制备的化合物的组合物用等体积的montanide isa 51 vg乳化,并将乳液在尾根区域进行皮内给药(每次给药,每只300 μg式4的化合物、每只225 μg肽seq id no: 3和每只100 ng实施例1中制备的化合物)。肿瘤移植27天后测量肿瘤直径,计算肿瘤体积。
[0400]
图2示出肿瘤移植后第27天各组中6只小鼠的平均肿瘤体积。与介质(a组)的情况相比,疫苗(b组)显著抑制肿瘤细胞的生长(非参数dunnett多重检验,*: p 《 0.05)。进而,添加了实施例1中制备的化合物的疫苗更有效地抑制肿瘤细胞的生长(c组,**: p 《 0.01)。
[0401]
结果表明,通过向疫苗添加本发明的化合物,可以增强用疫苗抑制肿瘤生长的预防作用。
[0402]
根据参考例1中记载的方法,由各相应的起始原料将表7中所示的肽制备为它们的三氟乙酸盐。因为它们不在本发明的化合物的范围内,所以将这些化合物作为参考例处理。
[0403]
根据wo 2007/0639032中记载的方法,将表8中所示的化合物制备为其三氟乙酸盐(其中c-c间的键为二硫键)。因为其不在本发明的化合物的范围内,因而将该化合物作为参考例处理。
[0404]
试验6hla-a
*
02:01转基因小鼠中的体内佐剂活性的评价实施例1的化合物的体内佐剂活性在下述步骤中进行评价。向通过将参考例6中制备的肽seq id no: 6与montanide isa 51 vg混合而制备的疫苗(以下,称为“疫苗c”)添加实施例1中制备的化合物以制备疫苗。将疫苗对hla-a
*
02:01转基因小鼠给药,通过试验抗原特异性ctl诱导来评价疫苗的佐剂活性。肽seq id no: 6中的glydgmehl对应于来源于hla-a
*
02:01-限制性mage-a10蛋白的抗原肽。
[0405]
疫苗c诱导对抗原肽(seq id no: 6)特异性的ctl的特性是通过测量用肽刺激来自小鼠的脾细胞时是否能够产生ifnγ来评价。此外,实施例1中的化合物发挥体内佐剂活性的特性是通过比较由疫苗c诱导的ctl的数量和由通过将实施例1中制备的化合物添加至疫苗c而制备的疫苗诱导的ctl的数量,并检查有无数量的增加来进行评价。
[0406]
具体地,将肽seq id no: 6溶解于dmso中,然后用注射用水稀释至0.1 mg/ml的浓度。混合稀释的肽溶液并用等体积的montanide isa 51 vg乳化而制备疫苗c。将疫苗c以每只10 μg肽seq id no: 6的给药量在尾根区域对小鼠进行皮内注射。或者,在制备疫苗c的步骤中,将实施例1中制备的化合物添加至稀释的肽溶液中以制备疫苗,将该制备的疫苗以每只10 μg肽seq id no: 6和每只0.4 nmol实施例1中制备的化合物的给药量在尾根区域对小鼠进行皮内注射。 给药是以一周间隔进行两次。最终给药一周后,将小鼠用co2气体处死。从取自小鼠的脾脏中收获脾细胞。如试验4那样,将肽(seq id no: 6)以10 μg/ml的终浓度添加至含有脾细胞的elispot板,将该板在37℃下在5 % co2的气氛下孵育过夜,以体外再刺激该肽。然后,从孔中除去上清后,对elispot板上的染色斑点进行计数。
[0407]
结果示于图3。图3中,纵轴表示来自每组各三只小鼠的响应于添加的细胞的刺激而产生ifnγ的细胞的平均数。给药至小鼠的疫苗表示于横轴上。图3中的黑色柱和白色柱分别表示来自hla-a
*
02:01转基因小鼠的脾细胞在肽seq id no: 6的存在或不存在下孵育的结果。本试验的结果表明,与未添加化合物的情况相比,在将实施例1中制备的化合物添加至疫苗c的情况中,响应于肽seq id no: 6的ctl计数更多。
[0408]
上述结果表明诱导的ctl计数通过对疫苗添加实施例1中制备的化合物而增加,并且强烈暗示实施例1中制备的化合物具有体内佐剂活性。
[0409]
试验7hla-a
*
02:01转基因小鼠中的体内佐剂活性的评价实施例1的化合物的体内佐剂活性在下述步骤中进行评价。向通过将参考例5中制备的肽seq id no: 5与montanide isa 51 vg混合而制备的疫苗(以下,称为“疫苗d”)添加实施例1中制备的化合物以制备疫苗。将疫苗对hla-a
*
02:01转基因小鼠给药,通过试验抗
原特异性ctl诱导来评价疫苗的佐剂活性。肽seq id no: 5中的vlqelnvtv对应于来源于hla-a
*
02:01-限制性蛋白酶-3蛋白的抗原肽。
[0410]
疫苗d诱导对抗原肽(seq id no: 5)特异性的ctl的特性是通过测量用肽刺激来自小鼠的脾细胞时是否能够产生ifnγ来评价。此外,实施例1中的化合物发挥体内佐剂活性的特性是通过比较由疫苗d诱导的ctl的数量和由通过将实施例1中制备的化合物添加至疫苗d而制备的疫苗诱导的ctl的数量,并检查有无数量的增加来进行评价。
[0411]
具体地,将肽seq id no: 5溶解于dmso中,然后用注射用水稀释至2 mg/ml的浓度。混合稀释的肽溶液并用等体积的montanide isa 51 vg乳化而制备疫苗d。将疫苗d以每只100 μg肽seq id no: 5的给药量在尾根区域对小鼠进行皮内注射。或者,在制备疫苗d的步骤中,将实施例1中制备的化合物添加至稀释的肽溶液中以制备疫苗,将该制备的疫苗以每只100 μg肽seq id no: 5和每只330 ng实施例1中制备的化合物的给药量在尾根区域对小鼠进行皮内注射。 1周后,将小鼠用co2气体处死。从取自小鼠的脾脏中收获脾细胞。如试验4那样,将肽(seq id no: 5)以10 μg/ml的终浓度添加至含有脾细胞的elispot板,将该板在37℃下在5 % co2的气氛下孵育过夜,以体外再刺激该肽。然后,从孔中除去上清后,对elispot板上的染色斑点进行计数。
[0412]
结果示于图4。图4中,纵轴表示来自每组各三只小鼠的响应于添加的细胞的刺激而产生ifnγ的细胞的平均数。给药至小鼠的疫苗表示于横轴上。图4中的黑色柱和白色柱分别表示来自hla-a
*
02:01转基因小鼠的脾细胞在肽seq id no: 5的存在或不存在下孵育的结果。本试验的结果表明,与未添加化合物的情况相比,在将实施例1中制备的化合物添加至疫苗d的情况中,响应于seq id no: 5的肽的ctl计数更多。
[0413]
上述结果表明诱导的ctl计数通过对疫苗添加实施例1中制备的化合物而增加,并且强烈暗示实施例1中制备的化合物具有体内佐剂活性。
[0414]
试验8hla-a
*
24:02转基因小鼠中的体内佐剂活性的评价实施例1的化合物的体内佐剂活性在下述步骤中进行评价。向通过将参考例20中制备的肽seq id no: 18与montanide isa 51 vg混合而制备的疫苗(以下,称为“疫苗e”)添加实施例1中制备的化合物以制备疫苗。将疫苗对hla-a
*
24:02转基因小鼠给药,通过试验抗原特异性ctl诱导来评价疫苗的佐剂活性。肽seq id no: 18中的tyagclsqif对应于来源于hla-a
*
24:02-限制性or7c1蛋白的抗原肽。
[0415]
疫苗e诱导对抗原肽(seq id no: 18)特异性的ctl的特性是通过测量用肽刺激来自小鼠的脾细胞时是否能够产生ifnγ来评价。此外,实施例1中的化合物发挥体内佐剂活性的特性是通过比较由疫苗e诱导的ctl的数量和由通过将实施例1中制备的化合物添加至疫苗e而制备的疫苗诱导的ctl的数量,并检查有无数量的增加来进行评价。
[0416]
具体地,将肽seq id no: 18溶解于dmso中,然后用注射用水稀释至3 mg/ml的浓度。混合稀释的肽溶液并用等体积的montanide isa 51 vg乳化而制备疫苗e。将疫苗e以每只300 μg肽seq id no: 18的给药量在尾根区域对小鼠进行皮内注射。或者,在制备疫苗e的步骤中,将实施例1中制备的化合物添加至稀释的肽溶液中以制备疫苗,将该制备的疫苗以每只300 μg肽seq id no: 18和每只0.4 nmol实施例1中制备的化合物的给药量在尾根区域对小鼠进行皮内注射。 给药是以一周间隔进行两次。最终给药一周后,将小鼠用co2气
体处死。从取自小鼠的脾脏中收获脾细胞。如试验3那样,将肽(seq id no: 18)以10 μg/ml的终浓度添加至含有脾细胞的elispot板,将该板在37℃下在5 % co2的气氛下孵育过夜,以体外再刺激该肽。然后,从孔中除去上清后,对elispot板上的染色斑点进行计数。
[0417]
结果示于图5。图5中,纵轴表示来自每组各三只小鼠的响应于添加的细胞的刺激而产生ifnγ的细胞的平均数。给药至小鼠的疫苗表示于横轴上。图5中的黑色柱和白色柱分别表示来自hla-a
*
24:02转基因小鼠的脾细胞在肽seq id no: 18的存在或不存在下孵育的结果。本试验的结果表明,与未添加化合物的情况相比,在将实施例1中制备的化合物添加至疫苗e的情况中,响应于seq id no: 18的肽的ctl计数更多。
[0418]
上述结果表明诱导的ctl计数通过对疫苗添加实施例1中制备的化合物而增加,并且强烈暗示实施例1中制备的化合物具有体内佐剂活性。
[0419]
试验9hla-a
*
02:01转基因小鼠中的体内佐剂活性的评价实施例8、9和10中制备的化合物和参考例12中制备的化合物的体内佐剂活性在下述步骤中进行评价。向包含参考例8中制备的式4的化合物和参考例3中制备的肽seq id no: 3与montanide isa51 vg的鸡尾酒疫苗b中添加实施例8、9或10中制备的化合物、或参考例12中制备的化合物以制备各疫苗。将疫苗对hla-a
*
02:01转基因小鼠给药,通过试验抗原特异性ctl诱导来评价各疫苗的佐剂活性。
[0420]
具体地,将式4的化合物和肽seq id no: 3溶解于dmso中,然后用注射用水稀释至3 mg/ml式4的化合物和2.25 mg/ml肽seq id no: 3的浓度。混合稀释的肽溶液并用等体积的montanide isa 51 vg乳化而制备鸡尾酒疫苗b。将鸡尾酒疫苗b以每只300 μg式4的化合物和每只225 μg肽seq id no: 3的给药量在尾根区域对小鼠进行皮内注射。或者,在制备鸡尾酒疫苗b的步骤中,将实施例8、9或10中制备的化合物、或参考例12中制备的化合物添加至稀释的肽溶液中而制备疫苗,将该制备的疫苗以每只300 μg式4的化合物、每只225 μg肽seq id no: 3和每只0.4 nmol实施例8、9或10中制备的化合物、或参考例12中制备的化合物的给药量在尾根区域对小鼠进行皮内注射。给药是以一周间隔进行两次。最终给药一周后,将小鼠用co2气体处死。从取自小鼠的脾脏中收获脾细胞。如试验4那样,将肽(seq id no: 1或seq id no: 4)以10 μg/ml的终浓度添加至含有脾细胞的elispot板,将该板在37℃下在5 % co2的气氛下孵育过夜,以体外再刺激该肽。然后,从孔中除去上清后,对elispot板上的染色斑点进行计数。
[0421]
结果示于图6和图7。本试验的结果表明,与未添加化合物的情况相比,在将实施例8、9或10中制备的化合物或参考例12中制备的化合物添加至鸡尾酒疫苗b的情况中,响应于肽的ctl计数更多。此外,结果表明,与参考例12中制备的化合物的情况相比,在添加实施例8、9或10中制备的化合物的情况中,响应于肽的ctl计数更多。
[0422]
上述结果表明诱导的ctl计数通过对疫苗添加实施例8、9或10中制备的化合物而增加,并且强烈暗示实施例8、9或10中制备的化合物具有体内佐剂活性。此外,结果还表明与参考例12中制备的不具有peg结构的化合物相比,实施例8、9或10中制备的化合物增加ctl的效果更高。
[0423]
试验10hla-a
*
02:01转基因小鼠中的体内佐剂活性的评价
实施例11的化合物的体内佐剂活性在下述步骤中进行评价。如试验9那样,向鸡尾酒疫苗b添加实施例11中制备的化合物而制备疫苗。将疫苗对hla-a
*
02:01转基因小鼠给药,通过试验抗原特异性ctl诱导来评价疫苗的佐剂活性。
[0424]
具体地,将式4的化合物和肽seq id no: 3溶解于dmso中,然后用注射用水稀释至3 mg/ml式4的化合物和2.25 mg/ml肽seq id no: 3的浓度。混合稀释的肽溶液并用等体积的montanide isa 51 vg乳化而制备鸡尾酒疫苗b。将鸡尾酒疫苗b以每只300 μg式4的化合物和每只225 μg肽seq id no: 3的给药量在尾根区域对小鼠进行皮内注射。或者,在制备鸡尾酒疫苗b的步骤中,将实施例11中制备的化合物添加至稀释的肽溶液中以制备疫苗,将该制备的疫苗以每只300 μg式4的化合物、每只225 μg肽seq id no: 3和每只0.4 nmol实施例11中制备的化合物的给药量在尾根区域对小鼠进行皮内注射。给药是以一周间隔进行两次。最终给药一周后,将小鼠用co2气体处死。从取自小鼠的脾脏中收获脾细胞。如试验4那样,将肽(seq id no: 1或seq id no: 4)以10 μg/ml的终浓度添加至含有脾细胞的elispot板,将该板在37℃下在5 % co2的气氛下孵育过夜,以体外再刺激该肽。然后,从孔中除去上清后,对elispot板上的染色斑点进行计数。
[0425]
结果示于图8和图9。本试验的结果表明,与未添加化合物的情况相比,在将实施例11中制备的化合物添加至鸡尾酒疫苗b的情况中,响应于肽 seq id no: 1或seq id no: 4的ctl计数更多。
[0426]
上述结果表明诱导的ctl计数通过对疫苗添加实施例11中制备的化合物而增加,并且强烈暗示实施例11中制备的化合物具有体内佐剂活性。
[0427]
试验11hla-a
*
02:01转基因小鼠中的体内佐剂活性的评价实施例1的化合物的体内佐剂活性在下述步骤中进行评价。向包含参考例8中制备的式4的化合物和参考例3中制备的肽seq id no: 3的鸡尾酒疫苗(乳化组合物1)(以下,称为“鸡尾酒疫苗f”)中添加实施例1中制备的化合物以制备疫苗。将疫苗对hla-a
*
02:01转基因小鼠给药,通过试验抗原特异性ctl诱导来评价疫苗的佐剂活性。
[0428]
例如,上述乳化组合物1如下制备。将95.8 % (w/w)大豆油、3 % (w/w)peg-30二多羟基硬脂酸酯和1.2 % (w/w)聚山梨酯80混合,制备油相混合物。制剂的量根据需要进行调节。将式4的化合物和肽seq id no: 3与ph 2.5缓冲液(10 mm 酒石酸,10 %海藻糖)混合,以将各浓度分别调节至3 mg/ml和2.25 mg/ml。将制备的肽稀释液与等体积的油相混合物混合,得到乳化产物,即鸡尾酒疫苗f。将鸡尾酒疫苗f以每只300 μg式4的化合物和每只225 μg肽seq id no: 3的给药量在尾根区域对小鼠进行皮内注射。 或者,在制备鸡尾酒疫苗f的步骤中,将实施例1中制备的化合物添加至稀释的肽溶液中以制备疫苗,将该制备的疫苗以每只300 μg式4的化合物、每只225 μg肽seq id no: 3和每只0.04 nmol或0.4 nmol实施例1中制备的化合物的给药量在尾根区域对小鼠进行皮内注射。给药是以一周间隔进行两次。最终给药一周后,将小鼠用co2气体处死。从取自小鼠的脾脏中收获脾细胞。如试验4那样,将肽(seq id no: 1或seq id no: 4)以10 μg/ml的终浓度添加至含有脾细胞的elispot板,将该板在37℃下在5 % co2的气氛下孵育过夜,以体外再刺激该肽。然后,从孔中除去上清后,对elispot板上的染色斑点进行计数。
[0429]
结果示于图10和图11。本试验的结果表明,与未添加化合物的情况相比,在将实施
例1中制备的化合物添加至鸡尾酒疫苗f的情况中,响应于肽 seq id no: 1或seq id no: 4的ctl计数更多。
[0430]
上述结果表明诱导的ctl计数通过对疫苗添加实施例1中制备的化合物而增加,并且强烈暗示实施例1中制备的化合物具有体内佐剂活性。
[0431]
试验12hla-a
*
02:01转基因小鼠中的体内佐剂活性的评价实施例1的化合物的体内佐剂活性在下述步骤中进行评价。向包含参考例8中制备的式4的化合物和参考例3中制备的肽seq id no: 3的鸡尾酒疫苗(乳化组合物2)(以下,称为“鸡尾酒疫苗g”)中添加实施例1中制备的化合物以制备疫苗。将疫苗对hla-a
*
02:01转基因小鼠给药,通过试验抗原特异性ctl诱导来评价疫苗的佐剂活性。
[0432]
例如,上述乳化组合物2如下制备。将95.8 % (w/w)中链甘油三酯 (myglyol 812)、3 % (w/w)peg-30二多羟基硬脂酸酯和1.2 % (w/w)聚山梨酯80 混合,制备油相混合物。制剂的量根据需要进行调节。式4的化合物和肽seq id no: 3与ph 2.5缓冲液(10 mm 酒石酸,10 %海藻糖)混合,以将各浓度分别调节至3 mg/ml和2.25 mg/ml。将制备的肽稀释液与等体积的油相混合物混合,得到乳化产物,即鸡尾酒疫苗g。将鸡尾酒疫苗g以每只300 μg式4的化合物和每只225 μg肽seq id no: 3的给药量在尾根区域对小鼠进行皮内注射。或者,在制备鸡尾酒疫苗g的步骤中,将实施例1中制备的化合物添加至稀释的肽溶液中以制备疫苗,将该制备的疫苗以每只300 μg式4的化合物、每只225 μg肽seq id no: 3和每只0.04 nmol或0.4 nmol实施例1中制备的化合物的给药量在尾根区域对小鼠进行皮内注射。给药是以一周间隔进行两次。最终给药一周后,将小鼠用co2气体处死。从取自小鼠的脾脏中收获脾细胞。如试验4那样,将肽(seq id no: 1或seq id no: 4)以10 μg/ml的终浓度添加至含有脾细胞的elispot板,将该板在37℃下在5 % co2的气氛下孵育过夜,以体外再刺激该肽。然后,从孔中除去上清后,对elispot板上的染色斑点进行计数。
[0433]
结果示于图12和图13。本试验的结果表明,与未添加化合物的情况相比,在将实施例1中制备的化合物添加至鸡尾酒疫苗g的情况中,响应于肽 seq id no: 1或seq id no: 4的ctl计数更多。
[0434]
上述结果表明诱导的ctl计数通过对疫苗添加实施例1中制备的化合物而增加,并且强烈暗示实施例1中制备的化合物具有体内佐剂活性。
[0435]
试验13hla-a
*
02:01转基因小鼠中的体内佐剂活性的评价实施例1的化合物的体内佐剂活性在下述步骤中进行评价。向包含参考例8中制备的式4的化合物和参考例3中制备的肽seq id no: 3的鸡尾酒疫苗(乳化组合物3)(以下,称为“鸡尾酒疫苗h”)中添加实施例1中制备的化合物以制备疫苗。将疫苗对hla-a
*
02:01转基因小鼠给药,通过试验抗原特异性ctl诱导来评价疫苗的佐剂活性。
[0436]
例如,上述乳化组合物3如下制备。将95.8 % (w/w)肉豆蔻酸异丙酯、3 % (w/w) peg-30二多羟基硬脂酸酯和1.2 % (w/w)聚山梨酯80混合,制备油相混合物。制剂的量根据需要进行调节。式4的化合物和肽seq id no: 3与ph 2.5缓冲液(10 mm 酒石酸,10 %海藻糖)混合,以将各浓度分别调节至3 mg/ml和2.25 mg/ml。将制备的肽稀释液与等体积的油相混合物混合,得到乳化产物,即鸡尾酒疫苗h。将鸡尾酒疫苗h以每只300 μg式4的化合物
和225 μg肽seq id no: 3的给药量在尾根区域对小鼠进行皮内注射。或者,在制备鸡尾酒疫苗h的步骤中,将实施例1中制备的化合物添加至稀释的肽溶液中以制备疫苗,将该制备的疫苗以每只300 μg式4的化合物、每只225 μg肽seq id no: 3和0.04 nmol实施例1中制备的化合物的给药量在尾根区域对小鼠进行皮内注射。给药是以一周间隔进行两次。最终给药一周后,将小鼠用co2气体处死。从取自小鼠的脾脏中收获脾细胞。如试验4那样,将肽(seq id no: 1)以10 μg/ml的终浓度添加至含有脾细胞的elispot板,将该板在37℃下在5 % co2的气氛下孵育过夜,以体外再刺激该肽。然后,从孔中除去上清后,对elispot板上的染色斑点进行计数。
[0437]
结果示于图14。本试验的结果表明,与未添加化合物的情况相比,在将实施例1中制备的化合物添加至鸡尾酒疫苗h的情况中,响应于肽seq id no: 1的ctl计数更多。
[0438]
上述结果表明诱导的ctl计数通过对疫苗添加实施例1中制备的化合物而增加,并且强烈暗示实施例1中制备的化合物具有体内佐剂活性。
[0439]
图26示出试验11~13中试验的小鼠中的各脾脏重量的结果。本发明的结果表明实施例1的给药不诱导显著的脾脏重量增加,暗示实施例1中制备的化合物具有体内佐剂活性而不引起脾肿大。
[0440]
试验14hla-a
*
02:01转基因小鼠中的体内佐剂活性的评价实施例1的化合物的体内佐剂活性在下述步骤中进行评价。向包含参考例8中制备的式4的化合物和参考例3中制备的肽seq id no: 3的鸡尾酒疫苗(油悬浮液制剂)(以下,称为“鸡尾酒疫苗i”)中添加实施例1中制备的化合物以制备疫苗。将疫苗对hla-a
*
02:01转基因小鼠给药,通过试验抗原特异性ctl诱导来评价疫苗的佐剂活性。
[0441]
例如,上述油悬浮液制剂如下制备。将蔗糖脂肪酸酯(ryoto sugar ester l-195)溶解于环己烷中以调节浓度至12.5 mg/ml,然后将式4的化合物和肽seq id no: 3添加至该溶液中,调节各自浓度为0.75 mg/ml和0.5625 mg/ml,得到油相混合物。相对于2 ml油相混合物,将1 ml的ph 2.5缓冲液(10 mm 酒石酸, 10 % 海藻糖)添加至油相混合物中,并将混合物用匀浆器分散并冻干。向冻干的产物添加1 ml肉豆蔻酸异丙酯,得到油悬浮液制剂,即鸡尾酒疫苗i。制剂的量根据需要进行调节。
[0442]
将鸡尾酒疫苗i以每只300 μg式4的化合物和每只225 μg肽seq id no: 3的给药量在尾根区域对小鼠进行皮内注射。或者,在制备鸡尾酒疫苗i的步骤中,将实施例1中制备的化合物添加至ph 2.5缓冲液中以制备疫苗,将该制备的疫苗以每只300 μg式4的化合物、每只225 μg肽seq id no: 3和每只0.04 nmol或0.4 nmol实施例1中制备的化合物的给药量在尾根区域对小鼠进行皮内注射。给药是以一周间隔进行两次。最终给药一周后,将小鼠用co2气体处死。从取自小鼠的脾脏中收获脾细胞。如试验4那样,将肽(seq id no: 1或seq id no: 4)以10 μg/ml的终浓度添加至含有脾细胞的elispot板,将该板在37℃下在5 % co2的气氛下孵育过夜,以体外再刺激该肽。然后,从孔中除去上清后,对elispot板上的染色斑点进行计数。
[0443]
结果示于图15和图16。本试验的结果表明,与未添加化合物的情况相比,在将实施例1中制备的化合物添加至鸡尾酒疫苗i的情况中,响应于肽 seq id no: 1或seq id no: 4的ctl计数更多。
[0444]
上述结果表明诱导的ctl计数通过对疫苗添加实施例1中制备的化合物而增加,并且强烈暗示实施例1中制备的化合物具有体内佐剂活性。
[0445]
试验15hla-a
*
02:01转基因小鼠中的体内佐剂活性的评价实施例1的化合物的体内佐剂活性在下述步骤中进行评价。向包含参考例8中制备的式4的化合物和参考例3中制备的肽seq id no: 3的疫苗(水凝胶制剂)(以下,称为“鸡尾酒疫苗j”)中添加实施例1中制备的化合物以制备疫苗。将疫苗对hla-a
*
02:01转基因小鼠给药,通过试验抗原特异性ctl诱导来评价疫苗的佐剂活性。
[0446]
例如,上述水凝胶制剂如下制备。将式4的化合物、肽seq id no: 3和聚氧乙烯(196)聚氧丙烯(67)二醇与ph 2.5缓冲液(10 mm 酒石酸)混合,以将各浓度分别调节至1.5 mg/ml、1.125 mg/ml和200 mg/ml。将混合物冷却至冰温度,得到水凝胶制剂,即鸡尾酒疫苗j。制剂的量根据需要进行调节。
[0447]
将鸡尾酒疫苗j以每只300 μg式4的化合物和每只225 μg肽seq id no: 3的给药量在尾根区域对小鼠进行皮内注射。或者,在制备鸡尾酒疫苗j的步骤中,将实施例1中制备的化合物添加至ph 2.5缓冲液中以制备疫苗,将该制备的疫苗以每只300 μg式4的化合物、每只225 μg肽seq id no: 3和每只0.4 nmol实施例1中制备的化合物的给药量在尾根区域对小鼠进行皮内注射。给药是以一周间隔进行两次。最终给药一周后,将小鼠用co2气体处死。从取自小鼠的脾脏中收获脾细胞。如试验4那样,将肽(seq id no: 1或seq id no: 4)以10 μg/ml的终浓度添加至含有脾细胞的elispot板,将该板在37℃下在5 % co2的气氛下孵育过夜,以体外再刺激该肽。然后,从孔中除去上清后,对elispot板上的染色斑点进行计数。
[0448]
结果示于图17和图18。本试验的结果表明,与未添加化合物的情况相比,在将实施例1中制备的化合物添加至鸡尾酒疫苗j的情况中,响应于肽 seq id no: 1或seq id no: 4的ctl计数更多。
[0449]
上述结果表明诱导的ctl计数通过对疫苗添加实施例1中制备的化合物而增加,并且强烈暗示实施例1中制备的化合物具有体内佐剂活性。
[0450]
图27示出试验14和15中试验的小鼠中的各脾脏重量的结果。本发明的结果表明实施例1的给药不诱导显著的脾脏重量增加,暗示实施例1中制备的化合物具有体内佐剂活性而不引起脾肿大。
[0451]
试验16hla-a
*
02:01转基因小鼠中的体内佐剂活性的评价实施例1的化合物的体内佐剂活性在下述步骤中进行评价。向包含参考例8中制备的式4的化合物和参考例3中制备的肽seq id no: 3的疫苗(脂质体制剂1)(以下,称为“鸡尾酒疫苗k”)中添加实施例1中制备的化合物以制备疫苗。将疫苗对hla-a
*
02:01转基因小鼠给药,通过试验抗原特异性ctl诱导来评价疫苗的佐剂活性。
[0452]
例如,上述脂质体制剂1如下制备。将47.1 mg氢化大豆磷脂酰胆碱和15.47 mg胆固醇溶解于叔丁醇中,将混合物冻干。向冻干的产物添加2 ml的含有2.5 mg/ml式4的化合物和1.875 mg/ml肽seq id no: 3的ph 2.5缓冲液(10 mm 酒石酸, 10 % 海藻糖),利用在约65℃下加热的挤压机(mini-extruder, avanti polar lipids),经由0.1 μm聚碳酸酯膜
滤器过滤该溶液,得到脂质体制剂1,即鸡尾酒疫苗k。制剂的量根据需要进行调节。
[0453]
将鸡尾酒疫苗k以每只500 μg式4的化合物和每只375 μg肽seq id no: 3的给药量在尾根区域对小鼠进行皮内注射。或者,在制备鸡尾酒疫苗k的步骤中,将实施例1中制备的化合物添加至ph 2.5缓冲液中以制备疫苗,将该制备的疫苗以每只500 μg式4的化合物、每只375 μg肽seq id no: 3和每只0.4 nmol实施例1中制备的化合物的给药量在尾根区域对小鼠进行皮内注射。给药是以一周间隔进行两次。最终给药一周后,将小鼠用co2气体处死。从取自小鼠的脾脏中收获脾细胞。如试验4那样,将肽(seq id no: 1)以10 μg/ml的终浓度添加至含有脾细胞的elispot板,将该板在37℃下在5 % co2的气氛下孵育过夜,以体外再刺激该肽。然后,从孔中除去上清后,对elispot板上的染色斑点进行计数。
[0454]
结果示于图19。本试验的结果表明,与未添加化合物的情况相比,在将实施例1中制备的化合物添加至鸡尾酒疫苗k的情况中,响应于肽seq id no: 1的ctl计数更多。
[0455]
上述结果表明诱导的ctl计数通过对疫苗添加实施例1中制备的化合物而增加,并且强烈暗示实施例1中制备的化合物具有体内佐剂活性。
[0456]
试验17hla-a
*
02:01转基因小鼠中的体内佐剂活性的评价实施例1的化合物的体内佐剂活性在下述步骤中进行评价。
[0457]
向包含参考例8中制备的式4的化合物和参考例3中制备的肽seq id no: 3的疫苗(脂质体制剂2)(以下,称为“鸡尾酒疫苗l”)中添加实施例1中制备的化合物以制备疫苗。将疫苗对hla-a
*
02:01转基因小鼠给药,通过试验抗原特异性ctl诱导来评价疫苗的佐剂活性。
[0458]
例如,上述脂质体制剂2如下制备。将42.66 mg的鞘磷脂和15.47 mg的胆固醇溶解于叔丁醇中,将混合物冻干。向冻干的产物添加2 ml的含有2.5 mg/ml式4的化合物和1.875 mg/ml肽seq id no: 3的ph 2.5缓冲液(10 mm 酒石酸, 10 % 海藻糖),利用在约65℃下加热的挤压机(mini-extruder, avanti polar lipids),经由0.1 μm聚碳酸酯膜滤器过滤该溶液,得到脂质体制剂2,即鸡尾酒疫苗l。制剂的量根据需要进行调节。
[0459]
将鸡尾酒疫苗l以每只500 μg式4的化合物和每只375 μg肽seq id no: 3的给药量在尾根区域对小鼠进行皮内注射。或者,在制备鸡尾酒疫苗l的步骤中,将实施例1中制备的化合物添加至ph 2.5缓冲液中以制备疫苗,将该制备的疫苗以每只500 μg式4的化合物、每只375 μg肽seq id no: 3和每只0.4 nmol实施例1中制备的化合物的给药量在尾根区域对小鼠进行皮内注射。给药是以一周间隔进行两次。最终给药一周后,将小鼠用co2气体处死。从取自小鼠的脾脏中收获脾细胞。如试验4那样,将肽(seq id no: 1或seq id no: 4)以10 μg/ml的终浓度添加至含有脾细胞的elispot板,将该板在37℃下在5 % co2的气氛下孵育过夜,以体外再刺激该肽。然后,从孔中除去上清后,对elispot板上的染色斑点进行计数。
[0460]
结果示于图20和图21。本试验的结果表明,与未添加化合物的情况相比,在将实施例1中制备的化合物添加至鸡尾酒疫苗l的情况中,响应于肽 seq id no: 1或seq id no: 4的ctl计数更多。
[0461]
上述结果表明诱导的ctl计数通过对疫苗添加实施例1中制备的化合物而增加,并且强烈暗示实施例1中制备的化合物具有体内佐剂活性。
[0462]
试验18hla-a
*
02:01转基因小鼠中的体内佐剂活性的评价实施例1的化合物的体内佐剂活性在下述步骤中进行评价。向包含参考例8中制备的式4的化合物和参考例3中制备的肽seq id no: 3的疫苗(脂质体制剂3)(以下,称为“鸡尾酒疫苗m”)中添加实施例1中制备的化合物以制备疫苗。将疫苗对hla-a
*
02:01转基因小鼠给药,通过试验抗原特异性ctl诱导来评价疫苗的佐剂活性。
[0463]
例如,上述脂质体制剂3如下制备。将36.7 mg的1,2-二棕榈酰基-sn-甘油基-3-磷酸胆碱、7.58 mg的1,2-二棕榈酰基-sn-甘油基-3-磷酸-l-丝氨酸钠盐和15.47 mg的胆固醇溶解于叔丁醇/水混合物中,将该混合物冻干。向冻干的产物添加2 ml的含有2.5 mg/ml式4的化合物和1.875 mg/ml肽seq id no: 3的ph 2.5缓冲液(10 mm 酒石酸, 10 % 海藻糖),利用在约65℃下加热的挤压机(mini-extruder, avanti polar lipids),经由0.1 μm聚碳酸酯膜滤器过滤该溶液,得到脂质体制剂3,即鸡尾酒疫苗m。制剂的量根据需要进行调节。
[0464]
将鸡尾酒疫苗m以每只500 μg式4的化合物和每只375 μg肽seq id no: 3的给药量在尾根区域对小鼠进行皮内注射。 或者,在制备鸡尾酒疫苗m的步骤中,将实施例1中制备的化合物添加至ph 2.5缓冲液中以制备疫苗,将该制备的疫苗以每只500 μg式4的化合物、每只375 μg肽seq id no: 3和每只0.4 nmol实施例1中制备的化合物的给药量在尾根区域对小鼠进行皮内注射。给药是以一周间隔进行两次。最终给药一周后,将小鼠用co2气体处死。从取自小鼠的脾脏中收获脾细胞。如试验4那样,将肽(seq id no: 1)以10 μg/ml的终浓度添加至含有脾细胞的elispot板,将该板在37℃下在5 % co2的气氛下孵育过夜,以体外再刺激该肽。然后,从孔中除去上清后,对elispot板上的染色斑点进行计数。
[0465]
结果示于图22。本试验的结果表明,与未添加化合物的情况相比,在将实施例1中制备的化合物添加至鸡尾酒疫苗m的情况中,响应于肽seq id no: 1的ctl计数更多。
[0466]
上述结果表明诱导的ctl计数通过对疫苗添加实施例1中制备的化合物而增加,并且强烈暗示实施例1中制备的化合物具有体内佐剂活性。
[0467]
图28示出试验16~18中试验的小鼠中的各脾脏重量的结果。本发明的结果表明实施例1的给药不诱导显著的脾脏重量增加,暗示实施例1中制备的化合物具有体内佐剂活性而不引起脾肿大。
[0468]
试验19hla-a
*
02:01/hla-drb1
*
01:01转基因小鼠中的体内佐剂活性的评价实施例1的化合物的体内佐剂活性在下述步骤中进行评价。向包含参考例1中制备的肽seq id no: 1和参考例20中制备的肽seq id no: 17与预乳化组合物的鸡尾酒疫苗(以下,称为“鸡尾酒疫苗n”)中添加实施例1中制备的化合物以制备各疫苗。将该疫苗对hla-a
*
02:01/hla-drb1
*
01:01转基因小鼠(c57bl/6crhla-a2.1dr1)给药,并通过试验抗原特异性ctl和抗原特异性辅助性t细胞诱导的方法来评价各疫苗的佐剂活性。肽seq id no: 17是来源于wt1蛋白的辅助肽。
[0469]
具体地,将肽seq id no: 1和肽 seq id no: 17溶解于dmso中,然后用注射用水稀释至2 mg/ml的肽seq id no: 1和4 mg/ml的肽 seq id no: 17的浓度。将制备的肽稀释液与等体积的如试验4那样制备的预乳化组合物混合,得到乳化产物,即鸡尾酒疫苗n。将鸡
尾酒疫苗n以每只200 μg肽seq id no: 1和每只400 μg肽seq id no: 17的给药量在尾根区域对小鼠进行皮内注射。 或者,在制备鸡尾酒疫苗n的步骤中,将实施例1中制备的化合物添加至稀释的肽溶液中以制备疫苗,将该制备的疫苗以每只200 μg肽seq id no: 1、每只400 μg肽seq id no: 17和每只0.04 nmol或0.4 nmol实施例1中制备的化合物的给药量在尾根区域对小鼠进行皮内注射。给药是以一周间隔进行两次。最终给药一周后,将小鼠用co2气体处死。从取自小鼠的脾脏中收获脾细胞。如试验4那样,将肽(seq id no: 1或seq id no: 17)以10 μg/ml的终浓度添加至含有脾细胞的elispot板,将该板在37℃下在5 % co2的气氛下孵育过夜,以体外再刺激该肽。然后,从孔中除去上清后,对elispot板上的染色斑点进行计数。
[0470]
结果示于图23和图24。本试验的结果表明,与未添加化合物的情况相比,在将实施例1中制备的化合物添加至鸡尾酒疫苗n的情况中,响应于肽seq id no: 1的ctl计数更多。此外,结果表明,与未添加化合物的情况相比,在将实施例1中制备的化合物添加至鸡尾酒疫苗n的情况中,响应于肽seq id no: 17的辅助t细胞计数更多。
[0471]
上述结果表明诱导的ctl计数和辅助t细胞计数通过对疫苗添加实施例1中制备的化合物而增加,并且强烈暗示实施例1中制备的化合物具有体内佐剂活性。
[0472]
试验20hla-a
*
24:02转基因小鼠中的体内佐剂活性的评价实施例1的化合物的体内佐剂活性在下述步骤中进行评价。向通过混合参考例22中制备的式5的化合物与预乳化组合物而制备的疫苗(以下,称为“疫苗o”)中添加实施例1中制备的化合物以制备疫苗。将疫苗对hla-a
*
24:02转基因小鼠给药,通过试验抗原特异性ctl诱导来评价疫苗的佐剂活性。
[0473]
具体地,将式5的化合物溶解于dmso中,然后用注射用水稀释至3 mg/ml的式5的化合物的浓度。将制备的化合物稀释液与等体积的如试验4那样制备的预乳化组合物混合,得到乳化产物,即疫苗o。将疫苗o以每只300 μg式5的化合物的给药量在尾根区域对小鼠进行皮内注射。或者,在制备疫苗o的步骤中,将实施例1中制备的化合物添加至稀释的化合物溶液以制备疫苗,将该制备的疫苗以每只300 μg式5的化合物和每只0.4 nmol实施例1中制备的化合物的给药量在尾根区域对小鼠进行皮内注射。给药是以一周间隔进行两次。最终给药一周后,将小鼠用co2气体处死。从取自小鼠的脾脏中收获脾细胞。如试验3那样,将肽(seq id no: 2)以10 μg/ml的终浓度添加至含有脾细胞的elispot板,将该板在37℃下在5 % co2的气氛下孵育过夜,以体外再刺激该肽。然后,从孔中除去上清后,对elispot板上的染色斑点进行计数。
[0474]
结果示于图25。本试验的结果表明,与未添加化合物的情况相比,在将实施例或1中制备的化合物添加至疫苗o的情况中,响应于肽seq id no: 2的ctl计数更多。
[0475]
上述结果表明诱导的ctl计数通过对疫苗添加实施例1中制备的化合物而增加,并且强烈暗示实施例1中制备的化合物具有体内佐剂活性。
[0476]
试验 21根据试验1的方法,用下述样品进行人tlr7报告基因测定,结果示于下表中。
[0477]
试验21的结果暗示本发明的实施例化合物可以作为人tlr7激动剂起作用。
[0478]
试验 22根据试验1的方法,用下述样品进行人tlr7报告基因测定,结果示于下表中。本文中使用的细胞是hek-blue
tm htlr7细胞系(invivogen)。hek-blue
tm htlr7细胞系是稳定共转染细胞系,其其在nf-κb应答元件的转录调控下表达全长人tlr7和分泌型seap报告基因。该细胞系的tlr7表达已经通过rt-pcr进行了试验。使用抗生素杀稻瘟菌素和吉欧霉素选择具有稳定表达的转染子。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1