抗半乳糖凝集素-9抗体及其用途的制作方法
抗半乳糖凝集素-9抗体及其用途
1.相关申请
2.本技术要求于2019年5月1日提交的美国临时申请号62/841,732的权益,该申请通过引用整体并入本文。
3.发明背景
4.免疫系统具有识别和摧毁癌细胞的巨大潜力,但控制肿瘤免疫逃逸的复杂网络是广泛有效免疫调节的障碍(martinez-bosch n等人,immune evasion in pancreatic cancer:from mechanisms to therapy.cancers(basel).2018;10(1))。经批准的免疫肿瘤学(io)药物为多种肿瘤类型(例如黑色素瘤、肺癌、肾癌、膀胱癌、某些结肠癌等)提供渐进式生存改善,并且正在迅速整合为附加于和连同手术、化疗和放疗的标准护理。然而,多种其他侵袭性恶性肿瘤的治疗和存活率仍存在重大差距。例如,转移性胰腺导管腺癌(pdac或pda)、胆管癌(cca)和结直肠癌(crc)的5年生存率仍然分别为《9%、《5%和《15%。这些胃肠道肿瘤非常具有侵袭性,许多患者在就诊时就患有晚期疾病,并且批准的免疫疗法的有效性并不理想(rizvi等人,cholangiocarcinoma-evolving concepts and therapeutic strategies;nat rev clin oncol.2018;15(2):95-111;kalyan等人,updates on immunotherapy for colorectal cancer;j gastrointest oncol.2018;9(1):160-169)。
5.第一代检查点抑制剂(抗pd1、抗pdl1和抗ctla4)的成功导致了新的io临床试验疗效和区分的爆炸式增长(holl等人,examining peripheral and tumor cellular immunome in patients with cancer;front immunol.2019;10:1767)。然而,在成功的同时,也有许多不幸的开发失败,因此,仍然需要更新颖和有效的治疗方法。
6.半乳糖凝集素-9是一种串联重复凝集素,其由两个碳水化合物识别结构域(crd)组成,并于1997年首次在患有霍奇金淋巴瘤(hl)的患者中发现和描述(tureci等人,j.biol.chem.1997,272,6416
–
6422)。存在三种同工型,并且可以位于细胞内或细胞外。已在多种癌症中观察到升高的半乳糖凝集素-9水平,包括黑色素瘤、霍奇金淋巴瘤、肝细胞癌、胰腺癌、胃癌、结肠癌和透明细胞肾细胞癌(wdowiak等人int.j.mol.sci.2018,19,210)。在肾癌中,具有半乳糖凝集素-9高表达的患者表现出更晚期的疾病进展,具有更大的肿瘤体积(kawashima等人;bju int.2014;113:320
–
332)。在黑色素瘤中,半乳糖凝集素-9在57%的肿瘤中表达,并且与健康对照相比,晚期黑色素瘤患者的血浆中的半乳糖凝集素-9显著增加(enninga等人,melanoma res.2016 oct;26(5):429
–
441)。许多研究显示了半乳糖凝集素-9作为预后标志物以及最近作为潜在的新药物靶标的实用性(enninga等人,2016;kawashima等人bju int 2014;113:320
–
332;kageshita等人,int j cancer.2002jun 20;99(6):809-16,以及其中的参考资料)。
7.半乳糖凝集素-9已被描述在许多细胞过程(例如粘附、癌细胞聚集、细胞凋亡和趋化性)中发挥重要作用。最近的研究表明,半乳糖凝集素-9在支持肿瘤的免疫调节中发挥作用,例如,通过负调节th1型反应、th2极化和巨噬细胞对m2表型的极化。这项工作还包括一些研究,这些研究表明半乳糖凝集素-9通过与t细胞免疫球蛋白和粘蛋白3(tim-3)受体的相互作用参与了t细胞的直接灭活(dardalhon等人,j immunol.,2010,185,1383-1392;
sanchez-fueyo等人,nat immunol.,2003,4,1093-1101)。
8.还发现半乳糖凝集素-9在极化向肿瘤抑制表型的t细胞分化中,以及在促进致耐受巨噬细胞编程和适应性免疫抑制中发挥作用(daley等人,nat med.,2017,23,556-567)。在胰腺导管腺癌(pda)的小鼠模型中,在肿瘤微环境(tme)中半乳糖凝集素-9与在先天免疫细胞上发现的受体dectin-1之间的检查点相互作用的阻断已被显示增加tme中的抗肿瘤免疫反应并减缓肿瘤进展(daley等人,nat med.,2017,23,556-567)。还发现半乳糖凝集素-9与cd206(m2型巨噬细胞的表面标志物)结合,导致cvl22(mdc)的分泌减少,cvl22是一种巨噬细胞衍生的趋化因子,其与肺癌的更长生存期和更低复发风险相关(enninga等人,j pathol.2018 aug;245(4):468-477)。
9.发明概述
10.本公开内容至少部分基于实体瘤(例如转移性实体瘤)例如胰腺导管腺癌(pdac)、结直肠癌(crc)、肝细胞癌(hcc)和胆管癌(caa)的治疗方案的开发,涉及能够结合人半乳糖凝集素-9的抗体,单独使用或与检查点抑制剂(例如抗pd-1抗体)结合使用。
11.因此,本公开内容的一个方面提供了一种通过施用结合人半乳糖凝集素-9的抗体来治疗受试者的实体瘤的方法。在一些实施方案中,实体瘤是胰腺癌(pda)、结直肠癌(crc)或肝细胞癌(hcc)或胆管癌。在一些实施方案中,该方法包括向患有实体瘤例如pda、crc、hcc或cca的受试者施用有效量的结合人半乳糖凝集素-9的抗体(在本文中称为抗gal 9抗体或抗半乳糖凝集素-9抗体)。
12.在一些实施方案中,抗半乳糖凝集素-9抗体是抗体g9.2-17,其结构在本文中提供。在一些实施方案中,抗半乳糖凝集素-9抗体包含与参考抗体g9.2-17相同的重链互补决定区(cdr)和/或相同的轻链cdr,其序列在本文中提供。在一些实施方案中,抗半乳糖凝集素-9抗体包含抗体g9.2-17的重链可变结构域和/或抗体g9.2-17的轻链可变结构域。
13.在一些实施方案中,抗体包含seq id no:1所示的轻链互补决定区1(cdr1)、seq id no:2所示的轻链互补决定区2(cdr2)和seq id no:3所示的决定区3(cdr3)和/或包含seq id no:4所示的重链互补决定区1(cdr1)、seq id no:5所示的重链互补决定区2(cdr2)和seq id no:6所示的重链互补决定区3(cdr3)。在一些实施方案中,抗体含有包含seq id no:7的重链可变区。在一些实施方案中,抗体含有包含seq id no:8的轻链可变区。在一些实施方案中,抗体含有包含seq id no:19的重链。在一些实施方案中,抗体含有包含seq id no:15的轻链。在一些实施方案中,抗体是g9.2-17 igg4。
14.在一些实施方案中,抗半乳糖凝集素-9抗体以每2-3周一次的约1mg/kg至约30mg/kg(例如,约3mg/kg至约15mg/kg或约2mg/kg至约16mg/kg)的剂量施用至受试者。在一些实施方案中,抗半乳糖凝集素-9抗体以选自2mg/kg、4mg/kg、8mg/kg、12mg/kg或16mg/kg的剂量施用至受试者。在一些实施方案中,抗体每2周施用一次。在一些实施方案中,抗半乳糖凝集素-9抗体以选自2mg/kg、4mg/kg、8mg/kg、12mg/kg或16mg/kg的剂量每2周一次施用至受试者。在一些实施方案中,抗半乳糖凝集素-9抗体每2周一次施用一个周期、每2周一次施用两个周期、每2周一次施用3个周期、每2周一次施用4个周期或每2周一次施用超过4个周期。在一些实施方案中,治疗持续时间为0-3个月、3-6个月、12-24个月或更长。在一些实施方案中,治疗持续时间为12-24个月或更长。在一些实施方案中,周期延续3个月至6个月、或6个月至12个月或12个月至24个月或更长的持续时间。在一些实施方案中,周期长度被修改,例
如临时或永久地修改为更长的持续时间,例如3周或4周。在一些实施方案中,通过静脉输注向受试者施用抗半乳糖凝集素-9抗体。在一些实施方案中,癌症是转移性癌症,包括任何上述癌症的转移性癌症。在一些实施方案中,包括施用抗半乳糖凝集素-9抗体的治疗方法不包括任何其他同步抗癌疗法。
15.在一些实施方案中,采用抗半乳糖凝集素-9抗体的治疗方法包括另一种同步抗癌疗法。因此,在一些实施方案中,采用抗半乳糖凝集素-9抗体的治疗方法进一步包括向受试者施用免疫检查点抑制剂。在一些实施方案中,免疫检查点抑制剂是结合pd-1的抗体,例如,派姆单抗、纳武单抗、替雷利珠单抗或西米普利单抗。在一些实施方案中,结合pd-1的抗体是纳武单抗,其以每两周一次的240mg的剂量施用至受试者。在一些实施方案中,结合pd-1的抗体是纳武单抗,其以每4周一次的480mg的剂量施用至受试者。在一些实施方案中,结合pd-1的抗体是派姆单抗,其以每3周一次的200mg的剂量施用。在一些实施方案中,结合pd-1的抗体是西米普利单抗,其以每3周一次的350mg的剂量施用。在一些实施方案中,结合pd-1的抗体是替雷利珠单抗,其以每3周一次的200mg的剂量施用。在一些实施方案中,免疫检查点抑制剂通过静脉输注施用。
16.在一些实施方案中,抗半乳糖凝集素-9抗体包含seq id no:4所示的重链互补决定区1(cdr1)、seq id no:5所示的重链互补决定区2(cdr2)和seq id no:6所示的重链互补决定区3(cdr3)和/或包含seq id no:1所示的轻链互补决定区1(cdr1)、seq id no:2所示的轻链互补决定区2(cdr2)和seq id no:3所示的轻链互补决定区3(cdr3)。在一些实施方案中,抗半乳糖凝集素-9抗体包含seq id no:7的重链可变结构域和/或seq id no:8的轻链可变结构域。在一些实施方案中,抗半乳糖凝集素-9抗体是全长抗体。在一些实施方案中,抗半乳糖凝集素-9抗体是igg1或igg4分子。在一些实施方案中,抗半乳糖凝集素-9抗体是具有人igg4的修饰的fc区的人igg4分子。在一些实施方案中,人igg4的修饰的fc区包含seq id no:14的氨基酸序列。在一些实施方案中,人igg4的修饰的fc区包含氨基酸序列seq id no:21。在一些实施方案中,抗半乳糖凝集素-9抗体含有包含氨基酸序列seq id no:19的重链和包含氨基酸序列seq id no:15的轻链。在一些实施方案中,抗半乳糖凝集素-9抗体含有包含氨基酸序列seq id no:23的重链和包含氨基酸序列seq id no:15的轻链。
17.在本文公开的任何方法中,受试者(例如,人患者)可已经历了一种或多种先前的抗癌疗法,例如手术、化学疗法、免疫疗法、放射疗法、涉及生物靶向小分子的疗法、激素剂或其组合。在一些实施方案中,受试者在一种或多种先前的抗癌疗法中疾病进展。在其他实施方案中,受试者对一种或多种先前疗法具有抗性(例如,从头或获得性)。在其他实施方案中,受试者在一种或多种先前疗法后复发。
18.在本文公开的任何治疗方法中,受试者可以是具有相对于对照值升高的半乳糖凝集素-9水平的人患者。在一些实施方案中,人患者具有相对于对照值升高的半乳糖凝集素-9的血清或血浆水平。在一些实施方案中,人患者具有在源自人患者的细胞的表面上表达的相对于对照值升高水平的半乳糖凝集素-9。这种细胞可以是癌症患者肿瘤中和/或血液中的癌细胞和/或免疫细胞。在一些实例中,癌细胞位于源自人患者的肿瘤类器官中。在一些实施方案中,对照值基于从健康人受试者获得的值。
19.本文公开的任何治疗方法还可包括监测受试者中不良反应的发生。在不良反应(例如,发生一种或多种严重不良反应)的情况下,抗半乳糖凝集素-9抗体(例如g9.2-17)的
剂量或检查点抑制剂(例如、抗pd-1抗体如纳武单抗)的剂量(如果共同使用)或两者可能减少。
20.在本公开内容的范围内还包括用于治疗实体瘤(例如,本文描述的那些并且包括转移性实体瘤)的药物组合物,以及任何抗半乳糖凝集素-9抗体用于制造用于治疗实体瘤的药物的用途,其中在一些实施方案中,本文公开的用途涉及如本文也公开的一种或多种治疗条件(例如,剂量、给药方案、施用途径等)。
21.本发明的一个或多个实施方案的细节在以下描述中阐述。本发明的其他特征或优点从以下附图和几个实施方案的详细描述以及从所附权利要求中显而易见。
22.附图简述
23.下列附图构成本说明书的一部分,并被包括在内以进一步说明本公开内容的某些方面,其通过参考附图并结合本文提出的具体实施方案的详细描述可以被更好地理解。
24.图1是显示抗半乳糖凝集素-9抗体的代表性尺寸排阻色谱(sec)特征谱的图。高分子量峰被标记。
25.图2a-2f包括条形图,显示了在使用抗半乳糖凝集素-9 g9.2-17fab片段和市售的抗半乳糖凝集素-9抗体(9m1-3)的胰腺癌活检所得的s2和s3类器官级分中,在t细胞(cd3+)、巨噬细胞(cd11b+)和肿瘤细胞(epcam+)中测量的半乳糖凝集素-9表达的水平。s2级分:类器官。s3级分:单个细胞。g9.2-17 fab的相应同工型(“fab同工型”)和“荧光减一”(fmo)9m1-3(“gal9 fmo”)用作特异性、背景染色和从其他通道渗出的荧光的对照。图2a显示了在s3级分中测量的cd3+细胞中半乳糖凝集素-9的水平。图2b显示了在s3级分中测量的cd11b+细胞中半乳糖凝集素-9的水平。图2c显示了在s3级分中测量的epcam+细胞中半乳糖凝集素-9的水平。图2d显示了在s2级分中测量的cd3+细胞中半乳糖凝集素-9的水平。图2e显示了在s2级分中测量的cd11b+细胞中半乳糖凝集素-9的水平。图2f显示了在s2级分中测量的epcam+细胞中半乳糖凝集素-9的水平。
26.图3a-3f包括条形图,显示在使用抗半乳糖凝集素-9 g9.2-17 fab片段和市售的抗半乳糖凝集素-9抗体(9m1-3)的结直肠癌活检所得的s2和s3类器官级分中,在t细胞(cd3+)、巨噬细胞(cd11b+)和肿瘤细胞(epcam+)中测量的半乳糖凝集素-9表达的水平。s2级分:类器官。s3级分:单个细胞。g9.2-17 fab的相应同工型(“fab同工型”)和fmo 9m1-3(“gal9 fmo”)用作特异性、背景染色和从其他通道渗出的荧光的对照。图3a显示了在s3级分中测量的cd3+细胞中半乳糖凝集素-9的水平。图3b显示了在s3级分中测量的cd11b+细胞中半乳糖凝集素-9的水平。图3c显示了在s3级分中测量的epcam+细胞中半乳糖凝集素-9的水平。图3d显示了在s2级分中测量的cd3+细胞中半乳糖凝集素-9的水平。图3e显示了在s2级分中测量的cd11b+细胞中半乳糖凝集素-9的水平。图3f显示了在s2级分中测量的epcam+细胞中半乳糖凝集素-9的水平。
27.图4a-4f包括条形图,显示了在使用抗半乳糖凝集素-9 g9.2-17fab片段和市售的抗半乳糖凝集素-9抗体(9m1-3)的第二胰腺癌活检所得的s2和s3类器官级分中,在t细胞(cd3+)、巨噬细胞(cd11b+)和肿瘤细胞(epcam+)中测量的半乳糖凝集素-9表达的水平。s2级分:类器官。s3级分:单个细胞。g9.2-17 fab的相应同工型(“fab同工型”)和fmo 9m1-3(“gal9 fmo”)用作特异性、背景染色和从其他通道渗出的荧光的对照。图4a显示了在s3级分中测量的cd3+细胞中半乳糖凝集素-9的水平。图4b显示了在s3级分中测量的cd11b+细胞
中半乳糖凝集素-9的水平。图4c显示了在s3级分中测量的epcam+细胞中半乳糖凝集素-9的水平。图4d显示了在s2级分中测量的cd3+细胞中半乳糖凝集素-9的水平。图4e显示了在s2级分中测量的cd11b+细胞中半乳糖凝集素-9的水平。图4f显示了在s2级分中测量的epcam+细胞中半乳糖凝集素-9的水平。
28.图5a-5c包括使用抗半乳糖凝集素-9抗体1g3的各种肿瘤的免疫组织化学分析的照片。所有放大倍数均为200x。图5a显示了具有异质强度评分2和3(中等和高)半乳糖凝集素-9表达的化疗治疗的结直肠癌。特别地在细胞膜处观察到半乳糖凝集素-9染色;此外,腺内巨噬细胞呈中度阳性,肿瘤中的基质反应显示具有中等强度的半乳糖凝集素-9表达的多核巨噬细胞巨细胞。图5b显示了具有高(强度评分3)半乳糖凝集素-9表达的结直肠癌的肝转移。染色位于膜和细胞质中。图5c显示了半乳糖凝集素-9阳性(强度评分2)截留的胆管和半乳糖凝集素-9阴性癌症。
29.图6包括显示作为所用抗体浓度的函数绘制的膜联蛋白v-和碘化丙啶(pi)-阳性细胞的分数的图。molm-13细胞与不同浓度的g9.2-17或人igg4同工型抗体和重组人半乳糖凝集素-9共孵育16小时。在流式细胞术分析之前,细胞用膜联蛋白v和碘化丙啶染色。每个条件一式三份进行。在flowjo软件上进行分析。
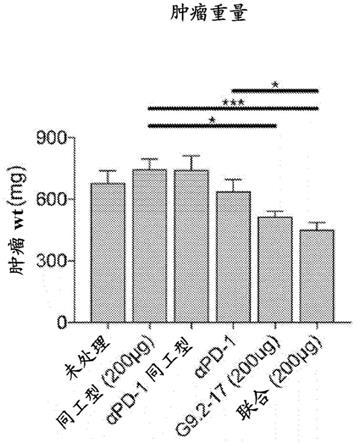
30.图7a和7b描绘了显示研究结果的图,其中用单独的或与αpd1mab组合的g9.2-17 migg2a处理小鼠。用商业αpd-1(200μg)mab或g9.2-17 mig2a(200μg)或g9.2-17和αpd-1的组合或匹配的同工型每周一次处理原位植入kpc肿瘤的小鼠(n=10/组)持续三周。取出肿瘤并称重(图7a),随后进行处理和染色以进行流式细胞术(图7b)。每个点代表一只小鼠;*p《0.05;**p《0.01;***p《0.001;****p《0.0001;通过未配对的学生t检验。
31.图7b描绘的柱状图显示了在实验结束时(第18天)从对照和治疗的动物切除肿瘤并进行处理以用于肿瘤内免疫细胞和相关活化和免疫抑制标志物的流式细胞术。小鼠肿瘤在流动前被消化。流式细胞术在attune nxt流式细胞仪(thermofisher scientific,waltham,ma)上进行。使用flowjo v.10.1(treestar,ashland,or)分析数据。
32.图8a和8b描绘的图显示了用g9.2-17的igg1形式(图8a)和g9.2-17的igg4形式(图8b)进行的adcc测定的结果。如对人igg4mab所预期的,g9.2-17不介导adcc(图8b)。这是针对作为阳性对照的g9.2-17的igg1人对应物(其介导adcc和adcp)进行测试的,如所预期的(图8a)。
33.图9a和9b描绘了显示9.2-17在b16f10皮下同基因模型中的作用的图。皮下移植肿瘤并用g9.2-17 igg1小鼠mab、抗pd1抗体或g9.2-17 igg1小鼠mab和抗pd1抗体的组合进行治疗。图9a描绘了显示对肿瘤体积的影响的图。图9b描绘了显示肿瘤内cd8 t细胞浸润的图。结果表明,在组合臂中,肿瘤内存在效应t细胞得到增强。
34.图10a和10b包括显示用g9.2-17处理的源自胆管癌患者的离体肿瘤培养物(类器官)的图表。患者衍生的离体肿瘤培养物(类器官)用g9.2-17或同工型对照处理三天。评估了来自pdots的cd3+t细胞中cd44(图10a)和tnfα(图10b)的表达。
35.发明详述
36.本文提供了使用抗半乳糖凝集素-9抗体(例如g9.2-17)治疗实体瘤(例如胰腺癌(pda)、结直肠癌(crc)、肝细胞癌(hcc)和胆管癌)的方法。在一些实施方案中,癌症是转移性的。在一些实施方案中,本文公开的方法提供特定剂量和/或给药方案。在一些情况下,本
文公开的方法针对特定的患者群体,例如,已经接受先前治疗并且在先前治疗中显示疾病进展的患者,或对先前治疗具有抗性(从头或获得性)的患者。
37.半乳糖凝集素-9(一种串联重复凝集素)是一种β-半乳糖苷结合蛋白,其已被证明在调节细胞-细胞和细胞-基质相互作用中起作用。发现它在霍奇金病组织和其他病理状态中强烈过度表达。在某些情况下,还发现它在肿瘤微环境(tme)中循环。
38.发现半乳糖凝集素-9与dectin-1相互作用,dectin-1是一种先天免疫受体,其在pda的巨噬细胞以及在癌细胞上高度表达(daley等人nat med.2017;23(5):556-6)。无论半乳糖凝集素-9的来源如何,已证明破坏其与dectin-1的相互作用导致cd4
+
和cd8
+
细胞重新编程为抗肿瘤免疫的不可或缺的介质。因此,半乳糖凝集素-9作为阻断由dectin-1介导的信号传导的有价值的治疗靶点。因此,在一些实施方案中,本文描述的抗半乳糖凝集素-9抗体破坏了半乳糖凝集素-9和dectin-1之间的相互作用。
39.还发现半乳糖凝集素-9与tim-3相互作用,tim-3是一种在所有急性髓系白血病(m3(急性早幼粒细胞白血病)除外)白血病干细胞表面表达的i型细胞表面糖蛋白,但其在正常人造血干细胞(hsc)中不表达。已发现由半乳糖凝集素-9接合产生的tim-3信号传导对免疫细胞具有多效作用,诱导th1细胞凋亡(zhu等人,nat immunol.,2005,6:1245-1252)并刺激分泌肿瘤坏死因子-α(tnf-α),导致单核细胞成熟为树突细胞,通过先天免疫导致炎症(kuchroo等人,nat rev immunol.,2008,8:577-580)。进一步发现半乳糖凝集素-9/tim-3信号传导共同激活nf-κb和β-连环蛋白信号传导,这是促进lsc自我更新的两种途径(kikushige等人,cell stem cell,2015,17(3):341-352)。干扰半乳糖凝集素-9/tim-3结合的抗半乳糖凝集素-9抗体可具有治疗效果,尤其是对于白血病和其他血液系统恶性肿瘤。因此,在一些实施方案中,本文所述的抗半乳糖凝集素-9抗体破坏半乳糖凝集素-9和tim-3之间的相互作用。
40.此外,发现半乳糖凝集素-9与cd206(一种在m2极化巨噬细胞上高度表达的甘露糖受体)相互作用,从而促进肿瘤存活(enninga等人,j pathol.2018 aug;245(4):468-477)。表达cd206的肿瘤相关巨噬细胞是肿瘤免疫抑制、血管生成、转移和复发的介质(参见,例如,scodeller等人,sci rep.2017 nov 7;7(1):14655,以及其中的参考文献)。具体而言,m1(也称为经典活化巨噬细胞)由th1相关细胞因子和细菌产物触发,表达高水平的il-12,并且具有杀肿瘤作用。相比之下,m2(所谓的替代激活巨噬细胞)被th2相关因子激活,表达高水平的抗炎细胞因子,例如il-10,并促进肿瘤进展(biswas and mantovani;nat immunol.2010 oct;11(10):889-96)。m2的促肿瘤作用包括促进血管生成、促进侵袭和转移,以及保护肿瘤细胞免受化疗诱导的细胞凋亡(hu等人,tumour biol.2015 dec;36(12):9119
–
9126,以及其中的参考资料)。肿瘤相关巨噬细胞被认为具有m2样表型并具有促肿瘤作用。半乳糖凝集素-9已被证明介导骨髓细胞向m2表型分化(enninga等人,melanoma res.2016 oct;26(5):429-41)。半乳糖凝集素-9结合cd206可能导致tam重编程为m2表型,类似于之前对dectin显示的结果。不希望受理论束缚,阻断半乳糖凝集素-9与cd206的相互作用可提供一种机制,通过该机制抗半乳糖凝集素-9抗体例如g9.2-17抗体可以在治疗上是有益的。因此,在一些实施方案中,本文所述的抗半乳糖凝集素-9抗体破坏半乳糖凝集素-9和cd206之间的相互作用。
41.半乳糖凝集素-9也显示出与蛋白质二硫键异构酶(pdi)和4-1bb相互作用(bi s等
人proc natl acad sci u s a.2011;108(26):10650-5;madireddi等人j exp med.2014;211(7):1433-48))。
42.抗半乳糖凝集素-9抗体可用作治疗与半乳糖凝集素-9相关的疾病(例如,半乳糖凝集素-9信号传导在其中起作用的疾病)的治疗剂。不受理论束缚,抗半乳糖凝集素-9抗体可阻断半乳糖凝集素-9介导的信号传导途径。例如,抗体可干扰半乳糖凝集素-9与其结合配偶体(例如,dectin-1、tim-3或cd206)之间的相互作用,从而阻断由半乳糖凝集素-9/配体相互作用触发的信号传导。或者或另外的,抗半乳糖凝集素-9抗体还可通过诱导阻断和/或细胞毒性例如针对表达半乳糖凝集素-9的病理细胞的adcc、cdc或adcp来发挥其治疗作用。病理细胞是指直接或间接促成疾病的发生和/或发展的细胞。
43.本文公开的抗半乳糖凝集素-9抗体能够抑制半乳糖凝集素-9介导的信号传导(例如半乳糖凝集素-9/dectin-1或半乳糖凝集素-9/tim-3介导的信号传导途径)或通过例如adcc消除表达半乳糖凝集素-9的病理细胞。因此,本文所述的抗半乳糖凝集素-9抗体可用于抑制任何半乳糖凝集素-9信号传导和/或消除半乳糖凝集素-9阳性病理细胞,从而有益于治疗与半乳糖凝集素-9相关的疾病。
44.发现抗半乳糖凝集素-9抗体例如g9.2-17有效诱导针对表达半乳糖凝集素-9的细胞的细胞凋亡。此外,抗半乳糖凝集素-9抗体(例如g9.2-17)的抗肿瘤作用已在小鼠模型中单独地或与检查点抑制剂(例如抗pd-1抗体)联合地被验证。如本文报道的,g9.2-17的功效在pdac和黑色素瘤的小鼠模型以及源自患者的类器官肿瘤模型(pdot)中进行了测试。使用的原位pdackpc小鼠模型(lsl-krasg12d/+;lsl-trp53r172h/+;pdx-1-cre)概括了人疾病的许多特征,包括对批准的检查点抑制剂无反应(bisht and feldmann g;animal models for modeling pancreatic cancer and novel drug discovery;expert opin drug discov.2019;14(2):127-142;weidenhofer等人,animal models of pancreatic cancer and their application in clinical research;gastrointestinal cancer:targets and therapy 2016;6)。b16f10黑色素瘤小鼠模型一直是测试免疫疗法的长期标准(curran等人,pd-1and ctla-4 combination blockade expands infiltrating t cells and reduces regulatory t and myeloid cells within b16 melanoma tumors;proc natl acad sci u s a.2010;107(9):4275-4280)。
45.从新鲜人肿瘤样品中分离的pdot保留自体淋巴和骨髓细胞群,包括抗原经历的肿瘤浸润cd4和cd8 t淋巴细胞,并对短期离体培养中的免疫疗法有反应(jenkins等人ex vivo profiling of pd-1 blockade using organotypic tumor spheroids.cancer discov.2018;8(2):196-215;aref等人,3d microfluidic ex vivo culture of organotypic tumor spheroids to model immune checkpoint blockade;lab chip.2018;18(20):3129-3143)。如本文所报道,在源自患者的类器官测定中观察到半乳糖凝集素-9在癌细胞上的表达。
46.使用g9.2-17小鼠igg1进行体内研究(g9.2-17 migg1包含与g9.2-17人igg4完全相同的结合表位,并具有相同的效应子功能),这作为原位kpc模型中的单一药剂实现了肿瘤生长的显著减少,而其中批准的检查点抑制剂不起作用。在b16f10模型中g9.2-17显著超过了抗pd1的功效。在这两种模型中,证明了使用g9.2-17 migg1通过上调效应t细胞活性和抑制免疫抑制信号以及增强肿瘤内cd8 t细胞浸润来调节肿瘤内免疫微环境。
47.这些结果证明本文公开的抗肿瘤方法(涉及抗半乳糖凝集素-9抗体,任选地与检查点抑制剂组合)将实现针对靶实体瘤的优异治疗功效。
48.因此,本文描述了抗半乳糖凝集素-9抗体用于治疗本文公开的某些癌症的治疗用途。
49.与半乳糖凝集素-9结合的抗体
50.本公开内容提供了用于本文公开的治疗方法的抗半乳糖凝集素-9抗体g9.2-17及其功能变体。
51.抗体(复数形式可互换使用)是一种免疫球蛋白分子,其能够通过位于免疫球蛋白分子的可变区的至少一个抗原识别位点特异性结合靶标,例如碳水化合物、多核苷酸、脂质、多肽等。如本文所用,术语“抗体”,例如抗半乳糖凝集素-9抗体,不仅包括完整的(例如,全长)多克隆或单克隆抗体,还包括其抗原结合片段(例如fab、fab'、f(ab')2、fv)、单链(scfv)、其突变体、包含抗体部分的融合蛋白、人源化抗体、嵌合抗体、双抗体、纳米抗体、线性抗体、单链抗体、多特异性抗体(例如双特异性抗体)和包含所需特异性的抗原识别位点的免疫球蛋白分子的任何其他修饰构型,包括抗体的糖基化变体、抗体的氨基酸序列变体和共价修饰的抗体。抗体(例如抗半乳糖凝集素-9抗体)包括任何类别的抗体,例如igd、ige、igg、iga或igm(或其亚类),并且该抗体不需要属于任何特定类别。取决于抗体重链恒定结构域的氨基酸序列,免疫球蛋白可分为不同的类别。免疫球蛋白有五个主要类别:iga、igd、ige、igg和igm,其中一些可以进一步分为亚类(同工型),例如igg1、igg2、igg3、igg4、iga1和iga2。对应于不同类别免疫球蛋白的重链恒定结构域分别称为α、δ、ε、γ和μ。不同类别免疫球蛋白的亚基结构和三维构型是众所周知的。
52.典型的抗体分子包含重链可变区(vh)和轻链可变区(v
l
),它们通常参与抗原结合。vh和v
l
区可以进一步细分为高变区,也称为“互补决定区”(“cdr”),散布着更保守的区域,称为“框架区”(“fr”)。每个vh和v
l
通常由三个cdr和四个fr组成,从氨基端到羧基端按以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。框架区和cdr的范围可以使用本领域已知的方法精确鉴定,例如通过kabat定义、chothia定义、abm定义、eu定义、“contact”编号方案、“imgt”编号方案、“aho”编号方案和/或接触定义,所有这些都是本领域公知的。参见,例如kabat,e.a.等人(1991)sequences of proteins of immunological interest,fifth edition,u.s.department of health and human services,nih publication no.91-3242,chothia等人,(1989)nature 342:877;chothia,c.等人(1987)j.mol.biol.196:901-917,al-lazikani等人(1997)j.molec.biol.273:927-948;edelman等人,proc natl acad sci u s a.1969may;63(1):78-85;and almagro,j.mol.recognit.17:132-143(2004);maccallum等人,j.mol.biol.262:732-745(1996),lefranc m p等人,dev comp immunol,2003 january;27(1):55-77;and honegger a and pluckthun a,j mol biol,2001 jun.8;309(3):657-70。还参见hgmp.mrc.ac.uk和bioinf.org.uk/abs。
53.在一些实施方案中,本文所述的抗半乳糖凝集素-9抗体是全长抗体,其包含两条重链和两条轻链,每条链包括可变结构域和恒定结构域。或者,抗半乳糖凝集素-9抗体可以是全长抗体的抗原结合片段。术语全长抗体的“抗原结合片段”所涵盖的结合片段的实例包括(i)fab片段,由v
l
、vh、c
l
和ch1结构域组成的单价片段;(ii)f(ab')2片段,包含在铰链区通过二硫键连接的两个fab片段的二价片段;(iii)由vh和ch1结构域组成的fd片段;(iv)由抗
体单臂的v
l
和vh结构域组成的fv片段,(v)dab片段(ward等人,(1989)nature 341:544-546),其由vh结构域组成;和(vi)保留功能的分离的互补决定区(cdr)。此外,虽然fv片段的两个结构域v
l
和vh由不同的基因编码,但可以使用重组方法通过合成接头将它们连接起来,使它们能够制成单个蛋白质链,其中v
l
和vh区配对形成单价分子,称为单链fv(scfv)。参见例如,bird等人(1988)science 242:423-426;和huston等人(1988)proc.natl.acad.sci.usa 85:5879-5883。
54.本文所述的任何抗体,例如抗半乳糖凝集素-9抗体,可以是单克隆的或多克隆的。“单克隆抗体”是指同质抗体群体,“多克隆抗体”是指异质抗体群体。这两个术语不限制抗体的来源或其制造方式。
55.参考抗体g9.2-17是指能够结合人半乳糖凝集素-9的抗体,并且包含seq id no:7的重链可变区和seq id no:8的轻链可变区,两者均提供在下文。在一些实施方案中,用于本文公开的方法中的抗半乳糖凝集素-9抗体是g9.2-17抗体。在一些实施方案中,用于本文公开的方法中的抗半乳糖凝集素-9抗体是具有与参考抗体g9.2-17相同的重链互补决定区(cdr)和/或与参考抗体g9.2-17相同的轻链互补决定区的抗体。具有相同vh和/或v
l cdr的两种抗体意味着当通过相同方法(例如,本领域已知的kabat方法、chothia方法、abm方法、contact方法或imgt方法,参见,例如,bioinf.org.uk/abs/)确定时,它们的cdr是相同的。
56.参考抗体g9.2-17的重链和轻链cdr在下表1中提供(使用kabat方法确定):
57.表1.g9.2-17的重链和轻链cdr
[0058][0059][0060]
在一些实例中,用于本文公开的方法中的抗半乳糖凝集素-9抗体可以包含(按照kabat方案)seq id no:4所示的重链互补决定区1(cdr1)、seq id no:5所示的重链互补决定区2(cdr2)和seq id no:6所示的重链互补决定区3(cdr3)和/或可以包含seq id no:1所示的轻链互补决定区1(cdr1)、seq id no:2所示的轻链互补决定区2(cdr2)和seq id no:3
所示的轻链互补决定区3(cdr3)。抗半乳糖凝集素-9抗体,包括参考抗体g9.2-17,可以是本文公开的任何形式,例如全长抗体或fab。本文使用的术语“g9.2-17(ig4)”是指作为igg4分子的g9.2-17抗体。同样,术语“g9.2-17(fab)”是指g9.2-17抗体,其是fab分子。
[0061]
在一些实施方案中,抗半乳糖凝集素-9抗体或其结合部分包含重链和轻链可变区,其中轻链可变区cdr1、cdr2和cdr3氨基酸序列与seq id no:1、2和3所示的轻链可变区cdr1、cdr2和cdr3氨基酸序列分别具有至少80%(例如,80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%以及其中的任何增量)的序列同一性。在一些实施方案中,抗半乳糖凝集素-9抗体或其结合部分包含重链可变区和轻链可变区,其中重链可变区cdr1、cdr2和cdr3氨基酸序列与seq id no:4、5和6所示的重链可变区cdr1、cdr2和cdr3氨基酸序列分别具有至少80%(例如,80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%以及其中的任何增量)的序列同一性。
[0062]
在共同拥有的共同未决美国专利申请16/173,970和共同拥有的共同未决国际专利申请pct/us18/58028和pct/us2020/024767中描述了额外的半乳糖凝集素-9抗体,例如,与半乳糖凝集素-9的crd1和/或crd2区域结合,它们各自的内容通过引用整体并入本文。
[0063]
在一些实施方案中,本文公开的抗半乳糖凝集素-9抗体包含与参考抗体g9.2-17的相应v
l cdr相比单独或共同地具有至少80%(例如,80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%以及其中的任何增量)的序列同一性的轻链cdr。或者或另外地,在一些实施方案中,抗半乳糖凝集素-9抗体包含与参考抗体g9.2-17的相应v
h cdr相比单独或共同地具有至少80%(例如,80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%以及其中的任何增量)的序列同一性的重链cdr。
[0064]
两个氨基酸序列的“同一性百分比”是使用karlin和altschul proc.natl.acad.sci.usa 87:2264-68,1990的算法,按照karlin和altschul proc.natl.acad.sci.usa 90:5873-77,1993中的修改确定的。这样的算法被合并到altschul等人j.mol.biol.215:403-10,1990的nblast和xblast程序(2.0版)中。可以用xblast程序(得分=50,字长=3)进行blast蛋白质搜索,以获得与本发明的蛋白质分子同源的氨基酸序列。当两个序列之间存在缺口时,可以使用缺口blast,如altschul等人,nucleic acids res.25(17):3389-3402,1997中所述。当使用blast和缺口blast程序时,可以使用各自程序(例如xblast和nblast)的默认参数。
[0065]
在其他实施方案中,本文所述的抗半乳糖凝集素-9抗体含有包含hc cdr1、hc cdr2和hc cdr3的vh,它们共同包含相对于参考抗体g9.2-17的hc cdr1、hc cdr2和hc cdr3的多至8个氨基酸残基变异(8、7、6、5、4、3、2或1个变异,包括添加、删除和/或取代)。或者或另外地,在一些实施方案中,本文所述的抗半乳糖凝集素-9抗体含有包含lc cdr1、lc cdr2和lc cdr3的vh,它们共同包含相对于参考抗体g9.2-17的lc cdr1、lc cdr2和lc cdr3的多至8个氨基酸残基变异(8、7、6、5、4、3、2或1个变异,包括添加、缺失和/或取代)。
[0066]
在一个实例中,氨基酸残基变异是保守的氨基酸残基取代。如本文所用,“保守氨基酸取代”是指不改变进行氨基酸取代的蛋白质的相对电荷或大小特征的氨基酸取代。变体可以根据本领域普通技术人员已知的改变多肽序列的方法来制备,例如在编译此类方法的参考资料中找到,例如,molecular cloning:a laboratory manual,j.sambrook等人,eds.,second edition,cold spring harbor laboratory press,cold spring harbor,
new york,1989,或current protocols in molecular biology,f.m.ausubel等人,eds.,john wiley&sons,inc.,new york。氨基酸的保守取代包括在以下组内的氨基酸之间进行的取代:(a)m、i、l、v;(b)f、y、w;(c)k、r、h;(d)a、g;(e)s、t;(f)q、n;和(g)e、d.
[0067]
在一些实施方案中,具有本文公开的重链cdr的本文公开的抗半乳糖凝集素-9抗体包含源自种系vh片段的亚类的框架区。这样的种系vh区是本领域众所周知的。参见例如imgt数据库(www.imgt.org)或www.vbase2.org/vbstat.php。实例包括ighv1亚家族(例如ighv1-2,ighv1-3,ighv1-8,ighv1-18,ighv1-24,ighv1-45,ighv1-46,ighv1-58和ighv1-69)、ighv2亚家族(例如,ighv2-5、ighv2-26和ighv2-70)、ighv3亚家族(例如,ighv3-7,ighv3-9,ighv3-11,ighv3-13,ighv3-15,ighv3-20,ighv3-21,ighv3-23,ighv3-30,ighv3-33,ighv3-43,ighv3-48,ighv3-49,ighv3-53,ighv3-64,ighv3-66,ighv3-72和ighv3-73、ighv3-74)、ighv4亚家族(例如,ighv4-4,ighv4-28,ighv4-31,ighv4-34,ighv4-39,ighv4-59,ighv4-61和ighv4-b)、ighv亚家族(例如,ighv5-51、或ighv6-1),以及ighv7亚家族(例如,ighv7-4-1)。
[0068]
或者或另外地,在一些实施方案中,具有本文公开的轻链cdr的抗半乳糖凝集素-9抗体包含源自种系vκ片段的框架区。示例包括igkv1框架(例如,igkv1-05、igkv1-12、igkv1-27、igkv1-33或igkv1-39)、igkv2框架(例如,igkv2-28)、igkv3框架(例如,igkv3-11、igkv3-15或igkv3-20)和igkv4框架(例如,igkv4-1)。在其他情况下,抗半乳糖凝集素-9抗体包含轻链可变区,该可变区含有源自种系vλ片段的框架。示例包括igλ1框架(例如,igλv1-36、igλv1-40、igλv1-44、igλv1-47、igλv1-51)、igλ2框架(例如,igλv2-8,igλv2-11,igλv2-14,igλv2-18,igλv2-23)、igλ3框架(例如,igλv3-1,igλv3-9,igλv3-10,igλv3-12,igλv3-16,igλv3-19,igλv3-21,igλv3-25,igλv3-27)、igλ4框架(例如igλv4-3,igλv4-60,igλv4-69)、igλ5框架(例如igλv5-39,igλv5-45)、igλ6框架(例如igλv6-57,)、igλ7框架(例如igλv7-43,igλv7-46,)、igλ8框架(例如igλv8-61)、igλ9框架(如igλv9-49)或igλ10框架(如igλv10-54)。
[0069]
在一些实施方案中,用于本文公开的方法中的抗半乳糖凝集素-9抗体可以是具有与参考抗体g9.2-17相同的重链可变区(vh)和/或相同的轻链可变区(v
l
)的抗体,vh和v
l
区氨基酸序列提供如下:
[0070]vh
:
[0071]
evqlvesggglvqpggslrlscaasgftvssssihwvrqapgkglewvayissssgytyyadsvkgrftisadtskntaylqmnslraedtavyycarywsypswwpyrgmdywgqgtlvtvss(seq id no:7)
[0072]vl
:
[0073]
diqmtqspsslsasvgdrvtitcrasqsvssavawyqqkpgkapklliysasslysgvpsrfsgsrsgtdftltisslqpedfatyycqqsstdpitfgqgtkveikr(seq id no:8)
[0074]
在一些实施方案中,抗半乳糖凝集素-9抗体与seq id no:7的重链可变区具有至少80%的序列同一性(例如,80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、80%、98%或99%同一性)。或者或另外地,抗半乳糖凝集素-9抗体与seq id no:8的轻链可变区具有至少80%的序列同一性(例如,80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性)。
[0075]
在一些情况下,本文公开的抗半乳糖凝集素-9抗体是参考抗体g9.2-17的功能变
体。功能变体可以在结构上与参考抗体相似(例如,包含在本文公开的g9.2-17的一个或多个重链和/或轻链cdr中有限数量的氨基酸残基变异,或相对于如本文公开的g9.2-17的重链和/或轻链cdr或g9.2-17的vh和/或v
l
的序列同一性),具有基本相似的与人半乳糖凝集素-9的结合亲和力(例如,具有同阶的kd值)。
[0076]
在一些实施方案中,如本文所述的抗半乳糖凝集素-9抗体可以结合并使半乳糖凝集素-9的活性抑制至少20%(例如,31%、35%、40%、45%、50%、60%、70%、80%、90%、95%或更高,包括其中的任何增量)。表观抑制常数(ki
app
或k
i,app
)(其提供抑制剂效力的量度)与降低酶活性所需的抑制剂浓度有关,并且不依赖于酶浓度。本文所述的抗半乳糖凝集素-9抗体的抑制活性可以通过本领域已知的常规方法确定。
[0077][0078]
抗体的k
i,app
值可以通过测量不同浓度的抗体对反应(例如酶活性)程度的抑制作用来确定;将伪一阶速率常数(v)的变化作为抑制剂浓度的函数拟合到修改后的莫里森方程(方程1),得出表观ki值的估计值。对于竞争性抑制剂,ki
app
可以从从k
i,app
与底物浓度的图的线性回归分析中提取的y截距获得。(方程1)
[0079]
其中a等于vo/e,即不存在抑制剂(i)时酶促反应的初始速度(vo)除以总酶浓度(e)。在一些实施方案中,本文所述的抗半乳糖凝集素-9抗体对于靶抗原或抗原表位的ki
app
值为1000、900、800、700、600、500、400、300、200、100、50、40、30、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5pm或更少。在一些实施方案中,相对于第二靶标(例如,半乳糖凝集素-9的crd1),抗半乳糖凝集素-9抗体对于第一靶标(例如,半乳糖凝集素-9的crd2)具有较低的ki
app
。ki
app
的差异(例如,对于特异性或其他比较)可以是至少1.5、2、3、4、5、10、15、20、37.5、50、70、80、91、100、500、1000、10000或105倍。在一些实例中,抗半乳糖凝集素-9抗体相对于第二抗原(例如,处于第二构象的相同第一蛋白质或其模拟物;或第二蛋白质)更大程度地抑制第一抗原(例如,处于第一构象的第一蛋白质或其模拟物)。在一些实施方案中,任何抗半乳糖凝集素-9抗体进一步亲和力成熟以降低抗体对靶抗原或其抗原表位的ki
app
。
[0080]
在一些实施方案中,抗半乳糖凝集素-9抗体抑制dectin-1信号传导,例如在肿瘤浸润免疫细胞如巨噬细胞中。在一些实施方案中,抗半乳糖凝集素-9抗体使由半乳糖凝集素-9触发的dectin-1信号传导抑制至少30%(例如,31%、35%、40%、50%、60%、70%、80%、90%、95%或更高,包括其中的任何增量)。这种抑制活性可以通过常规方法,例如常规测定来确定。或者或另外地,抗半乳糖凝集素-9抗体抑制由半乳糖凝集素-9启动的t细胞免疫球蛋白粘蛋白3(tim-3)信号传导。在一些实施方案中,抗半乳糖凝集素-9抗体抑制t细胞免疫球蛋白粘蛋白-3(tim-3)信号传导,例如,在肿瘤浸润免疫细胞中,例如,在一些实施方案中,抑制至少30%(例如,31%、35%、40%、50%、60%、70%、80%、90%、95%或更高,包括其中的任何增量)。这种抑制活性可以通过常规方法,例如常规测定来确定。
[0081]
在一些实施方案中,抗半乳糖凝集素-9抗体抑制cd206信号传导,例如,在肿瘤浸润免疫细胞中。在一些实施方案中,抗半乳糖凝集素-9抗体使由半乳糖凝集素-9触发的cd206信号传导抑制至少30%(例如,31%、35%、40%、50%、60%、70%、80%、90%、95%或更高,包括其中的任何增量)。这种抑制活性可以通过常规方法,例如常规测定来确定。在一
些实施方案中,抗半乳糖凝集素-9抗体使半乳糖凝集素-9与cd206的结合阻断或阻止至少30%(例如,31%、35%、40%、50%、60%、70%、80%、90%、95%或更高,包括其中的任何增量)。这种抑制活性可以通过常规方法,例如常规测定来确定。
[0082]
在一些实施方案中,抗半乳糖凝集素-9抗体在表达半乳糖凝集素-9的靶细胞中诱导细胞毒性,例如adcc,例如,其中靶细胞是癌细胞或免疫抑制性免疫细胞。在一些实施方案中,抗半乳糖凝集素-9抗体将免疫细胞例如t细胞或癌细胞中的凋亡诱导至少30%(例如,31%、35%、40%、50%、60%、70%、80%、90%、95%或更高,包括其中的任何增量)。这种抑制活性可以通过常规方法,例如常规测定来确定。在一些实施方案中,本文所述的任何抗半乳糖凝集素-9抗体诱导细胞细胞毒性,例如针对表达半乳糖凝集素-9的靶细胞的补体依赖性细胞毒性(cdc)。
[0083]
抗体依赖性细胞介导的吞噬作用(adcp)是一种重要的抗体作用机制,其通过吞噬作用介导其部分或全部作用。在那种情况下,抗体介导抗原呈递细胞对特定抗原的摄取。adcp可以由单核细胞、巨噬细胞、中性粒细胞和树突状细胞通过fcγriia、fcγri和fcγriiia介导,其中巨噬细胞上的fcγriia(cd32a)代表主要途径。
[0084]
在一些实施方案中,抗半乳糖凝集素-9抗体诱导靶细胞例如表达半乳糖凝集素-9的癌细胞或免疫抑制性免疫细胞的细胞吞噬作用(adcp)。在一些实施方案中,抗半乳糖凝集素-9抗体使靶细胞例如癌细胞或免疫抑制性免疫细胞的吞噬作用增加至少30%(例如,31%、35%、40%、50%、60%、70%、80%、90%、95%或更高,包括其中的任何增量)。
[0085]
在一些实施方案中,本文所述的抗半乳糖凝集素-9抗体诱导细胞细胞毒性,例如针对靶细胞例如癌细胞或免疫抑制性免疫细胞的补体依赖性细胞毒性(cdc)。在一些实施方案中,抗半乳糖凝集素-9抗体使针对靶细胞的cdc增加至少30%(例如,31%、35%、40%、50%、60%、70%、80%、90%、95%或更大,包括其中的任何增量)。
[0086]
在一些实施方案中,抗半乳糖凝集素-9抗体在例如肿瘤浸润性t细胞中诱导t细胞活化,即直接或间接抑制半乳糖凝集素-9介导的t细胞活化抑制。在一些实施方案中,抗半乳糖凝集素-9抗体使t细胞活化促进至少30%(例如,31%、35%、40%、50%、60%、70%、80%、90%、95%或更大,包括其中的任何增量)。t细胞活化可以通过常规方法确定,例如使用众所周知的测定细胞因子和检查点抑制剂的测定法(例如,cd44、tnfα、ifnγ和/或pd-1的测量)。在一些实施方案中,抗半乳糖凝集素-9抗体使cd4+细胞活化促进至少30%(例如,31%、35%、40%、50%、60%、70%、80%、90%、95%或更大,包括其中的任何增量)。在一个非限制性实例中,抗半乳糖凝集素抗体诱导cd4+细胞中的cd44表达。在一些实施方案中,抗半乳糖凝集素-9抗体使cd4+细胞中的cd44表达增加至少30%(例如,31%、35%、40%、50%、60%、70%、80%、90%、95%或更大,包括其中的任何增量)。在一个非限制性实例中,抗半乳糖凝集素抗体诱导cd4+细胞中的ifnγ表达。在一些实施方案中,抗半乳糖凝集素-9抗体使cd4+细胞中的ifnγ表达增加至少30%(例如,31%、35%、40%、50%、60%、70%、80%、90%、95%或更大,包括其中的任何增量)。在一个非限制性实例中,抗半乳糖凝集素抗体诱导cd4+细胞中的tnfα表达。在一些实施方案中,抗半乳糖凝集素-9抗体使cd4+细胞中tnfα的表达增加至少30%(例如,31%、35%、40%、50%、60%、70%、80%、90%、95%或更大,包括其中的任何增量)。
[0087]
在一些实施方案中,抗半乳糖凝集素-9抗体使cd8+细胞活化促进至少30%(例如,
31%、35%、40%、50%、60%、70%、80%、90%、95%或更大,包括其中的任何增量)。在一个非限制性实例中,抗半乳糖凝集素抗体诱导cd8+细胞中的cd44表达。在一些实施方案中,抗半乳糖凝集素-9抗体使cd8+细胞中的cd44表达增加至少30%(例如,31%、35%、40%、50%、60%、70%、80%、90%、95%或更大,包括其中的任何增量)。在一个非限制性实例中,抗半乳糖凝集素抗体诱导cd8+细胞中的ifnγ表达。在一些实施方案中,抗半乳糖凝集素-9抗体使cd8+细胞中的ifnγ表达增加至少30%(例如,31%、35%、40%、50%、60%、70%、80%、90%、95%或更大,包括其中的任何增量)。在一个非限制性实例中,抗半乳糖凝集素抗体诱导cd8+细胞中的tnfα表达。在一些实施方案中,抗半乳糖凝集素-9抗体使cd8+细胞中tnfα的表达增加至少30%(例如,31%、35%、40%、50%、60%、70%、80%、90%、95%或更大,包括其中的任何增量)。
[0088]
在一些实施方案中,本文所述的抗半乳糖凝集素-9抗体对靶抗原(例如,半乳糖凝集素-9)或其抗原表位具有合适的结合亲和力。如本文所用,“结合亲和力”是指表观结合常数或ka。ka是解离常数(kd)的倒数。本文所述的抗半乳糖凝集素-9抗体对靶抗原或抗原表位可具有至少10-5
,10-6
,10-7
,10-8
,10-9
,10-10
m或更低的结合亲和力(kd)。增加的结合亲和力对应于降低的kd。结合亲和力(或结合特异性)可以通过多种方法确定,包括平衡透析、平衡结合、凝胶过滤、elisa、表面等离子共振或光谱(例如,使用荧光测定)。用于评估结合亲和力的示例性条件是在hbs-p缓冲液(10mm hepes ph7.4,150mm nacl,0.005%(v/v)表面活性剂p20)中。
[0089]
这些技术可用于测量作为靶蛋白浓度的函数的结合的结合蛋白的浓度。在某些条件下,结合的结合蛋白的分数浓度([结合的]/[总共的])通过以下方程通常与总靶蛋白([靶标])的浓度有关:
[0090]
[结合的]/[总共的]=[靶标]/(kd+[靶标])
[0091]
然而,并不总是需要准确确定ka,因为有时获得亲和力的定量测量就足够了,例如,使用诸如elisa或facs分析的方法确定,其与ka成比例,因此可以用于比较,例如确定是否更高的亲和力(例如高2倍),来获得亲和力的定性测量,或获得亲和力的推断,例如通过功能测定(例如体外或体内测定)中的活性。在一些情况下,体外结合测定指示体内活性。在其他情况下,体外结合测定不一定指示体内活性。在一些情况下紧密结合是有益的,但在其他情况下紧密结合在体内并不理想,更理想的是结合亲和力较低的抗体。
[0092]
在一些实施方案中,如本文所述的任何抗半乳糖凝集素-9抗体中的任一个的重链进一步包含重链恒定区(ch)或其部分(例如,ch1、ch2、ch3或其组合)。重链恒定区可以是任何合适的来源,例如人、小鼠、大鼠或兔。在一个具体实例中,重链恒定区来自如本文所述的任何igg亚家族的人igg(γ重链)。
[0093]
在一些实施方案中,本文所述抗体的重链恒定区包含恒定区(例如,seq id no:4、5、6)的单个结构域(例如,ch1、ch2或ch3)或任何单个结构域的组合。在一些实施方案中,本文所述抗体的轻链恒定区包含恒定区的单个结构域(例如,cl)。下文列出了示例性的轻链和重链序列。下文列出了示例性的轻链和重链序列。higg1 lala序列包括两个突变(l234a和l235a(eu编号),它们抑制fcgr结合)以及p329g突变(eu编号)以消除补体c1q结合,从而消除所有免疫效应子功能。higg4 fab臂交换突变序列包括抑制fab臂交换的突变(s228p;eu编号)。il2信号序列(myrmqllscialslalvtns;seq id no:9)可以位于可变区的n-末端。
它用于表达载体中,其在分泌过程中被切割,因此不在成熟的抗体分子中。成熟蛋白(分泌后)的重链以“evq”开头,轻链以“dim”开头。示例性重链恒定区的氨基酸序列提供如下:
[0094]
higg1重链恒定区(seq id no:10)
[0095]
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk*
[0096]
higg1 lala重链恒定区(seq id no:12)
[0097]
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalgapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk*
[0098]
higg4重链恒定区(seq id no:13)
[0099]
astkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcpscpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslspgk*
[0100]
higg4重链恒定区(seq id no:20)
[0101]
astkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcpscpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk*
[0102]
higg4突变重链恒定区(seq id no:14)
[0103]
astkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslspgk*
[0104]
higg4突变重链恒定区(seq id no:21)
[0105]
astkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk*
[0106]
在一些实施方案中,具有任何上述重链恒定区的抗半乳糖凝集素-9抗体与具有以
下轻链恒定区的轻链配对:
[0107]
轻链恒定区(seq id no:11)
[0108]
tvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0109]
示例性全长抗半乳糖凝集素-9抗体提供如下:
[0110]
g9.2-17 higg1重链(seq id no:16)
[0111]
evqlvesggglvqpggslrlscaasgftvssssihwvrqapgkglewvayissssgytyyadsvkgrftisadtskntaylqmnslraedtavyycarywsypswwpyrgmdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk*
[0112]
g9.2-17 higg1 lala重链(seq id no:17)
[0113]
evqlvesggglvqpggslrlscaasgftvssssihwvrqapgkglewvayissssgytyyadsvkgrftisadtskntaylqmnslraedtavyycarywsypswwpyrgmdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalgapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk*
[0114]
g9.2-17 higg4重链(seq id no:18)
[0115]
evqlvesggglvqpggslrlscaasgftvssssihwvrqapgkglewvayissssgytyyadsvkgrftisadtskntaylqmnslraedtavyycarywsypswwpyrgmdywgqgtlvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcpscpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslspgk*
[0116]
g9.2-17 higg4重链(seq id no:22)
[0117]
evqlvesggglvqpggslrlscaasgftvssssihwvrqapgkglewvayissssgytyyadsvkgrftisadtskntaylqmnslraedtavyycarywsypswwpyrgmdywgqgtlvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcpscpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk*
[0118]
g9.2-17 higg4 fab臂交换突变重链(seq id no:19)
[0119]
evqlvesggglvqpggslrlscaasgftvssssihwvrqapgkglewvayissssgytyyadsvkgrf
tisadtskntaylqmnslraedtavyycarywsypswwpyrgmdywgqgtlvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslspgk*
[0120]
g9.2-17 higg4 fab臂交换突变重链(seq id no:23)
[0121]
evqlvesggglvqpggslrlscaasgftvssssihwvrqapgkglewvayissssgytyyadsvkgrftisadtskntaylqmnslraedtavyycarywsypswwpyrgmdywgqgtlvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk*
[0122]
任何上述重链可以与如下所示的(seq id no:15)的轻链配对:
[0123]
diqmtqspsslsasvgdrvtitcrasqsvssavawyqqkpgkapklliysasslysgvpsrfsgsrsgtdftltisslqpedfatyycqqsstdpitfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec*
[0124]
在一些实施方案中,抗半乳糖凝集素-9抗体包含重链igg1恒定区,其与seq id no:10具有至少80%(例如,80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%以及其中的任何增量)的序列同一性。在一个实施方案中,抗半乳糖凝集素-9抗体的恒定区包含重链igg4恒定区,该重链igg4恒定区包含seq id no:10。在一个实施方案中,抗半乳糖凝集素-9抗体的恒定区包含由seq id no:10组成的重链igg1恒定区。
[0125]
在一些实施方案中,抗半乳糖凝集素-9抗体包含重链igg4恒定区,其与seq id no:20具有至少80%(例如,80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%以及其中的任何增量)的序列同一性。在一个实施方案中,抗半乳糖凝集素-9抗体的恒定区包含重链igg4恒定区,该恒定区包含seq id no:20。在一个实施方案中,抗半乳糖凝集素-9抗体的恒定区包含由seq id no:20组成的重链igg4恒定区。
[0126]
在一些实施方案中,恒定区来自人igg4。在一个实施方案中,抗半乳糖凝集素-9抗体包含重链igg4恒定区,其与seq id no:13具有至少80%(例如,80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%以及其中的任何增量)的序列同一性。在一个实施方案中,抗半乳糖凝集素-9抗体包含重链igg4恒定区,该重链igg4恒定区包含seq id no:13。在一个实施方案中,抗半乳糖凝集素-9抗体包含由seq id no:13组成的重链igg4恒定区。
[0127]
在一些实施方案中,恒定区来自人igg4。在一个实施方案中,抗半乳糖凝集素-9抗体包含重链igg4恒定区,其与seq id no:20具有至少80%(例如,80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%以及其中的任何增量)的序列同一性。在一个实施方案中,抗半乳糖凝集素-9抗体包含重链igg4恒定区,该重链igg4恒定区包含seq id no:20。在一个实施方案中,抗半乳糖凝集素-9抗体包含由seq id no:20组成的重链
no:15组成的轻链和基本上由选自seq id no:16-19、22和23的任一序列组成的重链。在一些实施方案中,抗半乳糖凝集素-9抗体具有由seq id no:15组成的轻链和由选自seq id no:16-19、22和23的任一序列组成的重链。在一个具体实施方案中,抗半乳糖凝集素-9抗体具有基本上由seq id no:15组成的轻链和基本上由seq id no:19组成的重链。在另一个具体实施方案中,抗半乳糖凝集素-9抗体具有基本上由seq id no:15组成的轻链和基本上由seq id no:20组成的重链。
[0135]
在一个实施方案中,抗半乳糖凝集素-9抗体包含与seq id no:16具有至少80%(例如,80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%以及其中的任何增量)的序列同一性的重链序列。在一个实施方案中,抗半乳糖凝集素-9抗体含有包含seq id no:16的重链序列。在一个实施方案中,抗半乳糖凝集素-9抗体包含由seq id no:16组成的重链序列。
[0136]
在一个实施方案中,抗半乳糖凝集素-9抗体包含与seq id no:17具有至少80%(例如,80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%以及其中的任何增量)的序列同一性的重链序列。在一个实施方案中,抗半乳糖凝集素-9抗体含有包含seq id no:17的重链序列。在一个实施方案中,抗半乳糖凝集素-9抗体包含由seq id no:17组成的重链序列。
[0137]
在一个实施方案中,抗半乳糖凝集素-9抗体包含与seq id no:18具有至少80%(例如,80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%以及其中的任何增量)的序列同一性的重链序列。在一个实施方案中,抗半乳糖凝集素-9抗体含有包含seq id no:18的重链序列。在一个实施方案中,抗半乳糖凝集素-9抗体包含由seq id no:18组成的重链序列。
[0138]
在一个实施方案中,抗半乳糖凝集素-9抗体包含与seq id no:22具有至少80%(例如,80%、85%、90%、91%、92%、93%、94%、95%、96%1、97%、98%或99%以及其中的任何增量)的序列同一性的重链序列。在一个实施方案中,抗半乳糖凝集素-9抗体含有包含seq id no:22的重链序列。在一个实施方案中,抗半乳糖凝集素-9抗体包含由seq id no:22组成的重链序列。
[0139]
在一个实施方案中,抗半乳糖凝集素-9抗体包含与seq id no:19具有至少80%(例如,80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%以及其中的任何增量)的序列同一性的重链序列。在一个实施方案中,抗半乳糖凝集素-9抗体含有包含seq id no:19的重链序列。在一个实施方案中,抗半乳糖凝集素-9抗体包含由seq id no:19组成的重链序列。
[0140]
在一个实施方案中,抗半乳糖凝集素-9抗体包含与seq id no:23具有至少80%(例如,80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%以及其中的任何增量)的序列同一性的重链序列。在一个实施方案中,抗半乳糖凝集素-9抗体含有包含seq id no:23的重链序列。在一个实施方案中,抗半乳糖凝集素-9抗体包含由seq id no:23组成的重链序列。
[0141]
在这些实施方案的任一个中,抗半乳糖凝集素-9抗体包含与seq id no:15具有至少80%(例如,80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%以及其中的任何增量)的序列同一性的轻链序列。在一些实施方案中,抗半乳糖凝集素-9抗体含
有包含seq id no:15的轻链序列。在一些实施方案中,抗半乳糖凝集素-9抗体包含由seq id no:15组成的轻链序列。
[0142]
在具体实例中,本文公开的治疗方法中使用的抗半乳糖凝集素-9抗体具有seq id no:19的重链和seq id no:15的轻链。在一些实施方案中,本文公开的治疗方法中使用的抗半乳糖凝集素-9抗体是g9.2-17 igg4。
[0143]
抗半乳糖凝集素-9抗体的制备
[0144]
如本文所述能够结合半乳糖凝集素-9的抗体可以通过本领域已知的任何方法制备,包括但不限于重组技术。下面提供了一个示例。
[0145]
可以将编码如本文所述的抗半乳糖凝集素-9抗体的重链和轻链的核酸克隆到一个表达载体中,每个核苷酸序列与合适的启动子可操作地连接。在一个实例中,编码重链和轻链的每个核苷酸序列与不同的启动子可操作地连接。或者,编码重链和轻链的核苷酸序列可以与单个启动子可操作地连接,使得重链和轻链都从相同的启动子表达。必要时,可在重链和轻链编码序列之间插入内部核糖体进入位点(ires)。
[0146]
在一些实例中,编码抗体的两条链的核苷酸序列被克隆到两个载体中,这两个载体可以被引入相同或不同的细胞中。当两条链在不同的细胞中表达时,它们中的每一条都可以从表达它们的宿主细胞中分离出来,并且可以将分离的重链和轻链混合并在允许形成抗体的合适条件下孵育。
[0147]
通常,可以使用本领域已知的方法将编码抗体的一条或全部链的核酸序列克隆到合适的表达载体中与合适的启动子可操作地连接。例如,核苷酸序列和载体可以在合适的条件下与限制酶接触以在每个分子上产生互补末端,该互补末端可以彼此配对并用连接酶连接在一起。或者,合成的核酸接头可以连接到基因的末端。这些合成接头包含对应于载体中特定限制性位点的核酸序列。表达载体/启动子的选择将取决于用于产生抗体的宿主细胞的类型。
[0148]
多种启动子可用于表达本文所述的抗体,包括但不限于巨细胞病毒(cmv)中间早期启动子、病毒ltr例如劳斯肉瘤病毒ltr、hiv-ltr、htlv-1ltr、猿病毒40(sv40)早期启动子、大肠杆菌lac uv5启动子和单纯疱疹tk病毒启动子。
[0149]
也可以使用可调节的启动子。此类可调节启动子包括使用来自大肠杆菌的lac阻遏物作为转录调节剂来调节来自带有lac操纵子的哺乳动物细胞启动子的转录的那些[brown,m.等人,cell,49:603-612(1987)],使用四环素阻遏物(tetr)的那些[gossen,m.,and bujard,h.,proc.natl.acad.sci.usa 89:5547-5551(1992);yao,f.等人,human gene therapy,9:1939-1950(1998);shockelt,p.等人,proc.natl.acad.sci.usa,92:6522-6526(1995)]。其他系统包括使用雌二醇(astradiol)的vp16或p65、fk506二聚体、ru486、二酚米乐甾酮(diphenol murislerone)或雷帕霉素。诱导型系统可从invitrogen、clontech和ariad获得。
[0150]
可以使用包含阻遏物的操纵子的可调节启动子。在一个实施方案中,来自大肠杆菌的lac阻遏物可以作为转录调节剂来调节来自带有lac操纵子的哺乳动物细胞启动子的转录(m.brown等人,cell,49:603-612(1987);gossen and bujard(1992);m.gossen等人,natl.acad.sci.usa,89:5547-5551(1992)),将四环素阻遏物(tetr)与转录激活剂(vp 16)组合以创建tetr-哺乳动物细胞转录激活因子融合蛋白tta(tetr-vp 16),带有源自人巨细
胞病毒(hcmv)主要立即早期启动子的带有teto的最小启动子,以创建tetr-tet操纵系统来控制哺乳动物细胞中的基因表达。在一个实施方案中,使用四环素可诱导开关。当四环素操纵子合适地定位在cmvie启动子的tata元件下游时,单独的四环素阻遏物(tetr),而不是tetr-哺乳动物细胞转录因子融合衍生物,可以作为有效的反式调节剂来调节哺乳动物细胞中的基因表达(yao等人,human gene therapy,10(16):1392-1399(2003))。这种四环素可诱导开关的一个特殊优点是它不需要使用四环素阻遏物-哺乳动物细胞反式激活因子或阻遏物融合蛋白,其在一些情况下可对细胞有毒(gossen等人,natl.acad.sci.usa,89:5547-5551(1992);shockett等人,proc.natl.acad.sci.usa,92:6522-6526(1995)),以实现其可调节效果。
[0151]
此外,载体可包含例如以下的部分或全部:选择标记基因,例如用于选择哺乳动物细胞中的稳定或瞬时转染子的新霉素基因;用于高水平转录的来自人cmv立即早期基因的增强子/启动子序列;用于mrna稳定性的来自sv40的转录终止和rna加工信号;用于正确的游离复制的sv40多瘤复制起点和cole1;内部核糖体结合位点(ires),多功能多克隆位点;和用于有义和反义rna的体外转录的t7和sp6 rna启动子。合适的载体和用于产生含有转基因的载体的方法是本领域公知的和可获得的。
[0152]
可用于实施本文所述方法的聚腺苷酸化信号的实例包括但不限于人胶原蛋白i聚腺苷酸化信号、人胶原蛋白ii聚腺苷酸化信号和sv40聚腺苷酸化信号。
[0153]
可以将一种或多种包含编码任何抗体的核酸的载体(例如,表达载体)引入合适的宿主细胞中以产生抗体。宿主细胞可以在适合表达抗体或其任何多肽链的条件下培养。此类抗体或其多肽链可以通过常规方法(例如亲和纯化)由培养的细胞回收(例如,从细胞或培养上清液)。如果需要,抗体的多肽链可以在合适的条件下孵育合适的时间以允许产生抗体。
[0154]
在一些实施方案中,制备本文所述的抗体的方法涉及编码抗半乳糖凝集素-9抗体的重链和轻链的重组表达载体,也如本文所述。可以通过常规方法,例如磷酸钙介导的转染,将重组表达载体引入合适的宿主细胞(例如,dhfr-cho细胞)中。可以在允许形成抗体的两条多肽链的表达的合适条件下选择和培养阳性转化宿主细胞,所述多肽链可以从细胞或从培养基中回收。必要时,从宿主细胞中回收的两条链可以在允许形成抗体的合适条件下孵育。
[0155]
在一个实例中,提供了两种重组表达载体,一种编码抗半乳糖凝集素-9抗体的重链,另一种编码抗半乳糖凝集素-9抗体的轻链。两种重组表达载体均可通过常规方法(例如磷酸钙介导的转染)引入合适的宿主细胞(例如,dhfr-cho细胞)。或者,可以将每种表达载体引入合适的宿主细胞中。可以在允许抗体多肽链表达的合适条件下选择和培养阳性转化体。当两种表达载体被引入相同的宿主细胞时,其中产生的抗体可以从宿主细胞或从培养基中回收。如果需要,可以从宿主细胞或培养基中回收多肽链,然后在允许形成抗体的合适条件下孵育。当两种表达载体被引入不同的宿主细胞时,它们中的每一种都可以从相应的宿主细胞或从相应的培养基中回收。然后可以在合适的条件下孵育两条多肽链以形成抗体。
[0156]
使用标准分子生物学技术制备重组表达载体、转染宿主细胞、选择转化体、培养宿主细胞以及从培养基中回收抗体。例如,一些抗体可以通过亲和层析与蛋白a或蛋白g偶联
基质进行分离。
[0157]
编码如本文所述的抗半乳糖凝集素-9抗体的重链、轻链或两者的任何核酸、包含它们的载体(例如,表达载体)和包含载体的宿主细胞在本公开内容的范围内。
[0158]
可以使用本领域已知的方法表征由此制备的抗半乳糖凝集素-9抗体,由此检测和/或测量半乳糖凝集素-9生物活性的降低、改善或中和。例如,在一些实施方案中,elisa型测定适用于dectin-1或tim-3信号传导的半乳糖凝集素-9抑制的定性或定量测量。
[0159]
抗半乳糖凝集素-9抗体的生物活性可以通过将候选抗体与dectin-1和半乳糖凝集素-9一起孵育,并监测以下任何一个或多个特征来验证:(a)dectin-1和半乳糖凝集素-9之间的结合和由结合介导的信号转导的抑制;(b)预防、改善或治疗实体瘤的任何方面;(c)阻断或减少dectin-1的激活;(d)抑制(减少)半乳糖凝集素-9的合成、产生或释放。或者,tim-3可用于使用上述方案验证抗半乳糖凝集素-9抗体的生物活性。或者,cd206可用于使用上述方案验证抗半乳糖凝集素-9抗体的生物活性。
[0160]
在一些实施方案中,例如通过测量外周和肿瘤内t细胞比率、t细胞活化或通过巨噬细胞分型来评估在受试者中的生物活性或功效。
[0161]
确定抗半乳糖凝集素-9抗体生物活性的其他测定包括测量cd8+和cd4+(常规)t细胞活化(在体外或体内测定中,例如通过测量炎性细胞因子水平,例如,ifnγ、tnfα、cd44、icos颗粒酶b、穿孔素、il2(上调);cd26l和il-10(下调));巨噬细胞重编程的测量(体外或体内),例如从m2到m1表型(例如增加的mhcii、减少的cd206、增加的tnf-α和inos),或者,可以评估adcc的水平,例如,在体外测定中,如本文所述。
[0162]
药物组合物
[0163]
如本文所述的抗半乳糖凝集素-9抗体以及编码核酸或核酸组、包含它们的载体或包含载体的宿主细胞可以与药学上可接受的载体(赋形剂)混合以形成药物组合物用于治疗靶疾病。“可接受”是指载体必须与组合物的活性成分相容(并且优选地,能够稳定活性成分)并且对待治疗的受试者无害。药学上可接受的赋形剂(载体)包括本领域众所周知的缓冲剂。参见,例如,remington:the science and practice of pharmacy 20th ed.(2000)lippincott areiams and wilkins,ed.k.e.hoover。
[0164]
用于本方法的药物组合物可包含冻干制剂或水溶液形式的药学上可接受的载体、赋形剂或稳定剂。(remington:the science and practice of pharmacy 20th ed.(2000)lippincott areiams and wilkins,ed.k.e.hoover)。可接受的载体、赋形剂或稳定剂在所使用的剂量和浓度下对接受者是无毒的,并且包括缓冲剂,例如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸和蛋氨酸;防腐剂(例如十八烷基二甲基苄基氯化铵;六甲铵氯化物;苯扎氯铵、苄索氯铵;苯酚、丁醇或苯甲醇;对羟基苯甲酸烷基酯例如对羟基苯甲酸甲酯或丙酯;邻苯二酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)多肽;蛋白质,例如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,例如聚乙烯吡咯烷酮;氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或葡聚糖;螯合剂例如edta;糖例如蔗糖、甘露糖醇、海藻糖或山梨糖醇;形成盐的反离子例如钠;金属配合物(例如,锌-蛋白质配合物);和/或非离子表面活性剂,例如tween
tm
、pluronics
tm
或聚乙二醇(peg)。在一些实例中,本文所述的药物组合物包含含有抗体(或编码核酸)的脂质体,其可通过本领域已知的方法制备,例如epstein
等人,proc.natl.acad.sci.usa 82:3688(1985);hwang等人,proc.natl.acad.sci.usa 77:4030(1980);和美国专利号4,485,045和4,544,545中所描述的。具有延长循环时间的脂质体公开于美国专利号5,013,556中。特别有用的脂质体可以通过反相蒸发法用脂质组合物产生,该脂质组合物包含磷脂酰胆碱、胆固醇和peg衍生的磷脂酰乙醇胺(peg-pe)。脂质体通过限定孔径的过滤器挤出,以产生具有所需直径的脂质体。
[0165]
在一些实施方案中,抗半乳糖凝集素-9抗体或编码核酸被包裹在例如通过凝聚技术或通过界面聚合制备的微胶囊(例如分别地羟甲基纤维素或明胶-微胶囊和聚-(甲基丙烯酸甲酯(methylmethacylate))微胶囊)中、胶体药物递送系统(例如,脂质体、白蛋白微球、微乳液、纳米颗粒和纳米胶囊)或粗乳液中。此类技术是本领域已知的,参见例如remington,the science and practice of pharmacy 20th ed.mack publishing(2000)。
[0166]
在其他实例中,本文所述的药物组合物可以以缓释形式配制。缓释制剂的合适实例包括含有抗体的固体疏水聚合物的半透性基质,该基质呈成形制品的形式,例如薄膜或微胶囊。缓释基质的实例包括聚酯、水凝胶(例如,聚(2-羟乙基甲基丙烯酸酯)或聚(乙烯醇))、聚交酯(美国专利号3,773,919)、l-谷氨酸和7乙基-l-谷氨酸的共聚物、不可降解的乙烯-乙酸乙烯酯、可降解的乳酸-乙醇酸共聚物例如lupron depot
tm
(由乳酸-乙醇酸共聚物和醋酸亮丙瑞林组成的注射微球)、异丁酸蔗糖乙酸酯(sucrose acetate isobutyrate)和聚-d-(-)-3-羟基丁酸。
[0167]
用于体内施用的药物组合物必须是无菌的。这很容易通过例如通过无菌过滤膜过滤来实现。治疗性抗体组合物通常置于具有无菌入口的容器中,例如具有可被皮下注射针刺穿的塞子的静脉溶液袋或小瓶。
[0168]
本文所述的药物组合物可以是单位剂型,例如片剂、丸剂、胶囊剂、粉剂、颗粒剂、溶液剂或混悬剂,或栓剂,用于口服、肠胃外或直肠施用,或通过吸入或吹入施用。
[0169]
为了制备固体组合物例如片剂,主要活性成分可以与药物载体混合,例如常规压片成分例如玉米淀粉、乳糖、蔗糖、山梨糖醇、滑石、硬脂酸、硬脂酸镁、磷酸二钙或树胶,以及其他药物稀释剂,例如水,以形成含有本发明的化合物或其无毒的药学上可接受的盐的均匀混合物的固体预制剂组合物。当将这些预制剂组合物称为均质时,是指活性成分均匀地分散在整个组合物中,使得该组合物可以容易地细分为同样有效的单位剂型,例如片剂、丸剂和胶囊剂。然后将该固体预制剂组合物细分为含有0.1至约500mg本发明的活性成分的上述类型的单位剂型。新组合物的片剂或丸剂可以被包衣或以其他方式混合以提供具有延长作用优势的剂型。例如,片剂或丸剂可包含内部剂量和外部剂量组分,后者为在前者之上的包膜形式。这两种组分可以被肠溶层隔开,肠溶层用于抵抗胃中的崩解并允许内部组分完整地进入十二指肠或延迟释放。多种材料可用于此类肠溶层或包衣,此类材料包括多种聚合酸以及聚合酸与诸如虫胶、鲸蜡醇和醋酸纤维素的材料的混合物。合适的表面活性剂特别包括非离子试剂,例如聚氧乙烯脱水山梨糖醇(polyoxyethylenesorbitan)(例如tween
tm 20、40、60、80或85)和其他脱水山梨糖醇(例如span
tm 20、40、60、80或85)。具有表面活性剂的组合物方便地包含0.05至5%的表面活性剂,并且可以是0.1至2.5%。应当理解,如果需要,可以添加其他成分,例如甘露醇或其他药学上可接受的载体。
[0170]
合适的乳液可以使用市售的脂肪乳液制备,例如intralipid
tm
,liposyn
tm
,infonutrol
tm
,lipofundin
tm
和lipiphysan
tm
。活性成分可以溶解在预先混合的乳液组合物
中,或者它可以溶解在油(例如,大豆油、红花油、棉籽油、芝麻油、玉米油或杏仁油)和与磷脂(例如,卵磷脂、大豆磷脂或大豆卵磷脂)和水混合后形成的乳液中。应当理解,可以添加其他成分,例如甘油或葡萄糖,以调节乳液的张力。合适的乳液通常含有高达20%的油,例如5%至20%。脂肪乳液可包含0.1至1.0.im,特别是0.1至0.5.im的脂肪滴,并且具有5.5至8.0范围内的ph。
[0171]
乳液组合物可以是通过将抗体与intralipid
tm
或其组分(大豆油、卵磷脂、甘油和水)混合而制备的那些。
[0172]
用于吸入或吹入的药物组合物包括在药学上可接受的水性或有机溶剂或其混合物中的溶液和悬浮液,以及粉末。液体或固体组合物可包含合适的如上所述的药学上可接受的赋形剂。在一些实施方案中,组合物通过口腔或鼻呼吸途径施用以获得局部或全身作用。
[0173]
在优选无菌的药学上可接受的溶剂中的组合物可以通过使用气体雾化。雾化溶液可以直接从雾化装置呼吸,或者雾化装置可以连接到面罩、帐(tent)或间歇性正压呼吸机。溶液、悬浮液或粉末组合物可以从以适当方式递送制剂的装置施用,优选口服或鼻腔施用。
[0174]
治疗方法
[0175]
本公开内容提供了单独地或与检查点抑制剂例如抗pd-1抗体组合地使用任何抗半乳糖凝集素抗体(例如g9.2-17,例如g9.2-17 igg4)来治疗实体瘤例如pda、crc、hcc和胆管癌的方法。本文所述的任何抗半乳糖凝集素-9抗体可用于本文所述的任何方法。在一些实施方案中,抗半乳糖凝集素-9抗体是g9.2-17。此类抗体可用于治疗与半乳糖凝集素-9相关的疾病。
[0176]
在一些方面,本发明提供治疗癌症的方法。在一些实施方案中,本公开内容的方法用于减少、改善或消除一种或多种与癌症相关的症状。
[0177]
在一些实施方案中,本公开内容提供了一种治疗受试者中实体瘤的方法,该方法包括向有需要的受试者施用有效量的抗半乳糖凝集素-9抗体或有效量的包含本文所述的抗-半乳糖凝集素-9抗体或其抗原结合片段的药物组合物。在一些实施方案中,抗半乳糖凝集素-9抗体是具有与参考抗体g9.2-17相同的重链cdr序列和/或相同的轻链cdr序列的抗体。在一些实施方案中,抗半乳糖凝集素-9抗体是具有与参考抗体g9.2-17相同的vh和v
l
序列的抗体。在一些实施方案中,此类抗体是igg1分子(例如,具有如本文公开的那些的野生型igg1恒定区或其突变体)。或者,抗体是igg4分子(例如,具有如本文所述的那些的野生型igg4恒定区或其突变体)。在一些实施方案中,该抗体包含seq id no:1所示的轻链互补决定区1(cdr1)、seq id no:2所示的轻链互补决定区2(cdr2)和seq id no:3所示的轻链互补决定区3(cdr3)和/或包含seq id no:4所示的重链互补决定区1(cdr1)、seq id no:5所示的重链互补决定区2(cdr2)和seq id no:6所示的重链互补决定区3(cdr3)。在一些实施方案中,该抗体含有包含seq id no:7的重链可变区。在一些实施方案中,抗体含有包含seq id no:8的轻链可变区。在一些实施方案中,该抗体含有包含seq id no:7的重链可变区和包含seq id no:8的轻链可变区。在一些实施方案中,抗体含有包含seq id no:19的重链。在一些实施方案中,抗体含有包含seq id no:15的轻链。在具体实例中,本文使用的抗半乳糖凝集素-9抗体具有seq id no:19的重链和seq id no:15的轻链。在一些实施方案中,抗体是g9.2-17igg4。在一些实施方案中,抗半乳糖凝集素-9抗体以约1mg/kg至约32mg/kg的
剂量施用至受试者,例如,该剂量可选自2mg/kg、4mg/kg、8mg/kg、12mg/kg和16mg/kg。在一些实施方案中,抗体每两周施用一次,例如通过静脉输注施用。在一些实施方案中,该方法进一步包括向受试者施用免疫检查点抑制剂,例如抗pd1抗体。在一些实施方案中,实体瘤选自胰腺癌(pda)、结直肠癌(crc)、肝细胞癌(hcc)或胆管癌(cca),并且在一些实施方案中,实体瘤是转移性肿瘤。
[0178]
在本公开内容的范围内还包括用于治疗实体瘤(例如,本文描述的那些并且包括转移性实体瘤)的药物组合物,以及任何抗半乳糖凝集素-9抗体用于制造用于治疗实体瘤的药物的用途,其中在一些实施方案中,本文公开的用途涉及一种或多种治疗条件(例如,剂量、给药方案、施用途径等),如本文也公开的。在一些实施方案中,用于制造治疗实体瘤的药物的抗体包含seq id no:1所示的轻链互补决定区1(cdr1)、seq id no:2所示的轻链互补决定区2(cdr2)和seq id no:3所示的轻链互补决定区3(cdr3)和/或包含seq id no:4所示的重链互补决定区1(cdr1)、seq id no:5所示的重链互补决定区2(cdr2)和seq id no:6所示的重链互补决定区3(cdr3)。在一些实施方案中,抗体含有包含seq id no:7的重链可变区。在一些实施方案中,抗体含有包含seq id no:8的轻链可变区。在一些实施方案中,抗体含有包含seq id no:7的重链可变区和包含seq id no:8的轻链可变区。在一些实施方式中,抗体含有包含seq id no:19的重链。在一些实施方式中,抗体含有包含seq id no:15的轻链。在一些实施方式中,抗体含有包含seq id no:19的重链和包含seq id no:15的轻链。在一些实施方案中,抗体是g9.2-17 igg4。在一些实施方案中,用于制造用于治疗实体瘤的药物的抗半乳糖凝集素-9抗体以约1mg/kg至约32mg/kg的剂量施用至受试者,例如,剂量可以选自2mg/kg、4mg/kg、8mg/kg、12mg/kg和16mg/kg。在一些实施方案中,用于制造用于治疗实体瘤的药物的抗体每两周施用一次,例如通过静脉输注施用。在一些实施方案中,抗半乳糖凝集素-9抗体每2周一次施用一个周期、每2周一次施用两个周期、每2周一次施用3个周期、每2周一次施用4个周期或每2周一次施用超过4个周期。在一些实施方案中,抗半乳糖凝集素-9抗体每2周施用一次,共4个周期。在一些实施方案中,治疗持续时间为12-24个月或更长。
[0179]
在一些实施方案中,周期延续3个月至6个月、或6个月至12个月或12个月至24个月或更长的持续时间。在一些实施方案中,周期长度被修改,例如临时或永久地修改为更长的持续时间,例如3周或4周。在一些实施方案中,如本文所述,该用途进一步包括向受试者施用免疫检查点抑制剂,例如抗pd1抗体,例如根据本文所述的方案施用。在一些实施方案中,实体瘤选自胰腺癌(pda)、结直肠癌(crc)、肝细胞癌(hcc)或胆管癌(cca),并且在一些实施方案中,实体瘤是转移性肿瘤。
[0180]
鉴于半乳糖凝集素-9的促肿瘤作用是通过与免疫细胞的相互作用(例如,通过tim-3、cd44和41bb与淋巴样细胞相互作用,以及通过dectin-1和cd206与巨噬细胞相互作用)介导的并且鉴于半乳糖凝集素-9在大量肿瘤中表达,靶向半乳糖凝集素-9(例如,使用半乳糖凝集素-9结合抗体)以抑制与其受体的相互作用提供了一种可应用于多种不同肿瘤类型的治疗方法。
[0181]
在一些实施方案中,本公开内容提供了一种治疗受试者中实体瘤的方法,该方法包括向有需要的受试者施用有效量的本文所述的抗半乳糖凝集素-9抗体,包括但不限于g9.2-17 igg4。在一些实例中,本文公开的方法应用于患有胰腺癌例如导管腺癌(pda)的人
患者。在某些情况下,pda患者可患有转移性癌症。在一些实例中,本文公开的方法应用于患有结直肠癌(crc)的人患者。在一些实施方案中,结直肠癌是转移性的。在一些实例中,本文公开的方法应用于患有肝细胞癌黑色素瘤的人患者。在一些实施方案中,肝细胞癌是转移性的。在其他实例中,本文公开的方法应用于患有胆管癌的人患者。在一些实施方案中,胆管癌是转移性的。
[0182]
胰腺导管腺癌(pda)是一种毁灭性疾病,很少有长期幸存者(yadav等人,gastroenterology,2013,144,1252-1261)。炎症在pda进展中至关重要,因为在没有伴随炎症的情况下,单独的致癌突变不足以导致肿瘤发生(guerra等人,cancer cell,2007,11,291-302)。先天性免疫和适应性免疫协同促进pda中的肿瘤进展。特别地,肿瘤微环境(tme)内的特定先天免疫亚群倾向于将适应性免疫效应细胞培养成肿瘤允许表型。抗原呈递细胞(apc)群(包括m2极化的肿瘤相关巨噬细胞(tam)和髓样树突细胞(dc))诱导免疫抑制性th2细胞的产生,有利于肿瘤保护性th1细胞(ochi等人,j of exp med.,2012,209,1671-1687;zhu等人,cancer res.,2014,74,5057-5069)。类似地,已经显示髓源性抑制细胞(mdsc)在pda中消除抗肿瘤cd8+细胞毒性t淋巴细胞(ctl)反应并促进转移进展(connolly等人,j leuk biol.,2010,87,713-725;pylayeva-gupta等人,cancer cell,2012,21,836-847;bayne等人,cancer cell,2012,21,822-835)。
[0183]
胰腺癌仍然是一种难以治疗的疾病,原因是通常晚期的发现、对化疗的抵抗力相对较高以及缺乏有效的免疫和靶向治疗。在全球范围内,2018年报告了大约455000例胰腺癌新病例,估计到2040年每年将发生355000例新病例,每年报告的死亡人数几乎与新病例一样多。预计到2030年,它会成为美国癌症相关死亡的第二大原因。尽管进行了干预,但转移性胰腺癌患者的中位预期寿命在使用当前治疗的情况下小于一年,而大多数患者(多达80%)出现在晚期/转移阶段,此时疾病已无法治愈性切除。尽管胰腺癌的检测和管理取得了进步,但转移性疾病的五年生存率仍然保持在10%。目前转移性胰腺癌的护理标准主要是化疗,而患有brca1/2突变和错配修复缺陷肿瘤的不同少数患者(低于10%)可能会受益于parp抑制剂和潜在的抗pd-1治疗。然而,对于绝大多数患有这种疾病的患者,由于高度免疫抑制环境,目前批准的免疫疗法通常不成功。
[0184]
结直肠癌(crc),也称为肠癌、结肠癌或直肠癌,是影响结肠和直肠的任何癌症。众所周知,crc是由肿瘤细胞的遗传改变驱动的,并且还受肿瘤-宿主相互作用的影响。最近的报告表明了某些t淋巴细胞亚群的密度与crc的良好临床结果之间的直接相关性,支持t细胞介导的免疫在抑制crc肿瘤进展中的主要作用。
[0185]
结直肠癌是世界上最大的癌症负担之一,全球每年约有700000人被确诊。尽管标准护理疗法取得了重大进展,但转移性结直肠癌(crc)的五年生存率仍约为12%。预计未来20年内crc的死亡人数将增加近一倍。crc的当前护理标准是化疗方案,与抗血管生成疗法和抗egfr方式组合和/或依次进行。此外,目前的免疫疗法仅对不到20%的其肿瘤表现出错配修复缺陷的患者有效(尽管会产生深刻而持久的反应)。微卫星稳定crc(其是大多数的crc患者)的免疫治疗结果是不理想的并且需要新的治疗策略。
[0186]
肝细胞癌(hcc)是最常见的原发性肝癌类型。肝细胞癌最常见于患有慢性肝病(例如由乙型肝炎或丙型肝炎感染引起的肝硬化)的人。由于慢性病毒感染,hcc通常伴有肝硬化和广泛的淋巴细胞浸润。许多研究表明,肿瘤浸润效应cd8+t细胞和t辅助17(th17)细胞
与手术切除肿瘤后的存活率提高相关。然而,肿瘤浸润效应t细胞无法控制肿瘤生长和转移(pang等人,cancer immunol immunother 2009;58:877-886)。
[0187]
胆管癌是一组始于胆管的癌症。胆管癌通常根据其相对于肝脏的位置进行分类。例如,占所有胆管癌病例不到10%的肝内胆管癌始于肝脏内的小胆管。在另一个实例中,占胆管癌病例的多于一半的肝门周围胆管癌(也称为klatskin肿瘤)始于肝门,在那里两个主要胆管连接并离开肝脏。其他被归类为远端胆管癌,其起始于肝脏外的胆管。
[0188]
胆管癌是侵袭性肿瘤,大多数患者在就诊时已是晚期疾病。胆管癌的发病率正在上升,迫切需要有效的治疗方法。吉西他滨加顺铂仍然是晚期胆管癌的标准一线全身治疗,尽管它还有很多不足之处,因为中位生存期不到一年。除了失败的一线治疗之外,指导治疗决策的可用证据很少。三联化疗(nab-紫杉醇加吉西他滨-顺铂)方案以及fgfr2抑制剂在选定的队列中的使用可能在未来获得批准。然而,人临床试验中免疫疗法的次优反应率意味着胆管癌的优势是具有非t细胞浸润微环境的免疫“冷”肿瘤。事实上,迄今为止,免疫疗法的反应率还没有超过17%,截至本技术的申请日,还没有免疫肿瘤药物获得批准。
[0189]
患有任何上述癌症的受试者可以通过常规医学检查,例如实验室测试、器官功能测试、基因测试、介入程序(活检、手术)以及任何和所有相关成像方式来鉴定。在一些实施方案中,待通过本文所述方法治疗的受试者是已经接受或正在接受抗癌疗法例如化学疗法、放射疗法、免疫疗法或手术的人癌症患者。在一些实施方案中,受试者已经接受过先前的免疫调节抗肿瘤剂。此类免疫调节剂的非限制性实例包括但不限于作为抗pd1、抗pd-l1、抗ctla-4、抗ox40、抗cd137等。在一些实施方案中,受试者通过治疗显示疾病进展。在其他实施方案中,受试者对治疗具有抗性(从头的或获得的)。在一些实施方案中,此类受试者被证明患有晚期恶性肿瘤(例如,无法手术或转移性的)。或者或另外地,在一些实施方案中,受试者没有可用的标准治疗选项或不适合标准治疗选项,标准治疗选项是指临床环境中常用的用于治疗相应实体瘤的疗法。
[0190]
在一些情况下,受试者可以是患有难治性疾病的人患者,例如难治性pda、难治性crc、难治性hcc或难治性胆管癌。如本文所用,“难治性”是指对治疗没有反应或变得对治疗产生抗性的肿瘤。在一些情况下,受试者可以是患有复发性疾病(例如复发性pda、复发性crc、复发性hcc或复发性胆管癌)的人患者。如本文所用,“复发”或“复发性”是指在使用治疗改善(例如,部分或完全反应)的一段时间后复发或进展的肿瘤。
[0191]
在一些实施方案中,待通过本文公开的方法治疗的人患者满足以下实施例1中公开的一项或多项纳入和排除标准。例如,人患者可年满18岁或更大;具有组织学证实的不可切除的转移性或无法手术的癌症(例如,没有标准治疗选择),预期寿命》3个月,有近期存档的肿瘤样品可用于生物标志物分析(例如,通过ihc评估存档物种的半乳糖凝集素-9肿瘤组织表达水平);患有可测量的疾病,根据recist v1.1,具有eastern cooperative oncology group(ecog)表现状态0-1或karnofsky评分》70;没有可用的标准护理选择,具有msi-h(高微卫星不稳定性和mss(微卫星稳定);在晚期/转移性环境中接受过至少一种全身治疗线;具有足够的血液学和终末器官功能(定义在下面的实施例1中);已完成对脑转移的治疗(如果有)(参见下面的实施例1);在过去一个月内没有活动性感染的证据和没有严重感染;自最后一剂抗癌治疗后在第一次抗gal-9抗体施用前至少有四(4)周或5个半衰期(以较短者为准);如果适用,继续使用双膦酸盐治疗(唑仑膦酸)或狄诺塞麦用于骨转移。接受即时治
疗的ccr或cca患者可能需要在转移性环境中的至少一种先前的治疗线。在一些实施方案中,接受即时治疗的ccr或cca患者已具有在转移性环境中的至少一种先前的治疗线。
[0192]
或者或另外地,适合本文公开的治疗的受试者可不具有以下一项或多项:诊断患有未知原发灶的转移性癌症;任何活动性不受控制的出血,以及具有出血因素的任何患者(例如,活动性消化性溃疡病);在抗半乳糖凝集素-9抗体施用的4周或5个半衰期内接受任何其他研究药物;在第一剂抗半乳糖凝集素-9抗体的4周内接受放射治疗,有限区域的姑息性放射治疗除外,例如用于治疗骨痛或局灶性疼痛的肿瘤块;有真菌性肿瘤块;对于pdac患者,在治疗开始后6个月内接受过先前含有吉西他滨的治疗方案,患有局部晚期pdac的患者;有活动性临床严重感染》2级nci-ctcae 5.0版;有症状性或活动性脑转移;具有≥ctcae 3级毒性(参见实施例1中的详细信息和例外情况);有第二恶性肿瘤病史(参见实施例1中的例外情况);有严重或无法控制的全身性疾病、充血性心力衰竭的证据;有严重的不愈合伤口、活动性溃疡或未治疗的骨折;有不受控制的胸腔积液、心包积液或腹水,需要反复引流程序;患有未通过手术和/或放射得到明确治疗的脊髓压迫症。软脑膜疾病,活动性或先前治疗过的;患有严重的血管疾病;患有活动性自身免疫性疾病(参见实施例1中的例外情况);需要全身免疫抑制治疗;有对广泛的镇痛干预(口服和/或贴剂)无反应的肿瘤相关的疼痛(》3级);尽管使用了双膦酸盐,但仍有不受控制的高钙血症;有任何归因于先前检查点抑制剂治疗(cit)的免疫相关4级不良事件的历史;接受器官移植;和/或正在接受透析;对于hcc患者和/或cca患者,在治疗前进行过任何消融治疗;肝性脑病或严重的肝腺瘤;child-pugh评分≥7;患有在接受至少一种先前的全身治疗线时出现进展的转移性肝细胞癌;拒绝或不耐受索拉非尼;或已接受过被认为无效、不耐受或不合适的标准疗法,或没有有效的标准疗法可用。
[0193]
在一些情况下,受试者是具有相对于对照水平升高的半乳糖凝集素-9水平的人患者。半乳糖凝集素-9的水平可以是人患者中半乳糖凝集素-9的血浆或血清水平。在其他实例中,半乳糖凝集素-9的水平可以是细胞表面半乳糖凝集素-9的水平,例如癌细胞上的半乳糖凝集素-9的水平。在一个实施方案中,半乳糖凝集素-9的水平可以是在患者来源的器官型肿瘤球体(pdot)中的癌细胞上表达的表面半乳糖凝集素-9的水平,其可以通过例如以下实施例中公开的方法来制备。对照水平可以指没有实体瘤的相同物种(例如,人)受试者的匹配样品中的半乳糖凝集素-9水平。在一些实例中,对照水平代表健康受试者中半乳糖凝集素-9的水平。
[0194]
为了鉴定这样的受试者,可以从怀疑患有实体瘤的受试者获得合适的生物样品,并且可以分析生物样品以使用常规方法例如elisa或facs确定其中所含的半乳糖凝集素-9(例如,游离的、细胞表面表达的或全部)的水平。在一些实施方案中,例如如本文所述制备类器官培养物,并用于评估受试者中的半乳糖凝集素-9水平。从作为类器官制备过程的一部分获得的某些级分中衍生的单细胞也适用于评估受试者的半乳糖凝集素-9水平。在一些情况下,用于测量游离形式或在细胞表面表达的半乳糖凝集素-9水平的测定涉及使用特异性结合半乳糖凝集素-9(例如,特异性结合人半乳糖凝集素-9)的抗体。本领域已知的任何抗半乳糖凝集素-9抗体可以在上述任何测定中测试适用性,然后以常规方式用于此类测定中。在一些实施方案中,本文所述的抗体(例如,g9.2-17抗体)可用于诸如测定。在一些实施方案中,美国专利号10,344,091和wo2019/084553中描述的抗体、其各自的相关公开内容为
了本文中引用的目的和主题通过引用并入。在一些实例中,抗半乳糖凝集素-9抗体是fab分子。如本文所公开的用于确定半乳糖凝集素-9水平的测定方法也在本公开内容的范围内。
[0195]
可以通过合适的途径全身或局部地将有效量的本文所述的药物组合物施用至需要治疗的受试者(例如,人)。在一些实施方案中,抗半乳糖凝集素-9抗体通过静脉内施用,例如作为推注或通过一段时间内的连续输注、通过肌肉内、腹膜内、脑脊髓内、皮下、动脉内、关节内、滑膜内、鞘内、瘤内、口服、吸入或局部途径施用。在一个实施方案中,抗半乳糖凝集素-9抗体通过静脉输注施用至受试者。用于液体制剂的市售雾化器,包括喷射雾化器和超声雾化器可用于施用。液体制剂可直接雾化,冻干粉剂可复溶后雾化。或者,如本文所述的抗体可以使用碳氟化合物制剂和定量吸入器雾化,或作为冻干和研磨的粉末吸入。
[0196]
如本文所用,“有效量”是指单独或与一种或多种其他活性剂组合地赋予受试者治疗效果所需的每种活性剂的量。在一些实施方案中,治疗效果是在肿瘤微环境中降低的半乳糖凝集素-9活性和/或量/表达、降低的dectin-1信号传导、降低的tim-3信号传导、降低的cd206信号传导或增加的抗肿瘤免疫反应。增加的抗肿瘤反应的非限制性实例包括增加的效应t细胞的活化水平,或tam从m2表型转换为m1表型。在一些情况下,抗肿瘤反应包括增加的adcc反应。一定量的抗体是否达到治疗效果的确定对于本领域技术人员来说是明显的。如本领域技术人员所认识到的,有效量根据所治疗的特定病况、病况的严重程度、个体患者参数(包括年龄、身体状况、体型、性别和体重)、治疗的持续时间、同步治疗的性质(如果有的话)、具体的施用途径以及健康从业者知识和专业知识范围内的类似因素而变化。这些因素是本领域普通技术人员众所周知的,并且可以通过常规实验解决。通常优选使用个体组分或其组合的最大剂量,即根据合理的医学判断的最高安全剂量。
[0197]
经验考虑(例如半衰期)通常有助于确定剂量。例如,与人免疫系统相容的抗体(例如人源化抗体或全人抗体)在一些情况下用于延长抗体的半衰期和防止抗体受到宿主免疫系统的攻击。施用频率可以在治疗过程中确定和调整,并且通常但不一定基于目标疾病/病症的治疗和/或抑制和/或改善和/或延迟。或者,抗体的持续连续释放制剂可能是合适的。用于实现持续释放的各种制剂和装置是本领域已知的。
[0198]
在一个实例中,本文所述抗体的剂量在已经给予一次或多次抗体施用的个体中凭经验确定。向个体给予递增剂量的拮抗剂。为了评估拮抗剂的功效,可以遵循疾病/病症的指标。
[0199]
在一些情况下,本文公开的抗半乳糖凝集素-9抗体(例如,g9.2-17)可以以合适的剂量例如约1至约32mg/kg施用至受试者。实例包括1mg/kg至3mg/kg、3mg/kg至4mg/kg、4mg/kg至8mg/kg、8mg/kg至12mg/kg、12mg/kg至16mg/kg、16mg/kg至20mg/kg、20mg/kg至24mg/kg、24mg/kg至28mg/kg或28mg/kg至32mg/kg(例如1mg/kg、2mg/kg、3mg/kg、4mg/kg、5mg/kg、6mg/kg、7mg/kg、8mg/kg、9mg/kg、10mg/kg、11mg/kg、12mg/kg、13mg/kg、14mg/kg、15mg/kg、16mg/kg、17mg/kg、18mg/kg、19mg/kg、20mg/kg、21mg/kg、22mg/kg、23mg/kg、24mg/kg、25mg/kg、26mg/kg、27mg/kg、28mg/kg、29mg/kg、30mg/kg、31mg/kg或32mg/kg)或这些范围内的任何增量剂量。在一些实施方案中,半乳糖凝集素-9抗体以2mg/kg施用。在一些实施方案中,半乳糖凝集素-9抗体以4mg/kg施用。在一些实施方案中,半乳糖凝集素-9抗体以8mg/kg施用。在一些实施方案中,半乳糖凝集素-9抗体以12mg/kg施用。在一些实施方案中,半乳糖凝集素-9抗体以16mg/kg施用。在一些情况下,可以以合适的间隔或周期向受试者施用多剂量
的抗半乳糖凝集素-9抗体,例如每两至四周一次(例如每两、三或四周)。治疗可以持续合适的时期,例如长达3个月、长达6个月或长达12个月或长达24个月。
[0200]
在特定实施方案中,间隔或周期为2周。在一些实施方案中,方案为每2周一次持续一个周期、每2周一次用于两个周期、每2周一次持续三个周期、每2周一次持续四个周期、或每2周一次持续多于四个周期。在一些实施方案中,治疗为每2周一次持续1至3个月、每2周一次持续3至6个月、每2周一次持续6至12个月、或每2周一次持续12至24个月或更长时间。
[0201]
在特定实施方案中,间隔或周期为3周。在一些实施方案中,该方案为每三周一次持续一个周期、每三周一次用于两个周期、每三周一次持续三个周期、每三周一次持续四个周期、或每三周一次持续多于四个周期。在一些实施方案中,治疗为每3周一次持续1至3个月、每3周一次持续3至6个月、每3周一次持续6至12个月、或每3周一次持续12至24个月或更长时间。
[0202]
在特定实施方案中,间隔或周期为4周或更多周。在一些实施方案中,方案是每4周或更多周一次持续一个周期、每4周或更多周一次持续两个周期、每4周或更多周一次持续三个周期、每4周或更多周一次持续四个周期、或每4个或更多周一次持续多于四个周期。在一些实施方案中,治疗是每4周或更多周一次持续1至3个月、每4周或更多周一次持续3至6个月、每4周或更多周一次持续6至12个月、或每4周或更多周一次持续12至24个月或更长时间。在一些实施方案中,治疗是在不同时间的治疗的组合,例如2周、3周、4或多于4周的组合。在一些实施方案中,根据患者对治疗的反应来调整治疗间隔。在一些实施方案中,根据患者对治疗的反应调整剂量。在一些实施方案中,剂量在治疗间隔之间改变。在一些实施方案中,治疗可以暂时停止。
[0203]
在一些实例中,将抗半乳糖凝集素-9抗体以约3mg/kg的剂量通过静脉输注每两周一次施用至患有本文公开的目标实体瘤(例如,pda、crc、hcc或胆管癌)的人患者。在其他实例中,抗半乳糖凝集素-9抗体以约15mg/kg的剂量通过静脉输注每两周一次施用至患有目标实体瘤的人患者。
[0204]
术语“约”或“大约”是指在由本领域普通技术人员确定的特定值的可接受误差范围内,这部分取决于该值是如何测量或确定的,即测量系统的限制。例如,根据本领域的实践,“约”可以表示在可接受的标准偏差内。或者,“约”可以表示给定值的最多
±
20%,优选最多
±
10%,更优选最多
±
5%,更优选最多
±
1%的范围。或者,特别是对于生物系统或过程,该术语可表示在值的一个数量级内,优选在值的2倍内。在本技术和权利要求中描述特定值的情况下,除非另有说明,否则术语“约”是隐含的,并且在此上下文中表示在特定值可接受的误差范围内。
[0205]
在一些实施方案中,与治疗前或对照受试者中的水平相比,本公开内容的方法将抗肿瘤活性(例如,减少细胞增殖、肿瘤生长、肿瘤体积和/或肿瘤负担或负荷或减少转移性病灶的数量(随着时间的推移))增加至少约10%、20%、25%、30%、40%、50%、60%、70%、75%、80%、85%、90%、95%或更多。在一些实施方案中,通过比较受试者在施用药物组合物之前和之后的细胞增殖、肿瘤生长和/或肿瘤体积来测量减少。在一些实施方案中,治疗或改善受试者癌症的方法允许癌症的一种或多种症状改善至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或更多。在一些实施方案中,在施用药物组合物之前、期间和之后,在生物样品(例如血液、血清、血浆、尿液、腹膜液和/或来自组织或器官的活检)
中测量受试者的癌细胞和/或生物标志物。在一些实施方案中,该方法包括施用本发明的组合物以将受试者的肿瘤体积、大小、负担或负荷降低至不可检测的大小,或降低至治疗前受试者的肿瘤体积、大小、负担或负荷的小于约1%、2%、5%、10%、20%、25%、30%、40%、50%、60%、70%、75%、80%或90%。在其他实施方案中,该方法包括施用本发明的组合物以将受试者的细胞增殖率或肿瘤生长率降低至不可检测的速率,或降低至治疗前比率的小于约1%、2%、5%、10%、20%、25%、30%、40%、50%、60%、70%、75%、80%或90%。在其他实施方案中,该方法包括施用本发明的组合物以将受试者中转移性病灶的发展或转移性病灶的数量或大小降低至不可检测的比率,或降低至治疗前比率的小于约1%、2%、5%、10%、20%、25%、30%、40%、50%、60%、70%、75%、80%或90%。
[0206]
如本文所用,术语“治疗”是指将包含一种或多种活性剂的组合物应用或施用给患有目标疾病或病症、疾病/病症的症状或对疾病/病症的倾向的受试者,目的是治愈、愈合、缓解、缓和、改变、补救、减轻、改善或影响病症、疾病或病症的症状或对疾病或病症的倾向。
[0207]
减轻目标疾病/病症包括延迟疾病的发展或进展,或降低疾病严重程度或延长生存期。减轻疾病或延长生存期并不一定需要治愈结果。如本文所用,“延迟”目标疾病或病症的发展是指推迟、阻碍、减缓、延迟、稳定和/或延缓疾病的进展。这种延迟可以是不同的时间长度,这取决于疾病的历史和/或被治疗的个体。“延迟”或减轻疾病的发展或延迟疾病发作的方法是与不使用该方法相比,降低在给定时间范围内出现疾病的一种或多种症状的可能性和/或减轻在给定的时间范围内症状的程度的方法。此类比较通常基于临床研究,使用的受试者数量足以得出具有统计学意义的结果。
[0208]
疾病的“发展”或“进展”是指疾病的初始表现和/或随后的进展。可以使用本领域公知的标准临床技术检测和评估疾病的发展。然而,发展也指可能无法检测的进展。出于本公开内容的目的,发展或进展是指症状的生物学过程。“发展”包括发生、复发和发作。如本文所用,目标疾病或病症的“发作”或“发生”包括初始发作和/或复发。
[0209]
可以根据recist或更新的recist 1.1标准评估对治疗(例如本文所述的实体瘤的治疗)的反应,如下面的实施例1和eisenhower等人,new response evaluation criteria in solid tumours:revised recist guideline(version 1.1);european journal of cancer 45(2009)228
–
247(其内容通过引用整体并入本文)所述。
[0210]
在一些实施方案中,治疗可以改善总体反应(例如,在3、6或12个月,或更晚的时间),例如,与治疗开始前的基线水平相比或与未接受治疗的对照组相比。在一些实施方案中,治疗可导致完全反应、部分反应或稳定的疾病(例如,如在3个月、6个月或12个月,或在更晚的时间测量的)。这种反应可以是一段时间内的临时反应,或是永久反应。在一些实施方案中,例如与没有接受治疗的对照组相比,治疗可以提高完全反应、部分反应或稳定疾病的可能性(例如,如在3个月、6个月或12个月或在更晚的时间测量的)。这种反应可以是一段时间内的临时反应,或是永久反应。在一些实施方案中,例如与未接受治疗的对照组相比,治疗可导致减少或减弱的进展性疾病(例如,如在3个月、6个月或12个月或在更晚的时间测量的)。这种减弱可以是暂时的或永久的。
[0211]
部分反应是与治疗开始前的基线水平相比,响应治疗的肿瘤大小或体内癌症程度(即肿瘤负荷)的减小。例如,根据recist反应标准,部分反应被定义为目标病灶直径的总和减少至少30%,以基线总直径为参考。进展性疾病是一种正在增长、扩散或恶化的疾病。例
如,根据recist反应标准,进展性疾病包括其中观察到目标病灶直径总和至少增加20%并且总和还必须显示至少5mm的绝对增加的疾病。此外,一个或多个新病灶的出现也被认为是进展。与治疗开始前的基线水平相比,在程度或严重性上既没有减少也没有增加的肿瘤被认为是稳定的疾病。例如,根据recist反应标准,当既没有足够的收缩以满足部分反应的条件,也没有足够的增加以满足进展性疾病的条件时,出现稳定的疾病,以研究时的最小总直径作为参考。
[0212]
因此,在一些实施方案中,相对于治疗开始前的基线肿瘤大小,治疗可以永久地或在最短时间段内导致总体肿瘤大小减小、维持肿瘤大小(例如,如在3个月、6个月或12个月或在更晚的时间测量的)。在一些实施方案中,例如与未接受治疗的对照组相比,治疗可以永久地或在最短时间段内导致总体肿瘤大小减小或肿瘤大小维持的更大可能性(例如,如在3个月、6个月或12个月或在更晚的时间测量的)。肿瘤大小(例如肿瘤的直径)可以根据本领域已知的方法测量,包括结合各种软件工具从ct和mri图像进行测量,根据特定的测量方案,例如如上文参考的eisenhower等人所述的。因此,在一些实施方案中,在定期安排的再分期扫描(例如,具有对比的ct、具有对比的mri、pet-ct(诊断ct)和/或x射线)中测量肿瘤大小。在一些实施方案中,肿瘤大小减小、肿瘤大小的维持是指目标病灶的大小。在一些实施方案中,肿瘤大小减小、肿瘤大小的维持是指非目标病灶的大小。根据recist 1.1,当基线存在多于一个可测量的病灶时,代表所有受累器官的最多总共五个病灶(和每个器官最多两个病灶)的所有病灶都应被鉴定为目标病灶。包括病理淋巴结在内的所有其他病灶(或疾病部位)都应被鉴定为非目标病灶。
[0213]
在一些实施方案中,与治疗开始前的基线水平相比,治疗可导致肿瘤负荷的减少或肿瘤负荷的维持(例如,如在3个月、6个月或12个月或在更晚的时间测量的)。肿瘤负荷的减少可以是在一段时间内的暂时的或可以是永久性的。在一些实施方案中,治疗可以导致肿瘤负荷的减少或肿瘤负荷的维持的更大可能性,例如,与未接受治疗的对照组相比(例如,如在3个月、6个月或12个月或在更晚的时间测量的)。如本文所用,肿瘤负荷是指占疾病的所有部位的癌症的量、肿瘤的大小或体积(受试者体内)。可以使用本领域已知的方法(包括但不限于fdg正电子发射断层扫描(fdg-pet)、磁共振成像(mri)和光学成像,包括生物发光成像(bli)和荧光成像(fli))测量肿瘤负荷。
[0214]
在一些实施方案中,与未接受治疗的对照组相比,治疗可导致直到疾病进展的时间或无进展生存期的增加(例如,如在3个月、6个月或12个月或在更晚的时间测量的)。无进展生存可以是永久的或在一定时间段内的无进展生存。在一些实施方案中,与未接受治疗的对照组相比,治疗可导致无进展生存的更大可能性(永久无进展生存或在一定时间段内的无进展生存,例如,3、6或12个月,或例如,如在治疗开始后3个月、6个月或12个月或在更晚的时间测量的。无进展生存(pfs)定义为从临床试验中随机分配的时间例如从治疗开始到疾病进展或任何原因的死亡的时间。在一些实施方案中,治疗可导致更久的生存或更大的生存可能性(例如在某个时间,例如在6或12个月)。
[0215]
对治疗(例如本文所述的实体瘤的治疗)的反应可以根据irecist标准进行评估,如seymour等人,irecist:guidelines for response criteria for use in trials;the lancet,vol18,march 2017中所述,其内容通过引用整体并入本文。irecist被开发用于特别地在癌症免疫治疗试验中使用修改的recist1.1标准,以确保一致的设计和数据收集,并
可用作实体瘤测量的标准方法的指南,以及用于在使用免疫疗法的试验中使用的肿瘤大小客观变化的定义。irecist基于recist1.1。使用irecist分配的反应具有前缀“i”(即免疫),例如,“免疫”完全反应(icr)或部分反应(ipr),以及未确认的进展性疾病(iupd)或确认的进展性疾病(icpd)或稳定疾病(isd),以将它们与使用recist 1.1分配的反应区分开来,所有这些都在seymour等人中定义。
[0216]
因此,在一些实施方案中,与治疗开始前的疾病基线水平相比,治疗可导致“免疫”完全反应(icr)、部分反应(ipr)或稳定疾病(isd)(例如,如在3个月、6个月或12个月或在更晚的时间测量的)。“免疫”反应(例如icr、ipr或isd)的减少可以是一段时间内的暂时性或永久性的。在一些实施方案中,治疗可以提高完全反应(icr)、部分反应(ipr)或稳定疾病(isd)的可能性(例如,如在3个月、6个月或12个月或在更晚的时间测量的),例如,与未接受治疗的对照组相比。在一些实施方案中,治疗可导致未确认的进展性疾病(iupd)或确认的进展性疾病(icpd)的总体减少(例如,如在3个月、6个月或12个月或在更晚的时间测量的),例如,与治疗开始前的基线相比。iupd或icpd的减少可以是一段时间内的暂时性或永久性的。在一些实施方案中,治疗可导致未确认的进展性疾病(iupd)或确认的进展性疾病(icpd)的总体减少的更大可能性(例如,如在3个月、6个月或12个月或在更晚的时间测量的),例如,与未接受治疗的对照组相比。在一些实施方案中,与未接受治疗的对照组相比或与治疗开始前的基线相比,治疗可导致根据irecist标准的新病灶的总体数量减少(例如,如在3个月、6个月或12个月或在更晚的时间测量的)。病灶的减少可以是一段时间内的暂时性或永久性的。
[0217]
对治疗的反应也可以通过血液和肿瘤中的免疫表型、细胞因子谱(血清)、血液(血清或血浆)中的可溶性半乳糖凝集素-9水平、半乳糖凝集素-9肿瘤组织表达水平和通过免疫组织化学的表达模式(肿瘤、基质、免疫细胞)、肿瘤突变负荷(tmb)、pdl-1表达(例如,通过免疫组织化学)、错配修复状态或与疾病相关的肿瘤标志物中的一种或多种来表征(例如,如在3个月、6个月或12个月或在更晚的时间测量的)。此类肿瘤标志物的非限制性实例包括ca15-3、ca-125、cea、ca19-9、甲胎蛋白。这些参数可以与治疗开始前的基线水平进行比较,或可以与未接受治疗的对照组进行比较。
[0218]
在一些实施方案中,治疗可导致血液或肿瘤中免疫细胞和免疫细胞标志物水平的变化,例如,可导致免疫激活。可以使用本领域已知的方法(例如多重流式细胞术和多重免疫组织化学)在患者血液和组织样品中测量此类变化。例如,一组表型和功能性pbmc免疫标志物可以在治疗开始之前的基线和治疗期间的不同时间点进行评估。表a列出了对这些评估方法有用的标志物的非限制性实例。流式细胞术(fc)是一种分析细胞表型和功能的快速且信息量丰富的选择技术方法,并且在免疫表型监测中已获得突出地位。它允许表征复杂混合物(例如血液)中的许多细胞亚群,包括稀有亚群,并代表了一种获取大量数据的快速方法。fc的优点是高速度、灵敏度和特异性。标准化的抗体组和程序可用于分析和分类免疫细胞亚型。multiplex ihc是一种强大的调查工具,它提供客观的定量数据,描述免疫亚群数量和位置的肿瘤免疫环境,并允许在单个组织切片上评估多个标志物。计算机算法可用于从患者活检的整个幻灯片(slide)图像中量化基于ihc的生物标志物含量,将显色ihc方法和染色与数字病理学方法相结合。
[0219]
表a.pbmc分型标志物
[0220][0221]
因此,在一些实施方案中,治疗导致免疫激活标志物(例如表a中的那些)的调节,例如治疗导致以下中的一种或多种:(1)血浆或肿瘤组织中更多cd8细胞的增加、(2)血浆或肿瘤组织中的t调节细胞(treg)的减少、(3)血浆或肿瘤组织中m1巨噬细胞的增加和(4)血浆或肿瘤组织中mdsc的减少以及(5)血浆或肿瘤组织中m2巨噬细胞的减少(例如,如在3个月、6个月或12个月或在更晚的时间测量的)。在一些实施方案中,使用上述技术评估的或本领域已知的标志物选自cd4、cd8、cd14、cd11b/c和cd25。这些参数可以与治疗开始前的基线水平进行比较,或可以与未接受治疗的对照组进行比较。
[0222]
在一些实施方案中,如本文所述的治疗导致促炎和抗炎细胞因子的变化。在一些实施方案中,如本文所述的治疗导致以下中的一种或多种:(1)血浆或肿瘤组织中ifnγ水平的增加;(2)血浆或肿瘤组织中tnfα水平的升高;(3)血浆或肿瘤组织中il-10水平的降低(例如,如在3个月、6个月或12个月或在更晚的时间测量的)。这些参数可以与治疗开始前的基线水平进行比较,或可以与未接受治疗的对照组进行比较。
[0223]
在一些实施方案中,可以在剂量前1肿瘤活检和在可行时间进行的重复活检之间
评估细胞因子或免疫细胞的变化。在一些实施方案中,可在两次重复活检之间评估细胞因子或免疫细胞的变化。在一些实施方案中,治疗导致血液(血清或血浆)中的可溶性半乳糖凝集素-9水平或半乳糖凝集素-9肿瘤组织表达水平和表达模式(通过免疫组织化学)(肿瘤、基质、免疫细胞)中的一种或多种的改变(例如,如在3个月、6个月或12个月或在更晚的时间测量的)。在一些实施方案中,治疗导致血液(血清或血浆)中的可溶性半乳糖凝集素-9水平或半乳糖凝集素-9肿瘤组织表达水平和表达模式(通过免疫组织化学)(肿瘤、基质、免疫细胞)中的一种或多种的降低(例如,如在3个月、6个月或12个月或在更晚的时间测量的)。这些半乳糖凝集素-9水平可以与治疗开始前的基线水平进行比较,或可以与未接受治疗的对照组进行比较。
[0224]
在一些实施方案中,治疗导致pdl-1表达的改变,例如,如通过免疫组织化学评估的。在一些实施方案中,治疗导致与疾病相关的一种或多种肿瘤标志物的变化(增加或减少)(例如,如在3个月、6个月或12个月或在更晚的时间测量的)。此类肿瘤标志物的非限制性实例包括ca15-3、ca-125、cea、ca19-9、甲胎蛋白。这些参数可以与治疗开始前的基线水平进行比较,或可以与未接受治疗的对照组进行比较。
[0225]
在一些实施方案中,与治疗开始前的基线相比或与未接受治疗的对照组相比,治疗导致改善的生活质量和症状控制(例如,如在3个月、6个月或12个月或在更晚的时间测量的)。在一些实施方案中,可以在本文实施例1中描述的ecog量表上测量改善。
[0226]
在任何上述实施方案中,治疗可包括单独或与检查点抑制剂疗法例如抗pd-1抗体组合地施用本文所述的抗半乳糖凝集素-9抗体。在一些实施方案中,本公开内容提供用于治疗受试者(包括人受试者)的实体瘤的方法,包括向受试者施用治疗有效量的本文公开的抗半乳糖凝集素-9抗体。在一些实施方案中,抗体包含seq id no:1所示的轻链互补决定区1(cdr1)、seq id no:2所示的轻链互补决定区2(cdr2)和seq id no:3所示的轻链互补决定区3(cdr3)和/或包含seq id no:4所示的重链互补决定区1(cdr1)、seq id no:5所示的重链互补决定区2(cdr2)和seq id no:6所示的重链互补决定区3(cdr3)。在一些实施方案中,该抗体含有包含seq id no:7的重链可变区。在一些实施方案中,抗体含有包含seq id no:8的轻链可变区。在一些实施方案中,抗体含有包含seq id no:19的重链。在一些实施方案中,抗体含有包含seq id no:15的轻链。在一些实施方案中在一些实施方案中,抗体是g9.2-17 igg4。在一些实施方案中,抗半乳糖凝集素-9抗体以约1mg/kg至约32mg/kg的剂量施用至受试者,例如,该剂量可选自2mg/kg、4mg/kg、8mg/kg、12mg/kg和16mg/kg。在一些实施方案中,抗体每两周施用一次,例如通过静脉输注。在一些实施方案中,该方法进一步包括向受试者施用免疫检查点抑制剂,例如抗pd1抗体。在一些实施方案中,实体瘤选自胰腺癌(pda)、结直肠癌(crc)、肝细胞癌(hcc)或胆管癌(cca),并且在一些实施方案中,实体瘤是转移性肿瘤。
[0227]
在一些实施方案中,本公开内容提供用于改善受试者包括人受试者中的总体反应(例如根据recist 1.1.标准)的方法(例如,如在3个月、6个月或12个月或在更晚的时间测量的),包括向受试者施用治疗有效量的本文公开的抗半乳糖凝集素-9抗体。recist 1.1.标准可以与治疗开始前的基线水平进行比较,或可以与未接受治疗的对照组进行比较。在一些实施方案中,本公开内容提供用于实现完全反应、部分反应或稳定疾病(例如,如在3个月、6个月或12个月或在更晚的时间测量的)的方法,该方法包括向受试者施用治疗有效量
的本文公开的抗半乳糖凝集素-9抗体。这些反应可以在一定时间段内是暂时的,或可以是永久性的,并且可以与治疗开始前的基线水平进行比较,或可以与未接受治疗的对照组进行比较。
[0228]
在一些实施方案中,方法可以提高完全反应、部分反应或稳定疾病的可能性(例如,如在3个月、6个月或12个月或在更晚的时间测量的;并且是暂时的或永久性的),例如,与未接受治疗的对照组相比。在一些实施方案中,本公开内容提供用于减弱疾病进展或减少进展性疾病(例如,如在3个月、6个月或12个月或在更晚的时间测量的)的方法,例如,与未接受治疗的对照组相比或与治疗开始前的基线相比,方法包括向受试者施用治疗有效量的本文公开的抗半乳糖凝集素-9抗体。减弱或减少可以在一定时间段内是暂时的或永久的。在一些实施方案中,抗体包含seq id no:1所示的轻链互补决定区1(cdr1)、seq id no:2所示的轻链互补决定区2(cdr2)和seq id no:3所示的轻链互补决定区3(cdr3)和/或包含seq id no:4所示的重链互补决定区1(cdr1)、seq id no:5所示的重链互补决定区2(cdr2)和seq id no:6所示的重链互补决定区3(cdr3)。在一些实施方案中,该抗体含有包含seq id no:7的重链可变区。在一些实施方案中,抗体含有包含seq id no:8的轻链可变区。在一些实施方案中,抗体含有包含seq id no:19的重链。在一些实施方案中,抗体含有包含seq id no:15的轻链。在一些实施方案中,抗体是g9.2-17igg4。在一些实施方案中,抗半乳糖凝集素-9抗体以约1mg/kg至约32mg/kg的剂量施用至受试者,例如,该剂量可选自2mg/kg、4mg/kg、8mg/kg、12mg/kg和16mg/kg。在一些实施方案中,抗体每两周施用一次,例如通过静脉输注。在一些实施方案中,该方法进一步包括向受试者施用免疫检查点抑制剂,例如抗pd1抗体。在一些实施方案中,实体瘤选自胰腺癌(pda)、结直肠癌(crc)、肝细胞癌(hcc)或胆管癌(cca),并且在一些实施方案中,实体瘤是转移性肿瘤。
[0229]
在一些实施方案中,本公开内容提供了相对于开始治疗前受试者中的基线肿瘤大小,永久地或在最短时间段内减小或维持受试者(包括人受试者)中的肿瘤大小(例如,如在3个月、6个月或12个月或在更晚的时间测量的)的方法,该方法包括向受试者施用治疗有效量的本文公开的抗半乳糖凝集素-9抗体。在一些实施方案中,本公开内容提供了例如与未接受治疗的对照组相比,永久地或在最短时间段内提高减小或维持受试者(包括人受试者)中的肿瘤大小的可能性(例如,如在3个月、6个月或12个月或在更晚的时间测量的)的方法。在一些实施方案中,本公开内容提供了与治疗开始前的基线水平相比或与未接受治疗的对照组相比,降低或维持受试者(包括人受试者)中的肿瘤负荷(例如,如在3个月、6个月或12个月或在更晚的时间测量的)的方法,该方法包括向受试者施用治疗有效量的本文公开的抗半乳糖凝集素-9抗体。在一些实施方案中,本公开内容提供了例如与未接受治疗的对照组相比,增加降低或维持肿瘤负荷的可能性(例如,如在3个月、6个月或12个月或在更晚的时间测量的)的方法,所述方法包括向受试者施用治疗有效量的本文公开的抗半乳糖凝集素-9抗体。因此,在一些实施方案中,肿瘤大小和/或负荷在定期安排的再分期扫描(例如,具有对比的ct、具有对比的mri、pet-ct(诊断ct)和/或x射线)中测量。在一些实施方案中,抗体包含seq id no:1所示的轻链互补决定区1(cdr1)、seq id no:2所示的轻链互补决定区2(cdr2)和seq id no:3所示的轻链互补决定区3(cdr3)和/或包含seq id no:4所示的重链互补决定区1(cdr1)、seq id no:5所示的重链互补决定区2(cdr2)和seq id no:6所示的重链互补决定区3(cdr3)。在一些实施方案中,该抗体含有包含seq id no:7的重链可变区。
在一些实施方案中,抗体含有包含seq id no:8的轻链可变区。在一些实施方案中,抗体含有包含seq id no:19的重链。在一些实施方案中,抗体含有包含seq id no:15的轻链。在一些实施方案中,抗体是g9.2-17 igg4。在一些实施方案中,抗半乳糖凝集素-9抗体以约1mg/kg至约32mg/kg的剂量施用至受试者,例如,该剂量可选自2mg/kg、4mg/kg、8mg/kg、12mg/kg和16mg/kg。在一些实施方案中,抗体每两周施用一次,例如通过静脉输注。在一些实施方案中,该方法进一步包括向受试者施用免疫检查点抑制剂,例如抗pd1抗体。在一些实施方案中,实体瘤选自胰腺癌(pda)、结直肠癌(crc)、肝细胞癌(hcc)或胆管癌(cca),并且在一些实施方案中,实体瘤是转移性肿瘤。
[0230]
在一些实施方案中,本公开内容提供了与未接受治疗的对照组相比,在受试者包括人受试者中增加直到疾病进展的时间或增加无进展生存时间(例如,如在3个月、6个月或12个月或在更晚的时间测量的)的方法,方法包括向受试者施用治疗有效量的本文公开的抗半乳糖凝集素-9抗体。该方法可导致永久的无进展生存或在一定时间内的无进展生存。在一些实施方案中,本公开内容提供了与未接受治疗的对照组相比,增加无进展生存(永久的无进展生存或在一定时间内的无进展生存)的可能性(例如,如在3个月、6个月或12个月或在更晚的时间测量的)的方法。在一些实施方案中,抗体包含seq id no:1所示的轻链互补决定区1(cdrl)、seq id no:2所示的轻链互补决定区2(cdr2)和seq id no:3所示的轻链互补决定区3(cdr3)和/或包含seq id no:4所示的重链互补决定区1(cdr1)、seq id no:5所示的重链互补决定区2(cdr2)和seq id no:6所示的重链互补决定区3(cdr3)。在一些实施方案中,抗体含有包含seq id no:7的重链可变区。在一些实施方案中,抗体含有包含seq id no:8的轻链可变区。在一些实施方案中,抗体含有包含seq id no:19的重链。在一些实施方案中,抗体包括含有seq id no:15的轻链。在一些实施方案中,抗体是g9.2-17 igg4。在一些实施方案中,抗半乳糖凝集素-9抗体以约1mg/kg至约32mg/kg的剂量施用至受试者,例如,该剂量可选自2mg/kg、4mg/kg、8mg/kg、12mg/kg和16mg/kg。在一些实施方案中,抗体每两周施用一次,例如通过静脉输注。在一些实施方案中,该方法进一步包括向受试者施用免疫检查点抑制剂,例如抗pd1抗体。在一些实施方案中,实体瘤选自胰腺癌(pda)、结直肠癌(crc)、肝细胞癌(hcc)或胆管癌(cca),并且在一些实施方案中,实体瘤是转移性肿瘤。
[0231]
在一些实施方案中,本公开内容提供了用于改善受试者包括人受试者中的总体反应(ior)(例如根据irecist标准)(例如,如在3个月、6个月或12个月或在更晚的时间测量的)的方法,包括向受试者施用治疗有效量的本文公开的抗半乳糖凝集素-9抗体。在一些实施方案中,本公开内容提供用于实现“免疫”完全反应(icr)、部分反应(ipr)或稳定疾病(isd)(例如,如在3个月、6个月或12个月或在更晚的时间测量的)的方法,该方法包括向受试者施用治疗有效量的本文公开的抗半乳糖凝集素-9抗体。在一些实施方案中,该方法可以提高“免疫”完全反应(icr)、部分反应(ipr)或稳定疾病(isd)的可能性(例如,如在3个月、6个月或12个月或在更晚的时间测量的)。在一些实施方案中,本公开内容提供了用于减缓疾病进展或减少进展性疾病例如减少未确认的进展性疾病(iupd)或减少确认的进展性疾病(icpd)(例如,如在3个月、6个月或12个月或在更晚的时间测量的)的方法,该方法包括向受试者施用治疗有效量的本文公开的抗半乳糖凝集素-9抗体。上述那些irecist标准中的任何一个都可以与治疗开始前的基线水平进行比较,或可以与未接受治疗的对照组进行比较,并且反应可以在一定时间段内是暂时的或永久的。在一些实施方案中,本公开内容提
供了用于在受试者包括人受试者中增加未确认的进展性疾病(iupd)或确认的进展性疾病(icpd)的总体减少的可能性(例如,如在3个月、6个月或12个月或在更晚的时间测量的)的方法,例如与未接受治疗的对照组相比,所述方法包括向受试者施用治疗有效量的如本文公开的抗半乳糖凝集素-9抗体。在一些实施方案中,本公开内容提供用于根据irecist标准减少受试者(包括人受试者)中新病灶数量(例如,如在3个月、6个月或12个月或在更晚的时间测量的)的方法,所述方法包括向受试者施用治疗有效量的本文公开的抗半乳糖凝集素-9抗体。病灶数量的减少可以是相对于治疗开始前的基线水平,或可以是相对于未接受治疗的对照组,并且减少可以是在一定时间段内的暂时的,或可以是永久性的。在一些实施方案中,抗体包含seq id no:1所示的轻链互补决定区1(cdr1)、seq id no:2所示的轻链互补决定区2(cdr2)和seq id no:3所示的轻链互补决定区3(cdr3)和/或包含seq id no:4所示的重链互补决定区1(cdr1)、seq id no:5所示的重链互补决定区2(cdr2)和seq id no:6所示的重链互补决定区3(cdr3)。在一些实施方案中,该抗体含有包含seq id no:7的重链可变区。在一些实施方案中,抗体含有包含seq id no:8的轻链可变区。在一些实施方案中,抗体含有包含seq id no:19的重链。在一些实施方案中,抗体含有包含seq id no:15的轻链。在一些实施方案中,抗体是g9.2-17 igg4。在一些实施方案中,抗半乳糖凝集素-9抗体以约1mg/kg至约32mg/kg的剂量施用至受试者,例如,该剂量可选自2mg/kg、4mg/kg、8mg/kg、12mg/kg和16mg/kg。在一些实施方案中,抗体每两周施用一次,例如通过静脉输注。在一些实施方案中,该方法进一步包括向受试者施用免疫检查点抑制剂,例如抗pd1抗体。在一些实施方案中,实体瘤选自胰腺癌(pda)、结直肠癌(crc)、肝细胞癌(hcc)或胆管癌(cca),并且在一些实施方案中,实体瘤是转移性肿瘤。
[0232]
在一些实施方案中,本公开内容提供调节受试者的免疫反应的方法。如本文所用,术语“免疫反应”包括受免疫细胞活性调节例如t细胞活化影响的t细胞介导的和/或b细胞介导的免疫反应。在本公开内容的一个实施方案中,免疫反应是t细胞介导的。如本文所用,术语“调节”意味着改变或变化,并且包括上调和下调。例如,“调节免疫反应”是指改变或变化一种或多种免疫反应参数的状态。t细胞介导的免疫反应的示例性参数包括t细胞的水平(例如,效应t细胞的增加或减少)和t细胞活化的水平(例如,某些细胞因子产生的增加或减少)。b细胞介导的免疫反应的示例性参数包括b细胞水平的增加、b细胞活化和b细胞介导的抗体产生。
[0233]
当免疫反应受到调节时,一些免疫反应参数可能会降低,而另一些可能会增加。例如,在一些情况下,调节免疫反应导致一种或多种免疫反应参数的增加(或上调)和一种或多种其他免疫反应参数的减少(或下调),结果是免疫反应的总体增加,例如炎症免疫反应的总体增加。在另一个实例中,调节免疫反应导致一种或多种免疫反应参数的增加(或上调)和一种或多种其他免疫反应参数的减少(或下调),结果是免疫反应的总体降低,例如炎症反应的总体降低。在一些实施方案中,总体免疫反应的增加即总体炎性免疫反应的增加由肿瘤重量、肿瘤大小或肿瘤负荷的减少或本文所述的任何recist或irecist标准确定。在一些实施方案中,总体免疫反应的增加由一种或多种促炎细胞因子(例如包括两种或更多种、三种或更多种等或大多数促炎细胞因子)的增加的水平(一种或多种、两种或更多种等或大多数抗炎和/或免疫抑制细胞因子和/或一种或多种最强效的抗炎或免疫抑制细胞因子减少或保持不变)确定。在一些实施方案中,总体免疫反应的增加由一种或多种最强效的
促炎细胞因子的增加的水平(一种或多种抗炎和/或免疫抑制细胞因子包括一种或多种最强效的细胞因子减少或保持不变)确定。在一些实施方案中,总体免疫反应的增加由一种或多种包括大多数免疫抑制和/或抗炎细胞因子的降低的水平(一种或多种或大多数促炎细胞因子包括例如最强效的促炎细胞因子的水平增加或保持不变)确定。在一些实施方案中,总体免疫反应的增加由一种或多种最强效的抗炎和/或免疫抑制细胞因子的增加的水平(一种或多种或大多数促炎细胞因子包括例如最强效的促炎细胞因子增加或保持不变)确定。在一些实施方案中,总体免疫反应的增加由上述任一项的组合确定。此外,一种类型免疫反应参数的增加(或上调)可导致另一种类型免疫反应参数的相应减少(或下调)。例如,某些促炎细胞因子的产生的增加可导致某些抗炎和/或免疫抑制细胞因子的下调,反之亦然。
[0234]
在一些实施方案中,本公开内容提供了用于调节受试者包括人受试者的免疫反应(例如,如在3个月、6个月或12个月或在更晚的时间测量的)的方法,包括向受试者施用治疗性的有效量的本文公开的抗半乳糖凝集素-9抗体。在一些实施方案中,本公开内容提供了用于调节受试者(包括人受试者)的血液或肿瘤中免疫细胞和免疫细胞标志物(包括但不限于本文表a中描述的那些)的水平(例如,与治疗开始前的基线水平相比或与未接受治疗的对照组相比)的方法,包括向受试者施用治疗有效量的本文公开的抗半乳糖凝集素-9抗体。在一些实施方案中,调节的总体结果是促炎免疫细胞的上调和/或免疫抑制性免疫细胞的下调。在一些实施方案中,本公开内容提供了用于调节免疫细胞水平的方法,其中所述调节包括以下中的一种或多种:(1)增加血浆或肿瘤组织中的cd8细胞,(2)减少血浆或肿瘤组织中的treg,(3)增加血浆或肿瘤组织中的m1巨噬细胞和(4)减少血浆或肿瘤组织中的mdsc,和(5)减少血浆或肿瘤组织中的m2巨噬细胞,并且其中所述方法包括向受试者施用治疗有效量的如本文所公开的抗半乳糖凝集素-9抗体。在一些实施方案中,评估此类免疫细胞的水平的标志物包括但不限于cd4、cd8、cd14、cd11b/c和cd25。在一些实施方案中,本公开内容提供了例如与开始前的基线水平相比治疗,或与未接受治疗的对照组相比,调节受试者包括人受试者的血液或肿瘤中的促炎和免疫抑制细胞因子水平(例如,如在3个月、6个月或12个月或在更晚的时间测量的)的方法,包括向受试者施用治疗有效量的如本文公开的抗半乳糖凝集素-9抗体。在一些实施方案中,调节的总体结果是促炎细胞因子的上调和/或免疫抑制性细胞因子的下调。在一些实施方案中,本公开内容提供用于调节细胞因子细胞的水平的方法,其中所述调节包括以下中的一种或多种:(1)增加血浆或肿瘤组织中的ifnγ水平;(2)增加血浆或肿瘤组织中tnfα水平;(3)降低血浆或肿瘤组织中il-10的水平。在一些实施方案中,抗体包含seq id no:1所示的轻链互补决定区1(cdr1)、seq id no:2所示的轻链互补决定区2(cdr2)和seq id no:3所示的轻链互补决定区3(cdr3)和/或包含seq id no:4所示的重链互补决定区1(cdr1)、seq id no:5所示的重链互补决定区2(cdr2)和seq id no:6所示的重链互补决定区3(cdr3)。在一些实施方案中,抗体含有包含seq id no:7的重链可变区。在一些实施方案中,抗体含有包含seq id no:8的轻链可变区。在一些实施方案中,抗体含有包含seq id no:19的重链。在一些实施方案中,抗体含有包含seq id no:15的轻链。在一些实施方案中,抗体是g9.2-17 igg4。在一些实施方案中,抗半乳糖凝集素-9抗体以约1mg/kg至约32mg/kg的剂量施用至受试者,例如,剂量可选自2mg/kg、4mg/kg、8mg/kg、12mg/kg和16mg/kg。在一些实施方案中,抗体每两周施用一次,例如通过静脉输注。在一
些实施方案中,方法进一步包括向受试者施用免疫检查点抑制剂,例如抗pd1抗体。在一些实施方案中,实体瘤选自胰腺癌(pda)、结直肠癌(crc)、肝细胞癌(hcc)或胆管癌(cca),并且在一些实施方案中,实体瘤是转移性肿瘤。
[0235]
在一些实施方案中,本公开内容提供了改变血液(血清或血浆)中可溶性半乳糖凝集素-9水平或半乳糖凝集素-9肿瘤组织表达水平和表达模式(通过免疫组织化学)(肿瘤、基质、免疫细胞)中的一种或多种(例如,如在第2周、第4周、第1个月、第3个月、第6个月或第12个月或在更晚的时间测量的)的方法,包括向受试者施用治疗有效量的本文公开的抗半乳糖凝集素-9抗体。在所述方法的一些实施方案中,血液(血清或血浆)中可溶性半乳糖凝集素-9水平或半乳糖凝集素-9肿瘤组织表达水平和表达模式(通过免疫组织化学)(肿瘤、基质、免疫细胞)中的一种或多种保持不变。在一些实施方案中,本文提供的方法降低血液(血清或血浆)中可溶性半乳糖凝集素-9水平或半乳糖凝集素-9肿瘤组织表达水平和表达模式(通过免疫组织化学)(肿瘤、基质、免疫细胞)中的一种或多种(例如,如在第2周、第4周、第1个月、第3个月、第6个月或第12个月或在更晚的时间测量的)。半乳糖凝集素-9水平可以与治疗开始前的基线水平进行比较,或可以与未接受治疗的对照组进行比较。在一些实施方案中,治疗导致pdl-1表达的改变,例如通过免疫组织化学。在一些实施方案中,抗体包含seq id no:1所示的轻链互补决定区1(cdr1)、seq id no:2所示的轻链互补决定区2(cdr2)和seq id no:3所示的轻链互补决定区3(cdr3)和/或包含seq id no:4所示的重链互补决定区1(cdr1)、seq id no:5所示的重链互补决定区2(cdr2)和seq id no:6所示的重链互补决定区3(cdr3)。在一些实施方案中,该抗体含有包含seq id no:7的重链可变区。在一些实施方案中,抗体含有包含seq id no:8的轻链可变区。在一些实施方案中,抗体含有包含seq id no:19的重链。在一些实施方案中,抗体含有包含seq id no:15的轻链。在一些实施方案中在一些实施方案中,抗体是g9.2-17 igg4。在一些实施方案中,抗半乳糖凝集素-9抗体以约1mg/kg至约32mg/kg的剂量施用至受试者,例如,剂量可选自2mg/kg、4mg/kg、8mg/kg、12mg/kg和16mg/kg。在一些实施方案中,抗体每两周施用一次,例如通过静脉输注。在一些实施方案中,该方法进一步包括向受试者施用免疫检查点抑制剂,例如抗pd1抗体。在一些实施方案中,实体瘤选自胰腺癌(pda)、结直肠癌(crc)、肝细胞癌(hcc)或胆管癌(cca),并且在一些实施方案中,实体瘤是转移性肿瘤。
[0236]
在一些实施方案中,本公开内容提供用于改变pdl-1表达的方法,例如,如通过免疫组织化学评估的(例如,如在第2周、第4周、第1个月、第3个月、第6个月或第12个月或在更晚的时间测量的),包括向受试者施用治疗有效量的本文公开的抗半乳糖凝集素-9抗体。在该方法的一些实施方案中,pdl-1表达(例如,如通过免疫组织化学评估的)保持不变。pd-l1水平可以与治疗开始前的基线水平进行比较,或可以与未接受治疗的对照组进行比较。在一些实施方案中,本文提供的方法降低pdl-1表达,例如如通过免疫组织化学评估的。在一些实施方案中,抗体包含seq id no:1所示的轻链互补决定区1(cdr1)、seq id no:2所示的轻链互补决定区2(cdr2)和seq id no:3所示的轻链互补决定区3(cdr3)和/或包含seq id no:4所示的重链互补决定区1(cdr1)、seq id no:5所示的重链互补决定区2(cdr2)和seq id no:6所示的重链互补决定区3(cdr3)。在一些实施方案中,该抗体含有包含seq id no:7的重链可变区。在一些实施方案中,抗体含有包含seq id no:8的轻链可变区。在一些实施方案中,抗体含有包含seq id no:19的重链。在一些实施方案中,抗体含有包含seq id no:
15的轻链。在一些实施方案中在一些实施方案中,抗体是g9.2-17 igg4。在一些实施方案中,抗半乳糖凝集素-9抗体以约1mg/kg至约32mg/kg的剂量施用至受试者,例如,剂量可选自2mg/kg、4mg/kg、8mg/kg、12mg/kg和16mg/kg。在一些实施方案中,抗体每两周施用一次,例如通过静脉输注。在一些实施方案中,该方法进一步包括向受试者施用免疫检查点抑制剂,例如抗pd1抗体。在一些实施方案中,实体瘤选自胰腺癌(pda)、结直肠癌(crc)、肝细胞癌(hcc)或胆管癌(cca),并且在一些实施方案中,实体瘤是转移性肿瘤。
[0237]
在一些实施方案中,本公开内容提供用于改变与疾病相关的一种或多种肿瘤标志物(增加或减少)的方法(例如,如在第2周、第4周、1个月、3个月、6个月或12个月或在更晚的时间测量的),包括向受试者施用治疗有效量的本文公开的抗半乳糖凝集素-9抗体。在该方法的一些实施方案中,与疾病相关的一种或多种肿瘤标志物(增加或减少)保持不变。此类肿瘤标志物的非限制性实例包括ca15-3、ca-125、cea、ca19-9、甲胎蛋白。肿瘤标志物的水平可以与治疗开始前的基线水平进行比较,或可以与未接受治疗的对照组进行比较。在一些实施方案中,本文提供的方法减少与疾病相关的一种或多种肿瘤标志物的发生。在一些实施方案中,抗体包含seq id no:1所示的轻链互补决定区1(cdr1)、seq id no:2所示的轻链互补决定区2(cdr2)和seq id no:3所示的轻链互补决定区3(cdr3)和/或包含seq id no:4所示的重链互补决定区1(cdr1)、seq id no:5所示的重链互补决定区2(cdr2)和seq id no:6所示的重链互补决定区3(cdr3)。在一些实施方案中,该抗体含有包含seq id no:7的重链可变区。在一些实施方案中,抗体含有包含seq id no:8的轻链可变区。在一些实施方案中,抗体含有包含seq id no:19的重链。在一些实施方案中,抗体含有包含seq id no:15的轻链。在一些实施方案中在一些实施方案中,抗体是g9.2-17 igg4。在一些实施方案中,抗半乳糖凝集素-9抗体以约1mg/kg至约32mg/kg的剂量施用至受试者,例如,该剂量可选自2mg/kg、4mg/kg、8mg/kg、12mg/kg和16mg/kg。在一些实施方案中,抗体每两周施用一次,例如通过静脉输注。在一些实施方案中,该方法进一步包括向受试者施用免疫检查点抑制剂,例如抗pd1抗体。在一些实施方案中,实体瘤选自胰腺癌(pda)、结直肠癌(crc)、肝细胞癌(hcc)或胆管癌(cca),并且在一些实施方案中,实体瘤是转移性肿瘤。
[0238]
在一些实施方案中,本公开内容提供了用于在受试者包括人受试者中改善生活质量和/或改善症状控制(例如,如在1个月、3个月、6个月或12个月或在更晚的时间测量的)的方法,包括向受试者施用治疗有效量的本文公开的抗半乳糖凝集素-9抗体。与开始治疗前的基线相比或与未接受治疗的对照组相比,生活质量和症状控制得到改善。生活质量的改善可以在一定时期内是暂时的,或可以是永久性的。在一些实施方案中,可以在ecog量表上测量改善。在一些实施方案中,抗体包含seq id no:1所示的轻链互补决定区1(cdr1)、seq id no:2所示的轻链互补决定区2(cdr2)和seq id no:3所示的轻链互补决定区3(cdr3)和/或包含seq id no:4所示的重链互补决定区1(cdr1)、seq id no:5所示的重链互补决定区2(cdr2)和seq id no:6所示的重链互补决定区3(cdr3)。在一些实施方案中,该抗体含有包含seq id no:7的重链可变区。在一些实施方案中,抗体含有包含seq id no:8的轻链可变区。在一些实施方案中,抗体含有包含seq id no:19的重链。在一些实施方案中,抗体含有包含seq id no:15的轻链。在一些实施方案中在一些实施方案中,抗体是g9.2-17 igg4。在一些实施方案中,抗半乳糖凝集素-9抗体以约1mg/kg至约32mg/kg的剂量施用至受试者,例如,剂量可选自2mg/kg、4mg/kg、8mg/kg、12mg/kg和16mg/kg。在一些实施方案中,抗体每两
周施用一次,例如通过静脉输注。在一些实施方案中,该方法进一步包括向受试者施用免疫检查点抑制剂,例如抗pd1抗体。在一些实施方案中,实体瘤选自胰腺癌(pda)、结直肠癌(crc)、肝细胞癌(hcc)或胆管癌(cca),并且在一些实施方案中,实体瘤是转移性肿瘤。
[0239]
在一些实施方案中,将本文所述的抗体例如g9.2-17以足以使半乳糖凝集素-9(和/或dectin-1或tim-3或cd206)在肿瘤中的免疫抑制性免疫细胞中的活性抑制至少20%(例如,30%、40%、50%、60%、70%、80%、90%或更高)(在体内)的量施用至需要治疗的受试者。在其他实施方案中,以使半乳糖凝集素-9(和/或dectin-1或tim-3或cd206)在肿瘤中的免疫抑制性免疫细胞中的活性水平降低至少20%(例如,30%、40%、50%、60%、70%、80%、90%或更高)(与治疗前或对照受试者中的水平相比)的有效量施用本文所述的抗体例如g9.2-17。在一些实施方案中,将本文所述的抗体例如g9.2-17以足以使tam中的m1样编程促进至少20%(例如,30%、40%、50%、60%、70%、80%、90%或更高)(在体内)(与治疗前或对照受试者中的水平相比)的量施用至需要治疗的受试者。
[0240]
根据待治疗的疾病类型或疾病部位,可以使用医学领域普通技术人员已知的常规方法向受试者施用药物组合物。在一些实施方案中,抗半乳糖凝集素-9抗体可通过静脉输注施用至受试者。
[0241]
可注射组合物可包含各种载体,例如植物油、二甲基乳酰胺(dimethylactamide)、二甲基甲酰胺、乳酸乙酯、碳酸乙酯、肉豆蔻酸异丙酯、乙醇和多元醇(甘油、丙二醇、液体聚乙二醇等)。对于静脉注射,水溶性抗体可以通过滴注法施用,由此注入含有抗体和生理学上可接受的赋形剂的药物制剂。生理上可接受的赋形剂可以包括例如5%葡萄糖、0.9%盐水、林格氏溶液或其他合适的赋形剂。抗体的肌内制剂,例如合适的可溶性盐形式的无菌制剂,可以溶解并施用在药物赋形剂(例如注射用水、0.9%盐水或5%葡萄糖溶液)中。
[0242]
在一些实施方案中,本文描述的抗半乳糖凝集素-9抗体用作治疗本文公开的目标癌症的单一疗法,即,在使用抗半乳糖凝集素-9抗体的疗法同时没有其他抗癌疗法。
[0243]
在其他实施方案中,治疗方法进一步包括向受试者施用检查点分子例如pd-1的抑制剂。pd-1抑制剂的实例包括抗pd-1抗体,例如派姆单抗、纳武单抗、替雷利珠单抗和西米普利单抗。此类检查点抑制剂可以与根据本公开内容的抗半乳糖凝集素-9抗体同时或依次(以任何顺序)施用。在一些实施方案中,检查点分子是pd-l1。pd-l1抑制剂的实例包括抗pd-l1抗体,例如德瓦鲁单抗、阿维鲁单抗和阿替利珠单抗。在一些实施方案中,检查点分子是ctla-4。ctla-4抑制剂的一个实例是抗ctla-4抗体易普利姆玛。在一些实施方案中,抑制剂靶向选自cd40、gitr、lag-3、ox40、tigit和tim-3的检查点分子。
[0244]
在一些实施方案中,相对于单独包含检查点分子抑制剂(例如抗pd1,例如nivilumab)的方案,抗半乳糖凝集素-9抗体改善总体反应,例如在3个月时。
[0245]
在一些实施方案中,抗pd-1抗体是pd-1是纳武单抗,并且本文描述的方法包括以每两周一次的静脉内240mg的剂量向受试者施用纳武单抗。
[0246]
在一些实施方案中,结合pd-1的抗体使用固定剂量施用。在一些实施方案中,结合pd-1的抗体是纳武单抗,其以每4周一次的480mg的剂量施用至受试者。在一些实施方案中,结合pd-1的抗体是派姆单抗,其以每3周一次的200mg的剂量施用。在一些实施方案中,结合pd-1的抗体是西米普利单抗。在一些实施方案中,结合pd-1的抗体是西米普利单抗。在一些实施方案中,本文所述的方法包括每3周一次以350mg的剂量向受试者静脉内施用西米普利
单抗。在一些实施方案中,结合pd-1的抗体是替雷利珠单抗。在一些实施方案中,本文所述的方法包括每3周一次以200mg的剂量向受试者静脉内施用替雷利珠单抗。
[0247]
在一些实施方案中,结合pd-l1的抗体使用固定剂量施用。在一些实施方案中,结合pd-l1的抗体是阿替利珠单抗。在一些实施方案中,本文所述的方法包括每3周一次以1200mg的剂量向受试者静脉内施用阿替利珠单抗。在一些实施方案中,结合pd-l1的抗体是阿维鲁单抗。在一些实施方案中,本文所述的方法包括每2周以10mg/kg的剂量向受试者静脉内施用阿维鲁单抗。在一些实施方案中,结合pd-1的抗体是德瓦鲁单抗。在一些实施方案中,本文所述的方法包括每4周以1500mg的剂量向受试者静脉内施用德瓦鲁单抗。
[0248]
在具体实例中,本文公开的任何方法包括(i)向患有本文公开的目标实体瘤(例如,胰腺导管腺癌(pda或pdac)、crc、hcc或cca)的人患者以约1至约32mg/kg(例如,约3mg/kg或约15mg/kg)的剂量每两周一次施用本文公开的任何抗半乳糖凝集素-9抗体(例如,g9.2-17或具有seq id no:19的重链和seq id no:5的轻链的抗体);和(ii)向人患者施用有效量的抗pd-1抗体(例如,纳武单抗、派姆单抗、替雷利珠单抗或西米普利单抗、德瓦鲁单抗、阿维鲁单抗和阿替利珠单抗)。在一些实施方案中,抗体包含seq id no:1所示的轻链互补决定区1(cdr1)、seq id no:2所示的轻链互补决定区2(cdr2)和seq id no:3所示的轻链互补决定区3(cdr3)和/或包含seq id no:4所示的重链互补决定区1(cdr1)、seq id no:5所示的重链互补决定区2(cdr2)和seq id no:6所示的重链互补决定区3(cdr3)。在一些实施方案中,该抗体含有包含seq id no:7的重链可变区。在一些实施方案中,抗体含有包含seq id no:8的轻链可变区。在一些实施方案中,抗体含有包含seq id no:19的重链。在一些实施方案中,抗体含有包含seq id no:15的轻链。在一些实施方案中,抗体是g9.2-17 igg4。在一些实施方案中,抗半乳糖凝集素-9抗体以约1mg/kg至约32mg/kg的剂量施用至受试者,例如,剂量可选自2mg/kg、4mg/kg、8mg/kg、12mg/kg和16mg/kg。在一些实施方案中,抗体每两周施用一次,例如通过静脉输注。在一些实施方案中,该方法进一步包括向受试者施用免疫检查点抑制剂,例如抗pd1抗体。在一些实施方案中,实体瘤选自胰腺癌(pda)、结直肠癌(crc)、肝细胞癌(hcc)或胆管癌(cca),并且在一些实施方案中,实体瘤是转移性肿瘤。当使用纳武单抗时,合适的给药方案可以是每4周一次的约480mg。当使用派姆单抗时,合适的给药方案可以是每3周一次的约200mg。当使用西米普利单抗时,合适的给药方案可以是每三周一次的静脉内约350mg。当使用替雷利珠单抗时,合适的给药方案可以是每3周一次的静脉内约200mg。在一些实施方案中,使用抗pd-l1抗体代替抗pd-1抗体。当使用阿替利珠单抗时,合适的给药方案可以是每3周一次的静脉内约1200mg。当使用阿维鲁单抗时,合适的给药方案可以是每2周静脉内约10mg/kg。当使用德瓦鲁单抗时,合适的给药方案可以是每4周静脉内约1500mg。
[0249]
不受理论束缚,据认为,通过抑制dectin-1,抗半乳糖凝集素-9抗体可重新编程针对肿瘤细胞的免疫反应,例如通过抑制渗入肿瘤微环境的γδt细胞的活性,和/或通过例如激活cd4+和/或cd8+t细胞来增强针对肿瘤细胞的免疫监视。因此,预期抗半乳糖凝集素-9抗体和免疫调节剂(例如本文所述的那些)的组合使用将显著增强抗肿瘤功效。
[0250]
在一些实施方案中,提供的方法是将抗半乳糖凝集素-9抗体与检查点抑制剂同时施用。在一些实施方案中,抗半乳糖凝集素-9抗体在检查点抑制剂之前或之后施用。在一些实施方案中,全身性地施用检查点抑制剂。在一些实施方案中,局部施用检查点抑制剂。在
一些实施方案中,检查点抑制剂通过静脉内施用,例如作为推注或通过一段时间内连续输注,通过肌肉内、腹膜内、脑脊髓内、皮下、动脉内、关节内、滑膜内、鞘内、瘤内、口服、吸入或局部途径施用。在一个实施方案中,检查点抑制剂通过静脉输注施用至受试者。
[0251]
在本文所述的任何方法实施方案中,抗半乳糖凝集素-9抗体可以每2周一次施用(单独或与抗pd1抗体组合)一个周期,每2周一次施用两个周期,每2周一次施用三个周期,每两周一次施用四个周期,或每两周一次施用多于四个周期。在一些实施方案中,治疗为1至3个月、3至6个月、6至12个月、12至24个月或更长。在一些实施方案中,治疗为每2周一次持续1至3个月、每2周一次持续3至6个月、每2周一次持续6至12个月、或每2周一次持续12至24个月或更长时间。
[0252]
可以监测接受单独的或与本文公开的检查点抑制剂(例如,抗pd-1或抗pd-l1抗体)组合的本文公开的任何抗半乳糖凝集素-9抗体(例如g9.2-17)的治疗的受试者的不良反应(例如,严重的不良反应)的发生。在下面的实施例1中提供了要监测的示例性不良反应。如果观察到不良反应的发生,可以改变该受试者的治疗条件。例如,可以减少抗半乳糖凝集素-9抗体的剂量和/或可以延长施用间隔。减少的适当性和程度可由合格的临床医生评估。在一个具体的实例中,实施按照临床医生所评估的或至少30%的水平降低。如果需要,实施剂量水平-1的30%的再一次剂量减少(剂量水平-2)。或者或另外地,可以减少检查点抑制剂的剂量和/或可以延长检查点抑制剂的施用间隔。在一些情况下(例如,发生危及生命的不良反应),治疗可能会终止。
[0253]
用于治疗与半乳糖凝集素-9相关的疾病的试剂盒
[0254]
本公开内容还提供用于治疗或减轻与半乳糖凝集素-9相关例如与结合细胞表面糖蛋白(例如,dectin-1、tim3、cd206等)的半乳糖凝集素-9或表达半乳糖凝集素-9的病理性细胞(例如癌细胞)相关的疾病的试剂盒。实例包括实体瘤,例如pda、crc、hcc或胆管癌,以及本文所述的其他和本文所述的其他。此类试剂盒可包括一个或多个容器,其中包含抗半乳糖凝集素-9抗体,例如本文所述的任何抗体,以及任选地第二治疗剂(例如,检查点抑制剂,例如本文公开的抗pd-1抗体)以与也在本文中描述的抗半乳糖凝集素-9抗体共同使用。
[0255]
在一些实施方案中,试剂盒可包含根据本文所述的任何方法使用的说明。所包括的说明可以包括对施用抗半乳糖凝集素-9抗体和任选地第二治疗剂以治疗、延迟发作或减轻如本文所述的目标疾病的描述。在一些实施方案中,试剂盒进一步包括基于鉴定个体是否患有目标疾病(例如应用如本文所述的诊断方法)来选择适合治疗的个体的描述。在其他实施方案中,说明包括向处于目标疾病风险中的个体施用抗体的描述。
[0256]
与抗半乳糖凝集素-9抗体的使用相关的说明通常包括有关剂量、给药方案和预期治疗的施用途径的信息。容器可以是单位剂量、散装包装(例如,多剂量包装)或亚单位剂量。本发明的试剂盒中提供的说明通常是标签或包装插页上的书面说明(例如,试剂盒中包含的纸页),但机器可读的说明(例如,携带在磁或光存储盘上的说明)也是可以接受的。
[0257]
标签或包装插页表明该组合物用于治疗、延迟发作和/或减轻与半乳糖凝集素-9(例如,dectin-1、tim-3或cd206信号传导)相关的疾病。在一些实施方案中,提供了用于实践本文描述的任何方法的说明。
[0258]
本发明的试剂盒采用合适的包装。合适的包装包括但不限于小瓶、瓶子、广口瓶、
软包装(例如密封的聚酯薄膜或塑料袋)等。还考虑了与特定装置(例如吸入器、鼻施用装置(例如雾化器)或输注装置例如微型泵)结合使用的包装。在一些实施方案中,试剂盒具有无菌进入端口(例如容器可以是静脉内溶液袋或具有可被皮下注射针刺穿的塞子的小瓶)。在一些实施方案中,容器还具有无菌进入端口(例如容器是静脉内溶液袋或具有可被皮下注射针刺穿的塞子的小瓶)。组合物中的至少一种活性剂是本文所述的抗半乳糖凝集素-9抗体。
[0259]
试剂盒可以任选地提供附加组分,例如缓冲液和解释性信息。通常,试剂盒包括容器和在容器上或与容器相关的标签或包装插页。在一些实施方案中,本发明提供包含上述试剂盒的内容物的制品。
[0260]
一般技术
[0261]
除非另有说明,本发明的实施采用分子生物学(包括重组技术)、微生物学、细胞生物学、生物化学和免疫学的常规技术,这些技术在本领域的技术范围内。此类技术在文献中得到充分解释,例如,molecular cloning:a laboratory manual,second edition(sambrook等人,1989)cold spring harbor press;oligonucleotide synthesis(m.j.gait,ed.,1984);methods in molecular biology,humana press;cell biology:a laboratory notebook(j.e.cellis,ed.,1998)academic press;animal cell culture(r.i.freshney,ed.,1987);introduction to cell and tissue culture(j.p.mather and p.e.roberts,1998)plenum press;cell and tissue culture:laboratory procedures(a.doyle,j.b.griffiths,and d.g.newell,eds.,1993-8)j.wiley and sons;methods in enzymology(academic press,inc.);handbook of experimental immunology(d.m.weir and c.c.blackwell,eds.);gene transfer vectors for mammalian cells(j.m.miller and m.p.calos,eds.,1987);current protocols in molecular biology(f.m.ausubel等人,eds.,1987);pcr:the polymerase chain reaction,(mullis等人,eds.,1994);current protocols in immunology(j.e.coligan等人,eds.,1991);short protocols in molecular biology(wiley and sons,1999);immunobiology(c.a.janeway and p.travers,1997);antibodies(p.finch,1997);antibodies:a practical approach(d.catty.,ed.,irl press,1988-1989);monoclonal antibodies:a practical approach(p.shepherd and c.dean,eds.,oxford university press,2000);using antibodies:a laboratory manual(e.harlow and d.lane(cold spring harbor laboratory press,1999);the antibodies(m.zanetti and j.d.capra,eds.,harwood academic publishers,1995)。
[0262]
无需进一步阐述,相信本领域技术人员基于以上描述可以最大限度地利用本发明。因此,以下特定实施方案应被解释为仅是举例说明性的,而不以任何方式限制本公开内容的其余部分。为了本文引用的目的或主题,本文引用的所有出版物均通过引用并入。
实施例
[0263]
实施例1.在转移性实体瘤患者中单独或与抗pd1抗体联合使用抗半乳糖凝集素-9单克隆抗体的i-ii期开放标签非随机研究
[0264]
半乳糖凝集素-9是一种在许多实体瘤(包括胰腺癌、结直肠癌和肝细胞癌)中过度
表达的分子。此外,半乳糖凝集素-9在肿瘤相关巨噬细胞以及肿瘤内免疫抑制性γδt细胞上表达,从而充当癌症相关免疫抑制的有效介质。如本文所述,已经开发了靶向半乳糖凝集素-9(例如,g9.2-17、igg4)的单克隆抗体。数据表明,g9.2-17在原位kpc模型中阻止了50%的胰腺肿瘤生长,并将kpc动物的生存期延长了多于一倍。不希望受理论束缚,据认为抗半乳糖凝集素-9抗体将m2表型逆转至m1表型,促进肿瘤内cd8
+
t细胞活化。此外,已发现抗体g9.2-17(igg4)(具有seq id no:19的重链和seq id no:15的轻链)与抗pd1协同作用。
[0265]
这项i/ii期多中心研究的目的是确定在患有转移性实体瘤(例如胰腺癌(pda)、结直肠癌(crc)、肝细胞癌(hcc)或胆管癌(cca)的受试者中在三个月治疗后的安全性、耐受性、最大耐受或最大施用剂量(mtd)和客观肿瘤反应。该研究还检查了无进展生存(pfs)、反应持续时间(通过resist)、疾病稳定性、在3、6和12个月时存活的受试者的比例以及药代动力学(pk)和药效学(pd)参数。受试者接受治疗前和治疗后活检,以及研究前和研究期间每8周一次的pet-ct成像。此外,还检查了免疫学终点例如外周和肿瘤内t细胞比率、t细胞活化、巨噬细胞分型和半乳糖凝集素-9血清水平。该研究在主研究方案下进行,并且研究持续12-24个月。
[0266]
此外,概念数据的临床前证据表明g9.2-17(igg4)(又名g9.2-17 igg4)在原位((lsl-kras(g12d/
±
);lsl-trp53(r172h/+);pdx-1-cre)-胰腺导管腺癌)kpc模型和b16f10黑色素瘤、皮下模型中作为单一药剂使胰腺肿瘤生长减少多至50%。阻断半乳糖凝集素-9还延长kpc动物的存活。从机制上讲,靶向半乳糖凝集素-9促进肿瘤内效应t细胞的激活。在体内g9.2-17抗体和抗pd-1之间有协同作用的迹象。也就是说,在bl6f10黑色素瘤模型中,与单独用任一单一药剂治疗的组相比,在用抗半乳糖凝集素-9抗体和抗pd-1治疗的组中观察到肿瘤内cd8+t细胞显著增加。在非glp毒性研究中,g9.2-17(igg4)在啮齿类动物中的多至(包括)100mg/kg和在猴中的多至(包括)300mg/kg的剂量下在啮齿类动物和食蟹猴中是安全的。该ia/ib期研究性试验旨在评估最大耐受剂量的安全性和耐受性、pk、pd、疗效反应结果、疾病控制和在3、6和12个月时的存活率以及其他探索性参数。
[0267]
此ia/ib期研究性试验评估了最大耐受剂量(或最大施用剂量)的安全性和耐受性、pk、pd、免疫原性、疗效反应结果、患者存活率和其他探索性参数。虽然胰腺癌、结直肠癌和胆管癌是计划的扩展队列,但临床试验的剂量发现部分对上述肿瘤类型之外的所有转移性实体瘤患者开放。pdac、crc和cca之外的其他癌症类型可能受益于抗半乳糖凝集素-9治疗,并且虽然目前没有优先用于扩展队列,但可能在剂量递增部分显示出有意义的临床益处和机制原理,以保证专门的扩展队列。此外,计划了crc和cca中的扩展队列用于单药g9.2-17 igg4以及g9.2-17 igg4与已批准的抗pd-1药剂联合用于在转移环境中至少一种先前治疗线已失败否则有资格参加研究的患者。
[0268]
主要目标包括安全性、耐受性、最大耐受剂量(mtd)、3个月时的客观肿瘤反应(orr)。次要目标包括无进展生存(pfs)、通过recist 1.1的反应持续时间、疾病稳定性、在3、6和12个月时的存活比例以及药代动力学(pk)和药效学(pd)参数。
[0269]
受试者、疾病以及所有临床和安全性数据以平均值、中位数或比例描述性地呈现,并使用适当的方差度量(例如,95%置信区间范围)。waterfall和swimmers图用于以图形方式呈现每个疾病部位内每个研究臂的受试者的orr和反应持续时间,如下所述。还进行了探索性相关分析,以鉴定可能与orr相关的潜在生物标志物。所有统计分析均使用sas 9.2版
(sas,cary,nc)进行。
[0270]
该研究包括g9.2-17(igg4)的单一疗法以及g9.2-17和纳武单抗的组合。g9.2-17的剂量范围可以是每两周一次的约3mg/kg至15mg/kg。抗体通过静脉输注施用。
[0271]
研究目标、持续时间和研究人群总结在表b中。
[0272]
表b.研究概述
[0273]
[0274]
[0275]
[0276][0277]
研究设计
[0278]
患者群体:在3+3剂量递增阶段1(如下所述)中的所有转移人群,然后在pda、crc和cca或在其中在阶段1捕获作用模式和/或早期疗效信号的肿瘤类型中扩展。
[0279]
阶段1
[0280]
使用连续重新评估方法(crm)进行剂量发现研究-o'quigley等人(1990),这是一种根据过去的试验数据告知应如何针对下一个患者队列调整抗gal 9抗体的剂量的基于模型的设计。当抗半乳糖凝集素-9抗体作为单一药剂施用时,研究的阶段1是3+3剂量发现和安全性。
[0281]
使用单参数功效模型来描述g9.2-17(igg4)的剂量与观察到剂量限制性毒性(dlt)的概率之间的关系。dlt被定义为临床上显著的非血液学不良事件或异常实验室值,评估为与转移性肿瘤疾病进展、并发疾病或伴随药物无关,并且与研究药物相关,并且发生在满足以下任何一项以下标准的研究的第一个周期内:
[0282]
·
任何持续时间的所有4级非血液学毒性
[0283]
·
所有3级非血液学毒性。例外情况如下:
[0284]-不需要住院或tpn支持,并且可以在48小时内通过支持护理管理到《2级的3级恶
心、呕吐和腹泻。
[0285]-在24小时内校正为《2级的3级电解质异常。
[0286]
dlt周期=一(1)个周期,即在每个周期的第1天和第15天的两个剂量的抗gal 9抗体。
[0287]
·
ae/ctae和sae的发生率和严重程度,包括实验室参数、生命体征和ecg的临床显著变化
[0288]
·
dlt、pk和pd的发生率
[0289]
·
血浆pk参数(例如,auc
0-24h
、c
max
、t
max
、估计的半衰期);血清浓度相对时间曲线
[0290]
·
客观反应率(完全反应和部分反应)和临床受益率(客观反应和稳定疾病3个月或更长时间);无进展生存(pfs)、总生存(os)、疾病控制率(dcr)
[0291]
血液和肿瘤免疫分型、半乳糖凝集素-9血清、血浆水平以及肿瘤、基质、免疫细胞的组织表达水平和表达模式、反应时间(ttr)和其他生物标志物分析、ct(pet)成像/其他临床指示成像方式。
[0292]
obd是dlt的估计概率小于或等于25%的目标毒性水平(ttl)的最大剂量。一次给两名患者给药,最大可用样品大小为24。作为安全预防措施,在每次剂量递增时,只有在每个队列的第一名患者已接受抗gal 9抗体治疗并且至少在治疗后7天后才会进入并治疗新患者。
[0293]
剂量范围如下表2所示,并且抗体每两周一次(q2w)静脉内施用。
[0294]
表2:按队列给药
[0295][0296]a如果前3名患者均未出现剂量限制性毒性(dlt),则另外3名患者接受下一个更高剂量水平的治疗。然而,如果三名患者中的一名具有dlt,则另外3名患者接受相同剂量水平的治疗。剂量递增持续到3至6名患者的队列中至少有2名患者经历dlt。阶段ii的剂量是刚好低于表现出毒性的水平的剂量。
[0297]b当≤1名患者有反应时,相应的试验臂终止
[0298]
剂量递增遵循修正的斐波那契数列,其中剂量增加先前的第一次剂量的100%,然后增加前次剂量的67%、50%、40%和30%。如果前三名患者均未经历剂量限制性毒性
(dlt),则以下一个最高剂量水平治疗另外三名受试者。或者,如果三名受试者中的一名患有dlt,则以相同剂量水平治疗另外三名受试者。剂量递增一直持续到三至六名患者队列中至少有两名患者经历dlt。
[0299]
在替代设计中,当六名连续患者接受相同剂量且该剂量将被识别为obd时,将完成阶段1。在crm设计中总共要评估5个剂量水平。
[0300]
1.剂量水平1=2mg/kg
[0301]
2.剂量水平2=4mg/kg
[0302]
3.剂量水平3=8mg/kg
[0303]
4.剂量水平4=12mg/kg
[0304]
5.剂量水平5=16mg/kg
[0305]
6.给药方案:q2w
[0306]
7.施用途径:静脉内(iv)
[0307]
阶段2
[0308]
该研究的阶段2是simon的两阶段优化设计(六臂:胰腺导管腺癌(pda)、crc和胆管癌)。该研究调查了抗半乳糖凝集素-9抗体的单独使用(研究的单药臂)和与纳武单抗的组合使用(每两周一次施用的240mg固定剂量;研究的io组合臂)。所使用的抗半乳糖凝集素-9抗体的剂量低于在i期阶段发现的表现出毒性的水平。
[0309]
在crc和cca中,抗gal 9抗体将作为单一药剂进行测试。或者,将抗-gal 9抗体与经批准的抗-pd-1mab(例如,纳武单抗、派姆单抗、西米普利单抗或)组合进行测试。
[0310]
最佳的两阶段设计用于检验orr≤5%的零假设相对orr≥15%的替代(单药臂内)。在第一阶段对23名患者进行药物测试后,如果≤1名患者有反应,则终止相应的试验臂。如果试验继续进行到simon优化设计的第二部分,则每个单药臂中总共招募56名患者。如果有反应的患者总数≤5,则该臂内的药物被拒绝。如果≥6名患者在3个月时具有orr,则激活该臂的扩展队列。上述方法适用于研究的单药臂。
[0311]
对于io组合臂(crc和cca),g9.2-17 igg4的起始剂量比第1部分中确定的rp2d剂量水平(rp2d
–
1)低一个剂量。为了确保患者安全性,赞助者计划了安全试运行,其中前8名患者接受组合用药,并且只有≤2名患者发生dlt,其低于25%的ttl,该臂才会继续。如果3名或更多患者发生dlt,g9.2-17 igg4的剂量将根据临床医生的评估减少一个减少水平或至少减少30%(剂量水平-1)。如果需要,允许进行30%的剂量水平-1的再一次剂量减少(剂量水平-2)。不允许进一步减少剂量。仅当研究者评估正在获得临床益处并且可在剂量减少条件下继续获得时,才允许将剂量减少至剂量水平-1和-2。
[0312]
对于crc和cca中的抗pd-1mab组合臂,最优的两阶段设计也用于检验orr≤10%的零假设相对orr≥25%的替代。在第一阶段对18名患者进行测试组合用药后,如果≤2名患者有反应,则终止相应的试验臂。如果试验继续进行到simon优化设计的第二部分,则每个组合臂共招募43名患者。如果反应患者的总数≤7,则拒绝该臂内的组合。如果≥8名患者在3个月时具有orr,则激活该臂的扩展队列。
[0313]
阶段3
[0314]
阶段3包括已检测到早期疗效信号的队列的扩展。如果在可归因于肿瘤类型的六个试验臂之一中鉴定到有希望的疗效信号,则启动扩展队列以确认这一发现。每个扩展臂
的样品大小是根据阶段2确定的点估计值,结合orr周围95%置信区间(95%ci)的预定精度水平确定的。
[0315]
本研究分析了治疗前和治疗后活检样品,例如,根据临床指示,对研究前和q6/8w的pet-ct进行成像。pk、pd、免疫学终点包括外周和肿瘤内t细胞比率、t细胞活化、巨噬细胞表型、半乳糖凝集素-9血清水平和半乳糖凝集素-9组织表达水平。
[0316]
剂量和施用
[0317]
g9.2-17 igg4每两周(q2w)通过静脉内(iv)输注施用,直到疾病进展、不可接受的毒性或在第1部分和第2部分中的许可撤回。如果患者正在经历临床获益,则根据研究者的判断并与研究医学监察员讨论后,经历剂量限制性毒性的受试者可以恢复g9.2-17 igg4施用。剂量减少30%或根据研究者的临床判断并经医学监察员和赞助者同意。剂量减少30%将被视为剂量水平-1。将先前剂量水平的30%的下一次剂量减少视为剂量水平-2。允许不超过两次这样的剂量减少。
[0318]
第1部分:受试者根据crm设计单独接受g9.2-17 igg4。
[0319]
第2部分:受试者接受g9.2-17 igg4的rp2d作为单一药剂或g9.2-17 igg4与抗pd-1组合的(使用第1部分中确定的rp2d)。但是,在组合臂的情况下,对前8名患者给药,并且如果≤2名患者出现dlt(其低于30%的目标毒性水平(ttl)),则继续进行该臂。如果超过3名患者发生被确定为与g9.2-17 igg4相关且与组合使用的药物/方案无关的dlt,则g9.2-17 igg4的剂量将降低至rp2d-1剂量水平(g9.2-17 igg4的30%剂量减少或根据临床医生的评估)。
[0320]
研究目标
[0321]
(ii)阶段1(1a期)
[0322]
·
主要目标:安全性、耐受性、最佳生物剂量(obd)、最大耐受剂量(mtd)或最大施用剂量(mad)、推荐的2期剂量(rp2d)
[0323]
·
次要目标:药代动力学(pk)、药效学(pd)参数、免疫原性
[0324]
·
阶段1的探索性终点:下面列出的探索性终点之外:客观反应率(orr)、疾病控制率(dcr)、无进展生存(pfs)、6个月和12个月的患者生存
[0325]
(ii)crc和cca的阶段2和阶段3
[0326]
·
主要目标;客观反应率(orr)
[0327]
·
次要目标:无进展生存(pfs)、疾病控制率(dcr)、通过recist1.1的反应的持续时间和深度、6个月和12个月的患者生存、反应时间、安全性和耐受性
[0328]
(iii)pdac的阶段2和阶段3
[0329]
·
主要目标;6个月时的患者生存
[0330]
·
次要目标:客观反应率(orr)、无进展生存(pfs)、3、6和12个月的疾病控制率(dcr),6个月和12个月的患者生存,通过recist 1.1的反应的持续时间和深度、反应时间、安全性和耐受性
[0331]
(iv)所有研究部分的探索性终点:
[0332]
irecist标准、从血液和肿瘤的免疫分型、细胞因子谱(血清)、血液(血清或血浆)中的可溶性半乳糖凝集素-9水平、半乳糖凝集素-9肿瘤组织表达水平和表达模式(通过免疫组织化学)(肿瘤、基质、免疫细胞)、多重免疫组织化学、反应时间(ttr)、肿瘤突变负荷
(tmb)、通过免疫组织化学的pdl-1表达、错配修复状态、与疾病相关的肿瘤标志物-以及这些参数与反应的相关性。生活质量和症状控制。
[0333]
研究人群
[0334]
(i)阶段1:无论肿瘤类型如何,患有复发/难治性转移性癌症的患者都有资格用于使用o'quigley(1990)描述的持续重新评估方法(crm)进行剂量发现研究。
[0335]
(ii)阶段2:设想在pdac、crc和cca(计划的)中或在其中在阶段1捕获作用模式和/或早期疗效信号的肿瘤类型中进行扩展。
[0336]
(iii)阶段3:研究的最后和第三部分允许进一步扩展显示抗肿瘤活性的最低阈值的阶段2的队列。每个扩展臂的样品大小将根据阶段3中确定的点估计值,结合orr/患者存活率周围的95%置信区间(95%ci)的预定精确度水平来确定。
[0337]
患者纳入标准:
[0338]
1.书面知情同意书(心智健全、有理解能力和愿意签署知情同意书)
[0339]
2.年龄》18岁的男性或未怀孕女性
[0340]
3.组织学证实的不可切除的转移性癌症
[0341]
4.由研究者判断能够遵守研究方案
[0342]
5.预期寿命》3个月
[0343]
6.可用于生物标志物分析的近期存档肿瘤样品。必须提供自获得活检标本以来所接受的治疗的信息。研究员的判断将用于确定存档样品本身是否可接受。
[0344]
7.如果可用,应记录根据第5点中的纳入标准由ihc对存档样品评估的半乳糖凝集素-9肿瘤组织表达水平。
[0345]
8.患者能够并愿意接受治疗前和治疗中/治疗后活检。根据研究者的判断,计划的活检不应使患者暴露于并发症的显著增加的风险。尽一切努力在重复活检中对同一病灶进行活检。
[0346]
9.根据recistv1.1可测量的疾病。注意,拟进行活检的病灶不应是目标病灶。
[0347]
10.根据研究者判断的预期生存期》3个月
[0348]
11.对于第1部分:没有可用的护理标准选择,或患者拒绝了可用和指示的护理标准治疗,或不符合可用和指示的护理标准治疗。对于第2部分:pdac扩展队列-在转移性癌症环境中接受至少一种全身治疗线,以及未使用含吉西他滨的方案或距离使用含吉西他滨的方案的治疗至少6个月的患者。ccr和cca扩展队列-在转移性环境中接受至少一种先前治疗线。
[0349]
12.允许在研究期之前或期间接种covid-19疫苗。必须记录有关疫苗接种的时间和类型的信息。
[0350]
13.eastern cooperative oncology group(ecog)表现状态0-1/karnofsky评分》70(请尽可能记录两者)
[0351]
14.msi-h和mss患者将被允许进入研究的第1部分(阶段1)
[0352]
15.充分的血液学和终末器官功能,由在研究药物治疗的第一剂量前28天内和研究药物的任何连续剂量前72小时内获得的以下实验室结果定义:中性粒细胞计数≥1x109/l,血小板计数≥100x109/l,对于第1部分中的hcc≥50x109/l。在前一周未输血的情况下血红蛋白≥8.5g/dl,肌酐≤1.5uln,肌酐清除率≥30ml/min,ast(sgot)≤3 x uln(当存在
hcc或肝转移时≤5 x uln),alt(sgpt)≤3 x uln(当存在hcc或肝转移时,≤5 x uln),胆红素≤1.5 x uln(患有已知吉尔伯特病的患者的胆红素可≤3.0
×
uln),白蛋白≥3.0g/d linr和ptt≤1.5
×
uln;淀粉酶和脂肪酶≤1.5
×
uln。
[0353]
·
如果先前诊断出脑转移瘤,则必须在筛选前4周或更长时间完成脑部疾病治疗,无论是手术还是放射治疗,或者在研究开始前至少3个月脑部疾病稳定。在这种情况下,需要进行脑部mri以证明目前没有进展性脑转移瘤的证据,并且没有脑部中的新疾病和/或软脑膜疾病,
[0354]
·
患者必须在研究开始前至少28天停止使用类固醇治疗脑转移瘤。
[0355]
16.研究开始前4周内无活动性感染的证据且无严重感染
[0356]
17.有生育能力的女性必须在开始治疗前72小时内具有阴性妊娠测试。对于有生育能力的女性:同意在治疗期间和最后一次研究治疗后至少180天内保持禁欲(避免异性性交)或使用导致每年《1%的失败率的避孕方法。如果女性处于月经初潮后、未达到绝经后状态(≥12个连续月的闭经且除更年期以外没有确定的原因)且未接受手术绝育(切除卵巢和/或子宫),则她具有生育潜力。每年《1%的失败率的避孕方法的实例包括双侧输卵管结扎、男性绝育、抑制排卵的激素避孕药、释放激素的宫内节育器和宫内铜节育器。应该根据临床试验的持续时间以及患者的偏好和惯常生活方式来评估性禁欲的可靠性。定期禁欲(例如,日历(calendar)、排卵、症状热(symptom-thermal)或排卵后方法)和体外排精(withdrawal)是不可接受的避孕方法。有生育能力的男性在研究期间必须采用有效的避孕方法,除非存在不孕症的记录。
[0357]
18.自第一次g9.2-17 igg4施用前最后一剂抗癌治疗后四(4)周或5个半衰期(以较短者为准)
[0358]
19.对于在c1d1之前已经稳定至少6个月的骨转移,允许继续使用双膦酸盐治疗(唑仑膦酸)或狄诺塞麦。
[0359]
20.对于ccr和cca扩展队列,需要在转移环境中的至少一种先前治疗线。
[0360]
患者排除标准:
[0361]
1.被诊断患有不明原发灶的转移性癌症的患者
[0362]
2.不愿意或不能遵守协议要求
[0363]
3.以前或现在的非法吸毒成瘾
[0364]
4.临床显著的、活动性不受控制的出血,以及任何具有出血素质(例如,活动性消化性溃疡病)的患者。允许预防性或治疗性使用抗凝剂。
[0365]
5.哺乳期女性
[0366]
6.在研究的第1周期、第1天之前施用的药物的4周或5个半衰期(以较短者为准)内接受任何其他研究性药剂或参与涉及用于治疗实体瘤的另一种研究性药剂的任何其他临床试验或自同意日起4周内接受其他研究性治疗或大手术,或在预期研究开始后4周内进行计划的手术(包括牙科手术)。
[0367]
7.研究药物的首个剂量后4周内的放射治疗,但有限区域的姑息性放射治疗除外,例如用于治疗骨痛或局灶性疼痛的肿瘤块。
[0368]
8.具有真菌性肿瘤肿块的患者
[0369]
患有局部晚期pdac的患者。
[0370]
9.由于先前的癌症治疗≥ctcae 3级毒性(脱发和白斑除外)。使用先前的检查点抑制剂的4级免疫介导的毒性。2级或3级肺炎或导致免疫治疗中断的任何其他3级检查点抑制剂相关毒性。
[0371]
10.二次恶性肿瘤病史,但先前超过五年以治愈性意图治疗且未复发或复发可能性低的患者除外(例如非黑色素性皮肤癌、原位宫颈癌、前列腺癌或浅表性膀胱癌)
[0372]
11.严重或未控制的全身性疾病、充血性心力衰竭》纽约心脏协会(nyha)2级、6个月内心肌梗塞(mi)的证据或在研究者看来使患者非理想地参与试验的实验室发现
[0373]
12.研究者认为严重危及患者安全或损害g9.2-17 igg4毒性评估的解释的任何医学状况
[0374]
13.严重的不愈合伤口、活动性溃疡或未经治疗的骨折
[0375]
14.无法控制的胸腔积液、心包积液或需要反复引流手术的腹水
[0376]
15.对嵌合或人源化抗体或融合蛋白的严重变应、过敏或其他超敏反应史
[0377]
16.在周期1的第1天的6个月内的重大血管疾病(例如,需要手术修复的主动脉瘤或近期动脉血栓形成)
[0378]
17.周期1的第1天前2或3个月内的肺栓塞、中风或短暂性脑缺血发作的病史
[0379]
18.周期1的第1天前6个月内的腹部瘘管或胃肠道穿孔的病史
[0380]
19.活动性自身免疫性疾病(i型糖尿病、仅需要激素替代治疗的甲状腺功能减退症、白癜风、银屑病或脱发除外)
[0381]
20.需要全身免疫抑制治疗,包括但不限于(环磷酰胺、硫唑嘌呤、甲氨蝶呤、沙利度胺和抗肿瘤坏死因子[抗tnf]药物)。已接受或正在接受急性、低剂量、全身性免疫抑制剂药物(例如,地塞米松或泼尼松龙)的患者可以入组。替代疗法(例如,用于肾上腺或垂体功能不全的甲状腺素、胰岛素、生理性皮质类固醇替代疗法((例如,≤10mg/天的泼尼松等效物))不被视为全身治疗的形式。使用吸入性皮质类固醇和盐皮质激素(例如、氟氢可的松)、局部类固醇、鼻内类固醇、关节内和眼科类固醇是允许的
[0382]
21.对广泛镇痛干预(口服和/或贴剂)无反应的肿瘤相关疼痛(》3级)。
[0383]
22.不受控制的高钙血症,尽管使用了双磷酸盐
[0384]
23.任何其他疾病、代谢功能障碍、体格检查发现或临床实验室发现,其使得合理怀疑患有禁止使用研究药物或可能影响结果的解释或使患者处于治疗并发症的高风险的疾病或状况
[0385]
24.接受器官移植
[0386]
25.正在经历透析
[0387]
(肝)胆管癌的特定附加排除标准(对于第1部分的hcc和对于第1部分和第2部分的cca)
[0388]
1.试验进入前《6周的针对hcc的任何消融治疗(射频消融或经皮乙醇注射)
[0389]
2.肝性脑病或严重肝腺瘤
[0390]
3.child-pugh评分≥7
[0391]
4.在接受至少一种先前的全身治疗(包括索拉非尼)时出现进展,或在标准治疗(包括手术和/或局部区域治疗)上进展后不耐受或拒绝索拉非尼治疗或标准治疗被认为无效、不耐受或不合适或没有有效的标准疗法的转移性肝细胞癌
[0392]
5.允许胆管或胃出口梗阻,前提是通过内窥镜、手术或介入手段有效引流
[0393]
6.允许胰瘘、胆瘘或肠瘘,前提是它们用适当的未感染和开放的引流管控制(如果有任何引流管或支架在原位,则需要在研究开始前确认开放性)。
[0394]
研究评估
[0395]
评估计划在给药前筛选后分为2周周期,其可在治疗开始前最多4周进行。研究评估包括由合格的医师、从业者或医师助理进行的医学和身体检查。采集的病史包括肿瘤病史、放射治疗史、手术史、当前和过去的药物治疗。评估包括再分期扫描(具有对比的ct、具有对比的mri、pet-ct(诊断性ct)和/或x射线)。
[0396]
评估还包括肿瘤活检(从第1剂量前开始并在可行的情况下重复活检),这取决于扫描。或者,存档组织可以在给药前使用。
[0397]
视情况而定,在每个周期在给药前评估每种肿瘤类型的相关肿瘤标志物-例如ca15-3、ca-125、cea、ca19-9、甲胎蛋白等(治疗6个月后可能减少到每3个周期,按照与再分期扫描相同的计划)。评估还包括生命体征、ecog、不良事件、血细胞计数、血液化学、血液凝固(凝血酶原时间(pt)和部分凝血活酶时间(ptt)、活化部分凝血活酶时间(aptt))、血液和肿瘤生物标志物分析(免疫分型、细胞因子测量)和尿液分析(比重、蛋白质、白细胞酯酶、葡萄糖、酮、尿胆素原、亚硝酸盐、wbc、rbc和ph值)。血清化学包括葡萄糖、总蛋白、白蛋白、电解质[钠、钾、氯、总co2]、钙、磷、镁、尿酸、胆红素(总、直接)、sgpt(alt)或sgot(ast)、碱性磷酸酶、胆红素、乳酸脱氢酶(ldh)、肌酐、hgba1c、血尿素氮、cpk、tsh、ft4、脂肪酶、淀粉酶、pth、睾酮、雌二醇。催乳素、fsh、lh、crp。
[0398]
具有对比的ct是再分期扫描的首选方式(如果考虑到疾病位置,ct不可行或不合适,则mri、pet-ct和/或其他成像方式代替ct扫描或附加于ct扫描)。每6至8周+/-1周进行评估,如果在过去4至6周内未进行评估,则在治疗结束时进行评估。
[0399]
收集患者的血液样品用于常规临床实验室测试,包括血液学和血清化学。
[0400]
血液化学包括以下:葡萄糖、hgb a1c、总蛋白、白蛋白、电解质[钠、钾、氯、总co2]、钙、磷、镁、尿酸、胆红素(总、直接)、sgpt(alt)或sgot(ast)、碱性磷酸酶、胆红素、乳酸脱氢酶(ldh)、肌酐、血尿素氮、cpk)、tsh、ft4、脂肪酶、淀粉酶、pth、睾酮、雌二醇。催乳素、fsh、lh、crp。
[0401]
研究产品、剂量和施用
[0402]
抗gal 9抗体每两周(q2w)通过静脉内(iv)输注施用,直到疾病进展、不可接受的毒性或许可撤回。如果患者正在经历获益,则经历剂量限制性毒性的受试者在与研究医学监察员讨论后可以恢复抗gal 9抗体的施用。剂量最多减少25%或根据研究者的临床判断并经医学监察员和赞助者同意。
[0403]
·
阶段1:受试者根据crm设计单独接受抗gal 9抗体。
[0404]
·
阶段2:受试者接受抗gal 9抗体的rp2d作为单一药剂或抗体与抗pd-1组合(使用阶段1中鉴定的rp2d)。如果患者表现出毒性,减少抗ga9抗体的剂量(例如,减少25%)。
[0405]
·
阶段3:在阶段2观察到疗效的治疗臂将在阶段3使用,并相应地在阶段2中测试的剂量水平下扩展,即在orr/患者存活率(取决于肿瘤类型)超过定义的最低阈值时。
[0406]
其他药物
[0407]
·
组合药物:经批准的抗pd-1mab(例如,上述那些);
[0408]
·
剂量:抗pd-1mab剂量取决于待通过初始ind确定的经批准的药物来确定。
[0409]
·
施用方式:静脉内输注
[0410]
统计方法
[0411]
受试者、疾病和所有临床安全性数据以平均值、中位数或比例描述性地呈现,并使用适当的方差度量(即95%ci,范围)。waterfall和swimmers图用于以图形方式显示每个疾病部位内每个研究臂的患者的orr和反应持续时间。除非另有说明,否则所有功效分析都将基于itt人群。无进展生存(pfs)和总生存(os)的生存曲线由kaplan-meier方法生成。没有六个研究臂中的任何一个之间的比较分析。还进行了探索性相关分析,以鉴定潜在的生物标志物和其他预测因子,其可能与orr、pfs和os相关。所有统计分析都将使用sas9.2版(sas,cary,nc)进行。
[0412]
研究程序和评估
[0413]
·
ae/ctae和sae的发生率和严重程度,包括实验室参数、生命体征和ecg的临床显著变化
[0414]
·
dlt、pk和pd的发生率
[0415]
·
血浆pk参数(例如,auc0-24h、gm.、tmax、估计的半衰期);血清浓度与时间曲线
[0416]
·
客观反应率(完全反应和部分反应)(orr)和临床受益率(客观反应和病情稳定3个月或更长时间);无进展生存(pfs)、总生存(os)、疾病控制率(dcr)
[0417]
·
血液和肿瘤免疫分型、半乳糖凝集素-9血清、血浆水平和肿瘤、基质、免疫细胞的组织表达水平和表达模式、反应时间(ttr)和其他生物标志物分析、ct(pet)成像、其他临床相关成像。
[0418]
安全性监测
[0419]
常规安全性监测由医疗监测员执行。安全性监测(包括pk的分析)将由安全监测委员会(smc)进行,该委员会由主要研究者(和必要时的合作研究者)和赞助者代表以及研究指定的医学监测员组成。其他研究人员和研究团队成员将根据需要参与审查。这项开放标签研究不使用独立数据监测委员会。
[0420]
在阶段1,剂量递增阶段,在审查每个队列的周期1后,进行剂量递增到下一个队列。由smc使用安全性和可用的pk数据来评估每个队列中所有患者的剂量限制性毒性(dlt)。作为安全预防措施,在剂量递增期间,只有在每个队列中的第一位患者接受抗gal 9抗体治疗并且至少在治疗后7天后新患者才进入和治疗。在周期1完成后,对每位患者进行选择dlt安全性分析。
[0421]
剂量限制性毒性(dlt)被定义为临床上显著的血液学或非血液学不良事件或异常实验室值,被评估为与转移性肿瘤疾病进展、并发疾病或伴随药物无关,并且与研究药物相关,并且发生在满足以下任一标准的研究的第一个周期内:
[0422]
·
任何持续时间的所有4级血液学和非血液学毒性
[0423]
·
所有3级血液学和非血液学毒性。例外情况如下:
[0424]
ο不需要住院或tpn支持,并且可以在48小时内通过支持护理管理到≤2级的3级恶心、呕吐和腹泻。
[0425]
ο在24小时内校正为≤2级的3级电解质异常。
[0426]
其他3级无症状实验室异常dlt时期=一(1)个周期,即在每个周期的第1天和第15
天的两剂g9.2-17 igg4。
[0427]
患者通常应维持研究治疗直至证实的放射学进展。如果患者有放射学进展但没有明确的临床进展并且未启动替代治疗,则患者可以继续接受研究治疗,这由研究者决定。然而,如果患者有明确的临床进展而没有放射照相学进展,则停止研究治疗并向患者建议可用的治疗选项。
[0428]
在发生严重或危及生命的免疫相关不良反应(imar)或提示开始全身性类固醇的情况下,已批准的检查点抑制剂和g9.2-17 igg4均被停用,但特殊的例外情况(例如,临床稳定的患者中的某些内分泌疾病)可以在批准的产品标签中描述。
[0429]
如果方案建议在(a)扣留批准的检查点抑制剂或(b)开始全身性的类固醇用于imar的情况下继续使用实验药物,则提供足够的理由来支持这种方法的安全性。
[0430]
在剂量减少用于ae管理的情况下,允许两次剂量减少。每次减少剂量时按基线剂量的30%。只有当研究者评估临床获益正在并且可能继续获得时,才会进行剂量减少。
[0431]
治疗紧急不良事件(teae)将定义为在研究药物的第一次剂量时或之后发生的事件。medical dictionary for regulatory activities(meddra)编码词典将用于ae的编码。teae、严重或ctc 3或4级teae以及与治疗相关的teae将在整体上并按系统器官类别和治疗组的首选项进行总体总结。这些将总结事件的数量以及具有给定事件的患者的数量和百分比。此外,teae患者的数量和百分比将按最大严重程度提供。将提供在任一治疗组中至少5%的患者中出现的按系统器官类别和首选项的所有teae的总结。
[0432]
可能、大概或肯定与一种或多种研究药物相关的任何≥3级的ae将在继续给药前与医学监察员讨论,但以下例外情况不需要与医学监察员讨论:
[0433]
·
持续《72小时的局部注射部位反应,包括疼痛、发红、肿胀、硬结或瘙痒
[0434]
·
持续《72小时的发热、肌痛、头痛或疲劳的全身注射反应
[0435]
如果研究人员认为适当(在与医学监察员讨论后),对于≥3级不良事件可能需要延迟剂量,直到毒性消退(至1级或更低)。
[0436]
在方案的第2部分,如果一名或多名患者出现dlt,g9.2-17 igg4的剂量将减少至比推荐的2期剂量(rp2d)低1个剂量。
[0437]
患者完成治疗期后,每3个月进行总生存随访,进行最长2年。在可能的情况下,对因临床进展退出的患者进行放射学评估。
[0438]
以下程序将在最后一次剂量后的第59天或30天进行,包括提前停止治疗的患者。
[0439]
·
再分期扫描(具有对比的ct、mri、pet-ct或x射线)-如果研究结束在最后一个周期后》6至8周,则进行重复,并以较短的间隔进行,由研究者自行决定
[0440]
·
视情况而定,在每个周期在给药前评估相关的肿瘤标志物-例如,ca15-3、ca-125、cea、ca19-9、甲胎蛋白等(治疗6个月后可能减少到每3个周期,按照与再分期扫描相同的计划),视情况而定
[0441]
·
12导联ecg
[0442]
·
身体检查
[0443]
·
ecog
[0444]
·
仰卧5分钟后的生命体征(体温、hr、bp、rr,包括体重)
[0445]
·
伴随用药(名称、适应症、剂量、途径、开始和结束日期)
[0446]
·
不良事件
[0447]
·
如果是女性,怀孕测试
[0448]
·
全血计数(cbc)、分类(differential)、血小板、血红蛋白
[0449]
·
血液化学(葡萄糖、总蛋白、白蛋白、电解质[钠、钾、氯、总co2]、钙、磷、镁、尿酸、胆红素(总、直接)、sgpt(alt)或sgot(ast)、碱性磷酸酶、胆红素、乳酸脱氢酶(ldh)、肌酐、血尿素氮、cpk)、tsh、ft4、pth、雌二醇。催乳素、睾酮、fsh、lh
[0450]
·
血液凝固(pt、ptt)
[0451]
·
尿液分析
[0452]
·
pd血液——生物标志物分析
[0453]
·
pk血样
[0454]
肿瘤评估的recist标准
[0455]
在基线肿瘤评估中,肿瘤病灶/淋巴结被分类为可测量或不可测量,其中根据测量平面中的最长直径记录可测量的肿瘤病灶(病理淋巴结除外,其在最短轴上测量)。当基线存在超过一个可测量的病灶时,代表所有受累器官的最多总共五个病灶(每个器官最多两个病灶)的所有病灶都应被鉴定为目标病灶。目标病灶是根据其大小来选择的(具有最长直径的病灶)。计算所有目标病灶的直径总和并将其报告为基线总直径。
[0456]
包括病理淋巴结在内的所有其他病灶(或疾病部位)被确定为非目标病灶,并且也在基线记录。不需要测量,并且这些病灶被跟踪为“存在”、“不存在”或“明确进展”。
[0457]
疾病反应(完全反应(cr)、部分反应(pr)、稳定疾病(sd)和进展性疾病(pd))按如下所述进行评估。
[0458]
疾病反应测量允许计算总体疾病控制率(dcr)(包括cr、pr和sd)、客观反应率(orr)(包括cr和pr)、无进展生存期(pfs)和进展时间(ttp)。
[0459]
实体瘤中的反应评估标准(recist)指南
[0460]
根据recist1.1的总体反应来自基于肿瘤负荷的时间点反应评估,如下所示。
[0461]
靶病灶的评估:
[0462]
·
完全反应(cr):所有目标病灶消失。任何病理淋巴结(无论是目标还是非目标)的短轴都必须减少到《10mm。
[0463]
·
部分反应(pr):以基线总直径为参考,目标病灶的直径总和至少减少30%。
[0464]
·
进展性疾病(pd):以研究中的最小总和为参考,目标病灶的直径总和至少增加20%(如果基线总和在研究中最小,则这包括基线总和)。除了20%的相对增加外,总和还必须证明至少5毫米的绝对增加。(注意:一个或多个新病灶的出现也被认为是进展)。
[0465]
·
稳定疾病(sd):以研究时的最小总直径作为参考,既没有足够的收缩来满足pr的要求,也没有足够的增加来满足pd的要求。
[0466]
非目标病灶的评估:
[0467]
·
完全反应(cr):所有非目标病灶消失和肿瘤标志物水平的正常化。所有淋巴结的大小必须是非病理性的(《10mm短轴)。
[0468]
·
非cr/非pd:一个或多个非目标病灶的持续存在和/或肿瘤标志物水平维持在正常范围之上。
[0469]
·
进展性疾病(pd):现有非目标病灶的明确进展。(注意:一个或多个新病灶的出
现也被认为是进展)。
[0470]
ecog表现状态*
[0471][0472][0473]
·
发表于am j clin oncol:
[0474]
·
oken mm,creech rh,tormey dc等人toxicity and response criteria of the eastern cooperative oncology group.am j clin oncol.1982;5:649-655
[0475]
实施例2:抗半乳糖凝集素-9抗体稳定性研究
[0476]
候选igg4抗体在几种不同条件和不同浓度下储存后进行稳定性分析。使用tosoh tskgel super sw mab柱通过尺寸排阻色谱(sec)进行稳定性分析。比较储存前后的sec曲线,以鉴定蛋白质稳定性的任何问题(例如,聚集或降解)。
[0477]
材料和方法
[0478]
样品制备
[0479]
抗半乳糖凝集素-9抗体在使用前储存在-80℃。在分析之前,将样品在室温水浴中解冻并储存在冰上直至分析。在处理之前,使用nanodrop测量280nm处的吸光度。使用tbs(20mm tris ph8.0,150mm nacl)对仪器进行空白处理。然后将样品转移到聚丙烯微量离心管(usa scientific,1615-5500)中,并在4℃、16.1k x g下离心30分钟。通过0.22μm过滤器(millipore;slgv004sl)过滤样品。测量过滤后吸光度。
[0480]
hplc分析
[0481]
测试的样品条件包括:环境稳定性(室温下0小时,室温下8小时)、冷藏稳定性(4℃下0小时、4℃下8小时、4℃下24小时)和冷冻/解冻稳定性(1次冷冻/解冻,3次冷冻/解冻,5次冷冻/解冻)。每个条件以三种不同的浓度重复运行:原液、10倍稀释和100倍稀释。每种条件制备一百μl样品并储存在聚丙烯微量离心管中。必要时在tbs中制备稀释液。分析前读取280nm处的吸光度。室温样品在工作台上储存指定的时间。将4℃样品储存在冰上或4℃冰箱中,时间如表3所示。冻融样品在液氮中速冻,然后在室温水浴中解冻。冻融过程进行一次、
三或五次,然后将样品储存在4℃直至分析。
[0482]
sec分析是使用tosoh tskgel supersw mab hr柱在具有uv检测器的shimadzu hplc上进行的(在280nm)。将25μl样品装入色谱柱并以0.5ml/min运行40分钟。kbi缓冲液制剂用作流动相。
[0483]
结果
[0484]
使用紫外吸光度测量确定抗体浓度(过滤前和后),如表3所示。kbi提供的两个2ml样品被解冻,一个小瓶用于室温和冷冻/解冻条件,另一个小瓶用于4℃条件。吸光度读数显示过滤后几乎完全恢复。
[0485]
表3.样品制备后的蛋白质回收率
[0486][0487]
观察到比主峰更早洗脱的两个或三个高分子量峰(图1)。在所测定的每种条件下,这些峰约占总样品的5%(表4)。在所有测定条件下均未观察到蛋白质浓度的显著差异。
[0488]
表4.稳定性结果
[0489]
[0490][0491]
总之,抗半乳糖凝集素-9抗体在所有分析条件下储存后均表现出一致的稳定性,如sec曲线没有显著变化所示。过滤后没有明显的蛋白质损失,并鉴定出两到三个高分子量峰,约占总样品的5%。结果表明抗体在所有测试条件下都是稳定的,没有观察到聚集体形成或降解。
[0492]
实施例3.源自肿瘤活检的类器官级分中半乳糖凝集素-9表达的评估
[0493]
肿瘤类器官可用于预测患者结局,因为使用与原始肿瘤具有相似特征的肿瘤模型可导致更准确地预测患者的药物反应。(参见,例如,trends in biotechnology;volume 36,issue 4,p358-371,april 01,2018)。
[0494]
肿瘤中的半乳糖凝集素-9水平可作为预测药物反应的指标。源自活检的类器官可用作评估原始肿瘤中半乳糖凝集素-9水平的代理。因此,测试了评估单细胞或类器官级分中半乳糖凝集素-9水平的能力。
[0495]
从代表性的胰腺癌和结直肠癌接收活检并如下处理。人手术切除的肿瘤样品新鲜接收在冰上的dmem培养基中,并在10cm的培养皿中切碎。将切碎的肿瘤重新悬浮在含有100u/ml iv型胶原酶的dmem+10%fbs中以获得球体。将部分消化的样品沉淀,然后重新悬浮在新鲜的dmem+10%fbs中,并在100mm和40mm过滤器上过滤以生成s1(》100mm)、s2(40-100mm)和s3(《40mm)球体级分,随后将其保存在超低附着组织培养板中。
[0496]
s2级分用胰蛋白酶消化15分钟以生成单个细胞。对于流式细胞术制备,将s2和s3
级分的细胞沉淀重新悬浮,并在fc受体阻断(#422301;biolegend,san diego,ca)后通过将细胞与针对人cd45(hi30)、cd3(ucht1)、cd11b(m1/70)、epcam(9c4)和gal9(9m1-3;均来自biolegend)或g9.2-17的gal9 fab或fab同工型的荧光偶联mab一起孵育来进行细胞标记。使用僵尸黄(biolegend)将死细胞排除在分析之外。流式细胞术在attune nxt流式细胞仪(thermo scientific)上进行。使用flowjo v.10.1(treestar,ashland,or)分析数据。
[0497]
结果显示在图2a-2f、3a-3f和4a-4f中,表明在s2单细胞和s3类器官级分中由gal 9 g9.2-17 fab检测到的半乳糖凝集素-9水平相关。因此,s2单细胞和s3类器官均可用于评估源自肿瘤活检的类器官中的半乳糖凝集素-9水平。
[0498]
实施例4.用于细胞分析的患者来源的器官型肿瘤球体(pdot)的制备
[0499]
活检来源的类器官可以作为一种有用的措施来评估治疗剂刺激免疫反应的能力。因此,用抗半乳糖凝集素-9抗体g9.2-17处理上述实施例3中描述的用于离体培养的s2级分并制备用于免疫分析。
[0500]
在加入10
×
pbs和酚红并使用naoh调节ph值后,将s2级分的等分试样沉淀并以2.5mg/ml的浓度重新悬浮在i型大鼠尾胶原(corning)中。使用panpeha whatman纸(sigma-aldrich)确认ph值为7.0-7.5。然后将球体-胶原混合物注射到如jenkins等人,cancer discov.2018 feb;8(2):196-215;ex vivo profiling of pd-1 blockade using organotypic tumor spheroids(其内容通过引用整体并入本文)所述的3-d微流体培养装置的中心凝胶区域。在37℃下30分钟后,含有源自患者的器官型肿瘤球体(pdots)的胶原水凝胶与含有或不含抗半乳糖凝集素-9单克隆抗体g9.2-17的培养基水合。然后将pdots在37℃下培养3天。
[0501]
将细胞沉淀物重新悬浮在facs缓冲液中,将1x106个细胞首先用僵尸黄(biolegend)染色以排除死细胞。在活力染色后,将细胞与抗cd16/cd32 mab(ebiosciences,san diego,ca)一起孵育以阻断fcγriii/ii,然后用1μg荧光偶联的细胞外mab进行抗体染色。使用固定/透化溶液试剂盒(ebiosciences)对细胞因子和转录因子进行细胞内染色。有用的人流式细胞术抗体包括cd45(hi30)、cd3(ucht1)、cd4(a161a1)、cd8(hit8a)、cd44(bj18)、tnfα(mab11)、ifnγ(4s.b3)和epcam(9c4);均来自biolegend。流式细胞术在lsr-ii流式细胞仪(bd biosciences)上进行。使用flowjo v.10.1(treestar,ashland,or)分析数据。
[0502]
实施例5.癌症患者的血浆和血清中半乳糖凝集素-9水平的评估
[0503]
在患者样品中评估血浆和血清半乳糖凝集素-9水平,并与健康志愿者进行比较。从10名健康对照者和10名不能手术的癌症患者的外周静脉途径中抽取血液(10ml)。从每个血液样品中提取血清和血浆。在标准edta管中收集血液;基本上根据制造商的说明使用picokine
tm
elisa目录号:ek1113。单个值的结果列于表5和表6中。
[0504]
表5.患者样品
[0505]
[0506][0507]
表6健康志愿者样品
[0508]
样品编号血清血浆对照1536.4611.97对照2476.43592.58对照3612.66651.43对照4269.75414.41co对照ntrol 5460.26602.28对照6206.66405.8对照7385.88439.85对照8525.283654.2对照9711.047718.68对照10296.85349.09平均448.122544.029
[0509]
实施例6.使用免疫组织化学分析的半乳糖凝集素-9表达和定位的评估
[0510]
使用石蜡包埋活检来源的肿瘤样品评估使用免疫组织化学分析确定肿瘤中半乳糖凝集素-9表达水平的能力。
[0511]
简而言之,将载玻片脱蜡(二甲苯:2x 3分钟;无水酒精:2x 3分钟,甲醇:1x 3分钟)并在冷自来水中冲洗。对于抗原修复,柠檬酸盐缓冲液(ph6)在水浴中预热至100℃,并将载玻片在柠檬酸盐缓冲液中孵育5分钟。将载玻片在室温下冷却约10分钟,然后放入流水中。在pbs中清洗载玻片,在切片周围画一个纸笔圆圈,并将切片在封闭缓冲液(dako-过氧化物酶封闭溶液-s2023)中孵育5分钟。加入无血清阻断剂(novocastra无血清蛋白阻断剂),然后用pbs冲洗掉。一抗(sigma,抗半乳糖凝集素-9克隆1g3)在dako-s2022稀释剂中以1:2000稀释使用,切片在4℃下孵育过夜。用pbs洗涤载玻片,然后在室温下用二抗(抗小鼠)
孵育45分钟。将载玻片洗涤并用abc vector stain染色(45分钟),用pbs洗涤,用dab(1ml稳定dab缓冲液+1滴dab)染色5分钟,然后在流水中洗涤。添加苏木精1分钟,然后应用70%etoh+1%hcl以避免过度染色。将载玻片在流水中放置2-3分钟,然后浸入水中,然后浸入无水酒精中,然后浸入二甲苯中,各自2次30秒。捕获盖玻片和图像。化疗治疗的结直肠癌和结直肠癌的肝转移中的半乳糖凝集素-9染色如图5a和5b所示。半乳糖凝集素-9阴性胆管癌的结果如图5c所示。
[0512]
实施例7.抗半乳糖凝集素-9抗体g9.2-17与其他半乳糖凝集素的交叉反应
[0513]
为了评估抗体特异性和与其他半乳糖凝集素的交叉反应性,我们测试了抗半乳糖凝集素-9抗体g9.2-17与由半乳糖凝集素家族所有成员组成的人蛋白质组学阵列的结合,并测试两个工作浓度。使用cdi的huprot人蛋白质组微阵列(人蛋白质组的约75%)评估抗体特异性。微阵列与一抗一起孵育、冲洗、与荧光标记的二抗一起孵育,随后分析对于每个靶蛋白检测到的荧光量。结果编译为微阵列图像。结果表明,抗半乳糖凝集素-9抗体g9.2-17对半乳糖凝集素-9具有高度特异性,并且不与任何其他半乳糖凝集素家族成员发生交叉反应。
[0514]
实施例7.抗半乳糖凝集素-9抗体保护t细胞避免半乳糖凝集素-9介导的细胞凋亡
[0515]
为了研究抗半乳糖凝集素-9抗体g9.2-17的作用,进行了细胞凋亡测定以确定t细胞是否因细胞凋亡过程或其他机制而死亡。
[0516]
简而言之,将molm-13(人白血病)细胞在补充有10%fbs、2mm l-谷氨酰胺、10mm hepes、1mm丙酮酸钠、4.5g/l葡萄糖和1.5g/l碳酸氢钠的rpmi培养基中在37℃、5%co2下培养。然后将细胞转移到无血清rpmi培养基中,并以2.5e6个细胞/ml的浓度悬浮在无血清培养基中。将细胞以2e5个细胞/孔的密度(每孔80μl细胞悬液)接种到组织培养级96孔板的孔中。将单克隆抗半乳糖凝集素-9抗体或匹配的同工型添加到每个孔中,并在37℃、5%co2下孵育30分钟。孵育后,加入重组全长人半乳糖凝集素-9(r&d systems 2045-ga,在pbs中稀释)至终浓度为200nm。细胞在37℃、5%co2下孵育16小时。然后在通过流式细胞术分析之前用膜联蛋白v-488和碘化丙啶(pi)染色细胞。每个条件一式三份进行。pi对活细胞和凋亡细胞是不可渗透的,但会用红色荧光染色死细胞,与细胞中的核酸紧密结合。在缓冲液中用alexa488膜联蛋白v和pi对细胞群进行染色后,凋亡细胞显示绿色荧光,死细胞显示红色和绿色荧光,活细胞显示很少或没有荧光。使用具有用于激发的488nm氩离子激光线的流式细胞仪区分细胞。然后在flowjo软件上进行分析。膜联蛋白v和碘化丙啶(pi)阳性细胞的级分被绘制为图6中使用的抗体浓度的函数。如图6所示,用抗gal 9抗体处理的凋亡t细胞的水平与用人igg4同工型对照抗体处理的t细胞相比低得多,表明抗半乳糖凝集素-9抗体g9.2-17保护t细胞避免半乳糖凝集素-9介导的细胞凋亡。
[0517]
实施例8:单独或与检查点抑制剂组合的gal-9抗体在胰腺癌的小鼠模型中的评估和用g9.2-17 migg1处理的小鼠的肿瘤质量和免疫特征谱
[0518]
在胰腺癌小鼠模型中评估了g9.2-17 migg1对肿瘤重量和免疫特征谱的影响。对8周大的c57bl/6雄性(jackson laboratory,bar harbor,me)小鼠施用胰腺内注射的来源于pdx1cre;krasg12d;trp53r172h(kpc)小鼠的fc1242 pda细胞(zambirinis cp等人,tlr9 ligation in pancreatic stellate cells promotes tumorigenesis.j exp med.2015;212:2077-94)。将肿瘤细胞悬浮在含有50%matrigel(bd biosciences,franklin lakes,
nj)的pbs中,并通过剖腹手术将1x105个肿瘤细胞注射到胰腺体内。小鼠(n=10/组)接受一次治疗前剂量(i.p.),随后接受3剂(q.w.)的商业αgalectin 9 mab(rg9-1,200ug,bioxcell,lebanon,nh)或g9.2-17 migg1(200μg)或配对的同工型,g9.2-iso或大鼠igg2a(ltf-2,bioxcell,lebanon,nh)(200μg)(每周一剂,持续三周)。3周后处死小鼠,收获肿瘤用于流式细胞术分析。按照常规实践处理和制备组织并进行流式细胞术分析。参见例如美国专利号10,450,374。
[0519]
单独或与αpd1 mab组合的g9.2-17 migg2a治疗的小鼠的肿瘤质量和免疫特征谱
[0520]
g9.2-17 migg2a对肿瘤重量和免疫特征谱的影响在胰腺癌小鼠模型中进行评估(单独地或与免疫疗法组合)。对8周大的c57bl/6雄性小鼠(jackson laboratory,bar harbor,me)施用胰腺内注射的来源于pdx1cre;krasg12d;trp53r172h(kpc)小鼠的fc1242 pda细胞。将肿瘤细胞悬浮在含有50%matrigel(bd biosciences,franklin lakes,nj)的pbs中,并通过剖腹手术将1x105个肿瘤细胞注射到胰腺体内。小鼠接受一次治疗前剂量(i.p.),随后接受3剂(q.w.)的单独或组合的g9.2-17 migg2a(200μg)或中和αpd-1mab(29f.1a12,200μg,bioxcell,lebanon,nh)或配对的同工型(ltf-2和c1.18.4,bioxcell,lebanon,nh),如所示的。在第26天处死小鼠并收获肿瘤用于分析。按照常规实践处理和制备组织并进行流式细胞术分析。参见,例如,us10,450,374。每个点代表一只小鼠;*p《0.05;**p《0.01;***p《0.001;****p《0.0001;通过未配对的学生t检验。这些结果表明,使用g9.2-17migg2a的单药治疗在两个剂量水平下均减少了肿瘤生长,而单独的抗pd-1对肿瘤大小没有影响。图7。
[0521]
实施例9:在免疫活性小鼠的结直肠癌和黑色素瘤的两种同基因模型中评估抗gal-9抗体
[0522]
gal-9抗体g9.2-17和g9.1-8m13在免疫活性小鼠的结直肠癌和黑色素瘤同基因模型中进行评估。这两种抗体的结构在本文中提供或在pct/us2020/024767中公开,其相关公开内容为了本文引用的主题和目的通过引用并入本文中。在研究期间每周配制和准备测试物品。
[0523]
实验设计
[0524]
研究前动物(雌性c57bl/6,6-8周龄(charles river labs)适应环境3天,然后单侧皮下植入重新悬浮在100μlpbs中的5e5 b16.f10(黑色素瘤细胞系)或mc38细胞(结直肠癌细胞系)到左侧腹。从植入后2-3天开始,记录每个实验的研究前肿瘤体积。当肿瘤达到50-100mm3(优选50-75mm3)的平均肿瘤体积时,动物按肿瘤体积匹配到治疗组或对照组以用于给药并在第0天开始给药。表7和表8总结了用于测试抗-gal9 igg1和抗-gal9 igg2的研究设计。
[0525]
表7.抗gal9 igg1(b16f10和mc38)
[0526]
[0527][0528]
表8.抗gal9 igg2(b16f10和mc38)
[0529]
[0530][0531]
每周获取三次肿瘤体积。在研究达到终点的那天获取最终的肿瘤体积。如果发现动物垂死,则获取最终肿瘤体积。动物每周称重三次。在研究达到终点的当天或如果发现动物垂死,则称取最终重量。与第0天相比体重减轻≥10%的动物随意提供在持续7天的时间内表现出》20%的净体重减轻的任何动物,或者如果小鼠表现出》30%的净体重减轻(与第0天相比),则被认为垂死并被安乐死。研究终点设定在对照组(未经审查)的平均肿瘤体积达到1500mm3时。如果这发生在第28天之前,则对治疗组和个体小鼠给药用并测量直至第28天。如果到第28天对照组(未经审查)的平均肿瘤体积未达到1500mm3,则所有动物的终点是在对照组(未经审查)的平均肿瘤体积达到1500mm3直到60天的最大值时。从每组的所有动物收集血液。对于血液收集,在异氟醚吸入诱导的深度麻醉下,通过心脏穿刺将尽可能多的血液收集到k2edta管(400μl)和血清分离管(剩余的)中。收集到k2edta管中的血液放置在湿冰上,直到用于执行免疫面板流(immune panel flow)。
[0532]
允许收集到血清分离管中的血液在室温下凝结至少15分钟。样品在室温下以3500离心10分钟。将所得血清分离,转移到独特标记的透明聚丙烯管中,并立即在干冰上冷冻或在设置为-80℃的冰箱中冷冻,直到运送用于桥接ada测定(一周内运送)。
[0533]
如下收集所有动物的肿瘤。尺寸小于400mm3的肿瘤被速冻,置于干冰上,并储存在-80℃直至用于rt-qpcr分析。对于400-500mm3大小的肿瘤,将整个肿瘤收集到macs培养基中以用于flow panel。对于大于500mm3的肿瘤,将一小块(约50mm3)置于干冰上速冻,并在-80℃下储存以用于rt-qpcr,并将剩余的肿瘤收集在macs培养基中用于流式细胞术。对于流式细胞术,肿瘤被放置在macs培养基中并储存在湿冰上直到处理。
[0534]
所有动物的脾脏、肝脏、结肠、肺、心脏和肾脏在10%中性缓冲福尔马林(nbf)中保留18-24小时,转移到70%乙醇中并在室温下储存。将福尔马林固定的样品石蜡包埋。
[0535]
实施例10:在胆管癌模型中评估gal-9抗体
[0536]
如s.rizvi等人(yap-associated chromosomal instability and cholangiocarcinoma in mice,oncotarget,9(2018)5892-5905)(其内容通过引用整体并入本文)所述,在胆管癌小鼠模型中评估gal-9抗体的功效。在这种转导模型中,其中癌基因(akt/yap)直接注入胆管树,肿瘤起源于具有物种匹配肿瘤微环境的免疫活性宿主的胆管。
给药描述在表9中。
[0537]
表9.给药
[0538][0539][0540]
简而言之,收获鼠cca细胞(在s.rizvi等人中描述)并在dmem中洗涤。来自jackson labs的雄性c57bl/6小鼠使用1.5-3%异氟醚麻醉。在深度麻醉下,通过剑突下方1厘米的切口打开腹腔。无菌棉尖涂抹器用于暴露肝内叶的上外侧。使用27号针头,将含有1
×
10^6个细胞的40μl标准培养基注入内叶的侧面。棉尖涂抹器固定在注射部位,以防止细胞渗漏和失血。随后,腹壁和皮肤用可吸收的铬3-0肠线缝合材料缝合在隔离层中。
[0541]
植入后两周,将动物按肿瘤体积匹配到治疗组或对照组中以用于给药并在第0天开始给药。测量肿瘤体积并称重动物(每周3次)。在研究达到终点的那天(4周或当对照的肿
瘤负荷变为1500mm3时)测量最终的肿瘤体积和重量。从每组的所有动物收集血液。
[0542]
实施例11:抗gal9抗体g9.2-17的体外和体内表征
[0543]
如下所公开的进行体内和体外药效学和药理学研究以及安全药理学。体内研究使用用于小鼠研究的igg1形式的抗半乳糖凝集素-9mab g9.2-17进行,其基于这样一个事实,即该抗体被开发为具有与g9.2-17完全相同的vh和v
l
链,因此具有完全相同的结合表位和相同的交叉反应特征谱以及跨物种的结合亲和力和与g9.2-17相同的功能特征谱。
[0544]
体外研究
[0545]
g9.2-17具有多物种交叉反应性(人、小鼠、大鼠、食蟹猴),在体外评估时具有等效的《1nmol结合亲和力。参见,例如,pct/us2020/024767,其相关公开内容为了本文引用的主题和目的以引用方式并入本文中。g9.2-17不与半乳糖凝集素-9蛋白的crd1结构域交叉反应。它具有出色的稳定性和纯化特性,并且与灵长类动物中存在的任何其他半乳糖凝集素蛋白没有交叉反应。
[0546]
下表10总结了体外药理学研究的结果。
[0547]
表10.体外主要药效学
[0548]
[0549]
[0550]
[0551]
[0552]
[0553]
[0554][0555]
了解作用机制的研究包括adcc/adcp(抗体依赖性细胞介导的细胞毒性/抗体依赖性细胞吞噬作用)和阻断功能评估。如对人igg4 mab所预期的,g9.2-17不介导adcc或adcp(图8a)。这是针对g9.2-17的igg1人对应物进行测试的,其作为阳性对照,如预期的那样介导adcc和adcp(图8b)。
[0556]
此外,在竞争结合elisa测定中评估了g9.2-17的阻断功能。g9.2-17有效阻断半乳糖凝集素-9crd2结构域与其结合伴侣cd206人重组蛋白的结合,证实了g9.2-17的预期作用模式,即阻断半乳糖凝集素-9活性。此外,我们优化了molm-13 t细胞凋亡测定,其中g9.2-17有效地将细胞从由半乳糖凝集素-9蛋白处理引起的细胞凋亡中拯救出来(用半乳糖凝集素-9处理约50%的细胞凋亡,用半乳糖凝集素-9+g9.2-17处理约10%的细胞凋亡)。
[0557]
已经进行了进一步广泛的体外表征以比较g9.2-17与小鼠igg1 g9.2-17 mab的结合和功能特征,后者包含与g9.2-17完全相同的cdr结构域,因此具有相同的结合表位,即crd2半乳糖凝集素-9结构域。migg1 g9.2-17被开发用于小鼠同基因药理学功效研究,以避免与g9.2-17本身的免疫原性的任何潜在发生。migg1 g9.2-17具有等效的《1nmol跨物种亲和力,以及相同的与人癌细胞系crl-2134的基于细胞的结合亲和力。migg1 g9.2-17在molm-13 t细胞凋亡测定中产生的数据与g9.2-17本身等同。
[0558]
体内药理学
[0559]
体内测定包括同基因小鼠模型,使用小鼠mab-g9.2-17结合表位克隆到igg1小鼠骨架(用于动物功效研究的g9.2-17替代mab)进行,其共有g9.2-17的交叉反应性和结合亲和力特征。
[0560]
测试的同基因小鼠模型是:
[0561]
·
原位胰腺癌(kpc)小鼠模型(单一药剂和与抗pd-1组合):肿瘤体积评估和流式
细胞术;
[0562]
·
皮下黑色素瘤b16f10模型(单一药剂和与抗pd-1组合):肿瘤体积评估和流式细胞术。
[0563]
·
皮下mc38模型(单一药剂和与抗pd-1组合):肿瘤体积评估
[0564]
此外,用g9.2-17处理的患者来源的体外肿瘤培养物(类器官)将用于探索g9.2-17的作用机制。
[0565]
从机制上讲,发现g9.2-17具有阻断活性而不是adcc/adcp活性。观察到半乳糖凝集素-9与其结合受体(例如免疫抑制巨噬细胞上的cd206)的相互作用的阻断。在功能上,体内研究表明,在用g9.2-17 migg1替代抗体治疗的多个同基因模型(原位胰腺kpc肿瘤生长和皮下黑色素瘤b16f10模型)中,肿瘤生长减少。在用单药抗半乳糖凝集素-9mab和与抗pd-1组合治疗的小鼠肿瘤中,g9.2-17重新激活效应t细胞并降低免疫抑制细胞因子的水平。与抗pd-1mab的组合研究表明,效应t细胞的肿瘤内存在更高,支持组合方法的临床测试。重要的是,g9.2-17的机制效应已在患者来源的肿瘤培养物中得到研究和证明(jenkins等人,2018年)(从pdac、crc、cca、hcc的原发和转移部位切除肿瘤),其中g9.2-17诱导可重复且稳健的t细胞重新激活,表明逆转了半乳糖凝集素-9强加的肿瘤内免疫抑制(离体)。
[0566]
为了评估组合抗pd-1和抗半乳糖凝集素-9mab的相关性,s.c.黑色素瘤b16模型用单药抗pd-1和抗半乳糖凝集素-9以及组合进行治疗。肿瘤内存在效应t细胞在组合臂中得到增强。
[0567]
与抗半乳糖凝集素-9migg1 200μg相比,在使用抗半乳糖凝集素-9migg1 200μg+抗pd-1的治疗中(p《0.01),以及与单独的抗pd-1相比,在抗半乳糖凝集素-9igg1 200μg+抗pd-1之间(p《0.001)观察到细胞毒性t细胞(cd8)水平的显著增加。这样的结果表明,抗gal 9抗体和抗pd-1抗体的组合有望达到优异的治疗效果。
[0568]
下表11总结了体内药理学研究的结果。
[0569]
表11.体内主要药效学
[0570]
[0571]
[0572][0573]
此外,对使用g9.2-17 igg1小鼠mab(又名g9.2-17 migg)、抗pd1抗体或g9.2-17 igg1小鼠mab和抗pd1抗体的组合治疗的肿瘤免疫反应在本文描述的b16f10皮下同基因模型中进行了研究。如图9a和图9b所示,g9.2-17和抗pd1组合在小鼠模型中在减少肿瘤体积和增加cd8+细胞方面显示出协同作用。图10a和10b显示g9.2-17抗体增加了瘤内t细胞中cd44和tnfα的表达。
[0574]
实施例12.伴随1周和3周给药后观察期的雄性sprague dawley大鼠中的非glp单剂量、测距静脉内毒性研究
[0575]
本研究评估了在对sprague dawley大鼠进行单次静脉推注施用,然后在第8天和第22天进行1周(终末)和3周(恢复)尸检后g9.2-17igg4的解剖学终点。所有动物均存活至预定的尸检。在本研究的终末或回收尸检动物中,没有与测试物品相关的宏观发现、器官重量变化或微观发现。
[0576]
这项非glp探索性、单剂量、测距(range finding)、静脉内毒性研究的目的是鉴定和表征g9.2-17 igg4对sprague dawley大鼠的急性毒性(在2分钟的静脉推注施用随后1周(终末)和3周(回收)给药后观察期)。
[0577]
该非glp单剂量毒性研究在24只sprague dawley雄性大鼠中进行,以确定g9.2-17 igg4的毒代动力学和潜在毒性。在第1天通过缓慢推注静脉内注射至少2分钟给动物施用媒介物或10mg/kg、30mg/kg或70mg/kg g9.2-17 igg4,随后是给药后1周(终末,第8天)或3周(回收,第22天)的时期。研究终点包括死亡率、临床观察、体重和食物消耗、临床病理学(血液学、凝血、临床化学和尿液分析)、毒代动力学参数、ada评估和解剖病理学(大体尸检、器官重量和组织病理学)。实验设计的总结在下表13中提供。
[0578]
表13.实验设计
[0579][0580]a在第8天终末尸检时对3只动物/性别/组实施安乐死;其余3只动物/性别/组在第
22天回收尸检时被安乐死。
[0581]b媒介物是制剂缓冲液(20mm tris,150mm nacl,ph 8.0
±
0.05)。
[0582]
在第8天或第22天对所有存活的动物进行尸检。进行完整的尸检并收集器官重量。在终末和回收时对所有动物的器官进行称重。对显微评估所需的组织进行修剪、常规处理、石蜡包埋以及用苏木精和伊红染色。
[0583]
在本研究过程中没有意外死亡。所有动物均存活至终末或回收尸检。注意到的组织学变化被认为是偶然的发现或与试验操作的某些方面有关,而不是测试物品的施用。在这些偶然组织改变的发生率、严重程度或组织学特征方面没有与测试物品相关的改变。在临床观察、体重、食物消耗、临床病理学或解剖病理学中没有注意到与g9.2-17 igg4相关的发现。总之,对sprague dawley大鼠进行10、30和70mg/kg g9.2-17 igg4的单次静脉内施用是可以耐受的,没有不良发现。因此,在本研究条件下,noel为70mg/kg。
[0584]
实施例13.使用3周给药后观察期的在食蟹猴中的g9.2-17 igg4的非glp单剂量、测距静脉输注毒性研究
[0585]
这项非glp单剂量毒性研究在8只食蟹猴中进行,以鉴定和表征g9.2-17 igg4的急性毒性。通过30分钟静脉内(iv)输注向动物(1只雄性[m]/1只雌性[f]/组)施用媒介物或30mg/kg、100mg/kg或200mg/kg g9.2-17 igg4,然后是3周的给药后观察期。研究终点包括:死亡率、临床观察、体重和定性食物消耗;临床病理学(血液学、凝血、临床化学、免疫分型和半乳糖凝集素-9在白细胞亚群上的表达,以及细胞因子分析);毒代动力学参数;用于可能的抗药抗体评估(ada)的血清收集;和可溶性半乳糖凝集素-9分析;和解剖病理学(大体尸检、器官重量和组织病理学)。
[0586]
在临床观察、体重、食物消耗、临床病理学(血液学、临床化学、凝血或细胞因子分析)、免疫分型、白细胞亚群上的半乳糖凝集素-9表达、可溶性半乳糖凝集素-9或解剖病理学上没有与g9.2-17 igg4相关的发现。
[0587]
总之,对食蟹猴进行30、100和200mg/kg g9.2-17 igg4的单次静脉输注施用是可以耐受的,没有不良发现。因此,在本研究条件下,未观察到不良反应水平(noael)为200mg/kg,这是评估的最高剂量水平。研究设计如表14所示。
[0588]
表14.实验设计
[0589]
[0590][0591]a第4组在第1组至第3组的施用后1周施用。
[0592][0593]a第4组在第1组至第3组的施用后1周施用。
[0594]
在研究期间,通过经皮放置在隐静脉中的导管通过静脉内输注持续30分钟施用一次媒介物和测试物品。剂量水平为30、100和200mg/kg,并以20ml/kg的剂量体积施用。对照组以与治疗组相同的方式接受媒介物。
[0595]
在给药期间将动物置于吊索约束装置中。媒介物或测试物品基于最近的体重并使用输液泵和无菌一次性注射器施用。给药注射器填充有适当体积的媒介物或测试物品(20ml/kg,额外2ml)。在给药完成时,将动物从输注系统中取出。在每次输注开始和结束之前记录每个给药注射器的重量以确定剂量责任。
[0596]
详细的临床观察
[0597]
将动物从笼子中取出,并在第1天在开始输注(soi)后1小时和4.5小时对每只动物进行详细的临床检查,然后在研究期间每天进行一次。将动物从笼子中取出,并在第1天在开始输注(soi)后1小时和4.5小时对每只动物进行详细的临床检查,然后在研究期间每天进行一次。在转移时、随机化前、第-1天和研究期间每周测量并记录所有动物的体重。
[0598]
在所有动物预测试时和在第1天(给药前)、第3、8和21天进行临床病理学评估(血液学、凝血和临床化学)。用于测定血液学参数和外周血淋巴细胞和细胞因子分析样品的额外样品在soi后30分钟(输注结束后立即)和4.5、8.5、24.5和72.5小时(相对于第1天)收集。
收集并保存骨髓涂片。
[0599]
通过股静脉从所有动物采集血样(约0.5ml),用于测定测试物品的血清浓度(见表15)(对于偏差,见附录1)。动物在血液采集前不禁食,例外情况是与用于临床病理学采集的禁食一致的间隔。
[0600]
表15.生物分析样品采集时间表
[0601][0602]
x=收集样品。
[0603]a:仅对来自第1组动物的soi后0.583小时时间点进行分析测试物品内容。额外的时间点可以根据研究主任的判断进行分析
[0604]
为了进行处理,将血样收集在无添加剂无障碍微管中,并在收集后1小时内在受控室温下离心。将所得血清下分成2个大致相等的等分试样于预先标记的冷冻管中。在收集的2小时内将所有等分试样冷冻储存在-60℃至-90℃。
[0605]
在预定的尸检时对所有被安乐死的动物进行死后研究评估。
[0606]
尸检是在兽医病理学家批准的程序下进行的。仔细检查动物的外部异常,包括可触及的肿块。从腹侧中线切口反射皮肤,并识别任何皮下肿块并与死前发现相关联。检查腹腔、胸腔和颅腔是否有异常。取出器官,进行检查,并在需要时置于固定液中。除了眼睛(包括视神经)和睾丸外,所有指定的组织都固定在中性缓冲福尔马林(nbf)中。眼睛(包括视神经)和睾丸被放置在改良的戴维森固定液中,然后在最终放置在nbf中之前转移到70%乙醇中持续最多三天。福尔马林通过气管注入肺部。从所有动物收集完整的组织和器官。
[0607]
在预定的尸检时记录所有动物的体重和方案指定的器官重量,并计算适当的器官重量比(相对于体重和脑重量)。成对的器官一起称重。收集甲状腺和甲状旁腺的联合重量。
[0608]
结果
[0609]
所有动物都在第22天的预定尸检中存活。在处理的动物中没有注意到与测试物品相关的临床或兽医观察。在处理或回收期间,在处理动物中未观察到与测试物品相关的体重影响。在任何时间间隔的任何剂量水平下,对任何性别的血液学终点都没有g9.2-17 igg4相关的影响。
[0610]
在任何时间间隔的任何剂量水平下g9.2-17 igg4对凝血时间(即活化部分凝血活酶时间[aptt]和凝血酶原时间)或纤维蛋白原浓度都没有影响。个体凝血值之间的所有波动都被认为是偶发的,与生物学和手术相关的变化一致,和/或在幅度上可以忽略不计,并且与g9.2-17 igg4施用无关。
[0611]
在任何时间间隔的任何剂量水平下,对任何性别的临床化学终点都没有g9.2-17 igg4相关的影响。个体临床化学值之间的所有波动都被认为是偶发的,与生物学和手术相
关的变化一致,和/或在幅度上可以忽略不计,并且与g9.2-17 igg4施用无关。
[0612]
在任何时间间隔的任何剂量水平下,对任何性别的细胞因子终点都没有g9.2-17 igg4相关的影响。个体细胞因子值之间的所有波动都被认为是偶发的,与生物学和手术相关的变化一致,和/或在幅度上可以忽略不计,并且与g9.2-17 igg4施用无关。
[0613]
对大体尸体剖检观察的回顾显示没有被认为与测试物品相关的发现。没有被认为与测试物品相关的器官重量变化。没有与测试物品相关的变化。
[0614]
总之,对食蟹猴进行30、100和200mg/kg g9.2-17 igg4的单次静脉输注施用是可以耐受的,没有不良发现。因此,在本研究条件下,未观察到不良反应水平(noael)为200mg/kg,这是评估的最高剂量水平。
[0615]
将动物从笼子中取出,并在第1天开始输注(soi)后1小时和4.5小时对每只动物进行详细的临床检查,然后在研究期间每天进行一次。
[0616]
实施例12:食蟹猴中g9.2-17的静脉输注研究
[0617]
本研究的目的是进一步表征在食蟹猴中测试物品g9.2-17(与半乳糖凝集素-9结合的higg4单克隆抗体)的毒性和毒代动力学特征(在每周一次的30分钟的静脉(iv)输注持续5周后),并评估3周恢复期后任何观察到的变化的可逆性、进展或延迟出现。
[0618]
实验设计
[0619]
表12总结了研究设计。
[0620]
表12.实验设计
[0621][0622][0623]a基于最近的实际体重测量结果。
[0624]
研究中使用的动物(食蟹猴)通过标准、按体重、随机化程序(旨在实现相似组平均体重)分配到研究组。雄性和雌性分别随机化。分配给研究的动物的体重在每个性别平均体重的
±
20%以内。
[0625]
将缺乏g9.2-17(“媒介物”)或包含g9.2-17(“测试物品”)的制剂在研究期间每周一次通过30分钟静脉输注施用至动物,持续5周(第1、8、15、22和29天)。剂量水平为0、100和
300mg/kg/剂量并以10ml/kg的剂量体积施用。对照动物组以与治疗组相同的方式接受媒介物。剂量通过经皮放置的导管经大隐静脉施用,每次施用使用新的无菌一次性注射器。在毒代动力学样品收集日(第1、15和29天)在给药前和给药结束时测量并记录剂量责任,以确保施用
±
10%的目标剂量。个体剂量基于最近的体重。标记最后一次给药部位用于在末期和恢复尸检时收集。所有剂量均在测试物品制备的8小时内施用。
[0626]
对动物进行了生活程序、观察和测量,如下所示。
[0627]
对所有动物进行心电图检查。在记录心电图(ecg)之前,尽可能小心避免引起动物过度兴奋,以尽量减少这些测量中的极端波动或伪影。以50mm/sec记录标准ecg(10导联)。使用合适的导联,测量rr、pr和qt间期以及qrs持续时间并确定心率。使用基于bazett(1920)描述的方法的程序计算校正的qt(qtc)间期。所有追踪均由咨询兽医心脏病专家评估和报告。
[0628]
为了提高连续性和可靠性,功能观察组(fob)评估由两个独立的评估者针对所有场合进行,由详细的家笼和开放区域神经行为评估(gauvin和baird,2008年)组成。每个技术人员就每个家笼和笼外观察评分对猴子独立评分(不相互分享结果),然后在测试完成后评估个体评分与他们的合作伙伴的评分是否一致。对每只动物给药前(在第-9天或第8天)进行fob评估以建立基线差异,并在第1天和第15天输注开始起2至4小时,以及在终末和恢复尸检之前进行fob评估。观察包括但不限于评估活动水平、姿势、流泪、流涎、震颤、抽搐、自发收缩、刻板行为、面部肌肉运动、眼睑闭合、瞳孔反应、对刺激(视觉、听觉和食物)的反应、体温、chaddock和babinski反射、本体感觉、轻瘫、共济失调、测距不准和坡度评估、运动和步态。
[0629]
测量并记录每只动物的血压,包括收缩压、舒张压和平均动脉压。使用具有20mmhg内的平均动脉压(map)的三个读数报告血压测量值。
[0630]
每个动物/收集间隔通过按照测试设施sop目测评估测量和记录每只动物的呼吸频率3次。3次收集的平均值是报告值。
[0631]
以预定的时间间隔对所有动物进行临床病理学评估(例如,免疫分型和细胞因子评估)。收集并保存骨髓涂片。通过股静脉从所有动物采集血样(约0.5ml)用于测定测试物品的血清浓度。动物在血液采集前不禁食,例外情况是与临床病理学采集的禁食一致的间隔。在研究结束时(第36天或第50天),将动物安乐死并收集用于组织学处理和显微镜评估的组织。
[0632]
可溶性半乳糖凝集素-9如下评价。在给药前和在第1、8、15和29天开始输注起24小时以及在终末期和/或恢复尸检之前,通过股静脉从所有动物采集血样(约1ml),用于测定血清的可溶性半乳糖凝集素9。动物在血液采集前不禁食,例外情况是与临床病理学采集的禁食一致的间隔。
[0633]
可溶性半乳糖凝集素-9样品如下处理。将血样收集在无添加剂、无障碍管中,允许其在环境温度下凝结,并在环境温度下离心。将所得血清分成2个等分试样(在等分试样1中100μl,剩余在等分试样2中)于预先标记的冷冻管中。所有等分试样在收集后2小时内在干冰上快速冷冻,并在-60℃至90℃下冷冻储存。
[0634]
报告的表格中显示的所有结果都是使用非四舍五入的值根据原始数据四舍五入程序计算得出的,并且可能无法从所提供的个体数据中准确再现。
[0635]
结果
[0636]
·
死亡率
[0637]
所有动物都在第36天的预定终末尸检和第50天的恢复尸检中存活下来。
[0638]
·
详细的临床和兽医观察
[0639]
在治疗或恢复期间,在治疗的动物中没有注意到与测试物品相关的临床或兽医观察。
[0640]
·
功能观察组
[0641]
在治疗或恢复期间,在治疗的动物中没有注意到与测试物品相关的fob观察结果。
[0642]
·
体重和体重增加
[0643]
在治疗或恢复期间,在治疗的动物中没有注意到与测试物品相关的体重和体重增加的影响。
[0644]
·
眼科检查
[0645]
在治疗或恢复期间,在治疗的动物中没有注意到与测试物品相关的眼科检查中的影响。
[0646]
·
血压值
[0647]
在治疗或恢复期间,在治疗的动物中没有注意到与测试物品相关的血压值的影响。
[0648]
·
呼吸频率值
[0649]
在治疗或恢复期间,在治疗的动物中没有注意到与测试物品相关的呼吸频率值的影响。
[0650]
·
心电学
[0651]
在治疗或恢复期间,在治疗的动物中没有注意到与测试物品相关的心电图评价的影响。
[0652]
·
血液学
[0653]
在任何时间点的任何剂量水平下,任何性别的血液学参数都没有g9.2-17相关的影响。
[0654]
·
凝固
[0655]
在任何时间点的任何剂量水平下,任何性别的凝血参数之间都没有g9.2-17相关的影响。
[0656]
·
临床化学
[0657]
在任何时间点的任何剂量水平下,任何性别的临床化学参数之间都没有g9.2-17相关影响。
[0658]
·
尿液分析
[0659]
在13周期间,在任何剂量水平下任何性别的尿液分析参数之间均未观察到g9.2-17相关的改变。
[0660]
·
细胞因子
[0661]
在任何剂量水平或时间点均未观察到对细胞因子的明确的g9.2-17相关的影响。
[0662]
·
外周血白细胞分析(pbla)
[0663]
在任何时间点的任何剂量水平下,对任何性别的pbla终点都没有g9.2-17相关的
影响。
[0664]
·
生物分析、半乳糖凝集素-9和毒代动力学评估
[0665]
在剂量施用后,g9.2-17在来自所有g9.2-17给药的动物的所有食蟹猴样品中是可量化的。在对照食蟹猴样品中未检测到可测量的g9.2-17量。在来自所有动物的所有食蟹猴样品中,可溶性半乳糖凝集素-9是可量化的。在第1天从大多数g9.2-17治疗的动物和在第1天和第29天从对照动物给药前获得的所有血清样品中,g9.2-17血清浓度低于生物分析定量限(lloq《0.04ug/ml)。
[0666]
·
大体病理和器官重量
[0667]
在主要研究或恢复动物中没有确定的与测试物品相关的宏观观察。对于主要研究或恢复动物,也没有与测试物品相关的器官重量变化。
[0668]
·
组织病理学
[0669]
没有确定的与测试物品相关的显微观察。
[0670]
总之,对食蟹猴每周一次静脉输注施用100和300mg/kg的g9.2-17持续5周是可以耐受的,没有不良发现。
[0671]
实施例13:g9.2-17在sprague dawley大鼠中的静脉输注研究
[0672]
本研究的目的是评估g9.2-17(针对半乳糖凝集素-9的igg4人单克隆抗体)的潜在毒性,该抗体通过静脉注射连续4周每周一次施用至sprague dawley大鼠,随后是3周给药后恢复期。此外,还确定了g9.2-17的毒代动力学特征。
[0673]
实验设计
[0674]
表13总结了研究设计。
[0675]
表13:研究设计
[0676][0677]a个体剂量体积是根据最近的体重计算的。
[0678]bssd动物:仅在第1天单剂量施用后,3只动物/性别/组用于tk收集。
[0679]
一百八十六只动物(sprague dawley大鼠)按体重随机分配到治疗组。在第1、8、15、22和29天以0、100和300mg/kg的剂量水平通过尾静脉中的单次iv注射施用对照物品/媒介物、用于测试物品的制剂缓冲液和测试物品g9.2-17。在第1天以100和300mg/kg的剂量水平向分配到ssd亚组的动物施用测试物品一次。
[0680]
从环境适应的第二天开始,每天早上清洁房间前进行一次临床观察。每天进行两次死亡率检查以评估一般动物健康状况。每周一次称量容器中的食物供应量和剩余量来估计食物消耗量。平均克(g)/动物/天是从每周的食物消耗量计算的。在随机化之前、在第-1天、然后在整个研究期间每周一次以及在每次尸检当天测量体重。在第1、35和49天在剂量施用后大约24小时记录ssb动物的功能观察组(fob)观察。使用代谢笼收集过夜的尿液。在
第36天和第50天获得样品。
[0681]
在包括用于血清化学的样品的每个系列收集之前,动物禁食过夜。在这些情况下,相关的临床病理学评估来自禁食的动物。血液是从受限的清醒动物的颈静脉或麻醉动物的腔静脉收集的(在终末时)。
[0682]
在研究的生活检查期间评估的参数包括临床观察、食物消耗、体重、功能观察组。在选定的时间点收集血液样品用于临床病理学(血液学、凝血和血清化学)分析。收集尿液样品用于尿液分析。还在选定的时间点收集血液样品用于毒代动力学(tk)、免疫原性(例如,抗药抗体或ada)和细胞因子分析。在第36天和第50天对动物进行尸检。在每次尸检时,记录大体观察和器官重量,并收集组织用于显微镜检查。
[0683]
结果
[0684]
生活检查
[0685]
死亡率:在研究期间没有注意到该动物的异常临床观察或体重变化。
[0686]
临床观察:在研究期间没有注意到与g9.2-17相关的临床观察。
[0687]
食物消耗/体重:在研究期间没有注意到食物消耗、体重或体重增加方面的g9.2-17相关变化。
[0688]
临床病理学:在临床病理学参数中没有注意到g9.2-17相关的变化。
[0689]
细胞因子分析:在il-2、il-4、ifn-γ、il-5、il-6、il-10和/或tnf-α、mcp-1和mip-1b的血清浓度中没有g9.2-17相关的变化。
[0690]
大体病理学:没有与g9.2-17相关的大体观察。此外,绝对或相对器官重量没有与g9.2-17相关的变化。
[0691]
组织病理学:没有g9.2-17相关的组织学发现。
[0692]
总之,每周一次对sprague dawley大鼠进行总共5个剂量的静脉内g9.2-17施用是通常良好耐受的。在临床观察、食物消耗、体重、fob参数、临床病理、细胞因子、大体观察或器官重量方面没有g9.2-17相关的变化。
[0693]
等价物
[0694]
根据以上描述,本领域技术人员可以很容易地确定本发明的本质特征,并且在不脱离本发明的精神和范围的情况下,可以对本发明进行各种变化和修改以适应各种用途和条件。因此,其他实施方案也在权利要求内。
[0695]
虽然已在本文中描述和说明了几个本发明的实施方案,但本领域普通技术人员将容易地设想用于进行本文所述功能和/或获得本文所述的结果和/或一个或多个本文所述的有利方面的各种其它方法和/或结构,并且这样的变化和/或修改的每一种被认为在本文所述的本发明的实施方案的范围内。更通常地,本领域技术人员将容易地理解,本文所述的所有参数、尺度、材料和构型意欲为示例性的并且实际参数、尺度、材料和/或构型将取决于对其使用本发明的教导的具体应用。本领域技术人员将认可或能够确定本文所述的特定的本发明的实施方案的许多等同物(通过使用不超过常规实验)。因此,应理解,前述实施方案仅通过举例的方式提出,并且在所附权利要求和其等同物的范围内,本发明的实施方案可按与明确描述和要求保护的方式不同的方式来实施。本公开内容的本发明的实施方案涉及本文所述的各个个体特性、系统、物品、材料、试剂盒和/或方法。另外,如果这样的特性、系统、物品、材料、试剂盒和/或方法不是相互矛盾的,则两个或更多个这样的特性、系统、物
品、材料、试剂盒和/或方法的任意组合包括在本公开内容的发明范围内。
[0696]
如本文中所定义和使用的,所有定义应当被理解为优先于词典定义、通过引用并入的文献中的定义和/或所定义的术语的一般含义。
[0697]
本文中公开的所有参考文献、专利和专利申请在关于引用其每一个的主题方面通过引用并入本文,这在一些情况下可包括文献的完整内容。
[0698]
除非明确地指示与之相反,否则不定冠词“一种/一个(a)”和“一种/一个(an)”,如本文中在说明书和权利要求中所用,应当被理解为意指“至少一种/一个”。
[0699]
短语“和/或”,如在本文中在说明书和权利要求中所用,应当被理解为意指所连接的元素的“任一个或两者”,即元素在一些情况下结合地存在以及在其它情况下分离地存在。利用“和/或”列出的多个元素应当以相同的方式来解释,即所连接的元素的“一个或多个”。除通过“和/或”从句明确确定的元素外,还可任选地存在其它元素,无论与明确确定的那些元素相关还是无关。因此,作为非限定性实例,对“a和/或b”的提及,当与开放性措辞诸如“包含/包括”结合使用时,在一个实施方案中可仅指a(任选地包括除b外的元素);在另一个实施方案中可仅指b(任选地包括除a外的元素);在另一个实施方案中,可指a和b(任选地包括其它元素);依此类推。
[0700]
如本文中在说明书和权利要求中所用,“或”应当被理解为具有与如上定义的“和/或”相同的含义。例如,当在列表中分开各项时,“或”或“和/或”应当被理解为是包含性的,即包含至少一个,但也包括许多个元素或一列元素中的多于一个,以及任选地,包括另外未列出的项。只有明确地指明相反的术语,例如
“……
中的仅一个”或
“……
中的恰好一个”或当用于权利要求中时的“由
……
组成”将指包含多个元素或一列元素中的正好一个元素。一般地,如本文中所用的术语“或”应当仅在冠有排他性的术语诸如“任一”、
“……
之一”、
“……
中的仅一个”或
“……
中的恰好一个”时被解释为表示排他性选择(即“一个或另一个但非两个”)。“基本上由
……
组成”,当用于权利要求中时,应当具有其在专利法领域中使用的普通含义。
[0701]
如本文中在说明书和权利要求中所用,关于一列一个或多个元素的短语“至少一个”应当被理解为意指选自一列元素中的任何一个或多个元素的至少一个元素,但不一定包括元素列表内明确列出的每一和每个元素的至少一个并且不排除元素列表中的元素的任何组合。该定义还允许可任选地存在除短语“至少一个”所指的元素列表内明确确定的元素外的元素,无论与那些明确确定的元素相关还是不相关。因此,作为非限定性实例,“a和b的至少一个”(或,等同地,“a或b的至少一个”或,等同地“a和/或b的至少一个”)可在一个实施方案中指至少一个(任选地包括多于一个),a而无b存在(且任选地包括除b外的元素);在另一个实施方案中指至少一个(任选地包括多于一个),b而无a存在(且任选地包括除a外的元素);在另一个实施方案中指至少一个(任选地包括多于一个),a和至少一个(任选地包括多于一个)b(且任选地包括其它元素);依此类推。
[0702]
还应当理解,除非明确地指明与之相反,否则在包括多于一个步骤或行为的本文请求保护的任何方法中,所述方法的步骤或行为的顺序不必须地限定于其中叙述所述方法的步骤或行为的顺序。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1