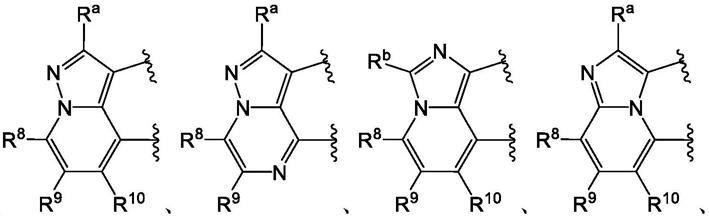
前列腺素E2受体4拮抗剂及其用途的制作方法
烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基和c
1-c6杂烷基;
13.r3是h或c
1-c6烷基;
14.或者r3和l2与它们所连接的n原子合起来形成未取代或被1、2、3或4个r2取代的含n的c
2-c6杂环烷基;
15.或者r3和环a与它们所连接的中间原子合起来形成取代或未取代的含n杂环烷基或者取代或未取代的含n杂芳基,其中如果所述环是取代的,则所述环被1-4个r2取代;
16.或者r3和环a上的一个r2与它们所连接的中间原子合起来形成形成具有环a的取代或未取代的稠合环,所述稠合环是取代或未取代的稠合含n杂环烷基或者取代或未取代的稠合5元或6元杂芳基,其中如果所述稠合环是取代的,则所述稠合环被1-4个r2取代;
17.x1是n、c-ra或n-rc;
18.x2是n、c-rb或n-rc;
19.ra是h、卤素、-oh、-cn、-nh2、-nh(c
1-c6烷基)、-n(c
1-c6烷基)2、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基和c
1-c6杂烷基;
20.rb是h、卤素、-oh、-cn、-nh2、-nh(c
1-c6烷基)、-n(c
1-c6烷基)2、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基和c
1-c6杂烷基;
21.rc是h、c
1-c6烷基、c
1-c6氟烷基、c
1-c6杂烷基、-c
1-c4亚烷基-(取代或未取代的芳基)、-c
1-c4亚烷基-(取代或未取代的杂芳基)、-c(=o)r
12
、-s(=o)2r
12
、-s(=o)2n(r
13
)2、-oc(=o)r
12
、-co2r
13
或-c(=o)n(r
13
)2;
22.x3是c或n;
23.x4是c或n;条件为x3和x4不同时是n;
24.l3是c
1-c4亚烷基、-o-c
1-c4亚烷基-、-nr
d-c
1-c4亚烷基-或-nr
d-;
25.rd是h、c
1-c6烷基、c
1-c6氟烷基或c
1-c6杂烷基;
26.x5是c-r8或n;
27.x6是c-r9或n;
28.x7是c-r
10
或n;
29.x8是c-r4或n;
30.每个r4、r5、r6和r7独立地选自h、卤素、-cn、-oh、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基、c
1-c6杂烷基、取代或未取代的c
3-c6环烷基、取代或未取代的c
2-c6杂环烷基、取代或未取代的苯基或取代未取代的单环杂芳基、-n(r
13
)2、-n(r
13
)c(=o)r
12
、-c(=o)n(r
13
)2、-c(=o)r
12
、-sr
13
、-s(=o)r
12
、-s(=o)2r
12
、-s(=o)2n(r
13
)2、-oc(=o)r
12
、-co2r
13
;
31.或者r5和r6与它们所连接的中间原子合起来形成取代或未取代的稠合环,所述稠合环是取代或未取代的稠合苯基或者取代或未取代的稠合5元或6元杂芳基,其中如果所述稠合环是取代的,则所述稠合环被1-4个r
11
取代;
32.或者r6和r7与它们所连接的中间原子合起来形成取代或未取代的稠合环,所述稠合环是取代或未取代的稠合苯基或者取代或未取代的稠合5元或6元杂芳基,其中如果所述稠合环是取代的,则所述稠合环被1-4个r
11
取代;
33.每个r8、r9、r
10
和r
11
独立地选自h、卤素、-cn、-oh、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基、c
1-c6杂烷基、取代或未取代的c
3-c6环烷基、取代或未取代的c
2-c6杂环烷基、取代或未取代的苯基或取代未取代的单环杂芳基、-n(r
13
)2、-n(r
13
)c(=o)r
12
、-c(=
o)n(r
13
)2、-c(=o)r
12
、-sr
13
、-s(=o)r
12
、-s(=o)2r
12
、-s(=o)2n(r
13
)2、-oc(=o)r
12
、-co2r
13
;
34.每个r
12
独立地选自c
1-c6烷基、c
1-c6氟烷基、c
1-c6杂烷基、取代或未取代的c
3-c6环烷基、取代或未取代的c
2-c6杂环烷基、取代或未取代的苯基或取代未取代的单环杂芳基;
35.每个r
13
独立地选自h、c
1-c6烷基、c
1-c6氟烷基、c
1-c6杂烷基、取代或未取代的c
3-c6环烷基、取代或未取代的c
2-c6杂环烷基、取代或未取代的苯基或取代未取代的单环杂芳基;
36.或者同一n原子上的两个r
13
与它们所连接的n原子合起来形成取代或未取代的含n的c
2-c6杂环烷基;
37.n是0、1、2、3或4。
38.一方面,本文提供了包含本文公开的化合物或其药学上可接受的盐或溶剂合物和至少一种药学上可接受的赋形剂的药物组合物。
39.在一些实施方案中,本文公开的化合物或其药学上可接受的盐被配制成通过静脉内施用、皮下施用、口服施用、吸入、鼻部施用、真皮施用或眼部施用的方式对哺乳动物施用。在一些实施方案中,本文公开的化合物或其药学上可接受的盐的形式为片剂、丸剂、胶囊、液体、悬浮液、凝胶、分散液、溶液、乳液、软膏或洗剂。
40.一方面,本文描述了调节哺乳动物中的前列腺素e2受体4(ep4)的活性的方法,包括对所述哺乳动物施用本文所述的化合物或其任何药学上可接受的盐或溶剂合物。
41.另一方面,本文描述了治疗哺乳动物中由前列腺素e2(pge2)对前列腺素e2受体4(ep4)的作用介导的疾病或病症的方法,包括对所述哺乳动物施用式(i)的化合物或其药学上可接受的盐或溶剂合物。在一些实施方案中,所述疾病或病症是癌症。
42.另一方面,本文描述了治疗哺乳动物的癌症的方法,所述方法包括对所述哺乳动物施用式(i)的化合物或其药学上可接受的盐或溶剂合物。
43.在一些实施方案中,所述癌症是实体肿瘤。在一些实施方案中,所述癌症是膀胱癌、结肠癌、脑癌、乳腺癌、子宫内膜癌、心脏癌、肾癌、肺癌、肝癌、子宫癌、血液和淋巴癌、卵巢癌、胰腺癌、前列腺癌、甲状腺癌或皮肤癌。在一些实施方案中,所述癌症是前列腺癌、乳腺癌、结肠癌或肺癌。在一些实施方案中,所述癌症是肉瘤、癌或淋巴瘤。
44.在本文所述的治疗方法的一些实施方案中,进一步的实施方案包括除了式(i)的化合物或其药学上可接受的盐或溶剂合物之外,还对所述哺乳动物共同施用至少一种另外的疗法。
45.在一些实施方案中,所述哺乳动物是人。
46.在任何前述方面中进一步的实施方案是将有效量的本文所述的化合物或其药学上可接受的盐:(a)对所述哺乳动物全身施用;和/或(b)对所述哺乳动物口服施用;和/或(c)对所述哺乳动物静脉内施用;和/或(d)通过注射对所述哺乳动物施用。
47.在任何前述方面中进一步的实施方案包括单次施用有效量的所述化合物,包括进一步的实施方案,其中对所述哺乳动物一天一次施用所述化合物,或经一天的时间对所述哺乳动物多次施用所述化合物。在一些实施方案中,所述化合物按连续给药方案施用。在一些实施方案中,所述化合物按连续每日给药方案施用。
48.提供了制品,其包括包装材料、所述包装材料内的制剂(例如适合局部施用的制剂)和标签,所述标签指示所述化合物或组合物或其药学上可接受的盐或溶剂合物用于降
低或抑制ep4活性,或者用于治疗、预防或改善与ep4活性相关的疾病或病症的一种或多种症状。
49.由以下详细描述可显而易见本文所述的化合物、方法和组合物的其它目的、特征和优点。然而,应当理解的是,详细描述和具体实施例虽然指示了具体的实施方案,但仅是以说明的方式给出,因为本领域技术人员由此详细描述可显而易见本公开的实质和范围内的各种变动和修改。
具体实施方式
50.前列腺素e2(pge2)是由花生四烯酸通过环氧合酶2(cox2)及其它代谢酶产生的有效炎症介体。在一些情况下,pge2由花生四烯酸通过cox1和cox2环氧合酶以及细胞溶质(cpges1)和微粒体(mpges1和mpges2)前列腺素e合酶产生。
51.前列腺素e2(pge2)受体是结合前列腺素e2并由其激活的g蛋白偶联受体。它们是前列腺素受体类别的受体的成员,并且包括以下同种型:前列腺素e2受体1(ep1)、前列腺素e2受体2(ep2)、前列腺素e2受体3(ep3)和前列腺素e2受体4(ep4)
52.pge2作用于前列腺素e2受体家族(ep
1-ep4)的所有成员,但其对ep3和ep4亲和力最高。前列腺素e2受体家族的调节牵涉多种治疗适应症,如癌症、溃疡性结肠炎、阿尔茨海默氏病、肺纤维化和心血管疾病。
53.前列腺素e2受体4(ep4、ptger4基因)是对诸如细胞增殖、细胞分化、细胞存活和血管生成的细胞功能至关重要的各种信号传导途径的主要效应物。
54.在许多癌症中发现cox2和pge2水平升高,并且与肿瘤发生和进展相关。另外,ptger4基因中的某些遗传变异与诸如炎性肠病、强直性脊柱炎和原发性移植物功能障碍的疾病的发病率增加相关。在一些情况下,ep4在人前列腺癌组织中过表达。ep4牵涉各种重要的生理和病理信号传导途径。
55.在一些情况下,ep4活性增加癌症的各种标志,如炎症、细胞运动、细胞迁移、血管生成、增殖、侵入和肿瘤侵袭性。在一些情况下,ep4在许多肿瘤谱系如脑癌、甲状腺癌、胰腺癌、乳腺癌、肾癌、肺癌、肝癌、骨癌、心血管癌、胶质母细胞瘤、卵巢癌和前列腺癌中上调。在一些情况下,在恶性肿瘤组织如乳腺癌、肾癌、结直肠癌、前列腺癌和肺癌中观察到ep4过表达。
56.在四种pge2受体当中,ep3和ep4在体内表达最广泛。相比之下,ep1受体的分布限于人的几个器官。所有ep受体亚型都存在于质膜上。ep3和ep4也在细胞核膜上表达。
57.癌症
58.已经检验了ep4拮抗剂用于治疗各种癌症,如但不限于前列腺癌、肺癌、乳腺癌、b细胞淋巴瘤和结直肠癌。此外,在恶性肿瘤组织如乳腺癌、肾癌、结直肠癌、前列腺癌和肺癌中经常观察到ep4过表达。
59.例如,已经注意到ep4的过表达导致小鼠异种移植疾病模型中的前列腺癌的进展,并且用ep4拮抗剂ono-ae3-208进行治疗抑制了去势抵抗性前列腺癌进展(terada,n等人,(2010)cancer res.70,1606
–
1615)。与这些发现一致,发现ep4表达在前列腺癌患者中上调(jain,s.等人,(2008)cancer res.68,7750
–
7759)。
60.pge2在肺癌中起重要作用。pge2在肺组织中大量表达,且抑制其信号传导抑制了
肺癌的动物模型中的致瘤作用。这些观察结果已被后续发现所证实,其显示:(i)pge2促进人nsclc体外生长,并且其致瘤作用通过用ep4拮抗剂ah-23848药理学阻断ep4活性而得到成功抑制;和(ii)在小鼠中静脉内注射的肺癌细胞的肺转移经由ep4受体得到促进。与ep4在前列腺癌和肺癌中的作用一致,评价ep4在乳腺癌中的作用的研究显示,使用ep4拮抗剂gw-627368x对ep4活性进行药理学阻断选择性地抑制了人炎性乳腺癌细胞的增殖和侵袭(robertson,f.m.等人,(2008).j.exp.ther.oncol.7,299
–
312)。此外,ep4受体拮抗剂ah-23848和ono-ae3-208减少了鼠乳腺肿瘤细胞的转移。
61.在若干体内研究中以及通过ep4受体的药理学阻断证实了在结直肠癌中阻断ep4信号传导的有益作用。例如,用致癌物处理的ep4-/-小鼠相对于用相同致癌物处理的野生型小鼠减少了异常隐窝病灶的发生(sonoshita,m.等人,(2001)nat.med.7,1048
–
1051)。ep4拮抗剂ono-ae2-227的施用减少了小鼠疾病模型中异常隐窝病灶和肠息肉的形成(mutoh,m.等人,(2002)cancer res.62,28
–
32)。
62.在一些实施方案中,本文公开了用式(i)的化合物或其药学上可接受的盐或溶剂合物治疗癌症的方法。
63.如本文所用的术语“癌症”是指细胞倾向于以不受控制的方式增殖并且在一些情况下转移(扩散)的异常生长。癌症的类型包括但不限于有或没有转移的疾病的任何阶段的实体肿瘤(如膀胱、肠、脑、乳腺、子宫内膜、心脏、肾、肺、肝、子宫、淋巴组织(淋巴瘤)、卵巢、胰腺或其它内分泌器官(甲状腺)、前列腺、皮肤(黑素瘤或基底细胞癌)的实体肿瘤或血液肿瘤(如白血病和淋巴瘤)。
64.在一些实施方案中,用本文所述的化合物治疗的哺乳动物患有癌症或肿瘤或与癌症或肿瘤相关的疾病或病症。因此,在一些实施方案中,所述哺乳动物是人肿瘤患者。这类疾病和病症以及癌症包括癌、肉瘤、良性肿瘤、原发性肿瘤、肿瘤转移、实体肿瘤、非实体肿瘤、血液肿瘤、白血病和淋巴瘤以及原发性和转移性肿瘤。
65.在一些实施方案中,本文所述的ep4受体拮抗剂用于治疗实体肿瘤。实体肿瘤是通常不含囊肿或液体区域的异常组织块。实体肿瘤可以是良性的(非癌症)或恶性的(癌症)。不同类型的实体肿瘤以形成它们的细胞类型命名。实体肿瘤的实例有癌、肉瘤和淋巴瘤。
66.癌包括但不限于食管癌、肝细胞癌、基底细胞癌、鳞状细胞癌、膀胱癌、支气管癌、结肠癌、结直肠癌、胃癌、肺癌(包括肺的小细胞癌和非小细胞癌)、肾上腺皮质癌、甲状腺癌、胰腺癌、乳腺癌、卵巢癌、前列腺癌、腺癌、肾细胞癌、维尔姆氏瘤、宫颈癌、子宫癌、睾丸癌、成骨癌、上皮癌和鼻咽癌。
67.肉瘤包括但不限于纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、脊索瘤、成骨肉瘤、骨肉瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜瘤、间皮瘤、尤因氏肉瘤、平滑肌肉瘤、横纹肌肉瘤及其它软组织肉瘤。
68.白血病包括但不限于:a)慢性骨髓增生综合征(多能造血干细胞的肿瘤性病症);b)急性骨髓性白血病;c)慢性淋巴细胞白血病(cll),包括b细胞cll、t细胞cll幼淋巴细胞白血病和毛细胞白血病;和d)急性成淋巴细胞性白血病(特征在于成淋巴细胞的积累)。淋巴瘤包括但不限于b细胞淋巴瘤(例如,伯基特淋巴瘤);霍奇金淋巴瘤;等等。
69.良性肿瘤包括例如血管瘤、肝细胞腺瘤、海绵状血管瘤、局灶性结节性增生、听神经瘤、神经纤维瘤、胆管腺瘤、胆管囊瘤、纤维瘤、脂肪瘤、平滑肌瘤、间皮瘤、畸胎瘤、粘液
瘤、结节性再生性增生、沙眼和化脓性肉芽肿。
70.原发性和转移性肿瘤包括例如肺癌;乳腺癌;结直肠癌;肛门癌;胰腺癌;前列腺癌;卵巢癌;肝和胆管癌;食管癌;膀胱癌;子宫癌;胶质瘤、成胶质细胞瘤、成神经管细胞瘤及其它脑肿瘤;肾癌;头颈癌;胃癌;多发性骨髓瘤;睾丸癌;生殖细胞肿瘤;神经内分泌肿瘤;宫颈癌;胃肠道、乳腺及其它器官的类癌。
71.一方面,式(i)的化合物或其药学上可接受的盐或溶剂合物减少、改善或抑制与癌症相关的细胞增殖。
72.化合物
73.本文所述的化合物(包括其药学上可接受的盐、前药、活性代谢物和溶剂合物)是前列腺素e2受体4(ep4)调节剂。在一些实施方案中,ep4调节剂是ep4拮抗剂。
74.一方面,本文描述了式(i)的化合物,或其药学上可接受的盐或溶剂合物:
[0075][0076]
其中,
[0077]
r1是-co2h、-co2(c
1-c6烷基)、-c(=o)nhso2r
12
、-c(=o)n(r
13
)2、
[0078]
四唑基或羧酸生物电子等排体;
[0079]
l1不存在、为c
1-c4亚烷基或c
3-c6亚环烷基;
[0080]
环a是苯基、萘基、c
3-c
12
环烷基、c
2-c
10
杂环烷基或杂芳基;
[0081]
l2不存在、为c
1-c4亚烷基或c
3-c6亚环烷基;
[0082]
每个r2独立地选自h、卤素、-oh、-cn、-nh2、-nh(c
1-c6烷基)、-n(c
1-c6烷基)2、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基和c
1-c6杂烷基;
[0083]
r3是h或c
1-c6烷基;
[0084]
或者r3和l2与它们所连接的n原子合起来形成未取代或被1、2、3或4个r2取代的含n的c
2-c6杂环烷基;
[0085]
或者r3和环a与它们所连接的中间原子合起来形成取代或未取代的含n杂环烷基或者取代或未取代的含n杂芳基,其中如果所述环是取代的,则所述环被1-4个r2取代;
[0086]
或者r3和环a上的一个r2与它们所连接的中间原子合起来形成形成具有环a的取代或未取代的稠合环,所述稠合环是取代或未取代的稠合含n杂环烷基或者取代或未取代的稠合5元或6元杂芳基,其中如果所述稠合环是取代的,则所述稠合环被1-4个r2取代;
[0087]
x1是n、c-ra或n-rc;
[0088]
x2是n、c-rb或n-rc;
[0089]
ra是h、卤素、-oh、-cn、-nh2、-nh(c
1-c6烷基)、-n(c
1-c6烷基)2、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基或c
1-c6杂烷基;
[0090]
rb是h、卤素、-oh、-cn、-nh2、-nh(c
1-c6烷基)、-n(c
1-c6烷基)2、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基或c
1-c6杂烷基;
[0091]
rc是h、c
1-c6烷基、c
1-c6氟烷基、c
1-c6杂烷基、-c
1-c4亚烷基-(取代或未取代的芳基)、-c
1-c4亚烷基-(取代或未取代的杂芳基)、-c(=o)r
12
、-s(=o)2r
12
、-s(=o)2n(r
13
)2、-oc(=o)r
12
、-co2r
13
或-c(=o)n(r
13
)2;
[0092]
x3是c或n;
[0093]
x4是c或n;条件为x3和x4不同时是n;
[0094]
l3是c
1-c4亚烷基、-o-c
1-c4亚烷基-、-o-、-nr
d-c
1-c4亚烷基-或-nr
d-;
[0095]
rd是h、c
1-c6烷基、c
1-c6氟烷基或c
1-c6杂烷基;
[0096]
x5是c-r8或n;
[0097]
x6是c-r9或n;
[0098]
x7是c-r
10
或n;
[0099]
x8是c-r4或n;
[0100]
每个r4、r5、r6和r7独立地选自h、卤素、-cn、-oh、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基、c
1-c6杂烷基、取代或未取代的c
3-c6环烷基、取代或未取代的c
2-c6杂环烷基、取代或未取代的苯基、取代未取代的单环杂芳基、-n(r
13
)2、-n(r
13
)c(=o)r
12
、-c(=o)n(r
13
)2、-c(=o)r
12
、-sr
13
、-s(=o)r
12
、-s(=o)2r
12
、-s(=o)2n(r
13
)2、-oc(=o)r
12
和-co2r
13
;
[0101]
或者r5和r6与它们所连接的中间原子合起来形成取代或未取代的稠合环,所述稠合环是取代或未取代的稠合苯基或者取代或未取代的稠合5元或6元杂芳基,其中如果所述稠合环是取代的,则所述稠合环被1-4个r
11
取代;
[0102]
或者r6和r7与它们所连接的中间原子合起来形成取代或未取代的稠合环,所述稠合环是取代或未取代的稠合苯基或者取代或未取代的稠合5元或6元杂芳基,其中如果所述稠合环是取代的,则所述稠合环被1-4个r
11
取代;
[0103]
每个r8、r9、r
10
和r
11
独立地选自h、卤素、-cn、-oh、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基、c
1-c6杂烷基、取代或未取代的c
3-c6环烷基、取代或未取代的c
2-c6杂环烷基、取代或未取代的苯基、取代未取代的单环杂芳基、-n(r
13
)2、-n(r
13
)c(=o)r
12
、-c(=o)n(r
13
)2、-c(=o)r
12
、-sr
13
、-s(=o)r
12
、-s(=o)2r
12
、-s(=o)2n(r
13
)2、-oc(=o)r
12
和-co2r
13
;
[0104]
每个r
12
独立地选自c
1-c6烷基、c
1-c6氟烷基、c
1-c6杂烷基、取代或未取代的c
3-c6环烷基、取代或未取代的c
2-c6杂环烷基、取代或未取代的苯基或取代未取代的单环杂芳基;
[0105]
每个r
13
独立地选自h、c
1-c6烷基、c
1-c6氟烷基、c
1-c6杂烷基、取代或未取代的c
3-c6环烷基、取代或未取代的c
2-c6杂环烷基、取代或未取代的苯基和取代未取代的单环杂芳基;
[0106]
或者同一n原子上的两个r
13
与它们所连接的n原子合起来形成取代或未取代的含n的c
2-c6杂环烷基;
[0107]
n是0、1、2、3或4。
[0108]
对于任何及所有实施方案,取代基选自所列出的替代方案的子集。例如,在一些实施方案中,r1是-co2h、-co2(c
1-c6烷基)、-c(=o)nhso2r
12
、-c(=o)n(r
13
)2、四唑基或羧酸生
物电子等排体。在其它实施方案中,r1是-co2h、-co2(c
1-c6烷基)、-c(=o)nhso2r
12
或-c(=o)n(r
13
)2。在其它实施方案中,r1是-co2h、四唑基或羧酸生物电子等排体。在一些实施方案中,x是r1是-co2h或-co2(c
1-c6烷基)。在一些其它实施方案中,r1是-co2h。
[0109]
另一方面,本文描述了式(i)的化合物,或其药学上可接受的盐或溶剂合物:
[0110][0111]
其中,
[0112]
r1是-co2h、-co2(c
1-c6烷基)、-c(=o)nhso2r
12
、-c(=o)n(r
13
)2、四唑基或羧酸生物电子等排体;
[0113]
l1不存在、为c
1-c4亚烷基或c
3-c6亚环烷基;
[0114]
环a是苯基、萘基、c
3-c
12
环烷基、c
2-c
10
杂环烷基或杂芳基;
[0115]
l2不存在、为c
1-c4亚烷基或c
3-c6亚环烷基;
[0116]
每个r2独立地选自h、卤素、-oh、-cn、-nh2、-nh(c
1-c6烷基)、-n(c
1-c6烷基)2、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基和c
1-c6杂烷基;
[0117]
r3是h或c
1-c6烷基;
[0118]
或者r3和l2与它们所连接的n原子合起来形成未取代或被1、2、3或4个r2取代的含n的c
2-c6杂环烷基;
[0119]
或者r3和环a与它们所连接的中间原子合起来形成取代或未取代的含n杂环烷基或者取代或未取代的含n杂芳基,其中如果所述环是取代的,则所述环被1-4个r2取代;
[0120]
或者r3和环a上的一个r2与它们所连接的中间原子合起来形成形成具有环a的取代或未取代的稠合环,所述稠合环是取代或未取代的稠合含n杂环烷基或者取代或未取代的稠合5元或6元杂芳基,其中如果所述稠合环是取代的,则所述稠合环被1-4个r2取代;
[0121]
x1是n、c-ra或n-rc;
[0122]
x2是n、c-rb或n-rc;
[0123]
ra是h、卤素、-oh、-cn、-nh2、-nh(c
1-c6烷基)、-n(c
1-c6烷基)2、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基或c
1-c6杂烷基;
[0124]
rb是h、卤素、-oh、-cn、-nh2、-nh(c
1-c6烷基)、-n(c
1-c6烷基)2、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基或c
1-c6杂烷基;
[0125]
rc是h、c
1-c6烷基、c
1-c6氟烷基、c
1-c6杂烷基、-c
1-c4亚烷基-(取代或未取代的芳基)、-c
1-c4亚烷基-(取代或未取代的杂芳基)、-c(=o)r
12
、-s(=o)2r
12
、-s(=o)2n(r
13
)2、-oc(=o)r
12
、-co2r
13
或-c(=o)n(r
13
)2;
[0126]
x3是c或n;
[0127]
x4是c或n;条件为x3和x4不同时是n;
[0128]
l3是c
1-c4亚烷基;
[0129]
rd是h、c
1-c6烷基、c
1-c6氟烷基或c
1-c6杂烷基;
[0130]
x5是c-r8或n;
[0131]
x6是c-r9或n;
[0132]
x7是c-r
10
或n;
[0133]
x8是c-r4或n;
[0134]
每个r4、r5、r6和r7独立地选自h、卤素、-cn、-oh、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基、c
1-c6杂烷基、取代或未取代的c
3-c6环烷基、取代或未取代的c
2-c6杂环烷基、取代或未取代的苯基、取代未取代的单环杂芳基、-n(r
13
)2、-n(r
13
)c(=o)r
12
、-c(=o)n(r
13
)2、-c(=o)r
12
、-sr
13
、-s(=o)r
12
、-s(=o)2r
12
、-s(=o)2n(r
13
)2、-oc(=o)r
12
和-co2r
13
;
[0135]
或者r5和r6与它们所连接的中间原子合起来形成取代或未取代的稠合环,所述稠合环是取代或未取代的稠合苯基或者取代或未取代的稠合5元或6元杂芳基,其中如果所述稠合环是取代的,则所述稠合环被1-4个r
11
取代;
[0136]
或者r6和r7与它们所连接的中间原子合起来形成取代或未取代的稠合环,所述稠合环是取代或未取代的稠合苯基或者取代或未取代的稠合5元或6元杂芳基,其中如果所述稠合环是取代的,则所述稠合环被1-4个r
11
取代;
[0137]
每个r8、r9、r
10
和r
11
独立地选自h、卤素、-cn、-oh、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基、c
1-c6杂烷基、取代或未取代的c
3-c6环烷基、取代或未取代的c
2-c6杂环烷基、取代或未取代的苯基、取代未取代的单环杂芳基、-n(r
13
)2、-n(r
13
)c(=o)r
12
、-c(=o)n(r
13
)2、-c(=o)r
12
、-sr
13
、-s(=o)r
12
、-s(=o)2r
12
、-s(=o)2n(r
13
)2、-oc(=o)r
12
和-co2r
13
;
[0138]
每个r
12
独立地选自c
1-c6烷基、c
1-c6氟烷基、c
1-c6杂烷基、取代或未取代的c
3-c6环烷基、取代或未取代的c
2-c6杂环烷基、取代或未取代的苯基或取代未取代的单环杂芳基;
[0139]
每个r
13
独立地选自h、c
1-c6烷基、c
1-c6氟烷基、c
1-c6杂烷基、取代或未取代的c
3-c6环烷基、取代或未取代的c
2-c6杂环烷基、取代或未取代的苯基和取代未取代的单环杂芳基;
[0140]
或者同一n原子上的两个r
13
与它们所连接的n原子合起来形成取代或未取代的含n的c
2-c6杂环烷基;
[0141]
n是0、1、2、3或4。
[0142]
在一些实施方案中,x3或x4至少之一是n。在一些实施方案中,x3是n;且x4是c。在一些实施方案中,x3是c;且x4是n。
[0143]
在一些实施方案中,x1是c-ra;x2是n或c-rb;x3是n;且x4是c;或者x1是c-ra;x2是n-rc;x3是c;且x4是c或n;或者x1是n;x2是c-rb;x3是n;且x4是c;或者x1是n或n-rc;x2是c-rb或n;x3是c;且x4是c或n。在一些实施方案中,x1是c-ra;x2是n或c-rb;x3是n;且x4是c。
[0144]
在一些实施方案中,x1是c-ra;x2是n或c-rb;x3是c或n;且x4是c或n;或者x1是n;x2是n-rc或c-rb;x3是c或n;且x4是c或n。在一些实施方案中,x1是n;x2是n-rc;x3是c;且x4是c。在一些实施方案中,x1是c-ra;x2是n;x3是c;且x4是c。
[0145]
在一些实施方案中,x1是c-ra;x2是n;x3是n;且x4是c;或者x1是n;x2是c-rb;x3是n;
且x4是c;或者x1是n;x2是c-rb;x3是c;且x4是n;或者x1是n;x2是n-rc;x3是c;且x4是c;或者x1是c-ra;x2是n-rc;x3是c;且x4是c;或者x1是c-ra;x2是n-rc;x3是c;且x4是n;或者x1是c-ra;x2是c-rb;x3是n;且x4是c;或者x1是n-rc;x2是n;x3是c;且x4是c。在一些实施方案中,x1是n;x2是c-rb;x3是n;且x4是c。
[0146]
在一些实施方案中,x5是n;x6是c-r9;且x7是c-r
10
;或者x5是c-r8;x6是n;且x7是c-r
10
;或者x5是c-r8;x6是c-r9;且x7是n;或者x5是n;x6是c-r9;且x7是n。
[0147]
在一些实施方案中,x1是c-ra;x2是n;x3是c;x4是c;x5是n x6是c-r9;且x7是c-r
10
。
[0148]
在一些实施方案中,是是
[0149][0150]
在一些实施方案中,是是
[0151]
在一些实施方案中,是是
[0152]
在一些实施方案中,r1是-co2h或-co2(c
1-c6烷基)。
[0153]
在一些实施方案中,r1是-co2h。
[0154]
在一些实施方案中,式(i)的化合物具有式(ii)、式(iii)、式(iv)的结构,或其药学上可接受的盐或溶剂合物:
[0155][0156]
在一些实施方案中,式(i)的化合物具有式(v)、式(vi)、式(vii)、式(viii)的结
构,或其药学上可接受的盐或溶剂合物:
[0157][0158][0159]
在一些实施方案中,l3是c
1-c4亚烷基、-o-c
1-c4亚烷基-、-nr
d-c
1-c4亚烷基-或-nr
d-。在一些实施方案中,l3是c
1-c4亚烷基、-nr
d-c
1-c4亚烷基-或-nr
d-。在一些实施方案中,l3是c
1-c4亚烷基。
[0160]
在一些实施方案中,l3是-ch
2-、-ch2ch
2-、-ch2ch2ch
2-、-ch(ch3)-、-c(ch3)
2-、-o-、-och
2-、-och2ch
2-、-och2ch2ch
2-、-och(ch3)-、-oc(ch3)
2-、-nh-、-nhch
2-、-nhch2ch
2-、-nhch2ch2ch
2-、-nhch(ch3)-或-nhc(ch3)
2-。在一些实施方案中,l3是-ch
2-、-ch2ch
2-、-ch2ch2ch
2-、-ch(ch3)-、-c(ch3)
2-、-och
2-、-och2ch
2-、-och2ch2ch
2-、-och(ch3)-、-oc(ch3)
2-、-nh-、-nhch
2-、-nhch2ch
2-、-nhch2ch2ch
2-、-nhch(ch3)-或-nhc(ch3)
2-。在一些实施方案中,l3是-ch
2-、-ch2ch
2-、-ch2ch2ch
2-、-ch(ch3)-、-c(ch3)
2-、-nh-、-nhch
2-、-nhch2ch
2-、-nhch2ch2ch
2-、-nhch(ch3)-或-nhc(ch3)
2-。
[0161]
在一些实施方案中,l3是-ch
2-、-ch2ch
2-、-ch(ch3)-、-o-、-och
2-、-och2ch
2-、-och(ch3)-、-nh-、-nhch
2-、-nhch2ch
2-或-nhch(ch3)-。在一些实施方案中,l3是-ch
2-、-ch2ch
2-、-ch(ch3)-、-och
2-、-och2ch
2-、-och(ch3)-、-nh-、-nhch
2-、-nhch2ch
2-或-nhch(ch3)-。在一些实施方案中,l3是-ch
2-、-ch2ch
2-、-ch(ch3)-、-nh-、-nhch
2-、-nhch2ch
2-或-nhch(ch3)-。在一些实施方案中,l3是-ch
2-、-ch2ch
2-或-ch(ch3)-。
[0162]
在一些实施方案中,l3是-ch
2-。
[0163]
在一些实施方案中,式(i)的化合物具有式(ix)的结构,或其药学上可接受的盐或
溶剂合物:
[0164][0165]
在一些实施方案中,式(i)的化合物具有式(x)的结构,或其药学上可接受的盐或溶剂合物:
[0166][0167]
在一些实施方案中,式(i)的化合物具有式(xa)的结构,或其药学上可接受的盐或溶剂合物:
[0168][0169]
在一些实施方案中,式(i)的化合物具有式(xi)的结构,或其药学上可接受的盐或溶剂合物:
[0170][0171]
在一些实施方案中,l1不存在、为-ch
2-、-ch2ch
2-、-ch2ch2ch
2-、-ch(ch3)-、-c(ch3)
2-、-ch(ch2ch3)-、-c(ch2ch3)
2-、环丙基-1,1-二基、环丁基-1,1-二基、环戊基-1,1-二基或环己基-1,1-二基;l2不存在、为-ch
2-、-ch2ch
2-、-ch2ch2ch
2-、-ch(ch3)-、-c(ch3)
2-、-ch(ch2ch3)-、-c(ch2ch3)
2-、环丙基-1,1-二基、环丁基-1,1-二基、环戊基-1,1-二基或环己基-1,1-二基。
[0172]
在一些实施方案中,l1不存在、为-ch
2-、-ch2ch
2-、-ch2ch2ch
2-、-ch(ch3)-、-c(ch3)
2-、-ch(ch2ch3)-、-c(ch2ch3)
2-、环丙基-1,1-二基、环丁基-1,1-二基、环戊基-1,1-二基或环己基-1,1-二基;l2不存在、为-ch
2-、-ch2ch
2-、-ch2ch2ch
2-或-ch(ch3)-。
[0173]
在一些实施方案中,l1不存在、为-ch
2-、-ch(ch3)-、-c(ch3)
2-或环丙基-1,1-二基;且l2不存在、为-ch
2-、-ch(ch3)-、-c(ch3)
2-或环丙基-1,1-二基。在一些实施方案中,l1和l2各自独立地为-ch
2-、-ch(ch3)-、-c(ch3)
2-或环丙基-1,1-二基。在一些实施方案中,l1和l2各自不存在。
[0174]
在一些实施方案中,是是
[0175]
在一些实施方案中,是是
[0176]
在一些实施方案中,是是
[0177]
在一些实施方案中,环a是苯基。
[0178]
在一些实施方案中,是
[0179]
在一些实施方案中,环a是单环c
3-c8环烷基或双环c
7-c
12
环烷基。
[0180]
在一些实施方案中,环a是单环c
3-c8环烷基;或者环a是双环c
7-c
12
环烷基,其为稠合双环c
7-c
12
环烷基、桥连双环c
7-c
12
环烷基或螺双环c
7-c
12
环烷基。
[0181]
在一些实施方案中,环a是环丁基、环戊基或环己基;或者环a是双环c
7-c
12
环烷基,其为螺[2.2]戊烷基、螺[3.3]庚烷基、螺[4.3]辛烷基、螺[3.4]辛烷基、螺[3.5]壬烷基、螺[4.4]壬烷基、螺[4.5]癸烷基、螺[5.4]癸烷基、螺[5.5]十一烷基、双环[1.1.1]戊烷基、双环[2.2.2]辛烷基、双环[2.2.1]庚烷基、金刚烷基或十氢萘基。
[0182]
在一些实施方案中,环a是环丁基、环戊基或环己基;或者环a是螺[3.3]庚烷基、双环[1.1.1]戊烷基或双环[2.2.2]辛烷基。
[0183]
在一些实施方案中,环a是苯基、环己基、螺[3.3]庚烷基、双环[1.1.1]戊烷基或双环[2.2.2]辛烷基。在一些实施方案中,环a是环己基、螺[3.3]庚烷基、双环[1.1.1]戊烷基或双环[2.2.2]辛烷基。
[0184]
在一些实施方案中,是是或者是是
[0185]
在一些实施方案中,是是或者
[0186]
是
[0187]
在一些实施方案中,是或者
[0188]
是
[0189]
在一些实施方案中,是或者
[0190]
是
[0191]
在一些实施方案中,是
[0192]
在一些实施方案中,是
[0193]
在一些实施方案中,是
[0194]
在一些实施方案中,是是
[0195]
在一些实施方案中,是
[0196]
在一些实施方案中,是
[0197]
在一些实施方案中,是是
[0198]
在一些实施方案中,是
[0199]
在一些实施方案中,是是
[0200]
在一些实施方案中,是是
[0201]
在一些实施方案中,环a是在环中含有至少1个n原子的单环c
2-c6杂环烷基,其选自氮丙啶基、氮杂环丁烷基、吡咯烷基、吗啉基、硫代吗啉基、哌啶基、哌嗪基和氮杂环庚烷基。
[0202]
在一些实施方案中,环a是双环c
5-c8杂环烷基,其为稠合双环c
5-c8杂环烷基、桥连双环c
5-c8杂环烷基或螺双环c
5-c8杂环烷基。
[0203]
在一些实施方案中,环a是单环杂芳基。
[0204]
在一些实施方案中,环a是选自呋喃基、噻吩基、吡咯基、噁唑基、噻唑基、咪唑基、吡唑基、三唑基、四唑基、异噁唑基、异噻唑基、噁二唑基、噻二唑基、吡啶基、嘧啶基、吡嗪
基、哒嗪基和三嗪基的单环杂芳基。
[0205]
在一些实施方案中,是是
[0206]
在一些实施方案中,环a是选自吲哚基、苯并呋喃基、苯并噻吩基、苯并噁唑基、苯并异噁唑基、苯并咪唑基、咪唑并吡啶基、咪唑并哒嗪基、嘌呤基、喹啉基、喹唑啉基和吡啶并嘧啶基的双环杂芳基。
[0207]
在一些实施方案中,每个r2独立地选自h、f、cl、br、-oh、-cn、-nh2、-nh(ch3)、-n(ch3)2、-ch3、-och3、-cf3和-ocf3;n是0、1或2。
[0208]
在一些实施方案中,是是
[0209]
在一些实施方案中,是是
[0210][0211]
在一些实施方案中,是是
[0212]
在一些实施方案中,是是
[0213]
在一些实施方案中,是是
[0214]
在一些实施方案中,是是
[0215]
在一些实施方案中,l1不存在、为-ch
2-、或环丙基-1,1-二基;l2不存在、为-ch
2-、或环丙基-1,1-二基;且l3是-ch
2-。
[0216]
在一些实施方案中,x1是n、c-ra或n-rc;ra是h、卤素、-oh、-cn、-nh2、-nh(c
1-c6烷基)、-n(c
1-c6烷基)2、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基或c
1-c6杂烷基;且rc是h、c
1-c6烷基、c
1-c6氟烷基、c
1-c6杂烷基、-c
1-c4亚烷基-(取代或未取代的芳基)、-c
1-c4亚烷基-(取代或未取代的杂芳基)、-c(=o)r
12
、-s(=o)2r
12
、-s(=o)2n(r
13
)2、-oc(=o)r
12
、-co2r
13
或-c(=o)n(r
13
)2。在一些实施方案中,ra是h。在一些实施方案中,rc是h、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基或c
1-c6杂烷基。在一些实施方案中,rc是h、c
1-c6烷基或c
1-c6氟烷基。在一些实施方案中,rc是c
2-c4烷基。在一些实施方案中,rc是c
2-c4氟烷基。在一些实施方案中,c
2-c4氟烷基包含一个、两个或三个氟取代基。
[0217]
在一些实施方案中,x2是n、c-rb或n-rc;rb是h、卤素、-oh、-cn、-nh2、-nh(c
1-c6烷基)、-n(c
1-c6烷基)2、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基或c
1-c6杂烷基;且rc是h、c
1-c6烷基、c
1-c6氟烷基、c
1-c6杂烷基、-c
1-c4亚烷基-(取代或未取代的芳基)、-c
1-c4亚烷基-(取代或未取代的杂芳基)、-c(=o)r
12
、-s(=o)2r
12
、-s(=o)2n(r
13
)2、-oc(=o)r
12
、-co2r
13
或-c(=o)n(r
13
)2。在一些实施方案中,rb是h。在一些实施方案中,rc是h、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基或c
1-c6杂烷基。在一些实施方案中,rc是h、c
1-c6烷基或c
1-c6氟烷基。在一些实施方案中,rc是c
2-c4烷基。在一些实施方案中,rc是c
2-c4氟烷基。在一些实施方案中,c
2-c4氟烷基包含一个、两个或三个氟取代基。在一些实施方案中,rc是h。
[0218]
在一些实施方案中,x8是c-r4或n;r4选自h、f、cl、br、-oh、-cn、-nh2、-nh(ch3)、-n
(ch3)2、-ch3、-och3、-cf3和-ocf3;r5选自h、f、cl、br、-oh、-cn、-nh2、-nh(ch3)、-n(ch3)2、-ch3、-och3、-cf3和-ocf3;r6选自h、f、cl、br、-oh、-cn、-nh2、-nh(ch3)、-n(ch3)2、-ch3、-och3、-cf3和-ocf3;或者r5和r6与它们所连接的中间原子合起来形成取代或未取代的稠合苯基,其中如果所述稠合苯基是取代的,则所述稠合苯基被1-4个r
11
取代;r7选自h、f、cl、br、-oh、-cn、-nh2,-nh(ch3),-n(ch3)2,-ch3,-och3,-cf3和-ocf3;或者r6和r7与它们所连接的中间原子合起来形成取代或未取代的稠合苯基,其中如果所述稠合苯基是取代的,则所述稠合环被1-4个r
11
取代。
[0219]
在一些实施方案中,x8是c-r4;r4是h;r5选自h、f、cl、br、-oh、-cn、-ch3、-och3、-cf3和-ocf3;r6选自h、f、cl、br、-oh、-cn、-ch3、-och3、-cf3和-ocf3;r7是h。
[0220]
在一些实施方案中,x8是n;r5和r6与它们所连接的中间原子合起来形成取代或未取代的稠合苯基,其中如果所述稠合苯基是取代的,则所述稠合苯基被1-4个r
11
取代;r7是h。
[0221]
在一些实施方案中,x8是n;r5是h;r6和r7与它们所连接的中间原子合起来形成取代或未取代的稠合苯基,其中如果所述稠合苯基是取代的,则所述稠合苯基被1-4个r
11
取代。
[0222]
在一些实施方案中,每个r8、r9和r
10
独立地选自h、f、cl、br、-oh、-cn、-nh2、-nh(ch3)、-n(ch3)2、-ch3、-och3、-cf3和-ocf3。在一些实施方案中,每个r8、r9和r
10
是h。
[0223]
在一些实施方案中,x1是n或c-ra;x2是n、c-rb或n-rc;每个ra、rb和rc独立地为h、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基或c
1-c6氟烷氧基;x3是c或n;x4是c;x5是c-h或n;x6是c-h;x7是c-h;x8是c-h;r5选自h、f、cl、br、-oh、-cn、-ch3、-och3、-cf3和-ocf3;且r6选自h、f、cl、br、-oh、-cn、-ch3、-och3、-cf3和-ocf3。
[0224]
在一些实施方案中,ra是h或c
1-c6烷基。在一些实施方案中,rb是h。在一些实施方案中,rc是h或c
1-c6烷基。在一些实施方案中,ra是h或c
1-c6烷基;rb是h;且rc是h或c
1-c6烷基。在一些实施方案中,ra或rc任一者的c
1-c6烷基是甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基或叔丁基。
[0225]
在一些实施方案中,x1是c-h;x2是n;x3是n;x4是c;x5、x6、x7和x8各自为c-h;r5是h或-cf3;r6是h或-cf3;且r7是h。
[0226]
在一些实施方案中,x1是n;x2是c-h;x3是n;x4是c;x5、x6、x7和x8各自为c-h;r5是h或-cf3;r6是h或-cf3;且r7是h。
[0227]
在一些实施方案中,x1是n;x2是n-rc;rc是h或c
1-c6烷基;x3是c;x4是c;x5、x6、x7和x8各自为c-h;r5是h或-cf3;r6是h或-cf3;且r7是h。在一些实施方案中,x1是n;x2是n-rc;rc是h;x3是c;x4是c;x5、x6、x7和x8各自为c-h;r5是h或-cf3;r6是h或-cf3;且r7是h。在一些实施方案中,x1是n;x2是n-rc;rc是c
1-c6烷基;x3是c;x4是c;x5、x6、x7和x8各自为c-h;r5是h或-cf3;r6是h或-cf3;且r7是h。
[0228]
在一些实施方案中,x1是n-rc;x2是n;rc是h或c
1-c6烷基;x3是c;x4是c;x5、x6、x7和x8各自为c-h;r5是h或-cf3;r6是h或-cf3;且r7是h。在一些实施方案中,x1是n-rc;x2是n;rc是h;x3是c;x4是c;x5、x6、x7和x8各自为c-h;r5是h或-cf3;r6是h或-cf3;且r7是h。在一些实施方案中,x1是n-rc;x2是n;rc是c
1-c6烷基;x3是c;x4是c;x5、x6、x7和x8各自为c-h;r5是h或-cf3;r6是h或-cf3;且r7是h。
[0229]
在一些实施方案中,x1是c-h;x2是n-rc;rc是h或c
1-c6烷基;x3是c;x4是c;x5、x6、x7和x8各自为c-h;r5是h或-cf3;r6是h或-cf3;且r7是h。在一些实施方案中,x1是c-h;x2是n-rc;rc是h;x3是c;x4是c;x5、x6、x7和x8各自为c-h;r5是h或-cf3;r6是h或-cf3;且r7是h。在一些实施方案中,x1是c-h;x2是n-rc;rc是c
1-c6烷基;x3是c;x4是c;x5、x6、x7和x8各自为c-h;r5是h或-cf3;r6是h或-cf3;且r7是h。
[0230]
在一些实施方案中,x1是c-h;x2是n-rc;rc是h或c
1-c6烷基;x3是c;x4是c;x5是n;x6、x7和x8各自为c-h;r5是h或-cf3;r6是h或-cf3;且r7是h。在一些实施方案中,x1是c-h;x2是n-rc;rc是h;x3是c;x4是c;x5是n;x6、x7和x8各自为c-h;r5是h或-cf3;r6是h或-cf3;且r7是h。在一些实施方案中,x1是c-h;x2是n-rc;rc是c
1-c6烷基;x3是c;x4是c;x5是n;x6、x7和x8各自为c-h;r5是h或-cf3;r6是h或-cf3;且r7是h。
[0231]
在一些实施方案中,rc是h。在一些实施方案中,rc是c
1-c6烷基。在一些实施方案中,rc的c
1-c6烷基是甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基或叔丁基。
[0232]
在一些实施方案中,r5是h或-cf3。在一些实施方案中,r6是h或-cf3。在一些实施方案中,r5是h,且r6是-cf3。在一些实施方案中,r5是-cf3,且r6是h。
[0233]
在一些实施方案中,l3是-ch
2-、-ch2ch
2-、-ch(ch3)-、-c(ch3)
2-、-o-、-och
2-、-och2ch
2-、-och(ch3)-、-oc(ch3)
2-、-nh-、-nhch
2-、-nhch2ch
2-、-nhch(ch3)-或-nhc(ch3)
2-。
[0234]
在一些实施方案中,l3是-ch
2-、-o-或-nh-。
[0235]
在一些实施方案中,l3是-ch
2-。
[0236]
在一些实施方案中,是
[0237]
另一方面,本文描述了式(xii)的化合物或其药学上可接受的盐或溶剂合物:
[0238][0239]
其中,
[0240]
l1不存在、为c
1-c4亚烷基或c
3-c6亚环烷基;
[0241]
环a是苯基或c
3-c
12
环烷基;
[0242]
l2不存在、为c
1-c4亚烷基或c
3-c6亚环烷基;
[0243]
每个r2独立地选自h、卤素、-oh、-cn、-nh2、-nh(c
1-c6烷基)、-n(c
1-c6烷基)2、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基和c
1-c6杂烷基;
[0244]
ra是h、卤素、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基或c
1-c6杂烷基;
[0245]
x8是c-r4或n;
[0246]
每个r4、r5、r6和r7独立地选自h、卤素、-cn、-oh、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基、c
1-c6杂烷基、取代或未取代的c
3-c6环烷基、取代或未取代的c
2-c6杂环烷基、取代或未取代的苯基、取代未取代的单环杂芳基、-n(r
13
)2、-n(r
13
)c(=o)r
12
、-c(=o)n(r
13
)2、-c(=o)r
12
、-sr
13
、-s(=o)r
12
、-s(=o)2r
12
、-s(=o)2n(r
13
)2、-oc(=o)r
12
和-co2r
13
;
[0247]
每个r8、r9和r
10
独立地选自h、卤素、-cn、-oh、c
1-c6烷基、c
1-c6烷氧基、c
1-c6氟烷基、c
1-c6氟烷氧基、c
1-c6杂烷基、取代或未取代的c
3-c6环烷基、取代或未取代的c
2-c6杂环烷基、取代或未取代的苯基、取代未取代的单环杂芳基、-n(r
13
)2、-n(r
13
)c(=o)r
12
、-c(=o)n(r
13
)2、-c(=o)r
12
、-sr
13
、-s(=o)r
12
、-s(=o)2r
12
、-s(=o)2n(r
13
)2、-oc(=o)r
12
和-co2r
13
;
[0248]
每个r
12
独立地选自c
1-c6烷基、c
1-c6氟烷基、c
1-c6杂烷基、取代或未取代的c
3-c6环烷基、取代或未取代的c
2-c6杂环烷基、取代或未取代的苯基和取代未取代的单环杂芳基;
[0249]
每个r
13
独立地选自h、c
1-c6烷基、c
1-c6氟烷基、c
1-c6杂烷基、取代或未取代的c
3-c6环烷基、取代或未取代的c
2-c6杂环烷基、取代或未取代的苯基和取代未取代的单环杂芳基;
[0250]
或者同一n原子上的两个r
13
与它们所连接的n原子合起来形成取代或未取代的含n的c
2-c6杂环烷基;
[0251]
n是0、1或2。
[0252]
在一些实施方案中,l1不存在或为c
1-c4亚烷基。在一些实施方案中,l2不存在或为c
1-c4亚烷基。在一些实施方案中,l1不存在或为c
1-c4亚烷基,且l2不存在或为c
1-c4亚烷基。在一些实施方案中,l1不存在,且l2是c
1-c4亚烷基。
[0253]
在一些实施方案中,l1不存在、为-ch
2-、或环丙基-1,1-二基。在一些实施方案中,l2不存在、为-ch
2-、、或环丙基-1,1-二基。在一些实施方案中,l1不存在,且l2是-ch
2-、或环丙基-1,1-二基。在一些实施方案中,l1不存在,且l2是-ch
2-。
[0254]
在一些实施方案中,l1不存在;l2是-ch
2-;且环a是c
3-c
12
环烷基或c
2-c
10
杂环烷基。
[0255]
在一些实施方案中,是
和r
10
各自为h;且是
[0267]
本文涵盖上文针对各种变量所述的基团的任意组合。在整个说明书中,由本领域技术人员选择基团及其取代基以提供稳定的部分和化合物。
[0268]
式(i)的代表性化合物包括但不限于:
[0269]
[0270]
[0271]
[0272]
[0273]
[0274][0275]
在一些实施方案中,化合物包括但不限于:
[0276]
4-[(1s)-1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸;
[0277]
2-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸;
[0278]
4-[(1s)-1-[[4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸;
[0279]
2-[[4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸;
[0280]
4-[(1s)-1-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸;
[0281]
顺式-2-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸;
[0282]
反式-2-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸;
[0283]
顺式-6-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-2-甲酸;
[0284]
反式-2-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸;
[0285]
2-[3-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸;
[0286]
2-[3-[[4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸;
[0287]
4-[1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环丙基]苯甲酸;
[0288]
4-[(1r)-1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸;
[0289]
2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]苯基]乙酸;
[0290]
1-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]苯基]环丙烷甲酸;
[0291]
(1s,4s)-4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环己烷甲酸;
[0292]
(1r,4r)-4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环己烷甲酸;
[0293]
2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环己基]乙酸;
[0294]
2-(4-(4-(4-(三氟甲基)苄基)吡唑并[1,5-a]吡啶-3-甲酰胺基)双环[2.2.2]辛烷-1-基)乙酸;
[0295]
4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]双环[2.2.2]辛烷-1-甲酸;
[0296]
2-[3-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环戊基]乙酸;
[0297]
2-((1r,4r)-4-(4-(4-(三氟甲基)苄基)吡唑并[1,5-a]吡啶-3-甲酰胺基)环己基)乙酸;
[0298]
(1r,3s)-3-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环戊烷甲酸;
[0299]
(1r,4r)-4-[[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]甲基]环己烷甲酸;
[0300]
2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]苯基]丙酸;
[0301]
4-[[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]甲基]降冰片烷-1-甲酸。
[0302]
更多的化合物形式
[0303]
一方面,本文所述的化合物呈药学上可接受的盐的形式。同样,这些化合物的具有相同类型活性的活性代谢物也包括在本公开的范围内。此外,本文所述的化合物可以以非溶剂化形式以及与药学上可接受的溶剂如水、乙醇等的溶剂化形式存在。本文提供的化合物的溶剂化形式也被认为是本文公开的。
[0304]
如本文所用的“药学上可接受的”是指不消除所述化合物的生物活性或特性且相对无毒的物质,如载体或稀释剂,即,对个体施用所述物质不引起不良的生物作用或以不利的方式与包含所述物质的组合物的任何组分相互作用。
[0305]
术语“药学上可接受的盐”是指治疗活性剂的形式,其由所述治疗活性剂的阳离子形式与合适的阴离子组合组成,或者在替代实施方案中,由所述治疗活性剂的阴离子形式与合适的阳离子组合组成。handbook of pharmaceutical salts:properties,selection and use。international union of pure and applied chemistry,wiley-vch 2002。s.m.berge,l.d.bighley,d.c.monkhouse,j.pharm.sci.1977,66,1-19。p.h.stahl和
c.g.wermuth编,handbook of pharmaceutical salts:properties,selection and use,weinheim/z
ü
rich:wiley-vch/vhca,2002。药用盐通常比非离子物质更容易在胃液和肠液中溶解并且更快速溶解,因此可用于固体剂型。此外,因为它们的溶解度通常是ph的函数,所以有可能在消化道的一部分或另一部分中选择性溶解,并且这种能力可作为延迟和持续释放行为的一个方面来进行控制。另外,因为成盐分子可以与中性形式平衡,所以可以调节通过生物膜的过程。
[0306]
在一些实施方案中,通过使式(i)的化合物与酸反应获得药学上可接受的盐。在一些实施方案中,式(i)的化合物(即游离碱形式)是碱性的,并且与有机酸或无机酸反应。无机酸包括但不限于盐酸、氢溴酸、硫酸、磷酸、硝酸和偏磷酸。有机酸包括但不限于1-羟基-2-萘甲酸;2,2-二氯乙酸;2-羟基乙磺酸;2-氧代戊二酸;4-乙酰胺基苯甲酸;4-氨基水杨酸;乙酸;己二酸;抗坏血酸(l);天冬氨酸(l);苯磺酸;苯甲酸;樟脑酸(+);樟脑-10-磺酸(+);羊蜡酸(癸酸);羊油酸(己酸);羊脂酸(辛酸);碳酸;肉桂酸;柠檬酸;环拉酸;十二烷基硫酸;乙烷-1,2-二磺酸;乙磺酸;甲酸;富马酸;半乳糖二酸;龙胆酸;葡庚糖酸(d);葡糖酸(d);葡糖醛酸(d);谷氨酸;戊二酸;甘油磷酸;乙醇酸;马尿酸;异丁酸;乳酸(dl);乳糖醛酸;月桂酸;马来酸;苹果酸(-l);丙二酸;扁桃酸(dl);甲磺酸;萘-1,5-二磺酸;萘-2-磺酸;烟酸;油酸;草酸;棕榈酸;双羟萘酸;磷酸;丙酸;焦谷氨酸(-l);水杨酸;癸二酸;硬脂酸;琥珀酸;硫酸;酒石酸(+l);硫氰酸;甲苯磺酸(p);和十一碳烯酸。
[0307]
在一些实施方案中,通过使式(i)的化合物与碱反应获得药学上可接受的盐。在一些实施方案中,式(i)的化合物是酸性的,并且与碱反应。在这样的情况下,式(i)的化合物的酸性质子被金属离子置换,例如锂、钠、钾、镁、钙或铝离子。在一些情况下,本文所述的化合物与有机碱配位,所述有机碱如但不限于乙醇胺、二乙醇胺、三乙醇胺、氨丁三醇、葡甲胺、n-甲基葡糖胺、二环己胺、三(羟甲基)甲胺。在其它情况下,本文所述的化合物与氨基酸形成盐,所述氨基酸如但不限于精氨酸、赖氨酸等。用于与包括酸性质子的化合物形成盐的可接受的无机碱包括但不限于氢氧化铝、氢氧化钙、氢氧化钾、碳酸钠、碳酸钾、氢氧化钠、氢氧化锂等。在一些实施方案中,本文提供的化合物被制备为钠盐、钙盐、钾盐、镁盐、葡甲胺盐、n-甲基葡糖胺盐或铵盐。
[0308]
应当理解的是,提到药学上可接受的盐包括溶剂加成形式。在一些实施方案中,溶剂合物含有化学计量或非化学计量的量的溶剂,并且在结晶过程期间与药学上可接受的溶剂如水、乙醇等形成。当溶剂是水时形成水合物,或者当溶剂是醇时形成醇合物。本文所述的化合物的溶剂合物在进行本文所述的方法期间方便地制备或形成。此外,本文提供的化合物任选以非溶剂化以及溶剂化形式存在。
[0309]
本文所述的方法和制剂包括使用具有式(i)的结构的化合物的n-氧化物(如果适当的话)或药学上可接受的盐以及具有相同类型活性的这些化合物的活性代谢物。
[0310]
在一些实施方案中,式(i)的化合物的有机基团(例如烷基、芳族环)上的位点易受各种代谢反应的影响。在有机基团上结合适当的取代基将减少、最小化或消除这种代谢途径。在具体的实施方案中,降低或消除芳族环对代谢反应的敏感性的适当取代基有(仅举例来说)卤素、氘、烷基、卤代烷基或氘代烷基。
[0311]
在另一实施方案中,本文所述的化合物被同位素标记(例如用放射性同位素)或通过别的其它方式标记,包括但不限于使用发色团或荧光部分、生物发光标记或化学发光标
记。
[0312]
本文所述的化合物包括同位素标记的化合物,其与本文提供的各种化学式和结构中列举的那些相同,但其实一个或多个原子被原子质量或质量数不同于通常见于自然界中的原子质量或质量数的原子置换。可结合到本发明化合物中的同位素的实例包括氢、碳、氮、氧、硫、氟氯、碘、磷的同位素,举例如2h、3h、
13
c、
14
c、
15
n、
18
o、
17
o、
35
s、
18
f、
36
cl、
123
i、
124
i、
125
i、
131
i、
32
p和
33
p。一方面,本文所述的同位素标记化合物(例如放射性同位素如3h和
14
c结合到其中的那些)可用于药物和/或底物组织分布测定。一方面,用同位素如氘取代提供了某些治疗优势,这源于代谢稳定性更高,举例如体内半衰期增加或剂量需求降低。在一些实施方案中,式(i)的化合物的一个或多个氢被氘置换。
[0313]
在一些实施方案中,式(i)的化合物具有一个或多个立构中心,并且每个立构中心独立地以r或s构型存在。在一些实施方案中,式(i)的化合物以r构型存在。在一些实施方案中,式(i)的化合物以s构型存在。本文提供的化合物包括所有的非对映异构体、单独的对映异构体、阻转异构体和差向异构体形式以及它们的适当混合物。本文提供的化合物和方法包括所有的顺式(cis)、反式(trans)、顺位(syn)、反位(anti)、e型(entgegen,e)和z型(zusammen,z)异构体以及它们的适当混合物。
[0314]
如果需要的话,通过诸如立体选择性合成和/或通过手性色谱柱分离立体异构体或通过非手性或手性色谱柱分离非对映异构体或在适当的溶剂或溶剂混合物中结晶和重结晶的方法获得单独的立体异构体。在某些实施方案中,通过如下方式将式(i)的化合物制备为其单独的立体异构体,使化合物的外消旋混合物与光学活性拆分剂反应以形成非对映异构化合物/盐对,分离非对映异构体,并回收光学纯的单独对映异构体。在一些实施方案中,使用本文所述的化合物的共价非对映异构衍生物进行单独对映异构体的拆分。在另一实施方案中,通过基于溶解度差异的分离/拆分技术来分离非对映异构体。在其它实施方案中,通过色谱法或通过形成非对映异构盐并通过重结晶或色谱法或其任意组合分离来进行立体异构体的分离。jean jacques,andre collet,samuel h.wilen,“enantiomers,racemates and resolutions”,john wiley and sons,inc.,1981。在一些实施方案中,通过立体选择性合成获得立体异构体。
[0315]
在一些实施方案中,本文所述的化合物被制备为前药。“前药”是指在体内被转化成母体药物的剂。前药通常是有用的,因为在一些情况下,它们比母体药物更容易施用。例如,它们通过口服施用是生物可利用的,而母体不是。进一步地或替代地,前药在药物组合物中的溶解度也比母体药物提高。在一些实施方案中,前药的设计增加了有效的水溶解度。前药的非限制性实例有本文所述的化合物,其作为酯(“前药”)施用,但然后被代谢水解以提供活性实体。前药的进一步的实例有与酸基团键合的短肽(聚氨基酸),其中肽被代谢以暴露活性部分。在某些实施方案中,在体内施用后,前药被化学转化为所述化合物的生物、药学或治疗活性形式。在某些实施方案中,前药通过一个或多个步骤或过程被酶促代谢为所述化合物的生物、药学或治疗活性形式。
[0316]
本文所述的化合物的前药包括但不限于酯、醚、碳酸酯、硫代碳酸酯、n-酰基衍生物、n-酰氧基烷基衍生物、n-烷氧基酰基衍生物、叔胺的季衍生物、n-曼尼希碱、席夫碱、氨基酸缀合物、磷酸酯和磺酸酯。参见例如design of prodrugs,bundgaard,a.编,elseview,1985和method in enzymology,widder,k.等人编;academic,1985,第42卷,第309-396页;
bundgaard,h.“design and application of prodrugs”,见a textbook of drug design and development,krosgaard-larsen和h.bundgaard编,1991,第5章,第113-191页;和bundgaard,h.,advanced drug delivery review,1992,8,1-38,每篇文献以引用的方式并入本文。在一些实施方案中,本文公开的化合物中的羟基用于形成前药,其中羟基被结合到酰氧基烷基酯、烷氧基羰基氧基烷基酯、烷基酯、芳基酯、磷酸酯、糖酯、醚等中。在一些实施方案中,本文公开的化合物中的羟基是前药,其中羟基然后在体内代谢以提供羧酸基团。在一些实施方案中,羧基用于提供酯或酰胺(即前药),其然后在体内代谢以提供羧酸基团。在一些实施方案中,本文所述的化合物被制备为烷基酯前药。
[0317]
本文所述的化合物的前药形式(其中前药在体内代谢以产生如本文所列举的式(i)的化合物)包括在权利要求的范围内。在一些情况下,一些本文所述的化合物是另一种衍生物或活性化合物的前药。
[0318]
在一些实施方案中,羟基、氨基和/或羧酸基团中的任一者以合适的方式被官能化以提供前药部分。在一些实施方案中,前药部分如上所述。
[0319]
在另外或进一步的实施方案中,本文所述的化合物在施用给有需要的生物体后被代谢以产生代谢物,然后所述代谢物用于产生所需效果,包括所需的治疗效果。
[0320]
本文公开的化合物的“代谢物”是当所述化合物被代谢时形成的该化合物的衍生物。术语“活性代谢物”是指化合物的生物活性衍生物,其是当所述化合物被代谢时形成的。如本文所用的术语“代谢”是指生物体改变特定物质的过程(包括但不限于水解反应和由酶催化的反应)的总和。因此,酶可以对化合物产生特定的结构改变。例如,细胞色素p450催化多种氧化和还原反应,而尿苷二磷酸葡糖醛转移酶催化活化的葡糖醛酸分子向芳族醇、脂族醇、羧酸、胺和游离巯基的转移。本文公开的化合物的代谢物任选通过对宿主施用化合物并分析来自宿主的组织样品或通过将化合物与肝细胞一起在体外温育并分析所得化合物来确认。
[0321]
化合物的合成
[0322]
采用标准合成技术或采用本领域中已知的方法结合本文所述的方法来合成本文所述的式(i)的化合物。除另有说明外,采用质谱法、nmr、hplc、蛋白质化学、生物化学、重组dna技术和药理学的常规方法。
[0323]
采用标准有机化学技术制备化合物,举例如march’s advanced organic chemistry,第6版,john wiley and sons,inc中描述的那些。可以采用本文所述的合成转化的替代反应条件,如改变溶剂、反应温度、反应时间以及不同的化学试剂及其它反应条件。
[0324]
在一些实施方案中,如实施例中概述的那样合成本文所述的化合物。
[0325]
某些术语
[0326]
除另有说明外,本技术中使用的以下术语具有下面给出的定义。术语“包括(including)”以及其它形式如“包括(include)”、“包括(includes)”和“包括(included)”的使用不是限制性的。本文使用的章节标题仅用于组织目的,不要被解释为限制所述主题。
[0327]
如本文所用,c
1-c
x
包括c
1-c2、c
1-c3...c
1-c
x
。仅举例来说,定名为“c
1-c
4”的基团表示在所述部分中有一至四个碳原子,即含有1个碳原子、2个碳原子、3个碳原子或4个碳原子的基团。因此,仅举例来说,“c
1-c4烷基”表示在烷基中有一至四个碳原子,即烷基选自甲基、
乙基、丙基、异丙基、正丁基、异丁基、仲丁基和叔丁基。
[0328]“烷基”是指脂族烃基。烷基是支链或直链的。在一些实施方案中,“烷基”具有1至10个碳原子,即c
1-c
10
烷基。每当诸如“1至10”的数字范围在本文中出现时,其是指给定范围内的每个整数;例如,“1至10个碳原子”意指烷基由1个碳原子、2个碳原子、3个碳原子等组成,最多并且包括10个碳原子,尽管本定义还涵盖其中未指定数字范围的术语“烷基”的出现。在一些实施方案中,烷基是c
1-c6烷基。一方面,烷基是甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基。典型的烷基包括但决不限于甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、新戊基或己基。
[0329]“亚烷基”是指二价烷基。任何上面提到的单价烷基可以通过从烷基中抽出第二个氢原子而成为亚烷基。在一些实施方案中,亚烷基是c
1-c6亚烷基。在其它实施方案中,亚烷基是c
1-c4亚烷基。典型的亚烷基包括但不限于-ch
2-、-ch(ch3)-、-c(ch3)
2-、-ch2ch
2-、-ch2ch(ch3)-、-ch2c(ch3)
2-、-ch2ch2ch
2-、-ch2ch2ch2ch
2-等。
[0330]
术语“烯基”是指其中存在至少一个碳-碳双键的一类烷基。在一个实施方案中,烯基具有式
–
c(r)=cr2,其中r是指烯基的剩余部分,其可以是相同的或不同的。在一些实施方案中,r是h或烷基。烯基的非限制性实例包括-ch=ch2、-c(ch3)=ch2、-ch=chch3、-c(ch3)=chch3和
–
ch2ch=ch2。
[0331]
术语“炔基”是指其中存在至少一个碳-碳三键的一类烷基。在一个实施方案中,烯基具有式-c≡c-r,其中r是指炔基的剩余部分。在一些实施方案中,r是h或烷基。炔基的非限制性实例包括-c≡ch、-c≡cch
3-c≡cch2ch3、-ch2c≡ch。
[0332]“烷氧基”是指(烷基)o-基团,其中烷基如本文所定义。
[0333]
术语“烷基胺”是指-nh(烷基)或-n(烷基)2。
[0334]
术语“芳族”是指具有含4n+2个π电子的离域π-电子体系的平面环,其中n是整数。术语“芳族”包括碳环芳基(“芳基”,例如苯基)和杂环芳基(或“杂芳基”或“杂芳族”)基团(例如,吡啶)。该术语包括单环或稠合环多环(即,共享相邻碳原子对的环)基团。
[0335]
术语“碳环的”或“碳环”是指其中形成环的骨架的原子都是碳原子的环或环体系。因此该术语将碳环与其中环骨架含有至少一个不同于碳的原子的“杂环”状环或“杂环”区分开来。在一些实施方案中,双环碳环的两个环中的至少一个是芳族的。在一些实施方案中,双环碳环的两个环都是芳族的。
[0336]
如本文所用,术语“芳基”是指其中形成环的每个原子都是碳原子的芳族环。一方面,芳基是苯基或萘基。在一些实施方案中,芳基是苯基。在一些实施方案中,芳基是c
6-c
10
芳基。根据结构,芳基是单价基团或二价基团(即,亚芳基)。
[0337]
术语“环烷基”是指单环或多环脂族非芳族基团,其中形成环的每个原子(即骨架原子)都是碳原子。在一些实施方案中,环烷基是螺环或桥连化合物。在一些实施方案中,环烷基任选与芳族环稠合,并且连接点在不是芳族环碳原子的碳上。环烷基包括具有3至10个环原子的基团。在一些实施方案中,环烷基选自环丙基、环丁基、环戊基、环戊烯基、环己基、环己烯基、环庚基、环辛基、螺[2.2]戊基、降冰片基和双环[1.1.1]戊基、双环[3.3.0]辛烷、双环[4.3.0]壬烷、顺式-十氢萘、反式-十氢萘、双环[2.1.1]己烷、双环[2.2.1]庚烷、双环[2.2.2]辛烷、双环[3.2.2]壬烷和双环[3.3.2]癸烷、金刚烷基、降冰片基和十氢萘基。在一些实施方案中,环烷基是c
3-c6环烷基。
[0338]
术语“卤代”或者“卤素”或“卤化物”意指氟代、氯代、溴代或碘代。在一些实施方案中,卤代是氟代、氯代或溴代。
[0339]
术语“氟烷基”是指其中一个或多个氢原子被氟原子置换的烷基。一方面,氟烷基是c
1-c6氟烷基。
[0340]
术语“杂烷基”是指其中烷基的一个或多个骨架原子选自除碳以外的原子的烷基,例如选自氧、氮(例如
–
nh-、-n(烷基)-、硫或其组合。杂烷基在所述杂烷基的碳原子处与分子的其余部分连接。一方面,杂烷基是c
1-c6杂烷基。
[0341]
这种杂烷基的实例有例如-ch2och3、-ch2ch2och3、-ch2ch2och2ch2och3、-ch(ch3)och3、-ch2nhch3、-ch2n(ch3)2和-ch2sch3。
[0342]
术语“杂环”或“杂环的”是指在环中含有一至四个杂原子的杂芳族环(也称为杂芳基)和杂环烷基环(也称为杂脂环基团),其中环中的每个杂原子选自o、s和n,其中每个杂环基团在其环体系中具有3至10个原子,且条件是任何环都不含有两个相邻的o或s原子。非芳族杂环基团(也称为杂环烷基)包括在其环体系中具有3至10个原子的环,并且芳族杂环基团包括在其环体系中具有5至10个原子的环。杂环基团包括苯并稠合环体系。非芳族杂环基团的实例有吡咯烷基、四氢呋喃基、二氢呋喃基、四氢噻吩基、噁唑烷酮基、四氢吡喃基、二氢吡喃基、四氢噻喃基、哌啶基、吗啉基、硫代吗啉基、噻噁烷基、哌嗪基、氮丙啶基、氮杂环丁烷基、氧杂环丁烷基、硫杂环丁烷基、高哌啶基、氧杂环庚烷基、硫杂环庚烷基、氧氮杂环庚三烯基、二氮杂环庚三烯基、硫氮杂环庚三烯基、1,2,3,6-四氢吡啶基、吡咯啉-2-基、吡咯啉-3-基、吲哚啉基、2h-吡喃基、4h-吡喃基、二噁烷基、1,3-二氧戊环基、吡唑啉基、二噻烷基、二硫环戊基、二氢吡喃基、二氢噻吩基、二氢呋喃基、吡唑烷基、咪唑啉基、咪唑烷基、3-氮杂双环[3.1.0]己烷基、3-氮杂双环[4.1.0]庚烷基、3h-吲哚基、吲哚啉-2-酮基、异吲哚啉-1-酮基、异吲哚啉-1,3-二酮基、3,4-二氢异喹啉-1(2h)-酮基、3,4-二氢喹啉-2(1h)-酮基、异吲哚啉-1,3-二硫酮基、苯并[d]噁唑-2(3h)-酮基、1h-苯并[d]咪唑-2(3h)-酮基、苯并[d]噻唑-2(3h)-酮基和喹嗪基。芳族杂环基团的实例有吡啶基、咪唑基、嘧啶基、吡唑基、三唑基、吡嗪基、四唑基、呋喃基、噻吩基、异噁唑基、噻唑基、噁唑基、异噻唑基、吡咯基、喹啉基、异喹啉基、吲哚基、苯并咪唑基、苯并呋喃基、噌啉基、吲唑基、吲哚嗪基、酞嗪基、哒嗪基、三嗪基、异吲哚基、蝶啶基、嘌呤基、噁二唑基、噻二唑基、呋咱基、苯并呋咱基、苯并苯硫基、苯并噻唑基、苯并噁唑基、喹唑啉基、喹喔啉基、萘啶基和呋喃并吡啶基。在可能的情况下,前述基团是c-连接的(或c-链接的)或n-连接的。例如,衍生自吡咯的基团包括吡咯-1-基(n-连接的)或吡咯-3-基(c-连接的)。进一步地,衍生自咪唑的基团包括咪唑-1-基或咪唑-3-基(均为n-连接的)或咪唑-2-基、咪唑-4-基或咪唑-5-基(均为c-连接的)。杂环基团包括苯并稠合环体系。非芳族杂环任选被一个或两个氧代(=o)部分取代,如吡咯烷-2-酮。在一些实施方案中,双环杂环的两个环中的至少一个是芳族的。在一些实施方案中,双环杂环的两个环都是芳族的。
[0343]
术语“杂芳基”或者“杂芳族”是指包括一个或多个选自氮、氧和硫的环杂原子的芳基。杂芳基的说明性实例包括单环杂芳基和双环杂芳基。单环杂芳基包括吡啶基、咪唑基、嘧啶基、吡唑基、三唑基、吡嗪基、四唑基、呋喃基、噻吩基、异噁唑基、噻唑基、噁唑基、异噻唑基、吡咯基、哒嗪基、三嗪基、噁二唑基、噻二唑基和呋咱基。双环杂芳基包括吲哚嗪、吲哚、苯并呋喃、苯并噻吩、吲唑、苯并咪唑、嘌呤、喹嗪、喹啉、异喹啉、噌啉、酞嗪、喹唑啉、喹
喔啉、1,8-萘啶和蝶啶。在一些实施方案中,杂芳基在环中含有0-4个n原子。在一些实施方案中,杂芳基在环中含有1-4个n原子。在一些实施方案中,杂芳基在环中含有0-4个n原子、0-1个o原子和0-1个s原子。在一些实施方案中,杂芳基在环中含有1-4个n原子、0-1个o原子和0-1个s原子。在一些实施方案中,杂芳基是c
1-c9杂芳基。在一些实施方案中,单环杂芳基是c
1-c5杂芳基。在一些实施方案中,单环杂芳基是5元或6元杂芳基。在一些实施方案中,双环杂芳基是c
6-c9杂芳基。
[0344]“杂环烷基”或“杂脂环族”基团是指包括至少一个选自氮、氧和硫的杂原子的环烷基。在一些实施方案中,杂环烷基与芳基或杂芳基稠合。在一些实施方案中,杂环烷基是噁唑烷酮基、吡咯烷基、四氢呋喃基、四氢噻吩基、四氢吡喃基、四氢噻喃基、哌啶基、吗啉基、硫代吗啉基、哌嗪基、哌啶-2-酮基、吡咯烷-2,5-二硫酮基、吡咯烷-2,5-二酮基、吡咯烷酮基、咪唑烷基、咪唑烷-2-酮基或噻唑烷-2-酮基。术语杂脂环族还包括碳水化合物(包括但不限于单糖、二糖和寡糖)的所有环形式。一方面,杂环烷基是c
2-c
10
杂环烷基。另一方面,杂环烷基是c
4-c
10
杂环烷基。在一些实施方案中,杂环烷基在环中含有0-2个n原子。在一些实施方案中,杂环烷基在环中含有0-2个n原子、0-2个o原子和0-1个s原子。
[0345]
术语“键”或“单键”是指两个原子之间的化学键,或者当通过键连接的原子被认为是较大子结构的一部分时两个部分之间的化学键。一方面,当本文所述的基团是键时,所提到的基团不存在,从而允许在剩余的确认基团之间形成键。
[0346]
术语“部分”是指分子的特定片段或官能团。化学部分通常被认为是嵌入或附加于分子的化学实体。
[0347]
术语“任选取代的”或“取代的”意指所提到的基团任选被一个或多个单独且独立地选自卤素、-cn、-nh2,-nh(烷基)、-n(烷基)2,-oh,-co2h,-co2烷基、-c(=o)nh2,-c(=o)nh(烷基)、-c(=o)n(烷基)2,-s(=o)2nh2,-s(=o)2nh(烷基)、-s(=o)2n(烷基)2、烷基、环烷基、氟烷基、杂烷基、烷氧基、氟烷氧基、杂环烷基、芳基、杂芳基、芳氧基、烷硫基、芳硫基、烷基亚砜、芳基亚砜、烷基砜和芳基砜的另外的基团取代。在一些其它实施方案中,任选的取代基独立地选自卤素、-cn、-nh2、-nh(ch3)、-n(ch3)2、-oh、-co2h、-co2(c
1-c4烷基)、-c(=o)nh2、-c(=o)nh(c
1-c4烷基)、-c(=o)n(c
1-c4烷基)2、-s(=o)2nh2、-s(=o)2nh(c
1-c4烷基)、-s(=o)2n(c
1-c4烷基)2、c
1-c4烷基、c
3-c6环烷基、c
1-c4氟烷基、c
1-c4杂烷基、c
1-c4烷氧基、c
1-c4氟烷氧基、-sc
1-c4烷基、-s(=o)c
1-c4烷基和-s(=o)2c
1-c4烷基。在一些实施方案中,任选的取代基独立地选自卤素、-cn、-nh2、-oh、-nh(ch3)、-n(ch3)2、-ch3、-ch2ch3、-cf3、-och3和-ocf3。在一些实施方案中,取代的基团被一个或两个前述基团取代。在一些实施方案中,脂族碳原子(无环或环状)上的任选取代基包括氧代(=o)。
[0348]
如本文所用的关于制剂、组合物或成分的术语“可接受的”意指对所治疗的受试者的总体健康状况没有持久的不利影响。
[0349]
如本文所用的术语“调节”意指直接或间接地与靶标相互作用,以便改变靶标的活性,包括(仅举例来说)增强靶标的活性、抑制靶标的活性、限制靶标的活性或延长靶标的活性。在一些实施方案中,“调节”意指直接或间接地与靶标相互作用,以便降低或抑制受体活性,
[0350]
如本文所用的术语“调节剂”是指直接或间接地与靶标相互作用的分子。相互作用包括但不限于激动剂、部分激动剂、反向激动剂、拮抗剂或其组合的相互作用。在一些实施
方案中,调节剂是拮抗剂。受体拮抗剂是受体活性的抑制剂。拮抗剂模拟与受体结合并阻止受体被天然配体激活的配体。阻止激活可具有许多影响。如果与受体结合的天然激动剂导致细胞功能的增加,则结合并阻断此受体的拮抗剂降低该功能。
[0351]
如本文所用的术语“施用(administer/administering/administration)”是指可用于实现向所需生物作用部位递送化合物或组合物的方法。这些方法包括但不限于口服途径、十二指肠内途径、肠胃外注射(包括静脉内、皮下、腹膜内、肌内、血管内或输注)、局部和直肠施用。本领域技术人员熟悉可与本文所述的化合物和方法一起使用的施用技术。在一些实施方案中,口服施用本文所述的化合物和组合物。
[0352]
如本文所用的术语“共同施用”等意指涵盖对单个患者施用选定的治疗剂,并且旨在包括其中通过相同或不同的施用途径或在相同或不同的时间施用剂的治疗方案。
[0353]
如本文所用的术语“有效量”或“治疗有效量”是指所施用的足够量的剂或化合物,其将在一定程度上缓解所治疗的疾病或疾患的一种或多种症状。结果包括疾病的病征、症状或病因的减少和/或减轻,或生物系统的任何其它所需的改变。例如,用于治疗用途的“有效量”是提供疾病症状的临床显著减少所需的包含本文公开的化合物的组合物的量。任选采用诸如剂量递增研究的技术来确定在任何个别情况下适当的“有效”量。
[0354]
如本文所用的术语“增强(enhance/enhancing)”意指增加或延长所需作用的效力或持续时间。因此,关于增强治疗剂的作用,术语“增强”是指在效力或持续时间方面增加或延长其它治疗剂对系统的作用的能力。如本文所用的“增强有效量”是指足以增强另一种治疗剂在所需系统中的作用的量。
[0355]
术语“试剂盒”和“制品”用作同义词。
[0356]
术语“受试者”或“患者”涵盖哺乳动物。哺乳动物的实例包括但不限于哺乳动物类的任何成员:人、非人灵长类动物如黑猩猩及其它猿类和猴物种;农场动物,如牛、马、绵羊、山羊、猪;家养动物,如兔子、狗和猫;实验室动物,包括啮齿动物,如大鼠、小鼠和豚鼠等。一方面,哺乳动物是人。
[0357]
如本文所用的术语“治疗(treat/treating/treatment)”包括预防性和/或治疗性地缓解、减轻或改善疾病或疾患的至少一种症状;预防另外的症状;抑制疾病或疾患,例如阻止疾病或疾患的发展、缓解疾病或疾患、使疾病或疾患消退、减轻由疾病或疾患引起的状况或者使疾病或疾患的症状停止。
[0358]
药物组合物
[0359]
在一些实施方案中,本文所述的化合物被配制成药物组合物。使用一种或多种药学上可接受的非活性成分以常规方式配制药物组合物,所述非活性成分有助于将活性化合物加工成药学上使用的制剂。适当的制剂取决于选择的施用途径。本文所述的药物组合物的概述见于例如remington:the science and practice of pharmacy,第十九版(easton,pa.:mack publishing company,1995);hoover,john e.,remington’s pharmaceutical sciences,mack publishing co.,easton,pennsylvania 1975;liberman,h.a.和lachman,l.编,pharmaceutical dosage forms,marcel decker,new york,n.y.,1980;和pharmaceutical dosage forms and drug delivery systems,第七版(lippincott williams&wilkins1999),这种公开内容以引用的方式并入本文。
[0360]
在一些实施方案中,本文所述的化合物单独施用或在药物组合物中与药学上可接
受的载体、赋形剂或稀释剂组合施用。本文所述的化合物和组合物的施用可通过能够将化合物递送至作用部位的任何方法来实现。这些方法包括但不限于经由肠内途径(包括口服、胃或十二指肠饲管、直肠栓剂和直肠灌肠剂)、肠胃外途径(注射或输注,包括动脉内、心内、真皮内、十二指肠内、髓内、肌内、骨内、腹膜内、鞘内、血管内、静脉内、玻璃体内、硬膜外和皮下)、吸入、透皮、透粘膜、舌下、口腔和局部(包括表皮、真皮、灌肠剂、滴眼剂、滴耳剂、鼻内、阴道)施用来递送,尽管最合适的途径可能取决于例如接受者的疾患和病症。仅举例来说,本文所述的化合物可通过例如手术期间的局部输注、局部施加如乳膏或软膏、注射、导管或植入物来局部施用于需要治疗的区域。施用也可以是通过在患病组织或器官的部位直接注射。
[0361]
在一些实施方案中,适合于口服施用的药物组合物呈现为离散单位,如各自含有预定量活性成分的胶囊、扁囊或片剂;粉末或颗粒;在水性液体或非水性液体中的溶液或悬浮液;或水包油液体乳液或油包水液体乳液。在一些实施方案中,活性成分呈现为大丸剂、药糖剂或糊剂。
[0362]
可以口服使用的药物组合物包括片剂、由明胶制成的推入配合(push-fit)胶囊以及由明胶和增塑剂如甘油或山梨糖醇制成的软密封胶囊。片剂可通过任选与一种或多种辅助成分一起压制或模制而制成。可通过在合适的机器中压制任选与粘结剂、惰性稀释剂或润滑剂、表面活性剂或分散剂混合的自由流动形式(如粉末或颗粒)的活性成分来制备压制片剂。可通过在合适的机器中模制用惰性液体稀释剂润湿的粉状化合物的混合物而制成模制片剂。在一些实施方案中,片剂被包衣或刻痕并且被配制,以便提供其中的活性成分的缓慢或受控释放。用于口服施用的所有制剂的剂量应适合于这种施用。推入配合胶囊可含有与填充剂如乳糖、粘结剂如淀粉和/或润滑剂如滑石或硬脂酸镁以及任选稳定剂混合的活性成分。在软胶囊中,活性化合物可溶解或悬浮在合适的液体中,如脂肪油、液体石蜡或液体聚乙二醇。在一些实施方案中,添加稳定剂。糖衣丸芯提供有合适的包衣。为此目的,可以使用浓缩糖溶液,其可任选含有阿拉伯树胶、滑石、聚乙烯吡咯烷酮、卡波普凝胶、聚乙二醇和/或二氧化钛、漆溶液及合适的有机溶剂或溶剂混合物。可以将染料或颜料添加到片剂或糖衣丸包衣中,用于确认或表征活性化合物剂量的不同组合。
[0363]
在一些实施方案中,药物组合物被配制成用于通过注射进行肠胃外施用,例如通过推注或连续输注。用于注射的制剂可呈单位剂型,例如在安瓿或多剂量容器中,添加有防腐剂。组合物可采取诸如在油性或水性媒介物中的悬浮液、溶液或乳液的形式,并且可含有配制剂,如悬浮剂、稳定剂和/或分散剂。组合物可存在于单位剂量或多剂量容器中,例如密封的安瓿和小瓶中,并且可以以粉末形式或在冷冻干燥(冻干)条件下储存,仅需要在临使用之前添加无菌液体载体,例如盐水或无菌无热原水。临时注射溶液和悬浮液可由前述种类的无菌粉末、颗粒和片剂制备。
[0364]
用于肠胃外施用的药物组合物包括活性化合物的水性和非水性(油性)无菌注射溶液,其可含有抗氧化剂、缓冲剂、抑菌剂和使制剂与预期接受者的血液等渗的溶质;以及可包括悬浮剂和增稠剂的水性和非水性无菌悬浮液。合适的亲脂性溶剂或媒介物包括脂肪油如芝麻油,或合成脂肪酸酯如油酸乙酯,或甘油三酯或脂质体。水性注射悬浮液可含有增加悬浮液粘度的物质,如羧甲基纤维素钠、山梨糖醇或葡聚糖。任选地,悬浮液还可以含有合适的稳定剂或增加化合物溶解度的试剂,以允许制备高度浓缩的溶液。
[0365]
应当理解的是,除了上面特别提到的成分之外,考虑到所讨论的制剂类型,本文所述的化合物和组合物还可以包括本领域中常规的其它试剂,例如适合于口服施用的那些可包括调味剂。
[0366]
治疗方法、给药和治疗方案
[0367]
本文公开的化合物或其药学上可接受的盐、溶剂合物或立体异构体可用于调节前列腺素受体。在一些实施方案中,由所述化合物和方法调节的前列腺素受体是前列腺素e2受体4(ep4)。
[0368]
本文提供了前列腺素e2受体4(ep4)的拮抗剂,其可用于治疗与ep4活性相关的一种或多种疾病或病症。
[0369]
在一些实施方案中,本文描述了治疗疾病或病症的方法,其中所述疾病或病症是癌症、过度增殖性病症、自身免疫性病症或炎性病症。
[0370]
在一个实施方案中,本文所述的化合物或其药学上可接受的盐用于制备药物,所述药物用于治疗哺乳动物的将受益于抑制或降低ep4活性的疾病或疾患。在需要治疗的哺乳动物中治疗本文所述的任何疾病或疾患的方法涉及对所述哺乳动物施用治疗有效量的药物组合物,所述药物组合物包括至少一种本文所述的化合物或其药学上可接受的盐、活性代谢物、前药或药学上可接受的溶剂合物。
[0371]
在某些实施方案中,施用含有本文所述的化合物的组合物用于预防性和/或治疗性治疗。在某些治疗应用中,对已经罹患疾病或疾患的哺乳动物施用所述组合物,其量足以治愈或至少部分地阻止所述疾病或疾患的至少一种症状。对于这种用途有效的量取决于所述疾病或疾患的严重程度和病程、先前的治疗、哺乳动物的健康状况、体重和对药物的反应以及医护从业人员的判断。治疗有效量任选通过包括但不限于剂量递增和/或剂量范围临床试验的方法确定。
[0372]
在预防性应用中,将含有本文所述的化合物的组合物施用给易患特定疾病、病症或疾患或不然有患特定疾病、病症或疾患风险的哺乳动物。这样的量被定义为“预防有效量或剂量”。在这种用途中,精确的量还取决于哺乳动物的健康状况、体重等。当用于哺乳动物时,这种用途的有效量将取决于疾病、病症或疾患的严重程度和病程、先前的治疗、哺乳动物的健康状况和对药物的反应以及医护专业人员的判断。一方面,预防性治疗包括对先前经历了所治疗的疾病的至少一种症状并且目前处于缓解中的哺乳动物施用包含本文所述的化合物或其药学上可接受的盐的药物组合物,以便防止疾病或疾患的症状重新出现。
[0373]
在哺乳动物的疾患没有改善的某些实施方案中,经医护专业人员的判断,化合物的施用是长期施用,即持续延长的时间段,包括贯穿哺乳动物生命的持续时间,以便改善或以其它方式控制或限制哺乳动物的疾病或疾患的症状。
[0374]
在哺乳动物的状态确实改善的某些实施方案中,将所施用的药物的剂量暂时减少或暂时中止一段时间(即,“药物假期”)。在具体的实施方案中,药物假期的长度在2天与1年之间,包括(仅举例来说)2天、3天、4天、5天、6天、7天、10天、12天、15天、20天、28天或超过28天。在药物假期期间剂量减少(仅举例来说)10%-100%,包括(仅举例来说)10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%和100%。
[0375]
一旦患者的疾患出现改善,必要时施用维持剂量。随后,在具体的实施方案中,根
据症状将施用的剂量或频率或这两者降低到保持疾病、病症或疾患改善的水平。然而在某些实施方案中,哺乳动物在任何症状复发后需要长期的间歇性治疗。
[0376]
对应于这种量的给定的剂的量根据多种因素如特定化合物、疾病状况及其严重程度、需要治疗的受试者或宿主的特质(例如,体重、性别)而变化,但仍然根据包括例如所施用的具体的剂、施用途径、所治疗的疾患和所治疗的受试者或宿主在内的围绕病例的特定情况确定。
[0377]
然而一般来说,用于成人治疗的剂量通常在每天0.01mg-5000mg的范围内。一方面,用于成人治疗的剂量为每天约1mg至约1000mg。在一个实施方案中,所需剂量方便地以单剂量或以同时或按适当间隔施用的分剂量提供,例如作为每天两个、三个、四个或更多个亚剂量。
[0378]
在一个实施方案中,适于本文所述的化合物或其药学上可接受的盐的日剂量为约0.01至约50mg/kg体重。在一些实施方案中,根据关于个体治疗方案的变量数,日剂量或剂型中活性物质的量低于或高于本文所指示的范围。在各种实施方案中,日剂量和单位剂量根据包括但不限于所使用的化合物的活性、要治疗的疾病或疾患、施用模式、个体受试者的要求、所治疗的疾病或疾患的严重程度和执业医师的判断的许多变量而改变。
[0379]
在细胞培养物或实验动物中通过标准药学程序确定这类治疗方案的毒性和治疗功效,包括但不限于测定ld
50
和ed
50
。毒性与治疗作用之间的剂量比为治疗指数,并且其表示为ld
50
与ed
50
之间的比率。在某些实施方案中,由细胞培养测定和动物研究获得的数据用于制定用于哺乳动物(包括人)的治疗有效日剂量范围和/或治疗有效单位剂量。在一些实施方案中,本文所述的化合物的日剂量在包括毒性最小的ed
50
的循环浓度范围内。在某些实施方案中,根据所使用的剂型和所采用的施用途径,日剂量范围和/或单位剂量在此范围内变化。
[0380]
在任何前述方面中进一步的实施方案中将有效量的本文所述的化合物或其药学上可接受的盐:(a)全身施用给哺乳动物;和/或(b)口服施用给哺乳动物;和/或(c)静脉内施用给哺乳动物;和/或(d)通过注射施用给哺乳动物;和/或(e)外用施用给哺乳动物;和/或(f)非全身或局部施用给哺乳动物。
[0381]
在任何前述方面中进一步的实施方案包括单次施用有效量的所述化合物,包括进一步的实施方案,其中(i)一天一次施用所述化合物,或(ii)经一天的时间对所述哺乳动物多次施用所述化合物。
[0382]
在任何前述方面中进一步的实施方案包括多次施用有效量的所述化合物,包括进一步的实施方案,其中(i)连续或间歇地施用所述化合物:如以单剂量;(ii)多次施用之间的时间为每隔6小时;(iii)每隔8小时对所述哺乳动物施用所述化合物;(iv)每隔12小时对所述哺乳动物施用所述化合物;(v)每隔24小时对所述哺乳动物施用所述化合物。在进一步或替代的实施方案中,所述方法包括药物假期,其中暂时中止化合物的施用或暂时减少施用化合物的剂量;在药物假期结束时,恢复化合物的给药。在一个实施方案中,药物假期的长度从2天至1年不等。
[0383]
在某些情况下,适当的是与一种或多种其它治疗剂组合施用至少一种本文所述的化合物或其药学上可接受的盐。在某些实施方案中,药物组合物还包含一种或多种抗癌剂。
[0384]
在一个实施方案中,本文所述的化合物之一的治疗有效性通过施用佐剂得到增强
(即,佐剂本身治疗益处最小,但在与另一种治疗剂组合的情况下,对患者的总体治疗益处得到增强)。或者,在一些实施方案中,通过将本文所述的化合物之一与也具有治疗益处的另一种剂(其也包括治疗方案)一起施用来增加患者所体验的益处。
[0385]
在一个具体实施方案中,本文所述的化合物或其药学上可接受的盐与第二治疗剂共同施用,其中本文所述的化合物或其药学上可接受的盐和第二治疗剂调节所治疗的疾病、病症或疾患的不同方面,从而提供比单独施用任一治疗剂更大的总体益处。
[0386]
在任何情况下,无论所治疗的疾病、病症或疾患如何,患者所体验的总体益处仅是两种治疗剂的加合,或者患者体验到协同益处。
[0387]
在某些实施方案中,当本文公开的化合物与一种或多种另外的剂(如另外的治疗有效药物、佐剂等)组合施用时,本文公开的化合物的不同治疗有效剂量将用于配制药物组合物和/或用于治疗方案中。用于组合治疗方案的药物及其它剂的治疗有效剂量任选通过与上文针对活性物质本身列举的那些类似的方式来确定。此外,本文所述的预防/治疗方法涵盖采用节拍式给药,即提供更频繁、更低的剂量,以便使毒副作用最小化。在一些实施方案中,组合治疗方案涵盖这样的治疗方案,其中在用本文所述的第二剂治疗之前、期间或之后开始施用本文所述的化合物或其药学上可接受的盐并持续,直到用第二剂治疗期间或用第二剂治疗终止之后的任何时间。其还包括其中本文所述的化合物或其药学上可接受的盐和组合使用的第二剂在治疗期间同时或在不同的时间和/或以减少或增加的间隔施用的治疗。组合治疗还包括在不同时间开始和停止的定期治疗,以协助患者的临床管理。
[0388]
要理解的是,根据多种因素(例如受试者罹患的疾病或病症;受试者的年龄、体重、性别、饮食和医疗状况)来修改治疗、预防或改善寻求缓解的疾病的给药方案。因此,在一些情况下,实际采用的给药方案会有所不同,并且在一些实施方案中,偏离本文中列出的给药方案。
[0389]
对于本文所述的组合疗法,共同施用的化合物的剂量根据所使用的共同药物的类型、所使用的具体药物、所治疗的疾病或疾患等而变化。在另外的实施方案中,当与一种或多种其它治疗剂共同施用时,本文提供的化合物与所述一种或多种其它治疗剂同时施用或顺序施用。
[0390]
在组合疗法中,多种治疗剂(其中之一是本文所述的化合物之一)以任意顺序施用或者甚至同时施用。如果施用是同时的,则多种治疗剂(仅举例来说)以单一统一的形式或以多种形式(例如,作为单一丸剂或作为两个分开的丸剂)提供。
[0391]
在疾病或疾患发生之前、期间或之后施用本文所述的化合物或其药学上可接受的盐以及组合疗法,并且施用含有化合物的组合物的时机有所不同。因此,在一个实施方案中,本文所述的化合物用作预防剂,并且连续施用给具有发生疾患或疾病的倾向的受试者,以便预防疾病或疾患的发生。在另一实施方案中,在症状发作期间或之后尽快地对受试者施用所述化合物和组合物。在具体的实施方案中,在检测到或怀疑疾病或疾患发作后在切实可行的情况下尽快施用本文所述的化合物,并且持续治疗疾病所需的时间长度。在一些实施方案中,治疗所需的时长有所不同,并且调节治疗时长以适应每个受试者的具体需要。例如,在具体实施方案中,持续至少2周、约1个月至约5年施用本文所述的化合物或含有所述化合物的制剂。
[0392]
在一些实施方案中,本文所述的化合物或其药学上可接受的盐与化学疗法、放射
疗法、单克隆抗体或其组合组合施用。
[0393]
化学疗法包括使用抗癌剂。
[0394]
实施例
[0395]
提供以下实施例仅用于说明目的,并不是限制本文提供的权利要求的范围。
[0396]
实施例1
–
4-[(1s)-1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸(化合物1)的合成
[0397][0398]
步骤1:4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸甲酯的制备
[0399][0400]
向4-溴吡唑并[1,5-a]吡啶-3-甲酸甲酯(708mg,2.77mmol,1当量)和4,4,5,5-四甲基-2-[[4-(三氟甲基)苯基]甲基]-1,3,2-二氧杂环戊硼烷(794.12mg,2.77mmol,1当量)在二噁烷(5ml)和h2o(1ml)中的溶液中添加pd(dppf)cl2(507.75mg,2.77mmol,1当量)和k3po4(697.2mg,2.77mmol,1当量)。将混合物在80℃下搅拌2小时。
[0401]
移除溶剂,得到粗产物。通过柱色谱法(sio2,石油醚/乙酸乙酯=100/1至0/1)纯化残留物,得到4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸甲酯(270mg,807.68μmol,29.10%收率),为白色固体。产物的lcms(esi):m/z 355.2[m+h]
+
。
[0402]1h nmr(400mhz,cdcl3)δ=8.51-8.48(m,2h),7.58(d,j=8.0hz,2h),7.33(d,j=8.0hz,2h),7.07(d,j=7.2hz,1h),6.96
–
6.92(m,1h),4.87(s,2h),3.87(s,3h)
[0403]
步骤2:4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸的制备
[0404][0405]
向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸甲酯(270mg,807.68μmol,1当量)在meoh(0.5ml)中的溶液中添加naoh(32.31mg,807.68μmol,1当量)和h2o
(0.5ml)。将混合物在40℃下搅拌4小时。
[0406]
移除溶剂,得到粗产物。用1n hcl将混合物调节至ph 4。将混合物过滤,并得到化合物4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(180mg,562.03μmol,69.59%收率),为白色固体。1h nmr(400mhz,dmso-d6)δ=12.3(br s,1h),8.77(d,j=6.8hz,1h),8.44(s,1h),7.62(d,j=8.4hz,2h),7.38-7.34(m,3h),7.12(t,j=6.8hz,1h),4.84(s,2h)
[0407]
步骤3:4-[(1s)-1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸甲酯的制备
[0408][0409]
向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(90mg,281.02μmol,1当量)和4-[(1s)-1-氨乙基]苯甲酸甲酯(75.54mg,421.53μmol,1.5当量)在dcm(8ml)中的溶液中添加hoat(7.65mg,56.20μmol,7.86μl,0.2当量)、et3n(142.18mg,1.41mmol,195.57μl,5当量)和edci(109.06mg,702.54μmol,124.36μl,2.5当量)。将混合物在25℃下搅拌16小时。
[0410]
移除溶剂,得到粗产物。通过柱色谱法(sio2,石油醚/乙酸乙酯=100/1至0/1)纯化残留物。得到化合物4-[(1s)-1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸甲酯(50mg,103.85μmol,36.95%收率),为白色固体,其不经进一步纯化即直接进入下一步使用。产物的lcms(esi):m/z 482.3[m+h]
+
。
[0411]
步骤4:化合物1即4-[(1s)-1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸的制备
[0412][0413]
向4-[(1s)-1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸甲酯(50mg,103.85μmol,1当量)在meoh(0.5ml)中的溶液中添加naoh(4.15mg,103.85μmol,1当量)和h2o(0.5ml)。将混合物在40℃下搅拌2小时。
[0414]
移除溶剂,得到粗产物。用1n hcl将混合物调节至ph 4。将混合物过滤,并得到化合物1,即4-[(1s)-1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸(10mg,19.68μmol,18.95%收率,92%纯度),为白色固体。产物的lcms(esi):m/z 468.1[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=8.72-8.68(m,2h),8.33(s,1h),7.91(d,j=
8.4hz,2h),7.50(d,j=8.4hz,2h),7.39-7.32(m,3h),7.19(d,j=8.4hz,2h),7.04(t,j=6.8hz,1h),5.17(t,j=7.2hz,1h),4.69(d,j=14.4hz,1h),4.49(d,j=14.4hz,1h),1.41(d,j=7.2hz,3h)
[0415]
实施例2
–
2-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(化合物2)的合成
[0416][0417]
步骤1:2-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸乙酯的制备
[0418][0419]
向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(90mg,281.02μmol,1当量)和2-氨基螺[3.3]庚烷-6-甲酸乙酯(77.24mg,421.53μmol,1.5当量)在dcm(8ml)中的溶液中添加hoat(7.65mg,56.20μmol,7.86μl,0.2当量)、et3n(142.18mg,1.41mmol,195.57μl,5当量)和edci(109.06mg,702.54μmol,2.5当量)。将混合物在25℃下搅拌16小时。
[0420]
移除溶剂,得到粗产物。通过柱色谱法(sio2,石油醚/乙酸乙酯=100/1至0/1)纯化残留物,得到2-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸乙酯(60mg,123.58μmol,43.98%收率),为白色固体,其不经进一步纯化即直接进入下一步使用。
[0421]
步骤2:化合物2即2-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸的制备
[0422][0423]
向2-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸乙酯(60mg,123.58μmol,1当量)在meoh(0.6ml)中的溶液中添加naoh(4.94mg,123.58μmol,1当量)和h2o(0.6ml)。将混合物在40℃下搅拌2小时。
[0424]
移除溶剂,得到粗产物。用1n hcl将混合物调节至ph 4。将混合物过滤,并得到化合物2,即2-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(40mg,84.82μmol,68.63%收率,97%纯度),为白色固体。产物的lcms(esi):m/z 458.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=12.06(brs,1h),8.67(d,j=6.8hz,1h),8.31(d,j=7.6hz,1h),8.19(s,1h),7.56(d,j=8.0hz,2h),7.34-7.27(m,3h),7.03(t,j=6.8hz,1h),4.63(s,2h),4.25-4.16(m,1h),2.96
–
2.50(m,1h),2.43-2.36(m,1h),2.35-2.17(m,3h),2.16-2.03(m,2h),1.96-1.84(m,2h)
[0425]
实施例3
–
4-[(1s)-1-[[4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸(化合物3)的合成
[0426][0427]
步骤1:4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸甲酯的制备
[0428][0429]
向4-溴吡唑并[1,5-a]吡啶-3-甲酸甲酯(800mg,3.136mmol,1当量)和4,4,5,5-四甲基-2-[[3-(三氟甲基)苯基]甲基]-1,3,2-二氧杂环戊硼烷(897.32mg,3.316mmol,1当量)在二噁烷(10ml)和h2o(2ml)中的溶液中添加k3po4(665.76mg,3.136mmol,1当量)和pd(dppf)cl2(688.48mg,940.92μmol,0.3当量)。将混合物在80℃下搅拌2小时。
[0430]
移除溶剂,得到粗产物。通过柱色谱法(sio2,石油醚/乙酸乙酯=100/1至0/1)纯化残留物,得到4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸甲酯(300mg,
897.42μmol,28.61%收率),为白色固体。1h nmr(400mhz,dmso-d6)δ=8.47(d,j=6.8hz,1h),8.44(s,1h),7.49-4.46(m,2h),7.39-7.33(m,2h),7.05(d,j=7.2hz,1h),6.91(t,j=6.8hz,1h),4.82(s,2h),3.84(s,3h)
[0431]
步骤2:4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸的制备
[0432][0433]
向4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸甲酯(290mg,867.51μmol,1当量)在meoh(1ml)中的溶液中添加naoh(34.70mg,867.51μmol,1当量)和h2o(2ml)。将混合物在40℃下搅拌12小时。
[0434]
移除溶剂,得到粗产物。用1n hcl将混合物调节至ph 4。将混合物过滤,并得到4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(140mg,437.14μmol,50.39%收率),为白色固体。产物的lcms(esi):m/z 321.2[m+h]
+
。
[0435]
步骤3:4-[(1s)-1-[[4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸甲酯的制备
[0436][0437]
向4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(65.00mg,202.96μmol,1当量)和4-[(1s)-1-氨乙基]苯甲酸甲酯(72.75mg,405.91μmol,2当量)在dcm(1ml)中的溶液中添加hoat(5.52mg,40.59μmol,5.68μl,0.2当量)、et3n(102.69mg,1.01mmol,141.25μl,5当量)和edci(63.01mg,405.91μmol,71.85μl,2当量)。将混合物在25℃下搅拌16小时。
[0438]
移除溶剂,得到粗产物。通过制备型tlc纯化残留物。得到化合物4-[(1s)-1-[[4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸甲酯(50mg,103.85μmol,51.17%收率),为白色固体,其不经进一步纯化即直接进入下一步使用。产物的lcms(esi):m/z 482.2[m+h]
+
。
[0439]
步骤4:化合物3即4-[(1s)-1-[[4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸的制备
[0440][0441]
向4-[(1s)-1-[[4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸甲酯(45mg,93.46μmol,1当量)在meoh(0.5ml)中的溶液中添加naoh(3.74mg,93.46μmol,1当量)和h2o(0.5ml)。将混合物在40℃下搅拌16小时。
[0442]
移除溶剂,得到粗产物。用1n hcl将混合物调节至ph 4。将混合物过滤,并得到化合物3,即4-[(1s)-1-[[4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸(30mg,62.90μmol,67.29%收率,98%纯度),为白色固体。产物的lcms(esi):m/z 468.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=8.73-8.68(m,2h),8.38(s,1h),7.88(d,j=8.0hz,2h),7.51-7.45(m,4h),7.38-7.29(m,3h),7.04(t,j=6.8hz,1h),5.19-5.11(m,1h),4.70(d,j=14.4hz,1h),4.56(d,j=14.4hz,1h),1.40(d,j=7.2hz,3h)。
[0443]
实施例4
–
2-[[4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(化合物4)的合成
[0444][0445]
步骤1:2-[[4-[[3-(三氟甲基)苯基]甲基]-吡唑并[1,5-a]吡啶-3-羰基]氨基]-螺[3.3]庚烷-6-甲酸乙酯的制备
[0446][0447]
向4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(65.00mg,202.96μmol,1当量)和2-氨基螺[3.3]庚烷-6-甲酸乙酯(37.19mg,202.96μmol,1当量)在dcm(1ml)中的溶液中添加hoat(5.52mg,40.59μmol,5.68μl,0.2当量)、et3n(102.69mg,1.01mmol,141.25μl,5当量)和edci(63.01mg,405.91μmol,71.85μl,2当量)。将混合物在25℃下搅拌
16小时。
[0448]
移除溶剂,得到粗产物。通过制备型tlc纯化残留物,得到2-[[4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸乙酯(35mg,72.69μmol,35.82%收率),为白色固体,其不经进一步纯化即直接进入下一步使用。产物的lcms(esi):m/z486.2[m+h]
+
。
[0449]
步骤2:化合物4即2-[[4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸的制备
[0450][0451]
向2-[[4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸乙酯(30mg,63.63μmol,1当量)在meoh(0.5ml)中的溶液中添加naoh(2.55mg,63.63μmol,1当量)和h2o(0.5ml)。将混合物在40℃下搅拌16小时。
[0452]
移除溶剂,得到粗产物。用1n hcl将混合物调节至ph 4。将混合物过滤,并得到化合物4,即2-[[4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(28mg,60.60μmol,95.23%收率,99%纯度),为白色固体。产物的lcms(esi):m/z 458.2[m+h]
+
。1hnmr(400mhz,dmso-d6)δ=12.03(brs,1h),8.67(d,j=6.8hz,1h),8.36(d,j=7.8hz,1h),8.21(s,1h),7.54-7.32(m,5h),7.03(t,j=6.8hz,1h),4.65(s,2h),4.27-4.13(m,1h),2.94
–
2.92(m,1h),2.43-2.35(m,1h),2.34-2.26(m,1h),2.24-2.17(m,2h),2.16-2.02(m,2h),2.00-1.87(m,2h)。
[0453]
实施例5
–
4-[(1s)-1-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]乙基]苯甲酸(化合物5)的合成
[0454][0455]
步骤1:8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-甲酸甲酯的制备
[0456][0457]
在氮气下向4,4,5,5-四甲基-2-[[4-(三氟甲基)苯基]甲基]-1,3,2-二氧杂环戊硼烷(560.83mg,1.96mmol,1当量)和8-溴咪唑并[1,5-a]吡啶-1-甲酸甲酯(500mg,1.96mmol,1当量)在h2o(1ml)和叔戊醇(1ml)中的溶液中添加二叔丁基(环戊基)磷烷;二氯钯;铁(127.76mg,196.03μmol,0.1当量)和cs2co3(1.28g,3.92mmol,2当量)。将混合物在80℃下搅拌16小时。
[0458]
将反应混合物用h2o 15ml稀释,并用dcm 30ml(10ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过柱色谱法(sio2,石油醚/乙酸乙酯=50/1至1/1)纯化残留物,得到8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-甲酸甲酯(262mg,40%收率),为白色固体。粗产物的lcms(esi):m/z 335.0[m+h]
+
。
[0459]
步骤2:8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-甲酸的制备
[0460][0461]
向8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-甲酸甲酯(150mg,448.7μmol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(28.00mg,699.99μmol,3当量)。将混合物在50℃下搅拌16小时。
[0462]
在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤,并得到化合物8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-甲酸(120mg,374.68μmol,80%收率),为白色固体。
[0463]
步骤3:4-[(1s)-1-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]乙基]苯甲酸甲酯的制备
[0464][0465]
在0℃下向8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-甲酸(40mg,124.90μmol,1当量)在dcm(2ml)中的溶液中添加hobt(3.38mg,24.98μmol,0.2当量)、et3n(63.19mg,624.48μmol,86.92μl,5当量)和edci(47.89mg,249.79μmol,2当量)。将混合物在
0℃下搅拌0.5小时。然后在0℃下添加4-[(1s)-1-氨乙基]苯甲酸甲酯(33.57mg,187.34μmol,1.5当量)。将混合物在25℃下搅拌16小时。将反应混合物用h2o 5ml稀释,并用dcm 30ml(10ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物4-[(1s)-1-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]乙基]苯甲酸甲酯(35mg,72.69μmol,58.20%收率),为白色固体,其不经进一步纯化即直接进入下一步使用。产物的lcms(esi):m/z 482.2[m+h]
+
。
[0466]
步骤4:化合物5即4-[(1s)-1-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]乙基]苯甲酸的制备
[0467][0468]
向4-[(1s)-1-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]乙基]苯甲酸甲酯(35mg,72.69μmol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(8.72mg,218.08μmol,3当量)。将混合物在50℃下搅拌16小时。
[0469]
在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤,并得到化合物5,即4-[(1s)-1-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]乙基]苯甲酸(21mg,44.92μmol,60%收率,99.13%纯度),为白色固体。产物的lcms(esi):m/z 468.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δppm 8.57(d,j=8.4hz,1h),8.52(s,1h),8.38(d,j=6.4hz,1h),7.90(d,j=8.0hz,2h),7.51(d,j=8.0hz,2h),7.40(d,j=8.0hz,2h),7.28(d,j=8.0hz,2h),6.96(d,j=6.4hz,1h),6.83(t,j=6.8hz,1h),5.23
–
5.16(m,1h),4.86(d,j=14.8hz,1h),4.67(d,j=14.8hz,1h),1.49(d,j=7.2hz,3h)
[0470]
实施例6
–
顺式-2-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]螺[3.3]庚烷-6-甲酸(化合物6a)的合成
[0471][0472]
步骤1:(s)-6-氧代螺[3.3]庚烷-2-甲酸1-苯基乙酯的制备
[0473][0474]
向化合物6-氧代螺[3.3]庚烷-2-甲酸(10g,64.87mmol,1当量)和dmap(8.72g,71.35mmol,1.1当量)在dcm(100ml)中的混合物中添加在dcm(50ml)中的dcc(14.72g,71.35mmol,14.43ml,1.1当量)。然后在0℃下向混合物中添加在dcm(100ml)中的(1s)-1-苯基乙醇(7.53g,61.62mmol,7.45ml,0.95当量)。将混合物在20℃下搅拌16小时。
[0475]
合并三个反应物进行后处理并纯化。将混合物通过硅藻土过滤。在真空下浓缩滤液,得到粗残留物。通过柱色谱法(sio2,石油醚/乙酸乙酯=20/1至5/1)纯化残留物,得到化合物(s)-6-氧代螺[3.3]庚烷-2-甲酸1-苯乙基酯(40g,154.85mmol,79.57%收率),为无色油状物。
[0476]1h nmr(et26855-102-p1,400mhz,氯仿-d)δppm=1.54(d,j=6.63hz,3h),2.40-2.61(m,4h),3.00-3.23(m,5h),5.89(q,j=6.59hz,1h),7.27-7.39(m,5h)。
[0477]
步骤2:(s)-6-(((s)-叔丁基亚磺酰基)亚氨基)螺[3.3]庚烷-2-甲酸1-苯基乙酯的制备
[0478][0479]
将ti(oi-pr)4(11.00g,38.71mmol,11.43ml,1当量)和化合物(s)-6-氧代螺[3.3]庚烷-2-甲酸1-苯基乙酯(10g,38.71mmol,1当量)在thf(90ml)中的混合物搅拌10分钟。然后添加2-甲基丙烷-2-亚磺酰胺(sμlfinamide)(5.63g,46.46mmol,1.2当量),并将反应混合物在20℃下搅拌1h。
[0480]
合并四个反应物进行后处理并纯化。在真空下浓缩混合物,得到残留物。将残留物溶解在etoac(500ml)中。将溶液用饱和nahco3(500ml)洗涤。将混合物通过硅藻土过滤。然后将混合物分层。将有机层经na2so4干燥,并在真空下浓缩,得到粗化合物(s)-6-(((s)-叔丁基亚磺酰基)亚氨基)螺[3.3]庚烷-2-甲酸1-苯基乙酯(30g,74.69mmol,48.23%收率),为无色油状物。将粗产物不经任何进一步纯化用于下一步。
[0481]1h nmr(et26855-134-p1,400mhz,氯仿-d)δ=1.16(s,9h),1.44(d,j=6.38hz,
2h),2.25-2.52(m,4h),2.93-3.12(m,4h),4.88-5.87(m,1h),7.20-7.36(m,4h)。
[0482]
步骤3:b4_顺式和b4_反式的制备
[0483][0484]
在-50℃下向化合物(s)-6-(((s)-叔丁基亚磺酰基)亚氨基)螺[3.3]庚烷-2-甲酸1-苯基乙酯(10g,27.66mmol,1当量)在thf(3ml)中的混合物中添加nabh4(3.14g,82.99mmol,3当量)。将混合物在-50℃下搅拌30分钟,然后升至20℃,并在20℃下搅拌1小时。
[0485]
合并三个反应物进行后处理并纯化。在真空下浓缩混合物以移除thf。将残留物用dcm(200ml)萃取。将有机层浓缩,得到粗产物。通过制备型hplc(柱:waters xbridge beh c18 100*30mm*10um;流动相:[水(10mm nh4hco3)-acn];b%:55%-75%,10min)纯化粗产物,得到两种非对映异构体:为白色固体的化合物b4_顺式(6.6g,16.34mmol,19.69%收率,90%纯度)和为白色固体的化合物b4_反式(6.5g,16.99mmol,20.47%收率,95%纯度)。
[0486]
化合物b4_顺式的hplc(et26855-136-p1a,保留时间13.558min)。化合物b4_反式的hplc(et26855-136-p2a,保留时间13.438min)。1h nmr(b4-顺式et26855-136-p1,400mhz,氯仿-d)δ=1.11(s,9h),1.45(d,j=6.63hz,3h),1.78-1.94(m,2h),2.03-2.13(m,1h),2.17-2.31(m,4h),2.35-2.45(m,1h),2.97(quin,j=8.41hz,1h),3.19(br d,j=6.25hz,1h),3.64-3.78(m,1h),5.79(q,j=6.55hz,1h),7.20-7.31(m,5h).1h nmr(b4-反式et26855-136-p2,400mhz,氯仿-d)δ=1.11(s,9h),1.44(d,j=6.50hz,3h),1.76-1.95(m,2h),2.04-2.15(m,1h),2.17-2.30(m,4h),2.39-2.49(m,1h),2.97(quin,j=8.44hz,1h),3.18(br d,j=6.50hz,1h),3.68(sxt,j=7.50hz,1h),5.79(q,j=6.59hz,1h),7.20-7.30(m,5h)。
[0487]
未确定b4的绝对构型,且顺式和反式命名是随机指定的。在氨基和羧基脱保护后,b_顺式和b4_反式彼此成为对映异构体。顺式和反式命名用于区分两组分子。下面的所有顺式螺[3.3]庚烷分子来自b4_顺式,并且所有反式螺[3.3]庚烷分子来自b4_反式。
[0488]
步骤4:顺式-(s)-2-氨基螺[3.3]庚烷-6-甲酸1-苯基乙酯的制备
[0489]
[0490]
在20℃下向化合物b4_顺式(6.6g,18.16mmol,1当量)在etoac(120ml)中的混合物中添加hcl/etoac(4m,120ml,26.44当量)。将混合物在20℃下搅拌2h。
[0491]
在真空下浓缩混合物,得到粗产物。将粗产物在mtbe(30ml)中研磨并过滤。在真空下干燥滤饼,得到顺式-(s)-2-氨基螺[3.3]庚烷-6-甲酸1-苯基乙酯(5.1g,17.24mmol,94.96%收率,hcl),为白色固体。
[0492]1h nmr(400mhz,dmso-d6)δppm=1.44(d,j=6.60hz,3h),2.11-2.20(m,6h),2.26-2.37(m,2h),3.00-3.10(m,1h),3.48(quin,j=7.89hz,1h),5.77(q,j=6.60hz,1h),7.23-7.43(m,5h),8.30(br s,3h)。
[0493]
步骤5:反式-(s)-2-氨基螺[3.3]庚烷-6-甲酸1-苯基乙酯的制备
[0494][0495]
在20℃下向化合物b4_反式(6.5g,17.88mmol,1当量)在etoac(120ml)中的混合物中添加hcl/etoac(4m,120ml,26.84当量)。将混合物在20℃下搅拌2h。
[0496]
将粗产物在mtbe(30ml)中研磨并过滤。在真空下干燥滤饼,得到反式-(s)-2-氨基螺[3.3]庚烷-6-甲酸1-苯基乙酯(5g,16.90mmol,94.53%收率,hcl),为白色固体。
[0497]1h nmr(400mhz,dmso-d6)δppm=1.44(d,j=6.60hz,3h),2.07-2.21(m,6h),2.26-2.38(m,2h),3.06(quin,j=8.34hz,1h),3.49(quin,j=8.04hz,1h),5.77(q,j=6.60hz,1h),7.23-7.41(m,5h),8.26(br s,3h)。
[0498]
步骤6:顺式-(s)-2-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯的制备
[0499][0500]
在0℃下向8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-甲酸(40mg,124.90μmol,1当量)在dcm(1ml)中的溶液中添加edci(47.89mg,249.79μmol,2当量)、et3n(63.19mg,624.48μmol,86.92μl,5当量)和hobt(3.38mg,24.98μmol,0.2当量)。将混合物在0℃下搅拌0.5小时。然后在0℃下添加顺式-(s)-2-氨基螺[3.3]庚烷-6-甲酸1-苯基乙酯(64.78mg,249.79μmol,2当量)。将混合物在25℃下搅拌16小时。
[0501]
将反应混合物用h2o 15ml稀释,并用dcm 30ml(10ml
×
3)萃取。将合并的有机层用
盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物顺式-(s)-2-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(30mg,53.42μmol,75%收率),为白色固体,其不经进一步纯化即直接进入下一步使用。产物的lcms(esi):m/z 562.3[m+h]
+
。
[0502]
步骤7:化合物6a即顺式-2-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]螺[3.3]庚烷-6-甲酸的制备
[0503][0504]
向顺式-(s)-2-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(30mg,53.42μmol,1当量)在dcm(1ml)和tfa(1ml)中的溶液中。将混合物在50℃下搅拌3小时。
[0505]
在减压下浓缩反应混合物以移除溶剂。将残留物用1n naoh(10ml)溶解并过滤。用1n hcl将滤液调节至ph 4。将混合物过滤。得到化合物6a,即顺式-2-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]螺[3.3]庚烷-6-甲酸(23mg,50.28μmol,76.67%收率,98.06%纯度),为白色固体。产物的lcms(esi):m/z 458.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δppm 12.01(br s,1h),8.48(s,1h),8.36(d,j=7.2hz,1h),8.24(d,j=8.0hz,1h),7.57(d,j=8.4hz,2h),7.38(d,j=8.4hz,2h),6.91(d,j=6.4hz,1h),6.83
–
6.79(m,1h),4.80(s,2h),4.29-4.23(m,1h),2.97
–
2.95(m,1h),2.40
–
2.36(m,1h),2.28
–
2.27(m,1h),2.27
–
2.22(m,2h),2.20
–
2.08(m,4h)。
[0506]
实施例7
–
反式-2-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]螺[3.3]庚烷-6-甲酸(化合物6b)的合成
[0507][0508]
步骤1:反式-(s)-2-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯的制备
[0509][0510]
在0℃下向8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-甲酸(40mg,124.90μmol,1当量)在dcm(1ml)中的溶液中添加edci(47.89mg,249.80μmol,2当量)、et3n(63.19mg,624.50μmol,86.92μl,5当量)和hobt(3.38mg,24.98μmol,0.2当量)。将混合物在0℃下搅拌0.5小时。然后在0℃下添加反式-(s)-2-氨基螺[3.3]庚烷-6-甲酸1-苯基乙酯(64.78mg,249.80μmol,2当量)。将混合物在25℃下搅拌16小时。
[0511]
将反应混合物用h2o 5ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物,得到反式-(s)-2-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(29mg,51.63μmol,72.5%收率),为白色固体,其不经进一步纯化即直接进入下一步使用。产物的lcms(esi):m/z 562.3[m+h]
+
。
[0512]
步骤2:化合物6b即反式-2-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]螺[3.3]庚烷-6-甲酸的制备
[0513][0514]
向反式-(s)-2-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(29mg,51.63μmol,1当量)在dcm(1ml)和tfa(1ml)中的溶液中。将混合物在50℃下搅拌3小时。
[0515]
在减压下浓缩反应混合物以移除溶剂。将残留物用1n naoh(10ml)溶解并过滤。用1n hcl将滤液调节至ph 4。将混合物过滤。得到化合物6b,即反式-2-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]螺[3.3]庚烷-6-甲酸(19mg,41.53μmol,65.52%收率,96.29%纯度),为白色固体。产物的lcms(esi):m/z 458.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=12.00(br s,1h),8.48(s,1h),8.37(d,j=6.8hz,1h),8.24(d,j=8.4hz,1h),7.58(d,j=8.0hz,2h),7.38(d,j=8.0hz,2h),6.91(d,j=6.8hz,1h),6.85-6.79(m,1h),4.80(s,2h),4.35-4.19(m,1h),2.94(t,j=8.4hz,1h),2.39-2.36(m,1h),2.28-2.22(m,2h),2.11-2.06(m,3h),2.03-2.00(m,1h)。
[0516]
实施例8
–
4-[(1s)-1-[[4-[[4-(三氟甲基)苯基]甲基]-1h-吲唑-3-羰基]氨基]乙基]苯甲酸(化合物7)的合成
[0517][0518]
步骤1:4-溴-1-四氢吡喃-2-基-吲唑-3-甲酸甲酯的制备
[0519][0520]
向4-溴-1h-吲唑-3-甲酸甲酯(1g,3.92mmol,1当量)、3,4-二氢-2h-吡喃(1.65g,19.60mmol,1.79ml,5当量)在dcm(10ml)中的混合物中添加4-甲基苯磺酸;吡啶(98.52mg,392.05μmol,0.1当量)。将混合物脱气,并用n2吹扫3次,然后将混合物在40℃和n2气氛下搅拌12小时。
[0521]
将残留物用h2o 30ml稀释,并用dcm 90ml(30ml
×
3)萃取。将合并的有机层用盐水30ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用,得到4-溴-1-四氢吡喃-2-基-吲唑-3-甲酸甲酯(1.1g,粗),为黄色固体,其不经进一步纯化直接进入下一步使用。
[0522]
步骤2:1-四氢吡喃-2-基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯的制备
[0523][0524]
在氮气下向4-溴-1-四氢吡喃-2-基-吲唑-3-甲酸甲酯(350mg,1.03mmol,1当量)和4,4,5,5-四甲基-2-[[4-(三氟甲基)苯基]甲基]-1,3,2-二氧杂环戊硼烷(295.38mg,1.03mmol,1当量)在二噁烷(2ml)和h2o(1ml)中的溶液中添加pd(dppf)cl2(323.59mg,442.24μmol,0.3当量)和k3po4(312.91mg,1.47mmol,1当量)。将混合物在80℃下搅拌12小时。
[0525]
在减压下浓缩反应混合物以移除二噁烷。将残留物用h2o 20ml稀释,并用ea450ml(15ml
×
3)萃取。将合并的有机层用盐水15ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过柱色谱法(sio2,石油醚/乙酸乙酯=50/1至1/1)纯化残留物。得到化合物1-四氢吡喃-2-基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯(180mg,430.20μmol,42%收率),为白色固体。粗产物的lcms(esi):m/z 419.3[m+h]
+
。
[0526]
步骤3:1-四氢吡喃-2-基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸的制备
[0527][0528]
向1-四氢吡喃-2-基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯(180mg,430.20μmol,1当量)在h2o(5ml)和meoh(3ml)中的溶液中添加naoh(51.62mg,1.29mmol,3当量)。将混合物在50℃下搅拌16小时。
[0529]
在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤,得到1-四氢吡喃-2-基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(150mg,370.93μmol,86.70%收率),为白色固体。
[0530]
步骤4:4-[(1s)-1-[[1-四氢吡喃-2-基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸甲酯的制备
[0531][0532]
在0℃下向1-四氢吡喃-2-基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(40mg,98.92μmol,1当量)在dcm(2ml)中的溶液中添加hobt(2.67mg,19.78μmol,0.2当量)、edci(37.92mg,197.83μmol,2当量)和et3n(50.05mg,494.58μmol,68.84μl,5当量)。将混合物在0℃下搅拌0.5小时。然后在0℃下添加4-[(1s)-1-氨乙基]苯甲酸甲酯(17.73mg,98.92μmol,1当量)。将混合物在25℃下搅拌16小时。
[0533]
将反应混合物用h2o 10ml稀释,并用dcm 30ml(10ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。得到化合物4-[(1s)-1-[[1-四氢吡喃-2-基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸甲酯(35mg,61.88μmol,62.56%收率),为白色固体,其不经进一步纯化即直接进入下一步使用。产物的lcms(esi):m/z 566.3[m+h]
+
。
[0534]
步骤5:4-[(1s)-1-[[4-[[4-(三氟甲基)苯基]甲基]-1h-吲唑-3-羰基]氨基]乙基]苯甲酸酯的制备
[0535][0536]
将4-[(1s)-1-[[1-四氢吡喃-2-基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸甲酯(35mg,61.88μmol,1当量)在hcl/meoh(3ml)中的溶液在50℃下搅拌
16小时。
[0537]
通过减压浓缩反应混合物,得到残留物。粗产物不经进一步纯化即进入下一步使用,得到4-[(1s)-1-[[4-[[4-(三氟甲基)苯基]甲基]-1h-吲唑-3-羰基]氨基]乙基]苯甲酸甲酯(30mg,62.31μmol,97.89%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 482.2[m+h]
+
。
[0538]
步骤6:化合物7即4-[(1s)-1-[[4-[[4-(三氟甲基)苯基]甲基]-1h-吲唑-3-羰基]氨基]乙基]苯甲酸的制备
[0539][0540]
向4-[(1s)-1-[[4-[[4-(三氟甲基)苯基]甲基]-1h-吲唑-3-羰基]氨基]乙基]苯甲酸甲酯(30mg,62.31μmol,1当量)在h2o(4ml)和meoh(1.5ml)中的溶液中添加naoh(7.48mg,186.93μmol,3当量)。将混合物在50℃下搅拌16小时。
[0541]
在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤,得到化合物7,即4-[(1s)-1-[[4-[[4-(三氟甲基)苯基]甲基]-1h-吲唑-3-羰基]氨基]乙基]苯甲酸(26mg,52.28μmol,83.90%收率,93.99%纯度),为白色固体。产物的lcms(esi):m/z 468.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δppm 13.56(s,1h),8.96(d,j=8.0hz,1h),7.91(d,j=8.0hz,2h),7.56(d,j=8.4hz,2h),7.50(d,j=8.4hz,1h),7.41-7.34(m,3h),7.22(d,j=8.0hz,2h),7.11(d,j=6.8hz,1h),5.27-5.23(m,1h),4.74(d,j=14.4hz,1h),4.56(d,j=14.4hz,1h),1.47(d,j=7.2hz,3h)。
[0542]
实施例9
–
2-[[4-[[4-(三氟甲基)苯基]甲基]-1h-吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(化合物8)的合成
[0543][0544]
步骤1:2-[[1-四氢吡喃-2-基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸乙酯的制备
[0545][0546]
向1-四氢吡喃-2-基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(50mg,123.65μmol,1当量)在dcm(1ml)中的溶液中添加edci(38.39mg,247.29μmol,43.77μl,2当量)、et3n(62.56mg,618.23μmol,86.05μl,5当量)和hobt(3.34mg,24.73μmol,0.2当量)。将混合物在0℃下搅拌0.5小时。然后在0℃下添加2-氨基螺[3.3]庚烷-6-甲酸乙酯(33.99mg,185.47μmol,1.5当量),将混合物在25℃下搅拌12小时。
[0547]
将残留物用h2o 10ml稀释,并用dcm 15ml(5ml*3)萃取。将合并的有机层用盐水15ml(5ml*3)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=2:1)纯化残留物,得到2-[[1-四氢吡喃-2-基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸乙酯(30mg,52.67μmol,42.60%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 570.4[m+h]
+
。
[0548]
步骤2:6-(4-(4-(三氟甲基)苄基)-1h-吲唑-3-甲酰胺基)螺[3.3]庚烷-2-甲酸乙酯的制备
[0549][0550]
向2-[[1-四氢吡喃-2-基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸乙酯(30mg,52.67μmol,1当量)在hcl/meoh(3ml)中的溶液中。将混合物在25℃下搅拌1小时。
[0551]
在减压下浓缩反应混合物以移除hcl/meoh。粗产物不经进一步纯化即进入下一步使用,并得到化合物6-(4-(4-(三氟甲基)苄基)-1h-吲唑-3-甲酰胺基)螺[3.3]庚烷-2-甲酸乙酯(25mg,51.49μmol,97.7%收率),为白色固体。
[0552]
步骤3:化合物8即2-[[4-[[4-(三氟甲基)苯基]甲基]-1h-吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸的制备
[0553][0554]
向6-(4-(4-(三氟甲基)苄基)-1h-吲唑-3-甲酰胺基)螺[3.3]庚烷-2-甲酸甲基乙酯(25mg,51.49μmol,42%收率)在h2o(1.5ml)和meoh(1.5ml)中的溶液中添加naoh(7.48mg,186.93μmol,3当量)。将混合物在50℃下搅拌16小时。
[0555]
在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤,并得到化合物8,即2-[[4-[[4-(三氟甲基)苯基]甲基]-1h-吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(20mg,41.97μmol,79.69%收率,96%纯度),为白色固体。产物的lcms(esi):m/z 458.1[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=13.50(s,1h),12.01(brs,1h),8.54(d,j=8.0hz,1h),7.54(d,j=8.0hz,2h),7.47(d,j=8.4hz,1h),7.38-7.29(m,3h),7.07(d,j=7.2hz,1h),4.68(s,2h),4.31-4.23(m,1h),2.93(t,j=8.4hz,1h),2.41-2.34(m,1h),2.32-2.25(m,1h),2.23-2.16(m,2h),2.15-2.02(m,3h),2.01-1.94(m,1h)。
[0556]
实施例10
–
4-[(1s)-1-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸(化合物9)的合成
[0557][0558]
步骤1:4-溴-1-乙基-吲唑-3-甲酸甲酯和4-溴-2-乙基-吲唑-3-甲酸甲酯的制备
[0559][0560]
向4-溴-1h-吲唑-3-甲酸甲酯(1g,3.92mmol,1当量)和碘乙烷(3.06g,19.60mmol,1.57ml,5当量)在dmf(3ml)中的溶液中添加k2co3(1.08g,7.84mmol,2当量)。将混合物在25℃下搅拌12小时。
[0561]
在减压下浓缩反应混合物以移除dmf。将残留物用h2o 30ml稀释,并用ea 30ml(10ml
×
3)萃取。将合并的有机层用盐水15ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得
到残留物。通过柱色谱法(sio2,石油醚/乙酸乙酯=50/1至1/1)纯化残留物,得到4-溴-1-乙基-吲唑-3-甲酸甲酯(700mg,2.47mmol,63.06%收率)和4-溴-2-乙基-吲唑-3-甲酸甲酯(300mg,1.06mmol,27.03%收率),为黄色油状物。
[0562]
4-溴-1-乙基-吲唑-3-甲酸甲酯:1h nmr(400mhz,dmso-d6)δ=7.87(d,j=8.4hz,1h),7.55(d,j=7.2hz,1h),7.42-7.38(m,1h),4.53(q,j=7.2hz,2h),3.91(s,3h),1.42(t,j=7.2hz,3h)。
[0563]
4-溴-2-乙基-吲唑-3-甲酸甲酯:
[0564]1h nmr(400mhz,dmso-d6)δ=7.77(d,j=8.4hz,1h),7.49(d,j=7.2hz,1h),7.27-7.23(m,1h),4.60(q,j=7.2hz,2h),4.00(s,3h),1.48(t,j=7.2hz,3h)。
[0565]
步骤2:1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯的制备
[0566][0567]
在氮气下向4-溴-1-乙基-吲唑-3-甲酸甲酯(200mg,706.41μmol,1当量)和4,4,5,5-四甲基-2-[[4-(三氟甲基)苯基]甲基]-1,3,2-二氧杂环戊硼烷(202.10mg,706.41μmol,1当量)在二噁烷(1.5ml)和h2o(0.5ml)中的溶液中添加pd(dppf)cl2(155.07mg,211.92μmol,0.3当量)和k3po4(149.95mg,706.41μmol,1当量)。将混合物在80℃下搅拌12小时。
[0568]
在减压下浓缩反应混合物以移除二噁烷。将残留物用h2o 10ml稀释,并用dcm 30ml(10ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=2:1)纯化残留物。得到化合物1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯(130mg,358.77μmol,50.79%收率),为白色固体。hplc显示产物是纯净的。产物的lcms(esi):m/z 331.3[m+h]
+
。
[0569]
步骤3:1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸的制备
[0570][0571]
向1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯(120mg,331.18μmol,1当量)在h2o(6ml)和meoh(3ml)中的溶液中添加naoh(26.5mg,662.36μmol,2当量)。将混合物在50℃下搅拌12小时。
[0572]
在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤,得到1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(90mg,258.38μmol,78.02%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 349.3[m+h]
+
。
[0573]
步骤4:4-[(1s)-1-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]
乙基]苯甲酸甲酯的制备
[0574][0575]
在0℃下向1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(45mg,129.19μmol,1当量)在dcm(1ml)中的溶液中添加et3n(65.36mg,645.96μmol,89.91μl,5当量)、edci(49.53mg,258.38μmol,2当量)和hobt(3.49mg,25.84μmol,0.2当量)。将混合物在0℃下搅拌0.5小时。然后添加4-[(1s)-1-氨乙基]苯甲酸甲酯(46.31mg,258.38μmol,2当量),将混合物在25℃下搅拌12小时。
[0576]
将残留物用h2o 5ml稀释,并用dcm 30ml(10ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=2:1)纯化残留物。得到化合物4-[(1s)-1-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸甲酯(30mg,58.88μmol,45.57%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 510.4[m+h]
+
。
[0577]
步骤5:化合物9即4-[(1s)-1-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸的制备
[0578][0579]
向4-[(1s)-1-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸甲酯(30mg,58.88μmol,1当量)在h2o(3ml)和meoh(1ml)中的溶液中添加naoh(7.06mg,176.64μmol,3当量)。将混合物在50℃下搅拌12小时。
[0580]
在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤,得到化合物9,即4-[(1s)-1-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸(15mg,29.36μmol,49.87%收率,97%纯度),为白色固体。产物的lcms(esi):m/z 496.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=8.89(d,j=8.4hz,1h),7.90(d,j=8.0hz,2h),7.64(d,j=8.4hz,1h),7.54(d,j=8.4hz,2h),7.40(dd,j=7.1,8.4hz,1h),7.34(d,j=8.4hz,2h),7.19(d,j=8.0hz,2h),7.13(d,j=7.2hz,1h),5.28-5.21(m,1h),4.72(d,j=14.4hz,1h),4.54-4.47(m,3h),1.48-1.40(m,6h)。
[0581]
实施例11
–
4-[(1s)-1-[[2-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸(化合物10)的合成
[0582][0583]
步骤1:2-乙基-4-[[4-(三氟甲基)苯基]-甲基]吲唑-3-甲酸甲酯的制备
[0584][0585]
向4-溴-2-乙基-吲唑-3-甲酸甲酯(100.00mg,353.21μmol,1当量)和4,4,5,5-四甲基-2-[[4-(三氟甲基)苯基]甲基]-1,3,2-二氧杂环戊硼烷(101.05mg,353.21μmol,1当量)在二噁烷(0.4ml)和h2o(0.2ml)中的溶液中添加pd(dppf)cl2(77.53mg,105.96μmol,0.3当量)和k3po4(74.98mg,353.21μmol,1当量)。将混合物在80℃下搅拌12小时。
[0586]
在减压下浓缩反应混合物以移除二噁烷。将残留物用h2o 10ml稀释,并用dcm 15ml(5ml*3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=2:1)纯化残留物,得到2-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯(35mg,96.59μmol,27.35%收率),为白色固体。hplc显示产物是纯净的。粗产物的lcms(esi):m/z 363.3[m+h]
+
。
[0587]
步骤2:2-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸的制备
[0588][0589]
向2-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯(33mg,91.07μmol,1当量)在h2o(0.5ml)和meoh(0.5ml)中的溶液中添加naoh(10.92mg,273.21μmol,3当量)。将混合物在50℃下搅拌12小时。
[0590]
在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤,并得到2-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(20mg,57.42μmol,63.05%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 349.3[m+h]
+
。
[0591]
步骤3:4-[(1s)-1-[[2-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸甲酯的制备
[0592][0593]
在0℃下向甲基2-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(10mg,28.71μmol,1当量)在dcm(1ml)中的溶液中添加et3n(14.53mg,143.55μmol,19.98μl,5当量)、edci(11.01mg,57.42μmol,2当量)和hobt(775.84ug,5.74μmol,0.2当量)。将混合物在0℃下搅拌0.5小时。然后在0℃下添加4-[(1s)-1-氨乙基]苯甲酸甲酯(10.29mg,57.42μmol,2当量),将混合物在25℃下搅拌12小时。
[0594]
将残留物用h2o 10ml稀释,并用dcm 15ml(5ml*3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea =2:1)纯化残留物。得到化合物4-[(1s)-1-[[2-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸甲酯(9mg,17.66μmol,61.53%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 510.3[m+h]
+
。
[0595]
步骤4:化合物10即4-[(1s)-1-[[2-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸的制备
[0596][0597]
向4-[(1s)-1-[[2-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸甲酯(9mg,17.66μmol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(2.12mg,52.99μmol,3当量)。将混合物在50℃下搅拌12小时。
[0598]
将残留物用h2o 10ml稀释,并用dcm 15ml(5ml*3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型hplc(hcl条件)纯化残留物,并且得到化合物10,即4-[(1s)-1-[[2-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸(1.5mg,2.94μmol,16.62%收率,97%纯度),为白色固体。产物的lcms(esi):m/z 496.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=9.53(d,j=7.6hz,1h),7.89(d,j=8.4hz,2h),7.55-7.48(m,5h),7.25-7.18(m,3h),6.79(d,j=6.8hz,1h),5.21
–
5.15(m,1h),4.38-4.32(m,2h),4.18(s,2h),1.40-1.31(m,6h)。
[0599]
实施例12
–
顺式-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(化合物11a)的合成
[0600][0601]
步骤1:4-溴-1-乙基-吲唑-3-甲酸甲酯和4-溴-2-乙基-吲唑-3-甲酸甲酯的制备
[0602][0603]
向4-溴-1h-吲唑-3-甲酸甲酯(1g,3.92mmol,1当量)和碘乙烷(3.06g,19.60mmol,1.57ml,5当量)在dmf(10ml)中的溶液中添加k2co3(1.08g,7.84mmol,2当量)。将混合物在25℃下搅拌12小时。
[0604]
将反应混合物用h2o 30ml稀释,并用dcm 60ml(20ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过柱色谱法(sio2,石油醚/乙酸乙酯=50/1至1/1)纯化残留物,得到4-溴-1-乙基-吲唑-3-甲酸甲酯(700mg,2.47mmol,63.06%收率)和4-溴-2-乙基-吲唑-3-甲酸甲酯(300mg,1.06mmol,27.03%收率),为黄色油状物。
[0605]
步骤2:1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯的制备
[0606][0607]
向4-溴-1-乙基-吲唑-3-甲酸甲酯(300mg,1.06mmol,1当量)和4,4,5,5-四甲基-2-[[4-(三氟甲基)苯基]甲基]-1,3,2-二氧杂环戊硼烷(303.15mg,1.06mmol,1当量)在二噁烷(3ml)和h2o(1ml)中的溶液中添加pd(dppf)cl2(232mg,319μmol,0.3当量)和k3po4(225mg,1.06mmol,1当量)。将混合物在80℃下搅拌12小时。
[0608]
将反应混合物用h2o 10ml稀释,并用dcm 60ml(20ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过柱色谱法(sio2,石油醚/乙酸乙酯=50/1至1/1)纯化残留物。得到化合物1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯(220mg,607.16μmol,57.30%收率),为白色固体。粗产物的lcms(esi):m/
z 363.3[m+h]
+
。
[0609]
步骤3:1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸的制备
[0610][0611]
向1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯(220mg,607.16μmol,1当量)在h2o(5ml)中的溶液中添加naoh(24.28mg,607.16μmol,1当量)和meoh(3ml)。将混合物在50℃下搅拌16小时。
[0612]
在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤,得到1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(170mg,488.06μmol,80.38%收率),为白色固体。产物的lcms(esi):m/z 349.3[m+h]
+
。
[0613]
步骤4:顺式-(s)-6-(1-乙基-4-(4-(三氟甲基)苄基)-1h-吲唑-3-甲酰胺基)螺[3.3]庚烷-2-甲酸1-苯基乙酯的制备
[0614][0615]
在0℃下向1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(50mg,143.55μmol,1当量)在dcm(1ml)中的溶液中添加hobt(3.88mg,28.71μmol,0.2当量)、et3n(72.63mg,717.75μmol,99.90μl,5当量)和edci(55.04mg,287.10μmol,2当量)。将混合物在0℃下搅拌0.5小时。然后在0℃下添加顺式-(s)-2-氨基螺[3.3]庚烷-6-甲酸1-苯基乙酯(40.95mg,157.91μmol,1.1当量)。将混合物在25℃下搅拌16小时。
[0616]
将反应混合物用h2o 3ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水3ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=2:1)纯化残留物。得到化合物顺式-(s)-6-(1-乙基-4-(4-(三氟甲基)苄基)-1h-吲唑-3-甲酰胺基)螺[3.3]庚烷-2-甲酸1-苯基乙酯(30mg,46.46μmol,32.37%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 590.4[m+h]
+
。
[0617]
步骤5:化合物11a即顺式-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸的制备
[0618][0619]
将顺式-(s)-6-(1-乙基-4-(4-(三氟甲基)苄基)-1h-吲唑-3-甲酰胺基)螺[3.3]庚烷-2-甲酸1-苯基乙酯(25.41mg,50.88μmol,1当量)在hcl/meoh(5ml,4m)中的溶液在25℃下搅拌6小时。
[0620]
在减压下浓缩反应混合物以移除meoh。将混合物用naoh(5ml,1m)溶解并过滤。用1n hcl将滤液调节至ph 4。将混合物过滤,得到化合物11a,即顺式-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(20mg,38.86μmol,76.39%收率,94.34%纯度),为白色固体。产物的lcms(esi):m/z 486.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=8.44(d,j=8.0hz,1h),7.62(d,j=8.4hz,1h),7.54(d,j=8.0hz,2h),7.39(t,j=7.2hz,1h),7.31(d,j=8.0hz,2h),7.10(d,j=7.2hz,1h),4.70-4.63(m,2h),4.47(q,j=7.0hz,2h),4.32-4.21(m,1h),2.88-2.76(m,2h),2.38-2.35(m,2h),2.25-2.21(m,2h),2.15-2.10(m,2h),2.05
–
1.95(m,2h),1.41(t,j=7.2hz,3h)
[0621]
实施例13
–
反式-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(化合物11b)的合成
[0622][0623]
步骤1:反式-(s)-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯的制备
[0624][0625]
向1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(50mg,143.55μmol,1当量)
在dcm(1ml)中的溶液中添加hobt(3.88mg,28.71μmol,0.2当量)、edci(55.04mg,287.10μmol,2当量)和et3n(72.63mg,717.75μmol,99.90μl,5当量)。将混合物在0℃下搅拌0.5小时。然后向混合物中添加反式-(s)-2-氨基螺[3.3]庚烷-6-甲酸1-苯基乙酯(40.95mg,157.91μmol,1.1当量)。将混合物在25℃搅拌16小时。
[0626]
将反应混合物用h2o 10ml稀释,并用dcm 30ml(10ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=2:1)纯化残留物,得到反式-(s)-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(30mg,61.79μmol,43.05%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 590.4[m+h]
+
。
[0627]
步骤2:化合物11b即反式-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸的制备
[0628][0629]
将反式-(s)-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(25.41mg,50.88μmol,1当量)在hcl/meoh(5ml,4m)中的溶液在25℃下搅拌6小时。
[0630]
在减压下浓缩反应混合物以移除meoh。将混合物用naoh(5ml,1m)溶解并过滤。用1n hcl将滤液调节至ph 4。将混合物过滤。得到化合物11b,即反式-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(23mg,76%收率,91.43%纯度),为白色固体。产物的lcms(esi):m/z 486.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=12.00(br s,1h),8.45(d,j=8.0hz,1h),7.62(d,j=8.4hz,1h),7.54(d,j=8.0hz,2h),7.40(t,j=8.0hz,1h),7.31(d,j=8.0hz,2h),7.10(d,j=7.2hz,1h),4.66(s,2h),4.47(q,j=7.2hz,2h),4.31-4.23(m,1h),2.95-2.91(m,1h),2.39-2.34(m,1h),2.22
–
2.17(m,3h),2.12-2.03(m,3h),2.20-1.95(m,1h),1.41(t,j=7.2hz,3h)
[0631]
实施例14
–
4-[(1s)-1-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸(化合物12)的合成
[0632][0633]
步骤1:3-(溴甲基)异喹啉的制备
[0634][0635]
在0℃下向3-异喹啉基甲醇(400mg,2.51mmol,1当量)和咪唑(188.18mg,2.76mmol,1.1当量)在dcm(4ml)中的溶液中添加pph3(308.12mg,2.76mmol,1.1当量)和br2(723.12mg,1.17mmol,1.1当量)。将混合物在0℃下搅拌10分钟。lc-ms显示反应物1完全消耗,并且有一个具有所需质量的主峰。将溶剂通过饱和亚硫酸氢钠(10ml)淬灭,并用dcm 30(3
×
10ml)萃取。将有机层用盐水(10ml)洗涤,用硫酸钠干燥,并通过减压浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物3-(溴甲基)异喹啉(400mg,1.801mmol,71.7%收率),为白色固体。
[0636]
步骤2:4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡唑并[1,5-a]吡啶-3-甲酸甲酯的制备
[0637][0638]
在25℃下向4-溴吡唑并[1,5-a]吡啶-3-甲酸甲酯(1g,3.92mmol,1当量)和4,4,5,5-四甲基-2-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-1,3,2-二氧杂环戊硼烷(1.09g,1.29mmol,1.1当量)在二噁烷(10ml)中的溶液中添加acok(1.15g,11.76mmol,3当量)和pd(dppf)cl2(57.36mg,78.4umol,0.02当量),并在100℃和氮气下搅拌12小时。lc-ms显示没有反应物1剩留。在lc-ms上显示有若干新峰,并检测到53%的所需化合物。
[0639]
在减压下浓缩反应混合物以移除二噁烷。将残留物用h2o 40ml稀释,并用ea 60ml(20ml
×
3)萃取。将合并的有机层用盐水20ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过柱色谱法纯化残留物(通过pe:ea=2:1洗脱)。得到化合物4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡唑并[1,5-a]吡啶-3-甲酸甲酯(750mg,2.48mmol,63.3%收率),为白色固体。hplc显示产物是纯净的。产物的lcms(esi):m/z 303.4[m+h]
+
。
[0640]
步骤3:4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-甲酸甲酯的制备
[0641][0642]
将4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)吡唑并[1,5-a]吡啶-3-甲酸甲酯(400mg,1323.92umol,1当量)、3-(溴甲基)异喹啉(394.02mg,1323.92umol,1当量)、pd(dppf)cl2(193.74mg,264.78umol,0.2当量)、k3po4(281.02mg,1.32mmol,2当量)在h2o(0.5ml)和thf(1ml)中的混合物脱气,并用n2吹扫3次,然后将混合物在25℃和n2气氛下搅拌12小时。lc-ms显示反应物1完全消耗,并且有一个具有所需ms的主峰。在减压下浓缩反应混合物以移除thf。将残留物用h2o 30ml稀释,并用ea 30ml(10ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-甲酸甲酯(200mg,630.9umol,47%收率),为白色固体,其不经进一步纯化即直接进入下一步使用。产物的lcms(esi):m/z 318.1[m+h]
+
。
[0643]
步骤4:4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-甲酸的制备
[0644][0645]
向4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-甲酸甲酯(200mg,630.22umol,1当量)在h2o(2ml)和meoh(2ml)中的溶液中添加naoh(75.62mg,1890.75umol,3当量)。将混合物在50℃下搅拌12小时。lc-ms显示反应物1完全消耗,并且有一个具有所需ms的主峰。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-甲酸(160mg,528.08umol,84%收率),为白色固体。产物的lcms(esi):m/z 304.3[m+h]
+
。
[0646]
步骤5:2-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯的制备
[0647]
[0648]
在0℃下持续30分钟向4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-甲酸(35mg,115.39μmol,1当量)在dcm(1ml)中的溶液中添加hobt(3.12mg,23.08μmol,0.2当量)、et3n(58.38mg,576.96μmol,80.31μl,5当量)和edci(44.24mg,230.78μmol,2当量)。然后在0℃下添加4-[(1s)-1-氨乙基]苯甲酸甲酯(41.36mg,230.78μmol,2当量)。将所得混合物在25℃下搅拌12小时。
[0649]
将残留物用h2o 5ml稀释,并用dcm 30ml(10ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea =1:1)纯化残留物,得到2-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(30mg,55.08μmol,41.77%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 465.2[m+h]
+
。
[0650]
步骤6:化合物12即4-[(1s)-1-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸的制备
[0651][0652]
向4-[(1s)-1-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸甲酯(20mg,43.06μmol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(5.17mg,129.17μmol,3当量)。将混合物在50℃下搅拌12小时。
[0653]
在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物12,即4-[(1s)-1-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸(20mg,44.42μmol,56.71%收率,100%纯度),为白色固体。产物的lcms(esi):m/z 451.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=9.13(s,1h),8.71-8.66(m,2h),8.33(s,1h),8.01(d,j=8.0hz,1h),7.82(d,j=8.4hz,2h),7.70-7.61(m,2h),7.61-7.55(m,1h),7.47-7.42(m,3h),7.27(d,j=7.2hz,1h),7.01(t,j=7.2hz,1h),5.19(q,j=7.2hz,1h),4.79(s,2h),1.33(d,j=7.2hz,3h)
[0654]
实施例15
–
顺式-2-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(化合物13a)的合成
[0655][0656]
步骤1:顺式-(s)-2-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯的制备
[0657][0658]
在0℃下向4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-甲酸(40mg,131.88μmol,1当量)在dcm(2ml)中的溶液中添加et3n(66.72mg,659.40μmol,91.78μl,5当量)、edci(50.56mg,263.76μmol,2当量)和hobt(3.56mg,26.38μmol,0.2当量)。添加后,将混合物在此温度下搅拌0.5小时,然后在0℃下添加顺式-(s)-2-氨基螺[3.3]庚烷-6-甲酸1-苯基乙酯(34.20mg,131.88μmol,1当量)。将所得混合物在25℃下搅拌12小时。
[0659]
将残留物用h2o 10ml稀释,并用dcm 30ml(10ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物,得到顺式-(s)-2-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(30mg,55.08μmol,41.77%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 545.2[m+h]
+
。
[0660]
步骤2:化合物13a即顺式-2-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸的制备
[0661][0662]
向顺式-(s)-2-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(30mg,55.08μmol,1当量)在tfa(1ml)和dcm(3ml)中的溶液中。将混合物在25℃下搅拌5小时。
[0663]
在减压下浓缩反应混合物以移除tfa。将残留物用naoh水溶液(10ml,1n)溶解并过滤。用1n hcl将滤液调节至ph 4。将混合物过滤。得到化合物13a,即顺式-2-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(20mg,43.81μmol,53.66%收率,93%纯度),为白色固体。产物的lcms(esi):m/z 441.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=12.01(brs,1h),9.16(s,1h),8.64(d,j=6.8hz,1h),8.32(d,j=7.2hz,1h),8.17(s,1h),8.03(d,j=8.0hz,1h),7.81(j=8.4hz,1h),7.80-7.73(m,1h),7.61-7.59(m,1h),7.53(s,1h),7.26(d,j=7.2hz,1h),6.99(t,j=6.8hz,1h),4.79(s,2h),4.23-4.18(m,1h),2.95
–
2.91(m,1h),2.37-2.21(m,2h),2.18-2.16(m,2h),2.05
–
2.03(m,2h),1.86-1.82(m,2h)
[0664]
实施例16
–
反式-2-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(化合物13b)的合成
[0665][0666]
步骤1:反式-(s)-2-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯
[0667][0668]
在0℃下向4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-甲酸(40mg,131.88μmol,1当量)在dcm(2ml)中的溶液中添加et3n(66.72mg,659.40μmol,91.78μl,5当量)、edci(50.56mg,263.76μmol,2当量)和hobt(3.56mg,26.38μmol,0.2当量)。添加后,将混合物在此温度下搅拌0.5小时,然后在0℃下添加反式-(s)-2-氨基螺[3.3]庚烷-6-甲酸1-苯基乙酯(34.20mg,131.88μmol,1当量)。将所得混合物在25℃下搅拌12小时。
[0669]
将残留物用h2o 5ml稀释,并用dcm 30ml(10ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物,得到反式-(s)-2-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(30mg,55.08μmol,41.77%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 545.2[m+h]
+
。
[0670]
步骤2:化合物13b即反式-2-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸的制备
[0671][0672]
向反式-(s)-2-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(30mg,55.08μmol,1当量)在tfa(1ml)和dcm(3ml)中的溶液中。将混合物在25℃下搅拌5小时。
[0673]
在减压下浓缩反应混合物以移除tfa。将残留物用naoh水溶液(10ml,1n)溶解并过滤。用1n hcl将滤液调节至ph 4。将混合物过滤。得到化合物13b,即反式-2-[[4-(3-异喹啉基甲基)吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(21mg,46.00μmol,53.66%收率,93%纯度),为白色固体。产物的lcms(esi):m/z 441.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=12.01(m,1h),9.16(s,1h),8.64(d,j=6.8hz,1h),8.32(d,j=7.2hz,1h),8.17(s,1h),8.03(d,j=8.0hz,1h),7.86-7.78(m,1h),7.75-7.69(m,1h),
7.64-7.56(m,1h),7.53(s,1h),7.26(d,j=7.2hz,1h),6.99(t,j=6.8hz,1h),4.76(s,2h),4.24-4.17(m,1h),2.91(q,j=8.4hz,1h),2.36-2.24(m,2h),2.22-2.16(m,2h),2.06
–
2.03(m,2h),1.86-1.83(m,2h)。
[0674]
实施例17
–
顺式-6-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-2-甲酸(化合物14a)的合成
[0675][0676]
步骤1:顺式-(s)-6-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-2-甲酸1-苯基乙酯
[0677][0678]
在0℃下向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(20mg,62.45μmol,1当量)在dcm(1ml)中的溶液中添加添加hobt(1.69mg,12.49μmol,0.2当量)、edci(23.95mg,124.90μmol,2当量)和et3n(31.59mg,312.25μmol,5当量)。添加后,将混合物在此温度下搅拌0.5小时,然后在0℃下滴加顺式-(s)-6-氨基螺[3.3]庚烷-2-甲酸1-苯基乙酯(24.29mg,93.68μmol,1.5当量)。将所得混合物在25℃下搅拌12小时。
[0679]
将残留物用h2o 5ml稀释,并用dcm 15ml(5ml*3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea =1:1)纯化残留物,得到顺式-(s)-6-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-2-甲酸1-苯基乙酯(15mg,26.60μmol,42.77%收率),为白色固体,其不经进一步纯化直接进入下一步使用。
[0680]
步骤2:化合物14a即顺式-6-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-2-甲酸的制备
[0681][0682]
向顺式-(s)-6-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-2-甲酸1-苯基乙酯(15mg,26.60μmol,1当量)在tfa(1ml)和dcm(3ml)中的溶液中。将混合物在25℃下搅拌5小时。
[0683]
在减压下浓缩反应混合物以移除tfa和dcm。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物14a,即顺式-6-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-2-甲酸(3.8mg,8.31μmol,31.24%收率,93.3%纯度),为白色固体。产物的lcms(esi):m/z 458.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=8.67(d,j=6.4hz,1h),8.31(d,j=7.2hz,1h),8.18(s,1h),7.56(d,j=8.0hz,2h),7.33-7.26(m,3h),7.02(t,j=6.8hz,1h),4.62(s,2h),4.23-4.16(m,1h),2.98-2.89(m,1h),2.42-2.34(m,1h),2.29-2.17(m,3h),2.15-2.05(m,2h),1.95-1.83(m,2h)
[0684]
实施例18
–
反式-2-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(化合物14b)的合成
[0685][0686]
步骤1:反式-(s)-2-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯
[0687][0688]
在0℃下向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(40mg,
124.90μmol,1当量)在dcm(1ml)中的溶液中添加添加hobt(3.38mg,24.98μmol,0.2当量)、edci(47.89mg,249.80μmol,2当量)和et3n(63.19mg,624.50μmol,86.92μl,5当量)。添加后,将混合物在此温度下搅拌0.5小时,然后在0℃下滴加反式-(s)-2-氨基螺[3.3]庚烷-6-甲酸1-苯基乙酯(48.59mg,187.35μmol,1.5当量)。将所得混合物在25℃下搅拌12小时。
[0689]
将残留物用h2o 10ml稀释,并用dcm 30ml(10ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物,得到反式-(s)-2-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(32mg,53.42μmol,42.77%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 584.1[m+na]
+
。
[0690]
步骤2:化合物14b即反式-2-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸的制备
[0691][0692]
向反式-(s)-2-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(30mg,53.42μmol,1当量)在tfa(1ml)和dcm(3ml)中的溶液中。将混合物在25℃下搅拌5小时。
[0693]
在减压下浓缩反应混合物以移除tfa和dcm。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物14b,即反式-2-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(21mg,45.95μmol,53.45%收率,93.3%纯度),为白色固体。产物的lcms(esi):m/z 458.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=8.67(d,j=6.8hz,1h),8.31(d,j=7.2hz,1h),8.18(s,1h),7.56(d,j=8.0hz,2h),7.33-7.26(m,3h),7.02(t,j=6.8hz,1h),4.63(s,2h),4.23-4.16(m,1h),2.98-2.89(m,1h),2.42-2.34(m,1h),2.29-2.17(m,3h),2.15-2.05(m,2h),1.95-1.83(m,2h)
[0694]
实施例19
–
2-[3-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸(化合物15)的合成
[0695][0696]
步骤1:2-[3-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯
[0697][0698]
在0℃下持续0.5小时向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(60mg,187.34μmol,1当量)在dcm(1ml)中的溶液中添加hobt(5.06mg,37.47μmol,0.2当量)、et3n(94.79mg,936.72μmol,130.38μl,5当量)和edci(71.83mg,374.69μmol,2当量)。然后在0℃下添加2-(3-氨基-1-双环[1.1.1]戊烷基)乙酸甲酯(34.89mg,224.81μmol,1.2当量),将混合物在25℃下搅拌12小时。
[0699]
将残留物用h2o 10ml稀释,并用dcm 30ml(10ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用,得到2-[3-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(62mg,72%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z458.2[m+h]
+
。
[0700]
步骤2:化合物15即2-[3-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸的制备
[0701][0702]
向2-[3-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(62mg,135.66μmol,1当量)在h2o(3ml)和meoh(1ml)中的溶液中添加naoh(15mg,375μmol,3当量)。将混合物在50℃下搅拌12小时。
[0703]
在减压下浓缩反应混合物以移除meoh。将残留物用h2o(10ml)稀释并过滤。用1n hcl将滤液调节至ph 4。将混合物过滤。得到化合物15,即2-[3-[[4-[[4-(三氟甲基)苯基]
甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸(50mg,110.84μmol,83%收率,98.3%纯度),为白色固体。产物的lcms(esi):m/z 444.1[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=12.10(brs,1h),8.66(d,j=8.4hz,2h),8.16(s,1h),7.55(d,j=8.0hz,2h),7.37-7.29(m,3h),7.03(t,j=6.8hz,1h),4.65(s,2h),2.50(s,2h),2.00(s,6h)
[0704]
实施例20
–
2-[3-[[4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸(化合物16)的合成
[0705][0706]
步骤1:4-溴吡唑并[1,5-a]吡啶-3-甲酸甲酯的制备
[0707][0708]
在25℃下向4-溴吡唑并[1,5-a]吡啶-3-甲酸(200mg,829.73μmol,1当量)在dcm(2ml)和dmf(0.01ml)中的溶液中添加(cocl)2(115.85mg,912.71μmol,79.89μl,1.1当量)。添加后,将混合物在此温度下搅拌3小时,然后在0℃下添加meoh(265.86mg,8.30mmol,335.77μl,10当量)和et3n(251.88mg,2.49mmol,346.47μl,3当量)。将所得混合物在0℃下搅拌1小时。
[0709]
在减压下浓缩反应混合物以移除溶剂。将残留物用h2o 20ml稀释,并用dcm 60ml(20ml
×
3)萃取。将合并的有机层用盐水20ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=2:1)纯化残留物,得到4-溴吡唑并[1,5-a]吡啶-3-甲酸甲酯(180mg,705.69μmol,85.05%收率),为白色固体。
[0710]
步骤2:4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸甲酯的制备
[0711][0712]
在氮气下向4-溴吡唑并[1,5-a]吡啶-3-甲酸甲酯(100mg,392.05μmol,1当量)和4,4,5,5-四甲基-2-[[3-(三氟甲基)苯基]甲基]-1,3,2-二氧杂环戊硼烷(112.17mg,392.05μmol,1当量)在二噁烷(1ml)和h2o(0.2ml)中的溶液中添加pd(dppf)cl2(86.06mg,117.62μmol,0.3当量)和k3po4(83.22mg,392.05μmol,1当量)。将混合物在80℃下搅拌12小时。
[0713]
移除溶剂,得到粗产物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸甲酯(50mg,149.57μmol,38.15%收率),为白色固体。
[0714]
步骤3:4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸的制备
[0715][0716]
向4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸甲酯(50mg,149.57μmol,1当量)在h2o(4ml)和meoh(2ml)中的溶液中添加naoh(18mg,448.71μmol,3当量)。将混合物在50℃下搅拌12小时。
[0717]
移除溶剂,得到粗产物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物,得到4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(30mg,93.67μmol,62.63%收率),为白色固体。
[0718]
步骤4:2-[3-[[4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯的制备
[0719][0720]
在0℃下持续0.5h向4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(30mg,93.67μmol,1当量)在dcm(1ml)中的溶液中添加et3n(47.39mg,468.36μmol,65.19μl,5当量)、edci(35.91mg,187.34μmol,2当量)和hobt(2.53mg,18.73μmol,0.2当量)。然后在0℃下添加2-(3-氨基-1-双环[1.1.1]戊烷基)乙酸甲酯(17.44mg,112.41μmol,1.2当量)。将混合物在25℃下搅拌12小时。
[0721]
将残留物用h2o 5ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物2-[3-[[4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(30mg,65.58μmol,70.01%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 458.3[m+h]
+
。
[0722]
步骤5:化合物16即2-[3-[[4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸的制备
[0723][0724]
向2-[3-[[4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(30mg,65.58μmol,1当量)在h2o(3ml)和meoh(2ml)中的溶液中添加naoh(7.86mg,196.74μmol,3当量)。将混合物在50℃下搅拌12小时。
[0725]
移除溶剂,得到粗产物。用1n hcl将混合物调节至ph 4。将混合物过滤,得到化合物16,即2-[3-[[4-[[3-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸(20mg,44.47μmol,67.81%收率,98.6%纯度),为白色固体。产物的lcms(esi):m/z 444.1[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=8.73(s,1h),8.66(d,j=6.8hz,1h),8.22(s,1h),7.49(d,j=8.0hz,1h),7.47-7.44(m,3h),7.39(t,j=7.2hz,1h),7.04(t,j=6.8hz,1h),4.69(s,2h),2.50(s,2h),2.02(s,6h)
[0726]
实施例21
–
2-[3-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸(化合物17)的合成
[0727][0728]
步骤1:2-[3-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯
[0729][0730]
在0℃下向8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-甲酸(40mg,124.89μmol,1当量)在dcm(1ml)中的溶液中添加edci(29.93mg,156.12μmol,2当量)、et3n(39.49mg,390.30μmol,54.33μl,5当量)和hobt(2.11mg,15.61μmol,0.2当量)。将混合物在0℃下搅拌0.5小时。然后在0℃下添加2-(3-氨基-1-双环[1.1.1]戊烷基)乙酸甲酯(37.5mg,241.63μmol,1.5当量)。将混合物在25℃下搅拌16小时。
[0731]
将反应混合物用h2o 5ml稀释,并用dcm 30ml(10ml
×
3)萃取。将合并的有机层用盐水(10ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用,得到2-[3-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰
基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(33mg,72.21μmol,57.7%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 458.3[m+h]
+
。
[0732]
步骤2:化合物17即2-[3-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸的制备
[0733][0734]
向2-[3-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(33mg,72.21μmol,1当量)在h2o(2ml)和meoh(2ml)中的溶液中添加naoh(8.67mg,216.63μmol,3当量)。将混合物在50℃下搅拌16小时。
[0735]
在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物17,即2-[3-[[8-[[4-(三氟甲基)苯基]甲基]咪唑并[1,5-a]吡啶-1-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸(24mg,54.12μmol,75%收率,95.12%纯度),为白色固体。产物的lcms(esi):m/z 444.1[m+h]
+
。1h nmr(400mhz,dmso-d6)δppm 8.50(d,j=6.4hz,1h),8.46(s,1h),8.36(d,j=6.8hz,1h),7.58(br d,j=8.0hz,2h),7.41(br d,j=7.6hz,2h),6.91(d,j=6.8hz,1h),6.84-6.80(m,1h),4.80(s,2h),2.30(s,2h),2.02(s,6h)。
[0736]
实施例22
–
2-(3-(4-(4-(三氟甲基)苄基)-1h-吲唑-3-甲酰胺基)双环[1.1.1]戊烷-1-基)乙酸(化合物18)的合成
[0737][0738]
步骤1:2-[3-[[1-四氢吡喃-2-基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯的制备
[0739]
向1-四氢吡喃-2-基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(60mg,148.38μmol,1当量)在dcm(2ml)中的溶液中添加hobt(4.00mg,29.68μmol,0.2当量)、edci(58.88mg,296.74μmol,2当量)和et3n(75.08mg,741.88μmol,100μl,5当量)。将混合物在0℃下搅拌0.5小时。然后将2-(3-氨基-1-双环[1.1.1]戊烷基)乙酸甲酯(27.64mg,178.04μmol,1.2当量)添加到混合物中。将混合物在25℃下搅拌16小时。
[0740]
将反应混合物用h2o 5ml稀释,并用dcm 30ml(10ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用,得到2-[3-[[1-四氢吡喃-2-基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(50mg,92.32μmol,62.22%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 542.3[m+h]
+
。
[0741]
步骤2:2-[3-[[4-[[4-(三氟甲基)苯基]甲基]-1h-吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯的制备
[0742][0743]
向2-[3-[[1-四氢吡喃-2-基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(50mg,92.32μmol,1当量)在hcl/meoh(6ml)中的溶液中。将混合物在25℃下搅拌1小时。
[0744]
将反应混合物用h2o 10ml稀释,并用dcm 30ml(10ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用,并得到化合物2-[3-[[4-[[4-(三氟甲基)苯基]甲基]-1h-吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(40mg,87.44μmol,94.71%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 458.1[m+h]
+
。
[0745]
步骤3:化合物18即2-(3-(4-(4-(三氟甲基)苄基)-1h-吲唑-3-甲酰胺基)双环[1.1.1]戊烷-1-基)乙酸的制备
[0746][0747]
向2-[3-[[4-[[4-(三氟甲基)苯基]甲基]-1h-吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(40mg,87.44μmol,1当量)在meoh(2ml)和h2o(2ml)中的溶液中添加naoh(10.5mg,262.32μmol,3当量)。将混合物在50℃下搅拌16小时。
[0748]
在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物
过滤,并且得到化合物18,即2-(3-(4-(4-(三氟甲基)苄基)-1h-吲唑-3-甲酰胺基)双环[1.1.1]戊烷-1-基)乙酸(21mg,47.33μmol,54.26%收率,97.44%纯度),为白色固体。产物的lcms(esi):m/z 444.1[m+h]
+
。1h nmr(400mhz,dmso-d6)δppm 13.50(s,1h),12.08(brs,1h),8.81(s,1h),7.53(d,j=8.0hz,2h),7.46(d,j=8.4hz,1h),7.38-7.32(m,3h),7.08(d,j=7.2hz,1h),4.70(s,2h),2.50(s,2h),2.02(s,6h)。
[0749]
实施例23
–
2-[3-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸(化合物19)的合成
[0750][0751]
步骤1:2-[3-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯
[0752][0753]
向1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(50mg,143.55μmol,1当量)在dcm(1ml)中的溶液中添加hobt(3.88mg,28.71μmol,0.2当量)、et3n(72.63mg,717.73μmol,99.90μl,5当量)和edci(55.04mg,287.09μmol,2当量)。将混合物在0℃下搅拌0.5小时。然后在0℃下添加2-(3-氨基-1-双环[1.1.1]戊烷基)乙酸甲酯(24.51mg,157.90μmol,1.1当量)。将混合物在25℃下搅拌16小时。
[0754]
将反应混合物用h2o 5ml稀释,并用dcm 9ml(3ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=2:1)纯化残留物,得到2-[3-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(40mg,82.39μmol,57.40%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 486.3[m+h]
+
。
[0755]
步骤2:化合物19即2-[3-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸的制备
[0756][0757]
向2-[3-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(40mg,82.39μmol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(9.89mg,247.17μmol,3当量)。将混合物在50℃下搅拌16小时。
[0758]
在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物19,即2-[3-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸(26mg,54.69μmol,66.38%收率,99.17%纯度),为白色固体。产物的lcms(esi):m/z 472.1[m+h]
+
。1h nmr(400mhz,cd3od)δ=8.67(s,1h),7.52(d,j=8.4hz,1h),7.46(d,j=8.4hz,2h),7.45-7.41(m,1h),7.27(d,j=8.0hz,2h),7.11(t,j=6.8hz,1h),4.70(s,2h),4.51
–
4.44(m,2h),2.58(s,2h),2.12(s,6h),1.48(t,j=7.2hz,3h)
[0759]
实施例24
–
4-[(1s)-1-[[1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸(化合物20)的合成
[0760][0761]
步骤1:4-溴-1-异丙基-1h-吲唑-3-甲酸甲酯和4-溴-2-异丙基-2h-吲唑-3-甲酸甲酯的制备
[0762][0763]
向4-溴-1h-吲唑-3-甲酸甲酯(1g,3.92mmol,1当量)和2-碘丙烷(3.33g,19.60mmol,1.96ml,5当量)在dmf(6ml)中的溶液中添加k2co3(1.08g,7.84mmol,2当量)。将混合物在25℃下搅拌5小时。将反应混合物用h2o 30ml稀释,并用ea 45ml(15ml
×
3)萃取。将合并的有机层用盐水30ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过柱色谱法(sio2,石油醚/乙酸乙酯=50/1至0/1)纯化残留物。得到化合物4-溴-1-异丙基-吲唑-3-甲酸甲酯(620mg,51%收率)和4-溴-2-异丙基-2h-吲唑-3-甲酸甲酯(410mg,35%收率),为黄色油状物。
[0764]
4-溴-1-异丙基-吲唑-3-甲酸甲酯:1h nmr(400mhz,dmso-d6)δ=7.90(d,j=8.4hz,1h),7.54(d,j=6.4hz,1h),7.39-7.35(m,1h),5.15-5.09(m,1h),3.91(s,3h),1.49(d,j=6.4hz,6h)。
[0765]
4-溴-2-异丙基-2h-吲唑-3-甲酸甲酯:1h nmr(400mhz,dmso-d6)δ=7.79(d,j=8.0hz,1h),7.48-7.46(m,1h),7.27-7.23(m,1h),5.11-5.04(m,1h),4.01(s,3h),1.54(d,j=6.4hz,6h)。
[0766]
步骤2:1-异丙基-4-[[4-(三氟甲基)苯基]甲基]-吲唑-3-甲酸甲酯
[0767][0768]
向4,4,5,5-四甲基-2-[[4-(三氟甲基)苯基]甲基]-1,3,2-二氧杂环戊硼烷(385.12mg,1.35mmol,2当量)和4-溴-1-异丙基-吲唑-3-甲酸甲酯(200.00mg,673.07umol,1当量)在h2o(0.5ml)和二噁烷(2ml)中的溶液中添加k3po4(142.87mg,673.07umol,1当量)和pd(dppf)cl2(147.75mg,201.92umol,0.3当量)。将混合物在80℃下搅拌16小时。在lc-ms上显示有若干新峰,并检测到41.15%的所需化合物。将反应混合物用h2o 10ml稀释,并用dcm 30ml(10ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=3:1)纯化残留物。得到化合物1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯(170mg,451.68umol,67.11%收率),为黄色油状物。产物的lcms(esi):m/z 377.3[m+h]
+
。
[0769]
步骤3:1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸
[0770][0771]
向1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯(170mg,451.68umol,1当量)在h2o(1.5ml)和meoh(1.5ml)中的溶液中添加naoh(54.20mg,1.36mmol,3当量)。将混合物在50℃下搅拌16小时。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph=5。将混合物过滤。得到化合物1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(130mg,358.77umol,79.43%收率),为白色固体。
[0772]
步骤4:4-[(1s)-1-[[1-异丙基-4-[[4-(三氟甲基)苯基]甲基]-吲唑-3-羰基]氨基]乙基]苯甲酸甲酯
[0773][0774]
在0℃下向4-[(1s)-1-氨乙基]苯甲酸甲酯(19.78mg,110.39umol,1当量)在dcm(1ml)中的溶液中添加hobt(2.98mg,22.08umol,0.2当量)、et3n(55.85mg,551.95umol,76.83ul,5当量)和edci(42.32mg,220.78umol,2当量)。将混合物在0℃下搅拌0.5小时。然后在0℃下添加1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(40mg,110.39umol,1当量)。将混合物在25℃下搅拌16小时。在lc-ms上显示有若干新峰,并检测到51.93%的所需化合物。将反应混合物用h2o 2ml稀释,并用dcm 9ml(3ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物4-[(1s)-1-[[1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸甲酯(35mg,66.85umol,60.56%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 524.3[m+h]
+
。
[0775]
步骤5:4-[(1s)-1-[[1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]-氨基]乙基]-苯甲酸
[0776][0777]
向4-[(1s)-1-[[1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸甲酯(35mg,66.85umol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(8.02mg,200.56umol,3当量)。将混合物在50℃下搅拌16小时。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph=5。将混合物过滤。得到化合物4-[(1s)-1-[[1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸(30mg,55.52umol,83.04%收率,94.29%纯度),为白色固体。产物的lcms(esi):m/z 510.1[m+h]
+
。1h nmr(400mhz,dmso-d6)δppm 12.83(brs,1h),8.79(d,j=8.4hz,1h),7.91(d,j=8.0hz,2h),7.66(d,j=8.4hz,1h),7.55(d,j=8.4hz,2h),7.38
–
7.33(m,3h),7.20(d,j=8.4hz,2h),7.12(d,j=8.0hz,1h),5.27
–
5.23(m,1h),5.08
–
5.02(m,1h),4.71(d,j=14.4hz,1h),4.50(d,j=14.4hz,1h),1.53(d,j=6.4,6h),1.48(d,j=7.2hz,3h)
[0778]
实施例25
–
反式-2-[[1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(化合物21)的合成
[0779][0780]
步骤1:反式-(s)-2-[[1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯
[0781][0782]
在0℃下向反式-(s)-2-氨基螺[3.3]庚烷-6-甲酸1-苯基乙酯(35.79mg,137.99umol,1当量)在dcm(1ml)中的溶液中添加hobt(3.73mg,27.60umol,0.2当量)、et3n(69.82mg,689.95umol,96.03ul,5当量)和edci(52.91mg,275.98umol,2当量)。将混合物在0℃下搅拌0.5小时。然后在0℃下添加1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(50mg,137.99umol,1当量)。将混合物在25℃下搅拌16小时。在lc-ms上显示有若干新峰,并检测到48.94%的所需化合物。将反应混合物用h2o 5ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。
[0783]
通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物反式-(s)-2-[[1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(45mg,74.54umol,54.02%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 604.4[m+h]
+
。
[0784]
步骤2:反式-2-[[1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸
[0785][0786]
向反式-(s)-2-[[1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(45mg,74.54umol,1当量)在tfa(1ml)和dcm(1ml)中的溶液中。将混合物在50℃下搅拌16小时。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合
物调节至ph=5。将混合物过滤。得到化合物反式-2-[[1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(22mg,41.06umol,55.08%收率,93.23%纯度),为白色固体。产物的lcms(esi):m/z 500.1[m+h]
+
。1h nmr(400mhz,dmso-d6)δppm 8.42(d,j=8.0hz,1h)7.66(d,j=8.4hz,1h)7.56(d,j=8.4hz,2h)7.40
–
7.37(m,1h),7.32(d,j=8.0hz,2h)7.11(d,j=7.2hz,1h)5.00-5.09(m,1h)4.67(s,2h)4.32-4.25(m,1h),2.97
–
2.91(m,1h),2.41-2.36(m,3h)2.21-2.12(m,2h)2.11-2.07(m,1h)2.03
–
2.00(m,2h)1.51(d,j=6.8hz,6h)。
[0787]
实施例26
–
2-[3-[[1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸(化合物22)的合成
[0788][0789]
步骤1:2-[3-[[1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯
[0790][0791]
在0℃下向2-(3-氨基-1-双环[1.1.1]戊烷基)乙酸甲酯(18.85mg,121.43umol,1.1当量)在dcm(1ml)中的溶液中添加hobt(2.98mg,22.08umol,0.2当量)、et3n(55.85mg,551.96umol,76.83ul,5当量)和edci(42.32mg,220.78umol,2当量)。将混合物在0℃下搅拌0.5小时。然后在0℃下添加1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(40mg,110.39umol,1当量)。将混合物在25℃下搅拌16小时。在lc-ms上显示有若干新峰,并检测到45.43%的所需化合物。将反应混合物用h2o 5ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物2-[3-[[1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(32mg,64.06umol,58.03%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 500.3[m+h]
+
。
[0792]
步骤2:2-[3-[[1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸
[0793][0794]
向2-[3-[[1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(32mg,64.06umol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(7.69mg,192.18umol,3当量)。将混合物在50℃下搅拌16小时。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph=5。将混合物过滤。得到化合物2-[3-[[1-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸(18mg,35.67umol,55.68%收率,96.20%纯度),为白色固体。产物的lcms(esi):m/z 486.1[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=12.10(br s,1h),8.74(s,1h),7.65(d,j=8.4hz,1h),7.54(d,j=8.4hz,2h),7.37(d,j=8.4hz,1h),7.37-7.33(m,2h),7.13(d,j=7.2hz,1h),5.06-4.99(m,1h),4.68(s,2h),2.50(s,2h),2.05(s,6h),1.49(d,j=6.4hz,6h)。
[0795]
实施例27
–
4-[(1s)-1-[[1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸(化合物23)的合成
[0796][0797]
步骤1:4-溴-1-异丁基-吲唑-3-甲酸甲酯
[0798][0799]
向4-溴-1h-吲唑-3-甲酸甲酯(1g,3.92mmol,1当量)和1-碘-2-甲基-丙烷(3.61g,19.60mmol,2.25ml,5当量)在dmf(1ml)中的溶液中添加k2co3(1.08g,7.84mmol,2当量)。将混合物在25℃下搅拌5小时。tlc指示反应物1完全消耗。将反应混合物用h2o 30ml稀释,并用ea 30ml(10ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过柱色谱法(sio2,石油醚/乙酸乙酯=50/1至0/1)纯化残留物。得到化合物4-溴-1-异丁基-吲唑-3-甲酸甲酯(750mg,61.8%收率)和4-溴-2-异丁基-吲唑-3-甲酸甲酯(380mg,31.3%收率),为黄色油状物。
[0800]
4-溴-1-异丁基-吲唑-3-甲酸甲酯:1h nmr(400mhz,dmso-d6)δ=7.89(d,j=8.0hz,1h),7.54-7.53(m,1h),7.40-7.36(m,1h),4.32(d,j=7.2hz,2h),3.91(s,3h),
2.26
–
2.19(m,1h),0.85(d,j=6.8hz,6h)。
[0801]
4-溴-2-异丁基-吲唑-3-甲酸甲酯:1h nmr(400mhz,dmso-d6)δ=7.78(d,j=8.4hz,1h),7.50(d,j=7.2hz,1h),7.28-7.23(m,1h),4.39(d,j=7.2hz,2h),4.00(s,3h),2.29
–
2.22(m,1h),0.85(d,j=6.8hz,6h)。
[0802]
步骤2:1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯
[0803][0804]
将4-溴-1-异丁基-吲唑-3-甲酸甲酯(200mg,642.73umol,1当量)、4,4,5,5-四甲基-2-[[4-(三氟甲基)苯基]甲基]-1,3,2-二氧杂环戊硼烷(367.76mg,1.29mmol,2当量)、k3po4(136.43mg,642.73umol,1当量)、pd(dppf)cl2(141.09mg,192.82umol,0.3当量)在二噁烷(1ml)和h2o(0.5ml)中的混合物脱气,并用n2吹扫3次,然后将混合物在n2气氛和80℃下搅拌12小时。在减压下浓缩反应混合物以移除二噁烷。将残留物用h2o 10ml稀释,并用ea30ml(10ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=3:1)纯化残留物。得到化合物1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯(170mg,435.45umol,67.75%收率),为白色固体。hplc显示产物是纯净的。粗产物的lcms(esi):m/z 391.3[m+h]
+
。
[0805]
步骤3:1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸
[0806][0807]
向1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯(170mg,435.45umol,1当量)在h2o(0.5ml)和meoh(2ml)中的溶液中添加naoh(52.26mg,1.36mmol,3当量)。将混合物在80℃下搅拌3小时。根据tlc,反应是纯净的。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(140mg,371.97umol,85.42%收率),为白色固体。
[0808]
步骤4:4-[(1s)-1-[[1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸甲酯
[0809]
[0810]
在0℃下向1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(45mg,119.56umol,1当量)在dcm(2ml)中的溶液中添加et3n(60.49mg,597.81umol,83.21ul,5当量)、hobt(3.23mg,23.91umol,0.2当量)和edci(45.84mg,239.13umol,2当量)。添加后,将混合物在此温度下搅拌0.5小时,然后在0℃下添加4-[(1s)-1-氨乙基]苯甲酸甲酯(32.14mg,179.34umol,1.5当量)。将所得混合物在25℃下搅拌12小时。将残留物用h2o 10ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物4-[(1s)-1-[[1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸甲酯(30mg,55.81umol,46.68%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 538.3[m+h]
+
。
[0811]
步骤5:4-[(1s)-1-[[1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸
[0812][0813]
向4-[(1s)-1-[[1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸甲酯(30mg,55.81umol,1当量)在meoh(2ml)和h2o(2ml)中的溶液中添加naoh(6.70mg,167.42umol,3当量)。将混合物在50℃下搅拌12小时。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph=5。将混合物过滤。得到化合物4-[(1s)-1-[[1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸(10mg,17.38umol,31.15%收率,91%纯度),为白色固体。产物的lcms(esi):m/z 524.1[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=8.75(d,j=8.0hz,1h),7.87(d,j=8.0hz,2h),7.65(d,j=8.4hz,1h),7.46-7.36(m,5h),7.25(d,j=8.0hz,2h),7.09(d,j=7.2hz,1h),5.24-5.17(m,1h),4.63(s,2h),4.26(d,j=7.2hz,2h),2.30-2.23(m,1h),1.44(d,j=7.2hz,3h),0.87(d,j=6.8hz,6h)。
[0814]
实施例28
–
反式-2-[[1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(化合物24)的合成
[0815][0816]
步骤1:反式-(s)-2-[[1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨
基]螺[3.3]庚烷-6-甲酸1-苯基乙酯
[0817][0818]
在0℃下向1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(50mg,132.85umol,1当量)在dcm(2ml)中的溶液中添加et3n(67.21mg,664.25umol,92.45ul,5当量)、hobt(3.59mg,26.57umol,0.2当量)和edci(50.93mg,265.70umol,2当量)。添加后,将混合物在此温度下搅拌0.5小时,然后在0℃下滴加反式-(s)-2-氨基螺[3.3]庚烷-6-甲酸1-苯基乙酯(51.68mg,199.28umol,1.5当量)。将所得混合物在25℃下搅拌12小时。将残留物用h2o 10ml稀释,并用dcm 30ml(10ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物反式-(s)-2-[[1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(45mg,72.85umol,54.84%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 618.4[m+h]
+
。
[0819]
步骤2:反式-2-[[1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸
[0820][0821]
向反式-(s)-2-[[1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(45mg,72.85umol,1当量)在tfa(2ml)和dcm(2ml)中的溶液中。将混合物在25℃下搅拌12小时。在减压下浓缩反应混合物以移除溶剂。通过添加1m naoh(10ml)溶解混合物,并用dcm 15ml(5ml
×
3)萃取。过滤溶液,并用1n hcl将滤液调节至ph 4。将混合物过滤。得到化合物反式-2-[[1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(31mg,55.35umol,75.98%收率,91.7%纯度),为白色固体。产物的lcms(esi):m/z 514.3[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=8.45(d,j=8.0hz,1h),7.64(d,j=8.4hz,1h),7.55(d,j=8.0hz,2h),7.41-7.36(m,1h),7.30(d,j=8.0hz,2h),7.09(d,j=6.8hz,1h),4.66(s,2h),4.30-4.21(m,3h),2.94-2.89(m,1h),2.39-2.24(m,3h),2.23-2.13(m,4h),2.04
–
1.94(m,2h),0.86(d,j=6.8hz,6h)。
[0822]
实施例29
–
2-[3-[[1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸(化合物25)的合成
[0823][0824]
步骤1:2-[3-[[1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯
[0825][0826]
在0℃下向1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(45mg,119.56umol,1当量)在dcm(2ml)中的溶液中添加et3n(60.49mg,597.81umol,83.21ul,5当量)、hobt(3.23mg,23.91umol,0.2当量)和edci(45.84mg,239.13umol,2当量)。添加后,将混合物在此温度下搅拌0.5小时,然后在0℃下滴加2-(3-氨基-1-双环[1.1.1]戊烷基)乙酸甲酯(27.83mg,179.34umol,1.5当量)。将所得混合物在25℃下搅拌12小时。将残留物用h2o 10ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物2-[3-[[1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(40mg,77.89umol,65.15%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 514.3[m+h]
+
。
[0827]
步骤2:2-[3-[[1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸
[0828][0829]
向2-[3-[[1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(40mg,77.89umol,1当量)在h2o(2ml)和meoh(2ml)中的溶液中添加naoh(3.12mg,77.89umol,1当量)。将混合物在50℃下搅拌12小时。在减压下浓缩反应混合物以移除溶剂。用1n hcl将混合物调节至ph=5。将混合物过滤。得到化合物2-[3-[[1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸
(33mg,62.76umol,80.57%收率,95%纯度),为白色固体。产物的lcms(esi):m/z 500.1[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=8.66(s,1h),7.62(d,j=8.4hz,1h),7.53(d,j=8.0hz,2h),7.40-7.33(m,3h),7.10(d,j=7.2hz,1h),4.67(s,2h),4.20(d,j=7.2hz,2h),2.29-2.19(m,3h),1.99(s,6h),0.84(d,j=6.8hz,6h)。
[0830]
实施例30
–
4-[1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环丙基]苯甲酸(化合物26)的合成
[0831][0832]
步骤1:4-[1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环丙基]苯甲酸甲酯
[0833][0834]
在0℃下向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(20mg,62.45umol,1当量)在dcm(1ml)中的溶液中添加hobt(1.69mg,12.49umol,0.2当量)、et3n(31.60mg,312.24umol,43.46ul,5当量)和edci(23.94mg,124.90umol,2当量)。将混合物在0℃下搅拌0..5小时。然后在0℃下添加4-(1-氨基环丙基)苯甲酸甲酯;盐酸盐(14.22mg,62.45umol,1当量)。将混合物在25℃下搅拌16小时。在lc-ms上显示有若干新峰,并检测到30.44%的所需化合物。将反应混合物用h2o 10ml稀释,并用dcm 12ml(4ml
×
3)萃取。将合并的有机层用盐水9ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea =1:1)纯化残留物。得到化合物4-[1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环丙基]苯甲酸甲酯(20mg,40.53umol,64.90%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 494.1[m+h]
+
。
[0835]
步骤2:4-[1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环丙基]苯甲酸
[0836][0837]
向4-[1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环丙基]苯甲酸甲酯(20mg,40.53umol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(4.86mg,121.59umol,3当量)。将混合物在50℃下搅拌16小时。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物4-[1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环丙基]苯甲酸(7mg,14.05umol,34.68%收率,96.26%纯度),为白色固体。产物的lcms(esi):m/z 480.0[m+h]
+1
h nmr(400mhz,dmso-d6)δppm 12.78(br s,1h)9.01(s,1h)8.74(d,j=7.2hz,1h)8.46(s,1h)7.82(d,j=8.0hz,2h)7.53(d,j=8.4hz,2h)7.31(d,j=7.2hz,1h)7.23-7.29(m,4h)7.07(t,j=6.8hz,1h)4.69(s,2h)1.25-1.23(m,4h)。
[0838]
实施例31
–
4-[(1r)-1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸(化合物27)的合成
[0839][0840]
步骤1:4-[(1r)-1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸甲酯
[0841][0842]
在0℃下向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(20mg,62.45umol,1当量)在dcm(1ml)中的溶液中添加hobt(1.69mg,12.49umol,0.2当量)、et3n(31.60mg,312.24umol,43.46ul,5当量)和edci(23.94mg,124.90umol,2当量)。将混合物在0℃下搅拌0.5小时。然后在0℃下添加4-[(1r)-1-氨乙基]苯甲酸甲酯(12.31mg,68.69umol,1.1当量)。将混合物在25℃下搅拌16小时。在lc-ms上显示有若干新峰,并检测到74.29%的所需化合物。将反应混合物用h2o 9ml稀释,并用dcm 12ml(4ml
×
3)萃取。将合并的有机层用盐水9ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型
tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物4-[(1r)-1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸甲酯(11mg,22.85umol,36.59%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 482.1[m+h]
+
。
[0843]
步骤2:4-[(1r)-1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸
[0844][0845]
向4-[(1r)-1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸甲酯(11mg,22.85umol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(2.74mg,68.54umol,3当量)。将混合物在50℃下搅拌16小时。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物4-[(1r)-1-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]乙基]苯甲酸(3mg,5.97umol,26.14%收率,93.04%纯度),为白色固体。产物的lcms(esi):m/z 468.0[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=12.85(br s,1h),8.75-8.69(m,2h),8.35(s,1h),7.92(d,j=8.4hz,2h),7.52(d,j=8.0hz,2h),7.40-7.34(m,3h),7.20(d,j=8.0hz,2h),7.06(t,j=6.8hz,1h),5.22-5.15(m,1h),4.71(d,j=14.8hz,1h),4.51(d,j=14.8hz,1h),1.43(d,j=7.2hz,3h)。
[0846]
实施例32
–
2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]苯基]乙酸(化合物28)的合成
[0847][0848]
步骤1:2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]苯基]乙酸乙酯
[0849][0850]
向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(30mg,93.67umol,1当量)和2-(4-氨基苯基)乙酸乙酯(16.79mg,93.67umol,1当量)在dcm(1ml)中的溶液中添加pyaop(53.72mg,103.04umol,1.1当量)和diea(30.27mg,234.18umol,40.79ul,2.5当量)。将混合物在25℃下搅拌5小时。lc-ms显示剩下0%的苯甲酸。在lc-ms上显示有若干新峰,并检测到76.01%的所需化合物。将反应混合物用h2o 10ml稀释,并用dcm 12ml(4ml
×
3)萃取。将合并的有机层用盐水9ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]苯基]乙酸乙酯(38mg,78.93umol,84.26%收率),为黄色油状物,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 482.1[m+h]
+
。
[0851]
步骤2:2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]苯基]乙酸
[0852][0853]
向2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]苯基]乙酸乙酯(38mg,78.93umol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(9.47mg,236.78umol,3当量)。将混合物在50℃下搅拌16小时。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]苯基]乙酸(13mg,28.49umol,36.10%收率,99.37%纯度),为白色固体。产物的lcms(esi):m/z 454.0[m+h]
+
。1h nmr(400mhz,dmso-d6)δppm 12.31(br s,1h)10.16(s,1h)8.76(d,j=6.8hz,1h)8.42(s,1h)7.62(d,j=8.4hz,2h)7.52(d,j=8.0hz,2h)7.34(d,j=7.6hz,3h)7.23(d,j=8.4hz,2h)7.10(t,j=6.94hz,1h)4.65(s,2h)3.55(s,2h)。
[0854]
实施例33
–
4-[(1s)-1-[[2-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸(化合物29)的合成
[0855][0856]
步骤1:2-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯
[0857][0858]
向4,4,5,5-四甲基-2-[[4-(三氟甲基)苯基]甲基]-1,3,2-二氧杂环戊硼烷(770.25mg,2.69mmol,2当量)和4-溴-2-异丙基-吲唑-3-甲酸甲酯(400.00mg,1.35mmol,1当量)在h2o(2ml)和二噁烷(10ml)中的溶液中添加k3po4(285.74mg,1.35mmol,1当量)和pd(dppf)cl2(295.49mg,403.84umol,0.3当量)。将混合物在80℃下搅拌16小时。将反应混合物用h2o 20ml稀释,并用dcm 45ml(15ml
×
3)萃取。将合并的有机层用盐水30ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物2-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯(320mg,850.22umol,63.16%收率),为白色固体。粗产物的lcms(esi):m/z 377.3[m+h]
+
。
[0859]
步骤2:2-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸
[0860][0861]
向2-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯(300mg,797.08umol,1当量)在h2o(5ml)和meoh(3ml)中的溶液中添加naoh(95.65mg,2.39mmol,3当量)。将混合物在50℃下搅拌16小时。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤,并干燥滤饼,得到化合物2-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(200mg,551.96umol,69.25%收率),为白色固体。
[0862]
步骤3:4-[(1s)-1-[[2-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸甲酯
[0863][0864]
向4-[(1s)-1-氨乙基]苯甲酸甲酯(27.20mg,151.79umol,1.1当量)在dcm(2ml)中的溶液中添加hobt(3.73mg,27.60umol,0.2当量)、et3n(69.82mg,689.95umol,96.03ul,5当量)和edci(52.91mg,275.98umol,2当量)。将混合物在0℃下搅拌0.5小时。然后在0℃下添加2-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(50.00mg,137.99umol,1当量)。将混合物在25℃下搅拌16小时。将反应混合物用h2o 5ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物4-[(1s)-1-[[2-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸甲酯(40mg,76.40umol,55.37%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 524.3[m+h]
+
。
[0865]
步骤4:4-[(1s)-1-[[2-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸
[0866][0867]
向4-[(1s)-1-[[2-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸甲酯(40mg,76.40umol,1当量)在h2o(2ml)和meoh(2ml)中的溶液中添加naoh(9.17mg,229.21umol,3当量)。将混合物在50℃下搅拌16小时。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤,并干燥滤饼,得到化合物4-[(1s)-1-[[2-异丙基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸(35mg,67.52umol,88.38%收率,98.30%纯度),为白色固体。产物的lcms(esi):m/z 510.1[m+h]
+
。1h nmr(400mhz,dmso-d6)δppm 12.89(br s,1h),9.60(d,j=7.6hz,1h),7.90(d,j=8.4hz,2h),7.59-7.56(m,3h),7.51(d,j=7.2hz,2h),7.26(d,j=8.0hz,2h),7.22(d,j=8.0hz,1h),6.74(d,j=6.8hz,1h),5.23(t,j=7.2hz,1h),4.76-4.69(m,1h),4.17(s,2h),1.52(d,j=6.8hz,3h),1.47(d,j=6.8hz,3h),1.42(d,j=7.2hz,3h)。
[0868]
实施例34
–
4-[(1s)-1-[[1-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸(化合物30)的合成
[0869][0870]
步骤1:2-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯
[0871][0872]
将4-溴-2-异丁基-吲唑-3-甲酸甲酯(200.00mg,642.73umol,1当量)、4,4,5,5-四甲基-2-[[4-(三氟甲基)苯基]甲基]-1,3,2-二氧杂环戊硼烷(367.76mg,1.29mmol,2当量)、k3po4(136.43mg,642.73umol,1当量)、pd(dppf)cl2(141.09mg,192.82umol,0.3当量)在二噁烷(1ml)和h2o(0.5ml)中的混合物脱气,并用n2吹扫3次,然后将混合物在n2气氛和80℃下搅拌12小时。在lc-ms上显示有若干新峰,并检测到75%的所需化合物。在减压下浓缩反应混合物以移除二噁烷。将残留物用h2o 30ml稀释,并用ea30ml(10ml
×
3)萃取。将合并的有机层用盐水15ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=3:1)纯化残留物。得到化合物2-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯(170mg,435.45umol,67.75%收率),为白色固体。产物的lcms(esi):m/z 391.3[m+h]
+
。
[0873]
步骤2:2-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸
[0874][0875]
向2-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸甲酯(170.00mg,435.45umol,1当量)在h2o(0.5ml)和meoh(3ml)中的溶液中添加naoh(52.26mg,1.3mmol,3当量)。将混合物在80℃下搅拌3小时。根据tlc,反应是纯净的。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物2-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(100mg,265.69umol,61.02%收率),为白色固体。
[0876]
步骤3:4-[(1s)-1-[[2-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸甲酯
[0877][0878]
在0℃下向2-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-甲酸(30.00mg,79.71umol,1当量)在dcm(2ml)中的溶液中滴加et3n(40.33mg,398.54umol,55.47ul,5当量)、hobt(2.15mg,15.94umol,0.2当量)和edci(30.56mg,159.42umol,2当量)。添加后,将混合物在此温度下搅拌0.5小时,然后在0℃下滴加4-[(1s)-1-氨乙基]苯甲酸甲酯(21.43mg,119.56umol,1.5当量)。将所得混合物在25℃下搅拌12小时。将残留物用h2o 5ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物4-[(1s)-1-[[2-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸甲酯(20mg,37.20umol,46.68%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 538.2[m+h]
+
。
[0879]
步骤4:4-[(1s)-1-[[2-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸
[0880][0881]
向4-[(1s)-1-[[2-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸甲酯(20mg,37.20umol,1当量)在h2o(2ml)和meoh(2ml)中的溶液中添加naoh(1.49mg,37.20umol,1当量)。将混合物在50℃下搅拌12小时。在减压下浓缩反应混合物以移除溶剂。用1n hcl将混合物调节至ph=5。将混合物过滤。得到化合物4-[(1s)-1-[[2-异丁基-4-[[4-(三氟甲基)苯基]甲基]吲唑-3-羰基]氨基]乙基]苯甲酸(8mg,15.28umol,41.07%收率,100%纯度),为白色固体。产物的lcms(esi):m/z 524.1[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=9.41(d,j=8.0hz,1h),7.87(d,j=8.0hz,2h),7.55(t,j=8.0hz,3h),7.40(d,j=7.6hz,2h),7.27-7.20(m,3h),6.85(d,j=6.8hz,1h),5.17-5.09(m,1h),4.32(d,j=15.6hz,1h),4.22(d,j=15.6hz,1h),4.14-4.07(m,2h),2.04-1.97(m,1h),1.34(d,j=7.2hz,3h),0.68-0.66(d,j=6.8hz,3h),0.62-0.60(d,j=6.4hz,3h)。
[0882]
实施例35
–
1-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨
基]苯基]环丙烷甲酸(化合物31)的合成
[0883][0884]
步骤1:1-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]苯基]环丙烷甲酸甲酯
[0885][0886]
向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(30mg,93.67umol,1当量)和1-(4-氨基苯基)环丙烷甲酸甲酯(19.70mg,103.04umol,1.1当量)在dcm(1ml)中的溶液中添加pyaop(53.72mg,103.04umol,1.1当量)和diea(30.27mg,234.18umol,40.79ul,2.5当量)。将混合物在25℃下搅拌5小时。在lc-ms上显示有若干新峰,并检测到75.50%的所需化合物。将反应混合物用h2o 10ml稀释,并用dcm 9ml(3ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物1-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]苯基]环丙烷甲酸甲酯(40mg,81.06umol,86.53%收率),为黄色油状物,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 494.1[m+h]
+
。
[0887]
步骤2:1-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]苯基]环丙烷甲酸
[0888]
[0889]
向1-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]苯基]环丙烷甲酯甲酯(40mg,81.06umol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(9.73mg,243.17umol,3当量)。将混合物在50℃下搅拌16小时。hplc显示剩下0%的s1-031-a。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物1-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]苯基]环丙烷甲酸(30mg,62.57umol,77.19%收率),为白色固体。产物的lcms(esi):m/z 480.0[m+h]
+
。1h nmr(400mhz,dmso-d6)δppm 10.16(s,1h)8.76(d,j=6.8hz,1h)8.42(s,1h)7.59(d,j=8.4hz,2h)7.52(d,j=8.0hz,2h)7.34(br d,j=8.4hz,3h)7.29(d,j=8.4hz,2h)7.10(t,j=6.8hz,1h)4.65(s,2h)1.42-1.47(m,2h)1.10-1.14(m,2h)。
[0890]
实施例36
–
(1s,4s)-4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环己烷甲酸(化合物32)的合成
[0891][0892]
步骤1:4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(2,5-二氧代吡咯烷-1-基)酯
[0893][0894]
向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(100mg,312.24umol,1当量)和1-羟基吡咯烷-2,5-二酮(43.12mg,374.69umol,1.2当量)在thf(1ml)中的溶液中添加dcc(83.75mg,405.91umol,82.11ul,1.3当量)。将混合物在25℃下搅拌16小时。在lc-ms上显示有若干新峰,并检测到50.43%的所需化合物。将反应混合物用h2o 10ml稀释,并用dcm 12ml(4ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(2,5-二氧代吡咯烷-1-基)酯(100mg,239.61umol,76.74%收率),为黄色油状物,其不经进一步纯化直接用于下一步。产物的lcms(esi):m/z 418.2[m+h]
+
。
[0895]
步骤2:(1s,4s)-4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]
氨基]环己烷甲酸
[0896][0897]
向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(2,5-二氧代吡咯烷-1-基)酯(35mg,83.86umol,1当量)和反式-4-氨基环己烷甲酸(60.04mg,419.32umol,5当量)在dmf(1ml)中的溶液中添加et3n(152.75mg,1.51mmol,210.11ul,18当量)。将混合物在60℃下搅拌16小时。在lc-ms上显示有若干新峰,并检测到2.81%的所需化合物。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物(1s,4s)-4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环己烷甲酸(10mg,22.19umol,26.45%收率,98.82%纯度),为白色固体。产物的lcms(esi):m/z 446.0[m+h]
+
。1h nmr(400mhz,dmso-d6)δppm 12.10(br s,1h)8.69(d,j=6.8hz,1h)8.20(s,1h)8.02(d,j=7.6hz,1h)7.56(d,j=8.0hz,2h)7.34-7.29(m,3h)7.04(t,j=6.8hz,1h)4.65(s,2h)3.79-3.73(m,1h)2.51-2.42(m,1h)1.93-1.85(m,2h)1.59-1.45(m,6h)。
[0898]
实施例37
–
(1r,4r)-4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环己烷甲酸(化合物33)的合成
[0899][0900]
步骤1:(1r,4r)-4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环己烷甲酸乙酯
[0901][0902]
在0℃下向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(20mg,62.45umol,1当量)在dcm(1ml)中的溶液中添加edci(23.94mg,124.90umol,2当量)、hobt(1.69mg,12.49umol,0.2当量)和et3n(31.60mg,312.24umol,43.46ul,5当量)。添加后,将混合物在此温度下搅拌30分钟,然后在0℃下添加反式-4-氨基环己烷甲酸乙酯;盐酸盐(19.46mg,93.67umol,1.5当量)。将所得混合物在25℃下搅拌12小时。将残留物用h2o 10ml稀释,并用dcm15ml(5ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc纯化粗产物,得到化合物(1r,4r)-4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环己烷甲酸乙酯(15mg,31.68umol,50.73%收率),为棕色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 460.2[m+h]
+
。
[0903]
步骤2:(1r,4r)-4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环己烷甲酸
[0904][0905]
向(1r,4r)-4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环己烷甲酸乙酯(15mg,31.68umol,1当量)在h2o(1ml)中的溶液中添加hcl(12m,13.20ul,5当量)。将混合物在80℃下搅拌12小时。过滤所得产物以收集不溶物。通过制备型hplc(hcl条件)纯化残留物。得到化合物(1r,4r)-4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环己烷甲酸(10mg,22.02umol,69.52%收率,98.1%纯度),为白色固体。产物的lcms(esi):m/z 446.0[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=12.06(br s,1h),8.67(d,j=7.2hz,1h),8.16(s,1h),8.01(d,j=8.0hz,1h),7.56(d,j=8.0hz,2h),7.29(d,j=8.0hz,3h),7.02(t,j=7.2hz,1h),4.64(s,2h),3.65-3.53(m,1h),2.17-2.06(m,1h),1.90(d,j=11.6hz,2h),1.82-1.72(m,2h),1.45-1.31(m,2h),1.26-1.11(m,2h)。
[0906]
实施例38
–
2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环己基]乙酸(化合物34)的合成
[0907][0908]
步骤1:2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环己基]乙酸甲酯
[0909][0910]
在0℃下向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(20mg,62.45umol,1当量)在dcm(1ml)中的溶液中滴加edci(23.94mg,124.90umol,2当量)、hobt(1.69mg,12.49umol,0.2当量)和et3n(31.60mg,312.25umol,43.46ul,5当量)。添加后,将混合物在此温度下搅拌0.5小时,然后在0℃下添加2-(4-氨基环己基)乙酸甲酯(16.04mg,93.68umol,1.5当量)。将所得混合物在25℃下搅拌12小时。将残留物用h2o 10ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环己基]乙酸甲酯(17mg,35.90umol,57.49%收率),为白色固体。其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 474.2[m+h]
+
。
[0911]
步骤2:2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环己基]乙酸
[0912][0913]
向2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环己基]乙酸甲酯(17mg,35.90umol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh
(2.88mg,71umol,2当量)。将混合物在50℃下搅拌12小时。在减压下浓缩反应混合物以移除溶剂。通过制备型hplc(hcl条件)纯化残留物。得到化合物2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环己基]乙酸(3mg,6.41umol,17.84%收率,98.1%纯度),为白色固体。产物的lcms(esi):m/z 460.0[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=12.03(br s,1h),8.63(t,j=6.8hz,1h),8.17(d,j=6.8hz,1h),8.04-7.85(m,1h),7.55(t,j=8.0hz,2h),7.33-7.25(m,3h),7.04-7.02(m,1h),4.67-4.61(m,2h),3.87-3.85(m,0.5h),3.86-3.55(m,0.5h),2.16-2.09(m,2h),1.85-1.67(m,3h),1.61-1.42(m,2h),1.40-1.30(m,1h),1.25-0.99(m,3h)。
[0914]
实施例39
–
2-(4-(4-(4-(三氟甲基)苄基)吡唑并[1,5-a]吡啶-3-甲酰胺基)双环[2.2.2]辛烷-1-基)乙酸(化合物35)的合成
[0915][0916]
步骤1:2-(4-(4-(4-(三氟甲基)苄基)吡唑并[1,5-a]吡啶-3-甲酰胺基)双环[2.2.2]辛烷-1-基)乙酸甲酯
[0917][0918]
在25℃下向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(90mg,281.02umol,1当量)和2-(4-氨基双环[2.2.2]辛烷-1-基)乙酸氰酸酐(83.1mg,421.53umol,1.5当量)在dcm(8ml)中的溶液中添加hoat(7.65mg,56.20umol,7.86ul,0.2当量)、et3n(142.18mg,1.41mmol,195.57ul,5当量)和edci(109.06mg,702.54umol,2.5当量),并在25℃下搅拌16小时。lcms显示所有羧酸完全消耗,并且检测到所需产物。移除溶剂,得到粗产物。通过制备型tlc纯化粗产物。得到化合物n-[1-(氰甲基)-4-双环[2.2.2]辛烷基]-4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酰胺(80mg,57%收率),为白色固体。hplc显示产物是纯净的。产物的lcms(esi):m/z 467.3[m+h]
+
。
[0919]
步骤2:2-(4-(4-(4-(三氟甲基)苄基)吡唑并[1,5-a]吡啶-3-甲酰胺基)双环[2.2.2]辛烷-1-基)乙酸
[0920][0921]
向n-[1-(氰甲基)-4-双环[2.2.2]辛烷基]-4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酰胺(35mg,75.03umol,1当量)在h2o(0.5ml)中的溶液中添加hcl(12m,6.25ul,1当量)。将混合物在90℃下搅拌24小时。浓缩反应混合物以移除溶剂。通过制备型hplc(hcl条件)纯化残留物。得到2-(4-(4-(4-(三氟甲基)苄基)吡唑并[1,5-a]吡啶-3-甲酰胺基)双环[2.2.2]辛烷-1-基)乙酸(10mg,26%收率,97%纯度),为白色固体。产物的lcms(esi):m/z 486.1[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=11.95(s,1h),8.65(d,j=7.2hz,1h),8.14(s,1h),7.58-7.55(m,3h),7.33-7.26(m,3h),7.00(t,j=7.2hz,1h),4.61(s,2h),1.99(s,2h),1.85
–
1.81(m,6h),1.57-1.52(m,6h)。
[0922]
实施例40
–
4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]双环[2.2.2]辛烷-1-甲酸(化合物36)的合成
[0923][0924]
步骤1:4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]双环[2.2.2]辛烷-1-甲酸甲酯
[0925][0926]
在0℃下向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(20mg,62.45umol,1当量)在dcm(1ml)中的溶液中添加edci(23.94mg,124.90umol,2当量)、hobt(1.69mg,12.49umol,0.2当量)和et3n(31.60mg,312.25umol,43.46ul,5当量)。添加后,将
混合物在此温度下搅拌0.5小时,然后在0℃下添加4-氨基双环[2.2.2]辛烷-1-甲酸甲酯(17.17mg,93.68umol,1.5当量)。将所得混合物在25℃下搅拌12小时。lc-ms显示羧酸完全消耗,并检测到一个具有所需质量的主峰。将残留物用h2o 10ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]双环[2.2.2]辛烷-1-甲酸甲酯(15mg,30.90umol,49.47%收率),为白色固体,其不经进一步纯化即直接用于下一步。产物的lcms(esi):m/z 486.4[m+h]
+
。
[0927]
步骤2:4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]双环[2.2.2]辛烷-1-甲酸
[0928][0929]
向4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]双环[2.2.2]辛烷-1-甲酸甲酯(15mg,30.90umol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(1.24mg,30.90umol,1当量)。将混合物在50℃下搅拌12小时。在减压下浓缩反应混合物以移除溶剂。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]双环[2.2.2]辛烷-1-甲酸(6mg,12.57umol,40.70%收率,98.8%纯度),为白色固体。产物的lcms(esi):m/z 472.0[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=8.65(d,j=6.8hz,1h),8.15(s,1h),7.63(s,1h),7.58(d,j=8.0hz,2h),7.33(d,j=8.0hz,2h),7.27(d,j=7.2hz,1h),7.00(t,j=6.8hz,1h),4.61(s,2h),1.90-1.82(m,6h),1.78-1.71(m,6h)。
[0930]
实施例41
–
2-[3-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环戊基]乙酸(化合物37)的合成
[0931][0932]
步骤1:(2e)-2-[3-(叔丁氧羰基氨基)亚环戊基]乙酸乙酯
[0933][0934]
在0℃下经10分钟向2-二乙氧基磷酰基乙酸乙酯(1g,4.46mmol,884.96ul,1.5当量)在thf(8ml)中的溶液中滴加nah(178.40mg,4.46mmol,60%纯度,1.5当量)。添加后,将混合物在25℃下搅拌1小时,然后在0℃下滴加n-(3-氧代环戊基)氨基甲酸叔丁酯(592.49mg,2.97mmol,1当量)。将所得混合物在25℃下搅拌1小时。lc-ms显示酮完全消耗,并检测到一个具有所需质量的主峰。通过在0℃下添加水10ml淬灭反应混合物,然后用水10ml稀释,并用ea 20(20ml
×
2)萃取。将合并的有机层用盐水50ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=7:1)纯化残留物。得到化合物(2e)-2-[3-(叔丁氧羰基氨基)亚环戊基]乙酸乙酯(760mg,2.82mmol,94.89%收率),为无色油状物。
[0935]
步骤2:2-[3-(叔丁氧羰基氨基)环戊基]乙酸乙酯
[0936][0937]
在n2气氛下向(2e)-2-[3-(叔丁氧羰基氨基)亚环戊基]乙酸乙酯(300mg,1.11mmol,1当量)在meoh(2ml)中的溶液中添加pd/c(10%,300mg)。将悬浮液脱气,并用h2吹扫5次。将混合物在h2(15psi)和25℃下搅拌2小时。tlc指示没有剩下双键化合物,并检测到一个具有较大极性的主要新斑点。将所得混合物通过硅藻土过滤,然后在减压下浓缩以移除meoh。粗产物不经纯化用于下一步。得到化合物2-[3-(叔丁氧羰基氨基)环戊基]乙酸乙酯(280mg,1.03mmol,92.64%收率),为无色油状物。
[0938]
步骤3:2-(3-氨基环戊基)乙酸乙酯
[0939][0940]
向2-[3-(叔丁氧羰基氨基)环戊基]乙酸乙酯(150mg,552.79umol,1当量)在thf(1.5ml)中的溶液中添加tfa(1.54g,13.51mmol,1ml,24.43当量)。将混合物在25℃下搅拌2
446.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=12.02(br s,1h),8.69(d,j=6.4hz,1h),8.28-8.06(m,2h),7.64-7.48(m,2h),7.39-7.26(m,3h),7.04(t,j=6.8hz,1h),4.66(s,2h),4.33-4.05(m,2h),2.30-2.21(m,2h),2.21-2.10(m,1h),2.01-1.63(m,2h),1.57-1.38(m,1h),1.35-1.22(m,1h),1.21-1.01(m,1h)。
[0947]
实施例42
–
2-((1r,4r)-4-(4-(4-(三氟甲基)苄基)吡唑并[1,5-a]吡啶-3-甲酰胺基)环己基)乙酸(化合物38)的合成
[0948][0949]
步骤1:2-((1r,4r)-4-(4-(4-(三氟甲基)苄基)吡唑并[1,5-a]吡啶-3-甲酰胺基)环己基)乙酸乙酯
[0950][0951]
在0℃下向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(20mg,62.45umol,1当量)在dcm(1ml)中的溶液中滴加edci(23.94mg,124.90umol,2当量)、hobt(1.69mg,12.49umol,0.2当量)和et3n(31.60mg,312.25umol,43.46ul,5当量)。添加后,将混合物在此温度下搅拌0.5小时,然后在0℃下添加反式2-(4-氨基环己基)乙酸乙酯(17.35mg,93.68umol,1.5当量)。将所得混合物在25℃下搅拌12小时。将残留物用h2o 10ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水10ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物2-((1r,4r)-4-(4-(4-(三氟甲基)苄基)吡唑并[1,5-a]吡啶-3-甲酰胺基)环己基)乙酸乙酯(20mg,41.02umol,65.69%收率),为白色固体。产物的lcms(esi):m/z 488.3[m+h]
+
。
[0952]
步骤2:2-((1r,4r)-4-(4-(4-(三氟甲基)苄基)吡唑并[1,5-a]吡啶-3-甲酰胺基)环己基)乙酸
[0953][0954]
向2-((1r,4r)-4-(4-(4-(三氟甲基)苄基)吡唑并[1,5-a]吡啶-3-甲酰胺基)环己基)乙酸乙酯(20mg,41.02umol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(1.64mg,41.02umol,1当量)。将混合物在50℃下搅拌12小时。在减压下浓缩反应混合物以移除溶剂。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物2-((1r,4r)-4-(4-(4-(三氟甲基)苄基)吡唑并[1,5-a]吡啶-3-甲酰胺基)环己基)乙酸(15mg,31.83umol,77.59%收率,97.5%纯度),为白色固体。产物的lcms(esi):m/z 460.0[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=8.67(d,j=6.8hz,1h),8.17(s,1h),7.98(d,j=8.0hz,1h),7.56(d,j=8.0hz,2h),7.30(d,j=8.4hz,3h),7.02(t,j=6.8hz,1h),4.64(s,2h),3.65-3.54(m,1h),2.11(d,j=7.2hz,2h),1.73(d,j=10.0hz,4h),1.64-1.52(m,1h),1.20-1.14(m,2h),1.08-1.02(m,2h)。
[0955]
实施例43
–
(1r,3s)-3-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环戊烷甲酸(化合物39)的合成
[0956][0957]
步骤1:(1r,3s)-3-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环戊烷甲酸
[0958][0959]
向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(2,5-二氧代吡咯烷-1-基)酯(50mg,119.81umol,1当量)和(1r,3s)-3-氨基环戊烷甲酸(77.37mg,
599.04umol,5当量)在dmf(2ml)中的溶液中添加et3n(218.22mg,2.16mmol,300.16ul,18当量)。将混合物在60℃下搅拌12小时。在lc-ms上显示有若干新峰,并检测到64%的所需化合物。在减压下浓缩反应混合物以移除dmf。将残留物用h2o 10ml稀释,并用ea 15ml(5ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型hplc(hcl条件)纯化残留物。得到化合物(1r,3s)-3-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]环戊烷甲酸(2.5mg,5.67umol,4.73%收率,97.8%纯度),为白色固体。产物的lcms(esi):m/z 432.0[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=12.12(br s,1h),8.67(d,j=6.8hz,1h),8.20-8.15(m,2h),7.56(d,j=8.0hz,2h),7.32(d,j=7.2hz,3h),7.03(t,j=7.2hz,1h),4.65(s,2h),4.21-4.13(m,1h),2.78-2.69(m,1h),2.17-2.14(m,1h),1.89-1.79(m,3h),1.67-1.63(m,1h),1.51-1.43(m,1h)。
[0960]
实施例44
–
(1r,4r)-4-[[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]甲基]环己烷甲酸(化合物40)的合成
[0961][0962]
步骤1:(1r,4r)-4-[[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]甲基]环己烷甲酸甲酯
[0963][0964]
在0℃下向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(20mg,62.45umol,1当量)在dcm(1ml)中的溶液中添加edci(23.94mg,124.90umol,2当量)、hobt(1.69mg,12.49umol,0.2当量)和et3n(31.60mg,312.25umol,43.46ul,5当量)。添加后,将混合物在此温度下搅拌0.5小时,然后在0℃下添加反式-4-(氨甲基)环己烷甲酸甲酯(16.04mg,93.68umol,1.5当量)。将所得混合物在25℃下搅拌12小时。将残留物用h2o 10ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物(1r,4r)-4-[[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]甲基]环己烷甲酸甲酯(20mg,42.24umol,67.64%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 474.3[m+h]
+
。
[0965]
步骤2:(1r,4r)-4-[[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰
基]氨基]甲基]环己烷甲酸
[0966][0967]
向(1r,4r)-4-[[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]甲基]环己烷甲酸甲酯(20mg,42.24umol,1当量)在h2o(1ml)中的溶液中添加hcl(12m,3.52ul,1当量)。将混合物在80℃下搅拌12小时。过滤所得产物以收集不溶物。通过制备型hplc(hcl条件)纯化残留物。得到化合物(1r,4r)-4-[[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]甲基]环己烷甲酸(15mg,32.39umol,76.67%收率,99.2%纯度),为白色固体。产物的lcms(esi):m/z 460.0[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=11.97(s,1h),8.68(d,j=6.8hz,1h),8.23(s,1h),8.17(t,j=5.6hz,1h),7.55(d,j=8.0hz,2h),7.29(d,j=8.8hz,3h),7.02(t,j=6.8hz,1h),4.68(s,2h),3.04(t,j=6.4hz,2h),2.15-2.06(m,1h),1.86(d,j=10.4hz,2h),1.70(d,j=10.4hz,2h),1.46-1.41(m,1h),1.24-1.20(m,2h),0.92-0.89(m,2h)。
[0968]
实施例45
–
反式-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(化合物41)的合成
[0969][0970]
步骤1:反式-(s)-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯
[0971]
[0972]
在0℃下向1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸(50mg,143.96umol,1当量)在dcm(2ml)中的溶液中添加hobt(3.89mg,28.79umol,0.2当量)、edci(55.19mg,287.91umol,2当量)和et3n(72.83mg,719.78umol,100.18ul,5当量)。将混合物在0℃下搅拌0.5小时。然后将反式-(s)-2-氨基螺[3.3]庚烷-6-甲酸1-苯基乙酯(37.33mg,143.96umol,1当量)添加到混合物中。将混合物在25℃下搅拌16小时。将反应混合物用h2o 3ml稀释,并用dcm 9ml(3ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物反式-(s)-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(30mg,50.96umol,35.40%收率),为白色固体。其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 589.4[m+h]
+
。
[0973]
步骤2:反式-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]螺[3.3]庚烷-6-甲酸
[0974][0975]
向反式-(s)-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(30mg,50.96umol,1当量)在dcm(1.5ml)中的溶液中添加tfa(5.81mg,50.96umol,3.77ul,1当量)。将混合物在25℃下搅拌16小时。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物反式-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(6mg,12.14umol,23.82%收率,98.02%纯度),为白色固体。产物的lcms(esi):m/z 485.1[m+h]
+
。1h nmr(400mhz,dmso-d6)δppm 12.05(br s,1h)8.13(d,j=7.6hz,1h)7.71(s,1h)7.52(d,j=8.4hz,2h)7.42(d,j=8.4hz,1h)7.28(d,j=8.00hz,2h)7.19(t,j=7.6hz,1h)7.03(d,j=7.2hz,1h)4.62(s,2h)4.25-4.18(m,3h)2.95(t,j=8.4hz,1h)2.44-2.29(m,2h)2.25-2.22(m,2h)2.15-2.05(m,2h)1.96-1.85(m,2h)1.38(t,j=7.13hz,3h)。
[0976]
实施例46
–
4-[(1s)-1-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]乙基]苯甲酸(化合物42)的合成
[0977][0978]
步骤1:4-溴-1h-吲哚-3-甲酸甲酯
[0979][0980]
向4-溴-1h-吲哚-3-甲酸(5g,20.83mmol,1当量)和dmf(304.49mg,4.17mmol,320.52ul,0.2当量)在dcm(60ml)中的溶液中添加(cocl)2(2.91g,22.91mmol,2.01ml,1.1当量)。将混合物在25℃下搅拌2h,然后在0℃下向反应中添加tea(6.32g,62.49mmol,8.70ml,3当量)和meoh(6.67g,208.29mmol,8.43ml,10当量),在25℃下搅拌反应2h。lc-ms显示剩下0%的羧酸。在lc-ms上显示有若干新峰,并检测到96.89%的所需化合物。将反应混合物用h2o 20ml稀释,并分离有机层。将水层用ea 90ml(30ml
×
3)萃取。将合并的有机层合并,用盐水(20ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物4-溴-1h-吲哚-3-甲酸甲酯(5.1g,20.07mmol,96.37%收率),为黄色油状物。
[0981]
步骤2:4-溴-1-乙基-吲哚-3-甲酸甲酯
[0982][0983]
向4-溴-1h-吲哚-3-甲酸甲酯(1g,3.94mmol,1当量)和碘乙烷(3.07g,19.68mmol,1.57ml,5当量)在dmf(2ml)中的溶液中添加k2co3(1.09g,7.87mmol,2当量)。将混合物在25℃下搅拌5小时。tlc指示起始物完全消耗,并产生一个新斑点。将反应混合物用h2o 10ml稀释,并用mtbe 30ml(10ml
×
3)萃取。将合并的有机层用盐水(10ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过柱色谱法(sio2,石油醚/乙酸乙酯=50/1至0/1)纯化残留物。得到化合物4-溴-1-乙基-吲哚-3-甲酸甲酯(1g,3.54mmol,90.06%收率),为黄色油状物,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 281.9[m+h]
+
。
[0984]
步骤3:1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸甲酯
[0985][0986]
向4,4,5,5-四甲基-2-[[4-(三氟甲基)苯基]甲基]-1,3,2-二氧杂环戊硼烷(454.89mg,1.59mmol,1.5当量)和4-溴-1-乙基-吲哚-3-甲酸甲酯(300mg,1.06mmol,1当量)在甲苯(4ml)中的溶液中添加cs2co3(690.74mg,2.12mmol,2当量)和二叔丁基(环戊基)磷烷;二氯钯;铁(69.09mg,106.00umol,0.1当量)。将混合物在80℃下搅拌16小时。lc-ms显示剩下0%的溴化物。在lc-ms上显示有若干新峰,并检测到41.65%的所需化合物。将反应混合物用h2o 5ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水(10ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=2:1)纯化残留物。得到化合物1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸甲酯(150mg,415.10umol,39.16%收率),为白色固体。产物的lcms(esi):m/z 362.3[m+h]
+
。
[0987]
步骤4:化合物1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸
[0988][0989]
向1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸甲酯(150mg,415.10umol,1当量)在meoh(2ml)和h2o(1ml)中的溶液中添加naoh(16.60mg,415.10umol,1当量)。将混合物在50℃下搅拌16小时。hplc显示剩下0%的甲酯。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸(130mg,374.28umol,90.17%收率),为白色固体。产物的lcms(esi):m/z 348.1[m+h]
+
。
[0990]
步骤5:4-[(1s)-1-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]乙基]苯甲酸甲酯
[0991][0992]
向1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸(70mg,201.54umol,1当量)在dcm(1ml)中的溶液中添加hobt(5.45mg,40.31umol,0.2当量)、et3n(101.97mg,1.01mmol,140.26ul,5当量)和edci(77.27mg,403.07umol,2当量)。将混合物在0℃下搅拌
0.5小时。然后将4-[(1s)-1-氨乙基]苯甲酸甲酯(36.12mg,201.54umol,1当量)添加到混合物中。将混合物在25℃下搅拌16小时。lc-ms显示剩下0%的羧酸。在lc-ms上显示有若干新峰,并检测到44.39%的所需化合物。将反应混合物用h2o 5ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物4-[(1s)-1-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]乙基]苯甲酸甲酯(40mg,78.66umol,39.03%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 509.3[m+h]
+
。
[0993]
步骤6:4-[(1s)-1-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]乙基]苯甲酸
[0994][0995]
向4-[(1s)-1-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]乙基]苯甲酸甲酯(40mg,78.66umol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(9.44mg,235.97umol,3当量)。将混合物在50℃下搅拌16小时。hplc显示剩下0%的甲酯。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物4-[(1s)-1-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]乙基]苯甲酸(30mg,60.31umol,76.68%收率,99.42%纯度),为白色固体。产物的lcms(esi):m/z 495.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δppm 12.84(br s,1h)8.51(d,j=8.0hz,1h)7.92(d,j=8.0hz,2h)7.93(s,1h)7.53(d,j=8.0hz,2h)7.44(d,j=8.4hz,1h)7.33(d,j=8.0hz,2h)7.16-7.22(m,3h)7.04(d,j=7.2hz,1h)5.19(t,j=7.6hz,1h)4.69(d,j=14.4hz,1h)4.50(d,j=14.4hz,1h)4.25(q,j=7.2hz,2h)1.43-1.38(m,6h)。
[0996]
实施例47
–
4-[(1s)-1-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]乙基]苯甲酸(化合物43)的合成
[0997][0998]
步骤1:4-溴-1-(2-氟乙基)吲哚-3-甲酸甲酯
[0999][1000]
向4-溴-1h-吲哚-3-甲酸甲酯(1g,3.94mmol,1当量)和1-溴-2-氟-乙烷(2.50g,19.68mmol,5当量)在dmf(2ml)中的溶液中添加k2co3(1.09g,7.87mmol,2当量)。将混合物在25℃下搅拌5小时。tlc指示起始物完全消耗。将反应混合物用h2o 20ml稀释,并用ea 30ml(10ml
×
3)萃取。将合并的有机层用盐水(15ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过柱色谱法(sio2,石油醚/乙酸乙酯=50/1至0/1)纯化残留物。得到化合物4-溴-1-(2-氟乙基)吲哚-3-甲酸甲酯(1.05g,3.33mmol,84.66%收率),为黄色油状物,其不经进一步纯化直接进入下一步使用。
[1001]
步骤2:1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸甲酯
[1002][1003]
向4,4,5,5-四甲基-2-[[4-(三氟甲基)苯基]甲基]-1,3,2-二氧杂环戊硼烷(428.97mg,1.50mmol,1.5当量)和4-溴-1-(2-氟乙基)吲哚-3-甲酸甲酯(300mg,999.59umol,1当量)在甲苯(2ml)中的溶液中添加cs2co3(651.37mg,2.00mmol,2当量)和二叔丁基(环戊基)磷烷;二氯钯;铁(65.15mg,99.96umol,0.1当量)。将混合物在80℃下搅拌16小时。lc-ms显示剩下0%的溴化物。在lc-ms上显示有若干新峰,并检测到45.96%的所需化合物。将反应混合物用h2o 5ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=2:1)纯化残留物。得到化合物1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸甲酯(160mg,421.78umol,42.19%收率),为黄色油状物。产物的lcms(esi):m/z 380.1[m+h]
+
。
[1004]
步骤3:1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸
[1005]
向1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸甲酯(160mg,421.78umol,1当量)在meoh(2ml)和h2o(1ml)中的溶液中添加naoh(16.87mg,421.78umol,1当量)。将混合物在50℃下搅拌16小时。hplc显示剩下0%的甲酯。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物1-乙基-4-[[4-(三
氟甲基)苯基]甲基]吲哚-3-甲酸(130mg,374.28umol,90.17%收率),为白色固体。
[1006]
步骤4:4-[(1s)-1-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]乙基]苯甲酸甲酯
[1007][1008]
向4-[(1s)-1-氨乙基]苯甲酸甲酯(24.53mg,136.87umol,1当量)在dcm(2ml)中的溶液中添加hobt(3.70mg,27.37umol,0.2当量)、et3n(69.25mg,684.33umol,95.25ul,5当量)和edci(52.47mg,273.73umol,2当量)。将混合物在0℃下搅拌0.5小时。然后向混合物中添加1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸(50mg,136.87umol,1当量)。将混合物在25℃下搅拌16小时。hplc显示剩下0%的羧酸。将反应混合物用h2o 5ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物4-[(1s)-1-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]乙基]苯甲酸甲酯(25mg,47.48umol,34.69%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 527.3[m+h]
+
。
[1009]
步骤5:4-[(1s)-1-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]乙基]苯甲酸
[1010][1011]
向4-[(1s)-1-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]乙基]苯甲酸甲酯(25mg,47.48umol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(5.70mg,142.44umol,3当量)。将混合物在50℃下搅拌16小时。hplc显示剩下0%的甲酯。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物4-[(1s)-1-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]乙基]苯甲酸c
28h24
n2o3f4(5mg,9.76umol,20.55%收率,100%纯度),为白色固体。产物的lcms(esi):m/z 513.0[m+h]
+
。1h nmr(400mhz,dmso-d6)δppm 8.57(d,j=8.0hz,1h)7.90(d,j=8.4hz,2h)7.82(s,1h)7.53-7.46(m,3h)7.34(d,j=8.0hz,2h)7.17-7.23(m,3h)7.06(d,j=7.2hz,1h)5.19(t,j=7.2hz,1h)4.83(t,j=4.4hz,1h)4.73-4.64(m,2h)4.59(t,j=4.4hz,1h)4.54-4.48(m,2h)1.41(d,j=7.2hz,3h)。
[1012]
实施例48
–
反式-2-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]-吲哚-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(化合物44)的合成
[1013][1014]
步骤1:反式-(s)-2-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯
[1015][1016]
向1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸(75mg,205.30umol,1当量)在dcm(1ml)中的溶液中添加hobt(5.55mg,41.06umol,0.2当量)、et3n(103.87mg,1.03mmol,142.88ul,5当量)和edci(78.71mg,410.60umol,2当量)。将混合物在0℃下搅拌0.5小时。然后将反式-(s)-2-氨基螺[3.3]庚烷-6-甲酸1-苯基乙酯(53.24mg,205.30umol,1当量)添加到混合物中。将混合物在25℃下搅拌16小时。hplc显示剩下0%的羧酸。将反应混合物用h2o 5ml稀释,并用dcm(5ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物反式-(s)-2-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(63mg,103.85umol,50.58%收率),为白色固体。其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 607.4[m+h]
+
。
[1017]
步骤2:反式-2-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]螺[3.3]庚烷-6-甲酸
[1018][1019]
向反式-(s)-2-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨
基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(63mg,103.85umol,1当量)在dcm(2ml)中的溶液中添加tfa(11.84mg,103.85umol,7.69ul,1当量)。将混合物在25℃下搅拌16小时。hplc显示剩下0%的酯。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物反式-2-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(45mg,85.03umol,81.88%收率,94.95%纯度),为白色固体。产物的lcms(esi):m/z 504.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δppm 8.17(d,j=8.0hz,1h)7.69(s,1h)7.51(d,j=8.0hz,2h)7.45(d,j=8.0hz,1h)7.27(d,j=8.0hz,2h)7.19(t,j=8.0hz,1h)7.04(d,j=7.2hz,1h)4.80(t,j=4.4hz,1h)4.68(t,j=4.4hz,1h)4.61(s,2h)4.55(t,j=4.4hz,1h)4.48(t,j=4.4hz,1h)4.24-4.18(m,1h)2.93(d,j=8.4hz,1h)2.42-2.34(m,2h)2.25-2.20(m,2h)2.13-2.04(m,2h)1.95-1.83(m,2h)。
[1020]
实施例49
–
反式-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]-吡咯并[2,3-b]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(化合物45)的合成
[1021][1022]
步骤1:反式-(s)-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]-吡咯并[2,3-b]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯
[1023]
在0℃下向1-乙基-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-甲酸(60mg,172.26umol,1当量)在dcm(1ml)中的溶液中添加et3n(87.15mg,861.28umol,119.88ul,5当量)、hobt(4.66mg,34.45umol,0.2当量)和edci(66.04mg,344.51umol,2当量)。添加后,将混合物在此温度下搅拌0.5小时,然后在0℃下添加反式-(s)-2-氨基螺[3.3]庚烷-6-甲酸1-苯基乙酯(67.01mg,258.38umol,1.5当量)。将所得混合物在25℃下搅拌12小时。lcms显示羧酸完全消耗。将残留物用h2o 3ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产
物不经进一步纯化即进入下一步使用。得到化合物反式-(s)-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(80mg,粗),为白色固体。其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 590.3[m+h]
+
。
[1024]
步骤2:反式-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸
[1025][1026]
向反式-(s)-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(80mg,135.68umol,1当量)在dcm(1ml)和tfa(1ml)中的溶液中。将混合物在25℃下搅拌1小时。在减压下浓缩反应混合物以移除溶剂。向混合物中添加1m naoh。然后用1n hcl调节至ph 4。将混合物过滤。得到化合物反式-2-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(59mg,121.2umol,89.6%收率,97%纯度),为白色固体。产物的lcms(esi):m/z 486.1[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=12.01(br s,1h),8.29-8.23(m,2h),8.02(s,1h),7.56-7.51(m,2h),7.40-7.27(m,2h),7.07(s,1h),4.68(s,2h),4.34-4.15(m,3h),2.96-2.82(m,1h),2.35-2.19(m,4h),2.16-2.05(m,2h),2.00-1.86(m,2h),1.45-1.32(m,3h)。
[1027]
实施例50
–
4-[(1s)-1-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]-吡咯并[2,3-b]吡啶-3-羰基]氨基]乙基]苯甲酸(化合物46)的合成
[1028][1029]
步骤1:4-溴-1-乙基-吡咯并[2,3-b]吡啶-3-甲酸甲酯
[1030][1031]
向4-溴-1h-吡咯并[2,3-b]吡啶-3-甲酸甲酯(1g,3.92mmol,1当量)在dmf(10ml)中的溶液中添加k2co3(1.08g,7.84mmol,2当量)和碘乙烷(3.06g,19.60mmol,1.57ml,5当量)。将混合物在25℃下搅拌2小时。lc-ms显示没有剩下起始物。在lc-ms上显示有若干新峰,并检测到80%的所需化合物。在减压下浓缩反应混合物以移除二噁烷。将残留物用h2o 5ml稀释,并用ea 30ml(10ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过柱色谱法(sio2,石油醚/乙酸乙酯=10/1至0/1)纯化残留物。得到化合物4-溴-1-乙基-吡咯并[2,3-b]吡啶-3-甲酸甲酯(850mg,3.00mmol,76.58%收率),为黄色油状物。hplc显示产物是纯净的。产物的lcms(esi):m/z 282.9[m+h]
+
。
[1032]
步骤2:1-乙基-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-甲酸甲酯
[1033][1034]
向4-溴-1-乙基-吡咯并[2,3-b]吡啶-3-甲酸甲酯(300mg,1.06mmol,1当量)和4,4,5,5-四甲基-2-[[4-(三氟甲基)苯基]甲基]-1,3,2-二氧杂环戊硼烷(454.73mg,1.59mmol,1.5当量)在甲苯(1ml)中的溶液中添加二叔丁基(环戊基)磷烷;二氯钯;铁(69.06mg,105.96umol,0.1当量)和cs2co3(690.49mg,2.12mmol,2当量)。将混合物在80℃下搅拌12小时。lc-ms显示剩下0%的溴化物。在lc-ms上显示有若干新峰,并检测到24%的所需化合物。在减压下浓缩反应混合物以移除甲苯。将残留物用h2o 5ml稀释,并用ea 15ml(5ml
×
3)萃取。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物1-乙基-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-甲酸甲酯(180mg,496.76umol,46.88%收率),为白色固体。产物的lcms(esi):m/z 363.1[m+h]
+
。
[1035]
步骤3:1-乙基-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-甲酸
[1036][1037]
向1-乙基-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-甲酸甲酯
(180mg,496.76umol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(19.87mg,496.76umol,1当量)。将混合物在80℃下搅拌2小时。hplc显示甲酯完全消耗。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物1-乙基-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-甲酸(120mg,344.51umol,69.35%收率),为白色固体。
[1038]
步骤4:4-[(1s)-1-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]乙基]苯甲酸甲酯
[1039][1040]
在0℃下向1-乙基-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-甲酸(60mg,172.26umol,1当量)在dcm(1ml)中的溶液中滴加et3n(87.15mg,861.28umol,119.88ul,5当量)、hobt(4.66mg,34.45umol,0.2当量)和edci(66.04mg,344.51umol,2当量)。添加后,将混合物在此温度下搅拌0.5小时,然后在0℃下滴加4-[(1s)-1-氨乙基]苯甲酸甲酯(46.31mg,258.38umol,1.5当量)。将所得混合物在25℃下搅拌12小时。lcms显示羧酸完全消耗。将残留物用h2o 3ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水(3ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物4-[(1s)-1-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]乙基]苯甲酸甲酯(60mg,粗),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 510.3[m+h]
+
。
[1041]
步骤5:4-[(1s)-1-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]乙基]苯甲酸
[1042][1043]
向4-[(1s)-1-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]乙基]苯甲酸甲酯(60mg,117.76umol,1当量)在h2o(5ml)和meoh(5ml)中的溶液中添加naoh(14.13mg,353.27umol,3当量)。将混合物在80℃下搅拌2小时。hplc显示甲酯完全消耗。在减压下浓缩反应混合物以移除溶剂。用1n hcl将混合物调节至ph=5。将混合物过滤。得到化合物4-[(1s)-1-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]乙基]苯甲酸(55mg,111.11umol,94.6%收率,100%纯度),为白色固体。产物的lcms(esi):m/z 496.0[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=8.63(d,j=8.0hz,1h),8.26-8.22(m,1h),8.11(s,1h),7.91(d,j=8.0hz,2h),7.51(d,j=8.0hz,2h),7.38(d,j=
8.4hz,2h),7.24(d,j=8.4hz,2h),7.10(d,j=4.8hz,1h),5.25-5.16(m,1h),4.75(d,j=13.6hz,1h),4.54(d,j=13.6hz,1h),4.36-4.28(m,2h),1.47-1.38(m,6h)。
[1044]
实施例51
–
4-[(1s)-1-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]乙基]苯甲酸(化合物47)的合成
[1045][1046]
步骤1:4-[(1s)-1-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]乙基]苯甲酸甲酯
[1047][1048]
在0℃下向1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-甲酸(60mg,163.80umol,1当量)在dcm(1ml)中的溶液中滴加et3n(82.87mg,818.98umol,113.99ul,5当量)、hobt(4.43mg,32.76umol,0.2当量)和edci(62.80mg,327.59umol,2当量)。添加后,将混合物在此温度下搅拌0.5小时,然后在0℃下添加4-[(1s)-1-氨乙基]苯甲酸甲酯(44.03mg,245.69umol,1.5当量)。将所得混合物在25℃下搅拌12小时。lcms显示羧酸完全消耗。将残留物用h2o 5ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物4-[(1s)-1-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]乙基]苯甲酸甲酯(60mg,粗),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z 528.3[m+h]
+
。
[1049]
步骤2:4-[(1s)-1-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]乙基]苯甲酸
[1050][1051]
向4-[(1s)-1-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]乙基]苯甲酸甲酯(60mg,113.74umol,1当量)在h2o(1ml)和meoh(1ml)中
的溶液中添加naoh(4.55mg,113.74umol,1当量)。将混合物在80℃下搅拌1小时。hplc显示甲酯完全消耗。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph=5。将混合物过滤。得到化合物4-[(1s)-1-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]乙基]苯甲酸(46mg,89.66umol,79.35%收率,98.4%纯度),为白色固体。产物的lcms(esi):m/z 514.0[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=8.69(d,j=8.0hz,1h),8.25(d,j=4.8hz,1h),8.10(s,1h),7.90(d,j=8.0hz,2h),7.50(d,j=8.0hz,2h),7.39(d,j=8.0hz,2h),7.24(d,j=8.0hz,2h),7.13(d,j=4.8hz,1h),5.25-5.15(m,1h),4.89(t,j=4.4hz,1h),4.79-4.70(m,2h),4.65(t,j=4.8hz,1h),4.60-4.52(m,2h),1.44(d,j=7.2hz,3h)。
[1052]
实施例52
–
反式-2-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]-吡咯并[2,3-b]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(化合物48)的合成
[1053][1054]
步骤1:4-溴-1-(2-氟乙基)吡咯并[2,3-b]吡啶-3-甲酸甲酯
[1055][1056]
向4-溴-1h-吡咯并[2,3-b]吡啶-3-甲酸甲酯(1g,3.92mmol,1当量)在dmf(1ml)中的溶液中添加k2co3(1.08g,7.84mmol,2当量)和1-溴-2-氟-乙烷(2.49g,19.60mmol,5当量)。将混合物在25℃下搅拌16小时。lc-ms显示没有剩下起始物。在lc-ms上显示有若干新峰,并检测到80%的所需化合物。在减压下浓缩反应混合物以移除二噁烷。将残留物用h2o 5ml稀释,并用ea15ml(5ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过柱色谱法(sio2,石油醚/乙酸乙酯=10/1至0/1)纯化残留物。得到化合物4-溴-1-(2-氟乙基)吡咯并[2,3-b]吡啶-3-甲酸甲酯(900mg,2.99mmol,76.24%收率),为白色固体。hplc显示产物是纯净的。产物的lcms(esi):m/z 300.9[m+h]
+
。
[1057]
步骤2:1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-甲酸甲酯
[1058][1059]
向4-溴-1-(2-氟乙基)吡咯并[2,3-b]吡啶-3-甲酸甲酯(406.51mg,1.35mmol,1当量)和4,4,5,5-四甲基-2-[[4-(三氟甲基)苯基]甲基]-1,3,2-二氧杂环戊硼烷(579.37mg,2.03mmol,1.5当量)在甲苯(3ml)中的溶液中添加cs2co3(879.74mg,2.70mmol,2当量)和二叔丁基(环戊基)磷烷;二氯钯;铁(87.99mg,135.00umol,0.1当量)。将混合物在80℃下搅拌12小时。lc-ms显示剩下0%的溴化物。在lc-ms上显示有若干新峰,并检测到24%的所需化合物。在减压下浓缩反应混合物以移除甲苯。将残留物用h2o 5ml稀释,并用ea 15ml(5ml
×
3)萃取。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-甲酸甲酯(150mg,394.39umol,29.21%收率),为白色固体。hplc显示产物是纯净的。产物的lcms(esi):m/z 381.1[m+h]
+
。
[1060]
步骤3:1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-甲酸
[1061][1062]
向1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-甲酸甲酯(150mg,394.39umol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(15.77mg,394.39umol,1当量)。将混合物在80℃下搅拌3小时。hplc显示甲酯完全消耗。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-甲酸(120mg,327.59umol,83.06%收率),为白色固体。
[1063]
步骤4:反式-(s)-2-[[1-(2-氟乙基)-4-[[4-(三氟甲基)-苯基]甲基]-吡咯并[2,3-b]吡啶-3-羰基]氨基]-螺[3.3]庚烷-6-甲酸1-苯基乙酯
[1064]
[1065]
在0℃下向1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-甲酸(30mg,81.90umol,1当量)在dcm(1ml)中的溶液中滴加et3n(41.44mg,409.50umol,57.00ul,5当量)、hobt(2.21mg,16.38umol,0.2当量)和edci(31.40mg,163.80umol,2当量)。添加后,将混合物在此温度下搅拌0.5小时,然后在0℃下滴加反式-(s)-2-氨基螺[3.3]庚烷-6-甲酸1-苯基乙酯(31.86mg,122.85umol,1.5当量)。将所得混合物在25℃下搅拌12小时。lcms显示羧酸完全消耗。将残留物用h2o 3ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物反式-(s)-2-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(15mg,24.69umol,30.14%收率),为白色固体,其不经进一步纯化进入下一步使用。产物的lcms(esi):m/z 608.3[m+h]
+
。
[1066]
步骤5:反式-2-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]-吡咯并[2,3-b]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸
[1067][1068]
向反式-(s)-2-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸1-苯基乙酯(15mg,24.69umol,1当量)在dcm(1ml)和tfa(1ml)中的溶液中。将混合物在25℃下搅拌0.5小时。hplc显示酯完全消耗。在减压下浓缩反应混合物以移除溶剂。向残留物中添加1m naoh(水溶液),并用h2o 3ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。用1n hcl将混合物调节至ph=5。将混合物过滤。得到化合物反式-2-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]螺[3.3]庚烷-6-甲酸(4.5mg,8.54umol,34.61%收率,95.6%纯度),为白色固体。产物的lcms(esi):m/z 504.0[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=8.32(d,j=7.6hz,1h),8.24(d,j=4.8hz,1h),7.97(s,1h),7.55(d,j=8.0hz,2h),7.34(d,j=8.0hz,2h),7.10(d,j=4.8hz,1h),4.87(t,j=4.4hz,1h),4.75(t,j=4.8hz,1h),4.68(s,2h),4.61(t,j=4.4hz,1h),4.55(t,j=4.4hz,1h),4.28-4.19(m,1h),2.94-2.87(m,1h),2.43
–
2.40(m,1h),2.25-2.20(m,3h),2.14-2.05(m,2h),1.99-1.88(m,2h)。
[1069]
实施例53
–
2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]苯基]丙酸(化合物49)的合成
[1070][1071]
步骤1:2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]苯基]丙酸甲酯
[1072][1073]
向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(20mg,62.45umol,1当量)和2-(4-氨基苯基)丙酸甲酯(13.43mg,74.94umol,1.2当量)在dcm(1ml)中的溶液中添加pyaop(35.82mg,68.69umol,1.1当量)和diea(20.18mg,156.12umol,27.19ul,2.5当量)。将混合物在25℃下搅拌5小时。lc-ms显示剩下0%的羧酸。在lc-ms上显示有若干新峰,并检测到61.38%的所需化合物。将反应混合物用h2o 2ml稀释,并用dcm 9ml(3ml
×
3)萃取。将合并的有机层用盐水(3ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=1:1)纯化残留物。得到化合物2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]苯基]丙酸甲酯(20mg,41.54umol,66.52%收率),为白色固体,其不经进一步纯化直接进入下一步使用。产物的lcms(esi):m/z482.2[m+h]
+
。
[1074]
步骤2:2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]苯基]丙酸
[1075][1076]
向2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]苯基]丙酸甲酯(20mg,41.54umol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh
(4.98mg,124.62umol,3当量)。将混合物在50℃下搅拌16小时。hplc显示剩下0%的甲酯。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物2-[4-[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]苯基]丙酸(15mg,31.79umol,76.54%收率,99.08%纯度),为白色固体。产物的lcms(esi):m/z 468.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δppm 12.28(br s,1h)10.16(s,1h)8.76(d,j=6.8hz,1h)8.42(s,1h)7.63(d,j=8.4hz,2h)7.52(d,j=8.0hz,2h)7.35-7.31(m,3h)7.26(d,j=8.8hz,2h)7.10(t,j=7.2hz,1h)4.66(s,2h)3.66(q,j=7.2hz,1h)1.38(d,j=7.2hz,3h)。
[1077]
实施例54
–
4-[[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]甲基]降冰片烷-1-甲酸(化合物50)的合成
[1078][1079]
步骤1:4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(2,5-二氧代吡咯烷-1-基)酯
[1080][1081]
向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(50mg,156.12umol,1当量)和1-羟基吡咯烷-2,5-二酮(21.56mg,187.34umol,1.2当量)在thf(1ml)中的溶液中添加dcc(41.88mg,202.96umol,41.05ul,1.3当量)。将混合物在25℃下搅拌16小时。lc-ms显示剩下0%的羧酸。lc-ms上显示有若干新峰,并检测到50.69%的所需化合物。在减压下浓缩反应混合物以移除thf。将残留物用h2o 3ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(2,5-二氧代吡咯烷-1-基)酯(48mg,115.01umol,73.67%收率),为黑色油状物。
[1082]
步骤2:4-[[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]甲基]降冰片烷-1-甲酸
[1083][1084]
向4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-甲酸(2,5-二氧代吡咯烷-1-基)酯(40mg,95.85umol,1当量)和4-(氨甲基)降冰片烷-1-甲酸(32.44mg,191.69umol,2当量)在dmf(1ml)中的溶液中添加et3n(174.58mg,1.73mmol,240.13ul,18当量)。将混合物在60℃下搅拌16小时。lc-ms显示剩下0%的酯。lc-ms上显示有若干新峰,并检测到30.14%的所需化合物。在减压下浓缩反应混合物以移除dmf。将残留物用h2o 3ml稀释,并用ea15ml(5ml
×
3)萃取。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型hplc(hcl条件)纯化残留物。得到化合物4-[[[4-[[4-(三氟甲基)苯基]甲基]吡唑并[1,5-a]吡啶-3-羰基]氨基]甲基]降冰片烷-1-甲酸(6mg,12.53umol,13.08%收率,98.49%纯度),为白色固体。产物的lcms(esi):m/z 472.0[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=12.01(s,1h),8.71(d,j=6.8hz,1h),8.30(s,1h),8.20(t,j=6.0hz,1h),7.58(d,j=8.0hz,2h),7.32-7.28(m,3h),7.04(t,j=6.8hz,1h),4.70(s,2h),2.69(s,2h),1.88-1.78(m,2h),1.59-1.50(m,4h),1.46(s,2h),1.30-1.24(m,2h)。
[1085]
实施例55
–
2-[3-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸(化合物51)的合成
[1086][1087]
步骤1:2-[3-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯
[1088][1089]
在0℃下向1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸(20mg,57.58umol,1当量)在dcm(2ml)中的溶液中添加hobt(1.56mg,11.52umol,0.2当量)、edci(22.08mg,
115.16umol,2当量)和et3n(29.13mg,287.91umol,40.07ul,5当量)。将混合物在0℃下搅拌0.5小时。然后将2-(3-氨基-1-双环[1.1.1]戊烷基)乙酸甲酯(13.40mg,86.37umol,1.5当量)添加到混合物中。将混合物在25℃下搅拌16小时。lc-ms显示剩下0%的羧酸。lc-ms上显示有若干新峰,并检测到62.99%的所需化合物。将反应混合物用h2o 3ml稀释,并用dcm 9ml(3ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物2-[3-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(10mg,20.64umol,35.84%收率),为黄色油状物,其不经进一步纯化进入下一步使用。产物的lcms(esi):m/z 485.3[m+h]
+
。
[1090]
步骤2:2-[3-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸
[1091][1092]
向2-[3-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(10mg,20.64umol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(825.52ug,20.64umol,1当量)。将混合物在50℃下搅拌16小时。hplc显示剩下0%的甲酯。在减压下浓缩反应混合物以移除meoh。通过制备型hplc(hcl条件)纯化残留物。得到化合物2-[3-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸(6mg,12.68umol,61.42%收率,99.41%纯度),为白色固体。产物的lcms(esi):m/z471.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δppm 12.05(br s,1h)8.41(s,1h)7.68(s,1h)7.48(d,j=7.6hz,2h)7.39(d,j=8.4hz,1h)7.29(d,j=8.0hz,2h)7.19-7.13(m,1h)7.04-7.00(m,1h)4.61(s,2h)4.20-4.13(m,2h)2.5(s,2h),1.97(s,6h)1.33(t,j=6.8hz,3h)。
[1093]
实施例56
–
2-[3-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]-吲哚-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸(化合物52)的合成
[1094][1095][1096]
步骤1:1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸甲酯
[1097][1098]
向4-溴-1-(2-氟乙基)吲哚-3-甲酸甲酯(300mg,999.59umol,1当量)在甲苯(3ml)和4,4,5,5-四甲基-2-[[4-(三氟甲基)苯基]甲基]-1,3,2-二氧杂环戊硼烷(428.97mg,1.50mmol,1.5当量)中的溶液中添加cs2co3(651.37mg,2.00mmol,2当量)和二叔丁基(环戊基)磷烷;二氯钯;铁(65.15mg,99.96umol,0.1当量)。将混合物在80℃下搅拌16小时。lc-ms显示剩下0%的溴化物。lc-ms上显示有若干新峰,并检测到22.2%的所需化合物。将反应混合物用h2o 3ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水3ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。通过制备型tlc(sio2,pe:ea=2:1)纯化残留物。得到化合物1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸甲酯(130mg,342.69umol,34.28%收率),为黄色油状物。
[1099]
步骤2:1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸
[1100]
向1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸甲酯(130mg,342.69umol,1当量)在meoh(2ml)和h2o(1ml)中的溶液中添加naoh(13.71mg,342.69umol,1当量)。将混合物在50℃下搅拌16小时。hplc显示剩下0%的甲酯。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物化合物1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸(110mg,301.11umol,87.86%收率),为白色固体。
[1101]
步骤3:2-[3-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯
[1102][1103]
在0℃下向1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸(40mg,109.49umol,1当量)在dcm(2ml)中的溶液中添加hobt(2.96mg,21.90umol,0.2当量)、edci(41.98mg,218.99umol,2当量)和et3n(55.40mg,547.46umol,76.20ul,5当量)。将混合物在
0℃下搅拌0.5小时。然后将2-(3-氨基-1双环[1.1.1]戊烷基)乙酸甲酯(25.49mg,164.24umol,1.5当量)添加到混合物中。将混合物在25℃下搅拌16小时。lc-ms显示剩下0%的羧酸。在lc-ms上显示有若干新峰,并检测到53.32%的所需化合物。将反应混合物用h2o 3ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物2-[3-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(30mg,59.70umol,54.53%收率),为黄色油状物,其不经进一步纯化进入下一步使用。产物的lcms(esi):m/z 503.3[m+h]
+
。
[1104]
步骤4:2-[3-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸
[1105][1106]
向1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸甲酯(30mg,342.69umol,1当量)在meoh(2ml)和h2o(1ml)中的溶液中添加naoh(13.71mg,342.69umol,1当量)。将混合物在50℃下搅拌16小时。hplc显示剩下0%的甲酯。在减压下浓缩反应混合物以移除meoh。用1n hcl将混合物调节至ph 4。将混合物过滤。得到化合物2-[3-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸(11mg,22.52umol,37.72%收率,100%纯度),为白色固体。产物的lcms(esi):m/z 489.1[m+h]
+
,rt:2.576分钟。1h nmr(400mhz,dmso-d6)δppm 8.53(s,1h)7.70(s,1h)7.52(d,j=8.00hz,2h)7.46(d,j=8.4hz,1h)7.32(d,j=8.0hz,2h)7.21(t,j=7.6hz,1h)7.08(d,j=7.2hz,1h)4.80(t,j=4.4hz,1h)4.68(m,1h)4.64(s,2h)4.52-4.56(m,1h)4.48(d,j=4.13hz,1h)3.15-3.31(m,2h),2.50(s,2h),2.01(s,6h)。
[1107]
实施例57
–
2-[3-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸(化合物53)的合成
[1108][1109][1110]
步骤1:2-[3-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯
[1111][1112]
在0℃下向1-乙基-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-甲酸(40mg,114.84umol,1当量)在dcm(1ml)中的溶液中滴加hobt(3.10mg,22.97umol,0.2当量)、et3n(58.10mg,574.19umol,79.92ul,5当量)和edci(44.03mg,229.67umol,2当量)。添加后,将混合物在此温度下搅拌30分钟,然后在0℃下添加2-(3-氨基-1-双环[1.1.1]戊烷基)乙酸甲酯(21.39mg,137.80umol,1.2当量)。将所得混合物在25℃下搅拌12小时。lcms显示羧酸完全消耗。将残留物用h2o 3ml稀释,并用dcm 15ml(5ml
×
3)萃取。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物2-[3-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(25mg,51.60umol,44.93%收率),为白色固体,其不经进一步纯化进入下一步使用。产物的lcms(esi):m/z486.1[m+h]
+
。
[1113]
步骤2:2-[3-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸
[1114][1115]
向2-[3-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(25mg,51.60umol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(2.06mg,51.60umol,1当量)。将混合物在80℃下搅拌1小时。hplc显示甲酯完全消耗。在减压下浓缩反应混合物以移除溶剂。通过制备型hplc(hcl条件)纯化残留物。得到化合物2-[3-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸(8mg,18.88umol,36.59%收率,98.7%纯度),为白色固体。产物的lcms(esi):m/z 472.0[m+h]
+
,rt:2.448分钟。1h nmr(400mhz,dmso-d6)δ=8.63(br s,1h),8.25(d,j=4.8hz,1h),7.98(s,1h),7.55(d,j=8.0hz,2h),7.37(d,j=8.0hz,2h),7.14-7.09(m,1h),4.70(s,2h),4.29-4.24(m,2h),2.50(s,2h),2.01(s,6h),1.37(t,j=7.2hz,3h)。
[1116]
实施例58
–
2-[3-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]-吡咯并[2,3-b]吡啶-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸(化合物54)的合成
[1117][1118]
步骤1:2-[3-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯
[1119][1120]
在0℃下向1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-甲酸(60mg,163.80umol,1当量)在dcm(1ml)中的溶液中滴加et3n(82.87mg,819.00umol,113.99ul,5当量)、hobt(4.43mg,32.76umol,0.2当量)和edci(62.80mg,327.60umol,2当量)。添加后,将混合物在此温度下搅拌0.5小时,然后在0℃下滴加2-(3-氨基-1-双环[1.1.1]戊烷基)乙酸甲酯(38.13mg,245.70umol,1.5当量)。将所得混合物在25℃下搅拌12小时。lc-ms显示没有剩下羧酸。在lc-ms上显示有若干新峰,并检测到80%的所需化合物。在减压下浓缩反应混合物以移除二噁烷。将残留物用h2o 3ml稀释,并用ea15ml(5ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物2-[3-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(60mg,119.17umol,72.75%收率),为白色固体,其不经进一步纯化进入下一步使用。产物的lcms(esi):m/z 504.2[m+h]
+
。
[1121]
步骤2:2-[3-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸
[1122][1123]
向2-[3-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸甲酯(60mg,119.17umol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(14.30mg,357.51umol,3当量)。将混合物在80℃下搅拌2小
时。hplc显示甲酯完全消耗。在减压下浓缩反应混合物以移除溶剂。通过制备型hplc(hcl条件)纯化残留物。得到化合物2-[3-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]-1-双环[1.1.1]戊烷基]乙酸(30mg,59.70umol,50.10%收率,97.4%纯度),为白色固体。产物的lcms(esi):m/z 490.2[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=8.70(s,1h),8.27(d,j=4.8hz,1h),7.97(s,1h),7.57(d,j=8.0hz,2h),7.39(d,j=8.0hz,2h),7.15(d,j=4.8hz,1h),4.87(t,j=4.8hz,1h),4.76-4.70(m,3h),4.62(t,j=4.8hz,1h),4.55(t,j=4.8hz,1h),2.50(s,2h),2.03(s,6h)。
[1124]
实施例59
–
(1r,4r)-4-[[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]甲基]环己烷甲酸(化合物55)的合成
[1125][1126]
步骤1:(1r,4r)-4-[[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]甲基]环己烷甲酸甲酯
[1127][1128]
在0℃下向1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸(20mg,57.58umol,1当量)在dcm(2ml)中的溶液中添加hobt(1.56mg,11.52umol,0.2当量)、edci(22.08mg,115.16umol,2当量)和et3n(29.13mg,287.91umol,40.07ul,5当量)。将混合物在0℃下搅拌0.5小时。然后向混合物中添加4-(氨甲基)环己烷甲酸甲酯;盐酸盐(17.94mg,86.37umol,1.5当量)。将混合物在25℃下搅拌16小时。lc-ms显示剩下0%的羧酸。在lc-ms上显示有若干新峰,并检测到68.75%的所需化合物。将反应混合物用h2o 3ml稀释,并用dcm 9ml(3ml
×
3)萃取。将合并的有机层用盐水3ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物(1r,4r)-4-[[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]甲基]环己烷甲酸甲酯(13mg,25.97umol,45.10%收率),为黄色油状物。粗产物不经进一步纯化即进入下一步使用。产物的lcms(esi):m/z 501.3[m+h]
+
。
[1129]
步骤2:(1r,4r)-4-[[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]甲基]环己烷甲酸
[1130][1131]
向(1r,4r)-4-[[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]甲基]环己烷甲酸甲酯(13mg,25.97umol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(1.04mg,25.97umol,1当量)。将混合物在50℃下搅拌16小时。hplc显示剩下0%的甲酯。在减压下浓缩反应混合物以移除meoh。通过制备型hplc(hcl条件)纯化残留物。得到化合物(1r,4r)-4-[[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]甲基]环己烷甲酸(5mg,10.28umol,39.57%收率,100%纯度),为白色固体。产物的lcms(esi):m/z 487.1[m+h]
+
。1h nmr(400mhz,dmso-d6)12.02(br s,1h)7.97(t,j=5.6hz,1h)7.75(s,1h)7.51(d,j=8.0hz,2h)7.43(d,j=8.0hz,1h)7.29(d,j=8.0hz,2h)7.19(t,j=7.8hz,1h)7.00(d,j=7.2hz,1h)4.66(s,2h)4.23(t,j=6.8hz,2h)3.04(t,j=6.0hz,2h)2.10-2.16(m,1h)1.88(d,j=6.8hz,2h)1.73(d,j=6.8hz,2h)1.35-1.46(m,4h)1.28
–
1.22(m,2h)0.98-0.90(m,2h)。
[1132]
实施例60
–
2-[(1r,4r)-4-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]环己基]乙酸(化合物56)的合成
[1133][1134]
步骤1:2-[(1r,4r)-4-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]环己基]乙酸乙酯
[1135][1136]
在0℃下向1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-甲酸(20mg,57.58umol,1当量)在dcm(2ml)中的溶液中添加hobt(1.56mg,11.52umol,0.2当量)、edci(22.08mg,115.16umol,2当量)和et3n(29.13mg,287.91umol,40.07ul,5当量)。将混合物在0℃下搅拌
0.5小时。然后将反式-2-(4-氨基环己基)乙酸乙酯;盐酸盐(19.15mg,86.37umol,1.5当量)添加到混合物中。将混合物在25℃下搅拌16小时。lc-ms显示剩下0%的羧酸。在lc-ms上显示有若干新峰,并检测到65.83%的所需化合物。将反应混合物用h2o 3ml稀释,并用dcm 9ml(3ml
×
3)萃取。将合并的有机层用盐水3ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物c
29h33
n2o3f3(17mg,33.04umol,57.37%收率),为黄色油状物,其不经进一步纯化进入下一步使用。产物的lcms(esi):m/z 515.3[m+h]
+
。
[1137]
步骤2:2-[(1r,4r)-4-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]环己基]乙酸
[1138][1139]
向2-[(1r,4r)-4-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]环己基]乙酸乙酯(17mg,33.04umol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(1.32mg,33.04umol,1当量)。将混合物在50℃下搅拌16小时。hplc显示剩下0%的乙酯。在减压下浓缩反应混合物以移除meoh。通过制备型hplc(hcl条件)纯化残留物。得到化合物2-[(1r,4r)-4-[[1-乙基-4-[[4-(三氟甲基)苯基]甲基]吲哚-3-羰基]氨基]环己基]乙酸(6mg,12.33umol,37.33%收率,100%纯度),为白色固体。产物的lcms(esi):m/z 487.1[m+h]
+
。1h nmr(400mhz,dmso-d6)12.06(br s,1h)7.78(d,j=7.8hz,1h)7.68(s,1h)7.52(d,j=8.0hz,2h)7.43(d,j=8.0hz,1h)7.29(d,j=8.00hz,2h)7.18(t,j=8.0hz,1h)7.01(d,j=7.2hz,1h)4.64(s,2h)4.20-4.25(m,2h)3.56-3.65(m,1h)2.13(d,j=6.8hz,2h)1.76-1.72(m,4h)1.64-1.57(m,1h)1.41-1.36(m,3h)1.26-1.18(m,2h)1.12-1.10(m,2h)。
[1140]
实施例61
–
2-[(1r,4r)-4-[[1-(2-氟乙基)-4-[[4-(三氟甲基)-苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]环己基]乙酸(化合物57)的合成
[1141][1142]
步骤1:2-[(1r,4r)-4-[[1-(2-氟乙基)-4-[[4-(三氟甲基)-苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]环己基]乙酸乙酯
[1143][1144]
在0℃下向1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-甲酸(40mg,109.20umol,1当量)在dcm(1ml)中的溶液中滴加et3n(11.05mg,109.20umol,15.20ul,1当量)、hobt(14.75mg,109.20umol,1当量)和edci(41.87mg,218.40umol,2当量)。添加后,将混合物在此温度下搅拌0.5小时,然后在0℃下滴加反式-2-(4-氨基环己基)乙酸乙酯;盐酸盐(29.05mg,131.04umol,1.2当量)。将所得混合物在25℃下搅拌12小时。在lc-ms上显示有若干新峰,并检测到80%的所需化合物。在减压下浓缩反应混合物以移除二噁烷。将残留物用h2o 3ml稀释,并用ea 15ml(5ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物2-[(1r,4r)-4-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]环己基]乙酸乙酯(40mg,粗),为白色固体,其不经进一步纯化进入下一步使用。产物的lcms(esi):m/z 534.2[m+h]
+
。
[1145]
步骤2:2-[(1r,4r)-4-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]-吡咯并[2,3-b]吡啶-3-羰基]氨基]环己基]乙酸
[1146][1147]
向2-[(1r,4r)-4-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]环己基]乙酸乙酯(40mg,74.97umol,1当量)在h2o(1ml)和meoh(1ml)中的溶液中添加naoh(3.00mg,74.97umol,1当量)。将混合物在80℃下搅拌2小时。hplc显示乙酯完全消耗。在减压下浓缩反应混合物以移除溶剂。通过制备型hplc(hcl条件)纯化残留物。得到化合物2-[(1r,4r)-4-[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]环己基]乙酸(13mg,25.72umol,34.30%收率,100%纯度),为白色固体。产物的lcms(esi):m/z 506.1[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=8.24(d,j=4.4hz,1h),8.00(d,j=7.6hz,1h),7.94(s,1h),7.55(d,j=8.0hz,2h),7.35(d,j=8.0hz,2h),7.09(d,j=4.8hz,1h),4.86(t,j=4.4hz,1h),4.74(t,j=4.0hz,1h),4.69(s,2h),4.62(d,j=4.4hz,1h),4.55(d,j=4.4hz,1h),3.63-3.60(s,1h),2.11(d,j=6.8hz,2h),1.82-1.70(m,4h),1.59(br s,1h),1.26-1.17(m,2h),1.07-0.94(m,2h)。
[1148]
实施例62
–
(1r,4r)-4-[[[1-(2-氟乙基)-4-[[4-(三氟甲基)-苯基]甲基]-吡咯并[2,3-b]吡啶-3-羰基]氨基]甲基]环己烷甲酸(化合物58)的合成
[1149][1150]
步骤1:(1r,4r)-4-[[[1-(2-氟乙基)-4-[[4-(三氟甲基)-苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]甲基]环己烷甲酸甲酯
[1151][1152]
在0℃下向1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-甲酸(40mg,109.20umol,1当量)在dcm(1ml)中的溶液中滴加et3n(55.25mg,545.99umol,76.00ul,5当量)、hobt(2.95mg,21.84umol,0.2当量)和edci(41.87mg,218.39umol,2当量)。添加后,将混合物在此温度下搅拌0.5小时,然后在0℃下滴加反式-4-(氨甲基)环己烷甲酸甲酯;盐酸盐(27.22mg,131.04umol,1.2当量)。将所得混合物在25℃下搅拌12小时。lc-ms显示没有剩下羧酸。在lc-ms上显示有若干新峰,并检测到80%的所需化合物。在减压下浓缩反应混合物以移除二噁烷。将残留物用h2o 3ml稀释,并用ea15ml(5ml
×
3)萃取。将合并的有机层用盐水5ml洗涤,经na2so4干燥,过滤并在减压下浓缩,得到残留物。粗产物不经进一步纯化即进入下一步使用。得到化合物(1r,4r)-4-[[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]甲基]环己烷甲酸甲酯(56mg,粗),为白色固体,其不经进一步纯化进入下一步使用。产物的lcms(esi):m/z 520.2[m+h]
+
。
[1153]
步骤2:(1r,4r)-4-[[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]-吡咯并[2,3-b]吡啶-3-羰基]氨基]甲基]环己烷甲酸
[1154][1155]
向(1r,4r)-4-[[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]甲基]环己烷甲酸甲酯(56mg,107.79umol,1当量)在meoh(1ml)和h2o(1ml)中的溶液中添加naoh(4.31mg,107.79umol,1当量)。将混合物在80℃下搅拌2小时。hplc显示甲酯完全消耗。在减压下浓缩反应混合物以移除溶剂。通过制备型hplc(hcl条件)
纯化残留物。得到化合物(1r,4r)-4-[[[1-(2-氟乙基)-4-[[4-(三氟甲基)苯基]甲基]吡咯并[2,3-b]吡啶-3-羰基]氨基]甲基]环己烷甲酸(40mg,76.99umol,71.43%收率,97.3%纯度),为白色固体。产物的lcms(esi):m/z 506.1[m+h]
+
。1h nmr(400mhz,dmso-d6)δ=11.98(br s,1h),8.25(d,j=4.8hz,1h),8.17(t,j=5.6hz,1h),8.00(s,1h),7.56(d,j=8.0hz,2h),7.36(d,j=8.0hz,2h),7.10(d,j=4.8hz,1h),4.88(t,j=4.8hz,1h),4.78-4.73(m,3h),4.64(t,j=4.4hz,1h),4.59-4.56(m,1h),3.07(t,j=6.0hz,2h),2.18-2.07(m,1h),1.92-1.87(m,2h),1.79-1.74(m,2h),1.45(br s,1h),1.27-1.22(m,2h),0.99-0.92(m,2h)。
[1156]
药物组合物
[1157]
实施例a-1:肠胃外药物组合物
[1158]
为了制备适于通过注射(皮下、静脉内)施用的肠胃外药物组合物,将1-1000mg本文所述的化合物的水溶性盐或其药学上可接受的盐或溶剂合物溶解在无菌水中,然后与10ml的0.9%无菌盐水混合。任选添加合适的缓冲剂以及任选酸或碱以调节ph。将混合物掺入到适于通过注射施用的剂量单位形式中。
[1159]
实施例a-2:口服溶液
[1160]
为了制备用于口服递送的药物组合物,将足量的本文所述的化合物或其药学上可接受的盐添加到水(具有任选的增溶剂、任选的缓冲剂和掩味赋形剂)中以得到20mg/ml溶液。
[1161]
实施例a-3:口服片剂
[1162]
通过混合20-50重量%的本文所述的化合物或其药学上可接受的盐、20-50重量%的微晶纤维素和1-10重量%的硬脂酸镁或其它适当的赋形剂来制备片剂。通过直接压制来制备片剂。压制片剂的总重量保持在100-500mg。
[1163]
实施例a-4:口服胶囊
[1164]
为了制备用于口服递送的药物组合物,将1-1000mg本文所述的化合物或其药学上可接受的盐与淀粉或其它合适的粉末共混物混合。将混合物掺入到适于口服施用的口服剂量单位如硬明胶胶囊中。
[1165]
在另一实施方案中,将1-1000mg本文所述的化合物或其药学上可接受的盐置于4号胶囊或1号胶囊(羟丙甲纤维素或硬明胶)中,并将胶囊封闭。
[1166]
生物学实施例
[1167]
实施例b-1:前列腺素类ep4结合测定
[1168]
将用人前列腺素类ep4受体(ep4)转染的hek293细胞保持在补充有l-谷氨酰胺、10%fbs和300μg/ml g418的dmem中。收获细胞,并在细胞于蛋白酶抑制剂存在下裂解后通过差速离心制备膜,用于受体结合测定。ep4结合测定在50mm hepes ph7.4、5mm mgcl2、1mm cacl2和0.2%bsa中进行。用dmso稀释测试化合物以制备8点4倍连续稀释液。在测定缓冲液中存在或不存在测试化合物的情况下,将细胞膜匀浆与3h-前列腺素e2一起在24℃下温育。在存在或不存在饱和冷配体前列腺素e2(pge2)的情况下测定非特异性结合(低对照:lc)和总结合(高对照:hc)。通过从总结合中减去非特异性结合来计算特异性结合。当结合测定完成时,将反应混合物在真空下通过于室温下用0.5%bsa预浸泡至少0.5小时的玻璃纤维过滤器(gf/c,packard)快速过滤,然后使用96个样品的perkin elmer filtermate收获器
(unifilter,packard),用冷洗涤缓冲液(50mm hepes ph7.4、500mm nacl、0.1%bsa)洗涤4次。将过滤器在50度下干燥1小时,然后使用perkin elmer microscint 20混合物在闪烁计数器中进行放射性计数。使用perkin elmer microbeta2读数器对过滤器上截留的3h进行计数。使用以下等式计算抑制:%抑制=(1-(测定孔-平均_lc)/(平均_hc-平均_lc))x100%。结果表示为对照放射性配体特异性结合的抑制百分比。分析数据,并使用graphpad prism 5和模型“log(抑制剂)与响应的关系
‑‑
可变斜率”计算ic50。通过使用cheng和prusoff等式ki=ic50/(1+[放射性配体]/kd)确定化合物的结合亲和力。
[1169]
表1中描述了代表性化合物的示例性结合亲和力。效力分成三个标准:+意指ki大于500nm;++意指ki在100nm与499nm之间;+++意指ki低于100nm。无活性化合物被指定为na。
[1170]
表1.
[1171]
[1172]
[1173][1174]
实施例b-2:前列腺素类ep4和ep2 flipr测定
[1175]
将用人前列腺素类ep4受体(ep4)转染的hek293细胞或用人前列腺素类ep2受体(ep2)转染的cho细胞保持在补充有l-谷氨酰胺、10%fbs和300μg/ml g418的dmem中。将细胞以20,000个细胞/孔铺板在黑色384孔聚-d-赖氨酸蛋白质涂层板中,并在37℃、5%co2下温育24h。在测定之前,根据制造商的说明书重构钙敏感染料fluo-4directtm(molecular devices)。在测定缓冲液(1x hbss、20mm hepes和2.5mm羟苯磺丙胺,ph 7.4)稀释重构的染料。移除生长培养基,并将20μl这种稀释的染料以2μm的最终浓度添加到每个孔中。添加染料后,将板在37℃、5%co2下温育50分钟,并在室温下温育10分钟。用dmso稀释测试化合物以制备10点4倍连续稀释液。预处理温育后,在flexstation ii荧光成像板读数器(molecular devices)上测量荧光强度。在pge2添加之前(20个读数)和之后(40个读数)测量相对荧光单位(rfu),总共60秒的读数时间(激发=485nm,发射=525nm)。分析数据,并使用graphpad prism 5和模型“log(抑制剂)与响应的关系
‑‑
可变斜率”计算ic50。
[1176]
表2中描述了代表性化合物的示例性数据。效力分成四个标准:+意指ki大于1,000nm;++意指ki在500nm与1,000nm之间;+++意指ki在100nm与499nm之间;++++意指ki低于100nm。
[1177]
表2.
[1178][1179]
本文描述的实施例和实施方案仅用于说明的目的,并且本领域技术人员建议的各种修改或变动包括在本技术的实质和范畴以及所附权利要求的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1