用于人乳头瘤病毒和性传播感染检测、鉴定和定量的方法和组合物与流程
用于人乳头瘤病毒和性传播感染检测、鉴定和定量的方法和组合物
1.相关申请
2.本技术要求于2019年6月7日提交的名称为“用于人乳头瘤病毒和性传播感染检测、鉴定和定量的方法和组合物(methods and compositions for human papillomaviruses and sexually transmitted infections detection,identification and quantification)”的美国临时专利申请第16/435,017号的优先权,其全部内容并入本文。
背景技术:
3.性传播感染(sexually transmitted infections,sti)给全球带来了巨大的疾病负担,并会导致癌症等导致死亡的疾病。卫生保健系统和卫生保健支出的负担是巨大的。在世界范围内,sti主要由七种感染引起:梅毒、淋病、衣原体、滴虫病、生殖器疱疹、乙型肝炎病毒(hbv)和人乳头瘤病毒(hpv)。这些感染中有许多通常是无症状和潜伏的。然而,sti有时会导致严重和致命的健康后果。例如,某些hpv类型会导致宫颈癌,全球每年发生超过530,000例宫颈癌事件和超过250,000例死亡(jemal a et al,ca cancer j clin.2008 mar-apr;58(2):71-96)。梅毒螺旋体(treponema pallidum)引起梅毒,在孕妇中,梅毒每年导致多达150万围产期死亡。淋病和衣原体会损害输卵管,从而导致不孕和输卵管妊娠,这是孕产妇死亡的重要原因。此外,生殖器疱疹和其他生殖器溃疡疾病会增加hiv传播的风险。
4.hpv是宫颈癌的直接病原体,并且已在99.7%的宫颈癌中检测到(n et al,int j cancer.1992 nov 11;52(5):743-9,walboomers jm,j pathol.1999 sep;189(1):12-9)。在诸如口咽癌、阴道癌、外阴癌、肛门癌和阴茎癌等其他癌症中也检测到了hpv。hpv是一种双链环状dna病毒,基因组有约8000个碱基对。hpv基因组包含8个分为早期基因和晚期基因的蛋白质编码基因:l1和l2编码衣壳蛋白,e1和e2、e4、e5、e6和e7编码参与复制、转录和转化的蛋白质以及在驱动细胞周期进入、免疫逃避和病毒释放方面发挥作用。hpv根据良性病变、癌前病变和恶性病变分为低风险和高风险的类型或基因型。然而,感染高风险hpv的那些中人只有一小部分会发展癌症。
5.宫颈癌是最可预防的癌症之一。从历史上看,细胞学筛查或帕普试验(pap test)一直是宫颈癌的初步筛查,其是对异常细胞转化的视觉、主观搜索。有组织的宫颈癌筛查项目已经挽救了大量女性的生命。此外,有组织的细胞学筛查项目已有效降低了hpv相关疾病的负担,灵敏的分子方法的引入有助于检测hpv病毒,从而显著提高了筛查项目的效率(wright,t.c.et al,jama.2002 apr 24;287(16):2120-9)。对暂时性hpv感染的检测会导致不必要的随访、治疗和昂贵的医疗程序。因此,宫颈癌筛查的目标是检测癌前病变和癌症,而不是暂时性hpv感染。
6.sti是全球最常见的疾病之一。在2015年,约有11亿人患有sti(不包括hiv),其中约:5亿人感染了梅毒、淋病、衣原体或滴虫病;5.3亿人感染了生殖器疱疹;2.9亿女性感染
了hpv(vos t.et al,lancet.2016 oct 8;388(10053):1545-1602)。在美国,2010年有1900万新的性传播感染病例。
7.迄今为止,已鉴定出超过200种hpv类型并且超过40种感染人类肛门生殖道(n et al,n engl j med.2003 feb 6;348(6):518-27)。它们分为高风险和低风险两组。通常认为,只有高风险类型会导致宫颈癌,而低风险类型会导致生殖器疣。在hpv分类中,序列相似度低于90%视为是一种新的hpv类型,同源性为90%到98%构成一个亚型,同源性高于98%代表一个类型变体。一致认为14种高风险类型是导致大多数宫颈癌的原因:hpv-16、18、31、33、35、39、45、51、52、56、58、59、66、68a和68b。然而,据报道,其他类型也会导致宫颈癌(n et al,n engl j med.2003 feb 6;348(6):518-27)。
8.多重pcr允许通过应用多个靶特异性引物的组合来同时扩增多个靶基因,以扩增感兴趣的靶区域。尽管多种引物在pcr中的使用非常实用并且减少了劳动力、成本和时间,但是,脱靶扩增或扩增伪影,例如引物-引物相互作用(引物-二聚体),会干扰最佳扩增和进一步分析,例如测序。这些伪影会耗尽pcr反应试剂并生成较短的片段,而不是预期的具体靶标。这些非特异性的较短片段往往在扩增反应中占主导地位,因为与所需的具体靶标相比,它们的扩增效率更高。这些不需要的伪影可能会干扰下游程序,例如ngs。这些伪影可能会消耗相当大一部分的序列读段(sequence read),从而产生无信息的结果。
9.在许多生物学应用中,增加寡核苷酸引物的数量以在单一扩增反应中扩增尽可能多的可能靶标是非常有利的。通过最小化或规避引物-引物相互作用和非特异性引发,可以实现更有效的多重pcr。一种方法是开发基于数学算法的选择方法来计算引物相互作用得分并选择具有最小相互作用的引物序列。尽管这可能会有所帮助,但在增加pcr反应中的引物数量时,它可能会受到影响。
10.目前在hpv检测中基于pcr的方法在分析上的灵敏性可以达到这类方法可检测到靶dna的几个拷贝的程度。对于hpv的检测,有两种hpv dna扩增方法:1)类型特异性引物扩增,由此每个引物对扩增一种特定的hpv基因型;和2)共有/通用引物扩增,这是广谱hpv扩增,由此通过简并引物可以在单一反应中扩增多个hpv类型。大多数共有序列扩增方法使用l1基因区域,因为它含有保守区域。最常用的共有引物是gp5+/gp6+、my09/my11和pgmy09(gravitt pe,et al,j clin microbiol.2000 jan;38(1):357-61和de ruda husman am et al,j gen virol.1995 apr;76(pt 4):1057-62)。
11.类型特异性扩增检测方法检测个别基因型,检测更多基因型需要多个反应或使用多重实时pcr检测反应中的更多类型,这限制了通量。另一方面,共有序列pcr具有在单一反应中检测多种hpv类型的优势,但它可能无法均一扩增所有类型,而且还需要二次方法来检测和鉴定具体基因型。共有引物方法使用简并引物,并依赖于退火到具有大量不同拷贝数的hpv dna类型上的错配位点,这会导致扩增偏差。由于易于使用,许多商业测定使用共有序列检测方法(barzon l et al,j clin virol.2011 oct;52(2):93-7and cornall am et al,j virol methods.2015 mar;214:10-4.)。然而,共有序列检测方法的主要缺点是,由于pcr中的hpv基因型抑制,共有引物对多重共感染的检测效果不佳,其中一种hpv基因型在多重共感染中的优势会导致检测水平较低的其他共存基因型的性能不佳。一般而言,当同一样本中存在混合的hpv基因型时,由于基因型竞争,共有序列广谱pcr表现出较差的性能。许多研究已经表明,由于不平衡的引物杂交和共有引物退火,类型特异性方法比共有序列检
测方法检测到更多的hpv基因型。这种不均匀和有偏差的扩增增加了ngs中类型的不平衡测序,导致成本更高且结果不准确。测定设计的影响对于分析性能和临床性能至关重要,尤其是对于能够准确且均匀检测混合感染而没有任何类型抑制而言。
12.每种致癌基因型的致癌性存在明显差异。高风险hpv中的一些基因型比其他基因型更具致癌性。因此,扩展的基因分型对于患者管理和分类很重要。许多临床验证的hpv筛查测试要么不提供基因型,要么提供部分基因型,主要仅提供两种类型:hpv-16和hpv-18。许多研究报告称,其他类型的知识对于患者管理和hpv阳性女性的分类具有重要的临床价值。例如,研究表明,hpv-31和hpv-33在10年期间具有与hpv18相同或更高的纵向风险(cuzick j,papillomavirus res.2016 dec;2:112-115)。其他具有显著致癌性和临床相关性的hpv类型是hpv-31、33、45、52和58(joura,cancer epidemiol biomarkers prev.2014 oct;23(10))。显然,扩展的基因分型可以对女性患癌前病变和癌症的风险进行分层,并允许对具有可比风险的hpv基因型进行分类,从而改善风险分层和临床管理。此外,类型特异性检测是一种更准确的方法,因为它消除了由共有序列简并pcr方法引起的类型抑制现象。
13.hpv是宫颈癌的病原体,但暂时性感染的高流行率并不容易鉴别出发展宫颈癌的风险较高的女性。病毒载量已被认为是非暂时性感染标志物,其中细胞学正常的高hpv载量已被证明与发展发育不良和原位癌(carcinoma in situ,cis)的风险相关。在一些将特定的高风险hpv与癌前病变和癌症相关联的研究中,已经报道了hpv病毒载量与持续感染和癌前病变风险之间的密切关联。许多科学报告表明,病毒载量与宫颈癌的严重程度、进展和发展之间存在关联,这表明,hpv dna的量与病变严重性成比例地增加,甚至可以在宫颈病变发展之前检测到。
14.另一方面,hpv病毒载量是浸润性癌的类型依赖性风险标志物。在调查hpv-16病毒载量与持续感染和进展为癌前病变和癌症的关系的研究中,(fu lf et al j infect dis.2011 may 15;203(10):1425-33)据报道,新检测到的感染的病毒载量以及病毒载量的变化预测hpv-16感染的持续性和进展,表明新检测到的hpv-16感染的病毒载量与从暂时性感染到快速进展为cin3的感染后果相关。在患有持续性hpv-16感染的那些人中,病毒载量的变化反映了后续和/或潜在的癌前病变风险。此外,已证明hpv病毒载量测量是感染清除的预测指标(trevisan a et al,j gen virol.2013 aug;94(pt 8):1850-7)。尽管由于技术的限制,并没有对所有类型的全面研究,但为了评估风险,hpv感染过程中病毒载量的纵向研究可能是监测癌症进展的有用方法。hpv载量提供了有关癌前病变和癌症后续发展风险的信息,但进展程度与hpv类型密切相关(moberg m et al,br j cancer.2005 mar 14;92(5):891-4)。病毒载量的定量允许临床灵敏性和特异性之间实现最佳平衡,以检测癌前病变或宫颈癌,这进而最大限度地减少对没有宫颈病变的高风险hpv阳性女性的过度治疗和不必要的随访程序。因此,需要准确检测、鉴定和测量所有类型的病毒载量,以允许研究病毒载量及其与癌前病变和癌症相关性的筛查方法。
15.及时筛查和检测可通过适当的预防和治疗来最大限度地减少sti的健康负担和经济负担。仍然需要以快速、准确和具有成本效益的方式检测、鉴定和定量广谱hpv和sti的临床方法。此外,筛查方法应涉及简单的工作流程并易于自动化。
技术实现要素:
16.在一些实施方案中,本公开描述了扩增核酸样品中hpv基因组和sti的选择性靶区域的方法和组合物。在一些实施方案中,该方法包括以下步骤:1)在pcr反应中,在带条形码的通用引物存在的情况下,使核酸样品与靶特异性引物接触;2)允许引物延伸以生成不同大小的靶扩增产物(扩增子)。在一些实施方案中,该方法包括确定是否存在靶扩增产物的步骤。在一些实施方案中,该方法包括建立靶扩增产物的序列的步骤。在一些实施方案中,小于50、40、30、20、10、5、0.5或0.1%的扩增产物是引物二聚体或伪影。
17.在一些实施方案中,每种靶特异性引物的浓度可以是约500、250、100、80、70、50、30、10、2或1nm。在一些实施方案中,靶特异性引物的gc含量可以不同,并且作为实例,它可以在40%和70%之间,或在30%和60%之间或在50%和80%之间。在一些实施方案中,靶特异性引物的解链温度(tm)可以在55℃和65℃之间,或在40℃和70℃之间,或在55℃和68℃之间。在一些实施方案中,靶特异性引物的长度可以在20和90个碱基之间、在40和70个碱基之间、在20和40个碱基之间或在25和50个碱基之间。在一些实施方案中,靶特异性引物的5'-区域是与样品中的任何核酸区域不互补或对其不具有特异性的通用引物结合位点。在一些实施方案中,靶扩增子的长度在50和500个碱基之间、在90和350个碱基之间或在200和450个碱基之间。
18.在本公开任何方面的各种实施方案中,引物延伸的方法基于最先进的聚合酶链反应(pcr)。在各种实施实施方案中,退火时间可以大于0.5、1、2、5、8、10或15分钟。在各种实施实施方案中,延伸时间可以大于0.5、1、2、5、8、10或15分钟。
19.hpv的高病毒载量可以预测癌前病变和宫颈癌的风险。在一些实施方案中,本文公开的方法定量样品中存在的各个类型和每一类型的拷贝数和病毒载量。在另一个实施方案中,在不同时间间隔重复检测阳性hpv样品可以指示基于拷贝数或病毒载量的病毒持续性或清除。
20.在本公开的各种实施方案中,根据以下不同因素计算所选引物的相容性和非相容性得分:靶扩增子gc含量、靶扩增子解链温度、靶扩增子杂合率、靶区域候选引物的互补率等;候选引物大小、靶扩增子大小以及扩增效率和脱靶率。所选的靶特异性引物可以与核酸靶标杂交并选择性扩增靶区域。在各种实施方案中,测试样品来自疑似患有感染或疾病或具有增加的感染或疾病风险的受试者或个体;并且其中一个或多个靶核酸在靶区域包含与感染或疾病或增加的感染或疾病风险相关的序列。在一些实施方案中,关于检测到的与疾病相关的感染类型或种类的信息可用于疾病管理。
21.在一个实施方案中,本文公开的方法可用于检测样品中的hpv和sti。在一些实施方案中,候选引物接触核酸样品;其中正向链和反向链靶特异性引物与靶区域(如果样品中存在)杂交,其中核酸样品可具有hpv和sti或疑似具有hpv和sti,扩增多个靶核酸(如果存在感染);对扩增子进行下一代测序;并通过软件算法分析序列数据。在一些实施方案中,检测到的感染可以是临床上可操作的。在一些实施方案中,检测到的感染可能与耐药性相关。在一些实施方案中,hpv和sti的检测、鉴定和定量可以与疾病、癌前病变或癌症相关。在一些实施方案中,可以针对癌症筛查生物样品。在一些实施方案中,来自患病或健康受试者的生物样品可以是全基因组dna或福尔马林固定石蜡包埋组织(ffpe)。
22.一方面,本文公开的方法和组合物经设计检测、鉴定和定量可能含有hpv或sti的
样品中的靶核酸。在一些实施方案中,所公开的方法包括以下步骤:1)使样品中的核酸靶标与引物接触,其中正向链和反向链靶特异性引物与测试反应中的不同靶区域杂交;2)在最佳扩增条件下扩增靶核酸,以确定存在或不存在hpv和sti;3)通过ngs对扩增产物进行测序;和4)通过定位和计数算法分析和定量测量生成的序列读段。
23.在一些实施方案中,核酸样品包含基因组dna。在一些实施方案中,样品包含从尿液、组织、唾液、活检、痰、拭子、手术切除、宫颈拭子、肿瘤组织、细针吸取(fna)、刮屑、拭子、粘液、精液、其他非限制性临床或实验室获得样品的核酸分子。
24.在另一方面,本公开涉及包含用于扩增样品的感兴趣的靶区域的靶特异性引物的试剂盒。
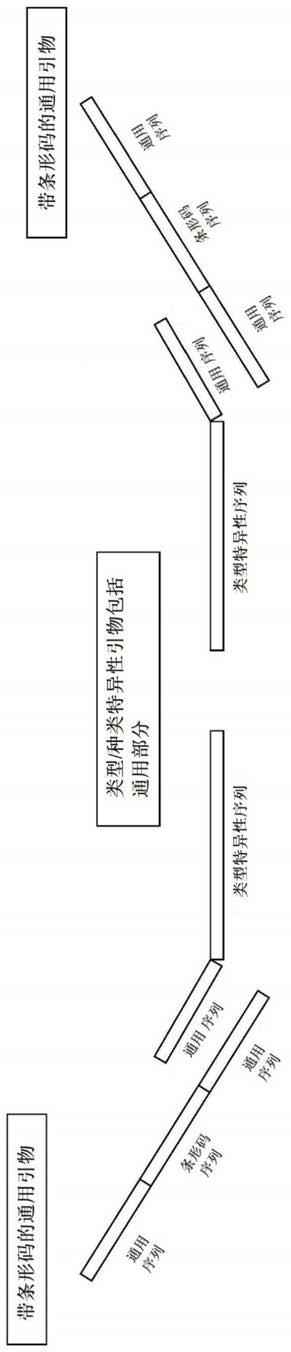
25.在一些实施方案中,所公开的方法包括以下步骤:进行一步多重pcr;并通过ngs对所得的扩增子进行测序。在一些实施方案中,该方法进一步包括定量每一类型或种类的拷贝数的步骤,从而允许最大的类型灵敏性和最小测序读段。在某些实施方案中,从患有多重共感染的受试者获得样品。在一些实施方案中,该方法的分析灵敏度对于样品中的每一病毒或种类为20个拷贝;高度多重pcr检测27种hpv和13种sti,同时具有最小化的引物-引物相互作用。在一些实施方案中,该方法包括进行单一反应、单一步骤多重pcr的步骤。该方法具有简单的工作流程,并且单次ngs测序运行可以对高达数万个样本进行测序。
26.在一些实施方案中,所公开的方法包括在反应测试中对每份样品使用两个内部对照,其中第一内部对照是持家基因,其监测扩增,并充当归一化和定性对照,并且其中第二内部对照是多态基因,包含对每个个体独特的序列,作为交叉污染对照。在一些实施方案中,hpv和sti测试反应包括每份样品的两个内部对照。在一些实施方案中,hpv和sti测试反应包含用于扩增两个内部对照的引物。
27.在一些实施方案中,本公开涉及用于在诸如下一代测序等下游分析之前应用hpv和sti的多重靶扩增和靶富集的方法、组合物和试剂盒。该方法依赖于在疑似具有hpv和sti的dna样品中使用多种靶特异性引物和靶富集扩增。hpv-sti靶特异性引物在扩增试剂例如聚合酶和dntp存在的情况下在最佳条件下扩增靶核酸,以至少扩增一种或多种感兴趣的核酸靶标。
28.在一些实施方案中,本公开涉及包含多种靶特异性引物的组合物,所述引物接触样品中的hpv、sti和内部对照的靶序列并具有下文提及的一种或多种(非限制性)hpv和sti的互补序列:高风险hpv-16、18、31、33、35、39、45、51、52、56、58、59、66、68a、68b、26、53、82和低风险hpv-6、11、40、42、43、44、55、61、81、83和沙眼衣原体(chlamydia trachomatis,ct)、梅毒螺旋体(treponema pallidum,tp)、生殖支原体(mycoplasma genitalium,mg)、阴道毛滴虫(trichomonas vaginalis,tv)、淋病奈瑟菌(neisseria gonorrhoeae,ng)、单纯疱疹病毒1型(hsv-1)、单纯疱疹病毒2型(hsv-2)、人型支原体(mycoplasma hominis,mh)、解脲脲原体(ureaplasma urealyticum,uu)、细小脲原体(ureaplasma parvum,up)、水痘-带状疱疹病毒(varicellazoster virus,vzv)、杜克雷嗜血杆菌(haemophilus ducreyi,hd)、性病性淋巴肉芽肿(lymphogranuloma venereum,lgv)。
29.在所公开方法的一些实施方案中,引物设计算法基于以下步骤选择候选靶特异性引物:1)提取每个靶向变体位置周围的基因组序列;2)针对靶序列中的每个变体,设计具有适当gc含量、tm以及距每个靶向区域不同距离的靶特异性正向链和反向链靶特异性引物;
3)对于每个引物,搜索靶基因组序列的脱靶匹配;过滤引物并保留那些通过脱靶阈值的引物;4)搜索每个引物3'-末端部分中与该组引物序列的互补匹配;逐步过滤引物,其中首先去除3'-末端具有最多互补匹配的引物;5)合成引物并使用下一代测序运行整个湿实验室实验;校准每个引物的性能并过滤掉具有不期望性能的引物。在一些实施方案中,重复引物选择程序步骤2-4和步骤2-5,直到每个靶变体被引物组中的至少一个正向链靶特异性引物和至少一个反向链靶特异性引物覆盖。
30.在本公开任何方面的各种实施方案中,该方法和组合物的特征在于hpv、sti和内部对照靶核酸区域的多重扩增和靶富集。在一些实施方案中,所公开的方法包括以下步骤:1)在带条形码的通用引物存在的情况下使靶特异性引物与靶核酸序列接触,并与样品中的靶核酸序列杂交;2)在最佳扩增条件下,对测试反应进行扩增;3)将每个个体样品的扩增产物汇集在一起;4)对一部分汇集的扩增产物进行珠净化,以去除未消耗的引物和引物二聚体并产生富集的扩增产物;5)对一部分富集的扩增产物进行标准归一化和定量;以及6)通过下一代测序对扩增子进行测序。
31.在一个实施方案中,带条形码的通用引物包含:a)3'末端的通用引发部分;b)中间的条形码部分;c)5'末端的通用引发部分(图1)。在一个实施方案中,每个靶特异性引物都包含针对靶核酸序列的特异性序列部分和通用引发部分。
32.在一些实施方案中,组合物包含多种靶特异性引物,其中至少一种靶特异性引物与任一种核酸靶标至少90%相同。在一些实施方案中,组合物包含多种靶特异性引物,所述引物具有与样品中的核酸靶标的至少91%、92%、93%、94%、95%、96%、97%、98%或99%的序列同一性。
33.在一些实施方案中,本公开涉及包含多种靶特异性引物的组合物,其中与感兴趣的靶核酸互补的序列的长度为约15-40个碱基。
34.在一些实施方案中,本公开涉及预先计算设计的靶引物的组合物,所述靶引物与组合物中的其他靶特异性引物生成最小交叉杂交或引物-引物相互作用。在一些实施方案中,组合物中的引物被设计为避免可导致非特异性扩增的非特异性引发。在一些实施方案中,可以调整扩增条件,例如退火温度、退火持续时间和引物浓度,以最小化扩增伪影,例如引物二聚体。
35.在一些实施方案中,本公开涉及包含多种与样品中存在的非特异性序列具有最小交叉杂交的靶特异性引物的方法或组合物。在一些实施方案中,这种与非特异性靶标的交叉杂交可以通过诸如下一代测序等下游分析来监测和评估。
36.在一些实施方案中,本公开涉及包含多种具有最小自互补结构的靶引物的方法或组合物。在一些实施方案中,组合物包含至少一种不形成诸如发夹或环等二级结构的靶特异性引物。在一些实施方案中,组合物包含多种靶特异性引物,其中大部分或可能所有靶特异性引物不形成二级结构,例如发夹和环。
37.在一些实施方案中,从来自受试者的生物样品获得靶核酸。在一些实施方案中,样品包含蛋白质、细胞、流体、生物流体、防腐剂和/或其他物质。在某些实施方案中,样品包括尿液、组织、唾液、活检、痰、颊拭子、福尔马林固定石蜡包埋材料(ffpe)、宫颈拭子、宫颈刷、肿瘤组织和细针吸取(fna)和宫颈活检。
38.在一些实施方案中,通过在当前最先进的下一代测序技术或平台上进行下一代测
序,对靶扩增产物测序,所述下一代测序技术或平台例如illumina平台(可逆染料终止子测序)、454焦磷酸测序、离子半导体测序(ion torrent)、pacbio smrt测序、qiagen genereader测序技术和牛津纳米孔测序。在一些实施方案中,所公开的方法不限于这些下一代测序技术实例,并且可以应用于新的测序创新。
39.在某些实施方案中,可以在多个时间点进行前述方法。
附图说明
40.参考以下附图可以更好地理解本公开。附图的元素不一定相对于彼此成比例,而是重点放在清楚地说明本公开的原理上。此外,贯穿多个视图,相同的附图标记表示相应的部件。
41.图1描绘了类型/种类特异性引物和带条形码的通用引物的图示。
42.图2描绘了单一pcr测试反应的引物组分的图示,其包括:1)类型/种类特异性引物对(27个hpv引物对和13个sti引物对);2)带条形码的通用引物,其包含3'末端的通用序列部分、中间的条形码序列和5'末端的通用序列部分;3)持家引物对;4)多态基因引物对。
43.图3说明了hpv-sti测定的工作流程。
44.图4描绘了该方法的图示。
45.图5显示了染色的琼脂糖凝胶的图像。条带显示汇集在一起并在凝胶电泳上运行的所有样品。扩增子带包含内部对照以及hpv和sti扩增。条带用箭头表示。
46.图6显示了实施例1的表格,其中对不同浓度的不同质粒(单一和混合物)进行了测序。数字表示拷贝数,将其标准化以使gapdh数为10,000。
47.图7显示了实施例2的表格,其中已经对hpv和sti阳性样品进行了测序。数字表示拷贝数,将其标准化以使gapdh数为10,000。
具体实施方式
48.本公开涉及用于在单一多重扩增步骤中检测、鉴定和定量27种hpv和13种sti的方法和组合物。某些hpv基因型的定量可作为癌症前期和癌症的预测指标,而sti可作为临床标本中性传播疾病(std)的预测指标。所公开的方法利用ngs对扩增产物进行序列分析。本公开还公开了试剂盒、系统和软件。以下实例、应用、描述和内容是示例性和解释性的,并且无论如何都是非限制性(non-limiting)和非限制的(non-restrictive)。
49.为含有宿主dna和病毒/种类dna的样品开发具有准确和高拷贝数灵敏性的高度多重pcr仍然是本领域的挑战。本公开涉及基于ngs的测定,其将病毒/种类dna的平衡类型特异性多重扩增和灵敏的拷贝数定量以及每种类型/种类的平衡测序读段相结合。所公开的测定还包括两个内部对照的独特特征。第一内部对照是检查扩增同时用于定量病毒载量或类型/种类拷贝数的人持家基因。第二内部对照是含有每个个体的独特序列、监测交叉污染的人多态基因。第二对照可以准确地监测微量污染,并作为pcr污染预防测量。
50.本文使用的所有科学术语与本领域普通技术人员常用和理解的含义相同。实例、材料、方法、图和表仅是说明性的而非意图限制。
51.如本文所用,“扩增条件”是指适合使用聚合酶链反应进行扩增的条件。聚合酶链反应可以是多重pcr。扩增条件包括但不限于本文公开的实施例1和2提供的实例。
52.如本文所用,“带条形码的通用引物”是指包含条形码序列和至少一个通用序列的通用引物。参见例如图1。
53.如本文所用,“珠净化”是指使用基于珠子的纯化,其中珠子配置为结合一种或多种靶标。如本领域技术人员所知,珠净化可以使用正选择(即,珠子配置为捕获感兴趣的靶标)或负选择(即,珠子配置为不捕获感兴趣的靶标)。可以使用多种,如本领域已知的,例如链霉亲和素珠或磁珠。珠子的一个实例是spri珠,如本文实施例1和2所公开的。
54.如本文所用,“相容性得分”是指基于下述不同因素计算的潜在正向链靶特异性引物或反向链靶特异性引物的得分:靶扩增子gc含量、靶扩增子解链温度、靶扩增子杂合率、靶区域候选引物的互补率;候选引物大小、靶扩增子大小、引物-引物相互作用以及扩增效率和脱靶率。
55.如本文所用,“ct”是指沙眼衣原体。
56.如本文所用,“dsdna”是指双链dna。
57.如本文所用,“ffpe”是指福尔马林固定石蜡包埋的。
58.如本文所用,“fna”是指细针吸取。
59.如本文所用,“正向链”是指dsdna样品的一条链。
60.如本文所用,“正向链靶特异性引物”是指配置为结合正向链上的靶序列的引物。
61.如本文所用,“gc含量”是指鸟嘌呤-胞嘧啶含量。
62.如本文所用,“hpv”是指人乳头瘤病毒。
63.如本文所用,“hsv1和hsv2”是指单纯疱疹1和2。
64.如本文所用,“mg”是指生殖支原体。
65.如本文所用,“mh”是指人型支原体。
66.如本文所用,“ng”是指淋病奈瑟菌。
67.如本文所用,“ngs”是指下一代测序。
68.如本文所用,“pcr”是指聚合酶链反应。
69.如本文所用,“反向链”是指dsdna样品的与正向链互补的第二条链。
70.如本文所用,“反向链靶特异性引物”是指配置为结合反向链上的靶序列的引物。
71.如本文所用,“种类特异性引物”是指配置为结合对具体种类具有特异性的靶标的引物。
72.如本文所用,“靶特异性引物”是指配置为结合具体靶标的引物。在一些实施方案中,靶特异性引物可以是类型特异性引物。在一些实施方案中,靶特异性引物可以是种类特异性引物。
73.如本文所用,“类型特异性引物”是指配置为结合对具体hpv基因型具有特异性的靶标的引物。
74.如本文所用,“通用序列”是指配置为被通用序列引物靶向的序列。
75.如本文所用,“up”是指细小脲原体。
76.本公开描述了用于扩增和富集具体和已知序列的hpv和sti靶标以确定核苷酸序列的方法、组合物和试剂盒。以下实例、应用、描述和内容是示例性和解释性的,并且无论如何都是非限制性和非限制的。
77.本公开涉及选择性扩增27种hpv、13种sti和两个内部对照,然后用ngs进行检测、
鉴定和定量。该测定可检测以下hpv类型和sti种类:高风险hpv-16、18、31、33、35、39、45、51、52、56、58、59、66、68a、68b 26、53、82和低风险hpv-6、11、40、42、43、44、55、61、81、83和沙眼衣原体(ct)、梅毒螺旋体(tp)、生殖支原体(mg)、阴道毛滴虫(tv)、淋病奈瑟菌(ng)、单纯疱疹病毒1型(hsv-1)、单纯疱疹病毒2型(hsv-2)、人型支原体(mh)、解脲脲原体(uu)、细小脲原体(up)、水痘-带状疱疹病毒(vzv)、杜克雷嗜血杆菌(hd)、性病性淋巴肉芽肿(lgv)。
78.所公开的方法提供了许多独特地组合在一起的优点,包括但不限于:1)单一反应pcr;2)一轮高度多重pcr,覆盖范围广泛的hpv和sti;3)双重索引条形码化(每个扩增子两端都有条形码),以最大限度地减少交叉污染;4)类型/种类特异性扩增,允许对所有hpv和sti进行均匀扩增;5)样品中每个个别类型/种类的定量,这对疾病管理具有临床价值;6)人持家基因作为每个测试反应中每份样品的内部对照,以监测扩增并作为定量的归一化因子;7)人多态基因,作为每个测试反应中每份样品的内部对照,以监测交叉污染;8)所有类型和种类的扩展分型,这对监测感染、疾病和癌症的治疗和预防具有临床意义;9)适合高通量规模,其中在一单一测序运行中,可以对高达数万份样品进行测序;10)该方法可同时用于筛查、检测、鉴定、分型以及流行病学研究和调查;以及11)快速、简单和容易的自动化。参见例如图2。
79.宫颈癌筛查的主要思想是检测癌前病变和癌症,而不是暂时性hpv感染,这可能会导致高昂的过度治疗和不必要的随访、治疗和医疗程序。所有阴道镜检查程序约有90%是过度治疗。对每种hpv类型进行定量并确定病毒载量,允许检测处于发展癌症风险较高的个体。
80.本文描述了通过ngs分析的hpv、sti和内部对照的多重扩增和靶富集方法。在本公开任何方面的各种实施方案中,方法和组合物的特征在于靶核酸区域hpv、sti和内部对照的多重扩增和靶富集。在一些实施方案中,所公开的方法包括以下步骤:1)在带条形码的通用引物存在的情况下,使靶特异性引物与靶核酸序列接触并与样品中的靶核酸序列杂交;2)在最佳扩增条件下对测试反应进行扩增;3)将每个个体或受试者样品的扩增产物汇集在一起;4)对一部分汇集的扩增产物进行珠净化,以去除可能未消耗的引物和引物二聚体以产生富集的扩增产物;5)对一部分富集的扩增产物进行标准归一化和定量;以及6)通过下一代测序对扩增子进行测序。参见例如图3-4。
81.在一个实施方案中,带条形码的通用引物包含:a)3'末端的通用引发部分;b)中间的条形码部分;c)5'末端的通用引发部分(图1)。在一个实施方案中,每个靶特异性引物都包含针对靶核酸序列的特异性序列部分和通用引发部分。
82.在一些实施方案中,本公开提供了在单一反应容器中检测一种以上hpv和sti株/类型/种类的方法、组合物和试剂盒。
83.在一些实施方案中,所公开的方法针对每个受试者在一个单一测试反应中利用一轮多重pcr,这使工作流程中的dna交叉污染和额外步骤最小化。通常,使用一轮以上pcr的方法容易受到dna交叉污染的损害,导致结果准确。
84.在一些实施方案中,所公开的方法包括在每个测试反应中针对每个受试者样品的临床相关hpv、sti和两个内部对照(扩增/定量对照和交叉污染对照)使用多种类型/种类特异性引物。参见例如图5。在一些实施方案中,所公开的方法是高度多重hpv-sti检测组,在单一反应和一轮pcr中覆盖前所未有且无与伦比的广范围hpv和sti。在一些实施方案中,多
重类型/种类特异性扩增允许每一类型或种类的显著更平衡和均匀的扩增,特别是当样品含有多重共感染时,而无需担心类型抑制。
85.在一些实施方案中,所公开的方法包括在每个测试反应中使用持家基因作为每个受试者的内部对照,内部对照检查扩增,并在每个测试反应中用作定量每份样品的每一类型/种类的病毒载量或拷贝数的归一化因子。在一些实施方案中,该方法可以在一个测试反应中定量多重共感染样品中的多种类型或种类。在一些实施方案中,每一类型/种类拷贝数或病毒载量的定量对于癌前病变、癌症和疾病的检测可具有临床价值。在一些实施方案中,每一类型/种类拷贝数或病毒载量的定量对于治疗、随访和必要的医疗程序可具有临床意义。
86.在一些实施方案中,所公开的方法包括在每个测试反应中使用多态基因作为每个受试者的内部对照,内部对照在每个测试反应中检查和监测每份样品中的交叉污染。在一些实施方案中,多态基因的序列对于每个人类受试者是独特的,并且除了受试者的多态基因序列之外存在其他多态基因序列表明交叉污染。
87.在一些实施方案中,所公开的方法包括使用双重条形码化索引,其中扩增子通过两端带条形码的通用引物进行条形码化,从而最小化交叉污染,以及在早期pcr扩增错误的情况下对条形码进行双重确认。
88.在一些实施方案中,所公开的方法包括使用下一代测序来检测、鉴定和定量hpv和sti。在某些实施方案中,对靶dna序列进行扩增和测序以揭示样品中存在的株、hpv类型或种类。
89.在一些实施方案中,将诸如循环数、退火温度、退火持续时间、延伸温度和延伸持续时间等扩增条件调整为最佳扩增条件。在一些实施方案中,基于商业dna聚合酶使用说明,将循环数,例如退火温度、退火持续时间、延伸温度和延伸持续时间的扩增条件调整至最佳扩增条件。
90.在一些实施方案中,核酸样品包含基因组dna。在另一个实施方案中,样品包含通过细胞刷从子宫颈获得的核酸分子。在另一个实施方案中,样品可以是自采样样本。在另一个实施方案中,样品包含从肛门拭子或刷子获得的核酸分子。在另一个实施方案中,样品包含从ffpe或存档的dna样品获得的核酸分子。在一些实施方案中,样品包含从唾液获得的核酸分子。在一些实施方案中,样品包含从尿液、组织、唾液、活检、痰、拭子、福尔马林固定石蜡包埋材料(ffpe)、手术切除、宫颈拭子、肿瘤组织、细针吸取(fna)、刮屑、拭子、粘液、尿液、精液和其他非限制性临床或实验室获得的样品获得的核酸分子。
91.在一些实施方案中,获得的核酸样品可以来自动物,例如人或哺乳动物受试者。在另一个实施方案中,获得的核酸样品可以来自非哺乳动物受试者,例如细菌、病毒、真菌和植物。
92.在一些实施方案中,本公开涉及来自正常或患病受试者的生物样品的至少一种靶序列的靶扩增。在一些实施方案中,本公开涉及至少一种靶序列的特异性和选择性靶扩增和核酸生物样品中可引起疾病的hpv和sti的检测和鉴定。在一些实施方案中,检测的hpv或sti可以是临床上可操作的感染。在一些实施方案中,可以针对性传播疾病(std)、癌前病变和癌症筛查生物样品。
93.在一些实施方案中,靶特异性引物包含多种设计为选择性扩增hpv和sti靶核酸序
列的引物;扩增范围因片段大小和引物在核酸片段上的位置而异,并且大小可以在该范围内变化。在一些实施方案中,靶特异性引物包含多种选择性地设计为扩增靶核酸序列的引物,其中扩增的靶核酸序列可以在长度上彼此不同,长度变化不超过90%、不超过70%、不超过50%、不超过25%或不超过10%。
94.在一些实施方案中,所公开的方法涉及通过多重靶特异性聚合酶链反应(pcr)进行靶标富集,其包括以下步骤:在带条形码的通用引物和诸如dna聚合酶、dntp、反应缓冲液等pcr试剂存在的情况下,使核酸靶标与多种靶特异性引物接触;给予变性、退火和延伸的最佳温度和时间条件的情况下,引物与互补的靶核酸序列杂交并延伸。在一些实施方案中,可以以任何顺序进行扩增步骤。在一些实施方案中,可以在优化用于下游过程的最佳多重靶扩增后,添加或去除扩增步骤、纯化步骤和净化步骤。
95.在一些实施方案中,所述方法使用聚合酶链反应(pcr)和dna聚合酶作为反应组分之一。在一些实施方案中,有多种dna聚合酶可供选择,其特征在于不同的特性,例如热稳定性、保真度、进行性和热启动(hot start)。取决于应用,该方法可以使用具有这些特征中的一种或多种的dna聚合酶。在一些实施方案中,用于多重pcr的dna聚合酶的浓度可以高于单重pcr(single-plex pcr)。
96.在一些实施方案中,本文公开的方法使用多重聚合酶链反应扩增靶核酸序列,其中在测试反应中扩增一种以上的靶序列。在一些实施方案中,多重扩增所需的核酸样品的量可以为约1ng。在一些实施方案中,核酸材料的量可以为约5ng、10ng、50ng、100ng或200ng。
97.在一些实施方案中,本文公开的方法使用多重聚合酶链反应扩增靶核酸序列,其中在测试反应中扩增一种以上的靶序列。在热循环仪上进行最先进的聚合酶链反应,每个pcr循环都包括变性、退火和延伸。每个pcr循环都包括至少一个变性步骤、一个退火步骤和用于核酸延伸的一个延伸步骤。在一些实施方案中,退火和延伸可以合并。在一些实施方案中,本文公开的方法包括25-35个pcr循环。每个循环或每组循环可以具有不同的持续时间和温度,例如,退火步骤的温度和持续时间可以递增和递减,或者延伸步骤的温度和持续时间可以递增和递减。在一些实施方案中,持续时间可以以5秒、10秒、30秒、1分钟、2分钟、4分钟、8分钟或更大的增量减少或增加。在一些实施方案中,温度可以以0.5、1、2、4、8或10摄氏度的增量降低或升高。
98.在本公开的一些实施方案中,靶特异性引物包含在3'-末端或5'-末端或在整个序列中的核苷酸修饰。在一些实施方案中,引物的靶特异性部分的长度可以是15-40个碱基。在一些实施方案中,每种靶特异性引物的tm可以为约55℃至约72℃。
99.在一些实施方案中,本公开的特征在于,使用靶特异性引物的靶特异性核酸扩增hpv和sti的靶富集和多重扩增方法。在一些实施方案中,所选的靶特异性引物接触可能与疾病相关的靶核酸序列并与其杂交。在一些实施方案中,疾病可以是std、癌前病变或癌症。在一个实施方案中,靶特异性引物在测试反应中与具有不同大小的核酸序列杂交。在一些实施方案中,扩增子大小选择可用于对一定长度范围的扩增产物进行测序。在一些实施方案中,长度范围为100-250个碱基对的扩增子可以是序列。在一些实施方案中,可以对150-300个碱基对范围的扩增子或120-350个碱基对范围的扩增子或200-500个碱基对范围或更大长度范围的扩增子进行测序。
100.在一些实施方案中,可以去除或可以重复任何程序。在一些实施方案中,可以添加纯化步骤以生成最佳结果。这些程序是非限制性的,并且本领域技术人员可以容易地添加、移除或重复这些步骤以获得最佳结果。
101.在多重pcr中增加靶特异性引物数量的能力允许同时扩增大量核酸靶标,同时减少输入dna的量、劳动力和时间。当起始输入核酸材料的量有限时,这尤其有利。
102.在所公开方法的一些实施方案中,引物设计算法基于下述逐步程序选择候选靶特异性引物:1)提取每个靶向变体位置周围的基因组序列;2)针对靶序列中的每个变体,设计具有适当gc含量、tm以及距每个靶向变体不同距离的靶特异性正向链和反向链靶特异性引物;3)对于每个引物,搜索靶基因组序列的脱靶匹配;过滤引物并保留那些通过脱靶阈值的引物;4)搜索每个引物3'-末端部分与该组引物序列的互补匹配;逐步过滤引物,其中首先去除3’末端具有最多互补匹配的引物;5)合成引物并运行包括下一代测序的整个湿实验室实验;校准每个引物的性能并过滤掉具有不期望性能的引物。在一些实施方案中,重复引物选择程序步骤2-4和步骤2-5,直到每个靶变体被引物组中的至少一个正向链靶特异性引物和一个反向链靶特异性引物覆盖。
103.在一些实施方案中,本公开的特征在于引物设计算法,该算法消除了在高度多重pcr中形成抑制有效扩增的伪影例如引物二聚体的低相容性引物。这种消除系统去除非生产性伪影例如引物二聚体,或使之显著最小化。除了下游过程例如高通量测序外,去除低相容性和有问题的引物显著提高了高度多重pcr的整体性能和效率。伪影和引物二聚体导致获得最佳序列结果方面的重大失败,并且很大一部分测序读数可能是非特异性的和无信息量的。
104.在一些实施方案中,引物选择算法的特征在于有关引物-引物相互作用和特异性靶核酸杂交的引物相容性得分,所述特异性靶核酸杂交没有非特异性引发或与脱靶区域杂交。候选靶特异性引物的较高相容性得分特征在于与靶核酸的特异性杂交,同时与引物组中其他引物的相互作用不存在或最小。去除不满足相容性得分的引物即高于最小阈值的引物。在所公开方法的各种实施方案中,针对该组中候选引物的至少80、90、95、98、99或99.5%的可能组合,计算相容性得分。根据许多参数,例如靶扩增子gc含量、靶扩增子解链温度、靶扩增子杂合率、靶区域候选引物的互补率;候选引物大小、靶扩增子大小和扩增效率,在引物选择中计算相容性得分。由于多个方面涉及决定相容性得分这一事实,因此基于多个参数计算平均得分,并且对于具体应用,平均值可能是可变的。引物选择算法会不断剔除低相容性引物,并重复剔除过程至等于或低于最小阈值,直到获得生成无引物二聚体或引物二聚体最少的高度多重靶扩增pcr的最佳选择引物组。
105.在一些实施方案中,引物选择算法的特征在于有关引物-引物相互作用和特异性靶核酸杂交而不与脱靶区域杂交的引物相容性得分。相容性得分低的引物,即高于最小阈值的引物,会被剔除。但是,如果在某些应用中对引物选择有限制,则可以将最小阈值提高到更高水平的第二阈值,以方便引物组的引物选择。在一些实施方案中,重复选择过程,直到选择的候选引物等于或低于第二水平的最小阈值。
106.在实施方案中,本文公开的方法的特征在于,通过利用接触靶hpv和sti核酸序列的靶特异性引物进行多重扩增和靶富集,其中可以通过调整不同参数,例如退火步骤的持续时间、增加或降低温度增量与循环次数相结合,减少或最小化引物二聚体。在一些实施方
案中,除了减少或最小化引物二聚体之外,可以降低引物浓度,并且可以增加退火温度和持续时间,以允许特异性扩增(引物具有更长的时间间隔与靶核酸杂交)。在一些实施方案中,引物的浓度可以是500nm、250nm、100nm、80nm、70nm、50nm、30nm、10nm、2nm、1nm或低于1nm。在一些实施方案中,退火温度可以是1分钟、3分钟、5分钟、8分钟、10分钟或更长。在一些实施方案中,退火时间较长的扩增使用1个循环、2个循环、3个循环、5个循环、8个循环、10个循环或更多循环,然后是标准退火持续时间。
107.一方面,所公开的方法包括扩增核酸样品中选择性hpv和sti靶区域的步骤。在一些实施方案中,该方法包括在测试反应中在带条形码的通用引物存在的情况下使核酸样品与靶特异性引物接触的步骤。在一些实施方案中,该方法包括确定存在或不存在靶扩增产物的步骤。在一些实施方案中,该方法包括确定扩增的靶产物的序列的步骤。在一些实施方案中,小于50、40、30、20、10、5、0.5或0.1%的扩增产物是引物二聚体或伪影。在一个实施方案中,可以存在一组以上的靶特异性引物,例如可以存在用于两个测试反应的两组靶特异性引物、用于3个测试反应的3组靶特异性引物或用于5个或更多测试反应的5组或更多组靶特异性引物。在一些实施方案中,出于实际原因,例如引物设计或选择的限制,也可以将样品分成使用多组靶特异性引物的多个平行多重测试反应。
108.在各种实施方案中,每种引物的浓度可以是500nm、250nm、100nm、80nm、70nm、50nm、30nm、10nm、2nm、1nm或低于1nm。在各种实施方案中,每种引物的引物浓度可以在1μm和1nm之间、1nm和80nm之间、1nm和100nm之间、10nm和50nm之间或1nm和60nm之间。在一些实施方案中,靶特异性引物的gc含量可以在40%和70%之间,或者在30%和60%之间,或者50%和80%之间,或者30%和80%之间。在一些实施方案中,引物gc含量范围可以小于20%、15%、10%或5%。在一些实施方案中,靶特异性引物的解链温度(tm)可以在55℃和65℃之间,或40℃和72℃之间,或50℃和68℃之间。在一些实施方案中,引物的解链温度范围可以小于20℃、15℃、10℃、5℃、2℃或1℃。在一些实施方案中,靶特异性引物的长度可以在20和90个碱基之间、40和70个碱基之间、20和40个碱基之间或25和50个碱基之间。在一些实施方案中,引物的长度范围可以是60、50、40、30、20、10或5个碱基。在一些实施方案中,靶特异性引物的5'-区域是与任何靶核酸区域均不互补或不特异的通用引发位点。
109.一方面,本公开涉及包含一组靶特异性引物的试剂盒;引物的设计和选择基于所描述的具有最小引物-引物相互作用或非特异性引发的标准。在另一个实施方案中,该试剂盒可以被配制用于诸如性传播疾病、癌前病变和癌症等疾病的检测、筛查、诊断、预后和治疗。
110.在一些实施方案中,所公开的方法包括以下步骤:1)在带条形码的通用引物存在的情况下,使靶特异性引物与靶核酸序列接触,并在测试反应中与每份样品中的靶核酸序列杂交;2)在最佳扩增条件下对测试反应进行扩增;3)将每份个体样品的扩增产物汇集在一起;4)对一部分汇集的扩增产物进行珠净化,以去除可能的引物二聚体以产生富集的扩增产物;5)对一部分富集的扩增产物进行标准归一化和定量;以及6)通过下一代测序对扩增子进行测序。该方法可以进一步包括额外的步骤,例如纯化。
111.一方面,高度多重pcr用于所公开的方法。在一些实施方案中,对于pcr,可以进行1-10个pcr循环;在一些实施方案中,可以进行1-15个循环或1-20个循环或1-25个循环或1-30个循环、1-35个循环或更多个循环。
112.在另一个实施方案中,所公开的方法在扩增两个以上的靶标时可以以多重方式使用,并且不限于任何数目的多重化。
113.在一些实施方案中,可以通过下一代测序平台对扩增产物进行测序。下一代测序是指可以对数百万到数十亿条dna链进行并行测序的非基于桑格的大规模并行dna核酸测序技术。当前最先进的下一代测序技术和平台的实例是illumina平台(可逆染料终止子测序)、454焦磷酸测序、离子半导体测序(ion torrent)、pacbio smrt测序、qiagen genereader测序技术和牛津纳米孔测序。本公开不限于这些下一代测序技术实例。
114.首先根据条形码序列用样品id(身份)标记序列读段。之后,将读段定位到靶参考序列。用高于预定义截止值的定位得分过滤序列读段和靶参考序列之间的那些比对。对于每个读段,仅保留具有最佳定位得分的比对,用于下游分析。定位到具体种类参考序列的序列读段计数用于接近样品中的拷贝数种类。为了比较不同样本之间的拷贝数,将所有读段计数都标准化为具有相同数量的内部对照基因gapdh的读段。此外,不同浓度的掺入标准对照,例如质粒,可以提供用于定量每个株/类型/种类的绝对拷贝数的标准曲线。
115.实施例1
116.不同hpv质粒类型混合物和浓度的分析
117.材料和方法
118.hpv质粒样品:hpv质粒来自who labnet国际精通hpv小组(international proficiency hpv panel)。从包括hpv-6、11、16、18、31、33、35、39、45、51、52、56、58、59、68a和68b型的组中选择了26份样品。根据评估检测的灵敏度和类型特异性的国际标准,样品要么是单一类型,要么是不同浓度的混合类型。hpv质粒单一类型和混合类型为每微升100和500个拷贝。
119.掺入人dna:在扩增之前,将2μl的每份hpv质粒样品与10ng人dna混合,用于定量。
120.扩增:在带条形码的通用引物存在的情况下,使用27种hpv、13种sti和两个内部对照靶特异性引物,使用hpv质粒dna、dna聚合酶、dntp和pcr缓冲液进行一步多重pcr。pcr扩增条件包括95℃起始2min,95℃ 30s、59℃ 2min、72℃ 1min 10个循环,95℃ 30s、68℃ 30s、72℃ 1min 5个循环,95℃ 30s、72℃ 1min 30s 15个循环,和最后72℃延伸10min。
121.样品制备和下一代测序:将所有26种扩增子汇集到一个试管中。然后根据制造商的说明,用spri珠(beckman coulter,ca,usa)纯化一部分样品。使用qubit 3测量纯化的样品浓度,并将浓度归一化,用于测序。使用illumina中通量测序试剂盒,使用illumina miniseq系统,对该文库进行测序。
122.结果:序列读段首先按条形码或id序列分组。将序列读段定位到靶参考序列,其中基于定位得分过滤序列读段和靶参考序列的比对。为了测量拷贝数,将所有读段计数归一化为具有相同数量的内部对照基因gapdh的读段。在这26份样品中,25份为hpv阳性且正确地基因分型和定量,1份样品为hpv阴性。结果与参考结果100%一致。检测限为20个拷贝数。
123.表1(图6)显示了已测序的具有不同浓度的不同质粒(单一和混合物)。数字表示拷贝数,其被归一化以使gapdh数目为10,000。
124.实施例2
125.临床样品中hpv和sti的检测、鉴定和定量
126.材料和方法
127.临床样品:已针对hpv测试过的149份dna样品用于所公开的方法。还没有检测样品是否存在sti。
128.dna提取:根据制造商的说明,通过qiagen小提dna试剂盒(qiagen,hilden,germany)提取dna。
129.hpv质粒对照:hpv质粒hpv-6、11、16、18、31、33、35、39、45、51、52、56、58、59和68用作阳性对照。在扩增之前,将2μl的每份hpv质粒样品与10ng人dna混合,用于定量。
130.扩增:在带条形码的通用引物、样品dna、dna聚合酶、dntp和pcr缓冲液存在的情况下,用27种hpv、13种sti和两种内部对照靶特异性引物,对175份样品和hpv质粒进行一步多重pcr。pcr扩增条件包括95℃起始2min,95℃ 30s、59℃ 2min、72℃ 1min 10个循环,95℃ 30s、68℃ 30s、72℃ 1min 5个循环,95℃ 30s、72℃ 1min 30s 15个循环,和最后72℃延伸10min。
131.样品制备和下一代测序:将所有175种扩增子和hpv质粒扩增子汇集到一个试管中。然后根据制造商的说明用spri珠(beckman coulter,ca,usa)纯化一部分样品。使用qubit 3测量纯化的样品的浓度,并将浓度归一化,用于测序。使用illumina中通量测序试剂盒,使用illumina miniseq系统,对该文库进行测序。
132.结果:序列读段首先按条形码或id序列分组。将序列读段定位到靶参考序列,其中基于定位得分过滤序列读段和靶参考序列的比对。为了测量拷贝数,将所有读段计数归一化为具有相同数量的内部对照基因gapdh的读段。所有hpv质粒都与结果一致。175份临床样品与之前的分型结果一致,但检测到更多基因型以及其他sti。仅测试了样品的hpv,未测试其他sti。一部分样品揭示存在其他sti。所有样品均根据其拷贝数进行定量。检测限为20个拷贝数。
133.表2(图7)显示了已测序的hpv和sti阳性样品。数字表示拷贝数,将其归一化以使gapdh数目为10,000。
134.本技术参考了各种出版物。这些出版物的公开内容在此通过引用整体并入本技术,以更全面地描述本技术所属领域的状态。对于在依赖于参考文献的句子中讨论的参考文献所含材料,所公开的参考文献还单独和特意通过引用并入本文。
135.本文所述的方法及其各种实施方案是示例性的。本文所述方法的各种其他实施方案是可能的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1