生物药物组合物和相关方法与流程
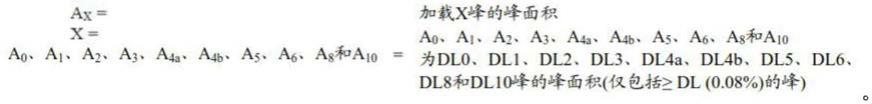
生物药物组合物和相关方法
1.序列表
2.本技术含有已经以ascii格式电子提交的序列表,并在此通过引用整体并入。
发明领域
3.本文所述的发明提供了包含抗bcma抗原结合蛋白的组合物和用于治疗bcma介导的疾病或病症的相关方法。
4.发明背景
5.bcma(cd269或tnfrsf17)是tnf受体超家族的成员。它是配体baff和april的非糖基化整合膜受体。bcma的配体还可以结合其他受体:taci(跨膜激活剂和钙调控剂和亲环蛋白配体相互作用物),其结合april和baff;以及baff-r(baff受体或br3),其显示对baff的限制性但高的亲和力。总之,这些受体及其相应的配体共同调节体液免疫、b细胞发育和体内稳态的不同方面。
6.bcma的表达通常仅限于b细胞谱系,并且据报道增加终末b细胞分化。bcma由人浆母细胞、来自扁桃体、脾和骨髓的浆细胞表达,但也由扁桃体记忆b细胞和生发中心b细胞表达,这些细胞具有taci-baffr低表型(darce et al.,2007)。bcma在初始和记忆b-25细胞中几乎不存在(novak et al.,2004a和b)。bcma抗原在细胞表面表达,因此可接近抗体,但也在高尔基体中表达。正如其表达谱所示,通常与b细胞存活和增殖有关的bcma信号传导在b细胞分化的晚期以及长寿骨髓浆细胞(o’connor et al.,2004)和浆母细胞(avery et al.,2003)的存活中很重要。此外,由于bcma以高亲和力结合april,表明bcma-april信号传导轴在b细胞分化的后期阶段占主导地位,这可能是生理上最相关的相互作用。
7.据报道,bcma表达(转录物和蛋白质)与各种b细胞病症,包括b细胞癌诸如多发性骨髓瘤(mm)的疾病进展相关。mm是克隆性b细胞恶性肿瘤,其在骨髓内的多个部位发生,然后扩散到循环;无论是从新,还是从意义未明的单克隆丙种球蛋白病(mgus)发展而来。其特征通常在于副蛋白和破骨细胞活性增加,以及高钙血症、血细胞减少、肾功能不全、高粘滞症和周围神经病变。正常抗体水平和中性粒细胞数量的降低也很常见,导致危及生命的感染易感性。bcma与体外骨髓瘤细胞系的生长和存活有关(novak et al.,2004和moreaux et al.,2004)。
技术实现要素:
8.组合物,其包含抗bcma抗体的异构化变体,其中所述异构化变体包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中该组合物包含≤25%的异构化变体。
9.组合物,其包含抗bcma抗体的氧化变体,其中所述氧化变体包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中该组合
物包含≤40%的氧化变体。
10.组合物,其包含抗bcma抗体,该抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,和具有seq id no:6中所列氨基酸序列的cdrl3;其中该组合物包含0.1-25%在cdrh3的d103处的异构化。
11.组合物,其包含抗bcma抗体,该抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,和具有seq id no:6中所列氨基酸序列的cdrl3;其中所述组合物包含0.1-40%在cdrh1的m34处的氧化。
12.组合物,其包含与seq id no:9的重链氨基酸序列和seq id no:10的轻链氨基酸序列至少约90%相同的抗bcma抗体,其中该组合物包含0.1-25%在cdrh3的d103处的异构化。
13.组合物,其包含与seq id no:9的重链氨基酸序列和seq id no:10的轻链氨基酸序列至少约90%相同的抗bcma抗体,其中该组合物包含0.1-40%在cdrh1的m34处的氧化。
14.组合物,其包含抗bcma抗体-药物-缀合物(adc),其中dl2百分比为至少约30%、约15%至约27%或约15%至约32%;dl4a百分比为至少约30%、约35%至约38%或约30%至约40%;dl4b百分比为至少约5%、约7%至约9%或约5%至约10%;dl6百分比为至少约10%、约14%至约20%或约10%至约20%;和/或dl8为至少约1%、约6.0%至约12.0%或约4%至约15%。
15.组合物,其包含抗bcma抗体-药物-缀合物(adc),其中dl0百分比小于或等于约10%或约5%。
16.附图简述
17.图1描绘了adc组合物内的dl种类的异质混合物的示意图代表。
18.图2描绘了用于测定adc组合物中的dar分布的代表性hic峰表征。
19.图3显示了adc组合物的平均dar对异种移植模型中肿瘤体积的影响。
20.图4描绘了贝兰他单抗的代表性cief电泳图。
21.发明详述
22.本文所述的发明提供了包含抗bcma抗原结合蛋白的组合物和用于治疗bcma介导的疾病或病症的相关方法。应当理解,如本文所述的包含抗bcma抗体的组合物也可以称为如本文所述的抗bcma抗体群:这些短语是可互换的。
23.抗bcma抗原结合蛋白
24.本文所述组合物中的抗bcma抗原结合蛋白可以用于治疗或预防各种bcma介导的疾病,包括例如b细胞介导的癌症,诸如淋巴瘤和多发性骨髓瘤。本文所述的抗bcma抗原结合蛋白可以结合人bcma,例如,含有genbank登录号q02223.2的氨基酸序列的人bcma,或编码对此具有至少百分之90同源性或至少百分之90同一性的人bcma的基因。
25.如本文所用,术语“抗原结合蛋白”是指抗体、抗体片段和其他能够结合bcma例如人bcma的蛋白质构建体。本发明的抗原结合蛋白可以包含本发明的重链可变区和轻链可变
区,其可以格式化成天然抗体或其功能片段或等同物的结构。因此,当与适当的轻链配对时,本发明的抗原结合蛋白可以包含格式化为全长抗体、(fab’)2片段、fab片段或其等同物的本发明的vh区(例如scfv、双体、三体或四体、tandab等)。抗体可以是igg1、igg2、igg3或igg4;或igm;iga、ige或igd或其修饰变体。可以相应地选择抗体重链的恒定结构域。轻链恒定结构域可以是κ或λ恒定结构域。此外,抗原结合蛋白可以包含所有类别的修饰,例如,igg二聚体、不再结合fc受体或介导clq结合的fc突变体。抗原结合蛋白也可以是wo86/01533中所述类型的嵌合抗体,其包含抗原结合区和非免疫球蛋白区。
26.在本发明的另一个方面,抗原结合蛋白可以是dab、fab、fab’、f(ab’)2、fv、双抗体、三抗体、四抗体、微型抗体或微抗体。在本发明的一个方面,抗原结合蛋白可以是完全人的、人源化的或嵌合的抗体。在进一步的方面,抗原结合蛋白是人源化的抗体。在本发明的一个方面,抗原结合蛋白是单克隆抗体。
27.已经将嵌合抗原受体(car)开发为人工t细胞受体,以在t细胞中生成新的特异性,而不需要与mhc抗原肽复合物结合。这些合成受体可以含有靶结合结构域,其通过单个融合分子中的柔性接头与一个或多个信号结构域缔合。可以使用靶结合结构域以将t细胞靶向病理细胞表面上的特异性靶标,并且信号传导结构域含有用于t细胞活化和增殖的分子机制。穿过t细胞膜的柔性接头(即形成跨膜结构域)可以允许car的靶结合结构域的细胞膜展示。car可以成功地允许t细胞重新针对在来自各种恶性肿瘤(包括淋巴瘤和实体瘤)的肿瘤细胞表面表达的抗原(jena et al.,2010,blood,116(7):1035-44)。在本发明的一个方面,抗bcma抗原结合蛋白可以包含嵌合抗原受体。在进一步的方面,car可以包含结合结构域、跨膜结构域和细胞内效应结构域。
28.示例性抗bcma抗原结合蛋白及其制备方法公开于国际公开号wo2012/163805中,其通过引用整体并入本文。其他示例性抗bcma抗原结合蛋白包括在wo2016/014789、wo2016/090320、wo2016/090327、wo2016/020332、wo2016/079177、wo2014/122143、wo2014/122144、wo2017/021450、wo2016/014565、wo2014/068079、wo2015/166649、wo2015/158671、wo2015/052536、wo2014/140248、wo2013/072415、wo2013/072406、wo2014/089335、us2017/165373、wo2013/154760和wo2017/051068中描述的那些,其中每篇通过整体引用并入本文。
29.在另一个实施方案中,本文所述的抗bcma抗原结合蛋白可以抑制baff和/或april与bcma受体的结合。在另一个实施方案中,本文所述的抗bcma抗原结合蛋白可能能够结合fcγriiia或能够具有fcγriiia介导的效应物功能。
30.在一个实施方案中,抗bcma抗原结合蛋白包含抗体(“抗bcma抗体”)。在另一个实施方案中,抗bcma抗原结合蛋白包含单克隆抗体。如本文所用,术语“抗体”是指具有免疫球蛋白样结构域(例如,igg、igm、iga、igd或ige)的分子,并且可以包括该类型的单克隆、重组、多克隆、嵌合、人和人源化分子。单克隆抗体可以由表达抗体的真核细胞克隆或原核闭合细胞(close cell)产生。单克隆抗体也可以由真核细胞系产生,该真核细胞系可以通过将编码重链和轻链的核酸序列引入细胞而重组表达抗体的重链和轻链。从不同真核细胞系诸如中国仓鼠卵巢细胞、杂交瘤或衍生自动物(例如人)的永生化抗体细胞产生抗体的示例性方法为本领域技术人员所熟知。
31.抗体可以衍生自例如大鼠、小鼠、灵长类(例如食蟹猴、旧大陆猴或大型猿)、人,或其他来源诸如使用本领域技术人员已知的分子生物学技术生成的编码抗体分子的核酸。
32.抗体可以包含恒定区,其可以是任何同种型或亚类。恒定区可以是igg同种型,例如igg1、igg2、igg3、igg4或其变体。
33.抗原结合蛋白可以包含一种或多种修饰,包括例如突变的恒定结构域,使得当抗原结合蛋白是抗体时,抗体具有增强的效应物功能/adcc和/或补体激活。
34.在一个实施方案中,抗bcma抗体具有增强的抗体依赖性细胞介导的细胞毒活性(adcc)效应物功能。如本文所用,术语“效应物功能”意指抗体依赖性细胞介导的细胞毒活性(adcc)、补体依赖性细胞毒活性(cdc)介导的反应、fc介导的吞噬作用和/或经由fcrn受体的抗体再循环中的一种或多种。对于igg抗体,效应物功能可以包括adcc并且adcp可以通过重链恒定区与免疫细胞表面上存在的fcγ受体家族的相互作用介导。在人中,这些可能包括fcγri(cd64)、fcγrii(cd32)和fcγriii(cd16)。与抗原结合的抗原结合蛋白与fc/fcγ复合物形成之间的相互作用可以诱导一系列效应,包括细胞毒性、免疫细胞活化、吞噬作用和/或炎性细胞因子的释放。
35.在另一个实施方案中,抗bcma抗体可以抑制baff和/或april与bcma受体的结合。在另一个实施方案中,抗bcma抗体可能能够与fcγriiia结合或可能具有fcγriiia介导的效应功能。
36.在一个实施方案中,组合物包括包含两条免疫球蛋白(ig)重链(“hc”)和两条ig轻链(“lc”)的抗bcma抗体。基本抗体结构单元可以包括例如亚基的四聚体。每个四聚体可以包括两对多肽链,每对具有一条“轻”链(约25kda)和一条“重”链(约50-70kda)。每条链的氨基端部分可包括主要负责抗原识别的约100至110个或更多个氨基酸的可变区。该可变区最初可以与可切割的信号肽连接表达。不具有信号肽的可变区可以称为成熟可变区。因此,在一个实例中,轻链成熟可变区可以包含不具有轻链信号肽的轻链可变区。每条链的羧基端部分可以定义恒定区。重链恒定区可能主要负责效应物功能。
37.每个轻/重链对的成熟可变区可以形成抗体结合位点(也称为抗原结合位点)。“抗原结合位点”是指抗体上能够特异性结合抗原的位点,这可以是单个可变结构域,或者它可以是标准抗体上可发现的成对的vh/v
l
结构域。因此,完整的抗体可以具有例如两个结合位点。除了在双功能或双特异性抗体中,两个结合位点可以相同。这些链均可以表现出由三个高变区(也称为互补决定区或“cdr”)接合的相对保守的框架区(fr)的相同一般结构。来自每对的两条链的cdr可以通过框架区对齐,而能够与特定表位结合。因此,在一个实例中,从n端到c端,轻链和重链均包含结构域fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。
38.将“cdr”定义为抗体的互补决定区氨基酸序列。这些是免疫球蛋白重链和轻链的高变区。在免疫球蛋白的可变部分中有三个重链和三个轻链cdr(或cdr区)。因此,如本文所用,“cdr”是指所有三个重链cdr、所有三个轻链cdr、所有重链和轻链cdr或至少两个cdr。在一个实施方案中,组合物包含抗bcma抗体,其包含一个或多个根据本文所述的本发明的cdr,或根据本文所述的本发明的重链或轻链可变结构域之一或两者。
39.术语“变体”、“抗体变体”、“cdr变体”和“翻译后修饰变体”是指抗体序列中的至少一个氨基酸变化。变体可以是翻译后修饰、化学变化或通过至少一种缺失、取代或添加的序列变化的结果。一些翻译后修饰导致不改变序列的化学变化(例如met和氧化的met;或asp和异构化/异asp;或聚集),而另一些则导致序列变化,诸如一种氨基酸残基转化为另一种(例如,通过脱酰胺作用将asn转化为asp;或缺失赖氨酸)。下文描述了进一步的翻译后修饰
变体。包含序列变化的变体抗体序列可以是经设计的序列变化或翻译后修饰的结果。氨基酸序列变化可以是缺失、取代或添加。
40.在一个此类实施方案中,取代是保守取代。在替代实施方案中,抗体变体包含至少一个取代,同时保留抗原结合蛋白的规范。在一个实施方案中,抗体变体是与抗体一级序列至少约80%、约85%、约90%或约95%相同(即具有序列同一性)的抗体。在另一个实施方案中,抗体变体包括包含与seq id no:9的氨基酸序列至少约80%、约85%、约90%或约95%相同的重链氨基酸序列,和/或与seq id no:10的氨基酸序列至少约80%、约85%、约90%或约95%相同的重链氨基酸序列的抗体。
41.本发明的抗原结合蛋白可以具有增加恒定结构域或其片段对fcrn的亲和力的氨基酸修饰。增加治疗性和诊断性igg抗体和其他生物活性分子的半衰期(即血清半衰期)具有许多益处,包括减少这些分子的给药的量和/或频率。在一个实施方案中,本发明的抗原结合蛋白包含具有以下一种或多种氨基酸修饰的igg恒定结构域的全部或部分(fcrn结合部分)。
42.例如,关于igg1,m252y/s254t/t256e(通常称为“yte”突变)和m428l/n434s(通常称为“ls”突变)在ph 6.0下增加fcrn结合(wang et al.2018)。
43.t250q/m428l、v259i/v308f/m428l、n434a和t307a/e380a/n434a突变(参考igg1和kabat编号)也可以增加半衰期(monnet et al.)。
44.也可以通过引入h433k和n434f突变(通常称为“hn”或“nhance”突变)(关于igg1)来延长半衰期和fcrn结合(wo2006/130834)。
45.wo00/42072公开了包含具有改变的fcrn结合亲和力的变体fc区的多肽,该多肽包含在fc区的氨基酸位置238、252、253、254、255、256、265、272、286、288、303、305、307、309、311、312、317、340、356、360、362、376、378、380、386、388、400、413、415、424、433、434、435、436、439和447中的任一个或多个处的氨基酸修饰(eu索引编号)。
46.wo02/060919公开了修饰的igg,其包含相对于野生型igg恒定结构域包含一个或多个氨基酸修饰的igg恒定结构域,其中修饰的igg的半衰期比具有以下特征的igg的半衰期增加野生型igg恒定结构域,并且其中所述一种或多种氨基酸修饰位于251、253、255、285-290、308-314、385-389和428-435中的一个或多个位置。
47.shields等人(2001,j biol chem;276:6591-604)使用丙氨酸扫描诱变来改变人igg1抗体的fc区中的残基,然后评估与人fcrn的结合。当变为丙氨酸时有效地消除与fcrn结合的位置包括i253、s254、h435和y436。其他位置显示出不太明显的结合减少,如下:e233-g236、r255、k288、l309、s415和h433。当改变为丙氨酸时,几个氨基酸位置表现出fcrn结合的改善;其中值得注意的是p238、t256、e272、v305、t307、q311、d312、k317、d376、e380、e382、s424和n434。许多其他氨基酸位置表现出与fcrn结合的轻微改善(d265、n286、v303、k360、q362和a378)或无变化(s239、k246、k248、d249、m252、e258、t260、s267、h268、s269、d270、k274、n276、y278、d280、v282、e283、h285、t289、k290、r292、e293、e294、q295、y296、n297、s298、r301、n315、e318、k320、k322、s324、k326、a327、p329、p331、e333、k334、t335、s337、k338、k340、q342、r344、e345、q345、q347、r356、m358、t359、k360、n361、y373、s375、s383、n384、q386、e388、n389、n390、k392、l398、s400、d401、k414、r416、q418、q419、n421、v422、e430、t437、k439、s440、s442、s444和k447)。
48.对于组合变体,发现了关于改善的fcrn结合的最明显效果。在ph 6.0下,e380a/n434a变体相对于天然igg1与fcrn的结合好8倍以上,相比e380a为2倍,n434a为3.5倍。向其中添加t307a导致相对于天然igg1结合提高12倍。在一个实施方案中,本发明的抗原结合蛋白包含e380a/n434a突变并且具有增加的与fcrn的结合。
49.dall’acqua等人(2002,j immunol.;169:5171-80)描述了针对小鼠fcrn的人igg1铰链-fc片段噬菌体展示文库的随机诱变和筛选。他们公开了位置251、252、254-256、308、309、311、312、314、385-387、389、428、433、434和436的随机诱变。igg1-人fcrn复合物稳定性的主要改善发生在取代位于跨fc-fcrn界面的带中的残基(m252、s254、t256、h433、n434和y436)时,并且在较小程度取代在外围的残基,诸如v308、l309、q311、g385、q386、p387和n389。对人fcrn具有最高亲和力的变体通过组合m252y/s254t/t256e(“yte”)和h433k/n434f/y436h突变获得,并且与野生型igg1相比,表现出57倍的亲和力增加。与野生型igg1相比,此类突变的人igg1的体内行为表现出在食蟹猴中近4倍的血清半衰期增加。
50.因此,本发明提供具有优化的与fcrn结合的抗原结合蛋白。在优选的实施方案中,抗原结合蛋白在所述抗原结合蛋白的fe区中包含至少一个氨基酸修饰,其中所述修饰位于选自下组的氨基酸位置:fc区的226、227、228、230、231、233、234、239、241、243、246、250、252、256、259、264、265、267、269、270、276、284、285、288、289、290、291、292、294、297、298、299、301、302、303、305、307、308、309、311、315、317、320、322、325、327、330、332、334、335、338、340、342、343、345、347、350、352、354、355、356、359、360、361、362、369、370、371、375、378、380、382、384、385、386、387、389、390、392、393、394、395、396、397、398、399、400、401、403、404、408、411、412、414、415、416、418、419、420、421、422、424、426、428、433、434、438、439、440、443、444、445、446和447。
51.此外,各种出版物描述了通过将结合fcrn的多肽引入分子中(wo97/43316、us5869046、us5747035、wo96/32478和wo91/14438)或通过将分子与其fcrn结合亲和力得以保留,但对其他fc受体的亲和力已经大大降低的抗体融合(wo99/43713),或与抗体的fcrn结合结构域融合(wo00/09560、us4703039)来获得具有改变的半衰期的生理活性分子的方法。
52.在ph 6.0下的筛选中鉴定了fcrn亲和力增强的fc变体以改善抗体的细胞毒性和半衰期。所选择的igg变体可以产生为低岩藻糖基化分子。所得变体在hfcrn小鼠中显示出增加的血清持久性,以及保守增强的adcc(monnet等人)。示例性变体包括(关于igg1和kabat编号):
53.p230t/v303a/k322r/n389t/f404l/n434s;
54.p228r/n434s;
55.q311r/k334r/q342e/n434y;
56.c226g/q386r/n434y;
57.t307p/n389t/n434y;
58.p230s/n434s;
59.p230t/v305a/t307a/a378v/l398p/n434s;
60.p23ot/p387s/n434s;
61.p230q/e269d/n434s;
62.n276s/a378v/n434s;
63.t307a/n315d/a330v/382v/n389t/n434y;
64.t256n/a378v/s383n/n434y;
65.n315d/a330v/n361d/a387v/n434y;
66.v259i/n315d/m428l/n434y;
67.p230s/n315d/m428l/n434y;
68.f241l/v264e/t307p/a378v/h433r;
69.t250a/n389k/n434y;
70.v305a/n315d/a330v/p395a/n434y;
71.v264e/q386r/p396l/n434s/k439r;
72.e294del/t307p/n434y(其中“del”指示缺失)。
73.本发明还提供了生产根据本发明的抗原结合蛋白的方法,其包括以下步骤:a)培养包括包含如本文所述的分离的核酸的表达载体的重组宿主细胞,其中编码α-1,6-岩藻糖基转移酶的fut8基因已经在重组宿主细胞中失活;和b)回收抗原结合蛋白。例如,可以使用可从biowa,inc.(princeton,nj)获得的potelligent技术系统进行产生抗原结合蛋白的此类方法,其中缺乏fut8基因的功能拷贝的chok1sv细胞产生具有增强的单克隆抗体依赖性细胞介导的细胞毒性(adcc)活性的抗体,其相对于在具有功能性fut8基因的细胞中产生的相同单克隆抗体是增加的。potelligent技术系统的方面在us7214775、us6946292、wo0061739和wo0231240中描述,其所有通过引用并入本文。本领域普通技术人员还将认识到用于生成抗原结合蛋白诸如抗体的其他适当系统和方法。
74.可以通过常规的蛋白质纯化规程回收和纯化抗体。例如,可以直接从培养基中收获抗体。可以通过澄清,例如通过离心和/或深度过滤收获细胞培养基。回收抗体,随后进行纯化以确保足够的纯度。因此,在一个方面,提供了包含本文所述抗体的细胞培养基。在一个实施方案中,细胞培养基包含cho细胞。
75.随后可以从细胞培养基中纯化抗体。这可以包括收获细胞培养上清液,使细胞培养上清液与纯化培养基(例如蛋白a树脂或蛋白g树脂以结合抗体分子)接触,并从纯化培养基中洗脱抗体分子以产生洗脱物。因此,在一个方面,提供了包含本文所述抗体的洗脱物。
76.一个或多个色谱步骤可以用于纯化,例如一种或多种色谱树脂;和/或一个或多个过滤步骤。例如,使用树脂诸如蛋白质a、g或l的亲和色谱可以用于纯化组合物。替代地或除此之外,可以使用离子交换树脂诸如阳离子交换树脂来纯化组合物。
77.或者,纯化步骤包括:亲和色谱树脂步骤,随后是阳离子交换树脂步骤。
78.在一个实施方案中,抗bcma抗体包含重链可变区cdr1(“cdrh1”),其包含与seq id no:1中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。
79.在一个实施方案中,重链可变区cdr1(“cdrh1”)包含与seq id no:1中所列的氨基酸序列具有一个氨基酸变异(“变体”)的氨基酸序列。
80.在一个实施方案中,抗bcma抗体包含重链可变区cdr2(“cdrh2”),其包含与seq id no:2中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。在一个实施方案中,重链可变区cdr2(“cdrh2”)包
含与seq id no:2中所列的氨基酸序列具有一个氨基酸变异(“变体”)的氨基酸序列。
81.在一个实施方案中,抗bcma抗体包含重链可变区cdr3(“cdrh3”),其包含与seq id no:3中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。在一个实施方案中,重链可变区cdr3(“cdrh3”)包含与seq id no:3中所列的氨基酸序列具有一个氨基酸变异(“变体”)的氨基酸序列。
82.在一个实施方案中,抗bcma抗体包含轻链可变区cdr1(“cdrl1”),其包含与seq id no:4中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。在一个实施方案中,轻链可变区cdl1(“cdr1”)包含与seq id no:4中所列的氨基酸序列具有一个氨基酸变异(“变体”)的氨基酸序列。
83.在一个实施方案中,抗bcma抗体包含轻链可变区cdr2(“cdrl2”),其包含与seq id no:5中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。在一个实施方案中,轻链可变区cdl2(“cdr2”)包含与seq id no:5中所列的氨基酸序列具有一个氨基酸变异(“变体”)的氨基酸序列。
84.在一个实施方案中,抗bcma抗体包含轻链可变区cdr3(“cdrl3”),其包含与seq id no:6中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。在一个实施方案中,轻链可变区cdl3(“cdr3”)包含与seq id no:6中所列的氨基酸序列具有一个氨基酸变异(“变体”)的氨基酸序列。
85.在一个实施方案中,抗bcma抗体包含cdrh1,其包含与seq id no:1中所列的氨基酸序列至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列相同的氨基酸序列;cdrh2,其包含与seq id no:2中所列的氨基酸序列至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列相同的氨基酸序列;cdrh3,其包含与seq id no:3中所列的氨基酸序列至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列相同的氨基酸序列;cdrl1其包含与seq id no:4中所列的氨基酸序列至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列相同的氨基酸序列;cdrl2其包含与seq id no:5中所列的氨基酸序列至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列相同的氨基酸序列;和/或cdrl3,其包含与seq id no:6中所列的氨基酸序列至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列相同的氨基酸序列。
86.在一个实施方案中,抗bcma抗体包含重链可变区(“v
h”),其包含与seq id no:7中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。
87.在一个实施方案中,抗bcma抗体包含轻链可变区(“v
l”),其包含与seq id no:8中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。
88.在一个实施方案中,抗bcma抗体包含vh,其包含与seq id no:7中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列;和v
l
,其包含与seq id no:8中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。
89.在一个实施方案中,抗bcma抗体包含重链可变区(“hc”),其包含与seq id no:9中
所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。
90.在一个实施方案中,抗bcma抗体包含轻链可变区(“lc”),其包含与seq id no:10中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。
91.在一个实施方案中,抗bcma抗体包含hc,其包含与seq id no:9中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列;和lc,其包含与seq id no:10中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。
92.查询氨基酸序列和主题氨基酸序列之间的“同一性百分比”是“同一性”值,表示为百分比,在进行成对blastp比对后,当主题氨基酸序列与查询氨基酸具有100%查询覆盖率时,通过blastp算法计算。查询氨基酸序列和主题氨基酸序列之间的此类一对高明的blastp比对是通过使用国家生物技术研究所网站上可用的blastp算法的默认设置进行的,其中低复杂性区域的过滤器关闭。重要的是,查询序列可以由本文一项或多项权利要求中确定的氨基酸序列描述。
93.在一个实施方案中,抗bcma抗体包含具有seq id no:1中所列氨基酸序列的cdrh1;具有seq id no:2中所列氨基酸序列的cdrh2;具有seq id no:3中所列氨基酸序列的cdrh3;具有seq id no:4中所列氨基酸序列的cdrl1;具有seq id no:5中所列氨基酸序列的cdrl2;以及具有seq id no:6中所列氨基酸序列的cdrl3。
94.在一个实施方案中,抗bcma抗体包含具有seq id no:7中所列氨基酸序列的vh;和具有seq id no:8中所列氨基酸序列的v
l
。
95.在一个实施方案中,抗bcma抗体包含贝兰他单抗,其包含具有seq id no:9所列氨基酸序列的hc和具有seq id no:10所列氨基酸序列的lc。
96.抗体的序列可以通过kabat编号系统确定(kabat et al.sequences of proteins of immunological interest nih,1987)。或者,它们可以使用chothia编号系统(al-lazikani et al.,(1997)jmb 273,927-948)、接触定义方法(maccallum r.m.,and martin a.c.r.and thornton j.m,(1996),journal of molecular biology,262(5),732-745)或本领域技术人员已知的用于编号抗体中的残基和确定cdr的任何其他已建立的方法来确定。技术人员可用的抗体序列的其他编号约定包括“abm”(巴斯大学)和“接触”(伦敦大学学院)方法。最后,抗体序列可以按顺序编号。
97.当对本文所述的氨基酸进行数字参考时,可以根据kabat方法或顺序编号方法对序列进行编号。除非另有明确说明,对特定氨基酸编号的数字参考在本文中使用顺序编号系统进行描述。在整个说明书中,术语“cdr”、“cdrl1”、“cdrl2”、“cdrl3”、“cdrh1”、“cdrh2”、“cdrh3”遵循kabat编号。可变区序列和全长抗体序列中的氨基酸残基按顺序编号以表示任何抗体序列变体位置或翻译后修饰变体位置,诸如异构化变体(例如,d103)、脱酰胺变体(例如n388)或氧化变体(例如,m34)。
98.参考cdr中的位置(例如,m34或d103)提供了与整个抗体序列相关的位置编号(顺序编号)。因此,应理解cdrh1的m34是指seq id no:1的第四个残基,即如下划线:nywmh(seq id no:1)。同样,cdrh3的d103是指seq id no:3的第五个残基,即如下划线:gaiydgydv
l
dn
(seq id no:3)。
99.在一个方面,组合物包含抗体变体,该抗体变体包含一级序列中的一个或多个氨基酸的变化。在一个实施方案中,组合物包含与seq id no:9的重链氨基酸序列和/或seq id no:10的轻链序列至少约90%相同的抗体,于天冬氨酸(d)到天冬酰胺(n)的氨基酸变化,例如在cdrh3的d103n(即kabat编号中的d99n)。
100.在另一个实施方案中,组合物包含抗体,该抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2、具有seq id no:6中所列氨基酸序列的cdrl3,并且包含天冬氨酸(d)到天冬酰胺(n)的氨基酸变化,例如在cdrh3的d103n。
101.在另一个实施方案中,抗bcma抗体包含贝兰他单抗并包含天冬氨酸(d)到天冬酰胺(n)的氨基酸变化,例如在cdrh3的d103n。
102.在一个实施方案中,组合物包含与seq id no:9的重链氨基酸序列和/或seq id no:10的轻链序列至少约90%相同的抗体混合物,其中约≥5%、≥10%、≥15%、≥20%、≥25%、≥50%、≥75%或≥90%的抗体包含在cdrh3的d103n。
103.在一个实施方案中,组合物包含抗体的混合物,该混合物包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列cdrl2、具有seq id no:6中所列氨基酸序列的cdrl3,其中混合物中约≥5%、≥10%、≥15%、≥20%、≥25%、≥50%、≥75%或≥90%的抗体包含在cdrh3的d103n。
104.在一个实施方案中,组合物包含贝兰他单抗,其中贝兰他单抗的约≥5%、≥10%、≥15%、≥20%、≥25%、≥50%、≥75%或≥90%包含在cdrh3的d103n。
105.在一个实施方案中,组合物包含贝兰他单抗,其包含使用kabat编号系统的选自下组的至少一种抗体变体:g27y、s30t、a93t、a24g、k73t、m48i、v67a、f71y、d99n、m4l和k45e。
106.翻译后修饰产物
107.本文所述抗体的“翻译后修饰产物”是抗体组合物,其中组合物的所有或部分包含“翻译后修饰”。翻译后修饰是抗体的化学变化,其可能是由于抗体在宿主细胞中的产生、上游和下游制备和/或贮存(例如暴露于光、温度、ph、水或通过与赋形剂和/或直接容器封闭系统反应)。因此,本发明的组合物可以由抗体的制备或贮存形成。示例性的翻译后修饰包括抗体序列变化(“抗体变体”,如上所述)、某些前导序列的切割、以各种糖基化模式添加各种糖部分、非酶糖基化、脱酰胺、氧化、二硫键加扰和其他半胱氨酸变体,诸如游离巯基、外消旋二硫键、硫醚和三硫键、异构化、c端赖氨酸切割和/或n端谷氨酰胺环化。
108.在一个实例中,翻译后修饰产物包含“产物相关杂质”,其包含导致功能和/或活性降低的化学变化。在另一个实例中,翻译后修饰产物包含“产物相关物质”,其包含不导致功能和/或活性降低的化学变化。本文所述抗体的产物相关杂质包括异构化变体和氧化变体。本文所述抗体的产物相关物质包括脱酰胺变体、糖基化变体、c端切割变体和n端焦谷氨酸变体。
109.在一个实施方案中,组合物包含seq id no:9的重链序列和seq id no:10的轻链
序列,其包含其一种或多种功能性翻译后修饰。在另一个实施方案中,组合物包含seq id no:11、seq id no:12、seq id no:13或seq id no:14的重链序列,以及seq id no:10的轻链,其包含一种或多种功能性翻译后修饰。
110.本文提供的变体百分比表示为组合物中抗体总量(例如,抗体“群”)的百分比。例如,40%或更少的氧化变体是指在组合物中的总量为100%的抗体,其中40%或更少被氧化。例如,25%或更少的异构化变体是在组合物中的总量为100%的抗体,其中25%或更少被异构化。
111.糖化是翻译后修饰,其包括还原糖(诸如葡萄糖)和蛋白质中的游离胺基之间的非酶化学反应,通常在赖氨酸侧链的ε胺或蛋白质的n端观察到。在还原糖的存在下,糖化可以在生产和/或贮存期间发生。
112.脱酰胺,例如,其可能在生产和/或贮存期间发生,可以是酶促反应或化学反应。脱酰胺可以通过分子内环化通过简单的化学反应发生,其中链中下一个氨基酸的酰胺氮亲核攻击酰胺(n+1攻击n);形成琥珀酰亚胺中间体。脱酰胺可以主要以3:1的比率将天冬酰胺(n)转化为异天冬氨酸(异天冬氨酸盐)和天冬氨酸(天冬氨酸盐)(d)。因此,该脱酰胺反应可能与天冬氨酸盐(d)异构化为异天冬氨酸盐有关。天冬酰胺的脱酰胺和天冬氨酸盐的异构化两者均可能涉及中间体琥珀酰亚胺。谷氨酰胺残基可以以类似的方式发生脱酰胺作用,但程度要小得多。脱酰胺作用可以发生在cdr、fab(非cdr区)或fc区。异构化是将天冬氨酸盐(d)转化为异天冬氨酸盐,其中涉及中间体琥珀酰亚胺。
113.氧化可以在生产和/或贮存期间发生(即在氧化条件存在下)并导致由活性氧直接诱导或通过与氧化应激的次级副产物反应间接诱导的蛋白质的共价修饰。氧化可能主要发生在甲硫氨酸残基上,但也可能发生在色氨酸和游离半胱氨酸残基上。氧化可以发生在cdr、fab(非cdr)区或fc区。
114.在生产和/或贮存条件下可能发生二硫键加扰。在某些情况下,二硫键可能断裂或错误形成,导致不成对的半胱氨酸残基(-sh)。这些游离的(未配对的)巯基(-sh)可能促进改组(shuffling)。
115.通过经由脱氢丙氨酸和过硫化物中间体将二硫桥回到半胱氨酸残基的β消除,硫醚的形成和二硫键的外消旋可以在生产或贮存中在碱性条件下发生。脱氢丙氨酸和半胱氨酸的后续交联可能导致硫醚键的形成,或者游离的半胱氨酸残基可能与d-和l-半胱氨酸的混合物重新形成二硫键。
116.三硫化物可能是由于硫原子插入二硫键(cys-s-s-s-cys)所致,并且可能由于生产细胞培养物中硫化氢的存在而形成。
117.重链和/或轻链中的n端谷氨酰胺(q)和谷氨酸盐(谷氨酸)(e)可以通过环化形成焦谷氨酸(pglu)。pglu形成可以在生产生物反应器中形成,但也可以例如非酶促形成,这取决于加工和贮存条件的ph值和温度。在天然人抗体中通常观察到n端q或e的环化。
118.c端赖氨酸切割是由羧肽酶催化的酶促反应,通常在重组和天然人抗体中观察到。该加工的变体包括由于来自重组宿主细胞的细胞酶而从一条或两条重链中除去赖氨酸。对人受试者/患者施用可能导致任何剩余的c端赖氨酸的除去。
119.本发明涵盖可能已经进行或经历本文所述的一种或多种翻译后修饰的抗体。示例性组合物可以包含以下的抗体的混合物或共混物:1)具有和不具有翻译后修饰(1种或多
种),或2)具有多于一种类型的本文所述的翻译后修饰。
120.该组合物可以包含抗体变体和翻译后修饰变体的混合物。例如,抗体组合物可以包含一种或多种,诸如两种或多种氧化变体、脱酰胺变体、异构化变体、n端焦谷氨酸变体和c端赖氨酸切割变体。
121.例如,在一个实施方案中,组合物可以包含抗体的混合物,其中混合物中10%的抗体包含seq id no 9和10的氨基酸序列,并且混合物中90%的抗体包含具有c端赖氨酸切割的seq id no 9和10的氨基酸序列。
122.在另一个示例性实施方案中,组合物可以包含抗体的混合物,其中混合物中10%的抗体包含seq id no 9和10的氨基酸序列,混合物中90%的抗体包含具有c端赖氨酸切割的seq id no 9和10的氨基酸序列,并且在该100%总抗体混合物中,高达100%的n端谷氨酰胺环化为焦谷氨酸。
123.在另一个示例性实施方案中,组合物可以包含抗体的混合物,其中混合物中10%的抗体包含seq id no 9和10的氨基酸序列,混合物中90%的抗体包含具有c端赖氨酸切割的seq id no 9和10的氨基酸序列,并且在该100%总抗体混合物中,高达100%为n端焦谷氨酸并且高达23%在cdrh3的d103处异构化。
124.在又一个示例性实施方案中,组合物包含抗体混合物,其中混合物中20%的抗体包含seq id no 9和10的氨基酸序列,混合物中80%的抗体包含在cdrh3具有变体n103的seq id no 9和10的氨基酸序列,并且在该100%总抗体混合物中,高达37%的抗体在氨基酸m34 cdrh1处氧化。
125.在一个实施方案中,本文所述的翻译后修饰不导致抗原结合亲和力、生物活性、药代动力学(pk)/药效学(pd)、聚集、免疫原性和/或与fc受体的结合的显著变化,除非指定和描述为与产物相关的杂质。
126.如本文所述,“功能”或“活性”定义为以下的一项或多项:1)与bcma结合,2)与fcγriiia结合,和/或3)与fcrn结合。在一个实施方案中,“降低的功能”或“降低的活性”是指与参考标准品相比,与bcma的结合、与fcγriiia的结合或与fcrn的结合以百分比降低,并且在测定变异性上显著。例如,功能或活性降低可以描述为降低≥5%、≥10%、≥15%、≥20%、≥25%、≥30%、≥35%、≥40%、≥45%或≥50%。
127.在一个实施方案中,抗bcma抗体包含与seq id no:9和seq id no:10的氨基酸序列至少约90%相同并且包括抗体的所有翻译后修饰(如果有的话)的抗体。
128.在另一个实施方案中,抗bcma抗体包含贝兰他单抗和所有翻译后修饰(如果有的话)。
129.当通过基于电荷的分离技术,诸如等电聚焦(ief)凝胶电泳、毛细管等电聚焦(cief)凝胶电泳、阳离子交换色谱(cex)和阴离子交换色谱(aex)分析抗体的组成时,通常会观察到抗体变体.
130.翻译后修饰可以导致抗体净电荷的增加或减少,并导致pi值的减少或增加,从而导致相对于主要同工型的酸性变体和碱性变体(统称为“带电荷变体”)。主要同工型是作为色谱图上主峰洗脱的抗体群。当使用基于ief的方法分析抗体时,酸性种类是具有较低表观pi的变体,且碱性种类是具有较高表观pi的变体。当通过基于色谱的方法进行分析时,酸性种类和碱性种类是基于它们相对于主峰的保留时间来定义的。酸性种类是早于cex主峰或
晚于aex主峰洗脱的变体,而碱性种类是晚于cex主峰或早于aex主峰洗脱的变体。这些方法将抗体的主要同工型从酸性同工型(酸性变体)和碱性同工型(碱性变体)中分离。带电荷变体可以通过各种方法检测,诸如离子交换色谱,例如wcx-10hplc(弱阳离子交换色谱)或ief(等电聚焦)。可以使用毛细管等电聚焦(cief)测定带电百分比。使用毛细管等电聚焦(cief)以测量dostarlimab和分离的电荷变体的pi(参见图1)。该方法可以用于定量酸性和碱性种类占总峰面积的百分比。术语“种类”、“同工型”、“形式”和“峰”可互换使用以指主要同工型和带电荷变体(酸性变体和碱性变体)。
131.在一个实施方案中,组合物包含抗体的酸性变体,其中酸性变体包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中该组合物包含1-70%的酸性变体。
132.一方面,组合物包含≤70%的酸性变体。在一个实施方案中,组合物包含≤60%、≤50%、≤40%、≤35%或≤30%的酸性变体。或者,该组合物包含10-70%、10-60%、10-50%、10-40%、10-35%或10-30%的酸性变体。或者,该组合物包含20-70%、20-60%、20-50%、20-40%、20-35%或20-30%的酸性变体。或者,该组合物包含约60%、约50%、约40%、约35%、约30%、约25%或约20%的酸性变体。
133.一方面,组合物包含抗体的碱性变体,其中该碱性变体包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中该组合物包含1-30%的碱性变体。
134.一方面,组合物包含≤30%的碱性变体。在一个实施方案中,组合物包含≤25%、≤20%、≤15%、≤10%、≤7.5%或≤5%的碱性变体。在一个实施方案中,组合物包含1-30%、1-25%、1-20%、1-15%、1-10%或1-5%的碱性变体。或者,该组合物包含约15%、约10%或约5%的碱性变体。
135.在一个方面,组合物包含抗体的主要同工型,其中主要同工型包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中该组合物包含1-90%的主要异构体。
136.在一个方面,组合物包含≥1%的主要同工型。在一个实施方案中,组合物包含≥5%、≥10%、≥20%、≥30%、≥40%、≥50%、≥55%、≥60%、≥65%、≥70%、≥75%、≥80%或≥90%的主要同工型。在一个实施方案中,组合物包含10-90%、20-90%、30-90%、40-90%、50-90%或60-90%的主要同工型。在一个实施方案中,组合物包含10-80%、20-80%、30-80%、40-80%、50-80%或60-80%的主要同工型。或者,该组合物包含约80%、约75%、约70%、约65%、约60%、约50%或约55%的主要同工型。
137.可以使用毛细管等电聚焦(cief)测定酸性变体百分比、碱性变体百分比和主要异构体百分比。应当理解,这些同工型/带电荷变体实施方案可以与本文所述抗体变体中的任何一种或组合组合。
138.在一个方面,组合物包含抗体的带电荷变体,其包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,和包含seq id no:4的
cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中该组合物包含:≤70%的酸性变体;和/或≤30%碱性变体;和/或≥1%的主要异构体。
139.在一个方面,组合物包含抗体,该抗体包含异构化翻译后修饰(“异构化”或“异构化的”)或“异构化变体”。变体可以在重链序列和/或轻链序列,诸如重链序列的cdr和/或轻链序列的cdr中包含异构化的氨基酸残基。异构化变体可以存在于重链或轻链的一条或两条链中。异构化翻译后修饰导致异天冬氨酸盐和/或琥珀酰亚胺-天冬氨酸盐。在一个实施方案中,可以使用如本文所述的胰蛋白酶肽图谱串联质谱法(肽图谱lc-ms/ms)测定天冬氨酸(asp)异构化。将理解,这些异构化变体实施方案可以与本文所述的抗体特征组合。
140.在一个实施方案中,组合物包含抗bcma抗体的异构化变体,其中所述异构化变体包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中该组合物包含≤25%的异构化变体。
141.在一个方面,组合物包含抗bcma抗体群,其包括:
142.抗体,其包括包含seq id no:1(cdrh1)、seq id no:2(cdrh2)和seq id no:3(cdrh3)的重链氨基酸序列以及包含seq id no:4(cdrl1)、seq id no:5(cdrl2)和seq id no:6(cdrl3)的轻链氨基酸序列,以及
143.其异构化变体,其中≤25%的抗体群由异构化变体组成。
144.在另一个实施方案中,组合物包含抗bcma抗体的异构化变体,其中该异构化变体包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中该组合物包含≤25%在cdrh3中的氨基酸d103处的异构化变体。
145.在一个实施方案中,组合物包含抗bcma抗体的异构化变体,其中该异构化变体包含seq id no:9的重链序列和seq id no:10的轻链序列;其中该组合物包含≤25%的异构化变体。
146.或者,异构化变体包含seq id no:11、12、13或14的重链序列。
147.在一个实施方案中,组合物包含与seq id no:9的重链氨基酸序列和/或seq id no:10的轻链序列至少约90%相同的抗体,并且包含在任一重链序列或轻链序列中的异构化,例如在cdrh3的氨基酸d103处的异构化。
148.在另一个实施方案中,组合物包含抗体,该抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列组cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2、具有seq id no:6中所列氨基酸序列的cdrl3,以及在六个cdr区中的至少一个中的异构化,例如在cdrh3的氨基酸d103处的异构化。
149.在另一个实施方案中,抗bcma抗体包含贝兰他单抗并且包含在任一重链序列或轻链序列中的异构化,例如在cdrh3的氨基酸d103处的异构化。
150.在一个实施方案中,组合物包含与seq id no:9的重链氨基酸序列和/或seq id no:10的轻链序列至少约90%相同的抗体混合物,其中混合物中约≤25%,≤23%、≤20%、≤15%、≤10%、≤8%、≤7%、0.1-25%、0.1-20%、0.1-15%、0.1-10%、0.1-8%、0.1-7%、1-6%、2-6%、3-6%、约4%、约5%或约6%的抗体在cdrh3的氨基酸d103处异构化。在
no:6(cdrl3)的轻链氨基酸序列,以及
159.其氧化变体,其中≤25%的抗体群由氧化变体组成。
160.在一个实施方案中,氧化变体包括在cdr中的一个或多个的氧化。在进一步的实施方案中,氧化变体包括在seq id no:1-6中任一个中的甲硫氨酸和/或色氨酸残基处的氧化。
161.在另一个实施方案中,组合物包含抗bcma抗体的氧化变体,其中该氧化变体包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中该组合物包含≤40%在cdrh1中的氨基酸m34处的氧化变体。
162.在一个实施方案中,组合物包含贝兰他单抗的氧化变体,其中该氧化变体包含seq id no:9的重链序列和seq id no:10的轻链序列;其中该组合物包含≤40%的氧化变体。
163.在一个实施方案中,组合物包含与seq id no:9的重链氨基酸序列和/或seq id no:10的轻链序列至少约90%相同的抗体,并且包含在重链氨基酸序列中的氧化,例如在氨基酸m34(cdrh1)、m256和/或m432处的氧化。
164.在另一个实施方案中,组合物包含抗体,该抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列组cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2、具有seq id no:6中所列氨基酸序列的cdrl3,并且包括在重链序列中的氧化,例如在氨基酸m34(cdrh1)、m256和/或m432处的氧化。
165.在另一个实施方案中,抗bcma抗体包含贝兰他单抗并且包含在重链序列中的氧化,例如在氨基酸m34(cdrh1)、m256和/或m432处的氧化。
166.在一个实施方案中,组合物包含与seq id no:9的重链氨基酸序列和/或seq id no:10的轻链序列至少约90%相同的抗体混合物,其中混合物中约≤40%、≤35%、30%、≤25%、≤20%、≤15%、≤10%、≤7.5%、≤5%、≤2.5%、≤2%、0.1-40%、0.1-35%、0.1-30%、0.1-25%、0.1-20%、0.1-15%、0.1-10%、0.1-7.5%、0.1-5%、0.1-2.5%、0.1-2%、约0.5%、约1%、约2%或约5%的抗体在氨基酸m34处氧化。在一个实施方案中,包含≤40%在重链m34处的氧化的组合物保留≥70%的bcma特异性抗原结合。在另一个实施方案中,包含≤37%在重链m34处的氧化的组合物保留≥70%的bcma特异性抗原结合。
167.在一个实施方案中,组合物包含抗体混合物,其包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列组cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2、具有seq id no:6中所列氨基酸序列的cdrl3,其中混合物中约≤40%、≤35%、30%、≤25%、≤20%、≤15%、≤10%、≤7.5%、≤5%、≤2.5%、≤2%、0.1-40%、0.1-35%、0.1-30%、0.1-25%、0.1-20%、0.1-15%、0.1-10%、0.1-7.5%、0.1-5%、0.1-2.5%、0.1-2%、约0.5%、约1%、约2%或约5%的抗体在氨基酸m34处氧化。在一个实施方案中,包含≤40%在重链m34处的氧化的组合物保留≥70%的bcma特异性抗原结合。在另一个实施方案中,包含≤37%在重链m34处的氧化的组合物保留≥70%的bcma特异性抗原结合。
168.在另一个实施方案中,组合物包含贝兰他单抗,其中约≤40%、≤35%、30%、≤
25%、≤20%、≤15%、≤10%、≤7.5%、≤5%、≤2.5%、≤2%、0.1-40%、0.1-35%、0.1-30%、0.1-25%、0.1-20%、0.1-15%、0.1-10%、0.1-7.5%、0.1-5%、0.1-2.5%、0.1-2%、约0.5%、约1%、约2%或约5%的贝兰他单抗在氨基酸m34处氧化。在一个实施方案中,包含≤40%在重链m34处的氧化的贝兰他单抗保留≥70%的bcma特异性抗原结合。在另一个实施方案中,包含≤37%在重链m34处的氧化的贝兰他单抗保留≥70%的bcma特异性抗原结合。
169.在一个实施方案中,组合物包含抗bcma抗体的氧化变体,其中该氧化变体包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中该组合物包含≤90%在fe区中的氧化变体。
170.在一个实施方案中,抗体包含在重链序列的fc区和/或轻链序列的fc区中的甲硫氨酸和/或色氨酸残基处的氧化。在一些实施方案中,氧化变体包含在以下位置的氧化的一种或组合:重链序列的fc区的m256和/或m432。
171.在另一个实施方案中,组合物包含抗bcma抗体的氧化变体,其中该氧化变体包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中所述组合物包含≤90%的氧化m256和/或m432变体。
172.在一个实施方案中,组合物包含贝兰他单抗的氧化变体,其中该氧化变体包含seq id no:9的重链序列和seq id no:10的轻链序列;其中该组合物包含≤90%在fe区中的氧化变体。
173.或者,氧化变体包含seq id no:11、12、13或14的重链序列。
174.在一个实施方案中,组合物包含与seq id no:9的重链氨基酸序列和/或seq id no:10的轻链序列至少约90%同一性的抗体混合物,其中混合物中约≤90%、≤80%、≤70%、≤65%、≤50%、≤40%、≤30%、≤20%、≤10%、≤7.5%、≤5%、0.1-90%、0.1-80%、0.1-70%、0.1-65%、0.1-50%、0.1-40%、0.1-30%、0.1-20%、0.1-10%、1-10%、1-5%、2-10%、2-4%、约2%、约3%或约4%的抗体在氨基酸m256处氧化。在一个实施方案中,包含≤90%或≤89%在重链m256处的氧化的组合物保留≥70%fcγriiia结合。在另一个实施方案中,包含≤65%或≤64%在重链m256处的氧化的组合物保留≥70%的fcrn结合。
175.在一个实施方案中,组合物包含抗体的混合物,该混合物包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列组cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2、具有seq id no:6中所列氨基酸序列的cdrl3,其中混合物中约≤90%、≤80%、≤70%、≤65%、≤50%、≤40%、≤30%、≤20%、≤10%、≤7.5%、≤5%、0.1-90%、0.1-80%、0.1-70%、0.1-65%、0.1-50%、0.1-40%、0.1-30%、0.1-20%、0.1-10%、1-10%、1-5%、2-10%、2-4%、约2%、约3%或约4%的抗体在氨基酸m256处氧化。在一个实施方案中,包含≤90%或≤89%在重链m256处的氧化的组合物保留≥70%fcγriiia结合。在另一个实施方案中,包含≤65%或≤64%在重链m256处的氧化的组合物保留≥70%的fcrn结合。
176.在另一个实施方案中,组合物包含贝兰他单抗,其中约≤90%、≤80%、≤70%、≤
65%、≤50%、≤40%、≤30%、≤20%、≤10%、≤7.5%、≤5%、0.1-90%、0.1-80%、0.1-70%、0.1-65%、0.1-50%、0.1-40%、0.1-30%、0.1-20%、0.1-10%、1-10%、1-5%、2-10%、2-4%、约2%、约3%或约4%的贝兰他单抗在氨基酸m256处氧化。在一个实施方案中,包含≤90%或≤89%在重链m256处的氧化的贝兰他单抗保留≥70%fcγriiia结合。在另一个实施方案中,包含≤65%或≤64%在重链m256处的氧化的贝兰他单抗保留≥70%fcrn结合。
177.在一个实施方案中,组合物包含与seq id no:9的重链氨基酸序列和/或seq id no:10的轻链序列至少约90%相同的抗体混合物,其中混合物中抗体的约≤86%、≤70%、≤60%、≤50%、≤40%、≤30%、≤20%、≤10%、≤7.5%、≤5%、≤2.5%、≤2%、0.1-86%、0.1-70%、0.1-60%、0.1-50%、0.1-40%、0.1-30%、0.1-20%、0.1-10%、0.1-5%、0.1-3%、约0.5%、约1%、约2%或约3%在氨基酸m432处被氧化。在一个实施方案中,包含≤86%在重链m432处的氧化的组合物保留≥70%fcγriia结合。在另一个实施方案中,包含≤60%在重链m432处的氧化的组合物保留≥70%fcrn结合。
178.在一个实施方案中,组合物包含抗体的混合物,该混合物包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列组cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2、具有seq id no:6中所列氨基酸序列的cdrl3,其中混合物中约≤86%、≤70%、≤60%、≤50%、≤40%、≤30%、≤20%、≤10%、≤7.5%、≤5%、≤2.5%、≤2%、0.1-86%、0.1-70%、0.1-60%、0.1-50%、0.1-40%、0.1-30%、0.1-20%、0.1-10%、0.1-5%、0.1-3%、约0.5%、约1%、约2%或约3%的抗体在氨基酸m432处氧化。包含≤86%在重链m432处的氧化的组合物保留≥70%fcγriiia结合。在另一个实施方案中,包含≤60%在重链m432处的氧化的组合物保留≥70%fcrn结合。
179.在另一个实施方案中,组合物包含贝兰他单抗,其中约≤86%、≤70%、≤60%、≤50%、≤40%、≤30%、≤20%、≤10%、≤7.5%、≤5%、≤2.5%、≤2%、0.1-86%、0.1-70%、0.1-60%、0.1-50%、0.1-40%、0.1-30%、0.1-20%、0.1-10%,0.1-5%、0.1-3%、约0.5%、约1%、约2%或约3%的贝兰他单抗在氨基酸m432处氧化。在一个实施方案中,包含≤86%在重链m432处的氧化的贝兰他单抗保留≥70%fcγriiia结合。在另一个实施方案中,包含≤60%在重链m432处的氧化的贝兰他单抗保留≥70%fcrn结合。
180.在一个实例中,可以使用胰蛋白酶肽图谱串联质谱法(肽图谱lc-ms/ms)测定氧化。在一个实例中,包含本文所述组合物的样品可以例如在6m盐酸胍中变性至例如4.2μg/μl的浓度。然后可以将二硫键还原,例如用50mm dtt在室温下还原20分钟。然后例如可以以例如100mm添加碘乙酸盐并与游离半胱氨酸残基反应例如在室温下避光反应30分钟。然后在37℃下用0.5%胰蛋白酶消化15分钟之前,可以例如使用biorad离心柱(部件号7326221)对样品进行缓冲液交换。然后可以将所得肽加载到反相超高效液相色谱(uplc)柱上,并且可以使用uplc在例如0.1%三氟乙酸中用水和乙腈梯度洗脱。然后可以用uv检测器和质谱仪(例如thermo scientific ltq orbitrap xl)检测肽。使用未修饰和修饰肽的提取离子色谱图以通过将修饰肽的曲线下面积除以修饰和未修饰肽两者的曲线下总面积来计算氧化的水平。
181.在一个方面,组合物包含抗体,该抗体包含脱酰胺翻译后修饰(“脱酰胺”或“脱酰
胺的”)或“脱酰胺变体”。在一个实施方案中,抗体包含重链序列的cdr和/或轻链序列的cdr中天冬酰胺残基的脱酰胺。在进一步的实施方案中,抗体包含重链序列的cdr中天冬酰胺残基的脱酰胺。在一个实施方案中,抗体包含重链序列的fc区和/或轻链序列的fc区中天冬酰胺残基的脱酰胺。脱酰胺变体可以存在于重链或轻链的一条或两条链中。将理解,这些脱酰胺变体实施方案可以与本文所述的抗体特征组合。在一些实施方案中,脱酰胺变体包含在以下位置的脱酰胺中的一种或组合:重链序列的fc区的n388和/或n393。
182.在一个实施方案中,脱酰胺变体包含选自以下的脱酰胺残基:天冬氨酸残基、琥珀酰亚胺-天冬氨酸残基或异天冬氨酸残基。
183.在一个实施方案中,组合物包含与seq id no:9的重链氨基酸序列和/或seq id no:10的轻链序列至少约90%相同的抗体,并且包含在重链氨基酸序列中的脱酰胺,例如在氨基酸n388和/或n393处的脱酰胺。
184.在一个实施方案中,组合物包含抗bcma抗体的脱酰胺变体,其中该脱酰胺变体包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中该组合物包含高达100%的脱酰胺变体。
185.在另一个实施方案中,组合物包含抗bcma抗体的脱酰胺变体,其中其中该氧化变体包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中该组合物包含高达100%的n388和/或n393脱酰胺变体。
186.在一个实施方案中,组合物包含贝兰他单抗的脱酰胺变体,其中该脱酰胺变体包含seq id no:9的重链序列和seq id no:10的轻链序列;其中该组合物包含高达100%的脱酰胺变体。在另一个实施方案中,组合物包含脱酰胺变体,该变体包含seq id no:12、seq id no:13或seq id no:14的重链序列和seq id no:10的轻链。
187.在另一个实施方案中,组合物包含抗体,该抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列组cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2、具有seq id no:6中所列氨基酸序列的cdrl3,并且包含在重链序列中的脱酰胺,例如在氨基酸n388和/或n393处的脱酰胺。
188.在另一个实施方案中,抗bcma抗体包含贝兰他单抗并且包含在重链序列中的脱酰胺,例如在氨基酸n388和/或n393处的脱酰胺。
189.在一个实施方案中,组合物包含与seq id no:9的重链氨基酸序列和/或seq id no:10的轻链序列至少约90%相同的抗体混合物,其中混合物中约≤100%、≤75%、≤60%、≤50%、≤40%、≤30%、≤25%、≤20%、≤15%、≤10%、≤5%、≤2%、0.1-100%、0.1-75%、0.1-50%、0.1-40%、0.1-30%、0.1-20%、or 0.1-10%、0.1-5%、0.1-3%、约0.5%、约1%、约2%、约5%或约10%的抗体在氨基酸n388处脱酰胺。
190.在一个实施方案中,组合物包含抗体混合物,其包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列组cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2、具有seq id no:6中所列氨基酸序列的cdrl3,其中混合物中约≤
100%、≤75%、≤60%、≤50%、≤40%、≤30%、≤25%、≤20%、≤15%、≤10%、≤5%、≤2%、0.1-100%、0.1-75%、0.1-50%、0.1-40%、0.1-30%、0.1-20%、or 0.1-10%、0.1-5%、0.1-3%、约0.5%、约1%、约2%、约5%或约10%的抗体在氨基酸n388处脱酰胺。
191.在另一个实施方案中,组合物包含贝兰他单抗,其中约≤100%、≤75%、≤60%、≤50%、≤40%、≤30%、≤25%、≤20%、≤15%、≤10%、≤5%、≤2%、0.1-100%、0.1-75%、0.1-50%、0.1-40%、0.1-30%、0.1-20%或0.1-10%、0.1-5%、0.1-3%、约0.5%、约0.5%、约1%、约2%、约5%或约10%的贝兰他单抗在氨基酸n388处脱酰胺。
192.在一个实施方案中,组合物包含与seq id no:9的重链氨基酸序列和/或seq id no:10的轻链序列至少约90%相同的抗体混合物,其中混合物中约≤100%、≤85%、≤70%、≤60%、≤50%、≤40%、≤30%、≤20%、≤15%、≤10%、≤5%、≤2%、0.1-100%、0.1-75%、0.1-50%、0.1-40%、0.1-30%、0.1-20%、or 0.1-10%、0.1-5%、0.1-3%、约0.5%、约1%、约2%、约5%或约10%的抗体在氨基酸n393处脱酰胺。
193.在一个实施方案中,组合物包含抗体的混合物,该混合物包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列组cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2、具有seq id no:6中所列氨基酸序列的cdrl3,其中混合物中约≤100%、≤85%、≤70%、≤60%、≤50%、≤40%、≤30%、≤20%、≤15%、≤10%、≤5%、≤2%、0.1-100%、0.1-75%、0.1-50%、0.1-40%、0.1-30%、0.1-20%或0.1-10%、0.1-5%、0.1-3%、约0.5%、约1%、约2%、约5%或约10%的抗体在氨基酸n393处脱酰胺。
194.在另一个实施方案中,组合物包含贝兰他单抗,其中约≤100%、≤85%、≤70%、≤60%、≤50%、≤40%、≤30%、≤20%、≤15%、≤10%、≤5%、≤2%、0.1-100%、0.1-75%、0.1-50%、0.1-40%、0.1-30%、0.1-20%、or 0.1-10%、0.1-5%、0.1-3%、约0.5%、约1%、约2%、约5%或约10%的贝兰他单抗在氨基酸n393处脱酰胺。
195.在一个实例中,可以使用胰蛋白酶肽图谱串联质谱法(肽图谱lc-ms/ms)测定脱酰胺。在一个实例中,包含本文所述组合物的样品可以例如在6m盐酸胍中变性至例如4.2μg/μl的浓度。然后可以将二硫键还原,例如用50mm dtt在室温下还原20分钟。然后例如可以以例如100mm添加碘乙酸盐并与游离半胱氨酸残基反应例如在室温下避光反应30分钟。然后在37℃下用0.5%胰蛋白酶消化15分钟之前,可以例如使用biorad离心柱(部件号7326221)对样品进行缓冲液交换。然后可以将所得肽加载到反相超高效液相色谱(uplc)柱上,并且可以使用uplc在例如0.1%三氟乙酸中用水和乙腈梯度洗脱。然后可以用uv检测器和质谱仪(例如thermo scientific ltq orbitrap xl)检测肽。使用未修饰和修饰肽的提取离子色谱图以通过将修饰肽的曲线下面积除以修饰和未修饰肽两者的曲线下总面积来计算脱酰胺的水平。
196.在一个实施方案中,翻译后修饰是抗体序列变体。示例性翻译后修饰抗体序列变体包含天冬酰胺(n)至天冬氨酸(d)开关、n端焦谷氨酸和/或c端赖氨酸切割。
197.在一个实例中,可以使用胰蛋白酶肽图谱串联质谱法(肽图谱lc-ms/ms)测定抗体变体,例如cdrh3处的n103d。在一个实例中,包含本文所述组合物的样品可以例如在6m盐酸胍中变性至例如4.2μg/μl的浓度。然后可以将二硫键还原,例如用50mm dtt在室温下还原20分钟。然后例如可以以例如100mm添加碘乙酸盐并与游离半胱氨酸残基反应例如在室温
下避光反应30分钟。然后在37℃下用0.5%胰蛋白酶消化15分钟之前,可以例如使用biorad离心柱(部件号7326221)对样品进行缓冲液交换。然后可以将所得肽加载到反相超高效液相色谱(uplc)柱上,并且可以使用uplc在例如0.1%三氟乙酸中用水和乙腈梯度洗脱。然后可以用uv检测器和质谱仪(例如thermo scientific ltq orbitrap xl)检测肽。使用未修饰和修饰肽的提取离子色谱图以通过将修饰肽的曲线下面积除以修饰和未修饰肽两者的曲线下总面积来计算抗体变体,例如cdrh3处的n103d的水平。
198.在一个方面,组合物包含抗体,该抗体包含在重链氨基酸序列中的n端焦谷氨酸(“焦谷氨酸”)过渡后修饰。在一个实施方案中,组合物包含与seq id no:9的重链氨基酸序列和/或seq id no:10的轻链序列至少约90%相同的抗体,并且包含在重链n端的焦谷氨酸。
199.在另一个实施方案中,组合物包含抗体,该抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列组cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2、具有seq id no:6中所列氨基酸序列的cdrl3,并且包含在重链n端的焦谷氨酸。
200.在另一个实施方案中,抗bcma抗体包含贝兰他单抗并且包含在重链n端的焦谷氨酸。
201.在一个实施方案中,组合物包含与seq id no:9的重链氨基酸序列和/或seq id no:10的轻链序列至少约90%相同的抗体混合物,其中混合物中约≥25%、≥50%、≥75%、≥80%、≥85%、≥90%、≥95%、100%或更少、95%或更少、90%或更少、85%或更少、80%或更少、75%或更少或50%或更少的抗体包含在重链氨基酸序列中的n端焦谷氨酸。
202.在一个实施方案中,组合物包含抗体混合物,其包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列组cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2、具有seq id no:6中所列氨基酸序列的cdrl3,其中混合物中约≥25%、≥50%、≥75%、≥80%、≥85%、≥90%、≥95%、100%或更少、95%或更少、90%或更少、85%或更少、80%或更少、75%或更少或50%或更少的抗体包含在重链氨基酸序列中的n端焦谷氨酸。
203.在一个实施方案中,组合物包含贝兰他单抗,其中约≥25%、≥50%、≥75%、≥80%、≥85%、≥90%、≥95%、100%或更少、95%或更少、90%或更少、85%或更少、80%或更少、75%或更少或50%或更少的贝兰他单抗包含在重链氨基酸序列中的n端焦谷氨酸。
204.在一个实例中,可以使用胰蛋白酶肽图谱串联质谱法(肽图谱lc-ms/ms)测定n端焦谷氨酸。在一个实例中,包含本文所述组合物的样品可以例如在6m盐酸胍中变性至例如4.2μg/μl的浓度。然后可以将二硫键还原,例如用50mm dtt在室温下还原20分钟。然后例如可以以例如100mm添加碘乙酸盐并与游离半胱氨酸残基反应例如在室温下避光反应30分钟。然后在37℃下用0.5%胰蛋白酶消化15分钟之前,可以例如使用biorad离心柱(部件号7326221)对样品进行缓冲液交换。然后可以将所得肽加载到反相超高效液相色谱(uplc)柱上,并且可以使用uplc在例如0.1%三氟乙酸中用水和乙腈梯度洗脱。然后可以用uv检测器和质谱仪(例如thermo scientific ltq orbitrap xl)检测肽。使用未修饰和修饰肽的提
取离子色谱图以通过将修饰肽的曲线下面积除以修饰和未修饰肽两者的曲线下总面积来计算焦谷氨酸的水平。
205.在一个方面,组合物包含抗体,该抗体包含在重链氨基酸序列中的c端赖氨酸切割翻译后修饰。在一个实施方案中,组合物包含与seq id no:9的重链氨基酸序列和/或seq id no:10的轻链序列至少约90%相同的抗体,并且包含重链的c端赖氨酸切割。
206.在另一个实施方案中,组合物包含抗体,该抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列组cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2、具有seq id no:6中所列氨基酸序列的cdrl3,并且包含并且包含重链的c端赖氨酸切割。
207.在另一个实施方案中,抗bcma抗体包含贝兰他单抗并且包含重链的c端赖氨酸切割。
208.在一个实施方案中,组合物包含与seq id no:9的重链氨基酸序列和/或seq id no:10的轻链序列至少约90%相同的抗体混合物,其中混合物中约≥25%、≥50%、≥75%、≥80%、≥85%、≥90%、≥95%、100%或更少、95%或更少、90%或更少、85%或更少、80%或更少、75%或更少或50%或更少的抗体包含c端赖氨酸切割。
209.在一个实施方案中,组合物包含抗体混合物,其包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列组cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2、具有seq id no:6中所列氨基酸序列的cdrl3,其中混合物中约≥25%、≥50%、≥75%、≥80%、≥85%、≥90%、≥95%、100%或更少、95%或更少、90%或更少、85%或更少、80%或更少、75%或更少或50%或更少的抗体包含重链的c端赖氨酸切割。
210.在一个实施方案中,组合物包含贝兰他单抗,其中约≥25%、≥50%、≥75%、≥80%、≥85%、≥90%、≥95%、100%或更少、95%或更少、90%或更少、85%或更少、80%或更少、75%或更少或50%或更少的贝兰他单抗包含重链的c端赖氨酸切割。
211.在一个实例中,可以使用胰蛋白酶肽图谱串联质谱法(肽图谱lc-ms/ms)测定c端赖氨酸切割。在一个实例中,包含本文所述组合物的样品可以例如在6m盐酸胍中变性至例如4.2μg/μl的浓度。然后可以将二硫键还原,例如用50mm dtt在室温下还原20分钟。然后例如可以以例如100mm添加碘乙酸盐并与游离半胱氨酸残基反应例如在室温下避光反应30分钟。然后在37℃下用0.5%胰蛋白酶消化15分钟之前,可以例如使用biorad离心柱(部件号7326221)对样品进行缓冲液交换。然后可以将所得肽加载到反相超高效液相色谱(uplc)柱上,并且可以使用uplc在例如0.1%三氟乙酸中用水和乙腈梯度洗脱。然后可以用uv检测器和质谱仪(例如thermo scientific ltq orbitrap xl)检测肽。使用未修饰和修饰肽的提取离子色谱图以通过将修饰肽的曲线下面积除以修饰和未修饰肽两者的曲线下总面积来计算c端赖氨酸切割的水平。
212.在一个方面,组合物包含抗体,该抗体包含糖基化翻译后修饰(“糖基化修饰”)或糖基化变体。示例性糖基化修饰包括抗体上g0、g1、g0-glcnac、g2和唾液酸化的表达变化。在一个实施方案中,组合物包含与seq id no:9的重链氨基酸序列和/或seq id no:10的轻
biolabs的pngasef试剂盒(cat#p0705l)通过用pngasef的酶促消化从例如包含贝兰他单抗的组合物中释放聚糖。聚糖可以通过pngasef释放并用邻氨基苯甲酰胺(sigma-aldrich,cat#a89804)进行标记。然后可以使用hilic柱步骤纯化经标记的聚糖以除去过量的标记溶液;可以加载聚糖并用水清洗并用乙腈洗脱。然后可以使用waters acquity uplc上的waters聚糖beh酰胺色谱柱(货号186004742)用甲酸铵/甲酸和乙腈梯度分离经标记的聚糖。然后可以,例如,通过使用在365nm处激发和在438nm处发射的荧光检测来检测聚糖。可以例如通过将聚糖的曲线下面积除以所有检测到的聚糖的曲线下总面积来实现聚糖的定量。
220.在一个方面,组合物包含为聚集抗体(高分子量(hmw)种类)的抗体,在本文中也称为“聚集变体”。聚集抗体可以包含由抗体单体及其亚基形成的二聚体或更高级结构。聚集变体可以是例如本文公开的抗体的共价或非共价、可还原或不可还原以及可见或仅显微镜可见(subvisible)的聚集体。聚集的或片段化的变体可以基于它们的大小来表征和区别于抗体。例如,可以使用尺寸排阻色谱(sec),例如se-hplc来检测抗体组合物的尺寸分布。
221.在一个方面,组合物包含抗体的聚集变体,其中该聚集变体包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链序列;其中该组合物包含≤10%的聚集变体。
222.抗体组合物可以包含≤10%的聚集变体,诸如≤7.5%、≤5%、≤4%、≤3%、≤2%或≤1%的聚集变体。在另一个实施方案中,组合物可以包含1-10%、1-5%、1-4%、1-3%或1-2%的聚集变体。或者,该组合物包含多于1%且少于10%的聚集变体。或者,组合物可以包含约7.5%、约5%、约4%、约3%、约2%或约1%的聚集变体。
223.片段化变体(“片段变体”)是包含全长抗体的部分的变体。例如,此类片段包括fab、fab’、f(ab’)2和fv片段、双抗体、线性抗体、单链抗体分子和免疫球蛋白单个可变结构域。
224.在一个方面,组合物包含抗体的片段变体,其中该片段变体包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链序列;其中该组合物包含≤10%的片段变体。
225.抗体组合物可以包含≤10%的片段化抗体,例如≤5%、≤4%、≤3%、≤2%或≤1%的片段化抗体。在另一个实施方案中,组合物可以包含0.5-10%、0.5-5%、0.5-4%、0.5-3%、0.5-2%、0.5-1.5%或0.5-1%的片段化抗体。或者,组合物可以包含约5%、约4%、约3%、约2%、约1%或约0.5%的片段化抗体。
226.组合物可以包含如本文所述的酸性、碱性、异构化、氧化、脱酰胺、n端焦谷氨酸、c端赖氨酸切割变体,和/或任何百分比的糖基化修饰变体,和/或聚集和/或片段化变体中的任一种或组合。
227.在一个实施方案中,组合物具有≥70%的bcma特异性抗原结合、≥70%的fcγriiia结合和/或≥70%的fcrn结合。
228.在另一个实施方案中,组合物具有约≥75%、≥80%、≥85%、≥90%或≥95%的bcma特异性抗原结合。在另一个实施方案中,组合物具有约≥75%、≥80%、≥85%、≥
90%、≥95%的fcγriiia结合。在另一个实施方案中,组合物具有约≥75%、≥80%、≥85%、≥90%、≥95%的fcrn结合。
229.在另一个实施方案中,组合物具有约70%至130%范围内的特异性抗原结合、约70%至130%范围内的fcγriiia结合和/或约70%至130%范围内的fcrn结合。
230.在一些实施方案中,组合物具有约75%至约125%、约80%至约120%、约90%至约110%、约70%、约80%、约90%或100%、约110%、约120%或约130%范围内的特异性抗原结合。在一些实施方案中,组合物具有约75%至约125%、约80%至约120%、约90%至约110%、约90%、约95%、约100%、约105%或约110%范围内的fcγriiia结合。在一些实施方案中,组合物具有约75%至约125%、约80%至约120%、约90%至约110%、约90%、约95%、约100%、约105%、约110%范围内的fcrn结合。
231.在另一个实施方案中,包含变体的组合物具有至少70%、至少75%、至少80%、至少85%、至少90%或至少95%的具有100%活性的贝兰他单抗的活性。在一个方面,组合物包含变体,其包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中该组合物具有包含以下的组合物的效力的至少70%:seq id no:9、11、12、13或14的重链序列和seq id no:10的轻链序列以及以下的任一种或组合(i)高达23%的在d103处的异构化,和/或(ii)高达37%的在m34处的氧化。
232.在另一个方面,组合物包含变体,其包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中该组合物具有包含以下的组合物的效力的至少70%:seq id no:9、11、12、13或14的重链序列和seq id no:10的轻链序列以及以下的任一种或组合(i)高达23%的在d103处的异构化,(ii)高达37%的在m34处的氧化,(iii)高达64%的在m256处的氧化,(iv)高达61%的在m432处的氧化,(v)高达100%在n388处的脱酰胺,和/或(vi)高达100%的在n393处的脱酰胺。在又一个方面,组合物包含变体,其包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中该组合物具有包含以下的组合物的效力的至少70%:seq id no:9、11、12、13或14的重链序列和seq id no:10的轻链序列以及以下的任一种或组合(i)高达23%的在d103处的异构化,(ii)高达37%的在m34处的氧化,(iii)高达64%的在m256处的氧化,(iv)高达61%的在m432处的氧化,(v)高达100%在n388处的脱酰胺,(vi)高达100%的在n393处的脱酰胺,(vii)高达100%的hc c端赖氨酸切割,和/或(viii)高达100%的hc n端焦谷氨酸。
233.在一个实例中,使用表面等离子共振(spr)测量贝兰他单抗莫福汀对bcma和fcγriiia的结合。可以用pbst将贝兰他单抗莫福汀稀释至10μg/ml,注射并由固定在cm5传感器芯片上的蛋白a捕获。然后可以注射bcma并与捕获的贝兰他单抗莫福汀结合。接下来,可以注射fcγriiia并使其与捕获的贝兰他单抗莫福汀结合。贝兰他单抗莫福汀与bcma和fcγriiia结合的功能浓度可以从参考标准曲线计算并分别报告为bcma或fcγriiia结合浓度。样品的总贝兰他单抗莫福汀浓度由280nm处的吸光度预先确定。可以通过将bcma或fcγriiia结合浓度除以280nm处的吸光度浓度来计算特异性结合活性(%)。
234.可以使用表面等离子共振(spr)测量新生fc受体(fcrn)与抗bcma抗原结合蛋白(例如贝兰他单抗)的结合。可以通过固定在氨三乙酸(nta)传感器芯片上的fcrn捕获贝兰他单抗。可以通过在校准曲线上内插结合响应来测定样品的fcrn结合浓度。通过将fcrn结合浓度除以总蛋白质浓度来计算特异性结合活性(%)。
235.在本领域技术人员已知的其他方法中,可以使用表面等离子共振(spr)测量抗bcma抗原结合蛋白(例如贝兰他单抗莫福汀)对bcma和fcγriiia的结合。在一个实例中,注射贝兰他单抗莫福汀并由固定在cm5传感器芯片上的蛋白a捕获。然后注射bcma并与捕获的贝兰他单抗莫福汀结合。接下来,注射fcγriiia并与捕获的贝兰他单抗莫福汀结合。贝兰他单抗莫福汀与bcma和fcγriiia结合的功能浓度可以从参考标准曲线计算并分别报告为bcma或fcγriiia结合浓度。样品的总贝兰他单抗莫福汀浓度可以通过280nm处的吸光度预先确定。可以通过将bcma或fcγriiia结合浓度除以例如280nm处的吸光度浓度来计算特异性结合活性(%)。
236.在某些实施方案中,平均dar或dl百分比影响与fcrn的结合。在另一个实施方案中,平均dar或dl百分比不影响与fcrn的结合。在又一个实施方案中,组合物包含贝兰他单抗莫福汀,并且平均dar或dl百分比影响与fcrn的结合。在又一个实施方案中,组合物包含贝兰他单抗莫福汀,并且平均dar或dl百分比不影响与fcrn的结合。在一个实施方案中,平均dar或dl百分比可能削弱与fcrn的结合。
237.可以使用表面等离子共振(spr)测量,新生fc受体(fcrn)与抗bcma抗原结合蛋白(例如贝兰他单抗莫福汀)的结合。可以通过固定在氨三乙酸(nta)传感器芯片上的fcrn捕获贝兰他单抗莫福汀。可以通过在校准曲线上内插结合响应来测定样品的fcrn结合浓度。通过将fcrn结合浓度除以总蛋白质浓度来计算特异性结合活性(%)。
238.当抗bcma抗原结合蛋白包含贝兰他单抗莫福汀时,本文所述的用于特异性抗原结合、fcγriiia和fcrn结合的spr方法可以使用贝兰他单抗或贝兰他单抗莫福汀的参考标准品。贝兰他单抗或贝兰他单抗莫福汀参考标准品可以用于测定以获得系统适用性和样品可比性数据,以确保方法正确执行。参考标准品可以允许建立校准曲线,并从曲线内插样品的浓度。例如,参考标准品可以是包含seq id no:9的重链氨基酸序列和seq id no:10的轻链氨基酸序列的组合物
239.包含上述抗体和抗体变体的抗体组合物保留特异性抗原结合和/或fcrn结合和/或fcγriiia结合和/或效力。例如,包含上述抗体和抗体变体以及翻译后修饰变体的抗体组合物具有》0.70的bcma特异性抗原结合;和/或》70%fcrn结合和/或70%fcγriiia结合和/或》70%效力。因此,这些水平(%)的变体在抗体组合物中可以耐受,而不显著影响功能(即不导致降低的活性)。在一个实施方案中,“降低的功能”或“降低的活性”是指与参考标准品相比,与bcma的结合或与fcrn的结合或与fcγriiia的结合或效力以百分比降低,并且在测定变异性上显著。例如,功能或活性或效力降低可以描述为降低≥5%、≥10%、≥15%、≥20%、≥25%、≥30%、≥35%、≥40%、≥45%,或≥50%。
240.在另一个实施方案中,参考样品标准品是包含seq id no:9的重链氨基酸序列和seq id no:10的轻链氨基酸序列的组合物,其中该组合物包含80%或更多的重链c端赖氨酸切割和100%或更少的重链n端焦谷氨酸。在进一步的实施方案中,参考样品标准品是包含seq id no:9的重链氨基酸序列和seq id no:10的轻链氨基酸序列的组合物,其中该组
al.(1993)cancer res.53:3336-3342)。
244.在一个实施方案中,抗bcma抗原结合蛋白是抗体-药物缀合物(“抗bcma adc”),其包含与一种或多种细胞毒剂,诸如化疗剂、药物、生长抑制物、毒素(例如蛋白质毒素、细菌、真菌、植物或动物来源的酶活性毒素或其片段)或放射性同位素(即放射性缀合物)缀合的抗体或抗体片段。
245.在一个实施方案中,抗bcma adc具有以下一般结构:
246.abp-((接头)
n-ctx)m247.其中:
248.abp是抗原结合蛋白、抗体或抗体片段;
249.接头不存在或为任何可切割或不可切割的接头;
250.ctx是本文所述的任何细胞毒剂;
251.n为0、1、2或3;和,
252.m是1、2、3、4、5、6、7、8、9或10。
253.在示例性实施方案中,可以使用的酶活性毒素及其片段包括白喉a链、白喉毒素的非结合活性片段、外毒素a链(来自铜绿假单胞菌(pseudomonas aeruginosa))、蓖麻毒蛋白(ricin)a链、相思豆毒蛋白(abrin)a链、蒴莲根毒蛋白(modeccin)a链、α-帚曲霉素(sarcin)、油桐(aleurites fordii)蛋白、香石竹毒蛋白(dianthin)蛋白质、美洲商陆(phytolaca americana)蛋白(papi、papii、和pap-s)、苦瓜(momordica charantia)抑制物、麻疯树毒蛋白、巴豆毒蛋白、肥皂草(sapaonaria officinalis)抑制物、白树毒蛋白(gelonin)、丝林霉素(mitogellin)、局限曲菌素(restrictocin)、酚霉素(phenomycin)、依诺霉素(enomycin)和单端孢菌素(trichothecenes。参见,例如,1993年10月28日公布的wo93/21232。多种放射性核素可用于生产放射性缀合抗体,包括例如
211
at、
212
bi、
131
i、
131
in、
90
y或
186
re。
254.本发明的抗bcma抗体或其片段也可以与一种或多种细胞毒剂缀合,包括但不限于加利车霉素、美登素类、尾海兔素(dolastatin)类、阿里他汀(auristatin)类、单端孢菌素(trichothecene)和cc1065,或有毒素活性的这些毒素的衍生物。合适的细胞毒剂包括,例如,阿里他汀,包括甲基缬氨酸-缬氨酸-海兔异亮氨酸-海兔脯氨酸-苯丙氨酸(mmaf)和单甲基澳瑞他汀e(mmae)以及mmae的酯形式、dna小沟区结合剂、dna小沟区烷化剂、烯二炔、lexitropsin、倍癌霉素(duocarmycin)、紫杉烷,包括紫杉醇和多西他赛(docetaxel)、嘌呤霉素、dolastatin、美登素和长春花生物碱。特异性细胞毒剂包括拓扑替康、吗啉代-多柔比星、根瘤菌素、氰基吗啉代-多柔比星、尾海兔素-10、棘霉素、康布他汀、卡里奇霉素(chalicheamicin)、美登素、dm-1、dm-4、纺锤菌素(netropsin)。其他合适的细胞毒剂包括抗微管蛋白剂,诸如阿里他汀、长春花生物碱、鬼臼毒素、紫杉烷、浆果赤霉素衍生物、隐藻素、美登素、考布他汀(combretastatin)或尾海兔素。抗微管蛋白剂包括二甲基缬氨酸-缬氨酸-海兔异亮氨酸-海兔脯氨酸-苯丙氨酸-对苯二胺(afp)、mmaf、mmae、阿里他汀e、长春新碱、长春碱、长春地辛、长春瑞滨、vp-16、喜树碱、紫杉醇、多西他赛、埃博霉素a、埃博霉素b、诺考达唑、秋水仙碱、秋水酰胺、雌莫司汀、西马多丁、圆皮海绵内酯(discodermolide)、美登素、dm-1、dm-4或软珊瑚醇(eleutherobin)。
255.在一个实施方案中,抗bcma adc包含与mmae或mmaf连接的抗bcma抗体。
[0256][0257]
示例性接头包括可切割和不可切割接头。可切割的接头在细胞内条件下可能易于切割。合适的可切割接头包括例如可由细胞内蛋白酶,诸如溶酶体蛋白酶或内体蛋白酶切割的肽接头。在示例性实施方案中,接头可以是二肽接头,例如缬氨酸-瓜氨酸(val-cit)或苯丙氨酸-赖氨酸(phe-lys)接头。其他合适的接头包括例如在小于5.5的ph下可水解的接头,诸如腙接头。其他合适的可切割接头包括例如二硫键接头。示例性接头包括6-马来酰亚胺基己酰基(mc)、马来酰亚胺基丙酰基(mp)、缬氨酸-瓜氨酸(val-cit)、丙氨酸-苯丙氨酸(ala-phe)、对氨基苄氧基羰基(pab)、n-琥珀酰亚胺基4-(2-吡啶基硫代)戊酸(spp)、n-琥珀酰亚胺基4-(n-马来酰亚胺甲基)环己烷-1羧酸酯(smcc)和n-琥珀酰亚胺基(4-碘-乙酰基)氨基苯甲酸酯(siab)。
[0258]
在一个实施方案中,接头可以包含巯基反应性马来酰亚胺、己酰基间隔物、二肽缬氨酸-5瓜氨酸、对氨基苄氧基羰基、自牺牲片段基团或蛋白酶抗性马来酰亚胺基己酰基。
[0259]
在另一个实施方案中,抗bcma adc包含通过mc接头与mmae或mmaf连接的抗bcma抗体,如以下结构所示:
[0260][0261][0262]
本文所述的抗bcma adc可以包含本文所述的任何抗bcma抗体和本文所述的任何细胞毒剂。
[0263]
在一个实施方案中,抗bcma adc包含抗bcma抗体,该抗bcma抗体包含cdrh1,其包含与seq id no:1中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列;cdrh2,其包含与seq id no:2中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或
100%序列同一性的氨基酸序列;cdrh3,其包含与seq id no:3中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列;cdrl1,其包含与seq id no:4中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列;cdrl2,其包含与seq id no:5中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列;和/或cdrl3,其包含与seq id no:6中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列;并与mmae或mmaf缀合。
[0264]
在又一个实施方案中,抗bcma adc包含抗bcma抗体,该抗体包含具有seq id no:1中所列氨基酸序列的cdrh1;具有seq id no:2中所列氨基酸序列的cdrh2;具有seq id no:3中所列氨基酸序列的cdrh3;具有seq id no:4中所列氨基酸序列的cdrl1;具有seq id no:5中所列氨基酸序列的cdrl2;以及具有seq id no:6中所列氨基酸序列的cdrl3;并与mmaf或mmae缀合。
[0265]
在一个实施方案中,抗bcma adc包含抗bcma抗体,该抗bcma抗体包含vh,其包含与seq id no:7中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列;和/或v
l
,其包含与seq id no:8中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列;并与mmae或mmaf缀合。
[0266]
在又一个实施方案中,抗bcma adc包含抗bcma抗体,该抗bcma抗体包含具有seq id no:7中所列氨基酸序列的vh;和具有seq id no:8中所列氨基酸序列的v
l
;并与mmaf或mmae缀合。
[0267]
在一个实施方案中,抗bcma adc包含抗bcma抗体,该抗bcma抗体包含hc,其包含与seq id no:9中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列;和/或lc,其包含与seq id no:10中所列的氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列;并与mmaf或mmae缀合。
[0268]
在又一个实施方案中,抗bcma adc是包含抗bcma抗体的贝兰他单抗莫福汀,该抗bcma抗体包含具有seq id no:9中所列氨基酸序列的hc和具有seq id no:10中所列氨基酸序列的lc;并与mmaf缀合。
[0269]
adc的制备和表征
[0270]
在某些天然igg1分子中包含16个二硫键(32个半胱氨酸或巯基基团)。在某些方面,可以以这样的方式还原抗体,该方式为仅将四个链间二硫键还原并与细胞毒剂缀合,而允许高达八个的细胞毒剂的附着位点。换言之,药物载荷(“dl”),即每个抗体分子的细胞毒剂数量可以在0到8的范围内,并且在本文中描述为dl0、dl2(包括dl2a和dl2b)、dl4(包括dl4a、dl4b和dl4c)、dl6(包括dl6a和dl6b)和dl8。
[0271]
对于给定的adc组合物,缀合过程可能导致药物-抗体附着的异质性,这在1)与每个抗体分子结合的药物的数量和2)细胞毒剂的位置上均不同。这可以导致如图1所例示的具有各种dl种类的adc组合物。如本文所用,术语“adc组合物”是指含有抗体种类的异质混合物的组合物,该抗体种类包含各种载药量(“dl”)。(参见例如图2)。整个异质adc组合物的
平均药物-抗体比在本文中称为“平均dar”或“dar”。例如,adc组合物可能包含抗体种类的混合物,每种抗体具有它们自己的dl(混合物中的一些种类是dl2,混合物中的一些种类是dl4,混合物中的一些种类是dl6,混合物中的一些种类是dl8),并且整个组合物的平均dar可能为约4。
[0272]
在另一个实施方案中,术语“dl百分比”可以用于描述异质adc组合物中特定dl种类的百分比(例如dl2百分比为总异质adc组合物的约10%至约30%)。
[0273]
在本发明的某些方面,药物可以通过抗体上的巯基基团与抗体缀合。巯基基团可以是半胱氨酸侧链上的巯基基团。半胱氨酸残基可以天然存在于抗体中(例如链间二硫化物)或通过其他方式引入,例如诱变。将药物与抗体上的巯基基团缀合的方法是本领域熟知的(参见,例如美国专利号7,659,241、7,498,298和国际公开号wo 2011/130613、wo 2014/152199、wo 2015/077605和bioconjugate chem.2005,16,1282-1290)。抗体通常在缀合之前被还原,以使巯基基团可用于缀合。可以使用本领域已知的条件还原抗体。还原条件是那些通常不引起抗体的任何实质性变性并且通常不影响抗体的抗原结合亲和力的条件。
[0274]
在本发明的一个方面,还原步骤中使用的还原剂是tcep(三(2-羧乙基)膦),并且添加tcep,例如,在室温下过量30分钟。例如,在室温下,250μl的tcep的10mm溶液(ph 7.4)将在30分钟内很容易地还原1至100ug抗体的链间二硫化物。然而,可以使用其他还原剂和条件。反应条件的实例包括在5到8的ph范围内从5℃到37℃的温度。
[0275]
存在多种方法并且为本领域技术人员所已知,用于计算adc组合物中的dl种类百分比和/或平均dar。例如,半胱氨酸连接的adc的异质性通常通过疏水相互作用色谱(hic)测量,该色谱根据装载的药物数量分离dl种类。还已经开发lc-ms测定来评估dl分布。可以在例如journal of chromatography b 1060(2017)182-18中找到用于计算adc组合物中药物载荷分布的示例性方法。
[0276]
例如,dl0在抗体上没有药物载荷。例如,dl2具有2的药物载荷。在一个实施方案中,dl2的缀合位点是lc c214和hc 224。例如,dl4具有4的药物载荷。在一个实施方案中,dl4a的缀合位点是lc c214、hc 224、lc c214和hc 224。在一个实施方案中,dl4b的缀合位点是lc c230、hc 233、lc c230和hc 233。例如,dl6具有6的药物载荷。在一个实施方案中,dl6的缀合位点是lc c214、hc 224、lc c230、hc 233、lc c230和hc 233。例如,dl8具有8的药物载荷。在一个实施方案中,dl8的缀合位点是lc c214、hc 224、lc c214、hc 224、lc c230、hc 233、lc c230和hc 233。
[0277]
在一个实施方案中,具体dl种类的百分比(例如dl0百分比、dl2百分比、dl4a百分比、dl4b百分比、dl6百分比、dl8百分比)可以通过使用疏水相互作用色谱(hic)分离单个dl种类、计算每个dl峰的曲线下面积,并且将每个dl峰除以所有组合的dl种类的曲线下总面积来测定。在一个实施方案中,可以使用以下公式从每个dl种类的曲线下面积计算平均dar:
[0278][0279][0280]
其中:
[0281]ax
=加载x峰的峰面积
[0282]
x=a0、a1、a2、a3、a
4a
、a
4b
、a5、a6、a8和a
10
[0283]
a0、a1、a2、a3、a
4a
、a
4b
、a5、a6、a8和a
10
=为dl0、dl1、dl2、dl3、dl4a、dl4b、dl5、dl6、dl8和dl10峰的峰面积(仅包括≥dl(0.08%)的峰)
[0284]
在一个实施方案中,具体dar亚种的百分比(例如,dl2a在总dl2中的百分比)通过使用可以包括hic、非还原分离方法和质量光谱技术的分析技术的组合收集特定dl种类来确定。
[0285]
在一个实施方案中,抗bcma adc组合物具有以下的平均dar:约2至约7、约2至约6、约2.1至约5.7、约2.1至约5.0、约2.1至约4.6、约2.1至约4.1、约2.1至约3.5、约2.1至约3.0、约3.0至约5.7、约3.0至约5.0、约3.0至约4.6、约3.0至约4.1、约3.0至约3.5、约3.5至约5.7、约3.5至约5.0、约3.5至约4.6、约3.5至约4.1、约3.8至约4.5、约4.1至约5.7、约4.1至约5.0、约4.1至约4.6、约4.6至约5.7、约4.6至约5.0、约5.0至约5.7、约2.1、约3.0、约3.5、约4.1、约4.6、约5.0或约5.7。
[0286]
在另一个实施方案中,组合物包含抗bcma adc,其中平均dar为约2.1至约5.7、约3.4至约4.6、约3.8至约4.5或约4。
[0287]
在一个实施方案中,组合物包含抗bcma adc,其中该抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2和具有seq id no:6中所列氨基酸序列的cdrl3;其中细胞毒剂是mmae或mmaf;并且其中平均dar为约2至约6、约2.1至约5.7、约3.4至约4.6或约3.8至约4.5。
[0288]
在一个实施方案中,组合物包含抗bcma adc,其中该抗体包含具有seq id no:7中所列氨基酸序列的vh和具有seq id no:8中所列氨基酸序列的v
l
;其中细胞毒剂是mmae或mmaf;并且其中平均dar为约2至约6、约2.1至约5.7、约3.4至约4.6或约3.8至约4.5。
[0289]
在一个实施方案中,组合物包含贝兰他单抗莫福汀,其中平均dar为约2至约6、约2.1至约5.7、约3.4至约4.6或约3.8至约4.5。
[0290]
在一个实施方案中,抗bcma adc组合物中的dl0种类百分比为约10%或更少、约5%或更少、约1%至约10%、约1%至约5%或约2.8%至约4.7%。
[0291]
在一个实施方案中,抗bcma adc组合物中dl2种类的百分比为至少约10%、至少约15%、约15.8%至约26.3%、约15%至约27%、约15%至约32%,或约10%至约40%。
[0292]
在一个实施方案中,抗bcma adc组合物中的dl4a种类百分比为至少约30%、至少约35%、约35.5%至约37.9%、约35%至约38%、约30%至约40%,或约20%至约50%。在另一个实施方案中,dl4a种类百分比是抗bcma adc组合物中的主要种类并且包含约≥30%、≥40%、≥50%、≥60%、≥70%、≥80%或≥90%的所有种类组合。
[0293]
在一个实施方案中,抗bcma adc组合物中的dl4b种类百分比为至少约5%、至少约7%、约7.1%至约8.5%、约7%至约9%、约5%至约10%,或约1%至约15%。
[0294]
在一个实施方案中,抗bcma adc组合物中的dl6种类百分比为至少约10%、至少约14%、约14.0%至约19.1%、约14%至约20%、约10%至约20%,或约5%至约30%。
[0295]
在一个实施方案中,抗bcma adc组合物中的dl8种类百分比为至少约1%、至少约6%、约6.0%至约12.0%、约4%至约15%,或约1%至约20%%。
[0296]
在一个实施方案中,组合物包含抗bcma adc,其中dl2百分比为约15%至约27%或约15%至约32%,dl4a百分比为约35%至约38%或约30%至约40%,dl4b百分比为约7%至约9%或约5%至约10%,dl6百分比为约14%至约20%或约10%至约20%,和/或dl8为约6.0%至约12.0%或约4%至约15%。
[0297]
在一个实施方案中,组合物包含抗bcma adc,其中该抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2和具有seq id no:6中所列氨基酸序列cdrl3;其中细胞毒剂是mmae或mmaf;并且其中dl2百分比为约15%至约27%或约15%至约32%,dl4a百分比为约35%至约38%或约30%至约40%,dl4b百分比为约7%至约9%或约5%至约10%,百分比dl6为约14%至约20%或约10%至约20%,和/或dl8为约6.0%至约12.0%或约4%至约15%。
[0298]
在一个实施方案中,组合物包含抗bcma adc,其中该抗体包含具有seq id no:7中所列氨基酸序列的vh和具有seq id no:8中所列氨基酸序列的v
l
;其中细胞毒剂是mmae或mmaf;并且其中dl2百分比为约15%至约27%或约15%至约32%,dl4a百分比为约35%至约38%或约30%至约40%,dl4b百分比为约7%至约9%或约5%至约10%,百分比dl6为约14%至约20%或约10%至约20%,和/或dl8为约6.0%至约12.0%或约4%至约15%。
[0299]
在一个实施方案中,组合物包含贝兰他单抗莫福汀,其中dl2百分比为约15%至约27%或约15%至约32%,dl4a百分比为约35%至约38%或约30%至约40%,dl4b百分比为约7%至约9%或约5%至约10%,dl6百分比为约14%至约20%或约10%至约20%,和/或dl8为约6.0%至约12.0%或约4%至约15%。
[0300]
如本文所用,术语“不期望的dar种类”是指在最终组合物中不期望并且可能对最终治疗产物的某些特性(例如靶结合、功效、安全性等)具有负面影响的任何dar种类。在一个实施方案中,不期望的dar种类是dl0,即在缀合过程之后不与细胞毒剂结合的抗体。在一个实施方案中,adc组合物中的dl0百分比小于或等于约15%、约14%、约13%、约12%、约11%、约10%、约9%、约8%、约7%、约6%、约5%、约4%、约3%、约2%、约1%或约0.5%。在另一个实施方案中,adc组合物中的dl0百分比为约1%至约10%、约2%至约5%或约2.0%至约4.8%。
[0301]
在一个实施方案中,组合物包含抗bcma adc,其中该抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2和具有seq id no:6中所列氨基酸序列的cdrl3;其中细胞毒剂是mmae或mmaf;其中dl0百分比小于或等于约10%或约5%。
[0302]
在一个实施方案中,组合物包含抗bcma adc,其中该抗体包含具有seq id no:7中所列氨基酸序列的vh和具有seq id no:8中所列氨基酸序列的v
l
;其中细胞毒剂是mmae或mmaf;其中dl0百分比小于或等于约10%或约5%。
[0303]
在一个实施方案中,组合物包含贝兰他单抗莫福汀,其中dl0百分比小于或等于约10%或约5%。
[0304]
在一个实施方案中,组合物包含贝兰他单抗莫福汀,其中dl0百分比小于或等于约
10%或约5%,dl2百分比为约15%至约27%或约15%至约32%,dl4a百分比为约35%至约38%或约30%至约40%,dl4b百分比为约7%至约9%或约5%至约10%,dl6百分比为约14%至约20%或约10%至约20%,和/或dl8为约6.0%至约12.0%或约4%至约15%。
[0305]
在某些实施方案中,平均dar或dl百分比影响细胞生长抑制和/或肿瘤体积。在某些实施方案中,平均dar不影响细胞生长抑制和/或肿瘤体积。在另一个实施方案中,随着平均dar或dl百分比增加,细胞生长抑制增加和/或肿瘤体积减少。在又一个实施方案中,组合物包含贝兰他单抗莫福汀,并且随着组合物的平均dar或dl百分比增加,癌细胞生长抑制增加和/或肿瘤体积减少。
[0306]
可以通过在与本文所述的组合物(例如贝兰他单抗莫福汀)温育后测量细胞系(例如多发性骨髓瘤细胞系)的细胞活力来测定细胞生长抑制相对效力。可以使用本领域技术人员已知的细胞活力测定法来测量细胞活力。可以使用非线性回归逻辑模型生成剂量响应(半数最大有效浓度或ec50)。可以计算参考标准品的ec50与包含该组合物的样品的ec50的比率以确定相对效力
[0307]
在一个实施方案中,组合物具有约0.5至约1.3,或约0.8至约1.1的细胞生长抑制相对效力。在另一个实施方案中,组合物包含约2.1至约5.7的平均dar,并且具有约0.5至约1.3的细胞生长抑制相对效力。在另一个实施方案中,组合物包含约3.0至约5.0或约3.5至约4.6的平均dar,并且具有约0.8至约1.1的细胞生长抑制相对效力。在另一个实施方案中,组合物包含具有约3.0至约5.0或约3.5至约4.6的平均dar的贝兰他单抗莫福汀,并且具有约0.8至约1.1的细胞生长抑制相对效力。
[0308]
在某些实施方案中,平均dar或dl百分比影响adcc活性。在另一个实施方案中,平均dar或dl百分比不影响adcc活性。在又一个实施方案中,组合物包含贝兰他单抗莫福汀,平均dar或dl百分比影响adcc活性。在又一个实施方案中,组合物包含贝兰他单抗莫福汀,平均dar或dl百分比不影响adcc活性。
[0309]
例如,可以通过温育贝兰他单抗莫福汀、细胞(例如多发性骨髓瘤细胞)和nk细胞(效应细胞)来测量adcc活性相对效力。不受理论束缚,贝兰他单抗莫福汀与细胞表面表达的bcma结合,抗体的fc区通过其fcγriiia受体与效应细胞上的fcγriiia结合。这些受体与效应细胞表面的结合导致细胞因子(ifng)的合成和分泌,以及进入靶细胞细胞质的颗粒(穿孔素和颗粒酶)的释放。颗粒酶在靶细胞内启动信号传导事件,导致这些细胞因凋亡而死亡。nk细胞的来源可以是分离自人全血的外周血单个核细胞(pbmc)。然后可以添加batda(双-(乙酰氧基甲基)2,2’:6’,2
”‑
三联吡啶-6,6
”‑
二羧酸盐)以穿透靶细胞膜以标记细胞。细胞溶解后,该配体可以与delfia铕溶液缔合以形成高荧光且稳定的螯合物(eutda)。所测得的信号与裂解细胞的量直接相关。然后可以将adcc活性报告为样品ec50值与参考标准值的比率。
[0310]
在一个实施方案中,组合物具有约0.70至约1.30,或约0.8至约1.1的adcc活性相对效力。在另一个实施方案中,组合物包含约2.1至约5.7的平均dar,并且具有约0.5至约1.3的adcc活性相对效力。在另一个实施方案中,组合物包含约3.0至约5.0或约3.5至约4.6的平均dar,并且具有约0.8至约1.1的adcc活性相对效力。在另一个实施方案中,组合物包含具有约3.0至约5.0或约3.5至约4.6的平均dar的贝兰他单抗莫福汀,并且具有约0.8至约1.1的adcc活性相对效力。
[0311]
在某些实施方案中,平均dar或dl百分比影响与bcma的结合。在另一个实施方案中,平均dar或dl百分比不影响与bcma的结合。在又一个实施方案中,组合物包含贝兰他单抗莫福汀,平均dar或dl百分比影响与bcma的结合。在又一个实施方案中,组合物包含贝兰他单抗莫福汀,平均dar或dl百分比不影响与bcma的结合。在一个实施方案中,平均dar或dl百分比可能削弱与bcma的结合。
[0312]
在一个实施方案中,组合物具有≥70%、≥75%、≥80%、≥85%、≥90%、≥95%的相对bcma特异性抗原结合。在另一个实施方案中,组合物包含贝兰他单抗莫福汀并且具有大于85%或大于90%的相对bcma特异性抗原结合。在另一个实施方案中,组合物包含贝兰他单抗莫福汀,具有约2.1至约5.7或约3.0至约5.0或约3.5至约4.6的平均dar,并且具有大于85%或大于90%的相对bcma特异性抗原结合。
[0313]
在某些实施方案中,平均dar或dl百分比影响与fcγriiia的结合。在另一个实施方案中,平均dar或dl百分比不影响与fcγriiia的结合。在另一个实施方案中,组合物包含贝兰他单抗莫福汀,平均dar或dl百分比影响与fcγriiia的结合。在又一个实施方案中,组合物包含贝兰他单抗莫福汀,平均dar或dl百分比不影响与fcγriiia的结合。在一个实施方案中,平均dar或dl百分比可能削弱与fcγriiia的结合。
[0314]
在一个实施方案中,组合物具有≥70%、≥75%、≥80%、≥85%、≥90%、≥95%的相对fcγriiia结合。在另一个实施方案中,组合物包含贝兰他单抗莫福汀并且具有大于85%或大于90%的相对fcγriiia结合。在另一个实施方案中,组合物包含贝兰他单抗莫福汀,具有约2.1至约5.7或约3.0至约5.0或约3.5至约4.6的平均dar,并且具有大于85%或大于90%的相对fcγriiia结合。
[0315]
在本领域技术人员已知的其他方法中,可以使用表面等离子共振(spr)测量抗bcma抗原结合蛋白(例如贝兰他单抗莫福汀)对bcma和fcγriiia的结合。在一个实例中,注射贝兰他单抗莫福汀并由固定在cm5传感器芯片上的蛋白a捕获。然后注射bcma并与捕获的贝兰他单抗莫福汀结合。接下来,注射fcγriiia并与捕获的贝兰他单抗莫福汀结合。贝兰他单抗莫福汀与bcma和fcγriiia结合的功能浓度可以从参考标准曲线计算并分别报告为bcma或fcγriiia结合浓度。样品的总贝兰他单抗莫福汀浓度可以通过280nm处的吸光度预先确定。可以通过将bcma或fcγriiia结合浓度除以例如280nm处的吸光度浓度来计算特异性结合活性(%)。
[0316]
在某些实施方案中,平均dar或dl百分比影响与fcrn的结合。在另一个实施方案中,平均dar或dl百分比不影响与fcrn的结合。在又一个实施方案中,组合物包含贝兰他单抗莫福汀,平均dar或dl百分比影响与fcrn的结合。在又一个实施方案中,组合物包含贝兰他单抗莫福汀,平均dar或dl百分比不影响与fcrn的结合。在一个实施方案中,平均dar或dl百分比可能削弱与fcrn的结合。
[0317]
可以使用表面等离子共振(spr)测量新生fc受体(fcrn)与抗bcma抗原结合蛋白,例如贝兰他单抗莫福汀的结合。可以由固定在氨三乙酸(nta)传感器芯片上的fcrn捕获贝兰他单抗莫福汀。可以通过在校准曲线上内插结合响应来测定样品的fcrn结合浓度。通过将fcrn结合浓度除以总蛋白质浓度来计算特异性结合活性(%)。
[0318]
当抗bcma抗原结合蛋白包含贝兰他单抗莫福汀时,本文所述的用于特异性抗原结合、fcγriiia和fcrn结合的spr方法可以使用贝兰他单抗或贝兰他单抗莫福汀的参考标准
品。贝兰他单抗或贝兰他单抗莫福汀参考标准品可以用于检测以获得系统适用性和样品可比性数据,以确保方法正确执行。参考标准品可以允许建立校准曲线,并从曲线内插样品的浓度。例如,参考标准品可以是包含seq id no:9的重链氨基酸序列和seq id no:10的轻链氨基酸序列并且包含已知的dl和/或平均dar含量的组合物。
[0319]
示例性参考标准品可以包括具有已知的dl种类组分/量和/或平均dar的贝兰他单抗莫福汀的样品。
[0320]
药物组合物
[0321]
本文所述的组合物可以是药物组合物的形式。“药物组合物”可以包含本文所述的组合物(即活性成分)和一种或多种药学上可接受的赋形剂。赋形剂必须在与配制剂的其他成分相容、能够制成药物配制剂、对其接受者无害和/或不干扰活性成分的功效的意义上是可接受的。
[0322]
如本文所用,“药学上可接受的赋形剂”可以包括任何和所有溶剂、稀释剂、载体、分散介质、包衣、抗菌剂和抗真菌剂、等渗剂和/或吸收延迟剂。药学上可接受的赋形剂的实例包括缓冲剂、水、盐水、磷酸盐缓冲盐水、右旋糖、甘油、乙醇等中的一种或多种,以及其组合。在许多情况下,优选在组合物中包括等渗剂,例如多元醇、糖、多元醇诸如甘露醇、山梨糖醇或氯化钠。防腐剂;共溶剂;抗氧化剂,包括抗坏血酸和甲硫氨酸;螯合剂,诸如edta;金属络合物(例如,zn2+-蛋白质络合物);生物可降解的聚合物;和/或形成盐的平衡离子,诸如钠或钾。
[0323]
赋形剂或其他材料的确切性质可能取决于施用途径,例如,口服、直肠、鼻腔、局部(包括口腔和舌下)、阴道、肠胃外(包括皮下、肌内、静脉内、皮内)、鞘内和硬膜外)和瘤内。应当理解,优选的赋形剂可以随例如接受者的状况和待治疗的疾病而变化。
[0324]
赋形剂的混合物和各自的浓度一起形成“药物配制剂”(或“配制剂”)。该配制剂可以是液体形式或冻干形式。可以将液体配制剂中的组合物填充到容器中并冷冻。在某些实施方案中,包含组合物的冷冻配制剂的等分物可以经冻干。可以通过添加水或其他水溶液来重构冻干物以产生包含该组合物的重构配制剂。
[0325]
在一些实施方案中,抗bmca抗原结合蛋白以至少约10mg/ml或至少约20mg/ml的浓度存在于配制剂中。在一些实施方案中,抗bmca抗原结合蛋白以约20mg/ml至约100mg/ml或约20mg/ml至约60mg/ml的浓度存在于配制剂中。在某些实施方案中,配制剂中抗bcma抗原结合蛋白的浓度为约20mg/ml、约25mg/ml、约50mg/ml、约60mg/ml或约100mg/ml。在一个实施方案中,抗bmca抗原结合蛋白以约20mg/ml或约25mg/ml的浓度存在于液体配制剂中。在另一个实施方案中,抗bmca抗原结合蛋白以约50mg/ml或约60mg/ml的浓度存在于冻干配制剂中。在又一个实施方案中,抗bmca抗原结合蛋白以约50mg/ml的浓度存在于重构配制剂中。
[0326]
在某些实施方案中,缓冲剂是柠檬酸盐缓冲剂。可以例如通过使用共轭酸/共轭碱系统(柠檬酸钠/柠檬酸)或通过柠檬酸钠溶液的hcl滴定来实现柠檬酸盐缓冲剂。在某些实施方案中,柠檬酸盐缓冲液的浓度为约10mm至约30mm。在优选的实施方案中,柠檬酸盐缓冲液的浓度为25mm。在一些实施方案中,缓冲剂是浓度为约5mm至约35mm的组氨酸缓冲剂。
[0327]
可以使用缓冲剂来帮助维持优选的ph范围。在某些实施方案中,配制剂的ph为约5.5至约7或约5.9至约6.5,优选ph 6.2。
no:5中所列氨基酸序列的cdrl2和具有seq id no:6中所列氨基酸序列的cdrl3;其中细胞毒素是mmae或mmaf;并且其中该配制剂包含约20mg/ml至约60mg/ml的adc、约10mm至约30mm的柠檬酸盐缓冲液、约120mm至约240mm的海藻糖、约0.01mm至约0.1mm的edta、约0.01%至约0.05%的聚山梨酯20或聚山梨酯80,ph为约5.9至约6.5。
[0337]
在一个实施方案中,组合物在配制剂中包含adc,其中抗体包含具有seq id no:7中所列氨基酸序列的vh和具有seq id no:8中所列氨基酸序列的v
l
;其中细胞毒素是mmaf或mmae;并且其中该配制剂包含约20mg/ml至约60mg/ml的adc、约10mm至约30mm的柠檬酸盐缓冲液、约120mm至约240mm的海藻糖、约0.01mm至约0.1mm的edta、约0.01%至约0.05%的聚山梨酯20或聚山梨酯80,ph为约5.9至约6.5。
[0338]
在一个实施方案中,组合物在配制剂中包含adc,其中adc是贝兰他单抗莫福汀;并且其中该配制剂包含约20mg/ml至约60mg/ml的贝兰他单抗莫福汀、约10mm至约30mm的柠檬酸盐缓冲液、约120mm至约240mm的海藻糖、约0.01mm至约0.1mm的edta、约0.01%至约0.05%的聚山梨酯20或聚山梨酯80,ph为约5.9至约6.5。
[0339]
在一个实施方案中,组合物包含配制剂中的贝兰他单抗莫福汀,该配制剂包含约20mg/ml、约25mg/ml、约50mg/ml或60mg/ml贝兰他单抗莫福汀、25mm柠檬酸盐缓冲液、200mm海藻糖、0.05mm edta二钠、0.02%聚山梨酯或80聚山梨酯80,ph为约5.9至约6.5。
[0340]“稳定的”配制剂是其中的蛋白质在制造、运输、贮存和施用期间基本上保持其物理和/或化学稳定性的配制剂。可以在选定的温度下在选定的时间段内测量稳定性。例如,对于在2℃至8℃的推荐温度下贮存的产物,配制剂在室温、约30℃或在40℃下稳定至少1个月和/或在约2至8℃下稳定至少1年,优选至少2年。例如,贮存期间的聚集程度可以用作蛋白质稳定性的指标。因此,“稳定的”配制剂可以是其中例如少于约10%,优选少于约5%的蛋白质作为聚集体存在于配制剂中的配制剂。用于测量蛋白质稳定性的各种分析技术在本领域中是可用的,并且在例如peptide and protein drug delivery,247-301,vincent lee ed.,marcel dekker,inc.,new york,n.y.,pubs.(1991)and jones,a.adv.drug delivery rev.10:29-90(1993)中综述。
[0341]
在本发明的某些方面,配制剂允许组合物在冷冻、解冻和/或混合时保持稳定。
[0342]
在又一方面,本发明涉及工业产品,例如试剂盒,其包括容纳本文所述配制剂中的组合物的容器。在一个方面,提供了包含该配制剂的注射装置。注射装置可以包括笔式注射器装置或自动注射器装置。在一个实施方案中,配制剂包含在预装填注射器中。
[0343]
治疗方法和使用组合物
[0344]
本发明的目的是提供治疗b细胞相关病症或疾病的治疗方法,诸如抗体介导的或浆细胞介导的疾病,或浆细胞恶性肿瘤(例如癌症,诸如多发性骨髓瘤),或可以通过抗bcma抗原结合蛋白治疗的其他疾病。特别地,本发明的目的是提供包含抗bcma抗原结合蛋白例如抗bcma抗体的组合物,其特异性结合至bcma(例如人bcma)并调控(即抑制或阻断)bcma和其配体(诸如baff和/或april)之间的相互作用,用于治疗对该相互作用的调控有响应的疾病和病症。
[0345]
在本发明的另一个方面,提供了治疗患有b细胞相关病症或疾病,诸如抗体介导的或浆细胞介导的疾病,或浆细胞恶性肿瘤(例如癌症,诸如多发性骨髓瘤)的受试者(例如,人患者)的方法,这种方法包括向所述受试者施用治疗有效量的本文所述的抗bcma抗原结
合蛋白组合物的步骤。
[0346]
在又一个实施方案中,本发明提供了治疗癌症患者的方法,该方法包括向所述患者施用治疗有效量的本文所述的抗bcma抗原结合蛋白组合物的步骤。
[0347]
如本文所用,术语“癌症”和“肿瘤”可互换使用,并且无论以单数或复数形式,是指已经经历转化,诸如恶性转化,这使得它们对宿主生物体来说是病理性的。通过确立已久的技术,特别是组织学检查,可以很容易地将原代癌细胞与非癌细胞区分开来。如本文所用,癌细胞的定义不仅包括原代癌细胞,还包括衍生自癌细胞祖先的任何细胞。这包括转移的癌细胞,以及衍生自癌细胞的体外培养物和细胞系。当提到通常表现为实体瘤的癌症类型时,“临床可检测的”肿瘤是指基于肿瘤块可检测到的肿瘤;例如,通过规程,诸如计算机断层摄影术(ct)扫描、磁共振成像(mri)、x射线、超声波或体格检查时的触诊,和/或其由于从患者可获得的样品中的一种或多种癌症特异性抗原的表达而可检测。肿瘤可以是造血(或血液的或血液学的或血液相关的)癌症,例如衍生自血细胞或免疫细胞的癌症,其可以称为“液体肿瘤”。基于血液肿瘤的临床病症的具体实例包括白血病,诸如慢性粒细胞白血病、急性粒细胞白血病、慢性淋巴细胞白血病和急性淋巴细胞白血病;浆细胞恶性肿瘤,诸如多发性骨髓瘤、mgus和华氏巨球蛋白血症;淋巴瘤,诸如非霍奇金淋巴瘤、霍奇金淋巴瘤;以及等等。
[0348]
癌症可以是其中存在异常数量的原始细胞或不想要的细胞增殖或诊断为血液癌症的任何癌症,包括淋巴和骨髓恶性肿瘤。髓系恶性肿瘤包括但不限于急性髓系(或髓细胞性或髓性或成髓细胞)白血病(未分化或分化)、急性早幼粒细胞(或早幼粒细胞性或早幼粒细胞或成早幼粒细胞)白血病、急性髓单核细胞(或成髓单核细胞)白血病、急性单核细胞(或成单核细胞)白血病、红白血病和巨核细胞(或成巨核细胞)白血病。这些白血病可以统称为急性髓性(或髓细胞性或髓性)白血病(aml)。髓系恶性肿瘤还包括骨髓增殖性病症(mpd),包括但不限于慢性髓性(或髓性)白血病(cml)、慢性粒单核细胞白血病(cmml)、原发性血小板增多症(或血小板增多症)和真性红细胞增多症(pcv)。髓系恶性肿瘤还包括骨髓增生异常(或骨髓增生异常综合征或mds),其可以称为难治性贫血(ra)、难治性贫血伴原始细胞增多症(raeb)和难治性贫血伴原始细胞转化增多(raebt);以及骨髓纤维化(mfs)伴或不伴原因不明的髓样化生等。
[0349]
造血系统癌症还包括淋巴恶性肿瘤,可能影响淋巴结、脾、骨髓、外周血和/或结外部位。淋巴癌包括b细胞恶性肿瘤,包括但不限于b细胞非霍奇金淋巴瘤(b-nhl)。b-nhl可能是惰性的(或低级的)、中级的(或侵袭性的)或高级的(极侵袭性的)。惰性b细胞淋巴瘤包括滤泡性淋巴瘤(fl);小淋巴细胞淋巴瘤(sll);边缘区淋巴瘤(mzl)包括淋巴结mzl、结外mzl、脾mzl和脾mzl伴绒毛淋巴细胞;淋巴浆细胞淋巴瘤(lpl);和粘膜相关淋巴组织(malt或结外边缘区)淋巴瘤。中级b-nhl包括套细胞淋巴瘤(mcl)伴或不伴白血病、弥漫性大细胞淋巴瘤(dlbcl)、滤泡性大细胞(或3级或3b级)淋巴瘤和原发性纵隔淋巴瘤(pml)。高级b-nhl包括burkitt淋巴瘤(bl)、burkitt样淋巴瘤、小无裂隙细胞淋巴瘤(snccl)和淋巴母细胞淋巴瘤。其他b-nhl包括免疫母细胞淋巴瘤(或免疫细胞瘤)、原发性渗出性淋巴瘤、hiv相关(或aids相关)淋巴瘤和移植后淋巴组织增生性病症(ptld)或淋巴瘤。b细胞恶性肿瘤还包括但不限于慢性淋巴细胞白血病(cll)、前淋巴细胞白血病(pll)、waldenstrom巨球蛋白血症(wm)、毛细胞白血病(hcl)、大颗粒淋巴细胞(lgl)白血病、急性淋巴(淋巴细胞或淋巴
母细胞)白血病和castleman病。nhl还可能包括t细胞非霍奇金淋巴瘤(t-nhl),包括但不限于非特指型t细胞非霍奇金淋巴瘤(nos)、外周t细胞淋巴瘤(ptcl)、间变性大细胞淋巴瘤(alcl)、血管免疫母细胞淋巴病症(aild)、鼻自然杀伤(nk)细胞/t细胞淋巴瘤、γ/δ淋巴瘤、皮肤t细胞淋巴瘤、蕈样肉芽肿和sezary综合征等。
[0350]
造血癌症还包括霍奇金淋巴瘤(或疾病),包括经典霍奇金淋巴瘤、结节硬化性霍奇金淋巴瘤、混合细胞型霍奇金淋巴瘤、淋巴细胞为主型(lp)霍奇金淋巴瘤、结节性lp霍奇金淋巴瘤和淋巴细胞耗竭型霍奇金淋巴瘤。造血癌症还包括浆细胞疾病或癌症,诸如多发性骨髓瘤(mm),包括冒烟型mm、意义不明(或未知或不清楚)的单克隆丙种球蛋白病(mgus)、浆细胞瘤(骨、髓外)、淋巴浆细胞性淋巴瘤(lpl)、waldenstroem巨球蛋白血症、浆细胞白血病和原发性淀粉样变性(al)。造血癌症还可以包括其他造血细胞的其他癌症,包括多形核白细胞(或嗜中性粒细胞)、嗜碱性粒细胞、嗜酸性粒细胞、树突状细胞、血小板、红细胞和自然杀伤细胞。包括本文称为“造血细胞组织”的造血细胞的组织包括骨髓;外周血;胸腺;和外周淋巴组织,例如脾、淋巴结、与粘膜相关的淋巴组织(例如肠道相关淋巴组织)、扁桃体、派尔集合淋巴结和阑尾,以及与其他粘膜相关的淋巴组织,例如支气管内衬(bronchial lining)。
[0351]
在一个实施方案中,该癌症选自结直肠癌(crc)、胃癌、食道癌、宫颈癌、膀胱癌、乳腺癌、头颈癌、卵巢癌、黑色素瘤、肾细胞癌(rcc)、ec鳞状细胞癌、非小细胞肺癌、间皮瘤、胰腺癌和前列腺癌。
[0352]
如本文所用,术语“治疗”及其衍生词意在包括治疗疗法。就特定病症而言,治疗意指:(1)改善病况或病况的一种或多种生物学表现;(2)干扰(a)生物级联中导致或负责该病况的一个或多个点,或(b)该病况的一个或多个生物学表现;(3)减轻与病况相关的一种或多种症状、作用或副作用或与病况或其治疗相关的一种或多种症状、作用或副作用;(4)减缓病况的进展或病况的一种或多种生物学表现和/或(5)通过消除或降低病况的一种或多种生物学表现至不可检测的水平持续一段时间,认为其是该表现的缓解状态,而在缓解期间无需额外治疗,来治愈所述病况或病况的一种或多种生物学表现。本领域技术人员将理解被认为是特定疾病或病况缓解的持续时间。
[0353]
b细胞病症可以分为b细胞发育/免疫球蛋白产生缺陷(例如免疫缺陷)和过度/不受控制的增殖(例如淋巴瘤、白血病)。如本文所用,b细胞病症指两种类型的疾病,并且提供了用于用本文所述的组合物治疗b细胞病症的方法。
[0354]
在特定方面,疾病或病症是多发性骨髓瘤(mm)、慢性淋巴细胞性白血病(cll)、孤立性浆细胞瘤(骨、髓外)、淀粉样变性(al)、冒烟型多发性骨髓瘤(smm)、孤立性浆细胞瘤(骨、髓外)髓质),或的巨球蛋白血症。
[0355]
还考虑了防治性疗法。本领域技术人员将理解“预防”不是绝对的术语。在医学中,将“预防”理解为是指防治性施用药物以显著降低病况或其生物学表现的可能性或严重性,或延迟此类病况或其生物学表现的发作。防治性疗法是适当的,例如,当认为受试者有发生癌症的高风险时,诸如当受试者具有强烈的癌症家族史或当受试者已经暴露于致癌物时。
[0356]“受试者”或“患者”在本文中可互换使用并且广义地定义为包括任何需要治疗的人,例如需要癌症治疗的人。受试者可以包括哺乳动物。在一个实施方案中,受试者是人患者。需要癌症治疗的受试者可以包括来自不同阶段的患者,包括新诊断、复发、难治、进行性
疾病、缓解和其他。需要癌症治疗的受试者还可以包括已经经历干细胞移植或被认为不适合移植的患者。
[0357]
可以预先筛选受试者以便选择用于用本文所述的组合物进行治疗。在一个实施方案中,在用本文所述的组合物治疗之前测试来自受试者的样品的bcma表达。
[0358]
在用本发明的组合物治疗之前,受试者可能已经接受过至少一种先前癌症疗法。在一个实施方案中,受试者在用本发明的组合物治疗之前已经用至少1种、至少2种、至少3种、至少4种、至少5种、至少6种或至少7种先前癌症疗法进行了治疗。
[0359]
在另一个实施方案中,受试者患有新诊断的癌症并且在用本发明的组合物治疗之前已经接受过0次先前治疗。
[0360]
本发明的组合物可以通过任何合适的途径施用。对于一些组合物,合适的途径包括口服、直肠、鼻、局部(包括口腔和舌下)、阴道、肠胃外(包括皮下、肌肉内、静脉内、皮内、鞘内和硬膜外)和瘤内。将理解,优选途径可以随例如接受者的状况和待治疗的癌症而变化。
[0361]
在某些实施方案中,本发明的组合物作为药物组合物施用。
[0362]
如本文所用,术语“施用”是指递送本文所述的组合物以实现治疗目标。组合物可以以一段足以实现临床益处的施用间隔施用。可以以将治疗靶向特定部位的方式将组合物施用于受试者。
[0363]
在一些实施方案中,组合物通过注射施用。因此,在一个方面,提供了一种包含本发明的组合物、药物组合物或配制剂的注射装置。注射装置可以包括笔式注射器装置或自动注射器装置。
[0364]
如本文所用,术语组合物的“治疗有效量”或“治疗有效剂量”是指在预防或治疗或减轻b细胞介导的病症或病症的症状中有效的量。治疗有效量和治疗方案通常根据经验确定,并且可能取决于因素,诸如患者的年龄、体重和健康状况以及待治疗的疾病或病症。这些因素在主治医师的职权范围内。
[0365]
本领域技术人员将容易地确定包含抗bcma抗原结合蛋白的组合物的适当治疗有效剂量。可以根据患者的体重计算本文所述组合物的合适剂量,例如合适的剂量可以在约0.1mg/kg至约20mg/kg的范围内,例如约1mg/kg至约20mg/kg,例如约10mg/kg至约20mg/kg或例如约1mg/kg至约15mg/kg,例如约10mg/kg至约15mg/kg。
[0366]
在一个实施方案中,包含抗bcma抗原结合蛋白的组合物的治疗有效剂量在约0.03mg/kg至约4.6mg/kg的范围内。在又一个实施方案中,包含抗bcma抗原结合蛋白的组合物的治疗有效剂量为0.03mg/kg、0.06mg/kg、0.12mg/kg、0.24mg/kg、0.48mg/kg、0.96mg/kg、1.92mg/kg、3.4mg/kg或4.6mg/kg。在又一个实施方案中,包含抗bcma抗原结合蛋白的组合物的治疗有效剂量为1.9mg/kg、2.5mg/kg或3.4mg/kg。
[0367]
在某些实施方案中,组合物可以与一种或多种另外的治疗剂共同施用于受试者。在另一个实施方案中,组合物可以与一种或多种另外的癌症治疗剂共同施用于受试者。另外的癌症治疗剂可以包括但不限于其他免疫调节药物、治疗性抗体(例如,抗cd38抗体,例如达雷木单抗(daratumumab))、car-t治疗剂、bite、hdac抑配制剂、蛋白酶体抑配制剂(例如,硼替佐米(bortezomib))、抗炎化合物和免疫调控酰亚胺药物(imid)(例如,沙利度胺(thalidomide)及其类似物)。
[0368]“共同施用”是指施用两种或更多种不同的药物组合物或治疗(例如放射治疗),它们通过在相同药物组合物或单独药物组合物中的组合施用给受试者。因此,共同施用涉及同时施用包含两种或更多种药剂的单一药物组合物或在相同或不同时间向同一受试者施用两种或更多种不同组合物。
[0369]
在本发明的一个方面,本发明提供了通过施用治疗有效剂量的包含本文所述的抗bcma抗原结合蛋白的组合物中的任何来在有需要的受试者中治疗b细胞疾病或病症的方法。
[0370]
在一个实施方案中,本发明提供了在有需要的受试者中治疗癌症的方法,其包括施用治疗有效剂量的包含抗bcma adc的组合物,其中平均dar为约3.4至约4.6。
[0371]
在另一个实施方案中,本发明提供了在有需要的受试者中治疗癌症的方法,其包括施用治疗有效剂量的包含抗bcma adc的组合物,其中该抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,和具有seq id no:6中所列氨基酸序列的cdrl3;其中细胞毒剂是mmae或mmaf;其中平均dar为约3.4至约4.6。
[0372]
在另一个实施方案中,本发明提供了在有需要的受试者中治疗癌症的方法,其包括施用治疗有效剂量的包含抗bcma adc的组合物,其中该抗体包含具有seq id no:7中所列氨基酸序列的vh和具有seq id no:8中所列氨基酸序列的v
l
;其中细胞毒剂是mmae或mmaf;其中平均dar为约3.4至约4.6。
[0373]
在又一个实施方案中,本发明提供了在有需要的受试者中治疗癌症的方法,其包括施用治疗有效剂量的包含贝兰他单抗莫福汀的组合物,其中平均dar为3.4至约4.6。
[0374]
在又一个实施方案中,本发明提供了在有需要的受试者中治疗多发性骨髓瘤的方法,其包括施用治疗有效剂量的包含贝兰他单抗莫福汀的组合物,其中平均dar为3.4至约4.6。
[0375]
在一个实施方案中,本发明提供了在有需要的受试者中治疗癌症的方法,其包括施用治疗有效剂量的包含抗bcma adc的组合物;其中dl0百分比小于或等于约10%或约5%,dl2百分比为约15%至约27%或约15%至约32%,dl4a百分比为约35%至约38%或约30%至约40%,dl4b百分比为约7%至约9%或约5%至约10%,dl6百分比为约14%至约20%或约10%至约20%,和/或dl8为约6.0%至约12.0%或约4%至约15%。
[0376]
在另一个实施方案中,本发明提供了在有需要的受试者中治疗癌症的方法,其包括施用治疗有效剂量的包含抗bcma adc的组合物,其中该抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,和具有seq id no:6中所列氨基酸序列的cdrl3;其中细胞毒剂是mmae或mmaf;和其中dl0百分比小于或等于约10%或约5%,dl2百分比为约15%至约27%或约15%至约32%,dl4a百分比为约35%至约38%或约30%至约40%,dl4b百分比为约7%至约9%或约5%至约10%,dl6百分比为约14%至约20%或约10%至约20%,和/或dl8为约6.0%至约12.0%或约4%至约15%。
[0377]
在另一个实施方案中,本发明提供了在有需要的受试者中治疗癌症的方法,其包
括施用治疗有效剂量的包含抗bcma adc的组合物,其中该抗体包含具有seq id no:7中所列氨基酸序列的vh和具有seq id no:8中所列氨基酸序列的v
l
;其中细胞毒剂是mmae或mmaf;和其中dl0百分比小于或等于约10%或约5%,dl2百分比为约15%至约27%或约15%至约32%,dl4a百分比为约35%至约38%或约30%至约40%,dl4b百分比为约7%至约9%或约5%至约10%,dl6百分比为约14%至约20%或约10%至约20%,和/或dl8为约6.0%至约12.0%或约4%至约15%。
[0378]
在又一个实施方案中,本发明提供了在有需要的受试者中治疗癌症的方法,其包括施用治疗有效剂量的包含贝兰他单抗莫福汀的组合物,其中dl0百分比小于或等于约10%或约5%,dl2百分比为约15%至约27%或约15%至约32%,dl4a百分比为约35%至约38%或约30%至约40%,dl4b百分比为约7%至约9%或约5%至约10%,dl6百分比为约14%至约20%或约10%至约20%,和/或dl8为约6.0%至约12.0%或约4%至约15%。
[0379]
在又一个实施方案中,本发明提供了在有需要的受试者中治疗多发性骨髓瘤的方法,其包括施用治疗有效剂量的包含贝兰他单抗莫福汀的组合物,其中dl0百分比小于或等于约10%或约5%,dl2百分比为约15%至约27%或约15%至约32%,dl4a百分比为约35%至约38%或约30%至约40%,dl4b百分比为约7%至约9%或约5%至约10%,dl6百分比为约14%至约20%或约10%至约20%,和/或dl8为约6.0%至约12.0%或约4%至约15%。
[0380]
在一个方面,本发明提供了在有需要的受试者中治疗癌症的方法,其包括施用治疗有效剂量的包含抗体的组合物,其包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,和具有seq id no:6中所列氨基酸序列的cdrl3;其中该组合物包含≤25%在cdrh3的重链d103处的异构化。
[0381]
在一个实施方案中,本发明提供了在有需要的受试者中治疗多发性骨髓瘤的方法,其包括施用治疗有效剂量的包含抗体的组合物,其包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,和具有seq id no:6中所列氨基酸序列的cdrl3;其中该组合物包含≤25%在cdrh3的重链d103处的异构化。
[0382]
在一个实施方案中,本发明提供了在有需要的受试者中治疗多发性骨髓瘤的方法,其包括施用治疗有效剂量的包含贝兰他单抗的组合物;其中该组合物包含≤25%在cdrh3的重链d103处的异构化。
[0383]
在一个方面,本发明提供了在有需要的受试者中治疗癌症的方法,其包括施用治疗有效剂量的包含抗体的组合物,其包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,和具有seq id no:6中所列氨基酸序列的cdrl3;其中该组合物包含≤40%在重链m34(cdrh1)处的氧化。
[0384]
在实施方案中,本发明提供了在有需要的受试者中治疗多发性骨髓瘤的方法,其包括施用治疗有效剂量的包含抗体的组合物,其包含具有seq id no:1中所列氨基酸序列
adc的组合物,其中该抗体包含具有seq id no:7中所列氨基酸序列的vh和具有seq id no:8中所列氨基酸序列的v
l
;其中细胞毒剂是mmae或mmaf;和其中dl0百分比小于或等于约10%或约5%,dl2百分比为约15%至约27%或约15%至约32%,dl4a百分比为约35%至约38%或约30%至约40%,dl4b百分比为约7%至约9%或约5%至约10%,dl6百分比为约14%至约20%或约10%至约20%,和/或dl8为约6.0%至约12.0%或约4%至约15%。
[0395]
在另一个实施方案中,本发明提供了用于治疗癌症的包含贝兰他单抗莫福汀的组合物,其中dl0百分比小于或等于约10%或约5%,dl2百分比为约15%至约26%,dl4a百分比为约35%至约38%,dl4b为约7%至约10%,dl6百分比为约14%至约20%,和/或dl8百分比为约6%至约12%。
[0396]
在又一个实施方案中,本发明提供了用于治疗多发性骨髓瘤的包含贝兰他单抗莫福汀的组合物,其中dl0百分比小于或等于约10%或约5%,dl2百分比为约15%至约27%或约15%至约32%,dl4a百分比为约35%至约38%或约30%至约40%,dl4b百分比为约7%至约9%或约5%至约10%,dl6百分比为约14%至约20%或约10%至约20%,和/或dl8为约6.0%至约12.0%或约4%至约15%。
[0397]
在一个方面,本发明提供了用于治疗癌症的包含抗体的组合物,其中该抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,和具有seq id no:6中所列氨基酸序列的cdrl3;并且其中该组合物包含≤25%在cdrh3的重链d103处的异构化。
[0398]
在一个方面,本发明提供了用于治疗多发性骨髓瘤的包含抗体的组合物,其中该抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,和具有seq id no:6中所列氨基酸序列的cdrl3;并且其中该组合物包含≤25%在cdrh3的重链d103处的异构化。
[0399]
在又一个实施方案中,本发明提供了用于治疗多发性骨髓瘤的包含贝兰他单抗莫福汀的组合物,其中该组合物包含≤25%在cdrh3的重链d103处的异构化。
[0400]
在一个方面,本发明提供了用于治疗癌症的包含抗体的组合物,其中该抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,和具有seq id no:6中所列氨基酸序列的cdrl3;并且其中该组合物包含≤40%在重链m34(cdrh1)处的氧化。
[0401]
在一个方面,本发明提供了用于治疗多发性骨髓瘤的包含抗体的组合物,其中该抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,和具有seq id no:6中所列氨基酸序列的cdrl3;并且其中该组合物包含≤40%在重链m34(cdrh1)处的氧化。
[0402]
在又一个实施方案中,本发明提供了用于治疗多发性骨髓瘤的包含贝兰他单抗莫福汀的组合物,其中该组合物包含≤40%在重链m34(cdrh1)处的氧化。
[0403]
在本发明的一个方面,提供了组合物在制备用于治疗b细胞疾病或病症的药物中
的用途。
[0404]
在一个实施方案中,提供了包含抗bcma adc的组合物在制备用于治疗癌症的药物中的用途,其中平均dar为约3.4至约4.6。
[0405]
在另一个实施方案中,提供了包含抗bcma adc的组合物在制备用于治疗癌症的药物中的用途,其中该抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,和具有seq id no:6中所列氨基酸序列的cdrl3;其中细胞毒剂是mmae或mmaf;其中平均dar为约3.4至约4.6。
[0406]
在另一个实施方案中,提供了包含抗bcma adc的组合物在制备用于治疗癌症的药物中的用途,其中该抗体包含具有seq id no:7中所列氨基酸序列的vh和具有seq id no:8中所列氨基酸序列的v
l
;其中细胞毒剂是mmae或mmaf;其中平均dar为约3.4至约4.6。
[0407]
在另一个实施方案中,提供了包含贝兰他单抗莫福汀的组合物在制备用于治疗癌症的药物中的用途,其中平均dar为3.4至约4.6。
[0408]
在另一个实施方案中,提供了包含贝兰他单抗莫福汀的组合物在制备用于治疗多发性骨髓瘤的药物中的用途,其中平均dar为3.4至约4.6。
[0409]
在一个实施方案中,提供了包含抗bcma adc的组合物在制备用于治疗癌症的药物中的用途;其中dl0百分比小于或等于约10%或约5%,dl2百分比为约15%至约27%或约15%至约32%,dl4a百分比为约35%至约38%或约30%至约40%,dl4b百分比为约7%至约9%或约5%至约10%,dl6百分比为约14%至约20%或约10%至约20%,和/或dl8为约6.0%至约12.0%或约4%至约15%。
[0410]
在另一个实施方案中,提供了包含抗bcma adc的组合物在制备用于治疗癌症的药物中的用途,其中该抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,和具有seq id no:6中所列氨基酸序列的cdrl3;其中细胞毒剂是mmae或mmaf;和其中dl0百分比小于或等于约10%或约5%,dl2百分比为约15%至约27%或约15%至约32%,dl4a百分比为约35%至约38%或约30%至约40%,dl4b百分比为约7%至约9%或约5%至约10%,dl6百分比为约14%至约20%或约10%至约20%,和/或dl8为约6.0%至约12.0%或约4%至约15%。
[0411]
在另一个实施方案中,提供了包含抗bcma adc的组合物在制备用于治疗癌症的药物中的用途,其中该抗体包含具有seq id no:7中所列氨基酸序列的vh和具有seq id no:8中所列氨基酸序列的v
l
;其中细胞毒剂是mmae或mmaf;和其中dl0百分比小于或等于约10%或约5%,dl2百分比为约15%至约27%或约15%至约32%,dl4a百分比为约35%至约38%或约30%至约40%,dl4b百分比为约7%至约9%或约5%至约10%,dl6百分比为约14%至约20%或约10%至约20%,和/或dl8为约6.0%至约12.0%或约4%至约15%。
[0412]
在另一个实施方案中,提供了包含抗bcma adc的组合物在制备用于治疗癌症的药物中的用途,其中dl0百分比小于或等于约10%或约5%,dl2百分比为约15%至约27%或约15%至约32%,dl4a百分比为约35%至约38%或约30%至约40%,dl4b百分比为约7%至约
9%或约5%至约10%,dl6百分比为约14%至约20%或约10%至约20%,和/或dl8为约6.0%至约12.0%或约4%至约15%。
[0413]
在另一个实施方案中,提供了包含贝兰他单抗莫福汀的组合物在制备用于治疗癌症的药物中的用途,其中dl0百分比小于或等于约10%或约5%,dl2百分比为约15%至约27%或约15%至约32%,dl4a百分比为约35%至约38%或约30%至约40%,dl4b百分比为约7%至约9%或约5%至约10%,dl6百分比为约14%至约20%或约10%至约20%,和/或dl8为约6.0%至约12.0%或约4%至约15%。
[0414]
在又一个实施方案中,提供了包含贝兰他单抗莫福汀的组合物在制备用于治疗多发性骨髓瘤的药物中的用途,其中dl0百分比小于或等于约10%或约5%,dl2百分比为约15%至约27%或约15%至约32%,dl4a百分比为约35%至约38%或约30%至约40%,dl4b百分比为约7%至约9%或约5%至约10%,dl6百分比为约14%至约20%或约10%至约20%,和/或dl8为约6.0%至约12.0%或约4%至约15%。
[0415]
在一个方面,提供了包含抗bcma抗原结合蛋白的组合物在制备用于治疗癌症的药物中的用途,其中该组合物包含抗体,其包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,和具有seq id no:6中所列氨基酸序列的cdrl3;并且其中该组合物包含≤25%在cdrh3的重链d103处的异构化。
[0416]
在一个实施方案中,提供了包含抗bcma抗原结合蛋白的组合物在制备用于多发性骨髓瘤的药物中的用途,其中该组合物包含抗体,其包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,和具有seq id no:6中所列氨基酸序列的cdrl3;并且其中该组合物包含≤25%在cdrh3的重链d103处的异构化。
[0417]
在又一个实施方案中,提供了包含贝兰他单抗的组合物在制备用于治疗多发性骨髓瘤的药物中的用途,其中该组合物包含≤25%在cdrh3的重链d103处的异构化。
[0418]
在一个方面,提供了包含抗bcma抗原结合蛋白的组合物在制备用于治疗癌症的药物中的用途,其中该组合物包含抗体,其包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,和具有seq id no:6中所列氨基酸序列的cdrl3;并且其中该组合物包含≤40%在重链m34(cdrh1)处的氧化。
[0419]
在一个实施方案中,提供了包含抗bcma抗原结合蛋白的组合物在制备用于多发性骨髓瘤的药物中的用途,其中该组合物包含抗体,其包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,和具有seq id no:6中所列氨基酸序列的cdrl3;并且其中该组合物包含≤40%在重链m34(cdrh1)处的氧化。
[0420]
在又一个实施方案中,提供了包含贝兰他单抗的组合物在制备用于治疗多发性骨
髓瘤的药物中的用途,其中该组合物包含≤40%在重链m34(cdrh1)处的氧化。
[0421]
本文公开的所有专利和参考文献均明确且完整地通过引用并入本文。
[0422]
本文所述的发明包括:
[0423]
1.组合物,其包含抗bcma抗体的异构化变体,其中所述异构化变体包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中所述组合物包含≤25%的异构化变体。
[0424]
2.组合物,其包含抗bcma抗体的氧化变体,其中所述氧化变体包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中所述组合物包含≤40%的氧化变体。
[0425]
3.组合物,其包含抗bcma抗体,所述抗bcma抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,和具有seq id no:6中所列氨基酸序列的cdrl3;其中所述组合物包含0.1-25%,在cdrh3的d103处的异构化。
[0426]
4.组合物,其包含抗bcma抗体,所述抗bcma抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,和具有seq id no:6中所列氨基酸序列的cdrl3;其中所述组合物包含0.1-40%在cdrh1的m34处的氧化。
[0427]
5.组合物,其包含与seq id no:9的重链氨基酸序列和seq id no:10的轻链氨基酸序列至少约90%相同的抗bcma抗体,其中所述组合物包含0.1-25%,在cdrh3的d103处的异构化。
[0428]
6.组合物,其包含与seq id no:9的重链氨基酸序列和seq id no:10的轻链氨基酸序列至少约90%相同的抗bcma抗体,其中所述组合物包含0.1-40%在cdrh1的m34处的氧化。
[0429]
7.根据前述权利要求中任一项所述的组合物,其中所述组合物包含≤65%在重链m256处的氧化和/或≤60%在重链m432处的氧化。
[0430]
8.根据前述权利要求中任一项所述的组合物,其中所述组合物包括包含选自下组中的至少一种的抗体变体:n388和/或n393处的重链脱酰胺、在cdrh3的d103至n103、c端赖氨酸切割和n端谷氨酰胺至焦谷氨酸的转化。
[0431]
9.根据前述权利要求中任一项所述的组合物,其中所述组合物包含选自下组中的至少一种:高达100%的n388和/或n393处的脱酰胺、高达100%的在cdrh3的n103、高达100%的c端赖氨酸切割,以及高达100%的n端谷氨酰胺至焦谷氨酸的转化。
[0432]
10.根据前述权利要求中任一项所述的组合物,其中所述组合物包含任何百分比的糖型g0、g1、g2、g0-glcnac或g0-2glcnac。
[0433]
11.根据前述权利要求中任一项所述的组合物,其中所述抗bcma抗体是贝兰他单抗。
[0434]
12.根据前述权利要求中任一项所述的组合物,其中所述抗bcma抗体与细胞毒剂缀合以形成抗体-药物-缀合物。
[0435]
13.根据前述权利要求中任一项所述的组合物,其中所述抗bcma抗体是贝兰他单抗莫福汀。
[0436]
14.权利要求12-13所述的组合物,其中dl2百分比为至少约30%、约15%至约27%或约15%至约32%;dl4a百分比为至少约30%、约35%至约38%或约30%至约40%;dl4b百分比为至少约5%、约7%至约9%或约5%至约10%;dl6百分比为至少约10%、约14%至约20%或约10%至约20%;和/或dl8为至少约1%、约6.0%至约12.0%或约4%至约15%。
[0437]
15.权利要求12-14所述的组合物,其中平均dar为约3.4至约4.6。
[0438]
16.权利要求12-15所述的组合物,其中dl0百分比小于或等于约10%或约5%。
[0439]
17.药物组合物,其包含前述权利要求中任一项所述的组合物和至少一种药学上可接受的赋形剂。
[0440]
18.包含权利要求17所述的药物组合物的配制剂,其包含约20mg/ml至约60mg/ml的抗bcma抗原结合蛋白、约10mm至约30mm的柠檬酸盐缓冲液、约120mm至约240mm的海藻糖、约0.01mm至约0.1mm的edta、约0.01%至约0.05%的聚山梨酯20或聚山梨酯80,ph为约5.9至约6.5。
[0441]
19.权利要求18所述的配制剂,其包含约20mg/ml、约25mg/ml、约50mg/ml或约60mg/ml贝兰他单抗莫福汀、25mm柠檬酸盐缓冲液、200mm海藻糖、0.05mm edta二钠,0.02%聚山梨酯20或聚山梨酯80,ph约5.9至约6.5。
[0442]
20.治疗癌症的方法,其包括向有此需要的受试者施用治疗有效量的权利要求1-16的组合物。
[0443]
21.权利要求1-14的组合物,其用于治疗癌症。
[0444]
22.权利要求1-16的组合物在制备用于治疗癌症的药物中的用途。
[0445]
23.组合物,其包含抗bcma抗体-药物-缀合物(adc),其中dl2百分比为至少约30%、约15%至约27%或约15%至约32%;dl4a百分比为至少约30%、约35%至约38%或约30%至约40%;dl4b百分比为至少约5%、约7%至约9%或约5%至约10%;dl6百分比为至少约10%、约14%至约20%或约10%至约20%;和/或dl8为至少约1%、约6.0%至约12.0%或约4%至约15%。
[0446]
24.权利要求23所述的组合物,其中所述抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,以及具有seq id no:6中所列氨基酸序列的cdrl3。
[0447]
25.权利要求23或24所述的组合物,其中dl2百分比为约15%至约32%,dl4a百分比为约30%至约40%,dl4b百分比为约5%至约10%,dl6百分比为约10%至约20%,dl8为约4%至约15%。
[0448]
26.权利要求23或24所述的组合物,其中dl2百分比为约15%至约27%,dl4a百分比为约35%至约38%,dl4b百分比为约7%至约9%,dl6百分比为约14%至约20%,dl8为约6.0%至约12.0%。
[0449]
27.权利要求23-26所述的组合物,其中所述平均药物-抗体比(dar)为约2.1至约
5.7。
[0450]
28.权利要求23-26所述的组合物,其中所述平均dar为约3.4至约4.6。
[0451]
29.权利要求23-26所述的组合物,其中所述平均dar为约3.8至约4.5。
[0452]
30.组合物,其包含抗bcma抗体-药物-缀合物(adc),其中dl0百分比小于或等于约10%或约5%。
[0453]
31.权利要求30所述的组合物,其中所述抗体包含具有seq id no:1中所列氨基酸序列的cdrh1、具有seq id no:2中所列氨基酸序列的cdrh2、具有seq id no:3中所列氨基酸序列的cdrh3、具有seq id no:4中所列氨基酸序列的cdrl1、具有seq id no:5中所列氨基酸序列的cdrl2,和具有seq id no:6中所列氨基酸序列的cdrl3。
[0454]
32.权利要求30或31所述的组合物,其中所述dl0百分比小于或等于约5%。
[0455]
33.权利要求30-32所述的组合物,其中dl2百分比为约15%至约32%,dl4a百分比为约30%至约40%,dl4b百分比为约5%至约10%,dl6百分比为约10%至约20%,dl8为约4%至约15%。
[0456]
34.权利要求30-32所述的组合物,其中dl2百分比为约15%至约27%,dl4a百分比为约35%至约38%,dl4b百分比为约7%至约9%,dl6百分比为约14%至约20%,dl8为约6.0%至约12.0%。
[0457]
35.权利要求30-34所述的组合物,其中所述平均药物-抗体比(dar)为约2.1至约5.7。
[0458]
36.权利要求30-34所述的组合物,其中所述平均dar为约3.4至约4.6。
[0459]
37.权利要求30-34所述的组合物,其中所述平均dar为约3.8至约4.5。
[0460]
38.权利要求23-37所述的组合物,其中所述抗体包含具有seq id no:7中所列氨基酸序列的vh和具有seq id no:8中所列氨基酸序列的v
l
。
[0461]
39.权利要求23-38所述的组合物,其中所述抗体是贝兰他单抗。
[0462]
40.权利要求23-37所述的组合物,其中所述细胞毒剂是mmae或mmaf。
[0463]
41.权利要求21-40所述的组合物,其中所述抗bcma adc是贝兰他单抗莫福汀。
[0464]
42.权利要求23-41所述的组合物,其中通过使用疏水相互作用色谱(hic)分离单个dl种类,计算每个dl峰的曲线下面积,并将每个dl峰除以所有组合的dl种类的曲线下总面积来确定所述dl百分比。
[0465]
43.权利要求42所述的组合物,其中使用以下公式从每个dl种类的曲线下面积计算所述平均dar:
[0466][0467][0468]
其中:
[0469]ax
=加载x峰的峰面积
[0470]
x=a0、a1、a2、a3、a
4a
、a
4b
、a5、a6、a8和a
10
[0471]
a0、a1、a2、a3、a
4a
、a
4b
、a5、a6、a8和a
10
=为dl0、dl1、dl2、dl3、dl4a、dl4b、dl5、dl6、dl8和dl10峰的峰面积(仅包括≥dl(0.08%)的峰)。
[0472]
44.药物组合物,其包含权利要求23-43所述的组合物和至少一种药学上可接受的赋形剂。
[0473]
45.包含权利要求44所述的药物组合物的配制剂,其包含约20mg/ml至约60mg/ml的抗bcma抗原结合蛋白、约10mm至约30mm的柠檬酸盐缓冲液、约120mm至约240mm的海藻糖、约0.01mm至约0.1mm的edta、约0.01%至约0.05%的聚山梨酯20或聚山梨酯80,ph为约5.9至约6.5。
[0474]
46.权利要求45所述的配制剂,其包含约20mg/ml、约25mg/ml、约50mg/ml或约60mg/ml贝兰他单抗莫福汀、25mm柠檬酸盐缓冲液、200mm海藻糖、0.05mm edta二钠,0.02%聚山梨酯20或聚山梨酯80,ph约5.9至约6.5。
[0475]
47.治疗癌症的方法,其包括向有此需要的受试者施用治疗有效量的权利要求23-43的组合物。
[0476]
48.权利要求23-43的组合物,其用于治疗癌症。
[0477]
49.权利要求23-43的组合物在制备用于治疗癌症的药物中的用途。
[0478]
50.组合物,其包含抗体的酸性变体,其中所述酸性变体包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中所述组合物包含1-70%的酸性变体。
[0479]
51.组合物,其包含抗体的酸性变体,其中所述酸性变体包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中所述组合物包含≤70%的酸性变体。
[0480]
52.组合物,其包含抗体的碱性变体,其中所述碱性变体包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中所述组合物包含1-30%的碱性变体。
[0481]
53.组合物,其包含抗体的碱性变体,其中所述碱性变体包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中所述组合物包含≤30%的碱性变体。
[0482]
54.组合物,其包含抗体的主要同工型,其中所述主要同工型包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中所述组合物包含1-90%的主要同工型。
[0483]
55.组合物,其包含抗体的主要同工型,其中所述主要同工型包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中所述组合物包含≥1%的主要同工型。
[0484]
56.组合物,其包含抗体的带电荷变体,所述抗体的带电荷变体包括包含seq id no:1的cdrh1、seq id no:2的cdrh2和seq id no:3的cdrh3的重链氨基酸序列,以及包含
seq id no:4的cdrl1、seq id no:5的cdrl2和seq id no:6的cdrl3的轻链氨基酸序列;其中所述组合物包含:≤70%的酸性变体;和/或≤30%的碱性变体;和/或≥1%的主要同工型。
实施例
[0485]
实施例1:adc组合物中dl种类百分比和平均dar的测定。
[0486]
对于实施例2-9,如下计算dl百分比和平均dar:
[0487]
具体dl种类的百分比(例如dl0百分比、dl2百分比、dl4a百分比、dl4b百分比、dl6百分比和dl8百分比)通过使用疏水相互作用色谱(hic)分离单个dl种类(如图2所例示),计算每个dl峰的曲线下面积,并将每个dl峰除以所有组合的dl种类的曲线下总面积来测定。
[0488]
通过使用以下公式从每个dl种类的曲线下面积计算每个样品的平均dar:
[0489][0490][0491]
其中:
[0492]ax
=加载x峰的峰面积
[0493]
x=a0、a1、a2、a3、a
4a
、a
4b
、a5、a6、a8和a
10
[0494]
a0、a1、a2、a3、a
4a
、a
4b
、a5、a6、a8和a
10
=为dl0、dl1、dl2,dl3、dl4a、dl4b、dl5、dl6、dl8和dl10峰的峰面积(仅包括≥dl(0.08%)的峰)
[0495]
实施例2-8中使用的参考标准品,并且其也可以用于其他实验,包括表1中的样品。
[0496]
表1
[0497][0498]
实施例2:平均dar对细胞生长抑制的影响。
[0499]
通过在与贝兰他单抗莫福汀温育48小时后测量人多发性骨髓瘤细胞系nci-h929细胞的细胞活力来测定贝兰他单抗莫福汀的细胞生长抑制作用。使用promega的celltiter glo技术测量细胞活力。贝兰他单抗莫福汀浓度的增加成比例地对应于celltiter glo发光
信号的减少。由softmax pro使用4参数非线性回归逻辑模型生成剂量响应(ec50)。计算参考标准品#132371424 ec50与样品ec50的比率以确定相对效力。结果总结在表2中。
[0500]
表2:
[0501]
平均dar值相对效力2.10.53.00.73.50.84.11.04.61.15.01.15.71.3
[0502]
实施例3:平均dar对adcc活性的影响。
[0503]
温育贝兰他单抗莫福汀、多发性骨髓瘤细胞和nk细胞(效应细胞)。不受理论束缚,贝兰他单抗莫福汀与多发性骨髓瘤细胞表面表达的bcma结合,抗体的fc区通过其fcγriiia受体与效应细胞上的fcγriiia结合。这些受体与效应细胞表面的结合导致细胞因子(ifng)的合成和分泌,以及进入靶细胞细胞质的颗粒(穿孔素和颗粒酶)的释放。颗粒酶在靶细胞内启动信号传导事件,导致这些细胞因凋亡而死亡。nk细胞的来源是分离自人全血的外周血单个核细胞(pbmc)。然后,在1ml的nci-h929细胞(人多发性骨髓瘤细胞系)中添加10μl荧光增强配体batda(双-(乙酰氧基甲基)2,2’:6’,2
”‑
三联吡啶-6,6
”‑
二羧酸盐)(perkin-elmercat#c136-100),其穿透细胞膜。batda中的酯键水解形成不再可以通过细胞膜的亲水性配体(tda)。将标记的细胞添加到不同量的贝兰他单抗莫福汀和效应细胞(pbmc)。细胞裂解并释放tda。细胞溶解后,该配体与200μl delfia铕溶液(perkin-elmercat#c135-100)缔合以形成高荧光且稳定的螯合物(eutda)。当用荧光读板器测量时,所测得的荧光与裂解细胞的量直接相关。将贝兰他单抗莫福汀的adcc活性报告为样品ec50值与参考标准品#132371424的ec50值的比率。结果总结在表3中。
[0504]
表3:
[0505]
平均dar值相对效力2.11.13.00.83.51.04.60.85.01.15.70.8
[0506]
实施例4:平均dar对bcma结合和fcγriiia结合的影响。
[0507]
使用表面等离子共振(spr)测量贝兰他单抗莫福汀对bcma和fcγriiia的结合。用pbst将贝兰他单抗莫福汀稀释至10μg/ml,注射并由固定在cm5传感器芯片上的蛋白a捕获。然后注射bcma并与捕获的贝兰他单抗莫福汀结合。接下来,注射fcγriiia并使其与捕获的贝兰他单抗莫福汀结合。贝兰他单抗莫福汀与bcma和fcγriiia结合的功能浓度从参考标准曲线(参考标准品#132371424)计算并分别报告为bcma或fcγriiia结合浓度。样品的总
贝兰他单抗莫福汀浓度由280nm处的吸光度预先确定。通过将bcma或fcγriiia结合浓度除以280nm处的吸光度浓度来计算特异性结合活性(%)。结果总结在表4中。
[0508]
表4:
[0509]
平均dar值bcma结合(%)fcγriiia(%)2.11011063.095983.51001034.689895.094945.79492
[0510]
实施例5:平均dar对肿瘤体积的影响。
[0511]
将多发性骨髓瘤细胞系皮下植入严重联合免疫缺陷(scid)小鼠的胁腹。从第15天左右开始,使用卡尺系统每周测量所有肿瘤三次,并记录每个小鼠肿瘤的长度和宽度以计算肿瘤体积(体积=长度x(宽度2)x0.5)。当平均肿瘤体积达到约200mm3时,将小鼠随机分组并用具有贝兰他单抗莫福汀与平均dar样品之一每周两次给药,持续2周。以这种方式测量所有肿瘤,并且一旦它们的肿瘤达到2.0mm3的平均肿瘤测量值或在第60天(以先到者为准),安乐死个体小鼠。研究设计的汇总总结在表5中,并且结果在图3中描绘。
[0512]
表5:
[0513]
平均dar值剂量2.12mg/kg3.02mg/kg3.52mg/kg4.12mg/kg4.62mg/kg4.92mg/kg5.72mg/kg3.54mg/kg4.14mg/kg4.64mg/kg
[0514]
实施例6:dl种类对bcma结合、fcγriiia结合和fcrn结合的影响。
[0515]
通过收集hic色谱图的单个峰制备包含具体dl种类的贝兰他单抗莫福汀样品。如实施例4所述,使用表面等离子共振(spr)测量贝兰他单抗莫福汀的bcma和fcγriiia的结合。
[0516]
使用表面等离子体共振(spr)测量新生fc受体(fcrn)与贝兰他单抗莫福汀的结合。稀释样品并且由固定在氨三乙酸(nta)传感器芯片上的fcrn捕获贝兰他单抗莫福汀。通过在校准曲线上内插结合响应来测定样品的fcrn结合浓度。通过将fcrn结合浓度除以总蛋白质浓度计算特异性结合活性(%)。结果总结在表6中。
[0517]
使用了参考标准品#162397940。
[0518]
表6:
[0519][0520]
实施例7:dl种类对细胞生长抑制的影响。
[0521]
如实施例7制备贝兰他单抗莫福汀的具体dl种类样品。如实施例2测定细胞生长抑制。使用参考标准品#162397940。结果总结在表7中。
[0522]
表7:
[0523]
dar种类相对效力dl00.0dl20.5dl4a0.9dl4b1.0dl61.6dl81.8
[0524]
实施例8:dl种类对adcc活性的影响。
[0525]
贝兰他单抗莫福汀与多发性骨髓瘤细胞表面表达的bcma结合。贝兰他单抗莫福汀的fc区与jurkat t效应细胞(promega,cat#g7102,biocat#140011)上的fcγriiia(cd16a)结合,这些细胞经过工程化改造以稳定表达1)人fcγriiia受体v158高亲和力变体和2)与nfat激活序列下游的启动子融合的萤光素酶报告基因。当抗体同时与h929和效应细胞结合时,nfat通路的激活导致萤光素酶报告基因的基因转录和萤火虫萤光素酶在效应细胞内的表达。在添加发光底物(bio-glotm萤光素酶检测系统,promega,cat#g7940)并发生细胞裂解后,使用酶标仪以相对发光单位(rlu)测量由于nfat激活而产生的萤光素酶。在该测定中,以剂量依赖性方式添加贝兰他单抗莫福汀;因此,使用非线性回归逻辑模型生成剂量响应(半数最大有效浓度或ec50)。计算参考标准品ec50与样品ec50的比率以确定相对效力。使用了参考标准品#162397940。结果总结在表8中。
[0526]
表8:
[0527][0528]
实施例9:若干个批次的贝兰他单抗莫福汀的平均dar和dl种类百分比
[0529]
制备了若干(19)个批次的贝兰他单抗莫福汀。如实施例1所述计算每批的平均dar和dl种类百分比。结果总结在表9-12中。
[0530]
表9:
[0531] 批次1批次2批次3批次4批次5dl02.03.54.03.93.9dl215.821.224.524.724.6dl4a37.136.136.435.835.7dl4b7.18.27.48.38.5dl619.116.315.115.215.2dl812.08.17.17.17.0平均dar4.54.13.93.93.9
[0532]
表10:
[0533] 批次6批次7批次8批次9批次10dl04.04.33.83.73.9dl224.725.424.424.123.9dl4a35.736.536.937.936.4dl4b8.47.67.77.17.6dl615.114.215.515.615.1dl87.06.16.96.97.5平均dar3.93.94.04.04.0
[0534]
表11:
[0535] 批次11批次12批次13批次14批次15dl04.84.04.24.24.5dl226.324.124.824.825.8dl4a35.936.236.235.936.6dl4b7.67.87.78.07.5dl614.015.014.614.614.3dl86.17.36.86.96.0平均dar3.84.03.93.93.8
[0536]
表12:
[0537] 批次16批次17批次18批次19dl04.14.14.24.0dl224.624.524.724.2dl4a36.335.535.635.8dl4b7.58.18.08.1dl614.714.514.315.0dl87.17.27.17.3平均dar3.93.93.94.0
[0538]
实施例10:贝兰他单抗莫福汀强制降解研究设计。
[0539]
实施例11-18的研究设计的汇总在表13中描绘。
[0540]
表13:贝兰他单抗莫福汀强制降解研究设计
[0541][0542]
1.rh:相对湿度
[0543]
实施例11:氧化条件
[0544]
为了创建氧化应激样品,将贝兰他单抗莫福汀样品稀释至10mg/ml并添加过氧化氢,使过氧化氢与贝兰他单抗莫福汀的摩尔比为500:1。用甲硫氨酸淬灭样品,并使用3kda分子量截留过滤器(mwco)进行缓冲液交换。
[0545]
使用胰蛋白酶肽图谱串联质谱法(肽图谱lc-ms/ms)测定脱酰胺和氧化。样品在6m盐酸胍中变性至浓度为4.2μg/μl。在室温下用50mm dtt还原二硫键20分钟。加入100mm碘乙酸盐,并在避光条件下,在室温下与游离半胱氨酸残基反应30分钟。在用0.5%胰蛋白酶的worthington胰蛋白酶(部件号trtpck)在37℃下消化15分钟之前,使用biorad离心柱(部件号7326221)对样品进行缓冲液交换。将所得肽加载到waters反相超高效液相色谱(uplc)柱(部件号186003687)上,并使用waters acquity uplc在0.1%三氟乙酸中用水和乙腈梯度洗脱。用紫外检测器和质谱仪(诸如thermo scientific ltq orbitrap xl)检测肽。使用未修饰和修饰肽的提取离子色谱图以通过将修饰肽的曲线下面积除以修饰和未修饰肽两者的曲线下总面积来计算脱酰胺或氧化水平。
[0546]
如实施例4中所述使用表面等离子共振(spr)测量贝兰他单抗莫福汀对bcma和fcγriiia的结合。如实施例6中所述使用表面等离子共振(spr)测量新生fc受体(fcrn)与贝兰他单抗莫福汀的结合.
[0547]
使用了参考标准品#182407660a。结果的汇总在表14和表15中描绘。
[0548]
表14:h2o2处理的贝兰他单抗莫福汀中的ptm丰度
[0549][0550]
表15:h2o2处理的贝兰他单抗莫福汀的结合活性
[0551][0552]
从hc met 34的氧化数据外推,高达37%的氧化可以导致至少70%的抗原特异性结合活性。这是使用时间0(0.2-0.4%)和24小时(45.1-45.5%)m34氧化样品的线性斜率计算的,它们分别具有88-99%和62-68%的抗原特异性结合活性。
[0553]
从hc met 256的氧化数据外推,高达89%的氧化可以导致至少70%的fcγriiia特异性结合活性。这是使用时间0(2.9-3.5%)和24小时(98.3-98.7%)m256氧化样品的线性斜率计算的,它们分别具有89-99%和66-70%的fcγriiia特异性结合活性。从hc met 256的氧化数据外推,高达64%的氧化可以导致至少70%的fcrn特异性结合活性。这是使用时间0(2.9-3.5%)和24小时(98.3-98.7%)m256氧化样品的线性斜率计算的,它们分别具有93-97%和52-57%的fcrn特异性结合活性。
[0554]
从hc met 432的氧化数据外推,高达86%的氧化可以导致至少70%的fcγriiia特异性结合活性。这是使用时间0(0.4-0.6%)和24小时(94.8-95.2%)m432氧化样品的线性斜率计算的,它们分别具有88-99%和66-70%的fcγriiia特异性结合活性。从hc met 432的氧化数据外推,高达61%的氧化可以导致至少70%的fcrn特异性结合活性。这是使用时间0(0.4-0.6%)和24小时(94.8-95.2%)m432氧化样品的线性斜率计算的,它们分别具有93-97%和52-57%的fcrn特异性结合活性。
[0555]
实施例12:化学:高ph(碱处理)
[0556]
为了创建高ph值样品,用4mm tris缓冲液稀释贝兰他单抗莫福汀样品以将ph值调节至9。将样品进一步稀释至10mg/ml并在25℃/50%rh下温育长达21天。
[0557]
如实施例11中所述,使用胰蛋白酶肽图谱串联质谱(肽图谱lc-ms/ms)测定脱酰胺、异构化和氧化。使用未修饰和修饰肽的提取离子色谱图以通过将修饰肽的曲线下面积除以修饰和未修饰肽两者的曲线下总面积来计算脱酰胺、异构化或氧化的水平。
[0558]
如实施例4中所述,使用表面等离子共振(spr)测量贝兰他单抗莫福汀对bcma和fcyriiia的结合。如实施例6中所述,使用表面等离子共振(spr)测量新生fc受体(fcrn)与贝兰他单抗莫福汀的结合。
[0559]
使用了参考标准品#182407660a。结果总结在表16和表17中。
[0560]
表16:碱处理的贝兰他单抗莫福汀中的ptm丰度
[0561][0562][0563]
表17:碱处理的贝兰他单抗莫福汀的结合活性
[0564][0565]
预计hc asn 388和hc asn 393的脱酰胺作用可以分别高于报告的10.3%和14.5%的水平,而对抗原特异性结合、fcγriiia特异性结合和fcrn特异性结合没有任何影响。
[0566]
实施例13:化学:低ph(酸处理)
[0567]
为了创建低ph值样品,用柠檬酸盐缓冲液稀释贝兰他单抗莫福汀样品以将ph值调节至5。将样品进一步稀释至10mg/ml并在25℃/50%rh下温育长达21天。
[0568]
如实施例11中所述,使用胰蛋白酶肽图谱串联质谱(肽图谱lc-ms/ms)测定异构化、脱酰胺和氧化。使用未修饰和修饰肽的提取离子色谱图以通过将修饰肽的曲线下面积除以修饰和未修饰肽两者的曲线下总面积来计算异构化、脱酰胺或氧化的水平。
[0569]
如实施例4中所述,使用表面等离子共振(spr)测量贝兰他单抗莫福汀对bcma和fcyriiia的结合。如实施例6中所述,使用表面等离子共振(spr)测量新生fc受体(fcrn)与贝兰他单抗莫福汀的结合。
[0570]
使用了参考标准品#182407660a。结果总结在表18和表19中。
[0571]
表18:酸处理的贝兰他单抗莫福汀中的ptm丰度
[0572]
[0573]
表19:酸处理的贝兰他单抗莫福汀的结合活性
[0574][0575]
实施例14:热:升高温度
[0576]
为了创建热应激样品,将贝兰他单抗莫福汀样品在配方缓冲液中稀释至10mg/ml,并在40℃/75%rh下温育长达28天。
[0577]
如实施例11中所述,使用胰蛋白酶肽图谱串联质谱法(肽图谱lc-ms/ms)测定异构化、脱酰胺和氧化。使用未修饰和修饰肽的提取离子色谱图以通过将修饰肽的曲线下面积除以修饰和未修饰肽两者的曲线下总面积来计算异构化、脱酰胺或氧化的水平。
[0578]
如实施例4中所述,使用表面等离子共振(spr)测量贝兰他单抗莫福汀对bcma和fcyriiia的结合。如实施例6中所述,使用表面等离子共振(spr)测量新生fc受体(fcrn)与贝兰他单抗莫福汀的结合。
[0579]
使用了参考标准品#182407660a。结果总结在表20和表21中。
[0580]
表20:热处理的贝兰他单抗莫福汀中的ptm丰度
[0581][0582]
表21:热处理的贝兰他单抗莫福汀的结合活性
[0583][0584]
从hc asp 130的异构化数据外推,高达23%的异构化可以导致至少70%的抗原特异性结合活性。这是使用时间0(4.1-4.4%)和28天(28.7-29.3%)d103异构化样品的线性斜率计算的,它们分别具有88-99%和55-62%的抗原特异性结合活性。
[0585]
实施例15:光暴露
[0586]
为创建光暴露样品,将贝兰他单抗莫福汀样品稀释至10mg/ml并装填至玻璃小瓶中,然后转移至25℃下的caron光稳定性室进行如表10所示的不同程度的光暴露。
[0587]
如实施例11中所述,使用胰蛋白酶肽图谱串联质谱法(肽图谱lc-ms/ms)测定氧化、脱酰胺和异构化。使用未修饰和修饰肽的提取离子色谱图以通过将修饰肽的曲线下面积除以修饰和未修饰肽两者的曲线下总面积来计算氧化、脱酰胺或异构化的水平
[0588]
如实施例4中所述,使用表面等离子共振(spr)测量贝兰他单抗莫福汀对bcma和fcyriiia的结合。如实施例6中所述,使用表面等离子共振(spr)测量新生fc受体(fcrn)与贝兰他单抗莫福汀的结合。
[0589]
使用了参考标准品#182407660a。结果总结在表22和表23中。
[0590]
表22:光处理的贝兰他单抗莫福汀中的ptm丰度
[0591][0592]
表23:光处理的贝兰他单抗莫福汀的结合活性
[0593][0594]
实施例16:c端切割和n端焦谷氨酸
[0595]
如实施例11中所述,使用胰蛋白酶肽图谱串联质谱法(肽图谱lc-ms/ms)分析几个批次的贝兰他单抗的n端焦谷氨酸水平和c端切割。使用未修饰和修饰肽的提取离子色谱图以通过将修饰肽的曲线下面积除以修饰和未修饰肽两者的曲线下总面积来计算c端切割和n端焦谷氨酸的水平
[0596]
如实施例4中所述,使用表面等离子共振(spr)测量贝兰他单抗对bcma和feyriiia的结合。如实施例6中所述,使用表面等离子共振(spr)测量新生fc受体(fcrn)与贝兰他单抗的结合。
[0597]
使用的参考标准品是#122368059和#172405900。结果总结在表24-25中。
[0598]
表24:贝兰他单抗中的焦谷氨酸和赖氨酸切割的丰度及相应的活性
[0599][0600]
表25:贝兰他单抗中的焦谷氨酸和赖氨酸切割的丰度及相应的活性
[0601][0602]
实施例17:糖基化
[0603]
分析了几个批次的贝兰他单抗的糖基化模式。使用具有亲水相互作用液相色谱(hilic)分离和荧光检测的超高效液相色谱(uplc)测定曲线。用水将样品稀释至10μg/μl的浓度,并使用来自new england biolabs的pngasef试剂盒(cat#p0705l)通过用pngasef酶解从贝兰他单抗中释放聚糖。用邻氨基苯甲酰胺(sigma-aldrich,cat#a89804)标记pngasef释放的聚糖。然后使用hilic柱步骤纯化经标记的聚糖以去除过量的标记溶液;加载聚糖并用水清洗并用乙腈洗脱。然后使用waters acquity uplc上的waters聚糖beh酰胺色谱柱(货号186004742)用甲酸铵/甲酸和乙腈梯度分离经标记的聚糖。使用在365nm处激发和在438nm处发射的荧光检测来检测聚糖。通过将聚糖的曲线下面积除以所有检测到的聚糖的曲线下总面积来实现聚糖的定量。
[0604]
使用的参考标准品是#122368059。结果总结在表26-27中。
[0605]
表26:贝兰他单抗的糖基化模式
[0606]
批次172405773182407670182408599182408314182408902182409958%g062.363.662.755.557.856.5%g126.025.225.530.829.329.8g0-glcnac1.11.01.00.90.91,0
[0607]
表27:贝兰他单抗的糖基化模式
[0608]
批次122368059122370432152390946162399241172405900%g069.377.576.078.060.2%g113.78.911.711.226.2
g0-glcnac4.15.33.23.21.1
[0609]
实施例18:糖工程学
[0610]
确定了富含糖的贝兰他单抗样品对adcc活性和结合的影响。如实施例3测量adcc活性。如实施例4测定bcma和fcγriiia结合。
[0611]
对于半乳糖基化实验,用还原的lc-ms测量糖基化。将样品稀释至1mg/ml,添加50ul的1m dtt并在25℃或37℃下反应30分钟,然后在可能包括micromass q-tof的质谱仪上进行分析。使用水、乙腈和三氟乙酸等度流动的尺寸排阻色谱分离重链和轻链。使用来自waters的maxent软件对每个重链和轻链的光谱进行求和和去卷积。检测到主要糖型,并根据信号计数或曲线下面积估计相对量。结果总结在表28-29中。
[0612]
表28:贝兰他单抗的富含糖的样品和相应的活性
[0613][0614]
表29:贝兰他单抗富含糖的样品的丰度(%)
[0615][0616]
实施例19:可耐受范围
[0617]
通过使用表11至表18中第一个和最后一个时间点的数据(第21天或第28天,视情况而定)来确定可耐受范围(70-130%活性)。将结合数据针对相关翻译后修饰的相对百分比作图以确定关系的斜率。使用该信息,对至少70%的结合测量值计算每个翻译后修饰的预测水平。这种外推的结果总结在表30中。报告的趋势广泛反映了用贝兰他单抗或贝兰他单抗莫福汀看到的观察结果。
[0618]
表30:贝兰他单抗和贝兰他单抗莫福汀功能变体的数据的外推
[0619]
[0620][0621]
实施例20:降解产物汇总
[0622]
在不同强制降解条件下观察到的对贝兰他单抗莫福汀活性不具有影响的降解产物的发生率总结如下(表31)。
[0623]
表31:不影响贝兰他单抗莫福汀效力的降解产物
[0624][0625]
实施例21
[0626]
实施例21至26中的贝兰他单抗强制降解的研究设计总结在表32中描绘。方法与上述实施例11-18中描述的对贝兰他单抗莫福汀的那些方法大体相似(除非另有说明)。
[0627]
表32:贝兰他单抗强制降解研究设计
[0628][0629]
1.rh:相对湿度
[0630]
实施例22:贝兰他单抗氧化条件
[0631]
在24小时后,hc m256的氧化从约2%增加到约98%,并且m432的氧化从约1%增加到约96%。spr对fcγriiia的特异性结合降低了21-25%,对fcrn的结合降低了10-18%。fc中的氧化可能改变贝兰他单抗对fcγriiia和fcrn的结合活性。24小时后,cdr1中hc m34的氧化从约0.3%增加到47.7-48.5%,在测定变异性内导致抗原结合无变化。半胱氨酸和色氨酸氧化水平在整个研究中很低,并且没有检测到其他显著的翻译后修饰。
[0632]
实施例23:贝兰他单抗碱处理
[0633]
在28天后观察到异构化在hc d103中从约3.5%增加到约6.5%。在28天后,脱酰胺在hc n31中从0.1%增加到约2.5%;在hc n388中从约2.0%增加到约10%,并且在hc n393中从约1.7%增加到约18.5%。此外,在ph 9应激28天的贝兰他单抗中也观察到hc m256氧化从约2.2%增加到约3.7%。cief分析显示酸性变体从约25%增加到约62%;以及碱性变体从约9%减少到约4.5%(见下表33)。观察到的所有变化均在抗原、fcγriiia和fcrn特异性结合的测定变异性范围内;因此,spr的结合与第28天ph 9.0应激的贝兰他单抗相当。
[0634]
表33:碱处理的贝兰他单抗的cief结果
[0635]
[0636]
实施例24:贝兰他单抗酸处理
[0637]
28天后片段从0.8%增加到2.3-2.7%。在28天后观察到hc d103处的琥珀酰亚胺形成从0.2%增加到4.0%,hc d103异构化从约3.5%增加到约5.8%。除了天冬氨酸异构化之外,在ph 3.5应激28天的贝兰他单抗中也观察到hc m256氧化从约2.2%增加到约3.7%。cief分析显示酸性变体从约25%增加到约28%;以及碱性变体从约9%增加到约13%(见下表34)。在抗原、fcγriiia和fcrn特异性结合中观察到的所有变化均在测定变异性范围内;因此,spr的结合与28天后ph 3.5应激的贝兰他单抗相当。
[0638]
表34:酸处理的贝兰他单抗的cief结果
[0639][0640]
实施例25:贝兰他单抗热处理
[0641]
28天后片段从0.8%增加到2.2-2.3%。%聚合没有变化。在28天后观察到hc d103处的琥珀酰亚胺形成从0.2%增加到2.2%,hc d103异构化从约3.5%增加到约29%。除了天冬氨酸异构化外,在热应激28天的贝兰他单抗中也观察到氧化在hc m256中从约2.2%增加到约5.3%,在hc m432中从约1%增加到2%。在28天后脱酰胺在hc n329中从约0%增加到约7%,在hc n388中从约2.0%增加到约2.5%,在hc n393中从约1.7%增加到约2.6%。抗原特异性结合在28天时降低到63-67%,这与hc d103异构化的增加一致,这已被证明会影响抗原结合。在fcγriiia和fcrn特异性结合中观察到的变化在测定变异性范围内。
[0642]
实施例26:贝兰他单抗光处理
[0643]
在1.5x ich时,片段从0.8%增加到1.5%,聚合从约1%增加到6.5-7.5%。在1.5x ich下的氧化在hcm34中从约0.3%增加到1.6-2.1%,在hcm256中从约2.2%增加到18.4-25.1%,在hcm432中从约1%增加到13.7-19.5%。cief分析显示酸性变体从约25%增加到约34%;碱性变体没有变化(见下表35)。在抗原、fcγriiia和fcrn特异性结合中观察到的所有变化均在测定变异性范围内;因此,spr的结合与28天后ph3.5应激的贝兰他单抗相当。
[0644]
表35:光处理的贝兰他单抗的cief结果
[0645][0646]
贝兰他单抗强制降解研究显示与上述贝兰他单抗莫福汀强制降解研究一致的结果,唯一的例外是高达48.5%在hc m34处的氧化导致抗原结合没有变化,在测定变异性内。
[0647]
值得注意的是,没有呈现贝兰他单抗莫福汀的cief数据,因为药物载荷有助于电荷谱,而对于贝兰他单抗,cief有效地将酸性和碱性变体与主要种类分离(参见图4)。
[0648]
序列表
[0649]
seq.id.no.1
–
cdrh1
[0650]
nywmh
[0651]
seq.id.no.2:cdrh2
[0652]
atyrghsdtyynqkfkg
[0653]
seq.id.no.3:cdrh3
[0654]
gaiydgydv
l
dn
[0655]
seq.id.no.4:cdrl1
[0656]
sasqdisnyln
[0657]
seq.id.no.5:cdrl2
[0658]
ytsnlhs
[0659]
seq.id.no.6:cdrl3
[0660]
qqyrklpwt
[0661]
seq.id.no.7:重链可变区(cdr加下划线)
[0662]
qvqlvqsgaevkkpgssvkvsckasggtfsnywmhwvrqapgqglewmgatyrghsdtyynqkfkgrvtitadkststaymelsslrsedtavyycargaiydgydv
l
dnwgqgtlvtvss
[0663]
sed.id.no.8:轻链可变区(cdr加下划线)
[0664]
diqmtqspsslsasvgdrvtitcsasqdisnylnwyqqkpgkapklliyytsnlhsgvpsrfsgsgsgtdftltisslqpedfatyycqqyrklpwtfgqgtkleikr
[0665]
seq.id.no.9:重链区(cdr加下划线)
[0666]
qvqlvqsgaevkkpgssvkvsckasggtfsnywmhwvrqapgqglewmgatyrghsdtyynqkfkgrvtitadkststaymelsslrsedtavyycargaiydgydv
l
dnwgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpav
l
qssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsv
l
tv
l
hqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfyps
diavewesngqpennykttppv
l
dsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
[0667]
seq.id.no.10:轻链区(cdr加下划线)
[0668]
diqmtqspsslsasvgdrvtitcsasqdisnylnwyqqkpgkapklliyytsnlhsgvpsrfsgsgsgtdftltisslqpedfatyycqqyrklpwtfgqgtkleikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0669]
seq.id.no.11:具有d103n的重链区(cdr加下划线)
[0670]
qvqlvqsgaevkkpgssvkvsckasggtfsnywmhwvrqapgqglewmgatyrghsdtyynqkfkgrvtitadkststaymelsslrsedtavyycargaiyngydv
l
dnwgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpav
l
qssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsv
l
tv
l
hqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppv
l
dsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
[0671]
seq.id.no.12:具有n388d的重链区(cdr加下划线)
[0672]
qvqlvqsgaevkkpgssvkvsckasggtfsnywmhwvrqapgqglewmgatyrghsdtyynqkfkgrvtitadkststaymelsslrsedtavyycargaiydgydv
l
dnwgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpav
l
qssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsv
l
tv
l
hqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesdgqpennykttppv
l
dsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
[0673]
seq.id.no.13:具有n393d的重链区(cdr加下划线)
[0674]
qvqlvqsgaevkkpgssvkvsckasggtfsnywmhwvrqapgqglewmgatyrghsdtyynqkfkgrvtitadkststaymelsslrsedtavyycargaiydgydv
l
dnwgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpav
l
qssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsv
l
tv
l
hqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpednykttppv
l
dsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
[0675]
seq.id.no.14:具有n388d和n393d的重链区(cdr加下划线)
[0676]
vqlvqsgaevkkpgssvkvsckasggtfsnywmhwvrqapgqglewmgatyrghsdtyynqkfkgrvtitadkststaymelsslrsedtavyycargaiydgydv
l
dnwgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpav
l
qssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsv
l
tv
l
hqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesdgqpednykttppv
l
dsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1