可用作胚胎-成体转变标志物的基因组差异甲基化区域的制作方法
可用作胚胎-成体转变标志物的基因组差异甲基化区域
1.相关申请的交叉引用
2.本技术要求于2019年8月23日提交的美国临时专利申请62/891,225的优先权利益,其内容通过引用方式全文并入本文。
技术领域
3.本发明涉及用于人类基因组的胚胎、胎儿和成体表观遗传状态的分析、诊断、预后、监测和调节的组合物和方法。本公开的方法可用于在个体中监测体外和体内细胞重编程的进展及癌症的诊断、预后和/或监测,和确定用于癌症治疗的最佳治疗方案。具体地,本发明提供了在确定可用于质量控制分析和治疗形式选择的人类细胞的发育状态中用于检测和解释观察到的差异dna甲基化模式和/或对核心组蛋白的相关表观遗传修饰的方法。
背景技术:
4.干细胞技术的进步构成了医学研究的重要新领域,例如人类多能干细胞(hps)(包括但不限于人胚胎干细胞(hes)和诱导多能干细胞(ips))的体外分离和增殖。hps细胞具有在未分化状态下增殖并随后被诱导分化为人体内的任何和所有细胞类型的潜力,所述细胞类型包括表现出胎前期早期的和产前发育标志物的细胞(参见:2006年4月11日提交的申请系列号为pct/us2006/013519且名称为“具有产前基因表达模式的细胞的新用途”的pct申请;2006年11月21日提交的申请系列号为11/604,047且名称为“加速从多能干细胞分离新型细胞株的方法及由此获得的细胞”的美国专利申请;以及2009年7月16日提交的申请系列号为12/504,630且名称为“加速从多能干细胞分离新型细胞株的方法及由此获得的细胞”的美国专利申请,其中每一个全文通过引用方式并入本文)。
5.虽然hips细胞与正常hes细胞的转录谱密切匹配,但hips细胞具有细微的差异,其包括通常不重编程端粒长度(vaziri等2010,spontaneous reversal of the developmental aging of normal human cells following transcriptional reprogramming regen med 5(3):345-363),以及表观遗传异常,例如显示它们所来源的细胞的表观遗传记忆(换言之,缺乏完整的表观遗传重编程)。我们先前公开了测定重编程细胞的端粒长度的方法,其作为生产中的质量控制步骤(west,m.d.,用于多能干细胞的端粒长度和基因组dna质量控制分析的方法,美国专利申请20170335392,通过引用方式并入本文)。然而,仍然需要提供用于量化体细胞重编程为多能性(ips细胞)及部分体内重编程以逆转衰老和诱导组织再生(itr)的程度的改善的灵敏性的其他标志物。更具体地,需要用于确定在体细胞体外重编程为多能性(ips细胞)和部分体内重编程以逆转衰老和诱导组织再生(itr)期间重编程表观基因组的程度的改进的方法。
6.我们先前公开了基因表达标志物以及胚胎-胎儿转变(eft)的调节子以及新生儿转变(nt),其被描述于“用于在哺乳动物中诱导组织再生的组合物和方法”(国际专利申请公开号wo2014/197421,其全文通过引用方式并入本文)和“用于检测和调节哺乳动物物种中的胚胎-胎儿转变的改进方法”(国际专利申请公开号wo2017/214342,其全文通过引用方
式并入本文);和“使用细胞外囊泡诱导组织再生”(2019年7月9日提交的美国临时专利申请62/872,246和2019年3月28日提交美国临时专利申请62/825,732,其中每一个全文通过引用方式并入本文)。我们教导了与从胚胎发育为胎儿和后来的成体发育的发育转变相关的这些基因也负责从在胚胎(胎前期的组织)中观察到的再生状态(例如那些组织进行无疤痕伤口修复的能力)转变为替代在胎儿和成体组织中观察到的再生的瘢痕形成的后期状态。我们还描述了特定基因的子集,其在胚胎(eft前)状态中在mrna水平上的表达谱与在大多数人类癌症中的表达相匹配(即,它们是泛癌标志物)。
7.发育、衰老和癌变期间的基因表达的改变与改变的dna甲基化(包括但不限于cpg岛中改变的dna甲基化)相关。在癌症的情况下,肿瘤抑制基因的甲基化参与到癌变中(kanai y.,hirohashi s.,“alterations of dna methylation associated with abnormalities of dna methyltransferases in human cancers during transition from a precancerous to a malignant state,”carcinogenesis,2007,28,2434-2442)。重要的是,当与正常组织对应物比较时,多样类型的癌症的基因组的全基因组亚硫酸氢盐测序(wgbs)反映出癌细胞基因组(例如与cpg序列相关的那些)中的大量差异甲基化区域(dmr)(su j,huang yh,cui x等,homeobox oncogene activation by pan-cancer dna hypermethylation.genome biol.2018;19(1):108.2018年8月10日公开,doi:10.1186/s13059-018-1492-3)(本文称为su等,2018)。
8.由于dna的甲基化状态在大多数生物环境中(例如在血液中)相对稳定,引起了使用差异甲基化作为标志物检测血液中来源于肿瘤的无细胞dna(cfdna)(循环的肿瘤来源dna(ctdna))的极大兴趣。虽然检测血液和其它体液中差异甲基化dna序列的方法是本领域众所周知的,但是需要新的和确定的差异甲基化区域,例如精确识别显示在eft和新生儿转变(nt)之前相对于eft和nt之后的细胞表型的细胞的那些,其能够被用于检测稀有细胞或循环dna,例如体液中源自已经恢复至所述胚胎而不是胎儿/成体的基因表达谱(胚胎-肿瘤表型)的癌症的细胞(液体活组织检查),或者监测体外或体内重编程的进展。此外,本发明公开了新的观察结果,即肿瘤内的细胞在eft前或eft后成熟状态方面是异质的,并且常用化疗或放疗方案中存活的细胞群体(通常称为癌症干细胞(csc))不是未分化的干细胞,而是实际上显示出导致较慢生长和对细胞凋亡的相对抗性的eft后表型。因此,本发明的方法和组合物提供了测定癌细胞关于它们是成体样癌(ac)细胞还是去成熟癌(dc)细胞的成熟状态的方法,其随之可用于癌症的诊断和预后以及确定靶向和消融ac或dc细胞的最佳治疗选择。
技术实现要素:
9.本发明教导了涉及检测与eft相关的dna的差异甲基化区域(dmr)的新型组合物和方法。更具体地,本发明涉及与dmr相关的新型组合物和方法,所述dmr在胎前期成熟状态的正常细胞中被超甲基化。具有本发明的超甲基化dmr的所述胎前期细胞可以是完全分化的但尚未完全成熟的,因为它们显示与eft后状态中相应细胞显著不同的表型,包括对细胞凋亡的敏感性增强,再生和增殖潜力增加,以及在胎前期(eft前)状态中衰老(senolysis)潜力的增加。
10.本发明公开了eft时细胞的成熟,尽管不一定改变它们的分化状态,但仍可作为肿
瘤抑制、抗再生和抗病毒机制。因此,本发明的dmr提供了测定正常成年体细胞类型重编程回胚胎或再生基因表达模式的程度,测定关于细胞是否转变为糖酵解或氧化磷酸化作为主要能量来源的细胞代谢状态,和确定所述细胞的相关表观遗传状态的方法。胎前期的表型的这些变化的方面在本文中也称为“胚胎-肿瘤表型”。本发明公开了这些dmr标志物出乎意料地几乎是各种类型恶性肿瘤(包括多样的肉瘤、癌和腺癌)的普遍标志(即“泛癌标志物”)。
11.此外,本发明教导了肿瘤中癌细胞异质性的重要特征是癌细胞的成熟状态。本发明教导了癌细胞可以从去成熟(eft前)癌细胞(dc细胞)向成体样ac细胞和从成体样ac细胞向dc细胞交替它们的发育状态。不同于预测化疗或放疗中存活的癌细胞亚群是甚至可能表达多能性标志物(例如oct4、klf4、sox2和myc)或其它es特异性转录因子的发育分化较低的“干细胞”的癌症干细胞模型,发育异质性的ac/dc模型公开了癌细胞的异质性是仅关于表型上是eft前或eft后的成熟状态。此外,本发明公开了化疗或放疗后的残留癌细胞在更成熟且对凋亡更有抗性的ac细胞中富集(图1),这与目前普遍认为残留细胞是更未分化的癌症干细胞相反。
12.因此,提供eft标志物的新型甲基化/脱甲基化基因组dna的鉴定可允许用于肿瘤中eft标志物的扩增和检测的方案,其可用于诊断、预后和治疗决策以及通过使用本领域内已知的差异甲基化dna的下游检测方法检测血液、支气管灌洗液、尿液或其他体液或组织中的循环肿瘤dna(ctdna)来检测患者中癌症的存在。本发明中描述的新型dmr提供了可用于为诊断和治疗的目的鉴定已恢复为所述胚胎(胎前期的)表型的恶性细胞且在一些情况下恶化前细胞的胚胎(胎前期的)以及胎儿(产前)标志物的新型测定法,以及作出与使那些细胞成熟为更成熟的胎儿或成体表型(在本文中也称为“诱导的癌症成熟”或“icm”)以阻止其生长和/或转移,或诱导癌症干细胞中的胚胎(胎前期的)表型以增强它们响应于化疗方案的细胞凋亡的易感性的可取性相关的临床决策。将csc恢复到更原始的胚胎状态的这后一种技术是反直觉的。本发明表明通过在癌症干细胞中引起itr(在本文中称为“诱导的癌症干细胞的衰老”或“is-csc”),结果是产生具有对细胞凋亡较低抗性的胚胎表型(胎前期的)基因表达谱的细胞。因此,本发明提供了检测和靶向具有成体基因表达谱的恶性细胞的方法,以及提供筛选能够引起is-csc的试剂的方法。令人惊讶的是,这种诊断涉及广泛癌症类型,包括癌瘤、腺癌和肉瘤。
13.本公开的实施方案涉及确定作为人dna样品来源的细胞的发育阶段的方法。更具体地,本发明提供了用于确定人dna是否包含胚胎(胎前期的)、胎儿(产前的)或出生后(成体的)标志物的甲基化或未甲基化cpg表观遗传标志物的组合物和方法。所述修饰出乎意料地提供了用于癌症的诊断、预后和治疗的有用的广泛的泛癌标志物,以及细胞的体外转录重编程为多能性(ips细胞重编程)或细胞和组织的体内重编程以逆转衰老或诱导体内不同组织中的组织再生(itr)的完整性的标志物。
14.本公开的方法本质上是泛癌的,因此可用于诊断和/或治疗出乎意料地广泛的各类癌症类型,其中包括但不限于:癌瘤和腺癌(包括但不限于任何类型,包括实体瘤肿瘤和白血病,包括:apud瘤、迷芽瘤、鳃原瘤、恶性类癌综合征、类癌心脏病、癌(例如,walker、基底细胞、基底鳞状细胞、brown-pearce、导管、艾利希氏瘤、原位、krebs 2、梅克尔细胞、粘蛋白、非小细胞肺、燕麦细胞、乳头状、硬癌、细支气管、支气管、鳞状细胞和移行性细胞)、组织
细胞障碍、白血病(例如b-细胞、混合-细胞、空-细胞、t-细胞、t-细胞慢性、htlv-ii-相关、淋巴细胞急性、淋巴细胞慢性、肥大细胞和粒细胞)、恶性组织细胞增生症、霍奇金氏病、免疫增生小、非霍奇金淋巴瘤、浆细胞瘤、网状内皮细胞瘤、黑色素瘤、软骨母细胞瘤、软骨瘤、软骨肉瘤、纤维瘤、纤维肉瘤、巨细胞瘤、组织细胞瘤、脂肪瘤、脂肪肉瘤、间皮瘤、粘液瘤、粘液肉瘤、骨瘤、骨肉瘤、尤文氏肉瘤、滑膜瘤、腺纤维瘤、腺淋巴瘤、癌肉瘤、脊索瘤、颅咽管瘤、无性细胞瘤、错构瘤、间充质瘤、中肾瘤、肌肉瘤、成釉细胞瘤、牙骨质瘤、牙瘤、畸胎瘤、胸腺瘤、滋养细胞肿瘤、腺癌、腺瘤、胆管瘤、胆脂瘤、圆柱瘤、囊腺癌、囊腺瘤、粒层细胞瘤、男性细胞瘤、肝细胞瘤、汗腺瘤、胰岛细胞瘤、间质细胞瘤、乳头状瘤、支持细胞瘤、卵泡膜细胞瘤、平滑肌瘤、平滑肌肉瘤、成肌细胞瘤、肌瘤、肌肉瘤、横纹肌瘤、横纹肌肉瘤、室管膜瘤、神经节瘤、胶质瘤、成神经管细胞瘤、脑膜瘤、神经鞘瘤、成神经细胞瘤、神经上皮瘤、神经纤维瘤、神经瘤、副神经节瘤、非嗜铬性副神经节瘤、血管角化瘤、血管淋巴增生伴嗜酸性粒细胞增多、血管瘤硬化、血管瘤病、血管球瘤、血管内皮瘤、血管瘤、血管外皮细胞瘤、血管肉瘤、淋巴管瘤、淋巴管肌瘤、淋巴管肉瘤、松果体瘤、癌肉瘤、软骨肉瘤、叶状囊肉瘤、纤维肉瘤、血管肉瘤、平滑肌肉瘤、白血病性肉瘤、脂肪肉瘤、淋巴管肉瘤、肌肉瘤、粘液肉瘤、骨肉瘤、横纹肌肉瘤、肉瘤(例如尤文氏(ewing’s)、实验性、卡波西氏(kaposi’s)和肥大细胞)、骨肿瘤、乳腺肿瘤、消化系统肿瘤、结肠直肠肿瘤、肝肿瘤、胰腺肿瘤、垂体肿瘤、睾丸肿瘤、眼眶肿瘤、头颈部肿瘤、中枢神经系统肿瘤、听神经瘤、骨盆肿瘤、呼吸道肿瘤和泌尿生殖系统肿瘤、神经纤维瘤病、宫颈发育不良、肝细胞癌、表皮样癌、肾细胞腺癌、结肠直肠癌和腺癌、食道癌和头颈癌、细支气管肺泡癌如非小细胞肺癌、小细胞肺癌、乳腺癌、乳腺导管癌;胃癌、前列腺癌、子宫腺癌、胚胎神经外胚层肿瘤和畸胎癌、脑细胞癌如成胶质细胞瘤和成神经细胞瘤、血细胞癌如组织细胞性和成淋巴细胞性淋巴瘤和b细胞成淋巴细胞性白血病、或肉瘤(包括但不限于胚胎和肺泡横纹肌肉瘤、骨肉瘤、软骨肉瘤、脂肪肉瘤、骨巨细胞肉瘤、子宫肉瘤、平滑肌肉瘤、维尔姆斯瘤、尤文氏肉瘤、变形性骨炎样肉瘤、上皮样肉瘤、滑膜肉瘤、纤维肉瘤和梭形细胞肉瘤)。
15.此外,本公开的方法可用于出乎意料地广泛多样的人类体细胞类型的发育状态的分期,其包括但不限于:三种胚层内胚层、中胚层和外胚层(包括神经嵴)的衍生物,内胚层体细胞类型的示例是但不限于食道、气管、肺、胃肠、肝和胰腺细胞。中胚层体细胞类型的示例是但不限于骨、软骨、腱、骨骼、心脏和平滑肌、肾脏、皮肤、白色和褐色脂肪、血液和血管内皮细胞。外胚层体细胞类型的示例是但不限于cns和pns神经元细胞,其包括但不限于神经元、神经胶质和感觉神经元细胞,例如视网膜和内耳中的那些。神经嵴体细胞类型的示例是但不限于头颈部的结缔组织,其包括真皮、软骨、骨、脑膜和肾上腺皮质细胞。所述分期可用于测定细胞体外转录重编程为多能性(ips细胞重编程)或细胞和组织的体内重编程以逆转衰老或诱导体内不同组织中的组织再生(itr)的完整性。
16.在一个实施方案中,该方法包括鉴定可用于区分胚胎(胎前期的)阶段细胞与出生后阶段细胞的dmr的步骤,所述方法包括以下步骤:1)测定多能干细胞来源的祖细胞及其成体细胞对应物的dna中cpg的甲基化状态,2)比较胚胎(胎前期的)细胞与其出生后对应物的甲基化以鉴定统计学显著的dmr。
17.在另一个实施方案中,该方法包括以下诊断癌症的步骤:1)从活检的人组织或体液来源的无细胞dna(cfdna)获得dna,2)测量本发明的dmr内甲基化或未甲基化dna的水平,
3)确定dmr或多个dmr中cpg的甲基化%是否为在统计学上显著高于正常组织或cfdna的水平,4)基于与正常对照样品相比的样品dmr中统计学上显著更高的甲基化诊断癌症。
18.在另一个实施方案中,该方法包括以下诊断癌症的步骤:1)从活检的人组织或体液来源的无细胞dna(cfdna)获得dna,2)使用亚硫酸氢盐将未甲基化的胞嘧啶残基转化为尿嘧啶,3)测序本发明的dmr以确定dm或多个dmr中cpg的甲基化%是否为在统计学上显著高于正常组织或ccfdna的水平,4)基于与正常对照样品相比的样品dmr中在统计学上显著更高的甲基化诊断癌症。
19.在另一个实施方案中,该方法包括以下诊断癌症的步骤:1)从活检的人组织或体液来源的无细胞dna(cfdna)获得dna,2)使用亚硫酸氢盐将未甲基化的胞嘧啶残基转化为尿嘧啶,3)用甲基化特异性限制酶消化dna样品,4)pcr扩增dmr区域内的序列以确定dmr或多个dmr中cpg的甲基化%是否为在统计学上显著高于正常组织或cfdna的水平,4)基于与正常对照样品相比的样品dmr中在统计学上显著更高的甲基化诊断癌症。
20.在另一个实施方案中,该方法包括以下诊断癌症的步骤:1)从活检的人组织或体液来源的无细胞dna(cfdna)获得dna,2)测定本发明的dmr内甲基化或未甲基化dna的水平,3)确定dmr或多个dmr中cpg的甲基化%是否为在统计学上显著高于正常组织或cfdna的水平,4)基于与正常对照样品相比的样品dmr中在统计学上显著更高的甲基化诊断癌症。
21.在另一个实施方案中,该方法包括以下诊断癌症的步骤:1)从活检的人组织或体液来源的无细胞dna(cfdna)获得dna,2)使用亚硫酸氢盐将未甲基化的胞嘧啶残基转化为尿嘧啶,3)测序本发明的dmr以确定dmr或多个dmr中cpg的甲基化%是否为在统计学上显著高于正常组织或cfdna的水平,4)基于与正常对照样品相比的样品dmr中在统计学上显著更高的甲基化诊断癌症。
22.在另一个实施方案中,该方法包括以下诊断癌症的步骤:1)从活检的人组织或体液来源的无细胞dna(cfdna)获得dna,2)使用亚硫酸氢盐将未甲基化的胞嘧啶残基转化为尿嘧啶,3)用甲基化特异性限制酶消化dna样品,4)pcr扩增dmr区域内的序列以确定dmr或多个dmr中cpg的甲基化%是否为在统计学上显著高于正常组织或cfdna的水平,4)基于与正常对照样品相比的样品dmr中在统计学上显著更高的甲基化诊断癌症。
23.在另一个实施方案中,该方法包括以下诊断癌症的步骤:1)从体液来源的无细胞dna(cfdna)获得dna,2)使用亲和分离方法去除含有胎儿或成体特异性组蛋白表观遗传修饰h3k4me1、h3k4me2、h3k4me3、h3k9ac和h2az的核小体,3)使用偏亚硫酸氢盐将未甲基化的胞嘧啶残基转化为尿嘧啶,4)pcr扩增dmr区域内的序列以确定dmr或多个dmr中cpg的甲基化%是否为在统计学上显著高于正常组织或cfdna的水平,5)基于与正常对照样品相比的样品dmr中在统计学上显著更高的甲基化诊断癌症。
24.在另一个实施方案中,该方法包括以下诊断癌症的步骤:1)从体液来源的无细胞dna(cfdna)获得dna,2)使用亲和分离方法分离存在于含有本发明的dmr区域内的组蛋白表观遗传修饰(包括h3k9me2和h3k9me3)的核小体,3)使用偏亚硫酸氢盐将未甲基化的胞嘧啶残基转化为尿嘧啶,4)pcr扩增dmr区域内的序列以确定dmr或多个dmr中cpg的甲基化%是否为在统计学上显著高于正常组织或cfdna的水平,5)基于与正常对照样品相比的样品dmr中在统计学上显著更高的甲基化诊断癌症。
25.在另一个实施方案中,该方法包括检测对is-csc或icm有反应的癌症干细胞(csc)
的步骤,所述步骤为:1)从活检的人组织获得dna,2)测量本发明的dmr内甲基化或未甲基化dna的水平,3)确定dmr或多个dmr中cpg的甲基化%是否为在统计学上显著高于正常组织的水平,4)基于与治疗反应性样品相比的样品dmr中在统计学上显著更低的甲基化诊断治疗抗性csc。
26.在另一个实施方案中,该方法包括检测对is-csc或icm有反应的癌症干细胞(csc)的步骤,所述步骤为:1)从活检的人组织获得dna,2)使用亚硫酸氢盐将未甲基化的胞嘧啶残基转化为尿嘧啶,3)测序本发明的dmr以确定dmr或多个dmr中cpg的甲基化%是否为在统计学上显著高于正常组织或cf-dna的水平,4)基于与治疗反应样品相比的样品dmr中在统计学上显著更低的甲基化诊断治疗抗性csc。
27.在另一个实施方案中,该方法包括检测对is-csc或icm有反应的癌症干细胞(csc)的步骤,所述步骤为:1)从活检的人组织获得dna,2)使用亚硫酸氢盐将未甲基化的胞嘧啶残基转化为尿嘧啶,3)用甲基化特异性限制酶消化dna样品,4)pcr扩增dmr区域内的序列以确定dmr或多个dmr中cpg的甲基化%是否为在统计学上显著高于正常组织或cf-dna的水平,4)基于与治疗反应性样品相比的样品dmr中在统计学上显著更低的甲基化诊断治疗抗性csc。
28.在另一个实施方案中,该方法包括对体外体细胞重编程为多能性(ips细胞)的完整性评分的步骤,所述步骤为:1)从用旨在将体细胞重编程为多能性的试剂处理的细胞中获得dna,2)测量本发明的dmr内甲基化或未甲基化dna的水平,3)确定dmr或多个dmr中cpg的甲基化%是否为在统计学上显著高于正常hes细胞dna的水平,4)利用所述dmr内甲基化的cpg的百分比对重编程的完整性进行评分。
29.在另一个实施方案中,该方法包括对体外体细胞重编程为多能性(ips细胞)的完整性评分的步骤,所述步骤为:1)从用旨在将体细胞重编程为多能性的试剂处理的细胞中获得dna,2)使用亚硫酸氢盐将未甲基化的胞嘧啶残基转化为尿嘧啶,3)测序本发明的dmr以确定dmr或多个dmr中cpg的甲基化%是否为在统计学上显著低于正常多能干细胞(hes细胞)的水平,4)利用所述dmr内甲基化的cpg的百分比对重编程的完整性进行评分。
30.在另一个实施方案中,该方法包括对体外体细胞重编程为多能性(ips细胞)的完整性评分的步骤,所述步骤为:1)从用旨在将体细胞重编程为多能性的试剂处理的细胞中获得dna,2)使用亚硫酸氢盐将未甲基化的胞嘧啶残基转化为尿嘧啶,3)用甲基化特异性限制酶消化dna样品,4)pcr扩增dmr区域内的序列以确定dmr或多个dmr中cpg的甲基化%是否为在统计学上显著高于正常人多能干细胞(hes细胞)的水平,4)利用所述dmr内甲基化的cpg的百分比对重编程的完整性进行评分。
31.在另一个实施方案中,该方法包括对体外体细胞重编程为eft前状态以逆转衰老和诱导组织再生(itr)的程度评分的步骤,所述步骤为:1)从用旨在逆转衰老和诱导组织再生的试剂处理的细胞中获得dna,2)测量本发明的dmr内甲基化或未甲基化dna的水平,3)确定dmr或多个dmr中cpg的甲基化%是否为在统计学上显著高于正常hes细胞dna的水平,4)利用所述dmr内甲基化的cpg的百分比对itr重编程的完整性进行评分。
32.在另一个实施方案中,该方法包括对体内体细胞重编程为eft前状态以逆转衰老和诱导组织再生(itr)的程度评分的步骤,所述步骤为:1)从用旨在逆转衰老和诱导组织再生的试剂处理的细胞、组织或体液中获得dna,2)测量本发明dmr内甲基化或未甲基化dna的
水平,3)确定dmr或多个dmr中cpg的甲基化%是否为在统计学上显著高于正常hes细胞dna的水平,4)利用所述dmr内甲基化的cpg的百分比对itr重编程的完整性进行评分。
33.在另一个实施方案中,该方法包括对体内体细胞重编程为eft前状态以逆转衰老和诱导组织再生(itr)的程度评分的步骤,所述步骤为:1)从用旨在逆转衰老和诱导组织再生的试剂处理的细胞、组织或体液中获得dna,2)使用亚硫酸氢盐将未甲基化的胞嘧啶残基转化为尿嘧啶,3)测序本发明的dmr以确定dmr或多个dmr中cpg的甲基化%是否为在统计学上显著低于正常多能干细胞(hes细胞)和/或高于体细胞对应物的水平,和4)利用所述dmr内甲基化的cpg的百分比对itr重编程的完整性评分。
34.在另一个实施方案中,该方法包括对体内体细胞重编程为eft前状态以逆转衰老和诱导组织再生(itr)的程度评分的步骤,所述步骤为:1)从用旨在逆转衰老和诱导组织再生的试剂处理的细胞、组织或体液中获得dna,2)使用亚硫酸氢盐将未甲基化的胞嘧啶残基转化为尿嘧啶,3)使用亚硫酸氢盐将未甲基化的胞嘧啶残基转化为尿嘧啶,4)用甲基化特异性限制酶消化dna样品,5)pcr扩增dmr区域内的序列以确定dmr或多个dmr中cpg的甲基化%是否为在统计学上显著低于正常人多能干细胞(hes细胞)和/或高于正常体细胞对照的水平,和4)利用所述dmr内甲基化的cpg的百分比对itr重编程的完整性进行评分。
35.根据本发明,提供了一种使用选自来自个体的培养细胞、组织、肿瘤、血液、血浆、血清、唾液、尿液的生物样品来检测或监测细胞的发育阶段的方法,所述方法包括:
36.(a)从所述生物样品获得dna;
37.(b)测定本发明的dmr内cpg残基的甲基化百分比;
38.(c)使用甲基化百分比来确定dna是代表胚胎(胎前期的)表观遗传状态或是成体表观遗传状态。
39.本发明的新颖性涉及有力地区分源自具有胚胎或胚胎-肿瘤表型的细胞的dna的新型dmr,以及所述信息用于诊断癌症、确定癌症干细胞的存在、监测体细胞体外重编程为多能性(ips细胞)的完整性和监测体内人细胞和组织体内重编程以诱导组织再生(itr)的程度的新用途。检测差异甲基化dna的下游方法,例如用于液体活检以检测癌症来源的cfdna(循环肿瘤来源的dna(ctdna))的应用是本领域众所周知的。作为非限制性示例,改变的dmr甲基化可以通过以下检测:
40.(a)从所述生物样品获得dna;
41.(b)用一种或多种甲基化敏感性限制酶消化所述dna样品;
42.(c)在步骤(b)之后定量或检测目标dna序列,其中所述目标的靶序列包含至少两个甲基化敏感性限制酶识别位点;以及
43.(d)比较来自个体的dna序列水平与正常标准以检测、预测或监测癌症。
44.在本发明的一个优选方面,步骤(c)中使用聚合酶链式反应。优选地,甲基化敏感性限制酶识别尚未被甲基化的dna序列。靶序列是在癌症患者中对甲基化敏感的序列,使得正常患者中未甲基化的靶序列被消化且不通过聚合酶链式反应扩增,而在癌症患者中,靶序列被甲基化且不被酶消化,并且随后可例如使用聚合酶链式反应定量或检测。
45.本发明的方法可用于预测个体对癌症的易感性、评估个体中癌症的阶段、预测个体总体生存的可能性、预测个体复发的可能性或评估个体的治疗有效性。
46.根据本发明的另一方面,提供了使用选自来自个体的组织、肿瘤、血液、血浆、血
清、唾液、尿液的生物样品来检测或监测癌症的方法,所述方法包括:
47.(a)从所述生物样品获得dna;
48.(b)用一种或多种甲基化敏感性限制酶消化所述dna样品;
49.(c)在步骤(b)之后定量或检测目标dna序列,其中所述dna序列是包含表i中dmr的部分或全部的序列;以及
50.(d)比较来自个体的dna序列水平与正常标准以检测、预测或监测癌症。
51.用于dmr的基于pcr的扩增和检测的方法,例如使用发光甲基化测定(luma)、亚硫酸氢盐转化、焦磷酸测序、质谱、qpcr阵列、基于亲和力和限制酶的阵列、基于亚硫酸氢盐转化的阵列和下一代测序是本领域众所周知的(kurdyukov,s.和bullock,m.dna methylation analysis:choosing the right method.2016biology 5(1):3和sant,k.e.等,dna methylation screening and analysis.2012.methods mol bio 889:385-406),其以普遍使用的一般规则通过引用并入本文。
52.根据本发明的另一方面,提供了用于本发明的方法的探针、引物和试剂盒。特别是,提供了:用于检测或监测选自来自个体的组织、肿瘤、血液、血浆、血清、唾液、尿液的生物样品中的癌症的引物组,其包括对表i的dmr特异性的引物,其中所述引物组示于表ii中;
53.用于检测或监测选自来自个体的组织、肿瘤、血液、血浆、血清、唾液、尿液的生物样品中的癌症的试剂盒,其包含本发明的探针和本发明的引物组;以及
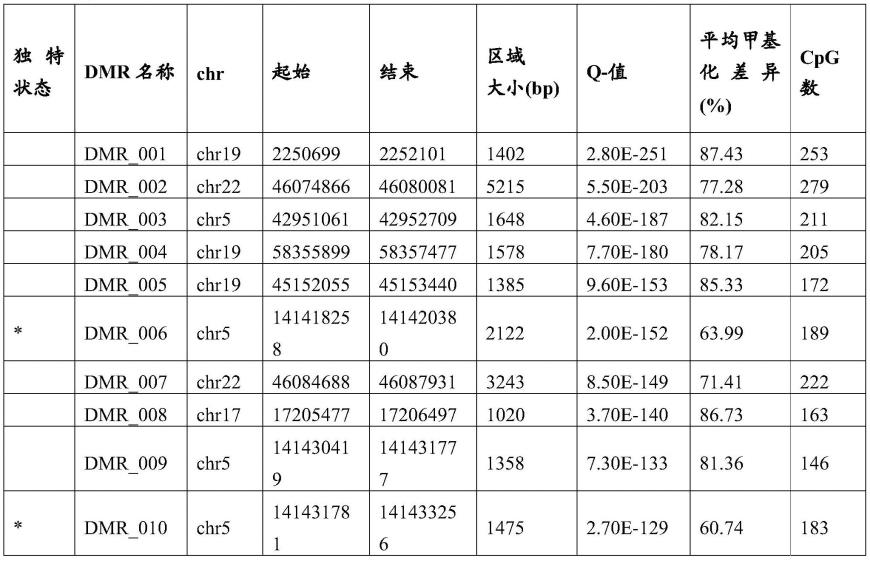
54.检测或监测选自来自个体的血液、血浆、血清、唾液、尿液的生物样品中的癌症的期间用作对照的试剂盒,其包含本发明的引物组和本发明的对照引物组。
附图说明
55.图1显示为修饰百分比的甲基化cpg残基的igv。其显示了分别对应于成骨间充质、血管内皮、骨骼肌成肌细胞和白色前脂肪细胞的四种hes细胞来源的克隆胚胎祖细胞系(4d20.8、30-mv2-6、sk5和e3),随后是它们各自的四种成体来源的对应物(骨髓间充质干细胞(msc)、主动脉内皮细胞(haec)、骨骼肌成肌细胞和白色前脂肪细胞)。dmr_327的位置显示为标记顶部dmr的行中的条形。
56.图2显示了对应于成骨间充质和血管内皮的两种hes细胞来源的克隆胚胎祖细胞系(分别为4d20.8和30-mv2-6)的atac-seq和cpg甲基化结果的igv,随后是它们各自的两种成体来源的对应物(骨髓间充质干细胞(msc)和主动脉内皮细胞(haec))。还显示了来自两种hes细胞系ma03和h9的相当的atac和bis结果,以及由最初的hes细胞来源的克隆细胞系en13产生的ipsc(vaziri等2010,spontaneous reversal of the developmental aging of normal human cells following transcriptional reprogramming regen med 5(3):345-363),以及人类成体真皮成纤维细胞来源的ipsc。标题为顶部dmr的行显示dmr的位置。
57.图3显示了通过对应于成骨间充质的hes细胞来源的克隆胚胎祖细胞系和作为骨髓间充质干细胞的正常成体对应物(分别为4d20.8和msc)的bis获得的cpg甲基化结果的igv,随后是来源于成骨间充质的对应成体来源的癌细胞系(骨肉瘤细胞系u-2、sjsa-1、khos-240s和khos/np)。还显示了通过对应于骨骼肌成肌细胞的hes细胞来源的克隆胚胎祖细胞系和作为成体骨骼肌成肌细胞的成体来源的正常对应物(分别为sk5和成体骨骼肌成肌细胞)的bis获得的cpg甲基化结果,随后是来源于肌肉间充质的对应成体来源的癌细胞
系(横纹肌肉瘤(rms)细胞系ccl-136、a-204、sjcrh30和te617.t)。还示出了通过对应于白色脂肪细胞祖细胞的hes细胞来源的克隆胚胎祖细胞系(e3)和作为成体前脂肪细胞的成体来源的正常对应物以及脂肪生成癌细胞系(94t778和93t449)的bis获得的cpg甲基化结果。标题为顶部dmr的行显示dmr的位置。
58.图4显示了四种hes细胞系和ep来源的ips细胞系(es&ipsc);42种不同的hesc来源的ep细胞系(不同ep);100种不同的体细胞类型,包括神经元、神经胶质、肝细胞、不同的基质细胞类型以及其他(不同的正常体细胞);24种不同的培养上皮细胞类型(上皮);39种不同的肉瘤细胞类型(肉瘤);35种不同的癌瘤和腺癌细胞类型(癌);以及四种血液癌细胞类型(血液ca)中转录物linc00865的fpkm中的rna-seq值。
59.图5显示了四种hes细胞系和ep来源的ips细胞系(es&ipsc);三种来自晚期胚胎(8周)人类胚胎(emb)上臂的真皮成纤维细胞培养物;12种来自9-16周龄人类胎儿(胎儿)上臂的真皮成纤维细胞培养物;13种来自3-13岁人类新生儿(新生儿)上臂的真皮成纤维细胞培养物;和29种19-83岁成体(老年)上臂的真皮成纤维细胞培养物;以及与由所述被标记的成纤维细胞产生的ips细胞(第6代)(老的和重编程的)一起如本文所述在诱导静止的条件下培养的来自上臂的59岁老年供体的人成体成纤维细胞(第5代)中转录物linc00865的fpkm中的rna-seq值。
60.图6显示hes细胞系h9、ma03、esi 017、esi 053和ep来源的ips细胞系eh3以及成体(59岁)来源的真皮成纤维细胞系中fpkm中rna-seq值,随后是转录物的来源于所述成体成纤维细胞的ips细胞系:a)dnmt3b;b)pou5f1(oct4);c)lin28b;和胎儿/成体发作基因pcdhga12。
61.图7:dmr_327和基因linc00865周围区域的igv图像。从上到下,行显示成骨间充质ep细胞系4d20.8的bis-产生的cpg甲基化,随后是其成体对应物骨髓来源的msc;ctcf结合位点(在该实施例中没有);dmr q值,随后是前1000个dmr的显著性排序;chip-seq读取胚胎相对于成体细胞中所示组蛋白修饰。
62.图8:在结肠癌vs正常结肠、前列腺癌vs良性前列腺、具有idh突变的胶质母细胞瘤vs正常大脑、msc表型的胶质母细胞瘤vs正常大脑、具有pdgfra扩增的胶质母细胞瘤vs正常大脑、具有egfr扩增的胶质母细胞瘤vs正常大脑、脂肪肉瘤细胞vs正常皮下前脂肪细胞、骨肉瘤细胞vs骨髓msc以及横纹肌肉瘤vs正常骨骼肌成肌细胞中的dmr_327中甲基化的cpg部分。每一个重复。
63.图9:来自外源表达成体水平的cox7a1的纤维肉瘤细胞系ht1080和hti080的异种移植肿瘤的生长的时间线。
64.图10:在胰腺肿瘤相对于kras消融后存活的胰腺癌干细胞中的成体细胞标志物cox7a1和cat的表达。
65.图11:通过icm基因cox7a1外源表达后的dc纤维肉瘤细胞系ht1080的tunel试验测量的细胞凋亡反应。表i显示了本发明的eft前细胞和dc细胞中超甲基化的dmr,以及它们的独特状态,其中用星号(“*”)标记的所述状态相对于su等,2018具有新颖性;具有su等,2018公开的dmr的至少2个核苷酸涵盖没有星号的那些,染色体编号(chr),人类基因组hg38中指定染色体上的起始和结束位置;dmr区域的大小以bp计,如在四种hes细胞来源的克隆胚胎祖细胞系(成骨间充质系4d20.8、内皮系30-mv2-6、前脂肪系e3和骨骼成肌细胞系sk-5,与
其成体对应物骨髓msc、主动脉内皮细胞、皮下白色前脂肪细胞和骨骼肌成肌细胞相比)中测定的差异甲基化的统计学显著性(q值);平均eft前系和成体之间的甲基化%差异,以及dmr中cpg的数量。表i中带星号的dmr(不是su等,2018中的dmr)作为本发明的一部分公开,用于测定eft状态并由此做出治疗选择,以及通常用于检测癌症,例如用液体活检。su等,2018公开了不带星号的dmr并且作为本发明的一部分被公开用于确定eft状态和随后的治疗决策。
具体实施方式
66.缩写
67.ac细胞-成体癌细胞是指显示eft后表观遗传标志物(例如本发明的相对未甲基化的dmr)的恶性癌细胞
68.amh-抗苗勒管激素
69.atac-转座酶可及染色质的测定
70.atac-seq-高通量dna测序后的转座酶可及染色质的测定
71.asc-成体干细胞
72.bis-亚硫酸氢盐测序是指在亚硫酸氢盐修饰未甲基化的胞嘧啶为尿嘧啶之后的dna测序,其作为鉴定甲基化cpg的一种手段
73.bp-dna的碱基对
74.chr-染色体
75.csc-癌症干细胞
76.cgmp-当前良好的制造工艺
77.cm-癌症成熟
78.cns-中枢神经系统
79.ctcf-ccctc结合因子
80.cfdna-无细胞dna
81.ctdna-循环的肿瘤来源dna
82.dc细胞-成熟癌细胞是指在肿瘤形成过程中获得的具有eft前基因表达模式和本发明的严重甲基化dmr的eft前模式的正常细胞
83.dmem-杜氏改良eagle培养基
84.dmr-差异甲基化区域是指相比于eft后细胞的eft前细胞中显著差异化的cpg
85.dpbs-杜氏磷酸盐缓冲盐水
86.ed cells-胚胎来源细胞;hed细胞为人ed细胞
87.edta-乙二胺四乙酸
88.eft-胚胎-胎儿转变是当胎儿发育开始时,人类妊娠第8周完成时发生的发育转变
89.eg细胞-胚胎生殖细胞;heg细胞为人eg细胞
90.ep-胚胎祖细胞
91.es细胞-胚胎干细胞;hes细胞为人es细胞
92.esc-胚胎干细胞
93.facs-荧光激活细胞分选
94.fbs-胎牛血清
95.fpkm-来自rna测序的每百万映射读数的每千碱基转录物片段
96.hed细胞-人胚胎来源细胞
97.heg细胞-人类胚胎生殖细胞是来源于胎儿组织的原始生殖细胞的干细胞
98.hesc-人类胚胎干细胞
99.hips细胞-人类诱导多能干细胞是暴露于hes特异性转录因子(例如sox2、klf4、oct4、myc或nanog、lin28、oct4和sox2)后具有与获取自体细胞的hes细胞相似特性的细胞
100.icm-诱导癌症成熟
101.igv-综合基因组察看器
102.ips细胞-诱导多能干细胞是暴露于es特异性转录因子(例如sox2、klf4、oct4、myc或nanog、lin28、oct4和sox2、sox2、klf4、oct4、myc和(lin28a或lin28b),或oct4、sox2、klf4、nanog、esrrb、nr5a2、cebpa、myc、lin28a和lin28b的其他组合)具有与获自hes细胞相似特性的细胞
103.is-诱导衰老是指使用itr以诱导老化或衰老细胞的内在细胞凋亡
104.is-csc-癌症干细胞的诱导衰老是指通过化疗药剂或放射疗法难以消融的恶性肿瘤细胞的处理,其中所述is-csc治疗导致所述难治性细胞恢复到胎前期基因表达模式且变为对化疗药剂或放射疗法敏感
105.itm-诱导组织成熟
106.itr-诱导组织再生
107.mem-最低要素培养基
108.mscs-间充质干细胞
109.msp-甲基化特异性pcr
110.nt-新生儿转变,即分娩时孕体的发育转变
111.pbs-磷酸盐缓冲盐水
112.rfu-相对荧光单位
113.rms-横纹肌肉瘤
114.rna-seq-rna测序
115.sfm-无血清培养基
116.本发明提供了评估、诊断、预测或监测个体中肿瘤的存在或进展的方法,其包括但不限于预测癌细胞对化疗药剂或icm方案的敏感性。令人惊讶地,这种诊断在性质上是泛癌的,并且涉及包括癌瘤、腺癌和肉瘤的广泛癌症类型,其中包括但不限于肝细胞癌、表皮样癌、肾细胞腺癌、结肠直肠癌和腺癌、细支气管肺泡癌如非小细胞肺癌、乳腺癌、乳腺导管癌;阴道和宫颈癌、胃癌、前列腺癌和腺癌、子宫腺癌;胚胎神经外胚层肿瘤和畸胎癌;脑细胞癌如成胶质细胞瘤和成神经细胞瘤;血细胞癌如组织细胞性和成淋巴细胞性淋巴瘤和b细胞成淋巴细胞性白血病;或肉瘤(包括但不限于胚胎和肺泡横纹肌肉瘤、骨肉瘤、软骨肉瘤、脂肪肉瘤、骨巨细胞肉瘤、子宫肉瘤、平滑肌肉瘤、维尔姆斯瘤、尤文氏肉瘤、变形性骨炎样肉瘤、上皮样肉瘤、滑膜肉瘤、纤维肉瘤和梭形细胞肉瘤)。
117.在通过本发明的方法已经确定这些癌症为其它癌瘤、腺癌、肉瘤和脑或血细胞癌的情况下,这些癌症已经恢复至胚胎表型(也称为胚胎-肿瘤表型)(也称为去成熟癌症(dc)
细胞),然后可应用适合于该表型的药剂(即在抑制特定表型的癌细胞复制或诱导细胞凋亡中有效的药剂)治疗患者的癌症,例如常用的化疗药剂,包括但不限于六甲蜜胺、苯达莫司汀、白消安、卡铂、卡莫司汀、苯丁酸氮芥、顺铂、环磷酰胺、达卡巴嗪、异环磷酰胺、洛莫司汀、甲氯乙胺、美法仑、奥沙利铂、替莫唑胺、噻替派或曲贝替定。或者,使用本发明的组合物和方法,表现出胎前期胚胎-肿瘤表型(dc细胞)的cns肿瘤(例如胶质母细胞瘤和星形细胞瘤)可被选择用于用穿过血脑屏障的烷化剂(例如卡莫司汀、洛莫司汀和链脲菌素)治疗。此外,使用本发明的组合物和方法,表现出胎前期胚胎-肿瘤表型(dc细胞)的肿瘤被确定为相比于表现出胎儿或成体表型的那些(成体癌症(ac)细胞)以相对快的速率增殖且更具侵袭性地转移,因此确定所述dc细胞对抗代谢物更敏感,所述抗代谢物包括但不限于氮杂胞苷、5-氟尿嘧啶(5-fu)、6-巯基嘌呤(6-mp)、卡培他滨、克拉屈滨、氯法拉滨、阿糖胞苷、地西他滨、氟尿苷、氟达拉滨、吉西他滨、羟基脲、甲氨蝶呤、奈拉滨、培美曲塞、喷司他丁、普拉曲沙、硫鸟嘌呤和三氟尿苷。或者,使用本发明的组合物和方法,显示胎前期胚胎-肿瘤表型(dc细胞)并因此被确定为相比于细胞以相对快的速率增殖且更具侵袭性地转移的肿瘤被确定为对抗肿瘤抗生素更敏感,所述抗肿瘤抗生素包括但不限于蒽环类柔红霉素、多柔比星、表柔比星、伊达比星和戊柔比星或博来霉素、更生霉素、丝裂霉素-c和米托蒽醌,或拓扑异构酶抑制剂伊立替康、拓扑替康、喜树碱、依托泊苷、替尼泊苷,有丝分裂抑制剂卡巴他赛、多西他赛、白蛋白结合型紫杉醇和紫杉醇、或长春花生物碱长春碱、长春新碱和长春瑞滨。
118.此外,或相反,在恶性细胞已经恢复至eft后表型(ac细胞)(令人惊讶地是通常也被命名为癌症干细胞)从而变得对细胞凋亡相对有抗性的情况下,抗性“癌症干细胞”可以被诱导回胎前期的表型以增加它们对诱导细胞凋亡的治疗的敏感性。这些包括使用本文公开的itr重编程方法(也称为癌症干细胞(is-csc)的衰老的诱导),抑制pi3k/akt/mtor(磷酸肌醇3-激酶/akt/雷帕霉素的哺乳动物靶标)途径,例如用雷帕霉素或mtor的其它抑制剂、饮食限制或饮食限制模拟物。与eft相关的途径在癌症诊断和治疗中的这些和相关用途是本发明的主题。
119.本领域已知许多肿瘤抑制基因在许多肿瘤细胞中相对高度甲基化。因此,在本领域中已知此类高度甲基化的循环肿瘤dna(ctdna)的用途可用作在动物(包括人类)中控制癌症的诊断和预后标志物。但是,仍然需要鉴定另外的此类癌症标志物,特别是作为所有癌症类型的标志物(泛癌标志物)的那些,以及在选择最佳治疗策略中支持临床决策的那些。本发明提供了大量新型dmr,其相比于它们的成体对应物,通过比较分析四种hes细胞来源的克隆胚胎祖细胞与骨软骨间充质、血管内皮、骨骼成肌细胞和白色前脂肪细胞的差异甲基化区域来鉴定。在人基因组的hg38版本中的这些dmr的位置示于表i中。dmr以差异甲基化的统计学显著性的等级排序列出,对于整个列表这种显著性《1x 10e-25。
120.表i
121.122.123.124.125.126.127.128.129.130.131.132.133.134.135.136.137.138.139.140.141.142.143.144.145.146.147.148.149.150.151.152.[0153][0154]
表i显示了胚胎(胎前期的)细胞和癌症中与它们的正常胎儿或成体对应物相比的差异甲基化的基因组区域。鉴定的位置来自人类基因组的hg38版本。
[0155]
甲基化特异性pcr(msp)是检测甲基化或未甲基化dna的最常用的方法。msp涉及亚硫酸氢盐转化的步骤。亚硫酸氢钠用于将胞嘧啶脱氨成尿嘧啶,同时保持5-甲基-胞嘧啶完整。甲基化特异性pcr使用靶向亚硫酸氢盐诱导的序列变化的pcr引物以特异性扩增甲基化或未甲基化的等位基因。亚硫酸氢盐转化破坏约95%的dna。由于血清或血浆中dna浓度通
常非常低,dna中的95%减少导致检测率低于50%。
[0156]
备选方法使用特异性消化甲基化或未甲基化dna的限制性酶。特异性切割甲基化dna的酶是罕见的。但是,特异性切割未甲基化dna的酶更容易获得。然后,检测方法确定消化是否已经发生,因此根据所用酶的特异性,允许检测潜在的dna是甲基化还是未甲基化,因此是否与癌症相关。
[0157]
先前已提出甲基化敏感性酶消化。例如,silva等,british journal of cancer,80:1262-1264,1999中进行了甲基化敏感性酶消化,然后进行pcr。
[0158]
本发明提供了利用与胚胎-胎儿转变(eft)并因此胚胎-肿瘤表型相关的新型差异甲基化基因的ctdna甲基化敏感性检测的改进方法,从而改进了癌症诊断性能。
[0159]
本方法涉及使用甲基化敏感性限制酶消化dna序列。选择含有至少两个可以或不可以甲基化的限制性位点的目标dna序列。本方法优选用甲基化敏感性限制酶进行,与甲基化序列相比,该酶优先切割未甲基化序列。甲基化序列保持未消化并被检测。至少一个甲基化敏感性限制酶位点的未甲基化序列的消化导致靶序列未被检测或扩增。因此甲基化序列可以区别于未甲基化序列。在本发明的一个实施方案中,因为靶序列在癌症患者中比在健康个体中更高度甲基化,所以在癌症患者的生物样品(例如血浆或血清)中检测到的未切割靶序列的量高于在相同类型的健康或无癌症个体的生物样品中被证实的量。
[0160]
或者,可以使用切割甲基化dna的限制性酶。未甲基化的dna序列未被消化且可被检测。在本发明的另一个实施方案中,当与在无癌症个体中相同类型的生物样品中证实的结果相比时,在癌症患者的生物样品(例如血浆或血清)中检测到较低量的未切割dna序列。
[0161]
在根据本发明的优选实施方案中,通过由pcr的扩增检测靶序列。可以使用实时定量pcr。引物序列选择使得至少两个甲基化敏感性限制酶位点存在于待使用此类引物扩增的序列中。根据本发明的方法不使用亚硫酸氢钠。通过合适的方法如pcr进行的扩增用于检测未切割的靶序列,从而鉴定未被限制酶切割的甲基化dna的存在。
[0162]
根据本发明,可以使用任何合适的甲基化敏感性限制酶。切割未甲基化dna的甲基化敏感性限制酶的示例列于表ii中。
[0163]
表ii
[0164]
[0165][0166]
表ii显示甲基化敏感性限制酶的示例。识别序列中的字母代码代表核苷酸的不同组合,总结如下:r=g或a;y=c或t;w=a或t;m=a或c;k=g或t;s=c或g;h=a、c或t;v=a、c或g;b=c、g或t;d=a、g或t;n=g、a、t或c。每个识别序列中的cpg二核苷酸用下划线标出。这些cpg二核苷酸的胞嘧啶残基进行甲基化。*识别序列中cpg二核苷酸的胞嘧啶的甲基化将阻止靶序列的酶切割。
[0167]
靶序列包括两个或更多个甲基化敏感性限制酶位点。这些位点可被相同或不同的酶识别。然而,选择位点使得当使用与甲基化序列相比优先切割未甲基化序列的酶时,每个序列中的至少两个位点被消化。
[0168]
在较不优选的实施方案中,靶序列包含至少两个被优先切割甲基化序列的限制性酶切割或裂解的位点。两个或更多个位点可被相同或不同的酶切割。
[0169]
表i中列出的任何dmr可以根据本发明使用。优选的dmr区是包含至少两个甲基化敏感性限制酶位点的那些。通常,这样的甲基化标志物是其中启动子和/或编码序列在胚胎细胞和癌症患者中被甲基化的基因。优选地,所选序列在胎儿和成体细胞以及非癌或无癌个体中未甲基化或甲基化程度较低。
[0170]
因此,根据本发明的一个替代方面,提供了一种使用选自来自个体的血液、血浆、血清、唾液、尿液的生物样品检测或监测癌症的方法,所述方法包括:
[0171]
(a)从所述生物样品获得dna;
[0172]
(b)用一种或多种甲基化敏感性限制酶消化所述dna样品;
[0173]
(c)在步骤(b)之后定量或检测目标dna序列,其中所述dna序列是表i中所列的序列;以及
[0174]
(d)比较来自个体的dna序列水平与正常标准以检测、预测或监测癌症。
[0175]
根据本发明的方法,从患者采集或获得样品。合适的样品包括血液、血浆、血清、唾液和尿液。根据本发明使用的样品包括全血、血浆或血清。从全血制备血清或血浆的方法是本领域技术人员熟知的。例如,可以将血液置于含有edta或专门商品如vacutainer sst(becton dickenson,franklin lake,n.j.)的管中以防止血液凝固,然后可以通过离心从全血中获得血浆。血液凝固后血清可以通过或不通过离心获得。如果使用离心,则通常但不专门以合适的速度例如1500-3000x g进行。血浆或血清在转移至用于dna提取的新鲜试管之前可以进行另外的离心步骤。
[0176]
优选地,使用合适的dna提取技术从样品中提取dna。dna的提取是本领域技术人员的常规问题。从包括血液的生物样品中提取dna有许多已知的方法。可以按照dna制备的一般方法,例如sambrook和russell,molecular cloning a laboratory manual,3rd edition(2001)所描述的。各种市售试剂或试剂盒也可用于从血液样品中获得dna。
[0177]
根据本发明,将包含dna的样品与一种或多种优先切割未甲基化dna的限制酶在一定条件下孵育,使得当两个或更多个限制酶位点存在于未甲基化状态的靶序列中时,限制酶可以在至少一个这样的位点切割靶序列。根据本发明的另一个方面,dna样品与一种或更多种限制性内切酶一起孵育,所述限制性内切酶仅在未甲基化状态中存在两种或更多种限制性内切酶位点,限制性内切酶可在至少一个这样的位点切割靶序列的条件下切割甲基化的dna。
[0178]
优选地,在允许完全消化的条件下孵育样品。这可以例如通过增加孵育时间和/或增加所用酶的量来实现。通常,将样品与100个活性单位的甲基化敏感性限制酶一起孵育长达16小时。本领域技术人员根据所用酶的量建立合适的条件是常规事情。
[0179]
孵育后,检测未切割的靶序列。优选地,通过扩增检测这些序列,例如使用聚合酶链式反应(pcr)。
[0180]
设计dna引物被设计为扩增包含至少两个甲基化敏感性限制酶位点的序列。这样的序列可以通过查看dna甲基化标志物和鉴定被甲基化敏感性酶识别的那些靶标中的限制酶位点来鉴定。例如,使用表ii中鉴定的甲基化敏感性酶的识别序列,可以在表i中鉴定合适的靶序列。
[0181]
当使用甲基化敏感性酶时,将根据特定个体中靶序列的甲基化状态来检测靶序列的改变量。在使用优先切割未甲基化dna的甲基化敏感性限制酶的本发明的优选方面,在未甲基化状态下(例如在健康个体中)将不会检测到靶序列。但是,当靶序列被甲基化时,例如在来自癌症患者的选定样品中,靶序列不被限制酶切割,因此可以通过pcr检测靶序列。
[0182]
因此,方法可用于确定靶序列的甲基化状态并提供个体癌症状态的指示。
[0183]
本发明的方法可另外包括定量或检测对照序列。选择在癌症中未显示异常甲基化模式的对照序列。根据本发明的优选方面,选择包含至少两个甲基化敏感性限制酶识别位点的对照序列。优选地,选择包含与目标dna序列相同的甲基化敏感性限制酶识别位点的数目的对照序列。通常,在用甲基化敏感性限制酶消化后,通过聚合酶链式反应扩增来检测这种对照序列的存在与不存在。这种对照序列可用于评估用一种或多种甲基化敏感性限制酶
消化的程度。例如,如果在用甲基化敏感性限制酶消化后,对照序列是可检测的,这将表明消化不完全,并且可以重复这些方法以确保完全消化已经发生。优选地,选择包含与存在于靶序列中的相同的甲基化敏感性限制酶位点的对照序列。
[0184]
本方法可用于评估个体的肿瘤状态。所述方法可用于例如癌症的诊断和/或预后。所述方法还可用于例如在治疗期间监测癌症的进展。所述方法还可用于监测甲基化水平随时间的变化,例如评估个体对癌症的易感性和疾病的进展。所述方法还可用于预测疾病的结果或治疗成功的可能性。
[0185]
引物设计
[0186]
在本发明的另一方面,提供了用于本发明方法的探针和引物。首先,提供了一组引物或可检测标记的探针,其可用于检测或监测选自来自个体的血液、血浆、血清、唾液、尿液的生物样品中的癌症。引物组包含或由使用本领域已知的指南设计的引物组成(davidovic rs等,2014.methylation-specific pcr:four steps in primer design.cent.eur.j.biol.9:1127-1139),其通过引用并入本文。本领域技术人员将认识到可针对表i的dmr多种用于pcr的功能正向和反向的引物产生,其中一些可包括本文所述dmr区域5’或3’的高达300bp的序列。在线资源可用于教导引物设计的方法。这种资源的示例包括mspprimer(http://www.mspprimer.org/cgi-bin/design.cgi)、methmark er(http://methmarker.mpi-inf.mpg.de/)、beacon designer(http://www.premierbiosoft.com/molecular_beacons/)和primo msp(http://www.changbioscience.com/primo/primom.html)。通常,引物选择的步骤将促进甲基化和未甲基化胞嘧啶残基的差异pcr扩增,并且将包括:1)从在线资源下载dmr序列,2)鉴定富含cpg位点的区域,3)在其3’末端具有至少一个cpg位点的引物,4)更多数量的非cpg胞嘧啶是优选的,5)引物长度通常为20-30个核苷酸长度,和6)因为bis处理使dna片段化,反应产物应选择为小于300bp长度。也可以使用资源测试引物设计的计算机分析,例如在uc santa cruz genome browser(https://genome.ucsc.edu/cgi-bin/hgpcr?hgsid=748426759_0fm tab4eddrojretr7blyfe6ympg)上可获得的那些。
[0187]
探针是可检测地标记的。可检测的标记允许通过确定探针和靶序列之间的特异性杂交形成的杂交产物的存在或不存在。可以使用任何标记。合适的标记包括但不限于荧光分子、放射性同位素(例如
125
i、
35
s)、酶、抗体和接头(例如生物素)。
[0188]
用于诱导组织再生(“itr”)的方法也可用于本发明。这种方法的示例被公开于标题为“用于在哺乳动物细胞中诱导组织再生和衰老的改进方法”的国际专利申请pct/us2019/028816,其全文通过引用方式并入本文,标题为“用于在哺乳动物物种中的诱导组织再生的组合物和方法”的国际专利申请公开wo2014/197421,其全文通过引用方式并入本文,以及标题为“用于在哺乳动物物种中检测和调节胚胎-胎儿转变的改进方法”的wo/2017/2142a1,其全文通过引用方式并入本文。用于诱导癌症成熟(“icm”)的方法也可用于本发明。此类方法的示例公开于标题为“用于在哺乳动物物种中检测和调节胚胎-胎儿转变的改进方法”的wo/2017/2142a1中,其全文通过引用方式并入本文。
[0189]
在另一个方面,提供了用于本发明方法的试剂盒。首先,提供了用于检测或监测选自来自个体的血液、血浆、血清、唾液、尿液的生物样品中的癌症的试剂盒。该试剂盒包含设计为检测表i的dmr中甲基化cpg的引物。
[0190]
其次,提供了在检测或监测选自来自个体的血液、血浆、血清、唾液、尿液的生物样品中的癌症期间用作对照的试剂盒。该试剂盒包含设计为检测表i的dmr中的甲基化cpg的引物。
[0191]
本发明的试剂盒可以另外包含一种或多种使得能够实施上述本发明方法的其它试剂或仪器。此类试剂或仪器包括以下一种或多种:合适的缓冲液(水溶液)、pcr试剂、荧光标记物和/或试剂、从个体受试者获得样品的方式(包含针的容器或仪器)或包含可在其上进行反应的孔的支持物。试剂可以干燥状态存在于试剂盒中,使得液体样品重新悬浮该试剂。试剂盒可任选地包含使试剂盒能够用于本发明方法的说明书。
[0192]
以下实施例更详细地描述本发明。
[0193]
实施例
[0194]
实施例1.胚胎-肿瘤表型的标志物用于表征恶性细胞的用途。
[0195]
如本发明本公开的,由于在不同分化细胞中基因表达的不同模式,存在许多细胞类型特异性dna甲基化标志。因此,可用于检测或诊断细胞的胚胎相对于胎儿或胚胎相对于成体表型的真实dmr的验证需要比较胚胎(而不是分化细胞)与eft后细胞,例如相同分化类型的成体分化细胞。而且为了确定那些dmr性质上是eft前还是eft后,还需要观察来自相应分化细胞类型的恶性细胞的dmr。在本实施例中,我们比较了胚胎、成体和恶性骨软骨间质;或胚胎、成体和恶性骨骼肌成肌细胞,或胚胎、成体和恶性前脂肪细胞和胚胎、成体和恶性骨骼肌成肌细胞。
[0196]
作为本发明的非限制性实例,具有hg38的+链中的chr10:89837217-89837885位置的dmr_327具有以下序列,其具有cpg位点(用大写字母表示并加下划线)和甲基化特异性限制性核酸内切酶位点的示例,其在这种情况下为核苷酸位置53和86处的限制性核酸内切酶smai(包围在以下方框中):
[0197][0198]
另外的甲基化特异性限制性位点是上述dmr的核苷酸位置29、167和237处的cfr10i和核苷酸位置269、349、522、539、580、617处的taui的那些。因此,相比于具有胚胎表观遗传谱的细胞或已经恢复为胚胎-肿瘤表观遗传谱的癌细胞,所述甲基化特异性限制性位点的引物5’和3’的选择在成体细胞中
将产生更大百分比的全长反应产物。作为非限制性实例,正向引物5
’‑
aggcggagaccggcaagag-3’和反向引物5
’‑
agaactaagggaggactcaggc-3’的选择在正常成体细胞中将产生212bp反应产物,并且在用smai核酸内切酶预处理的胚胎或癌细胞来源的dna的情况下没有产生反应产物。
[0199]
如图1所示,与它们的成体对应物相比,dmr内53个可能的cpg位点中的全部53个在胚胎祖细胞中超甲基化。如图2中所示,甲基化标志还显示了两种hes细胞系(h9和ma03)以及由命名为en13的克隆epc系产生的命名为eh3的ips细胞系中的胚胎性谱(vaziri等2010,spontaneous reversal of the developmental aging of normal human cells following transcriptional reprogramming regen med5(3):345-363)。然而,尽管ipsc细胞系表现出多能性基因表达谱,但由成年人类皮肤纤维母细胞产生的ips细胞仍保留了成体甲基化模式。
[0200]
如图3的igv图像所示,通过hes细胞来源的克隆胚胎祖细胞系的bis-seq获得的cpg甲基化结果在dmr_327中显著高于作为骨髓间充质干细胞的正常成体对应物的相应甲基化(分别为4d20.8和msc)。来源于成骨间充质的相应癌细胞系(骨肉瘤细胞系u-2、sjsa-1、khos-240s和khos/np)显示出与胚胎细胞的显著相关性,如与它们的成体对应物相反的。还显示了通过对应于骨骼肌成肌细胞的hes细胞来源的克隆胚胎祖细胞系和作为成人骨骼肌成肌细胞的成体来源的正常对应物(分别为sk5和成体骨骼肌成肌细胞),随后来源于肌肉间充质(横纹肌肉瘤(rms)细胞系ccl-136、a-204、sjcrh30和te617.t和te 617.t)的相应的成体来源的癌细胞系的bis获得的相当的cpg甲基化结果。还显示了通过对应于白色脂肪细胞祖细胞(e3)的hes细胞来源的克隆胚胎祖细胞系和作为成体前脂肪细胞和脂肪生成癌细胞系(94t778和93t449)的成体来源的正常对应物的bis获得的cpg甲基化结果。在本实施例中,与正常对应物相比,dmr_327中的胚胎甲基化模式以100%准确度预测10种不同癌细胞系的恶性状态。
[0201]
如图4所示,与dmr_327一致的称为linc00865的转录物在hes细胞和来源于不同克隆胚胎祖细胞系的ips细胞(图4中标志物为es&ipsc)中以低至不可检测的水平表达,但在大多数胎儿和成体来源的不同体细胞类型中表达。如图5所示,即使成人皮肤来源的ips细胞大量表达hes细胞的其他标志物,例如oct4、nanog、lin28a(图6中所示)、sox2以及其他hes细胞标志物,但是转录物已经表达于培养的晚期胚胎阶段皮肤成纤维细胞(妊娠8周)中,并且未恢复至成人皮肤来源的ips细胞中hes细胞的低至不可检测水平的表达。图6中还显示了pcdhga12表达的不完全重编程,先前公开为胎儿/成体发作标志物(“用于检测和调节哺乳动物物种中的胚胎-胎儿转变的改进方法”(国际专利申请公开号wo2017/214342,通过引用方式全文并入本文))。这证明了本文所述的dmr作为比胎儿或成体来源的体细胞的完全表观遗传重编程的多能性的传统标志物更敏感的标志物的效用。
[0202]
由于dmr_327的超甲基化也预测了处于eft前状态且不表达linc00865的正常和癌细胞系,本实施例证实了本发明的dmr在确定所述细胞的成熟状态中的有用性。如图7所示,组蛋白h3(h3k4me1和h3k4me2)、h2az和h3k9ac的翻译后修饰的抗体通过本发明的dmr的差异脱甲基化沉淀染色质,因此可用于富集本发明的eft后dmr,或者当试图检测eft前dmr时,去除eft后dmr。如图7所示,h3k9me2和h3k9me3的抗体沉淀本发明的eft前dmr,因此可用于富集本发明的eft前dmr。
[0203]
如图8所示,本发明的dmr适用于所有癌症类型(泛癌的)。如示的,作为非限制性实例,dmr_327在癌瘤中明显超甲基化,如结肠癌中与正常结肠相比、在前列腺癌中与正常前列腺相比和在脑癌(例如多种胶质母细胞瘤)中与正常大脑相比,以及肉瘤细胞与正常对应物相比,所述对应物包括作为非限制性实施例的脂肪肉瘤、骨肉瘤和横纹肌肉瘤。
[0204]
如本文所述,本领域技术人员知道在dmr的bp5’或3’内可以发现其他尽管不太常见的甲基化cpg标志。在本实施例中,在dmr_327的500bp扩展范围内,总计94个或另外41个cpg位点,其中许多在胚胎细胞相对于成体细胞中显示增加的甲基化,并且在相应癌症类型中也超甲基化。
[0205]
实施例2.去成熟(dc)细胞中的癌症成熟诱导(icm)。
[0206]
在本实施例中,我们在显示胎前期状态的本发明dmr标志物的癌细胞系中诱导癌症成熟,例如与在大多数胎前期的分化细胞类型中不表达的基因cox7a1共定位的dmr_038的超甲基化,在胎儿和成体发育期间的表达逐渐增加,并且在显示胎前期(dc)表型的癌细胞中被抑制。作为诱导癌症成熟的实施例,我们在dc纤维肉瘤细胞系ht1080中以成体水平表达cox7a1基因。然后我们分析了具有通过慢病毒感染引入的cox7a1(ht1080+cox7a1)和不具有cox7a1(ht1080-cox7a1)的ht1080细胞的转换率和生长动力学。然后在雌性无胸腺裸鼠中测量具有和不具有icm的细胞系的生长动力学。10只小鼠每天以5
×
106细胞皮下注射天然ht1080细胞或外源表达cox7a1的ht1080细胞(icm处理的)。对所有动物进行完整尸检,其中包括尸体和肌肉骨骼系统的检查;大脑的所有外表面和孔、颅腔和外表面;以及胸腔、腹腔和盆腔及其相关器官和组织。当右侧腹区域存在肿块时,小心地将其取出,并检查皮下和周围组织的原发肿块的任何转移迹象。研究病理学家进行了所有尸检,并评价了所有组织是否存在原发性和转移性肿瘤。大体发现限于右侧腹的肿块。如图9所示,dc细胞的icm处理显著减缓了所得肿瘤的生长。
[0207]
实施例3.当用itr试剂处理时,具有eft后基因表达谱的细胞对衰老的敏感性增强。
[0208]
本发明描述了eft的dmr标志物在确定细胞对于在损伤dna以其它方式诱导的细胞凋亡的化疗剂或放疗剂的存在下发生细胞凋亡或的敏感性中的用途。由于具有dna损伤的细胞的选择性去除包括通常被称为“衰老”细胞的细胞,例如具有端粒dna的明显损失的那些细胞,我们选择将损伤细胞中细胞凋亡的有意诱导命名为“衰老”作为通过本文所述的化疗和放疗在癌细胞中诱导细胞凋亡以及具有来自内在来源的明显dna损伤(例如具有端粒损耗)的细胞中诱导细胞凋亡的包含性术语。
[0209]
用表达cox7a1的慢病毒和表达绿色荧光蛋白(gfp)的对照系一起感染eft前(dc)纤维肉瘤细胞系ht1080。用0、0.37和37μm喜树碱处理所得细胞以产生dna损伤反应和细胞凋亡。tunel(tdt-介导的dutp-x切口末端标记)将标记添加到ssdna和dsdna的末端。使用的读数是通过显微镜读取的荧光核。简言之,在96孔板中以5000细胞/孔培养细胞系并生长过夜。第二天,去除生长培养基并用含有化合物和对照的生长培养基替换。24小时后,使用4%pfa固定细胞20分钟。在4℃下将板储存于pbs中直至处理。用0.1%tritonx-100和0.1%柠檬酸钠在冰上透化固定的细胞2分钟。洗涤细胞3次并根据制造商的方案在tunel反应缓冲液中在37℃下孵育60分钟。用pbs洗涤样品3次并储存于100μl pbs中以成像。在rt下用hoechst染料对细胞进行染色10分钟并用pbs洗涤1次。使用5x物镜对各孔成像。每孔收集9
个图像并分析总细胞数和细胞凋亡染色的细胞数。
[0210]
如图11所示,ht1080纤维肉瘤细胞系中cox7a1的表达与对细胞凋亡的敏感性的显著降低有关(p《0.05)。类似地,与成体主动脉内皮对应物(25.5%细胞凋亡)相比,正常eft前血管祖细胞在37μm的喜树碱下对细胞凋亡更敏感(39%细胞凋亡)。此外,在cox7a1表达敲低之前和之后,在eft后细胞(成体骨髓msc)中测量h2o
2-介导的细胞凋亡。虽然82.4%的正常msc在300μm h2o2中存活,但是作为itr形式的cox7a1的敲低导致59.8%的msc存活(p《0.05),即itr导致对衰老的敏感性增加。最后,来源于eft前的克隆胚胎血管内皮系30-mv2-6的pcdhb2阳性外来体特别地在衰老成纤维细胞中诱导衰老。这些实施例中的每一个都证实了eft后细胞对化疗或放疗诱导的衰老的相对抗性、itr和icm因子对衰老的抗性的修饰以及在确定细胞成熟状态中的本发明的dmr的值,特别是它们是否显示eft前或后状态。
[0211]
实施例4.与相对未分化的“癌症干细胞”相反,成熟的eft后(ac)表型与化疗和放疗中存活的细胞相关。
[0212]
目前广泛接受的癌症干细胞(cscs)的模型假设csc为像造血干细胞一样相对很少分裂的相对未分化的细胞,因此在许多化疗或放疗方案中存活并且在治疗后再定殖于身体。相反,本发明教导了这些存活的csc反而是显示eft后基因表达谱(即更成熟的模式)的癌细胞。使用基因cox7a1的表达作为eft前或eft后细胞的转录标志物,其中cox7a1在eft后细胞中表达,我们观察到具有导致胰腺csc的消融kras的胰腺癌导致增加的cox7a1和cat(也是eft后标志物),而不是通过当前模型所预测的降低(图10)。此外,用抗肿瘤蒽环类抗生素阿霉素治疗来源于乳腺癌细胞系mcf-7的异种移植乳腺肿瘤相比于对照组中3.84和4.52的对照,导致了5.04和5.57的cox7a1的rfu水平,再次表明化疗后存活细胞的更成熟状态。此外,在直肠癌的实施例中,相比于未治疗的结肠癌中的75rfu,放疗后的cox7a1表达水平为92.7rfu(p《0.05)。使用eft前标志物cpt1b,其中cpt1b表达于eft前细胞和癌细胞(对应于dmr_087)中,铂抗性卵巢癌细胞表达平均384.9rfu的cpt1b,而顺铂敏感性卵巢癌表达719.5rfu的平均表达(p《0.05),与对应于较高cpt1b表达、dmr_087的较高甲基化和eft前(dc)表型的化疗敏感性一致。最后,长春新碱敏感性卵巢癌细胞系表达平均75.2rfu的cpt1b,而长春新碱抗性卵巢癌细胞表达43.9rfu的平均表达(p《0.05),与对应于较高cpt1b表达、dmr_087的较高甲基化和eft前(dc)表型的化疗敏感性一致。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1