增强植物中基因表达的调节性核酸分子的制作方法
增强植物中基因表达的调节性核酸分子
1.发明描述
2.本发明属于植物分子生物学领域并且提供了用于产生高表达性启动子和产生核酸表达增强的植物的方法,其中增强核酸表达的核酸(neenas)与所述启动子功能性连接和/或引入植物中。
3.转基因在植物中的表达强烈地受多种外部及内部因素影响,从而导致转基因表达的可变和不可预测的水平。经常必须产生并分析大量转化体,以鉴定出表达强度合乎需要的株系。由于转化并筛选表达强度合乎需要的株系是昂贵和耗费人力的,故需要植物中高表达一个或多个转基因。当必须在转基因植物中协调表达几个基因以实现特定效应时,鉴于必须鉴定其中每个基因均强烈表达的植物,这个问题尤其严重。
4.例如,取决于构建体设计和在各个转化事件中t-dna插入基因座的位置效应,转基因的表达可以显著地变化。强启动子可以部分地克服这些难题。然而,显示强烈表达同时特异性合乎需要的合适启动子的可获得性经常有限。为了确保可获得具有合乎需要的表达特异性的充足启动子,额外启动子的鉴定和表征可以有助于弥合这种缺口。然而,具有相应特异性和强度的启动子的天然可获得性和费时的候选启动子的表征妨碍鉴定合适的新启动子。
5.为了克服这些难题,已经证明多样性遗传元件和/或基序积极地影响基因表达。在它们当中,已经认可一些内含子作为具有改善基因表达的强大潜能的遗传元件。虽然机制大多未知,但已经显示一些内含子积极地影响成熟mrna的稳态量,这可能通过增强转录活性、改善mrna成熟、增强胞核mrna输出和/或改善翻译起始来影响(例如huang和gorman,1990,nucleic acid research 18;le hir等人,2003,trend biochem sci 28;nott等人,2004,genes dev.18)。
6.此外,已经鉴定到并不必然与内含子有关的通用增强子。增强子是重要的顺式调节dna元件,通过募集转录因子并以细胞类型/组织特异性方式将它们引导至靶基因的启动子来调节转录程序。基因的表达可以由一个或多个增强子调节(marand等人2017;biochimica and biophysica acta 1860(131-139)。增强子难以鉴定,因为它们的位置相对于其同源启动子不可预测。它们可位于某个表达的核酸的转录起始位点的上游或下游,并且可在距相应启动子5000个或更多个核苷酸的位置发挥功能。值得注意的是,在植物物种中仅鉴定到少数的增强子,这主要是由于缺乏鉴定增强子的通用方法。
7.此外,基因组编辑技术的发展理论上还允许通过在内基因(endogenes)的启动子、非翻译区或内含子中插入增强子来增加内基因的表达水平。然而,这种方法受到迄今为止鉴定到的增强子的数量有限的妨碍。
8.本技术中将增强功能性连接的核酸表达的核酸分子描述为“增强核酸表达的核酸”(neena)。
9.发明详述
10.本发明的第一实施方案包括用于产生表达强度增强的启动子的方法,所述启动子包含一种或多种与启动子功能性连接的增强核酸表达的核酸(neena)分子,所述方法包括
11.i)具有如seq id no:16至22中任一项所限定的序列的核酸分子,或
12.ii)具有以下序列的核酸分子,所述序列与如seq id no:16至22中所限定的任一序列具有80%或更大的同一性;相对于如seq id no:16至22中所限定的任一序列,同一性优选地是85%或更大,同一性更优选地是90%或更大,同一性甚至更优选地是95%或更大、96%或更大、97%或更大、98%或更大或99%或更大,在最优选的实施方案中,同一性是100%,或
13.iii)30个或更多个核苷酸、40个或更多个核苷酸、50个或更多个核苷酸或100个或更多个核苷酸的核酸分子,所述核酸分子与包含seq id no:16至22中任何一项的转录增强性核苷酸序列的至少30个、优选地至少40个、更优选地至少50个、甚至更优选地至少100个、最优选地至少150个连续核苷酸的核酸分子或其互补物在等同于7%十二烷基硫酸钠(sds)、0.5m napo4、1mm edta中50℃时杂交连同2xssc,0.1%sds中50℃或65℃、优选地65℃时洗涤的条件下杂交。优选地,所述核酸分子与包含seq id no:16至22中任何一项的转录增强性核苷酸序列的至少30个、优选地至少40个、更优选地至少50个、甚至更优选地至少100个、最优选地至少150个连续核苷酸的核酸分子或其互补物在等同于7%十二烷基硫酸钠(sds)、0.5m napo4、1mm edta中50℃时杂交连同1xssc,0.1%sds中50℃或65℃、优选地65℃时洗涤的条件下杂交,更优选地,所述核酸分子与包含seq id no:16至22中任何一项的转录增强性核苷酸序列的至少30个、优选地至少40个、更优选地至少50个、甚至更优选地至少100个、最优选地至少150个连续核苷酸的核酸分子或其互补物在等同于7%十二烷基硫酸钠(sds)、0.5mnapo4、1mm edta中50℃时杂交连同0.1xssc,0.1%sds中50℃或65℃、优选地65℃时洗涤的条件下杂交。
14.iv)i)至iii)的核酸分子的30个或更多个连续碱基、优选地40个或更多个连续碱基、更优选地50个或更多连续碱基、甚至更优选100个或更多个连续碱基的片段,所述片段具有例如65%或更大、优选地70%或更大、更优选地75%或更大、甚至更优选地80%或更大、85%或更大或90%或更大的增强表达活性,在最优选的实施方案中,它具有95%或更大如具有如seq id no:16至22中所限定的任一序列的序列的相应核酸分子那样的增强表达活性,或
15.v)作为前述在i)至iv)下提到的核酸分子中任何项的互补物或反向互补物的核酸分子。
16.在一个实施方案中,一种或多种neena相对于功能性连接至neena的启动子为异源。
17.在又一个实施方案中,例如在wt植物的基因组中,将本发明的neena在与本发明的neena非天然相邻的序列相邻的5'端和/或3'端位置处引入启动子。
18.在本发明的另一个实施方案中,将本发明的neena的2个或更少个拷贝引入启动子。
19.原则上,neena可以与任何的启动子例如组织特异性、诱导型、发育特异性或组成型启动子功能性连接。相应的neena将引起在与至少一种neena功能性连接的相应启动子的控制下的异源核酸的增强表达。
20.一种或多种neena可以与任何的启动子功能性连接,并且将增强在所述启动子控制下的核酸分子表达。待用于本发明任何方法的组成型启动子可以源自植物例如单子叶或
双子叶植物、源自细菌和/或病毒或者可以是合成性启动子。待使用的组成型启动子例如是木薯脉花叶病毒启动子(verdaguer b等人(1996).pmb 31(6),1129-39)、地下车轴草矮缩病毒启动子(boevink p,等人(1995).virology 207(2),354-61)、与组蛋白3a内含子组合的拟南芥(a.thaliana)组蛋白4a启动子(chaboute等人(1984).pmb8(2),179-91)、欧洲油菜(b.napus)p450依赖性脂肪酸ω-羟化酶启动子(wo2016113333)、来自稻的pact10s启动子(mcelroy等人(1990).plant cell 2(2),163-71)、来自欧芹(p.crispum)的pcubi-启动子(wo2003102198)、来自玉蜀黍(zea mays)的zmubi-启动子(christensen等人(1992).plant mol biol.18(4),675-89)、来自编码腈水解酶1的拟南芥基因at3g44310的atnit-启动子、来自玄参花叶病毒(figwort mosaic virus)的34s-启动子(sanger等人,1990,pmb 14(3))、来自花椰菜花叶病毒(cauliflower mosaic virus)的35s-启动子(odell等人(1985).nature 313(6005),810-2)、源自根癌农杆菌(agrobacterium tumefaciens)的nos启动子(depicker等人(1982).j mol appl genet.1(6),561-73)和ocs-启动子、scbv-启动子(us 5 994 123)、超级-启动子(lee等人2007,plant.phys.145)、来自编码铁氧还蛋白nadh还原酶的拟南芥基因at5g66190的atfnr-启动子、来自豌豆(pisum sativum)的ptxa启动子(wo2005085450)、来自编码磷酸三糖易位蛋白的拟南芥基因at5g46110的attpt-启动子、来自拟南芥基因at4g14880和at4g14890的双向atoastl-启动子、来自编码3-磷酸甘油醛脱氢酶的拟南芥基因at1g13440的pro0194启动子、来自编码二磷酸果糖醛缩酶的拟南芥基因at3g52930的pro0162启动子、ahas-启动子(wo2008124495)、来自稻的咖啡酰辅酶a-mt启动子和oscp12(wo2006084868)或来自稻的pgos2启动子(de pater等人(1992).plant j.2(6),837-44)。
21.待用于本发明任何方法的组织或发育特异性或诱导型启动子可以来自植物例如单子叶或双子叶植物,源自细菌和/或病毒或者可以是合成性启动子。待使用的组织或发育特异性或诱导型启动子例如是种子特异性和/或种子优先启动子,例如来自普通小麦(t.aestivum)的高分子量麦谷蛋白bx17启动子(reddy p和appels r(1993)theor appl genet.85(5),616-24)、来自普通小麦的高分子量麦谷蛋白1dx5启动子(lamacchia等人(2001)j exp bot.52(355),243-50)、来自普通小麦的质体agpase启动子(thorneycroft等人(2003)plant biotechnol j.1(4),259-70)、来自大麦(hordeum vulgare)的大麦醇溶蛋白b1启动子(brandt等人(1985)carlsberg research communications 50,333)、来自蚕豆(vicia faba)的sbp-启动子(wo2000026388)、来自蚕豆的未知种子蛋白质启动子(usp)(wo2003092362)、来自欧洲油菜(brassica napus)的油菜籽蛋白启动子(ep0255378),来自亚麻(linum usitatissmum)的conlinin-启动子(wo2001016340)、来自编码过氧化物氧还蛋白样蛋白的拟南芥基因at5g01670的启动子(wo2006089950)、来自亚麻的过氧化物氧还蛋白样蛋白的启动子(wo2006089950)、来自欧洲油菜的球蛋白样蛋白启动子(roh等人,2014,journal of the korean society for applied biological chemistry 57(5))、来自菜豆(phaseolus vulgaris)的arcelin5-1启动子(wo2012077020)、来自玉蜀黍的玉米醇溶蛋白启动子(shepherd和scott biotechnol appl biochem.2009,52(3))、来自玉蜀黍的球蛋白启动子(mei等人,2004,maydica 49(4))、来自玉蜀黍的pkg86启动子(wo 2010122110)、来自马铃薯(solanum tuberosum)的叶特异性st-ls1启动子(stockhaus等人(1989)embo j.8(9),2445-51)、来自稻(oryza sativa)的叶特异性硫氧还蛋白启动子
(fukuda等人(2005)plant cell physiol.46(11),1779-86)、来自陆地棉(g.hirsutum)的根特异性或根优先启动子pbtg-26d(wo2017/025282)、来自玉蜀黍的pgl4和5(ep1862473)或来自玉蜀黍的pzrp2(held等人(1997)pmg 35(3),367
–
375)、来自拟南芥的诱导型启动子phpr1(wang等人(2009)molecular plant 2(1),191
–
200)、来自拟南芥的rd29a启动子(yamaguchi-shinozaki k和shinozaki k(1994)plant cell 6(2),251-64)、来自玉蜀黍的蛋白酶抑制启动子(cordero等人(1994)plant j.6(2),141-50)、或如wo2012093032、us2013081154、wo2004065571、wo2008083969或wo2012136788中所述的来自陆地棉的纤维特异性或优先启动子。
22.与neena功能性连接的本发明的高表达启动子可以用于任何植物中,所述植物包括例如苔藓、蕨类植物、裸子植物或被子植物,例如单子叶或双子叶植物。在一个优选的实施方案中,与neena功能性连接的本发明所述启动子可以用于单子叶或双子叶植物中,优选地是作物植物如玉米、大豆、卡诺拉油菜(canola)、棉、马铃薯、甜菜、稻、小麦、高粱、大麦、芭蕉属植物、甘蔗、芒属植物等。在本发明的一个优选的实施方案中,与neena功能性连接的所述启动子可以用于单子叶作物植物如玉米、稻、小麦、高粱、芭蕉属植物、芒属植物、甘蔗或大麦中。在一个特别优选的实施方案中,与neena功能性连接的启动子可以用于小麦中。
23.如本技术中所用的高表达性启动子意指例如与neena功能性连接的启动子,所述neena在植物或其部分中引起该启动子增强的表达,其中源自与neena功能性连接的相应启动子控制下的核酸分子的rna积累或rna合成速率比由缺少本发明neena的相同启动子引起的表达高,优选地显著更高。优选地,与相同条件下培育的包含不与本发明neena功能性连接的相同启动子的同龄对照植物相比,植物中相应核酸的rna的量和/或rna合成速率和/或rna稳定性增加50%或更大,例如100%或更大、优选地200%或更大、更优选地5倍或更大、甚至更优选地10倍或更大、最优选地20倍或更大,例如50倍。
24.在本文中使用时,显著更高指技术人员知晓如何确定的统计显著性,例如通过对相应的数据集合应用统计检验如t-检验。
25.用于检测由启动子赋予的表达的方法是本领域已知的。例如,该启动子可以与标记基因如gus、gfp或萤光素酶基因功能性连接,并且可以在植物或其部分中确定由相应标记基因编码的相应蛋白质的活性。作为代表性实例,下文详细描述用于检测萤光素酶的方法。其他方法例如是通过本领域已知的方法,例如rna印迹分析法、qpcr、连缀(run-on)测定法或本领域描述的其他方法测量受该启动子控制的核酸分子的rna稳态水平或合成速率。
26.技术人员知晓多种用于功能性连接两个或更多个核酸分子的方法。此类方法可以包括限制性切割/连接法、不依赖连接酶的克隆法、重组工程法、重组或合成法。其他方法可以用来功能性连接两个或更多个核酸分子。
27.本发明的又一个实施方案是用于生产植物或其部分的方法,所述植物或其部分与相应的对照植物或其部分相比具有一种或多种核酸分子的增强表达,所述方法包括步骤:将包含如上文在i)至v)下所限定核酸分子的一种或多种neena引入所述植物或其部分,并且将所述一种或多种neena与启动子和处在所述启动子控制下的核酸分子功能性连接,其中neena对所述核酸分子为异源。
28.neena可以相对于处在与neena功能性连接的所述启动子控制下的核酸分子为异源,或它可以相对于该启动子和处在该启动子控制下的核酸分子均为异源。
29.就核酸分子或dna而言,术语“异源的”指这样的核酸分子,所述核酸分子有效连接于或受到操作以变成有效连接于自然界中不与该核酸分子有效连接或自然界中与该核酸分子在不同位置有效连接的第二种核酸分子。例如,本发明的neena在其天然环境中与其天然启动子功能性连接,而在本发明中,它与可以源自相同生物、不同生物或可以作为合成性启动子如超级-启动子的另一个启动子连接。它也可以意指本发明的neena与其天然启动子连接,但是处于所述启动子控制下的核酸分子相对于包含其天然neena的启动子为异源。此外,应当理解,启动子和/或处在与本发明neena功能性连接的所述启动子控制下的核酸分子相对于所述neena为异源,原因是它们的序列已经受到例如突变如插入、缺失等操作,从而启动子的天然序列和/或处在所述启动子控制下的核酸分子的天然序列被修饰并且因此已经变得相对于本发明的neena为异源。也可以理解,当neena与其天然启动子功能性连接,其中neena的位置相对于所述启动子改变,从而该启动子在这种操作后显示更高表达时,该neena相对于与neena功能性连接的核酸为异源。
30.如本文中所意指的显示核酸分子表达增强的植物意指一种植物,其与在相同条件下培育的没有与相应核酸分子功能性连接的相应neena的对照植物相比,具有更高的、优选地统计学上显著更高的核酸分子表达。这种对照植物可以是野生型植物或是包含控制与本发明植物中相同的基因的相同启动子的转基因植物,其中所述启动子不与本发明的neena连接。
31.产生如本文所用的植物包括用于稳定转化的方法,例如通过农杆菌介导的转化、原生质体转化、粒子轰击等将重组dna构建体引入植物或其部分并且任选地随后再生出转基因植物。
32.它还包括瞬时转化植物或其部分的方法,例如病毒感染法或农杆菌浸润法。技术人员知晓用于稳定和/或瞬时转化植物或其部分的其他方法。
33.诸如育种方法、使用供体dna的原生质体融合或重组技术等方法也可用于产生本发明的植物并且在此涵盖。例如,可以使用本领域已知的重组技术如talen(wo12138939、wo12138927);锌指蛋白(wo02057293、wo05084190)、归巢核酸内切酶(wo11104382、wo14199358)或核酸引导的核酸酶如ago、cas9或cas12(wo13141680、wo13176772、wo14093595、wo15157534或wo16205711)将单链断裂(缺口)或双链断裂引入植物基因组中。连同这类单链或双链断裂诱导剂的引入,可以将一种或多种供体dna(wo13176772、wo14089290)引入植物或其部分中,所述供体dna包含neena分子,其侧翼为包含与缺口或双链断裂邻近的区域基本上相同或基本上互补的序列的核酸分子,从而促进同源重组并将neena分子引入植物或其部分的基因组中。
34.此外,本可以通过以下方式将本发明neena的序列引入基因组并且与相应的异源启动子功能性连接:使用技术如脱氨酶等(wo0058480、wo18027078)向基因组引入一系列点突变,所述技术可以通过将致突变性多肽部分(如脱氨酶或糖苷酶)与dna结合多肽(例如talen、锌指蛋白、归巢核酸内切酶或rna引导的核酸酶,切割酶或失活的核酸酶如cas9或cas12)融合,指向植物或其部分的基因组中特定区域,如wo15089406、us2017321210、wo15133554或wo17070632中所述。通过应用这些方法,在不引入异源分子的情况下,向基因组引入neena序列,不过neena序列代替基因组中的另一个序列。这类技术由术语向基因组中“整合”或“引入”neena序列或“整合”或“引入”neena分子并且将这类序列和/或分子与异
源启动子功能性连接所涵盖。
35.本发明的方法可以应用于任何植物,例如裸子植物或被子植物,优选地是被子植物,例如双子叶或单子叶植物,优选地是单子叶植物。优选的单子叶植物例如是玉米、小麦、稻、大麦、高粱、色蕉属植物、甘蔗、芒属植物和短柄草属植物(brachypodium),特别优选的单子叶植物是玉米、小麦和稻,最优选的是小麦。优选的双子叶植物例如是大豆、油菜籽、卡诺拉油菜、亚麻、棉、马铃薯、甜菜、万寿菊和拟南芥属植物(arabidopsis),特别优选的双子叶植物是大豆、油菜、卡诺拉油菜和马铃薯。
36.在本发明方法的一个实施方案中,通过应用基因组编辑技术将一种或多种neena分子或neena序列整合到植物或其部分的基因组中。
37.在本发明方法的又一个实施方案中,基因组编辑技术包括使用核酸引导的核酸酶例如ago、cas9或cas12核酸酶、talen、归巢核酸内切酶或锌指蛋白在neena分子待整合到基因组的位置处引入单链断裂或双链断裂,并进一步引入包含neena分子的dna修复模板,并且在所述dna修复模板的3'和5'端包含与单链断裂或双链断裂上游和/或下游基本上相同或基本上互补的序列,促进在单链或双链断裂位置处的重组。优选地,基本上相同或基本上互补的序列各自分别为至少1000个、至少500个碱基、至少450个碱基、至少400个碱基、至少350个碱基、至少300个碱基、至少250个碱基、至少200个碱基、至少150个碱基、至少100个碱基或至少50个碱基长。优选地,序列的同一性或互补性为与它们重组的相应基因组区域至少50%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少98%或至少99%相同或互补。
38.在本发明方法的又一个实施方案中,基因组编辑技术包括在植物或其部分的基因组中引入点突变,从而在植物基因组中引入neena序列。这可以例如通过引入与胞苷脱氨酶(wo17070633)或腺嘌呤脱氨酶(wo18027078)功能性结合的dna结合蛋白,例如锌指蛋白、tale蛋白或核酸引导的核酸酶如cas9、cas12(cpfi)或ago来实现。
39.在本发明的一个实施方案中,如上文定义的方法包括以下步骤:
40.a)将包含如上文的i)至v)中所限定核酸分子的一种或多种neena引入植物或其部分和
41.b)将所述一种或多种neena整合到所述植物或其部分的基因组中,从而所述一种或多种neena与相对所述一种或多种neena为异源的内源表达的核酸功能性连接和任选地
42.c)从所述转化的细胞再生出包含所述一种或多种neena的植物或其部分。
43.neena可以相对于处在与neena功能性连接的所述启动子的控制下的核酸分子为异源,或它可以相对于该启动子和处在该启动子控制下的核酸分子均为异源。
44.可以将一种或多种neena分子借助粒子轰击法、原生质体电穿孔法、病毒感染法、农杆菌介导的转化法、crispr/cas或本领域已知的任何其他方法引入植物或其部分。在crispr/cas方法中,可以将neena分子引入整合到例如质粒或病毒dna或病毒rna或供体dna中。neena分子也可以在引入植物或植物部分中之前包含于bac、yac或人工染色体上。也可以将neena分子作为包含neena序列的线性核酸分子引入,其中额外的序列可以邻近该核酸分子上的neena序列存在。这些与neena序列相邻的序列可以长约20bp,例如20bp至数百碱基对,例如100bp或更多,并且例如通过同源重组可以促进整合到基因组中。可以使用用于基因组整合的任何其他方法,无论是靶向整合方法,例如同源重组还是随机整合方法,例如
非常规重组(illegitimate recombination)。
45.可以与neena分子功能性连接的内源表达的核酸可以是任何核酸,优选地任何表达的核酸分子。该核酸分子可以是编码蛋白质的核酸分子或非编码分子如反义rna、rrna、trna、mirna、ta-sirna、sirna、dsrna、snrna、snorna或本领域已知的任何其他非编码rna。
46.实施本发明的方法的又一种方式可以是
47.a)提供包含一种或多种neena的表达构建体,所述neena包含如上文i)至v)中所限定的与如上文所限定的启动子和与一个或多个核酸分子功能性连接的核酸分子,所述后一核酸分子相对于所述一种或多种neena为异源并且处在所述启动子的控制下和
48.b)将包含所述一种或多种neena的所述表达构建体整合到所述植物或其部分的基因组中和任选地
49.c)从所述转化的植物或其部分再生出包含所述一个或多个表达构建体的植物或其部分。
50.neena可以相对于处在与neena功能性连接的所述启动子的控制下的核酸分子为异源,或它可以相对于该启动子和处在该启动子控制下的核酸分子均为异源。
51.表达构建体可以借助本领域已知的任何方法整合到相应植物的基因组中。使用如粒子轰击法或农杆菌介导的转化法或crispr/cas应用等方法时,整合可以是随机的。在一个优选的实施方案中,整合借助靶向整合,例如通过同源重组进行。后一种方法将允许包含与neena功能性连接的高表达启动子的表达构建体整合到有利的基因组区域中。有利的基因组区域例如是已知包含例如在种子中高度表达的基因的基因组区域,因而与显示无转录活性的基因组区域相比,可以增加源自所述表达构建体的表达。
52.在另一个优选的实施方案中,所述一种或多种neena与靠近所述异源核酸分子的转录起始位点的启动子功能性连接。
53.如本文中所意指的靠近转录起始位点包含将一种或多种neena与距离所述异源核酸分子的转录起始位点5000bp或更少、4000bp或更少、3000或更少、2500bp或更少、优选地2000bp或更少、更优选地1500bp或更少、甚至更优选地1000bp或更少并且最优选地500bp或更少的启动子功能性连接。应当理解,该neena可以距相应启动子的转录起始位点以相应距离在上游或下游整合。因此,一种或多种neena在与一种或多种neena功能性连接的优选的组成型启动子的控制下,可以包含在相应异源核酸的初级转录物中,或者它可以整合到启动子分子中。如果neena整合到相应启动子的转录起始位点下游,则整合位点优选在启动子控制下的异源核酸的5'utr、3'utr或内含子中,最优选地,整合位点整合到相应异源核酸的第1内含子中。
54.优选地,一种或多种neena整合到启动子、5'utr或第1内含子中或neena替换启动子、5'utr或第1内含子中的一部分。
55.在本发明的另一个方面,其中所述一种或多种neena与7a海藻糖-6-磷酸磷酸酶(t6pp)基因(wo/2018/113702,seq id no.23)连接,neena可以在翻译起始密码子上游约200bp处、约397bp处、约676bp处或1000bp处插入。所述一种或多种neena可以在翻译起始密码子上游介于150和250bp之间、350和450bp之间、620和720bp之间或950和1000bp之间的位置插入7a海藻糖-6-磷酸磷酸酶(t6pp)基因中。
56.本发明的又一个实施方案包括含有一种或多种neena的重组表达构建体,所述
neena包含如上文i)至v)中所限定的核酸分子。
57.重组表达构建体可以还包含与一种或多种neena功能性连接的一个或多个启动子和任选地一个或多个表达的核酸分子,所述核酸分子相对于所述一种或多种neena为异源。
58.neena可以相对于处在与neena功能性连接的所述启动子的控制下的核酸分子为异源,或它可以相对于该启动子和处在该启动子控制下的核酸分子均为异源。
59.该表达构建体可以包含与neena功能性连接的启动子和相对于相应的neena为异源的待表达核酸分子的一个或多个,例如两个或更多个,例如5个或更多个,如10个或更多个组合。该表达构建体也可以包含其他启动子,所述其他启动子不包含与相对于相应的启动子为同源或异源的待表达核酸分子功能性连接的neena。
60.包含如上文定义的一个或多个重组表达构建体的重组表达载体是本发明的另一个实施方案。可以在本发明中使用的多种表达载体是技术人员已知的。用于将包含这种表达构建体的此种载体引入植物基因组中的方法和用于从转化的细胞恢复转基因植物的方法也是本领域熟知的,其中所述表达构建体包含例如与neena功能性连接的启动子和任选地其他元件如终止子。取决于用于转化植物或其部分的方法,完整载体可以整合到所述植物或其部分的基因组中,或者载体的某些组分可以整合到所述基因组中,例如如t-dna。
61.本发明中还包括转基因植物或其部分,其包含如上文i)至v)中所限定的一种或多种异源neena。如果neena是合成的、源自另一种生物或源自相同生物,但是其天然基因组位置与对照植物例如野生型植物相比被转换(rendered),则将neena理解为相对于该植物为异源。应当理解,转换的基因组位置意指neena位于另一条染色体上或位于同一条染色体上,但是脱离其在野生型植物中的天然基因组位置10kb或更远,例如10kb,优选地5kb或更远,例如5kb,更优选地1000bp或更远,例如1000bp,甚至更优选地500bp或更远,例如500bp,特别优选地100bp或更远,例如100bp,最优选地10bp或更远,例如10bp。
62.包含如上文定义的重组表达载体或如上文定义的重组表达构建体的转基因细胞或转基因植物或其部分是本发明的又一个实施方案。转基因细胞、转基因植物或其部分可以选自由以下组成的组:细菌、真菌、酵母或植物、昆虫细胞或哺乳动物细胞或植物。优选地,转基因细胞是细菌、真菌、酵母或植物细胞。优选的细菌是肠细菌属细菌如大肠杆菌(e.coli)和农杆菌属的细菌,例如根癌农杆菌(agrobacterium tumefaciens)和发根农杆菌(agrobacterium rhizogenes)。优选的植物是单子叶或双子叶植物,例如单子叶或双子叶作物植物,如玉米、大豆、卡诺拉油菜、棉、马铃薯、甜菜、稻、小麦、高粱、大麦、芒属植物、芭蕉属植物、甘蔗等。优选的作物植物是玉米、稻、小麦、大豆、卡诺拉油菜、棉或马铃薯。特别优选的双子叶作物植物是大豆、卡诺拉油菜、棉或马铃薯。
63.特别优选的单子叶作物植物是玉米、小麦和稻。最优选的是小麦。
64.包含如上文所定义的源自转基因细胞或植物或其部分中的转基因细胞培养物、转基因种子、部分或繁殖材料是本发明的其他实施方案,其中所述转基因细胞或植物或其部分包含如上文在i)至v)中所定义的所述异源neena或如上文所定义的所述重组表达构建体或所述重组载体。
65.如本文中所意指的转基因部分或繁殖材料包含含有相应neena、重组表达构建体或重组载体的全部组织和器官,例如叶、茎和果实以及用于植物繁殖和/或再生的材料如插条、接穗、压条、枝条或幼苗。
66.本发明的又一个实施方案是如上文在i)至v)中所定义的neena或如上文所定义的重组构建体或重组载体在用于增强植物或其部分中表达的用途。
67.本技术提供增强基因表达的核酸分子,即包含与一种或多种neena功能性连接的一个或多个启动子的构建体。另外,提供了此类增强基因表达的核酸分子和包含此类增强基因表达的核酸分子的表达构建体、表达载体、转基因植物或其部分和转基因细胞的用途。
68.本发明中还包括源自如上文所定义的转基因细胞或植物或其部分中的转基因细胞培养物、转基因种子、部分或繁殖材料在用于生产食品、动物饲料、种子、药物或精细化学品中的用途。
69.定义
70.缩略语:neena-增强核酸表达的核酸,gfp-绿色荧光蛋白,gus-β-葡萄糖醛酸酶,bap-6-苄氨基嘌呤,2,4-d-2,4-二氯苯氧乙酸,ms-murashige-skoog培养基,naa-1-萘乙酸,mes,2-(n-吗啉代)-乙磺酸,iaa吲哚乙酸,kan:硫酸卡那霉素;ga3-赤霉酸;timentin
tm
:替卡西林二钠/克拉维酸钾,microl:微升。
71.应当理解,本发明不限于具体的方法或方案。还应当理解本文所用的术语目的仅在于描述具体实施方案,并且不意图限制本发明,本发明将仅受所附权利要求限制。必须指出,除非上下文另有明确规定,否则如本文中和所附权利要求中所用,单数形式“一个”、“一种”和“该”包括复数称谓。因此,例如,对“一种载体”的提及是对一种或多种载体的提及并且包括本领域技术人员已知的其等同物等。术语“约”在本文中用来指大约、大致、左右和在
……
范围内。当术语“约”与一个数字范围联合使用时,它通过扩展界限值高于和低于所述数值而修饰该范围。通常而言,术语“约”在本文中用来通过20%、优选地10%之上或之下(更高或更低)变化而修饰高于和低于所述值的数值。如本文所用,词汇“或”意指特定列出的任何一个成员并且还包括该列出的成员的任何组合。词汇“包含”、“包含着”、“包括”、“包括着”和“包括了”在本说明书中及以下权利要求中使用时,意图指明一个或多个所述特征、整数、组分或步骤的存在,但是它们不排除一个或多个其他特征、整数、组分、步骤或其组的存在或添加。为清晰起见,将本说明书中使用的某些术语如下定义并使用。
72.反平行:“反平行”在本文中指经互补性碱基残基之间氢键配对的两个核苷酸序列,其中磷酸二酯键在一个核苷酸序列中以5
’‑3’
方向趋向并且在另一个核苷酸序列中以3
’‑5’
方向趋向。
73.反义:术语“反义”指相对于其转录或发挥作用的正常方向为反向并且从而表达下述rna转录物的核苷酸序列,其中所述rna转录物与宿主细胞内部表达的靶基因mrna分子互补(例如,它可以通过watson-crick碱基配对与靶基因mrna分子或单链基因组dna杂交)或与靶dna分子(例如宿主细胞中存在的基因组dna)互补。
74.编码区:如本文所用,术语“编码区”在谈及结构基因使用时,指编码由mrna分子翻译所产生的新生多肽中存在的氨基酸的核苷酸序列。在真核生物中,编码区在5’侧以编码起始子甲硫氨酸的核苷酸三联体“atg”为界并且在3’侧以指定终止密码子的三个三联体(即,taa、tag、tga)之一为界。除含有内含子之外,基因的基因组形式也可以包含位于rna转录物上存在的序列的5’端至3’端二者上的序列。这些序列称作“侧翼”序列或区(这些侧翼序列位于mrna转录物上存在的非翻译序列的5’或3’)。5
’‑
侧翼区可以含有控制或影响基因转录的调节序列如启动子和增强子。3
’‑
侧翼区可以含有指导转录终止、转录后剪切和聚腺
苷酸化的序列。
75.互补的:“互补的”或“互补性”指包含反平行核苷酸序列的两个核苷酸序列,其中在反平行核苷酸序列中的互补性碱基残基之间形成氢键时所述反平行核苷酸序列能够相互配对(通过碱基配对原则)。例如,序列5
’‑
agt-3’与序列5
’‑
act-3’互补。互补性可以是“部分的”或“全部的”。“部分”互补性是其中一个或多个核酸碱基根据碱基配对规则未匹配的情况。核酸分子之间的“全部”或“完全”互补性是其中各自和每个核酸碱基按照碱基配对规则与另一个碱基匹配的情况。核酸分子链之间互补性的程度对核酸分子链之间杂交的效率和强度具有显著影响。如本文所用的核酸序列“互补物”指这样的核苷酸序列,其核酸分子显示与该核酸序列的核酸分子的全部互补性。
76.双链rna:“双链rna”分子或“dsrna”分子包含核苷酸序列的有义rna片段和该核苷酸序列的反义rna片段,二者均包含彼此互补的核苷酸序列,因而允许有义rna片段和反义rna片段配对并形成双链rna分子。
77.内源:“内源”核苷酸序列指存在于未转化的植物细胞的基因组中的核苷酸序列。
78.增强的表达:“增强”或“增加”核酸分子在植物细胞中的表达在本文中同等地使用,并且意指该核酸分子在应用本发明方法之后在植物、植物部分或植物细胞中的表达水平比其在应用该方法之前在植物、植物部分或植物细胞中的表达更高,或与缺少本发明重组核酸分子的参照植物相比更高。例如,参照植物包含仅缺少相应neena的相同构建体。如本文所用的术语“增强”或“增加”是同义的,并且在本文中意指待表达的核酸分子的更高、优选地显著更高的表达。如本文所用,“增强”或“增加”某物质(如蛋白质、mrna或rna)的水平意指相对于基本上相同条件下培育的、缺少本发明重组核酸分子(例如缺少本发明的neena分子、重组构建体或重组载体)的基本上相同植物、植物部分或植物细胞,该水平增加。如本文所用,“增强”或“增加”某物质(例如由靶基因表达的前rna、mrna、rrna、trna、snorna、snrna和/或由其编码的蛋白质产物)的水平意指,相对于缺少本发明重组核酸分子的细胞或生物,该水平增加50%或更多,例如100%或更多,优选地200%或更多,更优选地5倍或更多倍,甚至更优选地10倍或更多倍,最优选地20倍或更多倍,例如50倍。可以通过技术人员熟悉的方法确定所述增强或增加。因而,可以例如通过蛋白质的免疫学检测法确定核酸或蛋白质的量的增强或增加。另外,可以使用技术如蛋白质测定法、荧光法、rna杂交法、核酸酶保护测定法、逆转录法(定量rt-pcr)、elisa(酶联免疫吸附测定法)、蛋白质印迹法、放射免疫测定法(ria)或其他免疫测定法和荧光激活的细胞分析(facs)来测量植物或植物细胞中的特定蛋白质或rna。取决于所诱导蛋白质产物的类型,也可以确定其活性或对生物或细胞表型的影响。用于确定蛋白质数量的方法是技术人员已知的。可以提到的实例是:微量biuret法(goa j(1953)scand j clin lab invest 5:218-222)、folin-ciocalteau法(lowry oh等人(1951)j biol chem 193:265-275)或测量cbb g-250的吸光度(bradford mm(1976)analyt biochem 72:248-254)。作为用于量化蛋白质的活性的一个实例,在下文实施例中描述萤光素酶活性检测法。
79.表达:“表达”指基因产物的生物合成,优选地指细胞中核苷酸序列例如内源基因或异源基因的转录和/或翻译。例如,在结构基因的情况下,表达涉及结构基因转录为mrna并且任选地随后mrna翻译为一种或多种多肽。在其他情况下,表达可以仅指携带rna分子的dna的转录。
80.表达构建体:如本文所用,“表达构建体”意指能够指导特定核苷酸序列在植物或植物细胞中合适的部分中表达的dna序列,该dna序列包含在引入此dna序列的所述植物部分或植物细胞中有功能的启动子,所述启动子与任选地有效连接至终止信号的目的核苷酸序列有效连接。如果需要翻译,该dna序列一般还包含为正确翻译所述核苷酸序列所需的序列。编码区可以编码目的蛋白,但也可以以有义或反义方向编码功能性目的rna,例如rnaa、sirna、snorna、snrna、microrna、ta-sirna或任何其他非编码的调节性rna。包含目的核苷酸序列的表达构建体可以是嵌合的,这意指该表达构建体的组件中一个或多个相对于该表达构建体的其他组件中一个或多个是异源的。该表达构建体也可以是一种这样的表达构建体,它天然地存在,但已经以用于异源表达的重组形式获得。然而,一般而言,该表达构建体相对于宿主是异源的,即,该表达构建体的特定dna序列并非天然存在于宿主细胞中,并且必须已通过转化事件引入宿主细胞或该宿主细胞的祖先中。该表达构建体中的核苷酸序列的表达可以处在组成型启动子或处于仅在宿主细胞暴露于一些特定外部刺激时才启动转录的诱导型启动子的控制下。在植物的情况下,该启动子也可以对特定的组织或器官或发育阶段具有特异性。
81.外来的:术语“外来的”指任何核酸分子(例如,基因序列),所述核酸分子通过实验操作引入细胞的基因组中,并且可以包括该细胞中存在的序列,只要引入的序列含有一些修饰(例如,点突变、存在可选择标记基因等),那么相对于天然存在序列就是不同的。
82.功能性连接:将术语“功能性连接”或“功能性连接的”理解为意指例如调节性元件(例如启动子)与待表达的核酸序列并且根据需要与其他调节性元件(例如,终止子或neena)以如此方式依次排列,从而每种调节性元件可以履行其目的功能以允许、修饰、促进或影响所述核酸序列的表达。作为同义词,可以使用措辞“有效连接”或“有效连接的”。可以根据所述核酸序列相对于有义或反义rna的排列,产生表达。为此目的,不是必需要求化学意义上的直接连接。例如,遗传控制序列如增强子序列也可以从更远的位置或实际上从其他dna分子的位置对靶序列发挥作用。优选的排列是这样的排列,其中待重组表达的核酸序列位于充当启动子的序列之后,从而这两个序列彼此共价连接。该启动子序列与待重组表达的核酸序列之间的距离优选地小于200碱基对、特别优选地小于100碱基对、非常特别优选地小于50碱基对。在一个优选的实施方案中,待转录的核酸序列以如此方式位于启动子之后,使得转录起点与本发明的嵌合rna的合乎需要的起始点(beginning)相同。功能性连接和表达构建体可以借助(例如,在maniatis t,fritsch ef and sambrook j(1989)molecular cloning:a laboratory manual,第2版cold spring harbor laboratory,cold spring harbor(ny);silhavy等人(1984)experiments with gene fusions,cold spring harbor laboratory,cold spring harbor(ny);ausubel等人(1987)current protocols in molecular biology,greene publishing assoc.and wiley interscience;gelvin等人(编著)(1990)plant molecular biology manual;kluwer academic publisher,dordrecht,the netherlands)所述的惯用重组和克隆技术产生。然而,其他序列,例如充当带限制性酶特定切割位点的接头或充当信号肽的序列,也可以位于这两个序列之间。序列的插入也可以引起融合蛋白的表达。优选地,由调节性区域例如启动子和待表达的核酸序列连接组成的表达构建体可以以载体整合的形式存在并且例如通过转化法插入到植物基因组中。
83.基因:术语“基因”指与能够以某种方式调节基因产物(例如,多肽或功能性rna)表达的合适调节序列有效连接的区域。基因包括dna中位于编码区(可读框,orf)之前(上游)和之后(下游)的非翻译调节区(例如启动子、增强子、阻遏物等),以及在可用的情况下,在各个编码区(即,外显子)之间的间插序列(即,内含子)。如本文所用,术语“结构基因”意图指转录为mrna的dna序列,其中所述mrna随后翻译为以特异性多肽为特征的氨基酸的序列。
84.基因组和基因组dna:术语“基因组”或“基因组dna”指宿主生物的可遗传信息。所述基因组dna包含胞核的dna(也称作染色体dna),还包含质体(例如,叶绿体)和其他细胞器(例如,线粒体)的dna。优选地,术语“基因组”或“基因组dna”指胞核的染色体dna。
85.异源:就核酸分子或dna而言,术语“异源的”指这样的核酸分子,所述核酸分子有效连接于或受到操作以变成有效连接于自然界中(例如在wt植物的基因组中)不与该核酸分子有效连接的或自然界中(例如在wt植物的基因组中)与该核酸分子在不同位置有效连接的第二种核酸分子,例如启动子。
86.优选地,就核酸分子或dna如neena而言,术语“异源的”指这样的核酸分子,所述核酸分子有效连接于或受到操作以变成有效连接于自然界中不与该核酸分子有效的第二种核酸分子,例如启动子。
87.包含核酸分子和与其连接的一个或多个调节性核酸分子(如启动子或转录终止信号)的异源表达构建体例如是源自实验操作的构建体,在所述构建体中,a)所述核酸分子或b)所述调节性核酸分子或c)二者(即(a)和(b))不位于其天然(原有)遗传环境中或已经由实验操作而修饰,修饰的实例是一个或多个核苷酸残基的置换、添加、缺失、倒位或插入。天然遗传环境指来源生物中的天然染色体基因座或指存在于基因组文库中。在基因组文库的情况下,优选地保留,至少部分地保留该核酸分子序列的天然遗传环境。该环境在至少一侧的侧翼为核酸序列,并且具有至少50bp,优选地至少500bp,特别优选地至少1,000bp,非常特别优选地至少5,000bp长度的序列。天然存在的表达构建体例如启动子与相应基因的天然存在的组合在其通过非天然的合成性“人工”方法例如如诱变法修饰时变成转基因表达构建体。已经描述了此类方法(us 5,565,350;wo 00/15815)。例如,与启动子有效连接的编码蛋白质的核酸分子相对于该启动子视为异源,其中所述启动子不是该核酸分子的天然启动子。优选地,异源dna相对于引入该异源dna的细胞是非内源的或与该细胞非天然相关,但是已经从另一种细胞获得或已经合成。异源dna还包括含有一些修饰的内源dna序列、非天然存在的多拷贝的内源dna序列或与和其物理连接的另一个dna序列非天然接合的dna序列。通常但不是必需地,异源dna编码由所述异源dna在其中表达的细胞非天然产生的rna或蛋白质。
88.高表达启动子:如本文所用,“高表达启动子”意指在植物或其部分中引起表达的启动子,其中源自处于相应启动子控制下的核酸分子中的rna积累或合成速率或rna的稳定性比缺少本发明neena的启动子所引起的表达更高,优选显著更高。优选地,相对于缺少本发明neena的启动子,rna的量和/或rna合成速率和/或rna的稳定性增加50%或更大,例如100%或更大,优选地200%或更大,更优选地5倍或更多倍,甚至更优选地10倍或更多倍,最优选地20倍或更多倍,例如50倍。
89.杂交:如本文所定义的术语“杂交”是其中基本上互补的核苷酸序列彼此退火的过程。杂交过程可以完全在溶液中进行,即两种互补性核酸都在溶液中。杂交过程也可以在互
补性核酸之一固定在基质如磁珠、琼脂糖凝胶珠或任何其他树脂上的来进行。此外,杂交过程可以在互补核酸之一固定在固体支持物如硝酸纤维素或尼龙膜上或通过例如照相平版印刷术固定到例如硅酸玻璃支持物(后者称为核酸阵列或微阵列或称为核酸芯片)上的情况下来进行。为了进行杂交,通常使核酸分子热变性或化学变性以将双链解链成两条单链和/或从单链核酸去除发夹或其他二级结构。
90.术语“严格性”是指杂交发生的条件。杂交的严格性受诸如温度、盐浓度、离子强度和杂交缓冲液组成等条件的影响。通常,将低严格条件选择成在确定的离子强度和ph处,低于特定序列的热解链温度(tm)约30℃。中等严格条件是当温度低于tm以下20℃时,高严格条件是当温度低于tm以下10℃时。高严格杂交条件一般用于分离与靶核酸序列具有高序列相似性的杂交序列。然而,由于遗传密码的简并性,核酸可在序列上发生偏差,但仍编码基本上相同的多肽。因此,有时需要中等严格杂交条件来鉴定此类核酸分子。
[0091]“tm”是在确定的离子强度和ph值下的温度,在该温度下,50%的靶序列与完美匹配的探针杂交。tm取决于溶液条件以及探针的碱基组成和长度。例如,较长的序列在较高的温度下特异性杂交。在低于tm约16℃至高达32℃时获得最大杂交速率。杂交溶液中单价阳离子的存在降低了两条核酸链之间的静电排斥,从而促进杂交体的形成;这种作用对于高达0.4m的钠浓度是可见的(对于更高的浓度,这种影响可会被忽略)。甲酰胺降低dna-dna和dna-rna双链体的解链温度,每百分数甲酰胺降低0.6至0.7℃,尽管杂交速率会降低,添加50%甲酰胺允许在30至45℃下进行杂交。碱基对错配降低了双链体的杂交率和热稳定性。平均而言,对于大型探针,每%碱基错配tm降低约1℃。取决于杂交体的类型,tm可以使用以下等式计算:
[0092]
dna-dna杂交体(meinkoth和wahl,anal.biochem.,138:267-284,1984):
[0093]
tm=81.5℃+16.6xlog[na
+
]a+0.41x%[g/cb]
–
500x[lc]-1
–
0.61x%甲酰胺
[0094]
dna-rna或rna-rna杂交体:
[0095]
tm=79.8+18.5(log10[na
+
]a)+0.58(%g/cb)+11.8(%g/cb)2-820/lc
[0096]
oligo-dna或oligo-rnad杂交体:
[0097]
对于《20个核苷酸而言:tm=2(ln)
[0098]
对于20
–
35个核苷酸而言:tm=22+1.46(ln)
[0099]
a或对于其他单价阳离子,而仅在0.01-0.4m的范围内是精确的。
[0100]
b仅对于%gc在30%至75%范围内是精确的。
[0101]
c l=双链体的长度(以碱基对计)。
[0102]
d oligo,寡核苷酸;ln,引物的有效长度=2
×
(g/c数)+(a/t数)。
[0103]
可以使用多种已知技术中的任何一种来控制非特异性结合,例如用含有蛋白质的溶液封闭膜,向杂交缓冲液中加入异源rna、dna和sds,以及用rna酶处理。对于不相关的探针,可以通过改变以下条件之一进行一系列杂交:(i)渐进地降低退火温度(例如从68℃至42℃)或(ii)渐进地降低甲酰胺浓度(例如从50%至0%)。技术人员知晓在杂交期间可以加以改变和将维持或改变严格条件的多种参数。
[0104]
除了杂交条件之外,杂交的特异性通常还取决于杂交后洗涤的功能。为了去除非特异性杂交产生的背景,用稀释的盐溶液洗涤样品。此类洗涤的关键因素包括最终洗涤溶液的离子强度和温度:盐浓度越低并且洗涤温度越高,洗涤的严格性越高。洗涤条件一般在
杂交严格性处或低于杂交严格性而进行。阳性杂交产生的信号至少是背景信号的两倍。通常,用于核酸杂交测定法或基因扩增检测方法的合适严格条件如上文所述。也可以选择更严格或更不严格的条件。技术人员知晓在洗涤期间可以加以改变和将维持或改变严格性条件的多种参数。
[0105]
例如,用于长度大于50个核苷酸的dna杂交体的常见高严格杂交条件包括在65℃于1xssc中或在42℃于1xssc和50%的甲酰胺中杂交,然后在65℃于0.3xssc中洗涤。用于长度大于50个核苷酸的dna杂交体的中等严格杂交条件的例子包括在50℃于4xssc中或在40℃于6xssc和50%甲酰胺中杂交,然后在50℃于2xssc中洗涤。杂交体的长度是杂交用核酸的预期长度。当已知序列的核酸杂交时,杂交长度可以通过比对序列和鉴定本文所述的保守区来确定。1
×
ssc是0.15m nacl和15mm柠檬酸钠;杂交溶液和洗涤溶液可以额外地包含5xdenhardt试剂、0.5-1.0%sds、100μg/ml变性的片段化鲑精dna、0.5%焦磷酸钠。高严格条件的另一个实例是在65℃于包含0.1sds和任选的5xdenhardt试剂、100μg/ml变性的片段化鲑精dna、0.5%焦磷酸钠的0.1xssc中杂交,该ssc,然后在65℃于0.3xssc中洗涤。
[0106]
出于定义严格性水平的目的,可以参考sambrook等人(2001)molecular cloning:a laboratory manual,第3版,cold spring harbor laboratory press,csh,new york或参考current protocols in molecular biology,john wiley&sons,n.y.(1989年和年度更新版)。
[0107]“同一性”:在用于比较两个或更多个核酸或氨基酸分子时,“同一性”是指所述分子的序列具有某种程度的序列相似性,即所述序列是部分相同的。
[0108]
酶变体可以由它们与亲本酶相比时的序列同一性定义。序列同一性通常作为“序列同一性%”或“同一性%”提供。为了确定两个氨基酸序列之间的同一性百分数,在第一步骤中,在这两个序列之间生成配对序列比对结果,其中将两个序列在它们的完整长度上比对(即,配对的全局比对)。用实施needleman和wunsch算法(j.mol.biol.(1979)48,第443-453页)的程序,优选地通过使用程序“needle”(欧洲分子生物学开放软件包(the european molecular biology open software suite(emboss),使用程序默认参数(空位开口=10.0、空位延伸=0.5和矩阵=eblosum62),生成比对结果。为了本发明的目的,优选的比对是从中可以确定最高序列同一性的比对。
[0109]
以下实例旨在说明两个核苷酸序列,但相同的计算适用于蛋白质序列:
[0110]
序列a:aagatactg长度:9个碱基
[0111]
序列b:gatctga长度:7个碱基
[0112]
因此,较短的序列是序列b。
[0113]
产生在其完整长度范围内显示两个序列的配对的全局比对,产生
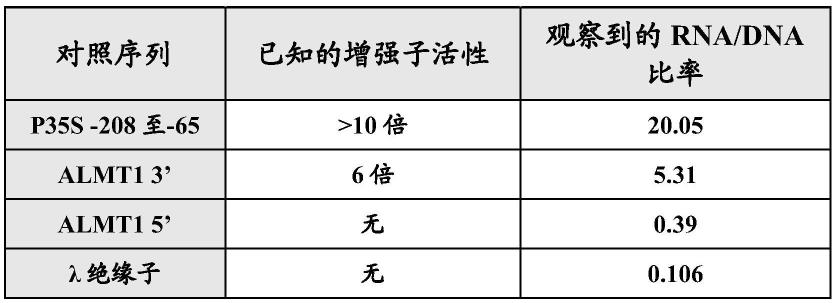
[0114][0115]
比对结果中的“i”符号表示相同的残基(其意指dna的碱基或蛋白质的氨基酸)。相同残基的数目为6。
[0116]
比对结果中的
“‑”
符号指示空位。在序列b中通过比对引入的空位数为1。在序列b的边界处通过比对引入的空位数为2,在序列a的边界处通过比对引入的空位数为1。
[0117]
在其完整长度范围内显示比对序列的比对长度为10。
[0118]
根据本发明,产生在其完整长度范围内显示较短序列的配对比对,产生
[0119][0120]
根据本发明,产生在其完整长度范围内显示序列a的配对比对,产生:
[0121][0122]
根据本发明,产生在其完整长度范围内显示序列b的配对比对,产生:
[0123][0124]
在其完整长度范围内显示较短序列的比对长度为8(存在一个空位,这是较短序列的比对长度的因素)。
[0125]
因此,在其完整长度范围内显示序列a的比对长度将为9(意指序列a是本发明的序列)。
[0126]
因此,在其完整长度范围内显示序列b的比对长度将为8(意指序列b是本发明的序列)。
[0127]
在比对两个序列后,在第二步骤中,从产生的比对中确定同一性值。为了本说明书的目的,通过以下方式计算同一性百分数:同一性%=(相同残基/在其完整长度范围内显示本发明相应序列的比对区域的长度)*100。因此,根据这个实施方案,与两个氨基酸序列的比较相关的序列同一性是通过将相同残基的数目除以在其完整长度范围内显示本发明相应序列的比对区域的长度来计算。这个值乘以100得到“同一性%”。根据上面提供的实例,同一性%:对于作为本发明序列的序列a(6/9)*100=66.7%;对于作为本发明序列的序列b(6/8)*100=75%。
[0128]
内含子:指基因内部的dna区段(间插序列),该dna区段不编码该基因产生的蛋白质的部分,并且从该基因转录的mrna中在该mrna从细胞核输出之前剪切下来。内含子序列指内含子的核酸序列。因而,内含子是dna序列的这些区域,它们随编码序列(外显子)一起转录但是在成熟mrna形成期间被除去。内含子可以位于实际编码区内部或位于前mrna(未剪接的mrna)的5’或3’非翻译前导序列中。初级转录物中的内含子被切下并且编码序列同时且精确地连接以形成成熟的mrna。内含子和外显子的交界形成剪接位点。内含子的序列始于gu并止于ag。另外,在植物中,已经描述au-ac内含子的两个实例:来自拟南芥(arabidopsis thaliana)的reca样蛋白基因的第14内含子和g5基因的第7内含子是at-ac含子。含有内含子的前mrna具有三种短序列,连同其他序列,这些短序列对于精确剪接内含子是必需的。这些序列是5’剪接位点、3’剪接位点和分支点。mrna剪接是除去初级mrna转录物中存在的间插序列(内含子)并接合或连接外显子序列。这也称作顺式剪接作用,所述顺式剪接作用将相同rna上的两个外显子接合,同时除去间插序列(内含子)。内含子的功能性元件包含由剪接体的特定蛋白质组分(例如在内含子末端处的剪接共有序列)识别并结合
的序列。功能性元件与剪接体的相互作用引起从不成熟mrna除去内含子序列和外显子序列的再接合。内含子具有三种短序列,这些短序列对于精确剪接内含子是必需的,但是并非足够的。这些序列是5’剪接位点、3’剪接位点和分支点。分支点序列在植物中的剪接过程和剪接位点选择方面是重要的。分支点序列通常位于3’剪接位点上游10-60个核苷酸处。
[0129]
同基因的:除可以因存在或不存在异源dna序列而不同之外,在遗传上相同的生物(例如植物)。
[0130]
分离的:如本文中所用,术语“分离的”意指已经通过人工去除并且离开其原来的天然环境而存在并且因此不是自然界的产物的材料。分离的材料或分子(如dna分子或酶)可以以纯化的形式存在或可以存在于非天然环境中如例如存在于转基因宿主细胞中。例如,活植物中存在的天然存在多核苷酸或多肽不是分离的,然而与该天然系统中一些或全部共存物质分开的相同多核苷酸或多肽是分离的。此类多核苷酸可以是载体的一部分和/或此类多核苷酸或多肽可以是组合物的一部分,并且将是分离的,因为此类载体或组合物不是其原来环境的一部分。优选地,术语“分离的”相对于核酸分子使用时,如在“分离的核酸序列”中,指被鉴定并且与该核酸序列天然来源中通常与其接合的至少一种杂质性核酸分子分开的核酸序列。分离的核酸分子是这样的核酸分子,其在与在自然界中发现的该核酸分子的形式或环境不同的形式或环境下存在。相反,未分离的核酸分子是在自然界中以它们存在的状态被发现的核酸分子如dna和rna。例如,给定的dna序列(例如,基因)在宿主细胞染色体上与相邻基因接近;rna序列,例如编码特定蛋白质的特定mrna序列,在细胞中作为与编码多种蛋白质的许多其他mrna的混合物而被发现。然而,包含例如seq id no:16的分离的核酸序列包括例如在细胞中通常含有seq id no:16的此类核酸序列,其中所述核酸序列位于与天然细胞的染色体或染色体外位置不同的染色体或染色体外位置,或否则侧翼有与自然界中发现的核酸序列不同的核酸序列。分离的核酸序列可以以单链或双链形式存在。当利用分离的核酸序列来表达蛋白质时,该核酸序列将最少含有有义链或编码链的至少一部分(即,该核酸序列可以是单链的)。备选地,它可以含有有义链和反义链(即,该核酸序列可以是双链的)。
[0131]
最小启动子:无活性或在缺少上游激活情况下启动子活性大大降低的启动子元件,特别是tata元件。在合适的转录因存在下,最小启动子发挥作用以引起转录。
[0132]
neena:参见“增强核酸表达的核酸”。
[0133]
非编码:术语“非编码”指核酸分子中不编码所表达蛋白质的部分或全部的序列。非编码序列包括但不限于内含子、增强子、启动子区、3’非翻译区和5’非翻译区。
[0134]
增强核酸表达的核酸(neena):术语“增强核酸表达的核酸”指这样的序列和/或特定序列的核酸分子,其具有在与neena功能性连接的启动子的控制下增强核酸表达的内在特性。不同于启动子序列,neena本身不能驱动表达。为了实现增强与neena功能性连接的核酸分子表达的功能,neena本身应当与启动子功能性连接。与本领域已知的增强子序列的区别在于,neena以顺式而非反式起作用,并且必须位于待表达核酸的转录起始位点附近。
[0135]
核酸和核苷酸:术语“核酸”和“核苷酸”指天然存在的或合成的或人工的核酸或核苷酸。术语“核酸”和“核苷酸”包括处于单链或双链、有义或反义形式的脱氧核糖核苷酸或核糖核苷酸或其任何核苷酸类似物和聚合物或杂合体。除非另外说明,否则特定核酸序列也内在地包括其保守修饰的变体(例如简并密码子替换)和互补序列,以及明确指出的序
列。术语“核酸”在本文中与“基因”、“cdna”、“mrna”、“寡核苷酸”和“多核苷酸”互换使用。核苷酸类似物包括在碱基、糖和/或磷酸酯的化学结构中具有修饰的核苷酸,所述修饰包括但不限于5-位置嘧啶修饰、8-位置嘌呤修饰、胞嘧啶外环胺处的修饰、5-溴-尿嘧啶替换等;和2'位置糖修饰,包括但不限于糖修饰的核糖核苷酸,其中2'-oh由选自h、or、r、卤素、sh、sr、nh2、nhr、nr2或cn的基团替换。短发夹rna(shrna)也可以包含非天然元件如非天然碱基,例如,肌苷和黄嘌呤,非天然糖,例如,2
’‑
甲氧基核糖,或非天然的磷酸二酯键,例如甲基磷酸酯、硫代磷酸酯和肽。
[0136]
核酸序列:短语“核酸序列”指从5’端至3’端读取的脱氧核糖核苷酸或核糖核苷酸碱基的单链或双链聚合物。它包括染色体dna、自我复制型质粒、dna或rna的感染性聚合物、和主要发挥结构性作用的dna或rna。“核酸序列”也指代表核苷酸的缩写、字母、字符或字的连续串。在一个实施方案中,核酸可以是“探针”,所述探针是相对短的核酸,通常长度小于100个核苷酸。经常地,核酸探针具有约50个核苷酸长度至约10个核苷酸长度。核酸的“靶区域”是核酸中被鉴定为目标的部分。核酸的“编码区”是核酸的部分,其中置于合适的调节性序列控制下时,所述部分以序列特异性方式转录和翻译以产生特定的多肽或蛋白质。称该编码区编码这种多肽或蛋白质。
[0137]
寡核苷酸:术语“寡核苷酸”指核糖核酸(rna)或脱氧核糖核酸(dna)或其模拟物的低聚物或聚合物,以及具有类似发挥作用的非天然存在部分的寡核苷酸。此类修饰或取代的寡核苷酸因合乎需要的特性,例如增强的细胞摄取、增强的核酸靶亲和力和在核酸酶存在下增加的稳定性而经常优选地胜过其天然形式。寡核苷酸优选地包括通过键(例如,磷酸二酯键)或取代键(substitute linkages)彼此共价偶联的两个或更多个核苷酸单体(nucleomonomers)。
[0138]
突出端:“突出端”是双链寡核苷酸分子的5’或3’羟基端上相对短的单链核苷酸序列(也称为“延伸”、“伸出端”或“粘性末端”)。
[0139]
植物:通常理解为意指能够进行光合作用的任何真核单细胞或多细胞生物或其细胞、组织、器官、部分或繁殖材料(如种子或果实)。为本发明的目的,包括植物界(plant kingdom)的高等和低等植物的所有属和种。优选地一年生、多年生、单子叶和双子叶植物。该术语包括成熟植物、种子、幼苗(shoot)和耔苗(seedling)及其衍生部分、繁殖材料(如种子或微孢子)、植物器官、组织、原生质体、愈伤组织和其他培养物(例如细胞培养物),和归并成产生功能单元或结构单元的任何其他类型的植物细胞。成熟植物指在除耔苗之外的任何目的发育阶段的植物。耔苗指在早期发育阶段的年幼不成熟植物。一年生、二年生、单子叶和双子叶植物是用于产生转基因植物的优选宿主生物。基因的表达在全部观赏植物、用材树或观赏树、花、切花、灌木或草坪草中都是进一步有利的。可以用举例方式、但非限制方式提到的植物是被子植物、苔藓植物例如如苔纲(hepaticae)(地钱(liverwort))和藓纲(musci)(苔藓植物);蕨类植物如蕨类、木贼类和石松类;裸子植物如松柏类(conifers)、苏铁类(cycads)、银杏(ginkgo)和买麻藤纲植物(gnetaeae);藻类如绿藻纲(chlorophyceae)、褐藻纲(phaeophpyceae)、红藻纲(rhodophyceae)、蓝藻纲(myxophyceae)、黄藻纲(xanthophyceae)、硅藻纲(bacillariophyceae)(硅藻类)和裸藻纲(euglenophyceae)。优选地是用于食品或饲料目的的植物,例如豆科(leguminosae),例如豌豆、苜蓿和大豆;禾本科(gramineae),例如稻、玉米、小麦、大麦、高粱、栗、黑麦、黑小麦或
燕麦;伞形科(umbelliferae),特别是胡萝卜(daucus)属,非常特别地是胡萝卜(carota)种(胡萝卜),和芹属(apium),特别是旱芹(graveolens dulce)种(旱芹)和许多其他植物;茄科(solanaceae),特别地是番茄属(lycopersicon),非常特别地是番茄(esculentum)种(番茄),和茄属(solanum),非常特别地是马铃薯(tuberosum)种(马铃薯)和茄(茄子)和许多其它植物(如烟草(tobacco)),和辣椒属(capsicum),非常特别地是辣椒(capsicum annum)种(辣椒)和许多其它植物;豆科(leguminosae),特别地是大豆属(glycine),非常特别地是大豆(max)种(大豆)、苜蓿、豌豆、紫花苜蓿、菜豆或花生和许多其它植物;和十字花科(cruciferae)(芸苔科(brassicacae)),特别地是芸苔属(brassica),非常特别地是欧洲油菜(napus)种(油料种子油菜)、芸苔油菜(campestris)(甜菜)、甘蓝(brassica oleracea cvtastie)(卷心菜)、花椰菜(brassica oleracea cv snowball y)(花挪菜)和花茎甘蓝(oleracea cv emperor)(花茎甘蓝);和拟南芥(arabidopsis)属,非常特别地是拟南芥(thaliana)种和许多其它植物;菊科(compositae),特别地是莴苣属(lactuca),非常特别地是莴苣(lettuce)种和许多其它植物;菊科(asteraceae)如向日葵、万寿菊、莴苣或金盏花和许多其它植物;葫芦科(cucurbitaceae)如甜瓜、西葫芦/南瓜或夏南瓜,和亚麻。更优选地是棉、甘蔗、大麻、亚麻、辣椒和多种树、坚果和藤本(wine)种。
[0140]
多肽:术语“多肽”、“肽”、“寡肽”、“多肽”、“基因产物”、“表达产物”和“蛋白质”在文中可互换使用,用来指连续氨基酸残基的聚合物或低聚物。
[0141]
前蛋白:正常情况下靶向细胞器如叶绿体并且仍包含其转运肽的蛋白质。
[0142]
初级转录物:如本文所用,术语“初级转录物”指基因的不成熟rna转录物。“初级转录物”例如仍包含内含子和/或仍不包含polya尾或帽子结构和/或是缺少对其作为转录物正确发挥作用必需的其他修饰,例如如修剪或编辑。
[0143]
启动子:术语“启动子”或“启动子序列”是等同物并且如本文所用,指与目的核苷酸序列连接时能够控制目的核苷酸序列转录为rna的dna序列。此类启动子可以例如在以下公共数据库http://www.grassius.org/grasspromdb.html、http://mendel.cs.rhul.ac.uk/mendel.php?topic=plantprom、http://ppdb.gene.nagoya-u.ac.jp/cgi-bin/index.cgi中找到。其中所列的启动子可以用本发明的方法来处理并且在此引用而包括在内。启动子位于由该启动子控制转录为mrna的目的核苷酸序列中5’(即,上游),靠近其转录起始位点,并且为rna聚合酶和用于转录起始的其他转录因子的特异性结合提供位点。所述启动子包含靠近转录起始位点例如至少10kb,例如5kb或2kb。它也可以包含靠近转录起始位点至少1500bp,优选地至少1000bp,更优选地至少500bp,甚至更优选地至少400bp,至少300bp,至少200bp或至少100bp。在又一个优选的实施方案中,启动子包含靠近转录起始位点至少50bp,例如至少25bp。启动子不包含外显子区和/或内含子区或5’非翻译区。启动子可以例如相对于相应植物为异源或同源。如果多核苷酸序列源自外来物种,或如果来自相同物种,但从其原有形式中被修饰,则它相对于生物或第二多核苷酸序列为“异源”。例如,与异源编码序列有效连接的启动子指来自与该启动子所源自的物种不同的物种的编码序列,或如果来自相同物种,编码序列与该启动子非天然接合(例如基因工程化的编码序列或来自不同生态型或品种的等位基因)。合适的启动子可以源自其中应当出现表达的宿主细胞的基因或源自该宿主细胞的病原体(例如,植物或植物病原体如植物病毒)。植物特异性启动子是适于调节植物中表达的启动子。这种启动子可以源自植物,也可
以源自植物病原体,或其可以是由人设计的合成性启动子。如果启动子是诱导型启动子,则转录速率响应于诱导剂而增加。此外,启动子可以以组织特异性或组织优先方式进行调节,以使其仅仅或优势地在特定组织类型(一个或多个)如叶、根或分生组织中转录所接合的编码区方面有活性。用于启动子时,术语“组织特异性”指这样的启动子,该启动子在相同目的核苷酸序列在不同类型组织(例如,根)中相对缺少表达的情况下,能够指导目的核苷酸序列在特定类型的组织(例如,花瓣)中选择性表达。可以例如通过这样的方式评估启动子的组织特异性:将报道基因与该启动子序列有效连接以产生报道构建体,将报道构建体引入植物基因组,从而该报道构建体整合到所产生的转基因植物的每种组织中,并且检测报道基因在转基因植物的不同组织中的表达(例如,检测mrna、蛋白质或由报道基因编码的蛋白质的活性)。相对于报道基因在其他组织中的表达水平,检测到该报道基因在一种或多种组织中的更大表达水平表明该启动子对其中检测到更大表达水平的组织是特异性的。用于启动子时,术语“细胞类型特异的”指这样的启动子,该启动子在相同目的核苷酸序列在相同组织内不同类型细胞中中相对缺少表达的情况下,能够指导目的核苷酸序列在特定类型的细胞中选择性表达。用于启动子时,术语“细胞类型特异的”还意指能够促进目的核苷酸序列在单一组织内的某区域中选择表达的启动子。使用本领域熟知的方法,例如gus活性染色法、gfp蛋白法或免疫组织化学染色法,可以评估启动子的细胞类型特异性。当提及启动子或源自启动子的表达时,术语“组成型”意指能够在贯穿植物或植物的部分的基本上整个生命周期的大部分植物组织和细胞中缺少刺激(例如,热休克、化学品、光等)的情况下,能够指导有效连接的核酸分子的转录的启动子。通常,组成型启动子能够指导转基因在基本上任何细胞和任何组织中的表达。
[0144]
启动子特异性:提及启动子时,术语“特异性”意指由相应启动子赋予的表达模式。特异性描述了植物或其部分的组织和/或发育状态,其中该启动子赋予处于相应启动子控制下的核酸分子表达。启动子的特异性也可以包含环境条件,在所述环境条件下,可以通过生物胁迫或环境胁迫如寒冷、干旱、受伤或感染来激活或下调如诱导或阻遏该启动子。
[0145]
纯化的:如本文所用,术语“纯化的”指从其天然环境去除、分离或分开的分子,即核酸序列或氨基酸序列。“基本上纯化的”分子至少60%没有、优选地至少75%没有和更优选地至少90%没有与它们天然结合的其他组分。纯化的核酸序列可以是分离的核酸序列。
[0146]
重组:就核酸分子而言,术语“重组”指通过重组dna技术产生的核酸分子。重组核酸分子也可以包括本身不存在于自然界中但是被人为修饰、改变、突变或其他操纵的分子。优选地,“重组核酸分子”是在序列方面与天然存在的核酸分子有至少一个核酸不同的非天然存在的核酸分子。“重组核酸分子”也可以包括“重组构建体”,其包含、优选有效地连接、不是按该顺序天然存在的核酸分子序列。用于产生所述重组核酸分子的优选方法可以包括克隆技术、定向或非定向诱变法、合成或重组技术。
[0147]
有义:术语“有义”理解为意指这样的核酸分子,其具有与靶序列互补或相同的序列,例如与蛋白质转录因子结合并参与给定基因表达的序列。根据一个优选的实施方案,该核酸分子包含目的基因和允许表达该目的基因的元件。
[0148]
显著的增加或减少:例如在酶活性或在基因表达方面大于测量技术中固有误差界限(margin of error inherent)的增加或减少优选地是对照酶的活性或在对照细胞中表达增加或减少约2倍或更多,更优选地增加或减少约5倍或更多,并且最优选地增加或减少
约10倍或更多。
[0149]
小核酸分子:“小核酸分子”理解为由核酸或其衍生物如rna或dna组成的分子。它们可以是双链或单链的,并且其长度在约15bp和约30bp之间,例如在15和30bp之间,更优选在约19bp和约26bp之间,例如在19bp和26bp之间,甚至更优选在约20bp和约25bp之间,例如在20bp和25bp之间。在一个特别优选的实施方案中,寡核苷酸的长度在约21bp和约24bp之间,例如在21bp和24bp之间。在一个最优选的实施方案中,小核酸分子的长度为约21bp和约24bp,例如21bp和24bp。
[0150]
基本上互补的:在最广意义上,本文中就核苷酸序列相对于参考或靶核苷酸序列而言使用时,术语“基本上互补的”意指这样的核苷酸序列,其具有在基本上互补的核苷酸序列和所述参考或靶核苷酸序列的完全互补序列之间至少60%、更期望地至少70%、更期望地至少80%或85%、优选地至少90%、更优选地至少93%、仍更优选地至少95%或96%、仍旧更优选地至少97%或98%、依旧更优选地至少99%或最优选地100%的同一性百分数(后者等同于本上下文中的术语“相同”)。优选地,在相对参考序列至少19个核苷酸长度、优选地至少50个核苷酸长度、更优选核酸序列的全部长度范围内来评估同一性(如果不是,则另外在下文说明)。基于needleman和wunsch算法(needleman和wunsch(1970)j mol.biol.48:443-453;如上文定义),使用威斯康辛大学(university of wisconsin)gcg的默认空位分析,空位的seqweb应用,实施序列比较。与参考核苷酸序列“基本上互补的”核苷酸序列与该参考核苷酸序列在低严格性条件、优选地中等严格性条件、最优选地高严格性条件(如上文定义)下杂交。
[0151]
转基因:如本文所用,术语“转基因”指通过实验操作引入细胞的基因组中的任何核酸序列。转基因可以是“内源dna序列”或“异源dna序列”(即,“外来dna”)。术语“内源dna序列”指这样的核苷酸序列,其天然存在于引入该核苷酸序列的细胞中,只要它相对于天然存在的序列不含有一些修饰(例如,点突变、存在可选择标记基因等)。
[0152]
转基因的:当提及生物时,术语“转基因的”意指用重组dna分子进行转化,优选地进行稳定转化,其中所述重组dna分子优选地包含与目的dna序列有效连接的合适启动子。
[0153]
载体:如本文所用,术语“载体”指能够运输已经与其连接的另一个核酸分子的核酸分子。载体的一种类型是基因组整合的载体,或“整合的载体”,其可以整合到宿主细胞的染色体dna中。载体的另一个类型是游离型(episomal)载体,即,能够进行染色体外复制的核酸分子。本文中将能够指导与其有效连接的基因的表达的载体称作“表达载体”。在本说明书中,除非上下文另有明确说明,否则“质粒”和“载体”可互换使用。设计用于在体外或体内产生如本文所述的rna的表达载体可以包含被任何rna聚合酶识别的序列,所述rna聚合酶包括线粒体rna聚合酶、rna pol i、rna pol ii和rna pol iii。这些载体可以用来在根据本发明的细胞中转录期望的rna分子。植物转化载体应理解为适用于植物转化过程中的载体。
[0154]
野生型:就生物、多肽或核酸序列而言,术语“野生型”、“天然”或“天然来源”意指所述生物是天然存在的或是在至少一种没有改变、突变或其他人为操作的天然存在生物中可获得的。
biolabs(ipswich,ma,usa)或roche diagnostics gmbh(penzberg,germany)。寡核苷酸由eurofins mwg operon(ebersberg,germany)合成。
[0165]
实施例1:来自小麦基因组中新的候选增强子序列的发现
[0166]
为了鉴定新的小麦增强子序列,从小麦基因组(iwgsc 1.0 2017版)中选择500个高度表达(平均cpm高于500)或中等表达水平(平均cpm在100和500之间)并且在小麦组织之间具有低基因表达变化性(低变化系数)的基因。使用tmm方法(edger)对基因表达水平进行标准化。
[0167]
从这500个基因中,基于基因组注释和改进的注释管提取假定启动子、第一内含子和3’utr的序列(如果在基因组序列中可获得)。对于内含子,5'10nt和3'20nt被排除在外。仅保留至少144nt长的那些序列。总共保留了1392个序列特征。
[0168]
这1392个序列在nhei、xbai、kpni、pvui和sfii位点进行了计算机消化。除了2个最3'片段重叠使得最后144-nt片段的3'端与原始序列的3'端一致以外,将得到的启动子和内含子序列分为144-nt长的片段,其中有20-nt重叠。将3’utr序列以相同的方式分为重叠的139-nt长片段,并将ctagc添加到每个3'utr片段的5'端,再次产生144-nt长序列片段。整个过程产生了9919个长度为144nt的序列。10个序列(seq id no 1至10)被添加到列表中。这些是从之前的实验中已知的对小麦原生质体的表达有影响的序列。p35s(seq id no 1)和almt1 3’(seq id no 4)序列分别增加35s最小启动子的表达》10倍和6倍,而λ绝缘子(seq id no 2)和almt1 5'(seq id no 3)序列不增加该最小启动子的表达。
[0169]
将得到的9929个序列克隆到mpra文库中(melnikov等人2014,j.vis.exp.(90),e51719),筛选具有启动子增强活性的序列。将每个序列与5个不同的独特的11-nt长的条形码相连接。条形码不含有nhei、xbai、kpni、pvui和sfii的限制性位点aataat、aataaa、attta、ttttt,差异至少2nt,没有碱基重复长度超过2nt,并且不以tc开头。合成了200-nt长的寡核苷酸,其含有各个49645个查询序列—条形码组合以及将文库扩增和克隆到表达载体中所需的序列(图1)。在第一个克隆步骤中,使用sfii限制性识别位点将扩增的寡核苷酸文库克隆到pbay02101(seq id no 11)的3’pin2上游。接下来,将含有来自pbay01697(seq id no 12)的最小35s启动子、矮牵牛cab22l前导序列、水稻肌动蛋白-1内含子和gus编码序列的kpn-nhei片段克隆到查询序列和条形码之间的kpni和xbai位点。得到的质粒文库含有最小35s启动子上游的查询序列和gus基因3'utr中的连接条形码。对来自质粒文库的48个克隆进行测序表明,44个克隆含有预期的查询序列,而4个克隆含有短于预期的插入片段。
[0170]
将得到的质粒文库转染到小麦叶肉原生质体中(在一百万个原生质体中转染80μg质粒dna 4次)。将转染的原生质体孵育6小时并收集用于rna分离。使用sigma植物rna分离试剂盒分离总rna。分离的rna以130μl的总体积洗脱,浓度为0.54μg/μl。使用来自ambion的turbo dna酶试剂盒在37℃下应用2μl dna酶对这种rna进行dna酶处理30分钟。
[0171]
在rna变性步骤(在65℃下5分钟)之后,使用来自thermofisher的superscript iii第一链合成试剂盒使用oligo dt和40μl(=18μg)总rna以最终体积为100μl合成cdna。cdna合成在50℃下进行50分钟,然后在80℃下进行5分钟。合成cdna后,在37℃下使用rnase h去除rna 20分钟。
[0172]
在下一步中,使用引物mpra_sfii(seq id no 13)和mpra_r3(seq id no 14)和hf缓冲液中的infusion dna聚合酶通过pcr扩增含有cdna区(15μl rt反应)和质粒文库dna区
(1ng)的条形码(最终体积为60μl)。
[0173]
pcr条件:
[0174]
95℃2分钟
[0175]
98℃30秒、55℃30秒、72℃30秒,进行25个循环
[0176]
72℃2分钟
[0177]
pcr反应使用0.8xagencourt ampure磁珠纯化剂纯化,并在30μl水中洗脱。将适量的pcr产物加载到miseq上进行26-bp单端(single read)测序。对于每个样本,获得了超过30个mio读长。根据这些数据,转染的原生质体的rna以及转染的质粒dna文库中每个条形码的频率被推导出来。rna中的条形码丰度与质粒文库dna中的丰度之比是与特定条形码相连的测试序列的增强表达活性的量度。由于每个测试序列与5个不同的条形码连接,因此每个测试序列具有5个rna/dna比率。中值用作测试序列的增强子活性的量度。配对t检验用于检验特定序列表达增加的显著性(p《0.05)。
[0178]
表1:对照序列的已知增强子作用与mpra表达文库中观察到的rna/dna比率的比较。
[0179][0180]
对照序列的结果(参见表1)显示35s增强子和almt1 3'序列具有高rna/dna比率,分别约为20和5,而非功能性almt1 5'和λ绝缘子序列具有远低于1的rna/dna比率。这表明rna/dna比率与这些对照序列的已知增强子活性一致。
[0181]
表2显示了7个查询序列,其rna/dna比率高于小麦almt1 3'增强子的rna/dna比率,并且不含有小麦基因组中以高拷贝数存在的序列。
[0182]
具有最高rna/dna比率的2个小麦序列(en2968和en4730)是来自1,2-二羟基-3-酮-5-甲基硫戊烯双加氧酶基因的b和d等位基因的启动子的重叠片段(参见图2中的比对)。
[0183]
列出的序列还包括来自d基因组焦磷酸激活液泡膜质子泵基因的3个序列:1个启动子序列(en5458)和2个重叠20nt的内含子序列(en1390和en1391)。
[0184]
表2:通过转染小麦原生质体验证增强子活性的mpra查询序列的列表。如果元件来自相同的基因或亚基因组变体,则用灰色背景标记。序列坐标包括3个字段,用_分开:
[0185]-字段1,prom:启动子,itr1:第一内含子
[0186]-字段2,iwgsc基因组注释
[0187]-字段3,序列的染色体和坐标。
[0188][0189][0190]
实施例2:小麦原生质体中增强子序列的验证
[0191]
表2中列出的所有144-nt长序列,加上en4730的前80nt(与en2968同源的区域)和组合的en1390+en1391序列被克隆到质粒pbay01697中最小35s启动子和gus编码序列的上游,用于在小麦原生质体中的验证。将所得质粒引入小麦叶肉原生质体中,提取蛋白质并在原生质体孵育过夜后确定gus活性。为了校正引入效率的差异,将转染的小麦原生质体的gus活性除以来自共同引入的对照载体的萤光素酶活性,所述对照载体具有受玉米泛素启动子(pka63,seq id no 15)控制的萤火虫萤光素酶基因。小麦原生质体的制备和小麦原生质体的peg转染按照shang等人(2014,nature protocols 9(10),2395-2410)进行。
[0192]
结果数据表明,大多数候选增强子有效地增加了最小35s启动子的表达(图3)。从1,2-二羟基-3-酮-5-甲基硫戊烯双加氧酶启动子片段中,代表2个mpra序列(en4730(nt 1-80))之间重叠序列的80-nt片段显示出最大的增强子活性(图3b),并被选中进行进一步验证。从焦磷酸激活液泡膜质子泵基因的2个内含子序列中,en1390显示出很强的增强子活性,而en1391没有增加进一步的活性(图3c)。
[0193]
实施例3:小麦增强子对小麦启动子活性的影响
[0194]
基于图3的结果,选择对最小35s启动子活性影响最大的5个增强子片段用于测试7a海藻糖-6-磷酸磷酸酶(t6pp)基因(wo/2018/113702,seq id no.23)的1-kb启动子片段。增强子片段插入翻译起始密码子上游200nt。
[0195]
图4中的数据显示,每个测试的增强子片段都将t6pp启动子的表达增加了7倍以上,其中en5458的影响最大。en5458显示出明显高于先前表征的almt1b增强子的表达增加(图5,ep 19173869.9)。
[0196]
这些结果表明,这些增强子片段中的每一个都可用于通过将增强子插入启动子内的适当位置来增加小麦启动子的表达。
[0197]
对于这些增强子中的2个(en5458,seq id no:17,和en1390,seq id no:16),还测试了当将上述两个增强子插入到小麦7a海藻糖-6-磷酸磷酸酶启动子内的2个额外位置(相对于翻译起始位点在-397和-676处)时,对所述启动子的影响。
[0198]
当插入到这些位点时,两种增强子都增加了启动子的活性,但程度低于在翻译起始位点上游200nt插入时的程度(图6)。
[0199]
实施例4:小麦增强子的取向对小麦启动子活性的影响
[0200]
两种增强子(en5458,seq id no:17和en1390,seq id no:16)以相反方向插入小麦t6pp基因的启动子中。两种增强子都保持功能,即小麦启动子的增加的表达(图7)。
[0201]
实施例5:小麦增强子的复制对小麦启动子活性的影响
[0202]
已将两种增强子(en5458,seq id no:17和en1390,seq id no:16)各自以复制的方式插入,即在小麦t6pp基因的启动子的一个位置插入两次所述增强子。对于两种增强子,与仅将一种增强子插入相同启动子时相比,复制显著增加了它们的活性(图8)。
[0203]
实施例6:映射增强子序列内的功能元件的mpra实验
[0204]
合成了一个mpra文库,其中含有选定的增强子序列(en1390和en5458)及其各自单核苷酸突变体,以及2个阳性(35s增强子和almt13')和2个阴性(almt1 5'和λ绝缘子片段)对照序列。每个序列与19个不同的条形码连接。这些序列被克隆到质粒文库中,其中增强子序列位于最小35s启动子的上游,条形码位于gus基因的下游,所述gus基因在最小35s启动子的控制下,并带有连接的增强子。将质粒文库转染到小麦原生质体中,并将表达的rna中的条形码频率与质粒文库中的条形码频率进行比较,作为连接的增强子序列的活性的量度。基于这些结果,序列基序选自en1390和en5458。
[0205]
其中影响en1390增强子活性的基序和突变:
[0206]
两个基序已被鉴定为包含增强子活性的最重要位置:
[0207]-第一基序:gataag,对应于seq id no:16的第65至70位核苷酸的核苷酸。
[0208]-第二基序:atctgtcactgacgtgt(seq id no:24),对应于seq id no:16的第81至87位核苷酸的核苷酸。
[0209]
因此,当seq id no:16的片段包含对应于seq id no:16的第65至70位核苷酸的核苷酸的第一基序、对应于seq id no:16的第81至87位核苷酸的核苷酸的第二基序或两个基序时,它是有功能的。
[0210]
一些突变对增强子活性有消极影响。在第一基序中,与以下seq id no:16中的替换之一相比,增强子活性降低:用a或c核苷酸替换seq id no:16的第65位核苷酸、用任何其
他核苷酸(c、g或t)替换seq id no:16的第66或67位核苷酸、用c核苷酸替换seq id no:16的第68位核苷酸、或用t或c核苷酸替换seq id no:16的第69位核苷酸。在第二基序中,与以下seq id no:16中的替换之一相比,增强子活性降低:用t或c核苷酸替换seq id no:16的第81位核苷酸、用a或t核苷酸替换seq id no:16的第83位核苷酸、用任何其他核苷酸(c、g或a)替换seq id no:16的第84位核苷酸、用t或c核苷酸替换seq id no:16的第85位核苷酸、用a或c核苷酸替换seq id no:16的第86位核苷酸、用g或c核苷酸替换seq id no:16的第90位核苷酸、用a或c核苷酸替换seq id no:16的第91位核苷酸、用任何其他核苷酸(g、t或c)替换seq id no:16的第92位核苷酸、用a或g核苷酸替换seq id no:16的第93位核苷酸、用任何其他核苷酸(a、c或t)替换seq id no:16的第94位核苷酸、用a或g核苷酸替换seq id no:16的第95位核苷酸、用a或c核苷酸替换seq id no:16的第96位核苷酸、或用a或c核苷酸替换seq id no:16的第97位核苷酸。
[0211]
然而,一些突变表现出对增强子活性的积极影响。在第一基序中,与用t或a核苷酸替换seq id no:16的第70位核苷酸的之一相比,增强子活性增加。在第二基序中,与以下seq id no:16中的替换之一相比,增强子活性增加:用c核苷酸替换seq id no:16的第82位核苷酸、用g核苷酸替换seq id no:16的第83位核苷酸、用g核苷酸替换seq id no:16的第86位核苷酸、用g核苷酸替换seq id no:16的第87位核苷酸、用g或c核苷酸替换seq id no:16的第88位核苷酸、用a核苷酸替换seq id no:16的第89位核苷酸、用t核苷酸替换seq id no:16的第91位核苷酸、用g核苷酸替换seq id no:16的第97位核苷酸。
[0212]
其中影响en5458增强子活性的基序和突变:
[0213]
一个基序已被鉴定为包含增强子活性的最重要位置:gatagaaccagctcgtcatcgccagc(seq id no:25),对应于seq id no:17的第58至83位核苷酸。
[0214]
因此,当seq id no:17的片段包含对应于seq id no:17的第58至83位核苷酸的该基序时,它是有功能的。
[0215]
一些突变对增强子活性有消极影响。与以下seq id no:17中的替换之一相比,增强子活性降低:用a或c核苷酸替换seq id no:17的第58位核苷酸、用任何其他核苷酸(t、c或g)替换seq id no:17的第59位核苷酸、用g或c核苷酸替换seq id no:17的第60位核苷酸、用c核苷酸替换seq id no:17的第61位核苷酸、用t或c核苷酸替换seq id no:17的第62位核苷酸、用t核苷酸替换seq id no:17的第64位核苷酸、用g核苷酸替换seq id no:17的第65位核苷酸、用a或g核苷酸替换seq id no:17的第66位核苷酸、用g核苷酸替换seq id no:17的第69位核苷酸、用g或c核苷酸替换seq id no:17的第70位核苷酸、用t或c核苷酸替换seq id no:17的第72位核苷酸、用a或c核苷酸替换seq id no:17的第73位核苷酸、用任何其他核苷酸(g、a或t)替换seq id no:17的第74位核苷酸、用g或c核苷酸替换seq id no:17的第75位核苷酸、用a核苷酸替换seq id no:17的第76位核苷酸、用c核苷酸替换seq id no:17的第78位核苷酸、用g或c核苷酸替换seq id no:17的第79位核苷酸、用a核苷酸替换seq id no:17的第80位核苷酸、用g或t核苷酸替换seq id no:17的第81位核苷酸、或用t或c核苷酸替换seq id no:17的第82位核苷酸、用g核苷酸替换seq id no:17的第83位核苷酸。
[0216]
一些突变对增强子活性有积极影响。与以下seq id no:17中的替换之一相比,增
强子活性增加:用g或c核苷酸替换seq id no:17的第63位核苷酸、用g或c核苷酸替换seq id no:17的第64位核苷酸、用g或c核苷酸替换seq id no:17的第67位核苷酸、用a或t核苷酸替换seq id no:18的第68位核苷酸、用a核苷酸替换seq id no:17的第70位核苷酸、或用a或t核苷酸替换seq id no:17的第71位核苷酸。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1