测定亚硫酸氢盐全局转化率的方法
测定亚硫酸氢盐全局转化率的方法
发明领域
1.本发明属于分子生物学领域,尤其涉及生物样品中核酸特征的测量。本发明涉及在亚硫酸氢盐将非甲基化胞嘧啶转化为尿嘧啶期间研究核酸化学修饰的方法,以及在此类方法中有用的部件试剂盒。
2.发明背景
3.表观遗传学研究基因表达中的可遗传修饰,这些修饰不通过dna序列的变化来描述,而是通过不同的dna碱基修饰和组蛋白改变来描述。dna甲基化是一种表观遗传修饰,其中甲基共价添加到胞嘧啶的5'碳上。尤其是胞嘧啶甲基化主要出现在动物的胞嘧啶-鸟嘌呤二核苷酸(5'-cpg-3')中,是研究最广泛的表观遗传学标记,因为它在基因调节、衰老、印迹、x染色体失活、疾病发展、癌症和重复dna区域沉默等方面起着重要作用。
4.为了用分子技术研究dna甲基化,cpg甲基化差异需要翻译为dna序列的改变。为了实现这一点,大多数技术使用亚硫酸氢钠(nahso3)的独特性质。在亚硫酸氢盐处理期间,非甲基化胞嘧啶转化为尿嘧啶,而甲基化胞嘧啶保持完整。随后的pcr扩增用胸腺嘧啶取代尿嘧啶,使表观遗传修饰可以检测为c/t改变。该方案于1992年开发,并成为dna甲基化研究的金标准,因为它可以在化学上区分甲基化和非甲基化胞嘧啶碱基。
5.尽管亚硫酸氢盐处理能力强大,但它本身存在一些影响下游分析的关键缺点。它使用苛刻的化学条件和高温,导致dna片段化和dna丢失。几项比较不同市售试剂盒的研究得出的结论是其性能取决于处理时间和过程中使用的初始dna量。此类试剂盒的制造商大多声称,样品dna中所有非甲基化胞嘧啶完全转化(》99%转化率),dna降解率极低(》80%dna回收率)。对于研究人员来说,目前还没有能够同时实际评估这些数字的方法。
6.自然,由于亚硫酸氢盐pcr扩增偏差,缺乏转化dna量和质量的信息可能会影响dna甲基化的准确检测,这在很大程度上取决于用作pcr反应模板的亚硫酸氢盐dna量。此外,每个转化试剂盒都有不同的方案,主要是关于亚硫酸氢盐转化反应的孵育时间和温度,这会导致不同水平的转化效率、dna回收和dna片段化。亚硫酸氢盐的转化x效率应接近100%(如果不是100%),以避免假阳性结果。dna回收率也应该准确地知道,以便确保最佳pcr条件。最后,还应计算dna片段化,以避免假阴性pcr结果。
7.亚硫酸氢盐pcr(即亚硫酸氢盐转化后的pcr反应)和下游分析中未知dna输入的问题非常大,因为它会直接影响检测到的dna甲基化水平,基于亚硫酸氢盐dna的分析的再现性/稳健性,以及基于健康和疾病研究和应用中检测到的dna甲基化水平的研究结果的最终统计评估。研究表明,随着亚硫酸氢盐dna起始量的减少,测得的dna甲基化的95%置信区间变宽,当使用有限的dna量时,这可能非常关键,例如在医学领域的常见ffpe样品和法医学的微量证据中。
8.如前所述,目前还没有准确的方法来评估亚硫酸氢盐转化dna的数量和质量。尽管存在一些评估亚硫酸氢盐转化dna数量的方法(例如nanodrop分光光度计(thermofisher,美国)、qubit荧光计(thermofisher)和bioanalyzer(agilent,美国)rna模式),这些方法都不是专门针对亚硫酸氢盐转化的dna开发的,但一些研究人员使用这些仪器的rna模式,因
为转化的dna预计主要是单链的。实际上,目前还没有评估亚硫酸氢盐dna样品转化效率的仪器/方法。
9.到目前为止,还没有能够同时准确评估亚硫酸氢盐转化dna质量和数量的组合方法。
10.因此,本发明的目的是提供可用于评估亚硫酸氢盐转化dna的数量和/或质量的方法和手段。此外,本发明的目的是提供评估亚硫酸氢盐转化dna的亚硫酸氢盐转化效率,优选基于基因组dna样品的方法和手段。
11.发明概述
12.发明人现已发现了评估亚硫酸氢盐转化dna质量和/或数量的方法和手段。更具体地,发明人发现了一种通过确定重复dna序列的数百个拷贝的亚硫酸氢盐转化状态(即亚硫酸氢盐转化/未转化比),并通过比较所述重复dna序列的亚硫酸氢盐转化和亚硫酸氢盐未转化拷贝的量,来确定全局(全基因组)亚硫酸氢盐转化效率的方法。此外,发明人还建立了同时测定全局亚硫酸氢盐转化效率、亚硫酸氢盐转化dna数量、亚硫酸氢盐转化后的dna片段化水平以及可能的pcr抑制水平的方法。这些方法使用qpcr。
13.因此,本发明在第一方面提供了一种在基因组dna样品中非甲基化胞嘧啶亚硫酸氢盐转化为尿嘧啶之后测定亚硫酸氢盐转化效率的方法,该方法包括以下步骤:
14.a)提供经亚硫酸氢盐处理的基因组dna样品,所述基因组dna包含作为重复dna元件的多拷贝靶dna序列,其中所述亚硫酸氢盐处理将所述重复dna元件序列中的非甲基化胞嘧啶转化为尿嘧啶,从而生成所述重复dna元件的亚硫酸氢盐转化拷贝;
15.b)提供第一组扩增引物,用于通过qpcr扩增所述亚硫酸氢盐处理的基因组dna样品中存在的所述重复dna元件的亚硫酸氢盐转化拷贝,并用于生成第一扩增子,以及提供标记有第一可检测标签的第一检测探针,用于通过qpcr检测所述第一扩增子;
16.c)提供第二组扩增引物,用于通过qpcr扩增存在于所述亚硫酸氢盐处理的基因组dna中的所述重复dna元件的未转化拷贝,并用于生成第二扩增子,以及提供用第二可检测标签标记的第二检测探针,用于通过qpcr检测所述第二扩增子;
17.d)使用所述第一组和第二组扩增引物和探针进行多重qpcr,并使用所述亚硫酸氢盐处理的基因组dna样品作为pcr模板,用所述第一组引物从所述亚硫酸氢盐处理的基因组dna样品中存在的所述重复dna元件的转化拷贝生成所述第一扩增子,以及用所述第二引物组从所述亚硫酸氢盐处理的基因组dna样品中存在的所述重复dna元件的未转化拷贝生成所述第二扩增子;
18.e)可任选地,提供用于确定所述亚硫酸氢盐处理的基因组dna样品中存在的重复dna元件(在步骤d)的多重qpcr前存在)的转化拷贝量的第一qpcr标准曲线,以及提供用于确定所述亚硫酸氢盐处理的基因组dna样品中存在的所述重复dna元件(在步骤d)的多重qpcr前存在)的未转化拷贝量的第二qpcr标准曲线,其中所述第一和第二标准曲线通过对参考样品进行多重qpcr获得,该参考样品作为pcr模板包含已知量的(i)第一合成dna标准,其由寡核苷酸组成,所述寡核苷酸包括与所述第一检测探针互补的探针结合侧,其侧接与所述第一组扩增引物互补的引物结合侧,优选寡核苷酸长度(以碱基计)等于所述第一扩增子(
±
5-30碱基),优选所述引物结合侧位于所述寡核苷酸的5
′
端和3
′
端,优选所述第一合成dna标准由具有所述第一扩增子的核苷酸序列的寡核苷酸组成,和(ii)由寡核苷酸组成
的第二合成dna标准物,所述寡核苷酸包括与所述第二检测探针互补的探针结合侧,其侧接与所述第二组扩增引物互补的引物结合侧,优选寡核苷酸长度(以碱基计)等于所述第二扩增子(
±
5-30碱基),优选所述引物结合侧位于所述寡核苷酸的5
′
端和3
′
端,优选所述第二合成dna标准由具有所述第二扩增子的核苷酸序列的寡核苷酸组成,
19.优选其中所述第一组扩增引物和所述第一检测探针用于通过qpcr对所述第一合成dna标准进行扩增和定量,并且其中所述第二组扩增引物和所述第二检测探针用于通过qpcr对所述第二合成dna标准进行扩增和定量;
20.f)基于在步骤d)中分别产生的所述第一和第二扩增子,并任选基于在步骤e)中提供的所述第一和第二qpcr标准曲线,确定所述亚硫酸氢盐处理的基因组dna样品中所述重复dna元件的转化和未转化拷贝的量或浓度;
21.g)基于在步骤f)中确定的所述亚硫酸氢盐处理的基因组dna样品中存在的所述重复dna元件的转化和未转化拷贝的量或浓度之间的比值,计算所述亚硫酸氢盐处理的亚硫酸氢盐转化效率。
22.在优选实施方式中,本发明提供了一种在基因组dna样品中的非甲基化胞嘧啶亚硫酸氢盐转化为尿嘧啶之后测定亚硫酸氢盐转化效率的方法,该方法包括以下步骤:
23.a)提供经亚硫酸氢盐处理的基因组dna样品,所述基因组dna包含作为重复dna元件的多拷贝靶dna序列,其中所述亚硫酸氢盐处理将所述重复dna元件序列中的非甲基化胞嘧啶转化为尿嘧啶,从而生成所述重复dna元件的亚硫酸氢盐转化拷贝;
24.b)提供第一组扩增引物,用于通过qpcr扩增所述亚硫酸氢盐处理的基因组dna样品中存在的所述重复dna元件的亚硫酸氢盐转化拷贝,并用于生成第一扩增子,以及提供标记有第一可检测标签的第一检测探针,用于通过qpcr检测所述第一扩增子;
25.c)提供第二组扩增引物,用于通过qpcr扩增存在于所述亚硫酸氢盐处理的基因组dna中的所述重复dna元件的未转化拷贝,并用于生成第二扩增子,以及提供用第二可检测标签标记的第二检测探针,用于通过qpcr检测所述第二扩增子;
26.d)使用所述第一组和第二组扩增引物和探针进行多重qpcr,并使用所述亚硫酸氢盐处理的基因组dna样品作为pcr模板,用所述第一组引物从所述亚硫酸氢盐处理的基因组dna样品中存在的所述重复dna元件的转化拷贝生成所述第一扩增子,以及用所述第二引物组从所述亚硫酸氢盐处理的基因组dna样品中存在的所述重复dna元件的未转化拷贝生成所述第二扩增子;
27.e)提供用于确定所述亚硫酸氢盐处理的基因组dna样品中存在的重复dna元件(在步骤d)的多重qpcr前存在)的转化拷贝量的第一qpcr标准曲线,以及提供用于确定所述亚硫酸氢盐处理的基因组dna样品中存在的所述重复dna元件(在步骤d)的多重qpcr前存在)的未转化拷贝量的第二qpcr标准曲线,其中所述第一和第二标准曲线通过对参考样品进行多重qpcr获得,该参考样品作为pcr模板包含已知量的(i)第一合成dna标准,其由寡核苷酸组成,所述寡核苷酸包括与所述第一检测探针互补的探针结合侧,其侧接与所述第一组扩增引物互补的引物结合侧,优选寡核苷酸长度(以碱基计)等于所述第一扩增子(
±
5-30碱基),优选所述引物结合侧位于所述寡核苷酸的5
′
端和3
′
端,优选所述第一合成dna标准由具有所述第一扩增子的核苷酸序列的寡核苷酸组成,和(ii)由寡核苷酸组成的第二合成dna标准,所述寡核苷酸包括与所述第二检测探针互补的探针结合侧,其侧接与所述第二组
扩增引物互补的引物结合侧,优选寡核苷酸长度(以碱基计)等于所述第二扩增子(
±
5-30碱基),优选所述引物结合侧位于所述寡核苷酸的5
′
端和3
′
端,优选所述第二合成dna标准由具有所述第二扩增子的核苷酸序列的寡核苷酸组成,优选其中所述第一组扩增引物和所述第一检测探针用于通过qpcr对所述第一合成dna标准进行扩增和定量,并且其中所述第二组扩增引物和所述第二检测探针用于通过qpcr对所述第二合成dna标准进行扩增和定量;
28.f)基于在步骤d)中分别产生的所述第一和第二扩增子,并基于在步骤e)中提供的所述第一和第二qpcr标准曲线,确定所述亚硫酸氢盐处理的基因组dna样品中所述重复dna元件的转化和未转化拷贝的量或浓度;
29.g)基于在步骤f)中确定的所述亚硫酸氢盐处理的基因组dna样品中存在的所述重复dna元件的转化和未转化拷贝的量或浓度之间的比值,计算所述亚硫酸氢盐处理的亚硫酸氢盐转化效率。
30.在另选实施方式中,本发明提供了一种在基因组dna样品中的非甲基化胞嘧啶亚硫酸氢盐转化为尿嘧啶之后测定亚硫酸氢盐转化效率的方法,该方法包括以下步骤:
[0031]-提供经亚硫酸氢盐处理以将非甲基化胞嘧啶转化为尿嘧啶的模板基因组dna样品,所述dna样品包含作为重复dna元件的多拷贝靶dna序列;
[0032]-提供第一组扩增引物,用于通过qpcr扩增所述重复dna元件的亚硫酸氢盐转化拷贝,并用于产生第一扩增子,以及提供用第一可检测标签标记的第一检测探针,用于通过qpcr检测所述第一扩增子;
[0033]-提供第二组扩增引物,用于通过qpcr扩增所述重复dna元件的未转化拷贝,并用于产生第二扩增子,以及提供用第二可检测标签标记的第二检测探针,用于通过qpcr检测所述第二扩增子;
[0034]-使用所述第一组和第二组扩增引物和探针进行多重qpcr,从而用所述第一组引物产生所述第一扩增子,如果存在未转化的拷贝,则用所述第二组引物产生所述第二扩增子;-可任选地,提供用于确定所述亚硫酸氢盐处理的基因组dna样品中存在的重复dna元件的亚硫酸氢盐转化拷贝量或所述第一扩增子的最初模板数量或浓度(在步骤d)的多重qpcr前存在)的第一qpcr标准曲线,以及提供用于确定所述亚硫酸氢盐处理的基因组dna样品中存在的所述重复dna元件的未转化拷贝量或确定所述第二扩增子最初模板数量或浓度(在步骤d)的多重qpcr前存在)的第二qpcr标准曲线,其中所述第一和第二标准曲线通过对参考样品进行多重qpcr获得,该参考样品作为pcr模板包含已知量的(i)第一合成dna标准,其由寡核苷酸组成,所述寡核苷酸包括与所述第一检测探针互补的探针结合侧,其侧接与所述第一组扩增引物互补的引物结合侧,优选寡核苷酸长度(以碱基计)等于所述第一扩增子(
±
5-30碱基),优选所述引物结合侧位于所述寡核苷酸的5
′
端和3
′
端,优选所述第一合成dna标准由具有所述第一扩增子的核苷酸序列的寡核苷酸组成,和(ii)由寡核苷酸组成的第二合成dna标准,所述寡核苷酸包括与所述第二检测探针互补的探针结合侧,其侧接与所述第二组扩增引物互补的引物结合侧,
[0035]
优选寡核苷酸长度(以碱基计)等于所述第二扩增子(
±
5-30碱基),优选所述引物结合侧位于所述寡核苷酸的5
′
端和3
′
端,优选所述第二合成dna标准由具有所述第二扩增子的核苷酸序列的寡核苷酸组成,
[0036]
优选其中所述第一组扩增引物和所述第一检测探针用于通过qpcr对所述第一合成dna标准进行扩增和定量,并且其中所述第二组扩增引物和所述第二检测探针用于通过qpcr对所述第二合成dna标准进行扩增和定量;
[0037]-可任选基于所述第一和第二qpcr标准曲线,优选基于qpcr cq值,确定所述亚硫酸氢盐处理的基因组dna样品中所述第一扩增子和所述第二扩增子的初始模板的量或浓度,以及通过比较所述第一和第二扩增子的所述量来计算亚硫酸氢盐处理的亚硫酸氢盐转化效率。
[0038]
优选在本发明的方法中,独立于在亚硫酸氢盐处理的基因组dna样品上进行的qpcr反应制作标准曲线,但优选使用来自单个批次的qpcr反应物(例如,优选地使用与除样品dna外的所有定量pcr组分相同的qpcr主混合物,并使用相同的引物和探针混合物)。因此,在本发明的优选实施方式中,参考样品上的多重qpcr独立于亚硫酸氢盐处理的基因组dna样品上的多重qpcr进行。
[0039]
在优选实施方式中,所述重复dna元件是长散在核元件(line),优选l1重复元件(line1)。
[0040]
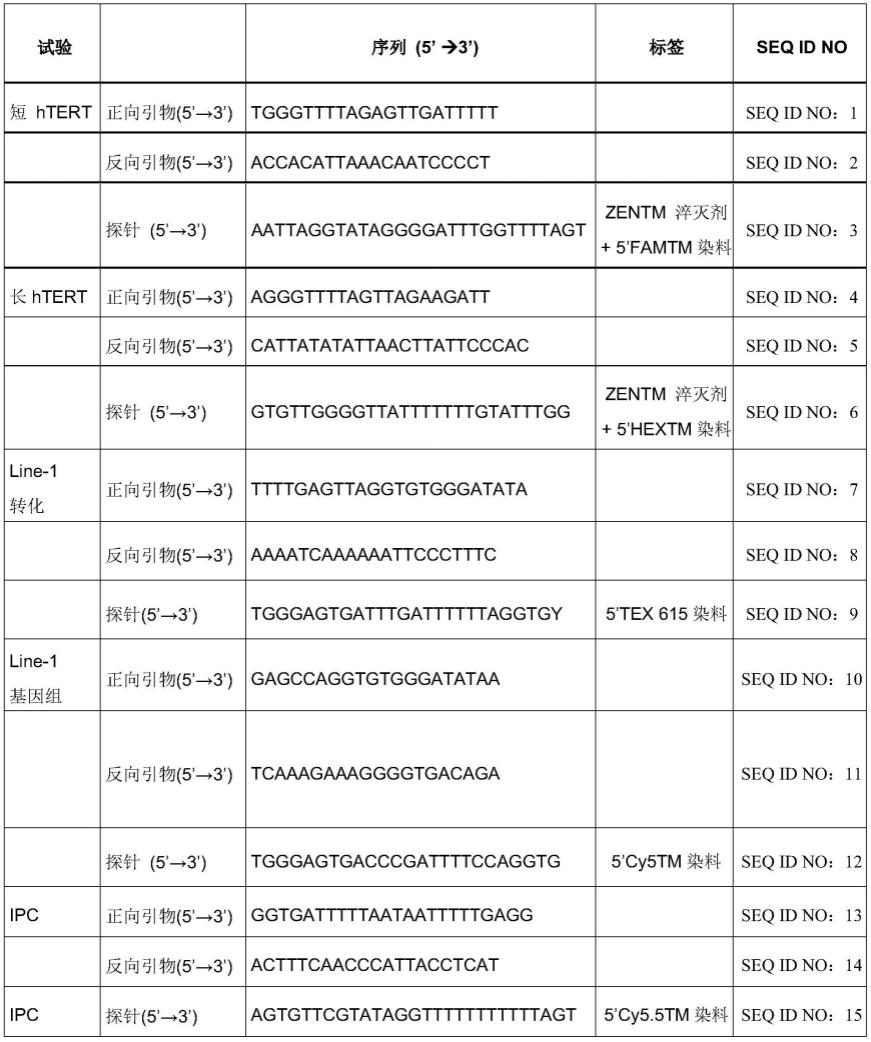
在另一优选实施方式中,所述第一组扩增引物包括包含seq id no:7核苷酸序列的正向引物和包含seq id no:8核苷酸序列的反向引物;并且任选地,其中第一检测探针包含seq id no:9的核苷酸序列。
[0041]
在另一优选实施方式中,所述第二组扩增引物包括包含seq id no:10核苷酸序列的正向引物和包含seq id no:11核苷酸序列的反向引物;并且任选地,其中第二检测探针包含seq id no:12的核苷酸序列。
[0042]
在另一种优选实施方式中,所述第一合成dna标准为seq id no:18的序列,所述第二合成dna标准为seq id no:19的序列。
[0043]
在又一优选实施方式中,亚硫酸氢盐转化效率使用以下公式计算:(所述亚硫酸氢盐处理的基因组dna样品中存在的所述重复dna元件的转化拷贝的数量或浓度)/(所述亚硫酸氢盐处理的基因组dna样品中存在的所述重复dna元件的转化拷贝的数量或浓度+所述亚硫酸氢盐处理的基因组dna样品中存在的所述重复dna元件的未转化拷贝的数量或浓度)。
[0044]
在又一优选实施方式中,第一可检测标签是tex616和/或第二可检测标签是cy5。
[0045]
在又一优选实施方式中,所述方法是用于同时测定亚硫酸氢盐转化效率、亚硫酸氢盐转化dna量和亚硫酸氢盐转化后dna片段化水平的方法;其中所述亚硫酸氢盐处理的基因组dna样品还包含单拷贝基因序列,所述方法还包括以下步骤:
[0046]
h)提供第三组扩增引物,用于通过qpcr扩增亚硫酸氢盐转化的所述单拷贝基因序列的至少一部分,并用于产生第三扩增子;和用第三可检测标签标记的第三检测探针,用于通过qpcr检测所述第三扩增子;
[0047]
i)提供第四组扩增引物,用于通过qpcr扩增亚硫酸氢盐转化的所述单拷贝基因序列的至少一部分,并用于产生第四扩增子,以及用第四可检测标签标记的第四检测探针,用于通过qpcr检测所述第四扩增子,其中第三组和第四组扩增引物的设计使得所述第四扩增子的长度(单位为bp)大于所述第三扩增子的长度(单位为bp),优选其中第三扩增子长度约为30-100bp,和优选其中第四扩增子长度在150-500bp之间;
[0048]
j)执行步骤d)的多重qpcr,其进一步包括所述第三和第四组引物和探针,从而进
一步用所述第三组引物产生所述第三扩增子和用所述第四组引物产生所述第四扩增子;
[0049]
k)任选地,提供用于确定所述亚硫酸氢盐处理的基因组dna样品中存在的所述单拷贝基因序列的转化和可任选片段化的拷贝数(在步骤d)的多重qpcr前存在)的第三qpcr标准曲线,以及提供用于确定所述亚硫酸氢盐处理的基因组dna样品中存在的所述单拷贝基因序列的转化和非片段化拷贝数(在步骤d)的多重qpcr前存在)的第四qpcr标准曲线,其中,所述第三和第四标准曲线是通过对参考样品进行多重qpcr获得的,该参考样品作为pcr模板包括已知量的(iii)由寡核苷酸组成的第三合成dna标准,所述寡核苷酸包括与所述第三检测探针互补的探针结合侧,其侧接与所述第三组扩增引物互补的引物结合侧,优选寡核苷酸长度(以碱基计)等于所述第三扩增子(
±
5-30碱基),优选所述引物结合侧位于所述寡核苷酸的5
′
端和3
′
端,优选所述第三合成dna标准由具有所述第三扩增子的核苷酸序列的寡核苷酸组成,和(iv)由寡核苷酸组成的第四合成dna标准,所述寡核苷酸包括与所述第四检测探针互补的探针结合侧,其侧接与所述第四组扩增引物互补的引物结合侧,优选寡核苷酸长度(以碱基计)等于所述第四扩增子(
±
5-30碱基),优选所述引物结合侧位于所述寡核苷酸的5
′
端和3
′
端,优选所述第四合成dna标准由具有所述第四扩增子的核苷酸序列的寡核苷酸组成,
[0050]
优选其中所述第三组扩增引物和所述第三检测探针用于通过qpcr对所述第三合成dna标准进行扩增和定量,并且其中所述第四组扩增引物和所述第四检测探针用于通过qpcr对所述第四合成dna标准进行扩增和定量;
[0051]
l)基于所述第三扩增子的产生,优选基于qpcr cq值确定所述亚硫酸氢盐处理的基因组dna样品中所述单拷贝基因序列的转化和可任选片段化拷贝的数量或浓度,从而提供在所述亚硫酸氢盐处理的基因组dna样品中亚硫酸氢盐转化的dna量,
[0052]
m)基于所述第四扩增子的产生,优选基于qpcr cq值,确定所述经亚硫酸氢盐处理的基因组dna样品中存在的所述单拷贝基因序列的转化和非片段化拷贝的数量或浓度,并通过将所述经亚硫酸氢盐处理的基因组dna样品中所述经转化和可任选片段化拷贝的测定量与所述经亚硫酸氢盐处理的基因组dna样品中存在的经转化和非片段化拷贝的量进行比较,提供亚硫酸氢盐转化后的dna片段化水平;
[0053]
n)任选地,其中确定所述亚硫酸氢盐处理的基因组dna样品中存在的所述单拷贝基因序列的转化和任选片段化拷贝的数量或浓度的步骤,以及确定所述亚硫酸氢盐处理的基因组dna样品中存在的所述单拷贝基因序列的转化和非片段化拷贝的数量或浓度的步骤基于所述第三和第四qpcr标准曲线。
[0054]
在又一优选实施方式中,本发明提供了如上所述的方法,其中所述方法是用于同时测定亚硫酸氢盐转化效率、亚硫酸氢盐转化dna量和亚硫酸氢盐转化后dna片段化水平的方法;其中所述亚硫酸氢盐处理的基因组dna样品进一步包含单拷贝基因序列,所述方法进一步包括以下步骤:
[0055]
h)提供第三组扩增引物,用于通过qpcr扩增亚硫酸氢盐转化的所述单拷贝基因序列的至少一部分,并用于产生第三扩增子;和用第三可检测标签标记的第三检测探针,用于通过qpcr检测所述第三扩增子;
[0056]
i)提供第四组扩增引物,用于通过qpcr扩增亚硫酸氢盐转化的所述单拷贝基因序列的至少一部分,并用于产生第四扩增子,以及提供用第四可检测标签标记的第四检测探
针,用于通过qpcr检测所述第四扩增子,其中第三组和第四组扩增引物的设计使得所述第四扩增子的长度(单位为bp)大于所述第三扩增子的长度(单位为bp);
[0057]
j)执行步骤d)的多重qpcr,其进一步包括所述第三和第四组引物和探针,从而进一步用所述第三组引物产生所述第三扩增子和用所述第四组引物产生所述第四扩增子;
[0058]
k)提供用于确定所述亚硫酸氢盐处理的基因组dna样品中存在的所述单拷贝基因序列的转化和可任选片段化的拷贝数的第三qpcr标准曲线,以及提供用于确定所述亚硫酸氢盐处理的基因组dna样品中存在的所述单拷贝基因序列的转化和非片段化拷贝数的第四qpcr标准曲线,其中,所述第三和第四标准曲线是通过对参考样品进行多重qpcr获得的,该参考样品作为pcr模板包括已知量的(iii)由寡核苷酸组成的第三合成dna标准,所述寡核苷酸包括与所述第三检测探针互补的探针结合侧,其侧接与所述第三组扩增引物互补的引物结合侧,和(iv)由寡核苷酸组成的第四合成dna标准,所述寡核苷酸包括与所述第四检测探针互补的探针结合侧,其侧接与所述第四组扩增引物互补的引物结合侧;
[0059]
l)基于步骤j)中所述第三扩增子的产生,并基于步骤k)中提供的所述第三qpcr标准曲线,确定所述亚硫酸氢盐处理的基因组dna样品中所述单拷贝基因序列的转化和可任选片段化拷贝的数量或浓度,从而在所述亚硫酸氢盐处理的基因组dna样品中提供亚硫酸氢盐转化的dna量,
[0060]
m)基于步骤j)中所述第四扩增子的产生和步骤k)中提供的所述第四qpcr标准曲线,确定所述经亚硫酸氢盐处理的基因组dna样品中所述单拷贝基因序列的转化和非片段化拷贝的数量或浓度;
[0061]
n)以及通过将步骤l)和m)中确定的所述经亚硫酸氢盐处理的基因组dna样品中存在的转化和可任选片段化拷贝的数量与所述经亚硫酸氢盐处理的基因组dna样品中存在的转化和非片段化拷贝的数量进行比较,计算亚硫酸氢盐转化后dna片段化水平。
[0062]
在本发明的所有方面中,pcr终点可基于cq值或基于确定循环次数后的rfu。
[0063]
在又一优选实施方式中,第三扩增子为60-100bp,优选约85bp,并且所述第四扩增子为150-350bp,优选约235bp。
[0064]
在又一优选实施方式中,所述单拷贝基因序列是(人)端粒酶逆转录酶基因(htert)。
[0065]
在另一优选实施方式中,所述第三组扩增引物包括包含seq id no:1核苷酸序列的正向引物和包含seq id no:2核苷酸序列的反向引物;并且任选地,其中第三检测探针包含seq id no:3的核苷酸序列。
[0066]
在另一优选实施方式中,所述第四组扩增引物包括包含seq id no:4核苷酸序列的正向引物和包含seq id no:5核苷酸序列的反向引物;并且任选地,其中第四检测探针包含seq id no:6的核苷酸序列。
[0067]
在另一优选实施方式中,所述第三合成dna标准为seq id no:16的序列,所述第四合成dna标准为seq id no:17的序列。
[0068]
在另一优选实施方式中,所述第一和第二合成dna标准的量相对于所述参考样品中所述第三和第四合成dna标准的量反映了所述亚硫酸氢盐处理的基因组dna样品中基因组dna中所述重复dna元件和所述单拷贝基因序列的拷贝数之比,优选地,其中所述第一和第二合成dna标准之间的比率约为1,并且其中所述第三和第四合成dna标准之间的比率约
为1,更优选地,其中所述参考样品中所述第一、第二第三和第四合成dna标准的拷贝数之间的比率分别为200:200:1:1。
[0069]
在另一优选实施方式中,本发明提供了一种用于同时测定亚硫酸氢盐转化效率、亚硫酸氢盐转化dna量、亚硫酸氢盐转化后dna片段化水平和pcr抑制的方法,所述方法包括以下步骤:
[0070]-执行上文所述的任何方法,并进一步包括以下步骤:
[0071]-向所述经亚硫酸氢盐处理的基因组dna样品中添加已知量的人工(合成)dna序列,其中所述人工dna序列优选包含seq id no:20的核苷酸序列;
[0072]-提供第五组扩增引物,用于通过qpcr扩增所述人工dna序列并生成第五扩增子;以及用第五可检测标签标记的第五检测探针,用于通过qpcr检测所述第五扩增子;
[0073]-执行所述多重qpcr,所述多重qpcr还包括所述第五组引物和探针,从而进一步用所述第五组引物产生所述第五扩增子;
[0074]-确定所述第五扩增子的量,优选基于qpcr cq值,并通过比较所述模板亚硫酸氢盐转化dna中所述第五扩增子的测定量与不预期有抑制的dna定量标准中相应确定的所述第五扩增子的量来确定pcr抑制水平。
[0075]
在另一优选实施方式中,所述第五组扩增引物包括包含seq id no:13核苷酸序列的正向引物和包含seq id no:14核苷酸序列的反向引物;并且任选地,其中第五检测探针包含seq id no:15的核苷酸序列。
[0076]
在另一方面,本发明提供一种qpcr试剂盒,其包括
[0077]-第一组扩增引物,用于扩增作为重复dna元件的基因组多拷贝靶dna序列的亚硫酸氢盐转化拷贝,并用于生成第一扩增子;
[0078]-用第一可检测标签标记的第一检测探针,用于检测所述第一扩增子;
[0079]-第二组扩增引物,用于通过qpcr扩增所述重复dna元件的未转化拷贝,并用于产生第二扩增子;
[0080]-用第二可检测标签标记的第二检测探针,用于检测所述第二扩增子;
[0081]
其中,所述qpcr试剂盒任选地还包括:
[0082]-第三组扩增引物,用于扩增亚硫酸氢盐转化的基因组单拷贝基因序列的一部分,并用于产生第三扩增子;
[0083]-用第三可检测标签标记的第三检测探针,用于检测所述第三扩增子;
[0084]-第四组扩增引物,用于扩增亚硫酸氢盐转化的所述基因组单拷贝基因序列的一部分,并用于产生长度比所述第三扩增子长的第四扩增子;
[0085]-用第四可检测标签标记的第四检测探针,用于检测所述第四扩增子;和/或
[0086]-第五组扩增引物,用于扩增内部阳性对照dna序列并生成第五扩增子,其中优选地,所述第五组扩增引物包括包含seq id no:13核苷酸序列的正向引物和包含seq id no:14核苷酸序列的反向引物;
[0087]-用第五可检测标签标记的第五检测探针,用于通过qpcr检测所述第五扩增子,优选地,其中所述第五检测探针包含seq id no:15的核苷酸序列;
[0088]
其中,所述qpcr试剂盒任选地还包括:
[0089]-第一合成dna标准,由所述第一扩增子的核苷酸序列组成,其中所述第一合成dna
标准优选为seq id no:18的序列;
[0090]-第二合成dna标准,由所述第二扩增子的核苷酸序列组成,其中所述第二合成dna标准优选为seq id no:19的序列;和/或
[0091]-第三合成dna标准,由所述第三扩增子的核苷酸序列组成,其中所述第三合成dna标准优选为seq id no:16的序列;和/或
[0092]-第四合成dna标准,由所述第四扩增子的核苷酸序列组成,其中所述第四合成dna标准优选为seq id no:17的序列;和/或
[0093]-一种(人工的、非人)内部阳性对照dna序列,优选由seq id no:20的序列组成。
[0094]
在本发明qpcr试剂盒的优选实施方式中,所述试剂盒以组合包括:seq id no:7-9的引物和探针,其适于支持5重pcr分析,优选seq id no:1-15的引物和探针,其适于支持5重pcr分析和/或seq id no:16-19的合成dna标准,所述试剂盒任选还包括包含seq id no:20的dna序列的内部阳性对照。
[0095]
在本发明方法的优选实施方式中,第一、第二、第三、第四和第五可检测标签是不同的。
[0096]
在另一个方面,本发明提供了第一和第二合成寡核苷酸,优选作为第一合成寡核苷酸的seq id no:18或19的寡核苷酸,以及作为第二合成寡核苷酸的seq id no:16或17的寡核苷酸的用途,其在测量亚硫酸氢盐处理的基因组dna样品中亚硫酸氢盐转化效率的方法中作为dna标准;其中,所述第一合成寡核苷酸具有与重复(基因组)dna元件的亚硫酸氢盐转化拷贝的序列相对应的核苷酸序列,所述第二合成寡核苷酸具有与所述(基因组)重复dna元件的非亚硫酸氢盐转化拷贝的序列相对应的核苷酸序列。
[0097]
在另一方面,本发明提供一种核酸,优选合成寡核苷酸,其包含seq id no:1-20序列或由其组成。
[0098]
图示说明
[0099]
图1:使用浓度在50-0.39纳克/微升范围内的合成dna标准(gblocks)开发qbico方法
[0100]
(a)qbico中包括的所有五种不同的qpcr分析的扩增曲线表明所有dna标准的成功扩增,(b)示例dna标准的5重qbico分析的扩增曲线(8个dna标准中的3个基于对应于12.5ng亚硫酸氢盐dna的gblock),表明在单个反应中所有分析的协调扩增,(c)四种分析(fam、hex、tex615、cy5)的标准曲线,由用于计算样品中所有四种片段浓度的gblock混合物的稀释系列(八种标准,50-0.39ng/μl)制成(注:ipc不需要标准曲线,因为每个反应中添加相同的量10ng),(d)内部阳性对照(ipc)性能,考虑到在方法开发过程中,在六个不同的qpcr实验中,由gblock混合物稀释系列制备的所有八个合成dna标准的所有复制品,表明了分析的平均预期cq(注:如果一个样品的平均ipc cq高于八个合成标准的平均ipc加标准偏差,那么我们认为该样品经历了某种程度的pcr抑制(定性指数,是/否),(e)16个阴性对照的性能,包括无dna模板(仅ipc),表明qbico(32个循环)使用的cq阈值,以避免可能污染,(f)四种分析(短htert、长htert、line-1转化和line-1基因组、标记的、fam、hex、tex615、cy5的gblock标准品)的检测限热图(50-0.39ng/μl),基于合成dna标准品中检测到的内容,已知预期浓度表明所有片段的高灵敏度,(g)在五天的时间范围内使用相同的dna标准的分析效率,表明dna标准品是稳定的,可使用长达两天。
[0101]
图2:使用zymoresearch试剂盒估算样品亚硫酸氢盐转化效率的qbico方法验证
[0102]
(a)qbico对三种不同的亚硫酸氢盐转化dna样品(zymoresearch、epigendx和thermofisher,用于亚硫酸氢盐转化的200ng,这是最佳量)在同一次qpcr中的六个重复中测定的转化效率,表明高重复性,(b)用qbico在三次不同的qpcr运行中,使用相同的三种不同的亚硫酸氢盐转化dna样品,在三个不同的重复中测定转化效率,表明高再现性,(c)用qbico测定的亚硫酸氢盐转化dna样品(epigendx)的转化效率,该样品已在6.25-0.048ng/ul的浓度范围内连续稀释,表明高灵敏度,(d)qbico测定的一个亚硫酸氢盐转化dna样品(epigendx)的转化效率,该样品已接触七种不同浓度的血红素(0-800mol/l,一种已知的pcr抑制剂)中,表明无论是否存在可能pcr抑制,都能准确计算转化效率,(e)用qbico对亚硫酸氢盐转化dna样品(epigendx)在转化(基因组dna)之前六次不同时间(从0到60分钟)的uv初始暴露后测定的转化效率,表明由于dna降解,转化效率计算受到》1分钟的直接uv暴露的影响,(f)由qbico测定的五个亚硫酸氢盐转化样品的转化效率,其中含有不同比例的转化/非转化dna(范围为0-100%转化的dna),表明转化效率的线性定量(通过亚硫酸氢盐转化200ng的epigendx高甲基化样品产生人工混合物,分别使用line-1基因组分析物和line-1转化分析,用qbico对未转化和转化的dna浓度定量,以等浓度(2ng/μl)稀释,以各自的比例混合,并在qbico反应中使用,1μl对应于2ng)。在图2、3和4中,a图和b图下的术语dna标准指的是不同的dna样品。
[0103]
图3:使用zymoresearch试剂盒估算样品亚硫酸氢盐dna回收率的qbico方法验证
[0104]
(a)用qbico对三种不同的亚硫酸氢盐转化dna样品(zymoresearch、epigendx和thermofisher,亚硫酸氢盐转化使用200ng的最佳量)在同一qpcr运行中的六个重复中测定的亚硫酸氢盐dna回收率,表明高重复性,(b)由qbico确定的亚硫酸氢盐dna回收率,使用相同的三种不同的亚硫酸氢盐转化dna样品,在三次不同的qpcr运行中进行三次重复,表明高重复性;(c)由qbico确定的亚硫酸氢盐dna回收率,用于亚硫酸氢盐转化dna样品(epigendx),其系列稀释到浓度范围为6.25-0.048ng/ul,表明高灵敏度,(d)qbico测定的一个亚硫酸氢盐转化dna样品(epigendx)的亚硫酸氢盐dna回收率,该样品已接触七种不同浓度的血红素(0-800mol/l,一种已知的pcr抑制剂)中,表明无论是否存在可能pcr抑制,都能准确计算转化效率,(e)在(基因组dna)转化前先最初暴露uv六次不同时间(从0到60分钟不等),qbico测定的亚硫酸氢盐转化dna样品(epigendx)的亚硫酸氢盐dna回收率,表明在直接uv暴露》1分钟后,严重的dna片段化影响短片段的扩增,(f)用qbico测定的五个亚硫酸氢盐转化样品的亚硫酸氢盐dna回收率,该样品含有不同比例的转化/未转化dna,范围为0-100%转化dna,表明亚硫酸氢盐转化dna的二次多项式量化符合之前文献报告的dna序列未转化与转化形式之间的扩增偏差。人工混合物是通过亚硫酸氢盐转化200ng的epigendx高甲基化样品产生的,分别使用line-1基因组和line-1转化分析物,用qbico定量未转化和转化的dna浓度,以等浓度(2ng/μl)稀释,以各自的比例混合,并在qbico反应中使用,其1μl对应于2ng。
[0105]
图4:用zymoresearch试剂盒估算完整亚硫酸氢盐dna(≥235bp)量的qbico方法验证
[0106]
(a)用qbico对三种不同的亚硫酸氢盐转化dna样品(zymoresearch、epigendx和thermofisher,亚硫酸氢盐转化使用200ng的最佳量)在同一qpcr运行中的六个重复中测定
的完整亚硫酸氢盐dna回收率,表明中等可重复性,(b)由qbico确定的完整亚硫酸氢盐dna回收率,使用相同的三种不同的亚硫酸氢盐转化dna样品,在三次不同的qpcr运行中进行三次重复,表明中等可重复性;(c)由qbico确定的完整亚硫酸氢盐dna回收率,用于亚硫酸氢盐转化dna样品(epigendx),其系列稀释到浓度范围为6.25-0.048ng/ul,表明中等灵敏度,(d)qbico测定的一个亚硫酸氢盐转化dna样品(epigendx)的完整亚硫酸氢盐dna回收率,该样品已接触七种不同浓度的血红素(0-800mol/l,一种已知的pcr抑制剂)中,表明影响长片段扩增的可能pcr抑制,(e)在(基因组dna)转化前先最初暴露uv六次不同时间(从0到60分钟不等),qbico测定的亚硫酸氢盐转化dna样品(epigendx)的完整亚硫酸氢盐dna回收率,表明在直接uv暴露》1分钟后,与短片段相比长片段的片段化更严重。
[0107]
图5:用zymoresearch试剂盒估算样品的可能pcr抑制的qbico验证
[0108]
在qbico验证过程中,对基于gblocks(紫色)和各种亚硫酸氢盐转化的dna样品(绿色)的八种合成dna标准进行七次不同的qpcr运行,其中内部阳性对照(ipc)(每个qpcr反应中使用10ng)的性能(每次运行中的样品数量取决于每次运行中包括的实验,即一次重复性运行、三次可复制性运行、一次灵敏度运行等,不包括人工抑制样品的运行),表明在亚硫酸氢盐转化的dna样品中具有高重复性、可复制性和检测小程度可能pcr抑制的能力。
[0109]
图6:在使用三种市售dna标准评估十种不同市售亚硫酸氢盐转化试剂盒中的qbico应用
[0110]
(a)亚硫酸氢盐转化效率,(b)亚硫酸氢盐dna回收率,(c)亚硫酸氢盐dna片段化对亚硫酸氢盐转化的起始dna量(200ng、100ng、50ng、10ng、1ng),其使用qbico在十个亚硫酸氢盐转化试剂盒中检测,表明试剂盒在所有三个指标上都存在很大差异(注:在每个qpcr反应中使用1μl洗脱体积),(d)在十个亚硫酸氢盐试剂盒中的内部阳性对照(ipc)(在每个qpcr反应中添加10ng)性能,表明qbico可以指示亚硫酸氢盐转化dna样品中的可能抑制作用,但这无论如何是稀有的,且取决于试剂盒,(e)显示基于qbico分数的试剂盒排名的热图,将所有三个指数-%亚硫酸氢盐dna回收率、%亚硫酸氢盐转化率和%亚硫酸氢盐完整dna-范围在0到1之间——相乘而得。
[0111]
图7:对两种亚硫酸氢盐转化dna样品(200ng和12.5ng,epigendx)的亚硫酸氢盐dna回收率评估,qbico与其他三种常见dna定量方法的比较表明qbico的优越性能。
[0112]
其他三种dna定量方法包括1)bioanalyzer
–
agilent rna 6000pico试剂盒,2)nanodrop-rna模式,3)qubit
–
qubit ssdna分析试剂盒,并遵循其标准厂商说明。对于全部定量,使用1μl洗脱的亚硫酸氢盐转化dna量。
[0113]
发明详述
[0114]
如本文所用,术语“核酸序列”指单链或双链形式的dna或rna。
[0115]“分离的核酸序列”是指不再存在于从中分离出来的自然环境中的核酸序列。除其他外,该术语指已从至少约50%、75%、90%或更多其天然相关的(例如在微生物宿主细胞中)蛋白质、脂类、碳水化合物或其他物质分离的核酸分子。
[0116]
本文在从生物样品中分离核酸序列中使用的术语“分离”指的是从感兴趣的样品中提取核酸(优选基因组dna)的体外过程。该过程通常涉及使用胍去污剂裂解溶液裂解生物样品(中的细胞),该溶液允许选择性沉淀(细胞)裂解物中的dna,以及用乙醇沉淀裂解物中的基因组dna。乙醇洗涤后,沉淀的dna可溶解于水或8mm naoh中,并用作pcr反应的模板。
可通过使用一般已知的dna分离技术获得基因组dna样品。可通过使用例如物理和化学方法的组合来纯化总基因组dna。可以使用非常适合商用的dna分离和纯化系统。
[0117]
本文使用的术语“样品”包括尿液、唾液、痰、脓液、伤口液、粪便、皮肤液、血液、灌洗液、活检样品(优选人体样品)、或环境样品、或植物、动物或食物的样品。
[0118]
本文使用的术语“基因组dna样品”包括包含基因组dna的样品。优选将其纯化至适于在qpcr中使用的程度。换言之,优选基因组dna已至少部分地从更复杂的样品中分离出来。
[0119]
术语“经甲基化”或“甲基化”,在本文中指例如在cpg基因座或岛中的胞嘧啶的甲基化状态,通常指在胞嘧啶残基的5位存在或不存在甲基(即,特定胞嘧啶是否为5-甲基胞嘧啶)。甲基化可直接测定,例如分析胞嘧啶甲基化状态的常规方法来证明,例如通过测定特定c-残基对亚硫酸氢盐处理转化为尿嘧啶的敏感性(或缺乏敏感性)。例如,当用亚硫酸氢盐以预期如果残基未甲基化,其会转化的方式(例如,在样品中的大多数或所有非甲基化胞嘧啶转化为尿嘧啶的条件下)处理样品时,样品中未转化为尿嘧啶的胞嘧啶残基通常认为会“甲基化”。
[0120]
如本文所用,术语“cpg岛”指包含相对于平均基因组cpg发生率(每相同物种、每相同个体或每亚群体(例如,菌株、种族亚群体等))百分比更高的cpg位点的基因组dna区域。
[0121]
术语“靶标”在用于核酸检测或分析方法时,指具有待检测或分析的特定核苷酸序列的核酸,例如在怀疑含有靶核酸的样品中。
[0122]
本文使用的术语“亚硫酸氢盐转化”是指在dna中未甲基化的胞嘧啶残基转化为尿嘧啶,但甲基化的胞嘧啶残基(5-甲基胞嘧啶)不转化为尿嘧啶的条件下,用亚硫酸氢盐处理dna的过程。亚硫酸氢盐处理通常采用例如以下方法:分离基因组dna,用naoh变性,用浓缩亚硫酸氢(钠)溶液转化数小时,最后脱硫和脱盐(例如:frommer等人:一种基因组测序方案,可在单个dna链中产生5-甲基胞嘧啶残基的阳性显示(a genomic sequencing protocol that yields a positive display of5-methylcytosine residues in individual dna strands),proc natl acad sci u s a1992年3月1日;89(5):1827-31)。有多种商业试剂盒可用于dna的亚硫酸氢盐转化,包括ez dna甲基化试剂盒
tm
(zymoresearch,usa)。
[0123]
本文使用的术语“亚硫酸氢盐转化效率”指亚硫酸氢盐转化发生的效率。效率可以表示为转化拷贝与总拷贝的比例,包括(高度)多拷贝dna序列(重复dna元件)的转化拷贝和未转化拷贝。
[0124]
本文使用的术语“扩增”包括使样品中的靶核酸经历线性或指数产生与靶核酸或其区段具有相同或基本相同核苷酸序列的扩增子核酸的过程。本文所使用的术语“扩增”可指使靶核酸(例如,在包含其他核酸的样品中)经历选择性地线性或指数产生与靶核酸或其区段具有相同或基本相同核苷酸序列的扩增子核酸的过程。术语“扩增”包括提及包含聚合酶链反应(pcr)的方法,更优选qpcr。
[0125]
本文使用的术语“聚合酶链反应(pcr)”是指从模板dna(即,包含要复制的目标区域的dna)中制备特定靶dna区段的多个拷贝的众所周知的体外技术。在反应过程中,将含有靶dna、引物、dntp和热稳定dna聚合酶的混合物加热至90-95℃,以使靶dna链变性。将溶液冷却至允许引物(长约18至30个核苷酸的单链dna分子)与其在靶dna上的互补序列退火的
温度,并提供dna合成所需的3'-oh。随后,dna聚合酶通过延伸引物合成与靶互补的新dna链,通常在约72℃的温度下进行。变性/引物退火/引物延伸的热循环方案重复多次,先前循环中合成的dna作为每个后续循环的模板。结果是,每个循环的靶dna都会倍增,靶dna序列在20-40个循环内呈指数级累积。带有自动热循环仪的加热模块用于精确的温度控制。本发明中使用的优选方法是qpcr扩增(也称为实时pcr),其中通常在pcr期间(即实时)监测靶dna分子的扩增,使用插入任何双链dna的非特异性荧光染料,或用荧光报告物标记的寡核苷酸组成的序列特异性dna探针实时检测pcr产物。
[0126]
本文使用的术语“qpcr”通常指实时定量聚合酶链反应、定量聚合酶链反应或动态聚合酶链反应的pcr技术。该技术使用pcr同时扩增和定量靶核酸,其中通过插入荧光染料或序列特异性探针进行定量,所述荧光染料或序列特异性探针包含仅在与靶核酸杂交后可检测的荧光报告物分子。
[0127]
如本文所使用的术语“pcr混合物”是指用于执行pcr反应的水溶液中的小体积生化反应物,包含(基因组)模板dna,所述模板dna包含靶dna序列、一组至少两种寡核苷酸引物,所述引物与目标dna序列的相对链杂交并侧接待扩增区域,一种热稳定dna聚合酶、四种脱氧核糖核苷三磷酸盐(dntp)、mg2+离子,和优选一种用荧光报告物标记的靶序列特异性寡核苷酸(dna)探针。
[0128]
本文使用的术语“模板”是指在核酸扩增反应中扩增靶序列的核酸。本文所使用的术语“可扩增模板”是指当扩增时产生单个扩增子的模板。可扩增模板包括用于扩增引物杂交的引物结合位点。
[0129]
本文使用的术语“扩增引物”是指与靶dna序列的相对链杂交并侧接待扩增区域的寡核苷酸引物。在扩增过程中,引物退火至其在靶dna上的特定引物结合位点,当聚合酶沿着模板链以3'-5'方向移动时,引物延伸发生,导致子链以5'-3'方向形成。
[0130]
本文使用的术语“杂交”通常指不同核酸分子之间与其核苷酸序列一致的碱基配对。术语“杂交”和“退火”可以互换使用。
[0131]
本文所使用的术语“互补性”通常指在适当的温度和离子缓冲条件下,在两个核苷酸的碱基之间形成有利的热力学稳定和特异配对的能力。这种配对取决于每种核苷酸的氢键性质。最基本的例子是胸腺嘧啶/腺嘌呤和胞嘧啶/鸟嘌呤碱基之间的氢键对。
[0132]
本文中互换使用的术语“扩增产物”和“扩增子”指(通常为双链的)核酸片段,其为核酸扩增或复制事件产物,例如在聚合酶链反应(pcr)中形成的产物。本文使用的术语“pcr扩增子”指pcr产物或扩增的靶dna。
[0133]
本文使用的术语“qpcr cq值”,或简称“cq值”是指(基线校正的)扩增曲线(实时pcr反应中从pcr产物生成的荧光读数)越过任意阈值时的循环值,表示发生了靶标扩增(即通过目标拷贝数的指数增加)。
[0134]
本文使用的术语“重复dna元件”指的是在整个基因组中存在多个拷贝的dna序列。术语“重复dna元件”包括转座子,如长散在核元件(line);(非自发)小散在核元件(sine),如alu dna元件;和长末端重复(ltr)逆转录转座子。优选重复dna元件具有至少100bp、更优选地至少400bp、甚至更优选地至少1kb或更优选地至少2kb长或至少4kb、以及最优选地6-7kb的元件长度(有重复)。优选重复dna元件是(人)line,包括line1、line2和line3。最优选line是line1。
[0135]
优选所述重复dna元件在整个基因组,优选人类基因组中具有10-1000个拷贝,更优选25-800或50-800个拷贝,甚至更优选100-500个拷贝,最优选150-450个拷贝。术语“重复dna元件”可与术语“重复序列”、“重复单元”或“重复”互换使用。
[0136]
可检测荧光的循环称为定量循环(简称cq),是qpcr的基本结果:较低的cq值意味着较高的目标初始拷贝数。这是实时pcr提供的定量方法的基本原理。
[0137]
亚硫氰酸盐转化效率
[0138]
本发明的方法采用qpcr作为分析手段。qpcr是本领域中众所周知的分析方法。本发明人出乎意料地确定,特别是包含由seq id no:1-12标识的引物和探针(如果将由seq id no:20标识的内部阳性对照物(ipc)添加到qpcr混合物中,则最好将seq id no:13-15的引物和探针添加到该分析中(这可在亚硫酸氢盐处理步骤之后,以使ipc成为未转化的序列))的5重qpcr分析法可有利地用于同时测定亚硫酸氢盐转化效率、亚硫酸氢盐转化dna量、亚硫酸氢盐转化后的dna片段化水平和pcr抑制水平。这种分析组合了评估pcr反应中所有相关反应变量的可能性,以便随后研究基于亚硫酸氢盐转化dna的dna甲基化。
[0139]
众所周知亚硫酸氢盐处理通常不会产生100%的转化效率。
[0140]
优选在本发明的测定全局亚硫酸氢盐转化效率的方法中,使用两组不同的扩增引物扩增经亚硫酸氢盐处理的作为dna重复元件的目标dna序列。优选两组扩增引物至少部分扩增含有胞嘧啶残基的相同靶dna序列,当发生亚硫酸氢盐转化时,这些胞嘧啶残基转化为尿嘧啶。因此,扩增这种多拷贝基因区域的多个拷贝可以区分亚硫酸氢盐转化的拷贝和未被亚硫酸氢盐转化的拷贝。使用区分这种多拷贝dna序列的转化拷贝和未转化拷贝的引物和/或探针,可以估计全局亚硫酸氢盐转化效率。
[0141]
在本发明的方法中,基因组dna优选首先由亚硫酸氢钠进行化学修饰(亚硫酸氢钠含量为1-10m,优选约3-6m,更优选约4-5m,可任选地以焦亚硫酸钠的形式提供)。这允许产生亚硫酸氢盐转化序列差异。然后可使用与预期转化的非cpg胞嘧啶重叠的引物(两个line-1引物退火位点都包含转化的胞嘧啶,但一组提供的引物中的一个与t结合,另一组的引物中的一个与未转化的c结合(即残余基因组))。因此,可在pcr扩增过程的水平上,也可在探针杂交过程的水平上,或者两者兼而有之,进行序列鉴别。pcr扩增水平上的序列鉴别要求引物和/或探针与预期转化的可能非cpg胞嘧啶重叠。
[0142]
优选在本发明涉及测定亚硫酸氢盐转化dna样品中的全局亚硫酸氢盐转化效率的方法中,检测探针提供序列鉴别(即亚硫酸氢盐转化拷贝和未转化拷贝之间的鉴别,或换言之,第一探针对亚硫酸氢盐转化拷贝而不是亚硫酸氢盐未转化拷贝具有特异性,而第二探针对亚硫酸氢盐未转化拷贝而不是亚硫酸氢盐转化拷贝具有特异性)。或者,在本发明涉及亚硫酸氢盐转化效率的方法中,扩增引物提供序列鉴别(即亚硫酸氢盐转化拷贝和未转化拷贝之间的鉴别,或者换言之,第一对引物对亚硫酸氢盐转化拷贝而非亚硫酸氢盐未转化拷贝具有特异性,而第二对引物对亚硫酸氢盐未转化拷贝而非亚硫酸氢盐转化拷贝具有特异性)。更优选地,在本发明涉及亚硫酸氢盐转化效率的方法中,扩增引物和检测探针都提供序列鉴别(即,鉴别亚硫酸氢盐转化拷贝和未转化拷贝,或者换言之,第一对引物和第一探针都对亚硫酸氢盐转化拷贝而不是亚硫酸氢盐未转化拷贝具有特异性,而第二对引物+第二探针对亚硫酸氢盐未转化拷贝而不是亚硫酸氢盐转化拷贝具有特异性)。
[0143]
在本发明的qpcr方法和试剂盒中,可使用常规的热稳定(taq)聚合酶。优选在这种
qpcr方法和试剂盒中,使用热启动dna聚合酶,例如热启动taq dna聚合酶,其是taq dna聚合酶和基于适配体的抑制剂的混合物。基于适配体的抑制剂可逆结合酶,在低于45℃的温度下抑制聚合酶活性,但在正常循环条件下释放酶,允许在室温下进行反应。可采用的热启动dna聚合酶的其他合适例子是,例如amplitaqdna聚合酶和高保真dna聚合酶。
[0144]
优选本发明的方法使用如下定义的本发明的qpcr试剂盒。优选在本发明的方法(2-重qpcr)中使用seq id no:7-12的引物和探针来确定本文所定义的转化效率,更优选在本发明的方法(3重qpcr)中使用seq id no:1-3的引物和探针与seq id no:7-12的引物和探针组合使用,更优选在本发明的方法(4重qpcr)中组合使用seq id no:1-12的引物和探针,并且最优选在本发明的方法(5重qpcr)中使用seq id no:1-15的引物和探针。一般在本发明的方法中,在待分析且将被或已被亚硫酸氢盐处理的qpcr dna样品中加入已知量的内部阳性对照物(ipc),其包含seq id no:20的dna。
[0145]
在本发明的方法或试剂盒的另选实施方式中,seq id no:12的探针(用于line-1基因组的探针)可由tgggagtgagtgacattcacagtg替换。在本发明的方法或试剂盒的另选实施方式中,seq id no:9的探针(用于line-1转化的探针)可由tgggagtgatttaattttttaggtgy替换。
[0146]
出乎意料的是,本发明人能够设计并成功验证5重qpcr分析,该分析具有本文所述的所有定量和定性效果,同时扩增多拷贝目标dna序列,并产生大量扩增产物,不会妨碍其他(单拷贝数目标序列)同时检测和定量的成功。在qpcr反应中,竞争相同反应物的dna模板的拷贝数差异可能高达200倍。
[0147]
亚硫酸氢盐转化效率(比值或%)可以通过任何合适的现有公式计算,基于量(单位:ng)或浓度(单位:ng/μl)。这些公式通常可供本领域技术人员使用。一个合适的例子是下式:([第一扩增子量(ng)]/[第一扩增子量(ng)+第二扩增子量(ng)]。
[0148]
本领域技术人员非常清楚如何在qpcr中使用标准曲线来计算后续样品中的目标dna量。
[0149]
dna回收
[0150]
发明人证实,通过利用亚硫酸氢盐处理后转化的特定序列差异,可以确定亚硫酸氢盐转化的dna数量。这通过使用第三组引物和/或第三探针完成,该引物和/或探针对单拷贝基因序列的亚硫酸氢盐转化dna具有特异性。
[0151]
优选在这种方法中,第三检测探针提供序列/扩增子鉴别(即,第三检测探针对亚硫酸氢盐转化的dna具有特异性,并且允许仅检测和定量亚硫酸氢盐转化的dna,而不检测或定量亚硫酸氢盐未转化的dna)。或者,在这种方法中,第三组扩增引物提供序列鉴别(即,第三组引物对转化的dna具有特异性,并且允许仅检测和定量亚硫酸氢盐转化的dna,而不检测或定量亚硫酸氢盐未转化的dna)。更优选在这种方法中,第三组扩增引物和第三检测探针都提供序列鉴别(即,第三组引物和第三探针都对亚硫酸氢盐转化的dna具有特异性,并且只允许检测和定量转化的dna)。这基本上适用于所有用于扩增、检测和定量转化dna的扩增引物/探针。
[0152]
优选由第三引物组扩增的扩增子相对较短,优选70-150bp,更优选80-130bp,甚至更优选90-100bp,最优选约85bp。为了实现这一点,可以适当地设计第三引物组,以仅从基
因组单拷贝dna基因座扩增相对较短的片段(例如,70-150bp之间,适当地约75-100bp,优选约85bp)。因此,通过扩增单拷贝dna基因座的dna短片段,可以准确定量样品中亚硫酸氢盐转化dna的总量。优选用于在亚硫酸氢盐转化后定量dna回收的扩增目标是假定的单拷贝基因或单拷贝靶基因座,例如人端粒酶逆转录酶基因(htert)、sry(y染色体)、核糖核酸酶p/mrp 30kda亚基(rpp30)、波形蛋白(vim)、白蛋白(alb)、γ-珠蛋白(hbg)、细胞周期蛋白依赖性激酶6(cdk6)或核糖核酸酶p(rpph1)。优选仅扩增单拷贝dna基因座的一部分。使用假定的单拷贝基因的优势在于它们的唯一性和高序列保守性。htert和rna酶p通常在市售人qpcr定量试剂盒中作为内源性参考基因。
[0153]
术语“单拷贝基因”指(假定)在基因组中具有单一物理位置且在不同物种中可能具有同源物的基因及其序列。这种单拷贝基因的一个例子是(人)端粒酶逆转录酶基因(htert)。
[0154]
优选在本发明的多个方面中,假定的单拷贝基因是常染色体基因,最优选htert作为用于确定dna回收率的假定单拷贝基因。人端粒酶逆转录酶基因(htert)的一部分位于5p15.33上,优选使用seq id no:1和2的引物作为扩增引物,以seq id no:3作为探针序列进行扩增。为了准确定量样品中亚硫酸氢盐转化dna的量,本领域技术人员知道二倍体细胞含有两个单拷贝基因拷贝(等位基因),每个染色体一个。
[0155]
进行qpcr的样品中亚硫酸氢盐dna浓度等于进行qpcr的样品中单拷贝dna基因座的亚硫酸氢盐转化dna短片段的浓度(浓度(短))。
[0156]
片段化水平
[0157]
为了定量由于亚硫酸氢盐处理引起的降解(这是由于高温和苛刻的化学条件引起的常见现象),使用额外的引物组来扩增相同单拷贝dna基因座的较长靶序列,从中扩增出短片段,以定量上述dna回收率。因此,本文可使用单拷贝dna基因座的短片段(例如,85bp,如本文所述的htert短的实施方式)来定量亚硫酸氢盐转化dna总量(使用本文定义的第三组引物),而本文可使用单拷贝dna基因座的较长片段(例如,235bp,如本文所述的htert长的实施方式所示)来定量亚硫酸氢盐转化期间dna的可能降解。因此,dna的质量可以适当地表示成完整dna(例如≥235bp的dna)的量或浓度,通过将长dna的数量或浓度除以短dna的数量或浓度(例如完整dna(≥235bp)=浓度(长)/浓度(短)。
[0158]
在本发明的多个方面中,检测探针可以用多种qpcr标签或染料标记,包括fam、hex、tex、cy5和cy5.5染料。也可以使用水解(例如)探针,在与目标序列互补的短寡核苷酸上掺入5'报告荧光团和3'猝灭剂。
[0159]
优选“长”扩增子(使用如本文所述的第四引物和探针组生成)具有180-400bp、更优选200-350bp、甚至更优选220-300bp和最优选约235bp的长度。
[0160]
pcr抑制
[0161]
最后,可使用第五组扩增引物来扩增添加到qpcr混合物中的人工设计的内部对照dna片段(例如,包含seq id no:20的dna)。这能确定可能的pcr抑制水平。本领域技术人员非常清楚如何在qpcr反应中使用内部标准。为了本发明的目的,产生一条人工序列,作为内部阳性对照(ipc)来评估样品抑制的存在。优选在人基因组中找不到这种合成dna的序列。还优选该人工dna的序列为合成dna,优选该dna类似于本文定义的单拷贝靶基因座短片段(例如htert短片段),其用于定量dna回收率。然后可使用专用引物组在本发明的多重pcr中
扩增该ipc序列,其中这些ipc引物结合到ipc片段,并且可通过使用荧光标记的另一探针(例如cy5.5tm染料)检测扩增子。为了确保仅从ipc模板dna而不是从pcr反应中存在的(人)基因组dna或转化dna中扩增ipc序列,并且为了防止本发明的多重pcr反应中的其他引物与ipc模板dna序列结合,ipc序列优选在自然界不存在。例如,可以通过执行本领域技术人员熟知的blast检索来评估这一点。同样对于ipc扩增子的探针,如同对于本发明中的每种其他探针一样,探针优选地被设计为在结合合成序列内的区域结合。
[0162]
可以使用专用软件包如bisearch软件设计引物和探针。优选将引物设计在不含cpg或cpg尽可能少的亚硫酸氢盐转化区,在这种情况下,在引物序列中添加“y”,以实现成功且无偏的结合,而不管甲基化状态如何。对于富含cpg的片段,可能并不总能找到产生不含cpg的单一pcr产物的引物组。在确定dna片段化水平的htert长序列中,较长片段的pcr产物包含1个cpg位点。为了鉴定探针的合适目标区域,可以借助methylprimer软件在计算机中转化pcr产物。探针退火位点最好包含尽可能多的转化胞嘧啶。一旦确定了合适的扩增靶位点,就可检查预测的扩增子在该区域是否存在snp。对此,可使用在线来源的ensemble。最好检查候选引物和探针是否形成发夹和引物二聚体。为此,可以使用autodimer v1软件包。
[0163]
通常在本发明的多个方面中,在本发明的多重pcr中用作ipc的dna量,以及优选用作模板的dna量约为10ng/μl dna。
[0164]
本发明的试剂盒
[0165]
一种用于在通过使用本发明的方法将基因组dna样品中的非甲基化胞嘧啶转化为尿嘧啶后评估亚硫酸氢盐转化效率的qpcr试剂盒,通常包括:
[0166]-第一组扩增引物,用于通过qpcr扩增所述基因组(优选人)dna样品中基因组重复dna元件的亚硫酸氢盐转化拷贝,并用于生成第一扩增子;以及用第一可检测标签标记的第一检测探针,用于通过qpcr检测所述第一扩增子;
[0167]-提供第二组扩增引物,用于通过qpcr扩增存在于所述基因组dna样品中的所述基因座重复dna元件的未转化拷贝,并用于产生第二扩增子,和用第二可检测标签标记的第二检测探针,用于通过qpcr检测所述第二扩增子;
[0168]-可任选试剂盒包含qpcr试剂(也称为主混合物(mastermix)组分),包括但不限于选自dna聚合酶、dntp、mgcl和pcr缓冲液的试剂。
[0169]
本发明各方面中的扩增引物组可包含来自第一组两种引物的第一引物,用于从转化dna模板中的完全互补结合位点进行qpcr反应的引物延伸,该模板是本文所定义的基因组dna中的重复元件。该引物延伸反应将提供转化dna模板的互补链,该互补链用作第一组两种引物中第二引物的模板。
[0170]
本发明各方面中的扩增引物组可包含来自第二组两种引物的第一引物,用于从未转化(基因组)dna模板中的完全互补结合位点进行qpcr反应的引物延伸,该模板是本文所定义的基因组dna中的重复元件。该引物延伸反应将提供未转化(基因组)dna模板的互补链,该互补链用作第二组两种引物中第二引物的模板。
[0171]
在本发明的各个方面中,第一组和第二组引物用于多重qpcr,用于用所述第一引物组产生第一扩增子,且如果存在未转化(基因组)拷贝,则使用所述第二引物组产生所述第二扩增子。
[0172]
本发明的试剂盒提供检测探针,用于通过qpcr检测由本文定义的第一组和第二组
引物生成的扩增子。荧光标记所述探针。
[0173]
本发明的试剂盒还可包括:
[0174]-第三组扩增引物,用于通过qpcr扩增所述基因组(优选人类)dna样品(优选如上所述的htert,尽管本文设想了另选靶点)中亚硫酸氢盐转化的基因组单拷贝dna基因座的一部分,并用于产生第三扩增子;以及用第三可检测标签标记的第三检测探针,用于如上所述通过qpcr检测所述第三扩增子;和
[0175]-第四组扩增引物,用于通过qpcr扩增亚硫酸氢盐转化的所述单拷贝dna基因座的一部分,并用于产生长度比所述第三扩增子长的第四扩增子;以及用第四可检测标签标记的第四检测探针,用于通过qpcr检测所述第四扩增子;
[0176]
本文使用的术语第一、第二、第三、第四和第五表示元件不同。
[0177]
任选试剂盒可包含如本文所述的dna标准或参考,包括包含如本文所述的任何gblock的dna序列,优选seg id no:20,其为内部阳性对照。
[0178]
优选本发明的试剂盒包含qpcr试剂盒。优选所述试剂盒包含seq id no:7-12的引物和探针(2-重qpcr试剂盒),用于测定本文定义的转化效率,更优选所述试剂盒包含seq id no:1-3的引物和探针与seq id no:7-12的引物和探针(3-重qpcr试剂盒)组合,甚至更优选地,本发明的试剂盒包含seq id no:1-12的引物和探针组合(4重qpcr试剂盒)中,和最优选本发明的试剂盒包含seq id no:1-15的引物和探针组合(5重qpcr试剂盒)。最优选本发明的试剂盒还包括内部阳性对照(ipc),其包含seq id no:20的dna。
[0179]
本发明还提供了一种qpcr试剂盒,其包括-第一组扩增引物,用于扩增作为重复dna元件的基因组多拷贝靶dna序列的亚硫酸氢盐转化拷贝,并用于产生第一扩增子,优选其中所述第一组扩增引物包括包含seq id no:7核苷酸序列的正向引物和包含seq id no:8核苷酸序列的反向引物。所述qpcr试剂盒还可包括用第一可检测标签标记的第一检测探针,用于检测所述第一扩增子,优选其中所述第一检测探针包含seq id no:9的核苷酸序列,更优选其中所述第一检测探针包含seq id no:9的核苷酸序列和5’tex 615染料。
[0180]
优选本发明的qpcr试剂盒还包括:第二组扩增引物,用于扩增所述重复dna元件的未转化拷贝,并用于产生第二扩增子;优选其中所述第二组扩增引物包括包含seq id no:10的核苷酸序列的正向引物和包含seq id no:11的核苷酸序列的反向引物。所述qpcr试剂盒还可包括用第二可检测标签标记的第二检测探针,用于检测所述第二扩增子,优选其中所述第二检测探针包含seq id no:12的核苷酸序列,更优选其中所述第二检测探针包含seq id no:12的核苷酸序列和5’cy5tm染料。
[0181]
优选将所述qpcr试剂盒包括所述第一组扩增引物和所述第二组扩增引物。此外,优选将所述第一和所述第二检测探针都包括在所述试剂盒中。
[0182]
优选本发明的qpcr试剂盒还包括第三组扩增引物,用于扩增亚硫酸氢盐转化的基因组单拷贝基因序列的一部分,并用于产生第三扩增子,优选其中所述第三组扩增引物包括包含seq id no:1核苷酸序列的正向引物和包含seq id no:2核苷酸序列的反向引物。所述qpcr试剂盒还可包括用第三可检测标签标记的第三检测探针,用于检测所述第三扩增子,优选其中所述第三检测探针包含seq id no:3的核苷酸序列,更优选其中所述第三检测探针包含seq id no:3的核苷酸序列、zentm猝灭剂和5’famtm染料。
[0183]
优选将所述第一组扩增引物、所述第二组扩增引物和所述第三组扩增引物包括在
所述qpcr试剂盒中。此外,优选将所述第一、第二和第三检测探针包括在所述试剂盒中。
[0184]
优选本发明的qpcr试剂盒还包括第四组扩增引物,用于扩增亚硫酸氢盐转化的所述基因组单拷贝基因序列的一部分,并用于产生长度比所述第三扩增子长的第四扩增子;优选其中所述第四组扩增引物包括包含seq id no:4核苷酸序列的正向引物和包含seq id no:5核苷酸序列的反向引物。所述qpcr试剂盒还可包括用第四可检测标签标记的第四检测探针,用于检测所述第四扩增子,优选其中所述第四检测探针包含seq id no:6的核苷酸序列,更优选其中所述第四检测探针包含seq id no:6的核苷酸序列、zentm猝灭剂和5’hextm染料。
[0185]
优选将所述第一组扩增引物、所述第二组扩增引物、所述第三组扩增引物和所述第四组扩增引物包括在所述qpcr试剂盒中。此外,优选将所述第一、第二、第三和第四检测探针包括在所述试剂盒中。
[0186]
优选所述qpcr试剂盒还包括:-第一合成dna标准,其由所述第一扩增子的核苷酸序列组成,优选其中所述第一合成dna标准为seq id no:18的序列;和-由所述第二扩增子的核苷酸序列组成的第二合成dna标准,其中所述第二合成dna标准优选为seq id no:19的序列;和/或-由所述第三扩增子的核苷酸序列组成的第三合成dna标准,其中所述第三合成dna标准优选为seq id no:16的序列;和/或-由所述第四扩增子的核苷酸序列组成的第四合成dna标准,其中所述第四合成dna标准优选为seq id no:17的序列。
[0187]
优选本发明的qpcr试剂盒还包括用于扩增人工dna序列(或内部阳性对照dna序列)和用于产生第五扩增子的第五组扩增引物;优选其中所述第五组扩增引物包含包含seq id no:13核苷酸序列的正向引物和包含seq id no:14核苷酸序列的反向引物。所述qpcr试剂盒还可包括用第五可检测标签标记的第五检测探针,用于通过qpcr检测所述第五扩增子,优选其中所述第五检测探针包含seq id no:15的核苷酸序列,更优选其中所述第五检测探针包含seq id no:15的核苷酸序列和5'cy5.5tm染料。
[0188]
优选将所述第一组扩增引物、所述第二组扩增引物、所述第三组扩增引物、所述第四组扩增引物和所述第五组扩增引物包括在所述qpcr试剂盒中。此外,优选将所述第一、第二、第三、第四和第五检测探针包括在所述试剂盒中。
[0189]
还优选本发明的qpcr试剂盒包括包含用于扩增的内部阳性对照的核苷酸序列,优选包含seq id no:20的核苷酸序列。
[0190]
本领域技术人员了解,第五组扩增引物和第五探针与内部阳性对照核苷酸序列(seq id no:20)匹配。原则上,本领域技术人员还可以使用与所述(即扩增)所述内部阳性对照核苷酸序列匹配的另选内部阳性对照核苷酸序列和扩增引物和探针。
[0191]
优选在本发明的方法中使用本发明的qpcr试剂盒。关于本发明方法所述的qpcr试剂盒的实施方式也适用于本发明的qpcr试剂盒。
[0192]
本发明还提供一种核酸,优选合成寡核苷酸,其包含seq id no:1-20序列或由其组成。
[0193]
qbico
[0194]
在一个高度优选的实施方式中,本发明提供了使用特定引物和标记探针(如本文所述的seq id no:1-15)执行5重pcr反应的方法和试剂盒,用于测定亚硫酸氢盐转化dna样品的各种定性和定量方面。
[0195]
qbico方法和试剂盒,无论是在这些高度优选的实施方式还是在更一般描述的方面,都包括基于测定重复dna元件(优选line-1)的转化和未转化扩增子来检测亚硫酸氢盐转化效率的引物和探针,可应用于利用亚硫酸氢盐转化dna的包括表观遗传学在内的许多科学领域。这不仅涉及基础研究和大数据表观基因组研究,即调查dna甲基化模式的大型队列研究,这些研究使用illumina微阵列平台(450k/epic)或全亚硫酸氢盐测序技术分析数百或数千个样品,还针对诊断研究和应用,即开发或应用目标诊断工具的团体,如癌症检测和疾病发展评估。qbico可用于标准化任何基于亚硫酸氢盐转化的方法,独立于下游分析平台,包括简单的pcr或复杂的下一代测序。
[0196]
本发明现提供测量或定量全局(全基因组)亚硫酸氢盐转化效率的方法和手段。如上文所述,所述手段和方法优选包括使用单拷贝基因作为通过qpcr对样品中的亚硫酸氢盐转化dna的量进行定量的靶标,以及使用相同单拷贝基因的不同大小片段通过qpcr对所述样品中的亚硫酸氢盐转化dna的片段化程度进行定量。优选如上文所述,所述手段和方法优选地包括使用内部阳性对照(ipc)来确定可能的pcr抑制。ipc优选为合成的非人dna序列。
[0197]
如上所述,用于测量或定量全局亚硫酸氢盐转化效率的手段和方法优选包括在参考样品中使用人工dna片段(“gblock”,如本文所述)作为dna模板,其与测试样品平行运行。这些参考样品优选使用与测试样品相同的pcr主混合物、引物和探针。参考样品用于制备参考或标准曲线,包括已知量的人工dna模板。在第一优选实施方式中,参考样品包括至少一个第一人工dna片段,该片段包含一个类似于或是重复dna元件的人基因组核苷酸序列的完全二硫化物转化序列(部分)的序列,以及一个第二人工dna片段,该片段包含一个类似于或是重复dna元素的人类基因组核苷酸序列(部分)的序列。
[0198]
ipc优选是一个合成的非人dna序列,该序列被添加到每个qpcr反应中(参考或标准,以及测试样品),以便检测可能的pcr抑制。
[0199]
gblock人工dna片段可包含作为合成dna标准(参考)的pcr产物的预期序列,其使用各种引物扩增,所述引物用于扩增具有基因组(未转化)序列且具有亚硫酸氢盐转化序列(例如line-1转化、line-1基因组)的重复dna元件。gblock人工dna片段还可包含作为合成dna标准(参考)的pcr产物的预期序列,该pcr产物使用用于扩增亚硫酸氢盐转化单拷贝基因(例如短htert、长htert)的各种引物扩增。优选在参考样品中,(未转化和转化的)重复dna元件模板以大约相等的量存在。此外,单拷贝基因靶标优选以大约相等的量存在。优选在参考样品中,(未转化和转化的)重复dna元件模板和单拷贝基因靶以模仿或类似于人亚硫酸氢盐转化dna样品中预期拷贝数的比例混合(例如,对于line-1对htert为200:1)。
[0200]
短htert和长htert包括基于人参考基因组的单拷贝序列。
[0201]
本文为dna参考提供的line-1转化和line-1基因组序列包括基于人类参考基因组的共有重复序列。
[0202]
参考样品中模板dna的总量优选按测试样品中预期的级别。对于不同的参考样品,多个参考样品可与不同量的模板dna一起使用。例如,可以在两个不同的参考样品中使用2种浓度的模板dna来制备标准曲线。或者,标准曲线可用于单个模板dna浓度。优选使用三个、四个、5个、6个、7个、8个、9个或10个参考样品,每个样品具有不同的模板dna浓度。参考样品中模板dna非常合适的浓度范围包括0.1-100ng/μl或0.5-50ng/μl。
[0203]
因此当使用浓度为50ng/μl的四种不同gblock时,它们最好以预期代表其人基因
组拷贝数的比例混合(短htert、长htert、line-1转化和line-1基因组分别为1:1:200:200)。
[0204]
本发明提供了一种人工“亚硫酸氢盐处理的dna”作为参考标准。本发明允许使用尽可能少的引物对测定亚硫酸氢盐处理的dna样品的全局转化效率。为此,本发明旨在使用上文定义的重复dna元件,例如,优选line-1。本发明的方法和手段以重复dna元件的基因组和转化形式为靶标。在line-1重复的情形中,人基因组提供了该基因的多个拷贝,具有非常相似的dna序列。然而,序列中可能会出现一些差异,例如单核苷酸差异。本领域技术人员将理解,可以为这些不同的序列获得共有序列,并且基于这种共有序列可设计适当的引物和探针,如果需要,可包括模糊碱基,以扩增和检测基本上重复dna元件的所有变体。当设计如本文所解释的参考dna标准时,本领域技术人员将进一步了解多重分析中的各种引物优选具有相当的解链温度。
[0205]
本发明的手段和方法可用于非常不同的研究领域,例如健康和疾病、癌症、进化、法医学、衰老、发育生物学、细胞和分子生物学、临床表观遗传学、流行病学、单细胞分析、儿科、生活方式和运动研究、植物生物学、微生物学、干细胞生物学等。
实施例
[0206]
实施例1.材料和方法
[0207]
dna样品
[0208]
在这项研究中,几种dna样品用于qbico的优化和开发。合成的双链dna片段,数量为5,gblock(integrated dna technologies,美国),被设计为在使用所建议的分析法时具有qpcr产生的预期pcr产物序列(表1)。用这五种序列优化和开发方法。此外,三种dna标准用于评估10种亚硫酸氢盐转化试剂盒的性能。本实验的dna标准为人甲基化dna(250ng/μl)(zymoresearch,美国)、人高甲基化基因组dna(100ng/μl)(美国epigendx)和quantilertm thp dna标准(100ng/μl)(美国thermofisher)。为了验证qbico,使用了人高甲基化基因组dna(100ng/μl)(epigendx)标准,而对于排名最佳的转化试剂盒,使用了人甲基化dna(250ng/μl)(zymoresearch)标准。最后,为了评估该方法的特异性,非人dna被纳入研究。更具体地说,测试了从felis catus(猫)、家犬(canis lupus familiaris)(犬)、小鼠(mus musculus)(小鼠)、大鼠(rattus)(大鼠)、家鸡(gallus gallus domesticus)(鸡)、家猪(sus scrofa domesticus)(猪)和牛(bos taurus)(奶牛)中提取的dna的非特异性扩增。人高甲基化基因组dna(100ng/μl)(epigendx)作为阳性对照与上述物种一起进行检测。
[0209]
表1.qbico分析中的引物和探针
[0210][0211]
表2.gblock扩增子序列
[0212][0213]
标出了正向和反向引物结合位点(下划线)以及探针退火位点(斜体,下划线)。
[0214]
基因组dna定量/定性
[0215]
在亚硫酸氢盐处理前定量本研究中包括的所有dna样品,以评估其dna数量和质量。用quantifiler duo dna定量试剂盒(美国thermofisher)测量dna样品的dna量。用quantifiler hp dna定量试剂盒(美国thermofisher)评估dna样品的dna数量和质量。quantifiler hp(thermofisher)是一种经过升级的定量试剂盒,它不仅可以通过靶向基因组中的一个小常染色体二倍体序列来提供dna数量信息,还可以通过靶向基因组中的一个大常染色体二倍体序列来提供dna本身的片段化水平信息。小片段和大片段的比例提供了有关dna片段化水平的信息。
dna甲基化试剂盒(zymoresearch,usa)的性能可再现性。为此,更大范围的dna量被用作亚硫酸氢盐转化的输入。经过亚硫酸氢盐转化的dna量分别为200ng、100ng、50ng、25ng、12.5ng、6.25ng、3.125ng和1.563ng。在不同的时间点重复亚硫酸氢盐转化,以评估试剂盒的性能再现性。最后,用亚硫酸氢钠处理200ng dna标准人高甲基化基因组dna(100ng/μl)(epigendx),并用于qbico的验证研究。使用排名最高的亚硫酸氢盐转化试剂盒ez dna甲基化试剂盒(zymoresearch)处理样品。
[0223]
亚硫酸氢盐转化的dna片段化分析
[0224]
为了与可用于亚硫酸氢盐转化dna片段分析的现有方法进行比较以评估qbico的性能,使用生物分析仪技术(安捷伦科技,美国)对样品进行分析。为此,在为评估最佳试剂盒ez dna甲基化试剂盒(zymoresearch)性能而准备的两个转化实验的每一个中,使用了八个亚硫酸氢盐转化样品中的两个。特别是,使用生物分析仪技术对dna输入量为作为最佳测试量的200ng的转化样品进行了片段化测试。此外,12.5ng用于转化的dna输入与200ng一起进行了测试,以评估转化在较低dna质量下的表现。由于亚硫酸氢盐转化的dna大多是单链的,因此使用安捷伦rna 6000pico试剂盒(安捷伦科技公司,美国)和生物分析仪仪器(安捷伦科技公司,美国)对片段化进行了评估。这四个样品在两次dna亚硫酸氢盐转化中一式两份运行。
[0225]
亚硫酸氢盐转化的dna定量
[0226]
通过与现有常用方法比较,对qbico的量化表现额外进行了评估。为此,使用分光光度法和荧光定量法分析用于生物分析仪的片段化评估的相同的四种亚硫酸氢盐转化样品。特别是,我们在ssdna模式下使用nanodrop分光光度计(thermofisher)和带有ssdna检测试剂盒的qubit荧光计(thermofisher)测量亚硫酸氢盐转化的dna量。所有样品一式两份测量。
[0227]
qbico分析设计
[0228]
对于qbico开发,设计了五组引物,每组包括一个探针(表1)。每个探针携带不同的荧光团以提供信号,该信号可根据不同染料与不同的探针分开。五个分析中的两个设计成针对基因组dna中的人l1重复元件(119pb;line-1基因组seq id no:19)和亚硫酸氢盐转化dna(148bp;line-1转化,seq id no:18)。这些引物组对应的两个探针设计用于区分转化dna和基因组dna,并分别用tex616
tm
和cy5
tm
标记。这两项分析旨在提供有关转化效率的信息,因为l1元件覆盖了整个基因组的17%。使用生物信息学工具,引物/探针设计成最大化其结合的位置,总共对应约200个位置。
[0229]
为了测定亚硫酸氢盐转化效率,设计了两组引物和探针,用不同染料标记,以基因组和转化的长散在元件1(l1/line-1)为靶点。
[0230]
此外,设计了两种针对亚硫酸氢盐转化形式的长(235bp;长htert)和短(85bp;短htert)片段的分析,这两种片段均属于人端粒酶逆转录酶基因(htert)。这些分析包括通过处理dna降解水平来评估转化dna的质量。此外,用短片段(htert)评估亚硫酸氢盐转化dna的数量。设计用于与htert基因的长片段和短片段杂交的探针分别用fam
tm
和hex
tm
荧光团标记。最后,设计了一组引物来扩增合成的非人dna序列(99bp;ipc)。该分析的相应探针用cy5.5
tm
标记,用作内部阳性对照(ipc)以及评估pcr抑制的手段(表1)。
[0231]
表4.qbico中包括的5个分析的说明
[0232][0233]
基因组浏览器ensembl用于定位人基因组中的感兴趣区域(grch37)并提取周围的dna序列。通过methylprimer软件获得预期的亚硫酸氢盐转化dna序列,并用于设计亚硫酸氢盐特异性引物和探针。使用bisearch软件计算机设计引物和探针组。此外,设计了五个合成双链dna片段,gblock(integrated dna technologies,idt),以模拟来自分析的每个预期pcr产物(表2)。这些片段被用作优化和验证该方法的dna样品,并且由于已知每个反应的每个片段的拷贝数,因此优于人dna。四种不同的gblock(内部阳性对照除外)按照预期代表50ng人dna相同的拷贝数的比例混合。使用gblock混合物(50ng/μl)进行系数2的连续稀释,得到八个浓度范围为50-0.39ng/μl的标准。ipc输入在所有反应中都是相同的,因此没有添加到gblock混合物中。
[0234]
(q)pcr定量-qbico
[0235]
使用上述引物和探针对,在pcr反应中同时扩增上述五种分析。pcr反应在最终体积20μl中进行了优化,其中包含10μl 2xmethylight qpcr(德国恰根)试剂、2μl 25mm mgcl2(美国应用生物系统公司)、0.8μl bsa(美国biolabs)、3.2μl无核酸酶水、2μl引物/探针混合物、1μl内部阳性对照gblock和1μl亚硫酸氢盐转化的dna模板。根据表5优化引物/探针混合物。该qpcr的循环条件包括聚合酶活化和变性(95℃,5分钟)、33个变性循环(95℃,15秒)、退火(56℃,30秒)和延伸(60℃,70秒)。对优化的分析进行了性能测试,如效率、再现性、重复性、特异性、灵敏度和稳健性。在所有实验中,从无核酸酶水中的50ng/μl gblock混合物中制备八种标准的系列稀释液,以获得50-0.39ng/μl范围内的浓度。此外,一式三份进行qpcr扩增,以评估分析的重复性。使用无核酸酶水作为阴性对照。所有反应均在qpcr仪器bio-rad cfx96 touchtm实时pcr检测系统(bio-rad)的96孔板(bio-rad,美国)中进行。
[0236]
表5.qbico的引物/探针主混合物的浓度组合
[0237][0238][0239]
数据分析
[0240]
为了评估每个分析的效率,使用gblock混合储液50ng/μl按二倍系数连续稀释,得到八个范围为50
–
0.39ng/μl的dna标准。这些稀释液一式两份运行,以获得亚硫酸氢盐转化dna定量的标准曲线。用仪器计算标准曲线的公式:c
t
=m[log(qty)]+b,其中m是斜率,b是y-截距,qty是每个标准的起始dna量。qpcr仪器还获得了有关r2、斜率和效率的信息。r2≥0.99表示标准曲线测得的c
t
值接近回归线的计算的c
t
值,但值》0.985也是可以接受的。斜率也表明pcr效率(e)且应为-3.6≥斜率≥-3.3,相当于90-100%的效率。直接通过htert短常染色体片段的数量测量亚硫酸氢盐dna回收率。此外,根据以下公式计算转化效率:转化效率=[转化的l1量(ng)]/[转化的l1量(ng)+基因组l1量(ng)]*100%。类似地,片段化指数和pcr抑制剂的存在计算如下:片段化指数=片段化程度[hp]-[htert长的量(ng)]/[htert小的量(ng)]。最后,对于pcr抑制剂的评估,ipc-ct阈值确定如下:抑制存在=样品中ipc ct的均值》(基于dna标准的ipc cq值的均值+标准偏差)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1