脂肪酸酰胺衍生物的制作方法
1.本发明涉及对血清素5-ht
2a
受体和血清素5-ht7受体具有拮抗活性的脂肪酸酰胺衍生物或其药学上可接受的盐,以及包含该衍生物作为活性成分的治疗神经精神性疾病的药剂。
背景技术:
2.血清素(5-羟色胺;以下也称为“5-ht”)已知为中枢神经系统的主要神经递质之一,并且还已知血清素与多种脑功能如情绪反应和认知功能有关。
3.作为5-ht受体亚型之一的5-ht
2a
受体是gq/11蛋白偶联受体,并且在例如大脑皮质、海马和中缝核中高度表达。对 5-ht
2a 受体具有拮抗活性的药物包括抗抑郁药米安色林和米氮平。对5-ht
2a
受体具有拮抗活性的非典型抗精神病药被用作治疗疾病如精神分裂症、躁郁症、重度抑郁症和自闭症谱系障碍的药剂(非专利文献1、非专利文献2)。
4.5-ht7受体是gs蛋白偶联受体,并且广泛表达于例如下丘脑、丘脑、海马和中缝核(非专利文献9)。对5-ht7受体具有拮抗活性的药物包括用作治疗精神分裂症和躁郁症的药剂的鲁拉西酮和用于治疗重度抑郁症的沃替西汀。然而,没有对5-ht7受体具有选择性拮抗活性的商业药物。鲁拉西酮用于治疗精神分裂症和躁郁症,并且沃替西汀用于治疗重度抑郁症(非专利文献3、非专利文献4和非专利文献5)。还已知在某些动物模型中,拮抗5-ht7受体导致抗抑郁和抗焦虑作用,以及改善认知功能的作用(非专利文献6、非专利文献7)。还已知5-ht7受体缺陷型小鼠表现出抗抑郁作用(非专利文献8)。
5.如上所述,表明5-ht
2a
受体和5-ht7受体拮抗剂分别可用于许多神经精神性疾病,但没有报道以选择性和强效方式对5-ht
2a
受体和5-ht7受体具有拮抗活性的药物。
6.引用列表非专利文献[非专利文献1] p. seeman, can. j. psychiatry. 4: 27-38, 2002[非专利文献2] c. j. schmidt, life science. 56(25): 2209-2222, 1995[非专利文献3] l. citrome, j. clinical practice. 65(2): 189-210, 2011[非专利文献4] ys. woo, neuropsychiatric disease and treatment. 9: 1521-1529, 2013[非专利文献5] c. sanchez, pharmacology & therapeutics. 145: 43-57, 2015[非专利文献6] bonaventure p, j pharmacol exp ther. 321: 690-8, 2007[非专利文献7] horisawa t, behavioural brain research. 220: 83-90, 2011[非专利文献8] m. guscott, neuropharmacology. 48: 492-502, 2005[非专利文献9] t w. lovenberg, neuron. 11: 449-458, 1993。
[0007]
发明概述
本发明解决的问题本发明的一个目的是提供对血清素5-ht
2a
受体和5-ht7受体均具有拮抗活性的新化合物,并可用作治疗神经精神性疾病的药剂。
[0008]
解决问题的方式本发明人为实现上述目的进行了深入研究,然后发现下述式(1)的化合物或其药学上可接受的盐(以下,也称为“本化合物”)对血清素5-ht
2a
受体和5-ht7受体均具有拮抗活性。基于这些新发现,已经实现了本发明。
[0009]
如下说明本发明。
[0010]
[项目1]式(1)的化合物:或其药学上可接受的盐,其中z是氮原子或-cr
a-;y是羰基或磺酰基;m是1、2、3或4;n是0、1、2或3;条件是当y是磺酰基时,n不是0;ra是氢、羟基、c
1-6
烷基或c
1-6
烷氧基;r
1a
、r
1b
、r
1c
和r
1d
各自独立地是氢、羟基、卤素或任选被相同或不同的1至3个卤素取代的c
1-6
烷基;r
2a
、r
2b
、r
2c
和r
2d
各自独立地是以下基团,并且当存在多个r
2c
或r
2d
时,r
2c
中的每一个或r
2d
中的每一个独立地是以下基团:氢、卤素或c
1-6
烷基(其中烷基可以任选被相同或不同的1至5个取代基取代,所述取代基选自卤素、羟基、c
3-8
环烷基和c
1-6
烷氧基),条件是当r
2a
和r
2b
或与相同碳原子连接的r
2c
和r
2d
各自独立地是所述c
1-6
烷基时,它们可以与它们连接的碳原子一起组合形成3-至6-元饱和碳环;r3是c
1-6
烷基,其中烷基可以任选被相同或不同的1至5个取代基取代,所述取代基选自卤素、羟基、氰基、c
3-8
环烷基和c
1-6
烷氧基;r
4a
、r
4b
、r
4c
和r
4d
各自独立地是以下基团,并且当存在多个r
4c
或r
4d
时,r
4c
中的每一个或r
4d
中的每一个独立地是以下基团:氢、卤素、c
1-6
烷基(其中烷基可以任选被相同或不同的1至5个取代基取代,所述取代基选自卤素、羟基、氰基、c
3-8
环烷基、c
1-6
烷氧基、c
1-6
烷基酯和任选被相同或不同的1或2个c
1-6
烷基取代的氨基(其中烷基可以任选被氧代取代))、c
2-6
炔基或氨基(其中氨基可以任选被相同或不同的1或2个c
1-6
烷基取代);条件是当r
4a
、r
4b
、r
4c
和r
4d
中的任意两个各自独立地是所述c
1-6
烷基时,它们可以与它们连接的一个或多个碳原子一起组合形成3-至6-元饱和碳环或4-至6-元饱和杂环,其中当所述c
1-6
烷基具有取代基时,所述取代基可以作为碳环或杂环的环成员被包括在内;条件是当y是磺酰基和n是1时,r
4c
或r
4d
中的任一个是氢;并且当y是磺酰基和n是2或3时,与邻近y的碳原子连接的r
4c
或r
4d
中的任一个是氢;和环q是下式(2a)、(2b)、(2c)、(2d)、(2e)或(2f)的基团:其中r
5a
、r
5b
、r
5c
和r
5d
各自独立地是氢、卤素、氰基、c
1-6
烷基、c
1-6
烷氧基(其中烷基和烷氧基可各自独立地任选被相同或不同的1至3个卤素取代)或任选被相同或不同的1或2个c
1-6
烷基取代的氨基;和r6是氢、c
1-6
烷基或c
3-8
环烷基,其中烷基和环烷基可各自独立地任选被相同或不同的1至3个卤素取代。
[0011]
[项目2]项目1的化合物或其药学上可接受的盐,其中r
1a
、r
1b
、r
1c
和r
1d
是氢。
[0012]
[项目3]项目1或2的化合物或其药学上可接受的盐,其中r
2a
、r
2b
、r
2c
和r
2d
是氢。
[0013]
[项目4]项目1至3中任一项的化合物或其药学上可接受的盐,其中m是1。
[0014]
[项目5]项目1至4中任一项的化合物或其药学上可接受的盐,其中r3是c
1-6
烷基。
[0015]
[项目6]项目1至5中任一项的化合物或其药学上可接受的盐,其中z是-cr
a-。
[0016]
[项目7]项目1至6中任一项的化合物或其药学上可接受的盐,其中ra是氢。
[0017]
[项目8]项目1至7中任一项的化合物或其药学上可接受的盐,其中r
5a
、r
5b
、r
5c
和r
5d
各自独立地是氢、卤素或c
1-6
烷基。
[0018]
[项目9]项目1至8中任一项的化合物或其药学上可接受的盐,其中r
5a
、r
5c
和r
5d
是氢。
[0019]
[项目10]项目1至9中任一项的化合物或其药学上可接受的盐,其中r
5b
是氢、卤素或c
1-6
烷基。
[0020]
[项目11]项目1至10中任一项的化合物或其药学上可接受的盐,其中r6是氢。
[0021]
[项目12]项目1至11中任一项的化合物或其药学上可接受的盐,其中r
4a
、r
4b
、r
4c
和r
4d
各自独立地是以下基团,并且当存在多个r
4c
或r
4d
时,r
4c
中的每一个或r
4d
中的每一个独立地是以下基团:氢、卤素或c
1-6
烷基,其中烷基可任选被相同或不同的1至5个取代基取代,所述取代基选自卤素、羟基和c
1-6
烷氧基。
[0022]
[项目13]项目1至12中任一项的化合物或其药学上可接受的盐,其中n是0或1。
[0023]
[项目14]项目1至13中任一项的化合物或其药学上可接受的盐,其中y是羰基。
[0024]
[项目15]项目1至13中任一项的化合物或其药学上可接受的盐,其中y是磺酰基。
[0025]
[项目16]项目1的化合物或其药学上可接受的盐,其中所述化合物选自:.[项目17]药物,其包含项目1至16中任一项的化合物或其药学上可接受的盐作为活性成分。
[0026]
[项目18]用于治疗精神疾病或中枢神经系统疾病的药剂,其包含项目1至16中任一项的化合物或其药学上可接受的盐作为活性成分。
[0027]
[项目19]项目18的药剂,其中所述精神疾病或中枢神经系统疾病为精神分裂症、躁郁症、睡眠障碍、自闭症谱系障碍、重度抑郁症、难治性抑郁症或与阿尔茨海默病或帕金森病相关的精神病症状或痴呆。
[0028]
[项目20]用于治疗精神疾病或中枢神经系统疾病的方法,包括向有此需要的患者施用治疗有效量的项目1至16中任一项的化合物或其药学上可接受的盐。
[0029]
[项目21]项目1至16中任一项的化合物或其药学上可接受的盐在制备治疗精神疾病或中枢神经系统疾病的药剂中的用途。
[0030]
[项目22]用于治疗精神疾病或中枢神经系统疾病的项目1至16中任一项的化合
物或其药学上可接受的盐。
[0031]
[项目23]用于治疗精神疾病或中枢神经系统疾病的药剂,其包含项目1至16中任一项的化合物或其药学上可接受的盐与至少一种药物的组合,所述药物选自用于治疗发育障碍如自闭症谱系障碍和注意力缺陷多动障碍的药物、抗精神病药物和精神分裂症药物、用于治疗躁郁症的药物、抗抑郁药物、抗焦虑药物、用于治疗强迫症的药物、用于治疗应激障碍如创伤后应激障碍的药物、用于治疗情感障碍的药物、用于治疗进食障碍的药物、用于治疗睡眠障碍如失眠、嗜睡症、睡眠呼吸暂停综合征和昼夜节律障碍的药物、用于治疗性功能障碍的药物、用于治疗药物依赖的药物、用于治疗痴呆如阿尔茨海默病的药物、用于治疗与痴呆相关的行为和心理症状的药物、脑代谢和循环改善药物、用于治疗运动障碍如帕金森病的药物、镇痛药物、抗癫痫药物、抗惊厥药物、偏头痛药物、麻醉剂和中枢兴奋剂。
[0032]
[项目24]用于治疗精神疾病或中枢神经系统疾病的药剂,其包含作为活性成分的项目1至16中任一项的化合物或其药学上可接受的盐,其中所述药剂与至少一种药物相伴用于治疗,所述药物选自用于治疗发育障碍如自闭症谱系障碍和注意力缺陷多动障碍的药物、抗精神病药物和精神分裂症药物、用于治疗躁郁症的药物、抗抑郁药物、抗焦虑药物、用于治疗强迫症的药物、用于治疗应激障碍如创伤后应激障碍的药物、用于治疗情感障碍的药物、用于治疗进食障碍的药物、用于治疗睡眠障碍如失眠、嗜睡症、睡眠呼吸暂停综合征和昼夜节律障碍的药物、用于治疗性功能障碍的药物、用于治疗药物依赖的药物、用于治疗痴呆如阿尔茨海默病的药物、用于治疗与痴呆相关的行为和心理症状的药物、脑代谢和循环改善药物、用于治疗运动障碍如帕金森病的药物、镇痛药物、抗癫痫药物、抗惊厥药物、偏头痛药物、麻醉剂和中枢兴奋剂。
[0033]
[项目25]实施例17、77、78、79和80中任一项的化合物的晶体,其特征在于粉末xrd图包含4个或更多个(优选10个或更多个)2θ
±
0.2值的粉末xrd峰,所述2θ
±
0.2值选自每个实施例中测量的那些。
[0034]
发明效果本化合物对5-ht
2a
受体和5-ht7受体具有拮抗活性。本化合物可用作用于治疗神经精神性疾病和中枢神经系统疾病的药剂。
[0035]
附图简述图1显示了使用实施例17的化合物进行的条件性恐惧试验(试验6)的结果。
[0036]
图2显示了使用实施例17的化合物测量大鼠脑中释放的谷氨酸量的结果(试验7)。
[0037]
图3显示了实施例78的化合物的粉末xrd测量图。
[0038]
实施方案描述下文详细说明本发明。在说明书中,“取代基”的定义中的碳原子数可以表示为例如“c
1-6”。具体而言,术语“c
1-6
烷基”是指具有1至6个碳原子的烷基。
[0039]
本文使用的“卤素”包括例如氟原子、氯原子、溴原子和碘原子。优选地,它包括氟原子和氯原子。
[0040]
本文使用的“c
1-6
烷基”是指具有1-6个碳原子的直链或支链饱和烃基。优选地,“c
1-6
烷基”包括“c
1-4
烷基”,并且更优选地,它包括“c
1-3
烷基”。“c
1-3
烷基”包括例如甲基、乙基、丙基和1-甲基乙基。除了上面列出的“c
1-3
烷基”的实例之外,“c
1-4
烷基”还包括例如丁基、1,1-二甲基乙基、1-甲基丙基和2-甲基丙基。除了上面列出的“c
1-4
烷基
”ꢀ
的实例之外,
“c1-6
烷基
”ꢀ
还包括例如戊基、1,1-二甲基丙基、1,2-二甲基丙基、1-甲基丁基、2-甲基丁基、4-甲基戊基、3-甲基戊基、2-甲基戊基、1-甲基戊基和己基。
[0041]
本文使用的短语“烷基被氧代取代”是指组成烷基的任一碳原子形成酮基(c=o)。
[0042]
本文使用的“c
3-8
环烷基”是指具有3至8个碳原子的环状饱和烃基,并且它包括具有部分不饱和键或桥接结构的那些。“c
3-8
环烷基”优选包括“c
3-6
环烷基”。“c
3-6
环烷基”包括例如环丙基、环丁基、环戊基和环己基。除了上面列出的“c
3-6
环烷基”的实例之外,“c
3-8
环烷基”还包括例如环庚基和环辛基。
[0043]“c
1-6
烷氧基”在本文中与“c
1-6
烷基氧基”可互换使用,并且“c
1-6
烷基”部分与上述“c
1-6
烷基”相同。“c
1-6
烷氧基”优选包括“c
1-4
烷氧基”,并且更优选“c
1-3
烷氧基”。“c
1-3
烷氧基”包括例如甲氧基、乙氧基、丙氧基和1-甲基乙氧基。除了上面列出的“c
1-3
烷氧基”的实例之外,“c
1-4
烷氧基”还包括例如丁氧基、1,1-二甲基乙氧基、1-甲基丙氧基和2-甲基丙氧基。除了上面列出的“c
1-4
烷氧基”的实例之外,“c
1-6
烷氧基”还包括例如戊氧基、1,1-二甲基丙氧基、1,2-二甲基丙氧基、1-甲基丁氧基、2-甲基丁氧基、4-甲基戊氧基、3-甲基戊氧基、2-甲基戊氧基、1-甲基戊氧基和己氧基。
[0044]
本文使用的“c
1-6
烷基酯”是指r'部分为上述“c
1-6
烷基”的酯(-coor')。“c
1-6
烷基酯”优选包括“c
1-4
烷基酯”,并且更优选“c
1-3
烷基酯”。“c
1-3
烷基酯”包括例如甲酯、乙酯、丙酯和1-甲基乙酯。除了上面列出的“c
1-3
烷基酯”的实例之外,“c
1-4 烷基酯”还包括例如丁酯、1,1-二甲基乙酯、1-甲基丙酯和2-甲基丙酯。除了上面列出的“c
1-4
烷基酯”的实例之外,“c
1-6
烷基酯”还包括例如戊酯、1,1-二甲基丙酯、1,2-二甲基丙酯、1-甲基丁酯、2-甲基丁酯、4-甲基戊酯、3-甲基戊酯 、2-甲基戊酯、1-甲基戊酯和己酯。
[0045]
本文使用的“c
2-6
炔基”是指具有三键和2至6个碳原子的直链或支链不饱和烃基。“c
2-6
炔基”优选包括“c
2-4
炔基”,并且更优选“c
2-3
炔基”。“c
2-3
炔基”包括例如乙炔基和丙炔基。除了上面列出的“c
2-3
炔基”的实例之外,“c
2-4
炔基”还包括例如丁炔基。除了上面列出的“c
2-4
炔基”的实例之外,“c
2-6
炔基”还包括例如戊炔基和己炔基。
[0046]
本文使用的“3-至6-元饱和碳环”是指具有3-6个碳原子的环状饱和烃基,包括具有部分不饱和键或桥接结构的那些。“3-至6-元饱和碳环”优选包括“5-或6-元单环饱和碳环”。“5-或6-元单环饱和碳环”包括例如环戊烷和环己烷。除了上面列出的“5-或6-元单环饱和碳环”的实例之外,“3-至6-元饱和碳环”还包括例如环丙烷和环丁烷。
[0047]“4-至6-元饱和杂环”基团是指由4-6个原子构成的饱和环,其除碳原子之外还包含1或2个独立地选自氮原子、氧原子和硫原子的原子。“4-至6-元饱和杂环”基团包括具有部分不饱和键或桥接结构的那些。“4-至6-元饱和杂环”基团优选包括“5-或6-元单环饱和杂环”基团。“5-或6-元单环饱和杂环”基团包括例如,四氢呋喃基、吡咯烷基、咪唑烷基、哌啶基、吗啉基、硫代吗啉基、二氧代硫代吗啉基、六亚甲基亚胺基、噁唑烷基、噻唑烷基、氧代咪唑烷基、二氧代咪唑烷基、氧代噁唑烷基、二氧代噁唑烷基、二氧代噻唑烷基、四氢呋喃基、四氢吡喃基。除了上面列出的“5-或6-元单环饱和杂环”基团的实例之外,“4-至6-元饱和杂环”基团还包括例如氧杂环丁烷基和氮杂环丁烷基。
[0048]
在式(1)的化合物中,z、y、m、n、ra、r
1a
、r
1b
、r
1c
、r
1d
、r
2a
、r
2b
、r
2c
、r
2d
、r3、r
4a
、r
4b
、r
4c
、r
4d
、q、r
5a
、r
5b
、r
5c
、r
5d
和r6的优选实例如下所示,但本发明的范围不限于下列化合物的范围。
[0049]
z的一个实施方案包括-cr
a-。z的另一个实施方案包括氮原子。
[0050]
y的一个实施方案包括羰基。y的另一个实施方案包括磺酰基。
[0051]
m的优选实施方案包括1和2。m的更优选实施方案包括1。
[0052]
n的优选实施方案包括0、1和2。n的更优选实施方案包括0和1。n的尤其优选实施方案包括1。
[0053]
ra的优选实施方案包括氢、羟基和c
1-6
烷基。更优选实施方案包括氢和c
1-3
烷基。进一步优选实施方案包括氢、乙基和甲基。最优选实施方案包括氢。
[0054]r1a
、r
1b
、r
1c
和r
1d
的优选实施方案各自独立地包括氢、羟基、卤素和c
1-6
烷基。更优选实施方案包括氢、卤素和c
1-3
烷基。进一步优选实施方案包括氢、氟原子、氯原子、乙基和甲基。尤其优选实施方案包括氢、氟原子和甲基。最优选实施方案包括氢。
[0055]r2a
、r
2b
、r
2c
和r
2d
的优选实施方案各自独立地包括氢、卤素和c
1-6
烷基。更优选实施方案包括氢、卤素和c
1-3
烷基。进一步优选实施方案包括氢、氟原子、氯原子、乙基和甲基。尤其优选实施方案包括氢、氟原子和甲基。最优选实施方案包括氢。
[0056]
r3的优选实施方案包括c
1-6
烷基。更优选实施方案包括c
1-3
烷基。进一步优选实施方案包括乙基和甲基。尤其优选实施方案包括乙基。
[0057]r4a
、r
4b
、r
4c
和r
4d
的优选实施方案各自独立地包括氢、卤素、c
1-6
烷基、c
2-6
炔基和任选被相同或不同的1或2个c
1-6
烷基取代的氨基。更优选实施方案包括氢、卤素、c
1-6
烷基和任选被相同或不同的1或2个c
1-6
烷基取代的氨基。进一步优选实施方案包括氢、卤素和c
1-6
烷基。尤其优选实施方案包括氢和c
1-6
烷基。尤其优选实施方案包括氢、甲基和甲氧基甲基。最优选实施方案包括氢。
[0058]
q的优选实施方案包括(2a)、(2c)、(2d)、(2e)和(2f)。更优选实施方案包括(2a)、(2d)和(2e)。尤其优选实施方案包括(2a)。
[0059]r5a
、r
5b
、r
5c
和r
5d
的优选实施方案各自独立地包括氢、卤素、氰基、c
1-6
烷基、c
1-6
烷氧基和任选被相同或不同的1或2个c
1-6
烷基取代的氨基。更优选实施方案包括氢、卤素、氰基、c
1-6
烷基和c
1-6
烷氧基。进一步优选实施方案包括氢、氟原子和氯原子。尤其优选实施方案包括氢和氟原子。
[0060]
r6的优选实施方案包括氢、c
1-6
烷基和c
3-8
环烷基。更优选实施方案包括氢和c
1-6
烷基。进一步优选实施方案包括氢和c
1-3
烷基。尤其优选实施方案包括氢。
[0061]
式(1)的化合物的一个实施方案包括下列实施方案(a):(a)化合物或其药学上可接受的盐,其中z是氮原子或-cr
a-;y是羰基或磺酰基;m是1或2;n是0、1、2或3;条件是当y是磺酰基时,n不是0;ra是氢或c
1-6
烷基;r
1a
、r
1b
、r
1c
和r
1d
各自独立地是氢或c
1-6
烷基;r
2a
、r
2b
、r
2c
和r
2d
各自独立地是以下基团,并且当存在多个r
2c
或r
2d
时,r
2c
中的每一个或r
2d
中的每一个独立地是以下基团:氢或c
1-6
烷基;r3是c
1-6
烷基;r4a
、r
4b
、r
4c
和r
4d
各自独立地是以下基团,并且当存在多个r
4c
或r
4d
时,r
4c
中的每一个或r
4d
中的每一个独立地是以下基团:氢、卤素、c
1-6
烷基(其中烷基可以任选被相同或不同的1至5个取代基取代,所述取代基选自卤素、羟基、c
1-6
烷氧基、c
1-6
烷基酯和任选被相同或不同的1或2个c
1-6
烷基取代的氨基(其中烷基可以任选被氧代取代))、c
2-6
炔基或氨基(其中氨基可以任选被相同或不同的1或2个c
1-6
烷基取代);条件是当r
4a
、r
4b
、r
4c
和r
4d
中的任意两个各自独立地是上述c
1-6
烷基时,它们可以与它们连接的一个或多个碳原子一起组合形成3-至6-元饱和碳环或4-至6-元饱和杂环,其中当c
1-6
烷基具有取代基时,所述取代基可以作为碳环或杂环的环成员被包括在内;条件是当y是磺酰基和n是1时,r
4c
或r
4d
的任一个是氢;并且当y是磺酰基和n是2或3时,与邻近y的碳原子连接的r
4c
或r
4d
的任一个是氢;和环q是下式(2a)、(2b)、(2c)、(2d)、(2e)或(2f)的基团:其中r
5a
、r
5b
、r
5c
和r
5d
各自独立地是氢、卤素或c
1-6
烷基;和r6是氢或c
1-6
烷基。
[0062]
式(1)的化合物的另一实施方案包括下列实施方案(b):(b)化合物或其药学上可接受的盐,其中z是氮原子或-cr
a-;y是羰基;m是1或2;n是0、1、2或3;ra是氢或c
1-6
烷基;r
1a
、r
1b
、r
1c
和r
1d
各自独立地是氢或c
1-6
烷基;r
2a
、r
2b
、r
2c
和r
2d
各自独立地是以下基团,并且当存在多个r
2c
或r
2d
时,r
2c
中的每一个或r
2d
中的每一个独立地是以下基团:氢或c
1-6
烷基;r3是c
1-6
烷基;r4a
、r
4b
、r
4c
和r
4d
各自独立地是以下基团,并且当存在多个r
4c
或r
4d
时,r
4c
中的每一个或r
4d
中的每一个独立地是以下基团:氢、卤素、c
1-6
烷基(其中烷基可以任选被相同或不同的1至5个取代基取代,所述取代基选自卤素、羟基、c
1-6
烷氧基、c
1-6
烷基酯和任选被相同或不同的1或2个c
1-6
烷基取代的氨基(其中烷基可以任选被氧代取代))、c
2-6
炔基或氨基(其中氨基可以任选被相同或不同的1或2个c
1-6
烷基取代);条件是当r
4a
、r
4b
、r
4c
和r
4d
中的任意两个各自独立地是上述c
1-6
烷基时,它们可以与它们连接的一个或多个碳原子一起组合形成3-至6-元饱和碳环或4-至6-元饱和杂环,其中当c
1-6
烷基具有取代基时,所述取代基可以作为碳环或杂环的环成员被包括在内;环q是下式(2a)、(2b)、(2c)、(2d)、(2e)或(2f)的基团:其中r
5a
、r
5b
、r
5c
和r
5d
各自独立地是氢、卤素或c
1-6
烷基;和r6是氢或c
1-6
烷基。
[0063]
式(1)的化合物的另一实施方案包括下列实施方案(c);(c)化合物或其药学上可接受的盐,其中z是氮原子或-cr
a-;y是磺酰基;m是1或2;n是1、2或3;ra是氢或c
1-6
烷基;r
1a
、r
1b
、r
1c
和r
1d
各自独立地是氢或c
1-6
烷基;r
2a
、r
2b
、r
2c
和r
2d
各自独立地是以下基团,并且当存在多个r
2c
或r
2d
时,r
2c
中的每一个或r
2d
中的每一个独立地是以下基团:氢或c
1-6
烷基;r3是c
1-6
烷基;r
4a
、r
4b
、r
4c
和r
4d
各自独立地是以下基团,并且当存在多个r
4c
或r
4d
时,r
4c
中的每一个或r
4d
中的每一个独立地是以下基团:氢、卤素、c
1-6
烷基(其中烷基可以任选被相同或不同
的1至5个取代基取代,所述取代基选自卤素、羟基、c
1-6
烷氧基、c
1-6
烷基酯和任选被相同或不同的1或2个c
1-6
烷基取代的氨基(其中烷基可以任选被氧代取代))、c
2-6
炔基或氨基(其中氨基任选被相同或不同的1或2个c
1-6
烷基取代);条件是当r
4a
、r
4b
、r
4c
和r
4d
中的任意两个各自独立地是上述c
1-6
烷基时,它们可以与它们连接的一个或多个碳原子一起组合形成3-至6-元饱和碳环或4-至6-元饱和杂环,其中当c
1-6
烷基具有取代基时,所述取代基可以作为碳环或杂环的环成员被包括在内;条件是当n是1时,r
4c
或r
4d
的任一个是氢;并且当n是2或3时,与邻近y的碳原子连接的r
4c
或r
4d
是氢;和环q是下式(2a)、(2b)、(2c)、(2d)、(2e)或(2f)的基团:其中r
5a
、r
5b
、r
5c
和r
5d
各自独立地是氢、卤素或c
1-6
烷基;和r6是氢或c
1-6
烷基。
[0064]
式(1)的化合物的另一实施方案包括下列实施方案(d):(d)化合物或其药学上可接受的盐,其中z是-cr
a-;y是羰基;m是1;n是0或1;ra是氢;r
1a
、r
1b
、r
1c
和r
1d
是氢;r
2a
、r
2b
、r
2c
和r
2d
是氢;r3是c
1-6
烷基;r
4a
、r
4b
、r
4c
和r
4d
各自独立地是以下基团,并且当存在多个r
4c
或r
4d
时,r
4c
中的每一个或r
4d
中的每一个独立地是以下基团:氢、卤素、c
1-6
烷基(其中烷基可以任选被相同或不同的1至5个取代基取代,所述取代基选自卤素、羟基、c
1-6
烷氧基、c
1-6
烷基酯和任选被相同或
不同的1或2个c
1-6
烷基取代的氨基(其中烷基可以任选被氧代取代))、c
2-6
炔基或氨基(其中氨基任选被相同或不同的1或2个c
1-6
烷基取代);条件是当r
4a
、r
4b
、r
4c
和r
4d
中的任意两个各自独立地是上述c
1-6
烷基时,它们可以与它们连接的一个或多个碳原子一起组合形成3-至6-元饱和碳环或4-至6-元饱和杂环,其中当c
1-6
烷基具有取代基时,所述取代基可以作为碳环或杂环的环成员被包括在内;和环q是式(2a)的基团。
[0065]
式(1)的化合物的另一实施方案包括下列实施方案(e):(e)化合物或其药学上可接受的盐,其中z是-cr
a-;y是羰基;m是1;n是0或1;ra是氢;r
1a
、r
1b
、r
1c
和r
1d
各自独立地是氢;r
2a
、r
2b
、r
2c
和r
2d
各自独立地是氢;r3是c
1-6
烷基;r
4a
、r
4b
、r
4c
和r
4d
各自独立地是以下基团,并且当存在多个r
4c
或r
4d
时,r
4c
中的每一个或r
4d
中的每一个独立地是以下基团:氢、卤素、c
1-6
烷基(其中烷基可以任选被相同或不同的1至5个取代基取代,所述取代基选自卤素、羟基、c
1-6
烷氧基、c
1-6
烷基酯和任选被相同或不同的1或2个c
1-6
烷基取代的氨基(其中烷基可以任选被氧代取代))、c
2-6
炔基或氨基(其中氨基任选被相同或不同的1或2个c
1-6
烷基取代);条件是当r
4a
、r
4b
、r
4c
和r
4d
中的任意两个各自独立地是上述c
1-6
烷基时,它们可以与它们连接的一个或多个碳原子一起组合形成3-至6-元饱和碳环或4-至6-元饱和杂环,其中当c
1-6
烷基具有取代基时,所述取代基可以作为碳环或杂环的环成员被包括在内;和环q是式(2d)的基团。
[0066]
式(1)的化合物的另一实施方案包括下列实施方案(f):(f)化合物或其药学上可接受的盐,其中z是-cr
a-;y是羰基;m是1;n是0或1;ra是氢;r
1a
、r
1b
、r
1c
和r
1d
是氢;r
2a
、r
2b
、r
2c
和r
2d
是氢;r3是c
1-6
烷基;r
4a
、r
4b
、r
4c
和r
4d
各自独立地是以下基团,并且当存在多个r
4c
或r
4d
时,r
4c
中的每一个或r
4d
中的每一个独立地是以下基团:氢、卤素、c
1-6
烷基(其中烷基可以任选被相同或不同的1至5个取代基取代,所述取代基选自卤素、羟基、c
1-6
烷氧基、c
1-6
烷基酯和任选被相同或不同的1或2个c
1-6
烷基取代的氨基(其中烷基可以任选被氧代取代))、c
2-6
炔基或氨基(其中
氨基任选被相同或不同的1或2个c
1-6
烷基取代);条件是当r
4a
、r
4b
、r
4c
和r
4d
中的任意两个各自独立地是上述c
1-6
烷基时,它们可以与它们连接的一个或多个碳原子一起组合形成3-至6-元饱和碳环或4-至6-元饱和杂环,其中当c
1-6
烷基具有取代基时,所述取代基可以作为碳环或杂环的环成员被包括在内;和环q是式(2e)的基团。
[0067]
式(1)的化合物的另一实施方案包括下列实施方案(g):(g)化合物或其药学上可接受的盐,其中z是-cr
a-;y是磺酰基;m是1;n是1;ra是氢;r
1a
、r
1b
、r
1c
和r
1d
是氢;r
2a
、r
2b
、r
2c
和r
2d
是氢;r3是c
1-6
烷基;r
4a
、r
4b
、r
4c
和r
4d
各自独立地是以下基团,并且当存在多个r
4c
或r
4d
时,r
4c
中的每一个或r
4d
中的每一个独立地是以下基团:氢、卤素、c
1-6
烷基(其中烷基可以任选被相同或不同的1至5个取代基取代,所述取代基选自卤素、羟基、c
1-6
烷氧基、c
1-6
烷基酯和任选被相同或不同的1或2个c
1-6
烷基取代的氨基(其中烷基可以任选被氧代取代))、c
2-6
炔基或氨基(其中氨基任选被相同或不同的1或2个c
1-6
烷基取代);条件是当r
4a
、r
4b
、r
4c
和r
4d
中的任意两个各自独立地是上述c
1-6
烷基时,它们可以与它们连接的一个或多个碳原子一起组合形成3-至6-元饱和碳环或4-至6-元饱和杂环,其中当c
1-6
烷基具有取代基时,所述取代基可以作为碳环或杂环的环成员被包括在内;条件是r
4c
或r
4d
的任一个是氢;和环q是式(2a)的基团。
[0068]
式(1)的化合物的另一实施方案包括下列实施方案(h):(h)化合物或其药学上可接受的盐,其中z是-cr
a-;y是磺酰基;m是1;n是1;ra是氢;r
1a
、r
1b
、r
1c
和r
1d
是氢;r
2a
、r
2b
、r
2c
和r
2d
是氢;r3是c
1-6
烷基;r
4a
、r
4b
、r
4c
和r
4d
各自独立地是以下基团,并且当存在多个r
4c
或r
4d
时,r
4c
中的每一个或r
4d
中的每一个独立地是以下基团:氢、卤素、c
1-6
烷基(其中烷基可以任选被相同或不同的1至5个取代基取代,所述取代基选自卤素、羟基、c
1-6
烷氧基、c
1-6
烷基酯、任选被相同或不同的1或2个c
1-6
烷基取代的氨基(其中烷基可以任选被氧代取代))、c
2-6
炔基或氨基(其中氨
基任选被相同或不同的1或2个c
1-6
烷基取代);条件是当r
4a
、r
4b
、r
4c
和r
4d
中的任意两个各自独立地是上述c
1-6
烷基时,它们可以与它们连接的一个或多个碳原子一起组合形成 3-至6-元饱和碳环或4-至6-元饱和杂环,其中当c
1-6
烷基具有取代基时,所述取代基可以作为碳环或杂环的环成员被包括在内;条件是r
4c
或r
4d
的任一个是氢;和环q是式(2e)的基团。
[0069]
式(1)的化合物可以具有至少一个不对称碳原子。因此,本化合物包括式(1)的化合物的外消旋体,以及式(1)的化合物的旋光异构体。当式(1)的化合物具有两个或更多个不对称碳原子时,它可以具有立体异构性。因此,本化合物包括式(1)的化合物的立体异构体及其混合物。
[0070]
另外,其中式(1)的化合物中的任意一个、两个或更多个1h被2h(d)替换的氘代化合物也包括在式(1)的化合物中。
[0071]
式(1)的化合物或其药学上可接受的盐可以以水合物和/或溶剂合物的形式存在,并且该水合物和溶剂合物例如乙醇溶剂合物包括在本化合物中。此外,本化合物还包括其所有实施方案的结晶形式的那些。
[0072]
当式(1)的化合物具有酸性基团时,其药学上可接受的盐包括例如碱金属盐如钠盐和钾盐;碱土金属盐如钙盐和镁盐;无机金属盐如锌盐;以及有机碱盐如三乙胺、三乙醇胺、三羟甲基氨基甲烷和氨基酸。
[0073]
当式(1)的化合物具有碱性基团时,其药学上可接受的盐包括例如无机酸盐如盐酸盐、氢溴酸盐、硫酸盐、磷酸盐和硝酸盐;有机酸盐如乙酸盐、丙酸盐、琥珀酸盐、乳酸盐、苹果酸盐、酒石酸盐、柠檬酸盐、马来酸盐、富马酸盐、甲磺酸盐、对甲苯磺酸盐、苯磺酸盐、抗坏血酸盐和乳清酸盐。
[0074]
以下,结合实施例对本化合物的制备方法进行说明,但本发明不限于此。
[0075]
制备方法本化合物可以通过任何下述制备方法以及与已知方法组合的方法制备。
[0076]
以下方案中出现的每种化合物也可以是其盐形式,并且此类盐可以包括例如例示为式(1)的化合物的盐的相应的盐。以下提及的反应仅是示例,并且因此本化合物可以基于有机合成技术人员的知识任选地通过其他方式制备。
[0077]
如果在下述制备方法中存在需要保护的官能团,可以适当保护该官能团,然后在完成反应或反应序列后脱保护以获得所需化合物,即使没有具体指出使用任何保护基也是如此。
[0078]
本文使用的保护基包括例如描述于t. w. greene和p. g. m. wuts, "protective groups in organic synthesis", 3rd ed., john wiley and sons, inc., new york (1999)的一般保护基。更详细地,氨基的保护基包括例如苄氧羰基、叔丁氧羰基、乙酰基和苄基。羟基的保护基包括例如三烷基甲硅烷基、乙酰基和苄基。
[0079]
保护和脱保护可以通过有机合成化学中的常规方式(例如,描述于t. w. greene和p. g. m. wuts, "protective groups in organic synthesis", 3rd ed., john wiley and sons, inc., new york (1999)中的方式)或它们的类似方式进行制备方法1
式(1)的化合物中的式(1a)的化合物可以例如通过以下方法制备:其中z、m、n、r
1a
、r
1b
、r
1c
、r
1d
、r
2a
、r
2b
、r
2c
、r
2d
、r3、r
4a
、r
4b
、r
4c
、r
4d
和环q如上述项目[1]所定义。
[0080]
化合物(1a)通过使化合物(4)和式(5)的羧酸在合适的惰性溶剂中在合适的缩合剂存在下反应来制备。该反应可以在合适的碱存在下进行。反应温度范围通常在约-20℃至本文所用溶剂的沸点。反应时间取决于反应条件如反应温度、本文使用的缩合剂、起始材料和本文使用的溶剂,并且通常范围为10分钟至48小时。
[0081]
本文使用的缩合剂的实例包括二环己基碳二亚胺(dcc)、二异丙基碳二亚胺(dipc)、1-乙基-3-(3-二甲基氨基丙基)-碳二亚胺(wsc)、苯并三唑-1-基-三(二甲基氨基)磷鎓六氟磷酸盐(bop)、二苯基磷酰胺(dppa)、n,n-羰基二咪唑(cdi)、苯并三唑-1-基-n,n,n',n'-四甲基脲鎓六氟磷酸盐(hbtu) 和 o-(7-氮杂苯并三唑-1-基)-n,n,n',n'-四甲基脲六氟磷酸盐(hatu)。
[0082]
必要时,可加入添加剂,例如n-羟基琥珀酰亚胺(hosu)、1-羟基苯并三唑(hobt)、3-羟基-4-氧代-3,4-二氢-1,2,3-苯并三嗪(hoobt)。
[0083]
本文使用的碱的实例包括有机碱如三乙胺、二异丙基乙胺和吡啶;无机碱如碳酸钾、碳酸钠、碳酸铯、碳酸氢钾、碳酸氢钠、磷酸二氢钾、磷酸氢二钾、磷酸钾、磷酸二氢钠、磷酸氢二钠、磷酸钠、氢氧化钾、氢氧化钠和氢化钠;以及金属醇盐如甲醇钠和叔丁醇钾。
[0084]
本文使用的惰性溶剂的实例包括卤代烃如氯仿和二氯甲烷;芳族烃如苯和甲苯;醚溶剂如乙醚、四氢呋喃(thf)和1,4-二氧杂环己烷;非质子极性溶剂如乙腈、丙酮、甲乙酮、二甲基甲酰胺、n-甲基-2-吡咯烷酮和二甲亚砜;碱性溶剂如吡啶;及其混合溶剂。
[0085]
制备方法2式(4)的化合物中的式(4a)的化合物可以例如通过以下方法制备:在该方案中,z、r
1a
、r
1b
、r
1c
、r
1d
、r
2a
、r
2b
、r
2c
、r
2d
、r3和环q如上述项目[1]所定义;和l是0、1、2或3。
[0086]
化合物(8)可以通过使化合物(6)和式(7)的醛在还原胺化下与合适的还原剂在合
适的惰性溶剂中反应来制备。必要时,该反应可以在合适的碱或酸的存在下进行。反应温度范围通常在约-20℃至本文所用溶剂的沸点。反应时间取决于反应条件如反应温度、本文使用的缩合剂、起始材料和本文使用的溶剂,并且通常范围为10分钟至48小时。
[0087]
本文使用的还原剂的实例包括复合氢化合物,例如三乙酰氧基硼氢化钠、氢化铝锂、硼氢化钠和氰基硼氢化钠;以及硼烷络合物如硼烷-二甲硫醚络合物和硼烷-四氢呋喃络合物。
[0088]
本文使用的碱的实例包括有机碱如三乙胺、二异丙基乙胺和吡啶;无机碱如碳酸钾、碳酸钠、碳酸铯、碳酸氢钾、碳酸氢钠、磷酸二氢钾、磷酸氢二钾、磷酸钾、磷酸二氢钠、磷酸氢二钠、磷酸钠、氢氧化钾、氢氧化钠和氢化钠;以及金属醇盐如甲醇钠和叔丁醇钾。
[0089]
本文使用的酸的实例包括有机酸如乙酸、三氟乙酸和甲磺酸;和无机酸如盐酸和硫酸。
[0090]
本文使用的惰性溶剂的实例包括水;乙腈;卤代烃如氯仿和二氯甲烷;芳族烃如苯和甲苯;醚溶剂如1,2-二甲氧基乙烷、四氢呋喃和1,4-二氧杂环己烷;醇溶剂如甲醇、乙醇和2-丙醇;非质子极性溶剂如二甲基甲酰胺和n-甲基-2-吡咯烷酮;及其混合溶剂。
[0091]
化合物(4a)可以通过用合适的酸在合适的惰性溶剂中处理化合物(8)来制备。反应温度范围通常在约-20℃至本文所用溶剂的沸点。反应时间取决于反应条件如反应温度、本文使用的酸、起始材料和本文使用的溶剂,并且通常范围为10分钟至48小时。
[0092]
本文使用的酸的实例包括有机酸如三氟乙酸;和无机酸如盐酸和硫酸。
[0093]
本文使用的惰性溶剂的实例包括卤代烃如氯仿和二氯甲烷;芳族烃如苯和甲苯;醚溶剂如乙醚、四氢呋喃、1,4-二氧杂环己烷和1,2-二甲氧基乙烷;低级醇如甲醇、乙醇和2-丙醇;以及非质子极性溶剂如乙腈、二甲基甲酰胺、n-甲基-2-吡咯烷酮和二甲亚砜;及其混合溶剂。
[0094]
制备方法3式(8)的化合物可以例如通过以下方法制备。
[0095]
在该方案中,z、m、r
1a
、r
1b
、r
1c
、r
1d
、r
2a
、r
2b
、r
2c
、r
2d
、r3和环q如上述项目[1]所定义;lg是离去基团,例如碘、溴、氯、取代的磺酰基(例如甲磺酰基和对甲苯磺酰基)。
[0096]
化合物(8)可以通过使化合物(6)与式(9)的烷基化剂在合适的惰性溶剂中反应来制备。必要时,该反应可以在合适的碱存在下,并且进一步在合适的相转移催化剂存在下进行。反应温度范围通常在约-20℃至本文所用溶剂的沸点。反应时间取决于反应条件如反应温度、本文使用的碱、起始材料和本文使用的溶剂,并且通常范围为10分钟至48小时。
[0097]
本文使用的碱的实例包括有机碱如三乙胺、二异丙基乙胺和吡啶;无机碱如碳酸钾、碳酸钠、碳酸铯、碳酸氢钾、碳酸氢钠、磷酸二氢钾、磷酸氢二钾、磷酸钾、磷酸二氢钠、磷酸氢二钠、磷酸钠、氢氧化钾、氢氧化钠和氢化钠;以及金属醇盐如甲醇钠和叔丁醇钾。
[0098]
本文使用的相转移催化剂的实例包括四丁基硫酸氢铵。
[0099]
本文使用的惰性溶剂的实例包括卤代烃如氯仿和二氯甲烷;芳族烃如苯和甲苯;醚溶剂如乙醚、四氢呋喃(thf)和1,4-二氧杂环己烷;低级醇如甲醇、乙醇和2-丙醇;非质子极性溶剂如乙腈、丙酮、甲乙酮、二甲基甲酰胺、n-甲基-2-吡咯烷酮和二甲亚砜;及其混合溶剂。
[0100]
化合物(11)可以通过使化合物(6)与式(10)的烷基化剂在合适的惰性溶剂中反应来制备。必要时,该反应可以在合适的碱存在下,并且进一步在合适的相转移催化剂存在下进行。反应温度范围通常在约-20℃至本文所用溶剂的沸点。反应时间取决于反应条件如反应温度、本文使用的碱、起始材料和本文使用的溶剂,并且通常范围为10分钟至48小时。
[0101]
本文使用的碱的实例包括有机碱如三乙胺、二异丙基乙胺和吡啶;无机碱如碳酸钾、碳酸钠、碳酸铯、碳酸氢钾、碳酸氢钠、磷酸二氢钾、磷酸氢二钾、磷酸钾、磷酸二氢钠、磷酸氢二钠、磷酸钠、氢氧化钾、氢氧化钠和氢化钠;以及金属醇盐如甲醇钠和叔丁醇钾。
[0102]
本文使用的相转移催化剂的实例包括四丁基硫酸氢铵。
[0103]
本文使用的惰性溶剂的实例包括卤代烃如氯仿和二氯甲烷;芳族烃如苯和甲苯;
醚溶剂如乙醚、四氢呋喃(thf)和1,4-二氧杂环己烷;低级醇如甲醇、乙醇和2-丙醇;非质子极性溶剂如乙腈、丙酮、甲乙酮、二甲基甲酰胺、n-甲基-2-吡咯烷酮和二甲亚砜;及其混合溶剂。
[0104]
化合物(8)可以通过使化合物(11)与式(12)的烷基化剂在合适的惰性溶剂中反应来制备。必要时,该反应可以在合适的碱存在下,并且进一步在合适的相转移催化剂存在下进行。反应温度范围通常在约-20℃至本文所用溶剂的沸点。反应时间取决于反应条件如反应温度、本文使用的碱、起始材料和本文使用的溶剂,并且通常范围为10分钟至48小时。
[0105]
本文使用的碱的实例包括有机碱如三乙胺、二异丙基乙胺和吡啶;无机碱如碳酸钾、碳酸钠、碳酸铯、碳酸氢钾、碳酸氢钠、磷酸二氢钾、磷酸氢二钾、磷酸钾、磷酸二氢钠、磷酸氢二钠、磷酸钠、氢氧化钾、氢氧化钠和氢化钠;以及金属醇盐如甲醇钠和叔丁醇钾。
[0106]
本文使用的相转移催化剂的实例包括四丁基硫酸氢铵。
[0107]
本文使用的惰性溶剂的实例包括卤代烃如氯仿和二氯甲烷;芳族烃如苯和甲苯;醚溶剂如乙醚、四氢呋喃(thf)和1,4-二氧杂环己烷;低级醇如甲醇、乙醇和2-丙醇;非质子极性溶剂如乙腈、丙酮、甲乙酮、二甲基甲酰胺、n-甲基-2-吡咯烷酮和二甲亚砜;及其混合溶剂。
[0108]
制备方法4在式(1)的化合物中,式(1f)的化合物可以例如通过以下方法制备。
[0109]
在该方案中,z、m、r
1a
、r
1b
、r
1c
、r
1d
、r
2a
、r
2b
、r
2c
、r
2d
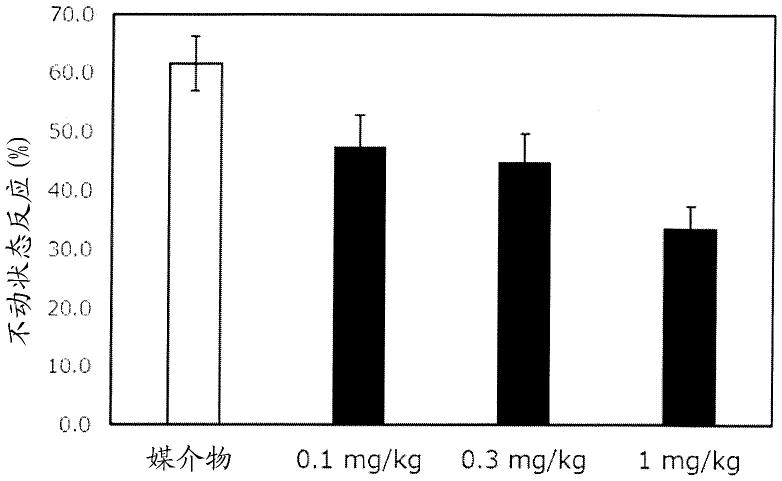
、r3、r
4a
、r
4b
、r
4c
和环q如上述项目[1]所定义。
[0110]
化合物(14)可以通过使化合物(4)与式(13)的磺酰氯在合适的惰性溶剂存在下反应来制备。该反应可以在合适的碱存在下进行。反应温度范围通常在约-20℃至本文所用溶剂的沸点。反应时间取决于反应条件如反应温度、本文使用的起始材料和溶剂,并且通常范围为10分钟至48小时。
[0111]
本文使用的碱的实例包括有机碱如三乙胺、二异丙基乙胺和吡啶;无机碱如碳酸钾、碳酸钠、碳酸铯、碳酸氢钾、碳酸氢钠、磷酸二氢钾、磷酸氢二钾、磷酸钾、磷酸二氢钠、磷
n-羟基琥珀酰亚胺(hosu)、1-羟基苯并三唑(hobt)和3-羟基-4-氧代-3,4-二氢-1,2,3-苯并三嗪(hoobt)。
[0120]
本文使用的碱的实例包括有机碱如三乙胺、二异丙基乙胺和吡啶;无机碱如碳酸钾、碳酸钠、碳酸铯、碳酸氢钾、碳酸氢钠、磷酸二氢钾、磷酸氢二钾、磷酸钾、磷酸二氢钠、磷酸氢二钠、磷酸钠、氢氧化钾、氢氧化钠和氢化钠;以及金属醇盐如甲醇钠和叔丁醇钾。
[0121]
本文使用的惰性溶剂的实例包括卤代烃如氯仿和二氯甲烷;芳族烃如苯和甲苯;醚溶剂如乙醚、四氢呋喃(thf)和1,4-二氧杂环己烷;非质子极性溶剂如乙腈、丙酮、甲乙酮、二甲基甲酰胺、n-甲基-2-吡咯烷酮和二甲亚砜;碱性溶剂如吡啶;及其混合溶剂。
[0122]
化合物(17)可以通过使化合物(15)与锂化化合物反应来制备,该锂化化合物通过用有机锂如正丁基锂在合适的惰性溶剂中处理化合物(16)产生。反应温度范围通常在约-78℃至本文所用溶剂的沸点。反应时间取决于反应条件如反应温度、本文使用的试剂、起始材料和本文使用的溶剂,并且通常范围为10分钟至48小时。
[0123]
本文使用的惰性溶剂的实例包括芳族烃如苯和甲苯;醚溶剂如乙醚、四氢呋喃(thf)和1,4-二氧杂环己烷;及其混合溶剂。
[0124]
必要时,化合物(18)可以通过化合物(17)与羟胺或其盐在合适碱的存在下反应来制备。反应温度范围通常在约-20℃至本文所用溶剂的沸点。反应时间取决于反应条件如反应温度、本文使用的碱、起始材料和本文使用的溶剂,并且通常范围为10分钟至48小时。
[0125]
本文使用的碱的实例包括有机碱如三乙胺、二异丙基乙胺和吡啶;无机碱如碳酸钾、碳酸钠、碳酸铯、碳酸氢钾、碳酸氢钠、磷酸二氢钾、磷酸氢二钾、磷酸钾、磷酸二氢钠、磷酸氢二钠、磷酸钠、氢氧化钾、氢氧化钠和氢化钠;金属醇盐如甲醇钠和叔丁醇钾;以及乙酸钠。
[0126]
本文使用的溶剂的实例包括芳族烃如苯和甲苯;醚溶剂如乙醚、四氢呋喃(thf)和1,4-二氧杂环己烷;低级醇如甲醇、乙醇和2-丙醇;非质子极性溶剂如二甲基甲酰胺和 n-甲基-2-吡咯烷酮;水;及其混合溶剂。
[0127]
化合物(19)可以通过用合适的碱在合适的惰性溶剂中处理化合物(18)来制备。反应温度范围通常在约-20℃至本文所用溶剂的沸点。反应时间取决于反应条件如反应温度、本文使用的碱、起始材料和本文使用的溶剂,并且通常范围为10分钟至48小时。
[0128]
本文使用的碱的实例包括有机碱如三乙胺、二异丙基乙胺和吡啶;无机碱如碳酸钾、碳酸钠、碳酸铯、碳酸氢钾、碳酸氢钠、磷酸二氢钾、磷酸氢二钾、磷酸钾、磷酸二氢钠、磷酸氢二钠、磷酸钠、氢氧化钾、氢氧化钠和氢化钠;以及金属醇盐如甲醇钠和叔丁醇钾。
[0129]
本文使用的惰性溶剂的实例包括卤代烃如氯仿和二氯甲烷;芳族烃如苯和甲苯;醚溶剂如乙醚、四氢呋喃(thf)和1,4-二氧杂环己烷;低级醇如甲醇、乙醇和2-丙醇;非质子极性溶剂如乙腈、丙酮、甲乙酮、二甲基甲酰胺、n-甲基-2-吡咯烷酮和二甲亚砜;及其混合溶剂。
[0130]
化合物(6a)可以通过用合适的酸在合适的惰性溶剂中处理化合物(19)来制备。反应温度范围通常在约-20℃至本文所用溶剂的沸点。反应时间取决于反应条件如反应温度、本文使用的酸、起始材料和本文使用的溶剂,并且通常范围为10分钟至48小时。
[0131]
本文使用的惰性溶剂的实例包括卤代烃如氯仿和二氯甲烷;芳族烃如苯和甲苯;醚溶剂如乙醚、四氢呋喃、1,4-二氧杂环己烷和1,2-二甲氧基乙烷;低级醇如甲醇、乙醇和
2-丙醇;非质子极性溶剂如乙腈、二甲基甲酰胺、n-甲基-2-吡咯烷酮和二甲亚砜;及其混合溶剂。
[0132]
本文使用的酸的实例包括无机酸如盐酸和硫酸;和有机酸如三氟乙酸。
[0133]
在所需位置具有所需官能团的本化合物可以通过适当组合上述制备方法来制备。上述制备过程中各中间体或产物的分离和纯化可通过有机合成中的常规方法进行,例如通过适当组合过滤、萃取、洗涤、干燥、浓缩、结晶、各种色谱法来进行。一些中间体可以不经纯化用于下一步。
[0134]
上述制备方法中的一些起始化合物或中间体可以根据反应条件以盐形式如盐酸盐形式存在,但可以按原样使用或以其游离形式使用。当以盐形式获得起始化合物或中间体并且需要以其游离形式使用或获得时,可以通过将其溶解或悬浮在合适的溶剂中并用碱如碳酸氢钠水溶液中和所得溶液或悬浮液,将其转化为其游离形式。
[0135]
一些式(1)化合物或其药学上可接受的盐可以作为异构体存在,例如互变异构体(例如,酮-烯醇形式)、位置异构体、几何异构体和光学异构体。本发明涵盖每种可能的异构体,包括上述异构体,以及它们具有各种混合比例的混合物。
[0136]
光学异构体可以通过已知的分离方法拆分,例如在上述制备方法中的合适步骤中使用光学活性柱和分级结晶的方法。另外,也可以使用光学活性的起始材料作为起始材料。
[0137]
为获得式(1)的化合物或其盐,当产物为式(1)的化合物的盐时,应直接纯化产物;或者当产物为式(1)的化合物的游离形式时,应将产物溶解或悬浮在适当的溶剂中,然后应向其中加入酸或碱以形成其盐。
[0138]
本化合物具有5-ht
2a
受体拮抗活性和5-ht7受体拮抗活性,并且具有与现有其他治疗精神疾病的药剂不同的机制。本化合物可为各种精神疾病的用药提供新的选择。具体而言,本化合物有益于治疗精神疾病。本化合物还有益于治疗中枢神经系统疾病。
[0139]
预期得到有效治疗的精神疾病或中枢神经系统疾病包括例如国际疾病分类第10版(icd-10)中的f00-f09:器质性精神障碍,包括症状性精神障碍,f10-f19:使用精神活性物质引起的精神和行为障碍,f20-f29:精神分裂症、分裂型障碍和妄想障碍,f30-f39:情感[情绪]障碍,f40-f48:神经障碍、压力相关障碍和躯体形式障碍,f51:非器质性睡眠障碍,f52:非器质性障碍或疾病引起的性功能障碍,f84:广泛性发育障碍,f90-f98:通常在儿童期和青春期发病的行为和情绪障碍,g20-g26:锥体外系和运动障碍,g30-g32:其他神经系统退行性疾病,以及g47:睡眠障碍。
[0140]
f00-f09:器质性精神障碍,包括症状性精神障碍,包括例如阿尔茨海默病、血管性痴呆、路易体痴呆、帕金森病痴呆、由其他疾病如脑损伤导致的精神障碍,以及由脑功能障碍和身体疾病导致的其他精神障碍。
[0141]
f10-f19:由使用精神活性物质导致的精神和行为障碍包括由使用各种物质导致的震颤谵妄、精神病性障碍和遗忘综合征。
[0142]
f20-f29:精神分裂症、分裂型障碍和妄想障碍包括偏执型精神分裂症、单纯型精神分裂症和妄想障碍。
[0143]
f30-f39:情感[情绪]障碍包括躁狂发作、双相情感障碍和抑郁发作。
[0144]
f40-f48:神经障碍、压力相关障碍和躯体形式障碍包括恐惧性焦虑障碍、强迫症和躯体形式障碍。
[0145]
f51:非器质性睡眠障碍包括非器质性失眠、梦游和噩梦。
[0146]
f52:非器质性障碍或疾病引起的性功能障碍包括缺乏或丧失性欲和未明确的性功能障碍。
[0147]
f84:广泛性发育障碍包括例如与智力迟钝和刻板动作相关的自闭症和过度活跃障碍。
[0148]
f90-f98:通常在儿童期和青春期发病的多动障碍和行为和情绪障碍包括多动障碍、品行障碍以及行为和情绪的混合障碍。
[0149]
g20-g26:锥体外系和运动障碍包括帕金森病和继发性帕金森病。
[0150]
g30-g32:其他神经系统退行性疾病包括阿尔茨海默病、额颞叶痴呆、额颞叶变性、路易体痴呆和大脑老年变性。
[0151]
g47:睡眠障碍包括睡眠的启动和维持障碍[失眠]、睡眠-觉醒时间程序障碍、发作性睡病和猝倒。
[0152]
本化合物可用于治疗或预防与这些疾病相关的各种症状的复发,例如精神病症状、睡眠障碍、抑郁症状、焦虑症状和认知功能障碍。
[0153]
血清素(5-羟色胺:5-ht)是中枢神经系统的主要神经递质之一,已知与各种脑功能如情绪反应和认知功能有关。5-ht
2a
受体是5-ht受体亚型之一,在例如大脑皮质、海马和中缝核中高度表达。还已知在前额皮质中表达的5-ht
2a
正调节腹侧被盖区域的多巴胺神经通路(非专利文献2)。也就是说,抑制前额叶皮层中的5-ht
2a
受体被认为会导致对精神病症状的抑制作用。
[0154]
5-ht7受体例如在下丘脑、丘脑、海马、中缝核中广泛表达,并且参与哺乳动物的昼夜节律的调节(非专利文献9)。已知昼夜节律缺陷与多种cns障碍有关,尤其是抑郁症、季节性情感障碍、睡眠障碍、轮班工作综合征和时差感。对5-ht7受体具有拮抗活性的药物包括用作治疗精神分裂症和躁郁症的药剂的鲁拉西酮和用于治疗重度抑郁症的沃替西汀。然而,不存在对5-ht7受体具有选择性拮抗活性的药物。
[0155]
还已知在某些动物模型中,拮抗5-ht7受体导致抗抑郁和抗焦虑作用,以及改善认知功能的作用(非专利文献6、非专利文献7)。
[0156]
根据以上药理学知识,预计抑制5-ht
2a
受体与抑制5-ht7受体一起可用于各种神经精神疾病如抑郁症、睡眠障碍和精神病症状。没有关于对5-ht
2a
受体和5-ht7受体均具有选择性和强效拮抗活性的药物的报道。
[0157]
本化合物对5-ht
2a
受体和5-ht7受体具有强结合亲和力(试验1),并且对5-ht
2a
受体和5-ht7受体均显示拮抗活性。在本发明的优选实施方案中,本化合物在不引起由d2拮抗活性导致的副作用如锥体外系症状和高泌乳素血症的血液浓度下,能够发挥基于对5-ht
2a
受体和5-ht7受体的拮抗能力的药理作用,因为本化合物对5-ht
2a
受体和5-ht7受体的结合亲和力是对d2受体的结合亲和力的100倍。
[0158]
在本发明的另一个优选实施方案中,由于长qt中作为心律失常的表达指标的herg通道的抑制浓度与预期药理作用的表达浓度之间存在大差异,因此预期本化合物对心血管系统的作用小(试验5)。
[0159]
药物的消除半衰期(“t
1/2”)是决定给药频率以保持其效果的一个因素。认为t
1/2
短的药物每天多次施用会导致忘记服药或未完成服药,并可能导致妨碍合适的药物治疗。此
外,如果施用频率增加,则担心与高剂量施用相关的副作用发生率会增加或耐受性会降低。从上述观点来看,如果发现t
1/2
长的药物,该药物有望成为上述问题极少的长效药物,可以引起用药患者的责任减轻。
[0160]
在本化合物的优选实施方案中,本化合物的估计人体消除半衰期(“t
1/2”)为8小时或更长(试验4)。因此,有望可以在人体内长期保持药物功效,可以提高服药患者的药物依从性,并且可以在施用时表现出高耐受性。
[0161]
本化合物可以口服或肠胃外施用。在口服施用的情况下,该化合物可以以常用剂型施用。在肠胃外施用的情况下,化合物可以例如以局部施用形式、注射形式、经皮形式和经鼻形式施用。口服形式或直肠施用形式包括例如胶囊、片剂、丸剂、散剂、扁囊剂、栓剂和液体。注射形式包括例如无菌溶液和悬浮液。局部施用形式包括例如乳膏、软膏、洗剂和透皮制剂(例如普通贴剂和基质)。
[0162]
上述剂型用药学上可接受的赋形剂和添加剂以常规方式制备。药学上可接受的赋形剂和添加剂包括载体、粘合剂、调味剂、缓冲剂、增稠剂、着色剂、稳定剂、乳化剂、分散剂、悬浮剂和防腐剂。
[0163]
药学上可接受的载体包括例如碳酸镁、硬脂酸镁、滑石、糖、乳糖、果胶、糊精、淀粉、明胶、黄蓍胶、甲基纤维素、羧甲基纤维素钠、低熔点蜡和可可脂。可以通过用本化合物和药学上可接受的载体填充胶囊来制备胶囊形式。可以将本化合物放入有或没有药学上可接受的赋形剂的胶囊中。也可以类似的方式制备扁囊剂。
[0164]
可注射液体形式包括溶液、悬浮液和乳液,包括例如水溶液和水-丙二醇溶液。液体形式可以包含水,并且也可以在聚乙二醇或/和聚丙二醇溶液中制备。适合口服施用的液体形式可以通过将本化合物加入水中并还酌情向其中加入着色剂、调味剂、稳定剂、甜味剂、增溶剂或增稠剂来制备。或者,可以通过将本化合物和分散剂加入水中并使液体变粘来制备适合口服施用的液体形式。本文使用的增稠剂包括例如药学上可接受的天然或合成树胶、树脂、甲基纤维素、羧甲基纤维素钠和已知的悬浮剂。
[0165]
每种化合物的剂量可以取决于患者的疾病、年龄、体重、性别、症状和施用途径。通常,本化合物以0.1至1000 mg/天,优选1至300 mg/天,每天一次或每天2至3个分剂量施用于成人(体重:50 kg)。或者,它可以在几天到几周施用一次。
[0166]
为了增强效果和/或减少其副作用,本化合物可以与另一种药物组合使用。例如,本化合物可以与抗焦虑药如选择性血清素再摄取抑制剂组合使用。以下,可与本化合物组合使用的药物简称为“伴随药物”。
[0167]
本文使用的伴随药物的实例包括用于治疗发育障碍如自闭症谱系障碍和注意力缺陷多动障碍的药物、抗精神病药物和精神分裂症药物、用于治疗躁郁症的药物、抗抑郁药物、抗焦虑药物、用于治疗强迫症的药物、用于治疗应激障碍如创伤后应激障碍的药物、用于治疗情感障碍的药物、用于治疗进食障碍的药物、用于治疗睡眠障碍如失眠、嗜睡症、睡眠呼吸暂停综合征和昼夜节律障碍的药物、用于治疗性功能障碍的药物、用于治疗药物依赖的药物、用于治疗痴呆如阿尔茨海默病的药物、用于治疗与痴呆相关的行为和心理症状的药物、脑代谢和循环改善药物、用于治疗运动障碍如帕金森病的药物、镇痛药物、抗癫痫药物、抗惊厥药物、偏头痛药物、麻醉剂和中枢兴奋剂。
[0168]
本化合物与其伴随药物之间的施用间隔不受限制;即,可将伴随药物与本化合物
同时或以合适的时间间隔适用于对象患者。或者,可以将本化合物及其伴随药物配制成包含它们的组合药物。伴随药物的剂量可以根据其临床使用剂量适当确定。本化合物及其伴随药物的组合比例可以根据其待施用对象患者、施用途径、疾病、病理及其组合来适当确定。例如,当对象患者是人时,可以以每1重量份的本化合物0.01至100重量份的方式使用伴随药物。为了减轻副作用,可以组合使用伴随药物如止吐药、睡眠诱导药和抗惊厥药。
[0169]
实例下面通过参照参考例、实施例和试验更详细地解释本发明;然而,本发明的范围不限于此。参考例和实施例中使用的化合物名称并不总是基于iupac命名系统。为了简洁,可以使用缩写,并且这些缩写具有与上述那些相同的含义。
[0170]
通过质子核磁共振吸收光谱(1h-nmr)或lc-ms鉴定化合物。参考例和实施例中的氨基色谱使用来自yamazen corporation的氨基柱进行。在下表所示的各种条件下进行lc-ms。保留时间(r.t.)表示质谱峰出现在lc-ms测量中的时间。
[0171]
粉末x射线衍射(粉末xrd)测量在下表中所示的各种条件下进行。
[0172]
在下表所示的各种条件下进行差示扫描量热法(dsc)测量。
[0173]
说明书中可能使用以下缩写。
[0174]
在参考例和实施例的nmr数据中,使用以下缩写。me: 甲基dmf: n,n-二甲基甲酰胺thf: 四氢呋喃tert-: 叔cdcl3: 氘代氯仿dmso-d6: 氘代二甲亚砜。
[0175]
质子核磁共振光谱用ft-nmr光谱仪(300 mhz或400 mhz, jeol)测量。化学位移以δ值(ppm)表示。nmr中使用的符号表示以下含义;s是单峰,d是双峰,dd是双二重峰,dt是双三重峰,t是三重峰,q是四重峰,m是多重峰,br是宽峰,brs是宽单峰,和j是耦合常数。
[0176]
实施例1(2r)-n-乙基-n-{2-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]乙基}-2-羟基丙酰胺向参考例1的化合物 (20.0 mg)在n,n-二甲基甲酰胺 (0.5 ml)中的溶液中加入 d-乳酸 (6.18 mg)、三乙胺 (20.8 mg)和2-(1h-苯并[d][1,2,3]三唑-1-基)-1,1,3,3-四甲基异脲鎓六氟磷酸盐 (33.8 mg)。将混合物在室温搅拌16小时,并向其中加入水 (4.0 ml)。混合物用氯仿 (10 ml x 2)萃取,用无水硫酸钠干燥,过滤并浓缩。浓缩残留物通过高效液相色谱纯化 (柱; semipreparative c-18柱, 分离条件; 乙腈/三氟乙酸: 水/三氟
乙酸),并用mp-碳酸盐树脂脱盐以获得标题化合物 (9.73 mg)。
[0177]
实施例2n-乙基-n-{2-[4-(5-氟-1h-吲唑-1-基)哌啶-1-基]乙基}-3-羟基丙酰胺向参考例2的化合物 (50.0 mg)在二氯甲烷 (1.0 ml)中的悬浮液中加入三乙胺 (0.077 ml)、30% 3-羟基丙酸水溶液 (0.046 ml)和2-(1h-苯并[d][1,2,3]三唑-1-基)-1,1,3,3-四甲基异脲鎓六氟磷酸盐 (67.9 mg)。将混合物在室温搅拌2小时,并通过硅胶柱色谱纯化 (氯仿/甲醇)以获得标题化合物 (43.2 mg)。
[0178]
实施例3(2r)-n-乙基-n-{2-[4-(5-氟-1h-吲唑-1-基)哌啶-1-基]乙基}-2-羟基丙酰胺向参考例2的化合物(50.0 mg)在二氯甲烷 (1.0 ml)中的悬浮液中加入三乙胺 (0.077 ml)、d-乳酸 (14.9 mg)和2-(1h-苯并[d][1,2,3]三唑-1-基)-1,1,3,3-四甲基异脲鎓六氟磷酸盐 (67.9 mg)。将混合物在室温搅拌4小时,并通过硅胶柱色谱纯化 (氯仿/甲醇)以获得标题化合物 (13.9 mg)。
[0179]
实施例4-15根据实施例3的方法,实施例4-15的化合物由相应参考例化合物制备。
[0180]
实施例16
(2s)-n-乙基-n-{2-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]乙基}-2-羟基丙酰胺向参考例1的化合物(400 mg)在四氢呋喃 (1.1 ml)中的悬浮液中加入三乙胺 (0.763 ml)、l-乳酸 (0.098 ml)和o-(7-氮杂苯并三唑-1-基)-n,n,n',n'-四甲基脲鎓六氟磷酸盐 (0.501 mg)。将混合物在室温搅拌4小时。向混合物中加入甲醇 (6.0 ml)、2 mol/l氢氧化钠水溶液 (3.0 ml)和水 (1.0 ml)。将混合物在室温搅拌1小时。然后,向其中加入水 (30 ml),并用氯仿 (30 ml x 2)萃取混合物,经无水硫酸钠干燥,过滤并浓缩。浓缩残留物通过硅胶柱色谱纯化 (氯仿/甲醇)以获得标题化合物 (279 mg)。
[0181]
实施例17n-乙基-n-{2-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]乙基}-3-羟基丙酰胺向参考例1的化合物 (3.97 g)在乙腈 (50 ml)中的悬浮液中加入三乙胺 (6.08 ml)、3-羟基丙酸 (4.91 g)和o-(7-氮杂苯并三唑-1-基)-n,n,n',n'-四甲基脲鎓六氟磷酸盐 (6.22 g)。将混合物在室温搅拌2小时。向混合物中加入甲醇 (50 ml)和碳酸铯 (14.2 g)。将混合物在70℃搅拌2小时,然后过滤并浓缩。向残留物中加入氯仿 (50 ml),并滤出不溶物。浓缩洗脱液。浓缩残留物通过氨基硅胶色谱纯化 (己烷/乙酸乙酯和氯仿/甲醇),并进一步通过硅胶柱色谱纯化 (氯仿/甲醇)以获得标题化合物 (2.97 g)。
焓(归一化):71.71 j/g起始x: 67.55
°
c。
[0182]
实施例18n-乙基-n-{2-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]乙基}-2-羟基-3-甲氧基丙酰胺向参考1的化合物 (70.0 mg)在四氢呋喃 (1.9 ml)中的悬浮液中加入三乙胺 (0.134 ml)、2-羟基-3-甲氧基丙酸 (27.7 mg)和o-(7-氮杂苯并三唑-1-基)-n,n,n',n'-四甲基脲鎓六氟磷酸盐 (88.0 mg)。将反应混合物在室温搅拌3小时并浓缩。残留物通过硅胶柱色谱纯化 (氯仿/甲醇)以获得标题化合物 (51.7 mg)。
[0183]
实施例19n-乙基-n-{2-[4-(6-氟-1h-吲唑-3-基)哌啶-1-基]乙基}-2-羟基丙酰胺向参考例6的化合物 (400 mg)在n,n-二甲基甲酰胺 (4.0 ml)中的溶液中加入二异丙基乙胺 (0.577 ml)、dl-乳酸 (0.082 ml)和o-(7-氮杂苯并三唑-1-基)-n,n,n',n'-四甲基脲鎓六氟磷酸盐 (628 mg)。将混合物在室温搅拌1小时。向反应混合物中加入2 mol/l氢氧化钠水溶液 (3.0 ml),并将混合物在室温搅拌1小时。然后,向反应混合物中加入水 (10 ml)。混合物用氯仿 (5.0 ml x 3)萃取,经无水硫酸钠干燥,过滤并浓缩。浓缩残
留物通过硅胶柱色谱纯化 (氯仿/甲醇)以获得标题化合物 (217 mg)。
[0184]
实施例20(2s)-n-乙基-n-{2-[4-(6-氟-1h-吲哚-3-基)哌啶-1-基]乙基}-2-羟基丙酰胺向参考例7的化合物 (30.0 mg)在四氢呋喃 (0.83 ml)中的悬浮液中加入三乙胺 (0.0575 ml)、l-乳酸 (8.95 mg)和o-(7-氮杂苯并三唑-1-基)-n,n,n',n'-四甲基脲鎓六氟磷酸盐 (37.8 mg)。将混合物在室温搅拌2小时。向反应混合物中加入甲醇 (0.8 ml)和2 mol/l氢氧化钠水溶液 (0.4 ml)。将混合物在室温搅拌30分钟。浓缩反应混合物,并向其中加入氯仿 (10 ml)。混合物经无水硫酸钠干燥,过滤并浓缩。浓缩残留物通过硅胶柱色谱纯化 (氯仿/甲醇)以获得标题化合物 (24.3 mg)。
[0185]
实施例21(2s)-n-乙基-n-{2-[4-(5-氟-1h-吲唑-1-基)哌啶-1-基]乙基}-2-羟基丙酰胺向参考例2的化合物 (400 mg)在四氢呋喃 (4.0 ml)中的悬浮液中加入三乙胺 (0.768 ml)、l-乳酸 (161 mg)和o-(7-氮杂苯并三唑-1-基)-n,n,n',n'-四甲基脲鎓六氟磷酸盐 (786 mg)。将混合物在室温搅拌3小时。向反应混合物中加入15 %氢氧化钠水溶液 (4.0 ml),并将混合物在室温搅拌1小时。然后,向其中加入浓盐酸直至反应混合物的ph达
到7,并浓缩混合物。浓缩残留物通过硅胶柱色谱纯化 (氯仿/甲醇)以获得标题化合物 (269 mg)。
[0186]
实施例22n-乙基-2-羟基-n-{2-[4-(1h-吲哚-3-基)哌啶-1-基]乙基}丙酰胺向参考例8的化合物 (300 mg)在四氢呋喃 (8.7 ml)中的悬浮液中加入三乙胺 (0.606 ml)、dl-乳酸 (94.0 mg)和o-(7-氮杂苯并三唑-1-基)-n,n,n',n'-四甲基脲鎓六氟磷酸盐 (398 mg)。将混合物在室温搅拌3小时,并向其中加入甲醇 (6.0 ml)和2 mol/l氢氧化钠水溶液 (3.0 ml)。将混合物在室温搅拌1小时。然后,浓缩反应混合物,并向残留物中加入氯仿 (30 ml)。混合物经无水硫酸钠干燥,过滤并浓缩。浓缩残留物通过硅胶柱色谱纯化 (氯仿/甲醇)以获得标题化合物 (258 mg)。
[0187]
实施例23(2s)-n-乙基-2-羟基-n-{2-[4-(1h-吲哚-3-基)哌啶-1-基]乙基}丙酰胺向参考例8的化合物 (300 mg)在四氢呋喃 (8.7 ml)中的悬浮液中加入三乙胺 (0.606 ml)、l-乳酸 (94.0 mg)和o-(7-氮杂苯并三唑-1-基)-n,n,n',n'-四甲基脲鎓六氟
磷酸盐 (398 mg)。将混合物在室温搅拌3小时,并向其中加入甲醇 (6.0 ml)和2 mol/l氢氧化钠水溶液 (3.0 ml)。将混合物在室温搅拌1小时。然后,浓缩反应混合物,并向残留物中加入氯仿 (30 ml)。混合物经无水硫酸钠干燥,过滤并浓缩。浓缩残留物通过硅胶柱色谱纯化 (氯仿/甲醇)以获得标题化合物 (258 mg)。
[0188]
实施例24-50根据实施例23的方法,实施例24-50的化合物由相应参考例化合物制备。
[0189]
实施例51n-乙基-n-{2-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]乙基}-2-羟基乙-1-磺酰胺向参考例23的化合物 (636 mg)在四氢呋喃 (20 ml)中的溶液中加入10%四丁基氢氧化铵水溶液 (17.3 m)。将混合物在60
°
c搅拌2小时并浓缩。残留物通过硅胶柱色谱纯
化 (氯仿/甲醇),并进一步通过氨基硅胶柱色谱纯化 (氯仿/甲醇)以获得标题化合物 (330 mg)。
[0190]
实施例52-64根据实施例51的方法,实施例52-64的化合物由相应参考例化合物制备。
mg)。将混合物在室温搅拌1小时,并向其中加入三乙胺 (0.053 ml)和参考例1的化合物 (60.0 mg)。将混合物在室温搅拌3小时,并向其中加入水 (10 ml)。混合物用氯仿/甲醇 (10 ml x 6)萃取,经无水硫酸钠干燥,过滤并浓缩。浓缩残留物通过硅胶柱色谱纯化 (氯仿/甲醇)。然后,向所得化合物 (50 mg)中加入4 mol/l盐酸-乙酸乙酯 (2.0 ml)。将混合物在室温搅拌1小时并浓缩。浓缩残留物通过氨基硅胶柱色谱纯化 (氯仿/甲醇)以获得标题化合物 (37.0 mg)。
[0192]
实施例66-70根据实施例65的方法,实施例66-70的化合物由相应参考例化合物制备。
[0193]
实施例713-乙酰胺-n-乙基-n-{2-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]乙基}-2-羟基丙酰胺
向实施例65的化合物 (20.0 mg)在四氢呋喃 (2.0 ml)中的溶液中加入无水乙酸 (0.00598 ml)。将混合物在室温搅拌1小时。然后,向其中加入2 mol/l氢氧化钠水溶液 (0.1 ml),并将混合物在室温搅拌10分钟。浓缩反应混合物,并通过氨基硅胶柱色谱纯化 (氯仿/甲醇)以获得标题化合物 (10.1 mg)。
[0194]
实施例72-74根据实施例71的方法,实施例72-74的化合物由相应参考例化合物制备。
[0195]
实施例75n-乙基-n-{2-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]乙基}-4-羟基-1-甲基吡咯烷-3-甲酰胺
向实施例66的化合物 (10.0 mg)在甲醇 (0.5 ml)中的溶液中加入37%甲醛水溶液 (0.002 ml)、氰基硼氢化钠 (1.09 mg)和乙酸 (0.003 ml)。将混合物在室温搅拌16小时。然后,向其中加入水 (10 ml),并用氯仿 (10 ml x 2)萃取混合物并浓缩。浓缩残留物通过高效液相色谱纯化 (柱; 半制备型c-18 柱, 分离条件; 乙腈/三氟乙酸: 水/三氟乙酸),并用mp-碳酸盐树脂脱盐以获得标题化合物 (6.88 mg)。
[0196]
实施例76n-乙基-n-{2-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]乙基}-4-羟基-1-甲基哌啶-3-甲酰胺根据与实施例75类似的方法,标题化合物由实施例67的化合物制备。
[0197]
实施例77n-乙基-n-{2-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]乙基}-3-羟基丙酰胺乳清酸盐向实施例17的化合物 (30 mg)在甲醇 (0.4 ml)中的溶液中加入乳清酸 (14.4 mg)。将混合物在60
°
c搅拌1小时,然后向其中加入乙酸乙酯 (2.0 ml)。将混合物在室温搅拌1小时,并通过过滤收集沉淀固体以获得标题化合物 (27.3 mg)。
焓(归一化):62.81 j/g起始x: 157.09
°
c。
[0198]
实施例78n-乙基-n-{2-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]乙基}-3-羟基丙酰胺氢溴酸盐,a型向实施例17的化合物 (6.03 g)在乙腈 (77 ml)中的溶液中滴加10-20% hbr-etoh (14.1 g)。将混合物在室温搅拌1小时,并确认固体沉淀。将混合物在80
°
c搅拌。确认沉淀的固体完全溶解后,搅拌混合物1小时。然后,将混合物逐渐冷却,并在室温搅拌12小时。沉淀的固体通过过滤收集,用乙腈 (10 ml)洗涤,并干燥以获得白色固体 (7.0 g)。将所得白色固体 (7.0 g)与四氢呋喃 (15 ml)混合,并将混合物在80
°
c搅拌3.5小时。然后,将混合物逐渐冷却,并在室温搅拌12小时。固体通过过滤收集,用四氢呋喃 (10 ml)洗涤,并干燥以获得标题化合物 (6.20 g)。
焓(归一化):82.83 j/g起始x: 163.64
°
c。
[0199]
实施例79n-乙基-n-{2-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]乙基}-3-羟基丙酰胺氢溴酸盐,b型向实施例17的化合物 (100 mg)在乙腈 (2.0 ml)中的溶液中滴加10-20% hbr-etoh (0.2 ml)。将混合物在室温搅拌1小时,并通过过滤收集沉淀固体以获得标题化合物 (67.0 mg)。焓(归一化):86.51 j/g起始x: 164.04
°
c。
[0200]
实施例80n-乙基-n-{2-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]乙基}-3-羟基丙酰胺甲苯磺酸盐向实施例17的化合物 (66.7 g)在丙酮 (200 ml)中的溶液中加入对甲苯磺酸一水合物(41.9 g)在丙酮 (150 ml)中的溶液。将混合物在室温搅拌2小时。沉淀的固体通过过滤收集,用丙酮 (60 ml)洗涤,并干燥以获得白色固体 (78.8 g)。将所得白色固体 (78.8 g)和丙酮 (608 ml)和水 (33.4 ml)的混合物在70℃搅拌。确认白色固体完全溶解后,将混合物逐渐冷却,并在室温搅拌12小时。在0℃搅拌1小时后,过滤收集所得固体,用5% 水-丙酮的混合溶剂 (70 ml)洗涤,冷却至 0
°
c,并干燥以获得标题化合物 (69.4 g)。
焓(归一化):99.47 j/g起始x: 162.26
°
c。
[0201]
参考例1n-乙基-2-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]乙-1-胺二盐酸盐向6-氟-3-(4-哌啶基)-1,2-苯并异噁唑 (5.78 g)在氯仿 (131 ml)中的溶液中加入乙基(2-氧代乙基)氨基甲酸叔丁酯 (4.91 g)和三乙酰氧基硼氢化钠 (11.1 g)。将混合物在室温搅拌5小时。向其中加入饱和碳酸氢钠水溶液 (100 ml),并用氯仿 (100 ml x 2)萃取混合物,经无水硫酸钠干燥,过滤并浓缩。残留物通过硅胶柱色谱纯化 (氯仿/甲醇)。向所得化合物在氯仿 (131 ml)中的溶液中加入4 mol/l盐酸-乙酸乙酯 (60 ml)。将混合物在室温搅拌2小时。沉淀的固体通过过滤收集,用乙酸乙酯 (20 ml x 2)洗涤,并干燥以获得标题化合物 (6.24 g)。
[0202]
参考例2-13根据参考例1的类似方法,参考例2-13的化合物由相应参考例化合物或试剂制备。
[0203]
参考例146-氟-5-甲基-3-(哌啶-4-基)-1,2-苯并异噁唑单盐酸盐
a) 4-[甲氧基(甲基)氨基甲酰基]哌啶-1-甲酸叔丁酯 (化合物in-1-1)的制备将1-(叔丁氧基羰基)哌啶-4-甲酸 (5.00 g), n,o-二甲基羟胺盐酸盐 (3.19 g)、n1-((乙基亚氨基)亚甲基)-n3,n3-二甲基丙烷-1,3-二胺盐酸盐 (5.02 g)、三乙胺 (4.41 g)和n,n-二甲基甲酰胺 (100 ml)的混合物在室温搅拌1.5小时。然后,向其中加入饱和氯化铵水溶液,并用乙酸乙酯萃取混合物。合并的有机层用饱和氯化铵水溶液洗涤两次,并用饱和碳酸氢钠水溶液和盐水洗涤,并经无水硫酸钠干燥。将混合物过滤并浓缩以获得标题化合物 (4.52 g)。
[0204]
b) 4-(2,4-二氟-5-甲基苯甲酰基)哌啶-1-甲酸叔丁酯 (化合物in-1-2)的制备在-78℃经3分钟向1-溴-2,4-二氟-5-甲基苯 (2.28 g)在四氢呋喃 (36 ml)中的溶液中滴加1.63 mol/l 正丁基锂/己烷 (7.43 ml)。在-78
°
c搅拌1小时后,向其中加入化合物in-1-1 (1.50 g),并在-78℃搅拌混合物2.5小时。然后,向其中加入饱和氯化铵水溶液,并用乙酸乙酯萃取混合物,经无水硫酸钠干燥,过滤并浓缩。浓缩的残留物通过硅胶柱色谱纯化 (己烷/乙酸乙酯)以获得标题化合物 (2.01 g)。
[0205]
c) 4-(6-氟-5-甲基-1,2-苯并噁唑-3-基)哌啶-1-甲酸叔丁酯 (化合物in-1-3)的制备将化合物in-1-2 (731 mg)、羟胺盐酸盐 (599 mg)和乙酸钠 (707 mg)在乙醇 (10 ml)中的混合物在60
°
c搅拌4小时。然后,向其中加入水,并用乙酸乙酯萃取混合物,用
盐水洗涤,经无水硫酸钠干燥,过滤并浓缩。浓缩残留物通过硅胶柱色谱纯化 (己烷/乙酸乙酯)。将所得产物 (335 mg)与碳酸铯 (615 mg)和乙腈 (9.0 ml)混合,并将混合物在密封管中在130
°
c下搅拌3.5小时。然后,将反应混合物过滤,浓缩,并通过硅胶柱色谱纯化 (己烷/乙酸乙酯)以获得标题化合物 (90.8 mg)。
[0206]
d) 6-氟-5-甲基-3-(哌啶-4-基)-1,2-苯并异噁唑单盐酸盐 (参考例14)的制备向化合物in-1-3 (131 mg)在二氯甲烷 (1.0 ml)中的溶液中加入4 mol/l盐酸/乙酸乙酯 (1.0 ml),并将混合物在室温搅拌1.5小时。然后,将反应混合物浓缩以获得标题化合物 (114 mg)。
[0207]
参考例155-甲基-3-(哌啶-4-基)-1,2-苯并异噁唑单盐酸盐根据与参考例14类似的方法,标题化合物由1-氟-2-碘-4-甲基苯制备。
[0208]
参考例16n-(环丙基甲基)-2-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]乙-1-胺
向2-(4-(6-氟苯并[d]异噁唑-3-基)哌啶-1-基)乙-1-胺 (50.0 mg)在氯仿 (2.0 ml)中的溶液中加入环丙烷甲醛(16.0 mg),并将混合物在室温搅拌30分钟。然后,向其中加入三乙酰氧基硼氢化钠 (60.4 mg),并将混合物在室温搅拌1小时。向其中加入饱和碳酸氢钠水溶液 (30 ml)。混合物用氯仿 (30 ml x 2)萃取,经无水硫酸钠干燥,过滤并浓缩以获得标题化合物 (26.0 mg)。
[0209]
参考例17n-{2-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]乙基}丙-2-胺根据与参考例16类似的方法,由丙酮制备标题化合物。
[0210]
参考例18({2-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]乙基}氨基)乙腈向55%氢化钠 (7.92 mg)在n,n-二甲基甲酰胺 (2.0 ml)中的悬浮液中加入参考例20的化合物 (60.0 mg),并将混合物在室温搅拌30分钟。向其中加入2-碘乙腈 (41.3 mg)。将反应混合物在室温搅拌1小时并向其中加入水 (30 ml)。混合物用氯仿 (30 ml x 2)萃取,经无水硫酸钠干燥,过滤并浓缩。向浓缩残留物中加入4 mol/l盐酸/乙酸乙酯 (3.0 ml),将混合物在室温搅拌1小时并浓缩。浓缩残留物通过氨基硅胶柱色谱纯化 (己烷/乙酸乙酯)以获得标题化合物 (25.0 mg)。
[0211]
参考例19n-乙基-3-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基] 丙-1-胺二盐酸盐根据与参考例18类似的方法,标题化合物由参考例21的化合物制备。
[0212]
参考例20{2-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]乙基}氨基甲酸叔丁酯向6-氟-3-(哌啶-4-基)苯并[d]异噁唑 (2.89 g)在氯仿中的溶液(60 ml)中加入(2-氧代乙基)氨基甲酸叔丁酯 (2.30 g),并将混合物在室温搅拌30分钟。向其中加入三乙酰氧基硼氢化钠 (3.34 g),并将混合物在室温搅拌3小时。向其中加入饱和碳酸氢钠水溶液 (100 ml),并用氯仿 (100 ml x 2)萃取混合物,经无水硫酸钠干燥,过滤并浓缩。浓缩残留物通过硅胶柱色谱纯化 (氯仿/甲醇)以获得标题化合物 (3.98 g)。
[0213]
参考例21{3-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]丙基}氨基甲酸叔丁酯向6-氟-3-(哌啶-4-基)苯并[d]异噁唑 (2.00 g)在乙腈 (50 ml)中的溶液中加入水 (12.5 ml)、 (3-溴丙基)氨基甲酸叔丁酯 (2.59 g)和碳酸钾 (3.76 g)。将混合物在60
°
c搅拌3.5小时,并向其中加入水 (200 ml)。混合物用乙酸乙酯 (200 ml x 2)萃取,经无水硫酸钠干燥,过滤并浓缩。浓缩残留物通过硅胶柱色谱纯化 (氯仿/甲醇)以获得标题化合物 (3.46 g)。
[0214]
参考例22n-{2-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]乙基}丙-1-胺
a) 3-[1-(2-氯乙基)哌啶-4-基]-6-氟-1,2-苯并异噁唑 (化合物in-2-1)的制备向6-氟-3-(哌啶-4-基)苯并[d]异噁唑 (3.00 g)在四氢呋喃中的溶液(25 ml)中加入水 (6.3 ml)、氢氧化钾 (1.68 g)和1-溴-2-氯乙烷 (5.65 ml),并将混合物在室温搅拌24小时。向其中加入水 (15 ml)。混合物用氯仿 (10 ml x 3)萃取,经无水硫酸钠干燥,过滤并浓缩。浓缩残留物通过硅胶柱色谱纯化 (乙酸乙酯/甲醇)以获得标题化合物 (1.94 g)。
[0215]
b) n-{2-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]乙基}丙-1-胺 (参考例22)的制备向化合物in-2-1 (80.0 mg)在乙腈 (1.4 ml)中的溶液中加入正丙胺 (0.0349 ml)、碳酸钾 (117 mg)、碘化钾 (9.39 mg),并将混合物在90
°
c搅拌4小时。将反应混合物过滤并浓缩。浓缩残留物通过氨基硅胶柱色谱纯化 (氯仿/甲醇)以获得标题化合物 (50.9 mg)。
[0216]
参考例23n-乙基-n-{2-[4-(6-氟-1,2-苯并异噁唑-3-基)哌啶-1-基]乙基}乙磺酰胺
向参考例1的化合物 (1.00 g)在二氯甲烷 (40 ml)中的溶液中加入三乙胺 (2.39 ml)和2-氯乙烷磺酰氯 (0.433 ml),并将混合物在室温搅拌4小时。浓缩反应混合物,并且浓缩残留物通过硅胶柱色谱纯化 (氯仿/甲醇)以获得标题化合物 (0.670 g)。
[0217]
参考例24-36根据参考例23的方法,参考例24-36的化合物由相应参考例化合物制备。
[0218]
参考例373-[4-(1,2-苯并异噁唑-3-基)哌啶-1-基]-n-乙基丙-1-胺二盐酸盐根据与参考例18和21类似的方法,标题化合物由3-(哌啶-4-基)苯并[d]异噁唑制备。
[0219]
参考例38n-乙基-3-[4-(6-氟-1,2-苯并异噁唑-3-基)哌嗪-1-基]丙-1-胺二盐酸盐根据与参考例18和21类似的方法,标题化合物由6-氟-3-(哌嗪-1-基)苯并[d]异噁唑单盐酸盐制备。
[0220]
试验1:评价对人 5-ht
2a
受体、人 5-ht
7 受体和人 d2受体的结合活性本化合物对人5-ht
2a
受体、人5-ht7受体和人d2受体的结合亲和力通过以下程序测量。
[0221]
其中表达人5-ht
2a
受体、人5-ht7受体或人d2受体的cho细胞膜级分购自perkinelmer, inc.。在用于评价结合亲和力的试验中,将溶于二甲亚砜(dmso)的试验化合物和用缓冲液稀释的每个受体膜样品分别与用于5-ht
2a
受体、5-ht7受体或d2受体的[3h]酮色林、[3h]sb-269970或[3h]螺哌隆(均购自perkinelmer, inc.)混合。将每种混合物在室温下孵育60分钟。在分别存在10 μmol/l 8-oh-dpat、10 μmol/l米安色林或10 μmol/l螺哌隆的情况下,通过竞争性结合试验获得与受体的非特异性结合。用液体闪烁计数器(perkinelmer, inc.)测量与受体结合引起的放射性,并计算50%抑制浓度。ki值由通过饱和结合试验计算的解离常数和底物浓度评价,并用作结合亲和力的指标。结果如下表所示。
[0222]
试验2:评估人5-ht
2a
受体和人5-ht7受体的拮抗活性水母发光蛋白、gα 16蛋白和每种受体在cho-k1细胞(中国仓鼠卵巢)中瞬时表达。将细胞在co2培养箱中于37
°
c培养过夜,接种到384孔板中,并在室温下放置2小时。向其中加入溶解在dmso中的各化合物,并通过fdss/μcell药物发现筛选支持系统(hamamatsu photonics k.k.)测量发光变化。至于拮抗活性,通过将添加10 μmol/l内源性配体的孔的发光水平设置为100%来计算每种化合物的抑制活性。结果如下表所示。
[0223]
试验3-1:人肝微粒体中的代谢稳定性试验如下所述评价本化合物在人肝微粒体中的代谢稳定性。人肝微粒体获自xenontech。将人肝微粒体、nadph和各试验化合物混合在25 mmol/l磷酸盐缓冲溶液(ph 7.4)中以达到如下所示的下列浓度,并将混合物在37℃孵育30分钟。
‑ꢀ
人肝微粒体:0.1 mg/ml
‑ꢀ
napdh:3.2 mmol/l
‑ꢀ
试验化合物:0.1 μmol/l通过lc-ms测量30分钟后各样品中试验化合物的残留率,并且由下式计算在人肝微粒体中的代谢稳定性。
[0224]
人肝微粒体中的代谢稳定性(ml/min/mg蛋白质) =
ꢀ‑
ln (残留率)/30/0.1结果如下表所示。
[0225]
试验3-2: 人肝微粒体中的代谢稳定性试验为了更准确地评价人肝微粒体中的代谢稳定性,如下所述,以适当浓度的人肝微粒体评价本化合物在人肝微粒体中的代谢稳定性。人肝微粒体获自xenontech。将人肝微粒体、nadph 和每种试验化合物混合在25 mmol/l 磷酸盐缓冲溶液(ph 7.4) 中以达到如下所示的下列浓度,并将混合物在37
°
c下孵育60分钟。
[0226]
‑ꢀ
人肝微粒体:0.5或1.0 mg/ml
‑ꢀ
napdh:3.2 mmol/l
‑ꢀ
试验化合物:0.1 μmol/l通过lc-ms测量30或60分钟后各样品中试验化合物的残留率,并由下式计算在人肝微粒体中的代谢稳定性。
[0227]
人肝微粒体中的代谢稳定性(ml/min/mg蛋白质) =
ꢀ‑
ln (残留率)/反应时间/人肝微粒体浓度结果如下表所示。
[0228]
试验4:人半衰期的预测试验如下所示预测本化合物在人中的消除半衰期。
[0229]
本化合物以0.01 mol/l盐酸水溶液的形式静脉内施用于大鼠。在施用后5分钟、15分钟、30分钟、1小时、2小时、4小时、6小时和24小时采集血液。从采集的血液中获取血浆,通过lc-ms测量血浆中的药物浓度,并根据浓度的转变计算大鼠的分布容积。
[0230]
本化合物在人或大鼠血清中的未结合级分率通过平衡透析法测量。
[0231]
使用大鼠分布容积、人或大鼠血清中的未结合级分率和试验3-2中得到的人肝微粒体中的代谢稳定性的结果,按照下式计算人的半衰期。
[0232]
‑ꢀ
人分布容积= 大鼠的分布容积 x 人血清中的未结合级分率/大鼠血清中的未结合级分率
‑ꢀ
人肝清除率 = (人肝血流量 x 人血清中未结合级分率 x 56.7 x 人肝微粒体中的代谢稳定性) / (人肝血流量 + 人血清中未结合级分率 x 56.7 x 人肝微粒体中的代谢稳定性)
‑ꢀ
人半衰期 = 0.693 x 人分布容积 / 人肝清除率结果如下表所示。
[0233]
试验5:评估herg通道的抑制活性本化合物对herg通道的抑制活性使用cho细胞通过具有自动膜片钳系统的全细胞膜片钳法测量,cho细胞中参与人快速激活延迟整流钾电流(i
kr
)的herg通道被强制表达。
[0234]
(细胞悬浮液的制备)将购自chantest cop.的herg-cho细胞在co2培养箱中于37
°
c培养,并在测量herg电流前不久用胰蛋白酶由烧瓶剥离以制备细胞悬浮液。
[0235]
(溶液的制备)测量中使用的细胞外液和细胞内液如下制备。
[0236]
细胞外液:2 mmol/l cacl2、1 mmol/l mgcl2、10 mmol/l hepes、4 mmol/l kcl、145 mmol/l nacl、10 mmol/l葡萄糖细胞内液:10 mmol/l hepes、10 mmol/l egta、20 mmol/l kcl、130 mmol/l kf试验化合物溶液: 将试验化合物溶解在dmso中以达到2 mmol/l或20 mmol/l的浓度,从而制备试验化合物溶液。将试验化合物溶液进一步用细胞外液稀释200倍,并用细胞外液连续稀释以制备计算herg抑制的ic
50
值所需的每个浓度的试验化合物溶液。
[0237]
(电流值的测量和数据分析)将细胞悬浮液、细胞外液、细胞内液和测量板置于自动膜片钳系统中,并采用全细胞膜片钳法测量herg电流。电压方案如下:将保持电位调整为-80 mv,在-50 mv至+20 mv下提供去极化脉冲5秒,在-50 mv下提供复极化脉冲5秒,然后电位恢复到保持电位。每个脉冲间隔为15秒。使用qube assay software (sophion sophion)进行数据分析。试验通过递增地应用每种试验化合物的4个浓度来进行,并且将由每个浓度的最后3次刺激获得的最大峰尾电流的平均值确定为评价数据。基于每种试验化合物各浓度下预施加电流的电流抑制率,利用软件通过希尔方程计算ic
50
值。
[0238]
结果如下表所示。
[0239]
试验6:条件性恐惧试验使用雄性sd大鼠。为了制备施用溶液,将试验化合物溶解在0.01 mol/l盐酸中,并使用水溶液。
[0240]
如下所述,使用o'hara & co., ltd的image j fz2 for contextual and cued fear conditioning test进行条件性恐惧试验。
[0241]
将动物放入在装配有image j fz2 for contextual and cued fear conditioning test的房间中,并以0.5 ma施加7次电刺激,持续10秒。然后,将大鼠轻轻地从房间中取出,第二天,将施用溶液(溶剂或试验化合物溶液)皮下施用,30分钟后将动物置于房间中。将动物放入室中到300秒后的不动状态反应时间百分比用作试验结果。
[0242]
试验结果的分析如下进行。
[0243]
对试验化合物施用组和溶剂施用组均进行参数dunnett的多重比较(显著性水平:两侧均为5%)。当试验化合物施用组与溶剂施用组相比显示出显著的不动状态反应时间抑制时,它被认为显示出抗焦虑作用。
[0244]
使用实施例17化合物的该试验结果示于图1。
[0245]
试验7: 大鼠脑中释放谷氨酸量的测量将套管留置在雄性wistar大鼠的前额皮质位置,并在至少1周的恢复期后对大鼠进行试验。
[0246]
对于生物传感器的校准,使用5 mm谷氨酸溶液和100 mm抗坏血酸溶液。用已校准的生物传感器测量释放的谷氨酸。在将生物传感器插入引导套管后12小时或更长时间开始测量。试验化合物施用后,进行2小时以上的测量。
[0247]
将施用前30分钟的平均谷氨酸释放量用作标准,并计算施用后2小时的曲线下面积。将化合物施用组的数据与溶剂施用组的数据进行比较。
[0248]
通过参数dunnett的多重比较试验比较各组的平均值,并且当试验化合物施用组与溶剂施用组相比显示出显著高的值时,认为显示出谷氨酸释放促进作用(显著性水平:两侧均为5%)。
[0249]
使用实施例17化合物的该试验结果示于图2。
[0250]
试验8:评价副作用相关受体的结合活性本化合物对副作用相关受体如肾上腺素能α1a受体的结合亲和力可以通过以下方法测量。
[0251]
利用表达人靶受体的cho细胞膜级分,如下进行结合评价试验。将溶解在二甲亚砜(dmso)中的试验化合物、用缓冲液稀释的各受体膜样品和对各靶受体具有强结合亲和力的[3h]-标记配体混合。将每种混合物在室温下孵育,快速添加到玻璃纤维滤板(multiscreen fb, millipore, inc.)上,并真空过滤。用液体闪烁计数器(perkinelmer, inc.)测量过滤器上残留的放射性。结合抑制率由下式计算。与靶受体具有强结合亲和力的对照化合物代替试验化合物用于计算与受体膜样品的非特异性结合量。
[0252]
对靶受体的结合抑制率(%) = 100
ꢀ‑ꢀ
100 x {(在存在试验化合物的情况下[3h]-标记配体的结合量)}
ꢀ‑ꢀ
(在存在10 μmol/l对照化合物的情况下[3h]-标记配体的结合量)} / {(在不存在试验化合物的情况下[3h]-标记配体的结合量)}
ꢀ‑ꢀ
(在存在10 μmol/l对照化合物的情况下[3h]-标记配体的结合量)}
试验9:脑内转移性评价(大鼠脑内转移性试验)在该试验中,本化合物的脑内转移性通过以下方法进行评价。本化合物作为盐水溶液皮下施用,或作为甲基纤维素悬浮液口服施用给7周龄的sd或wky大鼠。在施用后0.5小时、1小时或2小时收集血浆和脑,以便通过lc-ms测量血浆和脑中的药物浓度。
[0253]
本化合物与血浆和脑蛋白的结合率采用平衡透析法测量。
[0254]
kp,uu,脑(脑/血浆之间的未结合药物浓度比)可以通过将从上述试验获得的血浆和脑中的化合物浓度以及与血浆和脑蛋白的结合率应用于下式来计算。
[0255]
kp,uu,brain = (脑中的化合物浓度 x (100
ꢀ‑ꢀ
与脑蛋白的结合率 (%)) / 100) / (血浆中的化合物浓度 x (100
ꢀ‑ꢀ
与血浆蛋白的结合率 (%)) / 100)试验9的结果如下表所示。
[0256]
试验10:肝毒性风险评价(丹磺酰谷胱甘肽(dgsh)捕获测定)本化合物在肝微粒体中代谢,并从得到的代谢物中,按照以下方法检测和量化与丹磺酰谷胱甘肽(dgsh)反应的反应性代谢物。使用筛选机器人(tecan)进行代谢反应的测量,并使用荧光检测uplc系统(waters)进行代谢物-dgsh结合浓度的测量。
[0257]
(溶液的制备)将本化合物溶解于dmso中以制备10 mmol/l的试验化合物溶液。将7.6 ml磷酸钾缓冲液(500 mmol/l, ph 7.4)、1.9 ml人肝微粒体(xenotech, 20 mg蛋白质/ml)和1.27 ml纯水混合以制备微粒体溶液。向3.78 ml微粒体溶液中加入0.67 ml纯水以制备微粒体(dgsh(-))溶液。向6.48 ml微粒体溶液中加入1.14 mldgsh溶液(20 mmol/l)以制备微粒体(dgsh(+))溶液。将80.9 mg nadph溶解在30 ml纯水中以制备辅因子溶液。将33 mg三(2-羧基乙基)膦(tecp)溶解在115 ml甲醇中以制备反应终止液。
[0258]
(反应)将12 μl试验化合物溶液与388 μl纯水混合,并将混合物以各50 μl分配到96孔板的6个孔中。将6个孔分为3组,每组2个孔,并且各自命名为“反应组”、“未反应组”和“无dgsh组”。向“反应组”和“未反应组”中加入微粒体(dgsh(+))溶液,并向“无dgsh组”中加入微粒体(dgsh(-))溶液,各50 μl。向“反应组”和“无dgsh组”中加入辅因子溶液,并向“未反应组”中加入纯水,各50 μl。在37℃孵育60分钟后,加入反应终止液以终止反应,各450 μl。向“反应组”和“无dgsh组”加入纯水,并向“未反应组”加入辅因子溶液,各50 μl。将板在-20
°
c冷却1小时,并将溶液离心(4000 rpm,10分钟)。将上清液收集到另一个板中并进行分析。
[0259]
(分析)代谢物-dgsh结合浓度通过以下条件使用荧光检测uplc系统测量。
[0260]
柱:waters acquity uplc behc18 1.7 μm 2.1 x 10 mm洗脱液:a,0.2%甲酸水溶液;b,0.2%甲酸/乙腈梯度:b, 20% (0 min)
ꢀ‑
》 70% (9.33 min)
ꢀ‑
》 90% (10.63 min)
ꢀ‑
》 20% (11 min)
ꢀ‑
》 20% (14 min)因为荧光强度根据有机溶剂的组成而变化,所以用洗脱时的有机溶剂的组成校正荧光强度。
[0261]
试验10的结果如下表所示。
[0262]
工业适用性本化合物显示出对血清素5-ht
2a
受体和血清素5-ht7受体的拮抗活性,并且因此本化合物可用作治疗神经精神疾病的药剂。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1