用于免疫治疗的靶向含布罗莫结构域之蛋白4(BRD4)的经化学修饰的寡核苷酸的制作方法
用于免疫治疗的靶向含布罗莫结构域之蛋白4(brd4)的经化学修饰的寡核苷酸
1.相关申请
2.本技术根据35 u.s.c.
§
119(e)要求于2019年11月8日提交的题为“chemically modified oligonucleotides targeting bromodomain containing protein 4(brd4)for immunotherapy”的美国临时申请序列号62/932,813的申请日的权益,其全部公开内容通过引用以其整体并入本文中。
技术领域
3.在一些方面中,本公开内容涉及免疫调节组合物和制备免疫调节组合物的方法,所述方法包括使用寡核苷酸来调节参与转录和表观遗传调节的基因靶标即含布罗莫结构域之蛋白4(bromodomain containing protein 4,brd4)以改善治疗性免疫细胞的群(population)或亚群(subset)。本公开内容还涉及使用免疫调节组合物用于治疗细胞增生性病症或感染性疾病的方法,所述细胞增生性病症或感染性疾病包括例如癌症和自身免疫病。
背景技术:
4.免疫系统的生理功能是识别和消除肿瘤细胞。因此,肿瘤进展的一个方面是免疫抗性机制的发生。这些抗性机制一旦发生,不仅会阻止天然免疫系统影响肿瘤生长,还会限制任何免疫治疗方法对癌症的效力。免疫抗性机制涉及有时称为免疫检查点的免疫抑制途径。免疫抑制途径在肿瘤细胞与cd8+细胞毒性t淋巴细胞之间的相互作用中发挥特别重要的作用,所述免疫抑制途径包括过继细胞转移(adoptive cell transfer,act)治疗剂。
5.过继细胞转移(act)的多种方法涉及对从患者的样品(例如血液或肿瘤材料)中收集的细胞进行离体处理。基于细胞的处理的准备中涉及的常见步骤是从原始来源(例如,外周血)中分离细胞、基因编辑(例如,使嵌合抗原受体(chimeric antigen receptor,car)t细胞或经工程化的t细胞受体(t-cell receptor,tcr)细胞工程化)、活化和扩增。
6.在离体处理期间,细胞经历某些表型改变,所述改变可影响细胞的治疗特性,例如向肿瘤的运输、体内增殖能力和寿命,以及其在免疫抑制环境中的效力等。例如,t细胞分化和成熟的状态通常通过以下亚型的顺序进行:初始t细胞(tn)-干细胞记忆t细胞(t
scm
)-中枢记忆t细胞(t
cm
)-效应记忆t细胞(t
em
)-终末分化的效应t细胞(t
eff
)。已经观察到,cd8+t细胞中的早期记忆t细胞(ts
cm
/t
cm
)的表型属性和功能属性显示出比更分化的效应细胞(例如,t
em
、t
eff
等)优异的体内扩增、持久性和抗肿瘤效力。
技术实现要素:
7.在一些方面中,本公开内容涉及用于在产生免疫调节组合物期间控制t细胞的分化过程以增强期望的治疗性t细胞亚型(例如,t
scm
和t
cm
)的水平的组合物和方法。本公开内容部分地基于包含宿主细胞的免疫调节(例如,免疫原性)组合物以及产生这样的组合物的
方法,所述宿主细胞包含靶向与信号转导/转录因子靶标、表观遗传靶标、代谢和共抑制/负调节靶标相关的基因的寡核苷酸分子。在一些方面中,本公开内容提供了用于产生免疫调节组合物的方法中的经化学修饰的寡核苷酸分子。在一些实施方案中,由本公开内容所描述的方法和组合物可用于制备免疫调节组合物和用于治疗患有增生性或感染性疾病的对象。
8.因此,在一些方面中,本公开内容提供了经化学修饰的双链核酸分子,其靶向布罗莫结构域和末端外(bet)家族的成员即含布罗莫结构域之蛋白4(brd4)(例如,针对编码该成员的基因)。
9.在一些实施方案中,经化学修饰的双链核酸分子针对这样的序列:其包含选自表1中序列的序列的至少12个连续核苷酸。在一些实施方案中,经化学修饰的双链核酸分子是自递送rna(例如,intasyl
tm
;在本文中也称为sd-rxrna))。在一些实施方案中,经化学修饰的双链核酸分子(例如intasyl
tm
)包含表1或2中所示序列或其片段,或者由表1或2中所示序列或其片段组成,或者靶向或针对表1或2中所示序列或其片段。
10.在一些实施方案中,经化学修饰的双链核酸分子包含至少一个2
’‑
o-甲基修饰和/或至少一个2
’‑
o-氟修饰,以及至少一个硫代磷酸酯修饰。
11.在一些方面,本公开内容提供了针对编码brd4的基因的intasyl
tm
化合物。在一些实施方案中,intasyl
tm
化合物(sd-rxrna)包含选自表2中序列的序列的至少12个连续核苷酸。
12.在一些实施方案中,intasyl
tm
化合物是经疏水性修饰的。在一些实施方案中,intasyl
tm
化合物与一种或更多种疏水性缀合物连接。在一些实施方案中,疏水性缀合物是胆固醇。
13.在一些实施方案中,如本文中所述的经化学修饰的双链核酸分子或intasyl
tm
化合物包含brd4-20有义或反义链或者brd4-21有义或反义链或者brd4-22有义或反义链所示序列,或者由其组成。
14.在一些实施方案中,如本文中所述的经化学修饰的双链核酸分子或intasyl
tm
化合物包含具有brd4-20有义链所示序列的有义链和/或具有brd4-20反义链所示序列的反义链,或者由其组成。在一些实施方案中,如本文中所述的经化学修饰的双链核酸分子或intasyl
tm
化合物包含具有brd4-21有义链所示序列的有义链和/或具有brd4-21反义链所示序列的反义链,或者由其组成。在一些实施方案中,如本文中所述的经化学修饰的双链核酸分子或intasyl
tm
化合物包含具有brd4-22有义链所示序列的有义链和/或具有brd4-22反义链所示序列的反义链,或者由其组成。
15.在一些方面,本公开内容提供了包含如本文中所述的经化学修饰的双链核酸分子或intasyl
tm
化合物以及可药用赋形剂的组合物。
16.在一些实施方案中,如本文中所述的组合物包含针对brd4的经化学修饰的双链核酸分子或intasyl
tm
化合物。在一些实施方案中,针对brd4的经化学修饰的双链核酸分子或intasyl
tm
化合物包含选自表2的序列的至少12个连续核苷酸。
17.在一些方面中,本公开内容提供了免疫调节组合物,其包含宿主细胞(例如,免疫细胞,例如t细胞或nk细胞),所述宿主细胞已经用经化学修饰的双链核酸分子离体处理以控制和/或降低宿主细胞(例如,t细胞)的分化水平,以使得能够产生用于在人中施用的特
异性免疫细胞群(例如,针对特定t细胞亚型富集的群)。在一些实施方案中,免疫调节组合物包含针对特定细胞类型(例如,t细胞亚型)富集的多种宿主细胞。例如,在一些实施方案中,免疫调节组合物包含至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少99%或100%(例如,50%至100%之间的任何百分比,包括端值)的特定t细胞亚型的t细胞,例如t
scm
或t
cm
细胞。
18.在一些实施方案中,免疫调节组合物包含宿主细胞,该宿主细胞包含如本文中所述的经化学修饰的双链核酸分子(例如,针对编码brd4的基因的经化学修饰的双链核酸分子或intasyl
tm
化合物)。在一些实施方案中,经化学修饰的双链核酸分子或intasyl
tm
化合物针对这样的序列:其包含选自表1中序列的序列至少12个连续核苷酸。在一些实施方案中,经化学修饰的双链核酸分子(例如,intasyl
tm
)包含表1和2中所示序列或其片段,或者由表1和2中所示序列或其片段组成,或者靶向或针对表1和2中所示序列或其片段。
19.在一些实施方案中,宿主细胞包含针对brd4的经化学修饰的双链核酸分子。在一些实施方案中,针对brd4的经化学修饰的双链核酸分子包含选自表2的序列的至少12个连续核苷酸。
20.在一些实施方案中,宿主细胞选自:t细胞、nk细胞、抗原呈递细胞(antigen-presenting cell,apc)、树突细胞(dendritic cell,dc)、干细胞(stem cell,sc)、诱导多能干细胞(induced pluripotent stem cell,ipsc)、干细胞记忆t细胞和细胞因子诱导的杀伤细胞(cytokine-induced killer cell,cik)。在一些实施方案中,宿主细胞是t细胞。在一些实施方案中,t细胞是cd8
+ t细胞。在一些实施方案中,t细胞在引入经化学修饰的双链核酸或intasyl
tm
化合物之后分化成特定的t细胞亚型,例如t
scm
或t
cm
t细胞。
21.在一些实施方案中,t细胞包含表达高亲和力t细胞受体(tcr)和/或嵌合抗原受体(car)的一种或更多种转基因。
22.在一些实施方案中,宿主细胞源自健康供体。
23.在一些方面中,本公开内容提供了用于产生免疫调节组合物的方法,该方法包括将一种或更多种如本文中所述的经化学修饰的双链核酸分子或intasyl
tm
化合物引入到细胞中。在一些实施方案中,将经化学修饰的双链核酸分子或sd-rxrna离体引入到细胞中。
24.在本文中所述方法的一些实施方案中,细胞是t细胞、nk细胞、抗原呈递细胞(apc)、树突细胞(dc)、干细胞(sc)、诱导多能干细胞(ipsc)、干细胞记忆t细胞和细胞因子诱导的杀伤细胞(cik)。
25.在一些实施方案中,t细胞是cd8+ t细胞。在一些实施方案中,t细胞在引入经化学修饰的双链核酸或sd-rxrna之后分化成特定的t细胞亚型,例如t
scm
或t
cm
t细胞。在一些实施方案中,t细胞包含表达高亲和力t细胞受体(tcr)和/或嵌合抗原受体(car)的一种或更多种转基因。在一些实施方案中,细胞源自健康供体。
26.在一些方面中,本公开内容提供了用于治疗患有增生性疾病或感染性疾病的对象的方法,所述方法包括向对象施用如本文中所述的免疫调节组合物。在一些实施方案中,增生性疾病是癌症。在一些实施方案中,感染性疾病是病原体感染,例如病毒感染、细菌感染或寄生虫感染。
27.本发明的每个限制都可以涵盖本发明的多个实施方案。因此,预期涉及任何一个要素或要素组合的本发明的每个限制可以包含在本发明的每个方面中。本发明在其应用方
druggable)”靶标,例如难以被小分子(例如,转录因子)抑制的那些靶标;(ii)与替代的离体sirna转染技术(例如,脂质介导的转染或电穿孔)相比,intasyl
tm
可转染多种细胞类型,包括具有高的转染效力、保持高的细胞生存力的t细胞;(iii)当在早期扩增阶段添加至细胞培养基时,intasyl
tm
化合物在8至10个分裂周期期间提供目的靶标的瞬时沉默,从而使沉默作用到最终细胞群重新输注到患者中的时候在最终细胞群中消失;(iv)intasyl
tm
可组合使用以使多个靶标同时沉默,从而为在不同类型的细胞治疗方案中使用提供极大的灵活性。
40.本文中描述了针对参与t细胞分化的特定靶标的intasyl
tm
化合物,以及这样的intasyl
tm
在离体扩增期间和/或之后对t细胞表型的有益作用。还提出了可用于鉴定适合于特定细胞产生方案的intasyl
tm
化合物的筛选方法。
41.如本文中所使用的,“核酸分子”包括但不限于:intasyl
tm
、sd-rxrna、rxrnaori、寡核苷酸、aso、sirna、shrna、mirna、ncrna、cp-lasirna、airna、单链核酸分子、双链核酸分子、rna和dna。在一些实施方案中,核酸分子是经化学修饰的核酸分子,例如经化学修饰的寡核苷酸。在一些实施方案中,核酸分子是双链的。在一些实施方案中,如本文中所述的经化学修饰的双链核酸分子是intasyl
tm
(也称为sd-rxrna)分子。
42.intasyl
tm
(sd-rxrna)分子
43.本发明的一些方面涉及靶向与控制t细胞分化过程相关的基因(例如brd4)的intasyl
tm
分子。在一些实施方案中,本公开内容提供了靶向基因brd4的intasyl
tm
。在一些实施方案中,本文中所述的intasyl
tm
分子包含表2中所示序列或其片段,或者由表2中所示序列或其片段组成,或者靶向或针对表2中所示序列或其片段。
44.如本文中所使用的,“sd-rxrna”或“sd-rxrna分子”或“intasyl
tm”或“intasyl
tm
分子”或intasyl化合物”是指自递送rna分子,例如通过引用并入的来自以下专利中描述那些:2014年8月5日授权的题为“reduced size self-delivering rnai compounds”的美国专利no.8,796,443,2015年11月3日授权的题为“reduced size self-delivering rnai compounds”的美国专利no.9,175,289,2020年9月15日授权的题为“reduced size self-delivering rnai compounds”的美国专利no.10,774,330和2009年9月22日提交的题为“reduced size self-delivering rnai compounds”的pct公开no.wo2010/033247(申请no.pct/us2009/005247)。简言之,intasyl
tm
(也称为sd-rxrna
nano
)是分离的不对称双链核酸分子,其包含最小长度为16个核苷酸的引导链和长度为8至18个核苷酸的随从链,其中所述双链核酸分子具有双链区和单链区,单链区长度为4至12个核苷酸,并且具有至少三个核苷酸骨架修饰。在一些优选实施方案中,双链核酸分子具有一个平末端,或者包含一个或两个核苷酸的单链突出端(overhang)。可通过化学修饰,并且在一些情况下,通过附接疏水性缀合物对intasyl
tm
分子进行优化。以上引用的专利和出版物各自通过引用以其整体并入本文中。
45.在一些实施方案中,intasyl
tm
包含分离的双链核酸分子,所述双链核酸分子包含引导链和随从链,其中分子双链区的长度为8至15个核苷酸,其中引导链包含长度为4至12个核苷酸的单链区,其中引导链的单链区包含3、4、5、6、7、8、9、10、11或12个硫代磷酸酯修饰,并且其中双链核酸的至少40%核苷酸是经修饰的。
46.本发明的核酸分子在本文中是指本发明的分离的双链或双链体核酸、寡核苷酸或
多核苷酸、纳米分子、纳米rna、sd-rxrna
nano
、sd-rxrna、intasyl
tm
或rna分子。
47.与常规sirna相比,intasyl
tm
分子有效得多地被细胞摄取。这些分子在使靶基因表达沉默方面非常高效,并且相对于之前描述的rnai分子提供了显著的优点,包括在血清存在下的高活性、高效的自递送、与广泛多种接头的相容性、以及与毒性相关的化学修饰的存在降低或完全不存在。
48.与单链多核苷酸相比,双链体多核苷酸传统上难以递送至细胞,因为其具有刚性结构和大量负电荷,这使得膜转移变得困难。然而,尽管intasyl
tm
分子是部分双链的,但是被认为在体内是单链的,并且因此能够高效地被递送穿过细胞膜。因此,本发明的多核苷酸在许多情况下能够自递送。因此,本发明的多核苷酸可以以类似于常规rnai试剂的方式配制,或者其可单独(或者与非递送类型的载体一起)递送至细胞或对象并且允许自递送。在本发明的一个实施方案中,提供了自递送不对称双链rna分子,其中分子的一部分与常规rna双链体类似,并且分子的第二部分是单链的。
49.在一些方面中,本发明的寡核苷酸具有不对称结构的组合,其包括5个核苷酸或更长的双链区和单链区,特定的化学修饰模式,并且与亲脂性或疏水性分子缀合。在一些实施方案中,这一类rnai样化合物具有优异的体外和体内效力。认为刚性双链体区尺寸的减小与应用于单链区的硫代磷酸酯修饰的组合有助于所观察到的优异效力。
50.在一些实施方案中,本发明的rnai化合物包含不对称化合物,所述不对称化合物包含8至15个碱基长的双链体区(高效risc进入所需的)和4至12个核苷酸长的单链区。在一些实施方案中,双链体区为13或14个核苷酸长,并且在一些实施方案中,单链区为6至7个核苷酸长。rnai化合物(例如intasyl
tm
分子)的单链区还包含2至12个硫代磷酸酯核苷酸间键联(称为硫代磷酸酯修饰)。在一些实施方案中,单链区包含6至8个硫代磷酸酯核苷酸间键联。另外,本发明的rnai化合物还包含独特的化学修饰模式,其提供稳定性并且与risc进入相容。在一些实施方案中,这些要素的组合已产生对于体外和体内递送rnai试剂非常有用的预料不到的特性。
51.提供稳定性并且与risc进入相容的化学修饰模式包括对有义链或随从链以及反义链或引导链的修饰。例如,随从链可被赋予稳定性并且不干扰活性的任何化学实体修饰。这样的修饰包括2’核糖修饰(o-甲基、2’f、2脱氧等)和骨架修饰,例如硫代磷酸酯修饰。在一些实施方案中,随从链中的化学修饰模式包括随从链内c和u核苷酸的o-甲基修饰,或者替代地随从链可完全是o-甲基修饰的。
52.在一些实施方案中,引导链也可被赋予稳定性并且不干扰risc进入的任何化学修饰所修饰。在一些实施方案中,引导链中的化学修饰模式包括,大部分c和u核苷酸是2
′
f修饰的并且5
′
端被磷酸化。在一些实施方案中,引导链中的化学修饰模式包括第1位的2
′
o-甲基修饰和第11至18位的c/u和5
′
端化学磷酸化。在一些实施方案中,引导链中的化学修饰模式包括第1位的2
′
o-甲基修饰和第11至18位的c/u和5
′
端化学磷酸化以及第2至10位的c/u的2
′
f修饰。在一些实施方案中,随从链和/或引导链包含至少一个5-甲基c或u修饰。
53.在一些实施方案中,sd-rxrna(例如intasyl
tm
化合物)中至少30%的核苷酸是经修饰的。例如,intasyl
tm
化合物中至少30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、
69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的核苷酸是经修饰的。在一些实施方案中,intasyl
tm
化合物中100%的核苷酸是经修饰的。
54.本发明寡核苷酸的上述化学修饰模式是良好耐受的并且改善了不对称rnai化合物的效力。在一些实施方案中,消除任一种所述要素(component)(引导链稳定、硫代磷酸酯区段(strench)、有义链稳定和疏水性缀合物)或增大尺寸在一些情况下导致次优的效力,并且在一些情况下导致完全失去效力。要素的组合导致开发了在被动递送至细胞(例如hela细胞或t细胞)之后完全活化的化合物。
55.在一些情况下,可通过使用新化学物质类型改善化合物的疏水性来进一步改善intasyl
tm
。例如,一种化学物质涉及使用疏水性碱基修饰。任何位置的任何碱基都可被修饰,只要修饰导致碱基的分配系数提高即可。用于修饰化学物质的优选位置是嘧啶的4位和5位。这些位置的主要优点是:(a)易于合成,和(b)不干扰碱基配对以及a型螺旋的形成,这对于risc复合物装载和靶标识别是必须的。在一些实施方案中,使用其中存在多个脱氧尿嘧啶而不干扰总体化合物效力的intasyl
tm
化合物。另外,通过修饰疏水性缀合物的结构,可获得组织分布和细胞摄取中大的改善。在一些实施方案中,固醇的结构被修饰以改变(提高/降低)c17附接的链。这种类型的修饰导致细胞摄取的显著提高和体内组织摄取特性的改善。
56.在一些实施方案中,经化学修饰的双链核酸分子是经疏水性修饰的sirna-反义杂交分子,其包含约13至22个碱基对的双链区,具有或不具有每条有义链和反义链上的3
’‑
单链突出端,以及约2至9个核苷酸的反义链上的3’单链尾部。在一些实施方案中,经化学修饰的双链核酸分子包含至少一个2
’‑
o-甲基修饰、至少一个2
’‑
氟修饰,以及至少一个硫代磷酸酯修饰,以及选自以下的至少一个疏水性修饰:固醇、胆固醇、维生素d、萘基、异丁基、苄基、吲哚、色氨酸、苯基等疏水性修饰剂。在一些实施方案中,经化学修饰的双链核酸分子包含多个这样的修饰。
57.在一些方面中,本公开内容涉及经化学修饰的双链核酸分子,其靶向编码与细胞分化(例如,t细胞分化)相关的靶标的基因,所述靶标例如信号转导/转录因子靶标、表观遗传靶标、代谢和共抑制/负调节靶标。表观遗传蛋白的一些实例包括但不限于brd4。在一些实施方案中,经化学修饰的双链核酸靶向编码brd4的基因。
58.如本文中所使用的,“brd4”(也称为cap、mcap、hunk1、hunki)是指含布罗莫结构域之蛋白4或含布罗莫结构域4,是布罗莫结构域和末端外(bet)家族的成员,其是在癌症发生期间发挥作用的转录和表观遗传调节因子。brd4包含两个布罗莫结构域,其识别dna组蛋白尾部上的乙酰化赖氨酸残基。作为染色质调节蛋白,brd4与乙酰化组蛋白结合,并参与跨细胞分裂和转录调节的表观遗传记忆的传递。具体地,一旦蛋白质结合,其在整个细胞周期期间都与乙酰化染色质保持在一起,通过保留高级染色质结构为有丝分裂后g1基因转录提供表观遗传记忆。(wang et al.(2012)j.biol.chem.287:10738-10752)。brd4在起始和延伸步骤期间促进基因转录,因为其募集作为正转录延伸因子的p-tefb(yang et al.(2005)mol cell.19(4):535-45)。brd4与癌症有关,因为其在调节参与细胞周期和细胞凋亡的基因(例如c-myc和bcl2)的转录延伸中发挥作用。(jung et al.(2015)epigenomics,7(3):
487-501)。在一些实施方案中,brd4由由ncbi参考序列号nm_058243.2表示的核酸序列编码。
59.可被本公开内容的经化学修饰的双链核酸分子靶向的brd4序列的一些非限制性实例列于表2中。
60.在一些实施方案中,经化学修饰的双链核酸分子包含表2内序列的至少12个核苷酸。在一些实施方案中,经化学修饰的双链核酸分子包含表2内至少一个序列(例如,包含含有表2中任一个中所示序列的有义链或反义链)。在一些实施方案中,经化学修饰的双链核酸分子(例如,intasyl
tm
)包含表2中所示序列或其片段,或者由表2中所示序列或其片段组成,或者靶向或针对表2中所示序列或其片段。
61.在一些实施方案中,经化学修饰的双链核酸分子(例如,intasyl
tm
)包含具有brd4-20有义链所示序列的有义链和/或具有brd4-20反义链所示序列的反义链。在一些实施方案中,经化学修饰的双链核酸分子(例如,intasyl
tm
)包含具有brd4-21有义链所示序列的有义链和/或具有brd4-21反义链所示序列的反义链。在一些实施方案中,经化学修饰的双链核酸分子(例如,intasyl
tm
)包含具有brd4-22有义链所示序列的有义链和/或具有brd4-22反义链所示序列的反义链。
62.在一些实施方案中,根据本发明配制的dsrna为rxrnaori。rxrnaori是指来自以下中描述并通过引用并入的一类rna分子:2009年2月11日提交的题为“modified rnai polynucleotides and uses thereof”的pct公开no.wo2009/102427(申请no.pct/us2009/000852),以及2010年11月1日提交的题为“modified rnai polynucleotides and uses thereof”的美国专利公开no.us 2011/0039914。
63.在一些实施方案中,rxrnaori分子包含用于抑制靶基因表达的长度为12至35个核苷酸的双链rna(dsrna)构建体,其包含:具有5’端和3’端的有义链,其中所述有义链经2
’‑
修饰的核糖高度修饰,并且其中有义链中央部分的3至6个核苷酸未经2
’‑
修饰的核糖修饰;以及具有5’端和3’端的反义链,所述反义链与所述有义链以及与靶基因的mrna杂交,其中所述dsrna以序列依赖性方式抑制靶基因的表达。
64.rxrnaori可包含本文中描述的任一种修饰。在一些实施方案中,rxrnaori中至少30%的核苷酸是经修饰的。例如,rxrnaori中至少30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的核苷酸是经修饰的。在一些实施方案中,sd-rna中100%的核苷酸是经修饰的。在一些实施方案中,仅rxrnaori的随从链包含修饰。
65.因此,本发明的一些方面涉及包含引导(反义)链和随从(有义)链的分离的双链核酸分子。本文中使用的术语“双链”是指一种或更多种核酸分子,其中核苷酸单体(nucleomonomer)的至少一部分是互补的并且是氢键以形成双链区。在一些实施方案中,引导链的长度为16至29个核苷酸长。在某些实施方案中,引导链为16、17、18、19、20、21、22、23、24、25、26、27、28或29个核苷酸长。引导链与靶基因具有互补性。引导链和靶基因之间的互补性可存在于引导链的任意部分上。本文中使用的互补性可以是完全互补性或不完全互
补性,只要引导链与其介导rnai的靶标足够互补即可。在一些实施方案中,互补性是指引导链和靶标之间小于25%、20%、15%、10%、5%、4%、3%、2%或1%的错配。完全互补性是指100%互补性。在一些实施方案中,还已发现相对于靶序列具有插入、缺失和单点突变的sirna序列对于抑制有效。另外,并非sirna的所有位置对于靶标识别具有相同贡献。sirna中央的错配是最严重的,并且基本上消除了靶rna切割。参考反义链的中央上游或切割位点上游的错配是可耐受的,但是显著降低了靶rna切割。参考反义链中央或切割位点下游的错配,优选位于反义链的3’端附近,例如,距离反义链的3’端1、2、3、4、5或6个核苷酸的错配是可耐受的,并且仅稍微降低靶rna切割。
66.尽管不希望受到任何特定理论的限制,但在本文中所述的双链核酸分子的一些实施方案中,引导链为至少16个核苷酸长并且将argonaute蛋白锚定在risc中。在一些实施方案中,当引导链装载到risc中时,其具有限定的种子区(seed region),并且靶mrna切割发生在引导链10至11位的对面。在一些实施方案中,引导链的5’端被磷酸化或能够被磷酸化。本文中所述的核酸分子可被称为最小触发rna(minimum trigger rna)。
67.在本文中所述的双链核酸分子的一些实施方案中,随从链的长度为8至15个核苷酸长。在某些实施方案中,随从链为8、9、10、11、12、13、14或15个核苷酸长。随从链与引导链具有互补性。随从链与引导链之间的互补性可存在于随从链或引导链的任意部分上。在一些实施方案中,在分子双链区内引导链和随从链之间存在100%的互补性。
68.本发明的一些方面涉及具有最小双链区的双链核酸分子。在一些实施方案中,所述分子的双链区为8至15个核苷酸长。在某些实施方案中,所述分子的双链区为8、9、10、11、12、13、14或15个核苷酸长。在某些实施方案中,双链区为13或14个核苷酸长。在一些实施方案中,所述分子的双链区为13至22个核苷酸长。在某些实施方案中,所述分子的双链区为16、17、18、19、20、21或22个核苷酸长。
69.引导链和随从链之间可存在100%的互补性,或者引导链和随从链之间可存在一个或更多个错配。在一些实施方案中,在双链分子的一端,分子是平末端或具有一个核苷酸的单链突出端。在一些实施方案中,分子的单链区为4至12个核苷酸长。例如,单链区可以为4、5、6、7、8、9、10、11或12个核苷酸长。然而,在某些实施方案中,单链区也可以是小于4或大于12个核苷酸长。在某些实施方案中,单链区为至少6个或至少7个核苷酸长。在一些实施方案中,单链区为2至9个核苷酸长,包括2或3个核苷酸长。
70.与本发明相关的rnai构建体的热力学稳定性(δg)可小于-13kkal/mol。在一些实施方案中,热力学稳定性(δg)小于-20kkal/mol。在一些实施方案中,当(δg)低于-21kkal/mol时,存在效力损失。在一些实施方案中,高于-13kkal/mol的(δg)值与本发明的一些方面兼容。不希望受到任何理论的约束,在一些实施方案中,具有相对较高(δg)值的分子可在相对较高的浓度下变得有活性,而具有相对较低(δg)值的分子可在相对较低的浓度下变得有活性。在一些实施方案中,(δg)值可高于-9kkcal/mol。由与本发明相关的包含最小双链区的rnai构建体介导的基因沉默作用是出乎意料的,因为已经示出了几乎相同设计但热力学稳定性较低的分子是无活性的(rana et al 2004)。
71.不希望受到任何理论的约束,本文中所述的结果表明8至10bp的dsrna或dsdna区段将被risc的蛋白质组分或risc的辅因子在结构上识别。另外,对于触发化合物,存在自由能需求,所述化合物可被蛋白质组分感测和/或足够稳定以与这样的组分相互作用,使得其
可被装载到argonaute蛋白中。如果存在可接受的热力学并且存在优选为至少8个核苷酸的双链部分,则双链体将被识别并且装载到rnai机器(machinery)中。
72.在一些实施方案中,通过使用lna碱基来提高热力学稳定性。在一些实施方案中,引入另外的化学修饰。化学修饰的数种非限制性实例包括:5
′
磷酸酯(phosphate)、5’膦酸酯(5’phosphonate)、5
′
乙烯基膦酸酯、2
′‑
o-甲基、2
′‑
o-乙基、2
′‑
氟、胸腺嘧啶核糖核苷(ribothymidine)、c-5丙炔基-dc(pdc)和c-5丙炔基-du(pdu);c-5丙炔基-c(pc)和c-5丙炔基-u(pu);5-甲基c、5-甲基u、5-甲基dc、5-甲基du甲氧基、(2,6-二氨基嘌呤)、5
’‑
二甲氧基三苯甲基-n4-乙基-2
’‑
脱氧胞苷和mgb(小沟结合物)。应理解的是,同一分子内可组合多于一种化学修饰。
73.优化与本发明相关的分子以用于提高效力和/或降低毒性。例如,在一些方面中,引导链和/或随从链的核苷酸长度,和/或引导链和/或随从链中硫代磷酸酯修饰的数目可影响rna分子的效力,而在一些方面中,将2
’‑
氟(2’f)修饰替换成2
’‑
o-甲基(2’ome)修饰可影响分子的毒性。特别地,预期分子的2’f含量的降低将降低分子的毒性。另外,rna分子中硫代磷酸酯修饰的数目可影响分子进入到细胞中的摄取,例如分子被被动摄取到细胞中的效率。本文中所述分子的一些优选实施方案不具有2’f修饰并且还以在细胞摄取和组织渗透性方面相等的效力为特征。这样的分子相对于现有技术(例如由accell和wolfrum描述的用广泛使用的2’f大量修饰的分子)表现出显著改进。
74.在一些实施方案中,引导链的长度为约18至20个核苷酸并且具有约2至14个磷酸酯修饰。例如,引导链可包含2、3、4、5、6、7、8、9、10、11、12、13、14或多于14个经磷酸酯修饰的核苷酸。引导链可包含一个或更多个赋予提高的稳定性而不干扰risc进入的修饰。磷酸酯修饰的核苷酸,例如硫代磷酸酯修饰的核苷酸可在引导链的3’端、5’端或遍布引导链。在一些实施方案中,引导链3’端的10个核苷酸包含1、2、3、4、5、6、7、8、9或10个经硫代磷酸酯修饰的核苷酸。引导链还可包含2’f和/或2’ome修饰,其可位于整个分子中。在一些实施方案中,引导链第1位的核苷酸(引导链最5’位置的核苷酸)是2’ome修饰的和/或磷酸化的和/或包含乙烯基膦酸酯。引导链内的c和u核苷酸可以是2’f修饰的。例如,20个核苷酸的引导链的第2至10位(或者不同长度的引导链的相应位置)的c和u核苷酸可以是2’f修饰的。引导链内的c和u核苷酸还可以是2’ome修饰的。例如,19个核苷酸的引导链的第11至18位(或者不同长度的引导链的相应位置)的c和u核苷酸可以是2’ome修饰的。在一些实施方案中,引导链最3’端的核苷酸是未经修饰的。在某些实施方案中,引导链内的大部分c和u是2’f修饰的,并且引导链5’端是磷酸化的。在另一些实施方案中,第11至18位的c或u以及第1位是2’ome修饰的,并且引导链的5’端是磷酸化的。在另一些实施方案中,第11至18位的c或u以及第1位是2’ome修饰的,并且引导链的5’端是磷酸化的,并且第2至10位的c或u是2’f修饰的。
75.在一些方面中,随从链的长度为约11至14个核苷酸。随从链可包含赋予提高的稳定性的修饰。随从链中的一个或更多个核苷酸可以是2’ome修饰的。在一些实施方案中,随从链中的一个或更多个c和/或u核苷酸是2’ome修饰的,或者随从链中的所有c和u核苷酸均是2’ome修饰的。在某些实施方案中,随从链中的所有核苷酸均是2’ome修饰的。随从链上的一个或更多个核苷酸还可以是磷酸酯修饰的,例如硫代磷酸酯修饰的。随从链还可包含2’核糖、2’氟和2脱氧修饰或者上述修饰的任意组合。引导链和随从链二者上的化学修饰模式可良好耐受,并且化学修饰的组合可导致提高的rna分子的效力和自递送。
76.本发明的一些方面涉及rnai构建体,与之前用于rnai的分子相比,其具有相对于双链区延长的单链区。可对该分子的单链区进行修饰以促进细胞摄取或基因沉默。在一些实施方案中,单链区的硫代磷酸酯修饰影响细胞摄取和/或基因沉默。引导链的硫代磷酸酯修饰的区域可包含分子的单链区和双链区二者内的核苷酸。在一些实施方案中,单链区包含2至12个硫代磷酸酯修饰。例如,单链区可包含2、3、4、5、6、7、8、9、10、11或12个硫代磷酸酯修饰。在一些情况下,单链区包含6至8个硫代磷酸酯修饰。
77.还设计了与本发明相关的分子以用于细胞摄取。在本文中所述的rna分子中,引导链和/或随从链可与缀合物连接。在某些实施方案中,缀合物是疏水性的。疏水性缀合物可以是分配系数大于10的小分子。缀合物可以是固醇型分子(例如胆固醇)或者具有与c17连接的延长聚碳链的分子,并且缀合物的存在可在具有或不具有脂质转染试剂的情况下影响细胞摄取rna分子的能力。缀合物可通过疏水性接头与随从链或引导链连接。在一些实施方案中,疏水性接头的长度为5至12c,和/或是基于羟基吡咯烷的。在一些实施方案中,疏水性缀合物与随从链连接,并且随从链和/或引导链的cu残基是经修饰的。在一些实施方案中,随从链和/或引导链上的至少50%、55%、60%、65%、70%、75%、80%、85%、90%或95%的cu残基是经修饰的。在一些方面中,与本发明相关的分子是自递送(self-delivering,sd)的。如本文中使用的“自递送”是指分子不需要另外的递送载剂(例如转染试剂)而被递送到细胞中的能力。
78.本发明的一些方面涉及选择用于rnai的分子。在一些实施方案中,可选择具有8至15个核苷酸的双链区的分子来用于rnai。在一些实施方案中,基于分子的热力学稳定性(δg)选择分子。在一些实施方案中,选择(δg)小于-13kkal/mol的分子。例如,(δg)值可为-13、-14、-15、-16、-17、-18、-19、-21、-22或者小于-22kkal/mol。在另一些实施方案中,(δg)值可大于-13kkal/mol。例如,(δg)值可为-12、-11、-10、-9、-8、-7或者大于-7kkal/mol。应理解的是,可使用本领域中已知的任何方法计算δg。在一些实施方案中,使用可通过mfold网站(mfold.bioinfo.rpi.edu/cgi-bin/rna-form1.cgi)获得的mfold计算δg。用于计算δg的方法描述在通过引用并入的以下参考文献中:zuker,m.(2003)nucleic acids res.,31(13):3406-15;mathews,d.h.,sabina,j.,zuker,m.and turner,d.h.(1999)j.mol.biol.288:911-940;mathews,d.h.,disney,m.d.,childs,j.l.,schroeder,s.j.,zuker,m.,and turner,d.h.(2004)proc.natl.acad.sci.101:7287-7292;duan,s.,mathews,d.h.,and turner,d.h.(2006)biochemistry 45:9819-9832;wuchty,s.,fontana,w.,hofacker,i.l.,and schuster,p.(1999)biopolymers 49:145-165。
79.在某些实施方案中,多核苷酸包含5’和/或3’端的单链突出端。在多核苷酸一端上的单链核苷酸突出端的数目和/或序列可与多核苷酸另一端的相同或不同。在某些实施方案中,一个或更多个单链突出端核苷酸可包含化学修饰,例如硫代磷酸酯修饰或2
’‑
ome修饰。
80.在某些实施方案中,多核苷酸是未经修饰的。在另一些实施方案中,至少一个核苷酸是经修饰的。在另一些实施方案中,修饰包括在从引导序列的5’端开始的第二个核苷酸处的2
’‑
h或2
’‑
修饰的核糖。“第二个核苷酸”被定义为从多核苷酸的5
’‑
端开始的第二个核苷酸。
81.如本文中所使用的,“2
’‑
修饰的核糖”包括不具有2
’‑
oh基团的那些核糖。“2
’‑
修
饰的核糖”不包括2
’‑
脱氧核糖(见于未经修饰的典型dna核苷酸中)。例如,2
’‑
修饰的核糖可以是2
’‑
o-烷基核苷酸、2
’‑
脱氧-2
’‑
氟核苷酸、2
’‑
脱氧核苷酸,或其组合。
82.在某些实施方案中,2
’‑
修饰的核苷酸是嘧啶核苷酸(例如,c/u)。2
’‑
o-烷基核苷酸的一些实例包括2
’‑
o-甲基核苷酸或2
’‑
o-烯丙基核苷酸。
83.在某些实施方案中,具有上文提及的5’端修饰的本发明的sd-rxrna多核苷酸当与不具有特定5’端修饰的类似构建体相比时表现出显著更低(例如,降低至少约25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或更多)的“脱靶”基因沉默,因此极大改善了rnai试剂或治疗剂的整体特异性。
84.如本文中所使用的,“脱靶”基因沉默是指由于例如反义(引导)序列和非预期靶mrna序列之间的假序列同源性而导致的非预期的基因沉默。
85.根据本发明的这个方面,某些引导链修饰进一步提高核酸酶稳定性,和/或降低干扰素诱导,而不显著降低rnai活性(或者根本不降低rnai活性)。
86.修饰的某些组合可导致另一些意料之外的优点,如通过增强的抑制靶基因表达的能力、增强的血清稳定性和/或提高的靶标特异性等部分表现出的。
87.在某些实施方案中,引导链在引导链5’端上的第二个核苷酸处包含2
’‑
o-甲基修饰的核苷酸,并且没有其他经修饰的核苷酸。
88.在另一些方面中,本发明的经化学修饰的双链核酸分子结构通过微小rna机制介导序列依赖性基因沉默。如本文中所使用,术语“微小rna”(“mirna”)在本领域中也称为“小时序rna”(“small temporal rna,strna”),其是指(例如,通过病毒、哺乳动物或植物基因组)遗传编码的并且能够指导或介导rna沉默的小(10至50个核苷酸)rna。“mirna病症”应指以mirna的异常的表达或活性为特征的疾病或病症。
89.微小rna参与下调小鼠、蠕虫和哺乳动物中的关键途径(例如发育和癌症)中的靶基因。经由微小rna机制的基因沉默通过mirna与其靶信使rna(mrna)的具有特异性但不完全的碱基配对实现。多种机制可用于微小rna介导的靶mrna表达的下调。
90.mirna是约22个核苷酸的非编码rna,其可在植物和动物发育期间在转录后水平或翻译水平调节基因表达。mirna的一个普遍特征是其全部从被称为前mirna(pre-mirna)的约70个核苷酸的前体rna茎-环上切离,可能是通过dicer(iii型核糖核酸酶)或其同源物切离。天然存在的mirna在体内由内源基因表达,并且通过dicer或其他核糖核酸酶由发夹或茎-环前体(前mirna或pri-mirna)加工。mirna在体内可短暂地作为双链的双链体存在,但是仅一条链被risc复合物摄取以指导基因沉默。
91.在一些实施方案中,描述了在细胞摄取和抑制mirna活性中有效的经化学修饰的双链核酸化合物形式。基本上,化合物类似于risc进入形式,但是进行主要链化学修饰模式以阻断切割并且充当有效的risc作用抑制剂。例如,化合物可完全或大部分是o-甲基修饰的,其具有前述的硫代磷酸酯含量。在一些实施方案中,对于这些化合物类型,5’磷酸化不是必要的。双链区的存在是优选的,因为其促进细胞摄取和高效的risc装载。
92.使用小rna作为序列特异性调节剂的另一种途径是rna干扰(rnai)途径,其是进化保守的,响应于细胞中双链rna(dsrna)的存在。dsrna被dicer切割成约20个碱基对(base pair,bp)的小干扰rna(sirna)双链体。这些小rna装配成被称为rna诱导的沉默复合物(rna-induced silencing complexe,risc)的多蛋白效应子复合物。然后sirna指导具有完
全互补性的靶mrna的切割。
93.sirna途径与mirna途径之间共享生物发生、蛋白质复合物和功能的一些方面。单链多核苷酸可模拟sirna机制中的dsrna,或者mirna机制中的微小rna。
94.在某些实施方案中,与具有相同序列的未经修饰的rnai构建体相比,经修饰的rnai构建体在血清和/或脑脊髓液中可具有提高的稳定性。
95.在某些实施方案中,在原代细胞,例如哺乳动物原代细胞(包括来自人、小鼠和其他啮齿类动物以及其他非人哺乳动物的原代细胞)中,rnai构建体的结构不诱导干扰素响应。在某些实施方案中,rnai构建体还可用于抑制无脊椎生物体中靶基因的表达。
96.为了进一步提高本发明构建体的体内稳定性,可通过保护基封闭所述结构的3’端。例如,可使用保护基例如反向核苷酸、反向无碱基(abasic)部分或氨基端修饰的核苷酸。反向核苷酸可包含反向脱氧核苷酸。反向无碱基部分可包含反向脱氧无碱基部分,例如3’,3
’‑
连接的或5’,5
’‑
连接的脱氧无碱基部分。
97.本发明的rnai构建体能够抑制由靶基因编码的任何靶蛋白的合成。本发明包括抑制体外或体内细胞中靶基因表达的方法。因此,本发明的rnai构建体可用于治疗患有以靶基因的过表达为特征的疾病的患者。
98.靶基因对于细胞而言可以是内源的或者外源的(例如,通过病毒或使用重组dna技术引入到细胞中)。这样的方法可包括以足以抑制靶基因表达的量将rna引入到细胞中。例如,这样的rna分子可具有与靶基因的核苷酸序列互补的引导链,使得组合物抑制靶基因的表达。
99.本发明还涉及表达本发明核酸的载体,以及包含这样的载体或核酸的细胞。细胞可以是体内的或培养的哺乳动物细胞,例如人细胞。
100.本发明还涉及包含本发明rnai构建体和可药用载体或稀释剂的组合物。
101.所述方法可在体外、离体或体内进行,例如在培养的哺乳动物细胞(例如培养的人细胞)中进行。
102.可在递送试剂例如脂质(例如,阳离子脂质)或脂质体的存在下接触靶细胞(例如,哺乳动物细胞)。
103.本发明的另一个方面提供了用于抑制哺乳动物细胞中靶基因的表达的方法,其包括使哺乳动物细胞与表达本发明rnai构建体的载体接触。
104.在本发明的一个方面中,提供了更长的双链体多核苷酸,其包含:尺寸为约16至约30个核苷酸的第一多核苷酸;尺寸为约26至约46个核苷酸的第二多核苷酸,其中第一多核苷酸(反义链)与第二多核苷酸(有义链)和靶基因二者互补,并且其中两个多核苷酸形成双链体,并且其中第一多核苷酸包含长度大于6个碱基的单链区,并且被交替化学修饰模式修饰,和/或包含有助于细胞递送的缀合物部分。在该实施方案中,随从链的约40%至约90%核苷酸、引导链的约40%至约90%核苷酸、以及第一多核苷酸的单链区的约40%至约90%核苷酸是经化学修饰的核苷酸。
105.在一个实施方案中,多核苷酸双链体中经化学修饰的核苷酸可以是本领域中已知的任何经化学修饰的核苷酸,例如上文详细讨论的那些。在一个具体实施方案中,经化学修饰的核苷酸选自2’f修饰的核苷酸、2
’‑
o-甲基修饰的核苷酸和2’脱氧核苷酸。在另一个具体实施方案中,经化学修饰的核苷酸由核苷酸碱基的“疏水性修饰”导致。在另一个具体实
施方案中,经化学修饰的核苷酸是硫代磷酸酯。在另一个具体实施方案中,经化学修饰的核苷酸是硫代磷酸酯、2
’‑
o-甲基、2’脱氧、疏水性修饰和硫代磷酸酯的组合。因为这些修饰分组是指核糖环、骨架和核苷酸的修饰,所以可能的是一些修饰的核苷酸将携带所有三种修饰类型的组合。
106.在另一个实施方案中,化学修饰在双链体的多个区域间是不同的。在一个具体实施方案中,第一多核苷酸(随从链)在多个位置具有大量不同的化学修饰。对于这种多核苷酸,多至90%的核苷酸可以是经化学修饰的和/或具有引入的错配。
107.在另一个实施方案中,第一或第二多核苷酸的化学修饰包括但不限于尿嘧啶和胞嘧啶的5
′
位修饰(4-吡啶基、2-吡啶基、吲哚基、苯基(c6h5oh);色氨酰基(c8h6n)ch2ch(nh2)co)、异丁基、丁基、氨基苄基;苯基;萘基等),其中化学修饰可改变核苷酸的碱基配对能力。对于引导链,本发明这个方面的重要特征在于化学修饰相对于反义链序列的5’端的位置。例如,引导链5’端的化学磷酸化通常有利于效力。有义链种子区(相对于5’端的2位至7位)中的o-甲基修饰通常不能良好耐受,而2’f和脱氧是良好耐受的。引导链的中部和引导链的3’端更容忍所应用的化学修饰类型。引导链的3’端处不耐受脱氧修饰。
108.本发明这个方面的独特特征包括在碱基上使用疏水性修饰。在一个实施方案中,疏水性修饰优选地位于引导链的5’端附近,在另一些实施方案中,疏水性修饰位于引导链中部,在另一些实施方案中,疏水性修饰位于引导链的3’端,而在另一些实施方案中,疏水性修饰分布在多核苷酸的整个长度上。相同类型的模式适用于双链体的随从链。
109.分子的其他部分是单链区。预期所述单链区为7至40个核苷酸。
110.在一个实施方案中,第一多核苷酸的单链区包含选自以下的修饰:40%至90%的疏水性碱基修饰,40%至90%的硫代磷酸酯,40%至90%的核糖部分的修饰,以及前述修饰的任意组合。
111.由于大量修饰的多核苷酸可改变引导链(第一多核苷酸)装载到risc复合物中的效率,因此在一个实施方案中,双链体多核苷酸包含引导链(第一多核苷酸)上第9、11、12、13或14位核苷酸与有义链(第二多核苷酸)上的对侧核苷酸之间的错配,以促进高效的引导链装载。
112.以下部分中描述了本发明一些更详细的方面。
113.双链体特征
114.本发明的双链寡核苷酸可通过两个分开的互补核酸链形成。双链体形成可发生在含有靶基因的细胞的内部或外部。
115.如本文中所使用的,术语“双链体”包含与互补序列氢键键合的双链核酸分子的区域。本发明的双链寡核苷酸可包含相对于靶基因有义的核苷酸序列和相对于靶基因反义的互补序列。对应于靶基因序列的有义和反义核苷酸序列,例如相同或充分相同以实现对靶基因序列的靶基因抑制(例如,约至少约98%相同、96%相同、94%、90%相同、85%相同或80%相同)。
116.在某些实施方案中,本发明的双链寡核苷酸在其整个长度上是双链的,即,在分子的任一端没有突出的单链序列,即,是平末端。在另一些实施方案中,独立核酸分子可具有不同长度。换言之,本发明的双链寡核苷酸并非在其整个长度上是双链。例如,当使用两个分开的核酸分子时,一个分子(例如,包含反义序列的第一分子)可比与其杂交的第二分子
更长(保留分子的一部分为单链)。同样地,当使用单个核酸分子时,分子在任一端的一部分可保持单链。
117.在一个实施方案中,本发明的双链寡核苷酸包含错配和/或环或凸起(bulge),但是在寡核苷酸的至少约70%的长度上是双链的。在另一个实施方案中,本发明的双链寡核苷酸在寡核苷酸的至少约80%的长度上是双链的。在另一个实施方案中,本发明的双链寡核苷酸在寡核苷酸的至少约90%至95%的长度上是双链的。在另一个实施方案中,本发明的双链寡核苷酸在寡核苷酸的至少约96%至98%的长度上是双链的。在某些实施方案中,本发明的双链寡核苷酸包含至少或多至1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个错配。
118.修饰
119.本发明的核苷酸可在包括糖部分、磷酸二酯键联和/或碱基的多个位置进行修饰。
120.在一些实施方案中,核苷的碱基部分可以是经修饰的。例如,可在嘧啶环的2、3、4、5和/或6位修饰嘧啶碱基。在一些实施方案中,胞嘧啶的环外胺基可以是经修饰的。嘌呤碱基也可以是经修饰的。例如,可在1、2、3、6、7或8位修饰嘌呤碱基。在一些实施方案中,腺嘌呤的环外胺基可以是经修饰的。在一些情况下,碱基部分的环中的氮原子可被另外的原子(例如碳)取代。碱基部分的修饰可以是任何合适的修饰。修饰的实例是本领域普通技术人员已知的。在一些实施方案中,碱基修饰包括烷基化的嘌呤或嘧啶、酰基化的嘌呤或嘧啶、或者其他杂环。
121.在一些实施方案中,嘧啶可在5位被修饰。例如,嘧啶的5位可被烷基、炔基、烯基、酰基或者其经取代的衍生物修饰。在另一些实例中,嘧啶的5位可被羟基或烷氧基或其经取代的衍生物修饰。此外,嘧啶的n4位可以被烷基化。在另一些实施方案中,嘧啶5-6键可以是饱和的,嘧啶环内的氮原子可被碳原子取代,和/或o2和o4原子可被硫原子取代。应理解的是,其他修饰也是可能的。
122.在另一些实例中,嘌呤的n7位和/或n2和/或n3位可被烷基或其经取代的衍生物修饰。在另一些实例中,第三个环可与嘌呤双环体系稠合,和/或嘌呤环体系内的氮原子可被碳原子取代。应理解的是,其他修饰也是可能的。
123.在5位被修饰的嘧啶的一些非限制性实例公开在美国专利5591843、美国专利7,205,297、美国专利6,432,963和美国专利6,020,483中;在n4位被修饰的嘧啶的一些非限制性实例公开在美国专利5,580,731中;在8位被修饰的嘌呤的一些非限制性实例公开在美国专利6,355,787和美国专利5,580,972中;在n6位被修饰的嘌呤的一些非限制性实例公开在美国专利4,853,386、美国专利5,789,416和美国专利7,041,824中;以及在2位被修饰的嘌呤的一些非限制性实例公开在美国专利4,201,860和美国专利5,587,469中,其全部通过引用并入本文中。
124.经修饰碱基的一些非限制性实例包括n4,n
4-桥亚乙基胞嘧啶(n4,n
4-ethanocytosine)、7-脱氮黄苷(7-deazaxanthosine)、7-脱氮鸟苷、8-氧代-n
6-甲基腺嘌呤、4-乙酰基胞嘧啶、5-(羧基羟基甲基)尿嘧啶、5-氟尿嘧啶、5-溴尿嘧啶、5-羧甲基氨基甲基-2-硫尿嘧啶、5-羧甲基氨基甲基尿嘧啶、二氢尿嘧啶、肌苷、n
6-异戊烯基-腺嘌呤、1-甲基腺嘌呤、1-甲基假尿嘧啶、1-甲基鸟嘌呤、1-甲基肌苷、2,2-二甲基鸟嘌呤、2-甲基腺嘌呤、2-甲基鸟嘌呤、3-甲基胞嘧啶、5-甲基胞嘧啶、n
6-甲基腺嘌呤、7-甲基鸟嘌呤、5-甲基氨基甲基尿嘧啶、5-甲氧基氨基甲基-2-硫尿嘧啶、5-甲氧基尿嘧啶、2-甲硫基-n
6-异戊烯基
腺嘌呤、假尿嘧啶、5-甲基-2-硫尿嘧啶、2-硫尿嘧啶、4-硫尿嘧啶、5-甲基尿嘧啶、2-硫胞嘧啶和2,6-二氨基嘌呤。在一些实施方案中,碱基部分可以是嘌呤或嘧啶以外的杂环碱基。杂环碱基可以是任选地经修饰的和/或经取代的。
125.糖部分包括天然、未修饰的糖,例如单糖(例如,戊糖,例如核糖、脱氧核糖),经修饰的糖和糖类似物。通常来说,核苷酸单体的可能的修饰,特别是糖部分的可能的修饰包括例如将一个或更多个羟基替换成卤素、杂原子、脂族基团,或者将羟基官能化为醚、胺、硫醇等。
126.经修饰的核苷酸单体的一个特别有用的基团是2
’‑
o-甲基核苷酸。这样的2
’‑
o-甲基核苷酸可被称为“甲基化的”,并且相应的核苷酸可由未甲基化的核苷酸随后进行烷基化来制备,或者直接由甲基化的核苷酸试剂来制备。经修饰核苷酸单体可与未经修饰的核苷酸单体组合使用。例如,本发明的寡核苷酸可包含甲基化和未甲基化的核苷酸单体二者。
127.一些示例性经修饰的核苷酸单体包括糖或骨架被修饰的核糖核苷酸。经修饰的核糖核苷酸可含有非天然存在的碱基(而不是天然存在的碱基),例如在5
’‑
位经修饰的尿苷或胞苷,例如5
’‑
(2-氨基)丙基尿苷和5
’‑
溴尿苷;在8位经修饰的腺苷和鸟苷,例如8-溴鸟苷;脱氮核苷酸,例如7-脱氮-腺苷;以及n-烷基化的核苷酸,例如n6-甲基腺苷。另外,糖被修饰的核糖核苷酸可将2
’‑
oh基团替换成h、烷氧基(或or)、r或烷基、卤素、sh、sr、氨基(例如nh2、nhr、nr2)或cn基团,其中r是低级烷基、烯基或炔基。
128.经修饰的核糖核苷酸还可将与相邻核糖核苷酸连接的磷酸二酯基团替换成经修饰的基团,例如硫代磷酸酯基团。更普遍地,多种核苷酸修饰可组合。
129.尽管反义(引导)链可与靶基因(或多个靶基因)的至少一部分基本上相同,但是至少对于碱基配对特性来说,序列不必完全相同才可用于例如抑制靶基因表型的表达。通常来说,更高同源性可用于弥补较短反义基因的使用。在一些情况下,反义链通常将与靶基因基本上相同(尽管是以反义取向)。
130.在期望使细胞应激响应最小化的情况下,使用2
’‑
o-甲基修饰的rna也可以是有益的。具有2
’‑
o-甲基核苷酸单体的rna可能不被认为是识别未经修饰的rna的细胞机器识别。2
’‑
o-甲基化的或部分2
’‑
o-甲基化的rna的使用可避免对于双链核酸的干扰素响应,同时保持靶rna抑制。这可用于例如在诱导干扰素响应的短rnai(例如,sirna)序列和可诱导干扰素响应的更长rnai序列两种情况下避免干扰素或其他细胞应激响应。
131.总体上,经修饰的糖可包括d-核糖、2
’‑
o-烷基(包括2
’‑
o-甲基和2
’‑
o-乙基),即2
’‑
烷氧基、2
’‑
氨基、2
’‑
s-烷基、2
’‑
卤素(包括2
’‑
氟)、2
’‑
甲氧基乙氧基、2
’‑
烯丙氧基(-och2ch=ch2)、2
’‑
炔丙基、2
’‑
丙基、乙炔基、乙烯基、丙烯基和氰基等。在一个实施方案中,如所描述的,糖部分可以是己糖并且并入到寡核苷酸中(augustyns,k.,et al.,nucl.acids.res.18:4711(1992))。一些示例性核苷酸单体可见于例如美国专利no.5,849,902,其通过引用并入本文中。
132.下文更详细地描述了特定官能团和化学术语的定义。出于本发明的目的,化学元素是根据以下鉴定的:元素周期表,cas版,handbook of chemistry and physics,75
th ed,内封面,并且特定官能团如本文中所述一般定义。另外,有机化学的一般原则以及特定官能部分和反应性描述在organic chemistry,thomas sorrell,university science books,sausalito:1999中,其全部内容通过引用并入本文中。
133.本发明的某些化合物可以以特定几何或立体异构形式存在。本发明预期所有这样的化合物(包括顺式和反式异构体,r-和s-对映体、非对映体、(d)-异构体、(l)-异构体,其外消旋混合物及其其他混合物)落入本发明范围内。取代基例如烷基中可存在另外的不对称碳原子。所有这样的异构体及其混合物预期包含在本发明中。
134.可根据本发明使用包含多种异构体比例的任一种的异构混合物。例如,在仅两种异构体组合的情况下,包含50∶50、60∶40、70∶30、80∶20、90∶10、95∶5、96∶4、97∶3、98∶2、99∶1或100∶0异构体比例的混合物均被本发明所预期。本领域技术人员将容易理解,预期到类似比例用于更复杂的异构体混合物。
135.例如,如果期望的是本发明化合物的特定对映体,可通过不对称合成或者通过用手性助剂进行的衍生(derivation)来制备,其中将所得的非对映体混合物分离并且切割辅助基团以提供纯的期望的对映体。或者,在分子包含碱性官能团例如氨基,或者酸性官能团例如羧基的情况下,用合适的光学活性酸或碱形成非对映体盐,随后通过本领域中公知的分级结晶或色谱手段来拆分如此形成的非对映体,并随后回收纯对映体。
136.在某些实施方案中,本发明寡核苷酸包含3’和5’端(环形寡核苷酸除外)。在一个实施方案中,寡核苷酸的3’和5’端可基本上被保护免受核酸酶影响,例如通过修饰3’或5’键联(例如,美国专利no.5,849,902和wo 98/13526)。例如,可通过纳入“阻断基团”使寡核苷酸有抗性。本文中使用的术语“阻断基团”是指可连接至寡核苷酸或核苷酸单体作为保护基或用于合成的偶联基团的取代基(例如,除了oh基团)(例如,fitc、丙基(ch
2-ch
2-ch3)、乙二醇基(-o-ch
2-ch
2-o-)、磷酸根(po
32-)、磷酸氢根(hydrogen phosphonate)或亚磷酰胺)。“阻断基团”还包括保护寡核苷酸的5’和3’端的“末端阻断基团”或“外切酶阻断基团”,包括经修饰的核苷酸和非核苷酸外切酶抗性结构。
137.一些示例性末端阻断基团(end-blocking group)包括帽结构(例如,7-甲基鸟苷帽)、反向核苷酸单体,例如具有3
’‑3’
或5
’‑5’
端反向(参见,例如ortiagao et al.1992.antisense res.dev.2:129)、甲基膦酸酯、亚磷酰胺、非核苷酸基团(例如,非核苷酸接头、氨基接头、缀合物)等。3’端核苷酸单体可包含经修饰的糖部分。3’端核苷酸单体包含3
’‑
o,其可任选地被阻止寡核苷酸的3
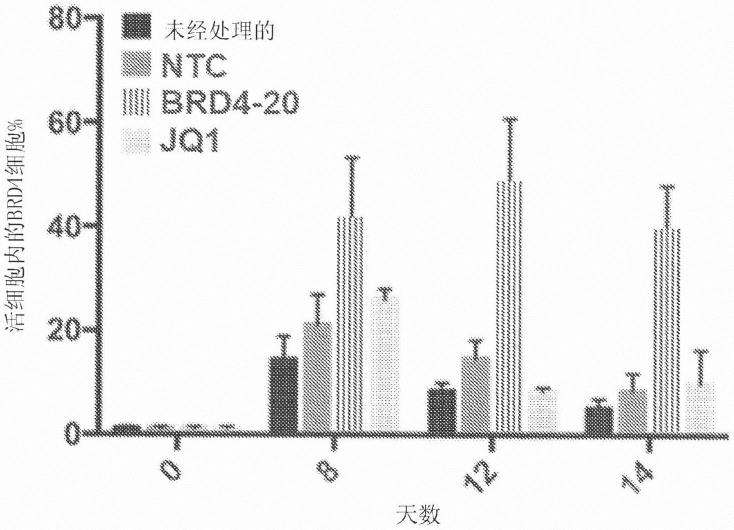
’‑
外切酶降解的阻断基团取代。例如,3
’‑
羟基可通过3
’→3’
核苷酸间键联与核苷酸酯化。例如,烷氧基基团可以是甲氧基、乙氧基或异丙氧基,并且优选乙氧基。任选地,3’端的3
’→3’
连接的核苷酸可通过替代键联(substitute linkage)来连接。为了降低核酸酶降解,最5’的3
’→5’
键联可以是经修饰的键联,例如硫代磷酸酯或p-烷氧基磷酸三酯键联。优选地,两个最5’的3
’→5’
键联是经修饰的键联。任选地,5’端羟基部分可用含磷的部分酯化,例如磷酸酯、硫代磷酸酯或p-乙氧基磷酸酯。
138.本领域普通技术人员将理解,本文中所述的合成方法使用多种保护基。如本文中所使用的,术语“保护基”意指特定官能部分(例如,o、s或n)被临时阻断,使得反应可选择性发生在多官能化合物的另一反应位点。在某些实施方案中,保护基以良好产率选择性反应,以得到对于预计的反应稳定的经保护物质;保护基应可通过不攻击其他官能团的容易获得的、优选无毒的试剂以良好产收率选择性地移除;保护基形成容易分离的衍生物(更优选地不生成新立体中心);并且保护基具有最小的额外官能性以避免另外的反应位点。如本文中详细描述的,可使用氧、硫、氮和碳保护基。羟基保护基包括甲基、甲氧基甲基(methoxylmethyl,mom)、甲硫基甲基(methylthiomethyl,mtm)、叔丁硫基甲基、(苯基二甲
基甲硅烷基)甲氧基甲基(smom)、苄氧基甲基(benzyloxymethyl,bom)、对甲氧基苄氧基甲基(p-methoxybenzyloxymethyl,pmbm)、(4-甲氧基苯氧基)甲基(p-aom)、愈创木酚甲基(guaiacolmethyl,gum)、叔丁氧基甲基、4-戊烯氧基甲基(pom)、甲硅烷氧基甲基、2-甲氧基乙氧基甲基(mem)、2,2,2-三氯乙氧基甲基、双(2-氯乙氧基)甲基、2-(三甲基甲硅烷基)乙氧基甲基(semor)、四氢吡喃基(thp)、3-溴四氢吡喃基、四氢硫代吡喃基、1-甲氧基环己基、4-甲氧基四氢吡喃基(mthp)、4-甲氧基四氢硫代吡喃基、4-甲氧基四氢硫代吡喃基s,s-二氧化物、1-[(2-氯-4-甲基)苯基]-4-甲氧基哌啶-4-基(ctmp)、1,4-二烷-2-基、四氢呋喃基、四氢硫代呋喃基、2,3,3a,4,5,6,7,7a-八氢-7,8,8-三甲基-4,7-亚甲基苯并呋喃-2-基、1-乙氧基乙基、1-(2-氯乙氧基)乙基、1-甲基-1-甲氧基乙基、1-甲基-1-苄氧基乙基、1-甲基-1-苄氧基-2-氟乙基、2,2,2-三氯乙基、2-三甲基甲硅烷基乙基、2-(苯基氢硒基)乙基(2-(phenylselenyl)ethyl)、叔丁基、烯丙基、对氯苯基、对甲氧基苯基、2,4-二硝基苯基、苄基、对甲氧基苄基、3,4-二甲氧基苄基、邻硝基苄基、对硝基苄基、对卤代苄基、2,6-二氯苄基、对氰基苄基、对苯基苄基、2-吡啶甲基、4-吡啶甲基、3-甲基-2-吡啶甲基n-氧、二苯基甲基、p,p
’‑
二硝基二苯甲基(p,p
’‑
dinitrobenzhydryl)、5-二苯并环庚基、三苯基甲基、α-萘基二苯基甲基、对甲氧基苯基二苯基甲基、二(对甲氧基苯基)苯基甲基、三(对甲氧基苯基)甲基、4-(4
’‑
溴苯甲酰甲基氧基苯基)二苯基甲基、4,4’,4
”‑
三(4,5-二氯邻苯二甲酰亚氨基苯基)甲基、4,4’,4
”‑
三(乙酰丙酰基氧基苯基)甲基(4,4’,4
”‑
tris(levulinoyloxyphenyl)methyl)、4,4’,4
”‑
三(苯甲酰基氧基苯基)甲基、3-(咪唑-1-基)双(4’,4
”‑
二甲氧基苯基)甲基、1,1-双(4-甲氧基苯基)-1
’‑
芘基甲基、9-蒽基、9-(9-苯基)呫吨基、9-(9-苯基-10-氧代)蒽基、1,3-苯并二噻吩-2-基、s,s-二氧苯并异噻唑基、三甲基甲硅烷基(trimethylsilyl,tms)、三乙基甲硅烷基(triethylsilyl,tes)、三异丙基甲硅烷基(triisopropylsilyl,tips)、二甲基异丙基甲硅烷基(ipdms)、二乙基异丙基甲硅烷基(deips)、二甲基己基甲硅烷基(dimethylthexylsilyl)、叔丁基二甲基甲硅烷基(t-butyldimethylsilyl,tbdms)、叔丁基二苯基甲硅烷基(t-butyldiphenylsilyl,tbdps)、三苄基甲硅烷基、三-对二甲苯基甲硅烷基、三苯基甲硅烷基、二苯基甲基甲硅烷基(diphenylmethylsilyl,dpms)、叔丁基甲氧基苯基甲硅烷基(t-butylmethoxyphenylsilyl,tbmps)、甲酸酯、苯甲酰基甲酸酯、乙酸酯、氯乙酸酯、二氯乙酸酯、三氯乙酸酯、三氟乙酸酯、甲氧基乙酸酯、三苯基甲氧基乙酸酯、苯氧基乙酸酯、对氯苯氧基乙酸酯、3-苯基丙酸酯、4-氧戊酸酯(乙酰丙酸酯)、4,4-(乙二硫基)戊酸酯(乙酰丙酰基二硫缩醛)、新戊酸酯、adamantoate、巴豆酸酯、4-甲氧基巴豆酸酯、苯甲酸酯、对苯基苯甲酸酯、2,4,6-三甲基苯甲酸酯(mesitoate)、烷基甲基碳酸酯、9-芴基甲基碳酸酯(fmoc)、烷基乙基碳酸酯、烷基2,2,2-三氯乙基碳酸酯(troc)、2-(三甲基甲硅烷基)乙基碳酸酯(2-(trimethylsilyl)ethyl carbonate,tmsec)、2-(苯基磺酸基)乙基碳酸酯(2-(phenylsulfonyl)ethyl carbonate,psec)、2-(三苯基磷基)乙基碳酸酯(peoc)、烷基异丁基碳酸酯、烷基乙烯基碳酸酯、烷基烯丙基碳酸酯、烷基对硝基苯基碳酸酯、烷基苄基碳酸酯、烷基对甲氧基苄基碳酸酯、烷基3,4-二甲氧基苄基碳酸酯、烷基邻硝基苄基碳酸酯、烷基对硝基苄基碳酸酯、烷基s-苄基硫代碳酸酯、4-乙氧基-1-萘基碳酸酯、甲基二硫代碳酸酯、2-碘代苯甲酸酯、4-叠氮基丁酸酯、4-硝基-4-甲基戊酸酯、邻-(二溴甲基)苯甲酸酯、2-甲酰基苯磺酸酯、2-(甲基硫甲氧基)乙基、4-(甲硫基甲氧基)丁酸酯、2-(甲硫基甲氧基
甲基)苯甲酸酯、2,6-二氯-4-甲基苯氧基乙酸酯、2,6-二氯-4-(1,1,3,3-四甲基丁基)苯氧基乙酸酯、2,4-双(1,1-二甲基丙基)苯氧基乙酸酯、氯二苯基乙酸酯、异丁酸酯、单琥珀酸酯、(e)-2-甲基-2-丁烯酸酯、邻-(甲氧基羰基)苯甲酸酯、α-萘甲酸酯、硝酸酯、烷基n,n,n’,n
’‑
四甲基二氨基磷酸酯、烷基n-苯基氨基甲酸酯、硼酸酯、二甲基硫膦基、烷基2,4-二硝基苯基次磺酸酯、硫酸酯、甲磺酸酯(mesylate)、苄基磺酸酯和甲苯磺酸酯(tosylate,ts)。为了保护1,2-或1,3-二醇,保护基包括亚甲基缩醛、亚乙基缩醛、1-叔丁基亚乙基缩酮、1-苯基亚乙基缩酮、(4-甲氧基苯基)亚乙基缩醛、2,2,2-三氯亚乙基缩醛、丙酮化合物、亚环戊基缩酮、亚环己基缩酮、亚环庚基缩酮、亚苄基缩醛、对甲氧基亚苄基缩醛、2,4-二甲氧基亚苄基缩酮、3,4-二甲氧基亚苄基缩醛、2-硝基亚苄基缩醛、甲氧基亚甲基缩醛、乙氧基亚甲基缩醛、二甲氧基亚甲基原酸酯、1-甲氧基亚乙基原酸酯、1-乙氧基亚乙基原酸酯、1,2-二甲氧基亚乙基原酸酯、α-甲氧基亚苄基原酸酯、1-(n,n-二甲基氨基)亚乙基衍生物、α-(n,n
’‑
二甲基氨基)亚苄基衍生物、2-氧杂亚环戊基原酸酯、二叔丁基亚甲硅烷基(di-t-butylsilylene group,dtbs)、1,3-(1,1,3,3-四异丙基二硅亚烷基)衍生物(tipds)、四叔丁氧基二硅氧烷-1,3-亚二基衍生物(tbds)、环状碳酸酯、环状硼酸酯、硼酸乙酯和硼酸苯酯。氨基保护基包括氨基甲酸甲酯、氨基甲酸乙酯、9-芴基甲基氨基甲酸酯(9-fluorenylmethyl carbamate,fmoc)、9-(2-磺基)芴基甲基氨基甲酸酯、9-(2,7-二溴)芴基甲基氨基甲酸酯、2,7-二叔丁基-[9-(10,10-二氧代-10,10,10,10-四氢噻吨基)]甲基氨基甲酸酯(dbd-tmoc)、4-甲氧基苯甲酰甲基氨基甲酸酯(phenoc)、2,2,2-三氯乙基氨基甲酸酯(troc)、2-三甲基甲硅烷基乙基氨基甲酸酯(teoc)、2-苯基乙基氨基甲酸酯(hz)、1-(1-金刚烷基)-1-甲基乙基氨基甲酸酯(adpoc)、1,1-二甲基-2-卤代乙基氨基甲酸酯、1,1-二甲基-2,2-二溴乙基氨基甲酸酯(db-t-boc)、1,1-二甲基-2,2,2-三氯乙基氨基甲酸酯(tcboc)、1-甲基-1-(4-联苯基)乙基氨基甲酸酯(bpoc)、1-(3,5-二叔丁基苯基)-1-甲基乙基氨基甲酸酯(t-bumeoc)、2-(2
’‑
和4
’‑
吡啶基)乙基氨基甲酸酯(pyoc)、2-(n,n-二环己基甲酰胺)乙基氨基甲酸酯、叔丁基氨基甲酸(boc)、1-金刚烷基氨基甲酸酯(adoc)、乙烯基氨基甲酰酯(voc)、烯丙基氨基甲酸酯(alloc)、1-异丙基烯丙基氨基甲酸酯(ipaoc)、肉桂基氨基甲酸酯(coc)、4-硝基肉桂基氨基甲酸酯(noc)、8-喹啉基氨基甲酸酯、n-羟基哌啶基氨基甲酸酯、烷基二硫基氨基甲酸酯、苄基氨基甲酸酯(cbz)、对甲氧基苄基氨基甲酸酯(moz)、对硝基苄基氨基甲酸酯、对溴苄基氨基甲酸酯、对氯苄基氨基甲酸酯、2,4-二氯苄基氨基甲酸酯、4-甲基亚磺酰基苄基氨基甲酸酯(msz)、9-蒽基甲基氨基甲酸酯、二苯基甲基氨基甲酸酯、2-甲硫基乙基氨基甲酸酯、2-甲基磺酰基乙基氨基甲酸酯、2-(对甲苯磺酰基)乙基氨基甲酸酯、[2-(1,3-二thianyl)]甲基氨基甲酸酯(dmoc)、4-甲硫基苯基氨基甲酸酯(mtpc)、2,4-二甲硫基苯基氨基甲酸酯(bmpc)、2-磷基乙基氨基甲酸酯(peoc)、2-三苯基磷基异丙基氨基甲酸酯(ppoc)、1,1-二甲基-2-氰基乙基氨基甲酸酯、间氯-对-酰氧基苄基氨基甲酸酯、对-(二羟基硼烷基)苄基氨基甲酸酯、5-苯并异唑基甲基氨基甲酸酯、2-(三氟甲基)-6-色酮基甲基氨基甲酸酯(tcroc)、间硝基苯基氨基甲酸酯、3,5-二甲氧基苄基氨基甲酸酯、邻硝基苄基氨基甲酸酯、3,4-二甲氧基-6-硝基苄基氨基甲酸酯、苯基(邻硝基苯基)甲基氨基甲酸酯、吩噻嗪基-(10)-羰基衍生物、n
’‑
对甲苯磺酰基氨基羰基衍生物、n
’‑
苯基氨基硫代羰基衍生物、叔戊基氨基甲酸酯、s-苄基硫代氨基甲酸酯、对氰基苄基氨
基甲酸酯、环丁基氨基甲酸酯、环己基氨基甲酸酯、环戊基氨基甲酸酯、环丙基甲基氨基甲酸酯、对癸氧基苄基氨基甲酸酯、2,2-二甲氧基羰基乙烯基氨基甲酸酯、邻-(n,n-二甲基甲酰胺基)苄基氨基甲酸酯、1,1-二甲基-3-(n,n-二甲基甲酰胺基)丙基氨基甲酸酯、1,1-二甲基丙炔基氨基甲酸酯、二(2-吡啶基)甲基氨基甲酸酯、2-呋喃基甲基氨基甲酸酯、2-碘乙基氨基甲酸酯、异茨烷基氨基甲酸酯(isoborynl carbamate)、异丁基氨基甲酸酯、异烟酰基氨基甲酸酯、对-(p
’‑
甲氧基苯基偶氮)苄基氨基甲酸酯、1-甲基环丁基氨基甲酸酯、1-甲基环己基氨基甲酸酯、1-甲基-1-环丙基甲基氨基甲酸酯、1-甲基-1-(3,5-二甲氧基苯基)乙基氨基甲酸酯、1-甲基-1-(对苯基偶氮苯基)乙基氨基甲酸酯、1-甲基-1-苯基乙基氨基甲酸酯、1-甲基-1-(4-吡啶基)乙基氨基甲酸酯、苯基氨基甲酸酯、对-(苯基偶氮)苄基氨基甲酸酯、2,4,6-三叔丁基苯基氨基甲酸酯、4-(三甲基铵)苄基氨基甲酸酯、2,4,6-三甲基苄基氨基甲酸酯、甲酰胺、乙酰胺、氯乙酰胺、三氯乙酰胺、三氟乙酰胺、苯基乙酰胺、3-苯基丙酰胺、吡啶酰胺、3-吡啶基甲酰胺、n-苯甲酰基苯基丙酰胺衍生物、苯甲酰胺、对苯基苯甲酰胺、邻硝基苯基乙酰胺、邻硝基苯氧基乙酰胺、乙酰乙酰胺、(n
’‑
二硫代苄氧基羰基氨基)乙酰胺、3-(对羟基苯基)丙酰胺、3-(邻硝基苯基)丙酰胺、2-甲基-2-(邻硝基苯氧基)丙酰胺、2-甲基-2-(邻苯基偶氮苯氧基)丙酰胺、4-氯丁酰胺、3-甲基-3-硝基丁酰胺、邻硝基肉桂酰胺、n-乙酰基甲硫氨酸衍生物、邻硝基苯甲酰胺、邻-(苯甲酰氧基甲基)苯甲酰胺、4,5-二苯基-3-唑啉-2-酮、n-邻苯二甲酰亚胺、n-二硫杂琥珀酰亚胺(dts)、n-2,3-二苯基马来酰亚胺、n-2,5-二甲基吡咯、n-1,1,4,4-四甲基二甲硅烷基氮杂环戊烷加合物(stabase)、5-取代的1,3-二甲基-1,3,5-三氮杂环己-2-酮、5-取代的1,3-二苄基-1,3,5-三氮杂环己-2-酮、1-取代的3,5-二硝基-4-吡啶酮、n-甲胺、n-丙烯胺、n-[2-(三甲基甲硅烷基)乙氧基]甲胺(sem)、n-3-乙酰氧基丙胺、n-(1-异丙基-4-硝基-2-氧代-3-吡咯啉-3-基)胺、季铵盐、n-苄胺、n-二(4-甲氧基苯基)甲胺、n-5-二苯并环庚胺、n-三苯基甲胺(tr)、n-[(4-甲氧基苯基)二苯基甲基]胺(mmtr)、n-9-苯基芴基胺(phf)、n-2,7-二氯-9-芴基亚甲基胺、n-二茂铁基甲胺(fcm)、n-2-吡啶甲基氨基n
’‑
氧化物、n-1,1-二甲硫基亚甲基胺、n-亚苄基胺、n-对甲氧基亚苄基胺、n-二苯基亚甲基胺、n-[(2-吡啶基)基]亚甲基胺、n-(n’,n
’‑
二甲基氨基亚甲基)胺、n,n
’‑
异亚丙基二胺、n-对硝基亚苄基胺、n-亚水杨基胺、n-5-氯亚水杨基胺、n-(5-氯-2-羟基苯基)苯基亚甲基胺、n-亚环己基胺、n-(5,5-二甲基-3-氧代-1-环己烯基)胺、n-硼烷衍生物、n-二苯基硼酸衍生物、n-[苯基(五羰基铬或钨)羰基]胺、n-铜螯合物、n-锌螯合物、n-硝胺、n-亚硝胺(n-nitrosoamine)、胺n-氧化物、二苯基次膦酰胺(diphenylphosphinamide,dpp)、二甲基硫代次膦酰胺(mpt)、二苯基硫代次膦酰胺(ppt)、二烷基氨基磷酸酯(dialkyl phosphoramidate)、二苄基氨基磷酸酯、二苯基氨基磷酸酯、苯亚磺酰胺(benzenesulfenamide)、邻硝基苯亚磺酰胺(nps)、2,4-二硝基苯亚磺酰胺、五氯苯亚磺酰胺、2-硝基-4-甲氧基苯亚磺酰胺、三苯基甲基亚磺酰胺、3-硝基吡啶亚磺酰胺(npys)、对甲苯磺酰胺(ts)、苯磺酰胺、2,3,6,-三甲基-4-甲氧基苯磺酰胺(mtr)、2,4,6-三甲氧基苯磺酰胺(mtb)、2,6-二甲基-4-甲氧基苯磺酰胺(pme)、2,3,5,6-四甲基-4-甲氧基苯磺酰胺(mte)、4-甲氧基苯磺酰胺(mbs)、2,4,6-三甲基苯磺酰胺(mts)、2,6-二甲氧基-4-甲基苯磺酰胺(imds)、2,2,5,7,8-五甲基色满-6-磺酰胺(pmc)、甲磺酰胺(ms)、β-三甲基甲硅烷基乙磺酰胺(ses)、9-蒽磺酰胺、4-(4’,8
’‑
二甲氧基萘基甲基)苯磺酰胺(dnmbs)、苄基磺酰胺、三氟甲磺酰胺和苯甲酰甲基磺酰胺。本文中详细描述了示例性的保护基。然而,应
理解的是,本发明并未旨在限于这些保护基;相反,使用上述标准可容易鉴定多种另外的等效保护基并且用于本发明的方法。另外,多种保护基描述在protective groups in organic synthesis,third ed.greene,tw.and wuts,p.g.,eds.,john wiley&sons,new york:1999中,其全部内容通过引用在此并入。
[0139]
应理解的是,本文中所述化合物可被任何数目的取代基或官能部分取代。通常来说,无论前面是否有术语“任选地”的术语“取代”以及在本发明的式中所含的取代基,是指将给定结构中的氢基团替换成指定取代基的基团。当任意给定结构中多于一个的位置可被选自特定组的多于一个取代基取代时,每个位置的取代基可以是相同的或不同的。本文中使用的术语“取代”预期包括有机化合物的所有可能的取代基。广义来讲,允许的取代基包括有化合物的无环和环形的、支链和无支链的碳环和杂环、芳族和非芳族取代基。杂原子例如氮可具有氢取代基和/或任何可能的本文中所述的满足杂原子化合价的有机化合物取代基。此外,本发明并未旨在以任何方式限制有机化合物的可能的取代基。本发明预期的取代基和变量的组合优选地是导致形成可用于治疗例如感染性疾病或增生性疾病的稳定化合物的那些。本文中使用的术语“稳定的”优选地是指这样的化合物:具有足以允许制备的稳定性,并且保持化合物的完整性持续充分的一段时间以便检测,以及优选地持续充分的一段时间以用于本文中详细描述的目的。
[0140]
本文中使用的术语“脂族(aliphatic)”包括饱和和不饱和的直链(即,无支链)、支链、无环、环形或多环脂族烃,其任选地被一个或更多个官能团取代。本领域普通技术人员将理解,“脂族”在本文中旨在包括但不限于烷基、烯基、炔基、环烷基、环烯基和环炔基部分。因此,本文中使用的术语“烷基”包括直链、支链和环形烷基。类似的约定适用于其他通用术语,例如“烯基”、“炔基”等。另外,本文中使用的术语“烷基”、“烯基”、“炔基”等涵盖经取代的和未经取代的基团二者。在某些实施方案中,本文中使用的“低级烷基”用于指示具有1至6个碳原子的那些烷基(环形、无环、经取代的、未经取代的、支链或无支链的)。
[0141]
在某些实施方案中,本发明中使用的烷基、烯基和炔基含有1至20个脂族碳原子。在某些另外的实施方案中,本发明中使用的烷基、烯基和炔基含有1至10个脂族碳原子。在另一些实施方案中,本发明中使用的烷基、烯基和炔基含有1至8个脂族碳原子。在又一些实施方案中,本发明中使用的烷基、烯基和炔基含有1至6个脂族碳原子。在另一些实施方案中,本发明中使用的烷基、烯基和炔基含有1至4个碳原子。因此,示例性脂族基团包括但不限于例如甲基、乙基、正丙基、异丙基、环丙基、-ch
2-环丙基、乙烯基、烯丙基、正丁基、仲丁基、异丁基、叔丁基、环丁基、-ch
2-环丁基、正戊基、仲戊基、异戊基、叔戊基、环戊基、-ch
2-环戊基、正己基、仲己基、环己基、-ch
2-环己基部分等,再一次,其可具有一个或更多个取代基。烯基包括但不限于例如乙烯基、丙烯基、丁烯基、1-甲基-2-丁烯-1-基等。一些代表性炔基包括但不限于乙炔基、2-丙炔基(炔丙基)、1-丙炔基等。
[0142]
本发明化合物的上述脂族(及其他)部分的取代基的一些实例包括但不限于:脂族、杂脂族、芳基、杂芳基、芳基烷基、杂芳基烷基、烷氧基、芳氧基、杂烷氧基、杂芳氧基、烷硫基、芳硫基、杂烷硫基、杂芳硫基、-f、-cl、-br、-i、-oh、-no2、-cn、-cf3、-ch2cf3、-chcl2、-ch2oh、-ch2ch2oh、-ch2nh2、-ch2so2ch3、-c(o)r
x
、-co2(r
x
)、-con(r
x
)2、-oc(o)r
x
、-oco2r
x
、-ocon(r
x
)2、-n(r
x
)2、-s(o)2r
x
、-nr
x
(co)r
x
,其中每次出现的r
x
独立地包括但不限于脂族、杂脂族、芳基、杂芳基、芳基烷基或杂芳基烷基,其中上文以及本文中所述的脂族、杂脂族、芳
基烷基或杂芳基烷基取代基中的任一种可以是经取代或未经取代的、支链或无支链的、环形或无环的,并且其中上文以及本文中所述的芳基或杂芳基取代基中的任一种可以是经取代的或未经取代的。一般适用的取代基的一些附加实例通过本文中描述的具体实施方案来举例说明。
[0143]
本文中使用的术语“杂脂族(heteroaliphatic)”是指含有一个或更多个例如替代碳原子的氧、硫、氮、磷或硅原子的脂族部分。杂脂族部分可以是支链、无支链、环形或无环的,并且包括饱和和不饱和的杂环,例如吗啉基、吡咯烷基等。在某些实施方案中,杂脂族部分通过将其上的一个或更多个氢原子独立地替换成一个或更多个包括但不限于以下的部分而被取代:脂族、杂脂族、芳基、杂芳基、芳基烷基、杂芳基烷基、烷氧基、芳氧基、杂烷氧基、杂芳氧基、烷硫基、芳硫基、杂烷硫基、杂芳硫基、-f、-cl、-br、-i、-oh、-no2、-cn、-cf3、-ch2cf3、-chcl2、-ch2oh、-ch2ch2oh、-ch2nh2、-ch2so2ch3、-c(o)r
x
、-co2(r
x
)、-con(r
x
)2、-oc(o)r
x
、-oco2r
x
、-ocon(r
x
)2、-n(r
x
)2、-s(o)2r
x
、-nr
x
(co)r
x
,其中每次出现的r
x
独立地包括但不限于脂族、杂脂族、芳基、杂芳基、芳基烷基或杂芳基烷基,其中上文以及本文中所述的脂族、杂脂族、芳基烷基或杂芳基烷基取代基中的任一种可以是经取代或未经取代的、支链或无支链的、环形或无环的,并且其中上文以及本文中所述的芳基或杂芳基取代基中的任一种可以是经取代的或未经取代的。一般适用的取代基的一些附加实例通过本文中描述的具体实施方案来举例说明。
[0144]
本文中使用的术语“卤代”和“卤素”是指选自氟、氯、溴和碘的原子。
[0145]
术语“烷基”包括饱和的脂族基团,包括直链烷基(例如,甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基等)、支链烷基(异丙基、叔丁基、异丁基等)、环烷基(脂环族)基团(环丙基、环戊基、环己基、环庚基、环辛基)、烷基取代的环烷基以及环烷基取代的烷基。在某些实施方案中,直链或支链烷基在其骨架中具有6或更少个碳原子(例如,直链为c
1-c6,支链为c
3-c6),并且更优选地4个或更少个。同样地,优选的环烷基在其环结构中具有3至8个碳原子,并且更优选的在环结构中具有5或6个碳原子。术语c
1-c6包括含有1至6个碳原子的烷基。
[0146]
另外,除非另有说明,否则术语烷基包括“未经取代的烷基”和“经取代的烷基”二者,后者是指具有独立选择的取代基的烷基部分,所述取代基替代烃骨架的一个或更多个碳原子上的氢。这样的取代基可包括例如烯基、炔基、卤素、羟基、烷基羰基氧基、芳基羰基氧基、烷氧基羰基氧基、芳氧基羰基氧基、羧酸酯、烷基羰基、芳基羰基、烷氧基羰基、氨基羰基、烷基氨基羰基、二烷基氨基羰基、烷硫基羰基、烷氧基、磷酸酯、膦酸根基(phosphonato)、次膦酸根基(phosphinato)、氰基、氨基(包括烷基氨基、二烷基氨基、芳基氨基、二芳基氨基和烷基芳基氨基)、酰胺基(包括烷基羰基氨基、芳基羰基氨基、氨基甲酰基和脲基)、脒基、亚氨基、巯基、烷硫基、芳硫基、硫代羧酸酯、硫酸酯、烷基亚磺酰基、磺酸根基(sulfonato)、氨磺酰基、磺酰氨基、硝基、三氟甲基、氰基、叠氮基、杂环基、烷基芳基、或者芳族或杂芳族部分。环烷基可进一步被例如上述取代基取代。“烷基芳基”或“芳基烷基”部分是芳基取代的烷基(例如,苯甲基(苄基))。术语“烷基”还包含天然和非天然氨基酸的侧链。术语“正烷基”意指直链(即,无支链)未经取代的烷基。
[0147]
术语“烯基”包括在长度和可能的取代方面与上述烷基类似但是包含至少一个双键的不饱和脂族基团。例如,术语“烯基”包括直链烯基(例如,乙烯基、丙烯基、丁烯基、戊烯
基、己烯基、庚烯基、辛烯基、壬烯基、癸烯基等)、支链烯基、环烯基(脂环族)基团(环丙烯基、环戊烯基、环己烯基、环庚烯基、环辛烯基)、烷基或烯基取代的环烯基、以及环烷基或环烯基取代的炔基。在某些实施方案中,直链或支链烯基在其骨架中具有6个或更少的碳原子(例如,直链为c
2-c6,支链为c
3-c6)。同样地,环烯基在其环结构中可具有3至8个碳原子,并且更优选地在环结构中具有5或6个碳。术语c
2-c6包括含有2至6个碳原子的烯基。
[0148]
另外,除非另有说明,否则术语烯基包括“未经取代的烯基”和“经取代的烯基”二者,后者是指具有独立选择的取代基的烯基部分,所述取代基替代烃骨架的一个或更多个碳原子上的氢。这样的取代基可包括例如烷基、炔基、卤素、羟基、烷基羰基氧基、芳基羰基氧基、烷氧基羰基氧基、芳氧基羰基氧基、羧酸酯、烷基羰基、芳基羰基、烷氧基羰基、氨基羰基、烷基氨基羰基、二烷基氨基羰基、烷硫基羰基、烷氧基、磷酸酯、膦酸根基、次膦酸根基、氰基、氨基(包括烷基氨基、二烷基氨基、芳基氨基、二芳基氨基和烷基芳基氨基)、酰胺基(包括烷基羰基氨基、芳基羰基氨基、氨基甲酰基和脲基)、脒基、亚氨基、巯基、烷硫基、芳硫基、硫代羧酸酯、硫酸酯、烷基亚磺酰基、磺酸根基、氨磺酰基、磺酰氨基、硝基、三氟甲基、氰基、叠氮基、杂环基、烷基芳基、或者芳族或杂芳族部分。
[0149]
术语“炔基”包括在长度和可能的取代方面与上述烷基类似但是含有至少一个三键的不饱和脂族基团。例如,术语“炔基”包括直链炔基(例如,乙炔基、丙炔基、丁炔基、戊炔基、己炔基、庚炔基、辛炔基、壬炔基、癸炔基等)、支链炔基、以及环烷基或环烯基取代的炔基。在某些实施方案中,直链或支链炔基在其骨架中具有6个或更少的碳原子(例如,直链为c
2-c6,支链为c
3-c6)。术语c
2-c6包括含有2至6个碳原子的炔基。
[0150]
另外,除非另有说明,否则术语炔基包括“未经取代的炔基”和“经取代的炔基”二者,后者是指具有独立选择的取代基的炔基部分,所述取代基替代烃骨架的一个或更多个碳原子上的氢。这样的取代基可包括例如烷基、炔基、卤素、羟基、烷基羰基氧基、芳基羰基氧基、烷氧基羰基氧基、芳氧基羰基氧基、羧酸酯、烷基羰基、芳基羰基、烷氧基羰基、氨基羰基、烷基氨基羰基、二烷基氨基羰基、烷硫基羰基、烷氧基、磷酸酯、膦酸根基、次膦酸根基、氰基、氨基(包括烷基氨基、二烷基氨基、芳基氨基、二芳基氨基和烷基芳基氨基)、酰胺基(包括烷基羰基氨基、芳基羰基氨基、氨基甲酰基和脲基)、脒基、亚氨基、巯基、烷硫基、芳硫基、硫代羧酸酯、硫酸酯、烷基亚磺酰基、磺酸根基、氨磺酰基、磺酰氨基、硝基、三氟甲基、氰基、叠氮基、杂环基、烷基芳基、或者芳族或杂芳族部分。
[0151]
除非另外说明碳的数目,否则本文中使用的“低级烷基”意指上文定义的、但是在其骨架结构中具有1至5个碳原子的烷基。“低级烯基”和“低级炔基”的链长为例如2至5个碳原子。
[0152]
术语“烷氧基”包括与氧原子共价连接的经取代和未经取代的烷基、烯基和炔基。烷氧基的一些实例包括甲氧基、乙氧基、异丙氧基、丙氧基、丁氧基和戊氧基。经取代的烷氧基的一些实例包括卤代烷氧基。烷氧基可被独立选择的基团取代,所述基团例如烯基、炔基、卤素、羟基、烷基羰基氧基、芳基羰基氧基、烷氧基羰基氧基、芳氧基羰基氧基、羧酸酯、烷基羰基、芳基羰基、烷氧基羰基、氨基羰基、烷基氨基羰基、二烷基氨基羰基、烷硫基羰基、烷氧基、磷酸酯、膦酸根基、次膦酸根基、氰基、氨基(包括烷基氨基、二烷基氨基、芳基氨基、二芳基氨基和烷基芳基氨基)、酰胺基(包括烷基羰基氨基、芳基羰基氨基、氨基甲酰基和脲基)、脒基、亚氨基、巯基、烷硫基、芳硫基、硫代羧酸酯、硫酸酯、烷基亚磺酰基、磺酸根基、氨
dna、dna-rna和rna-rna杂交体,以及通过碱基与氨基酸骨架缀合形成的“蛋白质核酸(protein nucleic acid,pna)”。
[0160]
术语“碱基”包括已知的嘌呤和嘧啶杂环碱基、脱氮嘌呤,及其类似物(包括杂环取代的类似物,例如氨基乙氧基吩嗪)、衍生物(例如,1-烷基-、1-烯基-、杂芳族-和1-炔基衍生物)及其互变异构体。嘌呤的一些实例包括腺嘌呤、鸟嘌呤、肌苷、二氨基嘌呤和黄嘌呤,及其类似物(例如,8-氧代-n
6-甲基腺嘌呤或7-二氮杂黄嘌呤)和衍生物。嘧啶包括例如胸腺嘧啶、尿嘧啶和胞嘧啶,及其类似物(例如,5-甲基胞嘧啶、5-甲基尿嘧啶、5-(1-丙炔基)尿嘧啶、5-(1-丙炔基)胞嘧啶和4,4-桥亚乙基胞嘧啶)。合适的碱基的另一些实例包括非嘌呤基和非嘧啶基碱基,例如2-氨基吡啶和三嗪类。
[0161]
在一个优选实施方案中,本发明的寡核苷酸的核苷酸单体是rna核苷酸。在另一个优选实施方案中,本发明的寡核苷酸的核苷酸单体是经修饰的rna核苷酸。因此,寡核苷酸包含经修饰的rna核苷酸。
[0162]
术语“核苷”包含与糖部分(优选核糖或脱氧核糖)共价连接的碱基。优选核苷的一些实例包括核糖核苷和脱氧核糖核苷。核苷还包括与氨基酸或氨基酸类似物连接的碱基,所述氨基酸或氨基酸类似物可包含游离羧基、游离氨基或保护基。合适的保护基是本领域中公知的(参见,p.g.m.wuts and t.w.greene,“protective groups in organic synthesis”,2
nd
ed.,wiley-interscience,new york,1999)。
[0163]
术语“核苷酸”包括进一步包含磷酸基团(phosphate group)或磷酸类似物的核苷。
[0164]
核酸分子可与疏水性部分缔合用于将分子靶向和/或递送至细胞。在某些实施方案中,疏水性部分通过接头与核酸分子缔合。在某些实施方案中,缔合通过非共价相互作用。在另一些实施方案中,缔合通过共价键。本领域中已知的任何接头可用于使核酸与疏水性部分缔合。本领域中已知的接头描述在公开的国际pct申请wo 92/03464、wo 95/23162、wo 2008/021157、wo 2009/021157、wo 2009/134487、wo 2009/126933、美国专利申请公开2005/0107325、美国专利5,414,077、美国专利5,419,966、美国专利5,512,667、美国专利5,646,126和美国专利5,652,359中,其通过引用并入本文。接头可像与多原子(multi-atom)接头共价键合那样简单。接头可以是环形的或无环的。接头可以是任选经取代的。在某些实施方案中,接头能够从核酸被切掉。在某些实施方案中,接头能够在生理条件下被水解。在某些实施方案中,接头能够通过酶(例如,酯酶或磷酸二酯酶)被切掉。在某些实施方案中,接头包含用于将核酸与疏水性部分分隔开的间隔元件。间隔元件可包含1至30个碳或杂原子。在某些实施方案中,接头和/或间隔元件包含可质子化的官能团。这样的可质子化的官能团可促进核酸分子的内体逃逸(endosomal escape)。可质子化的官能团还可有助于将核酸递送至细胞,例如中和分子的全部电荷。在另一些实施方案中,接头和/或间隔元件是生物学惰性的(即,不影响所得核酸分子的生物学活性或功能)。
[0165]
在某些实施方案中,具有接头和疏水性部分的核酸分子是本文中所述的式。在某些实施方案中,核酸分子是下式:
[0166][0167]
其中:
[0168]
x是n或ch;
[0169]
a是键;经取代或未经取代的、环形或无环的、支链或无支链的脂族;或者经取代或未经取代的、环形或无环的、支链或无支链的杂脂族;
[0170]
r1是疏水性部分;
[0171]
r2是氢;氧保护基;环形或无环的、经取代或未经取代的、支链或无支链的脂族;环形或无环的、经取代或未经取代的、支链或无支链的杂脂族;经取代或未经取代的、支链或无支链的酰基;经取代或未经取代的、支链或无支链的芳基;经取代或未经取代的、支链或无支链的杂芳基;并且
[0172]
r3是核酸。
[0173]
在某些实施方案中,分子是下式:
[0174][0175]
在某些实施方案中,分子是下式:
[0176]
[0177]
在某些实施方案中,分子是下式:
[0178][0179]
在某些实施方案中,分子是下式:
[0180][0181]
在某些实施方案中,x是n。在某些实施方案中,x是ch。
[0182]
在某些实施方案中,a是键。在某些实施方案中,a是经取代或未经取代的、环形或无环的、支链或无支链的脂族。在某些实施方案中,a是无环的、经取代或未经取代的、支链或无支链的脂族。在某些实施方案中,a是无环的、经取代的、支链或无支链的脂族。在某些实施方案中,a是无环的、经取代的、无支链的脂族。在某些实施方案中,a是无环的、经取代的、无支链的烷基。在某些实施方案中,a是无环的、经取代、无支链的c
1-20
烷基。在某些实施方案中,a是无环的、经取代的、无支链的c
1-12
烷基。在某些实施方案中,a是无环的、经取代的、无支链的c
1-10
烷基。在某些实施方案中,a是无环的、经取代的、无支链的c
1-8
烷基。在某些实施方案中,a是无环的、经取代的、无支链的c
1-6
烷基。在某些实施方案中,a是经取代或未经取代的、环形或无环的、支链或无支链的杂脂族。在某些实施方案中,a是无环的、经取代或未经取代的、支链或无支链的杂脂族。在某些实施方案中,a是无环的、经取代的、支链或无支链的杂脂族。在某些实施方案中,a是无环的、经取代的、无支链的杂脂族。
[0183]
在某些实施方案中,a是下式:
[0184][0185]
在某些实施方案中,a是下式之一:
[0186][0187]
在某些实施方案中,a是下式之一:
[0188][0189]
在某些实施方案中,a是下式之一:
[0190][0191]
在某些实施方案中,a是下式:
[0192][0193]
在某些实施方案中,a是下式:
[0194][0195]
在某些实施方案中,a是下式:
[0196][0197]
其中:
[0198]
每次出现的r独立地为天然或非天然氨基酸的侧链;并且
[0199]
n是1至20的整数(包括端值)。在某些实施方案中,a是下式:
[0200][0201]
在某些实施方案中,每次出现的r独立地为天然氨基酸的侧链。在某些实施方案中,n是1至15的整数(包括端值)。在某些实施方案中,n是1至10的整数(包括端值)。在某些实施方案中,n是1至5的整数(包括端值)。
[0202]
在某些实施方案中,a是下式:
[0203][0204]
其中n是1至20的整数(包括端值)。在某些实施方案中,a是下式:
[0205][0206]
在某些实施方案中,n是1至15的整数(包括端值)。在某些实施方案中,n是1至10的整数(包括端值)。在某些实施方案中,n是1至5的整数(包括端值)。
[0207]
在某些实施方案中,a是下式:
[0208][0209]
其中n是1至20的整数(包括端值)。在某些实施方案中,a是下式:
[0210][0211]
在某些实施方案中,n是1至15的整数(包括端值)。在某些实施方案中,n是1至10的整数(包括端值)。在某些实施方案中,n是1至5的整数(包括端值)。
[0212]
在某些实施方案中,分子是下式:
[0213][0214]
其中x、r1、r2和r3如本文中所定义;并且
[0215]
a’是经取代或未经取代的、环形或无环的、支链或无支链的脂族;或者经取代或未经取代的、环形或无环的、支链或无支链的杂脂族。
[0216]
在某些实施方案中,a’是下式之一:
[0217][0218]
在某些实施方案中,a是下式之一:
[0219][0220]
在某些实施方案中,a是下式之一:
[0221][0222]
在某些实施方案中,a是下式:
[0223][0224]
在某些实施方案中,a是下式:
[0225][0226]
在某些实施方案中,r1是类固醇。在某些实施方案中,r1是胆固醇。在某些实施方案中,r1是亲脂性维生素。在某些实施方案中,r1是维生素a。在某些实施方案中,r1是维生素e。
[0227]
在某些实施方案中,r1是下式:
[0228][0229]
其中ra是经取代或未经取代的、环形或无环的、支链或无支链的脂族;或者经取代
或未经取代的、环形或无环的、支链或无支链的杂脂族。在某些实施方案中,r1是下式:
[0230][0231]
在某些实施方案中,r1是下式:
[0232][0233]
在某些实施方案中,r1是下式:
[0234][0235]
在某些实施方案中,r1是下式:
[0236][0237]
在某些实施方案中,r1是下式:
[0238][0239]
在某些实施方案中,核酸分子是下式:
[0240][0241]
其中:
[0242]
x是n或ch;
[0243]
a是键;经取代或未经取代的、环形或无环的、支链或无支链的脂族;或者经取代或未经取代的、环形或无环的、支链或无支链的杂脂族;
[0244]
r1是疏水性部分;
[0245]
r2是氢;氧保护基;环形或无环的、经取代或未经取代的、支链或无支链的脂族;环形或无环的、经取代或未经取代的、支链或无支链的杂脂族;经取代或未经取代的、支链或无支链的酰基;经取代或未经取代的、支链或无支链的芳基;经取代或未经取代的、支链或无支链的杂芳基;并且
[0246]
r3是核酸。
[0247]
在某些实施方案中,核酸分子是下式:
[0248][0249]
其中:
[0250]
x是n或ch;
[0251]
a是键;经取代或未经取代的、环形或无环的、支链或无支链的脂族;或者经取代或未经取代的、环形或无环的、支链或无支链的杂脂族;
[0252]
r1是疏水性部分;
[0253]
r2是氢;氧保护基;环形或无环的、经取代或未经取代的、支链或无支链的脂族;环形或无环的、经取代或未经取代的、支链或无支链的杂脂族;经取代或未经取代的、支链或无支链的酰基;经取代或未经取代的、支链或无支链的芳基;经取代或未经取代的、支链或无支链的杂芳基;并且
[0254]
r3是核酸。
[0255]
在某些实施方案中,核酸分子是下式:
[0256][0257]
其中:
[0258]
x是n或ch;
[0259]
a是键;经取代或未经取代的、环形或无环的、支链或无支链的脂族;或者经取代或未经取代的、环形或无环的、支链或无支链的杂脂族;
[0260]
r1是疏水性部分;
[0261]
r2是氢;氧保护基;环形或无环的、经取代或未经取代的、支链或无支链的脂族;环形或无环的、经取代或未经取代的、支链或无支链的杂脂族;经取代或未经取代的、支链或无支链的酰基;经取代或未经取代的、支链或无支链的芳基;经取代或未经取代的、支链或无支链的杂芳基;并且
[0262]
r3是核酸。在某些实施方案中,核酸分子是下式:
[0263][0264]
在某些实施方案中,核酸分子是下式:
[0265][0266]
在某些实施方案中,核酸分子是下式:
[0267][0268]
其中r3是核酸。
[0269]
在某些实施方案中,核酸分子是下式:
[0270][0271]
其中r3是核酸;并且
[0272]
n是1至20的整数(包括端值)。
[0273]
在某些实施方案中,核酸分子是下式:
[0274][0275]
在某些实施方案中,核酸分子是下式:
[0276][0277]
在某些实施方案中,核酸分子是下式:
[0278][0279]
在某些实施方案中,核酸分子是下式:
[0280][0281]
在某些实施方案中,核酸分子是下式:
[0282][0283]
本文中使用的术语“键联(linkage)”包括共价偶联相邻核苷酸单体的天然存在的未经修饰的磷酸二酯部分(-o-(po
2-)-o-)。本文中使用的术语“替代键联”包括共价偶联相邻核苷酸单体的天然磷酸二酯基团的任何类似物或衍生物。替代键联包括磷酸二酯类似物,例如硫代磷酸酯、二硫代磷酸酯,和p-乙氧基磷酸二酯、p-乙氧基磷酸二酯、p-烷氧基磷酸三酯、甲基膦酸酯以及不含磷的(nonphosphorus containing)键联,例如缩醛和酰胺。这样的替代键联是本领域中已知的(例如,bjergarde et al.1991.nucleic acids res.19:5843;caruthers et al.1991.nucleosides nucleotides.10:47)。在某些实施方案中,优选不可水解的键联,例如硫代磷酸酯键联。
[0284]
在某些实施方案中,本发明的寡核苷酸包含经疏水性修饰的核苷酸或“疏水性修饰”。本文中使用的“疏水性修饰”是指经修饰以使得如下的碱基:(1)碱基的整体疏水性显著提高,和/或(2)碱基仍然能够形成接近常规的沃森-克里克相互作用。碱基修饰的数种非
限制性实例包括5位尿苷和胞苷修饰,例如苯基、4-吡啶基、2-吡啶基、吲哚基和异丁基、苯基(c6h5oh);色氨酰基((c8h6n)ch2ch(nh2)co)、异丁基、丁基、氨基苄基;苯基;以及萘基。
[0285]
可与经化学修饰的双链核酸分子的末端(3’或5’端)、环区域或任何其他部分连接的另一些类型的缀合物包括固醇、固醇型分子、肽、小分子、蛋白质等。在一些实施方案中,经化学修饰的双链核酸分子,例如sd-rxrna(intasyl
tm
)可包含多于一种缀合物(化学性质相同或不同)。在一些实施方案中,缀合物是胆固醇。
[0286]
在一些实施方案中,第一核苷酸相对于引导链的5’端具有2
’‑
o-甲基修饰,任选地其中2
’‑
o-甲基修饰是5p-2’o-甲基u修饰或5’乙烯基膦酸酯2
’‑
o-甲基u修饰。提高靶基因特异性或者降低脱靶沉默作用的另一种方法是在对应于引导序列的第二个5’端核苷酸的位置处引入2’修饰(例如,2
’‑
o甲基修饰)。本发明的反义(引导)序列可以是包含rna样区域和dna样区域的“嵌合寡核苷酸”。
[0287]
专用语(language)“核糖核酸酶h激活区”包括能够募集核糖核酸酶h以切割寡核苷酸所结合的靶rna链的寡核苷酸(例如,嵌合寡核苷酸)区域。通常来说,核糖核酸酶激活区包含dna或dna样核苷酸单体的最小核心(至少约3至5、通常约3至12、更通常约5至12、以及更优选约5至10个连续核苷酸单体)(参见,例如美国专利no.5,849,902)。优选地,核糖核酸酶h激活区包含约9个连续的含脱氧核糖的核苷酸单体。
[0288]
专用语“非激活区”包括不能募集或激活核糖核酸酶h的反义序列(例如,嵌合寡核苷酸)区。优选地,非激活区不包含硫代磷酸酯dna。本发明的寡核苷酸包含至少一个非激活区。在一个实施方案中,非激活区对于核酸酶可以是稳定的,或者可通过与靶标互补并与待与寡核苷酸结合的靶核酸分子形成氢键来提供针对靶标的特异性。
[0289]
在一个实施方案中,连续多核苷酸的至少一部分通过替代键联(例如,硫代磷酸酯键联)进行连接。
[0290]
在某些实施方案中,引导序列(2
’‑
修饰的或未修饰的)以外的大部分或全部核苷酸通过硫代磷酸酯键联进行连接。由于对于血清蛋白质的更高亲和力,这样的构建体倾向于具有改善的药动学。一旦引导链装载到risc中,多核苷酸的非引导序列部分中的硫代磷酸酯键联就通常不干扰引导链活性。在一些实施方案中,高水平的硫代磷酸酯修饰可实现改进的递送。在一些实施方案中,引导链和/或随从链是完全硫代磷酸酯化的。
[0291]
本发明的反义(引导)序列可包含“吗啉代寡核苷酸”。吗啉代寡核苷酸是非离子的并且通过不依赖于核糖核酸酶h的机制起作用。吗啉代寡核苷酸的四种遗传碱基(腺嘌呤、胞嘧啶、鸟嘌呤和胸腺嘧啶/尿嘧啶)中的每一种均与6元吗啉环连接。通过将4种不同的亚基类型经例如非离子的二氨基磷酸盐亚基间键联进行连接来制备吗啉代寡核苷酸。吗啉代寡核苷酸具有许多优点,包括:完全抗核酸酶(antisense&nucl.acid drug dev.1996.6:267);可预测的靶向性(biochemica biophysica acta.1999.1489:141);细胞中的可靠活性(antisense&nucl.acid drug dev.1997.7:63);优异序列特异性(antisense&nucl.acid drug dev.1997.7:151);最小非反义活性(biochemica biophysica acta.1999.1489:141);以及简单的渗透或刮擦递送(antisense&nucl.acid drug dev.1997.7:291)。吗啉代寡核苷酸还由于其在高剂量时无毒性而成为优选的。关于吗啉代寡核苷酸的制备的讨论可见于antisense&nucl.acid drug dev.1997.7:187中。
[0292]
认为本文中所述的化学修饰促进单链多核苷酸装载到risc中。已经表明单链多核
synthesis”;agrawal.methods in molecular biology 26:1中教导。示例性合成方法还在“oligonucleotide synthesis-a practical approach”(gait,m.j.irl press at oxford university press.1984)中教导。另外,限定序列的线性寡核苷酸,包括具有经修饰核苷酸的一些序列,可从数种商业来源容易地获得。
[0301]
寡核苷酸可通过聚丙烯酰胺凝胶电泳,或者通过多种色谱方法(包括凝胶色谱和高压液相色谱)中的任一种来纯化。为了确认核苷酸序列,尤其是未经修饰的核苷酸序列,可通过任一种已知的操作对寡核苷酸进行dna测序,所述方法包括maxam和gilbert测序、sanger测序、毛细管电泳测序、漂移斑点测序操作(wandering spot sequencing procedure),或者通过使用与hybond纸结合的寡核苷酸的选择性化学降解。还可通过激光解吸质谱或通过快原子轰击来分析短寡核苷酸的序列(mcneal,et al.,1982,j.am.chem.soc.104:976;viari,et al.,1987,biomed.environ.mass spectrom.14:83;grotjahn et al.,1982,nuc.acid res.10:4671)。测序方法也适用于rna寡核苷酸。
[0302]
可通过毛细管电泳测试寡核苷酸和使用例如bergot和egan.1992.j.chrom.599:35的方法的变性强阳离子hplc(sax-hplc)来确认合成的寡核苷酸的质量。
[0303]
其他示例性合成技术是本领域中公知的(参见,例如,sambrook et al.,molecular cloning:a laboratory manual,second edition(1989);dna cloning,volumes i and ii(dn glover ed.1985);oligonucleotide synthesis(m j gait ed,1984;nucleic acid hybridisation(b d hames and s j higgins eds.1984);a practical guide to molecular cloning(1984);或者methods in enzymology系列(academic press,inc.))。
[0304]
在某些实施方案中,本发明rnai构建体或者其至少一部分转录自编码本发明构建体的表达载体。任何本领域识别的载体均可用于该目的。转录的rnai构建体可被分离和纯化,之后进行期望的修饰(例如将未经修饰的有义链替换成经修饰的有义链等)。
[0305]
递送/载体
[0306]
不希望受到任何特定理论的限制,发明人认为,本文中所述的双链核酸分子(例如,intasyl
tm
)的随从链和引导链上的特定修饰模式有助于引导链进入到细胞核中,其中引导链介导基因沉默(例如,靶基因例如brd4的沉默)。
[0307]
不希望受到任何理论的限制,数种潜在的行动机制可解释这一活性。例如,在一些实施方案中,核酸分子(例如,[ntasyl
tm
)的引导链(例如,反义链)可从随从链分离并作为单链进入细胞核。一旦进入细胞核中,单链引导链可与核糖核酸酶h或另外的核糖核酸酶缔合并切割靶标(例如,brd4)(“反义作用机制”)。在一些实施方案中,核酸分子(例如,intasyl
tm
)的引导链(例如,反义链)可与细胞质中或细胞核外的argonaute(ago)蛋白缔合,从而形成负载的ago复合物。该负载的ago复合物可移位到细胞核中,并随后切割靶标(例如,brd4)。在一些实施方案中,核酸分子(例如,intasyl
tm
)的两条链(例如,双链体)均可进入细胞核并且引导链可与核糖核酸酶h、ago蛋白或另外的核糖核酸酶缔合并切割靶标(例如,brd4)。
[0308]
本领域技术人员理解,本文中所述的双链分子的有义链(例如,intasyl
tm
有义链)不限于本文中所述的双链核酸分子的引导链的递送。相反,在一些实施方案中,出于将所述其他分子靶向细胞的细胞核的目的,将本文中所述的随从链与某些分子(例如,反义寡核苷
酸,aso)连接(例如,共价结合、非共价结合、缀合、通过互补区杂交等)。在一些实施方案中,与本文中所述的有义链连接的分子是合成的反义寡核苷酸(aso)。在一些实施方案中,与反义寡核苷酸连接的有义链为8至15个核苷酸长、经化学修饰并且包含疏水性缀合物。
[0309]
不希望受到任何特定理论的限制,aso可通过氢键与互补的随从链连接。因此,在一些方面中,本公开内容提供了向细胞递送核酸分子的方法,所述方法包括向细胞施用分离的核酸分子,其中分离的核酸包含与反义寡核苷酸(aso)互补的有义链,其中有义链为8至15个核苷酸长,包含至少两个硫代磷酸酯修饰,有义链中至少50%的嘧啶是经修饰的,并且其中所述分子包含疏水性缀合物。
[0310]
细胞对寡核苷酸的摄取
[0311]
寡核苷酸和寡核苷酸组合物与一个/种或更多个/种细胞或细胞裂解物接触(即,使其与一个/种或更多个/种细胞或细胞裂解物接触,在本文中也称为施用或递送至一个/种或更多个/种细胞或细胞裂解物)并且被其摄取。术语“细胞”包括原核细胞和真核细胞,优选脊椎动物细胞,并且更优选哺乳动物细胞。在一些实施方案中,使本发明的寡核苷酸组合物与细菌细胞接触。在一些实施方案中,使本发明的寡核苷酸组合物与真核细胞(例如,植物细胞、哺乳动物细胞、节肢动物细胞(例如,昆虫细胞))接触。在一些实施方案中,使本发明的寡核苷酸组合物与干细胞接触。在一些实施方案中,使本发明的寡核苷酸组合物与免疫细胞例如t细胞(例如,cd8+t细胞)接触。在一些实施方案中,t细胞是t
scm
或t
cm
t细胞。在一个优选实施方案中,使本发明的寡核苷酸组合物与人细胞接触。
[0312]
本发明的寡核苷酸组合物可在体外(例如,在试管或培养皿中)(并且可引入或可不引入到对象中)或者在体内(例如,在对象例如哺乳动物对象中)或者离体接触细胞。在一些实施方案中,局部或通过电穿孔施用寡核苷酸。细胞通过内吞作用以低的速度摄取寡核苷酸,但是内吞的寡核苷酸通常被隔绝并且不能用于例如与靶核酸分子杂交。在一个实施方案中,可通过电穿孔或磷酸钙沉淀促进细胞摄取。然而,这些操作仅可用于体外或离体实施方案,并且是不方便的,并且在一些情况下与细胞毒性相关。
[0313]
在另一个实施方案中,可通过合适的本领域认可的方法来增强寡核苷酸向细胞的递送,所述方法包括磷酸钙、dmso、甘油或右旋糖酐、电穿孔,或者通过例如使用阳离子、阴离子或中性脂质组合物或脂质体,使用本领域中已知方法进行的转染(参见,例如wo 90/14074;wo 91/16024;wo 91/17424;美国专利no.4,897,355;bergan et al.1993.nucleic acids research.21:3567)。寡核苷酸的增强的递送也可使用载体(参见,例如shi,y.2003.trends genet 2003 jan.19:9;reichhart j m et al.genesis.2002.34(1-2):1604,yu et al.2002.proc.natl.acad sci.usa 99:6047;sui et al.2002.proc.natl.acad sci.usa 99:5515)、病毒、多胺或聚阳离子缀合物,使用化合物例如多赖氨酸、鱼精蛋白或ni,n12-双(乙基)精胺(参见,例如参见,例如bartzatt,r.et al.1989.biotechnol.appl.biochem.11:133;wagner e.et al.1992.proc.natl.acad.sci.88:4255)来介导。
[0314]
在某些实施方案中,本发明的经化学修饰的双链核酸分子可使用多种含β-葡聚糖的颗粒来递送,所述颗粒被称为gerp(包封有葡聚糖的负载rna的颗粒),描述在通过引用并入的2010年3月4日提交的题为“formulations and methods for targeted delivery to phagocyte cells”的美国临时申请no.61/310,611中。这样的颗粒还描述在通过引用并入
的美国专利公开us 2005/0281781 a1和us 2010/0040656以及pct公开wo 2006/007372和wo 2007/050643中。经化学修饰的双链核酸分子可以是经疏水性修饰的并且任选地可与脂质和/或两亲性肽缔合。在某些实施方案中,β-葡聚糖颗粒来源于酵母。在某些实施方案中,有效负载捕获分子是聚合物,例如分子量为至少约1000da、10,000da、50,000da、100kda、500kda等的那些。优选的聚合物包括(但不限于)阳离子聚合物、壳聚糖或pei(聚乙烯亚胺)等。
[0315]
葡聚糖颗粒可来源于真菌细胞壁(例如酵母细胞壁)的不溶性组分。在一些实施方案中,酵母是baker’s酵母。酵母来源的葡聚糖分子可包含β-(1,3)-葡聚糖、β-(1,6)-葡聚糖、甘露聚糖和几丁质中的一种或更多种。在一些实施方案中,葡聚糖颗粒包含中空酵母细胞壁,从而使颗粒保持类似细胞的三维结构,其中其可复合(complex)或包封分子例如rna分子。与使用酵母细胞壁颗粒相关的一些优点是组分的可用性、其生物可降解性质及其靶向吞噬细胞的能力。
[0316]
在一些实施方案中,葡聚糖颗粒可通过从细胞壁中提取不溶性组分,例如通过用1m naoh/ph 4.0 h2o提取baker’s酵母(fleischmann’s),随后进行洗涤并且干燥来制备。制备酵母细胞壁颗粒的方法在通过引用并入的以下专利中讨论:美国专利4,810,646、4,992,540、5,082,936、5,028,703、5,032,401、5,322,841、5,401,727、5,504,079、5,607,677、5,968,811、6,242,594、6,444,448、6,476,003,us专利公开2003/0216346、2004/0014715和2010/0040656,以及pct公开申请wo02/12348。
[0317]
用于制备葡聚糖颗粒的方案还描述在通过引用并入的以下参考文献中:soto and ostroff(2008),“characterization of multilayered nanoparticles encapsulated in yeast cell wall particles for dna delivery.”bioconjug chem 19(4):840-8;soto and ostroff(2007),“oral macrophage mediated gene delivery system,”nanotech,volume 2,chapter 5(“drug delivery”),pages 378-381;以及li et al.(2007),“yeast glucan particles activate murine resident macrophages to secrete proinflammatory cytokines via myd88-and syk kinase-dependent pathways.”clinical immunology 124(2):170-181。
[0318]
包含葡聚糖的颗粒(例如酵母细胞壁颗粒)还可商业地获得。数种非限制性实例包括:来自biorigin的nutricell mos 55(sao paolo,brazil);saf-mannan(saf agri,minneapolis,minn.);nutrex(sensient technologies,milwaukee,wis.);碱提取的颗粒,例如由nutricepts(nutricepts inc.,burnsville,minn.)和asa biotech生产的那些;来自biopolymer engineering的酸提取的wgp颗粒;以及有机溶剂提取的颗粒,例如来自alpha-beta technology,inc.(worcester,mass.)的adjuvax
tm
以及来自novogen(stamford,conn.)的微粒葡聚糖。
[0319]
根据生产和/或提取方法,葡聚糖颗粒,例如酵母细胞壁颗粒可具有不同的纯度水平。在一些情况下,将颗粒碱提取、酸提取或有机溶剂提取以移除细胞内组分和/或细胞壁的外甘露糖蛋白层。这样的方案可产生葡聚糖(w/w)含量为50%至90%的颗粒。在一些情况下,可优选较低纯度(意味着较低的葡聚糖w/w含量)的颗粒,而在另一些实施方案中,可优选较高纯度(意味着较高的葡聚糖w/w含量)的颗粒。
[0320]
葡聚糖颗粒,例如酵母细胞壁颗粒,可具有天然脂质含量。例如,颗粒可包含1%、
2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%或多于20%w/w的脂质。在一些情况下,天然脂质的存在可有助于rna分子的复合(complexation)或捕获。
[0321]
含葡聚糖的颗粒的直径通常为约2微米至4微米,但是直径小于2微米或大于4微米的颗粒也适用于本发明的一些方面。
[0322]
待递送的rna分子可复合或“捕获”在葡聚糖颗粒的壳内。可对颗粒的壳或rna组分进行标记以用于可视化,如在通过引用并入的soto and ostroff(2008)bioconjug chem 19:840中所描述的。下面将进一步讨论负载gerp的方法。
[0323]
用于摄取寡核苷酸的方案取决于多种因素,最关键的是所使用的细胞的类型。对于摄取来说重要的其他因素包括但不限于寡核苷酸的性质和浓度、细胞的汇合、细胞所处的培养类型(例如,悬浮培养或平板)以及细胞生长的培养基的类型。
[0324]
免疫调节组合物及其产生方法
[0325]
在一些实施方案中,本文中所述的经化学修饰的双链核酸分子(例如,intasyl
tm
分子)可用于产生用于免疫调节组合物的特定细胞亚型或t细胞亚型。如本文所使用的,“免疫调节组合物”是包含以下的组合物:含有如本文中所述的经化学修饰的核酸分子的宿主细胞和/或已经用如本文中所述的经化学修饰的核酸分子处理的宿主细胞。免疫调节组合物可任选地还包含一种或更多种可药用赋形剂或载体。不希望受到任何特定理论的约束,如本公开内容所述的免疫调节组合物的特征在于这样的免疫细胞(例如,t细胞、nk细胞、抗原呈递细胞(apc)、树突细胞(dc)、干细胞(sc)、诱导多能干细胞(ipsc)等)群:其已被工程化以具有富集的特定细胞亚型(例如,t细胞亚型,例如t
scm
或t
cm
t细胞)群;并且因此所述免疫调节组合物在一些实施方案中可用于调节(例如,刺激或抑制)对象的免疫应答。
[0326]
本文中使用的“宿主细胞”是已向其引入了一种或更多种经化学修饰的双链核酸分子的细胞。通常来说,宿主细胞是哺乳动物细胞,例如人细胞、小鼠细胞、大鼠细胞、猪细胞等。然而,在一些实施方案中,宿主细胞是非哺乳动物细胞,例如原核细胞(例如,细菌细胞)、酵母细胞、昆虫细胞等。通常来说,宿主细胞来自供体,例如健康供体(例如,已向其引入了经化学修饰的双链核酸的细胞从供体例如健康供体取得)。例如,可从获自供体(例如健康供体)的生物样品例如骨髓或血液中分离一种或更多种细胞。本文中使用的“健康供体”是指未患有或未被怀疑患有增生性病症或感染性疾病(例如,细菌感染、病毒感染或寄生虫感染)的对象。然而,在一些实施方案中,例如在自体细胞治疗的背景下,宿主细胞来自患有(或被怀疑患有)增生性疾病或感染性疾病的对象。
[0327]
在一些实施方案中,细胞(例如,宿主细胞)是免疫细胞,例如t细胞、b细胞、树突细胞(dc)、粒细胞、天然杀伤细胞、巨噬细胞等。在一些实施方案中,细胞(例如,宿主细胞)是能够分化成免疫细胞的细胞,例如干细胞(sc)或诱导多能干细胞(ipsc)。在一些实施方案中,细胞(例如,宿主细胞)是干细胞记忆t细胞,例如,如在通过引用并入的gattinoni et al.(2017)nature medicine 23;18-27中所描述的。
[0328]
在一些实施方案中,细胞(例如,宿主细胞)是t细胞,例如杀伤t细胞、辅助性t细胞、调节性t细胞或肿瘤浸润淋巴细胞(til)。在一些实施方案中,t细胞是杀伤t细胞(例如,cd8+ t细胞)。在一些实施方案中,t细胞是辅助性t细胞(例如,cd4+ t细胞)。在一些实施方案中,t细胞是活化的t细胞(例如,已经被抗原呈递细胞上的ii类mhc分子与肽抗原一起呈
递的t细胞)。
[0329]
在一些实施方案中,t细胞包含表达高亲和力t细胞受体(tcr)和/或嵌合抗体受体(car)的一种或更多种转基因。
[0330]
在一些方面中,本公开内容涉及以下发现:将本公开内容的一种或更多种经化学修饰的双链核酸分子(例如,一种或更多种intasyl
tm
分子)引入至细胞(例如,从供体获得的免疫细胞)以产生宿主细胞,该宿主细胞的特征在于宿主细胞中的一种或更多种信号转导/转录因子、表观遗传、代谢和/或共抑制/负调节蛋白(例如,brd4等)的表达或活性显著降低。在一些实施方案中,宿主细胞的特征在于,相对于不包含经化学修饰的双链核酸分子的细胞(例如,同一细胞类型的免疫细胞),约5%至约50%降低的免疫检查点蛋白表达。在一些实施方案中,宿主细胞(例如,患有或被怀疑患有增生性疾病或感染性疾病的对象的免疫细胞)的特征在于,相对于不包含经化学修饰的双链核酸分子的细胞(例如,同一细胞类型的免疫细胞),大于50%(例如,51%、52%、53%、54%、55%、60%、70%、75%、80%、85%、90%、95%、99%、100%,或者51%至100%之间的任何百分比,包括介于之间的所有值)降低的分化相关靶标(例如信号传导分子、激酶/磷酸酶、转录因子、表观遗传调节剂、代谢和调节靶标)的表达。
[0331]
在一些实施方案中,如本公开内容所述的免疫调节组合物包含多个宿主细胞。在一些实施方案中,多个宿主细胞是每千克约10,000个宿主细胞、每千克约50,000个宿主细胞、每千克约100,000个宿主细胞、每千克约250,000个宿主细胞、每千克约500,000个宿主细胞、每千克约1
×
106个宿主细胞、每千克约5
×
106个宿主细胞、每千克约1
×
107个宿主细胞、每千克约1
×
108个宿主细胞、每千克约1
×
109个宿主细胞、或每千克多于1
×
109个宿主细胞。在一些实施方案中,多个宿主细胞为每千克约1
×
105个至1
×
10
14
个宿主细胞。
[0332]
在一些方面中,本公开内容提供了用于产生如本公开内容所述的免疫调节组合物的方法。在一些实施方案中,所述方法包括将一种或更多种经化学修饰的双链核酸分子(例如,intasyl
tm
)引入到细胞中,从而产生具有特定细胞亚型或t细胞亚型(例如,t
scm
或t
cm
)的宿主细胞,其中所述经化学修饰的双链核酸分子靶向brd4。
[0333]
产生免疫调节组合物(例如,产生宿主细胞或宿主细胞群)的方法可在体外、离体或在体内在例如培养的哺乳动物细胞(例如培养的人细胞)中进行。在一些实施方案中,可在递送试剂例如脂质(例如阳离子脂质)或脂质体的存在下接触靶细胞(例如,获自供体的细胞)以促进经化学修饰的双链核酸分子进入到细胞中,如本公开内容中其他地方进一步详细描述的。
[0334]
载体和复合剂(complexing agent)
[0335]
本公开内容还涉及包含如本文中所述的rnai构建体以及可药用载体或稀释剂的组合物。在一些方面中,本公开内容涉及包含本文中所述的rnai构建体以及可药用载体的免疫调节组合物。
[0336]
本文中使用的“可药用载体”包括合适的溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等张剂和吸收延迟剂等。这样的介质和试剂用于药物活性物质的用途是本领域中公知的。除非任何常规介质或试剂与活性成分不相容,否则其可用于治疗组合物中。补充活性成分也可并入到组合物中。
[0337]
例如,在一些实施方案中,可将寡核苷酸并入到脂质体或用聚乙二醇修饰的脂质
体中,或者与阳离子脂质混合,用于肠胃外施用。将另外的物质(例如,针对在特定靶细胞上发现的膜蛋白具有反应性的抗体)并入到脂质体中可帮助将寡核苷酸靶向至特定的细胞类型(例如,免疫细胞,例如t细胞)。
[0338]
包封剂将寡核苷酸截留到囊泡内。在本发明的另一个实施方案中,如本领域技术人员所理解的,寡核苷酸可与载体或载剂(例如,脂质体或胶束)缔合,但是可使用其他载体。脂质体是由脂双层构成的具有类似于生物膜的结构的囊泡。这样的载体可用于促进寡核苷酸的细胞摄取或靶向性,或者改善寡核苷酸的药动学或毒理学特性。
[0339]
例如,本发明的寡核苷酸也可包封在脂质体、药物组合物中施用,其中活性成分被包含分散在或以不同方式存在于由黏附在脂质层上的水性同心层组成的小体(corpuscle)中。根据溶解性,寡核苷酸可存在于水性层和脂质层二者中,或者存在于通常被称为脂质体悬液的物质中。疏水性层(通常但不排他地)包含:磷脂,例如卵磷脂和鞘磷脂;类固醇,例如胆固醇;或多或少的离子表面活性剂,例如二乙酰基磷酸酯、十八胺或磷脂酸;或者其他疏水性物质。脂质体的直径通常为约15nm至约5微米。
[0340]
使用脂质体作为药物递送载剂提供了数种优点。脂质体提高胞内稳定性、提高摄取效率并且改善生物活性。脂质体是由脂质构成的中空球状囊泡,所述脂质以类似于构成细胞膜的那些脂质的方式排列。脂质体具有用于截留水溶性化合物的内部水性空间,并且直径尺寸为0.05微米至数微米。数个研究已经表明,脂质体可向细胞递送核酸并且核酸保持生物活性。例如,最初被设计为研究工具的脂质递送载剂,例如lipofectin或lipofectamine
tm 2000可向细胞递送完整的核酸分子。
[0341]
使用脂质体的具体优点包括以下:其为非毒性的并且在组成上生物可降解;其表现出长的循环半衰期;并且识别分子可容易地连接到其表面以用于靶向组织。最后,无论是在液体悬液还是在冻干产品中,制备基于脂质体的药物的成本效益已经示出了这种技术作为可接受的药物递送系统的可行性。
[0342]
在一些方面中,可针对一类天然存在的或者化学合成或经修饰的饱和和不饱和脂肪酸残基选择与本发明相关的制剂。脂肪酸可以以甘油三酯、甘油二酯或独立脂肪酸的形式存在。在另一个实施方案中,可使用目前在药理学中使用的脂肪酸和/或脂肪乳剂的充分确认的混合物用于肠外营养的用途。
[0343]
基于脂质体的制剂广泛用于寡核苷酸递送。然而,大部分市售脂质或脂质体制剂含有至少一种带正电荷的脂质(例如,阳离子脂质)。这种带正电荷的脂质的存在被认为是获得高寡核苷酸负载度和增强脂质体融合特性所必需的。已经进行和公开了数种方法来鉴定功能性带正电荷的脂质化学物质。然而,含有阳离子脂质的市售脂质体制剂以高的毒性水平为特征。体内有限的治疗指数已经揭示,在比实现rna沉默所需浓度稍高的浓度下,含有带正电荷脂质的脂质体制剂与毒性(例如,肝酶升高)相关。
[0344]
与本发明相关的核酸可以是经疏水性修饰的并且可包含在中性纳米运载体内。中性纳米运载体的进一步描述在通过引用并入的2009年9月22日提交的题为“neutral nanotransporters”的pct申请pct/us2009/005251中。这样的颗粒使得定量的寡核苷酸能够并入到不带电荷的脂质混合物中。在这样的中性纳米运载体中没有毒性水平的阳离子脂质是重要特征。
[0345]
如pct/us2009/005251中示出的,寡核苷酸可有效地并入到不含阳离子脂质的脂
质混合物中,并且这样的组合物可以以功能性方式向细胞有效递送治疗性寡核苷酸。例如,当脂质混合物由磷脂酰胆碱碱基脂肪酸和固醇例如胆固醇构成时,观察到高的活性水平。例如,中性脂肪混合物的一种优选制剂由至少20%dopc或dspc以及至少20%固醇例如胆固醇构成。发现即使低至1∶5的脂质与寡核苷酸的比对于寡核苷酸在不带电荷的制剂中的完全包封也是足够的。
[0346]
中性纳米运载体组合物能够将寡核苷酸有效负载到中性脂肪制剂中。所述组合物包含以一定方式修饰的寡核苷酸,以使得分子的疏水性提高(例如,将疏水性分子连接(共价或非共价)至寡核苷酸末端或非末端核苷酸、碱基、糖或骨架上的疏水性分子),经修饰的寡核苷酸与中性脂肪制剂(例如,含有至少25%胆固醇和25%dopc或其类似物)混合。货物分子,例如另外的脂质,也可包含在组合物中。这种组合物(其中制剂的一部分被构建到寡核苷酸本身中)能够将寡核苷酸高效包封到中性脂质颗粒中。
[0347]
在一些方面中,在疏水性寡核苷酸与优选制剂复合后,可形成尺寸为50nm至140nm的稳定颗粒。制剂本身通常不形成小颗粒,而是形成团聚体(agglomerate),其在添加经疏水性修饰的寡核苷酸后转化成稳定的50至120nm颗粒。
[0348]
在一些实施方案中,中性纳米运载体组合物包含经疏水性修饰的多核苷酸、中性脂肪混合物和任选的货物分子。本文中使用的“经疏水性修饰的多核苷酸”是具有至少一个修饰的本发明的多核苷酸(例如,sd-rxrna),所述修饰使多核苷酸比修饰前的多核苷酸疏水性更高。可通过向多核苷酸连接(共价或非共价连接)疏水性分子来实现修饰。在一些情况下,疏水性分子是或包含亲脂性基团。
[0349]
术语“亲脂性基团”意指对于脂质的亲和力比其对于水的亲和力更高的基团。亲脂性基团的一些实例包括但不限于:胆固醇、胆甾烯基或经修饰的胆甾烯基残基、金刚烷(adamantine)、双氢睾酮(dihydrotesterone)、长链烷基、长链烯基、长链炔基、油烯基-石胆酸(olely-lithocholic)、胆烯基(cholenic)、油酰基-胆烯基、棕榈基、十七基、肉豆蔻基、胆汁酸、胆酸或牛黄胆酸、脱氧胆酸盐、油烯基石胆酸、油酰基胆烯酸、糖脂、磷脂、鞘脂、类异戊二烯(例如类固醇)、维生素(例如维生素e)、饱和或不饱和脂肪酸、脂肪酸酯(例如甘油三酯)、芘、卟啉、得克萨卟啉(texaphyrine)、金刚烷、吖啶、生物素、香豆素、荧光素、罗丹明、德克萨斯红(texas-red)、洋地黄毒苷、二甲氧基三苯甲基、叔丁基二甲基甲硅烷基、叔丁基二苯基甲硅烷基、花青染料(例如,cy3或cy5)、hoechst 33258染料、补骨脂素或布洛芬。胆固醇部分可以是还原的(例如,在胆甾烷中)或可以是取代的(例如,通过卤素)。一个分子中不同亲脂性基团的组合也是可能的。
[0350]
疏水性分子可连接在多核苷酸的多个位置处。如上所述的,疏水性分子可与寡核苷酸的末端残基(例如多核苷酸的3’端或5’端)连接。或者,其可与多核苷酸的内部核苷酸或支链上的核苷酸连接。疏水性分子可与例如核苷酸的2’位置连接。疏水性分子也可与多核苷酸的核苷酸的杂环碱基、糖或骨架连接。
[0351]
疏水性分子可通过接头部分与多核苷酸连接。任选地,接头部分是非核苷酸接头部分。非核苷酸接头是例如无碱基残基(dspacer);寡聚乙二醇(oligoethyleneglycol),例如三乙二醇(间隔物9)或六乙二醇(间隔物18);或烷烃二醇,例如丁二醇。间隔物单元优选地通过磷酸二酯或硫代磷酸酯键连接。接头单元可在分子中仅出现一次,或者可并入数次,例如通过磷酸二酯、硫代磷酸酯、甲基磷酸酯或酰胺键联。
[0352]
通常缀合方案涉及在序列的一个或更多个位置处带有氨基接头的多核苷酸的合成,然而接头不是必须的。然后使用合适的偶联剂或激活剂使氨基与缀合的分子反应。缀合反应可在多核苷酸依然与固相支持物结合的情况下或者在溶液相中切割多核苷酸之后进行。通常通过hplc纯化经修饰的多核苷酸,得到纯的物质。
[0353]
在一些实施方案中,疏水性分子是固醇型缀合物、植物固醇(phytosterol)缀合物、胆固醇缀合物、具有改变的侧链长度的固醇型缀合物、脂肪酸缀合物、任何其他疏水性基团缀合物、和/或内部核苷的疏水性修饰,其提供足够的疏水性以并入到胶束中。
[0354]
出于本发明的目的,术语“固醇”是指或类固醇醇类(steroid alcohol)是在a环的3位处具有羟基的类固醇亚组。其为通过hmg-coa还原酶途径由乙酰辅酶a合成的两亲性脂质。整体分子是相当平的。a环上的羟基是极性的。脂族链的其余部分是非极性的。通常来说,固醇被认为在17位处具有8碳链。
[0355]
出于本发明的目的,术语“固醇型分子”是指在结构上与固醇类似的类固醇醇类。主要差异是环的结构和21位连接的侧链中碳的数目。
[0356]
出于本发明的目的,术语“植物固醇”(也称为植物甾醇)是植物中天然存在的一组类固醇醇类(植物化学物质)。有超过200种不同的已知植物固醇。
[0357]
出于本发明的目的,术语“固醇侧链”是指连接在固醇型分子的17位处的侧链的化学组成。在标准定义中,固醇限于在17位处携带8碳链的4环结构。在本发明中,描述了具有比常规侧链更长和更短的侧链的固醇型分子。侧链可以是支链的或者包含双骨架。
[0358]
因此,可用于本发明的固醇例如包括胆固醇,以及其中17位连接有2至7个碳或比9个碳更长的侧链的独特固醇。在一些实施方案中,聚碳尾部的长度为5至9个碳不等。这样的缀合物可具有显著更好的体内效力,特别是向肝递送。与和常规胆固醇缀合的寡核苷酸相比,预期这些分子类型以低5至9倍的浓度工作。
[0359]
或者,多核苷酸可与作为疏水性分子的蛋白质、肽或带正电荷的化学物质结合。蛋白质可选自鱼精蛋白(protamine)、dsrna结合结构域和富含精氨酸的肽。一些示例性的带正电荷的化学物质包括精氨、亚精胺、尸胺(cadaverine)和腐胺(putrescine)。
[0360]
在另一个实施方案中,当疏水性分子缀合物与多核苷酸的特定化学修饰模式(如本文中详细描述的)组合时,其可表现出甚至更高的效力,所述化学修饰包括但不限于疏水性修饰、硫代磷酸酯修饰和2’核糖修饰。
[0361]
在另一个实施方案中,固醇型分子可以是天然存在的植物固醇。聚碳链可以是长于9个碳的,并且可以是直链的、支链的和/或含有双键。在向多种组织递送多核苷酸时,一些含有植物固醇的多核苷酸缀合物可显著更强效且更有活性。一些植物固醇可表现出组织偏向性,并因此用作向特定组织特异性递送rnai的方法。
[0362]
将经疏水性修饰的多核苷酸与天然脂肪混合物混合以形成胶束。中性脂肪酸混合物是在生理ph下或生理ph附近为净中性或稍微带净负电荷的脂肪的混合物,其可与经疏水性修饰的多核苷酸形成胶束。出于本发明的目的,术语“胶束”是指由不带电荷的脂肪酸与磷脂的混合物形成的小纳米粒。中性脂肪混合物可包含阳离子脂质,只要其以不引起毒性的量存在即可。在一些实施方案中,中性脂肪混合物不含阳离子脂质。不含阳离子脂质的混合物是其中小于1%、并且优选0%的总脂质为阳离子脂质的混合物。术语“阳离子脂质”包括在生理ph下或生理ph附近具有净正电荷的脂质和合成脂质。术语“阴离子脂质”包括在生
理ph下或生理ph附近具有净负电荷的脂质和合成脂质。
[0363]
中性脂肪通过强的但是非共价吸引力(例如,静电力、范德华力、π-堆叠等相互作用)与本发明寡核苷酸结合。
[0364]
中性脂肪混合物可包括选自一类天然存在或化学合成或经修饰的饱和和不饱和脂肪酸残基的制剂。脂肪酸可以以甘油三酯、甘油二酯或独立脂肪酸的形式存在。在另一个实施方案中,可使用目前在药理学中使用的脂肪酸和/或脂肪乳剂的充分确认的混合物用于肠外营养的用途。
[0365]
中性脂肪混合物优选为基于胆碱的脂肪酸和固醇的混合物。基于胆碱的脂肪酸包括例如合成的磷酸胆碱衍生物,例如ddpc、dlpc、dmpc、dppc、dspc、dopc、popc和depc。dopc(化学品注册号4235-95-4)是二油酰基磷脂酰胆碱(也称为二反油酰基磷脂酰胆碱(dielaidoylphosphatidylcholine)、二油酰基-pc、二油酰基磷酸胆碱、二油酰基-sn-甘油-3-磷酸胆碱、二油烯基磷脂酰胆碱)。dspc(化学品注册号816-94-4)是二硬脂酰基磷脂酰胆碱(也称为1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱)。
[0366]
中性脂肪混合物中的固醇可以是例如胆固醇。中性脂肪混合物可完全由基于胆碱的脂肪酸和固醇构成,或者其可任选地包含货物分子。例如,中性脂肪混合物可具有至少20%或25%脂肪酸以及20%或25%固醇。
[0367]
出于本发明的目的,术语“脂肪酸”涉及脂肪酸的常规描述。其可作为独立实体或者以甘油二酯和甘油三酯的形式存在。出于本发明的目的,术语“脂肪乳剂”是指向不能在其饮食中获得足够脂肪的对象皮下施用的安全的脂肪制剂。其为大豆油(或其他天然存在的油)和卵磷脂的乳剂。脂肪乳剂被用于一些不溶性麻醉剂的制剂。在本公开内容中,脂肪乳剂可以是市售制剂(例如英脱利匹特(intralipid)、liposyn(乐补欣)、nutrilipid)、经修饰的市售制剂的一部分,其中其富含特定脂肪酸,或者是脂肪酸和磷脂的完全从头配制的组合。
[0368]
在一个实施方案中,使待与本发明的寡核苷酸组合物接触的细胞与包含寡核苷酸的混合物和包含脂质(例如,上文所述脂质或脂质组合物之一)的混合物接触持续约12小时至约24小时。在另一个实施方案中,使待与寡核苷酸组合物接触的细胞与包含寡核苷酸的混合物和包含脂质(例如,上文所述脂质或脂质组合物之一)的混合物接触持续约1天至约五天。在一个实施方案中,使细胞与包含脂质和寡核苷酸的混合物接触持续约三天至长至约30天。在另一个实施方案中,使包含脂质的混合物与细胞保持接触持续至少约五天至约20天。在另一个实施方案中,使包含脂质的混合物与细胞保持接触持续至少约七天至约15天。
[0369]
制剂的50%至60%可任选地是任何其他脂质或分子。这样的脂质或分子在本文中称作载货脂质(cargo lipid)或货物分子。货物分子包括但不限于英脱利匹特、小分子、融合肽或脂质或者可添加以改变细胞摄取、内体释放或组织分布特性的其他小分子。耐受货物分子的能力对于调节这些颗粒的特性很重要,如果期望这样的特性的话。例如,一些组织特异性代谢物的存在可彻底改变组织分布谱。例如,富含不同饱和度的较短或较长脂肪链的英脱利匹特型制剂的使用影响这些制剂类型的组织分布谱(及其负载)。
[0370]
根据本发明有用的载货脂质的一个实例是融合脂质(fusogenic lipid)。例如,两性离子型脂质dope(化学品注册号4004-5-1,1,2-二油酰基-sn-甘油-3-磷酸乙醇胺)是一
个优选的载货脂质。
[0371]
英脱利匹特可由以下组成构成:1 000ml含有:纯化大豆油90g,纯化卵磷脂12g,无水甘油22g,注射用水适量加至1 000ml。用氢氧化钠将ph调节至约8的ph。能量含量/l:4.6mj(190kcal)。重量摩尔渗透压浓度(osmolality)(约):300mosm/kg水。在另一个实施方案中,脂肪乳剂是乐补欣,其含有注射用水中的5%红花油、5%大豆油、作为乳化剂添加的至多1.2%卵磷脂,以及2.5%甘油。其还可包含氢氧化钠用于ph调节。ph 8.0(6.0至9.0)。乐补欣的渗量(osmolarity)为276m osmol/升(实际)。
[0372]
载货脂质的特性(identity)、量和比例的不同影响这些化合物的细胞摄取和组织分布特性。例如,脂质尾部的长度和饱和度水平将影响肝、肺、脂肪和心肌细胞中的差异摄取。添加特定的疏水性分子例如维生素或不同形式的固醇可有利于分布到参与特定化合物的代谢的特定组织。在一些实施方案中,使用维生素a或e。在不同寡核苷酸浓度下形成复合物,浓度越高越有利于高效的复合物形成。
[0373]
在另一个实施方案中,脂肪乳剂基于脂质的混合物。这样的脂质可包括天然化合物、化学合成的化合物、纯化的脂肪酸或者任何其他脂质。在另一个实施方案中,脂肪乳剂的组合物是完全人造的。在一个具体实施方案中,脂肪乳剂是多于70%亚油酸的。在另一个具体实施方案中,脂肪乳剂的至少1%是心磷脂。亚油酸(linoleic acid,la)是不饱和的ω-6脂肪酸。其为由具有18碳的链和两个顺式双键的羧酸制造的无色流体。
[0374]
在本发明的另一个实施方案中,脂肪乳剂的组成的改变用作改变经疏水性修饰的多核苷酸的组织分布的方法。这种方法提供了多核苷酸向特定组织的特异性递送。
[0375]
在另一个实施方案中,货物分子的脂肪乳剂包含超过70%的亚油酸(c
18h32
o2)和/或心磷脂。
[0376]
脂肪乳剂(例如英脱利匹特)之前已经用作一些非水溶性药物的递送制剂(例如,丙泊酚(propofol),复配(re-formulated)为得普利麻(diprivan))。本发明的独特特征包括(a)将经修饰多核苷酸与疏水性化合物组合的理念,因此其可并入到脂肪胶束中,以及(b)将其与脂肪乳剂混合以提供可逆载体。在注射到血流中之后,胶束通常与血清蛋白质(包括白蛋白、hdl、ldl等)结合。这种结合是可逆的并且最终脂肪被细胞吸收。然后将作为胶束的一部分并入的多核苷酸紧密递送到细胞表面,在这之后,可通过不同机制发生细胞摄取,所述机制包括但不限于固醇型递送。
[0377]
复合剂与本发明寡核苷酸通过强的非共价吸引力(例如,静电力、范德华力、π-堆叠等相互作用)结合。在一个实施方案中,本发明的寡核苷酸可与复合剂复合以提高寡核苷酸的细胞摄取。复合剂的一个实例包括阳离子脂质。阳离子脂质可用于向细胞递送寡核苷酸。然而,如上文所讨论的,不含阳离子脂质的制剂在一些实施方案中是优选的。
[0378]
术语“阳离子脂质”包括具有极性和非极性结构域的脂质和合成脂质,其能够在生理ph下或生理ph附近带正电荷,与聚阴离子(例如核酸)结合并且促进将核酸递送至细胞中。通常来说,阳离子脂质包括饱和和不饱和烷基醚和脂环族醚以及胺、酰胺的酯,或其衍生物。阳离子脂质的直链和支链烷基和烯基可包含例如1至约25个碳原子。优选的直链或支链烷基或烯基具有6个或更多个碳原子。脂环族基团包括胆固醇和其他类固醇基团。阳离子脂质可利用多种抗衡离子(阴离子)制备,所述抗衡离子(阴离子)包括例如cl-、br-、i-、f-、乙酸根、三氟乙酸根、硫酸根、亚硝酸根和硝酸根。
[0379]
阳离子脂质的一些实例包括聚乙烯亚胺、聚酰胺基胺(polyamidoamine,pamam)星放射状树枝状分子、lipofectin(dotma和dope的组合)、lipofectase、lipofectamine
tm
(例如,lipofectamine
tm 2000)、dope、cytofectin(gilead sciences,foster city,calif.)和eufectins(jbl,san luis obispo,calif.)。一些示例性阳离子脂质体可由n-[1-(2,3-二油酰氧基)-丙基]-n,n,n-三甲基氯化铵(dotma)、n-[1-(2,3-二油酰氧基)-丙基]-n,n,n-三甲基胺硫酸甲酯(dotap)、3β-[n-(n’,n
’‑
二甲基氨基乙烷)氨基甲酰基]胆固醇(dc-chol)、2,3,-二油酰氧基-n-[2(精胺羧酰胺)乙基]-n,n-二甲基-1-丙铵三氟乙酸盐(dospa)、1,2-二肉豆蔻酰基氧基丙基-3-二甲基-羟乙基溴化铵;以及二甲基双十八烷基溴化铵(dimethyldioctadecylammonium bromide,ddab)。发现例如阳离子脂质n-(1-(2,3-二油酰氧基)丙基)-n,n,n-三甲基三甲基氯化铵(dotma)使硫代磷酸酯寡核苷酸的反义作用提高1000倍(vlassov et al.,1994,biochimica et biophysica acta 1197:95-108)。寡核苷酸还可与例如聚(l-赖氨酸)或抗生素蛋白复合,并且这种混合物中可包含或可不包含脂质,例如甾醇基-聚(l-赖氨酸)。
[0380]
阳离子脂质已经在本领域中用于向细胞递送寡核苷酸(参见,例如美国专利no.5,855,910;5,851,548;5,830,430;5,780,053;5,767,099;lewis et al.1996.proc.natl.acad.sci.usa 93:3176;hope et al.1998.molecular membrane biology 15:1)。可用于促进本发明寡核苷酸摄取的其他脂质组合物可结合要求保护的方法使用。除了上文列出的那些外,其他脂质组合物也是本领域中已知的,并且包括例如以下专利中教导的那些:美国专利no.4,235,871;美国专利no.4,501,728;4,837,028;4,737,323。
[0381]
在一个实施方案中,脂质组合物还可包含物质(例如,病毒蛋白质)以增强脂质介导的寡核苷酸转染(kamata,et al.,1994.nucl.acids.res.22:536)。在另一个实施方案中,使作为包含寡核苷酸、肽和脂质的组合物的一部分的寡核苷酸与细胞接触,如例如美国专利5,736,392中所教导的。已经描述了具有血清抗性的经改良脂质(lewis,et al.,1996.proc.natl.acad.sci.93:3176)。阳离子脂质和其他复合剂用于提高通过内吞作用被携带进入到细胞中的寡核苷酸的数目。
[0382]
在另一个实施方案中,n取代的甘氨酸寡核苷酸(拟肽)可用于改善寡核苷酸的摄取。拟肽已经被用于产生用于转染的阳离子脂质样化合物(murphy,et al.,1998.proc.natl.acad.sci.95:1517)。拟肽可使用标准方法合成(例如,zuckermann,r.n.,et al.1992.j.am.chem.soc.114:10646;zuckermann,r.n.,et al.1992.int.j.peptide protein res.40:497)。阳离子脂质和拟肽的组合(liptoid)也可用于改善本发明寡核苷酸的摄取(hunag,et al.,1998.chemistry and biology.5:345)。liptoid可通过阐述拟肽寡核苷酸并且将氨基末端亚单体通过其氨基与脂质偶联来合成(hunag,et al.,1998.chemistry and biology.5:345)。
[0383]
本领域中已知带正电荷的氨基酸可用于产生高活性阳离子脂质(lewis et al.1996.proc.natl.acad.sci.us.a.93:3176)。在一个实施方案中,用于递送本发明寡核苷酸的组合物包含与亲脂性部分连接的多个精氨酸、赖氨酸、组氨酸或鸟氨酸残基(参见,例如美国专利no.5,777,153)。
[0384]
在另一个实施方案中,用于递送本发明寡核苷酸的组合物包含具有约一至约四个
biotechnology.16:857;以及derossi et al.1998.trends in cell biology.8:84;elliott and o
′
hare.1997.cell 88:223)。
[0392]
可使用已知技术使寡核苷酸与转运肽连接,例如(prochiantz,a.1996.curr.opin.neurobiol.6:629;derossi et al.1998.trends cell biol.8:84;troy et al.1996.j.neurosci.16:253,vives et al.1997.j.biol.chem.272:16010)。例如,在一个实施方案中,带有激活的巯基的寡核苷酸通过该巯基与转运肽中存在的半胱氨酸连接(例如,与触角足同源结构域的第二与第三螺旋之间的β转角中存在的半胱氨酸连接,如在例如derossi et al.1998.trends cell biol.8:84;prochiantz.1996.current opinion in neurobiol.6:629;allinquant et al.1995.j cell biol.128:919中所教导的)。在另一个实施方案中,boc-cys-(npys)oh基团可与转运肽偶联作为最后的(n端)氨基酸,并且具有sh基团的寡核苷酸可与肽偶联(troy et al.1996.j.neurosci.16:253)。
[0393]
在一个实施方案中,连接基团可与核苷酸单体连接,并且转运肽可与接头共价连接。在一个实施方案中,接头可用作转运肽的连接位点并且可提供针对核酸酶的稳定性。合适的接头的一些实例包括经取代的或未经取代的c
1-c
20
烷基链、c
2-c
20
烯基链、c
2-c
20
炔基链、肽和杂原子(例如,s、o、nh等)。其他示例性接头包括双官能交联剂,例如磺基琥珀酰亚胺基-4-(马来酰亚胺基苯基)-丁酸酯(smpb)(参见,例如smith et al.biochem j 1991.276:417-2)。
[0394]
在一个实施方案中,本发明的寡核苷酸作为分子缀合物合成,所述分子缀合物使用受体介导的内吞机制将基因递送到细胞中(参见,例如bunnell et al.1992.somatic cell and molecular genetics.18:559,以及其中引用的参考文献)。
[0395]
用于rnai试剂的体外和/或体内递送的另一些载体是本领域中已知的,并且可用于递送本发明rnai构建体(例如,递送至宿主细胞,例如t细胞)。参见,例如美国专利申请公开20080152661、20080112916、20080107694、20080038296、20070231392、20060240093、20060178327、20060008910、20050265957、20050064595、20050042227、20050037496、20050026286、20040162235、20040072785、20040063654、20030157030、wo 2008/036825、wo04/065601和au2004206255b2,仅列出一些(均通过引用并入)。
[0396]
治疗方法
[0397]
在一些方面中,本公开内容提供了通过向对象(例如,患有或被怀疑患有增生性疾病或感染性疾病的对象)施用如本公开内容所述的免疫调节组合物(例如,包含特定细胞亚型或t细胞亚型的一种或更多种宿主细胞的免疫调节组合物)来治疗增生性疾病或感染性疾病的方法。在一些实施方案中,如本文中所述的免疫调节组合物的特征在于:免疫细胞(例如,t细胞、nk细胞、抗原呈递细胞(apc)、树突细胞(dc)、干细胞(sc)、诱导多能干细胞(ipsc)等)群具有与控制t细胞分化过程相关的一种或更多种基因(例如,brd4)的降低(例如,抑制)的表达或活性。
[0398]
如本文中所使用的,“增生性疾病”是指特征在于细胞的过度增殖和细胞基质的过度更新(turnover)的疾病和病症,包括癌症、动脉粥样硬化、类风湿性关节炎、银屑病、特发性肺纤维化、硬皮病、肝硬化等。癌症的一些实例包括但不限于:肿瘤、恶性肿瘤、转移瘤或以(将被视为癌性的)不受控制的细胞生长为特征的任何其他疾病或病症。在一些实施方案中,癌症是原发性癌症。在一些实施方案中,癌症是转移性癌症。癌症的一些实例包括:胆道
癌;膀胱癌;脑癌,包括胶质母细胞瘤和髓母细胞瘤;乳腺癌;宫颈癌;绒毛膜癌;结肠癌;子宫内膜癌;食管癌;胃癌;血液癌症,包括急性淋巴细胞性和骨髓性白血病;多发性骨髓瘤;aids相关白血病和成人t细胞白血病淋巴瘤;上皮内肿瘤,包括鲍恩病(bowen’s disease)和佩吉特病(paget’s disease);肝癌;肺癌;淋巴瘤,包括霍奇金病(hodgkin’s disease)和淋巴细胞性淋巴瘤;神经母细胞瘤;口腔癌,包括鳞状细胞癌;卵巢癌,包括由上皮细胞、基质细胞、生殖细胞和间充质细胞引起的卵巢癌;胰腺癌;前列腺癌;直肠癌;肉瘤,包括平滑肌肉瘤、横纹肌肉瘤、脂肪肉瘤、纤维肉瘤和骨肉瘤;皮肤癌,包括黑素瘤、卡波西肉瘤(kaposi’s sarcoma)、基底细胞癌和鳞状细胞癌;睾丸癌,包括生殖肿瘤,例如精原细胞瘤、非精原细胞瘤、畸胎瘤;肿瘤突变负荷高的肿瘤;绒毛膜癌;间质肿瘤和生殖细胞肿瘤;甲状腺癌,包括甲状腺腺癌和髓样癌(medullar carcinoma);以及肾癌,包括腺癌和维尔姆斯瘤(wilms’tumor)。在一些实施方案中,癌症选自:小细胞肺癌、结肠癌、乳腺癌、肺癌、前列腺癌、卵巢癌、胰腺癌、黑素瘤、恶性血液病例如慢性髓系白血病等。在一些实施方案中,对象患有一种类型的癌症。在一些实施方案中,对象患有多于一种类型(例如,2、3、4、5或更多种类型)的癌症。在一些实施方案中,癌症包括小细胞肺癌、结肠癌、乳腺癌、肺癌、前列腺癌、卵巢癌、胰腺癌、黑素瘤或恶性血液病,例如慢性髓系白血病(chronic myeloid leukemia,cml)。
[0399]
本文中使用的术语“感染性疾病”是指由对象受病原体感染引起的疾病和病症。人病原体的一些实例包括但不限于某些细菌(例如,大肠杆菌(e.coli)、沙门氏菌(salmonella)的某些菌株等)、病毒(hiv、hcv、流感等)、寄生虫(原生动物、蠕虫、变形虫等)、酵母菌(例如,某些念珠菌(candida)物种等)和真菌(例如,某些曲霉菌(aspergillus)物种)。
[0400]
对象的一些实例包括哺乳动物,例如人和其他灵长类动物;牛、猪、马和农业(农用)动物;狗、猫和其他家养宠物;小鼠、大鼠和转基因的非人动物。
[0401]
在一些实施方案中,通过过继细胞转移(act)治疗方法将如本公开内容所述的免疫调节组合物施用于对象。act模式的一些实例包括但不限于自体细胞治疗(例如,取出对象自身的细胞,将其进行遗传修饰并返回至对象)、肿瘤浸润淋巴细胞(til)和异源细胞治疗(例如,细胞从供体取出,进行遗传修饰,并置于接受者体内)。在一些实施方案中,可对在act治疗方法中使用的细胞进行遗传修饰以表达嵌合抗原受体(car),所述嵌合抗原受体是经工程化的t细胞受体,其基于所选择的抗体部分显示出针对靶抗原的特异性。因此,在一些实施方案中,出于act治疗的目的,可使用本文中所述的方法用经化学修饰的双链核酸转染car t细胞(例如cart)。
[0402]
对于体内应用,本发明的制剂可以以适合于所选施用途径(例如,肠胃外、经口或腹膜内施用)的多种形式向患者施用。优选的肠胃外施用包括通过以下途径施用:静脉内;肌内;瘤内;间隙内(interstitially);动脉内;皮下;眼内;滑膜内;经上皮(trans epithelial),包括经皮(transdermal);通过吸入的经肺部;眼部;舌下和经颊;表面,包括眼部;经皮肤;经眼;经直肠;以及通过吹入法的鼻吸入。
[0403]
用于肠胃外施用的药物制剂包括水溶性或水分散性形式的活性化合物的水溶液。另外,可施用作为合适的油性注射混悬剂的活性化合物的混悬液。合适的亲脂性溶剂或载剂包括脂肪油(例如,芝麻油)或合成脂肪酸酯(例如,油酸乙酯或甘油三酯)。水性注射混悬
剂可包含提高混悬剂的黏度的物质,并且所述物质包括例如羧甲基纤维素钠、山梨糖醇或右旋糖酐,任选地,混悬剂还可包含稳定剂。本发明的寡核苷酸可配制在液体溶液中,优选地在生理相容性缓冲液(例如hank’s溶液或林格液)中。另外,寡核苷酸可配制成固体形式,并且在临使用前再溶解或悬浮。冻干形式也包含在本发明内。
[0404]
可选择药物递送载剂,例如用于体外施用、用于全身施用。这些载剂可设计成作为缓释储库或将其内容物直接递送到靶细胞。使用一些直接递送药物载剂的优点是每次摄取递送多个分子。已经表明这样的载剂提高药物的循环半衰期,否则的话所述药物将会被迅速从血流中清除。落入该分类中的这样的专用药物递送载剂的一些实例是脂质体、水凝胶、环糊精、生物可降解的纳米胶囊和生物黏附微球。
[0405]
施用本发明寡核苷酸的有效量被定义为在取得期望结果必需的剂量和时间段方面有效的量。例如,寡核苷酸的有效量可根据以下因素变化,例如细胞类型;所使用的以及用于体内应用的寡核苷酸;个体的疾病状态、年龄、性别和体重;以及寡核苷酸在个体中引起期望应答的能力。细胞内寡核苷酸的治疗水平的确立取决于摄取速率和流出或降解速率。降解程度的降低延长了寡核苷酸的胞内半衰期。因此,经化学修饰的寡核苷酸(例如,具有磷酸酯骨架修饰)可能需要不同的给药。
[0406]
免疫调节组合物的精确剂量和施用的剂量数目取决于通过实验和在临床试验中产生的数据。数种因素例如期望的效果、递送载剂、疾病指征和施用途径将影响剂量。本领域普通技术人员可容易地确定剂量并且将其配制成本发明药物组合物。优选地,治疗的持续时间将延伸至少贯穿疾病症状的进程。
[0407]
可调节给药方案以提供目标治疗响应。例如,免疫调节组合物可重复施用,例如如治疗情况的紧急状态所指示的,每天施用若干剂量或者按比例降低剂量。无论是向细胞还是向对象施用本发明经化学修饰的双链核酸分子或免疫调节组合物,本领域普通技术人员将能够容易地确定其施用的合适剂量和方案。
[0408]
可通过测试给药方案来改善免疫调节组合物的施用,例如通过皮内注射或皮下递送。在一些实施方案中,单次施用是足够的。为了进一步延长所施用的免疫调节组合物的作用,如本领域普通技术人员所熟悉的,可在缓释制剂或装置中施用组合物。
[0409]
在另一些实施方案中,多次施用经化学修饰的双链核酸分子或免疫调节组合物。在一些情况下,以如下频率施用:每天、每周两次、每周、每两周、每三周、每月、每两个月、每三个月、每四个月、每五个月、每六个月或者比每六个月更低的频率。在一些情况下,其每天多次、每周多次、每月多次和/或每年多次施用。例如,其可约每小时、每2小时、每3小时、每4小时、每5小时、每6小时、每7小时、每8小时、每9小时、每10小时、每12小时或每超过12小时施用。其可每天施用1次、2次、3次、4次、5次、6次、7次、8次、9次、10次或多于10次。
[0410]
本发明的一些方面涉及向对象施用免疫调节组合物。在一些情况下,对象是患者,并且施用免疫调节组合物涉及在医生办公室施用组合物。
[0411]
在一些实施方案中,同时施用多于一种免疫调节组合物。例如,可施用包含1、2、3、4、5、6、7、8、9、10种或多于10种不同组合物的组合物。在某些实施方案中,组合物包含2或3种不同的免疫调节组合物。
[0412]
自递送rnai免疫治疗剂
[0413]
如美国专利公开no.us 2016/0304873(其全部内容通过引用并入本文)中所描述
的,通过用特定的intasyl
tm
试剂处理细胞来产生免疫治疗剂,所述intasyl
tm
试剂被设计成靶向并敲低参与免疫抑制机制的特定基因。数种细胞和细胞系已用intasyl
tm
化合物成功地处理,并且已在特定的人细胞中显示出敲低至少70%的靶基因表达。
[0414]
这些研究示出了这些免疫调节剂在通常对转染具有极大抗性的细胞中抑制靶基因表达的效用,并且表明所述试剂能够在任何细胞类型中降低靶细胞表达。
[0415]
出于本发明的目的,范围可在本文中表示为从“约”一个特定值,和/或至“约”另一特定值。当表达这样的范围时,另一实施方案包括从一个特定值和/或至另一特定值。类似地,当通过使用先行词“约”将值表示为近似值时,将理解,特定值形成另一实施方案。还将理解,每个范围的端点相对于另一端点并且独立于另一端点都是重要的。
[0416]
此外,出于本发明的目的,没有数量词修饰的术语是指该实体的一个/种或更多个/种;例如,“蛋白质”或“核酸分子”是指这些化合物中的一种或更多种或者至少一种化合物。因此,没有数量词修饰的术语、“一个/种或更多个/种”和“至少一个/种”在本文中可互换使用。还应注意,术语“包含”、“包括”和“具有”可互换使用。此外,“选自以下的”化合物是指以下列表中的一种或更多种化合物,包括两种或更多种化合物的混合物(即,组合)。
[0417]
根据本发明,分离的或生物学上纯的蛋白质或核酸分子是已经从其天然环境中取出的化合物。因此,“分离的”和“生物学上纯的”不一定反映化合物已纯化的程度。本发明的分离的化合物可从其天然来源获得,可使用分子生物学技术产生或者可通过化学合成产生。
[0418]
通过以下实施例进一步说明本文中所述的组合物和方法,所述实施例绝不应被解释为进一步的限制。贯穿本技术引用的所有参考文献(包括文献参考、授权的专利、公开的专利申请和共同待决的专利申请)的全部内容在此明确地通过引用并入。
[0419]
实施例
[0420]
实施例1:靶向brd4的intasyl
tm
序列的鉴定
[0421]
使用专有算法分析brd4基因,以识别靶向brd4序列和靶标区域的优选intasyl
tm
分子。brd4靶序列和/或intasyl
tm
序列的一些非限制性实例示出在表1和2中。
[0422]
实施例2:靶向brd4的经化学修饰的intasyl
tm
分子在a549细胞中的两点剂量响应
[0423]
a549细胞获自atcc,并在含有10%胎牛血清和1%pen/strep的f12k培养基中培养。在转染之前24小时将细胞平板接种在96孔中。经化学修饰的靶向brd4的intasyl
tm
分子是通过在无血清accell培养基(孔)中将intasyl
tm
分子稀释至0.2至2μm来制备的,并将含有intasyl
tm
的培养基等分至细胞(96孔板中100μl/孔)。
[0424]
在施用之后72小时,裂解细胞,并使用基因特异性探针根据制造商的方案通过quantigene分支dna测定来确定mrna水平。相对于非靶向对照将数据归一化为持家基因(ppib)并进行作图。误差棒代表与生物学三次重复的平均值的标准偏差。
[0425]
图1所示的结果表明了递送至a549细胞的靶向brd4的intasyl
tm
分子brd4-11、brd4-20、brd4-21、brd4-22和brd4-23的显著沉默,其在2μm intasyl
tm
分子的情况下获得超过60至70%的基因表达抑制。
[0426]
实施例3:靶向brd4的intasyl
tm
分子在t细胞中的五点剂量响应曲线
[0427]
原代人t细胞获自allcells(ca),并在含有10%胎牛血清(gibco)和1000iu/ml il2的immunocult培养基中培养。在转染之前,将细胞用抗cd3/cd28 dynabead(gibco,
11131)根据制造商的说明书活化至少4天。通过独立地将化合物在每个样品(孔)的无血清rpmi中稀释至0.12至4μm来制备靶向brd4的intasyl
tm
分子,并将其以96孔板的每孔50μl进行等分。在含有5%fbs和il2 2000u/ml的immunocult培养基中以1,000,000个细胞/ml制备细胞,并将其以50μl/孔接种到具有预先稀释的intasyl
tm
分子的96孔板中。
[0428]
72小时之后,用每孔50ul裂解混合物和3ul蛋白酶k裂解经转染的细胞。细胞在37℃下裂解30分钟。通过分支dna测定根据制造商的方案来确定mrna水平。
[0429]
图2中所示的结果表明靶向brd4的intasyl
tm
分子在t细胞中的剂量依赖性沉默,在2μm intasyl
tm
分子brd4-20和brd4-21的情况下具有超过70至80%的基因表达抑制。
[0430]
实施例4:用靶向brd-4的intasyl
tm
化合物离体处理肿瘤浸润淋巴细胞(til)
[0431]
通过阴性选择从健康的人志愿者外周血单个核细胞(peripheral blood mononuclear cell,pbmc)中分离出cd8+ t细胞。然后使用国家癌症研究所的快速扩增方案(rep)扩增这些细胞。在rep期间,细胞用brd4-20、非靶向对照(ntc)、jq1(阳性对照)进行处理或不予处理。图4a中概述了化合物添加。在第0、8、12和14天确定brd4阴性细胞的百分比。在rep的第14天,收获细胞并通过流式细胞术分析brd4蛋白的水平以及分化标志物。用brd4-20(2μm)处理cd8+ t细胞导致与对照相比,brd4阴性cd8+ t细胞群提高(证明brd4蛋白降低)(图3),以及具有干细胞样记忆表型(ccr7+/cd62l+)的cd 8+t细胞的频率提高(图4b)。
[0432]
此外,如上所述处理的cd8+ t细胞亚群用于与恶性黑素瘤细胞系a375共培养,以确定肿瘤细胞的功能识别。在rep期间用brd4-20处理导致cd8+ t细胞对肿瘤细胞的识别增强,如infγ产生水平提高所表明的(图5)。
[0433]
还发现在rep期间用brd4-20处理导致分化为干细胞记忆t细胞(t
scm
)。图6a至6b示出了在rep第12天的流式细胞术结果,其表明与其他处理组相比,经brd4-20处理的细胞在cd45ra+cd62l+染色方面减少,但在cd45ra+ccr7+染色方面提高。
[0434]
实施例5:brd4-20的多剂量瘤内注射导致体内肿瘤生长的抑制
[0435]
荷hepa 1-6瘤小鼠(皮下注射了小鼠肝细胞癌的雌性c57bl/6crl小鼠)以两种剂量:0.5mg/肿瘤和2mg/肿瘤在第1、4、7、10和14天用靶向brd4的intasyl
tm
(brd4-20)进行瘤内处理。jq1是布罗莫结构域蛋白质的非特异性抑制剂,用作阳性对照。非靶向对照(ntc)用作阴性对照。记录纵向平均肿瘤体积(mm3)并在整个研究期间作图(图7)。发现brd4-20的瘤内注射在两种剂量水平下均抑制肿瘤生长。在最后剂量之后第14天处死小鼠,并切除肿瘤。分离til并通过流式细胞术分析cd45+群。如图8中所示,在两种剂量水平下,用brd4-20处理均提高了肿瘤微环境(tumor microenvironment,tme)中的cd45+ til。
[0436]
实施例6:brd4-20在荷hepa 1-6瘤小鼠中的剂量响应导致体内肿瘤生长的抑制
[0437]
荷hepa 1-6瘤小鼠用在第1、3、7、10和14天瘤内施用的提高剂量水平的靶向brd4的intasyl
tm
(brd4-20)进行处理(每次注射0.02mg至0.5mg)。用于开始给药的肿瘤体积靶标是150mm3。在第12天处死附属组(satellite group)(n=6)用于tme分析。研究计划如表3所示。
[0438]
表3.brd4-20剂量滴定研究设计
[0439][0440]
非靶向对照(ntc)用作阴性对照。记录纵向平均肿瘤体积(mm3)(图9a)并且通过梯形变换计算肿瘤体积auc(图9b)。通过单因素anova和tukey’s多重比较事后检验来评估统计学显著性。
[0441]
brd4-20的瘤内施用导致剂量依赖性的肿瘤生长抑制。
[0442]
表1.brd1靶位点(brd1人;nm_058243.2)
[0443]
[0444][0445]
表2.brd4 intasyl
tm
序列(随从/有义链;引导/反义链)
[0446]
[0447][0448]
检索表(key)
[0449]
a=腺苷
[0450]
g=鸟苷
[0451]
u=尿苷
[0452]
c=胞苷
[0453]
m=2
’‑
o-甲基核苷酸
[0454]
f=2’氟核苷酸
[0455]
y=5甲基尿苷
[0456]
x=5甲基胞苷
[0457]
*=硫代磷酸酯键联
[0458]
.=磷酸二酯键联
[0459]
teg-chl=胆固醇-teg-甘油
[0460]
p=5’无机磷酸
[0461]
vp-5’乙烯基膦酸酯
[0462]
s-5’硫代磷酸酯
[0463]
等同方案
[0464]
本领域中技术人员将认识到或能够仅使用常规实验确定本文中所述的本发明的一些具体实施方案的许多等同方案。这样的等同方案旨在涵盖在所附权利要求书中。
[0465]
本文中所公开的所有参考文献(包括专利文件)通过引用以其整体并入。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1