用于刺激和维持治疗部位处的免疫系统应答性的纳米颗粒系统的制作方法
用于刺激和维持治疗部位处的免疫系统应答性的纳米颗粒系统
1.相关申请的交叉引用
2.本技术要求2019年12月31日提交的美国临时专利申请号62/956,033的优先权,所述专利申请如同在本文中完全阐述一样以引用的方式整体并入本文。
技术领域
3.本公开提供了纳米颗粒系统,所述纳米颗粒系统在体内对单核细胞/巨噬细胞进行遗传修饰以(1)将额外的免疫细胞募集至治疗部位;(2)在所述治疗部位保持活化,从而向其他免疫细胞提供持续刺激信号;以及(3)分泌结合所述治疗部位处的靶向细胞上的抗原并且还结合并活化募集的免疫细胞以破坏所结合的细胞的多特异性免疫细胞衔接分子。所述系统还可抑制转化生长因子β(tgfβ)的活性。
4.发明背景
5.巨噬细胞是大量浸润癌性组织的关键免疫效应细胞。然而,在肿瘤微环境内,巨噬细胞经历从活化的杀肿瘤状态到实际上促进肿瘤生长和转移的免疫抑制表型的转变。pollard,nat rev cancer 4,71-78(2004);mantovani等人,nat rev clin oncol(2017)。
6.认识到肿瘤微环境内免疫抑制的巨噬细胞促进癌症生长和转移,因此已经投入了很多精力来开发靶向免疫抑制性肿瘤相关巨噬细胞(tam)的疗法。用于解决tam的许多努力一直集中于杀伤tam以减轻肿瘤微环境中的免疫抑制。然而,通过这种方法,在肿瘤环境中,tam仅被新出现的巨噬细胞替代。此外,即使在成功杀伤一些tam时,迄今为止开发的大多数疗法仍不能充分渗透到肿瘤微环境中。尽管一些小分子药物和抗体已显示出一定的成功,但这些方法抑制了体内所有的巨噬细胞,从而诱导危险的副作用。bowman和joyce,immunotherapy 6,663-666(2014)。因此,正如受癌症影响的每个人所理解的那样,迫切需要具有更少副作用的更有效的治疗策略。
7.在对免疫系统的t细胞进行遗传工程化以靶向并杀死目标细胞类型(如癌细胞)方面已经取得了重大进展。许多这些t细胞已进行遗传工程化以表达嵌合抗原受体(car)。car是包含允许经遗传修饰的t细胞识别并杀死癌细胞的若干不同亚组分的蛋白质。所述亚组分至少包括细胞外组分和细胞内组分。所述细胞外组分包含特异性地结合标志物的结合结构域,所述标志物优先存在于目标细胞表面上。当所述结合结构域结合此类标志物时,所述细胞内组分向t细胞发出信号以破坏所结合的细胞。car另外包含可将所述细胞外组分连接至所述细胞内组分的跨膜结构域,以及可增加car功能的其他亚组分。例如,包含一个或多个接头序列(如间隔区)可允许car具有额外的构象柔性,从而通常增加结合结构域结合经靶向的细胞标志物的能力。
8.当常规治疗失败时,使用表达car的t细胞(car-t)的临床试验显示在患有难治性大b细胞淋巴瘤的患者中的正向应答(neelapu,等人2017n engl j med 377:2531-2544)。然而,虽然经遗传工程化的car-t细胞导致癌细胞破坏,但对于一些适应症它们未能提供延长的体内抗癌活性。这种失败的一种原因可能是基于肿瘤微环境的免疫抑制作用。
9.双特异性t细胞衔接抗体结合癌细胞上的癌症抗原和t细胞活化表位两者,目的是将t细胞带至癌细胞以破坏癌细胞。参见例如,us 2008/0145362。大多数现有双特异性t细胞衔接抗体治疗剂包含成对的单特异性抗体来源的结合结构域。一些人探索了组合使用此类抗体,所述抗体靶向两种不同的t细胞活化表位(例如,cd3和cd28)。然而,许多这些抗体具有短的体内半衰期,因此给药仍然是挑战。
10.几个小组已经探索了克服与施用双特异性t细胞衔接抗体相关的一些挑战的途径。例如,stadler等人,(nature.medicine 23,815-817)描述了注射纳米载体,所述纳米载体递送编码双特异性t细胞衔接抗体的核酸。通过在体内表达这些抗体,这种方法能够实现循环双特异性t细胞衔接抗体的持续水平,从而避免输液泵进行连续递送。尽管如此,循环双特异性t细胞衔接抗体不能有效地穿透实体瘤,并且募集至并进入肿瘤微环境的t细胞的活性受到髓样抑制细胞的抑制。
11.choi等人,(nature biotechnology,37,1049-1058,2019)探索了遗传工程化t细胞产生并分泌双特异性t细胞衔接抗体。事实上,choi等人探索了遗传工程化t细胞表达car以及分泌双特异性t细胞衔接抗体。然而,这些t细胞需要离体遗传工程化。此外,car t细胞也不能有效地浸润实体瘤并在肿瘤部位处扩增(通常是由于髓样抑制细胞)。因此,尽管在癌症治疗策略方面取得了重大进展,但仍然存在重大挑战。
12.此外,转化生长因子β(tgf-β)家族蛋白因子在实体瘤中被发现处于高水平,并促成肿瘤微环境中的免疫功能障碍。
技术实现要素:
13.本公开提供系统和方法以使肿瘤相关巨噬细胞(tam)的免疫抑制性肿瘤支持状态逆转,并且将这些tam转变为高度活化的杀伤肿瘤细胞的巨噬细胞。因此,本文公开的系统和方法不仅旨在杀伤tam,而且使它们的活性从肿瘤促进转向肿瘤破坏。在特定实施方案中,所述系统和方法用作治疗剂以诱导杀伤癌细胞和/或减少或预防新的癌细胞的生长或发育。本文公开的数据表明,这些系统和方法能够完全根除并抑制卵巢癌,卵巢癌是非常难以控制的癌症类型。
14.已显示使用本文公开的tam活化策略将免疫细胞募集至肿瘤部位。然而,许多募集的免疫细胞并不结合由肿瘤表达的癌症抗原,并且因此这些募集的细胞对抗癌应答提供比以其他方式可能实现的更少的益处。为了解决这个问题,本公开提供了对活化的tam进行遗传工程化以表达多特异性免疫细胞衔接分子。然后,所述活化的tam为本文所述的癌症疗法的成功提供了三个关键方面。它们(1)将免疫细胞募集至肿瘤部位;(2)在所述肿瘤部位保持活化,从而向其他免疫细胞提供持续刺激信号;以及(3)分泌结合所述肿瘤部位的癌症抗原并且还结合并活化募集的免疫细胞以破坏所结合的癌细胞的多特异性免疫细胞衔接分子。所描述的杀死癌细胞的方法也可应用于其他目标细胞类型,如患病细胞、自身反应性细胞、受感染细胞和微生物细胞,仅举几例。
15.特定实施方案通过利用纳米颗粒系统来递送编码活化调控因子如转录因子的核苷酸来改变或维持体内巨噬细胞的活化状态。特别有用的纳米颗粒具有正核和带中性或负电荷的表面并递送核苷酸,所述核苷酸编码(i)产生和/或维持巨噬细胞的活化状态的转录因子;(ii)激酶;和/或(iii)多特异性免疫细胞衔接分子。在优选的实施方案中,所述系统
将包含递送编码这些组分中的每一者的核苷酸的纳米颗粒。《130nm的纳米颗粒粒度确保肿瘤浸润。纳米颗粒可任选地包括tam靶向配体,以指导tam更选择性地吸收所述纳米颗粒。作为一个实例,tam表达cd206,所述cd206是可通过在纳米颗粒表面上包括甘露糖来靶向的细胞表面受体。
16.特定实施方案包括《130nm、具有带正电荷的聚合物核心和带中性或负电荷的包衣的纳米颗粒。编码干扰素调控因子5(irf5);激酶ikkβ;多特异性抗体;和任选的tgfβ抑制剂的核苷酸被包封在带正电荷的聚合物核心内。在这个实例中,双特异性抗体结合选自epcam或酪氨酸酶相关蛋白1(tyrp1/gp75)的癌症抗原和选自cd3、cd28或4-1bb的免疫细胞活化表位。
17.本文公开的系统可另外包含转化生长因子β(tgfβ)抑制剂。
18.附图若干视图简述
19.本文提交的一些图可能在彩色情况下更好理解。申请人将附图的彩色版本视为原始提交的一部分,并且保留在以后的诉讼中呈递附图的彩色图像的权利。
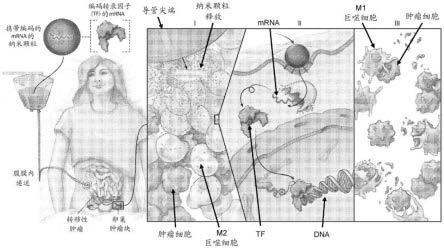
20.图1a-1d.使用靶向mrna纳米颗粒将肿瘤相关巨噬细胞(tam)遗传转化为杀肿瘤性细胞的方案。(图1a)开发了可注射的纳米载体以用于递送编码m1极化转录因子的体外转录的mrna,作为出于治疗目的使tam合理地重编程而不会引起全身毒性的新方法。示出第一计划的临床应用,旨在通过重复腹膜内输注mrna纳米颗粒来治疗卵巢癌患者。(图1b)使用靶向mrna纳米颗粒将颅内tam遗传上重编程为杀肿瘤性巨噬细胞的方案。(图1c)使用靶向mrna纳米颗粒将肿瘤相关巨噬细胞(tam)遗传转化为杀肿瘤性和双特异性抗体分泌细胞的方案。共递送编码m1极化转录因子的体外转录的mrna和使t细胞朝向肿瘤抗原重定向的抗体的可注射纳米载体提供新方法来出于治疗目的使tam合理地重编程并活化宿主适应性免疫应答而不会引起全身毒性。(图1d)呈fc和非fc形式的双特异性结合分子的示例性形式。
21.图2a-2k.携带编码irf5和ikkβ的mrna的纳米颗粒可压印促炎性m1样表型。(图2a)用编码巨噬细胞极化的关键调控因子的mrna配制的靶向巨噬细胞的聚合物np的设计。所述纳米颗粒由涂有pga-二-甘露糖层的pbae-mrna聚合复合物核心组成,所述pga-二-甘露糖层使纳米颗粒靶向m2类巨噬细胞表达的甘露糖受体(cd206)。还描绘了封装在np中的合成mrna,其经工程改造以编码重编程转录因子。(图2b)np群体(比例尺200nm)和单个np(插图,比例尺50nm)的透射电子显微术。(图2c)使用nanosight ns300仪器测量的np的粒度分布。(图2d)在1小时暴露后显示出高骨髓源性巨噬细胞(bmdm)转染率(46%)的np。(图2e)纳米颗粒转染后24小时,通过流式细胞术测量的基因转移至骨髓源性巨噬细胞(bmdm)中的效率。(图2f)np转染的和未转染的巨噬细胞的相对存活力(通过用膜联蛋白v和pi染色评估)。n.s.:不显著。(图2g)通过qrt-pcr测量的密码子优化的irf5 mrna(蓝色,左y轴)和内源性irf5 mrna(黑色,右y轴)的表达动力学,对于每个时间点n=3。(图2h)描绘用于图2i-2k中使用的bmdm的np转染方案和培养条件的时间线。(图2i)与用toll样受体6激动剂mpla刺激的标签m1细胞相比,irf5/ikkβnp转染的巨噬细胞的基因表达谱。结果以火山图描绘,所述火山图示出基因表达的倍数变化的分布。指示m1标签基因。通过gsea确定irf5/ikkβnp转染的巨噬细胞与m1标签基因集之间的重叠的p值。(图2j)在il-4中培养的巨噬细胞对比在il-4中培养并用irf5/ikkβnp转染的细胞中m1标签基因表达的热图。(图2k)示出所指示基因的平均计数和s.e.m的盒形图。
22.图3.体外筛选干扰素调控因子(irf)家族的不同成员(结合或不结合它们的活化激酶递送)对小鼠巨噬细胞的表型的影响。将来自c57bl/6小鼠的bmdm在m-csf条件培养基中孵育,并用携带合成mrna的mrna-pbae np转染,所述合成mrna编码(1)对照gfp,(2)鼠irf5,(3)鼠irf5和磷酸化irf5的ikkβ,(4)鼠irf8和ikkβ激酶,(5)鼠irf8 k310r,其是irf8的突变体,具有lys-310至arg(k310r)转化(white等人,j biol chem.2016年6月24日),或(6)鼠irf7/3(5d)。这种融合蛋白包括irf-7的dna结合结构域(dbd)和组成型活性结构域(cad)以及irf3的核输出信号(nes)和irf缔合结构域(lin等人,molecular and cellular biology.18.5,1998)。在np转染后两天,收获细胞用于tam相关巨噬细胞标志物egr2和活化的巨噬细胞标志物cd38的流式细胞术分析。基于这种体外筛选,选择共递送编码mirf5和ikkβ激酶的mrna的np用于本文所述的体外实验和治疗性体内实验的剩余部分。
23.图4a-4j.重复腹膜内注射将irf5和ikkβ基因递送到巨噬细胞中的mrna纳米载体使患有播散性卵巢癌的小鼠的平均存活率提高一倍以上。(图4a)时间线和给药方案。箭头指示腹膜内注射的时间。(图4b)在对照小鼠和经处理的小鼠中肿瘤生长的依序生物发光成像。(图4c)经处理的小鼠对比对照小鼠的卡普兰-迈耶存活曲线(kaplan-meier survival curve)。使用对数秩检验进行统计分析。(图4d)在作为对照的携带gfp mrna的d-甘露糖包被的np的单次腹膜内剂量后48小时,测量了不同免疫细胞亚群的体内转染率的流式细胞术定量:巨噬细胞(cd45+、cd11b+、mhcii+、cd11c-、ly6c-/低、ly6g-)、单核细胞(cd45+、cd11b+、mhcii+、cd11c-、ly6c+、ly6g-)、嗜中性粒细胞(cd45+、cd11b+、mhcii+、cd11c-、ly6g+)、cd4+t细胞(cd45+、tcr-β链+、cd4+、cd8-)、cd8+t细胞(cd45+、tcr-β链+、cd4-、cd8+)以及自然杀伤细胞(cd45+、tcr-β链-、cd49b+)。(图4e)患有播散性id8卵巢癌的小鼠的腹膜中巨噬细胞表型的流式细胞术分析。用4个剂量的irf5/ikkβnp或pbs处理动物。(图4f)总结ly6c-、f4/80+和cd206+(m2样)巨噬细胞的相对百分比(左图)和绝对数量(右图)的盒形图。(图4g)ly6c-、f4/80+和cd206-(m1样)巨噬细胞的相应数量。(图4h)从pbs对照(上图)或irf5/ikkβnp处理的动物(下图;比例尺100μm)分离出的卵巢肿瘤浸润的肠系膜的代表性苏木精和曙红染色的切片。代表性恶性病变的10倍放大图在右侧显示(比例尺50μm)。(图4i)测量来自每个处理组的分离的腹膜巨噬细胞产生的细胞因子的luminex测定。通过荧光活化细胞分选分离cd11b+、f4/80+腹膜巨噬细胞,并离体培养。在24小时后,收集细胞培养上清液。在平行实验中,通过prt-pcr直接分析facs分选的cd11b+、f4/80+腹膜巨噬细胞,以确定巨噬细胞表型的四种主调控因子(serpinb2、retnla、ccl11和ccl5)的表达水平。结果总结为图4j中的盒形图。
24.图5a-5f.巨噬细胞编程性mrna纳米载体对于重复给药是高度生物相容的且安全的。(图5a)在腹膜内施用后巨噬细胞靶向的irf5/ikkβnp的体内生物分布。在单次注射含50μg mrna的纳米颗粒后24小时,通过qpcr检测到np递送的(密码子优化的)mrna。(图5b)实验时间线的示意图。*最后一次剂量后二十四小时,通过co2吸入使小鼠安乐死。通过眼眶后放血将血液收集到肝素涂覆的管中,以进行血清化学分析和全血细胞计数。进行尸检用于肝、脾、胰腺、肠系膜和网膜、胃和膀胱的组织学分析。(图5c)从对照或np处理的动物分离的各种器官的代表性苏木精和曙红染色的切片。比例尺,100μm。基于比较病理学家的分析,此处示出并描述了在np处理的动物中发现的病变。每个编号图像的相关发现是:[1]细胞浸润物的离散病灶主要由与少量粒细胞混合的单核细胞组成;轻度髓外造血。[2]在一些局部广泛
区域,肝细胞轻度至中度肿胀。[3]红髓内中度髓样(主要)、类红细胞和巨核细胞增生。[4]白髓的轻度低细胞性。[5]肠系膜内,存在巨噬细胞、淋巴细胞、浆细胞和粒细胞的中度多灶性浸润物。[6]与淋巴细胞、浆细胞和粒细胞混合的巨噬细胞的轻度至中度浸润物;腺泡轻度解离和腺泡丢失;来自腺泡细胞的酶原颗粒的轻度弥漫性损失。[7]淋巴细胞的密集聚集体与脂肪组织周围的巨噬细胞混合。[8]胃粘膜内主细胞和顶细胞轻度多灶性液泡变性。(图5d)血清化学和血细胞计数。(图5e,图5f)在单次腹膜内注射irf5/ikkβnp后4或8天血清il-6(图5e)和tnf-α(图5f)细胞因子的luminex测定测量。
[0025]
图6a-6i.静脉内输注的irf5/ikkβ纳米颗粒可控制肺部的肿瘤转移。(图6a)在腹膜内施用后巨噬细胞靶向的irf5/ikkβnp的体内生物分布。在单次静脉注射含50μg mrna的纳米颗粒后24小时,通过qpcr测量密码子优化的mrna。(图6b-6h)经由尾静脉向c57bl/6患白化病的小鼠注射1
×
106个表达b16f10萤火虫荧光素酶的黑素瘤细胞,以建立肺转移。在7天后,将动物随机分为irf5/ikkβnp处理组、对照gfp np组或pbs对照。(图6b)时间线和给药方案。(图6c)健康肺(左图)和b16f10肿瘤浸润的肺(右图)的共聚焦显微镜检查。浸润性巨噬细胞群体发出绿色荧光。(图6d)依序生物发光肿瘤成像。(图6e)每个处理组的卡普兰-迈耶存活曲线。ms指示中值存活期。使用对数秩检验进行统计分析,并且p《0.05被认为是显著的。(图6f)在处理2周后代表每个组的含b16f10黑素瘤转移的肺的代表性照片(上排)和显微照片。(图6g)肺肿瘤病灶的计数。(图6h)来自每个处理组的支气管肺泡灌洗液中单核细胞/巨噬细胞群体的表型表征。(图6i)抑制性和活化的巨噬细胞的相对百分比的总结。
[0026]
图7a-7f.巨噬细胞重编程改善神经胶质瘤的放射疗法的效果。(图7a)在诱导后第21天rcas-pdgf-b/nestin-tv-a;ink4a/arf-/-;pten-/-转基因小鼠中在pdgfβ驱动的神经胶质瘤起始后的t2 mri扫描和组织学染色。(图7b)浸润神经胶质瘤边缘的cd68+tam的共聚焦显微术。比例尺300μm。(图7c)健康脑组织对比神经胶质瘤中巨噬细胞(f4/80+,cd11b+)群体的流式细胞术分析。(图7d-7e)作为单一疗法(图7d)或与脑肿瘤放射疗法组合(图7e)接受irf5/ikkβ处理的具有已建立的神经胶质瘤的小鼠的卡普兰-迈耶存活曲线。时间线和给药方案在顶部示出。ms,中值存活期。使用对数秩检验进行统计分析,并且p《0.05被认为是统计上显著的。(图7f)肿瘤进展的依序生物发光成像。
[0027]
图8a-8e.编码人irf5/ikkβ的携带ivt mrna的纳米颗粒使人巨噬细胞高效地重编程。(图8a)用于将人thp-1单核细胞系分化成抑制性m2样巨噬细胞的时间线和培养条件。(图8b)在24孔中培养并用所指示浓度的携带人irf5/ikkβmrna对比对照gfp mrna的np转染的m2分化的thp1-lucia细胞的生物发光成像。在转染后24小时使用quanti-luc测定irf诱导的lucia荧光素酶的水平。(图8c)生物发光计数的总结。(图8d-8e)il-1β细胞因子分泌(图8d)和m1-巨噬细胞标志物cd80的表面表达(图8e)的差异。
[0028]
图9.实施例1中描述的骨髓样和淋巴样免疫分型小组中使用的抗体的列表。
[0029]
图10a,10b.t细胞促成通过巨噬细胞编程纳米颗粒实现的抗肿瘤作用。(10a)纳米颗粒介导的巨噬细胞编程增加t细胞募集至肿瘤病灶中。显示的是肠系膜中id8卵巢癌细胞的腹膜转移的代表性共聚焦图像。在6次每两周腹膜内注射pbs或irf5/ikkβnp(50μgmrna/剂量)后收集组织并针对指定的淋巴细胞和骨髓标志物进行染色(a,c)。tu=肿瘤,mes=肠系膜。比例尺:100μm。(10b)使用halo
tm
图像分析软件显示每种表型标志物的荧光信号的盒形图。n=5。盒代表平均值,并且盒中的线代表中值。盒中的条形显示最小值和最大值。晶须
代表95%置信区间。n=5个生物学独立的样品。
[0030]
图11.支持本公开的示例性序列。
[0031]
图12.带有相关注释的蛋白质/编码序列配对。
具体实施方式
[0032]
巨噬细胞是大量浸润癌性组织的关键免疫效应细胞。然而,在免疫抑制性肿瘤环境中,它们经历从活化的杀肿瘤状态到免疫抑制性表型的转变,这促进肿瘤生长和转移。这些肿瘤相关的免疫抑制巨噬细胞(tam)与不良预后相关(komohara y等人(2014)cancer science105(1):1-8)。它们诱导血管生成、淋巴生成和基质重塑。它们还在通过分泌酶纤溶酶、upa、基质金属蛋白酶(mmp)和组织蛋白酶b来促进肿瘤侵袭和转移中起关键作用(komohara,y等人(2016)advanced drug delivery reviews 99:180-185;gocheva v等人(2010)genes dev 24:241-255;wang r等人(2011)lung cancer 74:188-196)。除了介导肿瘤生长和进展外,tam还可与其他免疫细胞相互作用,并且抑制先天性和适应性抗肿瘤免疫应答。
[0033]
若干小分子药物致力于通过靶向参与细胞募集或扩增的途径(即csf-1/csf-1r途径的抑制剂)(pyon;teck等人nat med 19,1264-1272(2013);tap等人n engl j med 373,428-437(2015))或ccl2途径(nywening,等人lancet oncol 17,651-662(2016))来阻断tam前体细胞定位至肿瘤。这些方法需要重复全身暴露于大剂量的小分子药物。此外,这些药物的临床试验显示,除非将它们与细胞减灭疗法组合使用,否则反应较低。nywening,等人lancet oncol 17,651-662(2016);butowski等人neuro oncol 18,557-564(2016)。此外,这些小分子方法不能积极地促进巨噬细胞抗肿瘤活性。
[0034]
常规纳米载体如脂质体已与双膦酸盐或其他抗增殖剂一起配制,以全身性地破坏肿瘤内的巨噬细胞(即氯膦酸二钠脂质体(liposomal-clodronate))(fritz等人,front immunol 5,587(2014))。溶瘤病毒也已用于递送sirna,以使肿瘤内的免疫逃避途径沉默,并间接促进tam的吞噬作用。(chao等人,curr opin immunol 24,225-232(2012))。然而,使用这些方法破坏的巨噬细胞自然地被新出现的巨噬细胞替代,所述新出现的巨噬细胞类似地变得免疫抑制性。
[0035]
已经开发出用于诱导tam的功能活化的抗体。这些方法利用抗体来靶向肿瘤内的限定抗原类型。mantovani,等人,nat rev clin oncol(2017)然而,这些抗体的成功受到它们的低肿瘤渗透和不均匀分布的限制。thurber等人,adv drug deliv rev 60,1421-1434(2008)。它们也没有解决缺乏由抗体靶向的抗原的肿瘤逃逸变体。
[0036]
如本文所公开的,所描述的方法中没有一种直接且有效地使tam编程或重编程来保持或成为活化的杀肿瘤巨噬细胞。本文公开的系统和方法是显著创新的,因为它们允许tam的重编程以成为清除肿瘤的巨噬细胞,同时减少促进肿瘤的tam负担。当前,其他方法均不允许医师为了这些治疗目的合理地使tam重编程。mantovani等人,nat rev clin oncol(2017);gabrilovich和nagaraj,nat rev immunol 9,162-174(2009)。这本身可在肿瘤的治疗中提供治疗益处。事实上,本文公开的方法的功效已在卵巢癌、黑素瘤和成胶质细胞瘤模型中得到证实。更具体地,输注用编码干扰素调控因子5(irf5)的核苷酸与其活化激酶ikkβ的组合配制的纳米颗粒使tam的免疫抑制性肿瘤支持状态逆转,并且将它们重新编程
为诱导抗肿瘤免疫的表型并促进肿瘤消退。
[0037]
一个令人感兴趣的观察结果是,t细胞促成通过巨噬细胞编程纳米颗粒实现的抗肿瘤作用。事实上,在所有irf5/ikkβ纳米颗粒处理的动物中都发现了围绕赘瘤的多灶致密宿主t细胞簇,从而表明免疫刺激性巨噬细胞的遗传编程可恢复淋巴细胞迁移和浸润到实体瘤中(np使t细胞浸润到肿瘤平均增加10.6倍(cd8)和3.5倍(cd4);参见图10a、10b)。
[0038]
然而,因为被募集至肿瘤中的大多数t细胞缺乏将结合肿瘤部位的癌症抗原的治疗上相关的t细胞受体,所以本公开提供了使用纳米颗粒,所述纳米颗粒递送编码巨噬细胞编程转录因子和t细胞重定向大分子(如双特异性抗体)的核苷酸以进一步活化先天性和适应性免疫细胞(图1c所示)。
[0039]
与现有双特异性分子技术相比的一个关键优势是这些分子由tam直接分泌并且因此在肿瘤病灶内达到最高浓度(从而使全身暴露最小化)。鉴于双特异性抗体的快速清除率(例如,在人血清中2小时),常规双特异性抗体疗法需要通过连续静脉输注施用,并且与剂量限制性毒性相关。这种方法在治疗实体瘤方面几乎没有临床成功,所述实体瘤被保护免于髓源性抑制细胞的t细胞攻击。使用本公开中描述的方法,医生可在体内对单核细胞/巨噬细胞进行遗传修饰,以(1)将另外的免疫细胞募集至肿瘤部位;(2)在所述肿瘤部位保持活化,从而向其他免疫细胞提供持续刺激信号;以及(3)分泌结合所述肿瘤部位的癌症抗原并且还结合并活化募集的免疫细胞以破坏所结合的癌细胞的多特异性免疫细胞衔接分子。重要的是,这种疗法在肿瘤内起作用,这与现有的可破坏免疫稳态的组合疗法形成对比。
[0040]
特定实施方案利用纳米颗粒来为细胞提供编码活化调控因子如转录因子(例如,干扰素调控因子(irf))和/或激酶(例如,ikkβ)的核苷酸编码基因。这些活化调控因子调控巨噬细胞极化。巨噬细胞极化是高度动态的过程,通过所述过程巨噬细胞的生理活性发生变化。如所指出的,在大多数肿瘤中,tam表现出免疫抑制表型,其可以是“m2”表型。相比之下,活化的巨噬细胞可表现出“m1”表型,其导致肿瘤细胞杀伤。本文公开的特定实施方案将促进肿瘤的tam的极化逆转为杀伤肿瘤的巨噬细胞。本文公开的特定实施方案对单核细胞进行遗传修饰,以在稍后分化为巨噬细胞后维持活化状态,使得所述巨噬细胞不会在肿瘤部位受到免疫抑制。这些作用通过诱导炎症性细胞因子、活化其他免疫细胞和吞噬肿瘤细胞来改善肿瘤内的免疫抑制环境。
[0041]“巨噬细胞活化”是指将巨噬细胞的表型或功能(i)从失活状态改变为活化的状态;(ii)从非活化状态为活化的状态;(iii)从活化的状态改变为更活化的状态;或(iv)从失活状态改变为非活化状态的过程。失活状态是指促进肿瘤生长和转移的免疫抑制表型。非活化状态意味着巨噬细胞既不促进肿瘤生长或转移,也不促进肿瘤细胞杀伤。活化是指巨噬细胞表现出杀肿瘤活性。在特定实施方案中,活化的状态产生m1表型,如下文更全面地描述。在特定实施方案中,失活状态产生m2表型,也如下文更全面地描述。
[0042]
在特定实施方案中,所公开的系统和方法的一个益处是患者可免于全身毒性,因为由治疗诱导的炎症仍位于治疗部位。为了实现这一益处,局部输注的纳米颗粒靶向肿瘤环境中的tam,递送选择性地对控制巨噬细胞极化的信号传导途径进行重编程的核苷酸,并且通过生理途径局部可完全降解(sahin等人,nat rev drug discov 13,759-780(2014))。本文所述的纳米颗粒也可静脉内施用,其中它们可被血流中的单核细胞摄取。
[0043]
在实体瘤中实现外源性核苷酸的高表达在体内具有挑战性。在当前公开之前,基
于病毒或常规纳米载体如脂质体的核苷酸递送系统受到它们在肿瘤组织内的受限扩散的限制。jain和stylianopoulos,nat rev clin oncol 7,653-664(2010)。为了回避此障碍,特定实施方案利用扩散性增强的纳米颗粒(本文中也称为np),以使得所述np将核苷酸递送至肿瘤内的大量tam。特定实施方案利用大小<130nm的np,所述np携带中性表面电荷。
[0044]
特定实施方案还可任选地包括附着于np表面的靶向配体。例如,巨噬细胞甘露糖受体1(mrc1),也称为cd206,是由巨噬细胞表达的i型跨膜蛋白。cd206在tam中也显示出高表达水平。因此,在特定实施方案中,可将二-甘露糖附着于np表面,从而能够更选择性地靶向tam细胞表面上表达的甘露糖受体(cd206)。对于关于cd206结合和靶向配体的更多信息,参见zhang等人,nature communications,10,3974(2019)。可靶向的其他tam细胞表面受体包括早期生长应答蛋白2(egr2)、cd163、cd23、白介素(il)27ra、clec4a、cd1a、cd1b、cd11b、cd14、cd16、cd31、cd93、cd115、cd192、cd226、il13-ra1、il-4r、il-1r ii型、诱饵il-1r ii型、il-10r、巨噬细胞清道夫受体a和b、ym-1、ym-2、低密度受体相关蛋白1(lrp1)、il-6r、cxcr1/2、cx3cr1、cxcr3、cxcr4和pd-l1。
[0045]
在特定实施方案中,本文公开的系统和方法包括向有需要的受试者施用纳米颗粒。所述纳米颗粒针对血流中的单核细胞和/或存在于受试者肿瘤中的巨噬细胞,并且被设计为被所述单核细胞/巨噬细胞内化。一旦被内化,所述纳米颗粒便进一步递送一种或多种具有编码irf5和ikkβ的序列的核苷酸。所述一种或多种核苷酸修饰单核细胞/巨噬细胞以表达irf5和ikkβ。不受理论的束缚,ikkβ激酶通过磷酸化活化irf5转录因子。活化的irf5然后引起i型干扰素(ifn)基因、炎症性细胞因子(包括肿瘤坏死因子(tnf)、il-6、il-12和il-23)以及肿瘤抑制因子的表达。在已经内化了一种或多种编码irf5和ikkβ的核苷酸的m2巨噬细胞中,上述基因通过irf5作用的表达导致巨噬细胞从m2表型向m1表型的表型或功能转变,这使巨噬细胞能够杀伤或以其他方式触发肿瘤细胞的破坏,从而治疗癌症。在特定实施方案中,通过吞噬作用将纳米颗粒内化在单核细胞/巨噬细胞中。在特定实施方案中,通过配体介导的内吞作用(例如cd-206介导的内吞作用)将纳米颗粒内化在单核细胞/巨噬细胞中。在特定实施方案中,将包括irf5和ikkβ基因的纳米颗粒递送至巨噬细胞中可包括例如(1)结合至巨噬细胞,(2)巨噬细胞对纳米颗粒的内化,(3)在内化后从胞吞小泡逃逸至细胞质中,(4)释放一种或多种核苷酸,(5)可转运至巨噬细胞的细胞核中,以及(6)转录以递送用于表达irf5和ikkβ的基因。
[0046]
如前所指示,本文公开的系统内的纳米颗粒另外对单核细胞/巨噬细胞进行遗传修饰,以产生和分泌双特异性免疫细胞活化分子。这种方法在图1c中进行了描绘,其中具有编码转录因子和双特异性抗体的核苷酸的纳米颗粒被包封在带正电荷的核心内。在图1c所描绘的方法中,纳米颗粒被血流内的单核细胞吸收。这些单核细胞然后离开血流并到达肿瘤部位。基于纳米颗粒摄取,所述细胞表达进入细胞核并允许创建或维持活化巨噬细胞状态的转录因子。活化巨噬细胞状态将免疫细胞吸引至肿瘤部位,在所述肿瘤部位它还分泌双特异性抗体。所述双特异性抗体结合所述肿瘤部位的癌症抗原,以及募集的免疫细胞上的活化表位。
[0047]
转化生长因子β(tgf-β)家族的蛋白质因子参与多种不同细胞和组织类型以及正常和病理过程的不同阶段的多种调控途径。在癌症中,tgf-β是被发现在实体瘤中出于高水平的多效细胞因子。tgfβ在肿瘤微环境中诱导调控性t细胞(tregs)并抑制cd8+和th1细胞,
从而驱动免疫功能障碍。参见例如,ravi等人,nature communications9,741(2018)。因此,本文公开的特定实施方案减少或中和肿瘤微环境中的tgf-β。例如,本文所述的纳米颗粒可递送编码tgfβ抑制剂如tgfβ抗体的核苷酸。
[0048]
现在如下用额外的细节和选项描述本公开的方面:(1)巨噬细胞和巨噬细胞表型;(2)影响巨噬细胞极化的细胞途径;(3)靶向抗原和相关结合结构域;(4)免疫细胞活化表位和相关结合结构域;(5)双特异性分子形式;(6)tgfβ抑制剂;(7)核苷酸;(8)纳米颗粒;(9)用于施用的组合物;(10)使用方法;(11)示例性实施方案;(12)实验性实施例;和(13)结束段落。这些标题不限制对本公开的解释,并且仅出于组构目的而提供。
[0049]
(1)巨噬细胞和巨噬细胞表型。“巨噬细胞”是指免疫系统的从骨髓来源的单核细胞分化的白细胞。巨噬细胞的特征在于它们的吞噬活性和它们的抗原呈递能力。巨噬细胞是先天性和适应性免疫应答两者的关键参与者。在表型上,巨噬细胞表达表面标志物f4/80(ly71),并且也可表达其他表面标志物,如cdllb(macl)、cdllc、cd14、cd40或cd68。
[0050]
巨噬细胞通过活化t淋巴细胞在先天性和适应性免疫两者中起重要作用。在癌症中,巨噬细胞是与实体瘤相关的浸润性白细胞的主要群体之一(gordon s和taylor pr(2005)nature reviews immunology5(12):953-964)。它们可从周围组织或通过趋化分子的分泌被肿瘤本身募集至肿瘤部位。巨噬细胞根据它们的表型以极化方式参与对肿瘤的免疫应答。“表型”在本文中用于指由于其基因型与环境的相互作用而产生的细胞的物理属性或生物化学特征,并且可包括细胞的功能。
[0051]
活化th1 t淋巴细胞的巨噬细胞提供炎症应答,并且通常被表示为具有m1极化的或“经典活化”的表型。处于活化的状态的巨噬细胞(即m1巨噬细胞或具有m1表型的巨噬细胞)(也称为“杀伤巨噬细胞”)抑制细胞增殖、引起组织损伤、介导对病原体的抗性并具有强杀肿瘤活性。这些巨噬细胞可增加负责抗原呈递和共刺激的介体的表达;从而促进嗜中性粒细胞向肿瘤区域的浸润,使得嗜中性粒细胞靶向的肿瘤消退。与相关的对照条件相比,抗原呈递增加也可证明m1型。在特定实施方案中,可通过m1巨噬细胞产生活性氧物质(ros)和一氧化氮(no)来证明m1表型。no具有对于保护免受病原体和异常细胞(如肿瘤细胞)而言所必需的抗增殖作用。在特定实施方案中,m1表型可通过促炎性状态来证明,所述促炎状态通过产生细胞因子如il-12来诱导th1免疫。在特定实施方案中,处于活化的状态的巨噬细胞是可吞噬病原体的经典活化的巨噬细胞。
[0052]
除功能外,m1表型还可由巨噬细胞表达的表面标志物;巨噬细胞在极化时产生的因子、蛋白质或化合物;或巨噬细胞在极化时诱导的基因证明。m1极化可产生由cd80、cd86、inos、细胞因子信号传导抑制因子3(socs3)、tnfα、il-1、il-6、il-12、il-23、i型ifn、cxcl1、cxcl2、cxcl3、cxcl5、cxcl8、cxcl9和cxcl10的表达证明的表型。在特定实施方案中,m1表型包括cd80表达的增加。在特定实施方案中,m1表型包括cd206-、mhcii+、cd11c-和cd11b+。
[0053]
在另一方面,活化th2 t淋巴细胞的巨噬细胞提供抗炎应答,并且通常被表示为具有“m2”表型。处于失活状态的巨噬细胞(即m2巨噬细胞或具有m2表型的巨噬细胞)(也称为“修复巨噬细胞”)参与后生动物寄生虫遏制、细胞增殖、组织修复、肿瘤进展、抗炎途径和免疫抑制。与相关对照条件相比,m2表型可减少抗原呈递并减少吞噬作用。m2表型还可通过例如精氨酸酶1(arg1(精氨酸酶活性与促增殖作用和组织修复应答相关))、il-10、tgf-β、
pparγ、klf4、cd206(mrc1)、dectin-1(一种信号传导非tlr模式识别受体)、dc-sign(c型凝集素)、清道夫受体a、清道夫受体b-1、cd163(血红蛋白-触珠蛋白复合物的高亲和力清道夫受体)、趋化因子受体ccr2、cxcr1和cxcr2、ym1(几丁质酶3样3)和fizz1中的一者或多者的表达;以及趋化因子ccl17、ccl22和ccl24的分泌证明。在特定实施方案中,处于失活状态的巨噬细胞促进转移和/或对化学疗法的抗性。在特定实施方案中,m2表型包括cd206+、mhcii-、cd11c+和cd11b
低
。
[0054]
表1提供可用于区分m1表型与m2表型(包括指定为m2a、m2b、m2c和m2d的子表型)的标准的特定组合。
[0055]
表1.用于对巨噬细胞表型进行分类的示例性标准。
[0056][0057]
[0058]
改编自t(2015)mediators inflamm 2015,816460和duluc d等人(2007)blood 110:4319-4330。arg-1,精氨酸酶-1;fizz1,抵抗素样分子-α(retnl-α);gc,糖皮质激素;ic,免疫复合物;il1-ra,il-1受体拮抗剂;lif,白细胞抑制因子;tgm2,转谷氨酰胺酶2;tgf-β,转化生长因子-β;tnfα,肿瘤坏死因子α;tlr,toll样受体;mmr(cd206),巨噬细胞甘露糖受体;inos,诱导型一氧化氮合酶;sr,清道夫受体;socs3,细胞因子信号传导抑制因子3;vegf,血管内皮生长因子;ym1(也称为几丁质酶3样蛋白3(chi3l3))。
[0059]
用于评估巨噬细胞表型的分析可利用m1或m2表型特有的不同分子标签。m1巨噬细胞的普遍接受的标志物谱是cd80+,而m2巨噬细胞可被表征为cd163+。因此,可进行流式细胞术以评估这些标志物。也可通过测量il-12/il-10比率或cd163-/cd163+巨噬细胞比率的增加来评估将巨噬细胞驱动朝向m1类型且远离m2类型。在特定实施方案中,可通过光学显微术来评估m1对比m2形态。在特定实施方案中,吞噬作用测定可与其他测定结合使用以评估巨噬细胞是m1型还是m2表型。可通过将待吞噬的实体与巨噬细胞以与其每个细胞的标准化总表面积一致的浓度孵育来进行不同巨噬细胞群体的吞噬作用测定。可将待吞噬的实体添加至巨噬细胞培养物。待吞噬的实体可例如用荧光标记进行标记。吞噬作用指数可通过每个巨噬细胞测量的中值总荧光强度来确定。吞噬作用的定量可通过例如流式细胞术进行。也可使用肿瘤细胞杀伤测定。在特定实施方案中,m1表型包括标签m2巨噬细胞基因的表达降低,所述标签m2巨噬细胞基因包括serpinb2(尿激酶型纤溶酶原活化因子的抑制剂)、ccl2(c-c基序趋化因子配体2)、ccl11(c-c基序趋化因子配体11)和retnla(抵抗素样α;fizz1)。在特定实施方案中,m1表型包括m1分化基因(包括ccl5(c-c基序趋化因子配体5))的表达增加。
[0060]
基因表达(例如,cd80、cd86和/或上述其他基因的m1表达)可通过熟练的技术人员众所周知的测定来测量。用于测量基因表达的方法包括nanostring表达测定(nanostring technologies,inc.,seattle,wa)、rna印迹、斑点印迹、微阵列、基因表达系列分析(sage)、rna-seq和定量rt-pcr。用于测量基因表达产物(例如蛋白质水平)的方法包括elisa(酶联免疫吸附测定)、蛋白质印迹、facs、放射免疫测定(ria)、夹心测定、荧光原位杂交(fish)、免疫组织学染色、免疫电泳、免疫沉淀以及使用检测试剂(如抗体或蛋白质结合剂)的免疫荧光。
[0061]
本文公开的实施方案可用于遗传修饰吞噬细胞,如多形核嗜中性粒细胞、单核细胞、单核细胞源性巨噬细胞、组织驻留型巨噬细胞、上皮细胞、成纤维细胞和树突细胞。吞噬细胞可以是专职的或非专职的。专职吞噬细胞包括多形核中性粒细胞、单核细胞、单核细胞源性巨噬细胞和组织驻留型巨噬细胞。在特定实施方案中,专职吞噬细胞的主要功能是吞噬作用。非专职吞噬细胞包括所有其他可执行吞噬作用的细胞类型,但它不被认为是细胞的主要功能。非专职吞噬细胞的实例包括上皮细胞、成纤维细胞和树突细胞。对于有关专职和非专职吞噬细胞的更多信息,参见lim,grinstein,和roth,frontiers in cellular and infection microbiology,2017年5月,第7卷,第191条。
[0062]
(2)影响巨噬细胞极化的细胞途径。巨噬细胞朝向活化或失活表型的极化由巨噬细胞与许多不同分子或环境的相互作用引起。例如,m1巨噬细胞极化由包括toll样受体(tlr)配体(例如脂多糖(lps)、鼠李二肽、脂磷壁酸、咪喹莫特、cpg)、ifnγ、tnfα和巨噬细胞集落刺激因子(gm-csf)的刺激物触发。m2极化的巨噬细胞可根据引发极化的刺激物分为
no:30中所示的核苷酸序列编码。在特定实施方案中,鼠irf1包括seq id no:12中所示的氨基酸序列。在特定实施方案中,鼠irf1由seq id no:34中所示的核苷酸序列编码。在特定实施方案中,人irf8包括seq id no:11中所示的氨基酸序列。在特定实施方案中,人irf8由seq id no:33中所示的核苷酸序列编码。在特定实施方案中,鼠irf8包括seq id no:16中所示的氨基酸序列。在特定实施方案中,鼠irf8由seq id no:38中所示的核苷酸序列编码。
[0069]
irf3是irf1和irf2的同源物。它含有若干功能结构域,包括nes、dbd、c-末端irf缔合结构域和若干调控性磷酸化位点。发现irf3呈无活性的细胞质形式,其在丝氨酸/苏氨酸磷酸化后与creb结合蛋白(一种转录共活化因子)形成复合物。这种复合物易位至细胞核并活化ifn-α和-β以及其他干扰素诱导的基因的转录。在特定实施方案中,人irf3的同种型包括同种型1(uniprot登录号q14653-1)、同种型2(uniprot登录号q14653-2)、同种型3(uniprot登录号q14653-3)、同种型4(uniprot登录号q14653-4)和同种型5(uniprot登录号q14653-5)。在特定实施方案中,人irf3同种型1包括seq id no:9中所示的氨基酸序列。在特定实施方案中,人irf3同种型1由seq id no:31中所示的核苷酸序列编码。在特定实施方案中,鼠irf3包括seq id no:13中所示的氨基酸序列。在特定实施方案中,鼠irf3由seq id no:35中所示的核苷酸序列编码。
[0070]
已经显示irf7在i型ifn基因的转录活化中起作用。在特定实施方案中,人irf7的同种型包括同种型a(uniprot登录号q92985-1)、同种型b(uniprot登录号q92985-2)、同种型c(uniprot登录号q92985-3)和同种型d(uniprot登录号q92985-4)。在特定实施方案中,人irf7同种型a包括seq id no:10中所示的氨基酸序列。在特定实施方案中,人irf7同种型a由seq id no:32中所示的核苷酸序列编码。在特定实施方案中,鼠irf7包括seq id no:14中所示的氨基酸序列。在特定实施方案中,鼠irf7由seq id no:36中所示的核苷酸序列编码。
[0071]
也可使用有助于irf活化的一种或多种irf突变体。例如:irf5的人变体3/变体4的拟磷酸突变体(同种型4,seq id no:4),其用模拟磷酸化的残基(如天冬氨酸残基)取代氨基酸残基s425、s427、s430、s436(chen w等人(2008)nat struct mol biol.15(11):1213
–
1220);irf5的人变体5的拟磷酸突变体(同种型2,seq id no:2),其用模拟磷酸化的残基(如天冬氨酸残基)取代氨基酸残基t10、s158、s309、s317、s451和/或s462(chang foreman h-c等人下文);irf5同种型a(变体1,同种型3,seq id no:3)和同种型b(变体2,同种型1,seq id no:1)残基s156、s158和t160突变为模拟磷酸化的残基,如天冬氨酸残基,用于irf5的组成型核聚集(lin r等人(2005)j biol chem 280(4):3088-3095);以及irf3拟磷酸酶突变体,其用模拟磷酸化的残基如天冬氨酸取代irf3的氨基酸残基s396(chen w等人,见下文)。在特定实施方案中,鼠irf7/irf3的融合蛋白在irf3缔合结构域中的四个丝氨酸和一个苏氨酸残基处包括asp(d)突变(seq id no:15),从而赋予融合蛋白的组成型活化和易位(lin r等人(1998),见上文;lin等人(2000)molecular and cellular biology 20:6342-6353)。在特定实施方案中,在irf3缔合结构域中的四个丝氨酸和一个苏氨酸残基处包括d突变的鼠irf7/irf3的融合蛋白由seq id no:37。在特定实施方案中,鼠irf8突变体包括在氨基酸残基310的赖氨酸(k)被精氨酸(r)取代(seq id no:17)。在特定实施方案中,包括在氨基酸残基310处的k被r取代的鼠irf8突变体由seq id no:39。主要在k310与irf8结合的小泛素样修饰因子(sumo)抑制irf8应答基因的活化。sentrin特异性蛋白酶1(senp1)靶向
sumo 2/3。senp1的活性使irf8(和其他蛋白质)“脱sumo化”,并且导致irf8从m1巨噬细胞分化的阻遏因子变成活化因子(直接和通过反式活化活性)。通过k310残基的突变防止sumo与irf8的结合使irf8特异性基因转录增加2-5倍(参见chang t-h等人(2012),见上文)。
[0072]
本公开的特定实施方案包括工程改造的irf转录因子。在特定实施方案中,工程改造的irf转录因子包括缺乏功能性自抑制结构域的irf,并且因此对反馈失活不敏感(thompson等人(2018)front immunol 9:2622)。例如,可通过缺失人irf5蛋白的aa 489-539来获得活性增加2至3倍的人irf5(barnes等人(2002)mol cell biol 22:5721-5740)。在特定实施方案中,在治疗自身免疫性疾病的情况下,irf4的自抑制结构域(一种促进m2表型的转录因子)可缺失或突变以产生更具活性的irf4。在特定实施方案中,在irf蛋白的羧基末端发现irf的自抑制结构域。在特定实施方案中,工程改造的irf转录因子包括缺乏一个或多个功能性核输出信号(nes)以将irf截留在细胞核中并因此增强转录的irf。例如,可通过用丙氨酸取代两个亮氨酸残基(l157a/l159a)来使人irf5的nes突变而实现人irf5的核聚集(lin等人(2000)molecular and cellular biology 20:6342-6353)。在特定实施方案中,工程改造的irf转录因子包括一种或多种irf的融合物、一种或多种irf的片段的融合物以及突变的irf的融合物。
[0073]
nfκb也是与巨噬细胞m1活化有关的关键转录因子。nfκb调控大量炎症基因,包括tnfα、il1b、环氧合酶2(cox-2)、il-6和il12p40的表达。经由活化κb激酶(ikk)三聚体复合物(两种激酶ikkα、ikkβ和调控蛋白ikkγ)的抑制剂来调节nfκb活性。当上游信号在ikk复合物处汇聚时,它们首先经由磷酸化活化ikkβ激酶,并且活化的ikkβ进一步磷酸化抑制性分子,即κb(i-κb)的抑制剂。这导致i-κb的蛋白酶体降解和从nfκb/i-κb复合物释放nfκbp65/p50异二聚体。nfκb p65/p50异二聚体然后易位至细胞核,并与炎症基因的启动子结合。
[0074]
ikkβ是nfκb以及其他转录因子(如irf5)的活化激酶。ikkβ类似地磷酸化若干其他信号传导途径组分,包括foxo3、ncoa3、bcl10、irs1、nemo/ikbkg、nfκb亚基rela和nfkb1以及ikk有关的激酶tbk1和ikbke。在特定实施方案中,人ikkβ的同种型包括同种型1(uniprot登录号o14920-1,seq id no:18)、同种型2(uniprot登录号o14920-2 seq id no:19)、同种型3(uniprot登录号o14920-3 seq id no:20)和同种型4(uniprot登录号o14920-4 seq id no:21)。在特定实施方案中,人ikkβ的同种型包括由seq id no:40中所示的核苷酸序列编码的同种型1、由seq id no:41中所示的核苷酸序列编码的同种型2、由seq id no:42中所示的核苷酸序列编码的同种型3以及由seq id no:43中所示核苷酸序列编码的同种型4。在特定实施方案中,鼠ikkβ包括seq id no:22中所示的氨基酸序列。在特定实施方案中,鼠ikkβ由seq id no:44中所示的核苷酸序列编码。
[0075]
如所示,缺氧也通过缺氧诱导型因子hif-1α和hif-2α影响巨噬细胞极化。hif-1α调控nos2表达并支持m1表型的出现,而hif-2α调控arg1表达并支持m2表型的出现(takeda n等人(2010)genes dev24:491-501)。
[0076]
表2.参与巨噬细胞极化的信号传导分子和基因。
[0077][0078][0079]
改编自sica a和mantovani a 2012(见上文)以及ch
á
vez-gal
á
n l等人(2015)front immunol 6,253。arg-1,精氨酸酶-1;fizz1,抵抗素样分子-α(retnl-alpha);stat,信号转导子和转录活化子因子;irf,干扰素调控因子;socs3,细胞因子信号传导抑制因子3;btk,布鲁顿酪氨酸激酶;hif-1α,缺氧诱导因子1;klf-4,kr
ü
ppel样因子4;tnfα,肿瘤坏死因子-α;bmp-7,骨形态发生蛋白7;p2y(2)r,p2y嘌呤受体2;pparγ,过氧化物酶体增殖物活化受体γ;nfκb,核因子κb;fabp4,脂肪酸结合蛋白4;lxrα;肝x受体α。
[0080]
本公开提供irf转录因子与一种或多种分子的共表达,所述一种或多种分子可活化irf以实现tam重编程为活化的状态以杀伤肿瘤。在特定实施方案中,共表达策略包括:irf5和ikkβ的共表达;irf5和tank结合激酶1(tbk-1)、tnf受体相关因子6(traf6)衔接子、受体相互作用蛋白2(rip2)激酶和/或nfκb激酶-ε(ikkε)的共表达(chang foreman h-c等人(2012)plos one 7(3):e33098);irf5和蛋白激酶dna-pk的共表达(ryzhakov g等人(2015)j of interferon&cytokine res 35(2):71-78);irf5和蛋白激酶酪氨酸激酶bcr-abl的共表达(massimo m等人(2014)carcinogenesis 35(5):1132
–
1143);以及irf5或irf8与cop9信号体的一种或多种组分的共表达(korczeniewska j等人(2013)mol cell biol 33(6):1124
–
1138;cohen h等人(2000)j biol chem 275(50):39081
–
39089)。
[0081]
(3)靶向抗原和相关结合结构域。如本文所用,抗原是指由目标细胞类型表达的蛋白质。目标细胞或目标细胞类型包括能够被免疫系统识别和破坏的任何预定义的细胞类型。在一些实施方案中,本发明中的目标细胞类型是对受试者的健康、活力或福祉具有不利、有害或其他不希望的影响(或倾向于具有这种影响)的细胞类型。目标细胞可包括,例如,(i)癌性或被病原体如病毒感染的真核细胞,和(ii)原核细胞,如某些细菌、真菌或酵母。目标细胞还包括可能有害和/或引起自身免疫的自身反应性细胞。此类目标自身反应性细胞包括,例如,自身反应性免疫细胞、自身反应性淋巴细胞、自身反应性t细胞、自身反应性b细胞。目标自身反应性细胞还可以是在发育过程中进行编程以控制免疫应答的自身反应性细胞,如调控性t细胞。自身反应性细胞有例如通过识别和结合不适当的自身抗原而助于受试者的自身免疫状况。在一些实施方案中,当在局部或循环细胞群体中过度代表时可能有害的细胞类型可以是根据本发明的目标细胞类型。例如,炎症反应可产生免疫细胞的过度代表,在这种情况下,目标细胞可包括例如嗜中性粒细胞或肥大细胞。此外,在一些情
况下,目标细胞可以是先前作为治疗的一部分施用的细胞,例如,经遗传修饰的细胞(例如,表达嵌合抗原受体(car)的细胞)。
[0082]
在特定实施方案中,抗原优先由目标细胞表达。“优先表达”是指与其他细胞类型相比,抗原被发现在目标细胞上出于更高水平。在一些情况下,抗原仅由目标细胞表达。在其他情况下,与在其他细胞类型上相比,抗原在目标细胞上表达多至少25%、35%、45%、55%、65%、75%、85%、95%、96%、97%、98%、99%或100%。
[0083]
以下提供了与不同癌症类型相关的癌细胞抗原的实例:
[0084][0085][0086]
癌细胞抗原的示例性结合结构域包括可从头产生或源自已知抗体或对所选癌症抗原具有特异性的结合结构域。
[0087]
上皮细胞粘附分子(epcam;也称为egp-40、trop-1、17-1a、ksa、ks1/4、aua1、ga733-2和cd326)在某些癌症(包括卵巢癌)中过表达。它是40kd的表面糖蛋白,具有带有两个egf样重复序列的细胞外结构域。靶向epcam的抗体是可商购的(richter等人,
am.j.obstet.gynecol.2010,203(6):582.e1-582e7)。结合epcam的示例性抗体包括mt201(阿德木单抗)和依决洛单抗。
[0088]
酪氨酸相关蛋白1或gp75糖蛋白(tyrp1/gp75)是参与恶性黑素细胞和黑素瘤进展的黑素体蛋白(ghanem等人,mol.oncol.2011april;5(2):150-155)。结合tyrp1/gp75的示例性抗体包括ta99(sa enger,等人,cancer research,68(23):9884-9891,2008)、20d7(pat el,等人,ios press,16(3-4):127-1036,2007)和夫兰妥单抗(imc-20d7s)(khalil,等人,clinical cancer research,22(21):5204-5210,2016。
[0089]
在特定实施方案中,结合tyrp1/gp75的抗体描述于us7951370中。在特定实施方案中,结合tyrp1/gp75的抗体包括包含rasqsvssyla(seq id no:84)的cdrl1序列、包含dasnrat(seq id no:85)的cdrl2序列、包含qqrsnwlmyt(seq id no:253)的cdrl3序列、包含gytftsyamn(seq id no:254)的cdrh1序列、包含wintntgnptyaqgftg(seq id no:255)的cdrh2序列和包含ryssswyldy(seq id no:256)的cdrh3序列。
[0090]
在特定实施方案中,结合tyrp1/gp75的抗体包括包含rasgniynyla(seq id no:257)的cdrl1序列、包含daktlad(seq id no:258)的cdrl2序列、包含qhfwslpft(seq id no:259)的cdrl3序列、包含gfnikdyflh(seq id no:260)的cdrh1序列、包含winpdngntvydpkfqg(seq id no:261)的cdrh2序列和包含dytyekaaldy(seq id no:262)的cdrh3序列。
[0091]
在特定实施方案中,tyrp1/gp75结合抗体包含:包含序列
[0092]
eivltqspatlslspgeratlscrasqsvssylawyqqkpgqaprlliydasnratgiparfsgsgsgtdftltisslepedfavyycqqrsnwlmytfgqgtkleik(seq id no:263)的可变轻链和包含序列
[0093]
qvqlvqsgselkkpgasvkisckasgytftsyamnwvrqapgqglecmgwintntgnptyaqgftgrfvfsmdtsvstaylqisslkaedtaiyycapryssswyldywgqgtlvtvss(seq id no:264)的可变重链或包含序列
[0094]
qvqlvqsgselkkpgasvkisckasgytftsyamnwvrqapgqglesmgwintntgnptyaqgftgrfvfsmdtsvstaylqisslkaedtaiyycapryssswyldywgqgtlvtvss(seq id no:265)的可变重链。
[0095]
具有结合间皮素的结合结构域的示例性抗体包括雷星-阿奈妥单抗、阿麦妥昔单抗和hn1。
[0096]
在特定实施方案中,hn1抗体包括包含rasegiyhwla(seq id no:55)的cdrl1序列、包含kasslas(seq id no:58)的cdrl2序列、包含qqysnyplt(seq id no:61)的cdrl3序列、包含tyymq(seq id no:64)的cdrh1序列、包含vinpsgvtsyaqkfqg(seq id no:71)的cdrh2序列和包含walwgdfgmdv(seq id no:73)的cdrh3序列。
[0097]
us8206710描述了间皮素结合抗体,所述间皮素结合抗体包含:包含序列
[0098]
mgwsciilflvatatgvhsdieltqspaimsaspgekvtmtcsasssvsymhwyqqksgtspkrwiydtsklasgvpgrfsgsgsgnsysltissveaeddatyycqqwskhpltfgsgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:79)的可变轻链,
[0099]
和包含序列
[0100]
mgwsciilflvatatgvhsqvqlqqsgpelekpgasvkisckasgysftgytmnwvkqshgkslewiglitpyngassynqkfrgkatltvdkssstaymdllsltsedsavyfcarggydgrgfdywgsgtpvtvssastkgp
svfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk*(seq id no:112)的可变重链;
[0101]
以及抗体,所述抗体具有包含序列mgwsciilflvatatgvhseivltqspatlslspgeratlscsasssvsymhwyqqkpgqaprlliydtsklasgvparfsgsgsgtdftltisslepedfavyycqqwskhpltfgsgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:113)的可变轻链,
[0102]
和包含序列
[0103]
mgwsciilflvatatgvhsqvqlvqsgaevkkpgasvkvsckasgysftgytmnwvrqapgqglewmglitpyngassynqkfrgrvtmtrdtststvymelsslrsedtavyycarggydgrgfdywgsgtpvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seq id no:114)的可变重链。
[0104]
us8911732、us7081518、us8357783和us8425904中描述了另外的间皮素结合抗体。
[0105]
muc16结合结构域可源自抗体奥戈伏单抗、欧伐瑞(ovarex)和阿巴伏单抗。us 7723485描述了muc16结合抗体,所述muc16结合抗体包含:包含序列
[0106]
diqmtqspsslsasvgdrvtitgrasqdvntavawyqqkpgkapklliysasflysgvpsrfsgsrsgtdftltisslqpedfatyycqqhyttpptfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:115)的可变轻链,
[0107]
和包含序列
[0108]
evqlvesggglvqpggslrlscaasgfnikdtyihwvhqapgkglewvariyptngytryadsvkgrftisadtskntaylqmnslraedtavyycsrwggdgfyamdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyignvnhkpsntkvdkkvepkscdkthtgppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seq id no:116)的可变重链。
[0109]
wo2016149368描述了muc16结合抗体,所述muc16结合抗体包含可变轻链,所述可变轻链包含:包含sediysg(seq id no:117)的cdrl1序列、包含gas的cdrl2序列、包含gysysstl(seq id no:118)的cdrl3序列、包含tlgmgvg(seq id no:119)的cdrh1序列、包含hiwwdddkyynpalks(seq id no:120)的cdrh2序列和包含igtaqatdaldy(seq id no:121)的cdrh3序列。
[0110]
叶酸受体结合抗体包括法勒珠单抗。在特定实施方案中,法勒珠单抗描述于us9133275中。在特定实施方案中,法勒珠单抗包含可变轻链,所述可变轻链包含:包含
kasqsvsfagtslmh(seq id no:122)的cdrl1序列、包含rasnlea(seq id no:123)的cdrl2序列和包含qqsreypyt(seq id no:124)的cdrl3序列;以及可变重链,所述可变重链包含:包含gyfmn(seq id no:125)的cdrh1序列、包含rihpydgdtfynqkfqg(seq id no:126)的cdrh2序列和包含ydgsramdy(seq id no:127)的cdrh3序列。us10101343b2、us8388972和us8709432中描绘了另外的folr结合抗体。
[0111]
示例性egfr抗体包括西妥昔单抗。在特定实施方案中,西妥昔单抗描述于us us7598350中。在特定实施方案中,西妥昔单抗包含可变轻链,所述可变轻链包含:包含rasqsvssyla(seq id no:84)的cdrl1序列、包含dasnrat(seq id no:85)的cdrl2序列、包含hqygstplt(seq id no:130)的cdrl3序列、包含sgdyyws(seq id no:131)的cdrh1序列、包含yiyysgstdynpslks(seq id no:132)的cdrh2序列和包含vsifgvgtfdy(seq id no:133)的cdrh3序列。
[0112]
us7247301、us7723484、us7132511和us5844093中描述了另外的egfr结合结构域。us7723484特别描述了egfr结合抗体,所述egfr结合抗体包含包含序列
[0113]
eivltqspdfqsvtpkekvtitcrasysigtnihwyqqkpdqspkllikyasesisgvpsrfsgsgsgtdftltinsleaedaatyycqqnnnwpttfgggtkveik(seq id no:134)的可变轻链,
[0114]
和包含序列
[0115]
qvtlkesgpvlvkptetltltctvsgfslsnwdvhwirqppgkalewlaviwsggatdyntpfnsrltiskdtsksqvvltmtnmdpvdtatyycaraldyydynfaywgqgtmvtvss(seq id no:135)的可变重链。
[0116]
cd19结合结构域存在于抗体fmc63、sj25c1和hd37中。(sj25c1:bejcek等人cancer res 2005,pmid 7538901;hd37:pezutto等人ji 1987,pmid 2437199)。在特定实施方案中,fmc63 cdr包含:包含rasqdiskyln(seq id no:136)的cdrl1序列、包含srlhsgv(seq id no:137)的cdrl2序列、包含gntlpytfg(seq id no:138)的cdrl3序列、包含dygvs(seq id no:139)的cdrh1序列、包含vtwgsettyynsalks(seq id no:140)的cdrh2序列和包含yamdywg(seq id no:141)的cdrh3序列。
[0117]
对rori具有特异性的许多抗体是本领域技术人员已知的,并且可容易地针对序列、表位结合和亲和力进行表征。参见例如,wo2008076868、wo/2008103849、wo201008069、wo2010124188、wo2011079902、wo2011054007、wo2011159847、wo2012076066、wo2012076727、wo 2012045085和wo2012097313。
[0118]
结合ror1的抗体的特定实例包括r11、r12、2a2和y31。
[0119]
所述r11抗体包含:包含qasqsidsnla(seq id no:142)的cdrl1序列、包含rasnlas(seq id no:143)的cdrl2序列、包含lggvgnvsyrts(seq id no:144)的cdrl3序列、包含dypis(seq id no:145)的cdrh1序列、包含finsggstwyaswvkg(seq id no:146)的cdrh2序列和包含gystyycdfni(seq id no:147)的cdrh3序列。
[0120]
所述r12抗体包含:包含tlssahktdtid(seq id no:148)的cdrl1序列、包含gsytkrp(seq id no:149)的cdrl2序列、包含gadyiggyv(seq id no:150)的cdrl3序列、包含ayyms(seq id no:151)的cdrh1序列、包含tiypssgktyyatwvng(seq id no:152)的cdrh2序列和包含dsyaddgalfni(seq id no:153)的cdrh3序列。
[0121]
所述2a2抗体包含:包含kasqnvdaava(seq id no:154)的cdrl1序列、包含sasnryt(seq id no:155)的cdrl2序列、包含qqydiypyt(seq id no:156)的cdrl3序列、包含dyemh
(seq id no:157)的cdrh1序列、包含aidpetggtaynqkfkg(seq id no:158)的cdrh2序列和包含yydydsfty(seq id no:159)的cdrh3序列。
[0122]
所述y31抗体包含:包含qasqsigsyla(seq id no:160的cdrl1序列、包含yasnlas(seq id no:161)的cdrl2序列、包含lgslsnsdnv(seq id no:162)的cdrl3序列、包含shwms(seq id no:163)的cdrh1序列、包含iiaasgstyyanwakg(seq id no:164)的cdrh2序列和包含dygdyrlvtfni(seq id no:165)的cdrh3序列。
[0123]
her2结合结构域可源自4d5抗体。所述4d5抗体包含:包含rasqdvntavaw(seq id no:166)的cdrl1序列、包含ysasfles(seq id no:167)的cdrl2序列、包含qqhyttpt(seq id no:168)的cdrl3序列、包含sgfntkdtyihw(seq id no:169)的cdrh1序列、包含riyptngytryadsvkgr(seq id no:170)的cdrh2序列和包含wggdgfyamdv(seq id no:171)的cdrh3序列。
[0124]
pd-l1结合抗体包括3g10抗体和us 2016/0222117中描述的那些。在特定实施方案中,源自3g10抗体的结合结构域包含:包含rasqsvssyl(seq id no:172)的cdrl1序列、包含dasnrat(seq id no:85)的cdrl2序列、包含qqrsnwprt(seq id no:173)的cdrl3序列、包含dygfs(seq id no:174)的cdrh1序列、包含witayngntnyaqklqg(seq id no:175)的cdrh2序列和包含dyfygmdy(seq id no:176)的cdrh3序列。
[0125]
pd-l1结合结构域还可包含:包含rasqdvstava(seq id no:177)的cdrl1序列、包含sasflys(seq id no:178)的cdrl2序列、包含qqylyhpat(seq id no:179)的cdrl3序列、包含sgftfsdswih(seq id no:180)的cdrh1序列、包含wispyggstyyadsvkg(seq id no:181)的cdrh2序列和包含rhwpggfdy(seq id no:182)的cdrh3序列,或(ii)包含tgtssdvggynyvs(seq id no:183的cdrl1序列、包含dvsnrps(seq id no:184)的cdrl2序列、包含ssytssstrv(seq id no:185)的cdrl3序列、包含sgftfssyimm(seq id no:186)的cdrh1序列、包含siypsggitfyadtvkg(seq id no:187)的cdrh2序列和包含iklgtvttvdy(seq id no:188)的cdrh3序列。
[0126]
具有pd-l1结合结构域的另外抗体包括阿特珠单抗、阿维鲁单抗和德瓦鲁单抗。
[0127]
在特定实施方案中,抗原由受病毒感染的细胞表达。示例性病毒包括腺病毒、沙粒病毒、布尼亚病毒、冠状病毒、黄病毒、汉坦病毒、肝炎病毒、疱疹病毒、乳头瘤病毒、副粘病毒、细小病毒、微小核糖核酸病毒、痘病毒、正粘病毒、逆转录病毒、呼肠孤病毒、弹状病毒、轮状病毒、海绵状病毒或披膜病毒。在另外的实施方案中,病毒抗原包括由cmv、感冒病毒、爱泼斯坦-巴尔、流感病毒、甲型、乙型和丙型肝炎病毒、单纯疱疹病毒、hiv、流感、日本脑炎、麻疹、脊髓灰质炎、狂犬病、呼吸道合胞体、风疹、天花、水痘带状疱疹或西尼罗河病毒表达的肽。
[0128]
作为其他特定实例,冠状病毒抗原包括刺突(s)蛋白,巨细胞病毒抗原包括包膜糖蛋白b和cmv pp65;爱泼斯坦-巴尔抗原包括ebv ebnai、ebv p18和ebv p23;肝炎抗原包括乙型肝炎病毒的s、m和l蛋白、乙型肝炎病毒的前s抗原、hbcagδ、hbv hbe、丙型肝炎病毒rna、hcv ns3和hcv ns4;单纯疱疹病毒抗原包括即刻早期蛋白和糖蛋白d;hiv抗原包括gag、pol和env基因的基因产物,如hiv gp32、hiv gp41、hiv gp120、hiv gp160、hiv p17/24、hiv p24、hiv p55 gag、hiv p66 pol、hiv tat、hiv gp36、nef蛋白和逆转录酶;流感抗原包括血凝素和神经氨酸酶;日本脑炎病毒抗原包括蛋白e、m-e、m-e-ns1、ns1、ns1-ns2a和
80%e;麻疹抗原包括麻疹病毒融合蛋白;狂犬病抗原包括狂犬病糖蛋白和狂犬病核蛋白;呼吸道合胞病毒抗原包括rsv融合蛋白和m2蛋白;轮状病毒抗原包括vp7sc;风疹抗原包括蛋白质e1和e2;并且水痘带状疱疹病毒抗原包括gpi和gpii。关于病毒抗原的另外实例,参见fundamental virology,第二版,fields,b.n.和knipe,d.m.编著(raven press,new york,1991)。
[0129]
在特定实施方案中,抗原由与细菌感染相关的细胞表达。示例性细菌包括炭疽;革兰氏阴性杆菌、衣原体、白喉、流感嗜血杆菌、幽门螺杆菌、疟疾、结核分枝杆菌、百日咳毒素、肺炎球菌、立克次体、葡萄球菌、链球菌和破伤风。
[0130]
作为细菌抗原的特定实例,炭疽抗原包括炭疽保护性抗原;革兰氏阴性杆菌抗原包括脂多糖;流感嗜血杆菌抗原包括荚膜多糖;白喉抗原包括白喉毒素;结核分枝杆菌抗原包括分枝菌酸、热休克蛋白65(hsp65)、30kda主要分泌蛋白和抗原85a;百日咳毒素抗原包括血凝素、百日咳杆菌粘附素、fim2、fim3和腺苷酸环化酶;肺炎球菌抗原包括肺炎球菌溶血素和肺炎球菌荚膜多糖;立克次体抗原包括rompa;链球菌抗原包括m蛋白;并且破伤风抗原包括破伤风毒素。
[0131]
超级细菌。在特定实施方案中,对淋巴细胞进行修饰以靶向多药耐药性“超级细菌”。超级细菌的实例包括粪肠球菌、艰难梭菌、鲍曼不动杆菌、铜绿假单胞菌和肠杆菌科(包括大肠杆菌、肺炎克雷伯氏菌、肠杆菌属)。
[0132]
在特定实施方案中,抗原由与真菌感染相关的细胞表达。
[0133]
示例性真菌包括念珠菌属、球孢子菌属、隐球菌属、组织胞浆菌属、利什曼原虫属、疟原虫、原生动物、寄生虫、血吸虫、癣、弓形虫和克氏锥虫。
[0134]
作为真菌抗原的其他特定实例,球虫属抗原包括小球体抗原;隐球菌属抗原包括荚膜多糖;组织胞浆菌属抗原包括热休克蛋白60(hsp60);利什曼原虫属抗原包括gp63和脂磷聚糖;恶性疟原虫抗原包括裂殖子表面抗原、子孢子表面抗原、环子孢子抗原、配子体/配子表面抗原、原生动物和其他寄生虫抗原,包括红内期抗原pf155/resa;血吸虫抗原包括谷胱甘肽-s-转移酶和副肌球蛋白;癣真菌抗原包括毛癣菌素;弓形虫抗原包括sag-1和p30;并且克氏锥虫抗原包括75-77kda抗原和56kda抗原。
[0135]
在特定实施方案中,抗原由与自身免疫性或变应性疾患相关的细胞表达。示例性自身免疫性疾患包括急性坏死性出血性脑病、变应性哮喘、斑秃、贫血、口疮性溃疡、关节炎(包括类风湿性关节炎、青少年类风湿性关节炎、骨关节炎、银屑病性关节炎)、哮喘、自身免疫性甲状腺炎、乳糜泻、结膜炎、克隆氏病(crohn's disease)、皮肤型红斑狼疮、皮炎(包括特应性皮炎和湿疹性皮炎)、糖尿病(diabetes)、糖尿病(diabetes mellitus)、麻风结节性红斑、角膜结膜炎、多发性硬化症、重症肌无力、银屑病、硬皮病、薛格连氏综合征(包括继发于薛格连氏综合征的干燥性角膜结膜炎)、史蒂文斯—约翰逊综合征(stevens-johnson syndrome)、全身性红斑狼疮、溃疡性结肠炎、阴道炎和韦格纳氏肉芽肿病(wegener's granulomatosis)。
[0136]
自身免疫性抗原的实例包括谷氨酸脱羧酶65(gad 65)、天然dna、髓鞘碱性蛋白、髓磷脂蛋白脂质蛋白、乙酰胆碱受体组分、甲状腺球蛋白和促甲状腺激素(tsh)受体。变应性抗原的实例包括花粉抗原如日本雪松花粉抗原、豚草花粉抗原、黑麦草花粉抗原、动物源性抗原(如尘螨抗原和猫科动物抗原)、组织相容性抗原以及青霉素和其他治疗性药物。
[0137]
由目标细胞表达的抗原的结合结构域也可来源于t细胞受体(tcr)。有许多方式来鉴定和选择用作结合结构域的特定tcr。例如,结合特定抗原片段的众多tcr的序列是已知的并且可公开获得。
[0138]
也可通过分离结合特定抗原的t细胞并对tcr链进行测序来鉴定有用的tcr。例如,可通过在抗原/mhc复合物存在下体外培养分离的人t细胞来诱导抗原特异性t细胞。可通过例如5'race程序使用对应于对tcrα-链基因和tcrβ-链基因具有特异性的序列的引物容易地克隆编码结合抗原/mhc复合物的tcr的tcr基因。
[0139]
在特定实施方案中,可能需要在测序后配对tcr链(即,执行配对链分析)。可使用各种方法来配对分离的α和β链。在特定实施方案中,测序后配对可能是不必要的或相对简单的,例如在其中α和β链配对信息在程序中不丢失的实施方案中,诸如如果要从单个细胞进行测序。链配对也可使用多孔测序来进行。还开发了诸如(adaptive biotechnologies corp.,seattle,wa)的测定。
[0140]
对于可在本公开的上下文中使用的tcr的特定实例,参见例如wo2018/129270;wo2017/112944;wo2011/039507;us 8,008,438;us2016/0083449;us2015/0246959;stromnes,等人(2015)cancer cell 28(5):638-652;kobayashi,等人(2013)nature medicine 19:1542-1546);varela-rohena,等人(2008)nature medicine.14(12):1390-1395);和robbins等人(2008)the journal of immunology 180(9):6116-6131。
[0141]
(4)免疫细胞活化表位和相关结合结构域。可靶向局部活化的免疫细胞包括例如t细胞和自然杀伤(nk)细胞。
[0142]
t细胞活化可由两种不同的信号介导:起始抗原依赖性初级活化并提供t细胞受体样信号的那些(初级细胞质信号传导序列)和以抗原非依赖性方式发挥作用以提供次级或共活化信号的那些(次级细胞质信号传导序列)。双特异性抗体的组合可靶向在结合后诱导t细胞活化的t细胞活化表位的任何组合。此类t细胞活化表位的实例是在t细胞标志物上,包括cd2、cd3、cd7、cd27、cd28、cd30、cd40、cd83、4-1bb(cd 137)、ox40、淋巴细胞功能相关抗原-1(lfa-1)、light、nkg2c和b7-h3。可被阻断的t细胞抑制性受体包括pd-1、lag3、tim-3、btla、ctla-4和cd200。具有pd-1结合结构域的抗体包括派姆单抗和纳武单抗,而ctla-4阻断抗体包括伊匹单抗。
[0143]
cd3是t细胞受体的主要信号转导元件,并在所有成熟t细胞上表达。cd3的结合结构域可来源于例如okt3、20g6-f3、4b4-d7、4e7-c9和18f5-h10。
[0144]
okt3在美国专利号5,929,212中进行了描述。okt3抗体包含:包含sasssvsymn(seq id no:189)的cdrl1序列、包含rwiydtsklas(seq id no:190)的cdrl2序列、包含qqwssnpft(seq id no:191)的cdrl3序列、包含kasgytftrytmh(seq id no:192)的cdrh1序列、包含inpsrgytnynqkfkd(seq id no:193)的cdrh2序列和包含yyddhycldy(seq id no:194)的cdrh3序列。
[0145]
以下序列是来源于okt3的scfv,其保留结合cd3的能力:qvqlqqsgaelarpgasvkmsckasgytftrytmhwvkqrpgqglewigyinpsrgytnynqkfkdkatlttdkssstaymqlssltsedsavyycaryyddhycldywgqgttltvsssggggsggggsggggsqivltqspaimsaspgekvtmtcsasssvsymnwyqqksgtspkrwiydtsklasgvpahfrgsgsgtsysltisgmeaedaatyycqqwssnpftfgsgtkleinr(seq id no:195)。它也可用作cd3结合结构域。
[0146]
20g6-f3抗体包含:包含qslvhnngnty(seq id no:196)的cdrl1序列、包含kvs的cdrl2序列、包含gqgtqypft(seq id no:197)的cdrl3序列、包含gftftkaw(seq id no:198)的cdrh1序列、包含ikdksnsyat(seq id no:199)的cdrh2序列和包含rgvyyalspfdy(seq id no:200)的cdrh3序列。
[0147]
4b4-d7抗体包含:包含qslvhdngnty(seq id no:201)的cdrl1序列、包含kvs的cdrl2序列、包含gqgtqypft(seq id no:197)的cdrl3序列、包含gftfsnaw(seq id no:202)的cdrh1序列、包含ikarsnnyat(seq id no:203)的cdrh2序列和包含rgtyyaskpfdy(seq id no:204)的cdrh3序列。
[0148]
4e7-c9抗体包含:包含qslehnngnty(seq id no:205)的cdrl1序列、包含kvs的cdrl2序列、包含gqgtqypft(seq id no:197)的cdrl3序列、包含gftfsnaw(seq id no:202)的cdrh1序列、包含ikdksnnyat(seq id no:206)的cdrh2序列和包含ryvhygigyamda(seq id no:207)的cdrh3序列。
[0149]
18f5-h10抗体包含:包含qslvhtngnty(seq id no:208)的cdrl1序列、包含kvs的cdrl2序列、包含gqgthypft(seq id no:209)的cdrl3序列、包含gftftnaw(seq id no:210)的cdrh1序列、包含kdksnnyat(seq id no:211)的cdrh2序列和包含ryvhyrfayalda(seq id no:212)的cdrh3序列。
[0150]
抗cd3抗体、结合结构域和cdr的另外实例可在wo2016/116626中找到。也可使用tr66。
[0151]
cd28是存在于人类80%的外周t细胞上的表面糖蛋白,并且存在于静止和活化t细胞上。cd28结合至b7-1(cd80)和b7-2(cd86),并且是已知共刺激分子中最有效的(june等人,immunol.today 15:321(1994);linsley等人,ann.rev.immunol.11:191(1993))。
[0152]
在特定实施方案中,cd28结合结构域可来源于cd80、cd86或抗体tgn1412、9d7、9.3、kolt-2、15e8、248.23.2和ex5.3d10。
[0153]
在特定实施方案中,源自tgn1412的结合结构域包含:包含hasqniyvwln(seq id no:213)的cdrl1序列、包含kasnlht(seq id no:214)的cdrl2序列、包含qqgqtypyt(seq id no:215)的cdrl3序列、包含syyih(seq id no:216)的cdrh1序列、包含ciypgnvntnynekfkd(seq id no:217)的cdrh2序列和包含shygldwnfdv(seq id no:218)的cdrh3序列。
[0154]
在特定实施方案中,cd80/cd86结合结构域来源于美国专利号7,531,175中描述的一种或多种单克隆抗体。在特定实施方案中,cd80/cd86结合结构域包含:包含svsssisssnlh(seq id no:219)的cdrl1序列、包含gtsnlas(seq id no:220)的cdrl2序列、包含qqwssyplt(seq id no:221)的cdrl3序列、包含dyymh(seq id no:222)的cdrh1序列、包含widpengntlydpkfqg(seq id no:223)的cdrh2序列和包含eglffay(seq id no:224)的cdrh3序列。
[0155]
活化t细胞表达4-1bb(cd137)。4-1bb,也称为cd137或tnfsf9(uniprot id号q07011)是t细胞共刺激受体。
[0156]
4-1bb结合结构域可来源于美国专利号9,382,328b2中描述的单克隆抗体。
[0157]
在特定实施方案中,4-1bb结合结构域包含:包含rasqsvs(seq id no:225)的cdrl1序列、包含asnrat(seq id no:226)的cdrl2序列、包含qrsnwppalt(seq id no:227)的cdrl3序列、包含yyws(seq id no:228)的cdrh1序列、包含inh的cdrh2序列和包含
ygpgnydwyfdl(seq id no:229)的cdrh3序列。
[0158]
在特定实施方案中,4-1bb结合结构域包含:包含sgdnigdqyah(seq id no:230)的cdrl1序列、包含qdknrps(seq id no:231)的cdrl2序列、包含atytgfgslav(seq id no:232)的cdrl3序列、包含gysfstywis(seq id no:233)的cdrh1序列、包含kiypgdsytnysps(seq id no:234)的cdrh2序列和包含gygifdy(seq id no:235)的cdrh3序列。
[0159]
细胞毒性t细胞破坏肿瘤细胞。这些细胞也被称为cd8+t细胞,因为它们在其表面表达cd8糖蛋白。这些细胞通过结合至与mhc i类相关的抗原来识别它们的靶标,所述mhc i类存在于身体的几乎每个细胞的表面。
[0160]
在特定实施方案中,cd8结合结构域可源自okt8抗体。okt8抗体包含:包含rtsrsisqyla(seq id no:236)的cdrl1序列、包含sgstlqs(seq id no:237)的cdrl2序列、包含qqhnenplt(seq id no:238)的cdrl3序列、包含gfnikd(seq id no:239)的cdrh1序列、包含rdpandnt(seq id no:240)的cdrh2序列和包含gygyyvfdh(seq id no:241)的cdrh3序列。
[0161]
在特定实施方案中,可通过遏制抑制性表位如pd-1、lag3、tim-3、btla、ctla-4、vista和/或cd200的活性来活化免疫细胞。
[0162]
pd-1,也称为cd279(uniprot id号q15116)是参与调控t细胞免疫应答的抑制性细胞表面受体。在特定实施方案中,pd-1结合结构域可源自美国专利公布2011/0271358中描述的单克隆抗体。在特定实施方案中,pd-1结合结构域包含:包含rasqsvstsgysymh(seq id no:242)的cdrl1序列、包含fgsnles(seq id no:243)的cdrl2序列、包含qhsweipyt(seq id no:244)的cdrl3序列、包含sswih(seq id no:245)的cdrh1序列、包含yiypstgfteynqkfkd(seq id no:246)的cdrh2序列和包含wrdssgyhamdy(seq id no:247)的cdrh3序列。
[0163]
在特定实施方案中,pd-1结合结构域可源自美国专利申请20090217401a1中描述的单克隆抗体。在特定实施方案中,pd-1结合结构域包含:包含rasqsvssyla(seq id no:84)的cdrl1序列、包含dasnrat(seq id no:85)的cdrl2序列、包含qqssnwprt(seq id no:248)的cdrl3序列、包含nsgmh(seq id no:249)的cdrh1序列、包含vlwydgskryyadsvkg(seq id no:250)的cdrh2序列和包含nddy(seq id no:251)的cdrh3序列。
[0164]
lag3,也称为cd223(uniprot id号p18627)结合至hla ii类抗原并参与淋巴细胞的活化。在特定实施方案中,lag3结合结构域可源自wo/2014/008218中描述的单克隆抗体。
[0165]
tim-3,也称为havcr-2或timd-3(uniprot id号q9tdq0)是在先天性和适应性免疫应答中起抑制作用的细胞表面受体。在特定实施方案中,tim-3结合结构域可源自美国专利公布2015/0218274中描述的单克隆抗体。
[0166]
btla,也称为cd272(uniprot id号q7z6a9)是抑制淋巴细胞免疫应答的抑制性受体。在特定实施方案中,btla结合结构域(例如,scfv)可源自美国专利公布2012/0288500中描述的一种或多种单克隆抗体。
[0167]
ctla-4,也称为cd152(uniprot id号p16410)是作为t细胞应答的主要负调控因子的抑制性受体。在特定实施方案中,ctla-4结合结构域可源自美国专利号6,984,720中描述的单克隆抗体。
[0168]
cd200(也称为ox-2膜糖蛋白,uniprot id号p41217)是可向免疫细胞传递抑制信号的蛋白质。在特定实施方案中,cd200结合结构域可源自美国专利公布2013/0189258中描
述的一种或多种单克隆抗体。
[0169]
在特定实施方案中,自然杀伤细胞(也称为nk细胞、k细胞和杀伤细胞)被双特异性抗体靶向以进行局部活化。nk细胞可通过释放破坏细胞膜的颗粒来诱导细胞凋亡或细胞溶解,并且可分泌细胞因子来募集其他免疫细胞。
[0170]
在nk细胞的表面上表达的活化蛋白质的实例包括nkg2d、cd8、cd16、kir2dl4、kir2ds1、kir2ds2、kir3ds1、nkg2c、nkg2e、nkg2d和天然细胞毒性受体(ncr)家族的几个成员。在配体结合时活化nk细胞的ncr的实例包括nkp30、nkp44、nkp46、nkp80和dnam-1。
[0171]
结合至nk细胞受体并诱导和/或增强nk细胞活化的市售抗体的实例包括:5c6和1d11,它们结合并活化nkg2d(可从san diego,ca获得);mab 33,其结合并活化kir2dl4(可从获得);p44-8,其结合并活化nkp44(可从获得);sk1,其结合并活化cd8;以及3g8,其结合并活化cd16。另外的nk细胞活化抗体描述于wo/2005/0003172和美国专利号9,415,104中。
[0172]
关于cdr序列和片段,天然存在的抗体结构单元包括四聚体。每个四聚体包含两对多肽链,每对具有一条轻链和一条重链。每条链的氨基末端部分包含负责抗原识别和表位结合的可变区。可变区表现出由三个高变区(也称为互补决定区(cdr))连接的相对保守的框架区(fr)的相同一般结构。来自各对的两条链的cdr通过框架区对准,这是的能够结合至特定表位。从n末端至c末端,轻链可变区与重链可变区两者均包含结构域fr1、cdr1、fr2、cdr2、fr3、cdr3及fr4。通常根据kabat sequences of proteins of immunological interest(national institutes of health,bethesda,md.(1987and 1991))或chothia和lesk,j.mol.biol.,196:901-917(1987);chothia等人,nature,342:878-883(1989)的定义将氨基酸分配至各结构域。
[0173]
(5)多特异性分子形式。如所指示,多特异性免疫细胞衔接分子结合治疗部位的抗原(例如,肿瘤部位的癌症抗原)和免疫细胞活化表位两者,目的是将免疫细胞带至目标细胞以破坏他们。双特异性抗体结合目标细胞上的抗原和一种免疫细胞活化表位。三特异性抗体可结合目标细胞上的两种抗原和一种免疫细胞活化表位,或目标细胞上的一种抗原和两种免疫细胞活化表位(例如,初级活化信号(例如,cd3)和共刺活化化信号(例如,cd28或4-1bb)。四特异性抗体可结合四种不同的结合配偶体,在目标细胞上的抗原与免疫细胞活化表位之间分为多种组合。在特定实施方案中,免疫细胞是t细胞或自然杀伤(nk)细胞。
[0174]
示例性双特异性抗体形式描述于例如wo2009/080251、wo2009/080252、wo2009/080253、wo2009/080254、wo2010/112193、wo2010/115589、wo2010/136172、wo2010/145792和wo2010/145793中。有关可使用的另外双特异性形式的综述,参见brinkmann和ko ntermann,mabs,2017.9:2,182-212,doi:10.1080/19420862.2016.1268307。yu等人,(journal of hematology&oncology(2017)10,155)描述了在实体瘤治疗中特别有用的另外形式,如以fc形式提供的那些(四源杂交瘤、钮入孔(knobs-into-holes)、scfv-igg、(igg)2、纳米抗体和scfv-fc)以及以非fc形式提供的那些(f(ab')2、scfv-has-scfv、tandscfv、双抗体、dart、immtac、对接锁定(dock and lo cks)和tandab)。
[0175]
在以上章节(3)或(4)中未提供的范围内,另外不同的结合结构域可来源于多种来源,如抗体、tcr、纤连蛋白、亲和体、天然配体(例如,对于cd28,cd80和cd86)等。在特定实施
方案中,结合结构域可来源于完整抗体或抗体的结合片段,例如fv、fab、fab'、f(ab')2、fc和单链fv片段(scfv)或特异性地结合至癌症抗原或免疫细胞活化表位(例如,t细胞受体)的免疫球蛋白的任何生物学上有效的片段。抗体或抗原结合片段包括多克隆抗体、单克隆抗体、人抗体、人源化抗体、合成抗体、嵌合抗体、双特异性抗体、微型抗体和线性抗体的全部或一部分。
[0176]
与非人抗体相比,包含来自人起源的抗体或人源化抗体的结合结构域的多特异性抗体在人体内具有降低的免疫原性,并且具有较低数量的非免疫原性表位。通常将选择结合结构域以在人受试者中具有降低的抗原性。结合结构域可特别包括特异性地结合所选癌症抗原或免疫细胞活化表位的任何肽。结合结构域的来源包括来自不同物种的抗体可变区(其可呈抗体、sfv、scfv、fab、基于scfv的grababody或可溶性vh结构域或结构域抗体的形式)。这些抗体可仅使用重链可变区形成抗原结合区,即这些功能性抗体仅是重链的同源二聚体(称为“重链抗体”)(jespers等人,nat.biotechnol.22:1161,2004;cortez-retamozo等人,cancer res.64:2853,2004;baral等人,nature med.12:580,2006;和barthelemy等人,j.biol.chem.283:3639,2008)。
[0177]
部分或完全合成的抗体的噬菌体展示文库是可用的,并且可筛选能够结合选定表位的抗体或其片段。例如,可通过筛选fab噬菌体文库中的与目标靶标特异性结合的fab片段来鉴定结合结构域(参见hoet等人,nat.biotechnol.23:344,2005)。人抗体的噬菌体展示文库也是可用的。此外,在方便的系统(例如,小鼠、humabtc mouse
tm
、美洲驼、鸡、大鼠、仓鼠、兔等)中,使用目标靶标作为免疫原进行杂交瘤开发的传统策略可用于开发结合结构域。在特定实施方案中,结合结构域特异性地结合至由靶向癌细胞和/或t细胞表达的选定表位,并且不与非特异性组分或无关靶标交叉反应。一旦鉴定,就可分离和/或确定编码结合结构域内的cdr的氨基酸序列或多核苷酸序列。
[0178]
结合结构域的替代来源包括编码随机肽文库的序列或编码替代非抗体支架的环区域中的工程化氨基酸多样性的序列,如sctcr(参见例如,lake等人,int.immunol.11:745,1999;maynard等人,j.immunol.methods 306:51,2005;美国专利号8,361,794))、mab2或fcab
tm
(参见例如,pct专利申请公布号wo 2007/098934;wo 2006/072620)、亲和体、高亲和性聚合体(avimer)、fynomers、细胞毒性t淋巴细胞相关蛋白4(weidle等人,cancer gen.proteo.10:155,2013)等(nord等人,protein eng.8:601,1995;nord等人,nat.biotechnol.15:772,1997;nord等人,euro.j.biochem.268:4269,2001;binz等人,nat.biotechnol.23:1257,2005;boersma和pl
ü
ckthun,curr.opin.biotechnol.22:849,2011)。
[0179]
在特定实施方案中,抗体片段用作多特异性抗体中的一个或多个结合结构域。“抗体片段”表示保留结合至表位的能力的完整或全长抗体的一部分。抗体片段的实例包括fv、scfv、fab、fab'、fab'-sh、f(ab')2;双抗体;和线性抗体。
[0180]
单链可变片段(scfv)是与短接头肽连接的免疫球蛋白重链和轻链的可变区的融合蛋白。fv片段包括抗体的单臂的vl和vh结构域。虽然fv片段的两个结构域vl和vh由单独基因编码,但其可使用例如重组方法通过合成接头加以衔接,所述合成接头使其能够以单一蛋白链形式制得,在所述单一蛋白链中,vl区和vh区配对以形成单价分子(单链fv(scfv))。有关fv和scfv的另外信息,参见例如,bird等人,science 242(1988)423-426;
huston等人,proc.natl.acad.sci.usa 85(1988)5879-5883;plueckthun,the pharmacology of monoclonal antibodies,第113卷,rosenburg和moore(编著),springer-verlag,new york),(1994)269-315;wo1993/16185;美国专利5,571,894;以及美国专利5,587,458。
[0181]
fab片段是包含vl、vh、cl和ch1结构域的单价抗体片段。f(ab')2片段是包含通过铰链区处的二硫桥键连接的两个fab片段的二价片段。对于具有增加的体内半衰期的fab和f(ab')2片段的讨论,参见美国专利5,869,046。双抗体包含两个可以是二价的表位结合位点。参见例如,ep 0404097;wo1993/01161;以及holliger等人,proc.natl.acad.sci.usa 90(1993)6444-6448。也可使用双重亲和力重靶向抗体(dart
tm
;基于双抗体形式,但具有c末端二硫键以获得额外的稳定(moore等人,blood 117,4542-51(2011))。抗体片段也可包括分离的cdr。对于抗体片段的综述,参见hudson等人,nat.med.9(2003)129-134。
[0182]
在特定实施方案中,多特异性抗体还可包括作为结合结构域的表位的天然受体或配体。例如,如果用于结合的靶标包括pd-l1,则结合结构域可包括pd-1(包括例如,pd-1/抗cd3融合体)。用于结合的受体融合体的一个实例是(amgen)。也可修饰天然受体或配体以增强结合。例如,betalacept是abatacept的经修饰型式。在特定实施方案中,多特异性可包括诱导吞噬作用的天然受体或配体。钙网蛋白(uniprot id号p27797)是定位于健康细胞内质网的蛋白质,但在垂死细胞中,它易位至细胞表面并诱导诸如巨噬细胞的免疫细胞的吞噬作用。在特定实施方案中,结合结构域可包括能够诱导吞噬作用的钙网蛋白或钙网蛋白的一部分。
[0183]
在特定实施方案中,多特异性可包括连接至轻链的c末端的单链抗体(参见例如,oncoimmunology.2017;6(3):e1267891)。这种形式可以是有用的,因为fc区的存在可有助于保持蛋白质半衰期。fc区的存在也可以是有用的,因为fc与几种受体相互作用并可有助于免疫应答。抗体-scfv融合体也可以是有用的,因为抗体部分以二聚体方式与其表位结合,这增强了亲和力,并且scfv部分以单体方式结合其表位,这例如对于结合t细胞表位可以是有用的并且仅允许在靶标(例如癌细胞)存在下进行多聚化。这些实施方案可以是“三特异性的”。
[0184]
如所指示,多特异性抗体的结合结构域可通过接头连接。接头是氨基酸序列,其可为多特异性抗体的结合结构域之间的构象运动提供柔性和空间。可使用任何适当的接头。接头的实例可在chen等人,adv drug deliv rev.2013年10月15日;65(10):1357
–
1369中找到。接头可以是柔性的、刚性的或半刚性的,取决于至靶标的所需功能结构域呈递。常用的柔性接头包括gly-ser接头,如ggsgggsggsg(seq id no:252)、ggsgggsgsg(seq id no:63)和ggsgggsg(seq id no:65)。另外的实例包括:ggggsggggs(seq id no:90);gggsgggs(seq id no:128);和ggsggs(seq id no:129)。也可使用包含一个或多个抗体铰链区和/或免疫球蛋白重链恒定区的接头,如单独的ch 3或ch2ch3序列。
[0185]
在一些情况下,柔性接头可能不能维持特定用途所需的结合结构域的距离或定位。在这些情况下,刚性或半刚性接头可能是有用的。刚性或半刚性接头的实例包括富含脯氨酸的接头。在特定实施方案中,富含脯氨酸的接头是具有比仅基于偶然性所预期的脯氨酸残基更多的肽序列。在特定实施方案中,富含脯氨酸的接头是具有至少30%、至少35%、至少36%、至少39%、至少40%、至少48%、至少50%或至少51%脯氨酸残基的接头。富含脯
氨酸的接头的具体实例包括富含脯氨酸的唾液蛋白(prp)的片段。
[0186]
yu等人,(journal of hematology&oncology(2017)10,155)中描述了双特异性抗体的特定实例,并且包括卡妥索单抗(epcam/cd3;呈三功能抗体形式并在临床试验nct00189345中进行了评估);mt110(epcam/cd3;呈bite(amgen)形式并在临床试验nct00635596中进行了评估);厄妥索单抗(her2/cd3;呈三功能抗体(triomab)形式并在临床试验nct00452140中进行了评估);mdx-447(egfr/cd64;呈2(fab')形式并在临床试验nct00005813中进行了评估);mm-141(her3/igf-ir;呈scfv-igg形式并在临床试验nct01733004中进行了评估);amg211(cea/cd3;呈bite形式并在临床试验nct02760199中进行了评估);ro6958688(cea/cd3;呈基于igg的形式并在临床试验nct02324257中进行了评估);ro6895882(cea/il2;呈scfv-igg形式并在临床试验nct02004106中进行了评估);tf2(cea/hsg;呈对接所定形式并在临床试验nct00860860中进行了评估);抗ceaxanti-dtpa(cea/di-dtpa-131;呈scfv-igg形式并在临床试验nct00467506中进行了评估);bay2010112(psma/cd3;呈bite形式并在临床试验nct01723475中进行了评估);以及mor209/es414(psma/cd3;呈scfv-fc-scfv形式并在临床试验nct02262910中进行了评估)。也可使用amg701(靶向bcma)和索利托单抗(靶向epcam/cd3)。有关结合双特异性分子的epcam的另外信息,参见brischwein等人,mol.immunol.2006;43:1129-1143和schlereth等人,cancer research,2005;65:2882-2889。也可使用如horn et al.,oncotarget,2017年8月29日8(35)中所述的pd-l1/cd3双特异性抗体。双特异性抗体的另外特定实例描述于wo2014/167022;us2016/0208001;us 2014/0302037和us 2014/0308285中。最后一个实例包括博纳吐单抗。有关双特异性t细胞衔接子的另外信息,参见ellerman,methods,154(2019)102-117。
[0187]
(6)tgfβ抑制剂。人类中存在三种高度同源的tgfβ同种型:tgfβ1、tgfβ2和tgfβ3。许多抑制性tgfβ肽和抗体是可用的。在特定实施方案中,单核细胞/巨噬细胞可被重新编程以表达抑制性tgfβ肽或抗体。tgfβ抑制剂的实例包括曲贝德生(ap12009;在临床试验nct00431561、nct00844064和nct00761280中评估的反义寡核苷酸);地司特肽(在临床试验nct00574613和nct00781053中评估的肽);乐迪利木单抗(人源化抗体);美特利木单抗(在临床试验nct00043706中评估的人源化抗体);夫苏木单抗(在临床试验nct00464321、nct01284322和nct01291784中评估的人源化抗体);ly2382770(在临床试验nct01113801中评估的人源化抗体);six-100(在临床试验nct01371305中评估的抗体);阿奥特明(avotermin)(在临床试验nct004322111和nct00656227中评估的重组蛋白);和imc-tr1(在临床试验nct01646203中评估的人源化抗体)。
[0188]
ravi等人,(nature communications 9,741(2018))描述了双功能抗体-配体陷阱(y-陷阱),包括在靶细胞微环境中同时禁用自分泌/旁分泌tgfβ的靶向与tgfβ受体ii胞外结构域序列融合的ctla-4或pd-l1的抗体(a-ctla4-tgfβriiecd和a-pdl1-tgfβriiecd)。ravi等人的图2b提供了a-ctla4-tgfβrii的重链和轻链的氨基酸序列,包括tgfβrii胞外结构域的配体结合序列。cuende等人,science translational medicine,2015年4月,7(284)还描述了体内抑制tgfβ的抗体的产生;例如,抗garp单克隆抗体mhg-8和lhg-10阻断活性tgf-β1的产生。
[0189]
另外tgfβ抑制剂的实例包括曲尼司特、吡非尼酮、lefty-1(1105i登录号:nm_
010094(小鼠)和nm_020997(人))、sb-431542、sb-202190和sb-505124(lindemann等人,mol.cancer,2003,2:20;glaxosmithkline)、npc30345、sd093、sd908、sd208(scios)、sm16(biogen idec)、ly2109761、ly364947、ly580276。ly2157299(lilly research laboratories)、a-83-01(wo 2009/146408)、alk5抑制剂ii(2-[3-[6-甲基吡啶-2-基]-1h-吡唑-4基]-1,5-萘啶)、tgfβri激酶抑制剂viii(6-[2-叔丁基-5-[6-甲基-吡啶-2-基]-1h-咪唑-4-基]-喹喔啉)及其衍生物。
[0190]
(7)核苷酸。在本公开中,编码调控活化状态的基因和导致多特异性分子和任选的tgfβ抑制剂表达的基因的核苷酸被递送至免疫细胞,如单核细胞和/或巨噬细胞。“基因”是指编码所编码分子的核苷酸序列。此定义包括各种序列多态性、突变和/或序列变体,其中此类改变不影响所编码分子的功能。术语“基因”不仅可包括编码序列,而且包括调控区,如启动子、增强子和终止区。所述术语还可包括从mrna转录物剪接的所有内含子和其他dna序列,连同由可变剪接位点产生的变体。编码活化所编码分子的核苷酸序列可以是指导所编码分子的表达的rna。这些核苷酸序列包括在特定实施方案中翻译成蛋白质的rna序列。在特定实施方案中,本领域普通技术人员可了解,包括胸腺嘧啶(t)碱基的dna序列可等效于除了t碱基被尿嘧啶(u)碱基替代外具有相同序列的mrna序列。核苷酸序列包括全长核苷酸序列以及源自全长蛋白质的非全长序列两者。所述序列还可包括天然序列的简并密码子或可被引入以在特定免疫细胞中提供密码子偏好的序列。编码本文所述的分子的基因序列可在公开可获得的数据库和出版物中获得。“编码”是指核苷酸序列如质粒、基因、cdna、mrna充当合成活化调控因子、多特异性抗体和/或tgfβ抑制剂的模板的性质。
[0191]
在特定实施方案中,核苷酸包括合成mrna。在特定实施方案中,使用5'-加帽对合成mrna进行工程改造以增加细胞内稳定性。可使用多个不同的5'-帽结构来生成合成mrna分子的5'-帽。例如,抗反向帽类似物(arca)帽含有5'-5'-三磷酸鸟嘌呤-鸟嘌呤连键,其中一个鸟嘌呤含有n7甲基以及3'-o-甲基。合成mrna分子也可使用负责产生5'-帽结构的酶在转录后加帽。例如,重组牛痘病毒加帽酶和重组2'-o-甲基转移酶可在mrna的最5'-端核苷酸与鸟嘌呤核苷酸(其中鸟嘌呤含有n7甲基化)之间建立规范的5'-5'-三磷酸连键,并且最终的5'-核苷酸含有2'-o-甲基,从而生成帽1结构。这使得帽具有更高的翻译能力和细胞稳定性以及减少的细胞促炎性细胞因子活化。
[0192]
在特定实施方案中,合成mrna用于降低免疫原性、促进mrna稳定性和/或促进mrna翻译的其他修饰可包括5'-和3'-末端非翻译区(utr)、5'utr中的kozak翻译起始序列、经修饰的核糖核苷和/或polya尾。在特定实施方案中,经修饰的核糖核苷可包括假尿苷(ψ)、5-甲基胞苷(5mc)、n6-甲基腺苷(m6a)、2-硫尿苷(2su)、5-甲氧基尿苷(5mou)和n-1-甲基假尿苷(m1ψ)。在特定实施方案中,utr可包括α-和/或β-珠蛋白utr。
[0193]
产生合成mrna的特定实施方案包括通过从相应dna质粒pcr扩增来产生dna模板,所述dna模板含有带5't
100-250
突出端的所需蛋白质的编码dna序列。然后可将所述dna模板用于通过体外转录反应产生mrna。在体外转录过程中,可并入5'帽结构(例如arca)、经修饰的核糖核苷和/或3'poly(a)尾。许多体外转录系统可商购,包括例如megascript t7转录试剂盒(thermofisher scientific,waltham,ma)、riboprobe
tm
系统t7(promega,madison,wi)、ampliscribe
tm
t7高产率转录试剂盒(epicentre,madison,wi)和hiscribe
tm
t7体外转录试剂盒(new england biolabs,ipswich,ma)。在特定实施方案中,合成mrna可由合成核
苷酸的公司(例如,trilink biotechnologies,san diego,ca)合成。
[0194]
合成mrna或其他核苷酸可制成环状。可使此类核苷酸环化或连环化(concatemerized),以产生有翻译能力的分子来帮助poly-a结合蛋白与5’端结合蛋白之间的相互作用。环化或连环化的机制可通过至少3种不同的途径发生:1)化学,2)酶,或3)核酶催化。新形成的5
’‑
/3
’‑
连键可以是分子内或分子间的。
[0195]
在第一途径中,核苷酸的5’端和3’端可含有当靠近时在分子的5’端与3’端之间形成新的共价连键的化学反应性基团。5’端可含有nhs-酯反应性基团并且3’端可含有3
’‑
氨基封端的核苷酸,以使得在有机溶剂中核苷酸分子的3’端上的3
’‑
氨基封端的核苷酸将经历5
’‑
nhs-酯部分上的亲核攻击,从而形成新的5
’‑
/3
’‑
酰胺键。
[0196]
在第二途径中,t4 rna连接酶可用于将5
’‑
磷酸化的核苷酸分子酶连接至核苷酸的3
’‑
羟基,从而形成新的磷酸二酯连键。在示例反应中,可根据制造商的方案将1μg核苷酸分子与1-10单位的t4 rna连接酶(new england biolabs,ipswich,ma)一起在37℃下孵育1小时。连接反应可在存在能够与并列的5
′‑
和3
′‑
区两者碱基配对以帮助酶连接反应的分离寡核苷酸的情况下发生。
[0197]
在第三途径中,cdna模板的5
’‑
或3
’‑
端编码连接酶核酶序列,以使得在体外转录过程中,所得核苷酸分子可含有能够将核苷酸分子的5’端连接至核苷酸分子的3’端的活性核酶序列。连接酶核酶可源自i组内含子、丁型肝炎病毒、发夹状核酶或可通过selex(指数富集的配体系统进化技术)选择。核酶连接酶反应可在0℃与37℃之间的温度下进行1至24小时。
[0198]
在特定实施方案中,核苷酸包括质粒、cdna或mrna,所述质粒、cdna或mrna可包括例如用于表达所编码分子的序列(例如,基因)。合适的质粒包括可用于将基因转移至单核细胞/巨噬细胞的标准质粒载体和小环质粒。核苷酸(例如小环质粒)还可包括任何另外的序列信息,以促进在经修饰的细胞中的瞬时表达。例如,核苷酸可包括启动子,如通用启动子、组织特异性启动子、细胞特异性启动子和/或对细胞质具有特异性的启动子。如所指示的,启动子和质粒(例如小环质粒)在本领域中通常是众所周知的,并且可使用常规技术来制备。
[0199]
有关可在本公开的实施方案中使用的核苷酸的另外信息,参见hardee等人,genes(2017),8,65。hardee等人综述了非病毒dna基因治疗载体,包括质粒、微环和微载体的方法。质粒载体和最小化dna载体已成功用于递送用于癌症的基因疗法。最近,微环已被用于工程化t细胞以递送双特异性抗体,从而允许t细胞杀死b细胞淋巴瘤(hardee等人,genes(2017),8,65)。特定实施方案包括使用双链dna(整合和/或非整合)、常规质粒、微环和/或封闭末端线性ce dna(参见li等人,plos one,2013年8月1日doi.org/10.1371/jou rnal.pone.0069879)。cedna是具有共价闭合末端的非病毒、aav来源的载体dna(li等人,plos one,2013,doi.org/10.1371/journal.po ne.0069879)。
[0200]
在特定实施方案中,编码巨噬细胞活化调控因子的核苷酸与编码其他活化调控因子的一种或多种另外核苷酸(例如,irf、多特异性抗体和/或tgfβ抑制剂的组合)组合使用。在特定实施方案中,将编码irf的核苷酸与编码其他irf的一种或多种另外的核苷酸以及与编码ikkβ的核苷酸组合使用。在特定实施方案中,编码irf的核苷酸与编码ikkβ的核苷酸、多特异性抗体和/或tgfβ抑制剂以0.5:1、1:1、2:1、3:1、4:1或5:1的比例组合使用。在特定
实施方案中,编码irf的核苷酸与编码ikkβ的核苷酸以3:1的比例组合使用。
[0201]
特定实施方案可在基因编辑系统内递送核苷酸。基因编辑系统修改或影响细胞内源性基因组的特定序列。基因编辑系统可用于靶向基因组编辑,例如基因破坏、通过同源重组进行的基因编辑以及将治疗性基因插入人基因组的适当染色体靶位点的基因疗法。
[0202]
特定实施方案利用转录活化因子样效应子核酸酶(talen)作为基因编辑系统。talen是指包括转录活化因子样效应子(tale)dna结合蛋白和dna裂解结构域的融合蛋白。talen通过在dna中诱导双链断裂(dsb)来编辑基因和基因组,从而诱导细胞中的修复机制。一般来说,两个talen必须结合并侧接在靶dna位点的每一侧,以使dna裂解结构域二聚化并诱导dsb。dsb通过非同源末端连接(nhej)或通过与外源性双链供体dna片段的同源重组(hr)在细胞中进行修复。
[0203]
如所指示,talen已被工程改造以结合例如内源性基因组的靶序列,并在所述靶序列的位置切割dna。talen的tale是由黄杆菌属细菌分泌的dna结合蛋白。tale的dna结合结构域包括高度保守的33或34个氨基酸的重复序列,每个重复序列的第12和13位具有不同的残基。这两个位置(称为重复可变双残基(rvd))显示出与特定核苷酸识别的强相关性。因此,可通过改变rvd中的氨基酸且并入非常规rvd氨基酸来改善靶向特异性。
[0204]
可用于talen融合体中的dna裂解结构域的实例是野生型和变体foki核酸内切酶。foki结构域起着二聚体的作用,从而对于靶序列上的位点需要两种具有独特dna结合结构域的构建体。foki裂解结构域在分离两个反向半位点的五或六个碱基对的间隔序列内裂解。
[0205]
特定实施方案利用megatal作为基因编辑系统。megatal具有单链稀有裂解核酸酶结构,其中tale与大范围核酸酶的dna裂解结构域融合。大范围核酸酶(也称为归巢核酸内切酶)是在同一结构域中具有dna识别和核酸酶功能两者的单肽链。与talen相比,megatal仅需要递送单一肽链来获得功能活性。
[0206]
特定实施方案利用锌指核酸酶(zfn)作为基因编辑系统。zfn是一类被工程改造以在特定位置结合并裂解dna的位点特异性核酸酶。zfn用于在dna序列的特定位点引入dsb,这使得zfn能够靶向多种不同细胞中的基因组内的独特序列。此外,在双链断裂之后,发生同源重组或非同源末端连接以修复dsb,从而能够进行基因组编辑。
[0207]
通过将锌指dna结合结构域融合至dna裂解结构域来合成zfn。dna结合结构域包括三至六种为转录因子的锌指蛋白。dna裂解结构域包括例如foki核酸内切酶的催化结构域。
[0208]
向导rna可例如与诸如crispr-cas系统的基因编辑系统一起使用。crispr-cas系统包括crispr重复序列和一组crispr相关基因(cas)。
[0209]
一般来说,在本公开内可使用能够引起递送的核苷酸的功能性表达的任何系统。然而,在特定实施方案中,排除了利用病毒载体的递送。
[0210]
(8)纳米颗粒。在某些实例中,本文公开的系统和方法中使用的纳米颗粒可起到缩合和保护核苷酸免受酶促降解的作用。为此目的在纳米颗粒内使用的特别有用的材料包括带正电荷的脂质和/或聚合物,包括聚(β-氨基酯)(pbae)。
[0211]
可在本公开的纳米颗粒内使用的带正电荷的聚合物的实例包括多胺;聚有机胺(例如,聚乙烯亚胺(pei)、聚乙烯亚胺纤维素);聚(酰氨基胺)(pamam);聚氨基酸(例如,聚赖氨酸(pll)、聚精氨酸);多糖(例如,纤维素、葡聚糖、deae葡聚糖、淀粉);精胺、亚精胺、聚
(乙烯基苄基三烷基铵)、聚(4-乙烯基-n-烷基-吡啶鎓)、聚(丙烯酰基-三烷基铵)和tat蛋白。
[0212]
带正电荷的脂质的实例包括磷脂酸与氨基醇的酯,如二棕榈酰基磷脂酸或二硬脂酰基磷脂酸与羟基乙二胺的酯。带正电荷的脂质的更具体实例包括3β-[n
‑‑
(n',n'-二甲基氨基乙基)氨基甲酰基)胆固醇(dc-chol);n,n'-二甲基-n,n'-二辛酰基溴化铵(ddab);n,n'-二甲基-n,n'-二辛酰基氯化铵(ddac);1,2-二油酰基氧基丙基-3-二甲基-羟乙基氯化铵(dori);1,2-二油酰基氧基-3-[三甲基铵基]-丙烷(dotap);n-(1-(2,3-二油酰基氧基)丙基)-n,n,n-三甲基氯化铵(dotma);二棕榈酰基磷脂酰胆碱(dppc);1,2-双十八烷基氧基-3-[三甲基铵基]-丙烷(dstap);以及在例如martin等人,current pharmaceutical design 2005,11,375-394中描述的阳离子脂质。
[0213]
也可使用任何浓度和任何比例的脂质与聚合物的混合物。使用各种等级以不同比例共混不同聚合物类型可导致从每种贡献聚合物中借用的特征。也可采用各种末端基团化学。
[0214]
本文公开的特定实施方案还可利用由能够形成多孔网络的任何材料构造的多孔纳米颗粒。示例性材料包括金属、过渡金属和准金属。示例性的金属、过渡金属和准金属包括锂、镁、锌、铝和二氧化硅。在特定实施方案中,多孔纳米颗粒包括二氧化硅。介孔二氧化硅的超高表面积(超过1,000m2/g)使核苷酸负载水平能够超过常规dna载体(如脂质体)。
[0215]
颗粒可以各种不同的形状形成,所述性状包括球形、立方形、锥形、椭圆形、圆柱形、螺旋管形等。核苷酸可以各种方式包括在纳米颗粒的孔中。例如,核苷酸可被包封在多孔纳米颗粒中。在其他方面,核苷酸可与多孔纳米颗粒的表面或表面附近紧密缔合(例如,共价和/或非共价)。在特定实施方案中,核苷酸可并入多孔纳米颗粒中,例如整合在多孔纳米颗粒的材料中。例如,可将核苷酸并入聚合物纳米颗粒的聚合物基质中。
[0216]
在特定实施方案中,本文公开的纳米颗粒包括包衣。包衣可用来屏蔽包封的核苷酸和/或减少或防止脱靶结合。通过将纳米颗粒的表面电荷降低至中性或负性来减少或防止脱靶结合。如本文其他地方更详细地公开的,包衣可包括基于带中性或负电荷的聚合物和/或脂质体的包衣。在特定实施方案中,包衣是亲水性和/或带中性电荷的亲水性聚合物的致密表面包衣,其足以防止所包封的核苷酸在释放到免疫细胞中之前暴露于环境。在特定实施方案中,所述包衣覆盖纳米颗粒表面的至少80%或至少90%。在特定实施方案中,包衣包括聚谷氨酸(pga)。在特定实施方案中,pga可充当将靶向配体连接至纳米颗粒的接头。在特定实施方案中,pga可充当将二-甘露糖连接至纳米颗粒的接头。在特定实施方案中,包衣包括透明质酸。
[0217]
可在本公开的实施方案中用作包衣的带中性电荷的聚合物的实例包括聚乙二醇(peg);聚丙二醇;和聚环氧烷共聚物(basf corp.,mount olive,nj)。
[0218]
带中性电荷的聚合物还包括两性离子聚合物。两性离子是指总体电荷中性、同时具有正电荷和负电荷的性质。两性离子聚合物的行为可类似于抵抗细胞和蛋白质粘附的细胞膜区域。
[0219]
两性离子聚合物包括两性离子结构单元,所述两性离子结构单元包括具有两性离子基团的侧基(即,从聚合物主链悬垂的基团)。示例性两性离子侧基包括羧基甜菜碱基团(例如,-ra-n+(rb)(rc)-rd-co
2-,其中ra是将聚合物主链共价偶联至羧基甜菜碱基团的阳
离子氮中心的接头基团,rb和rc是氮取代基,并且rd是将阳离子氮中心共价偶联至羧基甜菜碱的羧基的接头基团)。
[0220]
带负电的聚合物的实例包括海藻酸;羧酸多糖;羧甲基纤维素;羧甲基纤维素-半胱氨酸;角叉菜胶(例如,209、379,fmc corporation,philadelphia,pa);硫酸软骨素;糖胺聚糖;粘多糖;带负电的多糖(例如,硫酸葡聚糖);聚(丙烯酸);聚(d-天冬氨酸);聚(l-天冬氨酸);聚(l-天冬氨酸)钠盐;聚(d-谷氨酸);聚(l-谷氨酸);聚(l-谷氨酸)钠盐;聚(甲基丙烯酸);海藻酸钠(例如,lf 120m、lf 200m、lf 200d,fmc biopolymer corp.,drammen,norway);羧甲基纤维素钠(cmc);硫酸化多糖(肝素,琼脂果胶);果胶、明胶和透明质酸。
[0221]
在特定实施方案中,本文公开的聚合物可包括“星形聚合物”,其是指其中两个或更多个聚合物分支从核心延伸的支化聚合物。核心是具有两个或更多个官能团的原子团,通过聚合可从其延伸支链。在特定实施方案中,本公开的纳米颗粒包括星形聚合物。在特定实施方案中,本公开的纳米颗粒包括星形聚合物和包衣。在特定实施方案中,本公开的纳米颗粒包括星形聚合物和含有pga的包衣。在特定实施方案中,本公开的纳米颗粒包括星形聚合物和含有透明质酸的包衣。
[0222]
在特定实施方案中,分支是两性离子或带负电的聚合物分支。对于星形聚合物,可经由水解、紫外线照射或加热将支链前体转化为两性离子或带负电的聚合物。也可通过对不饱和单体的聚合有效的任何聚合方法来获得聚合物,所述方法包括原子转移自由基聚合(atrp)、可逆加成-断裂链转移聚合(raft)、光聚合、开环聚合(rop)、缩合、迈克尔加成反应、支链生成/繁殖反应或其他反应。
[0223]
脂质体是包括至少一个同心脂质双层的微观囊泡。选择形成囊泡的脂质以实现最终复合物的指定程度的流动性或刚性。在特定实施方案中,脂质体提供脂质组合物,所述脂质组合物围绕水性核心。在某些实例中,脂质体的结构可用于将纳米颗粒包封在其核心内(即,脂质体纳米颗粒)。在特定实施方案中,本公开的纳米颗粒作为脂质体纳米颗粒内的纳米颗粒使用。脂质纳米颗粒(lnp)是缺乏脂质体所特有的连续脂质双层的脂质体样结构。固体脂质纳米颗粒(sln)是在室温和体温下为固体的lnp。
[0224]
在前述段落中描述的脂质体和类似结构可以是中性的(胆固醇)或双极性的,并且包括磷脂,如磷脂酰胆碱(pc)、磷脂酰乙醇胺(pe)、磷脂酰肌醇(pi)和鞘磷脂(sm)以及其他类型的双极性脂质,包括具有长度在14-22范围内的烃链并且饱和或具有一个或多个双c=c键的二油酰基磷脂酰乙醇胺(dope)。能够单独或与其他脂质组分组合产生稳定脂质体的脂质的实例是磷脂,如氢化大豆磷脂酰胆碱(hspc)、卵磷脂、磷脂酰乙醇胺、溶血卵磷脂、溶血磷脂酰乙醇胺、磷脂酰丝氨酸、磷脂酰肌醇、鞘磷脂、脑磷脂、心磷脂、磷脂酸、脑苷脂、二硬脂酰磷脂酰乙醇胺(dspe)、二油酰磷脂酰胆碱(dopc)、二棕榈酰磷脂酰胆碱(dppc)、棕榈酰油酰磷脂酰胆碱(popc)、棕榈酰油酰磷脂酰乙醇胺(pope)和二油酰磷脂酰乙醇胺4-(n-马来酰亚胺基-甲基)环己烷-1-甲酸酯(dope-mal)。可并入脂质体的另外不含磷的脂质包括硬脂胺、十二烷基胺、十六烷基胺、肉豆蔻酸异丙酯、十二烷基硫酸三乙醇胺、烷基-芳基硫酸酯、乙酰基棕榈酸酯、甘油蓖麻油酸酯、十六烷基硬脂酸酯、两性丙烯酸聚合物、聚乙氧基化脂肪酸酰胺、ddab、双十八烷基二甲基氯化铵(dodac)、1,2-二肉豆蔻酰基-3-三甲基铵丙烷(dmtap)、dotap、dotma、dc-chol、磷脂酸(pa)、二棕榈酰基磷脂酰甘油(dppg)、二油酰
基磷脂酰甘油、dopg和磷酸二鲸蜡酯。在特定实施方案中,用于产生本文公开的脂质体的脂质包括胆固醇、氢化大豆磷脂酰胆碱(hspc)和衍生的形成囊泡的脂质peg-dspe。
[0225]
形成脂质体的方法描述于,例如,美国专利号4,229,360;4,224,179;4,241,046;4,737,323;4,078,052;4,235,871;4,501,728;和4,837,028以及szoka等人,ann.rev.biophys.bioeng.9:467(1980)和hope等人,chem.phys.lip.40:89(1986)中。有关纳米颗粒的另外信息,参见yetisgin等人,molecules 2020,25,2193。
[0226]
颗粒的大小可在广泛范围内变化,并且可以不同的方式进行测量。如所指示,在优选的实施方案中,所述颗粒是大小《130nm的纳米颗粒。然而,本公开的np也可具有等于或小于500nm、小于150nm、小于140nm、小于120nm、小于110nm、小于100nm、小于90nm、小于80nm、小于70nm、小于60nm、小于50nm、小于40nm、小于30nm、小于20nm或小于10nm的最小尺寸。在特定实施方案中,所述纳米颗粒是大小为90至130nm的np。
[0227]
在特定实施方案中,np可具有介于5nm与500nm之间、介于10nm与100nm之间、介于20nm与90nm之间、介于30nm与80nm之间、介于40nm与70nm之间以及介于40nm与60nm之间范围内的最小尺寸。在特定实施方案中,尺寸是np或包衣的np的直径。在特定实施方案中,本公开的纳米颗粒群体可具有等于或小于500nm、小于100nm、小于90nm、小于80nm、小于70nm、小于60nm、小于50nm、小于40nm、小于30nm、小于20nm或小于10nm的平均最小尺寸。在特定实施方案中,本公开的组合物中的np群体可具有介于5nm与500nm之间、介于10nm与100nm之间、介于20nm与90nm之间、介于30nm与80nm之间、介于40nm与70nm之间和介于40nm与60nm之间、介于70nm与130nm之间或介于75nm与125nm之间范围内的平均直径。可使用例如常规技术,如动态光散射和/或电子显微术来确定纳米颗粒的尺寸。尽管不是优选的,但在特定实施方案中,也可使用微颗粒。
[0228]
在特定实施方案中,pbae聚合物与核苷酸(例如体外转录的mrna)以20:1、30:1、40:1、50:1、60:1、70:1、80:1、90:1、100:1或更高的比率混合以生成pbae-核苷酸聚合复合物。在特定实施方案中,pbae聚合物与核苷酸(例如,体外转录的mrna)以60:1的比率混合以生成pbae-核苷酸聚合复合物。在特定实施方案中,pbae-核苷酸聚合复合物可与pga/二-甘露糖组合以形成最终np。
[0229]
在特定实施方案中,带正电荷的聚合物核心是通过将1,4-丁二醇二丙烯酸酯与4-氨基-1-丁醇以1:1的二丙烯酸酯与胺单体的摩尔比组合而形成的pbae。所述聚合物可以是哌嗪加帽的447聚合物。当与二-甘露糖缀合时,可将α-d-甘露吡喃糖基-(1
→
2)-α-d-甘露吡喃糖(二-甘露糖,omicron biochemicals inc.)修饰成糖胺,然后与pga缀合。
[0230]
可将密码子优化的mrna用抗反向帽类似物3
′‑
o-me-m7g(5
′
)pp p(5
′
)g(arca)加帽,并用经修饰的核糖核苷酸假尿苷(ψ)和5-甲基胞苷(m5c)完全取代。
[0231]
为了形成纳米颗粒,可将pbae-447聚合物以60:1(w:w)的比例添加至mrna,并立即以中等速度涡旋15秒。然后可将混合物在室温下孵育5分钟以形成pbae-mrna复合物。在下一步骤中,可将naoac缓冲液中的100μg/ml pga/二-甘露糖添加至所述聚合复合物溶液,以中等速度涡旋15秒,并在室温下孵育5分钟。在此过程中,pga/二-甘露糖包被pbae-mrna聚合复合物的表面以形成最终的np。为了长期储存,可将d-蔗糖(60mg/ml)作为防冻剂添加到np溶液中。可将纳米颗粒在干冰中速冻,然后冻干。可将干燥的np储存在-20℃或-80℃下直至使用。对于体内使用,可将冻干的np以1:20(w:v)的比率重新悬浮在水中。
[0232]
在特定实施方案中,np具有99.8
±
se/24.5的尺寸、0.183的多分散性和几乎中性的表面电荷(3.40
±
se/2.15mvζ-电位)。可在25℃下使用zetapals仪器(brookhaven instrument corporation)对np的这些物理化学性质进行表征。为了基于动态光散射测量流体力学半径和多分散性,可将np在25mm naoac(ph=5.2)中稀释5倍。为了测量ζ电位,可将np在10mm pbs(ph=7.0)中稀释10倍。为了评估np的稳定性,可将刚刚制备的纳米颗粒在10mm pbs缓冲液(ph=7.4)中稀释。每10分钟一次测量np的流体动力学半径和多分散性持续5小时,并使用nanosite 300仪器(malvern)从颗粒追踪分析中得出它们的大小和颗粒浓度。将刚刚制备的np(25μl,含0.83μg的mrna)沉积在辉光放电处理的200目碳/formvar涂覆的铜网格上。在30秒后,依次用50%karnovsky固定剂、0.1m椰油酸酯缓冲液、dh2o、然后1%(w/v)乙酸双氧铀处理网格。将样品用在120kv下操作的jeol jem-1400透射电子显微镜(jeol usa)成像。
[0233]
在特定实施方案中,纳米颗粒可任选地包括结合结构域靶向配体,所述结合结构域靶向配体结合存在于单核细胞和/或巨噬细胞表面上的细胞标志物。
[0234]
m2结合结构域。egr2由m2巨噬细胞表达。针对egr2的可商购的抗体可从thermo fisher,waltham,ma;abcam,cambridge,ma;millipore sigma,burlington,ma;miltenyi biotec,bergisch gladbach,germany;lifespan biosciences,inc.,seattle,wa;以及novus biologicals,littleton,co获得。抗egr2抗体的产生在例如murakami k等人(1993)oncogene 8(6):1559-1566中进行了论述。抗egr2抗体包括:兔单克隆抗egr2抗体克隆epr4004;小鼠单克隆抗egr2抗体克隆1g5;小鼠单克隆抗egr2抗体克隆oti1b12;识别人egr2的aa残基200-300的兔多克隆抗egr2抗体;识别人egr2的aa残基340-420的兔多克隆抗egr2抗体;以及识别人egr2的aa残基370-420的兔多克隆抗egr2抗体。结合结构域可源自这些抗体和本文公开的其他抗体。
[0235]
在特定实施方案中,靶向配体可以是包含结合结构域的纳米抗体,所述结合结构域包含:包含sgnifsinaig(seq id no:45)的cdr1序列、包含titlsgstn(seq id no:46)的cdr2序列、包含ntysdsdvygy(seq id no:47)的cdr3序列。这些反映结合cd206的cdr序列。
[0236]
在特定实施方案中,靶向配体可以是纳米抗体,所述纳米抗体包含:包含pgfkldyyaia(seq id no:48)的cdr1序列、包含sinssggst(seq id no:49)的cdr2序列和包含lrryyglnldpgsydy(seq id no:50)的cdr3序列。这些反映结合cd206的cdr序列。
[0237]
在特定实施方案中,所述靶向配体包括人或人源化结合结构域(例如,纳米抗体),所述人或人源化结合结构域包含:包含gfpfniypms(seq id no:51)的cdr1序列、包含yishggttt(seq id no:52)的cdr2序列和包含gyarlmtdselv(seq id no:53)的cdrh3序列。这些反映结合cd206的cdr序列。
[0238]
对cd206具有特异性的许多另外抗体是本领域技术人员已知的,并且可容易地针对序列、表位结合和亲和力进行表征。参见例如,wo 2014/140376、wo 2013/174537和us 7,560,534。针对cd206的可商购的抗体可从thermo fisher,waltham,ma;proteintech,rosemont,il;biolegend,san diego,ca;r&d systems,minneapolis,mn;lifespan biosciences,inc.,seattle,wa;novus biologicals,littleton,co;以及bio-rad,hercules,ca获得。在特定实施方案中,抗cd206抗体包括大鼠单克隆抗小鼠cd206单克隆抗体克隆c068c2(目录号141732,biolegend,san diego,ca)。
[0239]
在特定实施方案中,所述靶向配体包括结合结构域,所述结合结构域包含:包含asqsvshdv(seq id no:54)的cdrl1序列、包含yts的cdrl2序列、包含qdyssprt(seq id no:56)的cdrl3序列、包含gysitsdy(seq id no:57)的cdrh1序列、包含ysg的cdrh2序列和包含cvsgtyyfdywg(seq id no:59)的cdrh3序列。这些反映结合cd163的mac2-48抗体的cdr序列。
[0240]
在特定实施方案中,所述靶向配体包括结合结构域,所述结合结构域包含:包含asqsvssdv(seq id no:60)的cdrl1序列、包含yas的cdrl2序列、包含qdytsprt(seq id no:62)的cdrl3序列、包含gysitsdy(seq id no:57)的cdrh1序列、包含ysg的cdrh2序列和包含cvsgtyyfdywg(seq id no:59)的cdrh3序列。这些反映结合cd163的mac2-158抗体的cdr序列。
[0241]
对cd163具有特异性的许多另外的抗体或结合结构域是本领域技术人员已知的,并且可容易地针对序列、表位结合和亲和力进行表征。参见例如,wo 2011/039510、wo 2002/032941、wo 2002/076501和us 2005/0214871。针对cd163的可商购的抗体可从thermo fisher,waltham,ma;enzo life sciences,inc.,farmingdale,ny;biolegend,san diego,ca;r&d systems,minneapolis,mn;lifespan biosciences,inc.,seattle,wa;以及rdi research diagnostics,flanders,nj获得。在特定实施方案中,抗cd163抗体可包括:小鼠单克隆抗cd163抗体克隆3d4;小鼠单克隆抗cd163抗体克隆ber-mac3;小鼠单克隆抗cd163抗体克隆edhu-1;以及小鼠单克隆抗cd163抗体克隆ghi/61。
[0242]
在特定实施方案中,所述靶向配体包括结合结构域,所述结合结构域包含:包含rsssksllykdgktyln(seq id no:66)的cdrl1序列、包含lmstras(seq id no:67)的cdrl2序列、包含qqlveypft(seq id no:68)的cdrl3序列、包含gywms(seq id no:69)的cdrh1序列、包含eirlksdnyathyaesvkg(seq id no:70)的cdrh2序列和包含fid的cdrh3序列。这些反映结合cd23的cdr序列。
[0243]
对cd23具有特异性的许多抗体或结合结构域是本领域技术人员已知的,并且可容易地针对序列、表位结合和亲和力进行表征。参见例如,us 7,008,623、us 6,011,138 a(包括5e8、6g5、2c8,b3b1和3g12的抗体)、us 2009/0252725、rector等人(1985)j.immunol.55:481-488;flores-rumeo等人(1993)science 241:1038-1046;sherr等人(1989)j.immunol.142:481-489;以及pene等人,(1988)pnas 85:6820-6824。针对cd23的可商购的抗体可从thermo fisher,waltham,ma;abcam,cambridge,ma;bioss antibodies,inc.,woburn,ma;bio-rad,hercules,ca;lifespan biosciences,inc.,seattle,wa;以及boster biological technology,pleasanton,ca获得。在特定实施方案中,抗cd23抗体可包括:小鼠单克隆抗cd23抗体克隆tu 1;兔单克隆抗cd23抗体克隆sp23;兔单克隆抗cd23抗体克隆epr3617;小鼠单克隆抗cd23抗体克隆5b5;小鼠单克隆抗cd23抗体克隆1b12;小鼠单克隆抗cd23抗体克隆m-l23.4;和小鼠单克隆抗cd23抗体克隆3a2。
[0244]
m1结合结构。在特定实施方案中,所述靶向配体包括结合结构域,所述结合结构域包含:包含ssnigdny(seq id no:72)的cdrl1序列、包含rds的cdrl2序列、包含qsydsslsgs(seq id no:74)的cdrl3序列、包含gftfddyg(seq id no:75)的cdrh1序列、包含iswggkt(seq id no:76)的cdrh2序列和包含argslfhdssgfyfgh(seq id no:77)的cdrh3序列。这些反映结合cd38的ab79抗体的cdr序列。
[0245]
在特定实施方案中,所述靶向配体包括结合结构域,所述结合结构域包含:包含nsnigsnt(seq id no:78)的cdrl1序列、包含sds的cdrl2序列、包含qsydsslsgsr(seq id no:80)的cdrl3序列、包含gftfnnyg(seq id no:81)的cdrh1序列、包含isydgsdk(seq id no:82)的cdrh2序列和包含arvyyygfsgpsmdv(seq id no:83)的cdrh3序列。这些反映结合cd38的ab19抗体的cdr序列。
[0246]
在特定实施方案中,所述靶向配体包括结合结构域,所述结合结构域包含:包含rasqsvssyla(seq id no:84)的cdrl1序列、包含dasnrat(seq id no:85)的cdrl2序列、包含qqrsnwpptf(seq id no:86)的cdrl3序列、包含sfams(seq id no:87)的cdrh1序列、包含aisgsgggtyyadsvkg(seq id no:88)的cdrh2序列和包含dkilwfgepvfdy(seq id no:89)的cdrh3序列。这些反映结合在us 7,829,693中描述的cd38的达雷木单抗(daratumumab)抗体的cdr序列。
[0247]
对cd38具有特异性的许多抗体是本领域技术人员已知的,并且可容易地针对序列、表位结合和亲和力进行表征。参见例如,wo 2005/103083、wo 2006/125640、wo 2007/042309、wo 2008/047242、wo 2012/092612、wo 2006/099875、wo 2011/154453、wo 2015/130728、us 7,829,693以及us 2016/0200828。针对cd38的可商购的抗体可从thermo fisher,waltham,ma;abcam,cambridge,ma;和millipore sigma,burlington,ma获得。在特定实施方案中,抗cd23抗体可包括:兔单克隆抗cd38抗体克隆gad-3;小鼠单克隆抗cd38抗体克隆hit2;小鼠单克隆抗cd38抗体克隆at1;小鼠单克隆抗cd38抗体克隆at13/5;大鼠单克隆抗cd38抗体克隆nimr-5;和大鼠单克隆igg2a,κ抗cd38抗体克隆90/cd38(cat#bd biosciences,san jose,ca)。
[0248]
在特定实施方案中,g蛋白偶联受体18(gpr18)在m1巨噬细胞上被靶向。针对gpr18的可商购的抗体可从assay biotechnology company inc.,sunnyvale,ca;thermo fisher,waltham,ma;abcam,cambridge,ma;genetex,inc.,irvine,ca;和novus biologicals,littleton,co获得。在特定实施方案中,抗gpr18抗体包括:识别人gpr18的氨基酸1-50的一部分的兔多克隆抗gpr18抗体;识别包括人gpr18的氨基酸160-240的区域的兔多克隆抗gpr18抗体;识别包括人gpr18的氨基酸100-180的区域的兔多克隆抗gpr18抗体;兔单克隆抗gpr18抗体克隆epr12359;和识别包括人gpr18的氨基酸140-190的区域的兔多克隆抗gpr18抗体。
[0249]
在特定实施方案中,甲酰基肽受体2(fpr2)在m1巨噬细胞上被靶向。针对fpr2的可商购的抗体可从atlas antibodies,bromma,sweden;biorbyt,llc,san francisco,ca;cloud-clone corp.,katy,tx;us biological life sciences,salem,ma;和novus biologicals,littleton,co获得。在特定实施方案中,抗fpr2抗体包括:小鼠单克隆抗fpr2抗体克隆gm1d6;小鼠单克隆抗fpr2抗体克隆304405;重组抗fpr2抗体克隆rea663;和识别包括fpr2的氨基酸300-350的区域的兔多克隆抗fpr2抗体。
[0250]
在特定实施方案中,所述靶向配体包括结合结构域,所述结合结构域包含:包含rasqsvssyla(seq id no:84)的cdrl1序列、包含dassrat(seq id no:91)的cdrl2序列、包含qlrsnwppyt(seq id no:92)的cdrl3序列、包含gygmh(seq id no:93)的cdrh1序列、包含viwydgsnkyyadsvkg(seq id no:94)的cdrh2序列和包含dtgdrffdy(seq id no:95)的cdrh3序列。这些反映结合cd64的cdr序列。
[0251]
(9)用于施用的组合物。本文公开的纳米颗粒可作为被配制用于向受试者施用的组合物的一部分提供。组合物包括本文公开的纳米颗粒和药学上可接受的载体。
[0252]
常用的示例性药学上可接受的载体包括任何和所有增积剂或填充剂、溶剂或助溶剂、分散介质、包衣、表面活性剂、抗氧化剂(例如抗坏血酸、甲硫氨酸、维生素e)、防腐剂、等渗剂、吸收延迟剂、盐、稳定剂、缓冲剂、螯合剂(例如,edta)、凝胶、粘合剂、崩解剂和/或润滑剂。
[0253]
示例性缓冲剂包括柠檬酸盐缓冲剂、琥珀酸盐缓冲剂、酒石酸盐缓冲剂、富马酸盐缓冲剂、葡萄糖酸盐缓冲剂、草酸盐缓冲剂、乳酸盐缓冲剂、乙酸盐缓冲剂、磷酸盐缓冲剂、组氨酸缓冲剂和/或三甲胺盐。
[0254]
示例性防腐剂包括苯酚、苯甲醇、间甲酚、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、十八烷基二甲基苄基氯化铵、苯扎卤铵、氯化六烃季铵、对羟基苯甲酸烷基酯如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯、邻苯二酚、间苯二酚、环己醇和3-戊醇。
[0255]
示例性等渗剂包括多元糖醇,包括三元或更高级的糖醇,如甘油、赤藓糖醇、阿拉伯糖醇、木糖醇、山梨糖醇或甘露糖醇。
[0256]
示例性稳定剂包括有机糖、多元糖醇、聚乙二醇、含硫还原剂、氨基酸、低分子量多肽、蛋白质、免疫球蛋白、亲水性聚合物或多糖。
[0257]
在特定实施方案中,将组合物配制用于腹膜内、静脉内或颅内注射。本文公开的组合物可进一步配制用于动脉内、结内、淋巴内、肿瘤内、肌内、口服和/或皮下施用,且更特别地通过动脉内、结内、淋巴内、肿瘤内、肌内和/或皮下注射施用。可将本文公开的组合物配制成用于通过输注、灌注或摄入来施用。
[0258]
对于注射,可将组合物配制成水溶液,如在包括汉克斯氏溶液(hanks'solution)、林格氏溶液(ringer's solution)或生理盐水的缓冲液中。水溶液可含有配制剂,如悬浮剂、稳定剂和/或分散剂。或者,所述制剂可呈冻干和/或粉末形式,以便在使用前用合适的媒介物(例如无菌的无热原水)复原。
[0259]
组合物也可配制成贮库制剂。贮库制剂可用合适的聚合或疏水性材料(例如,配制为在可接受的油中的乳液)或离子交换树脂配制,或配制为微溶性衍生物,例如配制为微溶性盐。
[0260]
另外,可利用含有纳米颗粒的固体聚合物的半透性基质将组合物配制成持续释放系统。各种持续释放材料已经建立并且是本领域普通技术人员所熟知的。取决于其化学性质,持续释放系统可在施用数周后长达超过100天释放纳米颗粒。
[0261]
对于口服施用,组合物可配制成片剂、丸剂、糖衣丸、胶囊、液体、凝胶、糖浆、浆液、悬浮液等。
[0262]
当配制以用于治疗癌症时,所公开的组合物还可包括携带一种或多种选自以下的抗癌基因的核苷酸:p53、rb、brca1、e1a、bcl-2、mdr-1、p21、p16、bax、bcl-xs、e2f、igf-i vegf、血管抑素、制瘤素、内皮抑素、gm-csf、il-12、il-2、il-4、il-7、ifn-γ、tnfα和/或hsv-tk。
[0263]
本文公开的任何组合物制剂可有利地包括任何其他药学上可接受的载体,所述载体包括不会产生显著不利的、过敏或其他不合宜反应的那些载体,所述反应无论是用于研究、防治和/或治疗性治疗均超过施用益处。示例性药学上可接受的载体和制剂公开于
remington'spharmaceutical sciences,第18版mack printing company,1990中。此外,可按照美国fda生物标准办公室和/或其他相关外国监管机构的要求,制备制剂以满足无菌性、热原性、一般安全性和纯度标准。
[0264]
在特定实施方案中,所述纳米颗粒作为组合物的一部分提供,所述组合物可包括例如至少0.1%w/v或w/w纳米颗粒;至少1%w/v或w/w纳米颗粒;至少10%w/v或w/w纳米颗粒;至少20%w/v或w/w纳米颗粒;至少30%w/v或w/w纳米颗粒;至少40%w/v或w/w纳米颗粒;至少50%w/v或w/w纳米颗粒;至少60%w/v或w/w纳米颗粒;至少70%w/v或w/w纳米颗粒;至少80%w/v或w/w纳米颗粒;至少90%w/v或w/w纳米颗粒;至少95%w/v或w/w纳米颗粒;或至少99%w/v或w/w纳米颗粒。
[0265]
(10)使用方法本文公开的方法包括通过将包括编码一种或多种irf和ikkβ的核苷酸的纳米颗粒并入巨噬细胞中来将巨噬细胞的活化状态从失活状态改变为活化的状态。在特定实施方案中,所述改变导致与未用包括编码一种或多种irf和ikkβ的核苷酸的纳米颗粒处理的处于失活状态的巨噬细胞的百分比相比,用包括编码一种或多种irf和ikkβ的核苷酸的纳米颗粒处理的巨噬细胞群中失活状态的巨噬细胞(例如,m2巨噬细胞)的百分比降低5倍、10倍、15倍、20倍或更多倍。在特定实施方案中,所述改变导致与未用包括编码一种或多种irf和ikkβ的核苷酸的纳米颗粒处理的处于失活状态的巨噬细胞的数量相比,用包括编码一种或多种irf和ikkβ的核苷酸的纳米颗粒处理的巨噬细胞群体中处于失活状态的巨噬细胞(例如,m2巨噬细胞)的数量降低5倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍或更多倍。
[0266]
在特定实施方案中,通过将包括编码一种或多种irf和ikkβ的核苷酸的纳米颗粒引入巨噬细胞中来将巨噬细胞的活化状态从失活状态改变为活化的状态导致:恢复淋巴细胞迁移和浸润至治疗部位,如实体瘤或感染或炎症部位中;使包括il-1β、il-12、ifnγ和/或tnfα的促炎性(抗肿瘤)细胞因子的释放增加1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍或更多倍;使与m2巨噬细胞表型相关的细胞因子(包括il-6)的释放降低1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍或更多倍。
[0267]
在特定实施方案中,将巨噬细胞的活化状态从失活状态改变为活化的状态包括将包括编码irf5和irf8的核苷酸的纳米颗粒引入巨噬细胞中。在特定实施方案中,将巨噬细胞的活化从失活状态改变为活化的状态包括将包括编码突变型irf的核苷酸的纳米颗粒引入巨噬细胞中,所述突变型irf具有组成性活性或比其野生型对应irf更具活性。
[0268]
本文公开的方法另外导致从经遗传修饰的单核细胞/巨噬细胞以及任选的tgfβ抑制剂分泌多特异性分子(例如,双特异性分子)。
[0269]
本文公开的方法包括用本文公开的组合物治疗受试者(人、兽医动物、牲畜和研究动物)。治疗受试者包括递送治疗有效量。治疗有效量可提供有效量、防治性治疗和/或治疗性治疗。
[0270]“有效量”是引起受试者的所需生理变化所必需的化合物的量。通常施用有效量用于研究目的。本文公开的有效量免疫调节受试者的细胞。在特定实施方案中,待免疫调节的细胞是免疫抑制的细胞。在特定实施方案中,待免疫调节的细胞是巨噬细胞。在特定实施方案中,巨噬细胞的免疫调节包括将免疫抑制的巨噬细胞转变为活化的巨噬细胞。在特定实
施方案中,巨噬细胞的免疫调节包括将m2巨噬细胞转变为m1巨噬细胞。在特定实施方案中,待免疫调节的细胞包括免疫抑制的细胞,包括mdsc、treg、dcreg、嗜中性粒细胞、th17、breg和/或msc。在特定实施方案中,免疫抑制细胞的免疫调节包括免疫抑制细胞从促肿瘤至抗肿瘤的表型和/或功能转变。
[0271]“防治性治疗”包括如下治疗:施用至不展示疾病或疾患的体征或症状或仅展示疾病或疾患的早期体征或症状的受试者,以使得施用治疗是为了减轻、预防所述疾病或疾患或降低进一步发展所述疾病或疾患的风险。因此,防治性治疗用作针对疾病或病症的预防性治疗。例如,在特定实施方案中,防治性治疗包括向患有癌症但处于缓解状态的受试者施用本文公开的组合物,以使得施用治疗是为了减少或延迟复发的发生。
[0272]“治疗性治疗”包括施用至展示疾病或疾患的症状或体征的受试者的治疗,并且施用至受试者是为了减轻或消除所述疾病或疾患的那些体征或症状。例如,在特定实施方案中,治疗性治疗包括向患有癌症的受试者施用本文公开的组合物以减轻或消除肿瘤和/或转移。
[0273]
在特定实施方案中,治疗有效量在受试者中提供抗癌作用。癌症(医学术语:恶性赘瘤)是指一组细胞展示不受控制的生长(超出正常限值的分裂)、侵袭(侵入相邻组织上并破坏相邻组织)且有时转移的一类疾病。“转移”是指癌细胞从其原始增殖位点扩散到身体的另一部分。转移的形成是非常复杂的过程,并且取决于恶性细胞从原发肿瘤的分离、细胞外基质的侵袭、内皮基底膜的渗透从而进入体腔和血管,然后经血液运输、浸润目标器官。最后,在目标部位的新肿瘤,即继发性肿瘤或转移性肿瘤的生长取决于血管生成。即使在除去原发肿瘤之后,肿瘤转移也经常发生,因为肿瘤细胞或组分可能保留并发展转移潜力。
[0274]
在特定实施方案中,治疗有效量在受试者中提供抗肿瘤作用。“肿瘤”是由细胞(称为赘瘤性细胞或肿瘤细胞)的异常生长形成的肿胀或病变。“肿瘤细胞”是通过快速不受控制的细胞增殖分裂并在引发新分裂的刺激停止后继续分裂的异常细胞。肿瘤显示出部分或完全缺乏正常组织的结构组构和与正常组织的功能协调,并且通常形成明显的组织块,其可以是良性、恶性前或恶性的。
[0275]
抗肿瘤作用是指生物学作用,其可表现为肿瘤细胞数量减少、转移数量减少、肿瘤体积减小、预期寿命增加、诱导的癌细胞凋亡、诱导癌细胞死亡、诱导的癌细胞的化学敏感性或放射敏感性、抑制癌细胞附近的血管生成、抑制癌细胞增殖、抑制肿瘤生长、预防转移、延长受试者的生命、减轻癌症相关的疼痛、减少转移数量和/或减少治疗后癌症的复发或重现。因此,本文公开的组合物可用于治疗多种癌症,可预防或显著延迟转移,和/或可预防或显著延迟复发。在特定实施方案中,用本文公开的纳米颗粒组合物治疗的患有癌症的受试者的总体存活与未用所述纳米颗粒组合物治疗的患有相同癌症的对照受试者相比提高1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、2.1倍、2.2倍、2.3倍、2.4倍、2.5倍或更多倍。在特定实施方案中,用本文公开的纳米颗粒组合物治疗的患有癌症的受试者的转移的数量与未用所述纳米颗粒组合物治疗的患有相同癌症的对照受试者相比减少1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍或更多倍。
[0276]
在特定实施方案中,治疗性治疗包括将本文公开的组合物与另一种疗法组合施用至患有癌症的受试者以减少或消除肿瘤。在特定实施方案中,与本文公开的组合物组合使用的疗法包括癌症疫苗、car免疫疗法(例如,car-t免疫疗法)、化学疗法、放射疗法、激素疗
法、信号转导抑制剂、基因表达调节剂、凋亡诱导剂、血管生成抑制剂以及递送有毒分子的单克隆抗体。在特定实施方案中,将本文公开的纳米颗粒组合物与放射疗法组合施用至患有癌症的受试者与未施用所述纳米颗粒组合物与放射疗法的组合的患有相同癌症的对照受试者相比使总体存活提高1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、2.1倍、2.2倍、2.3倍、2.4倍、2.5倍或更多倍。
[0277]
可用本文公开的系统和方法治疗的癌症包括卵巢癌、乳腺癌、脑癌、黑素瘤、肺转移、精原细胞瘤、畸胎瘤、成神经细胞瘤、神经胶质瘤、直肠癌、子宫内膜癌、肾癌、肾上腺癌、甲状腺癌、皮肤癌、宫颈癌、肠癌、肝癌、结肠癌、胃癌、头颈癌、胃肠道癌、淋巴结癌、食道癌、结直肠癌、胰腺癌、耳鼻喉(ent)癌、前列腺癌、子宫癌、肺癌以及它们转移。
[0278]
在特定实施方案中,治疗有效量提供抗病原体作用。抗病原体作用可包括抗感染作用。抗感染作用可包括减少感染的发生、降低感染的严重程度、减少感染的持续时间、减少受感染细胞的数量、减少感染组织的体积、预期寿命增加、诱导受感染细胞对免疫清除的敏感性、减少感染相关的疼痛和/或减少或消除与所治疗感染相关的症状。
[0279]
在特定实施方案中,治疗有效量提供抗炎作用。抗炎作用可包括减轻炎症相关的疼痛、发热、发红、肿胀和/或功能丧失。
[0280]
在特定实施方案中,治疗有效量提供抗克隆氏病作用或抗溃疡性结肠炎作用。抗克隆氏病作用或抗溃疡性结肠炎作用可包括减少腹泻、减少直肠出血、减少不明原因的体重减轻、减少发热、减少腹痛和痉挛、减少疲劳和低能量感和/或恢复食欲。
[0281]
在特定实施方案中,治疗有效量提供抗关节炎作用。抗关节炎作用可包括减轻关节的疼痛、僵硬、肿胀、发红和/或恢复运动范围。关节炎的类型包括类风湿性关节炎(ra)、强直性脊柱炎和银屑病关节炎。
[0282]
在特定实施方案中,治疗有效量提供抗斑块状银屑病作用。抗斑块状银屑病作用可包括减少红色斑块、脱屑斑、瘙痒、灼热、酸痛、甲床异常和/或关节肿胀或僵硬。
[0283]
对于施用,可基于体外测定和/或动物模型研究的结果初始估计治疗有效量(本文中也称为剂量)。例如,可在动物模型中配制剂量以达到包括在细胞培养物中针对特定靶标确定的ic
50
的循环浓度范围。此类信息可用于更准确地确定目标受试者的可用剂量。
[0284]
施用至特定受试者的实际剂量的量可由医师、兽医或研究人员在考虑诸如包括受试者的目标、体重、疾患的严重程度、疾病类型、先前或同时的治疗干预、特发性疾病在内的身体和生理因素以及施用途径的参数的情况下确定。
[0285]
有用剂量通常在0.1至5μg/kg或0.5至1μg/kg的范围内。在特定实施方案中,剂量可包括1μg/kg、5μg/kg、10μg/kg、15μg/kg、20μg/kg、25μg/kg、30μg/kg、35μg/kg、40μg/kg、45μg/kg、50μg/kg、55μg/kg、60μg/kg、65μg/kg、70μg/kg、75μg/kg、80μg/kg、85μg/kg、90μg/kg、95μg/kg、100μg/kg、150μg/kg、200μg/kg、250μg/kg、350μg/kg、400μg/kg、450μg/kg、500μg/kg、550μg/kg、600μg/kg、650μg/kg、700μg/kg、750μg/kg、800μg/kg、850μg/kg、900μg/kg、950μg/kg、1000μg/kg、0.1至5mg/kg或0.5至1mg/kg。在特定实施方案中,剂量可包括1mg/kg、5mg/kg、10mg/kg、15mg/kg、20mg/kg、25mg/kg、30mg/kg、35mg/kg、40mg/kg、45mg/kg、50mg/kg、55mg/kg、60mg/kg、65mg/kg、70mg/kg、75mg/kg、80mg/kg、85mg/kg、90mg/kg、95mg/kg、100mg/kg、150mg/kg、200mg/kg、250mg/kg、350mg/kg、400mg/kg、450mg/kg、500mg/kg、550mg/kg、600mg/kg、650mg/kg、700mg/kg、750mg/kg、800mg/kg、850mg/kg、900mg/kg、
950mg/kg、1000mg/kg或更多。
[0286]
治疗有效量可通过在治疗方案的过程期间(例如每天、每隔一天、每3天、每4天、每5天、每6天、每周、每2周、每3周、每月、每2个月、每3个月、每4个月、每5个月、每6个月、每7个月、每8个月、每9个月、每10个月、每11个月或每年)施用单个或多个剂量来实现。在特定实施方案中,治疗有效量可通过在治疗方案过程期间施用重复剂量来实现。
[0287]
本文所述的纳米颗粒组合物可通过注射、吸入、输注、灌注、灌洗或摄入来施用。施用途径可包括静脉内、真皮内、动脉内、肠胃外、鼻内、结节内、淋巴管内、腹膜内、颅内、病变内、前列腺内、阴道内、直肠内、局部、鞘内、肿瘤内、肌肉内、膀胱内、口服、皮下和/或舌下施用,并且更特别地通过静脉内、肿瘤内、腹膜内和/或颅内注射施用。局部施用包括将治疗有效量的本文公开的组合物施用至身体的特定区域、器官或腔。例如,腹膜内注射可用于递送治疗卵巢癌的治疗剂,或颅内注射可用于递送治疗神经胶质瘤的治疗剂。在肿瘤部位施用治疗剂可包括使用如上所述的靶向配体将配体介导的治疗剂(例如,纳米颗粒组合物)靶向肿瘤细胞和/或肿瘤支持细胞而不靶向健康组织。在肿瘤部位施用治疗剂可包括使治疗剂(例如,纳米颗粒组合物)被动靶向肿瘤细胞和/或肿瘤支持细胞而不是健康组织。被动靶向的具体实施方案可包括基于纳米颗粒的大小范围以及肿瘤组织的渗漏血管系统和受损的淋巴引流的高渗透长滞留(enhanced permeability and retention,epr)现象。相比之下,全身性施用是全身的,并且典型地通过将组合物或治疗剂静脉内注射到循环中来实现。治疗剂的全身性施用可用于癌症如已转移的癌症的较不局部化的形式。
[0288]
(11)示例性实施方案。
[0289]
1.一种纳米颗粒,所述纳米颗粒包括:
[0290]
结合至专职吞噬细胞的靶向配体;和
[0291]
编码至少具有第一结合结构域和第二结合结构域的蛋白质分子的核酸,
[0292]
其中所述第一结合结构域对由免疫细胞表达的细胞表面蛋白具有特异性,并且
[0293]
其中所述第二结合结构域对由目标细胞表达的细胞表面蛋白具有特异性。
[0294]
2.如实施方案1所述的纳米颗粒,其中所述目标细胞是癌细胞、受感染细胞、自身反应性细胞或原核细胞。
[0295]
3.如实施方案1或2所述的纳米颗粒,其中所述靶向配体结合至由单核细胞、巨噬细胞或两者表达的细胞表面蛋白。
[0296]
4.如实施方案1-3中任一项所述的纳米颗粒,其中所述靶向配体包括二-甘露糖。
[0297]
5.如实施方案1-4中任一项所述的纳米颗粒,其中所述核酸包括核糖核酸(rna)。
[0298]
6.如实施方案5所述的纳米颗粒,其中所述rna包括信使rna(mrna)。
[0299]
7.如实施方案6所述的纳米颗粒,其中所述mrna包括合成rna或体外转录的rna(ivt rna)。
[0300]
8.如实施方案1-7中任一项所述的纳米颗粒,其中所述第一结合结构域对淋巴细胞的细胞表面蛋白具有特异性。
[0301]
9.如实施方案8所述的纳米颗粒,其中所述淋巴细胞选自包括以下的组:t细胞、b细胞、自然杀伤(nk)细胞和肿瘤浸润淋巴细胞(til)。
[0302]
10.如实施方案1-9中任一项所述的纳米颗粒,其中所述第一结合结构域对选自包括以下的组的t细胞的细胞表面蛋白具有特异性:cd8+t细胞、cd4+t细胞、γδt细胞和nk t
细胞。
[0303]
11.如实施方案1-10中任一项所述的纳米颗粒,其中所述第一结合结构域对cd3具有特异性。
[0304]
12.如实施方案1-11中任一项所述的纳米颗粒,其中所述蛋白质分子是多特异性t细胞衔接子。
[0305]
13.如实施方案1-12中任一项所述的纳米颗粒,其中所述蛋白质分子是epcam-cd3双特异性t细胞衔接子。
[0306]
14.如实施方案1-13中任一项所述的纳米颗粒,其中所述第二结合结构域对由所述目标细胞表达的抗原具有特异性。
[0307]
15.如实施方案1-14中任一项所述的纳米颗粒,所述纳米颗粒还包括编码一种或多种干扰素调控因子(irf)的第二核酸。
[0308]
16.如实施方案1-15中任一项所述的纳米颗粒,所述纳米颗粒还包括肿瘤细胞增殖抑制剂或编码肿瘤细胞增殖抑制剂的核酸。
[0309]
17.如实施方案1-16中任一项所述的纳米颗粒,其中所述核酸编码抗体或抗体的抗原结合片段。
[0310]
18.如实施方案1-17中任一项所述的纳米颗粒,其中所述纳米颗粒包括编码cd40-cd40l抑制剂或tgfβ抑制剂的核酸。
[0311]
19.如实施方案1-18中任一项所述的纳米颗粒,其中所述纳米颗粒是脂质体、脂质体纳米颗粒、脂质纳米颗粒或固体脂质纳米颗粒。
[0312]
20.一种组合物,所述组合物包含:
[0313]
第一多个纳米颗粒,其中所述第一多个纳米颗粒中的每一个包括:
[0314]
结合至专职吞噬细胞的靶向配体;和
[0315]
编码蛋白质分子的核酸,所述蛋白质分子具有对由免疫细胞表达的细胞表面蛋白具有特异性的第一结合结构域和对由目标细胞表达的细胞表面蛋白具有特异性的第二结合结构域。
[0316]
21.如实施方案20所述的组合物,其中所述目标细胞是癌细胞、受感染细胞、自身反应性细胞或原核细胞。
[0317]
22.如实施方案20或21所述的组合物,其中所述靶向配体结合至由单核细胞、巨噬细胞或两者表达的细胞表面蛋白。
[0318]
23.如实施方案20-22中任一项所述的组合物,其中所述靶向配体包括二-甘露糖。
[0319]
24.如实施方案20-23中任一项所述的组合物,其中所述核酸包括rna。
[0320]
25.如实施方案24所述的组合物,其中所述rna包括mrna。
[0321]
26.如实施方案25所述的组合物,其中所述mrna包括合成rna或ivt rna。
[0322]
27.如实施方案20-26中任一项所述的组合物,其中所述第一结合结构域对淋巴细胞的细胞表面蛋白具有特异性。
[0323]
28.如实施方案27所述的组合物,其中所述淋巴细胞选自包括以下的组:t细胞、b细胞、nk细胞和til细胞。
[0324]
29.如实施方案20-28中任一项所述的组合物,其中所述第一结合结构域对选自包括以下的组的t细胞的细胞表面蛋白具有特异性:cd8+t细胞、cd4+t细胞、γδt细胞和nk t
细胞。
[0325]
30.如实施方案20-29中任一项所述的组合物,其中所述第一结合结构域对cd3具有特异性。
[0326]
31.如实施方案20-30中任一项所述的组合物,其中所述蛋白质分子是双特异性t细胞衔接子。
[0327]
32.如实施方案20-31中任一项所述的组合物,其中所述蛋白质分子是epcam-cd3双特异性t细胞衔接子。
[0328]
33.如实施方案20-32中任一项所述的组合物,其中所述第二结合结构域对由所述目标细胞表达的抗原具有特异性。
[0329]
34.如实施方案20-33中任一项所述的组合物,所述组合物还包含药学上可接受的载体。
[0330]
35.如实施方案20-34中任一项所述的组合物,其中所述第一多个纳米颗粒的至少一个子集还包括(a)编码一种或多种干扰素调控因子(irf)的核酸和(b)编码ikkβ的核酸中的一者或多者。
[0331]
36.如实施方案20-35中任一项所述的组合物,其中所述第一多个纳米颗粒包括脂质体、脂质体纳米颗粒、脂质纳米颗粒或固体脂质纳米颗粒。
[0332]
37.如实施方案20-36中任一项所述的组合物,所述组合物还包含:
[0333]
第二多个纳米颗粒,其中所述第二多个纳米颗粒的至少一个子集包括(a)编码一种或多种干扰素调控因子(irf)的核酸和(b)编码ikkβ的核酸中的一者或多者。
[0334]
38.如实施方案20-37中任一项所述的组合物,所述组合物还包含肿瘤细胞增殖抑制剂。
[0335]
39.如实施方案20-38中任一项所述的组合物,其中所述第一或第二多个纳米颗粒的至少一个子集还包括编码肿瘤细胞增殖抑制剂的核酸。
[0336]
40.如实施方案20-39中任一项所述的组合物,其中所述第一或第二多个纳米颗粒的至少一个子集还包括编码肿瘤细胞增殖抑制剂的抗体的抗原结合片段的核酸。
[0337]
41.如实施方案37-40中任一项所述的组合物,其中所述第二多个纳米颗粒包括脂质体、脂质体纳米颗粒、脂质纳米颗粒或固体脂质纳米颗粒。
[0338]
42.如实施方案20-41中任一项所述的组合物,所述组合物还包含第三多个纳米颗粒,其中所述第三多个纳米颗粒的至少一个子集包括编码肿瘤细胞增殖抑制剂的抗体的抗原结合片段的核酸。
[0339]
43.如实施方案38-42中任一项所述的组合物,其中所述肿瘤细胞增殖抑制剂是cd40-cd40l抑制剂或tgfβ抑制剂。
[0340]
44.如实施方案42或43所述的组合物,所述组合物在不存在所述第二多个纳米颗粒的情况下包含所述第一多个纳米颗粒和所述第三多个纳米颗粒。
[0341]
45.如实施方案42-44中任一项所述的组合物,其中所述第三多个纳米颗粒包括脂质体、脂质体纳米颗粒、脂质纳米颗粒或固体脂质纳米颗粒。
[0342]
46.一种用于治疗人受试者的疾患的组合物,所述组合物包含:
[0343]
第一多个纳米颗粒,其中所述多个纳米颗粒中的每一个包括:
[0344]
(i)结合至单核细胞、巨噬细胞或两者的靶向配体;和
[0345]
(ii)编码蛋白质分子的mrna,所述蛋白质分子至少具有对由淋巴细胞表达的细胞表面蛋白具有特异性的第一结合结构域和对由目标细胞表达的细胞表面蛋白具有特异性的第二结合结构域;
[0346]
其中所述第一多个纳米颗粒刺激或增强所述人受试者中的免疫应答,从而治疗所述疾患。
[0347]
47.如实施方案46所述的组合物,其中所述目标细胞是癌细胞、受感染细胞、自身反应性细胞或原核细胞。
[0348]
48.如实施方案46或47中任一项所述的组合物,其中所述靶向配体包括二甘露糖。
[0349]
49.如实施方案46-48中任一项所述的组合物,其中所述mrna包括合成rna或ivt rna。
[0350]
50.如实施方案46-49中任一项所述的组合物,其中所述第一结合结构域对淋巴细胞的细胞表面蛋白具有特异性。
[0351]
51.如实施方案50所述的组合物,其中所述淋巴细胞选自包括以下的组:t细胞、b细胞、nk细胞和til细胞。
[0352]
52.如实施方案46-51中任一项所述的组合物,其中所述第一结合结构域对选自包括以下的组的t细胞的细胞表面蛋白具有特异性:cd8+t细胞、cd4+t细胞、γδt细胞和nk t细胞。
[0353]
53.如实施方案46-52中任一项所述的组合物,其中所述第一结合结构域对cd3具有特异性。
[0354]
54.如实施方案46-53中任一项所述的组合物,其中所述蛋白质分子是双特异性t细胞衔接子。
[0355]
55.如实施方案46-54中任一项所述的组合物,其中所述蛋白质分子是epcam-cd3双特异性t细胞衔接子。
[0356]
56.如实施方案46-55中任一项所述的组合物,其中所述第二结合结构域对由所述目标细胞表达的抗原具有特异性。
[0357]
57.如实施方案46-56中任一项所述的组合物,所述组合物还包含药学上可接受的载体。
[0358]
58.如实施方案46-57中任一项所述的组合物,其中所述第一多个纳米颗粒的至少一个子集还包括以下中的一者或多者:(a)编码一种或多种干扰素调控因子(irf)的mrna,(b)编码ikkβ的mrna,或(c)编码一种或多种irf的mrna和编码ikkβ的mrna,和(c)编码肿瘤细胞增殖抑制剂的mrna。
[0359]
59.如实施方案46-58中任一项所述的组合物,其中所述第一多个纳米颗粒包括脂质体、脂质体纳米颗粒、脂质纳米颗粒或固体脂质纳米颗粒。
[0360]
60.如实施方案46-59中任一项所述的组合物所述组合物还包含:
[0361]
第二多个纳米颗粒,其中所述第二多个纳米颗粒中的每一个包括
[0362]
结合至单核细胞、巨噬细胞或两者的靶向配体,和
[0363]
以下中的一者或多者:(a)编码一种或多种干扰素调控因子(irf)的mrna,(b)编码ikkβ的mrna,和(c)编码肿瘤细胞增殖抑制剂的mrna。
[0364]
61.如实施方案60所述的组合物,其中所述第二多个纳米颗粒包括编码肿瘤细胞
增殖抑制剂的抗体的抗原结合片段的mrna。
[0365]
62.如实施方案60或61所述的组合物,其中所述肿瘤细胞增殖抑制剂是cd40-cd40l抑制剂或tgfβ抑制剂。
[0366]
63.如实施方案60-62中任一项所述的组合物,其中所述第二多个纳米颗粒包括脂质体、脂质体纳米颗粒、脂质纳米颗粒或固体脂质纳米颗粒。
[0367]
64.一种用于治疗人受试者的疾患的方法,所述方法包括:
[0368]
向所述人受试者施用包含第一多个纳米颗粒的组合物,其中所述第一多个纳米颗粒中的每一个包括:
[0369]
(i)结合至单核细胞、巨噬细胞或两者的靶向配体;和
[0370]
(ii)编码蛋白质分子的mrna,所述蛋白质分子至少具有对由淋巴细胞表达的细胞表面蛋白具有特异性的第一结合结构域和对由目标细胞表达的细胞表面蛋白具有特异性的第二结合结构域;
[0371]
其中所述多个纳米颗粒刺激或增强所述人受试者中的免疫应答,从而治疗所述疾患。
[0372]
65.如实施方案64所述的方法,其中所述目标细胞是癌细胞、受感染细胞、自身反应性细胞或原核细胞。
[0373]
66.如实施方案64或65中任一项所述的方法,其中所述靶向配体包括二甘露糖。
[0374]
67.如实施方案64-66中任一项所述的方法,其中所述mrna包括合成rna或ivt rna。
[0375]
68.如实施方案64-67中任一项所述的方法,其中所述淋巴细胞选自包括以下的组:t细胞、b细胞、nk细胞和til细胞。
[0376]
69.如实施方案64-68中任一项所述的方法,其中所述第一结合结构域对选自包括以下的组的t细胞的细胞表面蛋白具有特异性:cd8+t细胞、cd4+t细胞、γδt细胞和nk t细胞。
[0377]
70.如实施方案64-69中任一项所述的方法,其中所述第一结合结构域对cd3具有特异性。
[0378]
71.如实施方案64-70中任一项所述的方法,其中所述蛋白质分子是双特异性t细胞衔接子。
[0379]
72.如实施方案64-71中任一项所述的方法,其中所述蛋白质分子是epcam-cd3双特异性t细胞衔接子。
[0380]
73.如实施方案64-72中任一项所述的方法,其中所述第二结合结构域对由所述目标细胞表达的抗原具有特异性。
[0381]
74.如实施方案64-73中任一项所述的方法,其中所述组合物还包含药学上可接受的载体。
[0382]
75.如实施方案64-74中任一项所述的方法,其中所述第一多个纳米颗粒的至少一个子集还包括以下中的一者或多者:(a)编码一种或多种干扰素调控因子(irf)的核酸,(b)编码ikkβ的核酸,和(c)编码肿瘤细胞增殖抑制剂的核酸。
[0383]
76.如实施方案64-75中任一项所述的组合物,其中所述第一多个纳米颗粒包括脂质体、脂质体纳米颗粒、脂质纳米颗粒或固体脂质纳米颗粒。
[0384]
77.如实施方案64-76中任一项所述的方法,所述方法还包括:
[0385]
向所述人受试者施用包含第二多个纳米颗粒的组合物,其中所述第二多个纳米颗粒中的每一个包括:
[0386]
结合至单核细胞、巨噬细胞或两者的靶向配体,和
[0387]
以下中的一者或多者:(a)编码一种或多种干扰素调控因子(irf)的mrna,和(b)编码ikkβ的mrna。
[0388]
78.如实施方案75-77中任一项所述的方法,其中所述第一或第二多个纳米颗粒的至少一个子集还包括编码肿瘤细胞增殖抑制剂的mrna。
[0389]
79.如实施方案77或78所述的组合物,其中所述第二多个纳米颗粒包括脂质体、脂质体纳米颗粒、脂质纳米颗粒或固体脂质纳米颗粒。
[0390]
80.如实施方案64-79中任一项所述的方法,所述方法还包括:
[0391]
向所述人受试者施用包含第三多个纳米颗粒的组合物,其中所述第三多个纳米颗粒中的每一个包括:
[0392]
结合至单核细胞、巨噬细胞或两者的靶向配体,和
[0393]
编码肿瘤细胞增殖抑制剂的mrna。
[0394]
81.如实施方案75-80中任一项所述的方法,其中,编码肿瘤细胞增殖抑制剂的mrna编码肿瘤细胞增殖抑制剂的抗体的抗原结合片段。
[0395]
82.如实施方案75-81中任一项所述的方法,其中所述肿瘤细胞增殖抑制剂是cd40-cd40l抑制剂或tgfβ抑制剂。
[0396]
83.如实施方案80-82中任一项所述的组合物,其中所述第三多个纳米颗粒包括脂质体、脂质体纳米颗粒、脂质纳米颗粒或固体脂质纳米颗粒。
[0397]
84.如实施方案77-83中任一项所述的方法,其中施用包含所述第一多个纳米颗粒的组合物的步骤和施用包含所述第二多个纳米颗粒的组合物的步骤同时或依序进行。
[0398]
85.如实施方案77-83中任一项所述的方法,其中施用包含所述第一多个纳米颗粒的组合物的步骤在施用包含所述第二多个纳米颗粒的组合物的步骤之后进行。
[0399]
86.如实施方案80-85中任一项所述的方法,其中施用包含所述第三多个纳米颗粒的组合物的步骤与施用所述第一多个纳米颗粒的步骤同时或依次进行。
[0400]
87.如实施方案80-85中任一项所述的方法,其中施用包含所述第三多个纳米颗粒的组合物的步骤与施用所述第二多个纳米颗粒的步骤同时或依次进行。
[0401]
88.如实施方案80-85中任一项所述的方法,所述方法包括在不存在施用包含所述第二多个纳米颗粒的组合物的步骤的情况下施用包含所述第一多个纳米颗粒的组合物和施用包含所述第三多个纳米颗粒的组合物的步骤。
[0402]
89.一种经修饰的专职吞噬细胞,所述经修饰的专职吞噬细胞包含:
[0403]
负载有编码蛋白质分子的核酸的纳米颗粒,所述蛋白质分子至少具有对由免疫细胞表达的细胞表面蛋白具有特异性的第一结合结构域和对由目标细胞表达的细胞表面蛋白具有特异性的第二结合结构域,
[0404]
其中所述纳米颗粒粘附于所述吞噬细胞的表面或者已被所述吞噬细胞内化。
[0405]
90.如实施方案89所述的经修饰的专职吞噬细胞,其中所述目标细胞是癌细胞、受感染细胞、自身反应性细胞或原核细胞。
[0406]
91.如实施方案89或90中任一项所述的经修饰的专职吞噬细胞,其中所述吞噬细胞是单核细胞或巨噬细胞。
[0407]
92.如实施方案89-91中任一项所述的经修饰的专职吞噬细胞,其中所述吞噬细胞是肿瘤相关巨噬细胞。
[0408]
93.如实施方案89-92中任一项所述的经修饰的专职吞噬细胞,其中所述核酸包括核糖核酸(rna)。
[0409]
94.如实施方案93所述的经修饰的专职吞噬细胞,其中所述rna包括信使rna(mrna)。
[0410]
95.如实施方案94所述的经修饰的专职吞噬细胞,其中所述mrna包括合成rna或体外转录的rna(ivt rna)。
[0411]
96.如实施方案89-95中任一项所述的经修饰的专职吞噬细胞,其中所述第一结合结构域对淋巴细胞的细胞表面蛋白具有特异性。
[0412]
97.如实施方案96所述的经修饰的专职吞噬细胞,其中所述淋巴细胞选自包括以下的组:t细胞、b细胞、nk细胞和til细胞。
[0413]
98.如实施方案89-97中任一项所述的经修饰的专职吞噬细胞,其中所述第一结合结构域对选自包括以下的组的t细胞的细胞表面蛋白具有特异性:cd8+t细胞、cd4+t细胞、γδt细胞和nk t细胞。
[0414]
99.如实施方案89-98中任一项所述的经修饰的专职吞噬细胞,其中所述第一结合结构域对cd3具有特异性。
[0415]
100.如实施方案89-99中任一项所述的经修饰的专职吞噬细胞,其中所述蛋白质分子是双特异性t细胞衔接子。
[0416]
101.如实施方案89-100中任一项所述的经修饰的专职吞噬细胞,其中所述蛋白质分子是epcam-cd3双特异性t细胞衔接子。
[0417]
102.如实施方案89-101中任一项所述的经修饰的专职吞噬细胞,其中所述纳米颗粒进一步负载有以下中的一者或多者:(a)编码一种或多种干扰素调控因子(irf)的核酸,(b)编码ikkβ的核酸,和(c)编码肿瘤细胞增殖抑制剂的核酸。
[0418]
103.如实施方案89-102中任一项所述的经修饰的专职吞噬细胞,其中所述纳米颗粒包括脂质体、脂质体纳米颗粒、脂质纳米颗粒或固体脂质纳米颗粒。
[0419]
104.如实施方案89-103中任一项所述的经修饰的专职吞噬细胞,所述经修饰的专职吞噬细胞还包含:
[0420]
负载有以下中的一者或多者的第二纳米颗粒:(a)编码一种或多种干扰素调控因子(irf)的核酸,(b)编码ikkβ的核酸,和(c)编码肿瘤细胞增殖抑制剂的核酸,
[0421]
其中所述第二纳米颗粒粘附于所述吞噬细胞的表面或者已被所述吞噬细胞内化。
[0422]
105.如实施方案104所述的经修饰的专职吞噬细胞,其中所述第二纳米颗粒包括脂质体、脂质体纳米颗粒、脂质纳米颗粒或固体脂质纳米颗粒。
[0423]
106.如实施方案104或105所述的经修饰的专职吞噬细胞,其中所述第一或第二纳米颗粒负载有编码肿瘤细胞增殖抑制剂的抗体或抗体的抗原结合片段的核酸。
[0424]
107.如实施方案102-106中任一项所述的经修饰的专职吞噬细胞,其中所述肿瘤细胞增殖抑制剂是cd40-cd40l抑制剂或tgfβ抑制剂。
[0425]
108.如实施方案89-107中任一项所述的经修饰的专职吞噬细胞,所述经修饰的专职吞噬细胞还包含以下中的至少一者:
[0426]
负载有以下中的一者或多者的第二纳米颗粒:(a)编码一种或多种干扰素调控因子(irf)的核酸,(b)编码ikkβ的核酸,或(c)编码肿瘤细胞增殖抑制剂的核酸,以及
[0427]
负载有编码肿瘤细胞增殖抑制剂的核酸的第三纳米颗粒,
[0428]
其中所述第二和第三纳米颗粒中的每一个粘附于所述吞噬细胞的表面或者已被所述吞噬细胞内化。
[0429]
109.如实施方案108所述的经修饰的专职吞噬细胞,其中所述第三纳米颗粒包括脂质体、脂质体纳米颗粒、脂质纳米颗粒或固体脂质纳米颗粒。
[0430]
110.一种纳米颗粒,所述纳米颗粒包括带正电荷的聚合物核心和围绕所述聚合物核心的带中性或负电荷的包衣,其中所述带正电荷的聚合物核心包封编码结合免疫细胞活化表位的至少一个结合结构域和/或结合目标细胞上的抗原的至少一个结合结构域的核苷酸。
[0431]
111.如实施方案110所述的纳米颗粒,其中所述纳米颗粒《130nm。
[0432]
112.如实施方案110或111所述的纳米颗粒,其中所述带正电荷的聚合物包括聚(β-氨基酯、聚(l-赖氨酸)、聚(乙烯亚胺)(pei)、聚-(酰氨基胺)树枝状大分子(pamam)、聚(胺-共-酯)、聚(甲基丙烯酸二甲基氨基乙酯)(pdmaema)、壳聚糖、聚-(l-丙交酯-共-l-赖氨酸)、聚[α-(4-氨基丁基)-l-乙醇酸](paga)或聚(4-羟基-l-脯氨酸酯)(php)。
[0433]
113.如实施方案110-112中任一项所述的纳米颗粒,其中所述带正电荷的聚合物包括聚(β-氨基酯)。
[0434]
114.如实施方案110-113中任一项所述的纳米颗粒,其中所述带中性或负电荷的包衣包括聚谷氨酸(pga)、聚(丙烯酸)、藻酸或半琥珀酸胆固醇酯/1,2-二油酰基-sn-甘油基-3-磷酸乙醇胺。
[0435]
115.如实施方案110-114中任一项所述的纳米颗粒,其中所述带中性或负电荷的包衣包括聚谷氨酸(pga)。
[0436]
116.如实施方案110-115中任一项所述的纳米颗粒,其中所述带中性或负电荷的包衣包括两性离子聚合物。
[0437]
117.如实施方案110-116中任一项所述的纳米颗粒,其中所述带中性或负电荷的包衣包括脂质体。
[0438]
118.如实施方案117所述的纳米颗粒,其中所述脂质体包括1,2-二油酰基-3-三甲基铵-丙烷(dotap)、1,2-二-o-十八烯基-3-三甲基铵丙烷(dotma)、3β-[n-(n',n'-二甲基氨基乙烷)-氨基甲酰基]胆固醇(dc-chol)、双十八烷基-酰氨基甘氨酰精胺(dogs)、胆固醇、1,2-二油酰基-sn-甘油基-3-磷酸乙醇胺(dope)或1,2-二油酰基-sn-甘油基-3-磷酸胆碱(dopc)。
[0439]
119.如实施方案110-118中任一项所述的纳米颗粒,其中所述核苷酸包括核糖核酸(rna)。
[0440]
120.如实施方案119所述的纳米颗粒,其中所述rna包括合成rna。
[0441]
121.如实施方案119或120所述的纳米颗粒,其中所述rna包括体外转录的mrna。
[0442]
122.如实施方案110-121中任一项所述的纳米颗粒,其中所述核苷酸包括整合或
非整合双链dna。
[0443]
123.如实施方案110-122中任一项所述的纳米颗粒,其中所述核苷酸呈质粒、微环质粒或封闭端线性cedna的形式。
[0444]
124.如实施方案110-123中任一项所述的纳米颗粒,其中所述目标细胞上的所述抗原是由卵巢癌细胞、黑素瘤细胞、成胶质细胞瘤细胞、多发性骨髓瘤细胞、黑素瘤细胞、前列腺癌细胞、乳腺癌细胞、干细胞癌细胞、间皮瘤细胞、肾细胞癌细胞、胰腺癌细胞、肺癌细胞、胆管癌细胞、膀胱癌细胞、神经母细胞瘤细胞、结肠直肠癌细胞或梅克尔细胞癌细胞表达的癌症抗原。
[0445]
125.如实施方案110-124中任一项所述的纳米颗粒,其中所述癌症抗原包括b细胞成熟抗原(bcma)、羧基-酐酶-ix(caix)、cd19、cd24、cd56、cd133、cea、双唾液酸神经节苷脂、epcam、egfr、egfr变体iii(egfrviii)、erbb2、叶酸受体(folr)、gd2、磷脂酰肌醇蛋白聚糖-2、her2、lewis y、l1-cam、间皮素、muc16、pd-l1、psma、前列腺干细胞抗原(psca)、ror1、tyrp1/gp75、sv40 t或wt-1。
[0446]
126.如实施方案110-125中任一项所述的纳米颗粒,其中结合所述癌症抗原的所述结合结构域包括抗体阿德木单抗、雷星-阿奈妥单抗、阿麦妥昔单抗、hn1、奥戈伏单抗、欧伐瑞、阿巴伏单抗、依决洛单抗、法勒珠单抗、夫兰妥单抗、ta99、20d7、西妥昔单抗、fmc63、sj25c1、hd37、r11、r12、2a2、y31、4d5、3g10阿特珠单抗、阿维鲁单抗或德瓦鲁单抗的互补决定区(cdr)或源自t细胞受体(tcr)。
[0447]
127.如实施方案110-126中任一项所述的纳米颗粒,其中结合癌症抗原的所述结合结构域是蛋白质分子。
[0448]
128.如实施方案127所述的纳米颗粒,其中所述纳米颗粒内的核苷酸编码包含结合不同癌症抗原的结合结构域的不同蛋白质分子。
[0449]
129.如实施方案128所述的纳米颗粒,其中所述不同的癌症抗原由相同癌症类型表达。
[0450]
130.如实施方案129所述的纳米颗粒,其中所述癌症类型是卵巢癌、黑素瘤或成胶质细胞瘤。
[0451]
131.如实施方案128-130中任一项所述的纳米颗粒,其中所述不同的癌症抗原包括
[0452]
选自epcam、l1-cam、muc16、叶酸受体(folr)、lewis y、ror1、间皮素、wt-1、pd-l1、egfr和cd56的至少两种癌症抗原;
[0453]
选自酪氨酸酶相关蛋白1(tyrp1/gp75)、gd2、pd-l1和egfr至少两种癌症抗原;或选自egfr变体iii(egfrviii)和il13ra2的两种癌症抗原。
[0454]
132.如实施方案110-131中任一项所述的纳米颗粒,其中所述蛋白质分子的至少一个结合结构域结合病毒抗原、细菌抗原、超级细菌抗原、真菌抗原或自身免疫性或变应性抗原。
[0455]
133.如实施方案132所述的纳米颗粒,其中
[0456]
所述病毒抗原由腺病毒、沙粒病毒、布尼亚病毒、冠状病毒、黄病毒、汉坦病毒、肝炎病毒、疱疹病毒、乳头瘤病毒、副粘病毒、细小病毒、微小核糖核酸病毒、痘病毒、正粘病毒、逆转录病毒、呼肠孤病毒、弹状病毒、轮状病毒、海绵状病毒或披膜病毒表达;
[0457]
所述细菌抗原由炭疽;革兰氏阴性杆菌、衣原体、白喉、流感嗜血杆菌、幽门螺杆菌、疟疾、结核分枝杆菌、百日咳毒素、肺炎球菌、立克次体、葡萄球菌、链球菌或破伤风表达;
[0458]
所述超级细菌抗原由粪肠球菌、艰难梭菌、鲍曼不动杆菌、铜绿假单胞菌或肠杆菌科表达;
[0459]
所述真菌抗原由念珠菌属、球孢子菌属、隐球菌属、组织胞浆菌属、利什曼原虫属、疟原虫、原生动物、寄生虫、血吸虫、癣、弓形虫和克氏锥虫表达;或者
[0460]
所述自身免疫性或变应性抗原由患有急性坏死性出血性脑病、变应性哮喘、斑秃、贫血、口疮、关节炎、哮喘、自身免疫性甲状腺炎、结膜炎、克隆氏病、皮肤型红斑狼疮、皮炎、糖尿病(diabetes)、糖尿病(diabetes mellitus)、麻风结节性红斑、角膜结膜炎、多发性硬化症、重症肌无力、银屑病、硬皮病、格连氏综合征(包括继发于格连氏综合征的干燥性角膜结膜炎)、史蒂文斯-约翰逊综合征、全身性红斑狼疮、溃疡性结肠炎、阴道炎和/或韦格纳氏肉芽肿病的受试者表达
[0461]
和/或其中所述抗原的所述结合结构域来源于tcr。
[0462]
134.如实施方案110-133中任一项所述的纳米颗粒,其中所述蛋白质分子的所述至少一个结合结构域结合由t细胞或自然杀伤(nk)细胞表达的免疫细胞活化表位。
[0463]
135.如实施方案110-134中任一项所述的纳米颗粒,其中所述免疫细胞活化表位由t细胞表达。
[0464]
136.如实施方案135所述的纳米颗粒,其中由所述t细胞表达的所述免疫细胞活化表位包括cd2、cd3、cd7、cd8、cd27、cd28、cd30、cd40、cd83、4-1bb、ox40、淋巴细胞功能相关抗原-1(lfa-1)、light、nkg2c或b7-h3。
[0465]
137.如实施方案135所述的纳米颗粒,其中由所述t细胞表达的所述免疫细胞活化表位包括cd3、cd28或4-1bb。
[0466]
138.如实施方案110-137中任一项所述的纳米颗粒,其中结合免疫细胞活化表位的所述结合结构域包括蛋白质分子。
[0467]
139.如实施方案138所述的纳米颗粒,其中所述纳米颗粒内的核苷酸编码包含结合不同免疫细胞活化表位的结合结构域的不同蛋白质分子。
[0468]
140.如实施方案139所述的纳米颗粒,其中所述不同的免疫细胞活化表位包括cd3和cd28或cd3和4-1bb。
[0469]
141.如实施方案110-140中任一项所述的纳米颗粒,其中至少一个结合结构域包括抗体okt3、20g6-f3、4b4-d7、4e7-c9、18f5-h10、tgn1412、9d7、9.3、kolt-2、15e8、248.23.2、ex5.3d10、okt8或sk1的cdr。
[0470]
142.如实施方案110-134中任一项所述的纳米颗粒,其中所述免疫细胞活化表位由nk细胞表达。
[0471]
143.如实施方案142所述的纳米颗粒,其中由所述nk细胞表达的所述免疫细胞活化表位包括nkg2d、cd8、cd16、kir2dl4、kir2ds1、kir2ds2、kir3ds1、nkg2c、nkg2e、nkg2d、nkp30、nkp44、nkp46、nkp80或dnam-1。
[0472]
144.如实施方案110-143中任一项所述的纳米颗粒,其中至少一个结合结构域包括抗体5c6、1d11、mab 33、p44-8、sk1或3g8的cdr。
[0473]
145.如实施方案110-144中任一项所述的纳米颗粒,其中所述结合结构域通过蛋白质接头连接。
[0474]
146.如实施方案145所述的纳米颗粒,其中所述蛋白质接头包括gly-ser接头。
[0475]
147.如实施方案145或146所述的纳米颗粒,其中所述蛋白质接头包括富含脯氨酸的接头。
[0476]
148.如实施方案110-147中任一项所述的纳米颗粒,其中所述蛋白质分子包含单链可变片段(scfv)。
[0477]
149.如实施方案110-148中任一项所述的纳米颗粒,其中所述蛋白质分子包含
[0478]
结合cea的至少一个结合结构域和结合cd3、cd28或4-1bb的至少一个结合结构域;
[0479]
结合egfr的至少一个结合结构域和结合cd3、cd28或4-1bb的至少一个结合结构域;
[0480]
结合epcam的至少一个结合结构域和结合cd3、cd28或4-1bb的至少一个结合结构域;
[0481]
结合her2的至少一个结合结构域和结合cd3、cd28或4-1bb的至少一个结合结构域;
[0482]
结合pd-l1的至少一个结合结构域和结合cd3、cd28或4-1bb的至少一个结合结构域;
[0483]
结合psma的至少一个结合结构域和结合cd3、cd28或4-1bb的至少一个结合结构域;或
[0484]
结合[tyrp1/gp75]的至少一个结合结构域和结合cd3、cd28或4-1bb的至少一个结合结构域。
[0485]
150.如实施方案149所述的纳米颗粒,其中所述蛋白质分子包括卡妥索单抗、mt110、厄妥索单抗、mdx-447、mm-141、amg211、ro6958688、ro6895882、tf2、bay2010112、amg701、索利托单抗或博纳吐单抗。
[0486]
151.如实施方案110-150中任一项所述的纳米颗粒,其中所述带正电荷的聚合物核心进一步包封编码一种或多种干扰素调控因子(irf)的核苷酸。
[0487]
152.如实施方案151所述的纳米颗粒,其中所述一种或多种irf缺乏功能性自抑制结构域。
[0488]
153.如实施方案151或152所述的纳米颗粒,其中所述一种或多种irf缺乏功能性核输出信号。
[0489]
154.如实施方案151-153中任一项所述的纳米颗粒,其中所述一种或多种irf选自irf1、irf3、irf5、irf7、irf8和/或irf7和irf3的融合体。
[0490]
155.如实施方案151-154中任一项所述的纳米颗粒,其中所述一种或多种irf选自与如seq id no:1-17中所示的序列具有》90%、》95%或大于98%同一性的序列。
[0491]
156.如实施方案151-155中任一项所述的纳米颗粒,其中所述一种或多种irf包括选自如seq id no:1-7中所示的序列的irf5。
[0492]
157.如实施方案154-156中任一项所述的纳米颗粒,其中所述irf5包含具有选自s156d、s158d和t160d的一个或多个突变的如seq id no:1或seq id no:3中所示的序列。
[0493]
158.如实施方案154-157中任一项所述的纳米颗粒,其中所述irf5包含具有选自
t10d、s158d、s309d、s317d、s451d和s462d的一个或多个突变的如seq id no:2中所示的序列。
[0494]
159.如实施方案154-158中任一项所述的纳米颗粒,其中所述irf5包含具有选自s425d、s427d、s430d和s436d的一个或多个突变的如seq id no:4中所示的序列。
[0495]
160.如实施方案151-159中任一项所述的纳米颗粒,其中所述一种或多种irf包括irf1,所述irf1包含如seq id no:8或12中所示的序列。
[0496]
161.如实施方案151-160中任一项所述的纳米颗粒,其中所述一种或多种irf包括irf8,所述irf8包含如seq id no:11、16或17中所示的序列。
[0497]
162.如实施方案154-161中任一项所述的纳米颗粒,其中所述irf8包含具有k310r突变的如seq id no:11中所示的序列。
[0498]
163.如实施方案151-162中任一项所述的纳米颗粒,其中所述一种或多种irf包含irf7/irf3融合蛋白,所述irf7/irf3融合蛋白包含n末端irf7 dna结合结构域、组成型活性结构域和c末端irf3核输出信号。
[0499]
164.如实施方案163所述的纳米颗粒,其中所述irf7/irf3融合蛋白包含如seq id no:15中所示的序列。
[0500]
165.如实施方案151-164中任一项所述的纳米颗粒,其中所述一种或多种irf包括irf4。
[0501]
166.如实施方案110-165中任一项所述的纳米颗粒,其中所述纳米颗粒的至少一个子集包括编码ikkβ的核苷酸。
[0502]
167.如实施方案166所述的纳米颗粒,其中所述ikkβ选自与如选自seq id no:18-22的序列中所示的序列具有》90%、》95%或》98%同一性的序列。
[0503]
168.如实施方案166或167所述的纳米颗粒,其中所述ikkβ包含如选自seq id no:18-22的序列中所示的序列。
[0504]
169.如实施方案166-168中任一项所述的纳米颗粒,其中所述核苷酸包含如选自seq id no:23-44的序列中所示的序列。
[0505]
170.如实施方案166-169中任一项所述的纳米颗粒,其中所述编码一种或多种irf的核苷酸和所述编码ikkβ的核苷酸被包封在同一纳米颗粒中。
[0506]
171.如实施方案151-170中任一项所述的纳米颗粒,其中所述编码一种或多种irf的核苷酸和所述编码ikkβ的核苷酸被包封在同一纳米颗粒核心内。
[0507]
172.如实施方案151-170中任一项所述的纳米颗粒,其中所述编码一种或多种irf的核苷酸和所述编码ikkβ的核苷酸被包封在不同的纳米颗粒中。
[0508]
173.如实施方案151-172中任一项所述的纳米颗粒,其中所述编码至少一个或多个结合结构域的核苷酸与所述编码一种或多种irf和/或ikkβ的核苷酸被包封在同一纳米颗粒内。
[0509]
174.如实施方案151-172中任一项所述的纳米颗粒,其中所述编码至少一个或多个结合结构域的核苷酸被包封在与包封编码一种或多种irf和/或ikkβ的核苷酸的那些纳米颗粒不同的纳米颗粒内。
[0510]
175.如实施方案110-174中任一项所述的纳米颗粒,所述纳米颗粒还包括转化生长因子β(tgfβ)抑制剂。
磷酸乙醇胺。
[0531]
191.如实施方案186-190中任一项所述的系统,其中所述带中性或负电荷的包衣包括聚谷氨酸(pga)。
[0532]
192.如实施方案186-191中任一项所述的系统,其中所述带中性或负电荷的包衣包括两性离子聚合物。
[0533]
193.如实施方案186-192中任一项所述的系统,其中所述带中性或负电荷的包衣包括脂质体。
[0534]
194.如实施方案193所述的系统,其中所述脂质体包括1,2-二油酰基-3-三甲基铵-丙烷(dotap)、1,2-二-o-十八烯基-3-三甲基铵丙烷(dotma)、3β-[n-(n',n'-二甲基氨基乙烷)-氨基甲酰基]胆固醇(dc-chol)、双十八烷基-酰氨基甘氨酰精胺(dogs)、胆固醇、1,2-二油酰基-sn-甘油基-3-磷酸乙醇胺(dope)或1,2-二油酰基-sn-甘油基-3-磷酸胆碱(dopc)。
[0535]
195.如实施方案182-194中任一项所述的系统,其中所述核苷酸包括核糖核酸(rna)。
[0536]
196.如实施方案195所述的系统,其中所述rna包括合成rna。
[0537]
197.如实施方案195或196所述的系统,其中所述rna包括体外转录的mrna。
[0538]
198.如实施方案182-197中任一项所述的系统,其中所述核苷酸包括整合或非整合双链dna。
[0539]
199.如实施方案182-198中任一项所述的系统,其中所述核苷酸呈质粒、微环质粒或封闭端线性cedna的形式。
[0540]
200.如实施方案182-199中任一项所述的系统,其中所述核苷酸被包封在所述带正电荷的核心内。
[0541]
201.如实施方案182-200中任一项所述的系统,其中所述一种或多种irf缺乏功能性自抑制结构域。
[0542]
202.如实施方案182-201中任一项所述的系统,其中所述一种或多种irf缺乏功能性核输出信号。
[0543]
203.如实施方案182-202中任一项所述的系统,其中所述一种或多种irf选自irf1、irf3、irf5、irf7、irf8和/或irf7和irf3的融合体。
[0544]
204.如实施方案182-203中任一项所述的系统,其中所述一种或多种irf选自与如seq id no:1-17中所示的序列具有》90%、》95%或大于98%同一性的序列。
[0545]
205.如实施方案182-204中任一项所述的系统,其中所述一种或多种irf包括选自如seq id no:1-7中所示的序列的irf5。
[0546]
206.如实施方案205所述的系统,其中所述irf5包含具有选自s156d、s158d和t160d的一个或多个突变的如seq id no:1或seq id no:3中所示的序列。
[0547]
207.如实施方案205或206所述的系统,其中所述irf5包含具有选自t10d、s158d、s309d、s317d、s451d和s462d的一个或多个突变的如seq id no:2中所示的序列。
[0548]
208.如实施方案205-207中任一项所述的系统,其中所述irf5包含具有选自s425d、s427d、s430d和s436d的一个或多个突变的如seq id no:4中所示的序列。
[0549]
209.如实施方案182-208中任一项所述的系统,其中所述一种或多种irf包括
irf1,所述irf1包含如seq id no:8或12中所示的序列。
[0550]
210.如实施方案182-209中任一项所述的系统,其中所述一种或多种irf包括irf8,所述irf8包含如seq id no:11、16或17中所示的序列。
[0551]
211.如实施方案182-210中任一项所述的系统,其中所述irf8包含具有k310r突变的如seq id no:11中所示的序列。
[0552]
212.如实施方案182-211中任一项所述的系统,其中所述一种或多种irf包含irf7/irf3融合蛋白,所述irf7/irf3融合蛋白包含n末端irf7 dna结合结构域、组成型活性结构域和c末端irf3核输出信号。
[0553]
213.如实施方案212所述的系统,其中所述irf7/irf3融合蛋白包含如seq id no:15中所示的序列。
[0554]
214.如实施方案182-213中任一项所述的系统,其中所述一种或多种irf包括irf4。
[0555]
215.如实施方案182-214中任一项所述的系统,其中所述纳米颗粒的至少一个子集包括编码ikkβ的核苷酸。
[0556]
216.如实施方案215所述的系统粒,其中所述ikkβ选自与如选自seq id no:18-22的序列中所示的序列具有》90%、》95%或》98%同一性的序列。
[0557]
217.如实施方案215或216所述的系统,其中所述ikkβ包含如选自seq id no:18-22的序列中所示的序列。
[0558]
218.如实施方案182-217中任一项所述的系统,其中所述核苷酸包含如选自seq id no:23-44的序列中所示的序列。
[0559]
219.如实施方案182-218中任一项所述的系统,其中所述编码一种或多种irf的核苷酸和所述编码ikkβ的核苷酸被包封在同一纳米颗粒中。
[0560]
220.如实施方案219所述的系统,其中所述编码一种或多种irf的核苷酸和所述编码ikkβ的核苷酸被包封在同一纳米颗粒核心中。
[0561]
221.如实施方案182-218中任一项所述的系统,其中所述编码一种或多种irf的核苷酸和所述编码ikkβ的核苷酸被包封在不同的纳米颗粒中。
[0562]
222.如实施方案182-221中任一项所述的系统,其中所述蛋白质分子的至少一个结合结构域结合由卵巢癌细胞、黑素瘤细胞、成胶质细胞瘤细胞、多发性骨髓瘤细胞、黑素瘤细胞、前列腺癌细胞、乳腺癌细胞、干细胞癌细胞、间皮瘤细胞、肾细胞癌细胞、胰腺癌细胞、肺癌细胞、胆管癌细胞、膀胱癌细胞、神经母细胞瘤细胞、结肠直肠癌细胞或梅克尔细胞癌细胞表达的癌症抗原。
[0563]
223.如实施方案222所述的系统,其中所述癌症抗原包括b细胞成熟抗原(bcma)、羧基-酐酶-ix(caix)、cd19、cd24、cd56、cd133、cea、双唾液酸神经节苷脂、epcam、egfr、egfr变体iii(egfrviii)、erbb2、叶酸受体(folr)、gd2、磷脂酰肌醇蛋白聚糖-2、her2、lewis y、l1-cam、间皮素、muc16、pd-l1、psma、前列腺干细胞抗原(psca)、ror1、tyrp1/gp75、sv40 t或wt-1。
[0564]
224.如实施方案182-223中任一项所述的系统,其中所述蛋白质分子的至少一个结合结构域包括抗体阿德木单抗、雷星-阿奈妥单抗、阿麦妥昔单抗、hn1、奥戈伏单抗、欧伐瑞、阿巴伏单抗、依决洛单抗、法勒珠单抗、夫兰妥单抗、ta99、20d7、西妥昔单抗、fmc63、
sj25c1、hd37、r11、r12、2a2、y31、4d5、3g10阿特珠单抗、阿维鲁单抗或德瓦鲁单抗的互补决定区(cdr)或tcr。
[0565]
225.如实施方案182-224中任一项所述的系统,其中所述系统内的不同蛋白质分子包含结合不同癌症抗原的结合结构域。
[0566]
226.如实施方案225所述的系统,其中所述不同的癌症抗原由相同癌症类型表达。
[0567]
227.如实施方案226所述的系统,其中所述癌症类型是卵巢癌、黑素瘤或成胶质细胞瘤。
[0568]
228.如实施方案225-227中任一项所述的系统,其中所述不同的癌症抗原包括
[0569]
选自epcam、l1-cam、muc16、叶酸受体(folr)、lewis y、ror1、间皮素、wt-1、pd-l1、egfr和cd56的至少两种癌症抗原;
[0570]
选自酪氨酸酶相关蛋白1(tyrp1/gp75)、gd2、pd-l1和egfr的至少两种癌症抗原;或
[0571]
选自egfr变体iii(egfrviii)和il13ra2的两种癌症抗原。
[0572]
229.如实施方案182-228中任一项所述的系统,其中所述蛋白质分子的至少一个结合结构域结合病毒抗原、细菌抗原、超级细菌抗原、真菌抗原或自身免疫性或变应性抗原。
[0573]
230.如实施方案229所述的系统,其中:
[0574]
所述病毒抗原由腺病毒、沙粒病毒、布尼亚病毒、冠状病毒、黄病毒、汉坦病毒、肝炎病毒、疱疹病毒、乳头瘤病毒、副粘病毒、细小病毒、微小核糖核酸病毒、痘病毒、正粘病毒、逆转录病毒、呼肠孤病毒、弹状病毒、轮状病毒、海绵状病毒或披膜病毒表达;
[0575]
所述细菌抗原由炭疽;革兰氏阴性杆菌、衣原体、白喉、流感嗜血杆菌、幽门螺杆菌、疟疾、结核分枝杆菌、百日咳毒素、肺炎球菌、立克次体、葡萄球菌、链球菌或破伤风表达;
[0576]
所述超级细菌抗原由粪肠球菌、艰难梭菌、鲍曼不动杆菌、铜绿假单胞菌或肠杆菌科表达;
[0577]
所述真菌抗原由念珠菌属、球孢子菌属、隐球菌属、组织胞浆菌属、利什曼原虫属、疟原虫、原生动物、寄生虫、血吸虫、癣、弓形虫和克氏锥虫表达;或者
[0578]
所述自身免疫性或变应性抗原由患有急性坏死性出血性脑病、变应性哮喘、斑秃、贫血、口疮、关节炎、哮喘、自身免疫性甲状腺炎、结膜炎、克隆氏病、皮肤型红斑狼疮、皮炎、糖尿病(diabetes)、糖尿病(diabetes mellitus)、麻风结节性红斑、角膜结膜炎、多发性硬化症、重症肌无力、银屑病、硬皮病、格连氏综合征(包括继发于格连氏综合征的干燥性角膜结膜炎)、史蒂文斯-约翰逊综合征、全身性红斑狼疮、溃疡性结肠炎、阴道炎和/或韦格纳氏肉芽肿病的受试者表达。
[0579]
231.如实施方案182-230中任一项所述的系统,其中所述蛋白质分子的至少一个结合结构域结合由t细胞或自然杀伤(nk)细胞表达的免疫细胞活化表位。
[0580]
232.如实施方案231所述的系统,其中所述免疫细胞活化表位由t细胞表达。
[0581]
233.如实施方案232所述的系统,其中由所述t细胞表达的所述免疫细胞活化表位包括cd2、cd3、cd7、cd8、cd27、cd28、cd30、cd40、cd83、4-1bb、ox40、淋巴细胞功能相关抗原-1(lfa-1)、light、nkg2c或b7-h3。
[0582]
234.如实施方案233所述的系统,其中由所述t细胞表达的所述免疫细胞活化表位包括cd3、cd28或4-1bb。
[0583]
235.如实施方案182-234中任一项所述的系统,其中所述系统内的不同蛋白质分子包含结合不同免疫细胞活化表位的结合结构域。
[0584]
236.如实施方案235所述的系统,其中所述不同的免疫细胞活化表位包括cd3和cd28或cd3和4-1bb。
[0585]
237.如实施方案182-236中任一项所述的系统,其中至少一个结合结构域包括抗体okt3、20g6-f3、4b4-d7、4e7-c9、18f5-h10、tgn1412、9d7、9.3、kolt-2、15e8、248.23.2、ex5.3d10、okt8或sk1的cdr。
[0586]
238.如实施方案231所述的系统,其中所述免疫细胞活化表位由nk细胞表达。
[0587]
239.如实施方案238所述的系统,其中由所述nk细胞表达的所述免疫细胞活化表位包括nkg2d、cd8、cd16、kir2dl4、kir2ds1、kir2ds2、kir3ds1、nkg2c、nkg2e、nkg2d、nkp30、nkp44、nkp46、nkp80或dnam-1。
[0588]
240.如实施方案182-239中任一项所述的系统,其中至少一个结合结构域包括抗体5c6、1d11、mab 33、p44-8、sk1或3g8的cdr。
[0589]
241.如实施方案182-240中任一项所述的系统,其中所述蛋白质分子的所述结合结构域通过蛋白质接头连接。
[0590]
242.如实施方案241所述的系统,其中所述蛋白质接头包括gly-ser接头。
[0591]
243.如实施方案241或242所述的系统,其中所述蛋白质接头包括富含脯氨酸的接头。
[0592]
244.如实施方案182-243中任一项所述的系统,其中所述蛋白质分子包含单链可变片段(scfv)。
[0593]
245.如实施方案182-244中任一项所述的系统,其中所述蛋白质分子包括
[0594]
结合cea的至少一个结合结构域和结合cd3、cd28或4-1bb的至少一个结合结构域;
[0595]
结合egfr的至少一个结合结构域和结合cd3、cd28或4-1bb的至少一个结合结构域;
[0596]
结合epcam的至少一个结合结构域和结合cd3、cd28或4-1bb的至少一个结合结构域;
[0597]
结合her2的至少一个结合结构域和结合cd3、cd28或4-1bb的至少一个结合结构域;
[0598]
结合pd-l1的至少一个结合结构域和结合cd3、cd28或4-1bb的至少一个结合结构域;
[0599]
结合psma的至少一个结合结构域和结合cd3、cd28或4-1bb的至少一个结合结构域;或
[0600]
结合[tyrp1/gp75]的至少一个结合结构域和结合cd3、cd28或4-1bb的至少一个结合结构域。
[0601]
246.如实施方案182-245中任一项所述的系统,其中所述蛋白质分子包括卡妥索单抗、mt110、厄妥索单抗、mdx-447、mm-141、amg211、ro6958688、ro6895882、tf2、bay2010112、amg701、索利托单抗或博纳吐单抗。
[0602]
247.如实施方案182-246中任一项所述的系统,其中所述编码至少两个结合结构域的核苷酸与所述编码一种或多种irf和/或ikkβ的核苷酸被包封在同一纳米颗粒内。
[0603]
248.如实施方案247所述的系统,其中所述编码至少两个结合结构域的核苷酸与所述编码一种或多种irf和/或ikkβ的核苷酸被包封在同一纳米颗粒核心内。
[0604]
249.如实施方案182-246中任一项所述的系统,其中所述编码至少两个结合结构域的核苷酸被包封在与包封编码一种或多种irf和/或ikkβ的核苷酸的那些纳米颗粒不同的纳米颗粒内。
[0605]
250.如实施方案182-249中任一项所述的系统,所述纳米颗粒还包括转化生长因子β(tgfβ)抑制剂。
[0606]
251.如实施方案250所述的系统,其中所述tgfβ抑制剂包括编码所述tgfβ抑制剂的核苷酸。
[0607]
252.如实施方案250或251所述的系统,其中所述tgfβ抑制剂包括抑制tgfβ的活性的抗体的cdr。
[0608]
253.如实施方案250-252中任一项所述的系统,其中所述tgfβ抑制剂包括抑制tgfβ的活性的抗体。
[0609]
254.如实施方案252或253所述的系统,其中所述抗体包括曲贝德生、地司特肽、美特利木单抗、夫苏木单抗、ly2382770、six-100、阿奥特明和/或imc-tr1。
[0610]
255.如实施方案182-254中任一项所述的系统,其中所述纳米颗粒还包括编码糖皮质激素诱导的亮氨酸拉链(gilz)的核苷酸。
[0611]
256.如实施方案182-255中任一项所述的系统,其中所述纳米颗粒还包括包含选自以下的抗癌基因的核苷酸:p53、rb、brca1、e1a、bcl-2、mdr-1、p21、p16、bax、bcl-xs、e2f、igf-i vegf、血管抑素、制瘤素、内皮抑素、gm-csf、il-12、il-2、il-4、il-7、ifn-γ、tnfα和/或hsv-tk。
[0612]
257.如实施方案182-256中任一项所述的系统,所述系统还包括药学上可接受的载体。
[0613]
258.一种经遗传修饰以表达实施方案182-257中任一项所述的系统的核苷酸的单核细胞或巨噬细胞。
[0614]
259.一种调节受试者体内的治疗部位的巨噬细胞活化状态、将免疫细胞募集至所述治疗部位并活化所述募集的免疫细胞的方法,所述方法包括:
[0615]
向所述受试者施用实施方案182-257中任一项所述的系统,从而调节所述受试者体内的所述治疗部位的所述巨噬细胞活化状态,将免疫细胞募集至所述治疗部位,以及活化所述募集的免疫细胞。
[0616]
260.如实施方案259所述的方法,其中所述治疗部位是肿瘤部位。
[0617]
261.如实施方案259或260所述的方法,其中所述施用包括静脉内施用,并且所述纳米颗粒被血流中的单核细胞吸收。
[0618]
262.如实施方案261所述的方法,其中所述单核细胞迁移至所述肿瘤部位并分化成巨噬细胞。
[0619]
263.如实施方案262所述的方法,其中所述分化的巨噬细胞对肿瘤抑制具有抗性。
[0620]
264.如实施方案259-263中任一项所述的方法,其中所述施用包括在所述肿瘤部
位局部施用,并且所述纳米颗粒被肿瘤相关巨噬细胞(tam)吸收。
[0621]
265.如实施方案264所述的方法,其中所述局部施用包括腹膜内施用或颅内施用。
[0622]
266.如实施方案264或265所述的方法,其中所述tam经历从抑制状态至活化状态的表型转化。
[0623]
267.如实施方案264-266中任一项所述的方法,其中所述肿瘤部位包括卵巢癌肿瘤部位、成胶质细胞瘤肿瘤部位或黑素瘤肿瘤部位。
[0624]
268.如实施方案259-267中任一项所述的方法,其中所述募集且活化的免疫细胞是t细胞或nk细胞。
[0625]
269.如实施方案259-268中任一项所述的方法,所述方法包括在施用包括编码至少两个结合结构域的核苷酸的纳米颗粒之前施用包括编码一种或多种irf的核苷酸的纳米颗粒。
[0626]
270.如实施方案259-269中任一项所述的方法,所述方法包括在施用包括编码至少两个结合结构域的核苷酸的纳米颗粒之前至少24小时施用包括编码一种或多种irf的核酸的纳米颗粒。
[0627]
(12)实验性实施例实施例1.材料和方法。pbae合成。先前描述了用于合成聚合物的方法(mangraviti a等人(2015)acs nano 9:1236-1249)。将1,4-丁二醇二丙烯酸酯与4-氨基-1-丁醇以二丙烯酸酯与胺单体的1:1摩尔比混合。通过在搅拌下将混合物加热至90℃持续24小时来形成丙烯酸酯封端的聚(4-氨基-1-丁醇-共-1,4-丁二醇二丙烯酸酯)。将2.3g的这种聚合物溶解在2ml四氢呋喃(thf)中。为了形成哌嗪-封端的447聚合物,将在13ml thf中的786mg 1-(3-氨基丙基)-4-甲基哌嗪添加至聚合物/thf溶液中,并在室温(rt)下搅拌2小时。用5体积的二乙醚使封端的聚合物沉淀,用2体积的新鲜醚洗涤,并在真空下干燥1天。将纯净的聚合物溶解在二甲亚砜(dmso)中至100mg/ml的浓度,并在-20℃下储存。
[0628]
pga与二-甘露糖缀合。将α-d-甘露吡喃糖基-(1
→
2)-α-d-甘露吡喃糖(二-甘露糖,omicron biochemicals inc.)修饰成糖胺,然后与聚谷氨酸(pga)缀合。首先,将二-甘露糖(157mg)溶解于10.5ml饱和碳酸铵水溶液中,然后在rt下搅拌24小时。在第二天,添加更多的固体碳酸铵,直到二-甘露糖从反应溶液中沉淀出来。搅拌混合物直至如通过tlc测量完成,然后冻干以除去过量的碳酸铵。通过将固体重新溶解在甲醇中来完全除去挥发性盐。这些程序在异头碳上生成胺,以备将来与pga缀合。
[0629]
为了将胺化的二-甘露糖缀合至pga,将底物溶解于水中至30mg m/l,然后超声处理10分钟。添加乙基-n
’‑
(3-二甲基氨基丙基)碳二亚胺
·
hcl水溶液(4mg/ml,30当量),在rt下混合4分钟。将n-羟基磺基琥珀酰亚胺水溶液(30mg/ml,35当量)与pga/edc溶液一起孵育1分钟。将磷酸盐缓冲盐水(pbs)中的胺化二甘露糖与所得的活化pga以44:1摩尔比合并,并在rt下混合6小时。通过用水透析24小时除去过量试剂。
[0630]
mrna合成。将egfp、irf5和ikk(trilink biotechnologies)的密码子优化的mrna用抗反向帽类似物3
′‑
o-me-m7g(5')ppp(5')g(arca)加帽,并用经修饰的核糖核苷酸假尿苷(ψ)和5-甲基胞苷(m5c)完全取代。
[0631]
纳米颗粒制备。将irf5和ikkβmrna以3:1(w:w)的比率合并,并在25mm乙酸钠(naoac)缓冲液(ph=5.2)中稀释至100μg/ml。同样在naoac缓冲液中,将dmso中的聚(β-氨
基酯)-447(pbae-447)聚合物(如上所述制备)从100μg/μl稀释至6μg/μl。为了形成纳米颗粒,将pbae-447聚合物以60:1(w:w)的比率添加至mrna中,并立即以中等速度涡旋15秒,然后将混合物在rt下孵育5min以允许形成pbae-mrna聚合复合物。在下一步骤中,将naoac缓冲液中的100μg/ml pga/二-甘露糖添加至所述聚合复合物溶液,以中等速度涡旋15秒,且在室温下孵育5分钟。在此过程中,pga/二-甘露糖包被pbae-mrna聚合复合物的表面以形成最终的np。为了长期储存,将d-蔗糖(60mg/ml)作为防冻剂添加到np溶液中。将纳米颗粒在干冰中速冻,然后冻干。将干燥的np储存在-20℃或-80℃下直至使用。对于体内实验,将冻干的np以1:20(w:v)的比率重新悬浮在水中。
[0632]
纳米颗粒粒度分布和ζ电位的表征。在25℃下使用zetapals仪器(brookhaven instrument corporation)对np的物理化学性质(包括流体动力学半径、多分散性、ζ电位和稳定性)进行了表征。为了基于动态光散射测量流体力学半径和多分散性,将np在25mm naoac(ph=5.2)中稀释5倍。为了测量ζ电位,将np在10mm pbs(ph=7.0)中稀释10倍。为了评估np的稳定性,将刚刚制备的纳米颗粒在10mm pbs缓冲液(ph=7.4)中稀释。每10分钟一次测量np的流体动力学半径和多分散性持续5小时,并使用nanosite 300仪器(malvern)从颗粒追踪分析中得出它们的大小和颗粒浓度。为了使用透射电子显微镜表征np,遵循先前描述的方案(smith tt等人(2017)nat nanotechnol 12:813-820)。将刚刚制备的np(25μl,含0.83μg的mrna)沉积在辉光放电处理的200目碳/formvar涂覆的铜网格上。在30秒后,依次用50%karnovsky固定剂、0.1m椰油酸酯缓冲液、dh2o、然后1%(w/v)乙酸双氧铀处理网格。将样品用在120kv下操作的jeol jem-1400透射电子显微镜(jeol usa)成像。
[0633]
骨髓来源的巨噬细胞(bmdm)和其他细胞系。为了制备bmdm,按照既定方案从小鼠股骨收获骨髓祖细胞(zhang x等人(2008)curr protoc immunol第14章:第14 11单元)。将这些细胞以0.5
–
1.0e6/ml的接种密度在完全培养基[dmem,补充有4.5g/l d-葡萄糖、l-谷氨酰胺、10%热失活的胎牛血清(fbs)、100u/ml青霉素和100μg/ml、glutamax 50ml/500ml,补充有20ng/ml m-csf(peprotech,目录号315-02)]中培养。使细胞在37℃、5%co2下离体分化为bmdm持续7天。接下来,将它们用巨噬细胞条件培养基[补充有20ng/ml mpla(sigma,目录号l6895)或20ng/ml il4(ebioscience,目录号34-8041)的巨噬细胞完全培养基]进行调理。bmdm在离体7-21天之间使用。将鼠卵巢癌细胞系id8(来自katherine roby博士(university of kansas medical center,kansas city,ks)的赠予)在补充有10%fbs、100u/ml青霉素、5μg/ml胰岛素、5μg/ml转铁蛋白和5ng/ml亚硒酸钠(全部sigma-aldrich)的dmem中培养。为了产生更具侵袭性的表达血管内皮生长因子(vegf)的id8菌株,将id8肿瘤细胞用编码鼠vegf的puno1质粒(invivogen)和杀稻瘟菌素抗性基因进行转染。为了获得稳定的转染子,将肿瘤细胞在含有10μg/ml杀稻瘟素(invivogen)的完全培养基中培养3周。将b16f10黑素瘤细胞系(美国典型培养物保藏中心(american type culture collection))在具有10%fbs,100u/ml青霉素、2mm/l-谷氨酰胺、1.5g/l碳酸氢钠、4.5g/l葡萄糖、10mm hepes、1.0mm丙酮酸钠和0.05mm 2-巯基乙醇的完全rpmi 1640培养基中培养。对于体内生物发光成像,使用萤火虫荧光素酶逆转录病毒转导id8-vegf和b16f10细胞系两者。在39℃、5%co2下,将携带racs-pdgfβ或rcas-cre逆转录病毒的df-1细胞系在补充有10%fbs和100u/ml青霉素的完全培养基中培养。
[0634]
bmdm的mrna转染。在转染前一天,将bmdm以250,000个/孔的浓度在24孔板上重新
no:96)、r-gatgatcggccacaaactg(seq id no:97);retnla、upl-078、f-ttgttcccttctcatctgcat(seq id no:98)、r-ccttgaccttattctccacga(seq id no:99);ccl5、upl-105、f-cctactcccactcggtcct(seq id no:100)、r-ctgatttcttgggtttgctgt(seq id no:101);ccl11、upl-018、f-agagctccacagcgcttc(seq id no:102)、r-cagcacctgggaggtgaa(seq id no:103);密码子优化的irf5、upl-022、f-tcttaaagaccacatggtagaacagt(seq id no:104)、r-agctgctgttgggattgc(seq id no:105);内源性irf5、upl-011、f-gctgtgcccttaacaaaagc(seq id no:106)、r-ggctgaggtggcatgtct(seq id no:107)。将标签基因mrna水平基于gapd、upl-060、f-agccacatcgctcagacac(seq id no:108)和r-gcccaatacgaccaaatcc(se q id no:109)的扩增进行标准化。使用运行quantstudio6软件的quant studio5 rt-pcr机器(applied biosystems)进行所有qrt-pcr反应。如果扩增图未跨越阈值且未获得ct值(“未确定”),则将等于测定中的最高循环数(40个循环)的ct值用于比较相对表达。
[0641]
小鼠和体内肿瘤模型。除了脑肿瘤模型有关的实验外,这些实验中使用的小鼠是从jackson laboratory获得;其他小鼠在fhcrc动物设施中繁殖和圈养。所有小鼠均在所述中心的机构动物护理和使用委员会批准的方案背景下使用。为了对卵巢肿瘤建模,将5
×
106个表达血管上皮生长因子(vegfp)的id8细胞腹膜内(i.p.)注射到4至6周龄的雌性白化病b6(c57bl/6j-tyr《c-2j》)小鼠中并允许建立2周。对于存活研究,将动物用携带50μg mrna的irf5 nps/egfp np进行腹膜内处理(每周两个剂量,持续9周,或直到健康状况达到安乐死要求为止)。对于机制研究,使用1、2或3周的处理,然后在最后一次剂量后48小时实施安乐死。进行腹膜灌洗以收集腹膜细胞。为了比较irf5/ikkβnp与现状巨噬细胞靶向疗法的疗效,一组小鼠接受携带50μg mrna的irf5/ikkβnp处理且持续3周,每周2个剂量;第二组接受15mg/kg在媒介物(聚乙二醇400中的5%1-甲基-2-吡咯烷酮)中配制的pi3kγ抑制剂ipi-594(medkoo biosciences inc)的口服管饲且持续3周;第三组接受30mg/kg在同一媒介物中配制的csf1r抑制剂吡昔替尼(pexidartinib)(plx3397,medkoo biosciences inc)的腹膜内注射,每天一次持续3周。
[0642]
为了对转移性肺癌进行建模,将用f-luc转导并悬浮在200μlrpmi培养基中的2.5
×
104个16f10细胞注射到4至6周龄雌性白化病b6(c57bl/6j-tyr《c-2j》)小鼠(jackson laboratories)中并允许建立1周。对于存活研究,将小鼠用(或不用)悬浮在pbs中的携带30μgmrna的irf5/ikkβ或egfp np进行了眼眶后处理。将小鼠用3个剂量/周进行处理且持续3周或直至健康状况达到安乐死的要求。对于机制研究,小鼠接受了相同的处理且持续2周。进行支气管肺泡灌洗以收集肺泡细胞用于分析。
[0643]
按照公布的方案产生携带神经胶质瘤的小鼠(uhrbom l等人(2004)nat med 10:1257-1260)。将产生rcas-pdgfβ和rcas-cre逆转录病毒的禽df-1细胞颅内注射到介于4-6周龄之间的nestin-tv-a/ink4a-arf-/-;pten-/-小鼠(c57bl/6)两个脑半球中(坐标:尾侧距前囟1mm,侧面距硬脑膜表面2mm、深度距硬脑膜表面2mm)。允许肿瘤建立2周。在第15天,小鼠一个半球接受10戈瑞(gy)辐射,而未被辐射的半球用铅屏蔽。第二天,小鼠接受携带30μg mrna的irf5/ikkβnp(3个剂量/周,持续3周)的眼眶后注射,或分配给pbs对照组。
[0644]
体内生物发光成像。pbs(15mg/ml)中的d-荧光素(xenogen)用作萤火虫荧光素酶成像的底物。用xenogen ivis光谱成像系统(xenogen)采集生物发光图像。在成像之前和期
间,将小鼠用2%异氟烷(forane,baxter healthcare)麻醉。对于id8-vegf卵巢肿瘤,将每只小鼠腹膜内注射300μg的d-荧光素,并且10分钟后采集图像。对于b16f10肺转移性肿瘤,将小鼠腹膜内注射3mg的d-荧光素,并在15分钟后采集图像。对于脑肿瘤模型,小鼠接受了75mg/kg体重的d-荧光素的眼眶后注射,并在4分钟后采集图像。采集时间在10秒至5分钟的范围内。
[0645]
生物分布分析。为了确定irf5 np在id8-vegf卵巢肿瘤模型中的生物分布,7-8组小鼠接受了腹膜内或眼眶后剂量的携带50μgmrna的np。在注射后二十四小时,收集全血,并用co2对小鼠实施安乐死以取回器官(肝、脾、肺、肾、心脏、肠、胰腺和膈肌)。将所有组织用rnalater稳定,然后在干冰上冷冻。使用rt-qpcr测量每个器官中密码子优化的irf5 mrna水平。
[0646]
毒性分析。为了测量重复输注靶向巨噬细胞的np的潜在体内毒性,在3周的过程中向小鼠(5只/组)静脉内注射了连续6个剂量的携带50μg mrna的irf5/ikkβ或egfp np。对照没有接受处理。最后一次输注后24小时,将小鼠麻醉并通过眼眶后放血收集血液以测定全血细胞计数。还收集血液用于血清化学和细胞因子谱分析(由phoenix central laboratories,mukilteo,wa进行)。然后用co2使动物安乐死以取回器官,将所述器官用去离子水洗涤,然后固定在4%多聚甲醛中。对组织进行常规处理,并用苏木精和曙红对切片染色。标本由董事会认证的工作人员病理学家dr.smitha pillai mvsc博士,dacvp以设盲方式进行解释。
[0647]
细胞因子测定。在fhcrc免疫监测共享资源中心使用luminex200系统(luminex)评价了细胞因子水平。对于离体研究,收集细胞培养上清液以测量il-6、il12p70、infγ和tnfα浓度。对于体内研究,测量了gm-csf、infγ、il-12p70、il-2、il-6和tnfα的血浆浓度。
[0648]
统计分析。使用未配对的双尾单向anova检验分析观察到的差异的统计显著性。图或图例中列出了每次测量的p值。使用对数秩检验来表征存活数据。所有统计分析均使用graphpad prism软件6.0版或r软件进行。
[0649]
结果。设计np以精心设计tam的ivt mrna转染。开发了靶向mrna递送系统,所述系统可通过利用阳离子聚(β-氨基酯)(pbae)聚合物与阴离子mrna之间的静电相互作用在靶向细胞中引入稳健的基因表达(图2a)。为了改进包封在所得纳米载体中的mrna的稳定性和翻译,使用并入经修饰的核糖核苷酸假尿苷(ψ)(kariko k等人(2008)mol ther 16:1833-1840)和5-甲基胞苷(m5c)并用arca(抗反向帽类似物)加帽的信使的合成型式(quabius es等人(2015)nbiotechnol 32:229-235)。通过水解裂解pbae主链中的酯键来从mrna-pbae复合物中细胞内释放mrna。使用这种系统先前已证明了高效的体内t细胞转染(smith tt等人(2017)nat nanotechnol)。为了将纳米颗粒靶向tam以及使所述纳米颗粒所含的mrna-pbae复合物进一步稳定,使用聚谷氨酸(pga)作为接头将二-甘露糖部分工程改造至所述纳米颗粒的表面上(图2a)。利用简单的两步骤、电荷驱动的自组装过程制造np。首先,将合成mrna与带正电荷的pbae聚合物复合,从而将mrna缩合成纳米级复合物。此步骤之后是添加用二-甘露糖官能化的pga,这屏蔽pbae-mrna纳米颗粒的正电荷并赋予巨噬细胞靶向性。所得的mrna纳米载体具有99.8
±
24.5nm的大小、0.183的多分散度以及中性表面电荷(3.40
±
2.15mvζ-电位,图2b-2c)。首先使用由绿色荧光蛋白编码mrna配制的np(gfp-np)在鼠骨髓来源的巨噬细胞(bmdm)中测试转染效率。简言之,将50,000个bmdm暴露于含有1μg mrna的
np中达1小时,然后在第二天进行gfp表达的流式细胞术测量。在单次np施加后,常规转染了这些原代巨噬细胞的31.9%(
±
8.5%)而不降低它们的存活力(图2e-2f)。用二-甘露糖对纳米颗粒进行的表面修饰有重大关系,因为在这种固有吞噬细胞类型中,使用未靶向(但包被有pga)的纳米载体的转染率下降到25%(
±
2.1%)的平均值。np选择性地靶向cd11b+、f4/80+巨噬细胞群体,其中46%的巨噬细胞已被转染并表达高水平的egfp(图2d)。这种高转染效率证明了所公开的系统和方法在将mrna靶向递送至tam中的效力。基于体外筛选诱导巨噬细胞极化的转录因子候选物的结果,选择了两种mrna用于包括在np中:第一种编码irf5(irf家族的有利于巨噬细胞朝向m1表型极化的关键成员),并且第二种编码ikkβ(磷酸化并活化irf5的激酶)。
[0650]
将免疫抑制巨噬细胞编程为促炎性表型。为了诱导巨噬细胞极化,选择了两种mrna用于包括在np中:第一种编码irf5(干扰素调控因子家族的有利于巨噬细胞朝向m1表型极化的关键成员)(krausgruber t等人(2011)nat immunol 12:231-238);第二种编码ikkβ(磷酸化并活化irf5的激酶(ren j等人(2014)proc natl acad sci u s a 111:17438-17443)。使用3个irf5 mrna对1个ikkβmrna的比率。使用对np递送(且密码子优化)的irf5 mrna具有特异性的实时定量pcr,发现巨噬细胞中的mrna表达在第1天最大,从而导致irf5相对于内源性因子水平增加1,500倍(图2a)。如所预期,基因表达是瞬时的,但irf5水平直至返回基线之前的第3天(增加了581倍)和第5天(增加了87倍)保持明显上调。
[0651]
为了确定编码irf5/ikkβ的np是否能够将m2巨噬细胞重编程为治疗上令人希望的抗癌m1表型,使用了nanostring基因表达分析。首先在白介素4(il-4)存在下培养bmdm,以诱导抑制性m2表型(图2h)。用对照gfp-mrna纳米颗粒或含irf5/ikkβmrna的np转染后,分析基因表达谱并将其与炎症性巨噬细胞进行比较,所述炎症性巨噬细胞是通过将bmdm暴露于tlr4激动剂单磷酰基脂质a单独产生的。尽管在含抑制性il-4的培养基中培养,但用irf5/ikkβmrna np转染的巨噬细胞显示出与炎症性巨噬细胞相似的基因表达谱(图2i)。标签m2巨噬细胞基因,如serpinb2和ccl2(jablonski k等人(2015)plos one 10:e0145342;varga t等人(2016)j immunol 196:4771-4782)在关键m1分化基因如ccl5(sica a等人(2012)j clin invest 122:787-795)上调时显著下调(图2j,2k)。这些数据确立,np介导的irf5及其激酶的表达使抑制性巨噬细胞偏向促炎性表型。
[0652]
实施例2.np递送的促m1基因对播散性卵巢癌的治疗作用。为了在临床相关的体内测试系统中评价这种治疗方法,使用了在c57bl/6小鼠中重演晚期、不可切除的卵巢肿瘤的模型;向这些动物注射了id8卵巢癌细胞,所述id8卵巢癌细胞用荧光素酶标记以实现肿瘤生长的系列生物发光成像(liao jb等人(2015)j immunother cancer 3:16;stephan sb等人(2015)nat biotechnol 33:97-101)。允许肿瘤建立两周。到此阶段,小鼠在整个腹膜壁和肠系膜中都发展出了结节。将动物分为3个组,其接受pbs(对照)、gfpnp(假的)或以100μg mrna/小鼠/周的腹膜内剂量持续9周的irf5/ikkβnp处理(图4a)。观察到在irf5/ikkβnp处理组中,疾病消退并且最终在40%的动物中被清除(中值存活期总体142天,对比对照组的60天;图4b-4c)。为了解irf5/ikkβnp介导的抗肿瘤作用的潜在机制,首先检查了甘露糖受体靶向性限制np与吞噬细胞的相互作用的排他性程度。在第一剂量的用二-甘露糖靶向的np后24小时收集的腹膜灌洗液的流式细胞术揭示优先基因转移到巨噬细胞和单核细胞中(平均值分别为37.1%和15.3%,图4d),而至脱靶细胞中的转染则很少或检测不到。接下来
在3周内(两次每周一次注射)用irf5/ikkβ纳米颗粒或pbs处理后,对患有确立的卵巢癌的小鼠腹膜中巨噬细胞/单核细胞群体进行了详细的表型和功能分析。流式细胞术分析揭示,irf5/ikkβnp将免疫抑制性巨噬细胞群体(ly6c-、f4/80+、cd206+)减少至平均2.6%
±
2.1%对比对照组43%
±
15.6%(图4e-4f)。相反,m1样巨噬细胞的评分从0.5%
±
0.2%增加至10.2%
±
4.1%(图4e,4g)。irf5基因疗法也影响了其他免疫细胞的群体。特别地,炎症性单核细胞(cd11b+、ly6c+、ly6g-)更丰富(73.4%
±
3.6%,相比之下未处理的小鼠中为4.5%
±
1.9%)。在所有用irf5 np处理的动物中,令人感兴趣的一个发现是在赘瘤内或周围存在淋巴细胞的多灶性密集簇(图4h),从而表明免疫刺激性巨噬细胞的遗传编程可恢复淋巴细胞迁移和浸润到实体瘤中。
[0653]
通过荧光活化细胞分选分离腹膜巨噬细胞以分析它们的细胞因子分泌,并检测到促炎性(抗肿瘤)细胞因子il-12(高3.4倍)、ifn-g(高8.4倍)和tnf-α(高1.5倍)释放的稳健增加,而与朝向交替活化的(m2样)巨噬细胞分化相关的调控性细胞因子il-6的水平降低97倍;图4i)。基因组表达谱分析证实在irf5/ikkβ纳米颗粒处理的小鼠中朝向m1样巨噬细胞表型的分化。包括在mpla或il-4中离体培养的巨噬细胞的基因表达水平,以分别提供经典m1样或m2样巨噬细胞的参考值(图4j)。
[0654]
生物分布和安全性。接下来在腹膜内注射后24小时,使用被设计为仅检测递送纳米颗粒(密码子优化)的irf5的rt-qpcr测定法对纳米颗粒在各个器官中的分布进行了定量。位于腹膜内的器官(包括肝、脾、肠、胰腺和膈肌)中发现了最高浓度的ivt mrna(图5a)。位于腹膜外部的器官(心脏、肺、肾)中检测到少量的颗粒递送的mrna,从而表明腹膜内注射的纳米载体的一部分进入全身循环。在分布数据的指导下,接下来评估这些纳米试剂是否具有生物相容性以及对于重复给药是否安全。向小鼠注射了总计8个剂量的irf5/ikkβnp(两个50μg mrna剂量/周持续4周,图5b)。在最终剂量后24小时对它们进行安乐死,记录体重,通过眼眶后放血收集血液以进行血清化学分析,并进行完整的大体尸检。组之间没有体重差异。由董事会认证的工作人员病理学家对以下组织进行了评价:肝、脾、肠系膜、胰腺、胃、肾、心脏和肺。组织病理学评价揭示在所有情况下肿瘤病变内或周围的淋巴细胞多灶性致密簇,但在不存在赘瘤性细胞的组织中未观察到炎症或症状明显的坏死的迹象(图5c)。此外,irf5/ikkβnp处理的小鼠的血清化学性质与pbs对照的血清化学性质相当,从而表明没有发生全身性毒性(图5d)。由于在生物分布研究中全身检测到少量irf5-mrna,因此设计了平行实验来定量外周血中的炎症性细胞因子。在单次腹膜内注射irf5/ikkβnp后,测量到白细胞介素6(il-6)的血清水平中等且短暂增加至26.8pg/ml的平均值(图5e)并且肿瘤坏死因子-α(tnf-α)中等且短暂增加至平均94.7pg/ml(图5f)。基于先前报告,这些水平比与病理学发现相关的那些水平低500倍,并且因此可被认为是安全的tarrant j.m.(2010)toxicol sci 117:4-16;copeland s等人.(2005)clin diagn lab immunol 12:60-67)。
[0655]
通过静脉内输注irf5/ikkβ纳米颗粒来控制全身性肿瘤转移。基于直接向腹膜腔内施用irf5/ikkβnp以治疗遍布整个腹膜的肿瘤病变所实现的治疗应答,下一个问题是静脉内输注的mrna纳米载体是否能够系统性地使巨噬细胞编程以控制播散性疾病。rt-qpcr生物分布研究揭示,静脉内输注的纳米载体优先将它们的mrna货物递送至具有大量常驻巨噬细胞/吞噬细胞的器官(主要是脾、肝和肺)(图6a)。为了在临床上相关的体内测试系统中测量抗肿瘤应答,将含有irf5/ikkβmrna的纳米颗粒施用至患有播散性肺部黑素瘤转移的
小鼠中(图6b)。最近的工作描述单核细胞和巨噬细胞在建立由这种疾病引起的转移中的基础作用(butler kl等人(2017)sci rep 7:45593;nielsen sr等人(2017)mediators inflamm 2017:9624760),并且通过共聚焦显微术证实肿瘤植入与肺中吞噬细胞累积相协调(图6c)。通过生物发光成像确定肿瘤负担,并将具有可检测癌症的小鼠分选为具有匹配水平的组。然后将各组随机分配至处理条件、不接受疗法(pbs)或静脉内注射gfp或irf5/ikkβ包封的纳米颗粒。只有irf/ikkβ纳米颗粒疗法显著减少了肺部肿瘤负担;实际上,它们将整体存活率平均提高了1.3倍(图6d-6e)。在平行实验中,在肿瘤接种22天后处死小鼠,以验证具有肺转移计数的生物发光肿瘤信号并通过流式细胞术评估巨噬细胞极化。irf5/ikk np处理的动物的肺中转移的总数与pbs对照(平均419
±
139个转移)相比,减少了8.7倍(平均40
±
16个转移)(图6f-6g)。支气管肺泡灌洗液细胞的流式细胞术揭示从免疫抑制性(cd206+、mhcii-、cd11c+、cd11b低)巨噬细胞朝向活化的(cd206-、mhcii+、cd11c-、cd11b+)吞噬细胞的明显转变(图6h-6i)。
[0656]
使肿瘤抑制性吞噬细胞编程以治疗神经胶质瘤。对于第三体内测试系统,对神经胶质瘤进行了检查,所述神经胶质瘤是难以控制的癌症类型,其中m2样巨噬细胞代表了大多数非赘瘤细胞并促进肿瘤生长和侵袭(hambardzumyan d等人(2016)nat neurosci 19:20-27)。目前,这种疾病的护理标准是放射疗法,不幸的是,所述放射疗法仅提供暂时的稳定或症状减轻,并将中值存活期延长3个月(mann j等人(2017)front neurol 8:748)。为了重演疾病的遗传事件和随后的分子进化,使用了pdgfβ驱动的神经胶质瘤的rcas-pdgf-b/nesti n-tv-a;ink4a/arf-/-;pten-/-转基因小鼠模型(pdg小鼠(hambardzu myan d等人(2009)transl oncol 2:89-95;quail df等人(2016)sci ence 352:aad3018))。向脑组织立体定向注射用rcas-pdgfβ或rc as-cre逆转录病毒转染的df-1细胞混合物(1:1混合物,2μl)。在神经胶质瘤祖细胞中pdgfβ致癌基因的过表达以及肿瘤抑制基因ink4a-arf和pten的不存在导致直径4-5mm的肿瘤形成(图7a),且在21天内几乎完全渗透(如先前所确立(hambardzumyan d等人(2009)tra nsl oncol 2:89-95))。使用免疫荧光,在已建立的神经胶质瘤(在从左侧第三图中指示)中证实肿瘤浸润性(cd68+)巨噬细胞的存在(图7b,在从左侧第三图中指示)。流式细胞术揭示f4/80+、cd11b+巨噬细胞群体占肿瘤中总细胞的32.8%,其为年龄匹配的健康对照小鼠中观察到者(3.7%)的9倍(图7c)。实验中的pdg小鼠表达与关键癌症基因启动子连接的萤火虫荧光素酶基因。已经证明来自这种报告基因的生物发光与肿瘤等级呈正相关(uhrbom l等人(2004)nat med 10:1257-1260),因此将其用于监测在处理开始后每四天肿瘤的发展。首先测试了作为单一疗法的irf/ikkβnp:在对照组中,pdg小鼠接受了9个剂量的负载有irf5/ikkβmrna的np或pbs(3个剂量/周持续3周)的静脉内输注。irf/ikkβnp处理仅中等抑制了肿瘤进展(与未处理的对照相比,平均仅产生5天存活期优势;图7d)。然而,与pbs对照组相比,将作为护理标准的放射疗法与irf5/ikkβnp注射相结合显著降低了肿瘤生长,并且使经处理小鼠的存活期提高一倍以上(分别52天对比25天;图7e-7f)。
[0657]
总之,来自三种临床前实体瘤模型的体内结果表明,局部或全身施用的纳米颗粒可递送编码巨噬细胞极化的主调控因子的基因,以将免疫抑制性巨噬细胞重编程为肿瘤清除性表型。
[0658]
从鼠至人巨噬细胞的翻译。为了证实在小鼠中获得的数据与治疗人疾病具有相关
性,制备了递送编码人irf5和ikkβ的ivt mrna的np(huirf5 np)。人单核细胞系thp-1用作公认的m1和m2巨噬细胞极化模型来测试这些纳米载体(li c等人(2016)sci rep 6:21044;surdziel e等人(2017)plos one 12:e0183679)。通过用pma处理thp-1细胞并用il-4和il-13将它们极化来产生m2型巨噬细胞(图8a)。为了证实huirf5 np具有功能并活化irf途径,用负载有huirf5/ikkβ或gfp对照mrna的纳米颗粒转染thp1-luciatm isg细胞。thp1-luciatm isg细胞在irf诱导型启动子的控制下分泌荧光lucia报告基因。这种复合启动子包括与isg54最小启动子融合的五个ifn刺激应答元件(isre),isg54最小启动子对nf-κb或ap-1途径的活化因子无应答。结果,thp1-lucia
tm
isg细胞允许通过确定lucia荧光素酶的活性来监测irf途径。已经发现,huirf5 np明显上调了m2极化的thp-1细胞中的荧光素酶表达,从而表明mrna构建体在人细胞中是有功能的(图8b-8c)。为了确定irf5途径活化是否能够将m2极化的thp-1细胞重编程为m1样表型,测量了在np转染后促炎性细胞因子il-1β的分泌。与未转染的对照相比,在用huirf5 np转染的thp-1细胞中,il-1β的产生显著增加(平均21倍;p《0.0001,图8d),这与m1巨噬细胞细胞表面标志物cd80的稳健上调(mfi为10.9倍,p《0.0001)有关(图8e)。
[0659]
实施例3.递送irf5/ikkb和epcam-cd3双特异性抗体mrna的纳米颗粒将在播散性4期卵巢癌和4t1乳腺癌肺转移模型的临床前小鼠模型中施用。将评估潜在机制(肿瘤微环境组成的变化)和双特异性抗体血清水平(与直接在肿瘤部位处的双特异性抗体浓度相比)。还将进行原位产生的对比静脉内施用的双特异性抗体蛋白的并行比较。
[0660]
(13)结束段落。本文所描述的核苷酸序列使用核苷酸碱基的标准字母缩写示出,如37c.f.r.
§
1.822中所定义。仅示出每个核苷酸序列的一条链,但是互补链应理解为包括在其中其为适当的实施方案中。
[0661]
还包括本文公开和引用的序列的变体。确定在不消除生物活性的情况下哪些氨基酸残基可被取代、插入或缺失的指导可使用本领域已熟知的计算机程序如dnastar
tm
(madison,wisconsin)软件发现。优选地,本文公开的蛋白质变体中的氨基酸变化是保守性氨基酸变化,即,类似地带电或不带电氨基酸的取代。保守性氨基酸变化涉及在其侧链中相关的氨基酸家族之一的取代。
[0662]
在肽或蛋白质中,氨基酸的合适的保守性取代是本领域技术人员已知的,并且通常可在不改变所得分子的生物活性的情况下进行。本领域技术人员认识到,一般来说,多肽的非必需区域中的单个氨基酸取代基本上不会改变生物活性(参见例如,watson等人molecular biology of the gene,第4版,1987,the benjamin/cummings pub.co.,第224页)。天然存在的氨基酸通常分为如下保守性取代家族:第1组:丙氨酸(ala)、甘氨酸(gly)、丝氨酸(ser)和苏氨酸(thr);第2组:(酸性):天冬氨酸(asp)和谷氨酸(glu);第3组:(酸性;也分类为极性带负电的残基及其酰胺):天冬酰胺(asn)、谷氨酰胺(gln)、asp和glu;第4组:gln和asn;第5组:(碱性;也分类为极性带正电荷的残基):精氨酸(arg)、赖氨酸(lys)和组氨酸(his);第6组(大的脂族非极性残基):异亮氨酸(ile)、亮氨酸(leu)、甲硫氨酸(met)、缬氨酸(val)和半胱氨酸(cys);第7组(不带电的极性):酪氨酸(tyr)、gly、asn、gln、cys、ser和thr;第8组(大的芳族残基):苯丙氨酸(phe)、色氨酸(trp)和tyr;第9组(非极性):脯氨酸(pro)、ala、val、leu、ile、phe、met和trp;第11组(脂族):gly、ala、val、leu和ile;第10组(小的脂族非极性或弱极性残基):ala、ser、thr、pro和gly;以及第12组(含硫):met和
cys。另外的信息可见于creighton(1984)proteins,w.h.freeman and company。
[0663]
在进行此类变化时,可考虑氨基酸的亲水性指数(hydropathic index)。本领域中通常了解亲水性氨基酸指数在对蛋白质赋予相互作用性生物功能方面的重要性(kyte和doolittle,1982,j.mol.biol.157(1),105-32)。已基于各氨基酸的疏水性和电荷特征对其指定亲水性指数(kyte和doolittle,1982)。这些值是:ile(+4.5);val(+4.2);leu(+3.8);phe(+2.8);cys(+2.5);met(+1.9);ala(+1.8);gly(-0.4);thr(-0.7);ser(-0.8);trp(-0.9);tyr(-1.3);pro(-1.6);his(-3.2);谷氨酸(-3.5);gln(-3.5);天冬氨酸(-3.5);asn(-3.5;lys(-3.9);和arg(-4.5)。
[0664]
本领域中已知某些氨基酸可被具有类似亲水性指数或评分的其他氨基酸取代且仍然产生具有类似生物活性的多肽,即仍然获得生物功能上等效的蛋白质。在进行此类变化中,其亲水性指数在
±
2内的氨基酸的取代是优选的,在
±
1内的那些是特别优选的,并且在
±
0.5内的那些是甚至更特别优选的。在本领域中还应了解,可基于亲水性有效地进行相似氨基酸的取代。
[0665]
如us 4,554,101中所详述,以下亲水性值已指定给氨基酸残基:arg(+3.0);lys(+3.0);天冬氨酸(+3.0
±
1);谷氨酸(+3.0
±
1);ser(+0.3);asn(+0.2);gln(+0.2);gly(0);thr(-0.4);pro(-0.5
±
1);ala(-0.5);his(-0.5);cys(-1.0);met(-1.3);val(-1.5);leu(-1.8);ile(-1.8);tyr(-2.3);phe(-2.5);trp(-3.4)。应理解,氨基酸可被取代成具有相似亲水性值的另一种氨基酸,并且仍然获得生物学上等效的且特别是免疫学上等效的蛋白质。在此类变化中,其亲水性值在
±
2内的氨基酸的取代是优选的,在
±
1内的那些是特别优选的,并且在
±
0.5内的那些是甚至更特别优选的。
[0666]
如上所述,氨基酸取代可基于氨基酸侧链取代基的相对相似性,例如,它们的疏水性、亲水性、电荷、大小等。如在别处指出的,基因序列的变体可包括密码子优化的变体、序列多态性、剪接变体和/或在统计学上不显著影响所编码产物的功能的突变。
[0667]
本文公开的蛋白质、核苷酸和基因序列的变体还包括与本文公开的蛋白质、核苷酸或基因序列具有至少70%序列同一性、80%序列同一性、85%序列同一性、90%序列同一性、95%序列同一性、96%序列同一性、97%序列同一性、98%序列同一性或99%序列同一性。
[0668]“序列同一性%”是指如通过比较序列所确定的两种或更多种序列之间的关系。在本领域中,“同一性”还意指如通过此类序列串之间的匹配所确定的蛋白质、核苷酸或基因序列之间的序列相关性程度。“同一性”(经常称为“相似性”)可通过已知方法来容易地计算,所述方法包括在以下中描述的那些:computational molecular biology(lesk,a.m.编辑)oxford university press,ny(1988);biocomputing:informatics and genome projects(smith,d.w.编辑)academic press,ny(1994);computer analysis of sequence data,part i(griffin,a.m.和griffin,h.g.编辑)humana press,nj(1994);sequence analysis in molecular biology(von heijne,g.编辑)academic press(1987);以及sequence analysis primer(gribskov,m.and devereux,j.编辑)oxford university press,ny(1992)。确定同一性的优选方法经设计以得到所测试序列之间的最佳匹配。确定同一性和相似性的方法编写于可公开获得的计算机程序中。序列比对和同一性百分比计算可使用lasergene生物信息学计算套件(dnastar,inc.,madison,wisconsin)的megalign程
序来执行。序列的多重比对还可使用clustal比对方法(higgins和sharp cabios,5,151-153(1989)以默认参数(空位罚分=10,空位长度罚分=10)来执行。相关程序还包括gcg程序套件(威斯康星软件包9.0版,genetics computer group(gcg),madison,wisconsin);blastp、blastn、blastx(altschul等人,j.mol.biol.215:403-410(1990);dnastar(dnastar,inc.,madison,wisconsin);以及并入smith-waterman算法的fasta程序(pearson,comput.methods genome res.,[proc.int.symp.](1994),会议日期1992,111-20.编辑:suhai,sandor.publisher:plenum,new york,n.y.。在本公开的上下文内,将了解在将序列分析软件用于分析的情况下,分析的结果是基于所引用的程序的“默认值”。如本文所用,“默认值”将意指在首次初始化时用软件最初加载的值或参数的任何集合。
[0669]
变体还包括在严格杂交条件下与本文公开的序列杂交并提供与参考序列相同功能的核苷酸分子。示例性严格杂交条件包括在42℃下在包含50%甲酰胺、5xssc(750mm nacl、75mm柠檬酸三钠)、50mm磷酸钠(ph 7.6)、5x登哈特氏溶液、10%硫酸葡聚糖和20μg/ml变性、剪切的鲑鱼精子dna的溶液中过夜孵育,然后在50℃下于0.1xssc中洗涤过滤器。杂交和信号检测严格性的改变主要通过操作甲酰胺浓度(较低甲酰胺百分比导致严格性降低);盐条件或温度来实现。例如,中高严格条件包括在37℃下在包含6xsspe(20xsspe=3m nacl;0.2m nah2po4;0.02m edta,ph 7.4);0.5%sds、30%甲酰胺、100μg/ml鲑鱼精子阻断dna的溶液中过夜孵育;然后在50℃下用1xsspe、0.1%sds洗涤。另外,为了获得甚至更低的严格性,可在更高的盐浓度(例如5xssc)下进行严格杂交后进行的洗涤。上述条件的变化可通过包含和/或取代用于抑制杂交实验中的背景的替代阻断试剂来实现。典型的阻断试剂包括登哈特氏试剂、blotto、肝素、变性鲑鱼精子dna和可商购获得的专有制剂。由于相容性问题,包含特定阻断试剂可能需要改变上述杂交条件。
[0670]“特异性结合”是指(例如,car结合结构域或纳米颗粒选择的细胞靶向配体的)结合结构域与其同源结合分子以等于或大于105m-1
的亲和力或ka(即特定结合相互作用的平衡缔合常数,单位为1/m)的缔合,而不与相关环境样品中的任何其他分子或组分显著缔合。“特异性结合”在本文中也称为“结合”。结合结构域可分类为“高亲和力”或“低亲和力”。在特定实施方案中,“高亲和力”结合结构域是指具有至少107m-1、至少108m-1、至少109m-1、至少1010m-1、至少1011m-1、至少1012m-1或至少1013m-1的ka的那些结合结构域。在特定实施方案中,“低亲和力”结合结构域是指具有至多107m-1、至多106m-1、至多105m-1的ka的那些结合结构域。或者,亲和力可被定义为特定结合相互作用的平衡解离常数(kd),单位为m(例如,10-5m至10-13m)。在某些实施方案中,结合结构域可具有“增强的亲和力”,其是指与野生型(或亲本)结合结构域相比,选择的或工程化的结合结构域与同源结合分子的更强结合。例如,增强的亲和力可能是由于同源结合分子的ka(平衡缔合常数)高于参考结合结构域,或者是由于同源结合分子的kd(解离常数)低于参考结合结构域的kd(解离常数),或者是由于同源结合分子的解离速率(koff)小于参考结合结构域的解离速率(koff)。已知多种测定用于检测特异性地结合特定同源结合分子的结合结构域以及确定结合亲和力,如蛋白质印迹、elisa和分析(还参见例如,scatchard,等人,1949,ann.n.y.acad.sci.51:660;和us 5,283,173、us 5,468,614或等效文献)。
[0671]
除非另有说明,否则本公开的实践可采用免疫学、分子生物学、微生物学、细胞生物学和重组dna的常规技术。这些方法在以下出版物中进行了描述。参见例如,sambrook,等
人molecular cloning:alaboratory manual,第2版(1989);f.m.ausubel,等人编辑,current protocols in molecular biology,(1987);the series methods in enzymology(academic press,inc.);m.macpherson,等人,pcr:apractical approach,irl press at oxford university press(1991);macpherson等人,编辑pcr 2:practical approach,(1995);harlow和lane,编辑antibodies,a laboratory manual,(1988);和r.i.freshney,编辑animal cell culture(1987)。
[0672]
如本领域普通技术人员将了解的,本文所公开的每个实施方案可包含以下、基本上由或由以下组成:所述实施方案特别陈述的要素、步骤、成分或组分。因此,术语“包括(include)”或“包括(including)”应解释为叙述:“包含(comprise)、由
……
组成或基本上由
……
组成”。过渡术语“包含/包括(comprise)”或“包含/包括(comprises)”意指具有但不限于,并且允许包括未指定的要素、步骤、成分或组分,即使在较大的量时也是如此。过渡短语“由
……
组成”排除未指定的任何要素、步骤、成分或组分。过渡短语“基本上由
……
组成”将实施方案的范围限制为指定的要素、步骤、成分或组分以及并不实质地影响所述实施方案的那些要素、步骤、成分或组分。根据本公开中描述的相关实验方法,材料效应将导致获得要求保护的作用的能力在统计学上显著降低。
[0673]
除非另外指示,否则说明书和权利要求中所用的表示成分的量,如分子量的性质、反应条件等的所有数值均应当理解为在所有情况下都由术语“约”修饰。因此,除非有相反的指示,否则说明书和所附权利要求中所陈述的数值参数都是近似值,所述近似值可根据本发明要寻求获得的所需性质而变化。在最低限度,并且不试图将等效物原则的应用限制于权利要求的范围,每个数值参数均应当至少根据报告的有效数字的数值和通过应用普通四舍五入技术来解读。当要求进一步澄清时,术语“约”当与陈述的数值或范围结合使用时具有本领域技术人员合理地归于它的含义,即将稍微大于或稍微小于陈述值或范围表示为在以下范围内:陈述值
±
20%;陈述值
±
19%;陈述值
±
18%;陈述值
±
17%;陈述值
±
16%;陈述值
±
15%;陈述值
±
14%;陈述值
±
13%;陈述值
±
12%;陈述值
±
11%;陈述值
±
10%;陈述值
±
9%;陈述值
±
8%;陈述值
±
7%;陈述值
±
6%;陈述值
±
5%;陈述值
±
4%;陈述值
±
3%;陈述值
±
2%;或陈述值
±
1%。
[0674]
尽管陈述本发明的宽泛范围的数值范围和参数是近似值,但在具体实施例中所陈述的数值尽可能准确地报告。然而,任何数值固有地含有必然由它们各自测试测量值中发现的标准偏差所产生的某些误差。
[0675]
除非本文另外指示或者与上下文明显矛盾,否则在描述本发明的上下文中(尤其在所附权利要求的上下文中)使用的术语“一个/种(a、an)”、“所述”以及类似的指代语应解读为涵盖单数和复数形式。本文中列举数值的范围仅意在作为一种单个地提及落在所述范围内的每个单独数值的速记方法。除非本文另外指明,否则每个单个数值都并入到本说明书中,如同其在本文中被单个地列举一样。除非本文另外指明或上下文明显矛盾,否则可按任何适合的顺序来执行本文所述的全部方法。本文提供的任何和所有实施例或示例性语言(例如,“诸如”)仅意在更好地说明本发明,而不会对原本要求保护的本发明的范围构成限制。说明书中的任何语言都不应解读为指示任何未要求保护的要素是实施本发明所必需的。
[0676]
本文所公开的本发明的替代要素或实施方案的分组不应解读为是限制性的。每个
组的成员可单个地提及和要求保护,或以与所述组的其他成员或本文中出现的其他要素的任何组合形式提及和要求保护。可预见,出于简便和/或可专利性的原因,一个组的一个或多个成员可包括于所述组内,或从所述组中删除。当出现任何这种包括或删除时,本说明书被认为含有所修改的组,因此满足所附权利要求中使用的所有马库什组(markush group)的书面描述。
[0677]
本文描述了本发明的某些实施方案,包括为本发明人所知用于实施本发明的最佳模式。当然,本领域技术人员在阅读前面的描述后将会明了这些所描述实施方案的变化形式。本发明人预期本领域的熟练技术人员会适时采用此类变化形式,而且本发明人意图本发明能以除了本文具体描述的方式之外的其他方式来实施。因此,本发明包括在适用法律允许的所附的权利要求中列举的主题的所有修改形式和等效形式。此外,除非本文另有指示或与上下文明显矛盾,否则呈所有可能变化形式的上述要素的任何组合都涵盖在本发明内。
[0678]
此外,在整个说明书中,已经大量参考了专利、印刷的出版物、期刊文章和其他书面文本(本文的参考材料)。每一参考材料关于它们的参考教义单个地以引用的方式整体并入本文。
[0679]
最后,应当理解,本文所公开的本发明的实施方案是对本发明原理的说明。可采用的其他修改形式也在本发明的范围内。因此,例如但不限于,可根据本文的教义利用本发明的替代性配置。因而,本发明不限于明确示出和描述的实施方案。
[0680]
本文示出的细节是作为实例并且仅出于说明性讨论本发明的优选实施方案的目的,并且之所以呈现所述细节,是为了提供认为是本发明的各个实施方案的原理和概念方面的最有用和易理解的描述的内容。就此而言,除对于本发明的基本理解所必需的之外,没有企图更详细地示出本发明的结构细节,借助于附图和/或实施例所作的描述使得本领域技术人员明了如何可以在实践中体现本发明的若干形式。
[0681]
除非在实施例中明确并毫无疑问地修改或是当含义的应用使得任何构建无意义或基本上无意义,否则在本公开中使用的定义和解释意指并且旨在控制任何未来构建。在术语的构建将使它无意义或基本上无意义的情况下,定义应该从韦氏字典(webster's dictionary)第3版或本领域普通技术人员已知的字典诸如生物化学和分子生物学牛津字典(attwood t编著,牛津大学出版社,oxford,2006)中取得。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1