抗CDCP1抗体的制作方法
抗cdcp1抗体
技术领域
1.本发明涉及抗cdcp1抗体。更具体而言,涉及与健康人骨髄造血干细胞的结合性低的抗人cdcp1抗体及其片段、以及它们的用途。
背景技术:
2.人cdcp1(cub domain containing protein 1,含cub结构域蛋白1)(以下也称为hcdcp1)是由总长度836个氨基酸组成的、具有3个cub结构域(complement c1r/c1s、uegf、bmp1结构域)的i型跨膜蛋白(参照非专利文献1)。cub结构域除存在于bmp1、c1r之外,还存在于tmprss7等具有蛋白酶活性的蛋白质、lrp3、nrp1和tll2等与细胞间相互作用相关的蛋白质等多种蛋白质中,但缺乏对分子功能的统一认识。在胞外域的n端侧具有大量的n-糖基化位点,已观察到糖基化程度与癌细胞的转移性状态之间具有相关性(参照非专利文献2)。hcdcp1在各种细胞中表达,但其可溶性配体不明,另一方面,暗示与egfr等各种膜蛋白相互作用(参照非专利文献3)。hcdcp1蛋白在电泳中显示出135kda的条带尺寸,但cub1结构域与cub2结构域之间的第368/369位或第369/370位的氨基酸位点被丝氨酸蛋白酶切割时,会产生70kda的片段。(参照非专利文献1)。
3.通过src家族激酶的作用等,hcdcp1的位于胞内区域的第734位、第743位、第762位的酪氨酸残基可被磷酸化。被磷酸化的hcdcp1通过将pkcδ磷酸化等诱发下游的信号,促进支架非依赖性增殖、细胞外基质的降解、细胞迁移和上皮间质转化等,引发癌细胞的转移。另外,已知hcdcp1与egfr、her2等各种分子相互作用而促进癌细胞的增殖、转移。
4.据报道,hcdcp1在各种癌细胞和正常组织中表达。例如,报道了hcdcp1mrna和蛋白在前列腺癌、肺癌、大肠癌、卵巢癌等癌细胞、由这些建立的细胞系以及结肠、皮肤、小肠和前列腺等正常组织中表达(参照专利文献1、专利文献2)。
5.迄今为止,已知一些针对hcdcp1的抗体(以下有时也称为抗人cdcp1或抗hcdcp1抗体)。
6.专利文献2中公开了:抗hcdcp1多克隆抗体以及使用了该抗体的卵巢癌的筛选方法、诊断方法和治疗方法。专利文献1中公开了抗hcdcp1单克隆抗体(克隆名:25a11)。公开了:25a11上结合有皂草素的adc(antibody-drug-conjugate)化抗体在体外对pc3癌细胞株显示出细胞毒性活性,通过将该adc化抗体静脉内给药而发挥显著的肿瘤生长抑制活性。
7.另外,专利文献4中公开了多个抗hcdcp1抗体,且公开了:通过吡咯并苯并二氮杂卓(pbd:pyrrolobenzodiazepine)而adc化的抗hcdcp1抗体在体外对前列腺癌细胞株显示出细胞毒性活性;通过mmae(monomethyl auristatin e,一甲基澳瑞他汀e)而adc化的抗hcdcp1抗体在移植了乳腺癌细胞株、大肠癌细胞株或前列腺癌细胞株的小鼠移植瘤模型中显示出抗肿瘤活性。
8.进而,专利文献3中公开了:4个抗hcdcp1单克隆抗体(cub1抗体、cub2抗体、cub3抗体和cub4抗体;分别来自杂交瘤克隆cub1~4)。公开了:这些抗hcdcp1单克隆抗体与在正常cd34阳性(cd34
+
)细胞和正常cd133阳性(cd133
+
)细胞中表达的hcdcp1蛋白结合,因此该抗
体可以用于造血干细胞、间充质干细胞和神经干细胞等的分离和鉴定。
9.现有技术文献
10.专利文献
11.专利文献1:国际公报wo2008/133851号
12.专利文献2:欧州专利公开公报1677875号
13.专利文献3:美国专利公开公报7,541,030号
14.专利文献4:国际公报wo2018/112334号
15.非专利文献
16.非专利文献1:mostageer等,oncogene 20:4402-4408 2001.
17.非专利文献2:yang等,oncotarget 6:43743-58 2015.
18.非专利文献3:he等,oncoscience 3:5-8 2016.
技术实现要素:
19.发明要解决的问题
20.如上所述,已经证实了hcdcp1 mrna和hcdcp1蛋白在正常组织/细胞和癌组织/细胞中表达,示出了专利文献3中公开的cub1抗体除了与表达hcdcp1的k562细胞(人慢性髓系白血病细胞)结合之外还与正常的cd34
+
/cd38-骨髄细胞强烈结合。
21.进而,本发明人等证实了:专利文献2中公开的25a11来源的抗hcdcp1抗体、专利文献3中公开的cub4抗体和由biolegend公司市售的抗hcdcp1抗体(克隆名:cub1)除了与表达hcdcp1的各种癌细胞结合之外,还与正常的cd34阳性骨髄细胞强烈结合(参照图11、图12、图13的a、图15和图16)。
22.骨髄细胞中的cd34阳性细胞群中包含具有使所有人类血液系统细胞再生的能力的造血干细胞,cd34被认为是人造血干细胞的细胞表面标记物之一。
23.在使用这些抗hcdcp1抗体作为抗肿瘤药时,这些已知抗体与造血干细胞强烈结合的性质会引发严重的问题。即,抗hcdcp1抗体所结合的正常的骨髄细胞受到免疫功能(例如adcc活性)的攻击,使细胞所属组织发生功能障碍和功能抑制,极有可能产生严重的副作用。进而,将抗hcdcp1抗体adc化的情况下,adc化抗体也会对正常组织和细胞造成伤害,从而导致更显著且严重的不良影响。
24.因此,本发明的目的在于,提供诱发上述严重的副作用的可能性低的抗hcdcp1抗体。
25.用于解决问题的方案
26.本发明人等对各种抗hcdcp1抗体的抗原结合特性进行了研究,结果成功地制备了具有如下性质的新型抗hcdcp1抗体,所述性质是与表达hcdcp1的各种癌细胞结合、而与表达hcdcp1的造血干细胞等cd34阳性细胞相对较弱地结合。
27.因此,本发明为抗体及其抗原结合片段,其特征在于,所述抗体与cdcp1结合且与cd34阳性细胞的结合性低。
28.发明的效果
29.根据本发明,提供与cd34阳性细胞(例如,cd34阳性骨髄细胞)的结合性低的抗hcdcp1抗体。本发明的抗hcdcp1抗体通过adc化而显示出抗肿瘤活性,因此作为副作用少的
抗癌剂发挥效果。
附图说明
30.图1示出:hcdcp1胞外域纯化蛋白的凝胶渗透色谱的直方图。
31.图2示出:通过纤溶酶对hcdcp1胞外域纯化蛋白进行切割处理而得到的蛋白的sds-page的结果。
32.图3示出:强制表达hcdcp1的ba/f3细胞的细胞表面的hcdcp1蛋白表达量的基于流式细胞术的观察结果。
33.图4示出:强制表达hcdcp1的ba/f3细胞的基于胰蛋白酶处理的细胞表面cdcp1的切割结果。a示出利用流式细胞仪测定的、细胞群的pe的平均荧光强度的经时变化。b示出截短型hcdcp1分子的免疫印迹的结果。
34.图5示出:使用pc3细胞和hcdcp1缺损pc3细胞通过细胞elisa的抗hcdcp1抗体产生杂交瘤的筛选结果。a、b、c和d示出:使用实验1、实验2和实验3(参照实施例部分)中由各免疫动物制作的杂交瘤的培养上清液的细胞elisa的结果。
35.图6a示出:制作了小鼠/人嵌合抗体(mh12a041系列、mh14a025系列)的序列的cdr突变导入位置。
36.图6b示出:制作了小鼠/人嵌合抗体(mh14a043系列、mh14a063系列)的序列的cdr突变导入位置。
37.图7示出:小鼠/人嵌合抗体与hcdcp1强制表达细胞的反应性的流式细胞术的观察结果。
38.图8示出:小鼠/人嵌合抗体对于经胰蛋白酶处理的hcdcp1强制表达ba/f3细胞的反应性的流式细胞术的观察结果。
39.图9示出:小鼠/人嵌合抗体对于食蟹猴cdcp1的反应性的流式细胞术的观察结果。
40.图10a示出:小鼠/人嵌合抗体与癌细胞株(sk-mes-1、h358、mda-mb-231、hcc1143、capan-2、dld-1和ovcar3)的反应性的流式细胞术的观察结果。
41.图10b示出:小鼠/人嵌合抗体对癌细胞株(sk-ov-3、tfk-1、pc3和du145)和正常组织来源原代培养细胞(hmepc和nhek)的反应性的流式细胞术的观察结果。
42.图11示出:对杂交瘤所产生的小鼠抗体在10μg/ml的比较抗体浓度下与健康人骨髄cd34阳性细胞的反应性进行比较的、流式细胞术的观察结果。
43.图12示出:对小鼠/人嵌合抗体在10μg/ml的比较抗体浓度下与健康人骨髄cd34阳性细胞的反应性进行比较的、流式细胞术的观察结果。
44.图13的a~c示出:生物素化的小鼠/人嵌合抗体与健康人骨髄cd34阳性细胞的反应性的流式细胞术的观察结果。图13的d示出:对a~c中使用的抗rs病毒抗体生物素化抗体及正常人血清来源纯化igg生物素化蛋白在10ng/ml的比较抗体浓度下与骨髄cd34阳性细胞的反应性进行比较的图。
45.图14示出:人源化的抗hcdcp1抗体与hcdcp1强制表达ba/f3细胞的反应性的流式细胞术的观察结果。
46.图15示出:生物素化的人源化抗hcdcp1抗体、生物素化的比较对象抗体在10ng/ml的比较抗体浓度下与健康人骨髄cd34阳性细胞的反应性的流式细胞术的观察结果。
47.图16示出:利用流式细胞仪观察生物素化的人源化抗体与健康人骨髄cd34阳性细胞的反应性的浓度依赖性的结果。
48.图17示出:结合了pbd的抗hcdcp1小鼠/人嵌合抗体药物复合体对于癌细胞株和正常组织来源原代培养细胞的体外细胞毒性活性。
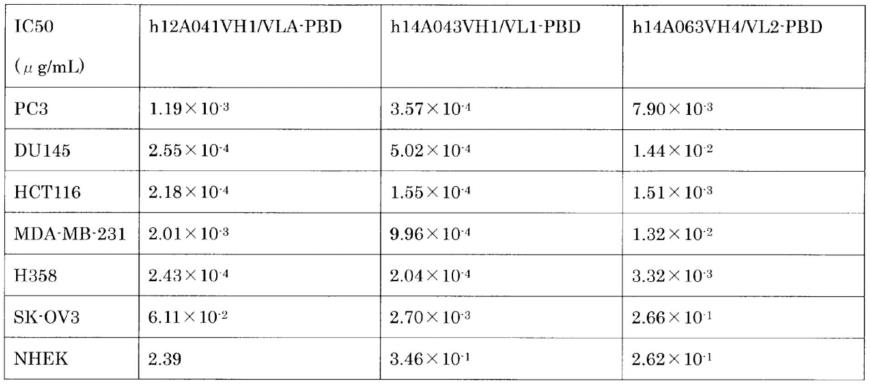
49.图18示出:结合了pbd的人源化抗hcdcp1抗体药物复合体对于癌细胞株和正常人表皮角化细胞原代培养细胞的体外细胞毒性活性。
50.图19的a和b示出:结合了pbd的抗hcdcp1小鼠/人嵌合抗体药物复合体在pc3细胞株移植瘤模型(scid小鼠模型)中的抗肿瘤活性。图19的c和d示出:结合了pbd的抗hcdcp1小鼠/人嵌合抗体药物复合体在pc3细胞株移植瘤模型(裸鼠模型)中的抗肿瘤活性。
51.图20的a示出:结合了pbd的人源化抗hcdcp1抗体药物复合体在pc3细胞株移植瘤模型(裸鼠模型)中的抗肿瘤活性。图20的b示出:结合了pbd的人源化抗hcdcp1抗体药物复合体在大肠癌细胞株hct116细胞株移植瘤模型中的抗肿瘤活性。
52.图21示出:结合了mmae的人源化抗hcdcp1抗体药物复合体在hct116细胞株移植瘤模型中的抗肿瘤活性。
具体实施方式
53.本发明的第1实施方式为抗体(以下也记为“本发明的抗hcdcp1抗体”)或其抗原结合片段,其特征在于,所述抗体与人cdcp1结合且与cd34阳性(cd34
+
)细胞的结合性低。
54.cd34阳性细胞是指在其细胞表面表达了cd34抗原的细胞。cd34是分子量约110kda的单链跨膜型磷酸化糖蛋白,在细胞外部具有结构不同的2个结构域。cd34是各种体干细胞的表面抗原标记物,在骨髄来源的造血干细胞/血管内皮祖细胞、骨骼肌卫星细胞、毛囊干细胞、脂肪组织间充质干细胞等中表达。
55.此处,若列举cd34阳性细胞的例子,则例如可列举出能分化为血液系统细胞的造血干细胞等。在造血干细胞中,在最低分化的细胞中表达最高,随着分化为各细胞系统,表达逐渐降低。
56.此处,本发明的hcdcp1抗体与cd34阳性细胞的“结合性”是指:该抗hcdcp1抗体与cd34阳性细胞的任意位点结合的能力(结合能力)。第1实施方式中,抗hcdcp1抗体与人cd34阳性细胞的结合性的评价通过跟非特异性人igg与cd34阳性细胞的结合能力进行比较来进行相对地评价。此处“非特异性人igg”是指:与人cdcp1蛋白不具有特异性反应性的人来源的igg,具体而言是指:已知与人cdcp1不具有特异性反应性的单克隆抗体、或者更优选为与cdcp1不具有特异性反应性的多个单克隆抗体的混合物、或者更优选为由人活体血清利用亲和色谱法等方法进行纯化提取而得到的igg混合物。作为具体的评价方法,在抗hcdcp1抗体和非特异性人igg为相同抗体浓度(以下作为“比较抗体浓度”)的条件下(即,抗hcdcp1抗体的浓度和非特异性人igg的浓度相同的条件下),对于人cd34阳性细胞,抗hcdcp1抗体和非特异性人igg显示出相同程度的结合能力时,评价抗hcdcp1抗体与人cd34阳性细胞的结合性低。例如,与非特异性人igg进行比较,抗hcdcp1抗体与人cd34阳性细胞未显示出统计学显著高的结合能力的情况,可以评价为结合性低。另外,抗hcdcp1抗体与非特异性人igg相比显示出高结合能力时,评价为抗hcdcp1抗体与人cd34阳性细胞的结合性高。例如,与非特异性人igg进行比较,抗hcdcp1抗体与人cd34阳性细胞显示出统计学显著高的结合能力
的情况,可以评价为结合性高。
57.另外,从另一个角度来看,本技术的保护范围包括具有比某个成为指标的抗体与cd34阳性细胞的结合性更低或相同程度的结合性的抗体。例如可列举出:具有跟“与cd34阳性细胞的结合性低于作为已知抗体的cub4的抗体(克隆名:h12a041vh1a/vl)”相同程度或比其低的结合性的抗体。
58.此处,“比较抗体浓度”没有特别限定,是指某特定的浓度点,例如为10ng/ml以上的任意浓度、100ng/ml以上的任意浓度、1μg/ml以上的任意浓度、更优选为10μg/ml以上的任意浓度。
59.另外,此处,10ng/ml的浓度点为在该试验系统中cub4充分反应的浓度、即cub4与cd34阳性细胞充分结合的浓度。因此,在该浓度点下能够充分地进行结合性的比较评价。
60.另外,抗hcdcp1抗体或非特异性人igg与cd34阳性细胞的结合性的评价没有特别限定,可以利用例如流式细胞术分析、elisa法、ria法、表面等离子共振法等来实施。
61.本发明的抗hcdcp1抗体例如可以如下制备。可以通过如下方式制备期望的抗体:从将人cdcp1的胞外域的整体或其一部分、或在表面上表达胞外域的整体或其一部分的细胞等作为抗原制作的抗体中,筛选与在癌细胞上表达的人cdcp1反应的抗体,进而从筛选出的抗体组中选择与健康人骨髄细胞的cd34阳性细胞级分的反应性低的抗体,从而制备。
62.关于本说明书中的“抗体”,其制备方法及其结构没有特别限定,例如包括单克隆抗体、多克隆抗体或纳米抗体等与期望的抗原以期望的特性结合的所有“抗体”。
63.本发明的抗hcdcp1抗体为多克隆抗体的情况下,例如可以通过对免疫动物(没有限定,例如,兔子、山羊、绵羊、鸡、豚鼠、小鼠、大鼠或猪等)注射抗原和佐剂的混合物来制备。通常,将抗原和/或佐剂向免疫动物的皮下或腹腔内多次注射。作为佐剂,没有限定,例如包括完全弗氏佐剂和单磷酰基脂质a合成海藻糖二十二烷酸酯(synthetic trehalose dicorynomycolate)(mpl-tmd)。进行抗原免疫后,可以通过从免疫动物来源的血清中利用常规方法(例如,使用含有proteina的琼脂糖等的方法等)将抗hcdcp1抗体纯化。
64.另外,本发明的抗hcdcp1抗体为单克隆抗体的情况下,例如可以如下方式制作。需要说明的是,本说明书中“单克隆”启示出由实质上均匀的抗体的群体(构成抗体的重链、轻链的氨基酸序列相同的抗体群体)得到的抗体的特性,并不意味着抗体由特定的方法(例如,杂交瘤法等)制作。
65.作为单克隆抗体的制作方法,例如可以列举出杂交瘤法(kohler和milstein,nature 256 495 1975)、或重组法(美国专利第4,816,567号)等。或者,本发明的抗hcdcp1抗体也可以从噬菌体抗体文库(例如,clackson等,nature 352 624-628 1991;marks等,j.mol.biol.222 581-597 1991等)、细胞文库(例如,日本专利4214234号;seo等,nature biotech.,23 731-735 2005等)中分离。更具体地说明,使用杂交瘤法制备时,该制备方法例如包括以下所示的4个工序:(i)对于免疫动物免疫抗原;(ii)回收单克隆抗体分泌性(或潜在分泌性)的淋巴细胞;(iii)使淋巴细胞与永生化细胞融合;(iv)选择分泌期望的单克隆抗体的细胞。作为免疫动物,例如可以选择小鼠、大鼠、豚鼠、仓鼠、兔子等。免疫后,使用聚乙二醇等融合剂、电融合法使由宿主动物得到的淋巴细胞与永生化细胞株融合以建立杂交瘤细胞。作为融合细胞,例如使用大鼠或者小鼠的骨髓瘤细胞株。进行细胞融合后,在包含抑制未融合的淋巴细胞和永生化细胞株的生长或存活的1种或多种基质的适合的培养基
中培养细胞。在通常的技术中,使用缺乏次黄嘌呤-鸟嘌呤磷酸核糖基转移酶(hgprt或hprt)这一酶的亲本细胞。在此情况下,可以通过如下方式获得目标单克隆抗体:将次黄嘌呤、氨基蝶呤和胸苷添加至抑制hgprt缺损细胞生长、且容许杂交瘤生长的培养基(hat培养基)中。从如此得到的杂交瘤中选择产生期望的抗体的杂交瘤,依据常规方法从所选择的杂交瘤生长的培养基中获得目标的单克隆抗体。
66.将如此制备的杂交瘤进行体外培养、或在小鼠、大鼠、豚鼠、仓鼠等的腹水中进行体内培养,能够由培养上清液或腹水制备目标抗体。
67.纳米抗体是指由抗体重链的可变区(variable domain of the heavy chain of heavy chain antibody;vhh)构成的多肽。通常人等的抗体由重链和轻链构成,但美洲驼、羊驼和骆驼等骆驼科的动物中,产生仅由重链构成的单链抗体(重链抗体)。重链抗体与通常的由重链和轻链构成的抗体同样地,能够识别靶抗原并与抗原结合。重链抗体的可变区是具有与抗原的结合亲和性的最小单位,该可变区片段被称为“纳米抗体”。纳米抗体具有高耐热性、抗消化性、常温稳定性,可以利用基因工程方法容易且大量地制备。
68.纳米抗体例如可以如下制作。对骆驼科的动物免疫抗原,从采集的血清中检测是否存在目标抗体,从检测到期望的抗体效价的免疫动物的外周血淋巴细胞来源的rna制作cdna。由得到的cdna扩增出编码vhh的dna片段,将其插入噬菌粒中,制备vhh噬菌粒文库。可以从制作的vhh噬菌粒文库中经过数次筛选而制作期望的纳米抗体。
69.本发明的抗hcdcp1抗体可以为基因重组抗体。作为基因重组抗体,没有限定,例如可列举出人抗体和与人抗体的嵌合抗体。嵌合抗体是指例如源自不同动物种属的可变区和恒定区连接而成的抗体(例如,小鼠来源抗体的可变区与人来源的恒定区结合的抗体)等(例如,proc.natl.acad.sci.u.s.a.81,6851-6855,(1984)等),可以通过基因重组技术容易地构建。
70.人源化抗体是在框架区(fr)具有人来源的序列、互补决定区(cdr)由其它动物种属(例如,小鼠等)来源的序列构成的抗体。对于人源化抗体,首先以其它动物种属、此处为小鼠进行说明,从小鼠来源的抗体的可变区中,将其cdr移植至人抗体可变区中,再构成重链和轻链可变区后,使这些人源化的再构成人抗体可变区与人抗体恒定区连接,从而可以制作。这样的人源化抗体的制作法是本领域中公知的(例如,proc.natl.acad.sci.usa,86:10029-10033(1989)等)。
71.本发明的抗体的抗原结合片段是本发明的抗体的一部分区域,是与人cdcp1结合的抗体片段,作为片段,例如可列举出fab、fab’、f(ab’)2、抗体可变区片段(fv:variable fragment of antibody)、单链抗体(重链、轻链、重链可变区、轻链可变区和纳米抗体等)、单链抗体(scfv:single chain fv)、双链抗体(scfv二聚体)、二硫键稳定性fv抗体(dsfv:disulfide-stabilized fv)、以及至少一部分中包含本发明的抗体的cdr的肽等。
72.fab是用蛋白质降解酶木瓜蛋白酶处理抗体分子而得到的片段中、通过二硫键键合了重链的n末端侧约一半和轻链整体的、具有抗原结合活性的抗体片段。fab的制作除了可以用木瓜蛋白酶处理抗体分子而获得片段之外,例如可以通过如下方式实施:构建插入了编码fab的dna的适合的表达载体,将其导入适合的宿主细胞(例如,cho细胞等哺乳类细胞、酵母细胞、昆虫细胞等)中后,在细胞内表达fab,从而实施。
73.f(ab’)2是用蛋白质降解酶胃蛋白酶处理抗体分子而得到的片段中、比通过铰链
区的二硫键结合了fab者稍大的、具有抗原结合活性的抗体片段。f(ab’)2除了用胃蛋白酶处理抗体分子而获得片段之外,也可以通过硫醚键或者二硫键来制作fab,进而,与fab同样地也可以通过基因工程方法来制作。
74.fab’是上述f(ab’)2的铰链区的二硫键被切割的、具有抗原结合活性的抗体片段。fab’也可以与fab等同样地利用基因工程方法制作。
75.scfv是使用适合的肽接头将1个重链可变区(vh)和1个轻链可变区(vl)连接而成的、vh-接头-vl或vl-接头-vh多肽,是具有抗原结合活性的抗体片段。scfv通过获得编码抗体的重链可变区和轻链可变区的cdna、利用基因工程方法而制作。
76.双链抗体(diabody)是scfv经二聚体化的抗体片段且具有2价的抗原结合活性的抗体片段。2价的抗原结合活性可以是相同抗原结合活性,或者,也可以是一者不同的抗原结合活性。双链抗体可以通过如下方式制作:获得编码抗体的重链可变区和轻链可变区的cdna,构建编码通过肽接头连接了重链可变区和轻链可变区的scfv的cdna,利用基因工程方法制作。
77.dsfv是指将重链可变区和轻链可变区中各1个氨基酸残基被置换为半胱氨酸残基的多肽通过该半胱氨酸残基间的二硫键结合而成者。置换为半胱氨酸残基的氨基酸残基可以基于抗体的立体结构预测进行选择。dsfv可以通过获得编码抗体的重链可变区和轻链可变区的cdna、构建编码dsfv的dna并利用基因工程方法而制作。
78.包含cdr的肽构成为包含重链或轻链的cdr(cdr1~3)中的至少1个区域以上。包含多个cdr的肽可以直接结合或通过适合的肽接头结合。关于包含cdr的肽,构建编码抗体的重链或轻链的cdr的dna并插入表达载体。作为载体的种类,没有特别限定,根据之后导入的宿主细胞的种类等进行适宜选择即可。导入适合以抗体形式来表达这些的宿主细胞(例如,cho细胞等哺乳类细胞、酵母细胞、昆虫细胞等)中,由此可以制造。另外,包含cdr的肽也可以通过fmoc法(芴甲氧基羰基法)和tboc法(叔丁氧基羰基法)等化学合成法来制造。
79.对于人抗体(完全人抗体),通常作为v区的抗原结合位点的超变区(hypervariable region)、v区的其它部分和恒定区的结构具有与人的抗体相同的结构。利用公知的技术,本领域技术人员则能够容易地制作人抗体。人抗体例如可以利用如下方法获得:使用具有包含人抗体的h链和l链的基因的人染色体片段的人抗体产生小鼠的方法(例如,tomizuka等,proc.natl.acad.sci.usa,(2000)97,722-727等);获得由人抗体文库选择的噬菌体展示来源的人抗体的方法(例如参照siriwardena等,opthalmology,(2002)109(3),427-431等)。
80.使用本发明的抗体的抗原结合片段,能够构成多特异性抗体。多特异性是指对2个以上的抗原具有结合特异性,例如可列举出对2个以上的抗原具有结合特异性的单克隆抗体或者包含抗原结合片段的蛋白质的形态。这由本领域技术人员利用已知的技术而实施。作为构成多特异性的方法,开发出了多种方法,所述方法分类为以使不同的2种抗体重链分子形成异源二聚体的方式实施了蛋白工程操作的非对称igg的构建技术;连接由抗体得到的抗原结合片段彼此或者与其它抗体分子连接的技术;等。具体的构建法的例子例如可以参考以下的文献。kontermann,r.e.,&brinkmann,u.(2015).bispecific antibodies.drug discovery today,20(7),838-847.
81.作为本发明的抗hcdcp1抗体及其抗原结合片段,例如可以列举出如下抗体及其抗
原结合片段,其特征在于,互补决定区(cdr:complementarity determining region)1~3的氨基酸序列满足下述的(a)~(s)中的任意者。
82.(a)具有:包含序列号25所示的氨基酸序列的重链cdr1、
83.包含序列号26所示的氨基酸序列的重链cdr2、
84.包含序列号27所示的氨基酸序列的重链cdr3、
85.包含序列号29所示的氨基酸序列的轻链cdr1、
86.包含序列号30所示的氨基酸序列的轻链cdr2、和
87.包含序列号31所示的氨基酸序列的轻链cdr3。
88.(b)具有:包含序列号33所示的氨基酸序列的重链cdr1、
89.包含序列号34所示的氨基酸序列的重链cdr2、
90.包含序列号35所示的氨基酸序列的重链cdr3、
91.包含序列号37所示的氨基酸序列的轻链cdr1、
92.包含序列号38所示的氨基酸序列的轻链cdr2、和
93.包含序列号39所示的氨基酸序列的轻链cdr3。
94.(c)具有:包含序列号41所示的氨基酸序列的重链cdr1、
95.包含序列号42所示的氨基酸序列的重链cdr2、
96.包含序列号43所示的氨基酸序列的重链cdr3、
97.包含序列号45所示的氨基酸序列的轻链cdr1、
98.包含序列号46所示的氨基酸序列的轻链cdr2、和
99.包含序列号47所示的氨基酸序列的轻链cdr3。
100.(d)具有:包含序列号49所示的氨基酸序列的重链cdr1、
101.包含序列号50所示的氨基酸序列的重链cdr2、
102.包含序列号51所示的氨基酸序列的重链cdr3、
103.包含序列号53所示的氨基酸序列的轻链cdr1、
104.包含序列号54所示的氨基酸序列的轻链cdr2、和
105.包含序列号55所示的氨基酸序列的轻链cdr3。
106.(e)具有:包含序列号57所示的氨基酸序列的重链cdr1、
107.包含序列号58所示的氨基酸序列的重链cdr2、
108.包含序列号59所示的氨基酸序列的重链cdr3、
109.包含序列号61所示的氨基酸序列的轻链cdr1、
110.包含序列号62所示的氨基酸序列的轻链cdr2、和
111.包含序列号63所示的氨基酸序列的轻链cdr3。
112.(f)具有:包含序列号65所示的氨基酸序列的重链cdr1、
113.包含序列号66所示的氨基酸序列的重链cdr2、
114.包含序列号67所示的氨基酸序列的重链cdr3、
115.包含序列号69所示的氨基酸序列的轻链cdr1、
116.包含序列号70所示的氨基酸序列的轻链cdr2、
117.包含序列号71所示的氨基酸序列的轻链cdr3。
118.(g)具有:包含序列号73所示的氨基酸序列的重链cdr1、
119.包含序列号74所示的氨基酸序列的重链cdr2、
120.包含序列号75所示的氨基酸序列的重链cdr3、
121.包含序列号77所示的氨基酸序列的轻链cdr1、
122.包含序列号78所示的氨基酸序列的轻链cdr2、和
123.包含序列号79所示的氨基酸序列的轻链cdr3。
124.(h)具有:包含序列号81所示的氨基酸序列的重链cdr1、
125.包含序列号82所示的氨基酸序列的重链cdr2、
126.包含序列号83所示的氨基酸序列的重链cdr3、
127.包含序列号85所示的氨基酸序列的轻链cdr1、
128.包含序列号86所示的氨基酸序列的轻链cdr2、和
129.包含序列号87所示的氨基酸序列的轻链cdr3。
130.(i)具有:包含序列号89所示的氨基酸序列的重链cdr1、
131.包含序列号90所示的氨基酸序列的重链cdr2、
132.包含序列号91所示的氨基酸序列的重链cdr3、
133.包含序列号93所示的氨基酸序列的轻链cdr1、
134.包含序列号94所示的氨基酸序列的轻链cdr2、和
135.包含序列号95所示的氨基酸序列的轻链cdr3。
136.(j)具有:包含序列号97所示的氨基酸序列的重链cdr1、
137.包含序列号98所示的氨基酸序列的重链cdr2、
138.包含序列号99所示的氨基酸序列的重链cdr3、
139.包含序列号101所示的氨基酸序列的轻链cdr1、
140.包含序列号102所示的氨基酸序列的轻链cdr2、
141.包含序列号103所示的氨基酸序列的轻链cdr3。
142.(k)具有:包含序列号105所示的氨基酸序列的重链cdr1、
143.包含序列号106所示的氨基酸序列的重链cdr2、
144.包含序列号107所示的氨基酸序列的重链cdr3、
145.包含序列号109所示的氨基酸序列的轻链cdr1、
146.包含序列号110所示的氨基酸序列的轻链cdr2、和
147.包含序列号111所示的氨基酸序列的轻链cdr3。
148.(l)具有:包含序列号49所示的氨基酸序列的重链cdr1、
149.包含序列号50所示的氨基酸序列的重链cdr2、
150.包含序列号51所示的氨基酸序列的重链cdr3、
151.包含序列号53所示的氨基酸序列的轻链cdr1、
152.包含序列号54所示的氨基酸序列的轻链cdr2、和
153.包含序列号55所示的氨基酸序列的轻链cdr3。
154.(m)满足前述(l)的抗体中,具有kabat定义中的轻链第28位和第29位的氨基酸、和重链第102位的氨基酸被置换为其它氨基酸的轻链可变区。此处,作为其它氨基酸,没有限定,例如,对于轻链第28位,可以列举出丝氨酸、苏氨酸、丙氨酸、甘氨酸、亮氨酸、异亮氨酸、缬氨酸、苯丙氨酸、精氨酸、色氨酸、组氨酸、蛋氨酸、谷氨酰胺、谷氨酸、赖氨酸、酪氨酸,但
优选为丝氨酸。对于轻链第29位,可以列举出丙氨酸、天冬氨酸、谷氨酸、蛋氨酸、精氨酸、亮氨酸、异亮氨酸、缬氨酸、赖氨酸,但优选为丙氨酸。对于重链第102位,可以列举出丙氨酸、谷氨酸、丝氨酸、苏氨酸、甘氨酸、亮氨酸、异亮氨酸、缬氨酸、苯丙氨酸、色氨酸、蛋氨酸、赖氨酸、组氨酸、谷氨酰胺,但优选为丝氨酸。
155.(n)具有:包含序列号65所示的氨基酸序列的重链cdr1、
156.包含序列号66所示的氨基酸序列的重链cdr2、
157.包含序列号67所示的氨基酸序列的重链cdr3、
158.包含序列号69所示的氨基酸序列的轻链cdr1、
159.包含序列号70所示的氨基酸序列的轻链cdr2、和
160.包含序列号71所示的氨基酸序列的轻链cdr3。
161.(o)满足前述(n)的抗体中,具有kabat定义中的重链第54位和第55位的氨基酸被置换为其它氨基酸的重链可变区。此处,作为其它氨基酸,没有限定,例如,对于重链第54位,可以列举出丝氨酸、苏氨酸、丙氨酸、甘氨酸、亮氨酸、异亮氨酸、缬氨酸、苯丙氨酸、精氨酸、色氨酸、组氨酸、蛋氨酸、谷氨酰胺、谷氨酸、赖氨酸、酪氨酸,但优选为丝氨酸、苯丙氨酸、精氨酸、苏氨酸、色氨酸。对于重链第55位,可以列举出丙氨酸、天冬氨酸、谷氨酸、蛋氨酸、精氨酸、亮氨酸、异亮氨酸、缬氨酸、赖氨酸,但优选为丙氨酸、天冬氨酸、谷氨酸、亮氨酸、蛋氨酸。
162.(p)具有:包含序列号73所示的氨基酸序列的重链cdr1、
163.包含序列号74所示的氨基酸序列的重链cdr2、
164.包含序列号75所示的氨基酸序列的重链cdr3、
165.包含序列号77所示的氨基酸序列的轻链cdr1、
166.包含序列号78所示的氨基酸序列的轻链cdr2、和
167.包含序列号79所示的氨基酸序列的轻链cdr3。
168.(q)满足前述(p)的抗体中,具有kabat定义中的重链第54位和第55位的氨基酸、轻链第33位的氨基酸被置换为其它氨基酸的重链和轻链可变区。此处,作为其它氨基酸,没有限定,例如,对于重链第54位,可以列举出丝氨酸、苏氨酸、丙氨酸、甘氨酸、亮氨酸、异亮氨酸、缬氨酸、苯丙氨酸、精氨酸、色氨酸、组氨酸、蛋氨酸、谷氨酰胺、谷氨酸、赖氨酸、酪氨酸,但优选为丝氨酸。对于重链第55位,可以列举出丙氨酸、天冬氨酸、谷氨酸、蛋氨酸、精氨酸、亮氨酸、异亮氨酸、缬氨酸、赖氨酸,但优选为丙氨酸。作为轻链第33位的氨基酸,可以列举出丝氨酸、苏氨酸、丙氨酸、甘氨酸、亮氨酸、异亮氨酸、缬氨酸、苯丙氨酸、精氨酸、色氨酸、天冬酰胺、天冬氨酸、谷氨酰胺、谷氨酸、酪氨酸、赖氨酸、组氨酸,但优选为亮氨酸。
169.(r)具有:包含序列号89所示的氨基酸序列的重链cdr1、
170.包含序列号90所示的氨基酸序列的重链cdr2、
171.包含序列号91所示的氨基酸序列的重链cdr3、
172.包含序列号93所示的氨基酸序列的轻链cdr1、
173.包含序列号94所示的氨基酸序列的轻链cdr2、和
174.包含序列号95所示的氨基酸序列的轻链cdr3。
175.(s)满足前述(r)的抗体中,具有kabat定义中的重链第52a位和第53位、轻链第33位被置换为其它氨基酸的重链和轻链可变区。此处,作为其它氨基酸,没有限定,例如,对于
重链第52a位,可以列举出丝氨酸、苏氨酸、丙氨酸、甘氨酸、亮氨酸、异亮氨酸、缬氨酸、苯丙氨酸、精氨酸、色氨酸、组氨酸、蛋氨酸、谷氨酰胺、谷氨酸、赖氨酸、酪氨酸,但优选为丝氨酸。对于重链第53位,可以列举出丙氨酸、天冬氨酸、谷氨酸、蛋氨酸、精氨酸、亮氨酸、异亮氨酸、缬氨酸、赖氨酸,但优选为丙氨酸。作为轻链第33位的氨基酸,可以列举出丝氨酸、苏氨酸、丙氨酸、甘氨酸、亮氨酸、异亮氨酸、缬氨酸、苯丙氨酸、精氨酸、色氨酸、天冬酰胺、天冬氨酸、谷氨酰胺、谷氨酸、酪氨酸、赖氨酸、组氨酸,但优选为亮氨酸。
176.进而,作为本发明的抗hcdcp1抗体及其抗原结合片段,例如可以列举出如下抗体或其抗原结合片段,其特征在于,重链可变区的cdr1~3的氨基酸序列满足下述(t)~(u)中的任意者,轻链可变区的cdr1~3的氨基酸序列满足下述(t)~(v)中的任意者。
177.(t)具有:包含序列号49所示的氨基酸序列的重链cdr1、
178.包含序列号50所示的氨基酸序列的重链cdr2、和
179.包含序列号113所示的氨基酸序列的重链cdr3;
180.(u)具有:包含序列号183所示的氨基酸序列的重链cdr1、
181.包含序列号50所示的氨基酸序列的重链cdr2、和
182.包含序列号113所示的氨基酸序列的重链cdr3;
183.(t)具有:包含序列号117所示的氨基酸序列的轻链cdr1、
184.包含序列号54所示的氨基酸序列的轻链cdr2、和
185.包含序列号55所示的氨基酸序列的轻链cdr3;
186.(u)具有:包含序列号186所示的氨基酸序列的轻链cdr1、
187.包含序列号54所示的氨基酸序列的轻链cdr2、和
188.包含序列号55所示的氨基酸序列的轻链cdr3。
189.(v)具有:包含序列号188所示的氨基酸序列的轻链cdr1、
190.包含序列号54所示的氨基酸序列的轻链cdr2、和
191.包含序列号55所示的氨基酸序列的轻链cdr3;
192.进而,作为本发明的抗hcdcp1抗体及其抗原结合片段,可以列举出如下抗体、以及它们的抗原结合片段,其特征在于,为具有包含序列号24、序列号32、序列号40、序列号48、序列号56、序列号64、序列号72、序列号80、序列号88、序列号96、序列号104、序列号112、序列号114、序列号124、序列号126、序列号128、序列号130、序列号132、序列号134、序列号136、序列号138、序列号140、序列号142、序列号144、序列号146、序列号150、序列号152、序列号169、序列号170、序列号172、序列号173、序列号177、序列号178、序列号179、序列号182或序列号184所示的氨基酸序列的重链可变区中的任意者及包含序列号28、序列号36、序列号44、序列号52、序列号60、序列号68、序列号76、序列号84、序列号92、序列号100、序列号108、序列号116、序列号118、序列号120、序列号122、序列号148、序列号154、序列号155、序列号171、序列号174、序列号175、序列号176、序列号180、序列号181、序列号185或序列号187所示的氨基酸序列的轻链可变区中的任意者的抗体、;以及由与它们的构成抗体的重链可变区和/或轻链可变区的各氨基酸序列具有约70%以上、优选具有约80%以上、约81%以上、约82%以上、约83%以上、约84%以上、约85%以上、约86%以上、约87%以上、约88%以上、约89%以上、更优选为约90%以上、约91%以上、约92%以上、约93%以上、约94%以上、约95%以上、约96%以上、约97%以上、约98%以上、最优选为约99%以上的氨基酸序列同
一性的氨基酸序列构成的抗体,该抗体与人cdcp1结合、且与人cd34阳性细胞的结合性低。
193.本发明的第2实施方式为抗体(以下也记为“本发明的竞争抗体”)或其抗原结合片段,所述抗体的特征在于与人cdcp1结合且与人cd34阳性细胞的结合性低,所述抗体竞争性抑制第1实施方式的抗体(即,本发明的抗hcdcp1抗体)与人cdcp1的结合。本发明的竞争抗体可以利用本领域技术人员公知的竞争实验等来制备和获得。具体而言,第1抗hcdcp1抗体(实施方式的抗体)与人cdcp1的结合在受到第2抗hcdcp1抗体竞争性抑制时,判断为第1抗hcdcp1抗体和第2抗hcdcp1抗体与实质上相同或极其接近的抗原位点结合。此外,该第2抗hcdcp1抗体与cd34阳性细胞的结合性低时,该第2抗hcdcp1抗体为本发明的竞争抗体。作为这样的竞争实验的方法,例如在本技术领域中通常进行使用fab片段等的方法。例如参照wo95/11317、wo94/07922、wo2003/064473、wo2008/118356和wo2004/046733等。
194.本发明的第3实施方式为结合有具有抗肿瘤活性的物质的第1实施方式的抗体或第2实施方式的抗体或其抗原结合片段。
195.可以通过使药物等具有抗肿瘤活性的物质与抗体结合来进行癌症的靶向治疗(以下将这样的复合体记为“本发明的抗体药物等复合体”)。这种情况下的具有抗肿瘤活性的物质包括抗癌剂等细胞毒性的药物、放射性同位素、操作免疫系统而间接诱导抗肿瘤活性的物质等,但不限定于此。
196.第3实施方式中可以使用显示出抗肿瘤活性的药物,将这样的复合体称为抗体药物复合体。作为所使用的显示出抗肿瘤活性的药物,已知有例如澳瑞他汀(auristatin)类(mmae,mmaf等)、美登素(maytansine)类(dm1、dm4等)、tubulysin类、念珠藻素(cryptophycin)类、根瘤菌素(rhizoxin)等微管蛋白抑制剂和微管聚合抑制剂、卡奇霉素(calicheamicin)类、阿霉素、蒽环类抗生素等抗生素类、倍癌霉素(duocarmycin)类、pbd(苯并二氮杂卓)类、igns(indolinobenzodiazepine,吲哚苯并二氮杂卓)等dna合成抑制剂、喜树碱(canptothecin类似物)(sn-38,dxd等)之类拓扑异构酶i抑制剂、鹅膏蕈碱(amanitin)类等rna聚合酶ii抑制剂、spliceostatin类、泰兰斯他汀(thailanstatin)类等rna剪接体抑制剂等,但不限定于这些。
197.另外,作为显示出抗肿瘤活性的药物,也可以使用被光能激发而表现出毒性的化合物。这样的抗体药物复合体能够用于被称为光免疫疗法(photoimmunotherapy:pit)的治疗法,所述治疗法在体内给药而与肿瘤细胞结合后,从体外施加近红外线等光能而杀死肿瘤细胞。本发明的抗hcdcp1抗体也可以用作光免疫疗法中使用的抗体。作为使用的化合物,已知ir700等,但不限定于此。
198.另外,已知使放射性同位素与抗体结合、利用该同位素所发出的放射线来杀死癌细胞的放射线免疫疗法(radioimmunotherapy:rit),本发明的抗hcdcp1抗体也可以用作放射线免疫疗法中使用的抗体。作为本发明的第3实施方式中使用的放射性同位素,已知有例如
131
i、
90
y等β射线核素、
213
bi、
211
at、
225
ac、
223
ra、
212
pb等α射线核素,但不限定于这些。
199.另外,本发明的第3实施方式中,可以使用通过操作肿瘤本身或免疫系统等除肿瘤以外的组织的生理作用而直接/间接发挥抗肿瘤活性的物质。若以免疫系统为例,则作为操作的免疫系统的要素,可以考虑出t细胞、b细胞、nk细胞等淋巴系统细胞、单核细胞、巨噬细胞、树突细胞、粒细胞等髓系细胞、或者分泌/呈递对这些免疫系统细胞产生影响的物质的除免疫系统细胞以外的细胞等。作为操作这些细胞的物质,可以列举出癌疫苗肽、细胞因子
(白细胞介素类、干扰素类、集落刺激因子(csf)类等)、激素类、生长因子类(tgf家族、fgf家族、igf家族、血小板生成素、促红细胞生成素等)等,但不限定于这些。
200.使抗肿瘤性物质与抗体结合的化学修饰的方法迄今为止已知多种,例如已知以下那样的方法。与赖氨酸残基侧链的共价结合、与半胱氨酸残基侧链的共价结合等化学修饰方法;在抗体肽链中导入非天然氨基酸,对该侧链实施位点特异性化学修饰的方法;对抗体中的特定的氨基酸序列、修饰糖链利用特异性酶反应实施修饰的方法;和使用了进行肽连接的酶的修饰方法等。另外,为了使药物等与蛋白质结合,通常对药物等实施化学改造,作为用于蛋白质结合的接头使用。这样的化学接头已知有很多种类,根据其性质,抗体药物等复合体在体内的药理作用发生较大变化。例如,腙接头、缬氨酸-瓜氨酸接头、ss键接头、焦磷酸接头等被体内的酶等切割,药物自抗体分离出,能够制备显示出高抗肿瘤效果的抗体药物复合体。另一方面,作为这样的化学接头,通常也使用在体内不发生切割的化学结构。涉及以上的方法的概要例如记载于以下的文献中。tsuchikama和an,(2018).antibody-drug conjugates:recent advances in conjugation and linker chemistries.protein and cell,9(1),33-46。
201.药物-抗体结合比率(drug antibody ratio:dar)是表示抗体药物复合体中在一个抗体分子上结合有几个药物分子的数值。dar根据使药物与抗体化学结合的方法而改变,通常为1至8,根据化学结合的方式也可以制作具有9以上的dar的抗体药物复合体。
202.本发明的第4实施方式为用于预防或治疗癌症的药物组合物(以下也记为“本发明的药物组合物”),其包含第3实施方式的本发明的抗体药物等复合体或其抗原结合片段。
203.本发明的药物组合物可以以除作为有效成分的本发明的抗体药物等复合体或其抗原结合片段之外还包含1种或2种以上的制剂用添加物的药物组合物的形态给药。另外,该实施方式的药物组合物中也可以同时配混公知的其它药剂。
204.使用本发明的抗体药物等复合体或其抗原结合片段,制造能向人给药的治疗用抗体时,已知在其制造过程中在抗体纯化后经常会发生化学修饰。在应对这种化学修饰时,在本技术领域中意识到纯化抗体的品质确保和安全性的确保是重要的。具体而言,在包含抗体的cdr区的序列中存在易受n型糖链修饰、蛋白切割、脱酰胺化、外消旋化、氧化等修饰的氨基酸序列基序时,预想会导致纯化抗体的品质降低。作为易受修饰的氨基酸序列基序,例如已知有天冬酰胺残基、包含天冬氨酸残基的基序(例如,sydow等,(2014).structure-based prediction of asparagine and aspartate degradation sites in antibody variable regions.plos one,9(6)等),显示出在保持抗体活性的同时能够改变它们的氨基酸基序时,抗体的有用性进一步提高。
205.本发明的药物组合物可以为经口或非经口用的剂型,没有特别限定,例如可列举出片剂、胶囊剂、颗粒剂、散剂、糖浆剂、悬浮剂、栓剂、软膏、霜剂、凝胶剂、贴剂、吸入剂或注射剂等。这些制剂可以依据常规方法制备。需要说明的是,液体制剂的情况,可以是在使用时溶解或悬浮于水或其它适合的溶剂中所得者。另外,片剂、颗粒剂也可以利用公知的方法包衣。注射剂的情况,将本发明的抗体或其功能性片段溶解于水中而制备,但根据需要也可以溶解于生理盐水或者葡萄糖溶液中,另外,也可以添加缓冲剂、保存剂。
206.对于本发明的药物组合物的制造中使用的制剂用添加物的种类、相对于有效成分的制剂用添加物的比例、或药物组合物的制造方法,本领域技术人员可以根据其形态进行
适宜选择。作为制剂用添加物,可以使用无机或有机物质、或者固体或液体的物质,通常,相对于有效成分重量,例如可以在0.1重量%~99.9重量%、1重量%~95.0重量%、或1重量%~90.0重量%之间配混。具体而言,作为制剂用添加物的例子,可列举出乳糖、葡萄糖、甘露醇、糊精、环糊精、淀粉、蔗糖、偏硅酸铝酸镁、合成硅酸铝、羧甲基纤维素钠、羟丙基淀粉、羧甲基纤维素钙、离子交换树脂、甲基纤维素、明胶、阿拉伯胶、羟丙基纤维素、羟丙基甲基纤维素、聚乙烯基吡咯烷酮、聚乙烯醇、轻质无水硅酸、硬脂酸镁、滑石、黄蓍胶、膨润土、begum、氧化钛、失水山梨醇脂肪酸酯、月桂醇硫酸钠、甘油、脂肪酸甘油酯、精制羊毛脂、甘油明胶、聚山梨醇酯、聚乙二醇、植物油、蜡、液体石蜡、白色凡士林、氟碳化合物、非离子性表面活性剂、丙二醇或水等。
207.为了制造经口给药用的固形制剂,将有效成分与赋形剂成分、例如乳糖、澱粉、结晶纤维素、乳酸钙或无水硅酸等混合制成散剂,或者进一步根据需要加入白糖、羟丙基纤维素或聚乙烯基吡咯烷酮等结合剂、羧甲基纤维素或羧甲基纤维素钙等崩解剂等进行湿式或干式造粒而制成颗粒剂。为了制造片剂,将它们的散剂和颗粒剂直接压片或加入硬脂酸镁或滑石等润滑剂压片即可。它们的颗粒或片剂也可以用羟丙基甲基纤维素邻苯二甲酸酯、甲基丙烯酸-甲基丙烯酸甲酯聚合物等肠溶剂基剂覆盖而制成肠溶剂制剂、或者用乙基纤维素、巴西棕榈蜡或固化油等覆盖而制成持续性制剂。另外,为了制造胶囊剂,可以将散剂或颗粒剂填充于硬胶囊中,或将有效成分直接制成软胶囊,或溶解于甘油、聚乙二醇、芝麻油或橄榄油等中溶解后用明胶覆盖而制成软胶囊。
208.为了制造注射剂,将有效成分与根据需要的盐酸、氢氧化钠、乳糖、乳酸钠、磷酸一氢钠或磷酸二氢钠等ph调节剂、氯化钠或葡萄糖等等渗剂一起溶解于注射用蒸馏水中进行无菌过滤并填充至安瓿中,或者,进而加入甘露糖醇、糊精、环糊精或明胶等进行真空冷冻干燥,制成使用时溶解型的注射剂。另外,也可以在有效成分中加入卵磷脂、聚山梨醇酯80或聚氧乙烯氢化蓖麻油等在水中使其乳化,制成注射剂用乳剂。
209.为了制造直肠给药剂,将有效成分与可可脂、脂肪酸甘油三酯、脂肪酸甘油二酯和脂肪酸甘油单酯或聚乙二醇等栓剂用基材一起加湿并溶解,流入模具中进行冷却,或者也可以将有效成分溶解于聚乙二醇或大豆油等中后,用明胶膜等覆盖。
210.本发明的药物组合物的给药量和给药次数没有特别限定,可以根据治疗对象疾病的恶化/进展的防止和/或治疗的目的、疾病的种类、患者的体重、年龄等条件、依据医生或药剂师的判断进行适宜选择。
211.通常,经口给药时成人每天的给药量为0.01~1000mg(有效成分重量)左右,可以1天1次或分多次、或每隔数日进行给药。用作注射剂时,对成人而言,期望的是以1天量0.001~100mg(有效成分重量)连续给药或间歇给药。
212.作为本发明的药物组合物的其它形态,可以列举出在细胞表面上表达本发明的抗体或其抗原结合片段的t细胞等细胞毒性细胞。嵌合抗原受体表达t细胞(car-t)疗法是使t细胞表达抗体的抗原结合位点和t细胞受体的一部分的融合基因(嵌合抗原受体基因)后移植到癌患者的体内,所移入的t细胞特异性攻击癌细胞而得到抗肿瘤活性的治疗法。将编码本发明的抗体或其抗原结合片段的基因用作上述嵌合抗原受体基因的构成要素,构建表达t细胞,由此能够构建特异性攻击表达人cdcp1分子的肿瘤的car-t疗法。
213.本发明的药物组合物能够攻击、杀死在细胞表面表达hcdcp1的癌细胞。因此,成为
本发明的药物组合物的治疗对象的癌可以是所有的癌症,没有特别限定。若示例出典型的癌症,例如可以列举出肝细胞癌、胆管细胞癌、肾细胞癌、鳞状细胞癌、基底细胞癌、移行细胞癌、腺癌、恶性胃泌素瘤、黑色素瘤、纤维肉瘤、粘液肉瘤、脂肪肉瘤、平滑肌肉瘤、横纹肌肉瘤、畸胎瘤、血管肉瘤、卡波西肉瘤、骨肉瘤、软骨肉瘤、淋巴管肉瘤、恶性脑膜瘤、非霍奇金淋巴瘤、霍奇金淋巴瘤、白血病和脑肿瘤等恶性肿瘤、上皮细胞来源新生物(上皮癌)、基底细胞癌、腺癌、口唇癌、口腔癌、食道癌、小肠癌及胃癌那样的消化道癌、结肠癌、直肠癌、膀胱癌、胰腺癌、卵巢癌、宫颈癌、肺癌、乳腺癌、皮肤癌、前列腺癌等恶性新生物、及侵袭全身的上皮系细胞、间充质细胞或血液细胞的其它已知的癌症等。
214.本发明的第5实施方式为癌症的预防和/或治疗方法(以下也记为“本发明的预防或治疗方法”),其包括将本发明的药物组合物向患者给药。
215.此处“治疗”是指:在已经患有癌症的患者中,阻止或缓和其病状的进展和恶化,是目的在于由此阻止或缓和癌症的进展和恶化的处置。
216.另外,“预防”是指:对于可能患上需要治疗的癌症的患者预先阻止其发病,是目的在于由此预先阻止癌症发病的处置。进而,用于阻止癌症治疗后的复发的处置也包括在“预防”中。
217.另外,治疗和预防的对象不限定于人,可以为人以外的哺乳动物,例如小鼠、大鼠、犬、猫及牛、马、绵羊等家畜、猴子、黑猩猩、大猩猩等灵长类等,特别优选为人。
218.另外,本发明的其它实施方式中,可列举出使用了本发明的抗体的癌症的诊断方法。本发明的抗体能够与人cdcp1分子特异性结合,通过用荧光物质、放射性同位素、酶等标记本发明的抗体,从而能够检测出表达人cdcp1分子的肿瘤和癌细胞、血液中存在的人cdcp1分子或其片段等。作为检测的方法,例如可列举出免疫染色法、流式细胞术法、免疫印迹法、elisa法、ria法、clia法、pet法等。可以直接检测体内的癌细胞、或观察患者待检体中的人cdcp1的表达量,由此能够评价是否存在原发性肿瘤、是否存在转移性肿瘤等。进而,通过利用使用了本发明的抗体的方法预先对癌症病例中的人cdcp1的表达量进行诊断,从而能够预测通过使用了本发明的抗体的药物组合物的给药带来的治疗效果。
219.成为诊断对象的癌症可以是所有的癌症,没有特别限定。若示例出典型的癌症,例如可以列举出肝细胞癌、胆管细胞癌、肾细胞癌、鳞状细胞癌、基底细胞癌、移行细胞癌、腺癌、恶性胃泌素瘤、黑色素瘤、纤维肉瘤、粘液肉瘤、脂肪肉瘤、平滑肌肉瘤、横纹肌肉瘤、畸胎瘤、血管肉瘤、卡波西肉瘤、骨肉瘤、软骨肉瘤、淋巴管肉瘤、恶性脑膜瘤、非霍奇金淋巴瘤、霍奇金淋巴瘤、白血病和脑肿瘤等恶性肿瘤、上皮细胞来源新生物(上皮癌)、基底细胞癌、腺癌、口唇癌、口腔癌、食道癌、小肠癌及胃癌那样的消化道癌、结肠癌、直肠癌、膀胱癌、胰腺癌、卵巢癌、宫颈癌、肺癌、乳腺癌、皮肤癌、前列腺癌等恶性新生物、及侵袭全身的上皮系细胞、间充质细胞或血液细胞的其它已知的癌症等。
220.本说明书中引用的所有文献的公开内容通过参照整体引入说明书中。另外,在整个本说明书中,包括单数形式的“a”、“an”和“the”的术语时,除非上下文另有明确规定,否则不仅包括单数还包括复数。
221.以下示出实施例对本发明进一步说明,实施例仅仅是本发明的实施方式的示例,不用于限定本发明的范围。
222.实施例
223.1.重组hcdcp1胞外域蛋白的表达和纯化
224.hcdcp1蛋白的氨基酸序列已作为uniprot注册编号q9h5v8的亚型1被注册(序列号1)。对于该序列的第30位至第666位的氨基酸,设计出在n端侧连接campath分泌信号、在c末侧插入6
×
his标签和flag标签的序列(序列号2)。基于哺乳类的密码子表将该氨基酸序列转化为碱基序列,通过基因合成而合成了在5’末端插入kozak翻译起始序列、在3’侧插入翻译终止密码子的dna序列(序列号3)(genewiz公司)。将合成的dna插入pef1/v5-his a(thermo fisher scientific k.k.)的限制酶kpni识别序列与pmei识别序列之间。以下使用根据以上制作的表达载体。
225.使用聚乙烯亚胺法将表达载体质粒瞬时性转染至freestyle293细胞(thermo fisher scientific k.k.)后,在37℃、5%co2恒温箱中培养5天。回收培养上清液,用0.22μm过滤器过滤后,与histrap excel柱(ge healthcare公司)结合。接着,在20mm磷酸缓冲液/300mm nacl/ph 7.5缓冲液中通过20mm至500mm咪唑的浓度梯度进行洗脱。每次分取1ml洗脱级分,回收利用sds-page法观察到约100kda的条带的级分。
226.在该洗脱级分中添加9倍量的20mm tris-hcl ph8.0,与hitrap q(ge healthcare公司)柱结合。在20mm tris-hcl ph8.0缓冲液中通过0m至1m的nacl浓度梯度进行洗脱。每次分取2.5ml洗脱级分,回收利用sds-page法观察到条带的级分。
227.进而,将该离子交换柱的洗脱级分浓缩至约1.7ml,将d-pbs(nacalai tesque)作为流动相,使用superdex 200pg 16/60(ge healthcare)进行分级。将使用了该凝胶渗透色谱的纯化实验中的洗脱曲线示于图1。每次分取1.0ml洗脱级分,回收利用sds-page法观察到条带的级分。将回收的蛋白质用作纯化重组hcdcp1胞外域蛋白(以下称为hcdcp1-ecd蛋白)。
228.2.全长ecd蛋白的纤溶酶处理和纯化
229.相对于hcdcp1-ecd蛋白,添加25分之1量的人血浆来源纤溶酶蛋白(sigma-aldrich公司),在4℃下反应18小时。利用sds-page法,确认hcdcp1-ecd蛋白通过该纤溶酶处理几乎被完全切割。通过complete his-tag purification resin(sigma-aldrich公司)和抗flag m2抗体亲和凝胶(sigma-aldrich公司)对该蛋白样品进行纯化,在还原条件和非还原条件下利用sds-page观察该样品的结果为图2。认为洗脱下来的蛋白中包含分子量不同的两种分子。这两种分子可认为是切割hcdcp1-ecd所产生的两种肽片段,认为这两种片段在被切割后也以某种方式保持结合状态的同时被纯化。
230.3.全长hcdcp1稳定表达ba/f3细胞的构建
231.相对于uniprot编号q9h5v8亚型1的第30位至第836位的氨基酸,设计出在n端侧连接了campath分泌信号和c-myc标签的序列(序列号4)。基于哺乳类的密码子表,将该氨基酸序列转换为碱基序列,通过基因合成而合成了包含该序列且在5’末端插入kozak序列和在3’末端插入了翻译终止密码子的dna(genewiz公司;序列号5)。将合成的dna插入pef1/v5-his a(thermo fisher scientific k.k.)的kpni/pmei识别序列之间,作为表达载体gs01。
232.通过限制酶pmei使质粒gs01线性化,通过nucleofector 2b(lonza公司)将2μg导入2
×
106个小鼠b细胞来源细胞株ba/f3细胞中。基因导入后,将细胞接种在96孔板中并添加最终浓度1μg/ml的g418(nacalai tesque公司)。6天后,从孔中回收观察到g418抗性生长的24个集落,使用抗hcdcp1抗体(r&dsystems公司;目录编号mab26662)利用流式细胞仪确
认hcdcp1的表达,进行已确认的集落来源的细胞的极限稀释。回收增殖的细胞,使用抗hcdcp1抗体(r&d systems公司)利用流式细胞仪确认hcdcp1的表达,最终选择单克隆来源的细胞株。图3示出使用相同的抗hcdcp1抗体、抗myc标签抗体(和光纯药公司)和pe标记抗小鼠igg二次抗体对该细胞进行染色的结果。在任意克隆中,确认了抗hcdcp1抗体、抗myc标签抗体呈阳性,确认了在细胞表面上表达了经基因导入的在n末端添加了myc标签的hcdcp1基因的产物。将该细胞作为ba/f3-hcdcp1细胞株用于以下的实验。
233.4.ba/f3-hcdcp1的基于胰蛋白酶处理的δn型分子的生成
234.使用在前项目中制作的hcdcp1表达ba/f3细胞株(以下记作ba/f3-hcdcp1)、和作为阴性对象的ba/f3本来株。用不含血清的冷rpmi1640培养基(sigma-aldrich公司)将细胞清洗2次,以1.25
×
107个细胞/ml的浓度悬浮于rpmi1640培养基中。在细胞悬浮液800μl中添加200μl的0.25%胰蛋白酶/edta(nacalai tesque公司)、或作为阴性对照的包含1mm edta的hank’s平衡盐液(以下记作hbss),在37℃下进行0分钟、5分钟、15分钟、30分钟处理。反应后添加9ml的包含10%的灭活胎牛血清(以下记作fbs)的rpmi1640培养基使反应停止。用包含1%bsa的pbs(以下称为流式细胞术缓冲液、fcm缓冲液)将该细胞清洗后,使用抗myc标签抗体(和光纯药公司)和抗hcdcp1抗体(r&d systems公司)将这些细胞染色。清洗细胞后,使用pe标记抗小鼠igg抗体(becton dickinson公司)进行染色。将细胞清洗后通过facscantoii(becton dickinson公司)进行观察。
235.图4的a是根据通过流式细胞仪测定的pe的荧光强度而将细胞群的平均荧光强度的变化图示而成的图。抗myc标签抗体的染色强度仅在添加了胰蛋白酶/edta时经时减少,由该结果示出ba/f3-hcdcp1上的hcdcp1分子的n末端被胰蛋白酶消化。另一方面,基于抗hcdcp1抗体的染色强度没有变化,示出即使通过胰蛋白酶处理也没有减少在本实验中使用的抗hcdcp1抗体所识别的hcdcp1分子的数量。
236.接着,利用免疫印迹法观察通过胰蛋白酶处理所产生的截短型hcdcp1分子的分子量。相对于ba/f3-hcdcp1细胞4
×
106个,利用用rpmi1640培养基稀释5倍的0.25%胰蛋白酶/edta、或包含50nm、500nm纤溶酶(sigma-aldrich公司)的pbs在37℃下进行5分钟、10分钟、或30分钟处理。回收这些细胞,用hbss清洗后,用包含1%tritonx和蛋白酶抑制剂混合物(thermo fisher scientific公司)的tris缓冲生理盐水溶解,利用micro bca试剂盒(thermo fisher scientific公司)进行蛋白定量,将20μg通过sds-page进行电泳。另外,同时,已知表达截短型hcdcp1的人前列腺癌来源细胞株pc3(atcc)也在粘附培养的状态下进行细胞溶解、或与ba/f3同样地用稀释胰蛋白酶/edta溶液处理后进行细胞溶解,一并进行sds-page。将蛋白由电泳后的凝胶转印至pvdf膜,作为检测用一次抗体,使用抗hcdcp1细胞内结构域抗体(abcam公司),作为二次抗体,使用碱性磷酸酶标记抗山羊igg抗体(promega corporation),作为检测用试剂,使用nbt/bcip stock solution(roche公司)进行免疫印迹法。
237.将免疫印迹法的结果示于图4的b。未经胰蛋白酶处理的ba/f3-hcdcp1细胞中在130kda附近观察到几乎单一条带,而经胰蛋白酶处理的细胞中在70kda附近观察到单一条带,由于该条带尺寸认为与由pc3细胞的溶解样品检测出的条带处于相同位置,由此启示出ba/f3的通过胰蛋白酶处理生成的分子种类与pc3表达的截短型hcdcp1相同。即使通过500nm纤溶酶处理,也以相同迁移度检测出切割蛋白的条带。
238.由此,启示出:ba/f3-cdcp1表达的hcdcp1因胰蛋白酶、纤溶酶的处理而被切割,在细胞上残留截短型hcdcp1分子。使用该方法,之后进行了与截短型hcdcp1分子反应的抗体的筛选。
239.5.使用hcdcp1敲除细胞株进行了杂交瘤的筛选
240.使用在前项目中制作的蛋白质和细胞制作杂交瘤,筛选产生示出hcdcp1特异性反应的抗体的杂交瘤。
241.为了用作筛选与癌细胞中表达的hcdcp1反应的克隆的阴性对照,制作敲除了hcdcp1分子的pc3细胞。人前列腺癌细胞株pc3使用从atcc购入者。利用nucleofector 2b(lonza)将cdcp1 crispr/cas9 ko plasmid(h)(santacruz公司)对于pc3细胞1
×
106个进行基因导入。该质粒中包含gfp基因序列。1天后,使用facsariaii(becton dickinson公司),在96孔培养板中对gfp的荧光呈阳性的细胞进行单细胞分选。对7~10天后观察到细胞增殖的克隆,使用抗hcdcp1抗体(r&d systems公司)通过流式细胞仪进行表达确认,扩增未表达hcdcp1的细胞克隆,将其作为hcdcp1-ko pc3细胞用于以下的实验。
242.使用hcdcp1纯化蛋白或者分离自用强制表达细胞免疫的小鼠的淋巴结细胞进行针对hcdcp1的单克隆抗体的制作。
243.实验1中,将hcdcp1-ecd蛋白与titermaxgold(titermax公司)混合进行足底静脉给药,每只小鼠50μg。在7天后和10天后,通过将每只小鼠10μg的抗原与titermaxgold混合来进行足底静脉给药,由此进行追加免疫。
244.实验2中,作为免疫物质,使用ba/f3-hcdcp1细胞。利用前述方法对该细胞进行胰蛋白酶处理后,使每只小鼠1
×
107个细胞与titermaxgold(titermax公司)混合进行足底静脉给药。在7天后和10天后,将每只小鼠1
×
105个经胰蛋白酶处理的ba/f3-hcdcp1细胞悬浮于pbs中后进行腹腔内给药,由此进行追加免疫。
245.实验3中,依据前项目中的方法利用纤溶酶对hcdcp1-ecd蛋白进行切割处理后,使用his-tag、flag-tag亲和树脂进行纯化,将所得物以每只小鼠50μg与titermaxgold混合进行足底静脉给药。在7天后和10天后,将每只小鼠10μg的抗原与titermaxgold混合进行足底静脉给药,由此进行追加免疫。
246.对于实验1、实验2、实验3,分别从免疫结束后的小鼠采集腘窝淋巴结制备细胞悬浮液后,在不含血清的rpmi1640(atcc modified;thermo fisher scientific公司)中与sp2/0-ag14骨髓瘤细胞混合,通过聚乙二醇(roche公司)进行细胞融合。将融合后的细胞悬浮于包含杂交瘤增强培养基(sigma-aldrich公司)的clonacell tm-hy medium d(stemcell公司)中并接种在塑料培养皿中。将8~10天后所形成的集落分离到分注了培养基(rpmi1640/10%fbs/hat supplement(thermo fisher scientific公司)/杂交瘤增强培养基(sigma-aldrich公司))的96孔塑料板中,进行扩大培养,将培养上清液用于结合性评价。
247.使用pc3细胞和hcdcp1-ko pc3细胞,利用细胞elisa法进行杂交瘤所产生的抗体的hcdcp1结合性筛选。在384孔板中以5000个细胞/孔接种pc3细胞和hcdcp1-ko pc3细胞,在37℃下培养整夜。去除培养基后,每孔添加25μl用杂交瘤的培养上清液或者培养基稀释的抗体液,在4℃下反应1小时。去除培养上清液并进行基于pbs的清洗后,用培养基稀释二次抗体并添加,在4℃下反应1小时。进而用pbs清洗3次,在完全去除清洗液后,使基质液(elisa pod substrate tmb kit、nacalai tesque公司)反应,10分钟后用1n硫酸停止,测
定450nm的吸光度。
248.图5的a、图5的b、图5的c、图5的d示出使用了由实验1、实验2、实验3的各免疫动物制作的杂交瘤的培养上清液的cell elisa的结果。图的数值表示由各克隆的测定值减去使不含抗体的杂交瘤培养基反应后的值而得到的数值。由该结果示出:由使用hcdcp1纯化蛋白质或者强制表达细胞的免疫小鼠可以得到产生与作为表达hcdcp1的癌细胞的pc3细胞反应的抗体的杂交瘤。另外,图5的a、图5的b、图5的c的结果示出:这些图所示的杂交瘤所产生的抗体不与hcdcp1-ko pc3细胞反应,确凿示出这些抗体与pc3所表达的hcdcp1特异性反应。
249.6.抗体序列解析
250.对于前项目中所述的产生与pc3细胞所表达的hcdcp1特异性反应的抗体的杂交瘤,如下所述实施了其免疫球蛋白基因可变区的序列的解析。
251.扩大培养杂交瘤细胞,使用superprep ii cell lysis&rt kit(东洋纺公司)进行rna提取和基于逆转录酶的cdna合成。通过合成的cdna,利用pcr法扩增抗体基因。使用在重链、轻链中均识别可变区上游和恒定区下游的引物进行扩增。所使用的引物序列如下所述。
252.重链5’扩增用:5’msvhe(序列号6)
253.重链3’扩增用:3’cg1_outer(序列号7)、3’cg2c_outer(序列号8)、3’cg2b_outer(序列号9)、3’cg3_outer(序列号10)、3’migg2a_ch(序列号11)
254.κ轻链5’扩增用:5’l-vk_3(序列号12)、5’l-vk_4(序列号13)、5’l-vk_5(序列号14)、5’l-vk_6(序列号15)、5’l-vk_689(序列号16)、5’l-vk_14(序列号17)、5’l-vk_19(序列号18)、5’l-vk_20(序列号19)
255.κ轻链3’扩增用:3’mck(序列号20)
256.λ轻链5’扩增用:5’mvλ1/2(序列号21)、5’mvλx(序列号22)
257.λ轻链3’扩增用:3’mcλ_outer(序列号23)
258.通过topo ta cloning kit(thermo fisher scientific k.k.)将得到的dna片段克隆至pcdna3.4载体,进行dna序列解析。
259.对于作为结果而得到的抗体序列,依据kabat等人的方法(sequences of proteins of immunological interests,fifth edition,nih publication no.91-3242,u.s.department of health and human services,1991),确定了cdr区。所解析的克隆的抗体序列及其cdr区序列汇总于以下的表1。
260.[表1]
[0261] vhcdrh1cdrh2cdrh3vlcdrl1cdrl2cdrl301a2c5序列号24序列号25序列号26序列号27序列号28序列号29序列号30序列号3112a033序列号32序列号33序列号34序列号35序列号36序列号37序列号38序列号3912a038序列号40序列号41序列号42序列号43序列号44序列号45序列号46序列号4712a041序列号48序列号49序列号50序列号51序列号52序列号53序列号54序列号5514a014序列号56序列号57序列号58序列号59序列号60序列号61序列号62序列号6314a025序列号64序列号65序列号66序列号67序列号68序列号69序列号70序列号7114a043序列号72序列号73序列号74序列号75序列号76序列号77序列号78序列号7914a055序列号80序列号81序列号82序列号83序列号84序列号85序列号86序列号8714a063序列号88序列号89序列号90序列号91序列号92序列号93序列号94序列号9514a091序列号96序列号97序列号98序列号99序列号100序列号101序列号102序列号103
14c013序列号104序列号105序列号106序列号107序列号108序列号109序列号110序列号111
[0262]
7.小鼠/人嵌合抗体的制作
[0263]
基于前项目中得到的抗体序列,制作小鼠重链/轻链可变区和人igg1重链/κ轻链恒定区的嵌合抗体(以下记作小鼠/人嵌合抗体)。对于在前项目中进行了序列解析的抗体中的12a041、14a025、14a043、14a055、14a063、14a091这6个制作了小鼠/人嵌合抗体,。
[0264]
对于12a041、14a025、14a043、14a063各自的抗体序列,制作与前项目中解析的氨基酸序列相同的序列,同时尝试了cdr区的氨基酸改变。序列改变的导入位置和改变后的氨基酸、及与改变后抗体序列的名称的对应关系如图6a和图6b所示,对认为存在于cdr区的未形成ss键的半胱氨酸、蛋白质在溶剂中容易遭受切断反应/氧化反应的可能性高的序列加以实施。
[0265]
另外认为,对于mh12a041hcori,通过使kabat编号第32位的丝氨酸残基突变为苯丙氨酸残基,另外对于mh12a041lcori,通过将kabat编号第27d位的组氨酸残基突变为酪氨酸残基、或分别将第27a位的丝氨酸残基和第28位的天冬酰胺残基同时突变为天冬酰胺残基和天冬氨酸残基,从而与抗原的亲和性改善,因此设计出了包含这些突变的序列(mh12a041hcoria、mh12a041lcoria、mh12a041lcorib)。
[0266]
以下的表2示出实施了cdr的序列改变的抗体序列、及其原有的序列。
[0267]
[表2]
[0268] 可变区序列cdr1cdr2cdr3mh12a041hcori序列号48序列号49序列号50序列号51mh12a041hcv1序列号112序列号49序列号50序列号113mh12a041hcoria序列号114序列号115序列号50序列号51mh12a041lcori序列号52序列号53序列号54序列号55mh12a041lcv1序列号116序列号117序列号54序列号55mh12a041lcv2序列号118序列号119序列号54序列号55mh12a041lcoria序列号120序列号121序列号54序列号55mh12a041lcorib序列号122序列号123序列号54序列号55mh14a025hcori序列号64序列号65序列号66序列号67mh14a025hcv1序列号124序列号65序列号125序列号67mh14a025hcv2序列号126序列号65序列号127序列号67mh14a025hcv5序列号128序列号65序列号129序列号67mh14a025hcv7序列号130序列号65序列号131序列号67mh14a025hcv8序列号132序列号65序列号133序列号67mh14a025hcv15序列号134序列号65序列号135序列号67mh14a025hcv17序列号136序列号65序列号137序列号67mh14a025hcv19序列号138序列号65序列号139序列号67mh14a025hcv21序列号140序列号65序列号141序列号67mh14a025hcv24序列号142序列号65序列号143序列号67mh14a025lcori序列号68序列号69序列号70序列号71mh14a043hcori序列号72序列号73序列号74序列号75
mh14a043hcv1序列号144序列号73序列号145序列号75mh14a043hcv2序列号146序列号73序列号147序列号75mh14a043lcori序列号76序列号77序列号78序列号79mh14a043lcv1序列号148序列号149序列号78序列号79mh14a063hcori序列号88序列号89序列号9o序列号91mh14a063hcv1序列号150序列号89序列号151序列号91mh14a063hcv2序列号152序列号89序列号153序列号91mh14a063lcori序列号154序列号93序列号94序列号95mh14a063lcv1序列号155序列号156序列号94序列号95
[0269]
对于表2中的序列,基于抗体分子的氨基酸序列设计出碱基序列,通过基因合成合成了表达载体。
[0270]
另外,对于14a055重链可变区(序列号80)、14a055轻链可变区(序列号84)、14a091重链可变区(序列号96)、14a091轻链可变区(序列号100),由在前项目中亚克隆到pcdna3.4载体上的序列利用pcr法扩增可变区dna,通过进行亚克隆制作表达载体。
[0271]
就所使用的载体而言,对于mh12a041抗体组和mh14a025抗体组以外的抗体组的重链可变区序列,克隆到pfuse-chig-hg1载体(invivogen公司)上,对于mh12a041抗体组和mh14a025抗体组的重链可变区序列,克隆到pfuse-chiome-hc载体上,对于所有抗体组的轻链可变区序列,克隆到pfuse2-clig-hk载体(invivogen公司)上。将这3个载体所具有的抗体恒定区的氨基酸序列分别示于序列号157、序列号158、序列号159。
[0272]
在expi293细胞(thermo fisher scientific公司)中表达制作的表达载体。此时,对于mh12a041、mh14a025、mh14a043、mh14a063的各抗体组,使重链/轻链的载体按照以下的方式组合表达。
[0273]
mh12a041:
[0274]
hcori/lcori、hcori/lcv1、hcori/lcv2、hcv1/lcori、hcv1/lcv1、hcv1/lcv2、hcori/lcoria、hcori/lcorib、hcoria/lcori、hcoria/lcoria、hcoria/lcorib
[0275]
mh14a025:
[0276]
hcori/lcori、hcv1/lcori、hcv2/lcori、hcv5/lcori、hcv7/lcori、hcv8/lcori、hcv15/lcori、hcv17/lcori、hcv19/lcori、hcv21/lcori、hcv24/lcori
[0277]
mh14a043:
[0278]
hcori/lcori、hcori/lcv1、hcv1/lcori、hcv1/lcv1、hcv2/lcori、hcv2/lcv1
[0279]
mh14a063:
[0280]
hcori/lcori、hcori/lcv1、hcv1/lcori、hcv1/lcv1、hcv2/lcori、hcv2/lcv1
[0281]
利于alphalisa法测定分泌到培养上清液中的抗体蛋白浓度,基于测定值稀释成各浓度,与ba/f3-hcdcp1细胞结合,进而使作为二次抗体的pe标记抗人igg抗体(becton dickinson公司)反应,通过流式细胞仪测定pe的荧光,由此评价了各抗体的反应性。将该结果示于图7。如图所示,评价的所有抗体保持了与hcdcp1的反应性。
[0282]
8.抗体与胰蛋白酶处理hcdcp1强制表达细胞的反应性
[0283]
为了调查得到的抗hcdcp1小鼠/人嵌合抗体是与hcdcp1分子的丝氨酸蛋白酶切割位置的n端侧结合还是与跨膜区域侧结合,利用前项目中说明的方法验证了相对于利用胰
蛋白酶处理切割的hcdcp1强制表达ba/f3细胞的反应性。所评价的抗hcdcp1小鼠/人嵌合抗体克隆如下所述。
[0284]
mh12a041hcori/lcori、mh14a025hcori/lcori、mh14a043hcori/lcori、mh14a055、mh14a063hcori/lcori、mh14a091
[0285]
将ba/f3-hcdcp1细胞在包含0.05%胰蛋白酶的rpmi1640培养基中以37℃处理30分钟,然后用rpmi1640/10%fbs清洗2次。利用与前项目中说明的同样的免疫印迹法证实了:在进行了该处理的ba/f3-cdcp1细胞中hcdcp1的全长型消失而仅留下截短型。对于该细胞,将抗hcdcp1小鼠/人嵌合抗体从5μg/ml至5ng/ml制作稀释系列,在4℃下反应30分钟。作为阴性对象,将以下项目中说明的抗rs病毒抗体作为非特异性人igg制作同样的稀释系列并在4℃下反应30分钟。接着,使用pe标记抗人igg fc抗体(southern biotech公司)作为二次抗体,清洗后,通过facscantoii(becton dickinson公司)观察荧光强度。
[0286]
将其结果示于图8。该结果表明,所评价的6个抗体全部与未进行胰蛋白酶处理时相同程度地跟具有通过胰蛋白酶处理而切割的hcdcp1分子的细胞发生反应,即示出:这些抗体结合到细胞跨膜区域侧而不是hcdcp1分子的丝氨酸蛋白酶切割位点。
[0287]
9.抗体与食蟹猴cdcp1分子的反应性
[0288]
相对于食蟹猴(macaca fascicularis)的cdcp1蛋白(isoform x1;ncbi reference sequence:xp_005546930.1;序列号160)的第30位至第836位的氨基酸,设计出在n端侧连接了campath分泌信号和c-myc标签的序列(序列号161)。基于哺乳类的密码子表,将该氨基酸序列转换为碱基序列,通过基因合成而合成了包含该序列且在5’末端插入kozak翻译起始序列和在3’末端插入了翻译终止密码子的dna(genewiz公司;序列号162)。合成的dna与pef1/v5-his a(thermo fisher scientific公司)的kpni/pmei位点连接,作为表达载体gs02。
[0289]
通过限制酶pmei使质粒gs01(前项目中制作)和gs02线性化,通过nucleofector(lonza公司)将2μg导入2
×
106个cho-k1细胞中。基因导入操作后在400μg/ml潮霉素的存在下培养3天,将之后的细胞剥离/分散后,用抗hcdcp1抗体(r&d systems公司)染色,使用facs ariaii(becton dickinson公司)对阳性的细胞进行单细胞分选。将分离后增殖的细胞克隆进一步用抗hcdcp1抗体(r&d systems公司)进行染色,由此分离了表达hcdcp1、食蟹猴cdcp1的克隆。扩大这些克隆,以下用作hcdcp1表达cho-k1细胞、食蟹猴cdcp1表达cho-k1细胞。
[0290]
通过0.25%胰蛋白酶/edta(nacalai tesque公司)将hcdcp1表达cho-k1细胞、食蟹猴cdcp1表达cho-k1细胞剥离/分散后,以各种浓度使mh12a041hcori/lcori、mh14a025hcori/lcori、mh14a043hcori/lcori、mh14a055、mh14a063hcori/lcori、mh14a091的各小鼠/人嵌合抗体反应,通过流式细胞仪观察结合性(图9)。结果这6个抗体均与食蟹猴的cdcp1反应,特别是对于除mh14a055以外的5抗体,与人相同程度地与食蟹猴的cdcp1反应。
[0291]
10.抗体与人癌细胞的反应性
[0292]
为了调查抗hcdcp1抗体组与各人癌细胞株的反应性,通过流式细胞仪进行抗体的结合反应性的评价。所使用的人癌细胞株及其供应商如下所述。
[0293]
前列腺癌:pc3(atcc)、du145(riken bioresource center)
[0294]
肺癌:h358(atcc)、sk-mes-1(atcc)
[0295]
乳腺癌:mda-mb-231(atcc)、hcc1143(atcc)
[0296]
胆管癌:tfk-1(riken bioresource center)
[0297]
卵巢癌:sk-ov3(atcc)、ovcar3(atcc)
[0298]
胰腺癌:capan-2(atcc)
[0299]
大肠/直肠癌:dld-1(jcrb)
[0300]
正常细胞:人乳腺上皮细胞(以下记作hmepc)(cell applications公司)、正常人表皮角化细胞(以下记作nhek)(promocell公司)
[0301]
对于各人癌细胞株/正常组织来源细胞,在10cm培养皿中用适于各种细胞的培养基进行培养。培养皿的细胞通过0.25%胰蛋白酶/edta(nacalai tesque公司)处理进行剥离处理和悬浮后,使用fcm缓冲液进行清洗,之后用fcm缓冲液将各抗体稀释至图中的各浓度,加入稀释所得物在4℃下反应30分钟。然后用fcm缓冲液清洗2次,使用作为二次抗体的pe标记小鼠抗人igg抗体(becton dickinson公司)进行染色。流式细胞仪解析使用facscantoii(becton dickinson公司)进行。
[0302]
将其结果示于图10a和图10b。候补克隆显示出对所有癌细胞的反应性。另外,对nhek和hmepc也显示出反应性。
[0303]
11.小鼠杂交瘤来源抗体与骨髄细胞的反应性
[0304]
健康人骨髄来源单核细胞从allcells公司、stemcell technologies公司、lonza公司中的任意者购入。
[0305]
将冷冻细胞储存物融解后,通过包含2%fbs的imdm培养基(thermo fisher scientific公司)进行清洗,然后,用fcr blocking reagent(miltenyi公司)进行室温15分钟处理。在此状态下加入最终浓度10μg/ml的一次抗体样品,在4℃下反应30分钟。作为一次抗体样品,使用利用protein g sepharose fast flow(ge healthcare公司)由通过前项的筛选而得到的杂交瘤克隆的培养上清液纯化而得到的抗体样品。作为阳性对象的抗体,使用抗hcdcp1抗体克隆cub1(biolegend公司)。非特异性小鼠igg(单克隆抗体克隆2e12)使用mbl公司制品。用fcm缓冲液清洗2次后,将pe标记抗小鼠igg抗体(becton dickinson公司)在4℃下反应30分钟。进而用fcm缓冲液清洗2次后,将apc标记抗人cd34抗体(biolegend公司)在4℃下反应30分钟。用fcm缓冲液清洗2次后,悬浮于包含7-aad(becton dickinson公司)的fcm缓冲液中,通过facscantoii(becton dickinson公司)进行流式细胞仪观察。
[0306]
将评价的抗体的反应性示于图11。从流式细胞术的数据中仅对cd34-apc阳性活细胞设门,制作该pe的荧光值的直方图。如图11所示,与非特异性小鼠igg相比,cub1抗体与骨髄单核细胞的cd34阳性细胞级分强烈地结合,而图11所列举的以下的抗体克隆的反应性充分低,在10μg/ml的比较抗体浓度下与非特异性小鼠igg也为相同程度,弱至检测不到与cd34阳性细胞级分的反应性。
[0307]
克隆:01a2c5、12a033、12a038、12a041、14a025、14c013
[0308]
12.小鼠/人嵌合抗体与骨髄细胞的反应性
[0309]
健康人骨髄来源单核细胞使用与前项相同者。将冷冻细胞储存物融解后,通过fcm缓冲液进行清洗,然后,加入fcr blocking reagent(miltenyi公司)在室温下进行15分钟处理。在此状态下加入最终浓度10μg/ml的一次抗体样品,在4℃下反应30分钟。作为一次抗
scientific k.k.)进行测定,确认为以下的表3所示。
[0322]
[表3]
[0323]
抗体mh12a041hcori/lcori-生物素1.37mh14a025hcori/lcori-生物素2.11mh14a043hcori/lcori-生物素2.14mh14a063hcori/lcori-生物素2.67cub4-生物素2.36cub1-生物素2.7625a11-生物素1.96higg-生物素1.91人血清来源igg-生物素3.72
[0324]
健康人来源骨髓单核细胞使用与前项相同者。将冷冻细胞储存物融解后,通过fcm缓冲液或者包含2%fbs的imdm培养基进行清洗,然后,加入fcr blocking reagent(miltenyi公司)在室温下进行15分钟处理。在此状态下加入一次抗体样品在4℃下反应30分钟。用fcm缓冲液清洗2次后,与混合了pe标记山羊抗人igg抗体(southem biotechnology公司)、apc标记抗人cd34抗体(biolegend公司)、pe-cy7标记抗人cd45抗体(biolegend公司)者在4℃下反应30分钟。用fcm缓冲液清洗2次后,悬浮于包含7-aad(becton dickinson公司)的fcm缓冲液中,通过facscantoii(becton dickinson公司)进行观察。
[0325]
将基于该实验的与骨髓细胞的反应性示于图13。该图中,对于观察到的结果,仅提取了cd34/cd45两阳性的活细胞,并计算出其平均pe荧光强度,示出与所添加的抗体浓度的相关性。由该图可知,cub1、cub4、25a11的生物素化抗体在低浓度域下也与骨髄cd34阳性细胞显示出充分的反应性,而mh12a041hcori/lcori、mh14a025hcori/lcori、mh14a043hcori/lcori、mh14a063hcori/lcori这4个抗体的生物素化抗体与cd34阳性细胞的反应性显著低,特别是在10ng/ml的比较抗体浓度下,cub1、cub4、25a11的生物素化抗体显示出强烈的反应性,而mh12a041hcori/lcori、mh14a025hcori/lcori、mh14a043hcori/lcori、mh14a063hcori/lcori这4个抗体的生物素化抗体显示出与生物素化非特异性人igg几乎为同水平的较弱的反应性。
[0326]
另外,图13的d示出:对于图13的a~c中作为非特异性人igg使用的抗rs病毒抗体生物素化抗体和正常人血清来源纯化igg生物素化蛋白,在10ng/ml的比较抗体浓度下比较与骨髄cd34阳性细胞的反应性的图。测定对独立的3个样品进行,图13的d示出pe平均荧光强度的平均值和标准误差。由此示出本发明中说明的抗hcdcp1抗体组的反应性与人血清来源igg蛋白为相同程度的反应性。
[0327]
14.抗体的人源化和与强制表达细胞的反应性
[0328]
接着,进行以下的小鼠抗hcdcp1抗体序列的人源化。mh12a041hcv1、mh12a041lcv1、mh14a043hcv2、mh14a043lcv1、mh14a063hcv1、mh14a063lcori。
[0329]
由各抗体可变区的序列基于cdr移植法进行人源化。人源化序列的设计基于以下的论文中记载的方法实施。tsurushita等,2005.design of humanized antibodies:from anti-tac to zenapax.methods 36:69-83.
[0330]
首先,利用常规方法制作小鼠抗体的三维分子模型。接着,基于该分子模型,在框架区的氨基酸序列中,推测对于cdr的结构形成重要的残基、以及认为与抗原的反应所必须的残基。同时,从人抗体重链可变区和轻链可变区的cdna序列数据库中,检索与各抗hcdcp1抗体的重链可变区、轻链可变区同源性高的序列。然后,设计出将检索的人抗体序列的框架部分的序列与各抗hcdcp1抗体的cdr序列连接而成的序列,向其中进一步移植认为cdr结构形成或者与抗原的反应所必须的残基的序列,设计了人源化抗体序列。所设计的序列如以下的表4所示。人源化抗体序列所具有的cdr序列与原始的小鼠抗体的序列相同,且为与前述所示的序列号相同的序列。
[0331]
[表4]
[0332] 可变区序列cdr1cdr2cdr3h12a041vh1序列号169序列号49序列号50序列号113h12a041vh2序列号170序列号49序列号50序列号113h12a041vl序列号171序列号117序列号54序列号55h14a043vh1序列号172序列号73序列号147序列号75h14a043vh2序列号173序列号73序列号147序列号75h14a043vl1序列号174序列号149序列号78序列号79h14a043vl2序列号175序列号149序列号78序列号79h14a043vl3序列号176序列号149序列号78序列号79h14a063vh2序列号177序列号89序列号151序列号91h14a063vh3序列号178序列号89序列号151序列号91h14a063vh4序列号179序列号89序列号151序列号91h14a063vl1序列号180序列号93序列号94序列号95h14a063vl2序列号181序列号93序列号94序列号95
[0333]
认为:对于mh12a041hcv1,将kabat编号第32位的丝氨酸残基突变为苯丙氨酸残基,另外对于mh12a041lcv1,将kabat编号第27d位的组氨酸残基突变为酪氨酸残基、或分别将第27a位的丝氨酸残基和第28位的丝氨酸残基同时突变为天冬酰胺残基和天冬氨酸残基,从而与抗原的亲和性改善,因此制作包含这些突变的以下的表5所示的序列。
[0334]
[表5]
[0335] 可变区序列cdr1cdr2cdr3h12a041vh1a序列号182序列号183序列号50序列号113h12a041vh2a序列号184序列号183序列号50序列号113h12a041vla序列号185序列号186序列号54序列号55h12a041vlb序列号187序列号188序列号54序列号55
[0336]
通过基因合成合成了编码所设计的可变区氨基酸序列的dna序列。对于重链可变区序列dna,连接人抗体分泌信号肽或者人il-2的分泌信号肽,并克隆至作为包含人igg1恒定区的载体的pfuse-chig-hg1上。对于轻链可变区序列dna,连接人抗体分泌信号肽或者人il-2的分泌信号肽,并克隆至作为包含人igκ恒定区的载体的pfuse2-clig-hk载体上。
[0337]
通过expifectamine将克隆的质粒基因导入至expi293细胞中,在培养液中表达抗体。将重链/轻链的载体按照以下方式组合而表达。
[0338]
h12a041:vh1/vl、vh2/vl、vh1/vla、vh2/vla、vh1/vlb、vh2/vlb、vh1a/vl、vh2a/vl、vh1a/vla、vh2a/vla、vh1a/vlb、vh2a/vlb
[0339]
h14a043:vh1/vl1、vh1/vl2、vh1/vl3、vh2/vl1、vh2/vl2、vh2/vl3
[0340]
h14a063:vh2/vl1、vh2/vl2、vh3/vl1、vh3/vl2、vh4/vl1、vh4/vl2
[0341]
对培养液进行回收/过滤器净化,利用alphalisa法测定培养液中的抗体蛋白浓度。
[0342]
使用制作的人源化抗hcdcp1抗体蛋白、和作为比较对象的成为基础的克隆的小鼠/人嵌合抗体,利用流式细胞仪研究了这些与hcdcp1的反应性。作为目标细胞使用ba/f3-hcdcp1细胞。作为二次抗体使用pe标记小鼠抗人igg抗体(becton dickinson公司)。由图14所示的该实验的结果明确了,设计出的人源化抗体均显示出与成为基础的小鼠/人嵌合抗体为相同程度或其以上的反应性。由该结果示出:制作的人源化抗hcdcp1抗体组充分地保留了与hcdcp1的反应性。
[0343]
15.人源化抗体与骨髄细胞的反应性
[0344]
对于具有以下的重链/轻链的组合的抗体的纯化蛋白,利用与前项目中说明的方法同样的方法直接进行生物素化。
[0345]
h12a041:vh1/vl、vh1/vla、vh1/vlb、vh1a/vl
[0346]
h14a043:vh1/vl1、vh1/vl2、vh1/vl3、vh2/vl1、vh2/vl2、vh2/vl3
[0347]
h14a063:vh4/vl1、vh4/vl2
[0348]
另外,作为比较对象的抗体,使用:将项目13中制作的25a11抗体、cub4抗体、cub1抗体、作为非特异性人igg抗体的抗rs病毒抗体、及正常人血清来源纯化igg蛋白质直接生物素化所得者。各抗体的生物素化价数使用biotin quantification kit(thermo fisher scientific k.k.)进行测定,如以下的表6所示。
[0349]
[表6]
[0350]
抗体 h12a041vh1/vl-生物素1.61h12a041vh1/vla-生物素2.02h12a041vh1/vlb-生物素1.51h12a041vh1a/vl-生物素2.37h14a043vh1/vl1-生物素2.14h14a043vh1/vl2-生物素1.89h14a043vh1/vl3-生物素1.94h14a043vh2/vl1-生物素1.89h14a043vh2/vl2-生物素2.30h14a043vh2/vl3-生物素2.14h14a063vh4/vl1-生物素1.74h14a063vh4/vl2-生物素1.35
[0351]
使用这些抗体,利用与前项目中说明同样的方法,通过流式细胞仪观察与健康人骨髓来源单核细胞的反应性。图15示出:使以下的生物素化抗体在10ng/ml的浓度下与健康人骨髓来源单核细胞结合后通过流式细胞仪进行观察,对cd34/cd45两阳性活细胞群的pe
荧光强度进行观察的结果的直方图。
[0352]
25a11-生物素、cub4-生物素、cub1-生物素、h12a041vh1/vla-生物素、h14a043vh1/vl1-生物素、h14a063vh4/vl2-生物素、人血清igg-生物素
[0353]
根据该结果,本发明中说明的抗体与比较对象的抗体相比,与骨髓中cd34阳性细胞的反应性非常低,显示出与人血清中的igg相同几乎没有反应性。
[0354]
进而对于表6所示的抗体组,改变发挥作用的抗体浓度进行同样的实验。图16是示出基于流式细胞术的测定结果,cd34阳性活细胞中的pe的平均荧光强度的浓度依赖性的双对数图。该结果是,cub4抗体对骨髄中的cd34阳性细胞显示出显著的结合性,而表6所示的抗体对阳性比较对象的抗体的反应性均足够低,至少在10ng/ml的比较抗体浓度下,为与作为阴性对象观察的非特异性人igg抗体相同程度的反应性。由该结果,本发明中说明的抗体对造血干细胞的反应性低,因此认为具有由这些衍生的抗肿瘤活性的修饰抗体对骨髄细胞的细胞毒性也低。
[0355]
16.pbd缀合物抗体的制作
[0356]
对于以下项目7中制作的小鼠/人嵌合抗体、项目14中制作的人源化抗体、及作为非特异性人igg的前述的抗rs病毒抗体,制作将作为抗癌剂的pbd(pyrrolobenzodiazepine,吡咯并苯并二氮杂卓)直接与该纯化抗体结合而成的抗体药物复合体,对其细胞毒性进行评价。
[0357]
mh12a041hcori/lcori、mh14a025hcori/lcori、mh14a043hcori/lcori、mh14a063hcori/lcori
[0358]
h12a041vh1/vla、h14a043vh1/vl1、h14a063vh4/vl2
[0359]
对于2mg的纯化抗体,通过三(2-羧乙基)膦盐酸盐(tcep:tris(2-carboxyethyl)phosphine hydrochloride)切割二硫醚键后,通过马来酰亚胺-半胱氨酸间的加成结合反应与马来酰亚胺-peg4-val-ala-pbd结合。然后,通过sephadex g50柱去除未反应的马来酰亚胺-peg4-val-ala-pbd,进行缓冲液置换至pbs ph7.2。制作的pbd缀合物抗体的名称如下所述。一并示出通过333nm的吸光与280nm的吸光之比测定的、每个抗体分子的结合pbd分子数(dar)。
[0360]
小鼠/人嵌合抗体pbd缀合物抗体:mh12a041-pbd(dar 2.1);mh14a025-pbd(dar 1.7);mh14a043-pbd(dar 1.8);mh14a063-pbd(dar 2.0)
[0361]
人源化抗体pbd缀合物抗体:h12a041-pbd(dar 3.8);h14a043-pbd(dar 3.6);h14a063-pbd(dar 3.4)
[0362]
抗rs病毒抗体pbd缀合物抗体:higg-pbd(dar 2.2)
[0363]
17.小鼠/人嵌合抗体pbd缀合物抗体对癌细胞的细胞毒性活性
[0364]
利用以下的方法评价了前项目中制作的小鼠/人嵌合抗体的pbd缀合物抗体对培养细胞的细胞毒性活性。癌细胞株和正常组织来源原代培养细胞使用与前项目中说明相同者。
[0365]
使用适合的培养基在塑料培养皿中培养细胞。通过胰蛋白酶处理将细胞剥离,在96孔平底孔板中接种每孔1000细胞或者2000细胞。在37℃下培养至第二天后,添加利用培养基稀释至各浓度的pbd缀合物抗体,在37℃恒温箱中分别培养3天(du145)、5天(pc3)、7天(其它细胞)。然后,通过cell titer glo(promega)测定细胞的存活率。对于各pbd缀合物抗
aminobenzyloxycarbonyl-monomethyl auristatin e(mc-vc-pab-mmae,马来酰亚胺己酰基-缬氨酸-瓜氨酸-对氨基苄氧基羰基-一甲基奥瑞他汀e)结合。然后,通过sephadex g50柱去除未反应的mc-vc-pab-mmae,进行缓冲液置换至pbs ph7.2。通过248nm的吸光与280nm的吸光之比测定每个抗体分子的结合mmae分子数,h14a043vh1/vl1测定约为3.9,h14a063vh4/vl2测定约为4.0。制作的mmae缀合物抗体的名称如下所述。
[0391]
h14a043-mmae;h14a063-mmae
[0392]
22.人源化抗体mmae缀合物抗体对移植瘤模型的抗肿瘤活性
[0393]
接着,利用以下的方法评价了人源化抗体mmae缀合物抗体在体内的抗肿瘤活性。小鼠使用裸鼠(balb/cajcl-nu/nu:clea japan,inc.)雌6~7周龄的小鼠。hct116细胞使用从atcc购入的细胞。hct116细胞利用与项目20同样的方法培养。
[0394]
用0.25%胰蛋白酶/0.02%edta(thermo fisher scientific k.k.)剥离细胞并用pbs清洗后,将每只5
×
106细胞与生长因子减少型基质胶无酚红型(corning公司)以1:1混合,移植至小鼠右右胁腹皮下。
[0395]
在肿瘤增殖且平均肿瘤体积超过100mm3的时间点,基于各个体的肿瘤体积进行随机分组(一组8只)。在分组当日作为初次给药日,将待检药和作为阴性对象的作为溶剂的磷酸缓冲生理盐水(pbs)每周2次、共计4次进行给药。给药以小鼠单位体重10μl/g通过尾静脉给药进行。肿瘤尺寸以及体重的测定利用与项目19同样的方法进行。
[0396]
图21示出实验结果。通过5mg/kg的4次给药,与pbs给药组相比,h14a043-pbd、h14a063-pbd均显著抑制了肿瘤。
[0397]
产业上的可利用性
[0398]
本发明所提供的抗体及其抗原结合片段被认为在提供癌症的预防或治疗、癌症的预防或治疗剂的开发等中发挥重要的作用,因此,可期待本发明用于医疗领域、制药领域等中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1