一种嵌合抗原受体、载体、人树突状细胞、细胞系、实体肿瘤治疗药物及制备方法和应用与流程
本发明涉及嵌合抗原受体
技术领域:
,具体涉及一种嵌合抗原受体、慢病毒载体、人树突状细胞、细胞系、免疫抑制性实体肿瘤治疗药物及制备方法和应用。
背景技术:
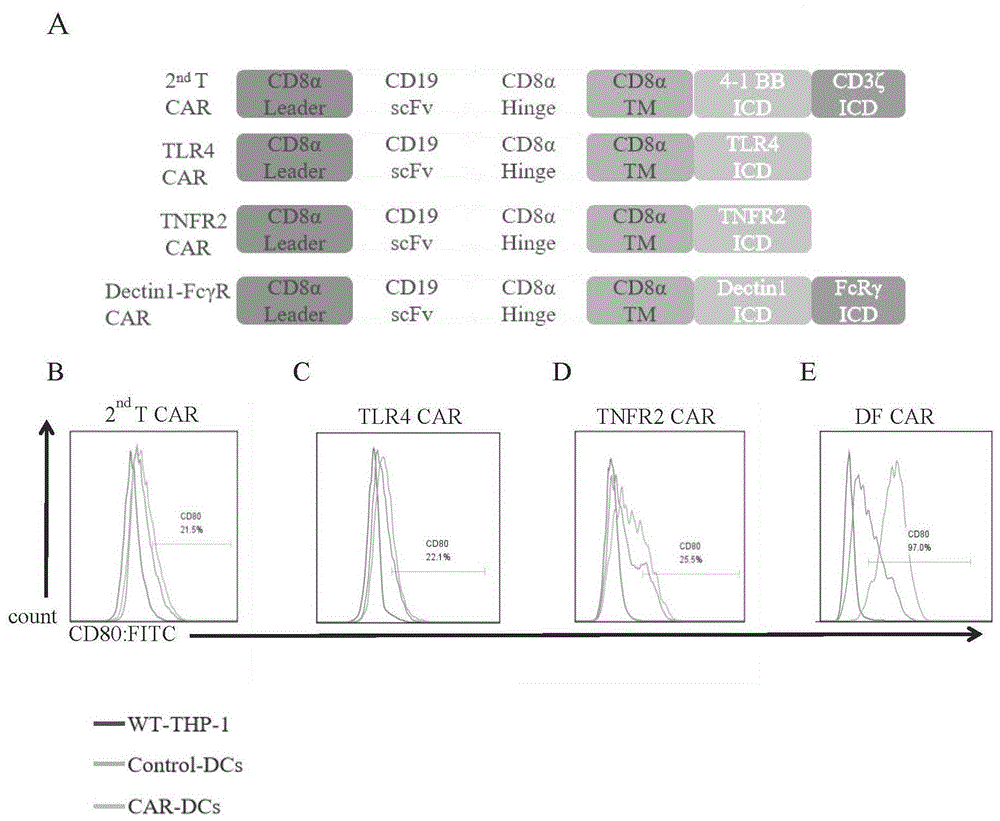
:树突状细胞(dcs)作为先天性免疫和适应性免疫系统的桥梁,是激活体液免疫和细胞免疫的最有效的抗原呈递细胞,特别是在触发肿瘤特异性免疫应答过程中发挥了关键的作用,在肿瘤免疫治疗中具有不可估量的潜力。近几十年来,大量的dcs疫苗被不断地研发,期待提高肿瘤免疫治疗效果。目前开发的dcs疫苗,大多由患者外周血单个核细胞(pbmcs)中的单核细胞诱导衍生而来,通过在体外脉冲肽段、蛋白质、肿瘤裂解物、dna或mrna的方法,使其负载特定肿瘤相关抗原(taa),以触发肿瘤抗原特异性cd8+t细胞的扩增反应并消除患者的肿瘤细胞,这是目前树突状细胞疫苗主要的生产方式。然而,迄今为止很少有dcs疫苗在临床试验中取得预期的效果。近年来的研究也已表明,由于免疫抑制性肿瘤微环境的影响,肿瘤浸润树突状细胞通常被极化而展示出未成熟或者耐受性的表型,dcs的功能紊乱直接导致了浸润到肿瘤中的t细胞减少并且处于失能状态。提示了目前的dcs疫苗应用于临床治疗中所面临的障碍。尽管有多种因素及信号通路被阐明用以纠正和逆转dcs异常行为,在临床应用中尚未取得能够有效重新恢复肿瘤浸润dcs活性的巨大成果。因此迫切需要开发新型的经设计改造的dcs疫苗,以促进其在免疫抑制性实体肿瘤微环境中的浸润和活化。技术实现要素:本发明的目的在于提供一种嵌合抗原受体、慢病毒载体、人树突状细胞、细胞系、免疫抑制性实体肿瘤治疗药物及制备方法和应用。在肿瘤靶点存在的情况下,本发明嵌合抗原受体在体内外均可以有效激活dcs,且能抵抗免疫抑制性分子ctla4-ig和pd-l1形成的环境,提高传统car-t细胞对免疫抑制性实体肿瘤的清除能力。在临床相关的人源化小鼠肿瘤模型中,本发明嵌合抗原受体修饰的人树突状细胞能够有效逆转免疫抑制性肿瘤微环境,重新激活体内耗竭的car-t细胞,从而抑制实体肿瘤的进展。本发明提供了一种嵌合抗原受体,所述嵌合抗原受体胞内信号域选自tlr4、tnfr2、dectin-1和fc受体γ链胞内域结构中的至少一种。优选的是,所述嵌合抗原受体的胞内信号域由dectin-1胞内域和fc受体γ链胞内域串联构成。优选的是,所述嵌合抗原受体的胞内信号域氨基酸序列如seqidno.1所示。本发明还提供了一种表达上述技术方案所述嵌合抗原受体的慢病毒载体。本发明还提供了一种经上述技术方案所述嵌合抗原受体修饰的人树突状细胞。优选的是,所述人树突状细胞的前体细胞的来源包括thp-1人单核细胞白血病细胞系,人外周血单个核细胞中的单核细胞和人源化鼠骨髓细胞。本发明还提供了上述技术方案所述嵌合抗原受体修饰的人树突状细胞的制备方法,包括以下步骤:将所述嵌合抗原受体转导入人树突状细胞的前体细胞,诱导分化,得到嵌合抗原受体修饰的人树突状细胞。本发明还提供了一种表达上述技术方案所述嵌合抗原受体的细胞系,所述细胞系通过将所述嵌合抗原受体转入人诱导多功能干细胞制备得到。本发明还提供了上述技术方案所述嵌合抗原受体或上述技术方案所述的慢病毒载体或上述技术方案所述人树突状细胞或上述技术方案所述制备方法制备得到的人树突状细胞或上述技术方案所述的细胞系在制备实体肿瘤免疫治疗的药物中的应用。本发明还提供了一种实体肿瘤免疫治疗的药物,所述药物包括上述技术方案所述嵌合抗原受体或上述技术方案所述的慢病毒载体或上述技术方案所述人树突状细胞或上述技术方案所述制备方法制备得到的人树突状细胞或上述技术方案所述的细胞系和嵌合抗原受体t细胞。本发明提供了一种嵌合抗原受体,本发明所述嵌合抗原受体后续能够制备得到慢病毒载体、人树突状细胞、细胞系和免疫抑制性实体肿瘤治疗药物。在肿瘤靶点存在的情况下,本发明嵌合抗原受体在体内外均可以有效激活dcs,且能抵抗免疫抑制性分子cp形成的环境,提高传统car-t细胞对免疫抑制性实体肿瘤的清除能力。此外,在人源化小鼠肿瘤模型中,新型cardf-dcs能够有效逆转免疫抑制性肿瘤微环境,重新激活体内耗竭的car-t细胞,从而增强对实体肿瘤的清除能力。本发明制备出源于人诱导多功能干细胞(hipscs)的cardf-dcs,提供了一种现货型cardf-dcs,极大优化了制备流程,降低生产成本,更有利于实际应用,为cardf-dcs用于实体瘤的临床治疗提供了理论和实践基础。具体的,本发明同时选取dectin-1胞内域和fc受体γ链胞内域两种结构串联作为car结构的内部信号域时,在肿瘤抗原存在的情况下可以有效地激活dcs。与传统脉冲肽段等方式负载肿瘤相关抗原的dcs疫苗相比,本发明所述嵌合抗原受体(cardf)修饰的dcs具有靶向趋向性,在具有免疫抑制性的实体瘤环境中亦可以特异性地识别靶细胞,更多地浸润到肿瘤内部,且能够有效逆转免疫抑制性的肿瘤微环境。本发明优化了在dcs进行慢病毒转导的方式,将表达cardf结构的慢病毒载体转导入dcs的前体细胞,再经诱导分化,可以保持dcs表面cardf结构高表达,也为提高dcs中慢病毒载体转导效率提供了理论和实践基础。本发明优化了将hu-mice骨髓细胞诱导分化为dcs并进行cardf转导的方法,得到了自体cardf-dcs以避免体内免疫排斥反应。本发明后续将嵌合抗原受体联合car-t细胞疗法,极大地提高了car-t细胞在免疫抑制性实体肿瘤中的活性,为难治疗易复发的实体瘤临床治疗提供了新的方案。本发明的cardf结构可以转入人诱导多功能干细胞(hipscs),构建现成的表达cardf结构的细胞系,经诱导分化可以大规模生产同质性的cardf-dcs,极大降低细胞治疗的成本,更有利于实际临床应用。附图说明图1为本发明提供的不同胞内域结构的car激活dcs效果的筛选结果图;其中,a为不同car的结构图,b为t-car激活dcs的效率;c为tlr-4car激活dcs的效率;d为tnfr2car激活dcs的效率;e为dfcar激活dcs的效率;图2为本发明提供的单核细胞来源的cardf-dcs的分化效率及转导效率;图3为本发明提供的单核细胞来源的cardf-dcs与a549cp肿瘤细胞体外共培养时激活效果结果图;其中,a为cardf结构对于dcs的激活效应;b为激活后的dcs刺激初始t细胞增殖的效应;图4为本发明提供的cardf-dcs与car-t联合体外杀伤a549cp肿瘤细胞效果结果图;其中,a为car-t细胞肿瘤杀伤能力;b为car-t细胞与对照dcs共培养时肿瘤杀伤能力;c为car-t细胞与cardf-dcs共培养时肿瘤杀伤能力;d为体外共培养杀伤肿瘤细胞后car-t细胞中ifn-γmrna表达情况;图5为本发明提供的nsg小鼠异种移植肿瘤模型免疫治疗结果图;其中,a为不同治疗组a549wt肿瘤的生长曲线;b为不同治疗组a549cp肿瘤的生长曲线;c为不同治疗组的小鼠脾脏中dcs激活情况;d为不同治疗组的小鼠脾脏中t细胞存活情况;图6为本发明提供的人源化小鼠(hu-mice)异种移植肿瘤模型免疫治疗结果图;其中,a为hu-mice骨髓细胞体外诱导为dcs的效率;b为hu-mice骨髓细胞体外经cardf转导诱导为cardf-dcs的效率;c为肿瘤的生长曲线;d为不同治疗组脾脏t细胞中表面表达pd-1和tim-3分子的比例;e为不同治疗组治疗后,肿瘤内cd206mrna表达情况;图7为本发明提供的转导cardf结构的hipscs衍生而来的dcs表面分子标志表达情况及刺激同种异体初始t细胞增殖结果图,其中,a为hipscs转导cardf的效率;b为cardf-hipscs分化为cardf-dcs的效率;c为hipscs分化的dcs刺激同种异体初始t细胞增殖情况;具体实施方式本发明提供了一种嵌合抗原受体,所述嵌合抗原受体胞内信号域选自tlr4(toll样受体4)、tnfr2(肿瘤坏死因子受体ii)、dectin-1(c型凝集素受体-1)和fc受体γ链胞内域结构中的至少一种。优选的,在本发明中,所述嵌合抗原受体的胞内信号域由dectin-1胞内域和fc受体γ链胞内域串联构成,后文简称df。在本发明中,所述dectin-1的胞内域来源于dectin1(nm_197947),序列优选为:rwppsaacsgkesvvairtnsqsdfhlqtygdedlneldphyem(seqidno.3)。所述fc受体γ链的胞内域来源于fcrγ(nm_004106),序列优选为:rlkiqvrkaaitsyeksdgvytglstrnqetyetlkhekppq(seqidno.4)。发明人需要说明的是,对于本发明嵌合抗原受体的scfv区域并没有特别的规定,可以依据所需治疗的肿瘤的类型进行靶点确定。在本发明中所述嵌合抗原受体的胞外域优选由cd8α的引导序列、scfv根据作用靶点不同分为anti-cd19的scfv和anti-epha2的scfv、cd8α的铰链区和cd8α的跨膜区域构成。在本发明中,所述cd8α的引导序列优选为:malpvtalllplalllhaarp(seqidno.5),anti-cd19的scfv序列优选为:diqmtqttsslsaslgdrvtiscrasqdiskylnwyqqkpdgtvklliyhtsrlhsgvpsrfsgsgsgtdysltisnleqediatyfcqqgntlpytfgggtkleitggggsggggsggggsevklqesgpglvapsqslsvtctvsgvslpdygvswirqpprkglewlgviwgsettyynsalksrltiikdnsksqvflkmnslqtddtaiyycakhyyyggsyamdywgqgtsvtvss(seqidno.6),anti-epha2的scfv序列优选为:qvqllesggglvqpggslrlscaasgftfssytmswvrqapgqalewmgtissrgtytyypdsvkgrftisrdnaknslylqmnslraedtavyycareaifthwgrgtlvtvssggggsggggsggggsdiqltqspsslsasvgdrvtitckasqdinnyhswyqqkpgqaprlliyranrlvdgvpdrfsgsgygtdftltinniesedaayyfclkynvfpytfgqgtkveik(seqidno.7),cd8α铰链区序列优选:tttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacd(seqidno.8),cd8α跨膜区域序列优选为:iyiwaplagtcgvlllslvitlyc(seqidno.9)。在本发明中,所述嵌合抗原受体胞内信号域的氨基酸序列如seqidno.1所示:rwppsaacsgkesvvairtnsqsdfhlqtygdedlneldphyemrlkiqvrkaaitsyeksdgvytglstrnqetyetlkhekppq。在本发明中,编码所述嵌合抗原受体胞内信号域的核苷酸序列如seqidno.2所示:cgctggcctccttctgcagcttgttcgggaaaagagtcagttgttgctataaggaccaatagccaatctgacttccacttacaaacttatggagatgaagatttgaatgaattagatcctcattatgaaatgcgactgaagatccaagtgcgaaaggcagctataaccagctatgagaaatcagatggtgtttacacgggcctgagcaccaggaaccaggagacttacgagactctgaagcatgagaaaccaccacag。本发明还提供了一种表达上述技术方案所述嵌合抗原受体的慢病毒载体。在本发明中,所述嵌合抗原受体优选克隆到慢病毒载体lenti-cas9(addgene)上。本发明对所述慢病毒载体优选采用二代病毒包装方法制备慢病毒。本发明还提供了一种经上述技术方案所述嵌合抗原受体修饰的人树突状细胞。在本发明中,所述人树突状细胞的前体细胞的来源包括thp-1人单核细胞白血病细胞系,人外周血单个核细胞中的单核细胞和人源化鼠骨髓细胞。本发明构建得到的人树突状细胞能够使其对特异性肿瘤靶点具有有效趋向性,在抑制性肿瘤微环境中同样可以接受刺激而被激活,增强肿瘤治疗效果。嵌合抗原受体修饰的人树突状细胞(cardf-dcs)能够有效逆转免疫抑制性肿瘤微环境,增强实体肿瘤免疫治疗效果。本发明还提供了上述技术方案所述嵌合抗原受体修饰的人树突状细胞的制备方法,包括以下步骤:将所述嵌合抗原受体转导入人树突状细胞的前体细胞,诱导分化,得到嵌合抗原受体修饰的人树突状细胞。采用这种方法,极大提高了树突状细胞表面表达cardf结构的效率,最终得到的cardf-dcs纯度达到85%以上。本发明所述嵌合抗原受体优选感染前体细胞,当所述前体细胞为人外周血单个核细胞中的单核细胞时,本发明感染单核细胞过程中病毒感染复数优选为100。在本发明中,感染后的单核细胞向dc细胞诱导分化的时间优选为4~5d。在本发明中,所述诱导分化过程中优选加入gm-csf和il-4两种细胞因子。本发明上述条件的设置能够提高dc分化和感染效率。gm-csf和il-4两种细胞因子在每毫升培养基中的质量优选为100ng。培养基优选为rpmi1640补充10%胎牛血清和1%青霉素-链霉素的完全培养基。当所述前体细胞为人源化鼠骨髓细胞时,病毒感染复数优选为100。在本发明中,感染后的骨髓细胞向dc细胞诱导分化的时间优选为9~10d。在本发明中,所述诱导分化过程中优选加入gm-csf和il-4两种细胞因子。gm-csf在每毫升培养基中的质量优选为20ng,il-4在每毫升培养基中的质量优选为5ng。培养基优选为rpmi1640补充10%胎牛血清和1%青霉素-链霉素的完全培养基。当所述前体细胞为thp-1人单核细胞白血病细胞系时,病毒感染复数优选为10。在本发明中,感染后的thp-1细胞向dc细胞诱导分化的时间优选为10~12d。在本发明中,所述诱导分化过程中优选加入gm-csf和il-4两种细胞因子。gm-csf在每毫升培养基中的质量优选为100ng,il-4在每毫升培养基中的质量优选为100ng。培养基优选为rpmi1640补充10%胎牛血清和1%青霉素-链霉素的完全培养基。本发明还提供了一种表达上述技术方案所述嵌合抗原受体的细胞系,所述细胞系通过将所述嵌合抗原受体转入人诱导多功能干细胞(hipscs)制备得到。hipscs具有无限增殖且能够分化为各种组织细胞的能力,在疾病的细胞治疗中具有极大的潜力。本发明优选采用慢病毒将嵌合抗原受体转导入hipscs,制备稳定的嵌合抗原受体的细胞系(如cardf-hipscs)。在本发明中,所述hipscs优选采用op9基质细胞滋养方法向dcs诱导分化(natprotoc.2011march;6(3):296–313.doi:10.1038/nprot.2010.184)。本发明中hipscs初始分化细胞量优选为1×106~1.5×106,初始培养基优选为mem-α补充20%胎牛血清和1%青霉素-链霉素的完全培养基。dc细胞诱导分化全过程优选为31~38d。本发明cardf-hipscs经诱导分化可以大规模生产同质性的嵌合抗原受体修饰的人树突状细胞(cardf-dcs)。本发明还提供了上述技术方案所述嵌合抗原受体或上述技术方案所述的慢病毒载体或上述技术方案所述人树突状细胞或上述技术方案所述制备方法制备得到的人树突状细胞或上述技术方案所述的细胞系在制备实体肿瘤免疫治疗药物中的应用。在本发明中,所述应用优选与嵌合抗原受体t细胞(car-t细胞)联合治疗。本发明所述car-t细胞优选来源与dc细胞同一个个体的外周血。在本发明中,所述实体肿瘤优选为免疫抑制性分子ctla4-ig和pd-l1存在的实体肿瘤,更优选的,所述肿瘤的模型是nsg小鼠中表达ctla4-ig和pd-l1的实体瘤模型。在本发明中,所述肿瘤优选包括肺癌。在本发明中,所述肺癌的细胞优选为a549,a549表面过表达ctla4-ig和pd-l1,以下简称a549cp。本发明具体实施例中,肿瘤移植动物模型优选为nsg小鼠,优选的,体内成瘤方式为皮下成瘤;本发明所述嵌合抗原受体修饰的dcs体内输注方式优选为尾静脉注射;更优选地,所述嵌合抗原受体修饰的dcs尾静脉注射的剂量为5×106/只/次;本发明所述car-t细胞在联合治疗时,体内输注方式优选为尾静脉注射;更优选地,所述car-t细胞联合治疗尾静脉注射的剂量为1×107/只/次。本发明还提供了一种实体肿瘤免疫治疗的药物,所述药物包括上述技术方案所述嵌合抗原受体或上述技术方案所述的慢病毒载体或上述技术方案所述人树突状细胞或上述技术方案所述制备方法制备得到的人树突状细胞或上述技术方案所述的细胞系和嵌合抗原受体t细胞。在本发明中,人源化动物肿瘤模型优选为人源化小鼠(hu-mice)。在本发明中,动物模型的体内成瘤方式为皮下成瘤。在本发明中,所述嵌合抗原受体的dcs的体内输注方式优选为尾静脉注射。在本发明中,所述嵌合抗原受体的dcs优选由同一批hu-mice骨髓细胞诱导分化而来。在本发明中,所述嵌合抗原受体的dcs的尾静脉注射的剂量优选为3×106/只。当嵌合抗原受体的dcs与car-t细胞联合治疗实体肿瘤,所述car-t细胞优选来源于同一批hu-mice脾脏中的人cd3+t细胞,car-t细胞联合治疗体内输注方式优选为尾静脉注射,car-t细胞联合治疗尾静脉注射的剂量优选为1×107/只。发明人需要进一步说明的是对于上述药物在肿瘤免疫治疗中的剂量没有特别的规定,可以依据所要治疗的肿瘤的大小以及患肿瘤生物体的患病阶段进行确定。下面结合具体实施例对本发明所述的一种嵌合抗原受体、慢病毒载体、人树突状细胞、细胞系、免疫抑制性实体肿瘤治疗药物及制备方法和应用做进一步详细的介绍,本发明的技术方案包括但不限于以下实施例。实施例11、表达car慢病毒载体的构建以及不同car结构激活thp-1来源的dcs的效果:(1)慢病毒载体的构建。所有dc特异性car的胞内信号域是将传统二代t-car结构的4-1bb和cd3ξ替换为tlr4(nm_138554.5)、tnfr2(nm_001066.3)、dectin1(nm_197947)和fcrγ(nm_004106)的胞内域部分,所有序列均经过最优化并由公司合成(广州艾基)。car最终克隆到lenti-cas9(addgene)载体上替代cas9的位置。结构图见图1中的a。df序列如下:核酸序列cgctggcctccttctgcagcttgttcgggaaaagagtcagttgttgctataaggaccaatagccaatctgacttccacttacaaacttatggagatgaagatttgaatgaattagatcctcattatgaaatgcgactgaagatccaagtgcgaaaggcagctataaccagctatgagaaatcagatggtgtttacacgggcctgagcaccaggaaccaggagacttacgagactctgaagcatgagaaaccaccacag(seqidno.2)氨基酸序列rwppsaacsgkesvvairtnsqsdfhlqtygdedlneldphyemrlkiqvrkaaitsyeksdgvytglstrnqetyetlkhekppq(seqidno.1)(2)慢病毒的制备。所有用来包装慢病毒的质粒dna,均使用nucleobondxtramidief试剂盒(购于takarabio)进行提取纯化。参照addgene网站上慢病毒生产常用的方法,采用pei(购自sigmaaldrich)包装慢病毒方法。包装病毒前一天将293ft细胞(购于atcc)以1:3的比例进行传代,分到15cm培养皿里,第二天当细胞汇合度达到90%,进行病毒包装。转染前1h把培养基更换为新鲜培养基。两个包装质粒pspax2(addgene12260)和pmd2.g(addgene12259)与目的质粒以及1mg/mlpei以dna:pei为1:3~1:4的比例在opti-mem(购自gibco)中稀释。在室温下静置孵育20分钟后,将质粒混合物轻柔地滴加到细胞培养基中,并在转染后8h用dmem完全培养基(购自gibco)进行替换培养基,在转染后48~72h收集慢病毒颗粒。使用lenti-x病毒浓缩液(购自takarabio)对包含有病毒的培养基上清进行浓缩。将收集到的含有病毒颗粒的培养基以1500g,离心15分钟,分离得到的上清液中加入1/3体积的lenti-x病毒浓缩液,混合均匀后在4℃条件下静置过夜。第二天将混合液在4℃,3000rpm,45min条件下离心后,将离心管底部的病毒颗粒沉淀用0.6~0.8ml预冷pbs缓冲液进行重悬,并分装保存于-80℃冰箱中,以备后续使用。(3)thp-1来源的car-dcs的制备及激活效果。首先制备car-thp-1细胞,用rpmi1640完全培养基重悬thp-1细胞,以5×105细胞/500μl的密度将细胞铺在24孔板的一个孔中,采用病毒感染复数(moi=10)进行转导。将适当体积的病毒浓缩溶液加入到细胞培养液中,并加入6ug/ml鱼精蛋白硫酸盐(购自sigmaaldrich)以增强病毒感染效率,最后添加完全培养基以达到每孔500μl的总体积。在37℃培养箱中孵育12h后,在每个孔中加入约500μl的完全培养基后继续培养。含有病毒的培养基在感染后24h被去除,细胞用pbs洗涤两次,并用rpmi1640完全培养基继续扩大培养。收集car-thp-1细胞,用rpmi1640完全培养基重悬细胞,以2×105细胞/ml的密度将细胞铺在6孔板的一个孔中,每个孔的总体积为3ml。刺激car-thp-1细胞向car-dcs分化过程中需要将重组人gm-csf(100ng/ml)和重组人il-4(100ng/ml)两种细胞因子直接加入培养基中。每2或3天用含有新鲜细胞因子培养基进行更换。在细胞因子存在下dcs分化持续至少10天,再收集分化的未成熟car-dcs与表达cd19的肿瘤细胞共培养检测激活效果,结果见图1中的b-e。由图1中的b可知:t-car激活dc细胞表达共刺激分子cd80的效率为21.5%。由图1中的c可知:tlr4-car激活dc细胞表达共刺激分子cd80的效率为22.1%。由图1中的d可知:tnfr2-car激活dc细胞表达共刺激分子cd80的效率为25.5%。由图1中的e可知:df-car激活dc细胞表达共刺激分子cd80的效率为97%。以上数据表明,四种car结构中,只有df结构能够有效激活dcs。2、单核细胞来源的cardf-dcs的制备:将健康志愿者的外周血通过密度梯度离心的方法分离出外周血单个核细胞(pbmc),然后用抗cd14微磁珠和automacspro分离器装置(购自miltenyibiotech)分离单核细胞。在细胞转导前,单核细胞以每个孔2-5×105细胞,400μl分化培养基(rpmi1640完全培养基,补充以100ng/mlgm-csf和100ng/mlil-4(购自peprotech)),在24孔超低附着组织培养板中进行培养。采用病毒感染复数(moi=100)进行转导。将适当体积的病毒浓缩溶液加入到细胞培养液中,并加入6ug/ml鱼精蛋白硫酸盐(购自sigmaaldrich)以增强病毒感染效率,最后添加分化培养基以达到每孔500μl的总体积。在37℃培养箱中孵育12h后,在每个孔中加入约500μl的分化培养基后继续培养。含有病毒的培养基在感染后24h被去除,细胞用pbs洗涤两次,并用1ml分化培养基重悬,进一步培养4~5天,car-dcs的分化效率及表面car表达效率用流式细胞术测定,结果见图2。由图2可知:dcs表面cardf表达的效率为87.6%。3、cardf-dcs与肿瘤细胞体外共培养及刺激初始t细胞增殖试验:将1×106个a549-cp细胞(a549wt细胞中过表达ctla4-ig和pd-l1)与1×106mock-dcs或cardf-dcs于6孔板中共培养,48h后,在37℃下用0.25%胰蛋白酶/edta消化细胞5min,用pbs洗涤并重悬。最后用流式荧光抗体pe-cd11c、fitc-cd80、bv605-cd86、apc-hla-abc、bv-510-hla-dr(购自bdbiosciences)对细胞进行染色,并用流式细胞术分析,结果见图3中的a和表1。表1各组对应平均荧光强度的平均值mock-dccardf-dccd80515710300cd861265.671378.67hla-abc8857.339416.33hla-dr696.6671001原代cd3+t细胞用celltracecfse(购自lifetechnologies)进行染色。收集t细胞,pbs洗两遍,用1mlpbs重悬细胞,1:2000加入celltracecfse,在37℃条件下孵育15分钟,再加入9ml完全培养基在4℃条件下孵育10分钟以终止染色,离心后用t细胞培养基,rpmi1640培养基中补充10%胎牛血清、2mml-谷氨酰胺(购自thermofisherscientific)、1%青霉素-链霉素,25μmβ-巯基乙醇(购自gibco)和人白介素2(il-2;100unit/ml;peprotech)进行重悬。dcs和a549-cp细胞以及初始t细胞同时进行共培养,细胞比例为:肿瘤靶细胞:dcs:t细胞=1:1:5。第4天用流式细胞术分析活细胞中cd3+t细胞的增殖情况,cfse稀释的比例代表t细胞增殖的比例,结果见图3中的b和表2。表2各组对应t细胞增殖比例平均值:tcell+mock-dctcell+cardf-dc6677.76由图3中的a可知:cardf-dcs与a549-cp共培养48h之后,表面共刺激分子cd80、hla-abc和hla-dr表达与对照组相比显著增强。由图3中的b可知:激活的cardf-dcs刺激初始t细胞增殖比例为77.76%,高于对照组的比例66%。以上数据表明,当接触到肿瘤靶点时,cardf-dcs能够被有效激活并具有刺激t细胞增殖的功能。4、cardf-dcs与car-t细胞联合作用时的体外杀伤试验:在48孔板的每个孔中铺大约2×104个a549-cp细胞(靶细胞),细胞用rpmi1640完全培养基进行培养,每个孔中再分别加入2×104个mock-dcs或cardf-dcs(刺激细胞),每个孔中再继续加入105个anti-epha2car-t细胞(效应细胞),最终用rpmi1640培养基补足,使每个孔总体积均为400μl。细胞共培养24小时后,收集剩余细胞进行流式细胞术分析和qpcr分析,结果见图4。由图4中的a可知:细胞共培养24小时后,car-t组a549-cp剩余比例为34.1%。由图4中的b可知:细胞共培养24小时后,car-t和mock-dcs组a549-cp剩余比例为17.4%。由图4中的c可知:细胞共培养24小时后,car-t和cardf-dcs组a549-cp剩余比例为1.42%。由图4中的d和表3可知:cardf-dcs与car-t细胞共培养杀伤肿瘤细胞时,可以提高car-t细胞中促炎性细胞因子ifn-γmrna水平的表达。表3各组对应ifn-γmrna相对表达水平平均值(car-t组标准化)car-t+tumorcar-t+mock-dc+tumorcar-t+cardf-dc+tumor11.70179.5077以上数据表明,在cardf-dcs存在时,car-t细胞对肿瘤杀伤能力显著增强。5、cardf-dc用于异种移植肿瘤小鼠的免疫治疗试验:将1×106个a549wt细胞和a549-cp细胞分别用100μlpbs重悬,并皮下注射到6周龄nsg小鼠的双侧背部,制备异种肿瘤移植动物模型。将荷瘤小鼠随机分成四组治疗组,每组5只小鼠,治疗分组分别为:(1)单独normalt细胞治疗组(2)单独car-t细胞治疗组(3)car-t细胞与mock-dcs联合治疗组(4)car-t细胞与cardf-dcs联合治疗组在细胞输入治疗实验中,t细胞和dcs在肿瘤移植的第5天和第14天通过尾静脉共同注射入小鼠体内,细胞用500μlpbs重悬,每次注射的剂量均为5×106dcs和1×107t细胞。细胞治疗过程中每隔一天用游标卡尺测量肿瘤的尺寸并进行统计。当小鼠被处以安乐死时,收集所有肿瘤,称重并拍照。另外采集小鼠脾脏和血液,分离并处理成单个细胞,用荧光标记的流式抗体进行染色,并用流式细胞术分析,结果见图5。由图5中的a和表4可知:在a549wt肿瘤中,car-t能够有效杀伤肿瘤,第17天时,normal-t组的肿瘤平均体积为177.31mm3,car-t组的肿瘤平均体积为42.7283mm3,同时cardf-dcs联合治疗进一步提高了car-t的肿瘤杀伤效果,肿瘤生长显著消退,第17天时的肿瘤平均体积仅为2.64768mm3。表4第17天各组肿瘤平均体积(mm3)normaltcar-tcar-t+mock-dccar-t+cardf-dc177.3142.728315.21622.64768由图5中的b和表5可知:在a549cp肿瘤中,car-t无法发挥杀伤作用,第17天时,normal-t组的肿瘤平均体积为216.426mm3,car-t组的肿瘤平均体积为220.673mm3,而cardf-dcs联合治疗促进了肿瘤生长消退,第17天时的肿瘤平均体积为12.7172mm3。表5第17天各组肿瘤平均体积(mm3)normaltcar-tcar-t+mock-dccar-t+cardf-dc216.426220.67375.693212.7172由图5中的c和表6可知:cardf-dcs治疗组中,脾脏循环中表达cd86的dcs比例为52.14%,高于对照组的28.54%。表6各组对应cd86+dcs比例的平均值由图5中的d和表7可知:cardf-dcs治疗组中,脾脏循环中t细胞比例3.016%,高于mock-dcs组的1.532%。表7各组对应脾脏t细胞比例的平均值normaltcar-tcar-t+mock-dccar-t+cardf-dc0.2890.97761.5323.016以上数据表明,cardf-dcs在体内能够抵抗cp形成的抑制性环境,刺激了car-t细胞活性,增强了car-t细胞治疗免疫抑制性实体肿瘤的效果。6、人源化鼠骨髓细胞来源的cardf-dcs的制备:用无菌剪刀取出人源化小鼠的股骨和胫骨,浸泡在70%的酒精中3分钟,用冰冷的pbs冲洗两次,然后用无菌注射器(26规格针头)吸去pbs,从一端冲洗骨髓内腔,将骨髓细胞冲出。用1ml枪头反复吹吸使骨髓细胞分散,然后将骨髓细胞通过70μm尼龙网过滤,收集滤过的细胞进行离心,然后用裂解缓冲液(bd生物科学)溶解红细胞。剩余的细胞用pbs洗涤两次后进行计数,将细胞调整至1×106/ml完全培养基(rpmi-1640配以20ng/ml的重组人gm-csf和5ng/ml的重组人il-4)进行转导。采用moi为100进行cardf转导,将适当滴度的慢病毒浓缩储存液在37℃环境下缓慢解冻。将适量病毒浓缩液与6ug/ml硫酸鱼精蛋白混合加入分化培养基中。37℃孵育12小时后,在每个孔中添加1ml分化培养基。转导24小时后,收集细胞进行离心,小心弃掉含有病毒的培养基,细胞用pbs洗涤两次,并在新鲜的分化培养基中进一步培养直至9-10d使用。人源化鼠骨髓细胞来源的cardf-dcs用于hu-mice异种移植肿瘤的免疫治疗试验:将1×106个a549细胞用100μlpbs重悬,并皮下注射到hu-mice的双侧背部,制备异种肿瘤移植hu-mice动物模型。将荷瘤hu-mice随机分成四组治疗组,每组3只小鼠,治疗分组分别为:(5)单独normalt细胞治疗组(6)单独car-t细胞治疗组(7)car-t细胞与mock-dcs联合治疗组(8)car-t细胞与cardf-dcs联合治疗组在细胞输入治疗实验中,t细胞和dcs来源于同一批hu-mice自身细胞,其中dcs由骨髓细胞诱导分化而来,t细胞来源于脾脏中人cd3+t细胞的体外扩增。所有细胞在体外准备共需10天,同时肿瘤移植后的第8天,将荷瘤hu-mice随机分成四组,细胞治疗通过尾静脉共同注射入小鼠体内,细胞用400μlpbs重悬,注射的剂量均为3×106dcs和1×107t细胞。细胞治疗过程中每隔一天用游标卡尺测量肿瘤的尺寸并进行统计。当小鼠被处以安乐死时,收集所有肿瘤,称重并拍照。另外采集小鼠脾脏、血液和骨髓,分离并处理成单个细胞,用荧光标记的流式抗体进行染色,并用流式细胞术分析。取肿瘤组织,提取rna进行rt-pcr反应,检测肿瘤中相关基因的表达情况,结果见图6。由图6中的a可知:hu-mice骨髓细胞可以诱导为人的dcs(hu-micebm-dcs),且最终dcs占全部骨髓细胞的比例为63.55%(8.25%+55.3%)。由图6中的b可知:hu-mice骨髓细胞经过cardf转导后可以诱导为人的cardf-dcs(hu-micebm-cardf-dcs),且最终cardf-dcs占全部骨髓细胞的比例为61.6%。由图6中的c和表8可知:经car-t治疗后的前5天,各组肿瘤均出现不同程度的消退,第5天之后,car-t组和mock-dcs联合治疗组肿瘤均恢复生长,而cardf-dcs联合治疗组中肿瘤生长显著消退,第8天时car-t组的肿瘤平均体积156.322mm3,cardf-dcs联合治疗组的肿瘤平均体积39.3334mm3。表8第8天各组肿瘤平均体积(mm3)normaltcar-tcar-t+mock-dccar-t+cardf-dc167.327156.322152.85639.3334由图6中的d和表9可知:car-t组脾脏t细胞同时表达pd-1和tim-3的细胞比例27.0333%,而cardf-dcs治疗组中,比例下降为9.89%。表9各组对应pd-1+tim-3+t细胞比例的平均值normaltcar-tcar-t+mock-dccar-t+cardf-dc18.5527.033317.29.89由图6中的e和表10可知:cardf-dcs治疗组中,肿瘤组织中2型巨噬细胞标记分子cd206的mrna表达水平相对car-t组显著降低。表10各组对应cd206mrna相对表达水平的平均值(normalt组标准化)normaltcar-tcar-t+mock-dccar-t+cardf-dc1.000384.190667.01940.0377096以上数据表明,car-dcs在hu-mice中逆转抑制性的肿瘤微环境为刺激性的状态,从而重新激活了体内耗竭的car-t细胞,促进了实体瘤的消退。7、构建表达cardf的hipscs细胞系及hipsc-cardf-dcs体外试验:hipscs在无血清和无饲养层细胞培养条件下进行维持,使用mtesr1培养基(购自stemcelltechnologies)和matrigel(购自corning)进行培养。hipscs感染前1h更换培养基,感染过程中将先前冻存的慢病毒溶液溶解,以感染复数(moi=5)进行感染,加入适量体积的慢病毒溶液,并加入10ug/mlpolybrene(购自sigmaaldrich)提高感染效率,12h后补充培养基,24小时更换培养基,48h后使用0.5ug/ml嘌呤霉素(购自sigmaaldrich)进行筛选。获得稳定表达cardf的hipscs细胞系,并根据已公开发表的natprotoc.2011march;6(3):296–313.doi:10.1038/nprot.2010.184中的方法,诱导多功能干细胞向dcs分化。采用三步分化法诱导cardf-hipscs向cardf-dcs分化。将op9细胞提前2-3天接种于0.1%明胶(sigmaaldrich)包被的10cm的培养皿上。在op9细胞达到完全汇合后,cardf-hipscs用1mg/ml胶原蛋白酶iv(lifetechnologies)消化成团块,1-1.5×106cardf-hipscs铺到op9细胞层上,并进行分化。共培养的细胞用op9的培养基(mem-α(购自thermofisherscientific)+20%胎牛血清(购自hyclone)+1%青霉素-链霉素)进行培养,并每2天或3天更换一次培养基,在第14-20天时使用0.1%胶原蛋白酶ⅳ和0.05%胰蛋白酶-0.5mmedta以及0.1%dnaseⅰ(stemcell)进行消化并收集细胞。将重悬后的细胞铺在10cm的皿上并在培养箱中放置过夜以去除贴壁的细胞,第二天收集悬浮细胞并用100μm尼龙网(lifetechnologies)进行过滤,获得的细胞经过离心,用含100ng/mlgm-csf的op9培养基在6孔板中进一步培养10-14天,培养基每隔4或5天更换一次。为了产生dcs,使用rpmi-1640完全培养基,添加100ng/mlgm-csf和100ng/mlil-4(peteprch)进一步培养上述扩增的细胞,每2或3天补充含有细胞因子的培养基。为了进一步获得成熟的dcs,在培养基中加入10ng/mltnf-α和3μg/mllps,并持续刺激2-3天。分化后收集细胞进行流式细胞术,检测细胞表面的标记分子。将分化的细胞与celltracecfse染色的初始t细胞共培养,检测t细胞增殖效应。结果见图7。由图7中的a可知:hipscs经转导,表面表达cardf的效率为75.8%。由图7中的b可知:cardf-hipscs能够诱导为dcs的效率为83.5%。由图7中的c和表11可知:hipsc-cardf-dcs刺激同种异体t细胞增殖的效率为85.5%,而hipsc-dcs刺激同种异体t细胞增殖的效率为80.9%。表11各组对应t细胞增殖比例的平均值tcell+ips-dctcell+ips-cardf-dc80.985.5以上数据表明,cardf结构转入hipscs中,不影响分化过程,且分化得到的dcs在体外具有正常的生物学功能,提供了一种现货型cardf-dcs的来源。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。序列表<110>深圳市珈钰生物科技有限公司广东圣赛生物科技有限公司<120>一种嵌合抗原受体、载体、人树突状细胞、细胞系、实体肿瘤治疗药物及制备方法和应用<160>9<170>siposequencelisting1.0<210>1<211>86<212>prt<213>人工序列(artificialsequence)<400>1argtrpproproseralaalacysserglylysgluservalvalala151015ileargthrasnserglnseraspphehisleuglnthrtyrglyasp202530gluaspleuasngluleuaspprohistyrglumetargleulysile354045glnvalarglysalaalailethrsertyrglulysseraspglyval505560tyrthrglyleuserthrargasnglngluthrtyrgluthrleulys65707580hisglulysproprogln85<210>2<211>258<212>dna<213>人工序列(artificialsequence)<400>2cgctggcctccttctgcagcttgttcgggaaaagagtcagttgttgctataaggaccaat60agccaatctgacttccacttacaaacttatggagatgaagatttgaatgaattagatcct120cattatgaaatgcgactgaagatccaagtgcgaaaggcagctataaccagctatgagaaa180tcagatggtgtttacacgggcctgagcaccaggaaccaggagacttacgagactctgaag240catgagaaaccaccacag258<210>3<211>44<212>prt<213>人工序列(artificialsequence)<400>3argtrpproproseralaalacysserglylysgluservalvalala151015ileargthrasnserglnseraspphehisleuglnthrtyrglyasp202530gluaspleuasngluleuaspprohistyrglumet3540<210>4<211>42<212>prt<213>人工序列(artificialsequence)<400>4argleulysileglnvalarglysalaalailethrsertyrglulys151015seraspglyvaltyrthrglyleuserthrargasnglngluthrtyr202530gluthrleulyshisglulysproprogln3540<210>5<211>21<212>prt<213>人工序列(artificialsequence)<400>5metalaleuprovalthralaleuleuleuproleualaleuleuleu151015hisalaalaargpro20<210>6<211>242<212>prt<213>人工序列(artificialsequence)<400>6aspileglnmetthrglnthrthrserserleuseralaserleugly151015aspargvalthrilesercysargalaserglnaspileserlystyr202530leuasntrptyrglnglnlysproaspglythrvallysleuleuile354045tyrhisthrserargleuhisserglyvalproserargphesergly505560serglyserglythrasptyrserleuthrileserasnleuglugln65707580gluaspilealathrtyrphecysglnglnglyasnthrleuprotyr859095thrpheglyglyglythrlysleugluilethrglyglyglyglyser100105110glyglyglyglyserglyglyglyglysergluvallysleuglnglu115120125serglyproglyleuvalalaproserglnserleuservalthrcys130135140thrvalserglyvalserleuproasptyrglyvalsertrpilearg145150155160glnproproarglysglyleuglutrpleuglyvaliletrpglyser165170175gluthrthrtyrtyrasnseralaleulysserargleuthrileile180185190lysaspasnserlysserglnvalpheleulysmetasnserleugln195200205thraspaspthralailetyrtyrcysalalyshistyrtyrtyrgly210215220glysertyralametasptyrtrpglyglnglythrservalthrval225230235240serser<210>7<211>237<212>prt<213>人工序列(artificialsequence)<400>7glnvalglnleuleugluserglyglyglyleuvalglnproglygly151015serleuargleusercysalaalaserglyphethrphesersertyr202530thrmetsertrpvalargglnalaproglyglnalaleuglutrpmet354045glythrileserserargglythrtyrthrtyrtyrproaspserval505560lysglyargphethrileserargaspasnalalysasnserleutyr65707580leuglnmetasnserleuargalagluaspthralavaltyrtyrcys859095alaargglualailephethrhistrpglyargglythrleuvalthr100105110valserserglyglyglyglyserglyglyglyglyserglyglygly115120125glyseraspileglnleuthrglnserproserserleuseralaser130135140valglyaspargvalthrilethrcyslysalaserglnaspileasn145150155160asntyrhissertrptyrglnglnlysproglyglnalaproargleu165170175leuiletyrargalaasnargleuvalaspglyvalproaspargphe180185190serglyserglytyrglythraspphethrleuthrileasnasnile195200205glusergluaspalaalatyrtyrphecysleulystyrasnvalphe210215220protyrthrpheglyglnglythrlysvalgluilelys225230235<210>8<211>45<212>prt<213>人工序列(artificialsequence)<400>8thrthrthrproalaproargproprothrproalaprothrileala151015serglnproleuserleuargproglualacysargproalaalagly202530glyalavalhisthrargglyleuaspphealacysasp354045<210>9<211>24<212>prt<213>人工序列(artificialsequence)<400>9iletyriletrpalaproleualaglythrcysglyvalleuleuleu151015serleuvalilethrleutyrcys20当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1