一种同时检测六种呼吸道病原体的组合物、试剂盒和方法与流程
一种同时检测六种呼吸道病原体的组合物、试剂盒和方法
1.技术领域:本发明属于生物检测技术领域,特别涉及一种同时检测六种呼吸道病原体的组合物、试剂盒和方法。
2.
背景技术:
呼吸道感染性疾病作为儿科常见疾病和多发性疾病,其中80%是由病毒感染引起的,而其他病原体感染相对较少。由于可引发呼吸道感染的病原体种类繁多,患者可能携带不止一种病原体,不同病毒之间以及病毒和细菌之间的临床体征和症状相互重叠,往往使得仅基于临床表现的病因诊断变得困难,无法确定致病原因,导致经常规治疗无效,造成抗生素滥用以及医源性交叉感染,因此需要对呼吸道病原体进行快速的检测,从而帮助诊断和准确用药。
3.流感病毒属于呼吸道病毒,会侵犯呼吸道,引起上呼吸道感染,造成咳嗽、打喷嚏、流鼻涕、发烧等,进一步引起下呼吸道感染,出现支气管炎、肺炎,并可能通过呼吸道进一步侵犯其他的组织器官,引起一系列的并发症,如脑炎、肾炎等。
4.人副流感病毒是呼吸道感染的常见病原体之一,可引起上、下呼吸道感染,如支气管炎、肺炎、喉炎等。hpivs属副粘病毒科,为单股负链rna病毒。根据基因组特征及血清学特点,hpivs分为hpiv1-4四个血清型,其中hpiv-4又分为a和b两种亚型,hpiv-1和3为呼吸道病毒属,hpiv-2和4为腮腺炎病毒。
5.呼吸道合胞病毒(respiratory syncytial virus, rsv)是临床常见的、重要的呼吸道病毒,形态为球形,基因组为线性、不分节段的单链rna,病毒体有包膜,膜上有刺突,由糖蛋白组成,无血凝素和神经氨酸酶。根据病毒表面蛋白抗原的变异,可将rsv分为两种类型:rsv a型和rsv b型。rsv是5岁以下婴幼儿呼吸道感染的最主要病因,此外,rsv还能感染其他各个年龄组的人群,并导致严重的呼吸道疾病,其病情在老年人中尤为严重。
6.人鼻病毒有相应的热敏感性,但加热到50℃-56℃会丧失感染性。人鼻病毒不仅是婴儿和儿童上呼吸道感染的重要病原,还能引起肺炎、细支气管炎、哮喘急性发作。而在成年人中多引起伴有免疫力低下或慢性阻塞性肺疾病患者的下呼吸道感染。人鼻病毒主要通过呼吸道传播,感染后表现为普通感冒,临床症状如头疼、喷嚏、流涕、咽喉肿痛等。症状一般在16h内出现,并在24-48h达到高峰,病程可持续一周。
7.冠状病毒在系统分类上属套式病毒目(nidovirales)冠状病毒科(coronaviridae)冠状病毒属(coronavirus)。该病毒是具有囊膜、基因组为线性单股正链的rna病毒,是自然界广泛存在的一大类病毒。该病毒最初于1937 年从鸡的感染组织中被发现,病毒表面具有如王冠般的钉状突起,最终被确认为新的物种,并因此被命名为冠状病毒;1965,年分离出第一株人冠状病毒;1975年,病毒命名委员会正式命名冠状病毒科。冠状病毒仅感染脊椎动物,如人、鼠、猪、猫、犬、狼、鸡、牛、禽类。
8.近年来,随着病原体分子诊断技术的不断提高,大量商品化试剂盒的使用和全自动检测技术水平的提升,实验室的工作效率得到了极大的提升。核酸扩增检测,已经被证明是一种速度快,灵敏性高,特异性强的检测方法。多重核酸扩增的使用可以显著减少检测操
作时间和成本,并且能够快速得到结果。此外,多重核酸扩增检测能够提供多目标产物的共扩增,从而能够对呼吸道疾病混合感染的预后和复发提供重要信息。
9.传统的检测方法包括血清学检测、抗原检测、病毒分离和电镜检测等,但是上述方法由于检测费时、方法复杂、特异性差、灵敏度低等缺点,临床检测实用性不高。通常实验室使用检测呼吸道病原体的仪器最多只能同时检测四个荧光通道,且部分仪器有通道间的信号干扰,使用前需校准,这一系列缺陷导致在实现快速鉴别目标病原体的方面存在着不少的限制。
10.目前,市面上缺乏针对同时检测六种呼吸道病原菌甲型流感病毒、乙型流感病毒、副流感病毒、呼吸道合胞病毒、鼻病毒和冠状病毒的探针及引物组合物以pcr为基础的分子生物学方法检测六种呼吸道病原菌甲型流感病毒、乙型流感病毒、副流感病毒、呼吸道合胞病毒、鼻病毒和冠状病毒的pcr检测试剂盒。
11.公开于该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域一般技术人员所公知的现有技术。
12.
技术实现要素:
本发明的目的在于提供一种同时检测六种呼吸道病原体的组合物,从而克服上述现有技术中的缺陷。
13.为实现上述目的,本发明提供了一种同时检测六种呼吸道病原体的组合物,包括:如seq1所示的甲型流感病毒的上游引物、如seq2所示的甲型流感病毒的下游引物,和如seq3所示的甲型流感病毒的探针;如seq4所示的乙型流感病毒的上游引物、如seq5所示的乙型流感病毒的下游引物,和如seq6所示的乙型流感病毒的探针;如seq7所示的副流感病毒的上游引物、如seq8所示的副流感病毒的下游引物,和如seq9所示的副流感病毒的探针;如seq10所示的呼吸道合胞病毒的上游引物、如seq11所示的呼吸道合胞病毒的下游引物,和如seq12所示的呼吸道合胞病毒的探针;如seq13所示的鼻病毒的上游引物、如seq14所示的鼻病毒的下游引物,和如seq15所示的鼻病毒的探针;如seq16所示的冠状病毒的上游引物、如seq17所示的冠状病毒的下游引物,如seq18所示的冠状病毒的下游引物,和如seq19所示的冠状病毒的探针。
14.优选地,上述技术方案中,如seq3所示的甲型流感病毒探针的荧光报告基团为fam;如seq6所示的乙型流感病毒探针的荧光报告基团为hex;如seq9所示的副流感病毒探针的荧光报告基团为rox;如seq12所示的呼吸道合胞病毒探针的荧光报告基团为cy5;如seq15所示的鼻病毒探针的荧光报告基团为cy5.5;如seq19所示的冠状病毒探针的荧光报告基团为cy7。
15.一种用于同时检测六种呼吸道病原体的试剂盒,试剂盒包括如前文所述的组合物。
16.优选地,上述技术方案中,还包括pcr反应液、酶混合液、阴性对照和阳性对照;pcr反应液包括缓冲液、mg2+和dntps;酶混合液包括rna酶抑制剂、dna聚合酶;
阳性对照为人工合成的基因;空白对照为灭菌的去rna酶水。
17.优选地,上述技术方案中,组合物中检测引物的浓度为400nm,所述组合物中探针的浓度为200nm ~ 500nm。
18.一种前文所述组合物在制备检测呼吸道病原体的试剂盒中的用途。
19.与现有技术相比,本发明具有如下有益效果:1、本发明提供给的试剂盒操作简便,适应性好、成本较低;2、效率高,单次单管检测在1小时内鉴别一份样本中是否存在甲型流感病毒、乙型流感病毒、副流感病毒、呼吸道合胞病毒、鼻病毒和冠状病毒这六种病毒;3、特异性强,与常见呼吸道的其他病原体无交叉反应;灵敏度高,甲型流感病毒、乙型流感病毒、副流感病毒、呼吸道合胞病毒、鼻病毒和冠状病毒的检出限均为1000copies/ml;本发明对于这六种呼吸道病原体的诊断与临床用药具有较高的参考价值,具有适用于多种样本的优势,适于推广应用。
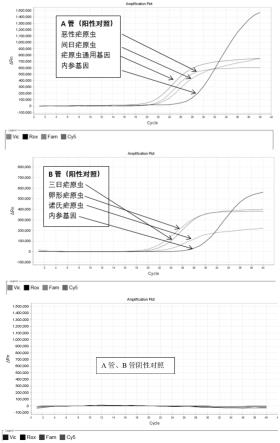
20.附图说明:图1为阳性对照、阴性对照检测的荧光pcr扩增曲线图。
21.图2为检测的甲型流感、乙型流感病毒、副流感病毒、呼吸道合胞病毒、鼻病毒和冠状病毒阳性样本荧光pcr扩增曲线图。
22.图3为特异性分析,分别对阳性腮腺炎病毒、博卡病毒、人偏肺病毒、肺炎衣原体、肺炎支原体、肺炎链球菌和化脓性链球菌等检测。
23.具体实施方式:下面对本发明的具体实施方式进行详细描述,但应当理解本发明的保护 范围并不受具体实施方式的限制。
24.除非另有其它明确表示,否则在整个说明书和权利要求书中,术语“包 括”或其变换如“包含”或“包括有”等等将被理解为包括所陈述的元件或 组成部分,而并未排除其它元件或其它组成部分。
25.本发明的目的在于提供一组用于快速鉴定六种呼吸道病原菌甲型流感病毒、乙型流感病毒、副流感病毒、呼吸道合胞病毒、鼻病毒和冠状病毒的特异性引物和探针,及一种用实时荧光pcr技术快速鉴定六种呼吸道病原菌甲型流感病毒、乙型流感病毒、副流感病毒、呼吸道合胞病毒、鼻病毒和冠状病毒的应用。本鉴定方法方便快捷、价格低廉,适于推广应用,为六种呼吸道病原菌甲型流感病毒、乙型流感病毒、副流感病毒、呼吸道合胞病毒、鼻病毒和冠状病毒提供临床辅助诊断。
26.为达到上述目的,本发明所采用的技术方案如下:本发明根据甲型流感病毒、乙型流感病毒、副流感病毒、呼吸道合胞病毒、鼻病毒和冠状病毒各基因组的特异性设计了12条特异性引物和6条探针,利用实时荧光pcr扩增技术根据不同通道的扩增曲线来区分甲型流感病毒、乙型流感病毒、副流感病毒、呼吸道合胞病毒、鼻病毒和冠状病毒。病原体及各探针(probe)的组合:
27.用于快速鉴定甲型流感病毒、乙型流感病毒、副流感病毒、呼吸道合胞病毒、鼻病毒和冠状病毒的特异性引物和探针,包括:(1)扩增甲型流感的引物探针,优选的引物探针浓度分别为400nm、400nm、200nm,序列如下:引物seq1:5
’‑
catggaatggctaaagaca-3’;引物seq2:5
’‑
gcgtgaacacaaatccta
‑ꢀ3’
;探针seq3(fam荧光标记):5’fam-accaatcttgtcacctctgactaagg
ꢀ‑3’
;(2)扩增乙型流感病毒的引物探针,优选的引物探针浓度分别为400nm、400nm、400nm,序列如下:引物seq4:5
’‑
tggtctcagctatgaacac-3’;引物seq5:5
’‑
gttgctttgcagctcttc-3’;探针seq6(hex荧光标记):5’hex-cgtcttctccttttcccattccattca-3’;(3)扩增副流感病毒的引物探针,优选的引物探针浓度分别为400nm、400nm、200nm,序列如下:引物seq7:5
’‑
ctcacacaattaatagagaagtca-3’;引物seq8:5
’‑
gtctgcatggtgaatagc-3’;探针seq9(rox荧光标记):5’rox-tgttctcgcatatctgagccaattcctg-3’;(4)扩增呼吸道合胞病毒的引物探针,优选的引物探针浓度分别为400nm、400nm、500nm,序列如下:引物seq10:5
’‑ꢀ
gatcaacttctgtcatccagcaaa
ꢀ‑3’
;引物seq11:5
’‑ꢀ
tgtgtttctgcacatcataattagga
ꢀ‑3’
;探针seq12(cy5荧光标记):5’cy5
‑ꢀ
acaccatccaacggagcacaggaga
ꢀ‑3’
;(5)扩增鼻病毒的引物探针,优选的引物探针浓度分别为400nm、400nm、200nm,序列如下:引物seq13:5
’‑ꢀ
tagtctggtcgatgaggctgaga
ꢀ‑3’
;引物seq14:5
’‑ꢀ
attaaggcgtcccagcatagg
ꢀ‑3’
;探针seq15(cy5.5荧光标记):5
’ꢀ
cy5.5
‑ꢀ
accgtgtctcagcctgcgtggc
ꢀ‑3’
;(6)冠状病毒的引物探针,优选的引物探针浓度分别为400nm、400nm、200nm,序列如下:引物seq16:5
’‑ꢀ‑3’
;ggtatwaattacttgggta引物seq17:5
’‑ꢀ‑3’
;gtgagtaagtactcagattcat引物seq18:5
’‑ꢀ‑3’
;taggaagacaactggatagga
探针seq19(cy7荧光标记):5
’ꢀ
cy7
‑ꢀ‑3’
;atgcaygccaaytatatattttggag本发明还提供一种基于实时荧光rt-pcr的甲型流感病毒、乙型流感病毒、副流感病毒、呼吸道合胞病毒、鼻病毒和冠状病毒核酸检测的试剂盒,包括上述的甲型流感病毒、乙型流感病毒、副流感病毒、呼吸道合胞病毒、鼻病毒和冠状病毒的引物和探针的组合物。还包括pcr反应液、酶混合液、阴性对照和阳性对照。pcr反应液包括缓冲液、mg2+和dntps。酶混合液包括rna酶抑制剂、dna聚合酶。阳性对照为人工合成的基因。空白对照为灭菌的去rna酶水。
28.一种同时检测甲型流感病毒、乙型流感病毒、副流感病毒、呼吸道合胞病毒、鼻病毒和冠状病毒的实时荧光pcr检测试剂盒,具体使用操作步骤如下:(1)模板rna的提取:提取待检样品的rna,可使用以下提取试剂,硕世生物公司的病毒核酸提取试剂盒(货号:sdk60102、sdk60103、sdk60104、sdk60105),凯杰公司的qiaamp viral rna mini kit(货号:52904、52906)提取试剂盒提取核酸,按试剂盒说明书操作。
29.(2)实时荧光pcr扩增反应:将上述反应管于实时荧光pcr仪按照
①
55℃
×
5min(1cycle);
②
95℃
×
1min(1cycle);
③
95℃
×
3sec,55℃
×
15sec(45cycles,55℃采集荧光,荧光通道选择fam、hex、rox、cy5、cy5.5、cy7)。
30.(3)结果判断:根据实时荧光pcr扩增曲线进行结果判断。阳性,检测结果ct≤35,扩增曲线应呈典型s形且具有明显的指数增长期;阴性:检测结果ct>38或未检出为阴性;疑似:35<ct≤38,需重复检测,ct值仍在此区间且曲线呈标准s型且有明显指数增长期,则判断为阳性,否则判断为阴性。
31.阳性对照阳性、阴性对照阴性的条件下,fam通道阳性为甲型流感、hex通道阳性为乙型流感病毒、rox通道阳性为副流感病毒、cy5通道阳性为呼吸道合胞病毒,cy5.5通道阳性为鼻病毒、cy7通道阳性为内标冠状病毒。
32.实施例1:引物、探针的设计:通过ncbi查找甲型流感病毒基因、乙型流感病毒基因、副流感病毒基因、呼吸道合胞病毒基因、鼻病毒基因、冠状病毒基因的基因组序列,通过primerexpress3.0.1进行序列比对,bioedit设计引物和探针,blast确认引物探针特异性,得到甲型流感病毒、乙型流感病毒、副流感病毒、呼吸道合胞病毒、鼻病毒和冠状病毒的引物和探针。
33.实施例2:模板rna的提取一、标本的采集适用样本类型为咽拭子等样本。
34.咽拭子样本采集按照《临床护理实践指南》(2011版)中关于咽拭子采集法进行采集。采集病人发病3日内的咽拭子样本,用专用采样棉签,棉签材质为脱脂棉和木棒。用压舌板轻压舌部,迅速用棉签擦拭患者口腔两侧腭弓及咽、扁桃体的分泌物,避免咽拭子触及其他部位;迅速将棉签放入装有3~5ml生理盐水的采集管中,在靠近顶端处折断棉签杆,旋紧管盖密封,以防干燥。
35.二、标本的保存用于病毒分离和核酸检测的标本应尽快进行检测,能在24小时内检测的标本可置于4℃保存;24小时内无法检测的标本则应置于-70℃或以下保存(如无-70℃保存条件,则于-20℃冰箱暂存)。标本采集后应尽快送往实验室,如果需要长途运输标本,建议采用干冰
等制冷方式进行保藏。
36.三、标本的运输1.运输温度和时间:置于-20℃或-20℃以下冷冻保存并运输,尽量缩短运输时间。
37.2.运输方式:可采用陆路、水路或航空等多种运输方式,但在运输过程中应采取保护措施,避免强烈震动、重力挤压等现象,并且要注意防火、防盗。
38.按照上述方法采集好的标本按照核酸提取试剂盒说明书进行提取,可使用以下提取试剂,硕世生物公司的病毒核酸提取试剂盒(货号:sdk60102、sdk60103、sdk60104、sdk60105),凯杰公司的qiaamp viral rna mini kit(货号:52904、52906)提取试剂盒提取核酸。
39.实施例3:引物探针反应液和试剂盒反应液的配制(1)引物探针反应液的配制:
40.(2)试剂盒反应液的配制:名称体积(μl/test)pcr反应液7.5酶混合液5引物探针反应液7.5总体积20
41.实施例4:扩增程序
(1)55℃
×
5min。1cycle;(2)95℃
×
1min。1cycle;(3)95℃
×
3sec,55℃
×
15sec;45cycles,55℃采集荧光,荧光通道选择fam、hex、rox、cy5、cy5.5、cy7)。
42.实施例5:结果判断在仪器正常,阳性对照和空白对照均正常的情况下进行结果分析:对于检测结果判读(fam通道为甲型流感病毒,hex通道为乙型流感病毒,rox通道为副流感病毒,cy5通道为呼吸道合胞病毒,cy5.5通道为鼻病毒,cy7通道为冠状病毒)。
43.。
44.实施例6:对阳性腮腺炎病毒、博卡病毒、人偏肺病毒、肺炎衣原体、肺炎支原体、肺炎链球菌和化脓性链球菌等检测,检测结果如表1所示,荧光pcr扩增曲线图如图3所示。
45.表1:特异性分析样本名称检测结果样本名称检测结果腮腺炎病毒阴性肺炎支原体阴性博卡病毒阴性肺炎链球菌阴性人偏肺病毒阴性化脓性链球菌阴性肺炎衣原体阴性
ꢀꢀ
46.基于实时荧光pcr的甲型流感、乙型流感病毒、副流感病毒、呼吸道合胞病毒、鼻病毒和冠状病毒的最低检出限的确认。对甲型流感、乙型流感病毒、副流感病毒、呼吸道合胞病毒、鼻病毒和冠状病毒不同浓度阳性质粒进行检测。
47.表2:甲型流感最低检出限确认质粒浓度(copies/ml)检测重复数检测阳性数阳性检出率1020420.0%
100201680.0%10002020100.0%100002020100.0%
48.表3:乙型流感病毒最低检出限确认质粒浓度(copies/ml)检测重复数检测阳性数阳性检出率1020525.0%100201365.0%10002020100.0%100002020100.0%
49.表4:副流感病毒最低检出限确认质粒浓度(copies/ml)检测重复数检测阳性数阳性检出率1020210.0%10020840.0%10002020100.0%100002020100.0%
50.表5:呼吸道合胞病毒最低检出限确认质粒浓度(copies/ml)检测重复数检测阳性数阳性检出率1020210.0%10020840.0%10002020100.0%100002020100.0%
51.表6:鼻病毒最低检出限确认质粒浓度(copies/ml)检测重复数检测阳性数阳性检出率1020210.0%10020840.0%10002020100.0%100002020100.0%
52.表7:冠状病毒最低检出限确认质粒浓度(copies/ml)检测重复数检测阳性数阳性检出率1020210.0%10020945.0%10002020100.0%100002020100.0%
53.前述对本发明的具体示例性实施方案的描述是为了说明和例证的目的。这些描述并非想将本发明限定为所公开的精确形式,并且很显然,根据上述教导,可以进行很多改变和变化。对示例性实施例进行选择和描述的目的在于解释本发明的特定原理及其实际应用,从而使得本领域的技术人员能够实现并利用本发明的各种不同的示例性实施方案以及各种不同的选择和改变。本发明的范围意在由权利要求书及其等同形式所限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1