与花生种皮颜色相关的KASP分子标记及其应用
与花生种皮颜色相关的kasp分子标记及其应用
技术领域
1.本发明涉及分子遗传学技术领域,具体涉及一种与花生种皮颜色相关的kasp分子标记及其应用。
背景技术:
2.花生(arachis hypogaea l.)是重要的蛋白和食用油原料,也是重要的休闲保健食品。根据花生籽仁外种皮颜色不同,可划分为粉色、红色、紫色、黑色、紫黑、紫红、红白、彩粒等,花生种子颜色影响品种的商业价值和营养价值,因此,选育特定种子颜色的花生品种成为育种家的重要目标。
3.花生种皮颜色差异与花青素含量有关,花青素等黄酮类化合物的生物合成包括许多酶促反应,由多个酶基因调控,最终影响花青素的合成与转化。由于花生属于地下结果,在生育期无法快速鉴定花生种子颜色,需要收获考种时才能确定种子颜色,增加了育种工作量。近年来广泛应用的分子标记则可以在幼苗期进行辅助选择,及时剔除非目标性状材料,可极大的提高筛选效率。因此开发与花生种子颜色紧密连锁的分子标记,以辅助多色花生品种改良,可有效提高花生育种效率、缩短育种年限。
4.目前,推广应用最广的花生品种以粉色和深红色为主,筛选能够快速鉴别两种种皮颜色的分子标记是加速育种进程的关键。
5.单核苷酸多态性(snp)是由某一特定区域的核苷酸序列因单个碱基的变异而引起的遗传多态性。snp应用于花生的分子标记属于起步阶段,仅有少数报道。唐月异等(2010年)从花生栽培种基因组dna的测序数据中获得了5496个候选snp位点,平均每27.86bp就出现一个候选snp位点,因此花生基因组序列候选snp表现出较高的频率。另外,通过分析85979条栽培花生est序列,发现snp的出现频率为4.71%。但目前对于花生snp标记功能性的研究极少。
6.kompetitive allele specific pcr(kasp)标记技术通过荧光探针,可以将snp标记的不同等位变异区分,并且kasp技术通量高、快速、稳定,是一种较为理想的分子标记。kasp技术是目前常见的一种鉴定snp位点的技术,但用于鉴定与花生种皮颜色相关的snp的kasp技术还很少见有报道。
技术实现要素:
7.针对上述现有技术,本发明的目的是提供一种与花生种皮颜色相关的kasp分子标记及其应用。本发明研究发现,花生种皮颜色(peanut testa color)基因ahptc12在外显子区域有一snp位点,该snp位点与花生种皮颜色相关;基于该snp位点,本发明开发了与花生种皮颜色相关的kasp分子标记,利用该kasp分子标记可以准确的对粉色种皮和深红色种皮的花生进行基因分型。通过本发明的方法可以在花生苗期进行辅助选择,能够快速、准确区分粉色和深红色种皮的花生,可有效提高花生育种效率、缩短育种年限。
8.为实现上述目的,本发明采用如下技术方案:
9.本发明的第一方面,提供检测特异snp的物质在鉴定或辅助鉴定花生种皮颜色中的应用;
10.所述特异snp为花生基因组12号染色体上第117190528位核苷酸;所述特异snp为g/a多态。
11.优选的,所述鉴定或辅助鉴定的花生种皮颜色为粉色和/或深红色。
12.本发明的第二方面,提供检测特异snp的物质在花生育种中的应用;所述特异snp为花生基因组12号染色体上第117190528位核苷酸;所述特异snp为g/a多态。
13.本发明的第三方面,提供一种检测特异snp的kasp分子标记引物组,包括:seq id no.5所示的第一等位特异引物、seq id no.6所示的第二等位特异引物和seq id no.7所示的通用引物。
14.所述特异snp为花生基因组12号染色体上第117190528位核苷酸;所述特异snp为g/a多态。
15.本发明的第四方面,提供上述kasp分子标记引物组在如下(1)或(2)中的应用:
16.(1)鉴定或辅助鉴定花生种皮颜色;
17.(2)花生育种。
18.优选的,所述鉴定或辅助鉴定的花生种皮颜色为粉色和/或深红色。
19.本发明的第五方面,提供一种鉴定或辅助鉴定花生种皮颜色的方法,包括以下步骤:
20.检测待测花生基于特异snp的基因型;gg基因型花生的种皮为粉色,aa基因型花生的种皮为深红色;
21.所述特异snp为花生基因组12号染色体上第117190528位核苷酸;所述特异snp为g/a多态。
22.优选的,采用上述kasp分子标记引物组检测待测花生基于特异snp的基因型。
23.优选的,检测的pcr反应程序为:94℃预变性15min;94℃变性10s,61-55℃梯度退火60s,每个循环降低0.6℃,10个循环;94℃变性20s,55℃退火延伸60s,26个循环。
24.本发明的第六方面,提供一种花生育种的方法,包括如下步骤:
25.在花生苗期检测花生基于特异snp的基因型;gg基因型花生的种皮为粉色,aa基因型花生的种皮为深红色;根据育种目标选择相应基因型的花生苗;
26.所述特异snp为花生基因组12号染色体上第117190528位核苷酸;所述特异snp为g/a多态。
27.本发明的有益效果:
28.(1)本发明筛选出了区分花生粉色和深红色种子颜色的snp,该snp为花生12号染色体上第117190528位核苷酸g
→
a。
29.(2)利用该snp开发出了kasp标记,通过该kasp标记可以准确的对粉色和深红色花生进行基因分型。利用该发明方法可以在花生苗期进行辅助选择,能够快速、准确区分粉色和深红色花生,可有效提高花生育种效率、缩短育种年限。
附图说明
30.图1:山花15号和中花12种子颜色对比。
31.图2:ril群体lb(山花15号
×
中花12)种皮颜色。
32.图3:ril群体lf(白沙1016
×
icgv86699)亲本及部分家系种子颜色。
33.图4:检测花生种子颜色的snp位点。
34.图5:基于kasp技术的花生ahptc12基因分型结果。
具体实施方式
35.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
36.正如背景技术部分所介绍的,筛选能够快速鉴别花生种皮颜色的分子标记是加速花生育种进程的关键。虽然花生基因组序列候选snp出现频率较高,但是,对于花生snp标记功能性的研究极少。
37.花生种皮颜色差异与花青素含量有关,花青素等黄酮类化合物的生物合成包括许多酶促反应,由多个酶基因和转录因子调控,最终影响花青素的合成与转化,目前有关花生种皮花青素的代谢途径研究较少,控制花青素合成与转化的关键基因尚不清楚;同时,栽培花生是异源四倍体(2n=4x=40,aabb),基因组大小为2.7gb,结构复杂,通过群体基因定位寻找花生种皮颜色相关的snp具有较大难度,通过单个snp进行花生种子颜色的筛选也未见有报道。
38.花生ahptc12基因是影响花生种皮颜色的候选基因。本发明在对粉色亲本品种
‘
山花15号’和深红色亲本
‘
中花12’的ahptc12基因进行cdna测序(
‘
山花15号’的cdna序列如seq id no.1所示,编码蛋白的氨基酸序列如seq id no.2所示;
‘
中花12’的cdna序列如seq id no.3所示,编码蛋白的氨基酸序列如seq id no.4所示),发现该基因在外显子区域有一snp位点,该snp位点位为花生基因组(https://www.peanutbase.org/peanut_genome/)12号染色体上第117190528位核苷酸g
→
a(对应于seq id no.1和seq id no.3所示cdna序列的第611位核苷酸)。
39.kasp标记开发的前提是对控制相关性状的基因进行准确定位,并挖掘snp。如果挖掘的snp位点附近重复序列过多、gc含量过高或过低,则不适合设计引物;同时,kasp标记设计的正向引物末端必须是snp突变位点,设计引物时受到局限,影响引物质量,可能出现非特异性扩增,导致分型失败。经验证,该处snp位点满足kasp标记开发的要求:临近无其他snp位点,位于非snp密集区域,避免连续at、gc含量高等序列复杂区域。
40.利用该snp位点开发kasp标记,本发明设计两条等位特异引物和一条通用引物。
41.等位引物1:下划线部分为fam荧光标签序列
42.gaaggtgaccaagttcatgctatcatcggcagctgcagtgac;(seq id no.5)
43.等位引物2:下划线部分为hex荧光标签序列
44.gaaggtcggagtcaacggattcatcatcggcagctgcagtgat;(seq id no.6)
45.通用引物:ccaaacctgtcccattgagttggtt。(seq id no.7)
46.利用开发的kasp标记,对基因型纯合的两个高世代ril群体及亲本共452个材料进行进行kasp标记验证,两个ril群体的颜色性状为粉色和深红色(具体表型结果见表1)。提取群体材料的dna作为扩增模板,使用开发的kasp引物进行pcr扩增,扩增结束后放置到
omega荧光信号阅读仪和araya上将荧光信号转变为可分析的数值,然后用lgc公司提供的分析软件krakentm进行基因型分析。检测分型结果显示,粉色种子家系和深红色种子家系能够准确分型,准确率为100%。
47.为了使得本领域技术人员能够更加清楚地了解本技术的技术方案,以下将结合具体的实施例详细说明本技术的技术方案。
48.本发明实施例中所用的试验材料均为本领域常规的试验材料,均可通过商业渠道购买得到。未注明详细条件的实验方法是按照常规试验方法或按照供应商所建议的操作说明书进行的。
49.本发明中采用的花生栽培品种有山花15号、白沙1016、中花12和icgv86699;其中,中花12和icgv86699来自中国农科院油料作物研究所,山花15号、白沙1016以及ril群体lf(白沙1016
×
icgv86699)、lb(山花15号
×
中花12)来自山东农业大学。
50.山花15号和中花12种子颜色对比如图1所示;ril群体lb(山花15号
×
中花12)种皮颜色如图2所示;ril群体lf(白沙1016
×
icgv86699)亲本及部分家系种子颜色如图3所示。
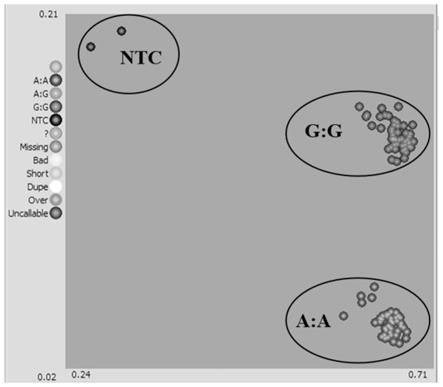
51.本发明中花生种皮颜色是依据《花生种质资源描述规范和数据标准》(姜慧芳,段乃雄.花生种质资源描述规范和数据标准[m].北京:中国农业出版社,2006)进行颜色判别。
[0052]
实施例1:花生ahptc12基因cdna的克隆测序
[0053]
对提取的rna进行电泳检测,检测合格后进行后续实验。
[0054]
1.1cdna第一链的合成(使用fermentas公司的revertaid first strand cdna synthesis kit)
[0055]
在无rna酶的pcr管中加入1μg的总rna,和1μl的100μm的oligo(dt)引物,并用depc处理过的灭菌水加至体积12μl;将上述混合液于65℃处理5分钟,然后在冰上立即冷却1分钟;然后再在反应液中依次加入4μl 5x reaction buffer、1μl ribolock rnase inhibitor(20u/μl)、2μl 10mm dntp mix、1μl revertaid m-mulv reverse transcriptase(200u/μl);将其轻轻混匀,并短暂离心;在pcr仪上42℃孵育1个小时;70℃孵育5分钟结束反应。
[0056]
1.2ahptc12基因的扩增
[0057]
引物序列由生工生物工程(上海)股份有限公司进行合成,序列如下:
[0058]
ahanr-f:5
’‑
atggctagcatcgagaacc-3’;(seq id no.8)
[0059]
ahanr-r:5
’‑
ctagttcttgagggcacc-3’。(seq id no.9)
[0060]
pcr扩增体系:总体系50μl,包括pcr-grade water:15.0μl,2
×
pcr buffer for kod fx neo:25.0μl,dntp mix(10mm):1.0μl,kod fx neo(1u/μl):1.0μl,cdna第一链:5.0μl,primer f(10x):1.5μl,primer r(10x):1.5μl。
[0061]
pcr反应程序:98℃预变性5min;98℃变性30s,55℃梯度退火30s,72℃延伸1.5min,35个循环;72℃后延伸10min。
[0062]
1.2琼脂糖凝胶回收:
[0063]
将琼脂糖凝胶电泳后从琼脂糖凝胶中切下的目的条带胶块放入干净的离心管中,称取重量;向胶块中加入3倍体积溶胶液,50-55℃水浴放置10min,期间不断温和地上下翻转离心管,以确保胶块充分溶解。将上一步所得溶液加入一个吸附柱中,12000rpm离心30-60秒,倒掉收集管中的废液,将吸附柱重新放入收集管中;向吸附柱中加入600μl漂洗液,
12000rpm离心1min,弃废液,将吸附柱放入收集管中;向吸附柱中加入600μl漂洗液,12000rpm离心1min,弃废液,将吸附柱放入收集管中;12000rpm离心2min,尽量除去漂洗液,将吸附柱敞口置于室温或50℃温箱放置数分钟,将吸附柱中残余的漂洗液去除,防止漂洗液中的乙醇影响后续的实验;将吸附柱放入一个干净的离心管中,向吸附膜中央悬空滴加适量经65℃水浴预热的洗脱液,室温放置2min,12000rpm离心1min;回收产物-20℃保存。
[0064]
1.3连接与转化:
[0065]
使用takara公司的t4连接酶试剂盒,10μl反应体系:pmd-18vector:1.0μl,pcr回收产物:7.0μl,t4 ligase buffer:1.0μl,t4 dna ligase:1.0μl,4℃连接过夜。从-80℃冰箱中取100μl感受态细胞悬液,冰上解冻;加入连接产物10μl,轻轻弹匀,冰上放置25分钟后;42℃水浴中热击45秒,热击后迅速置于冰上冷却2分钟;向管中加入0.6ml lb液体培养基(不含氨苄青霉素),混匀后37℃振荡培养1小时,使细菌恢复正常生长状态,并表达质粒编码的抗生素抗性基因;将上述菌液摇匀后取100μl涂布于含amp的筛选平板上,正面向上放置半小时,待菌液完全被培养基吸收后倒置培养皿,37℃培养16-24小时。
[0066]
1.4阳性克隆的鉴定与筛选
[0067]
用经灭菌的牙签随机挑选24个圆润、单一的白色菌落转入装有300μl氨苄青霉素培养液的ep管中,37℃培养8小时;阳性克隆鉴定50μl pcr反应体系:takara taq(5u/μl):0.28μl,10
×
pcr buffer(mg
2+
plus):5.0μl,dntp mixture(各2.5mm):4.0μl,被检测菌液:2.5μl,m13f(20μm):1.0μl,m13r(20μm):1.0μl,灭菌蒸馏水:36.25μl。pcr反应程序:94℃预变性2min;94℃变性10s,55℃梯度退火30s,68℃延伸1.0min,35个循环;68℃后延伸10min。
[0068]
根据电泳图检测的dna条带大小,挑出符合预期大小的克隆,送往生工生物工程(上海)股份有限公司测序。利用dnaman软件进行序列比对分析,结果表明,山花15号和中花12的ahptc12基因存在1个变异位点,该snp为花生12号染色体上第117190528位核苷酸g
→
a(图4)。
[0069]
实施例2:与花生种子颜色相关kasp标记开发
[0070]
选用粉色种子花生品种山花15号和白沙1016,深红色种子花生品种中花12和icgv86699开发kasp标记。
[0071]
利用实施例1中检测到的snp位点开发kasp标记,设计两条等位特异引物和一条通用引物。
[0072]
等位引物1:下划线部分为fam荧光标签序列
[0073]
gaaggtgaccaagttcatgctatcatcggcagctgcagtgac;
[0074]
等位引物2:下划线部分为hex荧光标签序列
[0075]
gaaggtcggagtcaacggattcatcatcggcagctgcagtgat;
[0076]
通用引物:ccaaacctgtcccattgagttggtt。
[0077]
采用ctab法提取花生叶片dna,分光光度计测定dna样品的纯度和浓度,a260/280:1.8-2.2,260/230》=2.0;将dna稀释为50-100ng/μl。
[0078]
kasp检测pcr反应体系:dna:0.8μl,2
×
master mix:0.4μl,引物:0.022μl,h2o:0.4μl。
[0079]
kasp检测pcr反应程序:94℃预变性15min;94℃变性10s,61-55℃梯度退火60s,每个循环降低0.6℃,10个循环;94℃变性20s,55℃退火延伸60s,26个循环。
[0080]
kasp荧光信号的读取
[0081]
待kasp检测pcr反应程序结束后,将96孔板或tape分别放置到omega荧光信号阅读仪和araya上将荧光信号转变为可分析的数值,然后用lgc公司提供的分析软件krakentm进行基因型分析。
[0082]
基于kasp技术的花生ahptc12基因分型结果如图5所示,图中右上角的分型结果为gg,对应的材料种皮颜色为粉色,图中右下角的分型结果为aa,对应的材料种子颜色为深红色。可见利用该snp标记可用于区分粉色和深红色花生种子。
[0083]
检测结果显示:本发明开发的kasp标记能够将粉色和深红色种子花生品种进行分型,基因型g:g的为粉色种子品种,基因型a:a的为深红色种子品种。
[0084]
实施例3:snp分子标记与花生种子颜色性状的关联度分析
[0085]
用本发明的snp验证了山东农业大学两个花生高世代ril群体共计452个材料,dna提取、kasp技术反应体系同实施例2;基因分型和表型统计结果见表1。
[0086]
表1:鉴定花生种子颜色材料的分型结果
[0087]
[0088]
[0089]
[0090][0091]
由表1可以看出,有两个家系基因型为杂合a:g,表型为粉色种子,其他基因型g:g的为粉色种子品种,基因型a:a的为深红色种子品种。结果表明:该分子标记用于鉴定粉色/深红色种子花生的准确为100%。
[0092]
以上所述仅为本技术的优选实施例而已,并不用于限制本技术,对于本领域的技术人员来说,本技术可以有各种更改和变化。凡在本技术的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1