结核分枝杆菌融合蛋白LT29构建及其表达纯化方法和应用
本发明涉及生物工程领域,尤其是应用基因工程的方法进行新型结核亚单位疫苗的构建。
背景技术:
结核分枝杆菌(mtb)是结核病的病原体,是人类病原体中最能适应人体环境的一种,它可以以潜伏状态在人体巨噬细胞内长时间存活。据估计,全球有三分之一的人口存在结核分枝杆菌潜伏感染,其中这一人群中有10%的人口在免疫功能低下时由潜伏期结核进展为活动性结核。对于结核病的控制策略很大程度上依赖于疾病的诊断和至少三种不同抗痨药物长期的治疗。但这导致了多重耐药结核的不断发展。另外,由于艾滋病病毒的流行,并发的结核分枝杆菌感染也逐渐成为亟待解决的问题。全球结核病对公共卫生健康的影响日益严重,迫切需要研制一种新的抗结核疫苗。
目前所使用的结核疫苗卡介苗(bcg),自1921年开始应用于临床,是一种减毒牛结核分枝杆菌活疫苗。研究证实,它能够有效预防新生儿和儿童患严重的脑膜结核及全身粟粒性结核病,但是不能有效的防止成人肺结核的发生。继bcg疫苗应用80多年以来,全球尚未研制出有效的新型抗结核疫苗。因此,为了在全球范围内彻底消灭结核病,我们迫切需要研制更为有效的结核病新型疫苗。
目前,新型结核疫苗主要分为两类,一类是替代型疫苗,如重组bcg、结核菌减毒株及非致病性分支杆菌疫苗等;另一类是加强型亚单位疫苗,如蛋白疫苗、dna疫苗、灭活的全细胞疫苗等。由于bcg对成人保护效果不好的原因主要是其保护效果随着免疫人群年龄的增加逐渐减退,因此用亚单位疫苗在儿童或青年期对bcg免疫后的人群进行加强免疫,进而增强并延长bcg保护效果的疫苗研究策略是合理并切合实际的。
亚单位疫苗能够表达具有免疫原性的mtb抗原,适合用于加强bcg的保护效应。亚单位疫苗是目前的研究热点,已有众多亚单位疫苗进入临床试验,如mva85a和m72已进入临床ⅱb期,h4/ic31、ad35/aeras-402、h1/h56/ic31、vpm1002进入了临床ⅱa期。这些疫苗大多只采用了结核分枝杆菌生长期的抗原如ag85b、esat-6、tb10.4等,很少采用潜伏期抗原,具有一定的局限性。而有研究证实,切实有效的结核病疫苗不但要对活动期结核病具有保护作用,而且要能够针对潜伏期结核菌起作用,才能更好的预防结核病发生。因此,理想的结核亚单位疫苗必须融合结核分枝杆菌活动期及潜伏期的多个抗原。
esat-6(earlysecretoryantigenictarget6,早期分泌抗原靶6)是mtb生长早期分泌的抗原,是结核菌的毒力因子之一。编码esat-6的基因rv3875存在于bcg缺失的rd1区,该基因仅存在于致病性的分枝杆菌中,而在bcg和非致病性的分枝杆菌中缺失,因此选择esat-6作为构建融合蛋白可以有效补充bcg的抗原缺失。同时,esat-6有多个cd4+t细胞表位和cd8+t细胞表位,可被t淋巴细胞特异性识别,促进th1细胞增殖,在人体诱导强烈的th1型免疫应答并产生特异性的细胞毒性t细胞。
rv2626c是结核菌潜伏期优势表达的保护性抗原之一,目前其功能尚未研究清楚,研究发现该基因在活动性结核患者的单个核细胞中可以诱导表达高水平的ifn-γ。此外有研究发现rv2626c也可使mtb进入休眠状态,使得结核菌能够逃避宿主对其的杀伤作用。该基因的抗体水平在活动期与休眠期也有显著差别,可以作为鉴别mtb在宿主体内的感染状态的血清学标志。
本发明利用基因工程的方法将east6蛋白和rv2626c蛋白在基因水平进行接合,构建了新的融合蛋白lt29,希望该融合蛋白和佐剂联合构建新型结核亚单位疫苗,后期成为有效的结核病候选疫苗。
技术实现要素:
本发明提供了一种融合了结核菌活动期抗原east6和结核菌潜伏期抗原rv2626c的新型融合蛋白lt29,并提出了该融合蛋白的构建表达纯化方法。
本发明所提供的新型融合蛋白lt29和佐剂进行联合构建结核亚单位疫苗,该疫苗可在小鼠体内诱导较强的细胞免疫应答并促进记忆性t细胞的产生,后期有望成为更为有效的结核病新型候选疫苗。
本发明的技术方案为:
运用基因工程的方法构建融合蛋白lt29表达质粒pet30a(+)-lt29。
首先构建pet30a-rv2626c质粒,然后在rv2626c基因前面插入esat6基因即可。
1.构建pet30a-rv2626c质粒
设计引物扩增rv2626c基因片段。引物分别为:上游(5’-3’
2.构建重组基因载体pet30a(+)-lt29(esat6-linker-rv2626c)。
通过genebank查找mtbh37rv菌株中的esat6的基因序列(esat6基因的碱基序列长285bp),使用primerpremier软件设计引物。为了使esat6与rv2626c两个蛋白在空间结构上不互相影响,因此在esat6下游引物中加入一段linker(ggggs)3,上下游引物序列如下。
上游引物:
下游引物:
以pet30a(+)-rv2626c质粒为载体,用上述两条引物,pcr扩增出east6-linker基因产物。该pcr产物经纯化后,用ndeⅰ和sacⅰ进行双酶切,克隆构建在质粒pet30(+)a-rv2626c上,构建成pet30a(+)-lt29(esat6-linker-rv2626c)载体。
3.新型融合蛋白lt29的表达方法
将上述构建成功的pet30a(+)-lt29(esat6-linker-rv2626c)载体转化入表达载体大肠杆菌e.colibl21(de3)中。活化表达eammh蛋白的e.colibl-21(de3)菌体,取1ml活化后菌体加入200mllb培养基中37℃震荡培养4h;加入蛋白诱导剂iptg(1.0mmol/l)100ul,29℃诱导振荡培养12h;4℃10000g离心10min收集菌体;菌体重悬于pb缓冲液(na2hpo4·12h2o20mmol/l,na2hpo4·12h2o20mmol/l,ph7.4)10ml/g湿菌,冰浴下超声破碎细菌0.5h(180~200w,超声3s停3s);10000g离心15min后分别收集上清和沉淀,将上清和沉淀分别进行聚丙烯酰胺凝胶电泳;经sds-page电泳分析,与e.colibl21(de3)空菌相比,分子量在29kd左右有明显的特异蛋白表达条带,以上清形式表达为主,沉淀中蛋白相对较少。
4.新型融合蛋白lt29的纯化方法
大量表达融合蛋白lt29,收集的菌体重悬于20mmpb缓冲液中,冰浴下超声破碎0.5h左右,4℃/10000g离心10min,离心后收集含lt29蛋白的上清;上清用0.45um滤器过滤。首先,将该融合蛋白用体积分数30%的饱和硫酸铵溶液进行盐析;然后,盐析出的蛋白用pb缓冲液(na2hpo4·12h2o20mmol/l,na2hpo4·12h2o20mmol/l,ph7.4)进行重悬;随后,将所收取的融合蛋白进行疏水层析,选用疏水层析材料butylsepharosehighperformance(gehealthcare)进行纯化,以高盐pb缓冲液(na2hpo4·12h2o20mmol/l,na2hpo4·12h2o20mmol/l,nacl1mol/l,ph7.4)上样,以pb缓冲液(na2hpo4·12h2o20mmol/l,na2hpo4·12h2o20mmol/l,ph7.4)洗涤杂蛋白,ddh2o清洗获得含有目的蛋白的样品以便下一步纯化。最后,将收取的纯化样本进行离子层析,选用离子层析材料deaesepharosefastflow(gehealthcare)进行纯化,以pb缓冲液(na2hpo4·12h2o20mmol/l,na2hpo4·12h2o20mmol/l,ph7.4)上样,以20%体积分数的高盐pb缓冲液(na2hpo4·12h2o20mmol/l,na2hpo4·12h2o20mmol/l,nacl1mol/l,ph7.4)与80%体积分数的pb缓冲液(na2hpo4·12h2o20mmol/l,na2hpo4·12h2o20mmol/l,ph7.4)洗涤获得目的蛋白,进行聚丙烯酰胺凝胶(sds-page)电泳分析得最终纯化物。
5.新型融合蛋白lt29的免疫原性检测
将融合蛋白lt29用pbs稀释到1mg/ml,0.2mg/ml或0.04mg/ml;polyi:c(作用于toll样受体3的激动剂)用磷酸盐缓冲液溶解至0.5mg/ml;阳离子脂质体二甲基三十六烷基铵(dimo-thylidioctylammoniumbromide,dda)用无菌蒸馏水配制成2.5mg/ml,80℃水浴10min,冷却至室温。取polyi:c溶液50μl与等量lt29蛋白溶液充分混匀,室温放置1min。在混合溶液中逐滴加入100μldda溶液,然后充分乳化,使疫苗呈均一的乳油状即得到亚单位疫苗lt29-dda/polyi:c。该疫苗用于免疫时,用量为200μl/只小鼠。
本发明的优点在于:本发明利用基因工程技术,成功构建、表达和纯化了不带有任何标签的结核分枝杆菌融合蛋白lt29,解决了融合蛋白所带有的标签可能会影响到动物实验以及后期临床试验的后续问题,并且通过盐析、疏水层析与离子层析相结合的方法使该无标签融合蛋白得到了有效的纯化。本发明中的新型融合蛋白lt29和佐剂联合构建结核亚单位疫苗,该疫苗可诱导较强的细胞免疫应答并促进记忆性t细胞的产生;该疫苗可以通过黏膜免疫产生较强的体液与细胞免疫。该疫苗在小鼠免疫过程中未见明显毒副作用。本发明有望成为临床结核病预防和治疗的候选疫苗。
附图说明
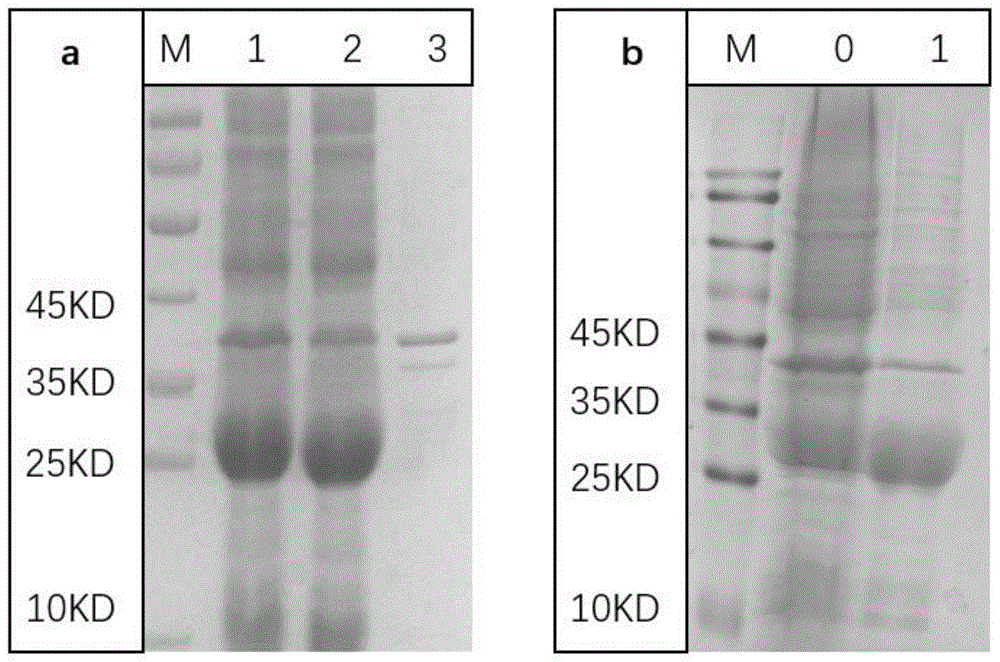
图1.融合蛋白lt29在大肠杆菌e.colibl21(de3)中的表达结果。(a)融合蛋白lt29的表达结果。m,marker;1,菌体破碎后全菌液;2,菌体破碎后上清;3,菌体破碎后沉淀。(b)融合蛋白lt29的盐析结果。m,marker;0,融合蛋白lt29菌体破碎后上清;1,融合蛋白lt29盐析纯化效果;
图2.融合蛋白lt29经盐析后样本疏水层析纯化效果。m,marker;0,lt29盐析后样本;1-2,流穿杂蛋白;3-6,pb缓冲液洗脱杂蛋白;7-8,ddh2o洗脱目的蛋白。
图3.融合蛋白lt29经疏水层析后样本离子层析纯化效果。m,marker;0,lt29疏水层析后样本;1-2,流穿杂蛋白;3-4,20%高盐pb缓冲液与80%pb缓冲液洗脱目的蛋白。
图4.结核亚单位疫苗lt29的细胞免疫原性检测结果。将lt29疫苗分别在第0、2、4周免疫小鼠三次,末次免疫后6周检测小鼠脾脏淋巴细胞在结核特异性抗原刺激下细胞因子ifn-γ分泌水平。(a)小鼠淋巴细胞体外rv2626c抗原刺激后,培养基上清ifn-γ水平。(b)小鼠淋巴细胞体外east6抗原刺激后,培养基上清ifn-γ水平。(c)小鼠淋巴细胞体内注射east6与rv2626c混合抗原刺激后,分离脾脏淋巴细胞体外rv2626c抗原刺激,cd4+t细胞ifn-γ分泌水平。(d)小鼠淋巴细胞体内注射east6与rv2626c混合抗原刺激后,分离脾脏淋巴细胞体外rv2626c抗原刺激,cd8+t细胞ifn-γ分泌水平。*p<0.05;**p<0.01;***p<0.005。
图5.结核亚单位疫苗m4的细胞免疫原性检测结果。将m4疫苗在第0、8周滴鼻免疫小鼠两次,末次免疫后6周检测小鼠脾脏淋巴细胞在结核特异性抗原刺激下胞内因子染色结果及细胞因子ifn-γ分泌水平。(a)小鼠淋巴细胞体内注射hspx与rv2626c混合抗原刺激后,分离脾脏淋巴细胞体外hspx与rv2626c抗原刺激,cd4+t细胞ifn-γ分泌水平。(b)小鼠淋巴细胞体内注射hspx与rv2626c混合抗原刺激后,分离脾脏淋巴细胞hspx与rv2626c抗原刺激,cd4+t细胞il-2分泌水平。(c)小鼠淋巴细胞体内注射hspx与rv2626c混合抗原刺激后,分离脾脏淋巴细胞体外hspx与rv2626c抗原刺激,cd8+t细胞il-2分泌水平。(d)小鼠淋巴细胞体内注射hspx与rv2626c混合抗原刺激后,分离脾脏淋巴细胞hspx与rv2626c抗原刺激,cd8+t细胞ifn-γ分泌水平。(e)小鼠脾脏淋巴细胞体外hspx与rv2626c抗原刺激后,培养基上清ifn-γ水平。*p<0.05;**p<0.01;***p<0.005
图6.结核亚单位疫苗m4的体液免疫原性检测结果。将m4疫苗在第0、8周滴鼻免疫小鼠两次,末次免疫后6周检测小鼠血清与肺部灌洗液中igg与siga的水平。(a)小鼠血清hspx与rv2626c特异性igg抗体水平,dp/m4组rv2626c特异性igg水平显著高于其余组。(b)小鼠肺部灌洗液中rv2626c特异性siga的滴度。
具体实施方式
以下对本发明的优选实施例进行说明,应当理解,此处所描述的优选实施例仅用于说明和解释本发明,并不用于限定本发明。
实施例1结核分枝杆菌融合蛋白lt29的构建、表达和纯化
本发明首先要将结核分枝杆菌活动期抗原east6和结核分支杆菌潜伏期抗原rv2626c进行基因水平的融合,构建重组载体pet30a(+)-lt29。首先构建好pet30a-rv2626c质粒,再在rv2626c基因前面插入esat6基因即可。为了使esat6与rv2626c两个蛋白在空间结构上不互相影响,因此在esat6下游引物中加入一段linker(ggggs)3,构成了重组质粒pet30a(+)-lt29(pet30a(+)-esat6-linker-rv2626c)。
然后,将pet30a(+)-lt29质粒载体转化入大肠杆菌e.coli中进行融合蛋白lt29的表达。最后,根据该蛋白的蛋白特性,通过盐析、疏水层析与离子层析相结合的方法成功纯化该融合蛋白。具体步骤如下:
1.pet30a-rv2626c质粒构建
设计引物扩增rv2626c基因片段。引物分别为:上游(5’-3’
2.融合蛋白lt29表达质粒pet30a(+)-lt29的构建
根据本实验室已经构建成功的pet30a-rv2626c、pet30a-esat6重组基因序列,设计引物扩增esat6基因片段。引物分别为:
上游引物:
下游引物:
以pet30a(+)-rv2626c质粒为载体,用上述两条引物,pcr扩增出east6-linker基因产物。该pcr产物经纯化后,用ndeⅰ和sacⅰ进行酶切,克隆构建在质粒pet30(+)a-rv2626c上,构建成pet30a(+)-lt29(esat6-linker-rv2626c)载体。
3.融合蛋白lt29的表达与纯化
(1)融合蛋白lt29的表达
将上述构建成功的pet30a(+)-lt29(esat6-linker-rv2626c)载体转化入表达载体大肠杆菌e.colibl21(de3)中。活化表达lt29蛋白的e.colibl-21(de3)菌体,取1ml活化后菌体加入200mllb培养基中37℃震荡培养4h;加入蛋白诱导剂iptg(1.0mmol/l)100ul,29℃诱导振荡培养12h;4℃10000g离心10min收集菌体;菌体重悬于pb缓冲液(na2hpo4·12h2o20mmol/l,na2hpo4·12h2o20mmol/l,ph7.4)10ml/g湿菌,冰浴下超声破碎细菌0.5h(180~200w,超声3s停3s);10000g离心15min后分别收集上清和沉淀,将上清和沉淀分别进行聚丙烯酰胺凝胶电泳;经sds-page电泳分析,与e.colibl21(de3)空菌相比,分子量在29kd左右有明显的特异蛋白表达条带,以上清形式表达为主,沉淀中蛋白相对较少【图1a,b】
(2)融合蛋白lt29的纯化
大量表达融合蛋白lt29,收集的菌体重悬于20mmpb缓冲液中,冰浴下超声破碎0.5h左右,4℃/10000g离心10min,离心后收集含lt29蛋白的上清;上清用0.45um滤器过滤。首先,将该融合蛋白用体积分数30%的饱和硫酸铵溶液进行盐析;然后,盐析出的蛋白用pb缓冲液(na2hpo4·12h2o20mmol/l,na2hpo4·12h2o20mmol/l,ph7.4)进行重悬;随后,将所收取的融合蛋白进行疏水层析,选用疏水层析材料butylsepharosehighperformance(gehealthcare)进行纯化,以高盐pb缓冲液(na2hpo4·12h2o20mmol/l,na2hpo4·12h2o20mmol/l,nacl1mol/l,ph7.4)上样,以pb缓冲液(na2hpo4·12h2o20mmol/l,na2hpo4·12h2o20mmol/l,ph7.4)洗涤杂蛋白,ddh2o清洗获得含有目的蛋白的样品以便下一步纯化。最后,将收取的纯化样本进行离子层析,选用离子层析材料deaesepharosefastflow(gehealthcare)进行纯化,以pb缓冲液(na2hpo4·12h2o20mmol/l,na2hpo4·12h2o20mmol/l,ph7.4)上样,以20%体积分数的高盐pb缓冲液(na2hpo4·12h2o20mmol/l,na2hpo4·12h2o20mmol/l,nacl1mol/l,ph7.4)与80%体积分数的pb缓冲液(na2hpo4·12h2o20mmol/l,na2hpo4·12h2o20mmol/l,ph7.4)洗涤获得目的蛋白,进行聚丙烯酰胺凝胶(sds-page)电泳分析得最终纯化样品【图2、3】。
实施例2融合蛋白lt29亚单位疫苗的配制
将融合蛋白lt29用pbs稀释到0.2mg/ml或0.04mg/ml;polyi:c(作用于toll样受体3的激动剂)用磷酸盐缓冲液溶解至0.5mg/ml;阳离子脂质体—二甲基三十六烷基铵(dimo-thylidioctylammoniumbromide,dda)用无菌蒸馏水配制成2.5mg/ml,80℃水浴10min,冷却至室温。取polyi:c溶液50μl与等量lt29蛋白溶液充分混匀,室温放置1min。在混合溶液中逐滴加入100μldda溶液,然后充分乳化,使疫苗呈均一的乳油状即得到亚单位疫苗lt29-dda/polyi:c。该疫苗用于免疫时,用量为200μl/只小鼠。
实施例3融合蛋白lt29亚单位疫苗的免疫学活性检测
1.实验材料:亚单位疫苗lt29-dda/polyi:c;卡介苗(bcg);磷酸盐缓冲液(pbs)。
2.实验动物:c57bl/6小鼠;
3.实验动物分组(共六组):
(1)pbs;(2)bcg;(3)dda/polyi:c;(4)east6-dda/polyi:c;(5)rv2626c-dda/polyi:c;(6)lt29-dda/polyi:c
4.免疫动物:
第0周用制备好的亚单位疫苗腹股沟皮下免疫实验组动物一次(200μl/只),同时免疫对照组pbs和bcg组(5×106cfu/只)。实验组动物第0周免疫后分别在第2、4周以相同剂量加强免疫动物两次。
5.免疫指标测定方法
(1)elisa方法检测小鼠分泌抗原特异性ifn-γ的水平
小鼠末次免疫20w后无菌分离脾脏淋巴细胞,抗原east6或rv2626c(5ug/ml)与脾脏淋巴细胞在24板中共同孵育68小时后,收集细胞培养上清,用elisa方法检测脾脏淋巴细胞在east6或rv2626c刺激后ifn-γ的分泌水平。具体步骤:无菌摘除脾脏,研磨后经200目尼龙网过滤,用淋巴细胞分离液分离淋巴细胞。将分离出的淋巴细胞加入到24孔细胞培养板中,终浓度为5×106,加入等体积的east6或rv2626c蛋白溶液(5ug/ml)。在37℃、5%co2条件下共同孵育68小时后,收集细胞培养上清。将细胞培养上清加入96孔elisa板中,100ul/孔,按elisa试剂盒说明依次加入检测抗体等试剂,洗板、显色、终止反应、酶标仪读板、根据标准曲线求得ifn-γ的数值(pg/ml)。
结果显示:本发明的融合蛋白lt29和佐剂联合所构建的亚单位疫苗所诱导的ifn-γ细胞因子的水平明显高于pbs和bcg对照组,说明该疫苗可以有效诱导机体产生结核抗原特异性t细胞【图4a,b】。
(2)两次抗原刺激法检测小鼠脾脏记忆性t淋巴细胞水平
小鼠末次免疫20w后,腹腔注射east6与rv2626c混合抗原(5ug/ml),9天后分离脾脏淋巴细胞,使用rv2626c抗原(5ug/ml)或east6抗原(5ug/ml)体外刺激,共同孵育12小时后胞内因子染色检测cd4+t细胞与cd8+t细胞的ifn-γ分泌水平。具体步骤:无菌摘除脾脏,研磨后经200目尼龙网过滤,用淋巴细胞分离液分离淋巴细胞。将分离出的淋巴细胞加入到24孔细胞培养板中,终浓度为5×106,加入等体积的east6或rv2626c蛋白溶液(5ug/ml)。在37℃、5%co2条件下共同孵育4小时,加入1ul蛋白转运抑制剂,孵育8小时后,胞内因子染色检测cd4+t细胞与cd8+t细胞的ifn-γ分泌水平。
结果显示:本发明的融合蛋白lt29和佐剂联合所构建的亚单位疫苗可以刺激机体产生记忆性t细胞并存活较长时间【图4c,d】。
实施例4融合蛋白lt29与融合蛋白mh联合亚单位疫苗的免疫学活性检测
1.实验材料:融合蛋白mh+lt29(m4)、hspx蛋白、rv2626c蛋白、佐剂dda/polyi:c、bcg、磷酸盐缓冲液pbs。
2.实验动物:c57bl/6小鼠
3.实验动物分组(共四组):
a:pbs;b:bcg;c:m4;d:dp/m4
4.免疫动物:
bcg组在第0周注射一次(5×106cfu,100μl)。pbs组、m4组及dp/m4组分别在第0周和第8周通过滴鼻进行二次免疫,m4及dp/m4组滴鼻接种100ul,m4剂量为10ug。
5.免疫指标测定方法
(1)胞内因子染色检测小鼠脾脏t淋巴细胞细胞因子分泌水平
小鼠末次免疫6w后分离脾脏淋巴细胞,使用rv2626c抗原(5ug/ml)和hspx抗原(5ug/ml)体外刺激4h,加入1ul蛋白转运抑制剂,孵育8h后,检测cd4+t细胞与cd8+t细胞的ifn-γ与il-2分泌水平。
结果显示:将pbs、bcg、m4、dp/m4四组进行比较,dp/m4组在hspx蛋白,rv2626c蛋白刺激后,cd4+与cd8+t细胞的il-2分泌水平均高于pbs组,cd4+t细胞的ifn-γ分泌水平高于pbs组,cd8+t细胞的ifn-γ分泌水平高于其余三组。结果证明融合蛋白lt29与融合蛋白mh联合亚单位疫苗可引起较强的细胞免疫反应【图5】。
(2)elisa方法检测小鼠分泌抗原特异性ifn-γ的水平。
小鼠末次免疫6周后无菌分离脾脏淋巴细胞,用特异性抗原和脾细胞在24板中共同孵育68小时后,收集细胞培养上清,用elisa法检测脾脏淋巴细胞在hspx蛋白,rv2626c蛋白刺激后ifn-γ的表达。
具体步骤:无菌摘除脾脏,研磨后经200目尼龙网过滤,用淋巴细胞分离液分离淋巴细胞。将分离出的淋巴细胞加入到24孔细胞培养板中,终浓度为5×106/well,分别给予hspx蛋白(5ug/ml),rv2626c蛋白(5ug/ml)刺激。在37℃、5%co2条件下共同孵育68时后,收集细胞培养上清。将细胞培养上清加入到96孔elisa板中,100u1/孔,按elisa说明书依次加入检测抗体等试剂,洗板、显色、终止反应、酶标仪读板、根据标准曲线求的ifn-γ的含量(pg/ml)。
结果显示:将pbs、bcg、m4、dp/m4四组进行比较,dp/m4组在hspx蛋白,rv2626c蛋白刺激后,脾细胞分泌ifn-γ的水平明显高于pbs组,bcg组和m4组(p<0.001),表明dp/m4组可产生较高水平的ifn-γ。结果证明融合蛋白lt29与融合蛋白mh联合亚单位疫苗可引起较强的细胞免疫反应【图5】。
(3)体液免疫反应
①用elisa法检测小鼠血清抗体表达水平。
分别用hspx、rv2626c(5ug/ml)包被96孔板,4℃过夜;用pbst溶液300u1/we11洗板5次;用5%的脱脂奶粉进行封闭,洗板。加入100u1倍比稀释的血清样品,37℃放置1h。洗板后,加入100u1/we11的1:5000稀释的羊抗鼠igg,37℃放置lh。洗板后,加入100u1/we11tmb显色液,室温避光反应15分钟显色后,加入50u1/we11终止液(2m的h2so4)终止反应;在450nm检测od值。
②用elisa法检测小鼠肺泡灌洗液siga抗体的表达水平。
分别用hspx、rv2626c(5ug/ml)包被96孔板,4℃过夜;用pbst溶液300u1/we11洗板5次;用5%的脱脂奶粉进行封闭,洗板。将包被hspx的肺泡灌洗液进行1:1稀释;将包被rv2626c蛋白的肺泡灌洗液进行1:3稀释,37℃放置1h。洗板后,加入100u1/we11的1:3000羊抗鼠siga,37℃放置1h。洗板后,加入100u1/we11tmb显色液,室温避光反应15分钟显色后,加入50u1/we11终止液(2m的h2so4,)终止反应;在450nm检测od值。
结果显示:pbs、bcg、m4、dp/m4四组结果进行比较,dp/m4组的rv2626c蛋白特异性igg和siga抗体水平明显高于pbs、bcg和m4组。
本实施例显示本发明所提供的结核亚单位疫苗lt29与结核亚单位疫苗mh滴鼻免疫联合使用,可刺激机体产生较为显著的体液和细胞免疫应答【图5、图6与表1】。
表1疫苗免疫后抗体水平检测
lt29的基因序列:
斜体部分为酶切位点,“”划出的是esat6的核酸序列,粗体为linker(ggggs)3的核酸序列,
lt29的氨基酸序列:
斜体为酶切位点,“_”划出的是esat6的氨基酸序列,粗体为liker(ggggs)3的氨基酸序列,
为了开发保护效果更好、保护时间更长的新型结核病疫苗,本发明构建含结核分枝杆菌多期抗原的新型亚单位疫苗。本发明将结核分枝杆菌活动期抗原east6和结核分支杆菌潜伏期抗原rv2626c进行融合构建了新型融和蛋白esat6-linker-rv2626c(简称为lt29)。本发明将该新型融合蛋白在工程菌大肠杆菌(e.coli)中进行表达纯化,与佐剂联合构建结核亚单位疫苗,并将该疫苗在小鼠模型分别进行免疫学评价。该融合蛋白在大肠杆菌中成功得到表达纯化;在小鼠体内可以诱导产生较强的针对结核杆菌特定抗原(esat6和rv2626c)的特异性细胞免疫反应,并促进较长时间存活的记忆性t细胞的产生,具有较强的免疫原性。本发明成功构建、表达和纯化了不带任何标签的新型融合蛋白lt29,该蛋白融合了结核菌活动期抗原和潜伏期抗原,可诱导产生抗原特异性细胞。本发明成果有望成为临床结核病预防和治疗的有效候选疫苗。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110>兰州大学
<120>结核分枝杆菌融合蛋白lt29及其表达纯化方法和应用
<130>2021
<160>5
<170>siposequencelisting1.0
<210>1
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>1
cgccatatgatgatgacagagcagcag27
<210>2
<211>65
<212>dna
<213>人工序列(artificialsequence)
<400>2
cgagctcgagaccaccaccaccagaaccaccaccaccagaaccaccaccacctgcgaaca60
tccca65
<210>3
<211>65
<212>dna
<213>人工序列(artificialsequence)
<400>3
cgagctcgagaccaccaccaccagaaccaccaccaccagaaccaccaccacctgcgaaca60
tccca65
<210>4
<211>812
<212>dna
<213>人工序列(artificialsequence)
<400>4
catatgatgacagagcagcagtggaatttcgcgggtatcgaggccgcggcaagcgcaatc60
cagggaaatgtcacgtccattcattccctccttgacgaggggaagcagtccctgaccaag120
ctcgcagcggcctggggcggtagcggttcggaggcgtaccagggtgtccagcaaaaatgg180
gacgccacggctaccgagctgaacaacgcgctgcagaacctggcgcggacgatcagcgaa240
gccggtcaggcaatggcttcgaccgaaggcaacgtcactgggatgttcgcaggtggtggt300
ggttctggtggtggtggttctggtggtggtggttctgagctcaccacggcgcgtgatatc360
atgaatgcgggtgtcacctgtgttggcgagcacgaaacgttgaccgcagcagcacagtac420
atgcgcgaacatgatatcggcgcattgccgatttgcggcgacgatgatcgtctgcacggt480
atgctgaccgaccgcgatatcgttatcaagggtctggccgcaggcttggacccgaacacc540
gcgaccgccggtgaactggcacgtgacagcatctattacgtcgacgcgaacgccagcatt600
caagagatgctgaacgtgatggaagagcatcaggtgcgtcgtgtcccggttatcagcgaa660
catcgtctggttggtatcgttaccgaagccgacatcgcacgtcacctgccggagcacgcg720
attgttcagttcgtgaaagcgatttgcagcccgatggcgttggcgtctcgtcaaaagggc780
gacacaaatttattctaaatgcatgaaagctt812
<210>5
<211>269
<212>prt
<213>人工序列(artificialsequence)
<400>5
hismetmetthrgluglnglntrpasnphealaglyileglualaala
151015
alaseralaileglnglyasnvalthrserilehisserleuleuasp
202530
gluglylysglnserleuthrlysleualaalaalatrpglyglyser
354045
glyserglualatyrglnglyvalglnglnlystrpaspalathrala
505560
thrgluleuasnasnalaleuglnasnleualaargthrileserglu
65707580
alaglyglnalametalaserthrgluglyasnvalthrglymetphe
859095
alaglyglyglyglyserglyglyglyglyserglyglyglyglyser
100105110
gluleuthrthralaargaspilemetasnalaglyvalthrcysval
115120125
glygluhisgluthrleuthralaalaalaglntyrmetarggluhis
130135140
aspileglyalaleuproilecysglyaspaspaspargleuhisgly
145150155160
metleuthraspargaspilevalilelysglyleualaalaglyleu
165170175
aspproasnthralathralaglygluleualaargaspseriletyr
180185190
tyrvalaspalaasnalaserileglnglumetleuasnvalmetglu
195200205
gluhisglnvalargargvalprovalilesergluhisargleuval
210215220
glyilevalthrglualaaspilealaarghisleuprogluhisala
225230235240
ilevalglnphevallysalailecysserprometalaleualaser
245250255
argglnlysglyaspthrasnleuphemethisgluser
260265
- 还没有人留言评论。精彩留言会获得点赞!