一种用于优化连续流人工心脏脉动工作模式的内皮细胞体外培养系统
本发明属于人工器官技术领域,涉及一种用于优化人工心脏脉动工作模式的内皮细胞培养腔及体外循环系统,是基于血流动力学原理、微流控芯片及智能反馈控制技术,用于研究连续流人工心脏泵速的不同脉动工作模式引起的血流动力学信号改变影响内皮细胞功能的微型体外模拟循环系统。
背景技术:
人工心脏是目前针对终末期心衰的非药物性机械治疗方法和康复手段。连续流人工心脏因其体积小、可靠性高、易于植入和操作等优点得到了极大推广和应用。它的主体是叶轮式血泵,叶轮恒速旋转时输出定常流,转速周期性改变时输出脉动流。临床使用时为了操作方便,通常将叶轮泵设置为恒定转速,而这种工作模式会导致动脉血流和血压的脉动性明显降低,造成血管内皮细胞功能失调,从而诱发动静脉畸形、出血性中风、以及肾脏等其他器官受损等大量不良事件的发生。
近20多年的基础和临床研究发现,人工心脏能够通过血流动力学机制影响动脉内皮功能,从而进一步调节外周血管的结构和功能。血管内皮作为介于血流和血管壁组织之间的一道屏障,位于血管壁的最内层,因此处于复杂的血流动力学微环境中,同时直接承受血流产生的壁面剪应力、血压以及血压导致的血管周向牵张应力(或应变)等血流动力学信号作用。内皮细胞能通过细胞膜表面受体及感受器识别细胞外微环境中的血流动力学信号及其变化,并将力学信号通过一系列的信号通路级联反应传递到细胞内部引起基因和蛋白表达的变化,即力学生物学(mechanobiology)机制,最终影响内皮细胞功能的变化,如舒血管因子一氧化氮(nitricoxide,no)和缩血管因子内皮素-1(endothelin-1,et-1)等血管活性物质的分泌、以及肿瘤坏死因子-α(tumornecrosisfactor-α,tnf-α)、白细胞介素-6(interleukin-6,il-6)、白细胞介素-8(interleukin-8,il-8)等促炎性细胞因子表达水平的变化。这些物质的短期效应会影响血管壁舒张和收缩功能、引起炎性反应等,长期效应则导致血管结构和功能的重建,即引起血管壁厚、管径大小、血管弹性等发生变化。
目前的研究已尝试将连续流人工心脏的血泵转速设置为各种周期性变化的脉动工作模式,周期性泵速变化波形的幅值调节主要根据心室和后负荷耦合作用的血流动力学机制进行设定,频率调节则包括同步调节(泵速变化的频率与心率一致)和异步调节(泵速变化的频率与心率无关)两种方式,期望通过改变血流动力学信号的脉动性从而改善血管内皮功能,降低外周血管及器官的不良事件发生率。然而,连续流人工心脏泵速的不同脉动工作模式如何影响血流动力学信号的规律及如何差异化调控动脉内皮细胞的功能,迄今为止未有全面、系统的研究,因而限制了人工心脏泵速的不同脉动工作模式在临床的精准实施及在治疗与康复中科学合理的使用。
动物模型与人体临床实验是将连续流人工心脏应用于临床之前开展动脉内皮血流动力学微环境特性分析的最直接方式。然而动物和人体的在体动脉内皮细胞所处的血流动力学微环境非常复杂,且极易受呼吸和神经调节等其他因素的影响,同时存在个体差异大、血流动力学参数监测精度低、成本高、周期长、以及伦理学上的争议等问题。针对上述局限性,目前的研究已使用机械泵模拟心室,各种分布参数(硅胶弹性管等)或集中参数元件(血管顺应性、血流惯性、外周阻力等)模拟动脉后负荷输入阻抗,建立包括人工心脏在内的体外模拟循环系统(mockcirculatorysystem,mcs)模型。然而这些研究还尚未对动脉内皮细胞附近局部微环境中的血压、壁面剪应力和牵张应变进行详细分析,同时普遍存在尺寸偏大、循环液体量多、不包含体外细胞培养腔等缺陷,不便于开展细胞力学生物学研究。
相比较而言,微流控芯片具有所需样品量少、易集成、易于光学检测及良好的生物适应性等优势。近年来的研究表明,基于微流控芯片的体外内皮细胞培养腔(endothelialcellculturemodel,eccm)是能够模拟且易于监控血流动力学微环境信号的微型化、客观化、标准化和定量化的内皮细胞力学生物学研究系统。但是,当前所建立的用于研究人工心脏泵速不同脉动工作模式对应的血流动力学微环境对动脉内皮细胞功能影响的eccm,未能真实再现人工心脏作用下人体动脉内皮微环境中真实的血流动力学信号。因此,迫切需要设计和构建能够精准模拟在体动脉内皮血流动力学微环境的微型体外模拟循环系统,既能实现人工心脏泵速在不同脉动工作模式下血流动力学信号的精准加载和控制,又能对微流控芯片细胞培养腔内的动脉内皮细胞力学生物学效应进行在线、实时的监测,以便于更好地分析不同脉动工作模式下动脉内皮细胞附近局部微环境中的血压、壁面剪应力、牵张应力(或应变)等关键血流动力学信号,以此为人工心脏泵速脉动工作模式的优化选择提供科学依据,从而提高人工心脏对心衰疾病的治疗与康复能力。
技术实现要素:
本发明的目的在于:提供一种能够真实模拟人工心脏脉动工作模式引起的动脉内皮血流动力学微环境中血压、壁面剪应力和牵张应变(应力)信号的方法。该方法将血流动力学原理、微流控芯片技术及智能反馈控制技术巧妙结合,通过集成度更高、耗材更少的微流控芯片细胞培养腔及表征其后负荷血流动力学特性的多元件集中参数模型搭建体外液体模拟循环系统,再现心衰患者在植入人工心脏后泵速的不同脉动工作模式下在体动脉内皮细胞所承受的压力、剪应力以及牵张应变的组合作用,可用于研究血流动力学信号与动脉内皮细胞力学生物学效应之间的定量关系及其分子生物学机制。
本发明的技术方案如下:
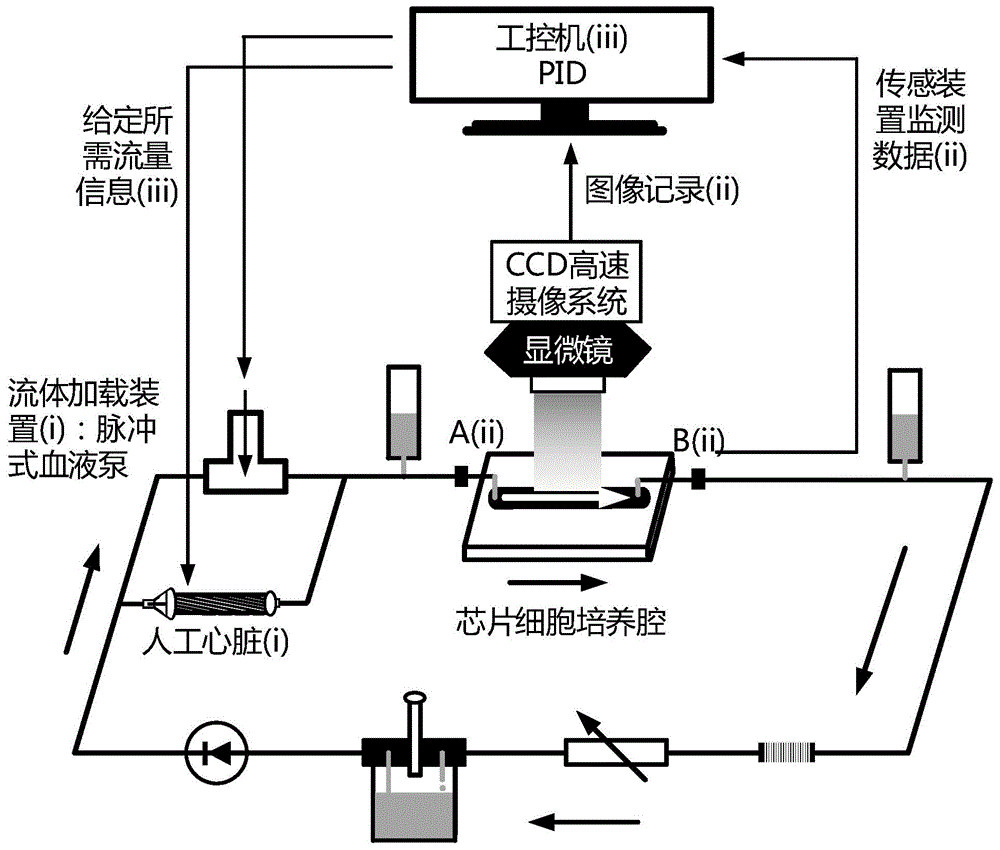
一种用于优化连续流人工心脏脉动工作模式的内皮细胞体外培养系统(如图1所示),包括三个基本单元:第一个基本单元为微流控芯片上的细胞培养腔及芯片外多元件主动脉弓后负荷流体力学循环回路(如图2所示);芯片外多元件主动脉弓后负荷流体力学循环回路包括与细胞培养腔串联的流感、阻力阀、弹性腔1、弹性腔2;弹性腔1、弹性腔2分别设置于细胞培养腔的两侧。
第二个基本单元为模拟心血管系统动力源的脉动式流体加载装置及人工心脏装置,如图2所示,流体加载装置利用脉冲式血液泵实现(图3中q1(t)),能够模拟正常和心衰病人在体动脉内皮细胞承受的血压、壁面剪应力和牵张应变波形;人工心脏装置并联接入到脉冲式血液泵的两端(图3中q2(t)),再将二者串联接入到上述流体力学循环回路之中,可模拟不同泵速脉动调制模式下在体动脉内皮细胞承受的血压、壁面剪应力和牵张应变信号;
第三个基本单元为外围检测与反馈控制系统,如图1所示,包括倒置的荧光显微镜、ccd高速摄像系统、压力传感器和流量传感器、以及比例-积分-微分反馈控制系统,压力传感器和流量传感器均设置在细胞培养腔的两侧,用于实时监测和采集细胞培养腔输入端和输出端的压力和流量波形,荧光显微镜位于细胞培养腔rc的上方,ccd高速摄像系统与荧光显微镜相连,用于采集微流控芯片细胞培养腔内细胞的实际形态结构,ccd高速摄像系统、压力传感器、流量传感器均与比例-积分-微分反馈控制系统相连,通过对细胞培养腔两端的压力和流量波形以及细胞形态结构数据的采集及反馈,比例-积分-微分反馈控制系统可定量调控相关血流动力学信号的变化,在微流控芯片细胞培养腔产生基于人工心脏泵速不同脉动工作模式下在体动脉内皮细胞承受的压力、剪应力及牵张应变信号的组合作用。
如图4所示,上述内皮细胞培养腔是断面为凹字形的腔体,与动脉弹性模量类似的弹性薄膜键合在硬质透光的聚甲基丙烯酸甲酯(polymethylmethacrylate,pmma)材料制成的腔体上,弹性薄膜下表面以下的细胞培养腔充满循环液体;弹性薄膜的上表面两侧空腔中通入空气,为两侧腔处薄膜在脉动流体压力作用下发生形变提供足够的空间;弹性薄膜上表面中部腔体的两端为光滑圆弧形,且薄膜上表面中部紧贴腔体凹部水平方向的内表面,能够使下方附着内皮细胞的弹性薄膜在两侧牵拉作用下仅发生水平方向的牵张应变,同时腔体凹部厚度的设计须确保在使用显微镜观察内皮细胞形态结构时可聚焦,且在脉动压力作用下不会发生形变;下层细胞培养腔的几何尺寸、弹性薄膜的弹性模量的选择需根据弹性力学原理,并通过精准模拟在主动脉不同部位内皮微环境中的血压、剪应力和牵张应变波形的实际需要确定。
进一步的,所述的细胞培养腔是通过单向阀和贮液池相配合来为细胞培养腔中的细胞提供循环液体的。
进一步的,所述的体外循环系统可等效为电路模型,其中:内皮细胞培养腔的流阻等效为电阻(图3中rc)、培养腔上薄膜的顺应性等效为电容(图3中c1)、主动脉弓下游血管床的顺应性、流阻和流感等效为电容、电阻和电感(图3中c2、r和l)。
进一步的,芯片外多元件主动脉弓后负荷流体力学循环回路的设计需使细胞培养腔薄膜上培养的内皮细胞承受的压力、壁面剪应力、牵张应变与植入人工心脏后心衰病人相应部位内皮细胞承受的血压、剪应力、牵张应变波形一致:
首先,以人体或动物实验检测分析得到的在体动脉内皮细胞局部附近的血压p(t)、壁面剪应力τω(t)和牵张应变ε(t)波形为模拟目标,为使细胞培养腔薄膜上培养的内皮细胞承受的血压和剪应力波形与在体动脉内皮微环境中的血压和壁面剪应力相等,血流量q(t)和压力降δp(t)必须满足:
式中,η为细胞培养液粘度,hc、wc和lc分别为细胞培养腔的高度、宽度和的长度。
其次,根据流体力学回路与电路之间的相似关系,将主动脉弓后负荷血流动力学行为等效为电路系统。其中流体力学回路输入阻抗表示为输入压力波形p(t)和血流量波形q(t)在频域上比值,用角频率ωn对应的血压和血流量谐波分量的幅值和相位表征:
∠z(ωn)=∠p(ωn)-∠q(ωn)(2b)
式中,|p(ωn)|和|q(ωn)|分别为血压和血流量经傅里叶变换后,在角频率ωn处的幅值;∠p(ωn)和∠q(ωn)分别为血压和血流量经傅里叶变换后,在角频率ωn处的相角;|z(ωn)|和∠z(ωn)分别为主动脉弓下游后负荷输入阻抗在ωn处的幅值和相角。等效电路模型的输入阻抗表示为图3中电路元件组合而成的复函数,可基于上述流体力学回路中输入阻抗的幅频曲线和相频曲线,通过式3中系统辨识方法来确定等效集中参数电路模型各元器件的参数值,
式中,
最后,根据流感l、阻力阀r、弹性腔c1、弹性腔c2数值搭建模拟主动脉弓后负荷血流动力学特性的多元件体外液体模拟循环系统。
如图1和图2所示,系统中的循环液体为体外血管内皮细胞培养液,弹性腔模拟动脉顺应性(流容),阻力阀模拟粘性阻力(流阻),流感元件模拟流动惯性。值得指出的是,由于主动脉弓不同部位壁面附近的血压、剪应力和牵张应变波形不同,描述主动脉弓这些不同部位的后负荷系统血流动力学行为的等效回路可能不是唯一的,需要根据实际波形的不同进行调整。由脉冲式血液泵和人工心脏产生期望的血流量波形。一旦知道细胞培养腔的输入血流量波形,则根据前述等效回路唯一确定压力波形。
上述模拟心血管系统动力源的装置是由人工心脏并联在脉动式流体加载装置两端实现的。可使用脉动式流体加载装置结合pid反馈控制装置实现正常和心衰生理条件下对在体动脉内皮细胞血流动力学微环境中的血压、壁面剪应力和牵张应变信号的模拟,将人工心脏装置与流体加载装置并联,再将二者串联接入到上述流体力学循环回路之中,并结合pid反馈控制装置可产生人工心脏泵速在不同脉动工作模式下主动脉弓不同部位血管内皮细胞承受的血流动力学信号波形,将采集的信号反馈到pid控制装置,可进一步调节流体加载装置及人工心脏,从而定量调控作用于多元件模拟循环系统的压力、流量信号幅度和频率的变化,最终在微流控芯片细胞培养腔产生基于人工心脏泵速不同脉动工作模式下的血压、剪应力和牵张应变的组合作用。
应用上述系统研究连续流人工心脏泵速的不同脉动工作模式与局部动脉内皮微环境血流动力学信号之间定量关系的实验步骤如下:
步骤一:将原代培养的内皮细胞进行传代培养,第2-5代用于实验。调整体外模拟循环系统中流感l、阻力阀r、弹性腔c1、弹性腔c2数值的大小,往细胞培养腔中通入循环液体,通过调控脉冲式血液泵和人工心脏装置,在连续流人工心脏泵速不同脉动工作模式下,加载对于动脉内皮细胞各种血流动力学信号的组合刺激。
步骤二:继续加载上述工作模式对应的血流动力学信号刺激,之后对细胞进行活性检测,以确保上述系统的有效性。
步骤三:从微流控芯片细胞培养腔内收集细胞样本,并进行基因和蛋白表达水平的检测,以此分析人工心脏泵速的不同脉动工作模式引起的血压、剪应力、以及牵张应变等血流动力学信号对血管活性物质及促炎性细胞因子基因和蛋白表达水平的影响。
本发明的有益效果:本发明基于上述体外模拟循环系统可成功再现人工心脏泵速的不同脉动工作模式对应的血压、壁面剪应力和牵张应变信号,并使用集成度更高、耗材更少的微流控芯片细胞培养腔研究上述工作模式下血流动力学信号的组合刺激对动脉内皮细胞功能的差异化影响;为研究血流动力学信号与动脉内皮细胞功能之间的定量关系提供了高效合理的实验平台,并为筛选出更有利于改善和维持正常内皮功能的连续流人工心脏泵速工作模式提供了科学依据。
附图说明
图1为体外内皮细胞培养腔及外围监控系统结构示意图。
图2为体外内皮细胞培养腔流体力学循环回路示意图。
图3为主动脉弓后负荷血流动力学行为等效电路模型示意图。
图4为微流控拉伸芯片细胞培养腔示意图。
图5为正常、心衰及异步调制模式下,通过在体实验获得的主动脉弓部位血管内皮细胞承受的血压和剪应力波形,及根据剪应力波形和细胞培养腔尺寸逆向求解获得的培养腔中血流量波形示意图。
图6为利用matlab/simulink对上述等效电路模型分别在正常、心衰和异步调制三种模式下,对实际输入阻抗幅值和相角的拟合结果,并以血流量信息作为电流激励,模型输出电压作为仿真目标,与图5中的血压进行对比后的结果示意图;(a-1):正常生理条件下输入阻抗的幅度-频率曲线;(a-2):正常生理条件下输入阻抗的相角-频率曲线;(a-3):正常生理条件下模型输出电压与血压对比图,(b-1):心衰条件下输入阻抗的幅度-频率曲线;(b-2):心衰条件下输入阻抗的相角-频率曲线;(b-3):心衰条件下模型输出电压与血压对比图,(c-1):人工心脏泵速的异步脉动工作模式下输入阻抗的幅度-频率曲线;(c-2):人工心脏泵速的异步脉动工作模式下输入阻抗的相角-频率曲线;(c-3):人工心脏泵速的异步脉动工作模式下模型输出电压与血压对比图。
图中:包括流体加载装置-脉冲式血液泵(i)和人工心脏(i);倒置的荧光显微镜、ccd高速摄像系统、压力传感器和流量传感器在内的信号采集处理系统(ii)和比例-积分-微分(proportional+integral+derivative,pid)反馈控制系统(iii);a(ii)和b(ii)为位于微流控芯片细胞培养腔两端的压力及流量传感器;rc为微流控芯片细胞培养腔流阻;c1为薄膜顺应性;r为连接管道流阻;c2为表征顺应性的弹性空气腔;l为液体循环过程中连接管道的流感。
具体实施方式
现针对人工心脏泵速不同脉动模式下的动脉内皮血流动力学微环境中血压的模拟,阐述具体实施方案:
(1)设计微流控芯片细胞培养腔高度hc、宽度wc和长度lc分别为0.3mm、6mm和15mm,通常细胞培养液的粘度η为0.001pa·s;利用图5中三种生理状态下的目标血压和血流量分别计算三种目标输入阻抗z(ωi);
(2)该体外模拟循环系统的血流动力学特性可使用如图3所示的五元件等效电路模型进行表征,根据相关电路理论可知,该电路的输入阻抗
(3)如公式4所示为该五元件集中参数模型的等效输入阻抗
(4)该芯片采用标准化微加工方法进行制作,与动脉弹性模量类似的弹性薄膜键合在硬质透光的pmma材料制成的腔体上,该腔体断面为凹字形,弹性薄膜下表面以下的细胞培养腔充满循环液体;弹性薄膜的上表面两侧空腔中通入空气,为两侧腔处薄膜在脉动流体压力作用下发生形变提供足够的空间;弹性薄膜上表面中部腔体的两端为光滑圆弧形,且薄膜上表面中部紧贴腔体凹部水平方向的内表面,能够使下方附着内皮细胞的弹性薄膜在两侧牵拉作用下仅发生水平方向的牵张应变,同时腔体凹部厚度的设计须确保在使用显微镜观察内皮细胞形态结构时可聚焦,且在脉动压力作用下不会发生形变;下层细胞培养腔的几何尺寸、弹性薄膜的弹性模量的选择需根据弹性力学原理,并通过精准模拟在主动脉不同部位内皮微环境中的血压、剪应力和牵张应变波形的实际需要确定;
(5)建立如图1所示的体外内皮细胞培养腔及外围监控系统,包括脉冲式血液泵(i)、人工心脏(i)、各种器件组成的信号采集处理系统(ii)和比例-积分-微分反馈控制系统(iii)。信号采集处理系统(ii)包括倒置的荧光显微镜、ccd高速摄像系统、压力传感器和流量传感器,用于实时监测和采集细胞培养腔输入端a和输出端b的压力及流量波形,以及微流控芯片细胞培养腔内细胞的实际形态结构。脉冲式血液泵(i)结合pid反馈控制装置(iii)可精确模拟正常和心衰生理条件,人工心脏装置(i)并联在脉冲式血液泵两端,可结合pid反馈控制装置(iii)精确模拟连续流人工心脏泵速在不同脉动工作模式下主动脉弓特定部位血管内皮细胞承受的血压、壁面剪应力和牵张应变信号,最终对多元件模拟循环系统加载定量可控的脉动流信号;将采集的信号反馈给pid控制装置(iii),可进一步调节脉冲式血液泵(i)及人工心脏(i),从而定量调控作用于多元件模拟循环系统的压力、流量信号幅度和频率的变化,最终在微流控芯片细胞培养腔内产生基于人工心脏泵速不同脉动工作模式下的血压、剪应力、以及牵张应变的组合作用。
微流控芯片内的压力可通过压力传感器测得;剪应力可通过流量传感器测得的流量波形和细胞培养腔几何尺寸计算得到;而对于芯片内弹性薄膜在不同压力下所产生的水平方向的牵张应变则可先利用荧光微球在薄膜上进行标定,并通过荧光显微镜测量。通过给定不同的压力来获得弹性薄膜相对应的牵张应变,进而建立压力与牵张应变之间的关系表达式。依据该近似表达式,在压力已知的情况下来确定实际实验中弹性薄膜的牵张应变。此外,内皮细胞的形态结构由显微镜结合ccd高速摄像系统检测记录并保存至工控机。
(6)用于研究连续流人工心脏泵速的不同脉动工作模式与局部动脉内皮微环境血流动力学信号之间定量关系的具体实验步骤如下:
步骤一,将原代培养的内皮细胞用egm培养基进行传代培养,第2-5代用于实验。实验时,将内皮细胞种植于经fibronection包被的微流控芯片细胞培养腔的弹性膜上,使细胞贴壁且融合度达到90%以上。
步骤二,对动脉内皮细胞加载人工心脏泵速不同脉动工作模式对应的血流动力学信号的组合刺激;使用nucviewtm-488细胞活性检测试剂进行细胞活性检测,以确保体外模拟循环系统的有效性。
步骤三,从微流控芯片细胞培养腔内收集细胞样本进行基因和蛋白表达水平的检测,以此得出人工心脏泵速的不同脉动工作模式下对应的血压、剪应力和牵张应变等血流动力学信号对血管活性物质及促炎性细胞因子基因和蛋白表达水平的影响。
本发明可成功地再现人工心脏泵速的不同脉动工作模式下在体动脉内皮细胞承受的血压、壁面剪应力和牵张应变信号,并可对上述血流动力学信号组合刺激下培养的动脉内皮细胞功能的差异化影响进行实时监测。
- 还没有人留言评论。精彩留言会获得点赞!