一种螺吡喃配合物光致变色材料及其制备方法与流程
1.本发明涉及光致变色材料技术领域,更具体的说是涉及一种螺吡喃配合物光致变色材料及其制备方法。
背景技术:
2.光致变色是一种化学物理现象,包含无机、有机、生物及聚合物等光诱导的化学和物理反应。对光致变色材料来说,光致变色过程是分子吸收不同波长的光子后,通过电子跃迁来实现的,直接实现信息存储,不需要经过光和热的转化,因此被称为光子型存储。在受到一定强度和波长的光照射下,通过特定的光化学反应,一个化合物a可以转化为产物b,由于化合物结构、电子组态的改变,化合物的吸收光谱亦发生明显的变化,即颜色发生变化;反之,在另一不同强度和波长光的照射下,化合物b又能恢复到a的现象,这就是光致变色现象。光致变色化合物就是一类能在光的作用下发生可逆颜色变化的化合物,通常,大多数光致变色体都属于单分子反应。
3.相比较于光热型存储相比,光子型存储具有更快的存储速率、更大的存储密及更高的分辨率。新型信息材料已经成为现代信息技术研究领域的前沿课题之一,光子型存储一直是无机、物理、材料和有机科学家广泛关注和研究的热点,因其可以实现单分子的存储水平及皮秒级的响应速度,所以光子型存储被认定为是最有应用前景的功能材料之一,并对其进行了广泛而深入的研究。
4.光致变色材料从材料可分为无机光致变色材料和有机光致变色材料两大类。其中,无机光致变色材料又可分为无机光致变色玻璃材料和无机光致变色晶体材料,无机光致变色材料具有很多优点,例如抗老化性能强、变色反应速率快、变色持续时间长、热稳定性能好等,广泛应用于信息储存、太阳镜、传感器、智能开关、国防等领域。有机光致变色材料不仅可以通过改变分子结构来调变其光学和热学性能,而且有机光致变色材料具有良好的灵敏性、清晰度和柔顺性,正因为上述许多优点,其逐渐成为光致变色材料的研究热点。目前,对光致变色的研究大都集中在螺吡喃、偶氮类、二芳基乙烯和俘精酸酐类化合物上,同时也在继续探索和发现新的光致变色体系。
5.偶氮苯及其衍生物是一类人们研究比较广泛的顺反异构型化合物。偶氮苯类化合物能够进行顺反异构化,属于有机光致变色体系。在紫外光照下,反式的偶氮苯转变为顺式,因此,紫外
‑
可见吸收光谱上的最大吸收波长也随之改变。但是顺式偶氮苯热稳定性差,在可见光照射下或热的作用下,发生可逆反应回到反式结构,由于这类光致变色化合物不仅热稳定性差,而且光致变色前后的吸收光谱变化小,因此在一定程度上,偶氮苯类化合物的实际应用受到限制。
6.目前研究最广泛的光致变色化合物莫过于螺吡喃和螺噁嗪,中心螺碳原子分别连接了分子中的苯并吡喃环和吲哚啉环,所以两个环相互正交,不存在共轭。在紫外光(<410nm)的照射下,分子中螺环处的c
‑
o键发生断裂,电子排布和分子构象发生改变,螺碳原子从sp3结构转变为sp2结构,两个环变为平面型结构,分子的紫外
‑
可见吸收光谱在500~
600nm处出现一个强的吸收峰,此处变为有色的开环态
‑
部花菁。在光照作用下,部花菁分子又经可逆反应转变回无色的闭环态螺吡喃。
7.因此,如何使用螺吡喃配合物制备一种光致变色材料是本领域技术人员亟需解决的问题。
技术实现要素:
8.有鉴于此,本发明的目的在于提供一种螺吡喃配合物光致变色材料及其制备方法,以解决现有技术中的不足。
9.为了实现上述目的,本发明采用如下技术方案:
10.一种螺吡喃配合物光致变色材料,包括以下原料:硝酸盐、n
‑
羟乙基
‑
3,3
‑
二甲基
‑6‑
硝基吲哚啉螺吡喃和脂肪二胺;其中,硝酸盐、n
‑
羟乙基
‑
3,3
‑
二甲基
‑6‑
硝基吲哚啉螺吡喃和脂肪二胺的摩尔体积比为(0.2
‑
0.4)mmol:(0.1
‑
0.2)mmol:(0.1
‑
0.2)ml,优选为0.3mmol:0.1mmol:0.1ml。
11.本发明的有益效果在于,打破了前人认为的螺吡喃类配体会直接与过渡金属阳离子发生配位反应的认知,在螺吡喃类配体、乙二胺和过渡金属阳离子共混的情况下,首先由螺吡喃配体与乙二胺发生原位反应形成席夫碱配体,然后再与过渡金属阳离子形成四配位化合物。
12.进一步,上述硝酸盐为硝酸镍或硝酸铜。
13.采用上述进一步技术方案的有益效果在于,过渡金属氧化物中的金属阳离子的d电子层容易失去电子或夺取电子,具有较强的氧化还原性能,过渡金属氧化物中金属离子的内层价轨道与外来轨道可以发生劈裂。
14.进一步,上述脂肪二胺为乙二胺或丙二胺。
15.采用上述进一步技术方案的有益效果在于,乙二胺和丙二胺呈现伯胺和仲胺的特性和化学结构特点,导致其化学性质活泼,溶于水放热,水溶液呈强碱性,碱性比脂肪胺要弱一些,但比氨要强。在通常的条件下,乙二胺和丙二胺在热力学上是稳定的。
16.一种螺吡喃配合物光致变色材料的制备方法,具体包括以下步骤:
17.(1)按上述螺吡喃配合物光致变色材料的摩尔体积比称取各原料;
18.(2)将硝酸盐、n
‑
羟乙基
‑
3,3
‑
二甲基
‑6‑
硝基吲哚啉螺吡喃和脂肪二胺加入n,n`
‑
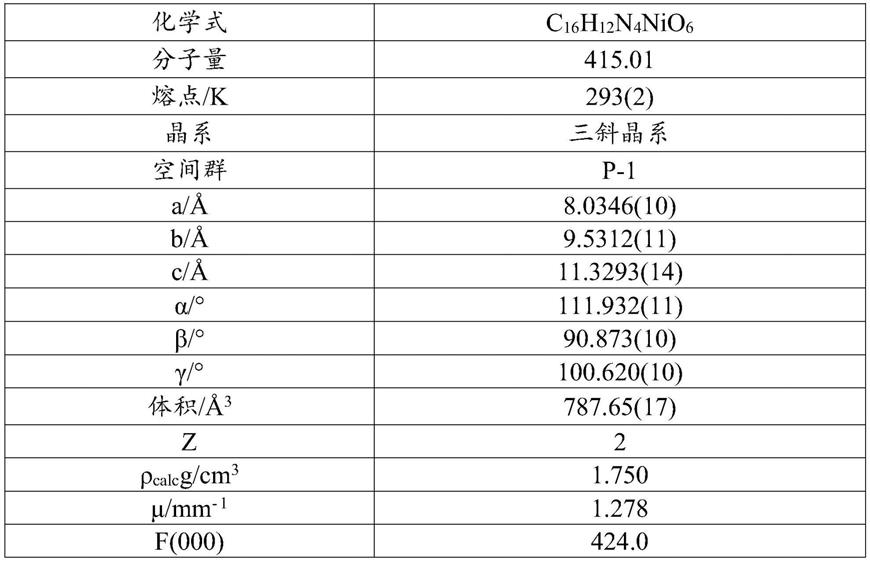
二甲基甲酰胺和正丙醇中,75
‑
85℃下恒温放置70
‑
75h,即得螺吡喃配合物光致变色材料。
19.本发明的有益效果在于,制备方法简单、原料易得、合成步骤少、合成条件温和,产率较高,具有产业化应用的潜力。
20.进一步,上述步骤(2)中,脂肪二胺、n,n`
‑
二甲基甲酰胺和正丙醇的体积比为(0.1
‑
0.2):(1
‑
2):(3
‑
4),优选为0.1:1:3。
21.采用上述进一步技术方案的有益效果在于,n,n`
‑
二甲基甲酰胺在无酸、碱、水存在下,即使加热到沸点也是比较稳定的,在酸的作用下分解成甲酸和二甲胺盐,而在碱的作用下则分解成甲酸盐和二甲胺;正丙醇主要增加配位的可能性。
22.经由上述的技术方案可知,与现有技术相比,本发明的有益效果如下:
23.通过水热合成法,以n
‑
羟乙基
‑
3,3
‑
二甲基
‑6‑
硝基吲哚啉螺吡喃为配体,合成了金属有机框架配合物,通过表征发现,螺吡喃配体与乙二胺、丙二胺发生了原位反应,形成
了席夫碱配体,金属ni与cu与席夫碱配体配位形成四配位的配合物,可以在紫外光照射下实现染料的光催化降解。
附图说明
24.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
25.图1为实施例1目标化合物的结构式;
26.图2为实施例2目标化合物的结构式;
27.图3为实施例1目标化合物的粉末x
‑
射线衍射图;
28.图4为实施例2目标化合物的粉末x
‑
射线衍射图;
29.图5为实施例1目标化合物对亚甲基蓝的光催化降解的紫外吸收光谱图;
30.图6为实施例2目标化合物对亚甲基蓝的光催化降解的紫外吸收光谱图;
31.图7为实施例1目标化合物对盐酸副玫瑰苯胺的光催化降解的紫外吸收光谱图;
32.图8为实施例2目标化合物对盐酸副玫瑰苯胺的光催化降解的紫外吸收光谱图;
33.图9为实施例1目标化合物的红外光谱图;
34.图10为实施例2目标化合物的红外光谱图;
35.图11为实施例1目标化合物的热重图;
36.图12为实施例2目标化合物的热重图。
具体实施方式
37.下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
38.实施例1
39.螺吡喃配合物光致变色材料,包括以下原料:硝酸镍、n
‑
羟乙基
‑
3,3
‑
二甲基
‑6‑
硝基吲哚啉螺吡喃和乙二胺,摩尔体积比为0.3mmol:0.1mmol:0.1ml;
40.上述螺吡喃配合物光致变色材料的制备方法,具体包括以下步骤:
41.(1)按上述摩尔体积比称取各原料;
42.(2)将0.3mmol硝酸镍、0.1mmol n
‑
羟乙基
‑
3,3
‑
二甲基
‑6‑
硝基吲哚啉螺吡喃和0.1ml脂肪二胺加入1mln,n`
‑
二甲基甲酰胺和3ml正丙醇中,80℃下恒温放置72h,即得螺吡喃配合物光致变色材料(棕黄色晶体,结构式如图1所示)。
43.实施例2
44.螺吡喃配合物光致变色材料,包括以下原料:硝酸铜、n
‑
羟乙基
‑
3,3
‑
二甲基
‑6‑
硝基吲哚啉螺吡喃和丙二胺,摩尔体积比为0.2mmol:0.2mmol:0.2ml;
45.上述螺吡喃配合物光致变色材料的制备方法,具体包括以下步骤:
46.(1)按上述摩尔体积比称取各原料;
47.(2)将0.3mmol硝酸铜、0.1mmoln
‑
羟乙基
‑
3,3
‑
二甲基
‑6‑
硝基吲哚啉螺吡喃和0.1ml脂肪二胺加入2mln,n`
‑
二甲基甲酰胺和3ml正丙醇中,75℃下恒温放置70h,即得螺吡喃配合物光致变色材料(棕黄色晶体,结构式如图2所示)。
48.实施例3
49.螺吡喃配合物光致变色材料,包括以下原料:硝酸镍、n
‑
羟乙基
‑
3,3
‑
二甲基
‑6‑
硝基吲哚啉螺吡喃和乙二胺,摩尔体积比为0.4mmol:0.1mmol:0.1ml;
50.上述螺吡喃配合物光致变色材料的制备方法,具体包括以下步骤:
51.(1)按上述摩尔体积比称取各原料;
52.(2)将0.3mmol硝酸镍、0.1mmol n
‑
羟乙基
‑
3,3
‑
二甲基
‑6‑
硝基吲哚啉螺吡喃和0.1ml脂肪二胺加入1mln,n`
‑
二甲基甲酰胺和4ml正丙醇中,80℃下恒温放置75h,即得螺吡喃配合物光致变色材料(棕黄色晶体)。
53.实施例4
54.螺吡喃配合物光致变色材料,包括以下原料:硝酸铜、n
‑
羟乙基
‑
3,3
‑
二甲基
‑6‑
硝基吲哚啉螺吡喃和丙二胺,摩尔体积比为0.3mmol:0.2mmol:0.2ml;
55.上述螺吡喃配合物光致变色材料的制备方法,具体包括以下步骤:
56.(1)按上述摩尔体积比称取各原料;
57.(2)将0.3mmol硝酸铜、0.1mmol n
‑
羟乙基
‑
3,3
‑
二甲基
‑6‑
硝基吲哚啉螺吡喃和0.2ml脂肪二胺加入1mln,n`
‑
二甲基甲酰胺和3ml正丙醇中,85℃下恒温放置75h,即得螺吡喃配合物光致变色材料(棕黄色晶体)。
58.性能测试
59.1、实施例1螺吡喃配合物光致变色材料(目标化合物晶体)的x
‑
射线单晶结构测定与数据
60.在室温下,使用显微镜观察并选取合适大小的实施例1目标化合物,在室温条件下进行x
‑
射线衍射实验。晶体的x
‑
射线衍射数据在oxford diffraction gemini e ultra衍射仪上收集,用经石墨单色器单色化的mo kα射线在293k温度下以方式收集衍射数据。部分结构的衍射数据使用sadabs程序进行吸收校正。晶体结构由直接法结合差值fourier合解。所有非氢原子坐标及各向异性参数进行全矩阵最小二乘法修正,c
‑
h原子的位置按理论模式计算从而确定,o
‑
h原子首先根据差值fourier找到,然后,其氢原子坐标及各向同性参数进行全矩阵最小二乘修正,并参与最终结构精修。
61.实施例1目标化合物的晶体学参数如表1所示,主要键长和键角分别如表2和表3所示。
62.表1实施例1目标化合物的晶体学参数表
[0063][0064][0065]
表2实施例1目标化合物的键长数据表
[0066][0067]
表3实施例1目标化合物的键角数据表
[0068]
[0069][0070]
2、实施例2螺吡喃配合物光致变色材料(目标化合物晶体)的x
‑
射线单晶结构测定与数据
[0071]
在室温下,使用显微镜观察并选取合适大小的实施例2目标化合物晶体,在室温条件下进行x
‑
射线衍射实验。晶体的x
‑
射线衍射数据在oxford diffraction gemini e ultra衍射仪上收集,用经石墨单色器单色化的mokα射线在287k温度下以方式收集衍射数据。部分结构的衍射数据使用sadabs程序进行吸收校正。晶体结构由直接法结合差值fourier合解。所有非氢原子坐标及各向异性参数进行全矩阵最小二乘法修正,c
‑
h原子的位置按理论模式计算从而确定,o
‑
h原子首先根据差值fourier找到,然后,其氢原子坐标及各向同性参数进行全矩阵最小二乘修正,并参与最终结构精修。
[0072]
实施例2目标化合物的晶体学参数如表4所示,主要键长和键角分别如5和6所示。
[0073]
表4实施例2目标化合物的晶体学参数表
[0074][0075]
表5实施例2目标化合物的键长数据表
[0076][0077]
表6实施例2目标化合物的键角数据表
[0078]
[0079]
[0080][0081]
3、实施例1和实施例2目标化合物的粉末衍射表征相纯度
[0082]
实施例1目标化合物的x
‑
射线单晶结构分析:在实施例1目标化合物的合成实验中,挑选出体积大小适宜、质量较好的晶体,进行化合物的x
‑
射线单晶结构的测试。该晶体的颜色为棕褐色,呈长条形状,整体均匀饱满,且晶体表面平整。
[0083]
如图3所示,实施例1目标化合物包含着一个ni(π)离子,且由一分子的乙二胺和二分子的n
‑
羟乙基
‑
3,3
‑
二甲基
‑6‑
硝基吲哚啉螺吡喃配体以原位反应自组装形成的席夫碱配体,进而再与ni原子进行配位,呈现出四配位的结构,而且其含有2个桥氧的结构。
[0084]
实施例2目标化合物的x
‑
射线单晶结构分析:在实施例2目标化合物的合成实验中,挑选出体积大小适宜、质量较好的晶体,进行化合物的x
‑
射线单晶结构的测试。该晶体的颜色为翠绿色,呈现出平行四边形块状,且晶体表面平整。
[0085]
如图4所示,实施例2目标化合物包含着一个cu(π)离子,且由一分子的1,3
‑
丙二胺和二分子的n
‑
羟乙基
‑
3,3
‑
二甲基
‑6‑
硝基吲哚啉螺吡喃配体以原位反应自组装形成的席夫碱配体,进而再与cu原子进行配位,呈现出四配位的结构,而且其含有2个桥氧的结构。
[0086]
实施例1和实施例2目标化合物的x
‑
射线粉末衍射(pxrd)数据通过具有d/tex超级衍射仪和以cu kα放射源的ultima iv在30kv和20ma的条件下测得。如图3和4所示,实施例1和实施例2目标化合物的x
‑
射线粉末衍射结果与晶胞模拟结果中的衍射峰在关键的位置均是相匹配的,说明化合物是单一相的纯度。衍射峰强度的不同可能是由于在实验pxrd模式收集数据过程中,粉末择优取向的变化。
[0087]
4、实施例1和实施例2目标化合物的光降解性能分析
[0088]
由图5和图6、图7和图8的纵向对比可知,在有机染料溶液的光催化降解测定实验中,实施例1和实施例2对同一种有机染料溶液的光催化降解性能的影响存在着明显的差异。
[0089]
由图5和图7、图6和图8的横向对比可知,在有机染料溶液的光催化降解测定实验中,同一种化合物对不同有机染料溶液的光催化降解性能的影响也存在着明显差异。
[0090]
5、实施例1和实施例2目标化合物的红外光谱性能分析
[0091]
由图9可知,在3423cm
‑1处为一宽吸收峰,应是水分子中羟基的伸缩振动吸收峰。在1637cm
‑1、1599cm
‑1处主要是硝基中的n=o的伸缩振动吸收峰和苯环上骨架的振动峰(σc=c)。在1315cm
‑1处为一尖锐吸收峰,应是c
‑
n的伸缩振动吸收峰。在1475
‑
1000cm
‑1区间中的
1109cm
‑1处是c
‑
c单键骨架的振动吸收峰。在1000
‑
650cm
‑1区间内主要是苯环上的c
‑
h面外弯曲振动区,其中837cm
‑1处是苯环对二取代的c
‑
h面外弯曲振动峰,而756cm
‑1处则是苯环邻二取代的c
‑
h面外弯曲振动峰。
[0092]
由图10可知,在3443cm
‑1处为一宽吸收峰,应是水分子中羟基的伸缩振动吸收峰。在2935cm
‑1处是饱和碳上的c
‑
h的伸缩振动吸收峰。在1644cm
‑1、1598cm
‑1处主要是硝基中的n=o的伸缩振动吸收峰和苯环上骨架的振动峰(σc=c)。在1315cm
‑1处为一尖锐吸收峰,应是c
‑
n的伸缩振动吸收峰。在1475
‑
1000cm
‑1区间中的1107cm
‑
1处是c
‑
c单键骨架的振动吸收峰。在1000
‑
650cm
‑1区间内主要是苯环上的c
‑
h面外弯曲振动区,其中835cm
‑1处是苯环对二取代的c
‑
h面外弯曲振动峰,而756cm
‑1处则是苯环邻二取代的c
‑
h面外弯曲振动峰。
[0093]
6、实施例1和实施例2目标化合物的热稳定结构性能分析
[0094]
由图11可知,实施例1目标化合物的重量自起始点28.7℃至85.1℃有小幅度降低,重量减少约为9.11%,重量减少主要是由于晶体化合物在夹杂的水分和dmf挥发。自85.1℃至375.7℃,实施例1目标化合物的重量基本维持稳定。自375.7℃至394.9℃,实施例1目标化合物的重量有较为明显的下降,重量减少约为19.12%,主要原因可能是晶体结构随着温度的升高而被破坏。
[0095]
由图12可知,实施例2目标化合物在回收时干燥程度较高,晶体夹杂水分和dmf较少,所以自起始点至340℃附近实施例1目标化合物的2重量基本维持稳定。自340℃至376.2℃,实施例1目标化合物的重量有较为明显的减少,减少约为39.75%,主要原因随着温度的增加,晶体结构被破坏。
[0096]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1