一种厄洛替尼衍生物及其在制备抑制IDO1活性药物、抗肿瘤药物中的应用
本发明要求于2020年04月21日提交中国专利局、申请号为202010315872.2、发明名称为“对野生型肺癌肿瘤细胞具有杀伤性能的厄洛替尼衍生物及其制备方法”的中国专利申请的优先权,其全部内容通过引用结合在本申请中。
本发明属于具有抗肿瘤活性药物的合成技术领域,具体涉及一种厄洛替尼衍生物及其在制备抑制ido1活性药物、抗肿瘤药物中的应用。
背景技术:
厄洛替尼(erlotinib)又名特罗凯(tarceva),由genetech、osi、roche三家公司共同研发,由roche(瑞士罗氏)制药厂生产的首个表皮生长因子酪氨酸激酶的选择性抑制剂。此药在我国、美国、欧洲分别于2006年4月、2004年11月以及2005年9月通过审批上市。同时,在2005年批准盐酸厄洛替尼与吉西他滨联用来治疗胰腺癌,是近年来首个被批准用于胰腺癌晚期治疗的药物。目前主要适用于在经过两个或者两个以上化疗方案失败后的,转移的非小细胞肺癌或者局部晚期的二、三线治疗;厄洛替尼含有喹唑啉骨架。在天然生物碱中存在喹唑啉衍生物,在药物化学中喹唑啉骨架也是重要的结构,许多含有喹唑啉结构的化合物表现出良好的抗癌、抗菌、消炎等作用。1,2,3-三氮唑是一种重要的农药、医药药效基团,具有良好的生物兼容性和芳香性。多年来,以1,2,3-三氮唑通常作为一种重要的药效基团,经过点击化学反应将不同底物的药效分子链接到一起,其经过结构改造显现出较好的效果。厄洛替尼作为一种抗癌药,已经出现了耐药性和不良反应。
技术实现要素:
有鉴于此,本发明的目的在于提供厄洛替尼衍生物在制备抑制ido1活性的药物、抗肿瘤药物中的应用。
为了实现上述发明目的,本发明提供了以下技术方案:
本发明提供了一种厄洛替尼衍生物,所述厄洛替尼衍生物的结构式为:
其中n为1或2,r1和r2和r3和r4为不同的取代基。
优选的,所述厄洛替尼衍生物的结构式为:
本发明提供了所述的厄洛替尼衍生物在制备抑制ido1活性的药物中的应用。
本发明提供了所述的厄洛替尼衍生物在制备抗肿瘤药物中的应用。
本发明提供了所述的厄洛替尼衍生物在制备预防和/或治疗肺癌的药物中的应用。
优选的,所述肺癌包括非小细胞肺癌。
本发明提供了所述的厄洛替尼衍生物在制备抑制野生型肺癌肿瘤细胞的药物中的应用。
本发明提供了所述的厄洛替尼衍生物在制备抑制突变型肺癌肿瘤细胞的药物中的应用。
本发明的有益效果:本发明所述的厄洛替尼衍生物为厄洛替尼-1,2,3-三氮唑类化合物;该类化合物对ido1具有良好的抑制作用,1,2,3-三氮唑结构能够与血红素中的fe离子形成比较强烈的作用效果,竞争性的抑制ido1酶活;该类化合物对野生型肺癌肿瘤细胞具有良好的抑制作用,同时对突变型肺癌肿瘤细胞也具有抑制作用,比厄洛替尼具有显著的肿瘤细胞抑制活性普遍性。
附图说明
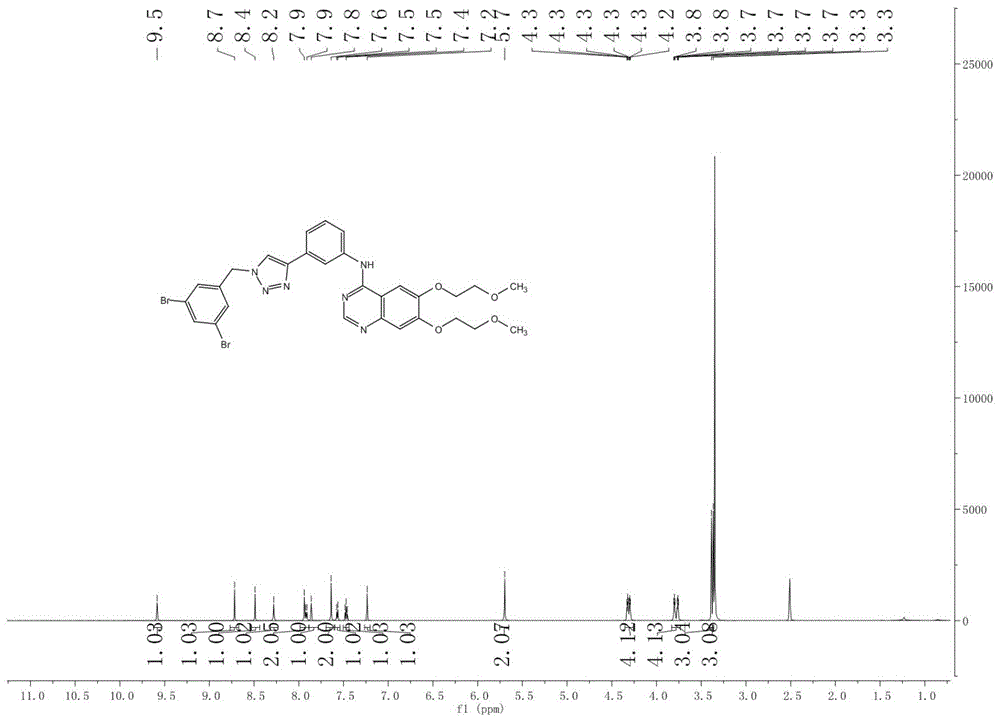
图1为实施例1所得到化合物的核磁氢谱;
图2为实施例1所得化合物诱导细胞凋亡;a为pc-9细胞,b为h460细胞,c为赫斯特染色(hoechststains)。
图3为实施例1所得化合物诱导细胞周期阻滞;a为pc-9细胞,b为h460细胞,c为qpcr结果。
图4为实施例1抑制pc-9肿瘤生长结果;a为肿瘤图像,b为肿瘤生长曲线,c为肿瘤重量,d为小鼠体重变化率;
图5为实施例1抑制4t1肿瘤生长结果;a为肿瘤图像,b为肿瘤生长曲线,c为肿瘤重量,d为肿瘤he染色。
具体实施方式
本发明提供了一种厄洛替尼衍生物,所述厄洛替尼衍生物的结构式为:
其中n为1或2,r1和r2和r3和r4为不同的取代基。
优选的,所述厄洛替尼衍生物的结构式为:
在本发明中,所述的的厄洛替尼衍生物的制备方法如下:
(1):把一定量的3,4-二(2-甲氧基乙养基)苯甲酸乙酯溶于二氯乙烷中,在室温条件下搅拌均匀后加入n-碘代丁二酰亚胺,然后在室温反应至原料反应完全,过滤反应液,滤液倒入冰水中,加入饱和的氢氧化钠溶液,分出有机相,有机相再用稀盐酸溶液调节ph为中性,再次分出有机相,用无水硫酸镁干燥后浓缩得到6-碘-3,4-二(2-甲氧基乙养基)苯甲酸乙酯;所述的3,4-二(2-甲氧基乙养基)苯甲酸乙酯与n-碘代丁二酰亚胺的投料量摩尔比为1:1.1~2。
(2):在带有分水器的密闭的反应瓶中,把一定量的6-碘-3,4-二(2-甲氧基乙养基)苯甲酸乙酯和三(三苯基膦)氯化钴和1,8-二氮杂二环十一碳-7-烯和碳酸铯加入到无水甲苯中,搅拌均匀后,通过氮气对反应瓶置换三次气体,然后缓慢升温至回流,回流搅拌反应一段时间后降至室温,缓慢滴加溶有叠氮基三甲基硅烷和碘化钾的甲苯溶液,滴加完后升温至70℃,保持该温度反应一段时间可以明显观察到反应液的颜色加深,由此可以判断苯环上的碘被置换,通过观察反应液颜色固定后升温至回流,然后向分水器中加入溶有氨基磺酸铵的水溶液,甲苯回流进入分水器与水混合,通过分水器缓慢向反应液中滴加混合液,再通过回流体系不断循环,持续反应一段时间后降至室温,然后向滤液中滴加稀盐酸,使滤液中的ph达到1~2,置于10℃条件下缓慢搅拌,逐渐有固体析出,过滤后在丙酮中重结晶,以此进一步除去碘引入的颜色,然后再次过滤,收集滤饼烘干后得到4,5-二(2-甲氧基乙养基)-2氨基苯甲酸乙酯盐酸盐;所述的6-碘-3,4-二(2-甲氧基乙养基)苯甲酸乙酯与叠氮基三甲基硅烷与碘化钾与氨基磺酸铵的投料量摩尔比为1:1.2:0.1:1.5。
(3):把一定量的4,5-二(2-甲氧基乙养基)-2胺基苯甲酸乙酯盐酸盐加入甲酰胺中,在室温条件下搅拌均匀后再加入溶有甲酸铵的甲酰胺溶液,在氮气氛围下,缓慢加热至一定温度,反应至原料反应完全,冷却至室温,向反应液中加入乙酸乙酯,搅拌一段时间后加入水,分出有机相,浓缩后得到6,7-二(2-甲氧基乙氧基)喹唑啉-4-酮;所述的4,5-二(2-甲氧基乙养基)-2胺基苯甲酸乙酯盐酸盐与酸铵的投料量摩尔比为1:3;所述的反应温度为130~160℃。
(4):把一定量的6,7-二(2-甲氧基乙氧基)喹唑啉-4-酮和n,n-二甲基甲酰胺加入到二氯亚砜中,缓慢升温至回流,反应结束后,真空蒸除未反应完的二氯亚砜,然后在0~10℃条件下加入饱和碳酸氢钠溶液,搅拌后用二氯甲烷萃取多次,合并有机相,然后用饱和食盐水洗涤一次,再用水洗涤多次,无水硫酸钠干燥后浓缩得到6,7-二(2-甲氧基乙氧基)喹唑啉-4-氯。
(5):把一定量的6,7-二(2-甲氧基乙氧基)喹唑啉-4-氯加入异丙醇中,在室温条件下搅拌均匀,然后加入间氨基苯乙炔,再次搅拌均匀,加热回流,反应一段时间后冷却至室温,有大量固体生成,抽滤后烘干得到厄洛替尼。
(6):把一定量的厄洛替尼和叠氮化合物加入叔丁醇,水和四氢呋喃的溶液中,再加入一定量的五水硫酸铜和抗坏血酸钠,然后加热至70℃反应至监控厄洛替尼反应完全,向反应液中加入二氯甲烷,然后过滤反应液,分出有机相,浓缩后得到产品;所述的厄洛替尼与叠氮化合物与五水硫酸铜与抗坏血酸钠的投料量质量比为2:2:1:2。
本发明所述的厄洛替尼衍生物的制备方法,其特征在于制备过程中的反应方程式为:
本发明提供了所述的厄洛替尼衍生物在制备抑制ido1活性的药物中的应用。
本发明提供了所述的厄洛替尼衍生物在制备抗肿瘤药物中的应用。
本发明提供了所述的厄洛替尼衍生物在制备预防和/或治疗肺癌的药物中的应用。
优选的,所述肺癌包括非小细胞肺癌。
本发明提供了所述的厄洛替尼衍生物在制备抑制野生型肺癌肿瘤细胞的药物中的应用。
本发明提供了所述的厄洛替尼衍生物在制备抑制突变型肺癌肿瘤细胞的药物中的应用。
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
把厄洛替尼1g和3,5-二溴苄基叠氮1g加入叔丁醇10ml,水10ml和四氢呋喃10ml的溶液中,再加入五水硫酸铜0.5g和抗坏血酸钠10ml,然后加热至70℃反应至tlc监控厄洛替尼反应完全,向反应液中加入二氯甲烷,然后过滤反应液,分出有机相,浓缩后得到产品1.21g;1hnmr(400hz,dmso-d6):9.56(s,1h),8.71(s,1h),8.48(s,1h),8.27(s,1h),7.91(d,j=8.0hz,2h),7.86(d,j=4.0hz,1h),7.63(s,2h),7.56(d,j=8.0hz,1h),7.46(t,j1=8.0hz,j2=8.0hz,1h),7.23(s,1h),5.69(s,2h),4.33-4.28(m,4h),3.81-3.74(m,4h),3.38(s,3h),3.36(s,3h);13cnmr(101hz,dmso-d6):156.83,154.07,153.40,148.56,147.44,147.21,140.82,140.54,133.73,131.21,130.67,129.53,123.23,122.41,120.84,119.29,109.43,108.67,103.68,70.60,70.53,68.82,68.51,58.87,58.82,52.01。
实施例2
ido1抑制活性检测
从co2培养箱中取出具有活力的人宫颈癌hela细胞培养皿,分别进行如下操作:在酒精灯旁进行无菌操作,打开皿盖,吸出培养液于废液缸中,用2ml的pbs洗培养瓶中的培养液两次,用0.25%的胰蛋白酶进行消化,待观察发现出现细胞间隙增大、细胞变成小圆圈形状时终止消化,使用移液枪吹打培养瓶底部使细胞脱落,将所得的细胞悬浮液转移至无菌离心管中,设置离心机为1000r/min,3min,进行离心,然后缓慢倾倒离心管中的上清液,加入2~5ml的培养液,于倒置显微镜下进行细胞计数。根据计数结果,将处于对数期生长的具有活力的人宫颈癌hela细胞以每孔50000个细胞的数目铺于96孔细胞培养板中,用含10%胎牛血清的rpmi1640培养5~6h,加入100μl用培养基稀释好的待测化合物(浓度分别为0.2μmol/l,0.4μmol/l,0.8μmol/l,1.6μmol/l,3.2μmol/l,6.4μmol/l,12.8μmol/l,25.6μmol/l)和重组人源干扰素γ(终浓度为100ng/mg)激活hela细胞中的ido1表达。操作完后将96孔细胞培养板放入富含5%二氧化碳的37℃细胞培养箱中培养18h后,用一定量的3.05n的三氯乙酸终止反应,然后置于50℃孵育30分钟。细胞培养液经沉淀后,取上清液用对(n,n-二甲基)苯甲醛显色后经多功能酶标仪检测480nm处的吸光度。将不含药物只有ifnγ培养基处理的组作为100%(at),只含0.1%dmso培养基处理的组作为空白对照0%(ab);根据下面的公式计算不同条件处理时的吸光度:吸光度%=(a-ab)/(at-ab),a:药物处理+100ng/mlifnγ,ab:空白对照,at:没有药物只含有100ng/mlifnγ;根据使用graphpadprism8.0软件生成具有ic50值的抑制曲线。实施例1得到的目标化合物为0.587μmol/l。
实施例3
抑制细胞增殖活性测试
从co2培养箱中取出肺癌细胞h460,h1975,h1299,a549,pc-9的培养皿,分别进行如下操作:在酒精灯旁进行无菌操作,打开皿盖,吸出培养液于废液缸中,用2ml的pbs洗培养瓶中的培养液两次,用0.25%的胰蛋白酶进行消化,待观察发现出现细胞间隙增大、细胞变成小圆圈形状时终止消化,使用移液枪吹打培养瓶底部使细胞脱落,将所得的细胞悬浮液转移至无菌离心管中,设置离心机为800r/min,3min,进行离心,然后缓慢倾倒离心管中的上清液,加入2~5ml的培养液,于倒置显微镜下进行细胞计数。根据计数结果,用相应的培养液将其配制成1×105cells/ml的单细胞悬液,然后接种于6孔板中,且每孔2ml。将6孔板放入37℃,5%co2培养箱中培养24h。
提前24h将100μl肿瘤细胞悬液接种96孔中,1500~2000个细胞/孔;除去原培养基,分别加入100μl含不同测试药物(终浓度为1μm、2μm、4μm、8μm或16μm)的培养基继续培养48h,每组3个复孔,用0.1%dmso作为对照;除去含药的培养基,加入100μl用完全培养基稀释的1xcellcountingkit-8(cck-8)试剂,并将96孔板放置于培养箱孵育1~4h;使用synergyhtx多功能酶标仪检测450nm处的吸光度;用吸光度计算抑制率,计算公式为:抑制率=[(ac-as)/(ac-ab)]×100%;as,实验孔(药物处理);ac,对照孔(0.1%dsmo处理);ab,空白组(不含细胞)。用graphpadprism8.0软件确定药物对细胞生长的半抑制浓度(ic50)。
实施例1得到的目标化合物测得半抑制浓度分别为5.18μmol/l,3.31μmol/l,7.06μmol/l,5.80μmol/l,4.38μmol/l;厄洛替尼分别为6.04μmol/l,12.67μmol/l,22.31μmol/l,10.20μmol/l,0.21μmol/l。
实施例4
细胞凋亡检测
根据生产商的使用说明书,使用annexinv/pi细胞凋亡试剂盒,通过流式细胞术进行细胞凋亡分析。提前24h将1mlpc-9或h460细胞悬液(4×104~6×104/孔)接种在12孔板中;除去原始培养基,用0.1%dmso(完全培养基稀释)作为对照,分别用1ml含不同浓度实施例1所得目标化合物(终浓度为4μm、8μm或12μm)的完全培养基处理48h;收集细胞,并用pbs洗涤;用100μl含有1μlpi和1μlfitcannexinv的1xannexinvbindingbuffer重悬细胞,在黑暗中室温孵育15min;将200μl1xannexinvbindingbuffer添加到每个试管中,并进行流式细胞术分析;使用flowjov10软件分析凋亡细胞的百分比。
用实施例1得到的目标化合物处理的pc-9细胞凋亡率分别为10.24%(4μm),14.45%(8μm)和35.74%(12μm);h460细胞凋亡率分别为9.78%(4μm),47.97%(8μm),72.37%(12μm)。
实施例5
赫斯特染色(hoechststains)检测细胞凋亡
将100μl的pc-9细胞悬液(3000/孔)铺于96孔板中,生长24h;分别用含用不同浓度实施例1所得目标化合物(终浓度为4μm、8μm或12μm)的完全培养基处理24h,将0.1%dmso(完全培养基稀释)作为对照;除去细胞培养基,加入100μl含1xhoechst33342染料的培养基替换,细胞在培养箱中孵育5~15min;用pbs洗涤两次;在nikonti-u显微镜下观察并成像。
与0.1%dmso处理的细胞相比,实施例1所得化合物处理的pc-9细胞表现出典型的凋亡特征,例如细胞核浓缩,染色质碎裂和细胞收缩,表明实施例1所得化合物的确诱导了pc-9细胞凋亡。
实施例6
细胞周期阻滞检测
根据生产商的使用说明书,使用细胞周期染色试剂盒(cell-cyclestainingkit),通过流式细胞术进行细胞周期分析。提前24h将2ml的pc-9或h460的细胞悬液(2×105~3×105/孔)接种在6孔板中;除去原始培养基,用0.1%dmso(完全培养基稀释)作为对照,分别用2ml含实施例1所得化合物(终浓度为4μm、8μm或12μm)的完全培养基处理24h(pc-9)或12h(h460);收集细胞,用pbs洗涤;将dnastainingsolution和permeabilizationsolution按100:1预混,每个样品加入300μl混合液,涡旋振荡5~10s混匀,室温避光孵育30min;选择最低上样速度在流式细胞仪上检测进行;使用modfitlt软件分析细胞dna含量及其周期相的分布。
实施例1得到的目标化合物使pc-9和h460细胞阻滞在g0/g1期。
实施例7
细胞周期调节相关基因qpcr检测
将1ml的a549细胞悬液(5×104~10×104/孔)接种于12孔板生长24h;分别用含不同浓度实施例1所得目标化合物(终浓度为4μm、8μm或12μm)的完全培养基处理细胞,将0.1%dmso(完全培养基稀释)作为对照;16h后收集细胞,并用pbs洗涤,弃上清;将细胞沉淀冻于-80℃超低温冰箱,直至提rna之前。将细胞沉淀从-80℃超低温冰箱取出;将300μl的lysisbuffer加入每个细胞样品,用移液器用力吹打10次,旋涡震荡10s以上,充分裂解细胞;向裂解的细胞中加入300μl的无水乙醇,上下颠倒或用移液器用力吹打10次,将液体加入离心柱;4000xg离心1min,弃收集管中的废液;向rna柱中加入500μl的washbuffer,12000xg离心1min,弃收集管中的废液;12000xg空管离心一次;将rna柱重放置于干净的无rna酶的1.5ml离心管,开盖晾干2min;在rna柱的膜中心部位加入20~50μlddh2o,室温静置2min;12000xg离心1min,测定rna浓度;将rna冻于-80℃超低温冰箱,直至下一步实验。按表1配制反应溶液:将配制好的反应溶液置于pcr仪中反应(42℃、2min);按表2配制反应溶液,向上一步骤的反应溶液中加入10μl配制好的反应溶液;将好的反应溶液置于pcr仪中反应(37℃、15min,85℃、15s,)。按以下条件在荧光定量pcr仪中扩增:holdingstage(95℃,30s),cyclingstage(95℃,5s;60℃,34s),40个循环;meltcurvestage(95℃,15s;60℃,1min)。引物序列见表3。mrna的平均相对表达量用2–δδct的计算方法计算。
表1反转录体系
表2rt-qpcr扩增体系
表3引物序列
实施例8
pc-9成瘤实验
取对数期生长的肺癌肿瘤细胞pc-9,用0.25%胰蛋白酶消化,收集细胞,并用pbs重悬细胞,计数后以3×106个细胞/只的密度接种于nsg小鼠皮下;待皮下肿瘤体积生长至可测量时,随机分为3组:对照组、实施例1得到的目标化合物组、厄洛替尼组;用含5%dmso和30%peg300的ddh2o溶解厄洛替尼和目标化合物组至终浓度为2.5mg/ml;按每天1次的频率分别给予不同的药物腹腔注射给药,按小鼠体重给予相应剂量(25mg/kg)的药物,对照组给予溶剂(含5%dmso和30%peg300的ddh2o),目标化合物组和厄洛替尼组分别给予终浓度为25mg/kg的化合物目标化合物组或厄洛替尼;测量肿瘤体积及小鼠体重:从第1天给药开始,每2天1次用游标卡尺测量肿瘤的长和宽,并测量小鼠体重,肿瘤体积计算公式为:肿瘤体积(mm3)v=长×宽×宽/2;待小鼠移植瘤生长至直径不超过15mm时停止给药,颈椎脱臼处死nsg鼠,解剖移植瘤并称重。
与给予溶剂的对照组相比,用目标化合物和厄洛替尼显示出良好的肿瘤生长抑制作用。此外,统计分析显示使用目标化合物或厄洛替尼治疗,肿瘤生长速度没有显著性差异。接种19天后解剖肿瘤并称重。给予目标化合物或厄洛替尼后,肿瘤重量显著降低,并且在两组之间未检测到显著差异。此外,给药后三组之间的体重改变未发现显著性差异。
实施例9
小鼠乳腺癌细胞4t1成瘤实验
取对数期生长的肿瘤细胞4t1,用0.25%胰蛋白酶消化,收集细胞,并用pbs重悬细胞,计数后以0.75×106个细胞/只的密度接种于balb/c小鼠皮下;待皮下肿瘤体积生长至可测量时,随机分为4组:对照组、实施例1得到的目标化合物组、厄洛替尼组、epacadostat组;用含5%dmso和30%peg300的ddh2o溶解厄洛替尼、目标化合物组或epacadostat至其终浓度为2.5mg/ml;分别按小鼠体重腹腔注射给予相应剂量(25mg/kg)的药物,对照组给予溶剂(含5%dmso和30%peg300的ddh2o),目标化合物组、厄洛替尼组和epacadostat组分别给予终浓度为25mg/kg的目标化合物组(qd)、厄洛替尼(qd)或epacadostat(bid);从第1天给药开始,每周2次用游标卡尺测量肿瘤的长和宽,肿瘤体积计算公式为:肿瘤体积(mm3)v=长×宽×宽/2;待裸鼠移植瘤生长至直径不超过15mm时停止给药,颈椎脱臼处死balb/c小鼠,解剖移植瘤并称重,留取部分肿瘤组织用于he染色。
目标化合物和epacadostat明显抑制了4t1肿瘤的生长,并且还降低了最终肿瘤的重量。虽然统计分析结果表明,厄洛替尼在接种后第14天抑制了4t1肿瘤的生长,但与给予溶剂的对照组相比,肿瘤的体积没有显著变化。另外,使用he染色发现,在暴露于目标化合物的肿瘤组织中更容易观察到核溶解和核碎裂等组织坏死现象。
实施例10
把3,4-二(2-甲氧基乙养基)苯甲酸乙酯3g溶于二氯乙烷30ml中,在室温条件下搅拌30min,然后分批加入n-碘代丁二酰亚胺2.5g,每批5g时间间隔10min,加完最后一批n-碘代丁二酰亚胺后在室温反应2h,tlc监控原料反应完全,过滤反应液,滤液倒入冰水30ml中,加入饱和的氢氧化钠溶液8ml,分出有机相,有机相再用稀盐酸溶液调节ph为中性,再次分出有机相,用无水硫酸镁干燥后浓缩得到6-碘-3,4-二(2-甲氧基乙养基)苯甲酸乙酯2.9g;1hnmr(400hz,dmso-d6):7.26(s,1h),7.11(s,1h),4.15(t,j1=4.0hz,j2=4.0hz,2h),4.11(t,j1=4.0hz,j2=4.0hz,2h),3.82-3.77(m,2h),3.74(t,j1=4.0hz,j2=4.0hz,2h),3.59-3.55(m,2h),3.39(s,3h),3.37(s,3h),1.28(t,j1=4.0hz,j2=4.0hz,3h);lc-ms(esi):425[m+h]+
实施例11
把3,4-二(2-甲氧基乙养基)苯甲酸乙酯3g溶于二氯乙烷30ml中,在室温条件下搅拌30min,然后分批加入n-碘代丁二酰亚胺4.6g,每批1.15g时间间隔10min,加完最后一批n-碘代丁二酰亚胺后在室温反应1h,tlc监控原料反应完全,过滤反应液,滤液倒入冰水50ml中,加入饱和的氢氧化钠溶液10ml,分出有机相,有机相再用稀盐酸溶液调节ph为中性,再次分出有机相,用无水硫酸镁干燥后浓缩得到6-碘-3,4-二(2-甲氧基乙养基)苯甲酸乙酯3.7g;1hnmr(400hz,dmso-d6):7.26(s,1h),7.11(s,1h),4.15(t,j1=4.0hz,j2=4.0hz,2h),4.11(t,j1=4.0hz,j2=4.0hz,2h),3.82-3.77(m,2h),3.74(t,j1=4.0hz,j2=4.0hz,2h),3.59-3.55(m,2h),3.39(s,3h),3.37(s,3h),1.28(t,j1=4.0hz,j2=4.0hz,3h);lc-ms(esi):425[m+h]+。
实施例12
在带有分水器的密闭的反应瓶中,把6-碘-3,4-二(2-甲氧基乙养基)苯甲酸乙酯4.5g和三(三苯基膦)氯化钴0.35g和1,8-二氮杂二环十一碳-7-烯2g和碳酸铯3.2g加入到无水甲苯50ml中,搅拌均匀后,通过氮气对反应瓶置换三次气体,然后缓慢升温至回流,回流搅拌反应2h,然后降至室温,缓慢滴加溶有叠氮基三甲基硅烷1.4g和碘化钾0.17g的甲苯溶液10ml,滴加完后升温至70℃,保持该温度反应30min,反应过程中可以明显观察到反应液的颜色加深,由此可以判断苯环上的碘被置换,通过观察反应液颜色固定后升温至回流,然后向分水器中加入溶有氨基磺酸铵1.8g的水溶液10ml,甲苯回流进入分水器与水混合,通过分水器缓慢向反应液中滴加混合液,再通过回流体系不断循环,持续反应1h,降至室温,然后向滤液中滴加稀盐酸,使滤液中的ph达到1~2,置于10℃条件下缓慢搅拌,逐渐有固体析出,过滤后在丙酮和石油醚混合液中重结晶,以此进一步除去碘引入的颜色,然后再次过滤,收集滤饼烘干后得到4,5-二(2-甲氧基乙养基)-2氨基苯甲酸乙酯盐酸盐3.0g。
实施例13
在反应瓶中,把4,5-二(2-甲氧基乙养基)-2胺基苯甲酸乙酯盐酸盐3.5g加入甲酰胺20ml中,在室温条件下搅拌10min,然后再加入溶有甲酸铵2g的甲酰胺溶液10ml,在氮气氛围下,缓慢加热至130℃,反应6h,tlc监控原料反应完全,冷却至室温,向反应液中加入乙酸乙酯35ml,搅拌30min,然后加入水15ml,继续搅拌10min,分出有机相,浓缩后得到6,7-二(2-甲氧基乙氧基)喹唑啉-4-酮2.7g。
实施例14
在反应瓶中,把6,7-二(2-甲氧基乙氧基)喹唑啉-4-酮3g和n,n-二甲基甲酰胺1ml加入到二氯亚砜30ml中,缓慢升温至回流,反应结束后,真空蒸除未反应完的二氯亚砜,然后在0~10℃条件下加入饱和碳酸氢钠溶液20ml,搅拌20min,用二氯甲烷10ml萃取多次,合并有机相,然后用饱和食盐水洗涤一次,再用水洗涤多次,无水硫酸钠干燥后浓缩得到6,7-二(2-甲氧基乙氧基)喹唑啉-4-氯2.4g。
实施例15
在反应瓶中,把6,7-二(2-甲氧基乙氧基)喹唑啉-4-氯3g加入异丙醇50ml中,在室温条件下搅拌均匀,然后加入间氨基苯乙炔1.3g,再次搅拌均匀,加热回流,反应1.2h,缓慢冷却至室温,有大量固体生成,继续降温至0℃搅拌30min,抽滤后烘干得到厄洛替尼3.1g。
实施例16
把厄洛替尼1g和2-氟苄基叠氮1g加入叔丁醇10ml,水10ml和四氢呋喃10ml的溶液中,再加入五水硫酸铜0.5g和抗坏血酸钠1g,然后加热至70℃反应至tlc监控厄洛替尼反应完全,向反应液中加入二氯甲烷,然后过滤反应液,分出有机相,浓缩后得到产品1.17g;1hnmr(400hz,dmso-d6):9.62(s,1h),9.11(s,1h),8.50(s,1h),8.38(s,1h),7.95(dd,j1=4.0hz,j2=8.0hz,3h),7.69-7.59(m,3h),7.54-7.47(m,2h),7.24(s,1h),4.34-4.29(m,4h),3.81-3.75(m,4h),3.39(s,3h),3.36(s,3h);13cnmr(101hz,dmso-d6):156.85,154.07,153.40,153.12,148.54,147.47,147.40,140.64,131.92,130.76,129.60,126.53,126.10,123.37,122.73,121.07,119.47,117.77,117.57,109.45,108.67,103.69,70.61,70.54,68.84,68.50,58.87,58.81。
实施例17
把厄洛替尼1g和4-甲基苯基叠氮1g加入叔丁醇10ml,水10ml和四氢呋喃10ml的溶液中,再加入五水硫酸铜0.5g和抗坏血酸钠1g,然后加热至70℃反应至tlc监控厄洛替尼反应完全,向反应液中加入二氯甲烷,然后过滤反应液,分出有机相,浓缩后得到产品0.66g;1hnmr(400hz,dmso-d6):9.63(s,1h),9.28(s,1h),8.51(s,1h),8.37(s,1h),7.95(d,j=4.0hz,2h),7.87(d,j=8.0hz,2h),7.67(d,j=4.0hz,1h),7.52(t,j1=8.0hz,j2=4.0hz,1h),7.45(d,j=4.0hz,2h),7.25(s,1h),4.34-4.30(m,4h),3.82-3.76(m,4h),3.39(s,3h),3.37(s,3h),2.51(s,3h);13cnmr(101hz,dmso-d6):156.88,154.09,153.40,148.58,147.70,147.40,140.59,138.83,134.89,131.06,130.75,129.57,122.69,121.02,120.36,120.02,119.46,109.43,108.64,103.69,70.60,70.54,68.84,68.52,58.88,58.82,21.07。
实施例18
把厄洛替尼0.5g和苄基叠氮0.5g加入叔丁醇5ml,水5ml和四氢呋喃5ml的溶液中,再加入五水硫酸铜0.25g和抗坏血酸钠0.5g,然后加热至70℃反应至tlc监控厄洛替尼反应完全,向反应液中加入二氯甲烷,然后过滤反应液,分出有机相,浓缩后得到产品0.41g;1hnmr(400hz,dmso-d6):9.55(s,1h),8.66(s,1h),8.48(s,1h),8.26(s,1h),7.90(d,j=12.0hz,2h),7.56(d,j=4.0hz,1h),7.45(t,j1=8.0hz,j2=8.0hz,1h),7.41-7.33(m,5h),7.23(s,1h),5.66(s,2h),4.32-4.28(m,4h),3.80-3.74(m,4h),3.38(s,3h),3.36(s,3h);13cnmr(101hz,dmso-d6):156.83,154.06,153.39,148.55,147.44,147.11,140.52,136.50,131.39,129.48,129.29,128.66,128.42,122.27,122.12,120.78,119.23,109.43,108.67,103.68,70.60,70.53,68.82,68.50,58.87,58.82,53.52。
实施例19
将hela细胞以每孔40000个细胞的数目铺于96孔细胞培养板中,用含10%胎牛血清的rpmi1640培养5-6h,加入稀释好的待测化合物(0.1μmol/l,0.2μmol/l,0.4μmol/l,0.8μmol/l,1.6μmol/l,3.2μmol/l,6.4μmol/l)和终浓度为100ng/mg重组人源干扰素γ激活ido1表达。细胞于富含5%二氧化碳的37℃细胞培养箱中培养20小时后,用5%三氯乙酸终止反应,并于50℃孵育30分钟。细胞培养液经沉淀后,取上清液送lc/ms检测其中的犬尿氨酸含量。根据xlfit5软件进行数据分析,检测到目标化合物ic50;实施例18得到的目标化合物为0.678μmol/l;实施例17得到的目标化合物为0.342μmol/l。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>南方医科大学;广东圣赛生物科技有限公司
<120>一种厄洛替尼衍生物及其在制备抑制ido1活性药物、抗肿瘤药物中的应用
<160>12
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>artificialsequence
<400>1
agctgtgcatctacaccgac20
<210>2
<211>20
<212>dna
<213>artificialsequence
<400>2
gaaatcgtgcggggtcattg20
<210>3
<211>20
<212>dna
<213>artificialsequence
<400>3
gtgaccagcagcggacaaat20
<210>4
<211>20
<212>dna
<213>artificialsequence
<400>4
tggactggagcaagacttcg20
<210>5
<211>20
<212>dna
<213>artificialsequence
<400>5
gcttttggagtccctgttcg20
<210>6
<211>20
<212>dna
<213>artificialsequence
<400>6
gcgagtcaccatctcagcaa20
<210>7
<211>20
<212>dna
<213>artificialsequence
<400>7
cggtactgaagtccgggaac20
<210>8
<211>20
<212>dna
<213>artificialsequence
<400>8
catgaatggtgaacgcaggc20
<210>9
<211>20
<212>dna
<213>artificialsequence
<400>9
gcagcaggagctttttgctt20
<210>10
<211>20
<212>dna
<213>artificialsequence
<400>10
ccaggtgctgcataactgga20
<210>11
<211>20
<212>dna
<213>artificialsequence
<400>11
caatgtggccgaggactttg20
<210>12
<211>22
<212>dna
<213>artificialsequence
<400>12
cattctccttagagagaagtgg22
- 还没有人留言评论。精彩留言会获得点赞!