CsSH1基因在提高黄瓜苗期耐徒长中的应用和方法
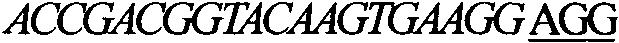
cssh1基因在提高黄瓜苗期耐徒长中的应用和方法
一、技术领域
1.本发明涉及生物技术领域,具体涉及利用crispr/cas9系统编辑cssh1基因,进而获得苗期耐徒长黄瓜的黄瓜品种。
二、
背景技术:
2.黄瓜是重要的蔬菜作物。中国的黄瓜种植面积、产量和人均年消费量均居世界首位。我国黄瓜生产以设施栽培为主,基本实现了周年供应。在生产过程中,培育壮苗是黄瓜生产中防治病虫害,获得高产的基础,但由于秋冬茬育苗期(7-8月)的高温高湿,越冬茬和冬春茬育苗期(11月后)的光照不足等气候因素,经常造成秧苗徒长问题。徒长黄瓜幼苗茎秆纤细、节间长、叶片薄而色淡,这种秧苗根系弱小,抗性差,栽植后缓苗期长,成活率低,很难获得早熟与丰产。加强保护地内的温、湿、光照和水肥管理,甚至使用一些激素类制剂能够在一定程度上防治黄瓜幼苗徒长,但偶遇极端气候就会造成生产问题,同时增加了生产成本。因此,培育苗期耐徒长的黄瓜品种是彻底解决黄瓜育苗徒长问题的最佳途径。
3.发明人团队在前期研究发现,源自我国云南省西双版纳地区的半野生资源材料西双版纳黄瓜(cucumis sativus l.var.xishuangbannanesis qi et yuan)表现为苗期下胚轴短、耐徒长的特点。发明人团队前期研究通过利用西双版纳黄瓜自交系(swcc8)和栽培黄瓜自交系
‘
北京截头’(cc3)构建了遗传定位群体,进一步通过构建遗传图谱结合基因组重测序,完成了西双版纳黄瓜短下胚轴基因cssh1的图位克隆,并研究发现该基因的突变是导致黄瓜幼苗下胚轴矮壮、耐徒长的原因(bo等,short hypocotyl1 encodes a smarca3-like chromatin remodeling factor regulating elongation,plant physiology,2016)。cssh1是一个极具商业价值的农艺性状基因,然而由于传统育种方法效率较低,cssh1基因在黄瓜改良中应用不足。
4.基因编辑技术是利用靶向性的序列特异核酸酶对基因组进行定点突变或精准修饰的技术,其中crispr/cas系统是一种具有核酸内切酶活性的复合体,识别特定的dna序列,进行特定位点切割造成双链dna断裂,在没有模板的条件下,发生非同源重组末端连接,造成移码突变,导致基因敲除。这一技术由于能快速、简便、高效地靶向基因组任何基因,从而引起了广泛的关注,在基因功能研究与作物的遗传改良中得到了广泛应用。目前随着crispr/cas9基因编辑技术的发展完善,可以在基因组的特定位点产dna双链断裂,实现基因敲除、定点插入或替换,可以定向的对植物基因组进行编辑,并且通过后代的分离可已将含有转基因成分的植株分离出去,达到精确快速改良品种的目的。
三、
技术实现要素:
5.本发明要解决的技术问题是解决不良栽培环境下黄瓜幼苗徒长的问题,提供一种培育耐徒长黄瓜的新方法。
6.为解决上述技术问题,本发明提供了一种利用crispr/cas系统编辑黄瓜cssh1基因从而制备苗期耐徒长黄瓜的方法。
7.本发明所编辑的与黄瓜下胚轴发育相关的基因,名称为cssh1。cssh1基因编码一个rad5同源蛋白,在dna修复过程中发挥功能。在西双版纳黄瓜中cssh1携带了一个罕见的变异位点,这个变异可能导致了基因功能的丧失,从而使黄瓜幼苗矮壮、耐徒长。所述黄瓜cssh1基因的蛋白编码区的核苷酸序列如seq id no.1所示。
8.进一步地,本发明分别在cssh1基因第1外显子处设计2个sgrna位点,分别记为sgrnaexon1-1、sgrnaexon1-2,均位于该基因的第1个外显子(见附图1),序列如下所示:
9.sgrnaexon1-1:accgacggtacaagtgaagg agg
10.sgrnaexon1-2:actcgcggatgcaatggggct tgg
11.斜体序列为19-20bp的sgrna,加下划线非斜体碱基为pam位点;sgrnaexon1-1和sgrnaexon2-1靶点均为正向序列,所述序列均是发明人通过创造性劳动筛选获得,非通过常规软件设计获得。
12.进一步地,本发明构建了含有上述sgrna和cas9蛋白的基因编辑载体;将所述含有的sgrna和cas9蛋白的基因编辑载体,利用农杆菌介导的遗传转化方法,转化到苗期不耐徒长黄瓜材料中,并进行pcr转基因鉴定。
13.进一步地,本发明采用pcr方法,扩增上述被鉴定为转基因黄瓜的cssh1靶标序列,通过对pcr产物测序,检测靶标序列处的编辑效果,确定被成功编辑的黄瓜植株。
14.进一步地,将靶点获得成功编辑的植株进行自交加代,从加代植株中采用pcr和测序方法筛选编辑靶点纯合,且不含外源基因片段的基因编辑黄瓜。
15.这些纯合的黄瓜编辑植株在高温高湿等逆境条件下幼苗表现为矮壮,与耐徒长西双版纳黄瓜swcc表型相似,而对照不耐徒长的黄瓜ccmc表现为徒长(附图2所示)。
16.本发明具有以下有益效果:
17.(1)利用基因编辑技术获得耐徒长的黄瓜植株,较传统的育种方法更经济、有效,是一种创建抗性材料的好方法,大大缩短了育种年限;
18.(2)提供了耐徒长的黄瓜基因编辑植株,为选育苗期耐徒长黄瓜杂交种提供了新的育种材料。
四、附图说明
19.图1:黄瓜cssh1基因的结构和靶点sgrnaexon1-1、sgrnaexon1-2所在位置。
20.图2:高温高湿处理下的被编辑植株和对照植株幼苗下胚轴长度的比较(左图),以及苗期下胚轴生长曲线(右图)。
21.swcc:耐徒长的西双版纳黄瓜,1和2号植株均表现为胚轴矮壮;
22.ccmc:不耐徒长的黄瓜品种,1和2号植株均表现为徒长;
23.被编辑植株:经测序验证靶点获得成功编辑的t0代黄瓜,进行自交加代的t1代植株材料,由于基因的自交分离,t1代植株表型也出现分离,其中编号sh1-3-4、sh1-3-5、sh1-3-6和sh1-3-19和sh1-3-19的植株表现为矮壮、耐徒长,而其他编号的植株表现为徒长。
24.图3:sh1-3-4、sh1-3-5、sh1-3-6和sh1-3-19和sh1-3-19这5个基因编辑黄瓜在cssh1基因靶点位置的编辑结果。
五、具体实施方式
25.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
26.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
27.举例说明本发明的具体实施过程,使本领域技术人员按照其不需要创造性劳动就能完成该发明即可,实施例的限定不能作为限定发明人保护范围的局限。
28.实施例1 黄瓜cssh1基因编辑靶点设计和编辑载体构建
29.在葫芦科作物基因组数据网站http://cucurbitgenomics.org/上找到cssh1的dna全长序列,其蛋白编码区的核苷酸序列如seq id no.1所示。将序列输入http://crispr.hzau.edu.cn/cgi-bin/crispr2/crispr在线工具,进行靶点设计及脱靶的预测。基于在线软件仅仅能用于辅助设计,因此为了提高打靶效率,本发明针对黄瓜cssh1基因设计了两个基因编辑靶点(sgrnaexon1-1和sgrnaexon1-2),均位于该基因的第1个外显子(见附图1),序列如下所示:
30.sgrnaexon1-1:
31.sgrnaexon1-2:
32.(斜体序列为19-20bp的sgrna,加下划线非斜体碱基为pam位点;sgrnaexon1-1和sgrnaexon2-1靶点均为正向序列)。
33.基因编辑基础载体pylcrispr/cas9-dn受赠于华南农业大学刘耀光院士研究团队,构建方法参照刘院士团队发表的实验技术论文ma xl,liu yg.crispr/cas9-based multiplex genome editing in monocot and dicot plants:crispr/cas9-based multiplex genome editing in plants.current protocols in molecular biology.john wiley & sons,inc.2016.)。两个靶点对应的sgrna分别由atu3b和atu61启动子驱动转录。最终构建的载体命名为pcrispr/cas9-sgrnash1。
34.实施例2 基因编辑载体的黄瓜遗传转化
35.采用通用的热激法,将构建好的pcrispr/cas9-sgrnash1重组载体转化至农杆菌gv3101中,并将pcrispr/cas9-sgrnash1/gv3101重组农杆菌转化不耐徒长的黄瓜自交系ccmc(cucumis sativus cv.ccmc,南京农业大学葫芦科作物遗传与种质创新实验室),具体方法为:
36.(1)取出保存较好的甘油pcrispr/cas9-sgrnash1/gv3101重组农杆菌菌株置于冰上溶解,在yeb液体培养基(含有50mg/l kan,50mg/l rif,20mg/l genta,10mg/l tet)中,28℃、250rpm条件下避光培育20h左右,农杆菌浓度od600的值达到0.5~1.0待用。
37.(2)选取ccmc无菌苗子叶节为转化外植体。将下胚轴纵切使子叶成均匀两片,子叶节处用刀尖轻刮造成伤口,正面向上接种于预培养基上,25℃、16小时光照条件下预培养1天。
38.(3)将预培养过后的外植体震荡重悬于重组农杆菌侵染液中孵育20min,用无菌滤纸吸除外植体表面的侵染液,正面朝上在共培养基上进行黑暗培养3天。
39.(4)将经过共培养的外植体转移到黄瓜再生诱导培养基上(100mg/l kan抗生素),15天继代一次,可继代培养2-3次,切取抗性芽转移至含有100mg/l kan的生根培养基,培养1周至生根,炼苗。
40.实施例3 转基因黄瓜分子鉴定
41.将实施例2中获得的抗性苗的幼叶去下,采用常用的ctab法提取基因组dna,设计载体所携带的卡那霉素抗性基因nptii的特异性引物nptii-f:ctgggcacaacagacaatc和nptii-r:taccgtaaagcacgaggaa,鉴定植株是插入外源t-dna。以ccmc未转化植株的基因组dna为阴性对照组,以pcrispr/cas9-sgrnash1质粒dna为阳性对照组,进行pcr扩增。pcr反应体系:模板dna 1.0μl,上下游引物各1.0μl,mix 4.2μl,加ddh2o补全至20μl。pcr设计程序为:94℃预变性5min;94℃变性30s,52℃退火40s,72℃延伸1min,35个循环;72℃10min。pcr的扩增产物在1%琼脂糖凝胶中电泳,如果扩增出38bp的目标dna条带则表示该样本为转基因,在ccmc和非转基因植株中无法扩增出dna条带,筛选到4株转基因植株。
42.实施例4 cssh1基因编辑黄瓜的筛选鉴定
43.将4株已鉴定为转基因植株的黄瓜移栽至玻璃温室,常规栽培管理,采用单株自交方式分别收获种子200-500粒。每个编号取100粒种子播种于穴盘,待植株长至2叶1心状态,分别采集叶片,采用ctab法提取基因组dna。
44.在sgrnaexonl-1和sgrnaexon2-1靶点位置设计引物sh1-pcr12-f:ggtgaccctgatgaggctatta和sh1-pcr12-r:ccaattatcaatgcctttatcttc,进行pcr扩增,pcr扩增产物约为216bp,pcr产物送公司测序,筛选靶点序列发生编辑(包括杂合、纯合、双位点编辑等)的植株。同时采用实施例3中所述的转基因鉴定引物nptii-f和nptii-r鉴定被编辑植株中是否含有转基因序列。选择被编辑位点为纯合,且无转基因序列的植株,移栽至温室,进行自交留种。
45.实施例5 被编辑植株的耐徒长性鉴定
46.分别选取上述筛选到的被编辑位点为纯合,且无外源基因插入的被编辑植株,以及不耐徒长黄瓜ccmc、耐徒长西双版纳黄瓜swcc作为对照,种子各30粒进行催芽,待种子露白后,播种到穴盘中。在人工气候箱中培养,设置高温高湿栽培条件:昼夜光周期16h/8h,温度36℃,相对湿度为80-100%,每周浇水4次,每次50ml/株。培养14天后,可以观察到swcc植株在高温高湿逆境条件下植株矮壮、耐徒长,而对照植株ccmc在逆境下出现明显徒长,编号sh1-3-4、sh1-3-5、sh1-3-6和sh1-3-19和sh1-3-21的被编辑植株表现为胚轴矮壮,其他编号的植株表现为徒长,见附图2。编号sh1-3-4、sh1-3-5、sh1-3-6和sh1-3-19和sh1-3-21的被编辑植株的靶点序列被编辑的结果见附图3。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1