一种荧光探针及其制备方法与应用
本发明属于生物医药技术领域,具体涉及一种靶向锚定线粒体中过氧亚硝酸根的荧光探针及其制备方法与应用。
背景技术:
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
在生物体内,过氧亚硝酸根(onoo-)是重要的活性氮物种,由超氧阴离子自由基和一氧化氮反应生成,能同时代表氧化应激和硝化应激的水平。而且,现有研究已表明,onoo-与多种疾病的发生和发展密切相关,包括神经退行性疾病、糖尿病、癌症等。
线粒体是活性氧和活性氮生成的主要细胞器,也是过氧亚硝酸根(onoo-)产生的主要场所。onoo-的生成、发生反应和发挥作用大部分都是在线粒体中进行的。线粒体可以生成onoo-,也可以消耗onoo-。许多与onoo-相关的生化反应,能够调节线粒体的功能。因此,检测线粒体内onoo-的浓度变化尤为重要。
目前传统的检测线粒体内onoo-的荧光探针,其结构中带有正电荷,因受到线粒体内膜负电位的牵引而靶向聚集于线粒体,进而荧光成像检测线粒体内onoo-。然而,发明人发现,线粒体膜电位处于动态变化之中,当膜电位降低时,线粒体对探针的亲和力相应降低,探针将从线粒体中渗出。而onoo-具有很强的细胞毒性,能够损害线粒体的结构和功能,使线粒体膜电位显著降低甚至完全消失,从而干扰探针对线粒体的靶向功能。因此,传统的靶向探针无法对线粒体内的过氧亚硝酸根进行稳定和精准的荧光成像检测。
技术实现要素:
为了解决现有技术的不足,本发明提供一种荧光探针及其制备方法与应用,该探针以萘酰亚胺为荧光信号单元,以甲酰胺作为过氧亚硝酸根响应基团,响应速度快,灵敏度高,选择性好。此外,探针结构中的吡啶阳离子使其能够靶向聚集于线粒体,苄基氯基团能够与线粒体内的巯基蛋白形成共价连接,进而使探针锚定在线粒体内,即使线粒体膜电位显著降低甚至完全消失,探针也不会从线粒体内渗出,从而对线粒体内的过氧亚硝酸根进行稳定和精准的荧光成像检测。
为了解决以上技术问题,本发明第一方面提供一种荧光探针,其结构式为:
其中,r1选自氢、乙酰基、c1-c8的直链烷基、f、cl或cn。
本发明第二方面提供一种上述荧光探针在对活细胞线粒体中过氧亚硝酸根进行荧光成像检测方面的应用。
本发明第三方面提供一种上述荧光探针的制备方法,具体步骤为:将化合物1和化合物2溶于乙腈中进行反应,即得所述荧光探针;
反应方程式为:
本发明的一个或多个实施方式至少具有以下有益效果:
(1)该探针对onoo-响应迅速,在化学体系中2秒钟内反应完毕,能够快速捕获生理环境中反应活性高、半衰期短的onoo-。
(2)该探针对onoo-的荧光响应具有高灵敏度,检测限低至187nm。同时,探针检测onoo-具有高的选择性,可用于细胞内复杂环境中的onoo-荧光成像检测。
(3)相比于传统的靶向探针,该探针能够靶向并锚定在线粒体内,即使线粒体膜电位显著降低甚至完全消失,探针也不会从线粒体内渗出,从而对线粒体内的过氧亚硝酸根进行稳定和精准的荧光成像检测,尤其能够用于检测线粒体膜电位降低的生命过程中线粒体onoo-的浓度变化,应用范围广。
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
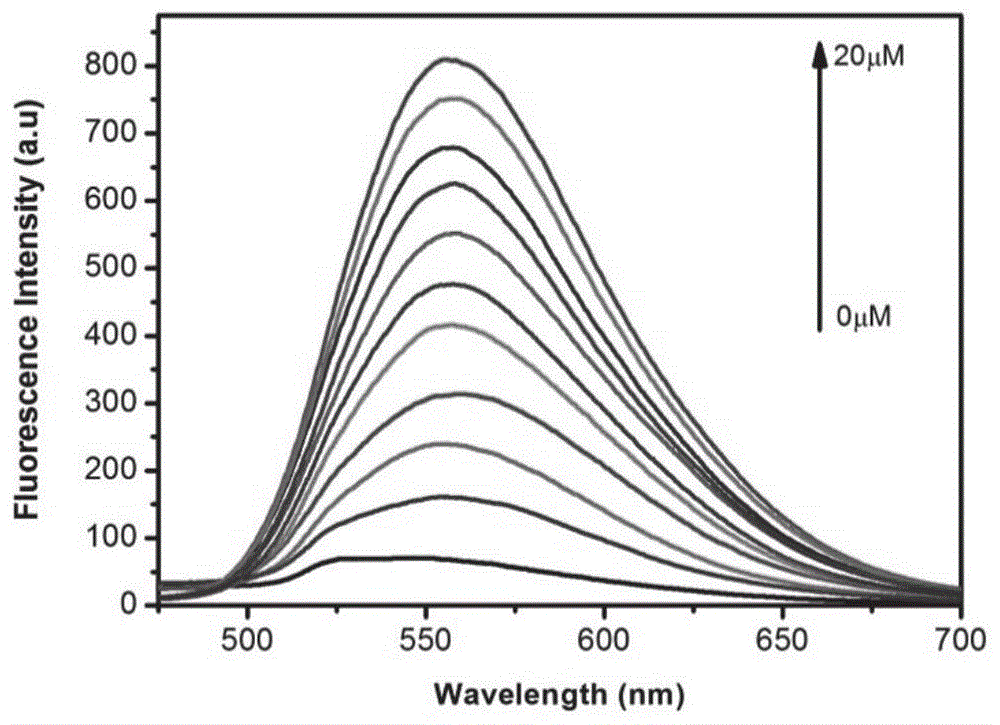
图1是本发明所述探针对不同浓度的onoo-的荧光响应光谱图;横坐标为波长(nm),纵坐标为荧光发射强度。
图2是本发明所述探针在556nm处的荧光强度与onoo-浓度的线性关系;横坐标为onoo-浓度(μm),纵坐标为荧光发射强度。
图3是本发明所述探针与onoo-孵育前后556nm处荧光强度的实时变化图;横坐标为时间(s),纵坐标为荧光发射强度。
图4是不同种类物质存在时,本发明所述探针556nm处的荧光强度。横坐标为不同种类物质,纵坐标为荧光发射强度。
图5是本发明所述探针与商品化线粒体染料在人宫颈癌细胞(hela)中的荧光成像图。
图6是本发明所述探针和对照探针对hela细胞线粒体膜电位降低过程中线粒体内onoo-的荧光成像图。
图7是本发明所述探针和对照探针对饥饿诱导自噬过程中hela细胞线粒体内onoo-的荧光成像图。
具体实施方式
应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式。此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
正如背景技术所介绍的,线粒体膜电位处于动态变化之中,当膜电位降低时,线粒体对探针的亲和力相应降低,探针将从线粒体中渗出,从而干扰探针对线粒体的靶向功能,因此,传统的靶向探针无法对线粒体内的过氧亚硝酸根进行稳定和精准的荧光成像检测。
为了解决如上的技术问题,本发明第一方面提供一种荧光探针,其结构式为:
其中,r1选自氢、乙酰基、c1-c8的直链烷基、f、cl或cn。
本发明第二方面提供一种上述荧光探针在对活细胞线粒体中过氧亚硝酸根进行荧光成像检测方面的应用。
上述荧光探针对活细胞线粒体中过氧亚硝酸根进行荧光成像检测的方法,包括如下步骤:将培养的细胞经适当处理后,用本发明所述探针的二甲基亚砜溶液孵育,去除上述溶液,并用pbs清洗,然后进行激光共聚焦成像;
优选的,孵育时间为20-40分钟。
在现有的活细胞线粒体中过氧亚硝酸根的荧光成像检测方法中,一般通过结构中带有正电荷的荧光探针来完成,其能够受到线粒体内膜负电位的牵引而靶向聚集于线粒体,进而检测线粒体内onoo-。但事实上采用这种方法来检测,结果非常不准确,原因在于:线粒体膜电位并非是一成不变的,其电位时刻处于动态变化之中,当膜电位降低时,线粒体对探针的亲和力相应降低,探针将从线粒体中渗出,而onoo-具有很强的细胞毒性,能够损害线粒体的结构和功能,使线粒体膜电位显著降低甚至完全消失,从而对荧光探针的线粒体靶向功能造成严重干扰,影响最终检测结果的准确性。
发明人正是意识到目前活细胞线粒体中过氧亚硝酸根的荧光成像检测方法所存在的上述弊端,意图提供一种能够更准确对具有特定存在场景(活细胞线粒体)的过氧亚硝酸根进行检测的方法,采用本发明所提供的荧光探针结构,不仅能够通过萘酰亚胺和甲酰胺基团的协同作用对onoo-进行快速响应,灵敏检测,还能通过探针结构中的吡啶阳离子使其能够靶向聚集于线粒体,通过苄基氯基团与线粒体内的巯基蛋白形成共价连接,进而使探针锚定在线粒体内,即使线粒体膜电位显著降低甚至完全消失,探针也不会从线粒体内渗出,从而对线粒体内的过氧亚硝酸根进行稳定和精准的荧光成像检测。
本发明第三方面提供一种上述荧光探针的制备方法,包括如下步骤:将化合物1和化合物2溶于乙腈中进行反应,即得所述荧光探针;
反应方程式为:
在本发明的一个或多个实施方式中,将化合物3溶于甲酸中进行反应,制备得到化合物1;
反应方程式为:
在本发明的一个或多个实施方式中,将化合物4和化合物5溶于无水乙醇中,反应得到化合物3;
反应方程式为:
在本发明的一个或多个实施方式中,化合物1和化合物2在80-90℃反应4-5h得到荧光探针;
在本发明的一个或多个实施方式中,化合物3与甲酸在100-105℃反应9-10h得到化合物1。
在本发明的一个或多个实施方式中,化合物4和化合物5在80-90℃反应3-3.5h得到化合物3。
在本发明的一个或多个实施方式中,化合物1和化合物2的物质的量之比为1:5;化合物4和化合物5的物质的量之比为1:5;化合物3在甲酸中的摩尔浓度为0.063mol/l。
在本发明的一个或多个实施方式中,每一步反应后还包括将反应产物进行旋干、纯化的步骤。
在本发明的一个或多个实施方式中,对得到的化合物3采用硅胶柱层析进行提纯;
优选的,所述硅胶柱层析的洗脱剂为二氯甲烷和甲醇的混合液,二氯甲烷和甲醇的体积比为20-100:1,进一步优选为50:1。
在本发明的一个或多个实施方式中,对得到的化合物1采用硅胶柱层析进行提纯;
优选的,所述硅胶柱层析的洗脱剂为二氯甲烷和甲醇的混合液,二氯甲烷和甲醇的体积比为10-50:1,进一步优选为20:1。
为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
实施例1
荧光探针的合成:
将化合物4(0.47mmol,100mg,r1为h)和化合物5(2.35mmol,286.7mg,r1为h)溶于10ml的无水乙醇中,80℃反应3h,将反应液旋干后用硅胶柱层析分离提纯,洗脱剂为二氯甲烷:甲醇=50:1,得到黄色固体116.2mg,产率为78%,即化合物3。将化合物3(0.315mmol,100mg)溶于5ml甲酸中,100℃反应10h,将反应液旋干后用硅胶柱层析分离提纯,洗脱剂为二氯甲烷:甲醇=20:1,得到浅黄色固体65.2mg,产率为60%,即化合物1。将化合物1(0.174mmol,60mg)和化合物2(0.87mmol,151.4mg)溶于10ml乙腈中,80℃反应5h,将反应液旋干后用丙酮洗涤多次,干燥后得到棕黄色固体29.5mg,产率为35%,即所述荧光探针。
核磁及质谱表征:
1hnmr(400mhz,dmso-d6):δ11.35(s,1h),9.08(s,2h),8.87(s,1h),8.62(s,1h),8.53(s,1h),8.37(d,j=17.9hz,2h),8.11(s,2h),7.87(s,1h),7.50(s,2h),7.44(s,2h),5.83(s,2h),4.79(s,2h),4.39(s,2h),3.29(s,2h)ppm.13cnmr(100mhz,dmso-d6):δ163.87,163.25,161.55,160.62,144.55,140.04,139.15,135.19,132.43,131.39,130.05,129.30,129.19,129.10,128.73,127.14,123.37,122.45,117.90,117.42,62.54,45.94,34.02ppm.hrms(esi):calculatedforc28h23cln3o3+(m+)484.1422,found484.1444.
效果实验:
1、探针对onoo-的荧光响应实验:
向2ml离心管中依次加入1mlpbs缓冲溶液(0.1m,ph=7.4),8μl0.5mm的探针储备液,不同体积的二次水,不同体积的onoo-储备液,定容到2ml,探针的终浓度为2μm,onoo-的终浓度为0-20μm。上述溶液在常温下进行荧光光谱检测。如图1所示,当用440nm激发时,探针在556nm左右基本无荧光发射,随着不同浓度(0μm、2μm、4μm、6μm、8μm、10μm、12μm、14μm、16μm、18μm、20μm)onoo-的加入,探针在556nm处的荧光强度逐渐增强。图2显示,探针在556nm处的荧光强度与onoo-的浓度(0-20μm)呈现出良好的线性相关性,线性相关系数r2=0.995,通过公式3σ/k(其中σ表示11次探针空白强度的标准偏差,k表示相应的线性关系方程的斜率)计算,得探针的检测限为187nm,表明本发明所述探针对onoo-的检测具有较高的灵敏度。
2、探针对onoo-的响应动力学
如图3所示,探针(2μm)自身在556nm处荧光较弱,当加入20μmonoo-之后,荧光迅速增强,在2s内到达顶点,表明探针能够快速响应onoo-,能够捕获生理环境中反应活性高、半衰期短的onoo-。
3、探针的选择性
图4中,探针的浓度为2μm,onoo-浓度为20μm,其他干扰物浓度均为100μm。其中,标号1代表onoo-,标号2代表空白对照,标号3代表·oh,标号4代表o2·-,标号5代表1o2,标号6代表hclo,标号7代表h2o2,标号8代表h2s,标号9代表no,标号10代表mg2+,标号11代表cu2+,标号12代表ca2+,标号13代表fe3+,标号14代表al3+,标号15代表k+,标号16代表zn2+,标号17代表na+,标号18代表fe2+,标号19代表pb2+,标号20代表mn2+,标号21代表co32-,标号22代表po43-,标号23代表hco3-,标号24代表no2-,标号25代表hso3-,标号26代表no3-,标号27代表so42-,标号28代表so32-,标号29代表ch3coo-,标号30代表hcy,标号31代表gsh,标号32代表cys。由图4可知,探针只在onoo-(对应标号1)存在下表现出明显的荧光增强,其他潜在干扰物质均不能引起探针的荧光变化。这说明探针检测onoo-具有高的选择性,可用于细胞内复杂环境中的onoo-荧光成像检测。
4、探针对活细胞线粒体内onoo-的荧光成像实验
采用共定位实验考察探针的线粒体靶向能力。hela细胞先用500μmsin-1(onoo-释放剂)孵育30min,然后用商品化线粒体染料和本发明所述探针共同孵育30min,然后进行共聚焦荧光成像。如图5所示,图5a是采用本发明探针的荧光成像图,图5b是采用商品化线粒体染料mitotrackerredcmxros(mtr)的荧光成像图,图5c是图5a与图5b的叠加图,图5d是荧光强度同步趋势图。结果表明mtr的红色荧光与本发明探针的绿色荧光几乎完全重叠,皮尔森共定位系数高达0.94,说明本发明探针能靶向线粒体,并对线粒体内onoo-进行荧光成像检测。
5、考察本发明探针和对照探针能否对hela细胞线粒体膜电位降低过程中线粒体内onoo-进行荧光成像检测
所用对照探针为传统的线粒体靶向探针,在线粒体膜电位正常时,能够对线粒体内onoo-进行荧光成像检测,但不能锚定在线粒体内。羰基氰基氯苯腙(cccp)是一种线粒体解偶联剂,能够引起hela细胞线粒体膜电位的降低甚至消失。图6中,图6a为500μmsin-1孵育30min,再用5μm本发明探针孵育20min后的荧光成像图,图6b为500μmsin-1孵育30min,再用5μm本发明探针和10μmcccp孵育1h后的荧光成像图,图6c为500μmsin-1孵育30min,再用5μm本发明探针和10μmcccp孵育6h后的荧光成像图,图6d为500μmsin-1孵育30min,再用5μm对照探针孵育20min后的荧光成像图,图6e为500μmsin-1孵育30min,再用5μm对照探针和10μmcccp孵育1h后的荧光成像图,图6f为500μmsin-1孵育30min,再用5μm对照探针和10μmcccp孵育6h后的荧光成像图,图6g为图6a到图6c的平均荧光强度输出图,图6h为图6d到图6f的平均荧光强度输出图。如图6所示,随着细胞与cccp孵育时间的延长,线粒体膜电位逐渐降低,对照探针的荧光强度逐渐降低(图6d、e、f),表明对照探针逐渐失去线粒体靶向能力,从线粒体中渗出,无法再对线粒体内的过氧亚硝酸根进行荧光成像检测;而本发明探针的荧光强度基本保持不变(图6a、b、c),表明本发明探针能够靶向并锚定在线粒体内,能够对线粒体内的过氧亚硝酸根进行稳定和精准的荧光成像检测。
6、考察本发明探针和对照探针能否对饥饿诱导自噬过程中hela细胞线粒体内onoo-进行荧光成像检测
采用无糖dmem培养基培养hela细胞构建饥饿诱导自噬模型。图7中,图7a为正常dmem培养基中5μm本发明探针孵育hela细胞10h后的荧光成像图,图7b为无糖dmem培养基中5μm本发明探针孵育细胞10h后的荧光成像图,图7c为正常dmem培养基中5μm对照探针孵育细胞10h后的荧光成像图,图7d为无糖dmem培养基中5μm对照探针孵育细胞10h后的荧光成像图,图7e为图7a到图7d的平均荧光强度输出图。如图7所示,对照探针在正常培养和饥饿培养细胞中发出微弱荧光,荧光强度基本一致,表明饥饿诱导自噬导致线粒体膜电位降低,对照探针无法检测此过程中onoo-的浓度变化;相比于正常培养细胞中的荧光强度,本发明探针在饥饿培养细胞中的荧光强度明显增强,表明本发明探针的荧光检测能力不受线粒体膜电位变化的影响,能够检测到饥饿诱导自噬过程中线粒体内onoo-的浓度变化,能够对线粒体内的过氧亚硝酸根进行稳定和精准的荧光成像检测。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!