一种提高胶球藻生物量和光合固碳能力的方法
本发明属于工业生物
技术领域:
,尤其涉及一种提高胶球藻生物量和光合固碳能力的方法。
背景技术:
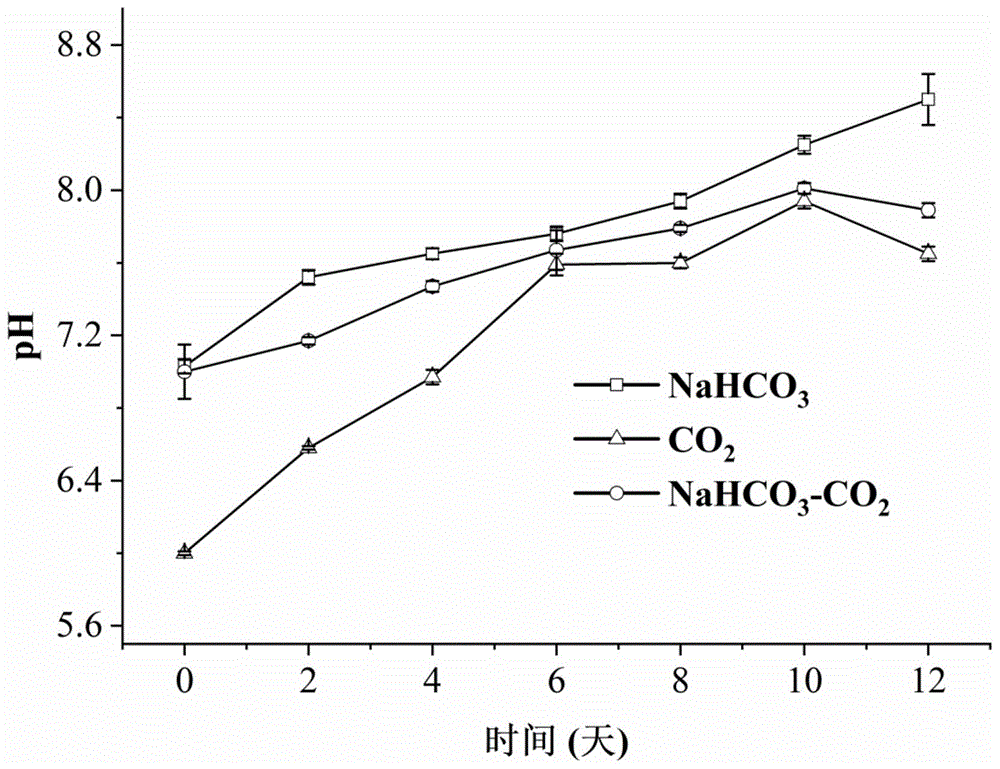
:co2是温室气体的重要组成部分,是造成全球气候变暖、严重灰霾天气的重要原因之一。co2来源包括机动车尾气、燃煤电厂、工业源(如钢铁、煤化工、水泥、发酵、石化等行业)排放等。碳捕获-利用-封存(ccus)技术能在一定程度上达到co2减排的目的,目前ccus技术有物理方法(co2驱油、co2封存)、化学方法(co2制备化学品、co2矿化)以及生物方法(植物、微藻等光合固定co2)。物理法与化学法面临co2二次溢出、装置要求高、耗能大、资源化利用不足等共性问题;而大型植物的光合固碳效率远不如微藻,微藻生长速度快,是陆生高等植物的100多倍;微藻生物质含碳量高达50%干重,每生成1kg微藻生物质就能固定1.83kgco2,固碳效率比陆生植物高10-50倍,所以采用微藻光合固碳是最有前景的生物ccus技术。微藻光合固碳的原理是光合作用,主要包括光反应和暗反应两个过程。光反应完成光能的吸收、传递并产生能量,暗反应(卡尔文循环)则完成co2固定。微藻的生长及固定co2的过程受到众多环境因子的调控,包括光照、ph、co2浓度、温度、其他营养物质供给等。基于微藻光合自养特性,光照作为其能量的来源,成为微藻固定co2最为关键的限制因子。当光强低于光饱和点时,光强会成为微藻生长和固碳的限制因素;当光强超过光饱和点时,会出现光抑制现象,即过高光强会破坏光合系统的电子传递和能量产生、光合色素合成,从而降低固碳效率。整个光合固碳暗反应过程需要许多酶的催化才能完成,如碳酸酐酶(ca)、1,5-二磷酸核酮糖缩化酶(rubisco)等,ph变化对光自养过程尤其是暗反应阶段的酶活影响非常明显。为了保证关键酶的催化功能,培养体系的ph维持相对稳定,是实现高固碳效率的前提条件。目前微藻光合固碳的生物过程存在光衰减严重、co2溶解度低且容易溢出等瓶颈问题。微藻在不同光自养生长阶段对光照的需求不同,现有光合固碳工艺多以恒定光强进行培养,未将光强调节与细胞密度相关联并进行有效调节,造成由于细胞密度增大带来光衰减而大大降低光合固碳能力。此外,co2溶解度低且容易溢出,碳源不足将导致微藻光合自养生长缓慢,增大固碳成本、降低固碳能力。为了克服上述不足,需要通过优化微藻光合自养培养调控策略,以提高微藻光合固碳能力。技术实现要素:为了克服现有技术存在的不足,本发明的目的是提供一种提高胶球藻生物量和光合固碳能力的方法。本发明采用一种将胶球藻细胞密度与光照强度相关联的阶梯式调光策略,在光合固碳中提供充足的光照强度;同时向培养体系中添加适量碳酸氢钠,弱碱性液体可实现co2的化学固定以增加co2溶解度,且nahco3-co2体系可稳定ph值在一定范围,提高胶球藻光合固碳能力。本发明的目的至少通过如下技术方案之一实现。本发明提供的提高胶球藻生物量和光合固碳能力的方法,包括如下步骤:将已活化的胶球藻(coccomyxasubellipsoideac-169)种子液在无菌条件下接种在含有nahco3的培养基中,将装有培养基的三角瓶置于摇床上,放入二氧化碳恒温培养箱中,通入co2和空气的混合气体进行光合自养培养。在培养过程中将光照强度与胶球藻细胞密度相关联,随着细胞密度增加阶梯式调高光强直至培养结束,完成提高胶球藻生物量和光合固碳能力的过程。进一步地,在所述含有nahco3的培养基中,nahco3浓度为0.01~0.84gl-1。优选地,在所述含有nahco3的培养基中,nahco3浓度为0.42gl-1。进一步地,所述含有nahco3的培养基为含有nahco3的basal培养基;所述basal培养基的氮源为nano3。优选地,所述basal培养基包含1.25~2.50gl-1的nano3。进一步优选地,所述basal培养基包含2.5gl-1的nano3。进一步地,所述含有nahco3的培养基的初始ph值为6.0~7.0。优选地,所述含有nahco3的培养基的ph值为7.0。进一步地,所述胶球藻的初始密度为8.0×106~1.0×107cellsml-1。优选地,所述胶球藻的初始密度为1.0×107cellsml-1。进一步地,所述混合气体为co2与空气的混合气体;在所述混合气体中,co2的体积分数为2~5%。优选地,在所述混合气体中,co2的体积分数为2%。所述co2的纯度为99.9%。进一步地,所述二氧化碳恒温培养箱中摇床的转速为120~170rpm,培养温度为25±1℃,培养时间为10~14天。优选地,所述二氧化碳恒温培养箱中摇床的转速为150rpm。优选地,所述光合自养培养时间为12天。进一步地,所述光合自养培养过程中,光源为白光,初始光强为80±5μmolm-2s-1,培养过程中每2天取一次样测定藻液中的细胞密度。当细胞密度大于1.0×107cellsml-1且小于1.0×108cellsml-1时,调节光强范围为86~150μmolm-2s-1;当细胞密度大于1.0×108cellsml-1且小于2.0×108cellsml-1时,调节光强范围为151~230μmolm-2s-1;当细胞密度大于2.0×108cellsml-1且小于3.0×108cellsml-1时,调节光强为231~250μmolm-2s-1。优选地,在所述光合自养培养过程中,光源为白光,初始光强为80±5μmolm-2s-1,培养过程中每2天取一次样测定藻液细胞密度。当细胞密度大于1.0×107cellsml-1且小于5.0×107cellsml-1时,调节光强为100±10μmolm-2s-1;当细胞密度大于5.0×107cellsml-1且小于1.0×108cellsml-1时,调节光强为150±10μmolm-2s-1;当细胞密度大于1.0×108cellsml-1且小于1.5×108cellsml-1时,调节光强为200±15μmolm-2s-1;当细胞密度大于1.5×108cellsml-1且小于2.0×108cellsml-1时,调节光强为230±15μmolm-2s-1;当细胞密度大于2.0×108cellsml-1且小于3.0×108cellsml-1时,调节光强为250±15μmolm-2s-1。在培养过程中,光源可以由led自然白光灯条提供。与现有技术相比,本发明具有如下优点和有益效果:(1)本发明提供的方法,通过在体系中加入适量nahco3形成弱碱性环境和有效的ph缓冲体系,提高了co2在培养基中的溶解度,克服了co2外溢问题,同时解决了培养过程中ph值波动大的问题,可将ph值控制在7.0~8.0。(2)本发明提供的方法,使用与胶球藻细胞密度相关联的阶梯式调光策略,克服了培养后期由于细胞密度增高导致光衰减和光利用率降低的关键问题,从而显著提高了胶球藻的光合固碳能力。(3)采用本发明提供的方法,胶球藻的生物量浓度最高达到7.42gl-1,比co2为碳源、恒定光强的对照培养提高了105.5%;co2固碳量达到3.57gl-1,是co2为碳源、恒定光强对照培养的2.0倍;co2光合固碳速率最高达1.09gl-1d-1,比co2为碳源、恒定光强的对照培养提高了103.4%。附图说明图1为实施例中不同碳源下光合自养培养胶球藻(coccomyxasubellipsoideac-169)时ph变化曲线;图2为实施例中不同碳源下光合自养培养胶球藻(coccomyxasubellipsoideac-169)时生物量浓度、固碳量和固碳速率;图3为实施例中不同nahco3浓度下光合自养培养胶球藻时生物量浓度、光合固碳量和固碳速率的结果图;图4为实施例中不同调光策略下光合自养培养胶球藻时细胞密度变化的结果图;图5为实施例中不同调光策略下光合自养培养胶球藻时生物量浓度、固碳量和固碳速率的结果图;图6为实施例中不同初始氮源浓度下光合自养培养胶球藻时生物量浓度、固碳量和固碳速率的结果图;图7为实施例中不同氮源添加方式下光合自养培养胶球藻时生物量浓度、固碳量和固碳速率的结果图。具体实施方式以下结合实例对本发明的具体实施作进一步说明,但本发明的实施和保护不限于此。需指出的是,以下若有未特别详细说明之过程,均是本领域技术人员可参照现有技术实现或理解的。所用试剂或仪器未注明生产厂商者,视为可以通过市售购买得到的常规产品。本发明实施例中采取的检测方法可参照如下说明。1.生物量浓度将2ml胶球藻藻液置于预先称重的离心管(标记为w1)中,在10,000rpm转速下离心4min,沉淀藻泥用蒸馏水洗涤两次,将含有藻泥的离心管置于60℃烘箱中烘干至恒重,测定其质量(标记为w2),并按如下公式计算生物量:生物量(gl-1)=(w2-w1)/0.002;w1为预先称重的离心管质量;w2为离心管与烘干后藻泥两者质量之和。2.固碳量和固碳速率取0时和培养结束时的藻液,在10,000rpm转速下离心4min,藻泥用蒸馏水洗涤两次,-40℃真空冷冻干燥获得藻粉。取冻干藻粉3~5mg用元素分析仪测定其中的c元素含量,结果用百分比表示。固碳量和固碳速率计算方式见如下公式:m=b·cc(1)rco2=cc·p(mco2/mc)(2)m——光合固碳量(gl-1);b——生物量浓度(gl-1);cc——总碳元素含量(%,w/w);rco2——co2固定速率(gl-1d-1);p——生物量产率(gl-1d-1);mco2,mc——表co2和碳元素相对分子质量;3.细胞密度取1ml新鲜胶球藻藻液,进行稀释后,利用流式细胞仪测定得到细胞密度。以下实施例中,图2、图3、图5、图6及图7中,若标注有不同字母代表数据具有显著性差异,相同字母代表数据无显著性差异(实验组别多于2组时用此种标注方法),若标注有**表示极显著性差异(p<0.01);#表示显著性差异(p<0.05);△表示显著性差异(p<0.05)(实验组别少于3组时用此种标注方法)。实施例1不同碳源下胶球藻光合自养过程中ph变化规律1.1藻种活化及种子液制备将胶球藻(coccomyxasubellipsoideac-169)转接到basal固体培养基上培养12天,培养温度25℃,ph值6.1,光照强度60μmolm-2s-1,并观察其生长的情况。从固体平板上挑取胶球藻藻苔于basal液体培养基中,在250ml三角瓶中装液量为100ml,置于光照恒温摇床中培养7天用作种子液,设置ph值6.1、温度25±1℃,光强80μmolm-2s-1、转速150rpm。其中,basal培养基配方如表1所示。表1basal培养基配方组分含量(mg/l)组分含量(mg/l)组分含量(mg/l)nano31250h3bo3114.2moo37.1kh2po41250cacl2·2h2o111mncl2·4h2o14.2mgso4·7h2o1000feso4·7h2o49.8cuso4·5h2o15.7edta500znso4·7h2o88.2cono3·6h2o6.1注:若配置固体basal培养基,需再加入2wt%琼脂;edta为乙二胺四乙酸。1.2不同碳源下胶球藻光合自养过程中ph变化规律1.2.1自养培养将活化好的胶球藻种子液在无菌条件下分别接种至100ml含有不同碳源的basal培养基中(起始细胞密度为1.0x107cellsml-1),装有培养基的250ml三角瓶置于二氧化碳恒温培养箱中的摇床上。组别1的碳源为0.42gl-1nahco3,组别2的碳源为2%co2,组别3是0.42gl-1nahco3+2%co2(表示nahco3与co2二者联合使用,下同)作为复合碳源。其他培养条件为:连续led自然白光照,光照强度为80μmolm-2s-1,温度25±1℃,转速150rpm,培养12天。培养过程中每2天取一次样,离心取上清液用于测定ph值。1.2.2分析结果在不同碳源下胶球藻培养液的ph变化曲线见图1所示。在以0.42gl-1nahco3+2%co2作为复合碳源时,培养体系ph值变化维持在7.0~8.0,波动范围为1.0;而以nahco3为碳源时ph变化为7.0~8.5,波动范围为1.5;以2%co2作为碳源时ph变化为6.0~7.7,波动范围为1.7。这表明nahco3+co2为复合碳源时,能形成有效的缓冲体系,使得ph值可以维持在相对稳定的范围内,有利于胶球藻的光合固碳。加入nahco3还能使培养体系处于弱碱性环境,有利于增加co2溶解度,提高固碳能力并节约成本。实施例2不同碳源下胶球藻生物量浓度和固碳能力2.1藻种活化及种子液制备按1.1所述方法活化制备胶球藻种子液。2.2不同碳源下胶球藻自养培养与固碳能力分析2.2.1自养培养按1.2所述方法自养培养胶球藻2.2.2分析检测培养结束后收集胶球藻悬浮液,2ml离心取藻泥,洗涤烘干至恒重后,测定生物量;另取培养0时和培养结束时的藻液,经离心、洗涤、-40℃真空冷冻干燥获得藻粉,用于测量藻细胞内碳含量。采用origin9.0软件进行绘图;spss22.0软件进行显著性分析,以不同字母和符号表示组间显著性差异(p<0.05)。2.2.3分析结果将胶球藻置于不同碳源下培养,生物量浓度和固碳能力见图2。在以0.42gl-1nahco3+2%co2为复合碳源时,生物量(3.43gl-1)、固碳量(1.73gl-1)和固碳速率(0.52gl-1d-1)均显著高于其他两个组别,其固碳量是以nahco3作为碳源时的9.2倍,比co2为碳源时提高了3.5%。显然,相较nahco3作为碳源,nahco3+co2复合碳源具有更好的ph缓冲能力;与co2为碳源相比,nahco3+co2的复合碳源能够提供弱碱性环境,提高co2的溶解度,减少co2外溢。因此,使用nahco3+co2复合碳源能够显著提高胶球藻的固碳能力。实施例3不同nahco3浓度下胶球藻生物量浓度和固碳能力3.1藻种活化及种子液制备按1.1所述方法活化胶球藻制备种子液。3.2不同碳酸氢钠浓度下胶球藻自养培养与固碳能力分析3.2.1自养培养实验过程中,配置好一定浓度的nahco3母液,经过0.45μm滤膜过滤除菌,分别添加至三组basal培养基中,使nahco3在培养基中终浓度分别为0、0.42、0.84gl-1。将活化种子液在无菌条件下接种至含有不同浓度nahco3的basal培养基中,所述胶球藻的起始密度为1.0×107cellsml-1。将装有100ml培养基的250ml三角瓶置于二氧化碳恒温培养箱中的要床上,在培养箱中通入纯度为99.9%的co2以保持培养箱中co2与空气的混合气体中co2体积分数为2%。其他培养条件:连续led自然白光照,光照强度为80μmolm-2s-1,温度25±1℃,转速150rpm,培养12天。3.2.2分析检测方法同2.2.23.2.3分析结果在不同碳酸氢钠浓度下通入2%co2,胶球藻生物量浓度和固碳能力见图3所示。当nahco3浓度为0.42gl-1时,生物量(3.64gl-1),固碳量(1.78gl-1)与固碳速率(0.54gl-1d-1)均显著高于其他组别,说明在此浓度下,nahco3-co2复合碳源的培养体系固碳能力最高。实施例4阶梯调光策略下胶球藻细胞密度变化规律4.1藻种活化及种子液制备按1.1所述方法活化制备胶球藻种子液。4.2阶梯调光策略下胶球藻自养培养与生长状态分析4.2.1自养培养将活化好的胶球藻种子液在无菌条件下接种至含有0.42gl-1nahco3的basal培养基中,起始细胞密度为1.0×107cellsml-1。接种后的胶球藻置于二氧化碳恒温培养箱并向其中间歇通入纯度为99.9%co2,保持培养箱中co2与空气的混合气体占比为2%。对照组为恒定光强80μmolm-2s-1,实验组初始光强为80μmolm-2s-1,实验过程中根据细胞密度阶梯式调高光强,调光策略见下表2。其他培养条件:温度25±1℃,转速150rpm,培养12天。4.2.2分析检测培养过程中,每2天取1ml藻液,适当稀释后用于细胞密度测定。4.2.3结果分析不同调光策略下光合自养培养胶球藻时细胞密度变化见图4。由图4可知,第0~4天细胞生长处于延滞期,两种光照方式对其生长的影响没有明显差异;在对数期末期,对照组细胞密度为1.3×108cellsml-1,实验组为2.0×108cellsml-1,是对照组的1.6倍。第8~12天,对照组已进入稳定期,而实验组表现出持续生长,未进入稳定期;培养结束时,实验组细胞密度到达3.1×108cellsml-1,说明根据细胞密度调节光强的阶梯调光策略可在很大程度上解决高细胞密度时细胞之间相互遮蔽的光衰减问题,可提高光利用效率、显著促进生物量增长,从而提升固碳能力。表2阶梯式调光策略实施例5阶梯调光策略下胶球藻生物量浓度和固碳能力5.1藻种活化及种子液制备按1.1所述方法活化制备胶球藻种子液。5.2阶梯调光策略下胶球藻自养培养与固碳能力分析5.2.1自养培养培养方法同4.2.1。对照组以恒定光强进行培养,实验组光强调控策略为:在培养初期,藻细胞生长处于延滞期(0~2d),细胞密度低,此时维持光强为80±5μmolm-2s-1;当藻细胞进入对数生长期(2~8d)后,细胞生长迅速,增大光强的调节幅度以适应藻细胞的快速增殖;藻细胞生长进入稳定期(10~12d)后,可维持光强稳定在一定范围,不进行调节。具体的调节参数见表2。5.2.2分析检测方法同2.2.2。5.2.3分析结果由图5可知,对照组以恒定光强80μmolm-2s-1培养结束时,最终生物量浓度为3.71gl-1,实验组阶梯调光培养结束时生物量浓度达到6.31gl-1,是对照组的1.7倍。对照组固碳量为1.81gl-1,实验组固碳量达到3.11gl-1,显著高于对照组且为对照组的1.7倍,固碳速率达到0.94gl-1d-1。显然,采用光照强度与细胞密度相关联的调光策略,能促进细胞光合作用,在培养时间一定时可延长细胞对数期、缩短稳定期,以此提高固碳能力。实施例6不同初始氮源浓度下胶球藻生物量浓度和固碳能力分析6.1藻种活化及种子液制备按1.1所述方法活化制备胶球藻种子液。6.2不同初始氮源浓度下胶球藻自养培养与固碳能力分析6.2.1自养培养配置好一定量nano3母液,经过0.45μm的滤膜过滤除菌,分别添加至5组培养基中,终浓度分别为1.25gl-1、2.50gl-1、5.00gl-1、7.50gl-1、10.00gl-1nano3。将活化完成的胶球藻种子液在无菌条件下接种至含有0.42gl-1nahco3的100mlbasal培养基中,起始密度为1×107cellsml-1。将接种后的250ml三角瓶置于二氧化碳恒温培养箱中的摇床上,在培养箱中通入纯度为99.9%co2,保持培养箱中co2在与空气的混合气体中的体积分数为2%。其他培养条件:调光策略见表2,温度为25±1℃,转速150rpm,培养12天。6.2.2分析检测方法同2.2.2。6.2.3分析结果不同初始nano3浓度下胶球藻生物量和固碳能力见图6。硝酸钠浓度为2.50gl-1时,生物量浓度,固碳量和固碳速率均显著高于其他组别,分别为7.42gl-1,3.57gl-1和1.09gl-1d-1。当nano3浓度高于2.50gl-1,生物量浓度为6.19~6.81gl-1、固碳量为3.11~3.30gl-1和固碳速率为0.89~1.09gl-1d-1。过多的氮可能影响光合色素的合成及氮代谢过程,导致固碳量降低。nano3浓度低于2.50gl-1时,会导致培养末期氮缺乏。实施例7不同氮源添加方式下胶球藻生物量浓度和固碳能力分析7.21.自养培养将活化完成的胶球藻种子液在无菌条件下接种至含有0.42gl-1nahco3的basal培养基中,氮源为nano3,其总含量为2.5gl-1,起始密度为1x107cellsml-1。接种后的250ml三角瓶置于二氧化碳恒温培养箱中的摇床上,在培养箱中通入纯度为99.9%co2,保持培养箱中co2在与空气的混合气体中的体积分数为2%。对照组氮源添加方式为培养0时一次性加入2.50gl-1nano3;实验组氮源添加方式为:保持氮源总量为2.50gl-1nano3,分两次加入,即培养0时加入1.25gl-1nano3,培养至第6天再加入1.25gl-1nano3。其他培养条件:调光策略见表2,温度25±1℃,转速150rpm,培养12天。7.2.2分析检测方法同2.2.2。7.2.3分析结果不同氮源添加方式下胶球藻生物量和固碳能力见图7。将2.50gl-1nano3在培养0时一次性加入时,生物量浓度为7.02gl-1,固碳量和固碳速率分别为3.38gl-1,1.03gl-1d-1,其固碳量是分2次加入模式的1.15倍,固碳速率也提高了13.1%。说明2.50gl-1nano3一次性加入培养基,能够维持合适的碳氮比,促进细胞碳代谢和氮代谢过程,固碳能力高。综合实例1-7的结果表明,以nahco3+co2为复合碳源,结合与细胞密度相关联的阶梯调光策略,能够维持ph值稳定,提高co2溶解度并提供充足的光照,从而显著提高胶球藻的光合固碳能力,生物量浓度达到7.42gl-1,比优化前提高了105.5%;固碳量达到3.57gl-1,是co2为碳源的恒定光强(对照培养)的2.0倍;固碳速率最高达1.09gl-1d-1,比co2为碳源的恒定光强(对照培养)显著提高了103.4%。因此,将用本发明所述的方法运用于胶球藻的光自养培养能够显著提高其光合固碳能力和生物质生产能力。以上实施例仅为本发明较优的实施方式,仅用于解释本发明,而非限制本发明,本领域技术人员在未脱离本发明精神实质下所作的改变、替换、修饰等均应属于本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1