一种火麻仁低聚肽及其制备方法和应用与流程
1.本发明属于火麻仁多肽制备技术领域,尤其涉及一种火麻仁低聚肽及其制备方法和应用。
背景技术:
2.火麻,属于工业大麻,其种子火麻仁食用价值很高,也可入药。火麻仁含有丰富的麻仁球蛋白(20%~30%),组成麻仁球蛋白的氨基酸有20多种,包括8种人体必需氨基酸,是一种优质蛋白。其精氨酸含量高于同类型的种子蛋白质,对于维持心血管方面的健康具有很好的作用。
3.目前,国内生产火麻仁多肽的主要方法是以火麻仁蛋白粉为原料,后经蛋白酶水解制备多肽。cn110777183a公开了一种火麻仁低聚肽粉及其制备方法和应用,首先原料筛选后动态提取浆液得到提取液,然后分步进行酶解得到酶解液,将酶解液进行纯化处理后,再制粉处理得到火麻仁低聚肽粉。此方法操作简单,制备成本低,环保无害,但因火麻仁蛋白以火麻仁球蛋白为主,水溶性较差,结构紧密,蛋白酶难以充分水解,获得的多肽分子量较大且得率较低。
4.目前,火麻仁多肽的提取工艺往往存在产物分子量较大、提取率较低的问题。如何提供一种火麻仁多肽的提取方法,可以提高产物得率,且产物的分子量也更小,方便利用与吸收,已成为亟待解决的问题。
技术实现要素:
5.针对现有技术的不足和实际需求,本发明提供一种火麻仁低聚肽及其制备方法和应用,通过加热和超声的方式进行预处理,可以改善酶解效果,提高提取效率的同时降低产物的分子量大小,最后通过超滤和脱盐降低了产物中的杂质,保证了产物的纯度与活性,应用价值更高。
6.为达此目的,本发明采用如下技术方案:
7.第一方面,本发明提供了一种火麻仁低聚肽的制备方法,所述火麻仁低聚肽的制备方法包括:
8.将火麻仁球蛋白粉与水混合,制备火麻仁球蛋白溶液,再将所述火麻仁球蛋白溶液加热、超声后酶解,再对所得酶解产物进行超滤和脱盐,得到所述火麻仁低聚肽。
9.本发明中,通过对火麻仁球蛋白进行热处理,使得蛋白质变性失活,致密的结构被破坏,更易被蛋白酶接触酶解;但加热的过程中蛋白质可能会发生聚集,形成较大的颗粒,因此进一步通过超声处理,使蛋白质解聚,粒径减小,从而进一步提高酶解效率,提高多肽得率并降低产物的分子量;最后通过超滤和脱盐对提取产物进行纯化,可以提高多肽的纯度,保持多肽的活性,很好地发挥其生物学功能。
10.优选地,所述火麻仁球蛋白溶液中火麻仁球蛋白的质量浓度为1%~15%,例如可以是1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%或15%。
11.优选地,所述火麻仁球蛋白粉的制备方法为:使用盐溶液从火麻仁粉中提取火麻仁球蛋白,干燥后制成火麻仁球蛋白粉。
12.优选地,所述提取火麻仁球蛋白的方法包括:将所述火麻仁粉加入盐溶液中,提取,离心后取上清,静置冷却后,析出蛋白,再离心,得到所述火麻仁球蛋白。
13.优选地,所述火麻仁粉的质量与盐溶液的体积的比值为1:(5~30)g/ml,例如可以是1:5g/ml、1:10g/ml、1:15g/ml、1:20g/ml、1:25g/ml或1:30g/ml。
14.优选地,所述盐溶液包括氯化钠溶液。
15.优选地,所述盐溶液中的盐的质量浓度为2%~10%,例如可以是2%、3%、4%、5%、6%、7%、8%、9%或10%。
16.优选地,所述提取的温度为40~60℃,例如可以是40℃、41℃、42℃、43℃、44℃、45℃、46℃、47℃、48℃、49℃、50℃、51℃、52℃、53℃、54℃、55℃、56℃、57℃、58℃、59℃或60℃,优选为55℃。
17.优选地,所述提取的时间为0.5~4h,例如可以是0.5h、1h、1.5h、2h、2.5h、3h、3.5h或4h,优选为2h。
18.优选地,所述静置冷却的温度为1~10℃,例如可以是1℃、2℃、3℃、4℃、5℃、6℃、7℃、8℃、9℃或10℃,优选为4℃。
19.优选地,所述静置冷却的时间1~12h,例如可以是1h、2h、3h、4h、5h、6h、7h、8h、9h、10h、11h或12h,优选为4h。
20.优选地,所述将火麻仁粉加入盐溶液中前还包括制备所述火麻仁粉的步骤。
21.优选地,所述制备火麻仁粉包括将火麻仁干燥,粉碎后脱脂。
22.优选地,所述脱脂包括物理压榨、溶剂萃取或超临界萃取中的任意一种。
23.优选地,所述溶剂萃取所用的溶剂包括正己烷和/或石油醚。
24.优选地,所述超临界萃取所用的溶剂包括二氧化碳。
25.优选地,所述火麻仁粉的含油量不高于5%,例如可以是1%、2%、3%、4%或5%。
26.优选地,所述火麻仁球蛋白粉的制备方法包括:
27.将火麻仁干燥,粉碎后,通过物理压榨、使用正己烷和/或石油醚作为溶剂进行溶剂萃取或使用二氧化碳作为溶剂进行超临界萃取进行脱脂后,得到含油量不高于5%火麻仁粉;
28.将所述火麻仁粉加入质量分数为2%~10%的氯化钠溶液中,所述火麻仁粉的质量与氯化钠溶液的体积的比值为1:(5~30)g/ml,在40~60℃下提取0.5~4h,离心后取上清,在1~10℃下静置冷却1~12h,析出蛋白,再离心,干燥,得到所述火麻仁球蛋白粉。
29.优选地,所述加热的温度为80~100℃,例如可以是80℃、81℃、82℃、83℃、84℃、85℃、86℃、87℃、88℃、89℃、90℃、91℃、92℃、93℃、94℃、95℃、96℃、97℃、98℃、99℃或100℃,优选为95℃。
30.本发明中,所述加热的温度在80~100℃的范围内,在该温度范围内可以使蛋白变性,蛋白结构变疏松,蛋白的肽键暴露,更加有利于蛋白酶的酶解;温度低于80℃时,火麻仁球蛋白难以充分变性失活,而温度过高则可能造成多肽的完全失活,影响其功能。
31.优选地,所述加热的时间为10~60min,例如可以是10min、15min、20min、25min、30min、35min、40min、45min、50min、55min或60min。
32.优选地,所述超声的功率为100~1000w/l,例如可以是100w/l、200w/l、300w/l、400w/l、500w/l、600w/l、700w/l、800w/l、900w/l或1000w/l,优选为400w/l。
33.本发明中,超声处理可以使因加热而聚集的蛋白重新分散为小颗粒,提高了蛋白的比表面积,更被蛋白酶水解;超声功率低于100w/l时,蛋白解聚成小颗粒的效果较差;而超声功率大于1000w/l时,成本升高且效果无明显改善。
34.优选地,所述超声的时间为10~60min,例如可以是10min、15min、20min、25min、30min、35min、40min、45min、50min、55min或60min。
35.优选地,所述酶解包括一次酶解和二次酶解。
36.本发明中,通过一次酶解可以将火麻仁球蛋白水解成分子量较小的多肽,方便后续的酶解处理;通过二次酶解进一步降低了多肽的分子量,并且将多肽链末端的疏水性氨基酸切除,消除苦涩味道,提高了多肽得率并优化了口感;本发明分别进行了两次水解,可以克服两次酶解同时进行时造成的产物分子量分布范围较大、产物较为复杂的缺点,得到的产物分子量小且产物相对单一,方便后续的加工与利用。
37.优选地,所述一次酶解包括向所得加热、超声后的产物中加入蛋白酶,一次酶解后,再进行灭酶,得到一次酶解的产物。
38.优选地,所述蛋白酶的添加量为所述火麻仁球蛋白质量的0.5%~5%,例如可以是0.5%、1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%或5%。
39.优选地,所述蛋白酶包括碱性蛋白酶、木瓜蛋白酶、胃蛋白酶、胰蛋白酶或中性蛋白酶中的任意一种或至少两种的组合,例如可以是碱性蛋白酶或木瓜蛋白酶和胃蛋白酶的组合。
40.优选地,所述一次酶解的温度为40~60℃,例如可以是40℃、41℃、42℃、43℃、44℃、45℃、46℃、47℃、48℃、49℃、50℃、51℃、52℃、53℃、54℃、55℃、56℃、57℃、58℃、59℃或60℃,优选为55℃。
41.优选地,所述一次酶解的时间为2~4h,例如可以是2h、2.5h、3h、3.5h或4h。
42.优选地,所述灭酶的温度不低于80℃,例如可以是80℃、81℃、82℃、83℃、84℃、85℃、86℃、87℃、88℃、89℃或90℃。
43.优选地,所述灭酶的时间为10~30min,例如可以是10min、11min、12min、13min、14min、15min、16min、17min、18min、19min、20min、21min、22min、23min、24min、25min、26min、27min、28min、29min或30min。
44.优选地,所述灭酶后还包括降温的步骤。
45.优选地,所述降温的温度为40~60℃,例如可以是40℃、41℃、42℃、43℃、44℃、45℃、46℃、47℃、48℃、49℃、50℃、51℃、52℃、53℃、54℃、55℃、56℃、57℃、58℃、59℃或60℃。
46.优选地,所述二次酶解包括向所述一次酶解的产物中加入蛋白酶,二次酶解后,再进行灭酶,得到二次酶解的产物。
47.优选地,所述蛋白酶的添加量为所述火麻仁球蛋白质量的0.5%~10%,例如可以是0.5%、1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%、5%、5.5%、6%、6.5%、7%、7.5%、8%、8.5%、9%、9.5%或10%。
48.优选地,所述蛋白酶包括风味蛋白酶。
49.优选地,所述二次酶解的温度为40~60℃,例如可以是40℃、41℃、42℃、43℃、44℃、45℃、46℃、47℃、48℃、49℃、50℃、51℃、52℃、53℃、54℃、55℃、56℃、57℃、58℃、59℃或60℃。
50.优选地,所述二次酶解的时间为2~4h,例如可以是2h、2.5h、3h、3.5h或4h。
51.优选地,所述灭酶的温度不低于80℃,例如可以是80℃、81℃、82℃、83℃、84℃、85℃、86℃、87℃、88℃、89℃或90℃。
52.优选地,所述灭酶的时间为10~30min,例如可以是10min、11min、12min、13min、14min、15min、16min、17min、18min、19min、20min、21min、22min、23min、24min、25min、26min、27min、28min、29min或30min。
53.优选地,所述灭酶后还包括降温的步骤。
54.优选地,所述降温的温度为20~30℃,例如可以是20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃或30℃。
55.优选地,所述酶解包括:
56.向所得加热、超声后的产物中加入蛋白酶,所述蛋白酶包括碱性蛋白酶、木瓜蛋白酶、胃蛋白酶、胰蛋白酶或中性蛋白酶中的任意一种或至少两种的组合,所述蛋白酶的使用量为所述火麻仁球蛋白质量的0.5%~5%,在40~60℃下一次酶解2~4h,再在不低于80℃下灭酶10~30min,降温至40~60℃,得到一次酶解的产物;
57.向所述一次酶解的产物中加入风味蛋白酶,所述风味蛋白酶的使用量为所述火麻仁球蛋白质量的0.5%~10%,在40~60℃下二次酶解2~4h,再在不低于80℃下灭酶10~30min,降温至20~30℃,得到二次酶解的产物。
58.优选地,所述超滤所用的超滤膜的分子截流量为1000~10000da,例如可以是1000da、2000da、3000da、4000da、5000da、6000da、7000da、8000da、9000da或10000da,优选为3000da。
59.本发明中,所述超滤膜的分子截流量在该分子量范围内时,制备得到的火麻仁低聚肽的抗氧化活性更好。
60.优选地,所述超滤前还包括离心的步骤。
61.优选地,所述脱盐包括柱层析脱盐。
62.本发明中,为了在酶解中维持蛋白酶的活性,需要通过添加酸或碱溶液来调节ph,因此在酶解后期溶液中会产生较多的盐,会影响低聚肽的纯度与活性,通过柱层析的方式可以最大限度地脱除多肽中的盐分,并且可以不丧失多肽本身的活性。
63.优选地,所述柱层析脱盐所用的洗脱溶剂包括水。
64.优选地,所述柱层析脱盐所用的层析柱填料包括葡聚糖凝胶和/或琼脂糖凝胶。
65.优选地,所述脱盐后还包括干燥的步骤。
66.优选地,所述干燥包括冷冻干燥和/或喷雾干燥。
67.作为优选技术方案,本发明所述火麻仁低聚肽的制备方法,包括以下步骤:
68.(1)将火麻仁干燥,粉碎后,通过物理压榨、使用正己烷和/或石油醚作为溶剂进行溶剂萃取或使用二氧化碳作为溶剂进行超临界萃取进行脱脂后,得到含油量不高于5%火麻仁粉;
69.(2)将所述火麻仁粉溶于质量分数为2%~10%的氯化钠溶液中,所述火麻仁粉的
质量与氯化钠溶液的体积的比值为1:(5~30)g/ml,在40~60℃下提取0.5~4h,离心后取上清,在1~10℃下静置冷却1~12h,析出蛋白,再离心,干燥,得到火麻仁球蛋白粉;将所述火麻仁球蛋白粉与水混合,得到火麻仁球蛋白的质量浓度为1%~15%的火麻仁球蛋白溶液;
70.(3)将所述火麻仁球蛋白溶液在80~100℃下加热10~60min,再在100~1000w/l下超声10~60min;
71.(4)向所得加热、超声后的产物中加入蛋白酶,所述蛋白酶包括碱性蛋白酶、木瓜蛋白酶、胃蛋白酶、胰蛋白酶或中性蛋白酶中的任意一种或至少两种的组合,所述蛋白酶的使用量为所述火麻仁球蛋白质量的0.5%~5%,在40~60℃下一次酶解2~4h,再在不低于80℃下灭酶10~30min,降温至40~60℃,得到一次酶解的产物;
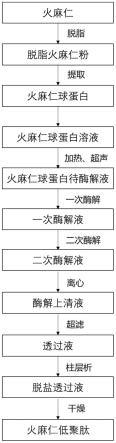
72.(5)向所述一次酶解的产物中加入风味蛋白酶,所述风味蛋白酶的使用量为所述火麻仁球蛋白质量的0.5%~10%,在40~60℃下二次酶解2~4h,再在不低于80℃下灭酶10~30min,降温至20~30℃,得到二次酶解的产物;
73.(6)所述二次酶解的产物离心后,所得上清液使用分子截流量为1000~10000da的超滤膜进行超滤,得到超滤膜透过液,再以水为洗脱溶剂通过柱层析脱盐,所用的层析柱填料包括葡聚糖凝胶和/或琼脂糖凝胶,得到脱盐膜透过液;
74.(7)所述脱盐膜透过液经过冷冻干燥和/或喷雾干燥后,得到所述火麻仁低聚肽。
75.所述火麻仁低聚肽的制备方法的流程图如图1所示。
76.第二方面,本发明提供了一种如第一方面所述的制备方法制备得到的火麻仁低聚肽。
77.本发明中,通过制备火麻仁球蛋白溶液,再进行加热、超声和两次酶解,再进行超滤和脱盐,制备得到的火麻仁低聚肽具有分子量小、纯度高、活性好且无苦涩味道的优点,具有实际应用的价值。
78.优选地,所述火麻仁低聚肽中肽含量不低于90%,例如可以是90%、91%、92%、93%、94%或95%,分子量在3000da以下的低聚肽含量不低于70%,分子量例如可以是2800da、2850da、2900da、2950da或3000da,含量例如可以是70%、71%、72%、73%、74%或75%。
79.第三方面,本发明提供了如第二方面所述的火麻仁低聚肽在制备抗氧化食品和/或保健品中的应用。
80.本发明中,制备得到的火麻仁低聚肽富含多种人体必需氨基酸,具有良好的抗氧化、抗衰老功效,可以提高免疫力,且通过风味蛋白酶改善了口感,改善了使用体验,具有极高的应用价值。
81.相比于现有技术,本发明具有如下有益效果:
82.(1)本发明通过加热和超声对火麻仁球蛋白溶液进行预处理,蛋白结构更为疏松,并分散成小颗粒,提高了蛋白的水解率,提高了产物得率,低聚肽多肽含量在94.5%以上,其中可溶性多肽的得率在75.2%以上,与不进行加热和超声处理相比,得率提高10~25%;通过两次酶解反应,降低了产物的分子量,分子量小于3000da的低聚肽的得率不低于70.5%,与仅进行单一酶解或进行混合酶解相比,得率提高15%~25%;且产物的种类较为单一,苦涩味道得到改善;通过超滤和柱层析去除了低聚肽中的杂质,产物纯度更高,活性
更好,dpph自由基清除的ec
50
值均不大于2.0mg/ml,abts自由基清除的ec
50
值均不大于0.6mg/ml;
83.(2)通过上述方法制备得到的火麻仁低聚肽具有较高的纯度和较低的分子量,可以更好地发挥其抗氧化、抗衰老的功能,且产物的口味较好,可以制成食品或保健品,方便使用,促进了产品的使用与推广。
附图说明
84.图1为本发明所述的火麻仁低聚肽的制备方法的流程图。
具体实施方式
85.为进一步阐述本发明所采取的技术手段及其效果,以下结合实施例和附图对本发明作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本发明,而非对本发明的限定。
86.实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
87.原料:
88.火麻仁购自榆社县田禾生物科技有限公司;
89.风味蛋白酶、碱性蛋白酶、木瓜蛋白酶、胰蛋白酶、胃蛋白酶、氯化钠、氢氧化钠、盐酸、乙醇和过硫酸钾购买于国药集团;
90.dpph和abts购买于阿拉丁。
91.制备例1
92.本制备例通过如下4种方法制备火麻仁粉,具体如下:
93.1-1:将火麻仁干燥,粉碎后,使用正己烷作为溶剂进行溶剂萃取脱脂,得到所述火麻仁粉。
94.1-2:与1-1的区别仅在于,使用石油醚替代正己烷,其余制备方法相同。
95.1-3:将火麻仁干燥,粉碎后,通过物理压榨脱脂,得到所述火麻仁粉。
96.1-4:将火麻仁干燥,粉碎后,使用二氧化碳作为溶剂进行超临界萃取脱脂,得到所述火麻仁粉。
97.含油量的测定
98.烘干火麻仁粉至含水量低于10%,称取样品2.0g,通过索氏提取器,使用正己烷萃取油脂,直至样品质量变化值小于0.02g,计算油脂含量。
99.油脂含量=样品减少的质量/样品原始质量
×
100%。
100.测定并计算得到的火麻仁粉中的油脂含量,1-1、1-2、1-3和1-4制备得到的火麻仁粉中的油脂含量分别为3%、4%、5%和3%,均满足低于5%的要求。
101.在后续的制备例与实施例中,均采用1-1的方法制备火麻仁粉。
102.制备例2
103.本制备例使用制备例1中的1-1制备的火麻仁粉,通过如下11种方法提取火麻仁球蛋白粉,具体如下:
104.2-1:将所述火麻仁粉加入质量分数为5%的氯化钠溶液中,所述火麻仁粉的质量与氯化钠溶液的体积的比值为1:20g/ml,在55℃下提取2h,离心后取上清,在4℃下静置冷却4h后,析出蛋白,再离心,干燥,得到火麻仁球蛋白粉。
105.2-2:与2-1的区别仅在于,氯化钠溶液的质量分数为2%,其余制备方法与2-1相同。
106.2-3:与2-1的区别仅在于,氯化钠溶液的质量分数为4%,其余制备方法与2-1相同。
107.2-4:与2-1的区别仅在于,氯化钠溶液的质量分数为6%,其余制备方法与2-1相同。
108.2-5:与2-1的区别仅在于,氯化钠溶液的质量分数为10%,其余制备方法与2-1相同。
109.2-6:与2-1的区别仅在于,提取温度为40℃,其余制备方法与2-1相同。
110.2-7:与2-1的区别仅在于,提取温度为50℃,其余制备方法与2-1相同。
111.2-8:与2-1的区别仅在于,提取温度为60℃,其余制备方法与2-1相同。
112.2-9:与2-1的区别仅在于,静置冷却的温度为1℃,其余制备方法与2-1相同。
113.2-10:与2-1的区别仅在于,静置冷却的温度为7℃,其余制备方法与2-1相同。
114.2-11:与2-1的区别仅在于,静置冷却的温度为10℃,其余制备方法与2-1相同。
115.火麻仁球蛋白粉得率=干燥得到的火麻仁球蛋白粉的质量/火麻仁粉的质量
×
100%。
116.制备例2-1~2-11制备的火麻仁球蛋白粉的得率如表1所示。
117.表1
[0118][0119]
由表1可知,对比制备例2-1~2-5的结果,可知随着氯化钠溶液质量分数的提高,球蛋白得率先提高后降低,质量分数在5%时球蛋白得率最高;结合制备例2-1和制备例2-6~2-8的结果,可知随着提取温度升高,球蛋白得率先提高后维持相对稳定;结合制备例2-1和制备例2-9~2-11的结果,可知随着静置冷却的温度提高,球蛋白得率先升高后降低。综合上述结果,可知当氯化钠溶液的质量分数为5%,提取温度为55℃,静置冷却温度为4℃,
可以达到最佳的提取效果。
[0120]
制备例3
[0121]
本制备例使用制备例2中的2-1中制备的火麻仁球蛋白粉,通过在不同的加热温度、400w/l下超声40min对火麻仁球蛋白溶液进行预处理,再进行一次酶解制备火麻仁低聚肽,具体如下:
[0122]
3-1:
[0123]
(1)将所述火麻仁球蛋白粉与水混合,得到火麻仁球蛋白的质量浓度为10%的火麻仁球蛋白溶液;
[0124]
(2)将所述火麻仁球蛋白溶液在25℃下加热40min;再在400w/l下超声40min;
[0125]
(3)向所得加热、超声后的产物中加入碱性蛋白酶,所述碱性蛋白酶的使用量为所述火麻仁球蛋白质量的2%,在55℃下一次酶解4h,再在80℃下灭酶30min,降温至25℃,得到一次酶解的产物;
[0126]
(4)所述一次酶解的产物离心后,所得上清液使用分子截流量为3000da的超滤膜进行超滤,得到超滤膜透过液,再以水为洗脱溶剂通过柱层析脱盐,所用的层析柱填料包括葡聚糖凝胶g-50,得到脱盐膜透过液;
[0127]
(5)所述脱盐膜透过液经过冷冻干燥后,得到所述火麻仁低聚肽。
[0128]
3-2:与3-1的区别仅在于,步骤(2)中加热的温度为70℃,其余制备方法与3-1相同。
[0129]
3-3:与3-1的区别仅在于,步骤(2)中加热的温度为75℃,其余制备方法与3-1相同。
[0130]
3-4:与3-1的区别仅在于,步骤(2)中加热的温度为80℃,其余制备方法与3-1相同。
[0131]
3-5:与3-1的区别仅在于,步骤(2)中加热的温度为85℃,其余制备方法与3-1相同。
[0132]
3-6:与3-1的区别仅在于,步骤(2)中加热的温度为90℃,其余制备方法与3-1相同。
[0133]
3-7:与3-1的区别仅在于,步骤(2)中加热的温度为95℃,其余制备方法与3-1相同。
[0134]
3-8:与3-1的区别仅在于,步骤(2)中加热的温度为98℃,其余制备方法与3-1相同。
[0135]
可溶性多肽得率计算
[0136]
酶解结束后,离心得上清液,上清液经冷冻干燥得到可溶性多肽,根据公式计算可溶性多肽的得率。
[0137][0138]
低聚肽得率计算
[0139]
超滤后,超滤膜透过液冷冻干燥得到低聚肽,根据公式计算低聚肽得率。
[0140][0141]
制备例3-1~3-8的可溶性多肽得率和低聚肽得率的计算结果如表2所示。
[0142]
表2
[0143][0144][0145]
由表2可知,当热处理温度超过80℃时,可溶性多肽得率显著提高,超过95℃后无显著变化;当温度高于90℃后,低聚肽得率无显著性变化,因次,综合判断可知,在95℃下进行预处理可以提高产物得率。
[0146]
制备例4
[0147]
本制备例使用制备例2中的2-1中制备的火麻仁球蛋白粉,在95℃下加热40min条件下,通过不同的超声功率对火麻仁球蛋白溶液进行预处理,再进行一次酶解制备火麻仁低聚肽,具体如下:
[0148]
4-1:
[0149]
(1)将所述火麻仁球蛋白粉与水混合,得到火麻仁球蛋白的质量浓度为10%的火麻仁球蛋白溶液;
[0150]
(2)将所述火麻仁球蛋白溶液在95℃下加热40min,再在50w/l下超声40min;
[0151]
(3)向所得加热、超声后的产物中加入碱性蛋白酶,所述碱性蛋白酶的使用量为所述火麻仁球蛋白质量的2%,在55℃下一次酶解4h,再在80℃下灭酶30min,降温至25℃,得到一次酶解的产物;
[0152]
(4)所述一次酶解的产物离心后,所得上清液使用分子截流量为3000da的超滤膜进行超滤,得到超滤膜透过液,再以水为洗脱溶剂通过柱层析脱盐,所用的层析柱填料包括葡聚糖凝胶g-50,得到脱盐膜透过液;
[0153]
(5)所述脱盐膜透过液经过冷冻干燥后,得到所述火麻仁低聚肽。
[0154]
4-2:与4-1的区别仅在于,步骤(2)中超声的功率为100w/l,其余制备方法与4-1相
同。
[0155]
4-3:与4-1的区别仅在于,步骤(2)中超声的功率为200w/l,其余制备方法与4-1相同。
[0156]
4-4:与4-1的区别仅在于,步骤(2)中超声的功率为400w/l,其余制备方法与4-1相同。
[0157]
4-5:与4-1的区别仅在于,步骤(2)中超声的功率为600w/l,其余制备方法与4-1相同。
[0158]
4-6:与4-1的区别仅在于,步骤(2)中超声的功率为800w/l,其余制备方法与4-1相同。
[0159]
4-7:与4-1的区别仅在于,步骤(2)中超声的功率为1000w/l,其余制备方法与4-1相同。
[0160]
可溶性多肽得率和低聚肽得率的计算方法与制备例3相同。
[0161]
制备例4-1~4-7的可溶性多肽得率和低聚肽得率的计算结果如表3所示。
[0162]
表3
[0163][0164][0165]
由表3可知,超声功率超过200w/l时,可溶性多肽和低聚肽的得率均有明显提高,当超声功率超过400w/l时,可溶性多肽和低聚肽的得率无明显变化,且提高了生产成本,因此,在95℃下加热、400w/l下超声可以达到较好的预处理效果。
[0166]
制备例5
[0167]
本制备例使用制备例2中的2-1中制备的火麻仁球蛋白粉,在95℃下加热40min、400w/l下超声40min的条件下,通过如下10种方法制备火麻仁低聚肽,具体如下:
[0168]
5-1:
[0169]
(1)将所述火麻仁球蛋白粉与水混合,得到火麻仁球蛋白的质量浓度为10%的火麻仁球蛋白溶液;
[0170]
(2)将所述火麻仁球蛋白溶液在95℃下加热40min,再在400w/l下超声40min;
[0171]
(3)向所得加热、超声后的产物中加入碱性蛋白酶,所述碱性蛋白酶的使用量为所
述火麻仁球蛋白质量的2%,在55℃下一次酶解4h,再在80℃下灭酶30min,降温至55℃,得到一次酶解的产物;
[0172]
(4)向所述一次酶解的产物中加入风味蛋白酶,所述风味蛋白酶的使用量为所述火麻仁球蛋白质量的4%,在50℃下二次酶解4h,再在80℃下灭酶30min,降温至25℃,得到二次酶解的产物;
[0173]
(5)所述二次酶解的产物离心后,所得上清液使用分子截流量为3000da的超滤膜进行超滤,得到超滤膜透过液,再以水为洗脱溶剂通过柱层析脱盐,所用的层析柱填料包括葡聚糖凝胶g-50,得到脱盐膜透过液;
[0174]
(6)所述脱盐膜透过液经过冷冻干燥后,得到所述火麻仁低聚肽。
[0175]
5-2:与5-1的区别仅在于,步骤(3)中所述碱性蛋白酶的使用量为所述火麻仁球蛋白质量的1%,其余制备方法与5-1相同。
[0176]
5-3:与5-1的区别仅在于,步骤(3)中所述碱性蛋白酶的使用量为所述火麻仁球蛋白质量的3%,其余制备方法与5-1相同。
[0177]
5-4:与5-1的区别仅在于,步骤(3)中所述碱性蛋白酶的使用量为所述火麻仁球蛋白质量的5%,其余制备方法与5-1相同。
[0178]
5-5:与5-1的区别仅在于,步骤(3)中一次酶解的温度为40℃,其余制备方法与5-1相同。
[0179]
5-6:与5-1的区别仅在于,步骤(3)中一次酶解的温度为50℃,其余制备方法与5-1相同。
[0180]
5-7:与5-1的区别仅在于,步骤(3)中一次酶解的温度为60℃,其余制备方法与5-1相同。
[0181]
5-8:与5-1的区别仅在于,步骤(3)中一次酶解的时间为2h,其余制备方法与5-1相同。
[0182]
5-9:与5-1的区别仅在于,步骤(3)中一次酶解的时间为3h,其余制备方法与5-1相同。
[0183]
5-10:与5-1的区别仅在于,步骤(3)中一次酶解的时间为5h,其余制备方法与5-1相同。
[0184]
可溶性多肽得率和低聚肽得率的计算方法与制备例3相同。
[0185]
制备例5-1~5-10的可溶性多肽得率和低聚肽得率的计算结果如表4所示。
[0186]
表4
[0187]
组别可溶性多肽得率(%)低聚肽得率(%)5-179.971.25-254.464.55-380.171.15-480.971.95-571.269.85-675.970.15-774.370.45-859.868.2
5-969.769.65-1079.871.6
[0188]
由表4可知,在加热、超声处理的基础上,当碱性蛋白酶添加量高于火麻仁球蛋白质量的2%时,可溶性多肽得率基本稳定,因而选择碱性蛋白酶添加量为2%可以降低成本;一次酶解温度对可溶性多肽得率有影响,得率随温度的升高先增加后下降,当温度在55℃时,可溶性多肽得率最高;当酶解时间在4h内时,随着酶解时间的增加,多肽产率增加,当酶解时间大于4h时,可溶性多肽得率稳定不变,因此4h为较优条件。
[0189]
制备例6
[0190]
本制备例使用制备例2中的2-1中制备的火麻仁球蛋白粉,在95℃下加热40min、400w/l下超声40min的条件下,一次酶解的方法与5-1相同,通过不同的二次酶解方法制备火麻仁低聚肽,具体如下:
[0191]
6-1:
[0192]
(1)将所述火麻仁球蛋白粉与水混合,得到火麻仁球蛋白的质量浓度为10%的火麻仁球蛋白溶液;
[0193]
(2)将所述火麻仁球蛋白溶液在95℃下加热40min,再在400w/l下超声40min;
[0194]
(3)向所得加热、超声后的产物中加入碱性蛋白酶,所述碱性蛋白酶的使用量为所述火麻仁球蛋白质量的2%,在55℃下一次酶解4h,再在80℃下灭酶30min,降温至55℃,得到一次酶解的产物;
[0195]
(4)向所述一次酶解的产物中加入风味蛋白酶,所述风味蛋白酶的使用量为所述火麻仁球蛋白质量的4%,在50℃下二次酶解4h,再在80℃下灭酶30min,降温至25℃,得到二次酶解的产物;
[0196]
(5)所述二次酶解的产物离心后,所得上清液使用分子截流量为3000da的超滤膜进行超滤,得到超滤膜透过液,再以水为洗脱溶剂通过柱层析脱盐,所用的层析柱填料包括葡聚糖凝胶g-50,得到脱盐膜透过液;
[0197]
(6)所述脱盐膜透过液经过冷冻干燥后,得到所述火麻仁低聚肽。
[0198]
6-2:与6-1的区别仅在于,步骤(4)中风味蛋白酶的使用量为所述火麻仁球蛋白质量的1%,其余制备方法与6-1相同。
[0199]
6-3:与6-1的区别仅在于,步骤(4)中风味蛋白酶的使用量为所述火麻仁球蛋白质量的2%,其余制备方法与6-1相同。
[0200]
6-4:与6-1的区别仅在于,步骤(4)中风味蛋白酶的使用量为所述火麻仁球蛋白质量的6%,其余制备方法与6-1相同。
[0201]
6-5:与6-1的区别仅在于,步骤(4)中风味蛋白酶的使用量为所述火麻仁球蛋白质量的10%,其余制备方法与6-1相同。
[0202]
6-6:与6-1的区别仅在于,步骤(4)中二次酶解的温度为40℃,其余制备方法与6-1相同。
[0203]
6-7:与6-1的区别仅在于,步骤(4)中二次酶解的温度为60℃,其余制备方法与6-1相同。
[0204]
6-8:与6-1的区别仅在于,步骤(4)中二次酶解的时间为2h,其余制备方法与6-1相同。
[0205]
6-9:与6-1的区别仅在于,步骤(4)中二次酶解的时间为3h,其余制备方法与6-1相同。
[0206]
6-10:与6-1的区别仅在于,步骤(4)中二次酶解的时间为5h,其余制备方法与6-1相同。
[0207]
可溶性多肽得率和低聚肽得率的计算方法与制备例3相同。
[0208]
制备例6-1~6-10的可溶性多肽得率和低聚肽得率的计算结果如表5所示。
[0209]
表5
[0210][0211][0212]
由表5可知,对比制备例6-1~6-5的结果,可知随着风味蛋白酶使用量的增加,可溶性多肽得率和低聚肽得率均有提高,但当添加量高于4%后,产率提升的效果并不明显,风味蛋白酶的利用率较低;对比制备例6~1和6-6~6-7的结果,可知随着酶解温度的升高,可溶性多肽得率降低,低聚肽得率先升高后降低,在50℃时的产率最高;对比制备例6~1和6-8~6-10的结果,可知二次酶解的时间在4h内时,时间越长,产物得率越高;超过4h后产量无明显变化,因此酶解时间为4h较为合适。综合上述结果,当风味蛋白酶的使用量为所述火麻仁球蛋白质量的4%、二次酶解的温度为50℃、二次酶解的时间为4h时,可以达到较好的二次酶解效果。
[0213]
制备例7
[0214]
本制备例使用制备例6中的6-1中制备的二次酶解的产物,通过不同的超滤方法制备火麻仁低聚肽,具体如下:
[0215]
7-1:
[0216]
(1)所述二次酶解的产物离心后,所得上清液使用分子截流量为3000da的超滤膜
进行超滤,得到超滤膜透过液,再以水为洗脱溶剂通过柱层析脱盐,所用的层析柱填料包括葡聚糖凝胶g-50,得到脱盐膜透过液;
[0217]
(2)所述脱盐膜透过液经过冷冻干燥后,得到所述火麻仁低聚肽。
[0218]
7-2:与7-1的区别仅在于,使用的超滤膜的分子截流量为1000da,其余制备方法与7-1相同。
[0219]
7-3:与7-1的区别仅在于,使用的超滤膜的分子截流量为5000da,其余制备方法与7-1相同。
[0220]
7-4:与7-1的区别仅在于,使用的超滤膜的分子截流量为10000da,其余制备方法与7-1相同。
[0221]
dpph自由基清除检测
[0222]
(1)配制0.2mmol/l dpph(2,2-二(4-叔辛基苯基)-1-苦肼基)-乙醇溶液,将火麻仁球蛋白低聚肽溶液配置成浓度为(0.5~5mg/ml)的梯度溶液,梯度浓度为0.1mg/ml;
[0223]
(2)分别取1ml不同浓度的低聚肽溶液和1ml dpph-乙醇溶液,混合后在黑暗环境下反应30min,在517nm下测吸光值,作为实验组;取1ml乙醇进行相同的操作,作为对照组;取1ml去离子水进行相同的操作,作为空白组;
[0224]
(3)根据公式计算dpph清除率,并记录清除率为50%时的火麻仁低聚肽溶液浓度(ec
50
)。
[0225]
dpph清除率(%)=[1-(a实验-a对照)/a空白]
×
100%。
[0226]
abts自由基清除检测
[0227]
(1)配制7mmol/l abts(2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐)溶液和140mmol/l过硫酸钾溶液,将火麻仁球蛋白低聚肽溶液配置成浓度为(0.5~2mg/ml)的梯度溶液,梯度浓度为0.1mg/ml;
[0228]
(2)取176μl过硫酸钾溶液和10ml abts溶液混匀,黑暗中反应12h,得到abts工作溶液;
[0229]
(3)向abts工作溶液中加入(50~80)倍体积的去离子水,在常温下在734nm处的吸光值为0.7
±
0.02;
[0230]
(4)取0.7ml低聚肽溶液和2.8ml abts溶液混合,黑暗环境下反应6min,在734nm下测量吸光值,作为实验组;取0.7ml去离子水进行相同的操作,作为对照组;
[0231]
(5)根据公式计算abts清除率,并记录清除率为50%时的火麻仁低聚肽溶液浓度(ec
50
)。
[0232]
abts清除率(%)=(1-a实验/a空白)
×
100%。
[0233]
低聚肽得率的计算方法与制备例3相同。
[0234]
制备例7-1~7-4的低聚肽得率、dpph自由基清除的ec
50
值和abts自由基清除的ec
50
值的结果如表6所示。
[0235]
表6
[0236][0237]
由表6可知,对比7-1~7-4的结果,可知随着超滤膜分子截流量的增加,低聚肽得率增加,当使用分子截流量为3000da的超滤膜进行超滤时,dpph自由基清除ec
50
和abts自由基清除ec
50
的值均较小,说明低聚肽的抗氧化活性较好,因此选用分子截流量为3000da可以达到较好的超滤效果。
[0238]
实施例1
[0239]
本实施例提供一种火麻仁低聚肽的制备方法,包括以下步骤:
[0240]
(1)将所述火麻仁粉加入质量分数为5%的氯化钠溶液中,所述火麻仁粉的质量与氯化钠溶液的体积的比值为1:20g/ml,在55℃下提取2h,离心后取上清,在4℃下静置冷却4h,析出蛋白,再离心,干燥,得到火麻仁球蛋白粉;将所述火麻仁球蛋白粉与水混合,得到火麻仁球蛋白的质量浓度为10%的火麻仁球蛋白溶液;
[0241]
(2)将所述火麻仁球蛋白溶液在95℃下加热40min,再在400w/l下超声40min;
[0242]
(3)向所得加热、超声后的产物中加入木瓜蛋白酶,所述木瓜蛋白酶的使用量为所述火麻仁球蛋白质量的2%,在55℃下一次酶解4h,再在80℃下灭酶30min,降温至55℃,得到一次酶解的产物;
[0243]
(4)向所述一次酶解的产物中加入风味蛋白酶,所述风味蛋白酶的使用量为所述火麻仁球蛋白质量的4%,在50℃下二次酶解4h,再在80℃下灭酶30min,降温至25℃,得到二次酶解的产物;
[0244]
(5)所述二次酶解的产物离心后,所得上清液使用分子截流量为3000da的超滤膜进行超滤,得到超滤膜透过液,再以水为洗脱溶剂通过柱层析脱盐,所用的层析柱填料包括葡聚糖凝胶g-50,得到脱盐膜透过液;
[0245]
(6)所述脱盐膜透过液经过冷冻干燥后,得到所述火麻仁低聚肽。
[0246]
实施例2
[0247]
与实施例1的区别仅在于,本实施例中使用胃蛋白酶替换木瓜蛋白酶,其余原料及制备方法与实施例1相同。
[0248]
实施例3
[0249]
与实施例1的区别仅在于,本实施例中使用胰蛋白酶替换木瓜蛋白酶,其余原料及制备方法与实施例1相同。
[0250]
对比例1
[0251]
与实施例1的区别仅在于,本对比例中不进行步骤(4),其余原料及制备方法与实施例1相同。
[0252]
对比例2
[0253]
与实施例1的区别仅在于,本对比例中不进行步骤(2),其余原料及制备方法与实施例1相同。
[0254]
对比例3
[0255]
与实施例1的区别仅在于,本对比例中使用胃蛋白酶替换木瓜蛋白酶,同时不进行步骤(2)及步骤(5)中的超滤,其余原料及制备方法与实施例1相同。
[0256]
对比例4
[0257]
与实施例1区别仅在于,本对比例中将木瓜蛋白酶和风味蛋白酶一同加入,在55℃下一次酶解40min,不进行二次酶解,其余原料及制备方法与实施例1相同。
[0258]
低聚肽中肽含量测定
[0259]
称0.5g低聚肽样品,通过浓硫酸消解,将有机氮转化为无机铵盐,通过凯氏定氮法对氮含量进行测定,乘以转换系数f=6.25,转换为肽含量,公式为:
[0260]
低聚肽中肽含量(%)=[氮含量
×
f]/低聚肽质量
×
100%
[0261]
计算实施例1~3和对比例1~4制备的火麻仁低聚肽的可溶性多肽得率、低聚肽得率、低聚肽中肽含量、dpph自由基清除的ec
50
值和abts自由基清除的ec
50
值的结果,同时对制备得到的产品的苦涩味进行评价,结果如表7所示。
[0262]
表7
[0263][0264][0265]
由表7可知,实施例1~3在制备过程中进行了加热、超声预处理、两次酶解反应、超滤和脱盐,产物的得率较高,可溶性多肽得率在75.2%以上,低聚肽得率在70.5%以上,低聚肽多肽含量在94.5%以上,制备得到的低聚肽的活性也较好,dpph自由基清除的ec
50
值均
不大于2.0mg/ml,abts自由基清除的ec
50
值均不大于0.6mg/ml;产品的苦涩味也并不明显,改善了使用体验;
[0266]
与实施例1~3进行比较,可知对比例1~3制备的火麻仁低聚肽的产率稍低,活性也稍差,无风味蛋白酶二次酶解得到的低聚肽苦涩味较为明显,其中对比例1中未进行二次酶解,因此产率较低,苦涩味也较为明显;对比例2中未对火麻仁球蛋白溶液进行加热、超声,蛋白的结构较为致密,影响了蛋白酶的水解作用;对比例3中未进行预处理和超滤,未进行预处理影响了蛋白酶的水解效率,而不进行超滤则无法将低聚肽与分子量较大的肽分开,因此无法计算低聚肽得率及含量,得到的产品的活性也较低;以上结果表明加热、超声预处理、二次酶解及超滤对于提高产率和产品的活性具有重要的作用,只有同时进行上述操作,才能达到较好的提取效果;
[0267]
将对比例4与实施例1对比,可知分别进行两次酶解与仅进行一次酶解相比较而言,制备获得可溶性多肽、低聚肽含量更高,活性更好。这表明两种蛋白酶单独进行酶解的效果好于同时进行一次酶解;
[0268]
此外对比实施例1~3的结果,实施例1中使用木瓜蛋白酶,实施例2中使用胃蛋白酶,实施例3中使用胰蛋白酶,以实施例3制备得到的火麻仁低聚肽的得率最高,活性最好,这表明与木瓜蛋白酶和胃蛋白酶相比,胰蛋白酶对预处理后的火麻仁球蛋白的水解效果较好。
[0269]
综上所述,本发明提供了一种火麻仁低聚肽的制备方法,通过对原料进行加热、超声预处理,可以增加底物与蛋白酶的水解面积,提高水解效率;通过依次进行两次酶解反应,可以显著降低产物的分子量大小,且产物的物质种类相当于单一,并且还可以改善产品的苦涩味;对酶解产物再进行超滤和脱盐,制备得到的火麻仁低聚肽的纯度较高,生物活性也较好;通过上述方法制备得到的火麻仁低聚肽具有良好的抗氧化能力,可以制备成相应的食品或保健品直接食用,具有广泛的应用价值。
[0270]
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1