哌啶-4-丁胺的制备方法与流程
哌啶
‑4‑
丁胺的制备方法
技术领域
1.本发明涉及化学合成技术领域,具体涉及一种哌啶
‑4‑
丁胺的制备方法。
背景技术:
2.哌啶
‑4‑
丁胺是一种异双功能蛋白质交联剂,在酶
‑
抗体交联、靶向药方面有特殊作用。
3.目前,哌啶
‑4‑
丁胺制备方法为先酯化、叠氮化然后还原的路线,该方法路线长,使用的原料易燃易爆,增加了操作的危险性,使得该路线在操作人员和地点的选择上有很大的局限性。
技术实现要素:
4.有鉴于此,本提供一种反应步骤短、原料安全性高、实验可操作性强的哌啶
‑4‑
丁胺的制备方法。
5.为解决上述技术问题,本发明采用以下技术方案:
6.根据本发明实施例的哌啶
‑4‑
丁胺的制备方法,包括如下步骤:
7.步骤s1,使得吡啶
‑4‑
丁酸在氨气条件下,转化成哌啶
‑4‑
丁酰胺;
8.步骤s2,使所述哌啶
‑4‑
丁酰胺与吡啶发生反应,生成吡啶
‑4‑
丁腈;
9.步骤s3,吡啶
‑4‑
丁腈在酸性环境中在催化剂作用下发生还原反应,生成所述哌啶
‑4‑
丁胺。
10.进一步地,所述步骤s1包括:
11.步骤s11,使得吡啶
‑4‑
丁酸与n
‑
羟基丁二酰亚胺发生反应,转化为活泼酯;
12.步骤s12,使所述活泼酯与氨气发生反应,得到所述哌啶
‑4‑
丁胺。
13.更进一步地,所述步骤s11中,在吡啶
‑4‑
丁酸的四氢呋喃溶液中,加入n
‑
羟基丁二酰亚胺,并分批加入1
‑
乙基
‑
3(3
‑
二甲基丙胺)碳二亚胺,以转化为所述活泼酯,所述步骤s12中,待步骤s11反应结束后,向反应液中加入氨气的四氢呋喃溶液,生成所述哌啶
‑4‑
丁酰胺。
14.更进一步地,吡啶
‑4‑
丁酸:n
‑
羟基丁二酰亚胺:1
‑
乙基
‑
3(3
‑
二甲基丙胺)碳二亚胺:氨气的摩尔比为1.0:(1.5
‑
2):(1.5
‑
2):(2
‑
3),反应温度控制在20
‑
25℃,所述步骤s11的反应时间为6
‑
10小时,所述步骤s12的反应时间为2
‑
4小时。
15.更进一步地,所述步骤s1还包括:
16.步骤s13,待所述步骤s12反应结束后进行抽滤,滤液加水、乙酸乙酯进行萃取,有机相再依次用水洗、饱和食盐水洗、无水硫酸钠干燥后,经过抽滤、减压蒸干,得到所述哌啶
‑4‑
丁酰胺。
17.进一步地,所述步骤s2中包括:
18.将吡啶加到所述吡啶
‑4‑
丁酰胺的二氧六环溶液中,再滴加三氟乙酸酐,生成所述吡啶
‑4‑
丁腈。
19.更进一步地,所述吡啶
‑4‑
丁酰胺:吡啶:三氟乙酸酐的摩尔比为1.0:(1.2
‑
2):(1.2
‑
2),所述步骤s2中反应温度为10
‑
15℃,反应时间为2
‑
4小时。
20.更进一步地,所述步骤s2还包括:
21.反应完全后,对反应液进行浓缩以去除所述二氧六环,此后加入水、二氯甲烷进行萃取,有机相再依次用水洗、饱和食盐水洗、无水硫酸钠干燥后,经过抽滤、减压蒸干得到吡啶
‑4‑
丁腈的粗品;
22.对所述吡啶
‑4‑
丁腈的粗品进行柱层析纯化,得到吡啶
‑4‑
丁腈的纯化物。
23.进一步地,所述步骤s3包括:
24.将6m盐酸加到吡啶
‑4‑
丁腈的异丙醇溶液中,再加氧化铂以发生所述还原反应,生成哌啶
‑4‑
丁胺。
25.更进一步地,所述吡啶
‑4‑
丁腈与氧化铂的摩尔比为1:(0.02
‑
0.1),反应温度为20
‑
25℃,反应压力为40
‑
60psi,反应时间为8
‑
12小时。
26.此外,在步骤s3反应完全后,还可以将反应液过滤除去氧化铂,加碳酸钠调ph7
‑
8,此后减压蒸干得到哌啶
‑4‑
丁胺的粗品,接着将哌啶
‑4‑
丁胺的粗品经柱层析纯化得到哌啶
‑4‑
丁胺的纯化物。
27.本发明的上述技术方案至少具有如下有益效果之一:
28.根据本发明实施例的制备方法,反应步骤短、原料安全性高、实验可操作性很强的制备方法。
具体实施方式
29.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例对本发明的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于所描述的本发明的实施例,本领域普通技术人员所获得的所有其他实施例,都属于本发明保护的范围。
30.根据本发明实施例的哌啶
‑4‑
丁胺的制备方法,包括如下步骤:
31.步骤s1,使得吡啶
‑4‑
丁酸在氨气条件下,转化成哌啶
‑4‑
丁酰胺。
32.也就是说,首先以吡啶
‑4‑
丁酸作为出发原料,使得吡啶
‑4‑
丁酸中的羧基被转化为酰胺基,得到中间产物哌啶
‑4‑
丁酰胺。
33.具体地,化学反应式如下述式(1)所示:
[0034][0035]
为了使得吡啶
‑4‑
丁酸中的羧基被转化为酰胺基,可以采用下述分步反应:
[0036]
步骤s11,使得吡啶
‑4‑
丁酸与n
‑
羟基丁二酰亚胺发生反应,转化为活泼酯;
[0037]
步骤s12,使所述活泼酯与氨气发生反应,得到所述哌啶
‑4‑
丁酰胺。
[0038]
也就是说,首先使得吡啶
‑4‑
丁酸发生酯化反应,此后使得酯与氨气发生反应得到
哌啶
‑4‑
丁酰胺。
[0039]
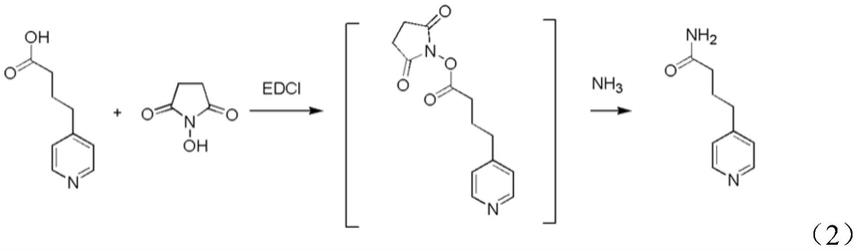
具体而言,其反应路线如下述式(2)所示:
[0040][0041]
其中,在所述步骤s11的酯化反应中,具体可以包括:
[0042]
在吡啶
‑4‑
丁酸的四氢呋喃溶液中,加入n
‑
羟基丁二酰亚胺(hosu),并分批加入1
‑
乙基
‑
3(3
‑
二甲基丙胺)碳二亚胺(edci),以转化为所述活泼酯。也就是说,通过分批加入edci能够很好地控制溶液为ph值,有利于促进反应的进行。
[0043]
另外,待步骤s11反应结束后,向反应液中加入氨气的四氢呋喃溶液,以发生步骤s12的反应,生成所述哌啶
‑4‑
丁酰胺。
[0044]
其中,吡啶
‑4‑
丁酸:n
‑
羟基丁二酰亚胺:1
‑
乙基
‑
3(3
‑
二甲基丙胺)碳二亚胺:氨气的摩尔比可以为1.0:(1.5
‑
2):(1.5
‑
2):(2
‑
3),优选为1.0:1.7:1.7:3.0。通过过量加入n
‑
羟基丁二酰亚胺:1
‑
乙基
‑
3(3
‑
二甲基丙胺)碳二亚胺:氨气有利于促进反应进行。
[0045]
另外,整个步骤s1的反应过程中,可以将温度控制在20
‑
25℃。此外,所述步骤s11的反应时间为6
‑
10小时,所述步骤s12的反应时间为2
‑
4小时。上述反应条件温和、易于操作。
[0046]
另外,在生成哌啶
‑4‑
丁酰胺之后,还可以包括:
[0047]
步骤s13,待所述步骤s12反应结束后进行抽滤,滤液加水、乙酸乙酯进行萃取,有机相再依次用水洗、饱和食盐水洗、无水硫酸钠干燥后,经过抽滤、减压蒸干,得到所述哌啶
‑4‑
丁酰胺。
[0048]
也就是说,在生成中间体哌啶
‑4‑
丁酰胺之后,对其进行纯化。从上述可知,步骤s1得到的中间体的纯化相对简单,无需过柱,通过萃取、抽滤、蒸干等简单的处理即可实现。
[0049]
步骤s2,使所述哌啶
‑4‑
丁酰胺与吡啶发生反应,生成吡啶
‑4‑
丁腈。
[0050]
也就是说,在得到中间体哌啶
‑4‑
丁酰胺后,使其进一步与吡啶发生反应,转化成中间体吡啶
‑4‑
丁腈。
[0051]
该反应具体可以包括:
[0052]
将吡啶加到所述吡啶
‑4‑
丁酰胺的二氧六环溶液中,再滴加三氟乙酸酐(tfaa),生成所述吡啶
‑4‑
丁腈。
[0053]
具体地,反应式如下述式(3)所示:
[0054][0055]
优选地,所述吡啶
‑4‑
丁酰胺:吡啶:三氟乙酸酐的摩尔比为1.0:(1.2
‑
2):(1.2
‑
2),更优选为1.0:1.5:1.5。通过过量加入吡啶以及三氟乙酸酐,有利于促进反应进行,提高收率。另外,所述步骤s2中反应温度为10
‑
15℃,反应时间为2
‑
4小时。
[0056]
同样地,在上述反应结束后,还可以包括如下的纯化处理:
[0057]
反应完全后,对反应液进行浓缩以去除所述二氧六环,此后加入水、二氯甲烷进行萃取,有机相再依次用水洗、饱和食盐水洗、无水硫酸钠干燥后,经过抽滤、减压蒸干得到吡啶
‑4‑
丁腈的粗品;
[0058]
对所述吡啶
‑4‑
丁腈的粗品进行柱层析纯化,得到吡啶
‑4‑
丁腈的纯化物。
[0059]
也就是说,可以首先进行萃取、抽滤、蒸干等得到粗品,此后进行柱层析纯化,得到吡啶
‑4‑
丁腈的纯化物。通过对中间体吡啶
‑4‑
丁腈进行纯化处理,有利于后续反应中减少不必要的副反应,提高收率。
[0060]
步骤s3,吡啶
‑4‑
丁腈在酸性环境中在催化剂作用下发生还原反应,生成所述哌啶
‑4‑
丁胺。
[0061]
在得到中间体吡啶
‑4‑
丁腈之后,进一步地,使其在酸性环境中在催化剂作用下发生还原反应,生成目标产物哌啶
‑4‑
丁胺。
[0062]
具体地,所述步骤s3可以包括:
[0063]
将6m盐酸加到吡啶
‑4‑
丁腈的异丙醇溶液中,再加氧化铂以发生所述还原反应,生成哌啶
‑4‑
丁胺。
[0064]
也就是说,加入高浓度盐酸使得环境为强酸性环境,同时以氧化铂作为催化剂,在溶剂异丙醇中发生所述还原反应。
[0065]
具体地,反应式如下述式(4)所示:
[0066][0067]
优选地,所述吡啶
‑4‑
丁腈与氧化铂的摩尔比为1:(0.02
‑
0.1),更有选为1:0.05。通过加入上述量的催化剂即可充分发挥催化作用,使吡啶
‑4‑
丁腈发生还原反应,得到哌啶
‑4‑
丁胺。
[0068]
其中,反应温度为20
‑
25℃,反应压力为40
‑
60psi,优选为50psi,反应时间为8
‑
12小时。
[0069]
此外,在步骤s3反应完全后,还可以将反应液过滤除去氧化铂,加碳酸钠调ph7
‑
8,此后减压蒸干得到哌啶
‑4‑
丁胺的粗品,接着将哌啶
‑4‑
丁胺的粗品经柱层析纯化得到哌啶
‑4‑
丁胺的纯化物。
[0070]
根据本发明实施例的制备方法,反应步骤短、原料安全性高、实验可操作性很强的制备方法。
[0071]
为使本领域的技术研究人员能够更好的理解本发明的技术方案,下面结合实施例对本发明作进一步的详细说明。
[0072]
实施例1:
[0073]
(1)化合物吡啶
‑4‑
丁酰胺的制备
[0074]
取500ml反应瓶加入吡啶
‑4‑
丁酸(50g,0.3mol,1.0eq)、hosu(58.65g,0.51mol,1.7eq)和四氢呋喃(200ml,4p),分批加edci(97.77g,0.51mol,1.7eq),20
‑
25℃搅拌8小时反应结束。滴加氨气的四氢呋喃溶液(8.3%,184.3g,0.9mol,3.0eq),保温20
‑
25℃反应3小时结束。反应液过滤,滤饼用四氢呋喃洗两遍,滤液中加200ml水、200ml乙酸乙酯萃取,有机相再用100ml水洗、100ml饱和食盐水洗后无水硫酸钠干燥、过滤、浓缩拿到31.0g吡啶
‑4‑
丁酰胺,收率63%。
[0075]
(2)化合物吡啶
‑4‑
丁腈的制备
[0076]
把吡啶
‑4‑
丁酰胺(31.0g,0.189mol,1.0eq)加到二氧六环(90ml,3p)中,再加吡啶(22.4g,0.283mol,1.5eq),冰水浴控温10
‑
15℃滴加三氟乙酸酐(59.4g,0.283mol,1.5eq),析出大量固体后又变稀、变清。保温反应3小时,反应液浓缩,加90ml水、180ml二氯甲烷萃取,有机相再用90ml水洗、90ml饱和食盐水洗,无水硫酸钠干燥、过滤、浓缩干拿到25.2g粗品,柱层析得到19.6g吡啶
‑4‑
丁腈,收率71%。
[0077]
(3)化合物哌啶
‑4‑
丁胺的制备
[0078]
把吡啶
‑4‑
丁腈(19.6g,0.134mol,1.0eq)、氧化铂(1.52g,6.7mmol,0.05eq)、6m盐酸(3ml)加到异丙醇(60ml,3p)中,50psi氢气压力、20
‑
25℃反应3小时,反应液抽滤,向滤液中加碳酸钠固体调ph7
‑
8,浓缩除去异丙醇拿到25.8g粗品,柱层析得到17.15g哌啶
‑4‑
丁胺,收率83%。
[0079]
将反应物进行核磁共振实验确认产物结构,数据如下:
[0080]
1h nmr(型号:avance iii hd 400m,cdcl3,400mhz):δ=2.73(t,4h),2.58(t,2h),2.05(m,3h)1.76(t,1h),1.73(m,4h),1.58(m,2h)1.25(m,4h)检测结果与结构吻合。
[0081]
实施例2:
[0082]
(1)化合物吡啶
‑4‑
丁酰胺的制备
[0083]
取1l反应瓶加入吡啶
‑4‑
丁酸(67.5g,0.41mol,1.0eq)、hosu(79.9g,0.69mol,1.7eq)和四氢呋喃(270ml,4p),分批加edci(132.3g,0.69mol,1.7eq),20
‑
25℃搅拌8小时反应结束。滴加氨气的四氢呋喃溶液(8.3%,252g,1.23mol,3.0eq),保温20
‑
25℃反应3小时结束。反应液过滤,滤饼用四氢呋喃洗两遍,滤液中加300ml水、300ml乙酸乙酯萃取,有机相再用150ml水洗、150ml饱和食盐水洗后无水硫酸钠干燥、过滤、浓缩拿到45.2g吡啶
‑4‑
丁酰胺,收率67%。
[0084]
(2)化合物吡啶
‑4‑
丁腈的制备
[0085]
把吡啶
‑4‑
丁酰胺(45.2g,0.275mol,1.0eq)加到二氧六环(135ml,3p)中,再加吡啶(32.6g,0.413mol,1.5eq),冰水浴控温10
‑
15℃滴加三氟乙酸酐(86.73g,0.413mol,1.5eq),析出大量固体后又变稀、变清。保温反应3小时,反应液浓缩,加150ml水、300ml二氯甲烷萃取,有机相再用150ml水洗、150ml饱和食盐水洗,无水硫酸钠干燥、过滤、浓缩干拿到31g粗品,柱层析得到29.1g吡啶
‑4‑
丁腈,收率72.5%。
[0086]
(3)化合物哌啶
‑4‑
丁胺的制备
[0087]
把吡啶
‑4‑
丁腈(29.1g,0.2mol,1.0eq)、氧化铂(2.3g,1mmol,0.05eq)、6m盐酸(4ml)加到异丙醇(90ml,3p)中,50psi氢气压力、20
‑
25℃反应3小时,反应液抽滤,向滤液中加碳酸钠固体调ph7
‑
8,浓缩除去异丙醇拿到31g粗品,柱层析得到25.5g哌啶
‑4‑
丁胺,收率82.8%。
[0088]
将反应物进行核磁共振实验确认产物结构,数据如下:
[0089]
1h nmr(型号:avance iii hd 400m,cdcl3,400mhz):δ=2.73(t,4h),2.60(t,2h),2.04(m,3h)1.76(t,1h),1.72(m,4h),1.57(m,2h)1.25(m,4h)检测结果与结构吻合。
[0090]
以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明所述原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1