动态动力学拆分α-芳基-α-烷基羧酸酯的方法及应用
动态动力学拆分
α
‑
芳基
‑
α
‑
烷基羧酸酯的方法及应用
技术领域
1.本发明涉及手性dmap氮氧类催化剂催化α
‑
芳基
‑
α
‑
烷基羧酸酯的动态动力学拆分的方法,属于有机化学中不对称合成技术领域。
背景技术:
2.光学活性的α
‑
芳基
‑
α
‑
烷基羧酸及其衍生物是重要的生物活性分子,例如(s)
‑
布洛芬、(s)
‑
萘普生、(s)
‑
酮洛芬、(s)
‑
菲诺洛芬和(s)
‑
氟比诺芬是广泛使用的非甾体类抗炎药。以前报道的催化剂中亲核位点仅限于氮原子或碳原子,而氧原子作为亲核位点的应用还没有被应用到这类反应中。
3.因此,发展有效的合成方法来制备手性α
‑
芳基
‑
α
‑
烷基羧酸及其衍生物具有重要的研究意义。
技术实现要素:
4.为了解决上述技术问题,本发明公开了手性dmap氮氧类催化剂催化α
‑
芳基
‑
α
‑
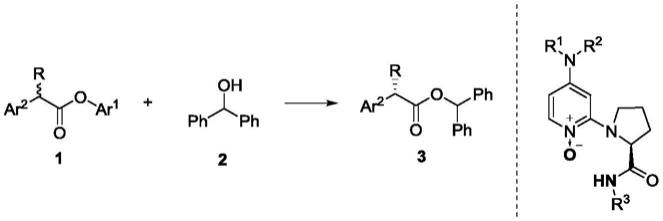
烷基羧酸酯的动态动力学拆分的方法。与以往dmap类催化剂中吡啶上氮参与亲核反应不同,本发明中dmap氮氧类手性催化剂是利用吡啶氮氧中的氧原子作为亲核位点参与动态动力学拆分反应,同时催化剂分子中的氢也起到了关键性作用。
5.本发明所述手性dmap氮氧类催化剂催化α
‑
芳基
‑
α
‑
烷基羧酸酯的动态动力学拆分的方法,包括如下步骤:以消旋α
‑
芳基
‑
α
‑
烷基酯1和二苯甲醇为原料,在dmap氮氧类手性催化剂催化下,动态动力学拆分反应得到手性α
‑
芳基
‑
α
‑
烷基酯3;反应方程式如下:
[0006][0007]
其中:r选自c1
‑
c8烷基或苄基;ar1选自含有缺电子芳基;ar2选自苯基、取代苯基、萘基、取代萘基;nr1r2为二甲胺或四氢吡咯;r3选自苯基、c1
‑
c4烷基、取代苯基、苄基或二苯基甲基;上述所述取代中均指c1
‑
c4烷氧基、c1
‑
c6烷基、卤素、硝基、腈基、羧酸酯基等。
[0008]
进一步地,在上述取代基中,优选情况下:r为me、et、bn;ar1为含有氯、氟、硝基、三氟甲基中的一种或多种取代的苯基;ar2为4
‑
meoc6h4、2
‑
meoc6h4、4
‑
ch3c6h4、2
‑
ch3c6h4、4
‑
clc6h4、2
‑
clc6h4、1
‑
萘基、2
‑
萘基等。
[0009]
进一步地,在上述技术方案中,所述dmap氮氧类手性催化剂,包括如下结构:
[0010][0011]
进一步地,在上述技术方案中,所述dmap氮氧类手性催化剂优选结构为c9f。
[0012]
进一步地,在上述技术方案中,所述反应在有机溶剂中进行,有机溶剂选自三氟甲苯、氯苯、二氯甲烷或甲苯中的一种或多种。优选溶剂为三氟甲苯和二氯甲烷混合溶剂。
[0013]
进一步地,在上述技术方案中,所述反应在有机碱中进行,有机碱选自三乙胺、二异丙基乙基胺或吡啶。优选有机碱为三乙胺或二异丙基乙基胺。
[0014]
进一步地,在上述技术方案中,所述dmap氮氧类手性催化剂与消旋α
‑
芳基
‑
α
‑
烷基酯1摩尔比为0.01
‑
0.2:1。两者优选比例为0.05
‑
0.1:1。
[0015]
进一步地,在上述技术方案中,所述反应温度为
‑
10℃至20℃。
[0016]
本发明在上述技术方案技术上,还提供了一种合成(s)
‑
萘普生、(s)
‑
布洛芬、(s)
‑
酮洛芬、(s)
‑
菲诺洛芬或(s)
‑
氟比诺芬的方法,包括如下步骤:将采用上述方案得到的手性α
‑
芳基
‑
α
‑
烷基酯3在钯碳中催化氢化得到(s)
‑
萘普生、(s)
‑
布洛芬、(s)
‑
酮洛芬、(s)
‑
菲诺洛芬或(s)
‑
氟比诺芬,具体对应反应结构如下:
[0017][0018]
进一步地,在上述技术方案中,所述催化氢化反应溶剂为四氢呋喃和乙醇混合溶剂。
[0019]
发明有益效果:
[0020]
1、以消旋α
‑
芳基
‑
α
‑
烷基酯和二苯甲醇为原料,通过动态动力学拆分反应,一步即可得到手性α
‑
芳基
‑
α
‑
烷基酯产物。接着进行催化氢化,还合成了(s)
‑
萘普生等多个手性药
物。该反应原料易得,反应收率和对映选择性最高分别可达93%和99%ee。
[0021]
2、与以往dmap类催化剂中吡啶上氮参与亲核反应不同,本发明中dmap氮氧类手性催化剂是利用吡啶氮氧中的氧原子作为亲核位点参与动态动力学拆分反应,同时催化剂分子中的氢也起到了关键性作用。
具体实施方式
[0022]
实施例1
[0023]
[0024][0025]
[a]除非另有说明,反应条件如下:酯(0.05mmol),2a(18.4mg,0.1mmol),催化剂c9f(2.2mg,0.005mmol,10mol%),ipr2etn(17.4μl,0.1mmol)在dcm(0.5ml)中放置72小时。[b]核磁收率。[c]通过手性hplc分析测定。n.r=不反应。
[0026]
以五氟苯酚酯1b和二苯甲醇2a为原料生成3a为例,进行反应条件优化,反应方程式如下:
[0027][0028]
具体反应结果如下表所示:
[0029][0030]
[a]反应条件:1(0.05mmol),2a(0.1mmol),催化剂(10mol%)和碱(2equiv)在溶剂(0.5ml)反应72h.[b]核磁收率。[c]通过手性hplc分析确定。[d]phcf3/dcm(1/1,v/v).[e]et3n(5equiv),phcf3/dcm(1/1,v/v).[f]1b(0.2mmol),2a(0.4mmol),c9f(10mol%),and et3n(5equiv)in phcf3/dcm(0.5ml,1/1,v/v)反应72h.[g]c9f(5mol%).
[0031]
在反应条件的筛选过程中,首先考察了催化剂对反应的影响(标号1
‑
10)。同时通过对照不同离去酯、碱、溶剂、温度、原料当量比和催化剂用量对反应的影响,最终确定c9f为最佳催化剂,加入量为10mol%,三氟甲苯和二氯甲烷混合溶剂为最佳反应溶剂,5倍三乙胺为最佳反应条件。
[0032]
反应条件的考察操作(以标号18为例):在干燥的5ml反应管中,分别加入手性催化剂c9f(8.8mg,0.02mmol,10mol%),二苯甲醇2a(73.6mg,0.4mmol)和五氟苯酚酯1b(63.2mg,0.2mmol),然后加三氟甲苯/二氯甲烷(1/1,v/v,0.5ml),最后加三乙胺(152μl,1mmol),将反应液在0℃搅拌72小时。柱层析分离得到57.6mg黄色油状物3a,收率91%,93%ee。hplc chiralcel ia,n
‑
hexane/2
‑
propanol=98/2,flow rate=0.5ml/min,λ=256nm,retention time:24.043min(minor),25.903min(major).[α]
d21
=+22.5(c=1.7,chcl3).1h nmr(400mhz,cdcl3)δ7.32
‑
7.22(m,10h),7.21
‑
7.15(m,3h),7.08
‑
7.02(m,2h),6.81(s,1h),3.83(q,j=7.2hz,1h),1.51(d,j=7.2hz,3h).
[0033]
实施例2
[0034]
在干燥的5ml反应管中,分别加入手性催化剂c9f(8.8mg,0.02mmol,10mol%),二苯甲醇2a(73.6mg,0.4mmol)和五氟苯酚酯1b
‑
l(0.2mmol),然后加三氟甲苯/二氯甲烷(1/1,v/v,0.5ml),最后加三乙胺(152μl,1mmol),将反应液在0℃搅拌72小时。反应结束,柱层
析后得到产物。
[0035]
具体结果如下:
[0036][0037][0038]
代表性的核磁表征数据如下:
[0039]
(s)
‑
benzhydryl
‑2‑
(o
‑
tolyl)propanoate(3c)
[0040][0041]
无色油状,55.5mg,84%yield,95%ee;r
f
=0.38(pet/etoac,10/1,v/v).hplc chiralcel id,n
‑
hexane/2
‑
propanol=90/10,flow rate=0.6ml/min,λ=256nm,retention time:9.060min(minor),9.478min(major).[α]
d21
=+33.4(c=2.0,chcl3);1h nmr(400mhz,cdcl3)δ7.32
–
7.22(m,5h),7.21
–
7.09(m,7h),7.06
–
7.00(m,2h),6.83(s,1h),4.07(q,j=7.2hz,1h),2.35(s,3h),1.50(d,j=7.2hz,3h).
[0042]
(s)
‑
benzhydryl
‑2‑
(p
‑
tolyl)propanoate(3d)
[0043]
[0044]
白色粉末,m.p.:48.3
‑
49.7℃;57.4mg,87%yield,88%ee;r
f
=0.34(pet/etoac,10/1,v/v).hplc chiralcel ig,n
‑
hexane/2
‑
propanol=98/2,flow rate=0.5ml/min,λ=256nm,retention time:33.425min(major),37.690min(minor).[α]
d21
=+17.6(c=2.4,chcl3).1h nmr(400mhz,cdcl3)δ7.32
–
7.24(m,5h),7.21
–
7.14(m,5h),7.13
–
7.06(m,4h),6.82(s,1h),3.80(q,j=7.2hz,1h),2.33(s,3h),1.50(d,j=7.2hz,3h).
[0045]
(s)
‑
benzhydryl
‑2‑
(2
‑
methoxyphenyl)propanoate(3e)
[0046][0047]
无色油状,56.0mg,81%yield,99%ee;r
f
=0.46(pet/etoac,10/1,v/v).hplc chiralcel ia,n
‑
hexane/2
‑
propanol=95/5,flow rate=0.5ml/min,λ=256nm,retention time:18.582min(minor),19.865min(major).[α]
d21
=+3.2(c=3.0,chcl3).
[0048]1h nmr(600mhz,cdcl3)δ7.30
–
7.20(m,9h),7.17
–
7.12(m,3h),6.90(t,j=7.2hz,1h),6.87(s,1h),6.81(d,j=8.4hz,1h),4.10(q,j=7.2hz,1h),3.59(s,3h),1.49(d,j=7.2hz,3h).
[0049]
(s)
‑
benzhydryl
‑2‑
(2
‑
chlorophenyl)propanoate(3g)
[0050][0051]
无色油状;58.8mg,84%yield,94%ee;r
f
=0.37(pet/etoac,20/1,v/v).hplc chiralcel oj
‑
h,n
‑
hexane/2
‑
propanol=70/30,flow rate=0.8ml/min,λ=256nm,retention time:9.200min(minor),10.788min(major).[α]
d21
=+31.8(c=2.40,chcl3).1h nmr(600mhz,cdcl3)δ7.41
–
7.37(m,1h),7.32
–
7.29(m,4h),7.27
–
7.24(m,1h),7.22
–
7.15(m,6h),7.13
–
7.09(m,2h),6.86(s,1h),4.37(q,j=7.2hz,1h),1.51(d,j=7.2hz,3h).
[0052]
(s)
‑
benzhydryl
‑2‑
(4
‑
chlorophenyl)propanoate(3h)
[0053][0054]
浅黄色油状;m.p.:49.6
‑
54.7℃;(60.9mg,87%yield,90%ee);r
f
=0.43(pet/etoac,20/1,v/v).hplc chiralcel ia,n
‑
hexane/2
‑
propanol=99/1,flow rate=0.8ml/min,λ=256nm,retention time:23.290min(major),26.117min(minor).[α]
d21
=+4.6(c=1.50,chcl3);1h nmr(400mhz,cdcl3)δ7.33
–
7.24(m,7h),7.23
–
7.17(m,5h),7.11
–
7.05(m,2h),6.82(s,1h),3.81(q,j=7.2hz,1h),1.50(d,j=7.2hz,3h).
[0055]
(s)
‑
benzhydryl
‑2‑
(naphthalen
‑1‑
yl)propanoate(3i)
[0056]
[0057]
浅黄色油状;m.p.:63.2
‑
65.4℃;63.6mg,87%yield,97%ee;r
f
=0.42(pet/etoac,50/1,v/v).hplc chiralcel ia,n
‑
hexane/2
‑
propanol=98/2,flow rate=0.5ml/min,λ=256nm,retention time:29.987min(major),33.043min(minor).[α]
d21
=+67.5(c=2.10,chcl3).1h nmr(600mhz,cdcl3)δ8.07(d,j=7.8hz,1h),7.89(d,j=7.8hz,1h),7.79(d,j=8.4hz,1h),7.52
–
7.44(m,2h),7.42
–
7.38(m,1h),7.38
–
7.34(m,1h),7.28
–
7.22(m,3h),7.21
–
7.12(m,5h),6.99(d,j=7.2hz,2h),6.86(s,1h),4.64(q,j=7.2hz,1h),1.69(d,j=7.2hz,3h).(s)
‑
benzhydryl
‑2‑
phenylbutanoate(3k)
[0058][0059]
无色油状;55.7mg,84%yield,93%ee;r
f
=0.46(pet/etoac,20/1,v/v).hplc chiralcel ia,n
‑
hexane/2
‑
propanol=98/2,flow rate=0.5ml/min,λ=256nm,retention time:25.242min(minor),28.140min(major).[α]
d21
=+24.5(c=1.00,chcl3).1h nmr(600mhz,cdcl3)δ7.30
–
7.24(m,10h),7.19
–
7.18(m,3h),7.07(t,j=3.6hz,2h),6.81(s,1h),3.57(t,j=7.2hz,1h),2.14
–
2.10(m,1h),1.85
–
1.80(m,1h),0.85(t,j=7.2hz,3h).
[0060]
实施例3
[0061][0062]
在干燥5ml的反应管中,分别加入手性催化剂c9f(8.8mg,0.02mmol,10mol%),二苯甲醇2a(73.6mg,0.4mmol)和五氟苯酚酯1m(74.4mg,0.2mmol),然后加三氟甲苯/二氯甲烷(1/1,v/v,0.5ml),最后加三乙胺(152μl,1mmol),将反应液在0℃搅拌72小时。柱层析分离得到66.2mg无色油状物3m,收率89%,90%ee。hplc chiralcel ia,n
‑
hexane/2
‑
propanol=99/1,flow rate=0.5ml/min,λ=256nm,retention time:27.917min(major),33.453min(minor)[α]
d21
=+20.5(c=1.40,chcl3).1h nmr(400mhz,cdcl3)δ7.32
‑
7.21(m,5h),7.21
‑
7.14(m,5h),7.11
‑
7.03(m,4h),6.81(s,1h),3.80(q,j=7.2hz,1h),2.46(d,j=7.2hz,2h),1.89
‑
1.82(m,1h),1.51(d,j=7.2hz,3h),0.91(d,j=7.2hz,6h).
[0063]
实施例4
[0064][0065]
在干燥5ml的反应管中,分别加入手性催化剂c9f(8.8mg,0.02mmol,10mol%),二苯甲醇2a(73.6mg,0.4mmol)和五氟苯酚酯1n(84mg,0.2mmol),然后加三氟甲苯/二氯甲烷
(1/1,v/v,0.5ml),最后加三乙胺(152μl,1mmol),将反应液在0℃搅拌86小时。柱层析分离得到72.2mg无色油状物3n,收率86%,88%ee。hplc chiralcel od
‑
h,n
‑
hexane/2
‑
propanol=99/1,flow rate=0.8ml/min,λ=256nm,retention time:34.585min(major),45.472min(minor).[α]
d21
=+20.4(c=1.10,chcl3).1h nmr(600mhz,cdcl3)δ7.72(d,j=7.2hz,3h),7.69(d,j=7.2hz,1h),7.56(t,j=7.2hz,1h),7.50(d,j=7.8hz,1h),7.42(q,j=7.2hz,3h),7.30
‑
7.23(m,5h),7.22
‑
7.15(m,3h),7.12
‑
7.06(m,2h),6.83(s,1h),3.91(q,j=7.2hz,1h),1.55(d,j=7.2hz,3h).
[0066]
实施例5
[0067][0068]
在干燥5ml的反应管中,分别加入手性催化剂c9f(2.2mg,0.005mmol,10mol%),二苯甲醇2a(36.8mg,0.1mmol)和五氟苯酚酯1o(20.4mg,0.05mmol),然后加三氟甲苯/二氯甲烷(1/1,v/v,0.5ml),最后加三乙胺(38μl,0.25mmol),将反应液在0℃搅拌72小时。柱层析分离得到17.1mg无色油状物3o,收率84%,94%ee。hplc chiralcel ia,n
‑
hexane/2
‑
propanol=98/2,flow rate=0.5ml/min,λ=256nm,retention time:18.135min(major),22.193min(minor).[α]
d21
=+20.6(c=1.42,chcl3).1h nmr(400mhz,cdcl3)δ7.33
‑
7.19(m,11h),7.13
‑
6.88(m,8h),6.83(s,1h),3.80(q,j=7.2hz,1h),1.50(d,j=7.2hz,3h).
[0069]
实施例6
[0070][0071]
在干燥5ml的反应管中,分别加入手性催化剂c9f(8.8mg,0.02mmol,10mol%),二苯甲醇2a(73.6mg,0.4mmol)和五氟苯酚酯1p(82.0mg,0.2mmol),然后加三氟甲苯/二氯甲烷(1/1,v/v,0.5ml),最后加三乙胺(152μl,1mmol),将反应液在0℃搅拌72小时。柱层析分离得到72.3mg白色粉末3p,收率88%,91%ee。hplc chiralcel oj
‑
h,n
‑
hexane/2
‑
propanol=70/30,flow rate=1.0ml/min,λ=256nm,retention time:17.982min(major),27.502min(minor).[α]
d21
=+6.4(c=1.40,chcl3).1h nmr(600mhz,cdcl3)δ7.54(d,j=7.8hz,2h),7.43(t,j=7.2hz,2h),7.39
‑
7.35(m,2h),7.32
‑
7.25(m,5h),7.23
‑
7.21(m,3h),7.14
‑
7.07(m,4h),6.86(s,1h),3.86(q,j=7.2hz,1h),1.55(d,j=7.2hz,3h).
[0072]
实施例7
[0073][0074]
向50ml的干燥圆底烧瓶中,加入手性催化剂c9f(114mg,0.26mmol,10mol%),二苯甲醇2a(956.8mg,5.2mmol)和五氟苯酚酯1q(1.0296g,2.6mmol),然后加三氟甲苯/二氯甲烷(1/1,v/v,7.0ml),最后加三乙胺(1.4ml,13mmol),在0℃下搅拌85小时。柱层析分离得到897.3mg白色固体3q,收率87%,93%ee。hplc chiralcel ia,n
‑
hexane/2
‑
propanol=98/2,flow rate=0.8ml/min,λ=256nm,retention time:32.408min(major),37.220min(minor).[α]
d21
=+16.6(c=1.60,chcl3);1h nmr(600mhz,cdcl3)δ7.67(d,j=8.4hz,1h),7.62(d,j=9.0hz,1h),7.59(s,1h),7.36(d,j=9.6hz,1h),7.28
‑
7.21(m,5h),7.16
‑
7.10(m,5h),7.05(d,j=7.2hz,2h),6.84(s,1h),3.96(q,j=7.2hz,1h),3.90(s,3h),1.58(d,j=7.2hz,3h).
[0075]
实施例8
[0076][0077]
向10ml的干燥反应管中加入萘普生酯3q(79.2mg,0.2mmol)和10%pd/c(40mg),用乙醇/四氢呋喃(1/1,v/v,2.0ml)溶解。抽真空置换氢气,使反应管完全充满氢气。将该反应放到0℃搅拌10小时。检测反应完成后,将反应液过硅藻土,然后用甲醇充分洗涤。滤液在减压下浓缩,残余物通过色谱法纯化(pet/etoac=3/1),最后以82%的收率和93%的ee值得到白色固体酸4q。hplc chiralcel od
‑
h,n
‑
hexane/2
‑
propanol=50/1,flow rate=1.0ml/min,with 0.1%tfa;λ=256nm,retention time:33.072min(minor),40.233min(major).[α]
d21
=+66.2(c=2.50,chcl3)。
[0078]
以上实施例描述了本发明的基本原理、主要特征及优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明原理的范围下,本发明还会有各种变化和改进,这些变化和改进均落入本发明保护的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1