光响应性的多肽衍生物、多肽纳米材料及其制备方法、应用
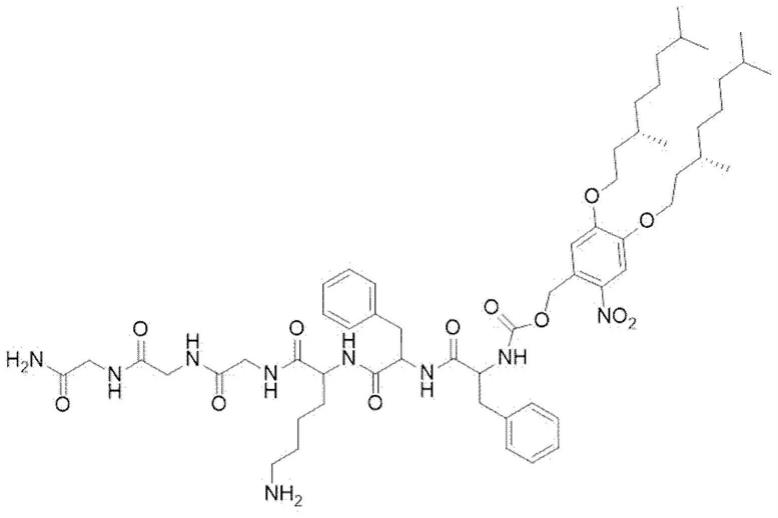
1.本发明属于纳米材料技术领域,具体涉及一种光响应性的多肽衍生物、多肽纳米材料及其制备方法、应用。
背景技术:
2.近年来,自组装纳米材料由于其合成制备方法简单、形貌尺寸易于调控等优势受到了极大的关注。其中,基于多肽的自组装纳米材料,由于多肽及其衍生物良好的生物相容性、低生物毒性、生物可降解性及易于化学修饰等特点,广泛应用于药物递送等生物医学领域。
3.通过调节影响多肽自组装的疏水相互作用、静电相互作用、氢键等非共价相互作用的相对强弱,可得到纳米纤维、球状纳米胶束、纳米囊泡、纳米棒、纳米带等多种纳米结构,纳米结构的尺寸及形貌对其在生物体内的应用有极大影响。例如有研究表明,纳米纤维在体内不易被清除,能延长血液循环时间及在肿瘤组织的保留时间。相比之下,球状纳米胶束则更有利于在肿瘤部位的渗透和富集。
4.目前虽然有关于多肽自组装纳米材料用于生物医药领域的报道,但利用体内不同阶段
‑
不同形貌的策略,以提高肿瘤部位富集效率的研究相对较少。
技术实现要素:
5.有鉴于此,本发明的目的在于公开一种光响应性的多肽衍生物、多肽纳米材料及其制备方法、应用,以期至少解决上述提及的技术问题中的至少之一。
6.为了实现上述目的,本发明公开了一种光响应性的多肽衍生物,包括:
7.多肽主链、光响应触发基团。
8.其中,多肽主链分子序列为phe
‑
phe
‑
lys
‑
gly
‑
gly
‑
gly;多肽主链的c
‑
末端为酰胺结构;多肽主链的n
‑
末端通过氨基甲酸酯结构连接光响应触发基团。
9.光响应触发基团包括4,5
‑
二烷氧基
‑2‑
硝基苄氧羰基,其结构如下:
[0010][0011]
其中,r为c8
‑
c12的烷基链;表示基团连接位点。
[0012]
根据本发明实施例,烷基链为(r)
‑
3,7
‑
二甲基辛基。
[0013]
本发明还公开了一种多肽衍生物的制备方法,包括:
[0014]
以rink
‑
amide树脂为载体,通过固相合成方法制备多肽主链。
[0015]
在固相合成器中,通过酰胺化法将所述多肽主链的n
‑
末端与光响应触发基团连接,制备得到负载在所述载体上的多肽衍生物。
[0016]
用三氟乙酸将所述多肽衍生物从所述载体上切割分离,得到多肽衍生物。
[0017]
本发明还公开了一种多肽纳米材料的制备方法,包括:
[0018]
将上述多肽衍生物溶于纯水中,在第一预设反应温度下加热第一预设反应时间,经自然冷却至室温,静置,得到多肽纳米材料。
[0019]
本发明还公开了一种多肽纳米材料,采用上述方法制备的多肽纳米材料。其中,多肽纳米材料为纤维状纳米材料。
[0020]
根据本发明实施例,将上述多肽纳米材料经紫外光辐照第二预设反应时长,多肽纳米材料的形貌由纤维状变为球状。
[0021]
本发明还公开了上述多肽纳米材料作为递送疏水药物载体的应用,其中,疏水药物包括阿霉素。
[0022]
(三)有益效果
[0023]
1.本发明公开的多肽衍生物,是一种n
‑
末端通过光响应触发基团连接两个疏水烷基链的多肽衍生物。该多肽衍生物在紫外光辐照下,光响应触发基团发生光解反应,导致两个疏水烷基链脱落。利用这一特性,将多肽衍生物制备成多肽纳米材料,以多肽纳米材料为载体递送疏水药物,可以提高递送疏水药物的效率。
[0024]
2.本发明公开的多肽纳米材料的原料为多肽衍生物,生物毒性低,可生物降解,具有广泛的应用前景。
附图说明
[0025]
图1是本发明实施例1制备的多肽衍生物分子结构图;
[0026]
图2是本发明实施例1制备的多肽衍生物的质谱图;
[0027]
图3是本发明实施例2制备的多肽纳米材料的扫描电镜图;
[0028]
图4是本发明实施例3中多肽纳米材料溶液的紫外光谱随辐照时间的变化图;
[0029]
图5是本发明实施例3中经紫外光辐照之后得到的多肽纳米材料扫描电镜图;
[0030]
图6a是本发明实施例2制备的包覆尼罗红探针的多肽纳米材料的激光共聚焦显微镜照片;
[0031]
图6b是本发明实施例3经紫外光辐照后的多肽纳米材料包覆尼罗红探针的激光共聚焦显微镜照片;
[0032]
图7是本发明实施例5中负载于实施例2制备的多肽纳米材料中的阿霉素随紫外光辐照时间的释放率变化图。
具体实施方式
[0033]
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明作进一步的详细说明。
[0034]
本发明公开了一种响应性的多肽衍生物、多肽纳米材料及其制备方法、应用,图1示意性地示出了本发明实施例1中的光响应性的多肽衍生物的分子结构。
[0035]
实施例1,光响应性的多肽衍生物的合成
[0036]
具体合成方法如下:
[0037]
步骤一:
[0038]
分别称取0.7grink amide树脂;
[0039]
原料样品粉末a:360mg fmoc
‑
gly
‑
oh、140mg hobt、380mg hbtu;
[0040]
原料样品粉末b:300mg fmoc
‑
gly
‑
oh、140mg hobt、380mg hbtu;
[0041]
原料样品粉末c:480mg fmoc
‑
lys(boc)
‑
oh、140mg hobt、380mg hbtu;
[0042]
原料样品粉末d:390mg fmoc
‑
phe
‑
oh、140mg hobt、380mg hbtu;
[0043]
原料样品粉末e:390mg fmoc
‑
phe
‑
oh、140mg hobt、380mg hbtu于小样品瓶中,冻干机冻干过夜。
[0044]
步骤二:用超干n,n
‑
二甲基甲酰胺(dmf)活化树脂半小时后,用含20%哌啶的dmf溶液切树脂的封端fmoc基团,每次15分钟,重复三次。用dmf洗涤三次后,将原料样品粉末a用4ml超干dmf溶解,加入200μl超干n,n
‑
二异丙基乙胺(dipea)后,用双针头转移至固相合成器,鼓氮气,室温反应4小时。
[0045]
步骤三:用超干dmf洗涤树脂三次后,再用乙酸酐∶吡啶按摩尔比3∶2的混合制剂对树脂进行封端,每次30分钟,重复三次后,用超干dmf洗涤树脂三次,洗涤完成后进行kaiser测试,若出现黄色,则继续实验;若出现蓝色,则重复封端操作并洗涤树脂,直至kaiser测试为黄色。
[0046]
步骤四:超干dmf洗涤三次后,将原料样品粉末b用4ml超干dmf溶解,加入200μl超干dipea后,用双针头转移至固相合成器,鼓氮气,室温反应4小时。超干dmf洗涤三次后进行kaiser测试,若出现黄色,则继续实验;若出现蓝色,则将原料样品粉末b重新配置一份,加入dipea用dmf溶解后加入固相合成器继续反应,用dmf洗涤后重新进行kaiser测试,直至测试为黄色。用20%哌啶的dmf溶液切氨基酸的fmoc保护基团,每次15分钟,重复三次后,用dmf洗涤三次。洗涤完成后,进行kaiser测试,若出现蓝色,则继续下一步操作;若出现黄色,则重复切fmoc操作并洗涤,直至kaiser测试为蓝色。
[0047]
步骤五:分别对原料样品粉末c、原料样品粉末d、原料样品粉末e按照步骤四进行操作,在树脂载体上依次接上gly,gly,gly,lys,phe,phe,制得多肽主链,此时,将多肽主链保留在树脂载体上。
[0048]
步骤六:将4,5
‑
二((r)
‑
3,7
‑
二甲基辛氧基)
‑2‑
硝基苄基氯甲酸酯(现制现用)用超干二氯甲烷(dcm)溶解加入固相合成器中,并加入200微升三乙胺,通入氮气,室温反应4小时。
[0049]
步骤七,依次用dcm、dmf、正己烷、水、四氢呋喃(thf)洗三次,三氟乙酸∶水=95∶5切树脂7次至红褐色。旋干后,利用制备hplc分离提纯,得到多肽衍生物纯品。
[0050]
其分子结构式如图1所示,质谱检测结果如图2所示。
[0051]
根据本发明实施例,该多肽衍生物的c
‑
末端酰胺化,n
‑
末端通过光响应触发基团连接两个疏水烷基链,利用光响应触发基团在紫外光辐照下会发生光解反应的特性,该多肽衍生物分子结构上的两个疏水烷基链会随光解反应脱落。
[0052]
实施例2多肽纳米材料的制备
[0053]
取1.1mg实施例1制得的多肽衍生物溶解于50ml纯水后,加热至80℃保持30min,缓慢降到室温,静置,即得纤维状多肽纳米材料。
[0054]
取样进行扫描电镜测试,结果如图3所示。
[0055]
根据本发明实施例,该多肽纳米材料以实施例1中的多肽衍生物为原料,即该多肽
纳米材料具有实施例1中多肽衍生物的分子结构特性,在紫外光辐照下会发生光解反应脱去疏水烷基链。同时由图3所示,在紫外光辐照前,该多肽纳米材料的形貌为纤维状。
[0056]
实施例3多肽纳米材料经光触发发生形貌转变
[0057]
取实施例2制得的多肽纳米材料溶液于1cm紫外比色皿中,内置小磁子,密封,冰浴,紫外固化灯辐照,跟踪紫外光谱随辐照时间变化情况,结果如图4所示。发现辐照至60分钟后,紫外光谱基本稳定。
[0058]
取紫外光谱稳定后样品,制样,拍扫描电镜,发现形貌已转变至球状胶束,结果如图5所示。
[0059]
实施例4利用激光共聚焦显微镜观察多肽纳米材料经光触发发生的形貌转变
[0060]
向干净的小样瓶中加入25μl浓度为0.03mm的尼罗红的thf溶液,氮气小心吹干后,分别加入1.5ml实施例2制得的多肽纳米材料溶液和实施例3经紫外光辐照之后的多肽纳米材料溶液,超声后,静置过夜。取样用激光共聚焦显微镜进行扫描测试。
[0061]
根据本发明实施例,图6(a)为未经紫外光辐照的实施例2制得的多肽纳米材料溶液的结果,图6(b)为实施例3中经紫外光辐照后的多肽纳米材料溶液的结果,表明经紫外光辐照后多肽纳米材料由纤维状转变为球状。
[0062]
实施例5多肽纳米材料作为递送疏水药物载体的应用
[0063]
向10μl浓度为0.02mm的阿霉素的二甲亚砜(dmso)溶液中,搅拌的同时快速加入1.5ml实施例2的多肽纳米材料溶液,透析,得到包覆阿霉素的多肽纳米材料水溶液。
[0064]
通过hplc跟踪分析紫外光辐照前后,阿霉素的释放率,发现在辐照前多肽纳米材料具有较优异的包覆稳定性,阿霉素的释放率低。紫外光辐照后,疏水烷基链掉落,纳米结构由纤维状转变为球状,阿霉素释放率逐渐增大,实现阿霉素的可控释放,结果如图7所示。
[0065]
对8周龄雌性icr小鼠,按10mg/kg分别注射游离阿霉素注射液、普通脂质体包覆阿霉素、实施例2的多肽纳米材料包覆的阿霉素、实施例3经辐照后的多肽纳米材料包覆的阿霉素。分别在不同时间点对小鼠静脉取血加入到肝素抗凝管中,低温2000r/min离心10min,取上清液,精密量取血浆250μl与内标混合,加入甲基叔丁基醚萃取,2000r/min离心5min后取上清液。冻干机冻干,hplc分析血药含量。
[0066]
根据本发明实施例,经药代动力学拟合得,四组实验的药物消除半衰期分别为:游离阿霉素1.20小时,脂质体阿霉素2.20小时,辐照前纤维状多肽纳米材料包覆的阿霉素20.42小时,辐照后球状胶束多肽纳米材料包覆的阿霉素11.30小时。可知,辐照前的纤维状多肽纳米材料很大程度地延长了阿霉素的血液循环时间。
[0067]
实施例5仅以阿霉素为例说明本发明的技术作用效果,本发明技术方案中可递送的疏水药物还包括姜黄素、紫杉醇等,在此不做赘述。
[0068]
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1