一种(Z)-3-甲硫基-2-溴丙烯酸酯化合物的合成方法
本发明涉及一种(z)-3-甲硫基-2-溴丙烯酸酯化合物的合成方法。特别涉及一种在无外加过渡金属类催化剂条件下,丙炔酸酯化合物、溴代试剂和二甲基亚砜进行多组分一锅反应合成(z)-3-甲硫基-2-溴丙烯酸酯化合物的方法,属于有机中间体合成技术领域。
背景技术:
(z)-3-甲硫基-2-溴丙烯酸酯化合物具有生物活性基团和可修饰基团,在药物研发领域发挥着重要的作用。根据文献和专利检索,目前还没有制备(z)-3-甲硫基-2-溴丙烯酸酯衍生物的相关报道。通过炔烃双官能化反应一步实现在多重键上引入卤原子和硫醚结构的研究主要局限于非活化炔烃,如2009年taniguchi等实现了铜催化炔烃与四丁基溴化铵及二芳基二硫醚反应,合成了(e)-2-芳硫基-1-溴苯乙烯化合物(tetrahedron.2009,65,2782–2790),如下反应(a);此外,2019年,段林海等人报道了芳基乙炔在120℃条件下与二甲基亚砜、3倍化学当量的盐酸-1,4环氧六环反应,得到(e)-2-甲硫基-1-氯苯乙烯化合物(asianj.org.chem.2019,8,479–481),如下反应(b)。这些方法需要使用过渡金属催化剂或者大量的盐酸-1,4环氧六环无机盐,增加反应成本,此外该反应的底物结构比较受限。
技术实现要素:
针对现有技术存在的缺陷,本发明的目的是在于提供一种以丙炔酸酯化合物、溴代试剂和二甲基亚砜等廉价原料通过多组分一锅反应合成(z)-3-甲硫基-2-溴丙烯酸酯化合物的方法,该方法无需外加过渡金属类催化剂,在温和条件下高选择性、高收率获得(z)-3-甲硫基-2-溴丙烯酸酯化合物,且反应原子效率高、成本低、环境友好、产物分离纯化简单,有利于大规模生产。
为了实现上述技术目的,本发明提供了一种(z)-3-甲硫基-2-溴丙烯酸酯化合物的合成方法,该方法是将丙炔酸酯化合物、溴代试剂和二甲基亚砜进行多组分一锅反应,即得;
所述丙炔酸酯化合物具有式1结构:
所述(z)-3-甲硫基-2-溴丙烯酸酯化合物具有式2结构:
其中,
r为烷基、含羟基取代基的烷基、芳基或者含芳基取代基的烷基。
本发明的(z)-3-甲硫基-2-溴丙烯酸酯化合物中r是由丙炔酸酯化合物引入的取代基团,r可以为烷基、含羟基取代基的烷基、芳基或者含芳基取代基的烷基。所述烷基为c1~c10的烷基,烷基可以为直链烷基或者带支链的烷基,碳原子数大于3时,可以为环状结构的烷基,具体为甲基、乙基、丁基、异丁基、己基、环己基等等。所述含羟基取代基的烷基为含羟基取代基的c1~c10的烷基,羟基数量和位置不限,可以为烷基主链上的任意碳原子上,常见为含有一个端羟基的烷基。所述芳基可以为苯基、萘基或含取代基的苯基,其中,含取代基的苯基是由苯基衍生出来的取代基,苯环上含有常见的取代基,可以为含有卤素取代基、三氟甲基、三氟甲氧基、硝基、c1~c5的烷基、c1~c5的烷氧基、c1~c4的烷氧酰基中至少一种取代基的苯基,也可以为苯并杂环类基团等;卤素取代基如氟取代基、氯取代基、溴取代基或碘取代基;c1~c5的烷基如甲基、乙基、丁基、异丁基等等,c1~c5的烷氧基如甲氧基、乙氧基、丁氧基等等,c1~c4的烷氧酰基如甲氧酰基、乙氧酰基等等,含取代基的苯基其苯环上可以含有一个或多个取代基,一般含有一个取代基,取代基的位置不限,可以为邻、间、对位。所述含芳基取代基的烷基为含有苯环取代基的c1~c5的烷基,最常见的如苄基。r对丙炔酸酯化合物、溴代试剂和二甲基亚砜三组分合成(z)-3-甲硫基-2-溴丙烯酸酯化合物的反应影响并不很明显,在优化反应条件下,r选择不同取代基时,(z)-3-甲硫基-2-溴丙烯酸酯化合物的收率均保持在85%以上。
作为一个优选的方案,所述溴代试剂为br2、nbs、dbdmh中至少一种。优选的溴代试剂都可以作为合成(z)-3-甲硫基-2-溴丙烯酸酯化合物的溴源,都能得到较高的目标产物收率,而效果最佳的为nbs,此外,nh4br等离子型溴源并不能与丙炔酸酯化合物和二甲基亚砜进行反应得到目标产物。
作为一个优选的方案,所述溴代试剂的用量为丙炔酸酯化合物摩尔量的90~150%。溴代试剂的用量为丙炔酸酯化合物摩尔量的100%时,达到最佳的反应效果,目标产物的收率最高,溴代试剂的相对用量超过丙炔酸酯化合物摩尔量的100%时,反应效果增加不明显,而溴代试剂的相对用量低于丙炔酸酯化合物摩尔量的100%时,目标产物的收率有下降趋势,特别是溴代试剂的相对用量低于丙炔酸酯化合物摩尔量的90%时,目标产物的收率下降明显。溴代试剂的用量进一步优选为丙炔酸酯化合物摩尔量的100~110%。
作为一个优选的方案,所述反应采用三乙胺和/或二异丙基乙胺作为催化剂。通过大量实验表明在没有添加催化剂时,反应也能顺利进行,但是收率相对较低,而添加了三乙胺或二异丙基乙胺作为催化剂,能够增加(z)-3-甲硫基-2-溴丙烯酸酯化合物收率,特别是采用二异丙基乙胺作为催化剂时效果明显,而采用其他的四甲基乙二胺或三乙烯二胺等作为催化剂时,对反应效果没有明显改善或者不利于反应。
作为一个优选的方案,所述催化剂用量为丙炔酸酯化合物摩尔量的5~30%。催化剂用量优选为丙炔酸酯化合物摩尔量的5~15%,最优选为10%。催化剂用量添加量高于或低于丙炔酸酯化合物摩尔量10%,目标产物的收率会稍有降低。
作为一个优选的方案,所述反应的条件为:在85~105℃温度下,反应6~10小时。在85~105℃温度下能够保证反应顺利进行,以高选择性获得(z)-3-甲硫基-2-溴丙烯酸酯化合物目标产物,而在90~100℃温度下能够保证反应获得较为理想的目标产物收率,如果温度过高则反应的选择性明显下降,目标产物收率也会降低,而温度过低,会造成反应收率相应降低。
本发明的二甲基亚砜同时作为反应的良性溶剂,又作为廉价的反应原料,其用量比例是相对过量的,为常见的溶剂添加量,这是本领域技术人员可以理解的。
本发明由丙炔酸酯化合物、溴代试剂与甲基亚砜进行反应的路线如下:
本发明还提出了合成(z)-3-甲硫基-2-溴丙烯酸酯化合物的反应机理:以丙炔酸乙酯、nbs与二甲基亚砜之间的反应为例进行具体说明。首先,n-溴代丁二酰亚胺作为溴代试剂与丙炔酸乙酯发生迈克尔加成反应,高立体选择性得到(z)-1,2-二溴代丙烯酸乙酯中间体,同时二甲基亚砜受热分解生成甲基硫醇,二溴丙烯酸乙酯中间体进一步与甲基硫醇发生亲核取代反应生成(z)-3-甲硫基-2-溴丙烯酸酯并释放出溴化氢分子。
相对现有技术,本发明的技术方案带来的有益技术效果:
1)本发明采用常见的溴代试剂和二甲基亚砜作为反应原料,原料成本低,且二甲基亚砜既是反应底物,又是反应介质,原子经济性高,无需额外添加氧化剂;
2)本发明采用的丙炔酸酯化合物的选择性广,官能团兼容性好;
3)本发明不使用过渡金属类催化剂,且反应选择性高,产物易分离提纯,收率高;
4)本发明的反应步骤简单,通过一锅反应可以实现,且反应条件温和,在较低的温度条件下可以实现。
附图说明
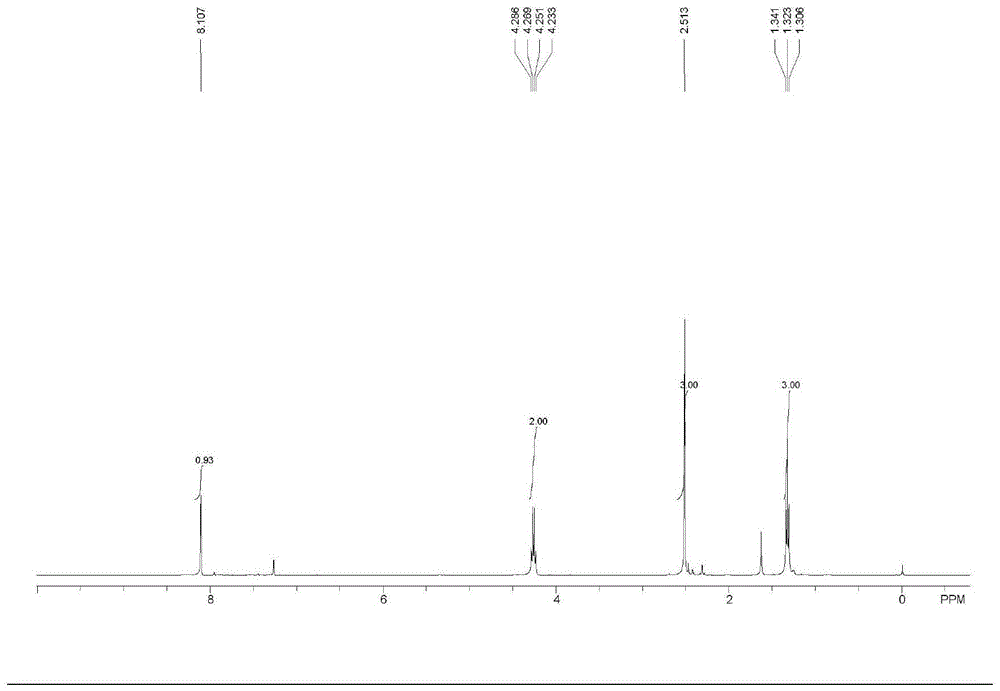
图1为(z)-3-甲硫基-2-溴丙烯酸乙酯1hnmr。
图2为(z)-3-甲硫基-2-溴丙烯酸乙酯13cnmr。
具体实施方式
以下具体实施例旨在进一步说明本发明内容,而不是限制本发明权利要求的保护范围。
以下实施例中涉及的反应原料如果没有特殊说明都是常规的商品原料。
以丙炔酸乙酯、二甲基亚砜及n-溴代丁二酰亚胺在最佳反应条件下进行的反应作为标准反应,具体反应式如下:
具体操作步骤为:在8ml反应瓶中,依次加丙炔酸乙酯(0.5mmol)、二异丙基乙胺(0.05mmol),n-溴代丁二酰亚胺(0.5mmol),dmso(1.0ml)。所得混合液在95℃条件下搅拌反应。利用薄层色谱监测反应进程,反应时间为8小时。反应结束后,将反应混合物倒入10ml水中,并使用乙酸乙酯(3ml×2)萃取,合并有机相并使用饱和食盐水洗涤,减压除去溶剂,核磁粗谱分析产率。
以下实验组1~16是以上述标准反应作为参考,进行对比说明:
上表中实验组1~4考察了不同叔胺催化剂对反应的影响,通过实验表明该反应在不添加催化剂时,反应可以顺利进行,但是反应的选择性较低,而通过添加i-pr2net或三乙胺作为催化剂时,目标产物的收率和选择性都有一定的改善,特比是采用i-pr2net作为催化剂时,目标产物的收率和选择性达到最高,而四甲基乙二胺或三乙烯二胺代替二异丙基乙胺作为反应的催化剂时反应收率有明显的降低且立体选择性也变差。
上表中实验组1、5~7考察了二异丙基乙胺催化剂用量对反应的影响,通过实验表明催化剂用量为丙炔酸乙酯底物的0.1当量时,最有利于反应,可以获得最高的目标产物收率,而二异丙基乙胺用量低于丙炔酸乙酯的0.1当量时,反应效果会有明显降低,而增加二异丙基乙胺用量高于的0.1当量时,反应的收率没有显著提升。如果反应中不使用二异丙基乙胺时,反应收率显著降低至22%,这说明催化剂的使用可以显著提升反应效果。
上表中实验组1、8~10考察了不同溴代试剂对反应的影响,通过实验表明以溴单质、二溴海因和n-溴代丁二酰亚胺都可以作为合成(z)-1,2-二溴代丙烯酸乙酯的溴代试剂,但是采用溴单质和二溴海因时,反应收率分别降低至61%和87%,效果要稍差于n-溴代丁二酰亚胺,而使用溴化铵等离子型溴源替代n-溴代丁二酰亚胺时反应无法进行。
上表中实验组1、11~13考察了n-溴代丁二酰亚胺的使用量对反应的影响,通过实验表明n-溴代丁二酰亚胺的用量为丙炔酸乙酯底物摩尔量的90~150%,反应能够顺利进行,都可以获得80%以上的目标产物收率,而n-溴代丁二酰亚胺的用量为丙炔酸乙酯底物摩尔量的100~110%范围内,都可以获得90%以上的目标产物收率,而过量的n-溴代丁二酰亚胺对反应效果没有明显提升,造成溴代试剂浪费,而n-溴代丁二酰亚胺用量过低时会明显降低目标产物收率。
上表中实验组1、14~16考察了反应温度对反应的影响,通过实验表明降低反应温度至85℃时,反应收率明显降低,反应效果相对较差,而升高反应温度至105℃及115℃时,反应产率有一定的降低,产物的立体选择性变得很差。因此,本反应的最佳反应温度为90~100℃。
实施例1~6
以下实施例1~6均按最优反应条件下反应,具体反应方程式如下,主要是考察不同底物在最优条件反应的收率情况:
具体操作步骤为:在8ml反应瓶中,依次加丙炔酸酯(1.0mmol)、二异丙基乙胺(0.1mmol),n-溴代丁二酰亚胺(1.0mmol),dmso(1.5ml)。所得混合液在95℃条件下搅拌反应。利用薄层色谱监测反应进程,反应时间为8小时。反应结束后,将反应混合物倒入15ml水中,并使用乙酸乙酯(5ml×2)萃取,合并有机相,使用饱和食盐水洗涤,干燥后真空浓缩并通过色谱柱层析纯化即可得到目标化合物。
实施例1
化合物1:收率92%,ethyl(z)-2-bromo-3-(methylthio)acrylate;
1hnmr(400mhz,cdcl3)δ8.11(s,1h),4.27(q,j=7.2hz,2h),2.52(s,3h),1.33(t,j=7.2hz,3h).
13cnmr(100mhz,cdcl3)δ161.1,149.0,107.7,62.2,17.12,14.2.
实施例2
化合物2:收率90%,cyclohexyl(z)-2-bromo-3-(methylthio)acrylate;
1hnmr(400mhz,cdcl3)δ8.07(s,1h),4.92–4.83(m,1h),2.51(s,3h),1.87–1.85(m,2h),1.76–1.73(m,2h),1.57(s,3h),1.56–1.48(m,3h),1.42–1.30(m,3h).
13cnmr(100mhz,cdcl3)δ160.5,148.5,108.4,74.6,31.5,25.3,23.5,17.1.
实施例3
化合物3:收率93%,4-hydroxybutyl(z)-2-bromo-3-(methylthio)acrylate;
1hnmr(400mhz,cdcl3)δ8.11(s,1h),4.25(t,j=6.4hz,2h),3.71(q,j=6.4hz,2h),2.52(s,3h),1.84–1.77(m,2h),1.71–1.64(m,2h),1.26(s,1h).
13cnmr(100mhz,cdcl3)δ161.1,149.3107.4,66.0,62.3,29.1,25.1,17.1.
实施例4
化合物4:收率89%,benzyl(z)-2-bromo-3-(methylthio)acrylate;
1hnmr(400mhz,cdcl3)δ8.15(s,1h),7.40–7.35(m,5h),5.25(s,2h),2.50(s,3h).
13cnmr(100mhz,cdcl3)δ160.9,149.8,135.5,128.6,128.4,128.2,107.3,67.8,17.2.
实施例5
化合物5:收率92%,benzo[d][1,3]dioxol-5-yl(z)-2-bromo-3-(methylthio)acrylate;
1hnmr(400mhz,cdcl3)δ8.34(s,1h),6.78(d,j=8.8hz,2h),6.64(s,1h),6.57(d,j=9.6hz,2h),6.00(s,2h),2.56(s,3h).
13cnmr(100mhz,cdcl3)δ159.8,151.7,148.0,145.5,145.1,113.9,107.9,106.3,103.6,101.7,17.3.
实施例6
化合物6:收率85%,4-bromophenyl(z)-2-bromo-3-(methylthio)acrylate;
1hnmr(400mhz,cdcl3)δ8.38(s,1h),7.51(d,j=8.8hz,2h),7.03(d,j=8.8hz,2h),2.57(s,3h);
13cnmr(100mhz,cdcl3)δ159.2,152.3,149.8,132.5,123.2,119.1,105.9,17.3.
- 还没有人留言评论。精彩留言会获得点赞!