一种表达病毒样颗粒的细胞核转化的转基因植物的制备方法及其在抵抗棉铃虫中的应用
本发明属于生物技术领域,尤其涉及一种表达病毒样颗粒的细胞核转化的转基因植物的制备方法及其在抵抗棉铃虫中的应用。
背景技术:
棉铃虫是我国最重要的农业害虫之一,也是世界性害虫,危害的植物多达200余种,使用苏云金芽孢杆菌(bt)来防治棉铃虫被认为是一种环境友好的防治方法,得到了广泛的应用。但是随着其广泛种植也带来了新的问题,例如棉铃虫对bt出现抗性、次要害虫变成主要害虫、棉铃虫的进化加速等等。近些年发展起来的rnai的抗虫技术有着序列专一性高,环境友好的优点,为害虫的治理提供了新的思路和方向。
rnai是一种在真核生物中由dsrna诱发的基因沉默现象,由核酸内切酶dicer将dsrna切割成21-24nt的sirna,接着sirna与体内的一些ago蛋白酶形成rna诱导的沉默复合物(risc),进而对互补的mrna进行切割,导致mrna的降解,诱发基因的沉默。在害虫防治领域,rnai技术通过抑制害虫关键基因的表达,从而影响害虫生长或者杀死害虫。该技术具有序列特异性,针对特定的靶位点,对作物和人畜无害,具有较大的应用潜力。
过去10来年中,利用植物介导的rnai技术在害虫防治方面取得了令人瞩目的成就。最早的报道:mao等用表达p450基因rnai分子的烟草和棉花饲喂棉铃虫后,棉铃虫肠道中p450基因的表达显著降低,从而抑制了棉铃虫的取食和生长发育。进一步研究表明同时在棉花中另外转入半胱氨酸蛋白酶基因能够进一步提高rnai的抗虫效果;baum等对玉米进行基因改造,使其表达以玉米根萤叶甲(diabroticavirgiferavirgiferaleconte)的液泡atp酶的a亚基基因为靶标的rnai分子,结果表明,取食经过基因改良的玉米能够抑制害虫肠道细胞靶标基因的表达,经过基因改良的玉米根部遭受的破坏要比野生型玉米的少50%;通过植物介导的rnai抗棉铃虫的研究中,不同课题组也报道了针对不同的靶标基因,可以抑制相应基因的表达,转基因植物对棉铃虫具有一定程度的抗性;另外,ni等报道了通过在棉花中聚合rnai与bt能够进一步提高植物的抗虫性并延缓棉铃虫对bt抗性的进化速度。通过植物介导的rnai对刺吸式口器害虫也有成功的报道,如pitino等用含有唾液腺mpc002基因和肠道rack1基因表达的dsrna的转基因植物喂食桃蚜,发现60%以上桃蚜的目标基因表达受抑制,同时其后代数量明显减少。zha等证明了rna干扰抗虫同样能够用在抗刺吸式昆虫---水稻褐飞虱上,取食表达rnai分子的水稻能够抑制对应基因的表达;王晖等用细胞色素p450基因表达的dsrna喂食麦长管蚜与桃蚜,成功抑制了蚜虫体内的细胞色素表达,最终导致蚜虫死亡。
尽管植物核转基因介导的rnai技术在虫害治理方面取得了令人瞩目的成就,但是其抗虫效果相对于利用bt作物抗虫不太理想。其可能的原因在于:①由于昆虫缺少rna依赖的rna聚合酶(rdrp),rnai抗虫效果将取决于吸收dsrna剂量,然而通过细胞核转化表达的dsrna量不够高,不足以引起目标害虫显著的rnai反应。②由于植物自身具有rnai途径,植物中表达的dsrna会被植物本身的dicer加工成sirna,而植物产生的sirna对抗虫的效果不佳。因而整体上降低了抗虫效果。因此,提高杀虫dsrna在植物的表达水平,并提高其在植物中的稳定性,将是有效提高抗虫效果的一种策略。
综上所述,现有技术存在的问题是:
棉铃虫是鳞翅目类害虫,目前通常认为鳞翅目类害虫对rnai具有不应性。第一:dsrna的稳定性与rnase的活性、生理ph有关,dsrna在鞘翅目的体液中稳定性较高,在鳞翅目中稳定性最低,很快被降解。第二:dsrna被内化进细胞的能力不同,在鞘翅目中dsrna通过依赖网格蛋白的内吞作用或其他dsrna转座子被中肠上皮细胞吸收,随后被释放到细胞质中,dsrna被切割成sirna有效地来激发rnai。在鳞翅目中,dsrna一部分被rnase降解,另一部分进入到中肠上皮细胞,大部分被内体捕获,没有被加工成sirna形成有用的rnai。有的dsrna被运输到血腔道内时迅速被血腔中的rnase降解,向脂肪细胞中转运不充分。第三:rnai核心元件的效率不同,即使dsrna被成功的内化进细胞并且接触到了rnai通路中的核心酶,这些核心酶的表达和功能的不同也会导致在昆虫中产生rnai效率不同。第四:rnai系统性的传播不足,细胞间的沉默信号的传递不足限制了rnai效率。由此,在植物中表达dsrna/amirna通过rnai的方法来抵抗棉铃虫受到极大限制。
因此,目前急需针对以上四个方面做出优化,以增强在植物中通过rnai方法对鳞翅目类害虫的抗虫效果,即提高dsrna在害虫体内的稳定性,增强dsrna被细胞内化的能力,提高rnai核心元件的效率以及增强rnai系统性传播,从而达到保护植物的效果。
技术实现要素:
针对现有技术存在的问题,本发明提供了一种表达病毒样颗粒的细胞核转化的转基因植物的制备方法及其在抵抗棉铃虫中的应用,目的是通过在植物中表达病毒样颗粒ms2和针对害虫必需基因的杀虫hprna来抵抗棉铃虫。为植物保护和鳞翅目害虫的防治提供了新的有效方法。
本发明是这样实现的,一种表达病毒样颗粒的细胞核转化的转基因植物的制备方法,通过农杆菌介导的t-dna插入细胞核基因将病毒衣壳蛋白与抑制害虫关键基因的hprna在植物中进行重组表达,获得表达重组病毒样颗粒的转基因植物。
本发明还披露了如上述的制备方法在制备抗棉铃虫的植物中的应用。
本发明还披露了如上述的抗棉铃虫的植物的制备方法,其特征在于:通过农杆菌介导的t-dna插入细胞核基因将病毒衣壳蛋白与抑制棉铃虫的关键基因的hprna在植物中进行重组表达获得。
进一步地,所述抑制棉铃虫的关键基因包括ace1基因。
棉铃虫ace1基因hprna制备方法为:将ace1基因和来自马铃薯内含子基因(ga20)构成hprna,结合双camv35s启动子,nos终止子构成表达盒,将其连接到具有卡那霉素表达盒的质粒pbl121中,在植物烟草中表达ace1基因的hprna。
进一步地,所述病毒衣壳蛋白包括ms2噬菌体衣壳蛋白和跨膜肽tat。
进一步地,所述病毒衣壳蛋白为2个拷贝的ms2衣壳蛋白,且在第二个拷贝的ms2衣壳蛋白abloop结构域融合了一段跨膜肽序列tat,整体序列见seqidno.2所示。
进一步地,所述植物包括烟草。将烟草种子于无菌条件下培养。培养条件为:温度:25℃/20℃、光照周期:16h光照/8h黑暗、光强:50–150μe。取2-4片幼嫩的烟草将叶片切割分解,将切碎的烟草叶片放入培养好的农杆菌中摇晃震荡,之后将烟草叶片碎片放入选择培养基进行阳性芽筛选,通过pcr检测其阳性后获得核转烟草,之后通过qrt-pcr检测核转烟草的表达量,选取最高的表达量的烟草进行后续生测实验。
进一步地,目标基因导入农杆菌的方法包括电转化方法和冻融法中的任一种。
进一步地,以质粒pbl121为表达载体,构建表达ace1基因的hprna和seqidno.2所示的ms2病毒衣壳蛋白的植物载体,并转化至烟草叶片中,培养获得抗棉铃虫的植物。
本发明还披露了如上述的抗棉铃虫的植物的制备方法制备的转基因植物在抵抗棉铃虫中的应用。
进一步地,所述应用表现为棉铃虫的生长发育延迟和/或死亡。
进一步地,所述应用表现为抑制棉铃虫的生长和/或化蛹和/或致死。
进一步地,所述应用表现为在一定程度上有效保护植物。
综上所述,本发明的优点及积极效果为:
大肠杆菌ms2噬菌体属于正极性单链rna球形病毒,基因组全长3659bp,编码成熟酶蛋白、外壳蛋白、复制酶蛋白和裂解蛋白等4种蛋白质分子,每个ms2噬菌体含有180个拷贝的外壳蛋白,一拷贝的成熟蛋白,包裹一分子rna的正二十面体。在早期噬菌体的研究中发现,噬菌体复制酶基因的5’端有一个约21个核苷酸组成的茎环区域(pac),噬菌体外壳蛋白的二聚体与这个茎环结构的结合不但引发了外壳蛋白本身的组装,而且还引发了外壳蛋白包裹整个噬菌体基因组rna的过程。tat多肽是来自于hiv病毒转导域的一段核苷酸序列,在噬菌体颗粒表面展示tat多肽可以帮助其跨细胞膜。通过pac位点将hprna包裹进噬菌体颗粒,成熟的病毒样颗粒可以防止hprna在植物细胞中被dicer酶加工剪切成sirna,并且可以保护hprna在植物细胞和棉铃虫肠道中被dnaase和rnase降解。tat帮助病毒样颗粒穿过细胞膜从而确保hprna进入棉铃虫细胞,引起有效的rnai反应。
本发明中首先构建烟草表达载体,通过westernblot成功检测到ms2噬菌体衣壳蛋白在烟草中高效表达,并且通过qrt-pcr检测hprna的表达,并选取其中表达量最高的烟草株系。其次建立成熟的棉铃虫饲养体系,在此基础上进行棉铃虫生理测试。本发明的技术方案有效地提高的植物对棉铃虫的抗性,抑制了棉铃虫的生长以及化蛹,通过qrt-pcr检测到目的基因ace1基因在处理组显著性下调,说明病毒样颗粒介导的rnai的成功应用可以有效提高植物对棉铃虫的抗性。通过vlp介导的rnai分子递送技术在植物中的成功应用为棉铃虫的防治奠定了坚实的基础,并为棉铃虫的防控提供了一种有效的途径。
附图说明
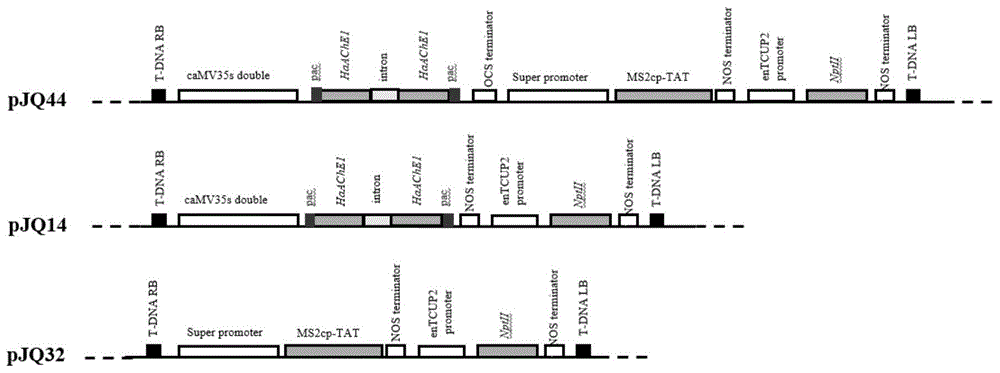
图1是本发明实施例提供的植物表达载体的载体图;
图2是本发明实施例提供的植物表达载体jq14转基因烟草不同株系中dsrna表达水平鉴定的qrt-pcr图;
图3是本发明实施例提供的植物表达载体jq44转基因烟草不同株系中dsrna表达水平鉴定的qrt-pcr图;
图4是本发明实施例提供的植物表达载体jq32诱导表达ms2噬菌体衣壳蛋白的westernblot图;
图5是本发明实施例提供的植物表达载体jq44诱导表达ms2噬菌体衣壳蛋白的westernblot图;
图6是本发明实施例的结果之棉铃虫体重变化图;
图7是本发明实施例的结果之棉铃虫第六天的表型图;
图8是本发明实施例的结果之用qrt-pcr方法检测棉铃虫体内ha-ace1基因表达水平图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例对本发明进行进一步详细说明,各实施例及试验例中所用的设备和试剂如无特殊说明,均可从商业途径得到。此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
根据本申请包含的信息,对于本领域技术人员来说可以轻而易举地对本发明的精确描述进行各种改变,而不会偏离所附权利要求的精神和范围。应该理解,本发明的范围不局限于所限定的过程、性质或组分,因为这些实施方案以及其他的描述仅仅是为了示意性说明本发明的特定方面。实际上,本领域或相关领域的技术人员明显能够对本发明实施方式作出的各种改变都涵盖在所附权利要求的范围内。
为了更好地理解本发明而不是限制本发明的范围,在本申请中所用的表示用量、百分比的所有数字、以及其他数值,在所有情况下都应理解为以词语“大约”所修饰。因此,除非特别说明,否则在说明书和所附权利要求书中所列出的数字参数都是近似值,其可能会根据试图获得的理想性质的不同而加以改变。各个数字参数至少应被看作是根据所报告的有效数字和通过常规的四舍五入方法而获得的。本发明中,“约”指给定值或范围的10%以内,优选为5%以内。
本发明下述各实施例中未特别限定温度时,则均为常温条件。常温是指四季中自然室温条件,不进行额外的冷却或加热处理,一般常温控制在10~30℃,最好是15~25℃。
本发明中涉及的基因、蛋白或其片段可以是天然纯化的产物,或是化学合成的产物,或使用重组技术从原核或真核宿主(例如,细菌、酵母、植物)中产生。
本发明基于棉铃虫转录组数据筛选到致死基因ace1基因,ms2装甲rna技术和tat多肽的跨膜特性,设计植物表达载体,开发了一种表达病毒样颗粒的细胞核转化的转基因植物的制备方法及其在抵抗棉铃虫中的应用,具体如下实施例所示。本发明中涉及的菌种包括:根癌农杆菌eha105;ms2衣壳蛋白表达的载体;双camv35s启动子和super启动子且具有卡那霉素抗性质粒pbl121为表达载体,作为表达ms2蛋白以及rna的植物载体。
实施例1棉铃虫室内饲养技术的建立
本实施例所选用的棉铃虫卵购于河南省济源白云实业有限公司(科云生物官方网店),虫在28℃、60%湿度、14h光照/10h黑暗的环境下孵化,挑选孵化时间点在6h之内的棉铃虫在棉铃虫人工饲料上培养。棉铃虫人工饲料的配方如下:
将700ml沸腾的超纯水加入135g酵母粉中混合均匀后倒入300g玉米面;150g黄豆面;75g糖,搅拌至顺滑后按顺序加入25ml22.4%naoh;60ml5%乙酸;22.5ml25%甲醛;22.5ml复合维生素(1.528g烟酸;1.525gb5;0.764g核黄素;0.382g维生素b1;0.382g维生素b6;0.382g叶酸b9;0.305g维生素h;0.003g氰钴胺素b12;500g水),然后加入3g山梨酸;3g尼泊金甲酯;9.4g维生素c,搅拌均匀,然后将30g琼脂加入800ml超纯水煮至粘稠拉丝后与之混合,再次搅拌均匀,放在盒子里晾凉备用,在4℃冰箱储存,保质期为一周。
在饲料上生长的虫长到二龄后期应单头分开用24孔板养,避免自相残杀,四龄之前两天一更换饲料,四龄之后每天更换并换入12孔板内。培养条件:28℃、60%湿度、14h光照/10h黑暗;光照强度:30-40μe·m-2·s-1。
实施例2棉铃虫ace1基因的获得
1、棉铃虫ace1基因特异性引物的设计
上游引物f:5'-acccatgtaagcttcaatgcaatataga-3'
下游引物r:5'-cgtaccagatcttactttcctctct-3'
目的片段(棉铃虫ace1基因cdna)序列如seqidno.1所示。
2.棉铃虫mrna的获得
2.1材料的获取:选取生长良好的棉铃虫成虫,立即液氮冷冻。
2.2总rna提取:采用takara公司rnaisoplus试剂提取棉铃虫的总rna,主要步骤为:取一头成虫放在液氮中快速冷冻,在打样机中研磨。加入1mltakararnaisoplus后迅速摇匀,涡旋18s左右,室温静置10min充分裂解。加入200μl氯仿,混匀,冰上静置,4℃,12000rpm,15min离心。取约400μl上层无色水相转移到新管中。重复4-5,再用氯仿萃取几次。加入等体积异丙醇,轻轻混匀,呈现透明状,-20℃静置10min,12000rpm离心10min,轻柔弃上清。用1ml75%乙醇洗涤沉淀,冰上静置2min,4℃,7500rpm离心5min,弃上清。微离心,用枪头吸走剩余酒精,干燥。室温干燥沉淀,加30-50μldepc水或(试剂盒里的rnasefreeh20),室温溶解,用无酶枪头测浓度。
3.逆转录反应
3.1残留基因组dna去除
在rnasefree离心管中配制如下混合液,用移液器轻轻吹打混匀。42℃孵育2min。
3.2逆转录反应体系配制(20μl体系)
在第1步的反应管中直接加入2×hifairtmⅱsupermixplus,用移液器轻轻吹打混匀。
3.3逆转录程序设置
将上述混合液按照下表程序进行孵育。
反应后可分装后储存于-80℃长期保存。
4.特异性扩增ace1基因及其验证
以棉铃虫cdna为模板,以已设计的引物组成配对引物,进行pcr反应,反应体系如下:
混匀后,进行pcr反应:
94℃,3min;95℃,15s,58℃,15s,72℃,30s(1min/kb),35循环;72℃,5min,上样、电泳,在紫外凝胶成像系统中观测目的条带。回收目的片段。
实施例3农杆菌感受态细胞的制备
一、农杆菌感受态细胞的制备
(1)划线活化根癌农杆菌eha105,挑取根癌农杆菌eha105单菌落于3ml的yeb液体培养基(含rif50mg/l)中,28℃振荡培养过夜;
(2)取过夜培养菌液1ml接种于50mlyeb(rif50mg/l)液体培养基中,28℃振荡培养至od600为0.5;
(3)将菌液分入两只50ml离心管(配平),5000-6000rpm,离心5min,(或4000rpm10min)弃上清;
(4)每管加入12.5ml(菌液的1/2量)20mmcacl2,使农杆菌细胞充分悬浮,冰浴30min;
(5)5000-6000rpm,离心5min,(或4000rpm10min)弃上清,置于冰上,加入6.25ml(菌液的1/4量)预冷的20mmcacl2,充分悬浮细胞,每管100-200μl分装在1.5mlep管中,液氮中速冻1min,置-80℃冰箱保存备用。
实施例4植物表达载体的构建
本实施例中采用含有双camv35s启动子和super启动子且具有卡那霉素抗性质粒pbl121为表达载体,并导入根癌农杆菌eha105中,作为表达ms2基因和rna的植物转化载体。
以质粒pbl121为载体骨架,把合成的ms2噬菌体衣壳蛋白序列(如seqidno.2所示)、haace1基因序列(如seqidno.3所示)、hivtat基因序列克隆到质粒pbl121中,构建一系列植物表达载体。所采用的ms2序列是两个相同拷贝的噬菌体的衣壳蛋白序列,第二个拷贝的ms2衣壳蛋白abloop结构域融合了一个tat序列(该序列翻译出来的蛋白质因具有抗核酸酶的特性以及穿过细胞膜的特性被用来保护体外合成的rna,保持rna的稳定性以及帮助其穿过细胞膜进入细胞参加rnai反应。);tat序列是来自于hiv病毒转导域的一段被认为有穿膜功能的氨基酸序列;haace1是棉铃虫的乙酰胆碱酯酶基因,选取其中一段298bp作为发夹环rna的茎,用来自于马铃薯的ga20氧化酶基因的内含子的一段203bp的序列(cctatataattttaagtggaaaaaaaaggttaactcatttacatatataatcgagaatatgtatatatatagtgcctctatatcaaattgtttatctggttttgagtgacacaaaatttaaaataataaagaaatttttgaatcttgcagtcagctgaaacaaataaatatattgaaacgaatagagtagtacggtccgtacc,如seqidno.4所示)作为发夹环的环。构建了一系列植物表达载体:pbl121+hphaace1;pbl121+ms2;pbl121+hphaace1+ms2。见图1所示。具体构建过程如下:
pbl121+hphaace1植物表达载体的构建;首先把载体pbl121用限制性内切酶xbai和xhoi在37℃双酶切3个小时后,回收线性载体骨架,将这个片段命名为片段1。酶切体系如下:pet28a:10.0μl;xbai和xhoi各0.5μl;10×buffer5.0μl;ddh2o34.0μl。
以棉铃虫cdna为模板,以引物haace-f1(5’tctagaacatgaggatcacccatgtaagcttcaatgcaatatagagt3’,)和haace1-r1(5’aaaattatataggggatcctactttcctctcttgata3’,)扩增得到ace1基因中298bp的靶标序列(体系同前),其前端带有限制性酶切位点xbai的片段,后端带有ga20前端同源序列,将这个片段命名为片段2。
以引物haace1-f2(5’cggtccgtaccagatcttactttcctctcttg3’,),haace1-r2(5’ctcgagacatgaggatcacccatgtcaatgcaatatagagt3’,)扩增(体系同前)得到ace1基因中298bp的反向靶标序列,其前端带有bglⅱ的酶切位点,后端带有限制性酶切位点xhoi的片段,将这个片段命名为片段3。
以马铃薯dna为模板,以ga20intron的引物ace-ga20-f(5’aagagaggaaagtaggatcccctatataattttaagtgg3’,)和ga20-ace-r(5’tcaagagaggaaagtaagatctggtacggaccgtact3’,扩增(体系同前)得到一头一段有正向ace1同源的序列,另一头有bglⅱ的酶切位点,将这个片段命名为片段4。
以片段2和片段4为模板,用重叠延伸pcr的方式,用haace-f1和ga20-ace-r这两对引物扩增得到拼接起来的片段,将其命名为片段5。
重叠延伸pcr的体系及程序如下:
混匀后,进行pcr反应:
94℃,3min;95℃,15s,58℃,15s,72℃,30s(1min/kb),35循环;72℃,5min,上样、电泳,在紫外凝胶成像系统中观测目的条带,并回收目的片段5。
将片段1,3,5按照摩尔比为1:10:10的量混合,与载体pbl12116℃连接,体系如下:
目的片段3和5各2μl
载体pbl1211μl
solutioni5μl。
其中,体系中目的片段的具体体积用量根据样品浓度进行计算,使样品用量符合摩尔比。连接后转化大肠杆菌xl10-gold,在含有卡那霉素的平板上进行筛选,通过酶切验证初步鉴定重组子,最后通过测序验证此重组子,把验证正确的重组子命名为pjq14。
接着将质粒转化到农杆菌eha105感受态细胞中,并涂布于加入卡那霉素的yeb培养基上,12h后,从培养基上随机挑取单菌落,分别接入50mg/l的含有卡那霉素的yeb液体培养基中,过夜培养(37℃,220rpm),培养的菌液直接作为pcr模板。
质粒dna导入农杆菌的方法如下:
①电转法:
2、加2μl质粒dna于100μl感受态细胞中,用枪头轻轻搅拌混匀;
3、然后再将其转入电转杯中(不要产生气泡),在2500v高压下电击;(电转杯预先用75%乙醇浸泡,再在无菌台中风干,使用前在-20℃中预冷,电击前擦干电转杯;电压随电转杯间隙不同而变化,四楼的设定可以直接使用)
4、取出电转杯,加入500μl预冷的yeb培养基(不含抗生素),轻轻吹打混匀,吸出菌液转入1.5ml离心管中,28℃,200rpm振荡培养5h;
5、取30-40μl菌液涂在含相应抗生素(50mg/lkan和50mg/lrif)的yeb平板上,28℃倒置培养1.5-2天;
②冻融法:
1、在200μl感受态细胞中加入2-10μl(约1-10μg)质粒dna,冰浴5min,液氮中速冻5min;
2、迅速转入37℃水浴中,热激5min;
3、加入1mlyeb(不含抗生素)液体培养基,28℃,180-200rpm振荡培养2-4小时;
4、3000rpm离心4min,去一部分上清,留取200μl菌液涂布于含有50mg/lkan和50mg/lrif的yeb平板;
5、放置约0.5h,待水份干后,28℃培养约24小时至长出菌落。
pcr反应体系如下:
混匀后,进行pcr反应:95℃,5min;95℃,30s,56℃,30s,72℃,30s,35cycles;72℃,5min。
选取pcr阳性克隆进行酶切及测序验证,筛选得到正确的单克隆,测序正确的菌种保存于-80℃备用。
pbl121+ms2植物表达载体的构建:首先把pbl121质粒dna用限制性内切酶kpni和spei采用通用酶切方法双酶切后,回收线性载体骨架,将其命名为片段6。在第三方公司合成一段834bp的密码子优化过的两个拷贝的ms2噬菌体衣壳蛋白序列,设计引物msf(5’-tttccatggtggcttctaactttactcagttcgttctt-3’)和msr(5’-tttggtaccttaataaattcctgaattagctgctatag-3’)扩增(体系同前),得到前端带有kpni,后端带有spei的片段,用ncoi和hindⅲ双酶切后回收的到目的片段将其命名为片段7。将片段6,7按照摩尔比为1:10的量混合,用solutioni酶连接后转化大肠杆菌xl10-gold,在含有卡那霉素的平板上进行筛选,通过酶切验证初步鉴定重组子,最后通过测序验证此重组子,把验证正确的重组子命名为pjq32。
接着将质粒转化到农杆菌eha105感受态细胞中,并涂布于加入卡那霉素的yeb培养基上,12h后,从培养基上随机挑取单菌落,分别接入50mg/l的含有卡那霉素的yeb液体培养基中,过夜培养(37℃,220rpm),培养的菌液直接作为pcr模板。pcr反应体系同上,选取pcr阳性克隆进行酶切及测序验证,筛选得到正确的单克隆,测序正确的菌种保存于-80℃备用。
pbl121+hphaace1+ms2植物表达载体的构建:首先把pbl121+hphaace1植物表达载体用和spei和xhoi双酶切后,回收hphaace1片段,将其命名为片段8。其次把pbl121+ms2细菌表达载体用spei和xhoi双酶切后,回收线性骨架,将其命名为片段9。将片段8、9按照摩尔比为10:1的量混合,用solutioni酶连接后转化大肠杆菌xl10-gold,在含有卡那霉素的平板上进行筛选,通过酶切验证初步鉴定重组子,最后通过测序验证此重组子,把验证正确的重组子命名为pjq44。
接着将质粒转化到农杆菌eha105感受态细胞中,并涂布于加入卡那霉素的yeb培养基上,12h后,从培养基上随机挑取单菌落,分别接入50mg/l的含有卡那霉素的yeb液体培养基中,过夜培养(37℃,220rpm),培养的菌液直接作为pcr模板。pcr反应体系同上,选取pcr阳性克隆进行酶切及测序验证,筛选得到正确的单克隆,测序正确的菌种保存于-80℃备用。
实施例5核基因组转化的植物的制备及其鉴定
1、试剂和培养基制备
灭菌后,每500ml培养基加入:
0.1mg/lnaa1mg/mlnaa50μl
1mg/l6-ba1mg/ml6-ba500μl
yeb:
固体培养基:
每升yeb液体培养基加15g琼脂粉,高压灭菌。
卡那霉素(kan)储液:100mg/ml
利福平(rif)储液:50mg/ml
yeb固体培养基平板:灭菌后的yeb固体培养基待其温度降至50℃时加入卡那霉素(kan)和利福平(rif),至终浓度为50mg/l,混匀后立即倒入培养皿,凝固后4℃倒置保存。
2、农杆菌介导的烟草细胞核基因转化
(1)将农杆菌在平板上划线,从平板上挑取单菌落,接种到20ml附加相应抗生素(kan50mg/l,rif50mg/l)的yeb液体培养基中,在恒温摇床上,于28℃下以180r/min培养至od600为0.6~0.8(约需17h)。
(2)将od600为0.6~0.8的菌液,按1%~2%的比例,转入新配制的无抗生素(含rif)的yeb液体培养基中,可同时加入100~500μmol/l的乙酰丁香酮。在上述相同的条件下再培养6h左右,待od600为0.2~0.5时即可用于转化。
(3)4℃,2500r/min离心沉淀菌体,在超净工作台上,用40mlms重悬,将重悬好的菌液倒入玻璃平板中,将切成5×5mm大小的烟草叶片(萌发一个月左右的烟草)放入菌液中,浸泡5-30min(通常10min左右),取出叶片置于无菌滤纸上吸去附着的菌液。
(4)将浸染过的叶片放在rmop上,在28℃暗培养条件下共培养2-4天(待周围稍长出一圈农杆菌)。
(5)将经过共培养的外植体移到加有抗生素(100mg/lkana)的rmop(附加500mg/l的羧苄青霉素,抑制根癌农标菌生长)上,在光照为25μmol·m-2·s-1、25℃条件下进行选择培养。
(6)选择培养2-3周后,外植体的转化细胞将分化出抗性不定芽或产生抗性愈伤组织,将这些抗性材料转入相应的选择培养基(rmop+100mg/lkana+500mg/lcb)中进行继代培养。
(7)待不定芽长到1cm以上时,切下并插入含有选择压的烟草生根培养基(ms+0.1mg/lnaa+100mg/lkana+500mg/lcb)上进行生根培养,两周左右长出不定根,稍长大后可做分子鉴定。
3、通过pcr鉴定阳性核转植株
3.1试剂制备:
ctab-extractionbuffer(100ml):
最后使用时加入β-me,按1:100的比例稀释(100mlbuffer加入1mlβ-me)。
3.2catb法提取dna
1.取约100mg植物叶片(大拇指盖大小)置于装有三颗灭菌钢珠的2mlep管中,放在液氮中快速冷冻,在打样机中研磨,先用液氮浸泡,对称放样,55hz40s,研磨充分(研磨不充分的样中可能有rnase),防止解冻。
2.加入500μlctab提取液,vortex,60℃温浴,30min(每隔十分钟混匀一下)。
3.加入200μl氯仿/异戊醇(24:1)混合液,混匀至乳白色。
4.4℃离心12000rpm,10min,取400μl上清液于新的1.5mlep管中,加入360μl异丙醇(0.8-0.9体积),混匀。
5.4℃离心12000rpm,30min。
6.弃上清,加入70%乙醇洗涤沉淀(0.5-1ml)1-2次。
7.微离心,弃上清,自然干燥,加入40μl左右ddh2o溶解,测浓度,-20℃保存。
3.3pcr鉴定阳性植物
将抽取的植物dna作为模板,使用引物haace1-f2(5’cggtccgtaccagatcttactttcctctcttg3’,),haace1-r2(5’ctcgagacatgaggatcacccatgtcaatgcaatatagagt3’,)鉴定转基因植物jq14,pcr反应体系如下:
混匀后,进行pcr反应:95℃,5min;95℃,30s,56℃,30s,72℃,30s,35cycles;72℃,5min。
将抽取的植物dna作为模板,使用引物msf(5’-tttccatggtggcttctaactttactcagttcgttctt-3’)和msr(5’-tttggtaccttaataaattcctgaattagctgctatag-3’)鉴定转基因植物jq32和jq44,pcr反应体系同上。
实施例6qrt-pcr检测核转植物的基因表达量
按前述方法提取rna、纯化、反转录,获得cdna。将肌动蛋白基因(actin)作为内参基因。采用sybrgreen法进行荧光定量检测,用takara公司的荧光定量检测试剂盒(tbgreenpremixextaq)。
actin上游引物f:5'-cctggtattgctgaccgtatgc-3'
actin下游引物r:5'-ctgttggaaggtggagagggaa-3'
ace1基因上游引物f:5'-cagtcaactccagctccatag-3'
ace1基因下游引物r:5'-aataagccagaacctccgaag-3'
然后使用荧光定量pcr仪(bio-rad)进行pcr,反应体系(10μl)如下:
混匀后,进行pcr反应:95℃,30s;95℃,5s,60℃,30s,39cycles;95℃,5s;60℃,30s。计算ace1基因表达量时,以actin为内参,使用标准曲线法计算表达量。
实验结果如图2、3所示,选取表达量最高的株系即jq14#7核jq44#9进行生测实验。
实施例7ms2蛋白的植物表达及检测
5.1试剂准备:
extractionbuffer(500ml)
用koh调节ph至9.4,定容至500ml。使用前,每500μl加:2%β-巯基乙醇(10μl)5μm和蛋白酶抑制剂(100mm,10μl);
nh4acinmethanol(500ml):0.1m即3.854gnh4ac溶于500mll甲醇。
5.2操作步骤如下:
1)取约100mg烟草植物叶片,(大拇指盖大小)放在液氮中快速冷冻,在打样机中研磨,先用液氮浸泡,对称放样,55hz40s,研磨充分。
2)加入500μlextractionbuffer到植物材料中,涡旋30s(计时)。
3)加入500μl苯酚,涡旋30s,4℃,13000rpm,10min。
4)转移上清到新的ep管中。
5)每200μl抽提物加入1ml0.1mnh4ac,涡旋10s。
6)置于冰箱最下层沉淀蛋白。
7)13000rpm,4℃,5min。
8)用50μl0.1mnh4ac洗两次后常温干燥。
9)用100μl1%sds溶解(60℃温浴溶解)。
10)取200μl离心,用80μl1%sds溶液重悬,加20μl5x蛋白loadingbuffer100℃加热10min,制备得到蛋白样品,用westernblot检测蛋白表达情况(ms2专一性抗体)。
结果见图4、5所示,在pbl121+ms2,pbl121+hphaace1+ms2中准确检测到了大小为28kda左右的ms2蛋白,说明植物的诱导表达成功,之后选取表达量最高的jq32#4株系进行生测实验。
实施例8植物表达载体抗棉铃虫效果测定
1、植物喂食对棉铃虫的影响
本实施例烟草叶片离体饲养棉铃虫,每两天换一次叶片,保持饲料新鲜、湿度适中,将二龄前期的虫接种到半活体的烟草叶片上。在28℃、60%湿度、14h光照/10h黑暗的环境下培养,每隔一天记录虫子的体重,并且更换新鲜的烟草叶片,喂养至化蛹。记录虫子体重,化蛹率。
喂食表达被ms2包裹的hpace1的植物的棉铃虫体重显著性低于对照组(wt)和喂食只表达hpace1的植物的处理组(如图6,p<0.001)。表型分析可以发现,取食表达靶向ace1基因hprna植物的棉铃虫在第六天生长明显迟缓于对照组,并且喂食表达被ms2包裹的hpace1的植物的棉铃虫相比与喂食只表达hpace1的植物的棉铃虫在第六天生长也有迟缓的趋势(如图7)。
2、植物喂食对棉铃虫ace1基因表达的影响
喂食6天后,每组虫在平均值附近取样各5头,迅速用液氮研磨,并按上述方法提取rna、纯化、反转录,获得cdna。将肌动蛋白基因(actin)作为内参基因。采用sybrgreen法进行荧光定量检测,用takara公司的荧光定量检测试剂盒(tbgreenpremixextaq)。
actin上游引物f:5'-cctggtattgctgaccgtatgc-3'
actin下游引物r:5'-ctgttggaaggtggagagggaa-3'
ace1基因上游引物f:5'-cagtcaactccagctccatag-3'
ace1基因下游引物r:5'-aataagccagaacctccgaag-3'
然后使用荧光定量pcr仪(bio-rad)进行pcr,反应体系(10μl)如上,计算ace1基因表达量时,以actin为内参,使用标准曲线法计算表达量。
取食表达ms2-hpace1的植物的成虫的ace1基因表达量显著性低于对照组(如图8,p<0.05),说明该rna递送方式可显著性的降解ace1基因的mrna。
以上结果表明,喂食表达靶向ace1基因hprna的转基因植物可以显著性抑制棉铃虫ace1基因,并可以有效的影响棉铃虫的生长和抑制幼虫化蛹。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
序列表
<110>湖北大学
<120>一种表达病毒样颗粒的细胞核转化的转基因植物的制备方法及其在抵抗棉铃虫中的应用
<160>4
<170>siposequencelisting1.0
<210>1
<211>1488
<212>dna
<213>ace1基因cdna
<400>1
aagtcgacgcgtggttcggcattccttacgctcaaaaacctgtaggtgacttgagattta60
gacaccccagaccagcggaaagttggggtgatgaaatactgaatactacgacactgccac120
actcatgcgtccaaattatagatactgtgttcggtgattttcctggagcgatgatgtgga180
atcccaacacagatatgcaggaagactgtctgtttattaacatagtgacgccaagaccac240
gacccaaaaacgcagctgttatgctttgggtcttcggtggtggattttactcaggaacgg300
ctactttagatgtttatgatccgaaaattcttgtgtcagaagagaaagttgtttacgttt360
caatgcaatatagagtagcgtctcttggttttctattctttgatactcccgacgttccag420
gcaatgccggtctttttgatcagcttatggcattgcaatgggtaaaagataacatagctt480
acttcggaggaaatccccataacataactttattcggtgagtcggctggggcagcatcag540
tatctttacatctattgtcccctattgtcccctctgtcaaggaacttgttttctcaagcg600
ataatgcaatcaggagcggctaccgcaccttgggctattatatcaagagaggaaagtatt660
ttgagaggaattcgtttagccgaagctgttcactgtccgcattctagaacagatatgggg720
ccgatgatcgagtgcctcaggaagaagagtcctgatgaactagtcaacaacgagtggggc780
actctcggcatttgtgaatttcctttcgtcccgataatagacggttcattcttagacgag840
ttacctgttagatccttagttcaccagaactttaagaagaccaatattttgatgggatca900
aacacagaggagggttattactttatactttattacttaactgaattgttccccaaagag960
gagaatgttggaattagtagggagcagtacttgcaggcagtgagggaattgaacccctat1020
gtgaatgacgctggacgacaagctattgttttcgagtacactgactggttgaatcccgaa1080
gaccctataaagaatcgaaatgctctggataaaatggtgggtgattaccactttacgtgt1140
ggagtgaacgaatttgcgcatcgttatgcagagactggaaacaatgttttcacatattat1200
tacaagcatcggagcaagaacaacccctggccctcgtggacaggagtgatgcacgctgac1260
gaaatcaattacgtattcggagaacccttgaacccagggaagaattattctcccgaggaa1320
gtggaatttagtaagcgactaatgagatattgggcgaacttcgcgagaagcggaaaccca1380
tctataaacccgagtggagactcaacgaagatcaattggccggtgcacacggcgtccggg1440
cgtgaatacctgtccttagcagtcaactccagctccataggccacggg1488
<210>2
<211>834
<212>dna
<213>ms2
<400>2
ggccttaagatggcttctaactttactcagttcgttctcgtcgacaatggcggaactggc60
gacgtgactgtcgccccaagcaacttcgctaacggggtcgctgaatggatcagctctaac120
tcgcgttcacaggcttacaaagtaacctgtagcgttcgtcagagctctgcgcagaatcgc180
aaatacaccatcaaagtcgaggtgcctaaagtggcaacccagactgttggtggtgtagag240
cttcctgtagccgcatggcgttcgtacttaaatatggaactaaccattccaattttcgct300
acgaattccgactgcgagcttattgttaaggcaatgcaaggtctcctaaaagatggaaac360
ccgattccctcagcaatcgcagcaaactccggcatctacgcaagcaatttcacacaattt420
gtactggtggataacggaggttatggcaggaagaagcggagacagcgacgaagaggtacc480
ggggatgtaacggtagctcctagtaattttgcaaatggcgtagcagagtggataagtagc540
aatagtagatctcaagcgtataaggttacgtgcagtgtaaggcaatcaagtgcacaaaac600
aggaagtatactattaaggtagaagttccgaaggtcgcgactcaaacagtcggaggcgtg660
gaattgccagtggctgcctggagaagctatttgaacatggagcttacgatacctatattt720
gcgaccaatagcgattgtgaactcatagtcaaagctatgcagggactgctgaaggacggt780
aatccaatcccaagcgcgatagctgcgaattcagggatttattaagggcccgct834
<210>3
<211>298
<212>dna
<213>haace1
<400>3
caatgcaatatagagtagcgtctcttggttttctattctttgatactcccgacgttccag60
gcaatgccggtctttttgatcagcttatggcattgcaatgggtaaaagataacatagctt120
acttcggaggaaatccccataacataactttattcggtgagtcggctggggcagcatcag180
tatctttacatctattgtcccctattgtcccctctgtcaaggaacttgttttctcaagcg240
ataatgcaatcaggagcggctaccgcaccttgggctattatatcaagagaggaaagta298
<210>4
<211>203
<212>dna
<213>ga20
<400>4
cctatataattttaagtggaaaaaaaaggttaactcatttacatatataatcgagaatat60
gtatatatatagtgcctctatatcaaattgtttatctggttttgagtgacacaaaattta120
aaataataaagaaatttttgaatcttgcagtcagctgaaacaaataaatatattgaaacg180
aatagagtagtacggtccgtacc203
- 还没有人留言评论。精彩留言会获得点赞!