用于提取细菌中质粒DNA的方法与流程
用于提取细菌中质粒dna的方法
技术领域
1.本发明属于生物制药技术领域,具体涉及一种用于提取细菌中质粒dna的方法。
背景技术:
2.近年来,由于基因治疗和dna疫苗临床上的成功,人们对工业化规模的质粒发酵生产需求已经非常迫切。基因治疗是将外源基因导入靶细胞,在患者细胞中表达基因来治疗或预防疾病,其最终目标是通过添加、纠正或替换基因来治愈遗传和后天疾病。实现这些目标的基因治疗载体主要有两种,即以灭活病毒为基础的病毒载体和以质粒dna为基础的非病毒载体。dna疫苗又称核酸疫苗或基因疫苗,是指将编码某种蛋白质抗原的重组真核表达载体直接注射到体内,使外源基因在活体内表达,产生的抗原激活机体的免疫系统,从而诱导特异性的体液免疫和细胞免疫应答。dna疫苗被称为继灭活疫苗、弱毒疫苗和亚单位疫苗之后的“第三代疫苗”,具有广阔的发展前景,而质粒为dna疫苗的常用载体。所以质粒的大规模生产技术对于基因治疗和dna疫苗的发展至关重要。
3.当前规模化质粒的生产技术主要包括以下几道工序:载体构建、细菌发酵、菌体裂解、固液分离及澄清、质粒纯化。虽然目前的质粒生产工艺可以生产出符合药学质量标准的质粒,满足临床要求,但在这些工艺中还存在一些难以克服的瓶颈。如产量规模化(千克级)较难,载体拷贝数、稳定性问题,裂解过程中导致dna变性、hcd残留去除,固液分离较难,内毒素残留等难题。
4.用于生物制药的质粒dna主要在大肠杆菌中生产,碱裂解法是一种应用最为广泛的制备质粒dna的方法,利用碱性条件将细胞裂解,同时染色体dna发生不可逆变性,而质粒dna在ph恢复中性时可复性的原理,将质粒与染色体dna分离。质粒制备的第一步也是最关键的一步是细胞裂解,如何将细胞彻底裂解,染色体dna完全共沉淀,去除大部分的rna成为细胞裂解的核心问题。目前工业规模的质粒提取工艺存在的主要问题有:1、碱裂解无自动化设备或设备能力满足不了充分混合的要求;2、使用大量有机溶剂及酸液,这在大规模工业化生产中增加安全风险及对厂房设备要求较高;3、使用中和液(溶液ⅲ)混合后,无自动化的混合设备或混合设备满足不了均匀低剪切的混合要求;4、中和混合液固液分离生产成本较高;5、宿主dna残留较高;6、rna去除率较低,影响下游纯化;7、重复用管路设备清洗困难,不利于cip清洗,而一次性耗材设备成本较高。
5.中国专利cn111808716a公开了一种质粒提取装置,包括裂解容器、沉淀容器、洗脱液容器、收集容器和层析柱,所述裂解容器与沉淀容器之间通过第一连接管连通,所述沉淀容器与层析柱之间通过第二连接管连通,所述洗脱液容器与层析柱之间通过第三连接管连通,所述第一连接管、第二连接管和第三连接管上均设置有阀门,所述收集容器设置在层析柱的下方,所述层析柱连接有振动机构。上述技术方案采取了振动式结构,加工过程不连续,需要进一步提升加工效率,并且该种方式存在宿主dna残留较高的问题,还需要进一步改进。
6.虽然我们为了解决目前大规模生产质粒dna的方法存在的缺陷,先前研发了一种
通过混合腔震荡的方式进行裂解、中和提取细菌中质粒dna的方法(参见:200610114061.6,一种连续大量提取质粒的方法),但是其不容易放大,提取的质粒dna的效率较低;为解决这一问题,我们又研发了通过气泡混合器提取质粒dna的装置(参见:202011120617.9,用于提取细菌中质粒dna的气泡发生装置),其使菌液与裂解液能均一且充分混合,气泡混合有效降低剪切力,有效提高收率与质量,但是其仍存在不太容易放大的问题,需要根据规模定制不同大小的气泡混合器,摸索通气量,流速等放大条件。
7.因此,我们又发明设计了一种新的质粒dna的提取方法,除了能有效控制混合过程剪切力,更容易实现放大工艺,相比通过气泡混合器(气泡发生装置)的方式,能有效提高裂解及中和过程的混合效率,增加收率;通过易控地调节混合参数,能有效控制剪切力,提高质粒质量。并且此工艺所用的装置原理简单,可精准调控,因此缩短放大条件摸索的时间,进一步提高工作效率,会大大促进连续地、大规模提取质粒dna相关研究的发展,具有重要意义。
技术实现要素:
8.本发明针对现有技术中存在的问题,提供一种用于提取细菌中质粒dna的方法,其所需设备简单,操作方便,且成本低廉,不需要专业的定制化、价格高昂的设备,就可以去除细胞裂解过程中的大量杂质,成分安全,可以实现自动化连续裂解,有利于工业化生产。
9.为实现上述发明目的,本技术的技术方案如下:
10.一方面本发明提供一种用于提取细菌中质粒dna的方法,在两个串联的混合组件中实现质粒生产过程中的裂解和中和,具体包括以下步骤:
11.(1)混合;
12.(2)裂解;
13.(3)中和;
14.其中,步骤(1)在第一混合组件中完成,步骤(2)在裂解螺旋管中完成,步骤(3)在第二混合组件中完成,第一混合组件、裂解螺旋管和第二混合组件依次串联。优选地,所述第一混合组件的转速为50rpm-1500rpm,优选为200rpm-500rpm;所述第二混合组件的转速为20rpm-1000rpm,优选为150rpm-500rpm。
15.优选地,在步骤(2)中,裂解2min-10min,优选5min。
16.优选地,所述第一混合组件和第二混合组件的结构各自独立地选自搅拌式、乳化式、离心式中的任一种,所述第一混合组件和第二混合组件均优选为混合泵或搅拌器;优选地,所述第一混合组件为搅拌式或乳化式,所述第二混合组件为离心式。
17.优选地,所述第一混合组件和第二混合组件分别为第一混合泵和第二混合泵,所述第一混合泵和第二混合泵的泵腔体积与单个混合泵额定每分钟进料体积的比值范围均为1:6-1:1,优选为1:6-1:3;或所述第一混合泵和第二混合泵的泵腔体积均为料液流经泵腔内10s-60s的体积,优选为料液流经泵腔内10s-20s的体积。所述第一混合泵和第二混合泵的叶轮均优选为半闭式叶轮。通过采用混合泵的形式,使得裂解和中和过程在密闭的环境中,降低污染环境的几率,使用后方便进行cip和sip。
18.优选地,所述裂解螺旋管内径为0.5cm-15cm,优选为0.5cm-6cm;所述第一混合泵和第二混合泵的泵头直径均为2cm-100cm,优选为4cm-30cm。
19.优选地,所述第一混合泵和第二混合泵的叶轮均包括后盖板;所述后盖板上均匀分布有多个导流柱,所述导流柱上至少沿叶轮旋转方向的外侧面呈弧面设置。
20.优选地,所述导流柱为圆柱、圆台或扇形柱的一种或多种组合。
21.更为优选地,所述导流柱的横截面宽度为0.5mm-40mm,优选为2mm-10mm。通过导流柱多个均匀分布,且直径在合适的范围内,能够减小剪切力,防止宿主dna污染产品,使得裂解中和可以自动化进行。
22.进一步优选地,所述导流柱优选为圆柱,或所述导流柱的截面积中间最大,且由中间至两端的截面积逐渐变小,具体实施时,所述导流柱的结构可为纺锤形。
23.优选地,所述质粒制备工艺具体包括以下步骤:
24.(1)用溶液i将菌体重悬后,得到重悬菌液,再将重悬菌液、溶液ii导入第一混合组件混合,得到菌体混合液;
25.(2)所述菌体混合液从第一混合组件中流出,进入裂解螺旋管裂解,得到裂解液;
26.(3)所述裂解液与溶液iii进入第二混合组件后,进行中和反应(或所述裂解液与溶液iii混合后,再通入第二混合组件),中和完成后得到中和反应液;
27.优选地,得到中和反应液后,还包括将其进行固液分离和纯化的步骤。
28.其中,
29.步骤(1)中,重悬菌液与菌体的体积质量比为3-20:1(l:kg),进一步优选为7:1(l:kg)。
30.步骤(1)中,溶液i与溶液ii的体积比为1:0.5-1:3,进一步优选为1:1。通过不同的管路粗细和长度,控制碱裂解时间为2min-10min,保证菌体裂解完全及裂解效果。
31.步骤(1)中,所述溶液i包括tris-hcl和edta-2na,进一步优选地,所述tris-hcl浓度为2mmol/l-100mmol/l,edta-2na浓度为0.1mmol/l-50mmol/l,溶液i的ph范围为6.0-9.0。
32.步骤(1)中,所述溶液ii包括naoh和sds,进一步优选地,所述naoh浓度为0.02-5mol/l,sds浓度为0.1-10%。
33.步骤(2)中,所述裂解的时间为2min-10min,进一步优选为5min。
34.步骤(3)中,所述溶液iii包括kac和nh4ac,进一步优选地,所述kac浓度为0.1mol/l-6mol/l,nh4ac浓度为0.2mol/l-10mol/l。
35.步骤(3)中,裂解液与溶液iii的体积比为1:0.3-5,进一步优选为1:1。通过上述条件来控制裂解、中和效果,保证宿主dna的沉淀和宿主rna去除效果。
36.优选地,通过过滤组件进行固液分离,所述固液分离方式包括但不限于过滤、深层过滤、离心等方式中的一种或多种组合。
37.进一步优选地,通过过滤组件进行固液分离,所述过滤组件结构为筛网式、深层过滤式、离心过滤式中的一种或多种组合;进一步优选地,所述过滤组件为筛网式或深层过滤式结构;过滤孔径为0.2μm-800μm,优选0.1μm-200μm;过滤材质包括纤维素、硅藻土、活性炭、聚丙烯纤维和硅胶。
38.更进一步优选地,所述过滤组件结构为离心式结构;离心力为1000g~20000g,离心时间为2min~60min,温度为2℃~40℃。
39.另外一方面,本发明还提供一种通过上述方法用于提取细菌中质粒dna的装置,包
括:第一混合组件和第二混合组件;
40.所述第一混合组件与所述第二混合组件通过所述裂解螺旋管相连接;所述裂解螺旋管与所述第二混合组件的连接管路上设有至少一个进液口;
41.重悬菌液流入所述第一混合组件混合后,通过所述裂解螺旋管裂解得到裂解液,再通入所述第二混合组件与溶液ⅲ中和得到中和反应液,所述裂解液通过所述进液口进入所述第二混合组件。
42.更优选地,所述裂解螺旋管内径为0.5cm~15cm,优选为0.5cm~6cm;所述第一混合泵和第二混合泵的泵头直径均可为2cm~100cm,优选为4cm~30cm。
43.更优选地,所述导流柱的长度与分布位置关联,各导流柱的长度由所述后盖板的中心处向外缘依次递减,且各导流柱的顶点均位于同一抛物面上。
44.更优选地,所述第一混合泵和第二混合泵的进液端均可与出液端同轴设置;所述进液端位于泵壳的中心处,所述出液端位于所述泵座的中心处。这样流体进入泵腔内需沿后盖板中心至边缘的顺序经过,绕至后方才可排出,使其充分接触导流柱,达到均匀混合的目的,提升中和反应质量。
45.更优选地,所述装置还包括过滤组件,所述第二混合组件的出液端连接至所述过滤组件的进液端,所述中和反应液通过所述过滤组件过滤。
46.更优选地,所述重悬菌液包括溶液ⅰ和含有质粒dna的菌体,所述重悬菌液通过第一输送泵混合输送至第一混合组件,与通过第二输送泵输送至第一混合组件的溶液ⅱ混合后通入裂解螺旋管裂解。
47.和现有技术相比,本发明的有益效果是:
48.(1)本发明在质粒生产过程中的碱裂解和中和环节创新性的采用的混合组件(可为泵)的形式,使得裂解和中和过程在密闭的环境中,降低污染环境的几率,使用后方便进行cip和sip,且实现了连续的加工,提升了生产效率,且成本低廉,不需要专业的定制化、价格高昂的设备,易于在生产中放大,生产成本低;裂解时混合充分且混合时间较短,中和时条件温和均一,裂解中和后,宿主dna和rna残留均低于起泡混合器的效果,产品质量好;同时优化了泵腔的大小,使得裂解中和的时间和剪切力适合产品生产,同时也方便生产规模的放大,相较于目前主流的气泡混合器airmix的生产体系来讲,比较容易放大,不需要根据规模定制不同大小的气泡混合器,缩短了放大条件摸索的时间,提高了工作效率。
49.(2)该质粒dna的提取方法所用到的设备简单,操作方便,使用的两台混合组件既可以使菌液和裂解液充分混合又可以保证和中和液温和地混合中和,避免使用复杂的低剪切中和设备,裂解后的质粒超螺旋比例较高,宿主dna、rna残留较少;此外,使用复杂的多级的膜过滤系统,裂解后也不需要过夜沉淀等步骤,设备可直接用cip清洗,符合药物生产的生产规范,同时节省了工艺时间,降低成本;不使用复杂的多级的膜过滤系统,裂解后也不需要过夜沉淀等步骤,裂解后的质粒超螺旋比例较高,宿主dna、rna残留较少,设备可直接用cip清洗,符合药物生产的生产规范,同时节省了工艺时间,降低成本,操作方便,不需要专业的定制化、价格高昂的设备,易于在生产中放大,生产成本低。
50.(3)质粒dna的提取过程中不添加高风险的动物来源成分,如rnase、溶菌酶、蛋白酶k等,生产工艺不使用有毒害的有机溶剂如异丙醇、酚、无水乙醇和其他诱变剂等,所用的试剂可以使用一般的试剂或满足药用级别,不使用酸液中和,对厂房设备要求较低,适合大
规模生产。
51.(4)通过优化混合泵腔的大小,结合调整泵腔和流速的比例,使得裂解中和的时间和剪切力适合产品生产,同时也方便生产规模的放大;对混合泵头的性状尺寸进行优化,使用3d打印技术,对泵头进行设计和定制在保证混合效果的前提下,降低了剪切力,防止宿主dna污染产品,使得裂解中和可以自动化进行。
附图说明
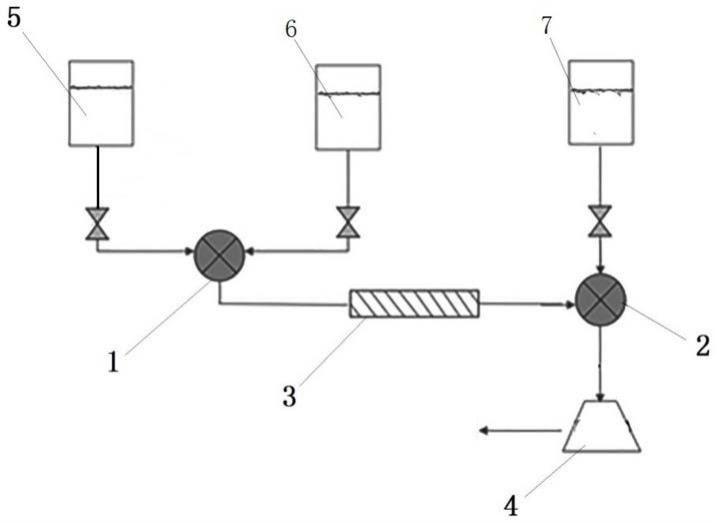
52.图1为本发明的用于提取细菌中质粒dna的装置的示意图;
53.图2为本发明实施例中装置第一混合组件叶轮立体图;
54.图3为本发明实施例中装置第二混合组件立体图,箭头表示料液流动方向;
55.图4为图3中的第二混合组件爆炸图;
56.图5为图3中第二混合组件去除泵壳后结构图;
57.图6为图3中第二混合组件叶轮立体图;
58.图7为实施例1电泳结果对比图,其中,泳道1为marker,泳道2为实施例1裂解中和反应液上清,泳道3为标准品;
59.图8为对比例1电泳结果对比图,其中,泳道1为实施例1的中和反应液上清,泳道2为对比例1的中和反应液上清,泳道3为标准品,泳道4为marker;
60.图9为对比例2所用叶轮的示意图;
61.图10为对比例3所用叶轮的示意图;
62.图11为对比例3电泳结果对比图,其中,泳道1为实施例1的中和反应液上清,泳道2为对比例3的中和反应液上清,泳道3为标准品,泳道4为marker;
63.图12为实施例2、3电泳结果对比图,其中,泳道1为实施例3的中和反应液上清,泳道2为实施例1的中和反应液上清,泳道3为实施例2的中和反应液上清,泳道4为标准品,泳道5为marker;
64.图13为实施例4中的导流柱的立体结构的示意图;
65.上述图1-6中:
66.1-第一混合组件;2-第二混合组件;201-主轴;202-泵座;203-密封圈;204-叶轮;205-泵壳;2021-环形槽;2041-后盖板;2042-导流柱;3-裂解螺旋管;4-过滤组件;5-重悬菌液;6-溶液ⅱ;7-溶液ⅲ。
具体实施方式
67.以下非限制性实施例可以使本领域的普通技术人员更全面的理解本发明,但不以任何方式限制本发明。下述内容仅仅是对本技术要求保护的范围的示例性说明,本领域技术人员可以根据所公开的内容对本技术的发明作出多种改变和修饰,而其也应当属于本技术要求保护的范围之中。下面描述中的附图仅是本发明的一个或几个实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
68.下面以具体实施例的方式对本发明作进一步的说明。本发明实施例中所使用的各种化学试剂如无特殊说明均通过常规商业途径获得。若无特殊说明,浓度百分数均为质量百分数。
69.除非特别指明,本文中的“裂解溶液”均指“溶液
ⅱ”
。
70.除非特别指明,本文中的“中和液”均指“溶液
ⅲ”
。
71.下述实施例中,所述下一步纯化可选择本领域常规纯化手段。
72.本发明所用装置:
73.如图1所示,主要包括:第一混合组件1、第二混合组件2和过滤组件4。两混合组件按功能区分,第一混合组件1可为裂解混合组件,第二混合组件2为中和混合组件。
74.优选地,第一混合组件1与第二混合组件2串联连接;两混合组件之间还串接有裂解螺旋管3。具体地,溶液ⅰ与含质粒dna的菌体配比后形成重悬菌液5,通过第一输送泵控制流量与流速,向第一混合组件1即裂解混合泵输送。具体实施时,输送管路上还串接有一个第一三通接头(即“y”形连接器,重悬菌液与溶液ⅱ6分别通过第一输送泵、第二输送泵送至第一三通接头处,再通入第一混合组件1混合,得到菌体混合液。
75.第一混合组件1的出液端连接裂解螺旋管3的进液端;裂解螺旋管3的出液端连接第二混合组件2的进液端。其中,裂解螺旋管3与第二混合组件2之间的管路上设有一个进液口,具体为串接管路中的第二三通接头,第二三通接头的一端还通过第三输送泵连接溶液ⅲ7的容器。
76.本实施例所用的第一混合组件1和第二混合组件2可为搅拌器或混合泵,具体地可分别为第一混合泵和第二混合泵,包括不限于搅拌泵、乳化泵和离心泵等,其中搅拌泵的搅拌桨可选用桨式搅拌器、推进式搅拌器、涡轮式搅拌器、锚式搅拌器、框式搅拌器、螺旋式搅拌器;乳化泵的转子和定子包括但不限于:粗齿、中齿、细齿。通过一定规则形状的泵头,实现了溶液的充分混合,且剪切力较低,保证染色体dna不发生大量断裂,且可以在密闭环境下进行,没有污染。进一步由于第一混合组件1用于裂解反应,优选第一混合组件1结构选为搅拌式或乳化式其中一种,具体可选取乳化泵,其叶片结构如图2中所示(还可为现有技术中的其他乳化泵的形式,此处仅以图2示之);第二混合组件2用于中和反应,可选取离心式结构,如图3、4所示,第二混合组件2主要包括主轴201、泵座202、密封圈203、叶轮204、泵壳205。流体输送路线如图3中箭头所示方向,流体通过泵壳205中心处的进液端进入泵内部,经过离心混合后可通过泵壳205侧向设置的出液端流出,出液端内部管路与泵内腔相切。其中主轴201一端连接外部电机的输出端,另一端通过密封装置穿过泵座202的中心处,并与叶轮204固定连接,泵座202与泵壳205接触区域加工有环形槽,用于安装密封圈203。叶轮204优选为半闭式叶轮;但是传统的叶轮存在较大缺点,即剪切力比较大,故本实施例中,叶轮204如图5、6所示设计,包括后盖板2041。后盖板2041上均匀分布有多个导流柱2042,共计32根,分三层环绕中心处,且导流柱2042垂直于后盖板2041的表面。进一步,为了更好的降低产生的剪切力,导流柱2042的形状可为圆柱、圆台或扇形台的一种或多种组合,优选为圆柱。导流柱2042的直径范围为0.5mm-40mm;经检验,优选直径为2mm-10mm时可获得较佳的效果。通过优化设计可以减小剪切力,防止宿主dna污染产品,使得裂解中和可以自动化进行。经过实验可知第二混合组件2通过设定一定转速范围,控制不同规模的混合效果及剪切力的大小,结合第一混合组件1可实现不同规模的菌液自动裂解、中和,从而实现连续化、大规模生产,具体实施时,第一混合组件1的结构还可与第二混合组件1的结构相同。具体地,第二混合组件2的叶轮转速为20rpm-1000rpm时产生较好的混合效果。还可针对第二混合组件2改变泵头性状、大小、转速以控制中和效果;第二混合泵的泵头直径为2cm-100cm,优选为
4cm~30cm,转速控制在20rpm-1000rpm,优选为150rpm~500rpm,泵腔体积与该混合泵额定每分钟进料体积的比值范围为1:6~1:1,优选为1:6~1:3;或泵腔体积设计为料液流经泵腔内10s-60s的体积,优选为料液流经泵腔内10s-20s的体积,保证中和完全且产生较低的剪切力,减少染色体dna的断裂,提高质粒dna的质量。
77.第二混合组件2的出液端连接过滤组件4的进液端。
78.优选地,过滤组件4结构为筛网式、深层过滤式、离心过滤式其中一种或多种组合。具体地,本实施例中过滤组件4结构为深层过滤式结构;过滤孔径为0.2μm-800μm;具体可选过滤孔径在0.1μm-200μm之间。通过深层过滤的方式对中和后上清液进行二次澄清,过滤的材质成分包括不限于纤维素、硅藻土、活性炭、聚丙烯纤维、硅胶及其组合产品。深层过滤膜包膜面积在0.01m
2-2m2之间。
79.上述实施例中的提取装置均可用于以下实施例,如有不同具体会示出,具体从细菌中提取质粒dna的方法如下:
80.实施例1 50l发酵规模处理
81.实施例1的用于提取细菌中质粒dna的装置,泵头直径为10cm,两个泵的泵头叶轮均如附图6所示,导流柱直径为5mm。
82.(1)将含有质粒a的大肠杆菌高密度发酵菌液,分光光度计测定od600为84.2,取该发酵液23.3l离心,收获菌体3684g,湿重为15.8%。将3684g的细胞重悬于由25mm tris-hcl和10mm edta-2na构成的ph为8.0重悬液(溶液i)中,得重悬菌液,体积为25.8l(菌体与溶液i的质量体积比为1:7(kg:l))。
83.(2)将重悬菌液以140ml/min的速度泵送至“y”形连接器的一侧,同时将由0.2m naoh和1%sds构成的裂解溶液(溶液ii)以140ml/min的速度泵送至“y”形连接器的另一侧。将“y”形连接器接入裂解混合泵(第一混合泵),调节转速为200rpm,开始裂解混合,得到菌体混合液。其中,溶液i与溶液ii的体积比为1:1,其中,裂解混合泵的泵腔体积为与单个混合泵额定每分钟进料体积的比值1:3。
84.(3)菌体混合液从第一混合组件(裂解混合泵)中泵出后,进入裂解螺旋管,裂解螺旋管内径为1.9cm,长度为5m,在裂解螺旋管中裂解时间为5min,得到裂解液。
85.(4)裂解后的裂解液进入另一“y”形连接器,连接器另一端由1m kac和7m nh4ac组成的溶液iii(预冷2-8℃)以280ml/min的速度进入,通过“y”形连接器进入中和混合泵(第二混合组件),混合泵设置转速250rpm。裂解液和溶液iii的体积比为1:1。其中,中和混合泵叶轮上的导流柱的直径为5mm,导流柱的形状为圆柱,中和混合泵的泵头直径为8.5cm;其中,中和混合泵的泵腔体积为与单个混合泵额定每分钟进料体积的比值1:4。
86.(5)中和完成后,收集中和反应液,以8000g离心力离心20min,收集到上清液,可进行下一步纯化。
87.结果检测:
88.重悬菌液测得质粒浓度为545mg/l(qiagen的质粒小提试剂盒测得),质粒总量为14.06g。
89.中和后得到中和反应液100l,离心得到上清液共82l,以hplc定量法测得上清液质粒浓度为121.8mg/l(hplc机型:waters 2695;色谱柱型号:tosoh,tskgel dna-npr 4.6mm*7.5cm 2.5um,下述实施例中的hplc测定条件相同),裂解收率71%。
90.电泳结果如图7所示,从图7可以看出通过本技术的方法裂解后的上清中质粒纯度较高,rna及宿主dna较少。
91.通过hplc试验以及药典方法检测上述方法制得的质粒dna,结果表明质粒为目的质粒,且纯度较高,超螺旋比例大于95%,开环比例较少。
92.实施例2
93.与实施例1不同的是,第一混合泵的转速为400rpm,第二混合泵的转速为500rpm。导流柱为圆柱,其直径为1mm。其余皆相同。
94.然后中和后的中和反应液进行琼脂糖核酸电泳,电泳图如图12所示。可以看出实施例2裂解上清中宿主dna和rna均高于实施例1裂解上清,转速偏高时,杂质会较多。
95.实施例3
96.与实施例1不同的是,菌体重悬液为2.5l,第一混合泵的转速为100rpm,第二混合泵的转速为50rpm,导流柱为圆柱,其直径为1mm。其余皆相同。
97.通过hplc检测中和后得到中和反应液10l,离心得到上清液共7.8l,测得上清液质粒浓度为96mg/l(hplc测定),裂解收率55.0%。
98.电泳图如图12所示,由图12可以看出混合泵转速较低时会导致混合和中和不充分,质粒dna收率较实施例1低。
99.实施例4
100.与实施例1不同的是,本实施例中导流柱2042为变截面设计,目的是为了进一步降低剪切了对中和过程的影响,通过流体运动分析,如图13中箭头所示,单根导流柱转动中,流体相对主体的流速分布情况;即从中间层向两边减小,原因分析为流体上下两侧分别受到泵壳即泵座的粘滞阻力,速度呈梯度分布,由此为了保持单根导流柱对流体中遗传物质产生的剪切力较为一致,故将其设计为变截面结构。具体地,以实施例1中圆柱体为例,单根导流柱的截面从泵壳一侧至泵座一侧依次为先增加后减小,形成“纺锤形”结构,具体参阅图13。上述设计,虽然导流柱中心处相对速度较大,冲击较强,但是结合较大曲率半径及受力面积,可以有效减少对质粒的剪切作用,一定程度上提升了质粒产率。
101.对比例1气泡混合器处理
102.与实施例1不同的是,对比例1的中和步骤不使用泵,在气泡混合器中进行,具体步骤如下:
103.(1)将含有质粒a的大肠杆菌高密度发酵菌液,分光光度计测定od600为78.9。取该发酵液23.5l离心,收获菌体3603g,湿重为15.3%。将3603g的细胞重悬于由25mm tris-hcl和10mm edta-2na构成的ph为8.0重悬液(溶液i)中,得重悬菌液,体积为25.2l(菌体与溶液i的质量体积比为1:7)。
104.(2)将重悬菌液与以140ml/min的速度泵送至“y”形连接器的一侧,同时将由0.2m naoh和1%sds构成的裂解溶液(溶液ii)以140ml/min的速度泵送至“y”形连接器的另一侧。将“y”形连接器接入裂解混合泵(第一混合泵),调节转速为200rpm,开始裂解混合,得到菌体混合液。其中,溶液i与溶液ii的体积比为1:1。
105.(3)菌体混合液从裂解混合泵中泵出后,进入裂解螺旋管,裂解螺旋管内径为1.9cm,长度为5m,在裂解螺旋管中裂解时间为5min,得到裂解液。
106.(4)裂解后的裂解液进入另一“y”形连接器,连接器另一端由1m kac和7m nh4ac组
成的溶液iii(预冷2-8℃)以280ml/min的速度进入,通过“y”形连接器进入气泡混合器,气泡混合器设置压缩空气流速为1.2l/min。裂解液和溶液iii的体积比为1:1。
107.(5)中和完成后,收集中和反应液,以8000g离心力离心20min,收集到对比上清液,可进行下一步纯化。
108.通过酶标仪检测,结果表明,重悬菌液测得质粒浓度为570mg/l(通过qiagen的质粒小提试剂盒计算得出),质粒总量为14.36g。
109.中和后得到中和反应液101l,离心得到上清液共79.3l,测得对比上清液质粒浓度为116.3mg/l(hplc测定),裂解收率64.2%。
110.电泳结果如图8所示,从图8可以看出本对比例中和过程使用气泡发生器的方法得到质粒dna与实施例1的方法得到的质粒dna相比,质粒浓度相当,但是其宿主rna较多,说明本技术的制备方法更优,并且更容易放大,操作简单。
111.对比例2
112.与实施例1不同的是,该实施例中第二混合泵所用离心泵头叶轮如图9所示,其余皆相同。
113.通过酶标仪检测:
114.中和后得到中和反应液80l,离心得到上清液共66l,测得上清液质粒浓度为106.6mg/l(hplc测定),裂解收率64.5%。裂解收率低于实施例1。
115.对比例3
116.与实施例1不同的是,该实施例中第二混合泵所用离心泵头叶轮如图10所示,其余设置均相同。
117.电泳图如图11所示,从图11可以看出,与实施例1结果相比,使用图10所示泵头,裂解上清中宿主dna和rna含量均较多,不利于质粒纯化。
118.基于上述实施例结果可知,本发明的提取装置和提取方法,最终产品裂解时混合充分且混合时间较短,中和时条件温和均一,裂解中和后,宿主dna和rna残留均低于起泡混合器的效果,产品质量较好,且速度适中时提取的质粒dna杂质少,收率高。
119.本发明在质粒生产过程中的碱裂解和中和环节创新性的采用的混合组件(可为泵)的形式,使得裂解和中和过程在密闭的环境中,降低污染环境的几率,使用后方便进行cip和sip,且实现了连续的加工,提升了生产效率,且成本低廉,不需要专业的定制化、价格高昂的设备,易于在生产中放大,生产成本低;裂解时混合充分且混合时间较短,中和时条件温和均一,裂解中和后,宿主dna和rna残留均低于起泡混合器的效果,产品质量好;同时优化了泵腔的大小,使得裂解中和的时间和剪切力适合产品生产,同时也方便生产规模的放大,相较于目前主流的气泡混合器airmix的生产体系来讲,比较容易放大,不需要根据规模定制不同大小的气泡混合器,缩短了放大条件摸索的时间,提高工作效率。
120.(2)该方法所用到的设备简单,操作方便,使用的两台混合组件既可以使菌液和裂解液的充分混合又可以保证和中和液温和地混合中和,避免使用复杂的低剪切中和设备,裂解后的质粒超螺旋比例较高,宿主dna、rna残留较少[;此外,使用复杂的多级的膜过滤系统,裂解后也不需要过夜沉淀等步骤,设备可直接用cip清洗,符合药物生产的生产规范,同时节省了工艺时间,降低成本;不使用复杂的多级的膜过滤系统,裂解后也不需要过夜沉淀等步骤,裂解后的质粒超螺旋比例较高,宿主dna、rna残留较少,设备可直接用cip清洗,符
合药物生产的生产规范,同时节省了工艺时间,降低成本,操作方便,不需要专业的定制化、价格高昂的设备,易于在生产中放大,生产成本低。
[0121]
(3)过程中不添加高风险的动物来源成分,如rnase、溶菌酶、蛋白酶k等,生产工艺不使用有毒害的有机溶剂如异丙醇、酚、无水乙醇和其他诱变剂等,所用的试剂可以使用一般的试剂或满足药用级别,不使用酸液中和,对厂房设备要求较低,适合大规模生产。
[0122]
(4)通过优化泵腔的大小,结合调整泵腔和流速的比例,使得裂解中和的时间和剪切力适合产品生产,同时也方便生产规模的放大;对混合泵头的性状尺寸进行优化,使用3d打印技术,对泵头进行设计和定制在保证混合效果的前提下,降低了剪切力,防止宿主dna污染产品,使得裂解中和可以自动化进行。
[0123]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1