一种基于基因改造脊椎动物的携带通用定点偶联接口的抗体的制备方法与流程
1.本发明涉及生物技术领域,具体涉及一种基于基因改造脊椎动物的携带通用定点偶联接口的抗体的制备方法。
背景技术:
2.脊椎动物,如鼠,兔,羊,鸡,骆驼等是开发单克隆抗体和多克隆抗体的重要动物平台。
3.以往研究表明,在抗体定点位置引入特定氨基酸序列,可以实现通过连接酶,如sortase,butelase,oaaep1,介导的特异性连接反应,可以定点的引入若干基团。
4.目前为止,现有技术中未见在动物水平直接对抗体编码基因进行基因编辑,定点敲入接口编码基因,进而获得可以直接生产自带接口的抗体的动物的相关报道。
技术实现要素:
5.本发明的目的是提供一种基于基因改造脊椎动物的携带通用定点偶联接口的抗体的制备方法。
6.第一方面,本发明要求保护一种脊椎动物模型的构建方法,所述脊椎动物模型用于生产携带通用定点偶联接口的抗体。
7.本发明所要求保护的脊椎动物模型的构建方法,可包括如下步骤:在受体动物的基因组中免疫球蛋白的某一编码基因a的某一位置a处定点敲入某种连接酶a的特异性识别序列的编码基因或者某种内含肽(intein)a的编码基因,得到所述脊椎动物模型。
8.在所述方法中,所述编码基因a为igkc基因(即抗体kappa轻链的恒定区结构域编码基因),所述位置a为igkc基因的3’端。即在抗体水平,所述连接酶a的特异性识别序列将被定点插入到抗体kappa型轻链的c端。
9.在所述方法中,所述脊椎动物可选自如下任一:小鼠、大鼠、兔、羊、鸡、骆驼、马、驴、仓鼠、豚鼠、羊驼。
10.在本发明的具体实施方式中,所述脊椎动物为小鼠;所述编码基因a为小鼠基因组中6号染色体上的igkc基因;所述位置a位于小鼠基因组中6号染色体上的igkc基因(gene id:16071)的第70726754和第70726755位(小鼠基因组grcm38/mm10版本)之间。
11.在所述方法中,所述连接酶a可选自如下任一:sortase
staph
酶、sortase
strep
酶、butelase酶、oaaep1酶、formylglycine生成酶(fge)、谷胺酰转氨酶、微管蛋白酪氨酸连接酶(tubulin tyrosine ligase;ttl)、trypsiligase、sfp phosphopantetheinyl转移酶、spyligase。
12.当所述连接酶a为sortase
staph a(以下统称sortase a)酶时,所述特异性识别序列可为lpxtg(x为任意氨基酸);当所述连接酶a为sortase
strep
酶时,所述特异性识别序列可为lpxta(x为任意氨基酸);当所述连接酶a为butelase酶时,所述特异性识别序列可为nhv;当
所述连接酶a为oaaep1酶时,所述特异性识别序列可为ngl;当所述连接酶a为formylglycine生成酶时,所述特异性识别序列可为cxpxr(x为任意氨基酸);当所述连接酶a为谷胺酰转氨酶时,所述特异性识别序列可为llqga;当所述连接酶a为微管蛋白酪氨酸连接酶时,所述特异性识别序列可为vdsvegeeegee;当所述连接酶a为trypsiligase时,所述特异性识别序列可为yrh;当所述连接酶a为sfp phosphopantetheinyl转移酶时,所述特异性识别序列可为dslefiaskla;当所述连接酶a为sfp phosphopantetheinyl转移酶时,所述特异性识别序列可为dslefiaskla;当所述连接酶a为spyligase时,所述特异性识别序列可为ahivmvdaykptk或athikfskrd。
13.在所述方法中,所述定点敲入可通过crispr/cas9技术实现。
14.进一步地,作为被cas9核酸酶切割的靶序列位于所述受体动物的基因组中免疫球蛋白的所述编码基因a的所述位置a上下游500bp范围内,以便通过同源重组机制插入特异性识别序列的dna。
15.在本发明的具体实施方式中,所述靶序列具体为seq id no.1(即ggaatgagtgttagaga*caaagg,其中*是cas9切割位置)(此时,所述脊椎动物为小鼠,所述免疫球蛋白的所述编码基因a的所述位置a位于小鼠基因组中6号染色体上的igkc基因(gene id:16071)的第70726754位和第和第70726755位(小鼠基因组grcm38/mm10版本)。
16.进一步地,作为定点敲入工具的同源重组载体上含有dna片段a;所述dna片段a自上游到下游依次由5’同源臂、所述连接酶a的特异性识别序列的编码基因或所述内含肽a的编码基因,以及3’同源臂组成;所述5’同源臂为位于所述受体动物基因组中免疫球蛋白的所述编码基因a的所述位置a上游的120bp序列;所述3’同源臂为位于所述受体动物基因组中免疫球蛋白的所述编码基因a的所述位置a下游的150bp序列。
17.在本发明的具体实施方式中,所述5’同源臂为seq id no.2的第1-120位;所述3’同源臂为seq id no.2的第157-306位。
18.进一步地,所述连接酶a的特异性识别序列的编码基因为seq id no.2的第133-147位(所述连接酶a为sortase a酶,seq id no.2的第133-147位为sortase a酶的特异性识别序列的编码基因)。
19.更进一步地,所述dna片段a的核苷酸序列如seq id no.2所示。
20.本发明所要求保护的脊椎动物模型的构建方法,具体可包括如下步骤:
21.(1)将cas9 mrna、grna和前文所述的同源重组载体注射到所述受体动物的受精卵胞质中,得到f0代动物;
22.所述grna的序列为seq id no.4。
23.(2)将步骤(1)获得的所述f0代动物与所述受体动物进行杂交,从f1代动物中获得在基因组中所述免疫球蛋白的所述编码基因a的所述位置a处定点敲入所述连接酶a的特异性识别序列的编码基因或所述内含肽a的编码基因的杂合体动物。
24.进一步地,在步骤(2)之后,还可包括如下步骤(3):
25.(3)将雄性的所述杂合体动物与雌性的所述杂合体动物进行一次或多次杂交,从杂交后代中获得在基因组中所述免疫球蛋白的所述编码基因a的所述位置a处定点敲入所述连接酶a的特异性识别序列的编码基因或所述内含肽a的编码基因的纯合体动物。
26.步骤(2)中的所述杂合动物和步骤(3)中的所述纯合动物均可作为能够用于生产
携带通用定点偶联接口的抗体的所述脊椎动物模型。
27.其中,所述cas9 mrna的序列可为seq id no.3。
28.所述同源重组载体具体为所述dna片段a(seq id no.2)。
29.第二方面,本发明要求保护利用前文所述方法构建得到的脊椎动物模型在生产携带通用定点偶联接口的抗体中的应用。
30.第三方面,本发明要求保护一种生产携带通用定点偶联接口的抗体的方法。
31.本发明所要求保护的生产携带通用定点偶联接口的抗体的方法,可包括如下步骤:
32.p1、按照前文第一方面中所述方法制备得到脊椎动物模型;
33.p2、用免疫原对所述脊椎动物模型进行免疫,从而制备得到携带通用定点偶联接口且抗所述免疫原的抗体。
34.其中,所述抗体为单克隆抗体或多克隆抗体。
35.在本发明的具体实施方式中,所述免疫原为s1抗原(东抗生物,visc2-s101),所述脊椎动物为小鼠(如c57bl/6j小鼠)。
36.在本发明中,所述通用定点偶联接口具体是指与抗体特定位置相连的所述连接酶a的特异性识别序列或所述内含肽a的编码基因。
37.当所述接口为与抗体特定位置相连的所述连接酶a的特异性识别序列时,利用该接口和用于与效应基团(如hrp、多聚hrp、dna)相连的linker可以实现所述抗体与所述效应基团相偶联,所述linker能够在所述连接酶a的作用下催化所述特异性识别序列与所述linker连接(如共价连接)。
38.在本发明中,所述连接酶a为sortase a酶,所述特异性识别序列可为lpxtg(x为任意氨基酸),相应的所述linker为n末端(游离端)为以寡甘氨酸(如1-5个连续的g,再如3-5个连续的g)的多肽分子或者为n末端(游离端)为烷基胺(alkylamine)的多肽分子。
39.在本发明的具体实施方式中,所述连接酶a为sortase a酶,所述特异性识别序列为lpetg,相应的所述linker为n末端(游离端)为ggg的多肽分子。
40.当所述接口为与抗体特定位置相连的所述内含肽a的编码基因时,利用还原剂对所述抗体进行还原,其上会产生活性基团,所述活性基团可用与n端起始分子为半胱氨酸的效应分子或多肽反应。
41.本发明以小鼠为例,直接在脊椎动物抗体基因座位定点引入编码特定氨基酸序列的dna序列,使动物生成的抗体携带特定可被酶介导的定点连接位点。
42.小鼠的抗体由重链和轻链组成,超过95%的抗体轻链是kappa链,本发明把特定氨基酸序列通过crispr介导的基因敲入方式加到了kappa链的c端,使得被基因改造的小鼠生成的超过95%的抗体都携带特定可被酶介导的定点连接位点。
43.本发明示例引入的定点连接位点为sortase a识别位点,实验表明,被改造的小鼠可以正常激发免疫反应,生成带定点连接位点的多克隆抗体与单克隆抗体。实验表明,生成的带定点连接位点的抗体可以正常进行定点连接,加上各种应用基团,实现抗体下游应用,比如elisa、免疫荧光染色、免疫pcr。
附图说明
44.图1为本发明usb小鼠基因编辑示意图。小鼠lgkc基因座示意图(基因从左到右显示,全长532bp),灰色区域代表开放阅读框(orf),白色区域代表基因非翻译区域(utr)。编辑成功后,基因组中的野生型等位基因将被突变型等位基因替代。
45.图2为阳性野生型和f0代小鼠小鼠的测序结果。上部:野生型小鼠基因序列;下部:突变型小鼠基因序列。箭头所示为插入基因插入位点,f0代小鼠基因测序显示在插入位置后为混合序列,表明插入成功。
46.图3为f0代小鼠和f1突变型小鼠基因型检测结果。a为pcr检测f0代小鼠基因型,共筛选得到6只阳性小鼠(标数字者)。b为pcr检测f1突变型小鼠基因型,共筛选得到3只阳性小鼠(标数字者)。
47.图4为pcr和测序检测突变型纯合子小鼠基因型。
48.图5为s1抗原免疫效果检测。
49.图6为usb杂合子小鼠(a)和usb纯合子小鼠(b)血清提取抗体与多肽交联反应。
50.图7为培养杂交瘤细胞制备抗体与多肽交联反应。
51.图8为sortase a蛋白以5-15%sds-page梯度胶检测结果。
52.图9为elisa检测usb-抗体直标hrp功能。
53.图10为usb-抗体与dna连接结果。a为还原缓冲液处理样品;b为非还原缓冲液处理样品。
具体实施方式
54.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
55.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
56.实施例1、usb小鼠基因编辑
57.通过crispr-cas9技术,在小鼠受精卵里的6号染色体的igkc基因(gene id:16071)第70726754位-第70726755位之间(小鼠基因组grcm38/mm10版本)之间通过同源重组插入了“ggaggtggatcacttccagaaactggtggaggaagt”这段序列,暨“usb”序列,如图1所示。此基因编辑使得将出生的小鼠的igkc轻链羧基端加上了“gggslpetgggs”的氨基酸,其中,“lpetg”是转肽酶(sortase a)的特异性识别位点,可以在蛋白质水平上实现定点连接。经过胚胎植入,对出生的小鼠进行是否有“usb序列”的pcr和基因测序,如期待一样,若干出生小鼠有相应的正确序列。通过后续的交配,生成纯系usb小鼠。具体如下:
58.一、grna的设计
59.igkc基因的grna靶向基因组的序列如下:
[0060]5’‑
ggaatgagtgttagaga*caaagg-3’(seq id no.1)。
[0061]
带下划线的碱基为pam,*为切割位点。
[0062]
二、同源重组载体(donor vector)
[0063]
同源重组载体(donor vector):dna化学合成seq id no.2所示dna片段。
[0064]
seq id no.2的第1-120位为5’同源臂;第133-147位为sortase a酶的特异性识别序列的编码基因,第157-306位为3’同源臂。
[0065]
三、cas9 mrna和grna的体外转录
[0066]
经体外转录所得的cas9 mrna的核苷酸序列为seq id no.3。
[0067]
经体外转录所得的grna的核苷酸序列为seq id no.4,其靶向序列为seq id no.1。
[0068]
四、注射受精卵获得f0代嵌合体小鼠
[0069]
用水将步骤二构建的同源重组载体和步骤三体外转录获得的cas9 mrna和grna配制成40μl体系,使其中同源重组载体、cas9 mrna和grna的终浓度分别为100ng/μl,100ng/μl,50ng/μl。将配制好的样品注射到c57bl/6j小鼠的受精卵胞质中,于37℃培养24小时至二细胞期后移植到代孕雌鼠(小鼠品种icr)中,至f0代小鼠出生。
[0070]
五、f0代小鼠基因型的鉴定
[0071]
1、提取小鼠总dna
[0072]
(1)使用takara minibest universal genomic dna extraction kit(ver.5.0_code no.9765)提取总基因组dna。
[0073]
(2)剪取2-5mm小鼠尾巴组织,每个样品加180μl gl缓冲液,20μl蛋白酶k和10μl rnase a。56℃孵育过夜。
[0074]
(3)12,000rpm,2min离心取上清。
[0075]
(4)加200μl gl缓冲液,200μl无水乙醇,充分混匀。
[0076]
(5)上述混合物加如试剂盒中的离心柱,12000rpm离心2min,弃离心穿出液。
[0077]
(6)加500μl wa缓冲液,12000rpm离心1min,弃离心穿出液。
[0078]
(7)加700μl wb缓冲液,12000rpm离心1min,弃离心穿出液。
[0079]
(8)重复步骤(7)。
[0080]
(9)将离心柱转移到收集管中,12,000rpm离心2min。
[0081]
(10)将离心柱转移到1.5ml ep管中,加50~200μl灭菌水溶解dna,室温放置5min。
[0082]
(11)12,000rpm离心2min,得到小鼠基因组dna。
[0083]
2、pcr检测
[0084]
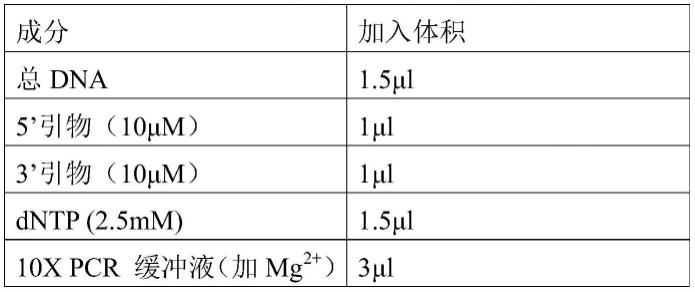
pcr反应混合物按如下表1所示比例配制:
[0085]
表1、pcr反应混合物配制比例
[0086]
[0087][0088]
注:引物序列:5’引物:5
’‑
gctgatgctgcaccaactgtatcc-3’;
[0089]3’
引物:5
’‑
ggactgccatgtagtggacagcc-3’。
[0090]
pcr产物:
[0091]
野生型:695bp
[0092]
突变型:731bp
[0093]
pcr反应条件设置:
[0094][0095]
变性-退火-延伸共35个循环。
[0096]
并对pcr产物进行测序鉴定。
[0097]
结果显示:经受精卵显微注射,本发明共获得23只f0代小鼠。通过pcr+测序对f0代小鼠的基因型进行鉴定,pcr结果经测序确认,共获得6只正确同源重组的阳性f0代小鼠(图3中a和图2)。图2为野生型和阳性f0代小鼠的测序结果(测序引物:ggtgcctcagtcgtgtgcttcttg)。
[0098]
六、f1代小鼠获得及基因型鉴定
[0099]
f0代阳性小鼠与野生型c57bl/6j小鼠交配,繁育获得f1代阳性小鼠。
[0100]
鉴定步骤与f0相同(pcr+测序)。
[0101]
结果显示:f1代中有三只小鼠为突变型(图3中b)。
[0102]
七、f1代阳性小鼠杂交获得纯合阳性小鼠
[0103]
雌性的f1代阳性小鼠(杂合)与雄性的f1代阳性小鼠(杂合)交配,从繁育后代中获得纯合阳性小鼠。
[0104]
鉴定步骤与f0相同(pcr+测序)。
[0105]
结果显示:所有受检测小鼠均为突变型纯合子(图4)。
[0106]
实施例2、usb小鼠免疫反应
[0107]
纯合usb小鼠可以产生正常的免疫应是用usb小鼠产生usb抗体的前提。对usb小鼠进行了抗原免疫(s1抗原,东抗生物,visc2-s101)。具体如下:
[0108]
1、免疫动物:4-6周纯合usb小鼠(即实施例1步骤七所得的纯合阳性小鼠)取血作为免疫前对照,免疫周期第一天,30微克抗原加等体积的弗氏完全佐剂混匀皮下注射小鼠(弗氏完全佐剂,sigma f5881)。第14天二次免疫(30μg抗原加等体积的弗氏不完全皮下注射;弗氏不完全佐剂,thermo,77140),第21天采血,elisa检测血清效价,第35天三次免疫(30μg抗原加等体积的弗氏不完全皮下注射),第42天采血(第三次免疫),elisa检测血清效价。
[0109]
2、elisa步骤:
[0110]
(1)s1抗原用包被液(包被液:溶解1.59g na2co3和2.94g nahco3于990ml纯净水,加10ml 10%(质量分数)nan3,ph 9.6。4℃保存),稀释后100μl/孔加到96孔板中,4℃过夜。
[0111]
(2)pbs-t洗4次后封闭1h。
[0112]
(3)usb小鼠血清用于封闭液(pbs-t含2%bsa和0.1%(质量分数)nan3。4℃保存)稀释1000、2000、4000、8000、16000、32000、64000、128000倍,加100μl/孔。室温孵育1h。
[0113]
(4)pbs-t洗4次。
[0114]
(5)用pbst稀释hrp标记大鼠抗小鼠二抗(爱博生,030604a06h)1:1000,每孔加100μl显色液。室温孵育1h。
[0115]
(6)pbs-t洗4次。
[0116]
(7)配制显色液:4mg abts(azino-di-3-ethyl-benzthiazodinsulphonate)溶解于10ml 50mm柠檬酸中,ph 4.0,加10μl 30%h2o2。每孔加100μl显色液。
[0117]
(8)显色后405nm波长读取数值。
[0118]
取免疫前,二次免疫,和三次免疫后的血清,elisa检测血清效价。结果如表1和图5所示,可见:usb小鼠抗体效价逐步增高,意味着其有正常的免疫反应。
[0119]
表1、随着免疫进行usb小鼠抗体效价逐步增高
[0120][0121]
实施例3、usb端口功能验证
[0122]
一、具有usb遗传背景的小鼠血清提取的多克隆抗体与多肽连接反应
[0123]
为验证usb小鼠体内产生的b细胞分泌的抗体是否可在酶催化作用下,将多肽定点连接到含usb序列的轻链区。本实施例使用基因背景分别为usb杂合子(即实施例1所得的f1代杂合阳性小鼠)和usb纯合子(即实施例1所得的f1代纯合阳性小鼠)的小鼠血清提取的抗体与含sortase a识别序列的多肽反应,用western blot检测连接产物。
[0124]
1、实验材料
[0125]
经实施例1鉴定得到的usb杂合子小鼠和usb纯合子小鼠的血清;蛋白a珠(sigma,5015979001)、sortase a酶(具体制备方法参见实施例4)、多肽(gggsypydvpdyagkpipnpllglds teqkliseedlk,北京中科亚光生物科技有限公司合成)、pbs、hrp标记大鼠抗小鼠二抗(爱博生,030604a06h)、ecl发光液(上海天能,180-5001)。
[0126]
2、实验步骤
[0127]
(1)分别取usb杂合子小鼠和usb纯合子小鼠血清各20μl,用30μl蛋白a珠提取总抗体检测提纯抗体浓度。
[0128]
(2)按50倍摩尔浓度将多肽(gggsypydvpdyagkpipnpllgldsteqkliseedlk)与抗体混合,并加sortase a酶至终浓度2μm。阴性对照为多肽(gggsypydvpdyagkpipnpllgldsteqkliseedlk)与抗体混合物,不加sortase a酶,37℃过夜。
[0129]
(3)取15μl反应混合物,12%胶上还原样,转膜3h,5%脱脂奶粉封闭过夜。
[0130]
(4)1:3000(体积比)牛奶+pbst稀释hrp标记大鼠抗小鼠igg二抗(爱博生,030604a06h),室温1h,显色。
[0131]
3、实验结果
[0132]
usb杂合子小鼠体内天然产生的抗体与多肽交联后,分子量变大,在连接组中,在原型kappa链的上方出现的条带即为连接产物,此条带不出现在对照组(图6中a)。由于杂合子小鼠并非所有的细胞都携带usb基因,因而分泌的抗体为正常抗体和携带usb接口抗体的混合物,与多肽连接后,仍有相当一部分抗体未能连接多肽。
[0133]
与之相比,usb纯合子小鼠体内产生的抗体几乎全部携带usb标签,与多肽交联后,绝大部分抗体都能与多肽交联(图6中b)。
[0134]
该实验证明具有usb遗传背景的小鼠体内的抗体可以在sortase a酶催化下完成交联反应。
[0135]
二、具有usb遗传背景的骨髓杂交瘤细胞产生的单克隆抗体与多肽连接反应
[0136]
骨髓杂交瘤是规模化制备抗体原料的重要来源。本实施例用从纯合usb小鼠(即实施例1所得的f1代纯合阳性小鼠)提取的b细胞制备骨髓杂交瘤细胞,从细胞培养上清液中提取单克隆抗体,验证该单克隆抗体可在sortase a酶作用下将多肽交联到抗体轻链。
[0137]
1、实验材料
[0138]
骨髓杂交瘤细胞(从实施例1所得的usb小鼠提取的b细胞制备骨髓杂交瘤细胞);转肽酶sortase a;蛋白a吸附珠(sigma,5015979001);多肽(gggsypydvpdyagkpipnpllglds teqkliseedlk,北京中科亚光生物科技有限公司合成);hrp标记大鼠抗小鼠二抗(爱博生,030604a06h);
[0139]
2、实验步骤
[0140]
(1)杂交瘤细胞制备:待血清抗体滴度达到1:8000后即可以进行细胞融合。融合前3天静脉注射s1抗原(东抗生物,visc2-s101)。融合当天取小鼠脾细胞与sp2/0细胞融合,融合生成的杂交瘤细胞在hat选择性培养基中(sigma,h0262)生长。
[0141]
(2)筛选抗体滴度较高的细胞株:elisa检测。方法同上。杂交瘤细胞上清液倍比稀释的前几个浓度,elisa读数高于1.8,抗体滴度越高越好。
[0142]
检测时包被s1抗原(东抗生物,visc2-s101),取杂交瘤细胞培养上清液作为一抗,hrp标记的大鼠抗小鼠igg(爱博生,030604a06h)作为二抗,筛选出稳定表达特异性抗体的细胞株,扩大培养并冻存。
[0143]
(3)取3ml上清液,用100μl蛋白a吸附珠提抗体,并检测提纯抗体浓度。
[0144]
(4)抗体与多肽交联反应实验组、对照组设置和操作与步骤一2相同。
[0145]
3、实验结果
[0146]
选取的三个单克隆抗体与多肽连接后,轻链均发生上移(图7)。该实验证明,通过体外培养杂交瘤细胞制备的携带usb标签的单抗可在sortase a酶作用下将特定的分子交联到该抗体上。
[0147]
实施例4、usb抗体实际应用
[0148]
一、usb小鼠产生的单克隆抗体在elisa中的应用
[0149]
(一)、实验材料
[0150]
1、s1抗原,东抗生物,visc2-s101;
[0151]
2、sortase a蛋白的制备
[0152]
序列:
[0153]
atgcaggcaaaaccgcagattccgaaagataaaagcaaagtggccggttatattgaaattccggatgcagatattaaggaaccggtgtatccgggcccggcaacccgcgaacagctgaatcgtggcgtgagttttgccaaagaaaatcagagtctggatgatcagaatattagcattgcaggtcatacctttattgatcgtccgaattatcagtttaccaatctgaaagcagccaaaaaaggtagcatggtttattttaaagtgggcaatgaaacccgtaaatataaaatgaccagtattcgtaacgtgaaaccgaccgcagttgaagtgctggatgaacagaaaggcaaagataaacagctgaccctgattacctgtgatgattataatgaagaaaccggtgtgtgggaaacccgtaagatttttgtggccaccgaagtgaaactcgagcaccaccaccaccaccactga(seq id no.5)
[0154]
(1)sortase a基因的5’和3’端分别构建ndel和xhoi识别序列,插入到pet30a(+)载体的相应酶切位点中,经测序验证正确后得到重组质粒pet30a-sortase a。将重组质粒pet30a-sortase a转化到bl21(de3)感受态中,在kan
+
抗性的固体lb培养基培养16小时。
[0155]
(2)挑取一单克隆菌落于lb培养基(kan
+
抗性)培养至细菌od
600
0.6左右,加入iptg 30℃诱导表达4小时。
[0156]
(3)表达后的细菌超声裂解,将诱导前,诱导后裂解上清和沉淀进行sds-page检测,结果显示,sortase a蛋白以可溶形式表达。
[0157]
(4)扩大培养细菌,iptg 30℃诱导表达4小时。
[0158]
(5)超声细菌,将裂解上清过ni柱纯化,最终sds-page检测sortase a蛋白纯度大于90%。,sortase a蛋白以5-15%sds-page梯度胶检测(图8)。
[0159]
3、usb小鼠:实施例1所得的f1代纯合阳性小鼠和实施例1所得的f1代杂合阳性小鼠。
[0160]
4、多肽-biotin,序列:gggsenlyfqak-biotin,中科亚光合成。
[0161]
5、pd-10纯化柱,ge healthcare,17085101。
[0162]
6、streptavidin-hrp,sigma,s5512。
[0163]
7、hrp标记的大鼠抗小鼠二抗(爱博生,030604a06h)
[0164]
(二)、实验方法
[0165]
1、免疫动物:第1天,30微克s1抗原加等体积的弗氏完全佐剂混匀,皮下多点注射4-6周龄usb小鼠。第21、42、63天加强免疫,均为30微克抗原加等体积的弗氏不完全佐剂混匀,皮下多点注射小鼠。第1、28、49、70天尾静脉采血,elisa检测血清效价(第1天所采血清用于检测免疫前血清抗体滴度)。抗体滴度指的是,血清样品读数比背景值高出0.5时的最大稀释倍数的倒数。
[0166]
2、融合细胞筛选:待血清抗体滴度达到1:8000后即可以进行细胞融合。融合前三天静脉注射s1抗原。融合当天取小鼠脾细胞与sp2/0细胞融合,融合生成的杂交瘤细胞在hat选择性培养基中生长。
[0167]
3、筛选抗体滴度高的细胞株:杂交瘤是否分泌特异性抗体用elisa方法检测。检测
时包被抗原(即s1抗原),取杂交瘤细胞培养上清液作为一抗,hrp标记的大鼠抗小鼠igg(爱博生,030604a06h)为二抗,筛选出稳定表达特异性抗体(记为s1-ubs抗体)的细胞株,扩大培养并冻存。
[0168]
4、提取s1-ubs抗体,抗体与50倍摩尔浓度的多肽-biotin混合,加sortase a蛋白至终浓度2μm。37℃连接过夜。连接产物为抗体-多肽-biotin。
[0169]
5、pd-10提纯柱提纯抗体-多肽-biotin。
[0170]
6、取等摩尔量的streptavidin-hrp与抗体-多肽-biotin孵育。得到抗体-hrp。
[0171]
7、设置对照,即带s1-usb端口的抗体与streptavidin-hrp的混合物,因为s1-usb抗体未连接多肽-biotin,故理论上不能与streptavidin-hrp结合,也不能显色。
[0172]
8、抗体-hrp与对照组做elisa。elisa步骤如下:
[0173]
(1)s1抗原用包被液稀释至0.1-5g/ml,100μl/孔加到96孔板中,4℃湿盒过夜。
[0174]
(2)pbs-t洗4次。
[0175]
(3)每孔加160-200μl封闭液,室温湿盒孵育1h。
[0176]
(4)一抗(步骤6所得的“抗体-hrp”或步骤7的对照)稀释于pbs-t或封闭液中,加100μl/孔。室温湿盒培养1h。
[0177]
(5)pbs-t洗4次。
[0178]
(8)每孔加100μl显色液。
[0179]
(9)显色后405nm波长读取数值。
[0180]
(三)、实验结果
[0181]
结果如图9所示。可见,利用usb小鼠免疫的得到的b细胞与骨髓瘤细胞融合得到的杂交瘤细胞可以分泌含有ubs接口的抗体,该抗体可以经过sortase a催化使之携带biotin基团,并与streptavidin-hrp结合形成携带hrp的s1抗体,该s1-hrp抗体具有正常识别抗原并显色的能力。与之形成对比的是,s1-usb抗体在不含biotin的情况下,不能与streptavidin-hrp结合,因而背景很低。进一步说明usb接口在该模型中的关键作用。
[0182]
二、usb小鼠产生的多克隆抗体在与dna连接中的应用
[0183]
(一)、实验材料:
[0184]
1、s1抗原,东抗生物,visc2-s101;
[0185]
2、sortase a蛋白的制备,同步骤一。
[0186]
4、多肽-azide:gggsypydvpdyagkpipnpllgldsteqklise edlk-azide(c末端azide修饰),中科亚光合成。
[0187]
3、dna oligo
[0188]
序列:5
’‑
caggtagtagtacgtctgtttcacgatgagactggattcg-3’,5’端dbco修饰;安徽通用合成。
[0189]
(二)、实验方法
[0190]
1、s1抗原免疫动物方法与步骤一种相同。
[0191]
2、免疫过程结束后,处死小鼠,取免疫小鼠的血清2ml,用500μl蛋白a珠与血清孵育1h,蛋白a珠以1ml pbs洗涤3次,蛋白a珠以0.1ml ph 2.0甘氨酸缓冲液洗脱5min,以2m tris-hcl ph8.0调节洗脱液ph至7.4,得到抗s1蛋白的多克隆抗体。使用bca试剂盒(thermofisher,23225)定量。
[0192]
3、取100μg多克隆抗体与25倍摩尔浓度的多肽-azide混合,加sortase a蛋白至终浓度2μm。37℃连接过夜。连接产物为抗体-多肽-azide。
[0193]
4、pd-10提纯柱提纯抗体-多肽-azide。使用bca试剂盒(thermofisher,23225)定量。
[0194]
5、取2μg多克隆抗体与2倍摩尔浓度的dna oligo孵育,室温反应过夜。
[0195]
对照为相同量抗体与水孵育样本。
[0196]
6、反应混合物分别用还原上样缓冲液和非还原上样缓冲液混和,煮沸5min。
[0197]
7、以western blot检测小鼠kappa轻链。使用抗体为大鼠抗小鼠kappa轻链抗体(爱博生生物技术有限公司,116111c10),hrp标记小鼠抗大鼠二抗(爱博生生物技术有限公司,011003g07h)。
[0198]
(三)、实验结果:
[0199]
结果如图10所示,还原缓冲液处理样品抗体与对照相比,轻链位置明显上移(图10中a)。非还原缓冲液处理显示,整个抗体分子量也上移(图10中b),这些结果显示usb小鼠生成的抗体经过sortase a催化使之携带azide基团,该抗体与dbco-dna oligo连接生成抗体-dna复合物,该复合物可用于相关检测。
[0200]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1