一种原核生物来源的Mbp_Argonaute蛋白及其应用
一种原核生物来源的mbp_argonaute蛋白及其应用
技术领域
1.本发明属于分子生物学技术领域,具体涉及一种原核生物来源的mbp_argonaute蛋白及其应用。
背景技术:
2.目前,真核生物来源的argonaute蛋白(简称eagos)能够在常温条件下催化rna向导(grna)引导的rna切割反应,并在体内的rna干扰(rna interference,rnai)途径中发挥至关重要的作用。原核生物来源的argonaute蛋白(简称pagos)相比eagos功能和结构更加多样化,但其生理功能长期以来难以捉摸。早期研究主要集中于高温生物来源的pagos,除了marinitoga piezophila来源的mpago偏爱利用5’末端羟基化(5’oh)的向导rna(grna)切割靶单链dna(single
‑
stranded dna,ssdna)和靶rna之外,其余高温来源的pagos都偏爱利用5’末端磷酸化(5’p)的gdna切割靶ssdna和/或靶rna。然而高温生物来源的pagos在中温条件下都只有低水平的gdna引导的靶ssdna和/或靶rna切割活性,这限制了基于pagos的rna编辑技术的应用开发。最近的研究开始集中于中温生物来源的pagos,以期找到能够在中温条件下有效切割靶dna和/或靶rna的pagos。
3.几乎所有已经表征的中温pagos都偏爱在中温下催化gdna引导的靶dna切割,rna切割活性不强。natronobacterium gregory来源的ngago可以在常温下在gdna的引导下切割靶rna,但它的切割位点不确定,且并未证明能切割具有高级结构的rna。此外,尽管eagos被认为自pagos进化而来,但是目前表征的pagos并不能像eagos一样在中温下催化grna引导的靶rna切割反应。
4.长期以来,人们广泛关注靶向rna的可编程核酸内切酶,因为这类酶可以应用于rna结构功能研究、核酸检测领域、rna纳米技术和rna治疗学等领域。早期使用的的方法都存在一定的局限性,例如需要大量重新设计或针对每个靶标的额外选择性进化。新近发展的crispr/cas核酸酶正迅速应用到核酸检测领域和病毒清除领域。但crispr/cas核酸酶需要rna向导,而rna向导必须在体外转录和纯化,或者需要化合合成。此外,该类核酸酶尚未显示出识别结构化的rna元件的功能。有的eagos能够在gdna的引导下在中温切割几乎所有类型的rna,但大多数动植物细胞内存在rnai途径,这些eagos可能会干扰细胞本身的rnai功能,这阻碍了将eagos应用于细胞内的rna编辑。而原核生物体内不存在rnai途径,因此pagos可能不会影响细胞本身的rnai功能。rna编辑领域仍然存在对能在常温条件下发挥作用并能应用于动植物细胞的rna编辑的pagos蛋白的迫切需求。
5.即现有技术存在的问题及缺陷为:rna编辑是指在mrna水平上改变遗传信息的过程,rna编辑与生物细胞发育和分化有关,是基因表达调控的一种重要方式。然而现有技术没有能在常温条件下有效靶向切割各类rna并能应用于动植物细胞的rna编辑的pagos蛋白。而通用的rnai技术需要使用双链rna(dsrna),化学合成dsrna价格高、定制周期长,体外转录dsrna价格相对低廉,但操作困难、耗时,shrna表达质粒方式基因干扰效果持久、经济,但制备耗时、存在非特异性基因抑制等。至于基于crispr的技术也需要用到长的rna向导,
存在和rnai技术一样的问题,此外crispr相关蛋白(如cas13a)依赖于靶位点附近的特殊基序来识别并结合靶,这限制了可以编辑的范围,并且crispr相关蛋白还存在极强的非特异性“附带切割”活性,这令人担忧其可能的脱靶反应。
技术实现要素:
6.本发明的目的在于提供一种新的原核生物来源的mbp_argonaute蛋白及其应用,本发明合成了一种来源于耐冷原核生物mucilaginibacter paludis的argonaute蛋白基因,将该蛋白命名为mbpago,研究发现该mbpago对单链向导dna具有结合活性,并且对与单链向导dna互补配对的靶rna和/或靶dna具有核酸酶活性,因此可利用所述mbpago进行体内外靶向rna编辑,进而对遗传材料进行特异性位点修饰。所述mbpago不仅可对高级结构的rna进行修饰,而且不会影响动植物细胞的内源rnai途径,为rna编辑提供了一个全新的有力工具,并且切割活性强,特异性好。
7.本发明的目的之一在于提供一种mbp_argonaute蛋白,所述mbp_argonaute蛋白的氨基酸序列如seq id no:1或如与seq id no:1具有至少50%或至少80%同源性的序列所示。
8.优选地,与seq id no:1具有至少90%同源性;更优选地,具有至少95%同源性。
9.进一步地,所述mbp_argonaute蛋白的氨基酸序列如与seq id no:1的非催化活性位点具有至少50%或至少80%同源性的序列所示。
10.优选地,与seq id no:1的非催化活性位点具有至少90%同源性;更优选地,具有至少95%同源性。
11.进一步地,所述seq id no:1的非催化活性位点为seq id no:1的第562
‑
570位、第597
‑
606位、第631
‑
639位和第764
‑
772位以外的位点。
12.进一步地,所述mbp_argonaute蛋白的长度是795个氨基酸,也可能是一段更长或更短的连续氨基酸,氨基酸个数(更长或更短)可能是1
‑
1000中任一数字。
13.本发明的目的之二在于提供一种编码上述mbp_argonaute蛋白的基因,所述基因的核苷酸序列如seq id no:2或如与seq id no:2具有至少50%或至少80%同源性的序列所示。
14.优选地,与seq id no:2具有至少90%同源性;更优选地,具有至少95%同源性。
15.本发明的目的之三在于提供一种载体,所述载体中包含上述基因。
16.本发明的目的之四在于提供一种细胞,所述细胞中包含上述载体。
17.本发明的目的之五在于提供一种pago复合物,所述pago复合物中包括:上述mbp_argonaute蛋白和单链向导dna。
18.进一步地,所述单链向导dna的长度为8至40个核苷酸。
19.优选地,所述单链向导dna的长度为12至30个核苷酸,更优选地为15至20个核苷,如16、17或18个核苷酸。
20.进一步地,所述单链向导dna为5’末端磷酸化的dna或5’末端羟基化的dna。
21.本发明的目的之六在于提供上述mbp_argonaute蛋白,或上述载体,或上述细胞,或上述pago复合物在特异性切割靶rna或靶dna中的应用。
22.进一步地,所述靶rna没有高级结构;或有高级结构;或为双链rna;或为体外转录
地rna;或为病毒基因组rna;或为mrna;或细胞内的其他rna。
23.进一步地,所述靶dna是单链dna或双链dna。
24.本发明的目的之七在于提供一种特异性切割靶rna或靶dna的方法,包括:将上述mbp_argonaute蛋白与单链向导dna结合形成pago复合物,然后特异性切割与单链向导dna互补配对的靶rna或靶dna。
25.进一步地,与单链向导dna互补配对,意味着该单链向导dna要么与靶序列包含的相同长度的序列完全互补,要么存在许多错配(通常是分离的,也可能是连续的),错配的数目可能是1、2、3、4或5等。
26.进一步地,特异性切割靶rna或靶dna时的温度为4~65℃。
27.优选地,所述温度为30~55℃,更优选地为37℃。
28.进一步地,pago复合物在缓冲液中特异性切割靶rna或靶dna,所述缓冲液中包含:选自mn
2+
,mg
2+
,co
2+
和ni
2+
中至少一种的二价金属阳离子。
29.进一步地,所述二价金属阳离子的浓度为0.05~10mm。
30.优选地,当向导dna为5’磷酸化的dna时,mn
2+
浓度至少为0.05mm或mg
2+
浓度至少为0.1mm。
31.本发明的目的之八在于提供一种包括上述mbp_argonaute蛋白和单链向导dna的试剂盒。
32.与现有技术相比,本发明的有益效果是:
33.(1)本发明提供了一种来源于耐冷原核生物mucilaginibacter paludis的argonaute蛋白,将其命名为mbpago,其对单链向导dna具有结合活性,并对与单链向导dna互补配对的靶rna和/或dna具有核酸酶活性,因此可利用mbpago进行体内外的靶向rna编辑,进而对遗传材料进行特异性位点修饰,是一种新型、有效的工具,极大的促进rna编辑领域的发展。
34.(2)所述mbpago可对高度二级结构的rna进行切割,使得切割各类rna成为可能。
35.(3)所述mbpago不用依赖靶位点附近的特殊基序来识别和结合靶序列,因此dna向导设计方便,不用考虑位点限制;并且相比于传统的向导rna,向导dna的合成周期短,价格低廉,极大节省成本。
36.(4)所述mbpago的切割活性强,严格依赖于向导和靶的互补配对发挥切割活性,不存在crispr相关蛋白的非特异性“附带切割”活性,特异性更好。
37.(5)可对所述mbpago的核酸酶活性位点进行突变,得到完全丧失切割活性的pago,可以融合其它效应蛋白,进一步拓展了其应用。
38.(6)所述mbpago会干扰动植物细胞内的rnai途径,避免了对动植物细胞内源rnai途径的影响,并且mbpago的蛋白大小比大约只有eagos的四分之三,crispr相关蛋白的二分之一,更易于转染进入细胞。
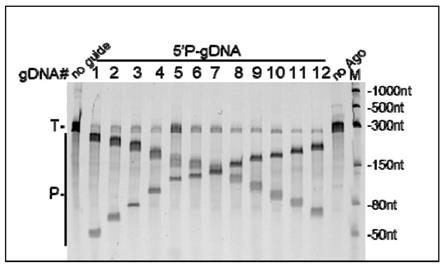
附图说明
39.图1为本发明实施例1中sds
‑
page凝胶分析mbpago纯度示意图;
40.图2为本发明实施例1中mbpago与部分已表征的argonaute蛋白的进化树;
41.图3为本发明实施例1中mbpago与已表征ago蛋白的序列比对示意图;
42.图4为本发明实施例2中用于测试的靶dna、靶rna、向导ssdna和向导ssrna的序列示意图;
43.图5为本发明实施例2中mbpago切割靶ssrna的检测结果图,以及mbpago双突变体dm对靶rna的切割活性检测结果图;
44.图6为本发明实施例2中mbpago切割靶ssdna的检测结果图;
45.图7为本发明实施例3中不同长度向导dna对mbpago切割靶rna的产物尿素/聚丙烯酰胺凝胶检测结果图;
46.图8为本发明实施例4中不同二价金属阳离子条件下mbpago切割靶rna的产物尿素/聚丙烯酰胺凝胶检测结果图;
47.图9为本发明实施例4中不同mn
2+
或mg
2+
离子浓度条件下mbpago切割靶rna的产物尿素/聚丙烯酰胺凝胶检测结果图;
48.图10为本发明实施例5中不同温度条件下mbpago切割靶rna的产物尿素/聚丙烯酰胺凝胶检测结果图;
49.图11为本发明实施例6中提供的高级结构的sars
‑
cov2 rdrp的局部rna的序列结构图以及向导dna靶向区域的设计示意图;
50.图12为本发明实施例7中mbpago切割具有高级结构的靶rna的产物尿素/聚丙烯酰胺凝胶检测结果图。
具体实施方式
51.下面将结合本发明中的实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动条件下所获得的所有其它实施例,都属于本发明保护的范围。
52.实施例1 mbpago表达和纯化
53.从耐冷原核生物mucilaginibacter paludis中扩增得到如seq id no:2所示的核苷酸序列,并采用常规方法连接至pet28a上得到pet28a
‑
mbpago质粒,然后转化至大肠杆菌rosetta(de3),单菌落接种到含有50mg/ml卡那霉素的lb液体培养基中,于37℃、220rpm的摇床上摇瓶培养,当菌体od
600
达到0.8时,移至18℃摇床,iptg诱导过夜。6000rpm离心10min收集菌体,用buffer a(20mm tris
–
hcl ph 7.4,500mm nacl,10mm imidazole)洗菌后,将菌体重悬于buffer a,添加终浓度1mm的pmsf,高压破碎。18000rpm离心30min,收集上清。上清过滤后,进行ni
‑
nta纯化。
54.20mm咪唑各洗10个柱体积(分3次加入),50mm、80mm、100mm、150mm、200mm、250mm、300mm、1m各洗3个柱体积,取样进行sds
‑
page检测。收集含有高纯度目的蛋白的洗脱组分,超滤换液至buffer b(20mm tris
–
hcl ph 7.4,500mm nacl,1mm tcep)。经ni
‑
nta纯化的蛋白用分子筛(superdex 200 16/600column,ge healthcare)纯化,分子筛预先用buffer b平衡。收集纯化的蛋白,用sds
‑
聚丙烯酰胺凝胶鉴定纯度并分析,将蛋白分成小份,经液氮速冻后,储存在
‑
80℃。
55.sds
‑
聚丙烯酰胺凝胶鉴定分析结果如图1所示,通过http://www.expasy.org/计算,mbpago的预期大小为96.4kda,其氨基酸序列如seq id no:1所示。所述mbpago与部分已
表征的argonaute蛋白(ago蛋白)的进化树如图2所示,mbpago的催化dedx四联体以及与十七个已表征ago蛋白的序列比对示意图如图3所示。
56.实施例2 mbpago切割活性测定
57.为了评估mbpago能够裂解向导rna/dna和靶rna/dna的哪些组合,对所有可能的组合进行了活性测定。其中靶dna、靶rna、向导ssdna和向导ssrna的序列示意图如图4所示,其中箭头表示预测的切割位点
58.裂解试验均在37℃下以4:2:1(mbpago:向导:靶)摩尔比进行。将800nm mbpago与400nm向导放在含有10mm hepes
‑
naoh,ph 7.5、100mm nacl,5mm mncl2和5%甘油的反应缓冲液中混合,并在37℃孵育10分钟以用于向导加载。将核酸靶添加至200nm。37℃反应1h后,通过将样品与2x rna上样染料(95%甲酰胺,18mm edta和0.025%sds和0.025%溴酚蓝)混合并在95℃加热5分钟来终止反应。裂解产物通过20%变性page解析,用sybr gold(invitrogen)染色,用gel doc
tm xr+(bio
‑
rad)可视化。其中对靶ssrna的切割结果如图5所示,对靶ssdna的切割结果如图6所示。
59.结果显示,在没有mbpago的情况下(no ago泳道)进行孵育的dna/rna(引导/靶)对照测定中未观察到产物带(34nt),表明产物带的形成是mbpago核酸酶活性的结果。mbpago可以利用5’磷酸化的向导dna和5’羟基化的向导dna切割靶rna和dna,而无法利用rna作为向导。图5显示mbpago可以在结合ssdna向导后切割靶ssrna,图6显示mbpago可以在结合ssdna向导之后切割靶dna。
60.实施例3 gdna长度对靶rna切割活性影响
61.分别选择长度为8
‑
40nt的dna作为向导dna,将其与mbpago孵育结合形成pago复合物,并测定不同长度向导dna对mbpago识别并切割靶rna的活性。测定结果如图7所示。
62.结果显示,向导dna的长度对于mbpago识别切割靶rna活性有一定影响,其中当向导dna长度的范围为8
‑
40nt,优选长度为10
‑
30nt时,可以有效切割靶rna。
63.实施例4二价金属离子及其浓度对靶rna切割活性影响
64.将mbpago与向导dna放在含有10mm hepes
‑
naoh ph 7.5、100mm nacl,5mm二价金属阳离子和5%甘油的反应缓冲液中混合,并在37℃孵育10分钟以用于向导加载,接着加入靶序列进行切割活性检测。其中二价金属阳离子选自mn
2+
,mg
2+
,ca
2+
,cu
2+
,fe
2+
,co
2+
,zn
2+
和ni
2+
,测定不同金属阳离子对切割活性的影响,测定结果如图8所示。结果显示,二价金属阳离子的选择对于mbpago的切割活性有一定的影响,其中在mn
2+
,mg
2+
,co
2+
,和ni
2+
条件下以有效切割靶rna。
65.进一步对二价金属离子的最低浓度进行摸索,分别选取0.05mm~5.00mm的mn
2+
或mg
2+
加入缓冲液中,反应15min后测定mbpago对靶rna的切割活性,测定结果如图9所示。结果显示,二价金属阳离子的浓度对mbpago的切割活性有一定影响。当向导为5’磷酸化的dna时,mn
2+
浓度最低为0.05mm或mg
2+
浓度最低为0.1mm时,就可以高效切割靶rna。即mn
2+
的添加浓度应大于等于0.05mm,而mg
2+
的添加浓度应大于等于0.1mm。
66.实施例5温度对mbpago切割靶rna活性的影响
67.将mbpago与向导dna孵育结合形成复合物后,添加靶序列,分别于4~70℃反应15min后,测定切割活性,结果如图10所示。结果显示,当向导为5’磷酸化的dna,温度为4~65℃时可以切割靶rna,其中30~55℃切割活性相对较高,即所述mbpago可在较宽广的温度
条件下切割靶基因,
68.实施例6 mbpago对高级结构的靶rna的切割效果
69.sars
‑
cov2 rdrp是存在高度结构化的rna,其预测的局部结构如图11所示。使用t7 rna聚合酶和带有t7启动子序列的合成dna模板体外转录sars
‑
cov2 rdrp的局部rna。用于切割测定的转录物经dnase i处理并凝胶纯化。分别设计12个gdna(长度为18nt,靶向区域如图11所示)来指导mbpago在不同的位点进行切割。将向导dna与mbpago在室温下孵育10分钟,然后在37℃反应30min,测定结果如图12所示。结果显示,在所有位点的预期位置都检测到切割产物,尽管程度不同,这表明即使在高度结构化的rna中,mbpago
‑
gdna复合物也会切割靶rna序列,即mbpago可在中温下切割具有高级结构的靶rna。
70.实施例7 mbpago催化活性位点突变
71.图2已显示了mbpago催化四联体dedd,分别为seq id no:1所示序列的第562
‑
570位、第597
‑
606位、第631
‑
639位和第764
‑
772位。通过突变对mbpago蛋白的催化活性必不可少的一个或多个氨基酸残基以形成新的核酸酶活性,特别是核酸内切酶活性缺失。例如,对mbpago催化四联体,
72.yigidvhdr
73.sqrvekvrak
74.vivrdgrsf
75.iklidtlle
76.第1个和第3个d突变为a,得到双突变体dm,并测定其对于靶rna的切割活性,测定结果如图5的最后两个泳道(dm)所示,结果显示,对mbpago的催化四连体进行突变后,会使其失去dna向导切割靶rna的活性。也就是说,至少突变一个位于进化保守的氨基酸四联体中的氨基酸,可改变mbpago蛋白的催化活性。即该四联体为mbpago催化活性关键位点。
77.本发明进一步提供了一种位点特异性靶向阻断靶dna或靶rna的体外方法,包括以下步骤:提供如本发明所述的无核酸酶活性的pago和ssdna向导,向导和所述pago形成pago
‑
向导复合物;使所得的pago
‑
向导复合物与靶rna或靶dna接触,所述靶具有与所述向导序列大部分互补的核苷酸序列,所述pago
‑
向导复合物结合在靶上与向导大部分互补的区域。
78.以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1