一种三价磷取代的胺类化合物的合成方法
1.本发明属有机合成领域,具体涉及一种三价磷取代的胺类化合物的合成方法。
背景技术:
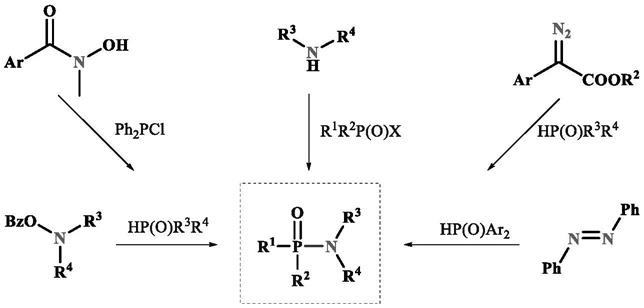
2.有机磷化合物被广泛应用于有机合成、生物、医药、农业及材料等领域,探索新方法合成一些结构新颖的有机磷化合物在有机合成领域备受关注。三价磷取代的胺类化合物作为路易斯碱可以在许多反应中被用作有效的配体或催化剂。但是,三价磷取代的胺类化合物一般都十分不稳定,其三价磷很容易被氧化成五价磷,并且其氮磷键非常容易断裂,这种不稳定性导致此类化合物的合成及应用受到极大地挑战。所以,发明新的、高效的合成三价磷取代的胺类化合物的方法是十分必要的。已报道的氮磷键构筑的方法如下所示:
[0003][0004]
1)经典的构筑方法是:在碱的作用下,通过胺和三价磷氯之间脱除一分子氯化氢,然后再进行氧化得到相对稳定的磷酰胺类化合物。
[0005]
2)微波条件下,磷酸与胺的脱水缩合反应。此类方法反应温度在220度左右,并且转化率极低。后来通过使用丙烷磷酸酐来活化磷酸,能够将反应温度降低到室温,尽管如此,反应过程中还是需要两倍以上的碱来催化反应,并且底物适用范围也十分有限。
[0006]
3)磷氯与羟胺的氧化重排:三价磷氯与羟胺在碱的作用下脱除一分子氯化氢,然后在加热的条件下发生重排得到相对稳定的磷酰胺类化合物。此方法需要预先合成羟胺类底物,并且反应对羟胺类化合物的结构要求比较高,普适性比较低。
[0007]
4)其它方法:磷氢与苯甲酰羟胺的偶联、重氮或偶氮的磷氢化。
[0008]
上述几种方法多数都以对空气和水十分敏感的磷氯或膦氢作为底物,所生成的三价磷中间体很不稳定,底物适用范围窄,反应条件苛刻,转化率低,一般用于磷酰胺的合成,很少用于三价磷取代的胺类化合物的合成。
技术实现要素:
[0009]
本发明要解决的技术问题是克服现有的缺陷,提供一种操作简单、反应效率高,并且具有广普性的三价磷取代的胺类化合物的合成方法。
[0010]
本发明的目的通过以下技术方案来具体实现:
[0011]
一种三价磷取代胺类化合物的合成方法,所述三价磷取代胺类化合物的结构式如
下式(ⅰ)所示,
[0012][0013]
所述方法为:将与叠氮化合物r2‑
n3在有机溶剂中混合反应;
[0014]
其中,所述r选自苯基或者环己基;r1选自烷基、苯基、取代芳基、取代烷基;r2选自苄基、取代芳基、氨基酸及天然产物骨架基团。
[0015]
优选地,所述有机溶剂为甲苯、氯苯、乙醚、二氯甲烷或乙腈中的任一种或几种的组合。
[0016]
优选地,所述有机溶剂为甲苯。
[0017]
优选地,所述叠氮化合物包括苄基叠氮、2
‑
(叠氮甲基)异吲哚啉
‑
1,3
‑
二酮、2,6
‑
二甲基苯基叠氮、2,4,6
‑
三甲基苯基叠氮、氨基酸衍生的叠氮、氨基茚醇衍生的叠氮、酒石酸衍生的叠氮、双丙酮葡萄糖衍生的叠氮、奎宁衍生的叠氮、联萘酚衍生的叠氮。
[0018]
优选地,所述酰基二苯基膦(或酰基二环己基膦)包括苯甲酰基二苯基膦、苯甲酰基二环己基膦、苯环取代的苯甲酰基二苯基膦、呋喃
‑2‑
甲酰基二苯基膦、噻吩
‑2‑
甲酰基二苯基膦、丙酰基二苯基膦、丁酰基二苯基膦、4'
‑
((二苯基膦基)羰基)
‑
[1,1'
‑
联苯]
‑2‑
腈、雌酚酸衍生的酰基二苯基膦。
[0019]
优选地,所述叠氮化合物和的摩尔比为1:1
‑
2。
[0020]
优选地,所述叠氮化合物和的摩尔比为1:1.5。
[0021]
优选地,所述反应体系中叠氮化合物的反应浓度为0.10
‑
0.25mol/l。
[0022]
优选地,所述反应体系中叠氮化合物的反应浓度为0.20mol/l。
[0023]
优选地,所述反应过程中的反应温度为25
‑
40℃;反应气氛为氩气条件,反应时间为2
‑
8h。
[0024]
优选地,所述反应温度为40℃。
[0025]
优选地,所述方法还包括:将与叠氮化合物r2‑
n3在有机溶剂中混合反应后进行柱层析。
[0026]
优选地,所述柱层析过程中的洗脱剂为石油醚和乙酸乙酯混合溶剂。
[0027]
优选地,所述石油醚和乙酸乙酯的体积比为4:1
‑
10:1。
[0028]
本发明的有益效果是:与现有技术相比,本发明方法最大的优点在于反应无需任何碱和催化剂便可顺利地进行,反应中唯一的副产物为氮气,不存在环境污染等问题,绿色环保并且原子经济性极好。此外,原料合成简单、反应条件温和,反应效率高,底物普适性好。
附图说明
[0029]
图1为本发明所述三价磷取代的胺类化合物的合成结果。
具体实施方式
[0030]
以下对本发明的优选实施例进行说明,应当理解,此处所描述的优选实施例仅用于说明和解释本发明,并不用于限定本发明。
[0031]
本发明根据所述方法具体合成了图1所示的38种化合物,但并不局限于图1中所示的38种化合物。
[0032]
本发明实施例具体展示了其中20种化合物的合成。
[0033]
实施例1
[0034]
在反应器中,加入0.4毫摩尔苯甲酰基二苯基膦、0.2毫摩尔苄基叠氮和1毫升甲苯,40℃反应4小时后,反应液直接使用洗脱剂(v
石油醚
:v
乙酸乙酯
=10:1)通过硅胶柱层析得到三价磷取代的胺类化合物3aa,产率为93%,无色油状液体。
[0035]
产物检测数据为:1h nmr(400mhz,cdcl3)δ7.59(d,j=7.6hz,2h),7.45
‑
7.33(m,13h),7.03
‑
7.02(m,3h),6.79
‑
6.77(m,2h),4.80(s,2h).
13
c nmr(100mhz,cdcl3)δ176.8(d,j
c
‑
f
=32.0hz),138.0,137.2(d,j
c
‑
f
=3.0hz),135.4,135.2,132.5,132.3,130.1,129.8,128.8,128.7,128.1,127.9,127.9,127.8,126.9,126.3,49.5(d,j
c
‑
f
=8.0hz).
31
p nmr(162mhz,cdcl3)δ57.31.hrms(esi)m/z calcd for c
26
h
22
nnaop[m+na]
+
:418.1331,found 418.1334。
[0036]
产物结构式如下:
[0037]
[0038]
实施例2
[0039]
在反应器中,加入0.4毫摩尔呋喃
‑2‑
甲酰基二苯基膦、0.2毫摩尔苄基叠氮和1毫升甲苯,40℃反应4小时后,反应液直接使用洗脱剂(v
石油醚
:v
乙酸乙酯
=10:1)通过硅胶柱层析得到三价磷取代的胺类化合物3ai,产率为84%,无色油状液体。
[0040]
产物检测数据为:1h nmr(400mhz,cdcl3)δ7.53(d,j=1.2hz,1h),7.46
‑
7.42(m,4h),7.33
‑
7.32(m,6h),7.15(d,j=3.6hz,1h),7.01
‑
6.99(m,3h),6.79
‑
6.76(m,2h),6.47
‑
6.46(m,1h),4.75(s,2h).
13
c nmr(100mhz,cdcl3)δ165.8(d,j
c
‑
f
=10.0hz),147.7,144.5,137.9,135.3,135.1,132.7,132.5,129.8,128.7,128.6,127.8,127.0,126.3,117.5,117.4,111.4,50.2(d,j
c
‑
f
=7.0hz).
31
p nmr(162mhz,cdcl3)δ59.11.hrms(esi)m/z calcd for c
24
h
20
nnao2p[m+na]
+
:408.1124,found 408.1127。
[0041]
产物结构式如下:
[0042][0043]
实施例3
[0044]
在反应器中,加入0.4毫摩尔噻吩
‑2‑
甲酰基二苯基膦、0.2毫摩尔苄基叠氮和1毫升甲苯,40℃反应4小时后,反应液直接使用洗脱剂(v
石油醚
:v
乙酸乙酯
=10:1)通过硅胶柱层析得到三价磷取代的胺类化合物3aj,产率为81%,无色油状液体。
[0045]
产物检测数据为:1h nmr(400mhz,cdcl3)δ7.77(d,j=3.2hz,1h),7.49(d,j=4.4hz,1h),7.46
‑
7.43(m,4h),7.34
‑
7.33(m,6h),7.04
‑
7.00(m,4h),6.79
‑
6.77(m,2h),4.77(s,2h).
13
c nmr(100mhz,cdcl3)δ169.2(d,j
c
‑
f
=30.0hz),137.9,137.6(d,j
c
‑
f
=3.0hz),135.2,135.0,133.1,132.9,132.6,132.4,130.8(d,j
c
‑
f
=7.0hz),129.9,128.8,128.7,127.8,126.9,126.8,126.3,50.6(d,j
c
‑
f
=7.0hz).
31
p nmr(162mhz,cdcl3)δ57.57.hrms(esi)m/z calcd for c
24
h
20
nnaops[m+na]
+
:424.0895,found 424.0898。
[0046]
产物结构式如下:
[0047][0048]
实施例4
[0049]
在反应器中,加入0.4毫摩尔2
‑
乙烯基苯甲酰基二苯基膦、0.2毫摩尔苄基叠氮和1毫升甲苯,40℃反应4小时后,反应液直接使用洗脱剂(v
石油醚
:v
乙酸乙酯
=10:1)通过硅胶柱层析得到三价磷取代的胺类化合物3ak,产率为84%,无色油状液体。
[0050]
产物检测数据为:1h nmr(400mhz,cdcl3)δ7.60(d,j=8.0hz,1h),7.38
‑
7.30(m,11h),7.27
‑
7.22(m,2h),7.03
‑
6.99(m,3h),6.83(dd,j=17.4,11.0hz,1h),6.74
‑
6.72(m,2h),5.76(d,j=17.2hz,1h),5.30(d,j=11.2hz,1h),4.83(d,j=6.8hz,2h).
13
c nmr(100mhz,cdcl3)δ176.2(d,j
c
‑
f
=36.0hz),137.9,136.7,135.2,135.0,135.0,134.1,
132.5,129.7,129.2,128.7,128.6,127.7,127.5,127.4,126.7,126.6,126.4,125.4,116.7,49.2.
31
p nmr(162mhz,cdcl3)56.25.hrms(esi)m/z calcd for c
28
h
25
nop[m+h]
+
:422.1668,found 422.1672。
[0051]
产物结构式如下:
[0052][0053]
实施例5
[0054]
在反应器中,加入0.4毫摩尔苯甲酰基二环己基膦、0.2毫摩尔苄基叠氮和1毫升甲苯,40℃反应4小时后,反应液直接使用洗脱剂(v
石油醚
:v
乙酸乙酯
=10:1)通过硅胶柱层析得到三价磷取代的胺类化合物3al,产率为73%,无色油状液体。
[0055]
产物检测数据为:1h nmr(400mhz,cdcl3)δ7.45
‑
7.43(m,2h),7.38
‑
7.35(m,5h),7.30(t,j=7.6hz,2h),7.25
‑
7.20(m,1h),4.82(s,2h),1.93(s,2h),1.69
‑
1.61(m,10h),1.22
‑
1.01(m,10h).
13
c nmr(100mhz,cdcl3)δ177.9(d,j
c
‑
f
=23.0hz),139.1,138.2(d,j
c
‑
f
=2.0hz),129.5,128.4,128.3,127.9,127.5,126.9,48.62,36.9,36.7,29.6,29.5,29.2,29.0,26.8,26.7,26.6,26.1.
31
p nmr(162mhz,cdcl3)δ76.71.hrms(esi)m/z calcd for c
26
h
34
nnaop[m+na]
+
:430.2270,found 430.2274。
[0056]
产物结构式如下:
[0057][0058]
实施例6
[0059]
在反应器中,加入0.4毫摩尔丙酰基二苯基膦、0.2毫摩尔苄基叠氮和1毫升甲苯,40℃反应4小时后,反应液直接使用洗脱剂(v
石油醚
:v
乙酸乙酯
=10:1)通过硅胶柱层析得到三价磷取代的胺类化合物3am,产率为48%,无色油状液体。
[0060]
产物检测数据为:1h nmr(400mhz,cdcl3)δ7.30
‑
7.21(m,10h),6.87(d,j=3.2hz,3h),6.51(d,j=3.2hz,2h),4.59(s,2h),2.91
‑
2.90(m,2h),1.18(t,j=7.4hz,3h).
13
c nmr(100mhz,cdcl3)δ179.3(d,j
c
‑
f
=34.0hz),138.1,134.9(d,j
c
‑
f
=19.0hz),132.4,132.1,129.6,128.6,128.5,127.4,126.5,125.8,49.1(d,j
c
‑
f
=8.0hz),28.9(d,j
c
‑
f
=29.0hz),10.2(d,j
c
‑
f
=9.0hz).
31
p nmr(162mhz,cdcl3)δ53.31.hrms(esi)m/z calcd for c
22
h
23
nop[m+h]
+
:348.1512,found 348.1516。
[0061]
产物结构式如下:
[0062][0063]
实施例7
[0064]
在反应器中,加入0.4毫摩尔苯甲酰基二苯基膦、0.2毫摩尔α
‑
叠氮基丙酮和1毫升甲苯,40℃反应6小时后,反应液直接使用洗脱剂(v
石油醚
:v
乙酸乙酯
=10:1)通过硅胶柱层析得到三价磷取代的胺类化合物3ba,产率为82%,无色油状液体。
[0065]
产物检测数据为:1h nmr(400mhz,cdcl3)δ7.59(d,j=7.6hz,2h),7.44(d,j=7.2hz,1h),7.40
‑
7.37(m,12h),4.14(s,2h),1.84(s,3h).
13
c nmr(100mhz,cdcl3)δ201.3,176.4(d,j
c
‑
f
=32.0hz),136.2(d,j
c
‑
f
=3.0hz),135.2,135.0,132.3,132.1,130.5,129.9,128.9,128.9,128.2,128.0,127.9,54.9(d,j
c
‑
f
=9.0hz),27.0.
31
p nmr(162mhz,cdcl3)δ54.40.hrms(esi)m/z calcd for c
22
h
21
no2p[m+h]
+
:362.1304,found 362.1307。
[0066]
产物结构式如下:
[0067][0068]
实施例8
[0069]
在反应器中,加入0.4毫摩尔苯甲酰基二苯基膦、0.2毫摩尔n
‑
叠氮甲基邻苯二甲酰亚胺和1毫升甲苯,40℃反应6小时后,反应液直接使用洗脱剂(v
石油醚
:v
乙酸乙酯
=10:1)通过硅胶柱层析得到三价磷取代的胺类化合物3ca,产率为80%,无色油状液体。
[0070]
产物检测数据为:1h nmr(400mhz,cdcl3)δ7.69
‑
7.67(m,2h),7.66
‑
7.61(m,4h),7.51
‑
7.41(m,7h),7.31
‑
7.21(m,6h),5.56(d,j=1.2hz,2h).
13
c nmr(100mhz,cdcl3)δ176.8(d,j
c
‑
f
=28.0hz),167.18,136.6(d,j
c
‑
f
=2.0hz),134.05,133.86,132.41,132.20,131.58,130.50,129.69,128.75,128.69,128.25,128.19,128.13,123.03,50.1(d,j
c
‑
f
=5.0hz).
31
p nmr(162mhz,cdcl3)δ53.67.hrms(esi)m/z calcd for c
28
h
22
n2o3p[m+h]
+
:465.1363,found465.1367。
[0071]
产物结构式如下:
[0072][0073]
实施例9
[0074]
在反应器中,加入0.4毫摩尔苯甲酰基二苯基膦、0.2毫摩尔2,4,6
‑
三甲基苯基叠氮和1毫升甲苯,40℃反应4小时后,反应液直接使用洗脱剂(v
石油醚
:v
乙酸乙酯
=10:1)通过硅胶柱层析得到三价磷取代的胺类化合物3ea,产率为78%,无色油状液体。
[0075]
产物检测数据为:1h nmr(400mhz,cdcl3)δ7.57(t,j=6.8hz,4h),7.35(d,j=
7.6hz,2h),7.30
‑
7.22(m,7h),7.12(t,j=7.4hz,2h),6.61(s,2h),2.12(s,3h),2.06(s,6h).
13
c nmr(100mhz,cdcl3)δ172.8(d,j
c
‑
f
=3.0hz),138.6,137.1(d,j
c
‑
f
=1.0hz),136.4,136.2,136.0(d,j
c
‑
f
=3.0hz),135.7(d,j
c
‑
f
=2.0hz),133.7,133.4,130.3,129.5,129.3,128.2,127.9,127.8,127.5,20.8,19.7,19.7.
31
p nmr(162mhz,cdcl3)59.44.hrms(esi)m/z calcd for c
28
h
27
nop[m+h]
+
:424.1825,found 424.1830。
[0076]
产物结构式如下:
[0077][0078]
实施例10
[0079]
在反应器中,加入0.4毫摩尔苯甲酰基二苯基膦、0.2毫摩尔(s)
‑
n
‑
(1
‑
叠氮基
‑3‑
苯基丙烷
‑2‑
基)
‑4‑
甲基苯磺酰胺和1毫升甲苯,40℃反应6小时后,反应液直接使用洗脱剂(v
石油醚
:v
乙酸乙酯
=4:1)通过硅胶柱层析得到三价磷取代的胺类化合物5aa,产率为86%,无色油状液体。
[0080]
产物检测数据为:1h nmr(400mhz,cdcl3)δ7.54(d,j=10.8hz,2h),7.46
‑
7.29(m,11h),7.25
‑
7.05(m,10h),6.76(d,j=10.0hz,2h),5.22(d,j=7.2hz,1h),3.91(t,j=16.6hz,1h),3.40(d,j=18.8hz,1h),3.10
‑
3.06(m,1h),2.44(s,1h),2.41(s,3h).
13
c nmr(100mhz,cdcl3)δ178.6(d,j
c
‑
f
=44.0hz),142.8,138.2,136.4,135.0(d,j
c
‑
f
=25.0hz),134.3(d,j
c
‑
f
=24.0hz),133.3,133.0,131.8,131.5,130.2,130.0,129.7,129.6(d,j
c
‑
f
=2.0hz),129.0,128.9,128.9,128.3,127.9,127.8,127.7,127.0,126.4,54.8,48.5(d,j
c
‑
f
=10.0hz),40.7,21.6.
31
p nmr(162mhz,cdcl3)δ59.82.hrms(esi)m/z calcd for c
35
h
34
n2o3ps[m+h]
+
:593.2022,found593.2026。
[0081]
产物结构式如下:
[0082][0083]
实施例11
[0084]
在反应器中,加入0.4毫摩尔苯甲酰基二苯基膦、0.2毫摩尔(s)
‑2‑
叠氮基
‑3‑
苯基丙酸甲酯和1毫升甲苯,40℃反应6小时后,反应液直接使用洗脱剂(v
石油醚
:v
乙酸乙酯
=7:1)通过硅胶柱层析得到三价磷取代的胺类化合物5ba,产率为88%,无色油状液体。
[0085]
产物检测数据为:1h nmr(400mhz,cdcl3)δ7.64
‑
7.60(m,2h),7.45(d,j=7.4hz,2h),7.41
‑
7.38(m,4h),7.35
‑
7.28(m,7h),7.17(t,j=3.1hz,3h),6.84(d,j=3.2hz,2h),4.33(s,1h),3.66(dd,j=14.4,7.8hz,1h),3.55(s,3h),2.91(dd,j=14.4,5.3hz,1h).
13
c nmr(100mhz,cdcl3)δ176.4(d,j
c
‑
f
=28.0hz),171.2,138.8,137.1(d,j
c
‑
f
=3.0hz),135.1(d,j
c
‑
f
=3.0hz),135.0(d,j
c
‑
f
=4.0hz),133.5,133.3,132.9,132.7,130.2,130.1,129.7,129.4,128.9,128.8,128.5,128.5,128.2,127.4,127.4,126.3,62.6,52.2,37.7.
31
p nmr
nmr(162mhz,cdcl3)57.20.hrms(esi)m/z calcd for c
29
h
27
no2p[m+h]
+
:452.1774,found 452.1778。
[0096]
产物结构式如下:
[0097][0098]
实施例14
[0099]
在反应器中,加入0.4毫摩尔雌酚酰基二苯基膦、0.2毫摩尔(s)
‑2‑
叠氮基
‑3‑
苯基丙酸甲酯和1毫升甲苯,40℃反应6小时后,反应液直接使用洗脱剂(v
石油醚
:v
乙酸乙酯
=4:1)通过硅胶柱层析得到三价磷取代的胺类化合物5bn,产率为41%,无色油状液体。
[0100]
产物检测数据为:1h nmr(400mhz,cdcl3)δ7.64
‑
7.60(m,2h),7.40
‑
7.33(m,4h),7.30
‑
7.21(m,7h),7.19
‑
7.17(m,3h),6.85
‑
6.84(m,2h),4.32(s,1h),3.67(dd,j=14.4,7.6hz,1h),3.54(s,3h),2.93(dd,j=14.4,5.2hz,1h),2.83(t,j=4.4hz,2h),2.51(dd,j=20.0,8.0hz,1h),2.41
‑
2.28(m,2h),2.19
‑
2.12(m,1h),2.10
‑
1.93(m,3h),1.65
‑
1.41(m,6h),0.90(s,3h).
13
c nmr(100mhz,cdcl3)δ220.8,176.5(d,j
c
‑
f
=32.0hz),171.3,142.3,138.8,136.7,135.3(d,j
c
‑
f
=5.0hz),135.1(d,j
c
‑
f
=6.0hz),134.5(d,j
c
‑
f
=3.0hz),133.5,133.2,133.0,132.8,130.0,129.7,129.4,128.9,128.8,128.5,128.4,128.1,126.3,125.0,124.7(d,j
c
‑
f
=7.0hz),62.7,52.1,50.5,47.9,44.5,37.8,37.7,35.9,31.6,29.2,26.3,25.5,21.6,13.9.
31
p nmr(162mhz,cdcl3)57.36.hrms(esi)m/z calcd for c
41
h
43
no4p[m+h]
+
:644.2924,found 644.2929。
[0101]
产物结构式如下:
[0102][0103]
实施例15
[0104]
在反应器中,加入0.4毫摩尔4'
‑
((二苯基膦基)羰基)
‑
[1,1'
‑
联苯]
‑2‑
腈、0.2毫摩尔(s)
‑2‑
叠氮基
‑3‑
甲基丁酸甲酯和1毫升甲苯,40℃反应6小时后,反应液直接使用洗脱剂(v
石油醚
:v
乙酸乙酯
=4:1)通过硅胶柱层析得到三价磷取代的胺类化合物5em,产率为43%,无色油状液体。
[0105]
产物检测数据为:1h nmr(400mhz,cdcl3)δ7.79
‑
7.73(m,3h),7.68
‑
7.54(m,8h),7.49
‑
7.44(m,4h),7.37
‑
7.35(m,3h),4.02(t,j=12.2hz,1h),3.70(s,3h),2.57
–
2.45(m,1h),0.94(d,j=8.8hz,3h),0.67(d,j=9.2hz,3h).
13
c nmr(100mhz,cdcl3)δ174.8(d,j
c
‑
f
=12.0hz),171.3,144.4,139.4,137.6,135.7,135.6(d,j
c
‑
f
=5.0hz),135.4,135.2,
135.0,133.9,132.9,131.9,131.7,130.6,130.1,129.0,128.7,128.7,128.6,128.3,128.2,127.9,127.7(d,j
c
‑
f
=4.0hz),118.5,111.2,67.6,52.0,30.6(d,j
c
‑
f
=6.0hz),20.7,20.2.
31
p nmr(162mhz,cdcl3)55.55.hrms(esi)m/z calcd for c
32
h
30
n2o3p[m+h]
+
:521.1989,found521.1994。
[0106]
产物结构式如下:
[0107][0108]
实施例16
[0109]
在反应器中,加入0.2毫摩尔苯甲酰基二苯基膦、0.2毫摩尔2,2'
‑
二叠氮
‑
1,1'
‑
联萘和1毫升甲苯,40℃反应4小时后,反应液直接使用洗脱剂(v
石油醚
:v
乙酸乙酯
=4:1)通过硅胶柱层析得到三价磷取代的胺类化合物5ma,产率为47%,无色油状液体。
[0110]
产物检测数据为:1h nmr(400mhz,cdcl3)δ8.31(d,j=12.0hz,1h),8.15(d,j=11.6hz,1h),8.08
–
8.03(m,3h),7.88(d,j=11.6hz,1h),7.78(d,j=10.8hz,1h),7.65(d,j=11.6hz,1h),7.51(t,j=9.8hz,1h),7.38
‑
7.22(m,12h),7.19
‑
7.08(m,3h),7.06
–
7.01(m,1h),6.67
‑
6.61(m,2h).
13
c nmr(100mhz,cdcl3)δ159.4(d,j
c
‑
f
=5.5hz),146.4,144.8,135.9,132.5,132.2,132.0,132.0,131.9,131.7,131.6,131.4,130.9,130.9,130.8,130.6,130.0,129.9,129.1,128.9,128.5(d,j
c
‑
f
=7.3hz),128.1,128.0,127.7(d,j
c
‑
f
=5.8hz),127.5,127.4,127.3,125.9,125.8,125.6,125.4,125.2,123.8.
31
p nmr(162mhz,cdcl3)δ18.91.hrms(esi)m/zcalcd for c
39
h
28
n2op[m+h]
+
:571.1934,found 571.1938。
[0111]
产物结构式如下:
[0112][0113]
实施例17
[0114]
在反应器中,加入0.8毫摩尔苯甲酰基二苯基膦、0.2毫摩尔2,2'
‑
双(叠氮甲基)
‑
1,1'
‑
联萘和1毫升甲苯,40℃反应6小时后,反应液直接使用洗脱剂(v
石油醚
:v
乙酸乙酯
=4:1)通过硅胶柱层析得到三价磷取代的胺类化合物5na,产率为31%,无色油状液体。
[0115]
产物检测数据为:1h nmr(400mhz,cdcl3)δ7.80(dd,j=14.6,8.2hz,4h),7.58(d,j=6.8hz,4h),7.43
‑
7.28(m,10h),7.22
‑
7.15(m,11h),7.08(t,j=7.0hz,2h),6.96
‑
6.86(m,11h),6.69(s,2h),4.04(dd,j=52.2,15.8hz,4h).
13
c nmr(100mhz,cdcl3)δ176.3(d,j
c
‑
f
=32.0hz),137.2,135.4,135.2,135.0,134.1,133.2,133.0,132.4,132.1,131.9,131.7,131.6,130.3,129.6,129.3,128.5,128.5,128.4,128.3,128.2,127.9,127.8,
127.6,126.2,125.4,125.1,123.7,48.0.
31
p nmr(162mhz,cdcl3)δ61.39.hrms(esi)m/z calcd for c
60
h
47
n2o2p2[m+h]
+
:889.3107,found 889.3112。
[0116]
产物结构式如下:
[0117][0118]
实施例18
[0119]
在反应器中,加入0.4毫摩尔苯甲酰基二苯基膦、0.2毫摩尔(1s,2s,4s,5r)
‑2‑
((r)
‑
叠氮基(6
‑
甲氧基喹啉
‑4‑
基)甲基)
‑5‑
乙烯基喹核苷和1毫升甲苯,40℃反应6小时后,反应液直接使用洗脱剂(v
石油醚
:v
乙酸乙酯
=4:1)通过硅胶柱层析得到三价磷取代的胺类化合物5pa,产率为51%,无色油状液体。
[0120]
产物检测数据为:1h nmr(400mhz,cdcl3)δ8.64(d,j=6.0hz,1h),8.03(d,j=12.4hz,1h),7.66(d,j=5.6hz,1h),7.60(s,1h),7.41(q,j=9.2hz,3h),7.20
‑
7.15(m,3h),7.00(q,j=10.3hz,2h),6.84(t,j=9.2hz,2h),6.75(t,j=10.0hz,2h),6.61(d,j=9.6hz,3h),6.49(t,j=9.6hz,2h),6.04
‑
5.92(m,1h),5.11
‑
5.03(m,2h),4.23
‑
4.12(m,1h),3.85(s,3h),3.61
‑
3.51(m,1h),3.27(dd,j=17.8,13.8hz,1h),2.94
‑
2.86(m,2h),2.35(s,1h),1.83(t,j=15.6hz,1h),1.74(s,1h),1.63
‑
1.55(m,2h),0.86(t,j=9.2hz,1h).
13
c nmr(100mhz,cdcl3)δ177.1(d,j
c
‑
f
=15.0hz),158.2,147.2,144.8,143.1,142.3,138.5,135.6(d,j
c
‑
f
=22.0hz),134.9(d,j
c
‑
f
=24.0hz),132.5,132.3,131.8,131.2,130.9,129.4,128.3,128.2,127.8,127.7,127.6,127.5,126.0,122.2,122.1,114.4,102.0,57.3(d,j
c
‑
f
=22.0hz),56.7(d,j
c
‑
f
=26.0hz),55.9(d,j
c
‑
f
=17.0hz),41.8,40.1,28.1(d,j
c
‑
f
=19.0hz),27.7.
31
p nmr(162mhz,cdcl3)δ41.65.hrms(esi)m/z calcd for c
39
h
39
n3o2p[m+h]
+
:612.2774,found 612.2778。
[0121]
产物结构式如下:
[0122][0123]
实施例19
[0124]
在反应器中,加入0.8毫摩尔苯甲酰基二苯基膦、0.2毫摩尔(4r,5r)
‑
4,5
‑
双(叠氮甲基)
‑
2,2
‑
二甲基
‑
1,3
‑
二氧戊环和1毫升甲苯,40℃反应8小时后,反应液直接使用洗脱剂(v
石油醚
:v
乙酸乙酯
=7:1)通过硅胶柱层析得到三价磷取代的胺类化合物5qa,产率为43%,无色
油状液体。
[0125]
产物检测数据为:1h nmr(400mhz,cdcl3)δ7.54(d,j=7.2hz,4h),7.45
‑
7.42(m,4h),7.40(s,1h),7.38
‑
7.32(m,21h),3.40(s,4h),3.33(s,2h).
13
c nmr(100mhz,cdcl3)δ177.0(d,j
c
‑
f
=32.0hz),137.1(d,j
c
‑
f
=3.0hz),135.5(d,j
c
‑
f
=19.0hz),135.2(d,j
c
‑
f
=17.0hz),132.6(d,j
c
‑
f
=7.0hz),132.4(d,j
c
‑
f
=7.0hz),130.2,129.8,129.5,128.7(d,j
c
‑
f
=6.0hz),128.6(d,j
c
‑
f
=6.0hz),128.2(d,j
c
‑
f
=6.0hz),128.1,108.9,77.1,48.7(d,j
c
‑
f
=7.0hz),26.7.
31
pnmr(162mhz,cdcl3)56.70.hrms(esi)m/z calcd for c
45
h
43
n2o4p2[m+h]
+
:737.2693,found 737.2696。
[0126]
产物结构式如下:
[0127][0128]
实施例20
[0129]
在反应器中,加入0.4毫摩尔苯甲酰基二苯基膦、0.2毫摩尔(3as,5r,6r,6as)
‑6‑
叠氮基
‑5‑
((s)
‑
2,2
‑
二甲基
‑
1,3
‑
二氧戊环
‑4‑
基)
‑
2,2
‑
二甲基四氢呋喃[2,3
‑
d][1,3]二恶唑和1毫升甲苯,40℃反应4小时后,反应液直接使用洗脱剂(v
石油醚
:v
乙酸乙酯
=4:1)通过硅胶柱层析得到三价磷取代的胺类化合物5ra,产率为79%,无色油状液体。
[0130]
产物检测数据为:1h nmr(400mhz,cdcl3)δ7.72
‑
7.69(m,2h),7.65
‑
7.61(m,2h),7.48(d,j=6.8hz,2h),7.36
‑
7.32(m,9h),5.52(d,j=4.0hz,1h),5.41(s,1h),3.97
‑
3.91(m,2h),3.78(t,j=10.2hz,2h),3.69(s,1h),1.55(s,3h),1.42(s,3h),1.30(s,3h),1.14(s,3h).
13
cnmr(100mhz,cdcl3)δ175.2(d,j
c
‑
f
=14.0hz),138.5,136.2(d,j
c
‑
f
=18.0hz),133.3,133.0,132.9,132.6,129.6,129.2,129.1,128.4,128.2,128.1,128.1,128.0,126.4(d,j
c
‑
f
=3.0hz),112.9,109.9,103.8,79.8,76.9,76.2(d,j
c
‑
f
=12.0hz),67.4,65.4(d,j
c
‑
f
=3.0hz),26.5,26.2,26.1,25.8.
31
p nmr(162mhz,cdcl3)54.38.hrms(esi)m/z calcd for c
31
h
35
no6p[m+h]
+
:548.2197,found 548.2202。
[0131]
产物结构式如下:
[0132][0133]
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的
保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1