基于催化发夹自组装恒温扩增技术检测核酸的通用探针及其应用
本发明属于分子生物学技术领域,具体涉及基于催化发夹自组装恒温扩增技术检测核酸的通用探针及其应用。
背景技术:
乳腺癌是全球女性最常见的恶性肿瘤。根据2020年全球癌症统计,女性乳腺癌已经超过肺癌,成为发病率最高的癌。由于乳腺癌病因尚不明确,早期诊治是降低乳腺癌死亡率、提高乳腺癌患者生存质量的关键。外泌体是活细胞分泌的可以进入体液循环的细胞外囊泡,具有圆形或杯状脂质双分子层结构,粒径为40~160nm之间,广泛存在于体液中,包括血液、尿液乳汁等。外泌体通过携带亲本细胞的一些蛋白质、rna、dna等物质可以反映亲本细胞的表型状态,特别是肿瘤细胞。肿瘤细胞分泌的外泌体在外周血中浓度明显高于非癌性细胞的外泌体,是研究肿瘤诊断生物标志物的宝贵来源。而众多研究表明,分泌到循环系统中的外泌体包裹的mirna/pirna是疾病诊断的一种新型分子标志物。microrna是一类18~24个核苷酸的非编码单链,在翻译水平上调控基因的表达。而pirna是一类24~32个核苷酸,和argonatue蛋白的piwi亚家族相互作用,在表观遗传基因蛋白调控中起重要作用。众多研究表明,microrna/pirna的表达情况和人类多种恶性肿瘤的发生、发展、诊断预后相关,稳定存在于体液中的microrna约有90%是包裹于外泌体中,因此说外泌体中的microrna、pirna被认为是潜在的疾病生物标志物。
目前检测rna的方法主要有northernblot、基因微阵列、实时定量荧光pcr(rt-qpcr)、基因表达系列分析、原位杂交、高通量测序、电化学分析等方法,每一种方法都各有长短,但上述方法应用于不易获得的微量外泌体样本中痕量rna测定时,仍需要一系列程序,如外泌体裂解、rna提取分离、cdna合成等,对外泌体样品消耗量较大,且步骤繁琐耗时,精密度较差,从而影响结果的准确度和可靠性。因此,寻找一种操作简便、选择性高、准确廉价、无需分离前处理而能直接检测循环外泌体中痕量标志物的有效方法非常必要。催化发夹自组装(catalytichairpinassembly,cha)作为一种等温核酸自组装扩增技术,是一种能够放大信号的dna循环回路。在微量目标核酸短链存在的情况下,通过toehold介导的链置换反应,使两种互补的亚稳定核酸发夹结构发生循环杂交自组装反应,产生大量双链dna产物,以产物中标记的荧光基团信号强度或变化指示目标核酸的含量。由于cha反应具有设计简单,背景低,周转率高的特点,目前已广泛应用于各种痕量检测物的扩增分析,主要包括核酸和蛋白质。而传统的cha扩增技术也存在着一定的局限性,如扩增所需的h1和h2寡核苷酸发夹结构的序列需根据检测目标microrna的序列来设计,每改变一个检测目标核酸,则需重新设计合成不同的h1和h2序列并优化反应条件,繁琐耗时,不适用于高通量筛查。同时,尚无将cha扩增技术用于pirna检测的报道。
技术实现要素:
本发明第一方面的目的,在于提供一组基于催化发夹自组装恒温扩增技术检测核酸的通用探针。
本发明第二方面的目的,在于提供一种包含本发明第一方面的通用探针的试剂盒。
本发明第三方面的目的,在于提供本发明第一方面的通用探针和/或第二方面的试剂盒在检测核酸中的应用。
本发明第四方面的目的,在于提供一种检测核酸的方法。
为了实现上述目的,本发明所采取的技术方案是:
本发明的第一个方面,提供一组通用探针,包含发夹探针h1和发夹探针h2;所述发夹探针h1的核苷酸序列如seqidno.4所示;所述发夹探针h2的核苷酸序列如seqidno.5所示。
优选地,所述发夹探针h1上修饰有第一荧光基团,所述发夹探针h2上修饰有第二荧光基团,且所述第一荧光基团与所述第二荧光基团之间可以发生荧光共振能量转移。
荧光共振能量转移(fluorescenceresonanceenergytransfer,fret)是指两个不同的荧光发色基团,其中一个荧光发色基团(供体)的发射光谱与另一荧光发色基团(受体)的吸收光谱有一定的重叠,当供体分子被激发后,受体与供体相距一定合适的距离(通常小于10nm),处于激发态的供体将把一部分或全部能量通过偶极子的介导转移给受体,使受体被激发,发射荧光。本发明在发夹探针h1和发夹探针h2上分别修饰第一荧光基团和第二荧光基团,在两个探针发生自组装循环扩增反应后,使杂交双链产物中两个荧光基团的距离靠近,导致荧光共振能量转移,根据受体荧光强度与供体荧光强度的比值可对目标核酸进行定量检测。
优选地,所述第一荧光基团和第二荧光基团选自(1)~(3):
(1)所述第一荧光基团为cy3,所述第二荧光基团为cy5;
(2)所述第一荧光基团为alexa488,所述第二荧光基团为cy3;
(3)所述第一荧光基团为fitc,所述第二荧光基团为rhodaminered。
本发明的第二个方面,提供一种包含本发明第一方面的通用探针的检测核酸的试剂盒。
一种定量检测核酸的试剂盒,包含本发明第一方面的通用探针。
优选地,所述核酸包括mirna和pirna;
所述试剂盒还包含启动发夹h0;
所述启动发夹h0从5’到3’依次包括:第一序列、第二序列和第三序列;
所述第一序列与所述发夹探针h1的5’端互补,第一序列的核苷酸序列如seqidno.17所示;
所述第二序列与所述核酸互补:
所述核酸为mirna时,所述第三序列与所述第一序列的3’端互补形成茎部分,所述第三序列的碱基数为7~12个;
所述核酸为pirna时,所述第三序列与所述第一序列的3’端及所述第二序列的5’端的三个碱基互补形成茎部分,所述第三序列的碱基数为7~12个。
优选地,所述核酸为mirna时,所述第三序列的碱基数为9~12个;
所述核酸为pirna时,所述第三序列的碱基数为10~12个。
优选地,所述核酸为pir-651时,所述启动发夹h0的核苷酸序列如seqidno.1所示。
优选地,所述核酸为mir-1246时,所述启动发夹h0的核苷酸序列如seqidno.2所示。
优选地,所述核酸为celmir-39时,所述启动发夹h0的核苷酸序列如seqidno.3所示。
优选地,所述试剂盒还包含nacl、缓冲液。
优选地,所述缓冲液为pbs、tris和hepes中的至少一种;进一步为pbs。
优选地,所述试剂盒还包含tritonx-100、蛋白酶k(proteinasek)。
优选地,所述试剂盒还包含蛋白酶抑制剂、核糖核酸酶a(rnasea)、十二烷基硫酸钠(sds)。
本发明的第三个方面,提供本发明第一方面的通用探针和/或第二方面的试剂盒在非疾病诊断用途的核酸检测中的应用。
优选地,所述核酸包括mirna和pirna。
本发明的第四个方面,提供一种非疾病诊断用途的核酸检测方法,用本发明第一方面的通用探针和/或第二方面的试剂盒检测待测样品,包括如下步骤:
将待测样品、启动发夹h0、发夹探针h1、发夹探针h2、nacl、缓冲液混合,35~50℃下孵育2~4h,测定荧光信号强度。
优选地,所述待测样品包括核酸、预处理后的包含核酸的外泌体和预处理后的包含核酸的血浆。
优选地,所述核酸包括mirna和pirna。
优选地,所述发夹探针h1的核苷酸序列如seqidno.4所示;所述发夹探针h2的核苷酸序列如seqidno.5所示。
优选地,所述发夹探针h1上修饰有第一荧光基团,所述发夹探针h2上修饰有第二荧光基团,且所述第一荧光基团与所述第二荧光基团之间可以发生荧光共振能量转移。
优选地,所述第一荧光基团和第二荧光基团选自(1)~(3):
(1)所述第一荧光基团为cy3,所述第二荧光基团为cy5;
(2)所述第一荧光基团为alexa488,所述第二荧光基团为cy3;
(3)所述第一荧光基团为fitc,所述第二荧光基团为rhodaminered。
所述启动发夹h0从5’到3’依次包括:第一序列、第二序列和第三序列;
所述第一序列与所述发夹探针h1的5’端互补,第一序列的核苷酸序列如seqidno.17所示;
所述第二序列与目标核酸互补:
所述核酸为mirna时,所述第三序列与所述第一序列的3’端互补形成茎部分,所述第三序列的碱基数为7~12个;
所述核酸为pirna时,所述第三序列与所述第一序列的3’端及所述第二序列的5’端的三个碱基互补形成茎部分,所述第三序列的碱基数为7~12个。
优选地,所述核酸为mirna时,所述第三序列的碱基数为9~12个;
所述核酸为pirna时,所述第三序列的碱基数为10~12个。
优选地,所述启动发夹h0、发夹探针h1、发夹探针h2的摩尔比为30:(50~80):(50~100);进一步为30:(50~80):100。
优选地,所述缓冲液为pbs、tris和hepes中的至少一种;进一步为pbs。
优选地,所述核酸为pir-651时,所述启动发夹h0的核苷酸序列如seqidno.1所示。
优选地,所述核酸为mir-1246时,所述启动发夹h0的核苷酸序列如seqidno.2所示。
优选地,所述核酸为celmir-39时,所述启动发夹h0的核苷酸序列如seqidno.3所示。
优选地,所述预处理后的包含核酸的外泌体通过如下方法得到:将包含核酸的外泌体、tritonx-100、蛋白酶k(proteinasek)混合,35~40℃孵育20~40min。
优选地,所述预处理后的包含核酸的血浆通过如下方法得到:将包含核酸的血浆与蛋白酶k(proteinasek)混合,35~40℃孵育20~40min;加入蛋白酶抑制剂,35~40℃孵育10~30min;加入核糖核酸酶a(rnasea)35~40℃孵育20~40min;加入十二烷基硫酸钠(sds);加入tritonx-100、蛋白酶k(proteinasek),35~40℃孵育20~40min。
优选地,所述测定荧光信号强度的方法为:在第一荧光基团的最大激发波长处激发,分别在第一、第二荧光基团的最大发射波长处测定荧光强度。
本发明的有益效果是:
本发明提供了一组通用探针,包含发夹探针h1、发夹探针h2,可用于各种目标核酸的检测,无需根据目标核酸的改变重新设计。
本发明提供了一种试剂盒,包含发夹探针h1、发夹探针h2和启动发夹h0,其中h1和h2的核苷酸序列为固定序列,仅根据所检测的目标核酸序列简单地改变h0发夹结构的第二序列和第三序列的核苷酸数量,即可检测不同的目标核酸,适用于高通量筛查,该试剂盒灵敏度高、检出限低、特异性高,具有较好的应用前景。
本发明提供的试剂盒通过添加tritonx-100、蛋白酶k(proteinasek)、蛋白酶抑制剂、核糖核酸酶a(rnasea)、十二烷基硫酸钠(sds),从而不需要分离提取外泌体、血浆中的核酸,可以直接用于检测血浆、外泌体,更加简单快捷。
本发明提供的核酸检测方法简单快捷、灵敏度高、检出限低、特异性高、成本低廉,具有较好的应用前景;并且本发明首次将恒温扩增技术用于检测pirna。
附图说明
图1是实施例中催化发夹自组装(cha)检测系统的原理图。
图2是实施例1中cha检测系统可行性验证的非变性凝胶电泳结果图。
图3是实施例1中cha检测系统可行性验证的荧光发射光谱结果图。
图4是实施例1中不同反应温度对mir-1246的cha检测效果的影响图。
图5是实施例1中不同缓冲液对mir-1246的cha检测效果的影响图。
图6是实施例1中不同h0、h1、h2的比例对mir-1246的cha检测效果的影响图。
图7是实施例1中茎部分不同碱基个数的h0对mir-1246的cha检测效果的影响图。
图8是实施例1中不同反应温度对pir-651的cha检测效果的影响图。
图9是实施例1中不同缓冲液对pir-651的cha检测效果的影响图。
图10是实施例1中不同h0、h1、h2的比例对pir-651的cha检测效果的影响图。
图11是实施例1中茎部分不同碱基个数的h0对pir-651的cha检测效果的影响图。
图12是实施例1中cha检测系统灵敏度和检出限检测结果图:其中,a是cha检测系统检测不同浓度的pir-651的荧光光谱图;b是cha检测系统检测不同浓度的mir-1246的荧光光谱图;c是cha检测系统检测不同浓度的celmir-39的荧光光谱图;d是fa(666nm处的荧光值)/fd(564nm处的荧光值)值与pir-651浓度的线性拟合曲线图;e是fa(666nm处的荧光值)/fd(564nm处的荧光值)值与mir-1246浓度的线性拟合曲线;f是fa(666nm处的荧光值)/fd(564nm处的荧光值)值与celmir-39浓度的线性拟合曲线。
图13是实施例1中cha检测系统特异性检测结果图:其中,a是mir-1246cha检测系统检测不同靶标的结果图;b是pir-651cha检测系统检测不同靶标的结果图。
图14是实施例2中cha检测系统检测mcf-7外泌体和mcf-10a外泌体的结果图。
图15是实施例3中cha检测系统检测血浆的结果图:其中,a是mir-1246cha检测系统检测血浆的散点图;b是pir-651cha检测系统检测血浆的散点图;c是celmir-39cha检测系统检测血浆的散点图;d是mir-1246cha检测系统的受试者工作特征曲线图;e是pir-651cha检测系统的受试者工作特征曲线图;***表示p<0.0001,ns表示p>0.05。
具体实施方式
以下通过具体的实施例对本发明的内容作进一步详细的说明。
应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。本实施例中所使用的材料、试剂等,如无特别说明,为从商业途径得到的试剂和材料。
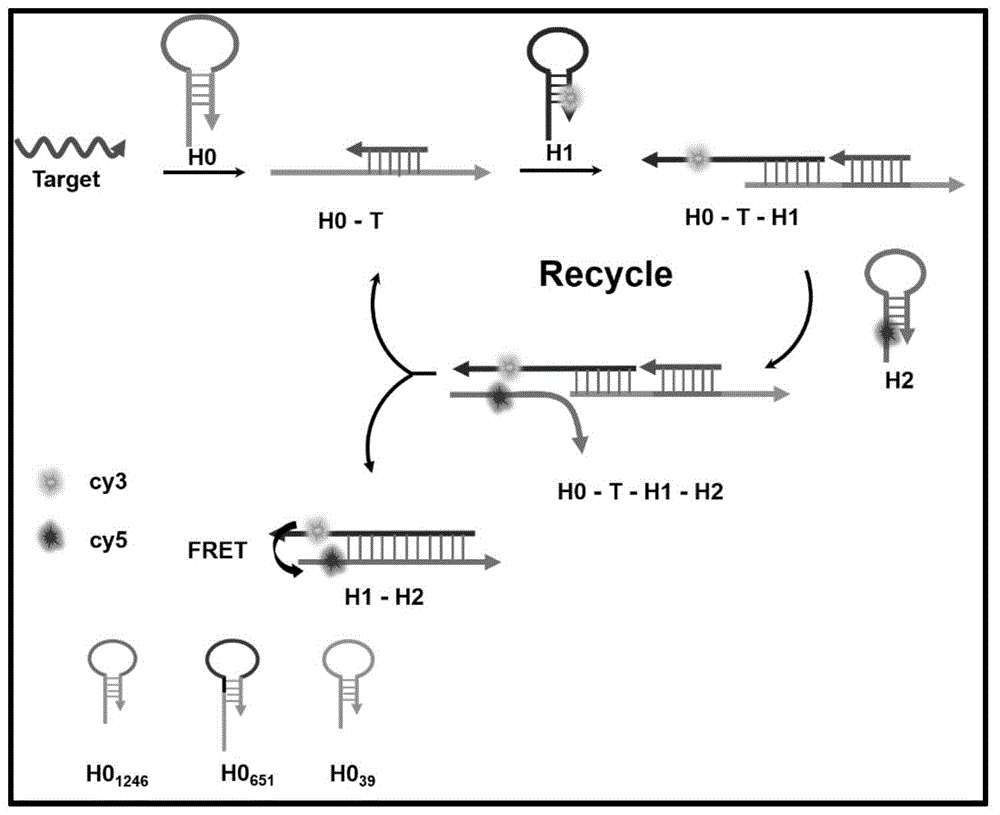
本发明原理如图1所示:本发明的试剂盒(cha通用检测系统)包括三个寡核苷酸链发夹结构:启动发夹h0、发夹探针h1-第一荧光基团和发夹探针h2-第二荧光基团,其中h1和h2为固定序列(seqidno.4、seqidno.5所示),启动发夹h0从5’到3’依次包括:第一序列、第二序列和第三序列;第一序列与发夹探针h1的5’端互补,第一序列的核苷酸序列如seqidno.17所示;第二序列与目标核酸互补;第三序列与第一序列的3’端互补形成茎区,第三序列的碱基数为7~12个。目标核酸首先通过与h0环上的核苷酸发生杂交反应打开h0,h0暴露出来的单链部分催化发夹探针h1-第一荧光基团和发夹探针h2-第二荧光基团发生自组装循环扩增反应,利用固定时间内生成的产物h1-h2杂交链中的第一荧光基团与第二荧光基团的能量共振转移荧光信号强度定量测定目标核酸。在这个检测系统中,只需改变h0环上的碱基或部分第三序列的碱基就可以实现不同靶标的检测。
实施例1cha检测系统的设计、可行性验证及测定条件优化
1.cha检测系统中启动发夹h0(h0651、h01246、h039)、发夹探针h1、发夹探针h2(发夹探针h1上标记有cy3、发夹探针h2上标记有cy5)的序列如表1所示。
表1动发夹h0(h0651、h01246、h039)、发夹探针h1、发夹探针h2的核苷酸序列表
注:h0651、h01246、h039中斜体部分为相同序列(seqidno.17)、下划线为stem部分(茎部分),cy3及cy5均在t碱基上修饰。
2.电泳实验及荧光实验验证可行性
(1)电泳实验
对cha检测系统中启动发夹h0(h0651、h01246、h039)、发夹探针h1、发夹探针h2进行非变性凝胶电泳实验:分别进行如下处理:取h1,h2,h1+h2,h0651+h1+h2,pir-651+h0651+h1+h2,h01246+h1+h2,mir-1246+h01246+h1+h2(h0终浓度为30nm,h1终浓度为50nm,h2终浓度为100nm,mir-1246/pir-651终浓度为10nm),加入nacl(终浓度200mm),补充pbs至总体积20μl,45℃反应3h,然后,进行凝胶电泳,结果如图2所示:当h1、h2、h0及其对应靶标均存在下才会产生反应的条带h1-h2,表明本检测系统的设计可行。
(2)荧光实验
对cha检测系统中启动发夹h0(h0651、h01246、h039)、发夹探针h1、发夹探针h2进行荧光实验:分别进行如下处理:取h1+h2,h0651+h1+h2,pir-651+h0651+h1+h2,h01246+h1+h2,mir-1246+h01246+h1+h2(h0终浓度为30nm,h1终浓度为50nm,h2终浓度为100nm,mir-1246/pir-651终浓度为1nm),加入nacl(终浓度200mm),补充pbs至总体积100μl,45℃反应3h,然后进行荧光检测,结果如图3所示:当检测体系中仅含h1+h2或h0+h1+h2时,只能获得非常弱的背景荧光信号,加入对应靶标后导致荧光强度急剧增加,表明只有目标物存在时才能发生h0与h1、h2的反应,进一步说明该检测系统的设计可行。
3.cha检测系统溶液体系下测定条件的优化
(1)mir-1246cha检测系统测定条件优化
1)反应温度的优化
在200μl的ep管中加入终浓度为30nm的h01246、终浓度为50nm的h1、终浓度为100nm的h2及终浓度为200mm的nacl后,分别加入终浓度为0、50pm、200pm及1nm的靶标(seqidno.6),用pbs补充至总体积为100μl,分别于37℃、40℃、45℃避光孵育3h后用荧光分光光度计以540nm为激发波长测定564nm(fd)及666nm(fa)处的荧光强度值,平行两组实验,结果如图4所示:在反应温度为45℃时,测定灵敏度最高,因而该检测系统选用45℃为反应温度。
2)反应缓冲体系的优化
在200μl的ep管中加入终浓度为30nm的h01246、终浓度为50nm的h1、终浓度为100nm的h2及终浓度为200mm的nacl后,分别加入终浓度为0、50pm、200pm及1nm的靶标(seqidno.6),然后分别用pbs、tris、hepes缓冲溶液补充至总体积为100μl,45℃避光孵育3h后用荧光分光光度计以540nm为激发波长测定564nm(fd)及666nm(fa)处的荧光强度值,平行两组实验,结果如图5所示:在反应缓冲体系为pbs时,测定灵敏度最高,因而该检测系统选用pbs为反应缓冲体系。
3)h0、h1、h2比例的优化
在200μl的ep管中分别加入终浓度为50nm的h1和终浓度为100nm的h2、终浓度为50nm的h1和终浓度为50nm的h2以及终浓度为80nm的h1和终浓度为100nm的h2,分别加入终浓度为30nm的h01246及终浓度为200mm的nacl后,分别加入终浓度为0、50pm、200pm及1nm的靶标(seqidno.6),用pbs补充至总体积为100μl,45℃避光孵育3h后用荧光分光光度计以540nm为激发波长测定564nm(fd)及666nm(fa)处的荧光强度值,平行两组实验,结果如图6所示:在h0:h1:h2=30:50:100(nm)时,空白信号小,灵敏度最高,因而该检测系统选用h0:h1:h2=30:50:100(nm)为反应比例。
4)h0stem部分碱基个数的优化
在200μl的ep管中分别加入中浓度为30nm的stem部分(茎部分)碱基个数为7个、9个的h01246,加入终浓度为50nm的h1和终浓度为100nm的h2及终浓度为200mm的nacl后,分别加入终浓度为0、50pm、200pm及1nm的靶标(seqidno.6),用pbs补充至总体积为100μl,45℃避光孵育3h后用荧光分光光度计以540nm为激发波长测定564nm(fd)及666nm(fa)处的荧光强度值,平行两组实验,结果如图7所示:h01246stem部分碱基个数为9个时,空白信号小,检测灵敏度高,因而该检测系统选用stem部分碱基个数为9个的h01246。
(2)pir-651cha检测系统测定条件优化
1)反应温度的优化
在200μl的ep管中加入终浓度为30nm的h0651、终浓度为50nm的h1、终浓度为100nm的h2及终浓度为200mm的nacl后,分别加入终浓度为0、50pm、200pm及1nm的靶标(seqidno.7),用pbs补充至总体积为100μl,分别于37℃、40℃、45℃避光孵育3h后用荧光分光光度计以540nm为激发波长测定564nm(fd)及666nm(fa)处的荧光强度值,平行两组实验,结果如图8所示:在反应温度为45℃时,测定灵敏度最高,因而该检测系统选用45℃为反应温度。
2)反应缓冲体系的优化
在200μl的pcr管中加入终浓度为30nm的h0651、终浓度为50nm的h1、终浓度为100nm的h2及终浓度为200mm的nacl后,分别加入终浓度为0、50pm、200pm及1nm的靶标(seqidno.7),然后分别用pbs、tris、hepes缓冲溶液补充至总体积为100μl,45℃避光孵育3h后用荧光分光光度计以540nm为激发波长测定564nm(fd)及666nm(fa)处的荧光强度值,平行两组实验,结果如图9所示:在反应缓冲体系为pbs时,测定灵敏度最高,因而该检测系统选用pbs为反应缓冲体系。
3)h0、h1、h2比例的优化
在200μl的ep管中分别加入终浓度为50nm的h1和终浓度为100nm的h2、终浓度为50nm的h1和终浓度为50nm的h2以及终浓度为80nm的h1和终浓度为100nm的h2,分别加入终浓度为30nm的h0651及终浓度为200mm的nacl后,分别加入终浓度为0、50pm、200pm及1nm的靶标(seqidno.7),用pbs补充至总体积为100μl,45℃避光孵育3h后用荧光分光光度计以540nm为激发波长测定564nm(fd)及666nm(fa)处的荧光强度值,平行两组实验,结果如图10所示:在h0:h1:h2=30:50:100(nm)时,空白信号小,灵敏度最高,因而该检测系统选用h0:h1:h2=30:50:100(nm)为反应比例。
4)h0stem部分碱基个数的优化
在200μl的ep管中分别加入中浓度为30nm的stem部分(茎部分)碱基个数为7个、10个、12个的h0651,加入终浓度为50nm的h1和终浓度为100nm的h2及终浓度为200mm的nacl后,分别加入终浓度为0、50pm、200pm及1nm的靶标(seqidno.7),用pbs补充至总体积为100μl,45℃避光孵育3h后用荧光分光光度计以540nm为激发波长测定564nm(fd)及666nm(fa)处的荧光强度值,平行两组实验,结果如图11所示:h0651stem部分碱基个数为10个时,空白信号小,检测灵敏度高,因而该检测系统选用stem部分碱基个数为10个的h0651。
因此,pir-651cha检测系统测定条件除h0651stem部分最佳碱基个数为10个外其余反应条件均与mir-1246cha检测系统一致,进一步验证了该检测系统为一个通用型的检测系统,仅需改变h0就可以实现不同靶标的测定。
(3)cha检测系统的检测性能
1.cha检测系统灵敏度、检出限和线性范围
在200μl的ep管中加入终浓度为30nm的h0、终浓度为50nm的h1、终浓度为100nm的h2及终浓度为200mm的nacl后,分别加入终浓度为0-5000pm的靶标(mir-1246,seqidno.6;pir-651,seqidno.7;cel-mir-39,ucaccggguguaaaucagcuug,seqidno.8),用pbs补充至总体积为100μl,分别于45℃避光孵育3h后用荧光分光光度计测定其荧光信号。以540nm为激发波长扫描555~700nm处的荧光值,荧光光谱如图12中a、b、c所示:各检测系统产生的荧光信号随相应靶标浓度增加而增加;以540nm为激发波长测定564nm(fd)及666nm(fa)处的荧光值,结果如图12中d、e、f所示:对pir-651对pir-651检测的线性范围为50pm-1nm,线性拟合曲线为y=0.6431x+0.1743,响应灵敏度为0.6431fold/nm,相关系数为0.9968,检出限为19.5pm;对mir-1246检测的线性范围为50pm-1nm,线性拟合曲线为y=0.4846x+0.2354,响应灵敏度为0.4836fold/nm,相关系数为0.9938,检出限为25.9pm;对cel-mir-39检测的线性范围为50pm-1nm,线性拟合曲线为y=0.4857x+0.2326,响应灵敏度为0.4857fold/nm,相关系数为0.9893,检出限为25.8pm,表明该检测系统在溶液体系中对于不同靶标的检测均具有较好的灵敏度,对于作为阴性质控的cel-mir-39也是具有较低的检出限。
2.cha检测系统特异性
为了研究该检测系统是否对靶标特异性响应,设计合成了一系列与靶标相差1个、2个或3个碱基差异的random序列以及外泌体中含量较高的mir-21(序列见表2)。在200μl的ep管中加入终浓度为30nm的h0651(stem部分碱基个数为10个)/h01246(stem部分碱基个数为9个),分别加入终浓度为50nm的h1、终浓度为100nm的h2及终浓度为200mm的nacl后,分别加入终浓度为1nm的靶标(seqidno.6、7、9、10、11、12、13、14、15、16),用pbs补充至总体积为100μl,45℃避光孵育3h后用荧光分光光度计测定其荧光信号。以540nm为激发波长测定564nm(fd)及666nm(fa)处的荧光值,结果如图13所示:该检测系统可以区分单碱基差异,具有较好的特异性。
表2.cha检测系统选择性实验所用dna/rna序列
注:下划线“____”的序列与mir-1246部分或完全相同(其中dna中的“t”等同于rna中的“u”);下划线“___”的序列与pir-651部分或完全相同。
实施例2cha检测系统应用于外泌体检测
分别在200μl的ep管中分别加入终浓度为0、1×106个/μl,5×106个/μl,1×107个/μl,5×107个/μl,1×108个/μl和2×108个/μl的mcf-7外泌体(用mcf-7细胞培养上清液经超高速离心分离获得),加入终浓度为1%的tritonx–100以及终浓度为84.5μg/ml的proteinasek于37℃孵育30min,再加入终浓度为30nm的h0(h0651(stem部分碱基个数为10个)/h01246(stem部分碱基个数为9个)/h039(stem部分碱基个数为12个))、终浓度为50nm的h1、终浓度为100nm的h2及终浓度为200mm的nacl后,用pbs补充至总体积为100μl,于45℃避光孵育3h后用荧光分光光度计以540nm为激发波长测定564nm(fd)及666nm(fa)处的荧光值,样品溶液产生的fa/fd值与空白溶液(外泌体加入浓度为0)的fa/fd值的比值随外泌体浓度的变化如图14所示:产生的荧光信号与mcf-7外泌体的浓度呈显著正相关,当检测靶标为mir-1246,外泌体浓度为1×106个/μl时产生的信号与空白值已有明显差异,显示了较低的检测限;当检测靶标为pir-651,外泌体浓度为5×106个/μl时产生的信号与空白背景值已有明显差异,而mir-39产生的信号不随外泌体浓度的变化而变化,均接近空白背景信号,质控信号为阴性,表明另外两个检测系统(mir-1246、pir-651)产生的信号是探针与检测到的外泌体中相应靶标的响应信号,而非是与外泌体表面蛋白或超高速离心分离外泌体时共沉淀的杂质产生的假阳性信号。
同时,检测正常乳腺上皮细胞mcf-10a外泌体中mir-1246与pir-651的相对含量(方法同mcf-7外泌体),结果如图14所示:产生的荧光信号与mcf-10a外泌体的浓度呈显著正相关,但mcf-10a外泌体内相应靶序列的信号均低于mcf-7的,表示mcf-10a的外泌体中也存在靶mir-1246和pir-651,但其含量低于mcf-7外泌体,这与二代测序结果一致,具体如表3所示。
表3.mcf-7和mcf-10细胞分泌的外泌体中hsa-mir-1246和has-pir-651相对表达量的二代测序结果(通过bgiseq-500平台测定)
实施例3cha检测系统应用于临床血浆样本的检测
分别取从南方医科大学南方医院检验科收集的乳腺癌患者和健康人对照组的血浆标本数例,100μl进行前处理:首先加入proteinasek(终浓度为65μg/ml)37℃孵化30min,以破坏血浆中游离的蛋白,再加入蛋白酶抑制剂pmsf(终浓度为5mm)室温下孵化20min终止过量的proteinasek,接着加入rnasea(终浓度为4u/ml)37℃孵化30min以破坏血浆外泌体外游离的rna,然后加入sds(终浓度为0.2%)抑制过量的rnasea,再加入终浓度为1%的tritonx-100和proteinasek(终浓度为84μg/ml)37℃孵育40min后经2500×g离心5min,取95μl上清与加入终浓度为30nm的h0(h0651(stem部分碱基个数为10个)/h01246(stem部分碱基个数为9个)/h039(stem部分碱基个数为12个))、终浓度为50nm的h1、终浓度为100nm的h2及终浓度为200mm的nacl后,用pbs补充至总体积为100μl,于45℃避光孵育3h后用荧光分光光度计以540nm为激发波长测定564nm(fd)及666nm(fa)处的荧光值,结果如图15所示:当检测mir-1246时,t检验显示乳腺癌患者组与正常对照组的平均信号水平有显著差异(p<0.0001)(图15中a);通过受试者工作特征曲线(roc)图说明在最佳截断值1.25处阳性敏感度为89.7%,特异性为100%,曲线下面积为0.9861(图15中d);当检测pir-651时,t检验显示乳腺癌患者组与正常对照组的平均信号水平有显著差异(p<0.0001)(图15中b);通过受试者工作特征曲线(roc)图说明在最佳截断值1.14处阳性敏感度为73.3%,特异性为100%,曲线下面积为0.9233(图15中e);而阴性质控检测系统所产生的信号在两者间没有差别(图15中c);表明该系统应用于临床样本也是可行的并且具有较好的灵敏度和准确性。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
sequencelisting
<110>南方医科大学
<120>基于催化发夹自组装恒温扩增技术检测核酸的通用探针及其应用
<130>
<160>17
<170>patentinversion3.5
<210>1
<211>61
<212>dna
<213>人工序列
<400>1
aaaccgttaccattacagtgatgacgctttccaaggcacgggcccctctctgtcatcact60
g61
<210>2
<211>50
<212>dna
<213>人工序列
<400>2
aaaccgttaccattacagtgatcctgctccaaaaatccattatcactgta50
<210>3
<211>56
<212>dna
<213>人工序列
<400>3
aaaccgttaccattacagtgatcaagctgatttacacccggtgaatcactgtaatg56
<210>4
<211>51
<212>dna
<213>人工序列
<400>4
atcactgtaatggtaacggtttggattccgaggcataccgttaccattaca51
<210>5
<211>54
<212>dna
<213>人工序列
<400>5
aacggtatgcctcggaatccaaaccgttaccattacaggtttggattccgaggc54
<210>6
<211>19
<212>rna
<213>homosapiens
<400>6
aauggauuuuuggagcagg19
<210>7
<211>29
<212>rna
<213>homosapiens
<400>7
agagaggggcccgugccuuggaaagcguc29
<210>8
<211>22
<212>rna
<213>caenorhabditiselegans
<400>8
ucaccggguguaaaucagcuug22
<210>9
<211>22
<212>rna
<213>homosapiens
<400>9
uagcuuaucagacugauguuga22
<210>10
<211>19
<212>dna
<213>人工序列
<400>10
aatggatttttggagcagt19
<210>11
<211>19
<212>dna
<213>人工序列
<400>11
aatggattcttggagcagg19
<210>12
<211>19
<212>dna
<213>人工序列
<400>12
aatggatttttggagcaat19
<210>13
<211>19
<212>dna
<213>人工序列
<400>13
aatggattcttggtgcagg19
<210>14
<211>29
<212>dna
<213>人工序列
<400>14
agagaggggcccgtgccttggaaagcgac29
<210>15
<211>29
<212>dna
<213>人工序列
<400>15
agagaggggcccgtgccttggaaagcgag29
<210>16
<211>29
<212>dna
<213>人工序列
<400>16
tgagaggggcccgtgccttggaaagcgag29
<210>17
<211>22
<212>dna
<213>人工序列
<400>17
aaaccgttaccattacagtgat22
- 还没有人留言评论。精彩留言会获得点赞!