一种用于制备磷脂酰乙醇胺的中间体及其制备方法与流程
1.本发明涉及一种用于制备磷脂酰乙醇胺的中间体及其制备方法,以及在制备磷脂酰乙醇胺或其胺基聚乙二醇衍生物中的应用。
背景技术:
2.脂质体(liposome)是一种类似生物膜结构的双分子层闭合囊泡,通常由磷脂等双亲性分子在水溶液中定向排列自发形成,具有细胞亲和性、可生物降解、无抗原性等特点,是一种靶向药物载体,在医药、保健、化妆品等领域得到广泛的研究和应用。当药物以脂质体的形式进行输送时,在稳定性、吸收及体内分布、生物利用率等方面都有很大的提高。
3.磷脂是构成脂质体的主要成分,通常由一个亲水性基团(一个水溶性头部,由磷酸和水溶性分子如胆碱、丝氨酸酯化形成)和两个亲脂性基团(两个疏水性尾部,为两个较长的平行的烃基链)组成,是一种双亲性结构分子。根据来源的不同,可将制备脂质体所使用的磷脂划分为天然磷脂和合成磷脂两类。天然磷脂是从蛋黄和大豆中提取而来,主要以混合物的形式呈现。合成磷脂则以化学合成的方式获得,具有性质稳定、抗氧化性强、成品稳定等特点。此外,合成磷脂具有比较固定的相变温度,可以根据需要控制官能团,因此性质相对单一、稳定。是目前国内外制备脂质体时首选的辅料。
4.二脂肪酰磷脂酰乙醇胺(如式ii所示)及其胺基聚乙二醇化衍生物(如式i所示)是使用非常广泛的合成磷脂,被应用于众多上市的脂质体药物中。在磷脂的亲水链端采用聚乙二醇修饰,可以制得长循环脂质体。静脉注射以后,长循环脂质体不会迅速被组织清除,药物在血液中的循环时间得以延长,从而增加进入病理组织的机会。
[0005][0006]
合成二脂肪酰磷脂酰乙醇胺的关键步骤在于如何高效地构建两个膦氧键,目前常用的方法是通过二脂肪酰甘油醇酯,膦试剂和胺基经过保护的乙醇胺三组分缩合反应来进行。在膦试剂的选择上,可以采用五价的膦酰化试剂(o=px3)和三价的亚膦酰化试剂(px3)。直接使用膦酰化试剂虽然可以避免缩合完成后磷原子位点的氧化反应,但是对于位阻比较大的醇(如长链的二脂肪酰甘油醇酯),五价膦试剂往往存在反应效率低,缩合产率低的缺点(j.org.chem.1994,59,4805-4820)。而且反应中直接或者间接(改性的五价膦试剂)使用到的pocl3为剧毒品,试剂较难获取,对人和环境的危害更大。亚膦酰化试剂px3对位阻较大的底物具有更好的反应活性,但是常规的pcl3非常活泼,醇片段与其进行缩合时,往往存在中间体不稳定,容易过度反应等缺点,即两个相同的醇片段连接到膦试剂上,从而造成了总收率的损失。为了实现更好的反应选择性,需要对其结构进行改性。
[0007]
文献和专利中采用简单的醇试剂对pcl3进行改性,从而改善其反应活性和中间体的稳定性。醇试剂也可以作为保护基,在缩合完成以后进行脱保护从而获得二脂肪酰膦酯
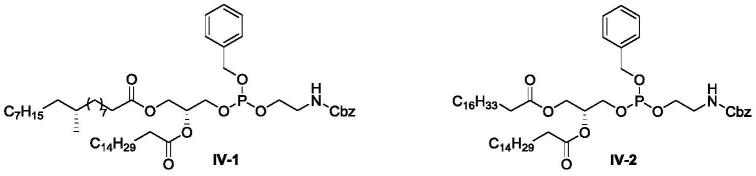
酰乙醇胺。所用的醇试剂如2-氰基乙醇(cn108727426a),甲醇、2-三甲基硅基乙醇(j.org.chem.1994,59,4805-4820),苯酚(j.med.chem.1994,37,4118-4129)中,但是这些保护基存在价格昂贵,或者脱保护条件苛刻等缺点。另一方面,在二脂肪酰磷脂酰乙醇胺的合成过程中,中间体iv-a和iii-b中胺基保护基ra的选择以及胺基保护基ra和羟基保护基rb的匹配也很重要。例如,用cbz保护胺基(ra=cbz)的合成过程中(j.lipid res.,2010,51,1017),钯碳脱除cbz过程中中间体的稳定性以及催化剂对产物的吸附等因素造成收率偏低,从iv-a到iii-b到ii的两步总收率仅为54%。另外,昂贵的钯碳价格、氢化设备的投入以及氢化反应的安全性等因素使得二脂肪酰磷脂酰乙醇胺的合成成本显著升高。
[0008][0009]
综上所述,亟需开发一种反应效率高,条件温和,成本低廉,易于放大的方法来进行二脂肪酰磷脂酰乙醇胺及其胺基聚乙二醇化衍生物的合成。
技术实现要素:
[0010]
针对已报道的二脂肪酰膦酯酰乙醇胺的合成方法存在缩合效率低(五价膦酰化试剂),保护基成本高或脱保护条件苛刻(三价膦酰化试剂)造成收率偏低等不足之处,本发明以如式vi所示的化合物为亚膦酰化试剂,经温和而高效的三组分缩合反应后,对膦原子进行氧化并进行简易的保护基脱除反应,得到二脂肪酰膦酯酰乙醇胺,并对其进行聚乙二醇修饰。特别是对中间体iv-a和iii-b中胺基保护基ra的选择以及胺基保护基ra和羟基保护基rb的脱除等做了大量的筛选工作,发现通过如式iv、iva和iii所示的化合物可以高效地合成二脂肪酰膦酯酰乙醇胺及其聚乙二醇修饰化合物。该方法反应条件温和,成本低廉,合成收率高且纯化简便,所得的产物具有非常高的纯度,适于大规模生产如式ii所示的所示的二脂肪酰膦酯酰乙醇胺以及如式i所示的胺基聚乙二醇化二脂肪酰膦酯酰乙醇胺。
[0011][0012][0013]
本发明提供一种如式iv所示的化合物,
[0014][0015]
其中,ar为取代或非取代的芳基;r1,r2分别独立地为c
3-27
直链或支链、饱和或不饱和烷基;r3,r4分别独立地为氢或c
1-4
烷基;ra为胺基保护基;化合物的构型可以是r型、s型或外消旋型;如式vi所示的化合物不包含如式iv-1和iv-2所示的化合物:
[0016][0017]
本发明提供一种如式iva所示的化合物,
[0018][0019]
其中,ar为取代或非取代的芳基;r1,r2分别独立地为c
3-27
直链或支链、饱和或不饱和烷基;r3,r4分别独立地为氢或c
1-4
烷基;化合物的构型可以是r型、s型或外消旋型。
[0020]
本发明一个优选的实施方案中,ar为取代或非取代的苯基;分别独立地选自花生酰、油酰、硬脂酰、棕榈酰、月桂酰;r3,r4分别为氢;化合物iva的构型为r构型;
[0021]
本发明还提供一种如式iv所示的化合物的制备方法,其特征在于,通过如式vii所示的化合物、如式vi所示的化合物,以及如式v所示的化合物经过缩合反应制得,
[0022][0023]
其中,ar为取代或非取代的芳基;r1,r2分别独立地为c
3-27
直链或支链、饱和或不饱和烷基;r3,r4分别独立地为氢或c
1-4
烷基;ra为胺基保护基;x和y分别独立地为离去基团,优选为氯,溴,碘或取代的胺基;化合物的构型可以是r型、s型或外消旋型。如式vi所示的化合物不包含如式iv-1和iv-2所示的化合物:
[0024][0025]
本发明还提供一种如式iva所示的化合物的制备方法,其特征在于,通过如式vii所示的化合物、如式vi所示的化合物,以及如式va所示的化合物经过缩合反应制得,
[0026][0027]
其中,ar为取代或非取代的芳基;r1,r2分别独立地为c
3-27
直链或支链、饱和或不饱和烷基;r3,r4分别独立地为氢或c
1-4
烷基;x和y分别独立地为离去基团,优选为氯,溴,碘或取代的胺基;化合物的构型可以是r型、s型或外消旋型。
[0028]
本发明的一个优选的实施方案中,ar优选为取代或非取代的苯基;分别独立地选自花生酰、油酰、硬脂酰、棕榈酰、月桂酰;r3,r4分别为氢;x、y优选为氯、二异丙基胺基;化合物vii的构型为s构型;化合物iva的构型为r构型;
[0029]
本发明的一个优选的实施方案中,包含以下步骤:
[0030]
在茄形瓶中称入化合物vi和含氮试剂,加入dcm溶解,将化合物vii滴加入上述反应液,滴加完后升至室温搅拌至tlc显示原料转化完全。反应液用冰水浴降温,再加入化合物va,滴加完升温至室温搅拌至tlc显示反应完全。粗品浓缩后柱层析纯化得到化合物iva;
[0031]
所述的含氮试剂优选四氮唑、苯基四氮唑。
[0032]
本发明还提供一种如式iii所示的化合物,其特征在于,
[0033][0034]
其中,ar为取代或非取代的芳基;r1,r2分别独立地为c
3-27
直链或支链、饱和或不饱和烷基;r3,r4分别独立地为氢或c
1-4
烷基;化合物的构型可以是r型、s型或外消旋型。
[0035]
本发明还提供一种如式iii所示的化合物的制备方法,其特征在于,通过如式iva所示的化合物经过氧化反应制得,
[0036][0037]
所述反应优选在氧化剂存在的条件下进行;所述的氧化剂优选为间氯过氧苯甲酸,双氧水,过氧叔丁醇等。
[0038]
本发明还提供一种如式iii-a所示的化合物的制备方法,其特征在于,通过如式iv所示的化合物经过氧化反应制得,
[0039][0040]
所述反应优选在氧化剂存在的条件下进行;所述的氧化剂优选为间氯过氧苯甲酸,双氧水,过氧叔丁醇等;如式vi所示的化合物不包含如式iv-1和iv-2所示的化合物:
[0041][0042]
本发明还提供一种如式ii所示的二脂肪酰磷脂酰乙醇胺化合物的制备方法,其特征在于,通过如式iii所示的化合物在酸性条件下水解脱保护反应制得,
[0043][0044]
ar为取代或非取代的芳基;r1,r2分别独立地为c
3-27
直链或支链、饱和或不饱和烷基;r3,r4分别独立地为氢或c
1-4
烷基;所涉及的中间体或产物的构型可以是r型、s型或外消旋型。所述的酸性条件所用的酸为三氟乙酸、盐酸、氢溴酸、甲烷磺酸、对甲苯磺酸等。
[0045]
本发明还提供一种如式ii所示的二脂肪酰磷脂酰乙醇胺化合物的制备方法,其特征在于,其特征在于包含如下步骤:
[0046][0047]
其中,ar为取代或非取代的芳基;r1,r2分别独立地为c
3-27
直链或支链、饱和或不饱
和烷基;r3,r4分别独立地为氢或c
1-4
烷基;ra为胺基保护基;如式vi所示的化合物不包含如式iv-1和iv-2所示的化合物:
[0048][0049]
具体来说,该合成方法包括以下步骤:
[0050]
1)式iv化合物经过氧化反应得到如式iii-a所示的化合物;所述反应优选在氧化剂存在的条件下进行;所述的氧化剂优选为间氯过氧苯甲酸,双氧水,过氧叔丁醇等;
[0051]
2)式iii-a化合物经过脱保护反应得到如式ii所示的化合物或其药学上可接受的盐;所述的脱保护反应可以是同时脱除两个保护基,也可以是分步脱除两个保护基。分步脱除两个保护基时,可以按照先脱除胺基保护基再脱除膦酸保护基的顺序,也可以按照先脱除膦酸保护基再脱除胺基保护基的顺序。脱除保护基的条件可以是酸性条件,碱性条件,或者催化加氢还原条件;
[0052]
3)可选地,式ii化合物可以以内盐的形式存在,也进一步与酸反应成盐;所述的酸包括但不限于盐酸、三氟乙酸、氢溴酸、氢碘酸、硫酸、对甲苯磺酸等;
[0053]
本发明还提供一种如式ii所示的二脂肪酰磷脂酰乙醇胺化合物的制备方法,其特征在于,其特征在于包含如下步骤:
[0054][0055]
其中,ar为取代或非取代的芳基;r1,r2分别独立地为c
3-27
直链或支链、饱和或不饱和烷基;r3,r4分别独立地为氢或c
1-4
烷基。
[0056]
具体来说,该合成方法包括以下步骤:
[0057]
1)式iva化合物经过氧化反应得到如式iii所示的化合物;所述反应优选在氧化剂存在的条件下进行;所述的氧化剂优选为间氯过氧苯甲酸,双氧水,过氧叔丁醇等;
[0058]
2)式iii化合物经过酸性条件下脱保护反应得到如式ii所示的化合物或其药学上可接受的盐;所述的酸性条件所用的酸为三氟乙酸、盐酸、氢溴酸、甲烷磺酸、对甲苯磺酸等;
[0059]
3)可选地,式ii化合物可以以内盐的形式存在,也进一步与酸反应成盐;所述的酸包括但不限于盐酸、三氟乙酸、氢溴酸、氢碘酸、硫酸、对甲苯磺酸等;
[0060]
本发明一个优选的实施方案中,ar优选为取代或非取代或非取代的苯基;分别独立地选自花生酰、油酰、硬脂酰、棕榈酰、月桂酰;r3,r4分别为氢;化合物iva、iii、ii的构型为r构型。
[0061]
在一个特别优选的实施方案中,本发明提供如式iia所示的二脂肪酰磷脂酰乙醇
胺化合物的合成路线如下:
[0062][0063]
其中,分别独立地选自花生酰、油酰、硬脂酰、棕榈酰、月桂酰。
[0064]
具体来说,该合成方法包括以下步骤:
[0065]
1)式ivb化合物经过氧化反应得到如式iiia所示的化合物;所述反应优选在氧化剂存在的条件下进行;所述的氧化剂优选为间氯过氧苯甲酸,双氧水,过氧叔丁醇等;
[0066]
2)式iiia化合物经过脱保护反应得到如式iia所示的化合物或其药学上可接受的盐;所述的脱保护反应为在酸性条件下同时脱除两个保护基。在一个示例的反应条件下,中控显示先脱除boc保护基,后脱除苄基保护基;所述的酸性条件所用的酸为三氟乙酸、盐酸、氢溴酸、甲烷磺酸、对甲苯磺酸等;
[0067]
3)可选地,式iia化合物可以以内盐的形式存在,也进一步与酸反应成盐;所述的酸包括但不限于盐酸、三氟乙酸等;
[0068]
本发明还提供一种如式ii所示的二脂肪酰磷脂酰乙醇胺化合物的制备方法,其合成路线如下:
[0069][0070]
其中,ar为取代或非取代的芳基;r1,r2分别独立地为c
3-27
直链或支链、饱和或不饱和烷基;r3,r4分别独立地为氢或c
1-4
烷基;x和y分别独立地为离去基团,优选为氯,溴,碘或取代的胺基;化合物的构型可以是r型、s型或外消旋型。
[0071]
具体来说,该合成方法包括以下步骤:
[0072]
1)式viii化合物经过脱保护反应得到如式vii所示的化合物;所述的脱保护反应优选在酸性或氧化性试剂的作用下进行;所述的酸性或氧化性试剂优选为硝酸铈铵;
[0073]
2)式vii化合物与式vi所示的化合物和式va所示的化合物经过缩合反应得到如式iva所示的化合物;所述的缩合反应优选在含氮试剂的作用下进行;所述的含氮试剂优选为四氮唑、苯基四氮唑等;
[0074]
3)式iva化合物经过氧化反应得到如式iii所示的化合物;所述反应优选在氧化剂存在的条件下进行;所述的氧化剂优选为间氯过氧苯甲酸,双氧水,过氧叔丁醇等;
[0075]
4)式iii化合物经过酸性条件下脱保护反应得到如式ii所示的化合物或其药学上
可接受的盐;所述的酸性条件所用的酸为三氟乙酸、盐酸、氢溴酸、甲烷磺酸、对甲苯磺酸等;
[0076]
5)可选地,式ii化合物可以以内盐的形式存在,也进一步与酸反应成盐;所述的酸包括但不限于盐酸、三氟乙酸、氢溴酸、氢碘酸、硫酸、对甲苯磺酸等;
[0077]
本发明一个优选的实施方案中,ar优选为取代或非取代的苯基;分别独立地选自花生酰、油酰、硬脂酰、棕榈酰、月桂酰;r3,r4分别为氢;x、y优选为氯、二异丙基胺基;化合物iva、iii、ii的构型为r构型;
[0078]
在一个特别优选的实施方案中,本发明提供如式iia所示的二脂肪酰磷脂酰乙醇胺化合物的合成路线如下:
[0079][0080]
其中,分别独立地选自花生酰、油酰、硬脂酰、棕榈酰、月桂酰。
[0081]
具体来说,该合成方法包括以下步骤:
[0082]
1)式viiia化合物经过脱保护反应得到如式viia所示的化合物;所述的脱保护反应优选在酸性或氧化性试剂的作用下进行;所述的酸性或氧化性试剂优选为硝酸铈铵;
[0083]
2)式viia化合物与式via所示的化合物和式va所示的化合物经过缩合反应得到如式ivb所示的化合物;所述的缩合反应优选在含氮试剂的作用下进行;所述的含氮试剂优选为四氮唑、苯基四氮唑等;
[0084]
3)式ivb化合物经过氧化反应得到如式iiia所示的化合物;所述反应优选在氧化剂存在的条件下进行;所述的氧化剂优选为间氯过氧苯甲酸,双氧水,过氧叔丁醇等;
[0085]
4)式iiia化合物经过酸性条件脱保护反应得到如式iia所示的化合物或其药学上可接受的盐;所述的脱保护反应为在酸性条件下同时脱除两个保护基。在一个示例的反应条件下,中控显示先脱除boc保护基,后脱除苄基保护基;所述的酸性条件所用的酸为三氟乙酸、盐酸、氢溴酸、甲烷磺酸、对甲苯磺酸等;
[0086]
5)可选地,式iia化合物可以以内盐的形式存在,也进一步与酸反应成盐;所述的酸包括但不限于盐酸、三氟乙酸等;
[0087]
本发明还提供如式viiia和ivb所示的化合物:
[0088][0089]
其中,r1,r2分别独立地为c
3-27
直链或支链、饱和或不饱和烷基。
[0090]
本发明还提供一种如式ii所示的二脂肪酰磷脂酰乙醇胺化合物或其药学上可接受的盐的制备方法,其特征在于,通过如式iii所示的化合物通过酸性条件下脱保护反应制得,
[0091][0092]
其中,ar为取代或非取代的芳基,优选为取代或非取代的苯基;r1,r2分别独立地为c
3-27
直链或支链、饱和或不饱和烷基,优选分别独立地选自花生酰、油酰、硬脂酰、棕榈酰、月桂酰;r3,r4分别独立地为氢或c
1-4
烷基;化合物iii或ii的构型可以是r型、s型或外消旋型,优选为r构型。
[0093]
所述的酸性条件中的酸优选为三氟乙酸、盐酸、氢溴酸、甲烷磺酸、对甲苯磺酸。
[0094]
本发明还提供一种如式iii所示的化合物的制备方法,其特征在于,通过如式iva所示的化合物经过氧化反应制得,
[0095][0096]
其中,ar为取代或非取代的芳基;r1,r2分别独立地为c
3-27
直链或支链、饱和或不饱和烷基;r3,r4分别独立地为氢或c
1-4
烷基;化合物的构型可以是r型、s型或外消旋型。
[0097]
本发明的一个优选的实施方案中,ar为取代或非取代的苯基;分别独立地选自花生酰、油酰、硬脂酰、棕榈酰、月桂酰;r3,r4分别为氢。
[0098]
本发明的一个优选的实施方案中,包含以下步骤:
[0099]
在反应瓶中称入化合物iva,加入有机溶剂溶解,-30~0℃下加入氧化试剂,加完后升温到20~60℃,tlc显示原料已消耗完全。浓缩后纯化得到化合物iii。
[0100]
所述的有机溶剂优选二氯甲烷、四氢呋喃、乙腈、甲醇、乙醇、二噁烷;
[0101]
所述的氧化试剂优选为mcpba、双氧水、过氧叔丁醇。
[0102]
如果可以购得,也可使用上述反应步骤中的部分产物依更短路线制得式iv或iva
所示化合物;例如可通过购买前述式vii、vi、v所示的中间体,而后依照上述方法中提供的步骤制得式iv或iva所示的化合物。
[0103]
化合物v的合成方法可参照文献j.am.chem.soc.2018,140,6278-6287;j.med.chem.2012,55,871-882;bioorg.med.chem.2010,18,3518-3534;synlett 2012,290-294;j.org.chem.2014,79,4544-4552;j.med.chem.2008,51,2208-2215;j.org.chem.2001,66,7615-7625;bioorg.med.chem.2008,16,941-949.
[0104]
化合物x的合成方法可参照文献rsc adv.2015,5,54658-54666;bioorg.med.chem.lett.2018,28,3502-3505;syn.commun.1990,20,2951-2957;tetrahedron:asymmetry 1998,9,4193-4202;wo2008/70490;acs comb.sci.2014,16,367
–
374;org.lett.2007,9,5151-5154.
[0105]
本发明还提供了一条合成式i所示的胺基聚乙二醇化二脂肪酰膦酯酰乙醇胺化合物的新方法,
[0106][0107]
其中,ar为取代或非取代的芳基;r1,r2分别独立地为c
3-27
直链或支链、饱和或不饱和烷基;r3,r4分别独立地为氢或c
1-4
烷基;z为羰基活化基团;r5为烷基或羟基保护基;r6为h或na或nh4;n=5~800;所涉及的中间体或产物的构型可以是r型、s型或外消旋型。
[0108]
具体来说,该合成方法包括以下步骤:
[0109]
1)式iva化合物经过氧化反应得到如式iii所示的化合物;所述反应优选在氧化剂存在的条件下进行;所述的氧化剂优选为间氯过氧苯甲酸,双氧水,过氧叔丁醇等;
[0110]
2)式iii化合物经过酸性条件下脱保护反应得到如式ii所示的化合物或其药学上可接受的盐;所述的酸性条件中的酸优选为三氟乙酸、盐酸、氢溴酸、甲烷磺酸、对甲苯磺酸。
[0111]
3)式ii化合物与式x化合物经过缩合反应得到如式i所示的化合物或其药学上可接受的盐;所述的缩合反应优选在碱性条件下进行;所述的碱优选为三乙胺,二异丙基乙基胺,吡啶,1,8-二氮杂二环十一碳-7-烯,氢氧化锂,氢氧化钠,碳酸氢钠,碳酸钠;
[0112]
本发明一个优选的实施方案中,ar优选为取代或非取代的苯基;分别独立地选自花生酰、油酰、硬脂酰、棕榈酰、月桂酰;r3,r4分别为氢;r5选自甲基、苄基、叔丁基二甲基硅基、对甲基苯磺酰基等;r6为na或nh4;z为对硝基苯基氧基;n=10~460;化合物iva、iii、ii、i的构型为r构型。
[0113]
在一个特别优选的实施方案中,本发明提供如式ia所示的二硬脂酰磷脂酰乙醇胺
聚乙二醇衍生物(dspe-peg2000)化合物的合成路线如下:
[0114][0115]
具体地说,该方法包括下列步骤:
[0116]
1)式iva化合物经过氧化反应得到如式iiia所示的化合物;所述反应优选在氧化剂存在的条件下进行;所述的氧化剂优选为间氯过氧苯甲酸,双氧水,过氧叔丁醇等;
[0117]
2)式iiia化合物经过脱保护反应得到如式iia所示的化合物或其药学上可接受的盐;所述的脱保护反应为在酸性条件下同时脱除两个保护基。在一个示例的反应条件下,中控显示先脱除boc保护基,后脱除苄基保护基;所述的酸性条件中的酸优选为三氟乙酸、盐酸、氢溴酸、甲烷磺酸、对甲苯磺酸。
[0118]
3)式iia化合物与式xa化合物经过缩合反应得到如式ia所示的化合物或其药学上可接受的盐;所述的缩合反应优选在碱性条件下进行;所述的碱优选为三乙胺,二异丙基乙基胺,吡啶,氢氧化锂,氢氧化钠,碳酸氢钠,碳酸钠;
[0119]
4)可选地,式ia化合物还可以进一步转化为钠盐或铵盐。
[0120]
本发明还提供一种如式i所示的化合物的制备方法,
[0121][0122]
其中,ar为取代或非取代的芳基;r1,r2分别独立地为c
3-27
直链或支链、饱和或不饱和烷基;r3,r4分别独立地为氢或c
1-4
烷基;x和y分别独立地为离去基团,优选为氯,溴,碘或取代的胺基;z为羰基活化基团;r5为烷基或羟基保护基;r6为h或na或nh4;n=5~800;所涉
及的中间体或产物的构型可以是r型、s型或外消旋型。
[0123]
具体来说,该合成方法包括以下步骤:
[0124]
1)式viii化合物经过脱保护反应得到如式vii所示的化合物;所述的脱保护反应优选在酸性或氧化性试剂的作用下进行;所述的酸性或氧化性试剂优选为硝酸铈铵;
[0125]
2)式vii化合物与式vi所示的化合物和式va所示的化合物经过缩合反应得到如式iva所示的化合物;所述的缩合反应优选在含氮试剂的作用下进行;所述的含氮试剂优选为四氮唑、苯基四氮唑等;
[0126]
3)式iva化合物经过氧化反应得到如式iii所示的化合物;所述反应优选在氧化剂存在的条件下进行;所述的氧化剂优选为间氯过氧苯甲酸,双氧水,过氧叔丁醇等;
[0127]
4)式iii化合物经过酸性条件脱保护反应得到如式ii所示的化合物或其药学上可接受的盐;所述的酸性条件中的酸优选为三氟乙酸、盐酸、氢溴酸、甲烷磺酸、对甲苯磺酸。
[0128]
5)式ii化合物与式x化合物经过缩合反应得到如式i所示的化合物或其药学上可接受的盐;所述的缩合反应优选在碱性条件下进行;所述的碱优选为三乙胺,二异丙基乙基胺,吡啶,1,8-二氮杂二环十一碳-7-烯,氢氧化锂,氢氧化钠,碳酸氢钠,碳酸钠;
[0129]
本发明一个优选的实施方案中,ar优选为取代或非取代的苯基;分别独立地选自花生酰、油酰、硬脂酰、棕榈酰、月桂酰;r3,r4分别为氢;x、y优选为氯、二异丙基胺基;z为对硝基苯基氧基;n=10~460;化合物iv、iii、ii、i的构型为r构型;化合物i的盐为钠盐或铵盐。
[0130]
在一个特别优选的实施方案中,本发明提供如式ia所示的二硬脂酰磷脂酰乙醇胺聚乙二醇衍生物(dspe-peg2000)化合物的合成路线如下:
[0131][0132]
具体地说,该方法包括下列步骤:
[0133]
1)式viiia化合物经过脱保护反应得到如式viia所示的化合物;所述的脱保护反应优选在酸性或氧化性试剂的作用下进行;所述的酸性或氧化性试剂优选为硝酸铈铵;
[0134]
2)式viia化合物与式via所示的化合物和式va所示的化合物经过缩合反应得到如
式iva所示的化合物;所述的缩合反应优选在含氮试剂的作用下进行;所述的含氮试剂优选为四氮唑、苯基四氮唑等;
[0135]
3)式iva化合物经过氧化反应得到如式iiia所示的化合物;所述反应优选在氧化剂存在的条件下进行;所述的氧化剂优选为间氯过氧苯甲酸,双氧水,过氧叔丁醇等;
[0136]
4)式iiia化合物经过脱保护反应得到如式iia所示的化合物或其药学上可接受的盐;所述的脱保护反应为在酸性条件下同时脱除两个保护基。在一个示例的反应条件下,中控显示先脱除boc保护基,后脱除苄基保护基;所述的酸性条件中的酸优选为三氟乙酸、盐酸、氢溴酸、甲烷磺酸、对甲苯磺酸。
[0137]
5)式iia化合物与式xa化合物经过缩合反应得到如式ia所示的化合物或其药学上可接受的盐;所述的缩合反应优选在碱性条件下进行;所述的碱优选为三乙胺,二异丙基乙基胺,吡啶,氢氧化锂,氢氧化钠,碳酸氢钠,碳酸钠;
[0138]
6)可选地,式ia化合物还可以进一步转化为钠盐或铵盐。
[0139]
另一方面,本发明还提供了一种制备二脂肪酰磷脂酰乙醇胺或二脂肪酰磷脂酰乙醇胺聚乙二醇衍生物的方法,该方法先依照本发明前述提供的方法制得式iv或iva所示的化合物,而后依照已知的方法经式iii或式ii所示的化合物制得二脂肪酰磷脂酰乙醇胺或二脂肪酰磷脂酰乙醇胺聚乙二醇衍生物。
[0140]
本发明所使用的术语,除有相反的表述外,具有如下的含义:
[0141]“烷基”指饱和的或不饱和的脂族烃基团,包括1至27个碳原子的直链和支链基团。烷基可以含有手性碳原子和非手性碳原子。c1-c27烷基与酰基的组合形成c2-c28烷基酰基。本发明中的c2-c28烷基酰基可以选自但不限于来自乙酸、丙酸、丁酸、辛酸、癸酸、月桂酸、十四烷酸、棕榈酸、棕榈烯酸、油酸、亚油酸、硬脂酸、花生酸、山嵛酸等的酰基。
[0142]“芳基”指具有共轭的π电子体系的5至14元全碳单环或杂环或稠合多环(也就是共享毗邻碳原子对的环)基团,优选为5至10元,更优选苯基和萘基,最优选苯基。芳基可以是取代的或未取代的,当被取代时,取代基优选为一个或多个以下基团,独立地选自烷基、烯基、炔基、烷氧基、烷硫基、烷基氨基、卤素、硫醇、羟基、硝基、氰基、环烷基、杂环烷基、芳基、杂芳基、环烷氧基、杂环烷氧基、环烷硫基、杂环烷硫基。
[0143]
本发明的羟基保护基是本领域已知的适当的用于羟基保护的基团,参见文献(“protective groups in organic synthesis”,5
th ed.t.w.greene&p.g.m.wuts)中的羟基保护基团。作为示例,优选地,所述的羟基保护基可以是(c
1-10
烷基或芳基)3硅烷基,例如:三乙基硅基,三异丙基硅基,叔丁基二甲基硅基,叔丁基二苯基硅基等;可以是c
1-10
烷基或取代烷基,例如:甲基,叔丁基,烯丙基,苄基,甲氧基甲基,乙氧基乙基,2-四氢吡喃基(thp)等;可以是(c
1-10
烷基或芳香基)酰基,例如:甲酰基,乙酰基,苯甲酰基等;可以是(c
1-6
烷基或c
6-10
芳基)磺酰基;也可以是(c
1-6
烷氧基或c
6-10
芳基氧基)羰基。
[0144]
本发明的胺基保护基是本领域已知的适当的用于胺基保护的基团,参见文献(“protective groups in organic synthesis”,5
th
ed.t.w.greene&p.g.m.wuts)中的胺基保护基团。作为示例,优选地,所述的胺基保护基可以是烷基酰基、芳基酰基、烷基氧基羰基、芳基甲基等,例如:叔丁氧羰基,苄氧羰基,笏甲氧羰基,三氯乙氧基羰基、烯丙基氧基羰基,三苯基甲基,4-甲基三苯基甲基,4-甲氧基三苯基甲基,苄基,苯甲酰基,邻苯二甲酰基等。
[0145]
本发明的离去基团是本领域已知的适当的可以离去的基团。作为示例,优选地,所述的离去基团可以是氯、溴、碘、对甲苯磺酸酯基、三氟甲磺酸酯基等。作为膦酸或亚膦酸上的离去基团时,还可以是取代的胺基。作为示例,优选地,取代的胺基可以是二甲胺基、二乙胺基、二丙胺基、二异丙基胺基、二丁胺基、二苯基胺基、二苄基胺基等。
[0146]
本发明的羰基活化基团是本领域已知的适当的用于活化羰基的基团。作为示例,优选地,羰基活化基团包括但不限于4-硝基苯基氧基、咪唑基、氯、n-琥珀酰亚胺基氧基、苯并三氮唑基、三氯甲基氧基、五氟苯甲酰基等。
[0147]
在本发明中,术语“药学上可接受的盐”指本发明化合物与酸或碱所形成的适合用作药物的盐。药学上可接受的盐包括无机盐和有机盐。一类优选的盐是本发明化合物与酸形成的盐。适合形成盐的酸包括但并不限于:盐酸、氢溴酸、氢氟酸、硫酸、硝酸、磷酸等无机酸,甲酸、乙酸、三氟乙酸、丙酸、草酸、丙二酸、琥珀酸、富马酸、马来酸、乳酸、苹果酸、酒石酸、柠檬酸、苦味酸、甲磺酸、甲苯磺酸、苯磺酸等有机酸;以及天冬氨酸、谷氨酸等酸性氨基酸。另一类优选的盐是本发明化合物与碱形成的盐。适合形成盐的碱包括但并不限于:氨水、氢氧化钠、碳酸氢钠、碳酸钠、氢氧化锂、氢氧化钾、碳酸钾、三乙胺、二异丙基乙基胺、s-苯乙胺、r-苯乙胺、l-苯甘氨酰胺等。
[0148]
缩写表:
[0149][0150][0151]
下表为实施例中所涉及的化合物的结构式
[0152]
[0153]
[0154]
[0155]
[0156]
[0157]
[0158]
具体实施方式
[0159]
以下将结合具体实例详细地解释本发明,使得本领域普通技术人员更全面地理解本发明,具体实例仅用于说明本发明的技术方案,并不以任何方式限定本发明。
[0160]
实施例1~3为如式ix所示化合物的合成
[0161]
实施例1:制备化合物ixa
[0162]
对甲氧基苯酚(15.44g)溶于乙醇中,加入naoh(5.97g)的水溶液100ml,加热回流10min,加入(r)-氯代甘油醇(11g),100℃下反应16小时;tlc显示氯代甘油醇消耗完。加入二氯甲烷萃取,有机相干燥浓缩,得到化合物ixa为白色固体16.3g。
[0163]
ms(esi)m/z:199(m+h
+
)
[0164]1h nmr(400mhz,chloroform-d)δ6.92
–
6.77(m,4h),4.14
–
4.04(m,1h),4.04
–
3.94(m,2h),3.88
–
3.80(m,1h),3.79
–
3.69(m,4h),2.70(d,j=4.2hz,1h),2.20
–
2.06(m,1h).
[0165]
实施例2:制备化合物ixb
[0166]
对甲氧基苯酚(15.44g)溶于乙醇中,加入naoh(5.97g)的水溶液100ml,加热回流10min,加入(s)-氯代甘油醇(11g),100℃下反应16小时;tlc显示氯代甘油醇消耗完。加入二氯甲烷萃取,有机相干燥浓缩,得到化合物ixa为白色固体16.8g。
[0167]
ms(esi)m/z:199(m+h
+
)
[0168]1h nmr(400mhz,chloroform-d)δ6.92
–
6.77(m,4h),4.14
–
4.04(m,1h),4.04
–
3.94(m,2h),3.88
–
3.80(m,1h),3.79
–
3.69(m,4h),2.70(d,j=4.2hz,1h),2.20
–
2.06(m,1h).
[0169]
实施例3:制备化合物ixc
[0170]
对甲氧基苯酚(15.44g)溶于乙醇中,加入naoh(5.97g)的水溶液100ml,加热回流10min,加入消旋的氯代甘油醇(11g),100℃下反应16小时;tlc显示氯代甘油醇消耗完。加入二氯甲烷萃取,有机相干燥浓缩,得到化合物ixa为白色固体17.2g。
[0171]
ms(esi)m/z:199(m+h
+
)
[0172]1h nmr(400mhz,chloroform-d)δ6.92
–
6.77(m,4h),4.14
–
4.04(m,1h),4.04
–
3.94(m,2h),3.88
–
3.80(m,1h),3.79
–
3.69(m,4h),2.70(d,j=4.2hz,1h),2.20
–
2.06(m,1h).
[0173]
实施例4~14为如式viii所示化合物的合成
[0174]
实施例4:制备化合物viiia
[0175]
化合物ixa(4g),硬脂酸(14.35g)溶于dcm中,冰水浴下加入dmap(493mg),三乙胺
(6.13g)和dic(6.37g),反应在室温下搅拌16h。tlc显示原料转化完全,浓缩反应液后,打浆纯化得到化合物viiia为10.22g白色固体。
[0176]
ms(esi)m/z:731(m+h
+
)
[0177]1h nmr(400mhz,chloroform-d)δ6.89
–
6.77(m,4h),5.39
–
5.29(m,1h),4.43(dd,j=11.9,3.9hz,1h),4.28(dd,j=11.9,6.1hz,1h),4.06(d,j=5.1hz,2h),2.40
–
2.25(m,4h),1.73-1.62(m,4h),1.38
–
1.14(m,56h),0.87(t,j=6.6hz,6h).
[0178]
实施例5:制备化合物viiib
[0179]
化合物ixa(4g),棕榈酸(12.94g)溶于dcm中,冰水浴下加入dmap(493mg),三乙胺(6.13g)和dic(6.37g),反应在室温下搅拌16h。tlc显示原料转化完全,浓缩反应液后,打浆纯化得到化合物viiib为11.33g白色固体。
[0180]
ms(esi)m/z:676(m+h
+
)
[0181]
实施例6:制备化合物viiic
[0182]
化合物ixa(4g),十四酸(11.52g)溶于dcm中,冰水浴下加入dmap(493mg),三乙胺(6.13g)和dcc(10.4g),反应在室温下搅拌10h。tlc显示原料转化完全,浓缩反应液后,打浆纯化得到化合物viiic为10.37g白色固体。
[0183]
ms(esi)m/z:619(m+h
+
)
[0184]
实施例7:制备化合物viiid
[0185]
化合物ixa(4g),月桂酸(10.11g)溶于dcm中,冰水浴下加入dmap(493mg),三乙胺(6.13g)和dcc(10.4g),反应在室温下搅拌16h。tlc显示原料转化完全,浓缩反应液后,打浆纯化得到化合物viiid为9.11g白色固体。
[0186]
ms(esi)m/z:563(m+h
+
)
[0187]
实施例8:制备化合物viiie
[0188]
化合物ixa(4g),油酸(14.25g)溶于dcm中,冰水浴下加入dmap(493mg),三乙胺(6.13g)和dic(6.37g),反应在室温下搅拌16h。tlc显示原料转化完全,浓缩反应液后,打浆纯化得到化合物viiie为12.54g白色固体。
[0189]
ms(esi)m/z:727(m+h
+
)
[0190]
实施例9:制备化合物viiif
[0191]
化合物ixa(4g),二丁基氧化锡(5.02g),(r)-10-甲基-十八烷酰氯(6.11g)溶于甲苯中,反应在80度加热3h,tlc显示原料转化完全。冰水浴下向其中加入三乙胺(4.08g)和棕榈酰氯(8.32g),反应在室温下搅拌2h。tlc显示原料转化完全,浓缩反应液后,打浆纯化得到化合物viiif为10.65g白色固体。
[0192]
ms(esi)m/z:717(m+h
+
)
[0193]
实施例10:制备化合物viiig
[0194]
化合物ixa(4g),二丁基氧化锡(5.02g),硬脂酰氯(6.11g)溶于甲苯中,反应在80度加热3h,tlc显示原料转化完全。冰水浴下向其中加入三乙胺(4.08g)和月桂酰氯(6.62g),反应在室温下搅拌2h。tlc显示原料转化完全,浓缩反应液后,打浆纯化得到化合物viiif为10.03g白色固体。
[0195]
ms(esi)m/z:647(m+h
+
)
[0196]
实施例11:制备化合物viiih
[0197]
化合物ixa(4g),丁酸(4.44g)溶于dcm中,冰水浴下加入dmap(493mg),三乙胺(6.13g)和dic(6.37g),反应在室温下搅拌5h。tlc显示原料转化完全,浓缩反应液后,打浆纯化得到化合物viiih为6.15g白色固体。
[0198]
ms(esi)m/z:339(m+h
+
)
[0199]
实施例12:制备化合物viiii
[0200]
化合物ixa(4g),二十八酸(21.43g)溶于dcm中,冰水浴下加入dmap(493mg),三乙胺(6.13g)和dic(6.37g),反应在室温下搅拌20h。tlc显示原料转化完全,浓缩反应液后,打浆纯化得到化合物viiii为14.29g白色固体。
[0201]
ms(esi)m/z:1011(m+h
+
)
[0202]
实施例13:制备化合物viiij
[0203]
化合物ixb(4g),硬脂酸(14.35g)溶于dcm中,冰水浴下加入dmap(493mg),三乙胺(6.13g)和dic(6.37g),反应在室温下搅拌16h。tlc显示原料转化完全,浓缩反应液后,打浆纯化得到化合物viiij为10.03g白色固体。
[0204]
ms(esi)m/z:731(m+h
+
)
[0205]1h nmr(400mhz,chloroform-d)δ6.89
–
6.77(m,4h),5.39
–
5.29(m,1h),4.43(dd,j=11.9,3.9hz,1h),4.28(dd,j=11.9,6.1hz,1h),4.06(d,j=5.1hz,2h),2.40
–
2.25(m,4h),1.73-1.62(m,4h),1.38
–
1.14(m,56h),0.87(t,j=6.6hz,6h).
[0206]
实施例14:制备化合物viiik
[0207]
化合物ixc(4g),硬脂酸(14.35g)溶于dcm中,冰水浴下加入dmap(493mg),三乙胺(6.13g)和edci(9.67g),反应在室温下搅拌16h。tlc显示原料转化完全,浓缩反应液后,打浆纯化得到化合物viiik为10.41g白色固体。
[0208]
ms(esi)m/z:731(m+h
+
)
[0209]1h nmr(400mhz,chloroform-d)δ6.89
–
6.77(m,4h),5.39
–
5.29(m,1h),4.43(dd,j=11.9,3.9hz,1h),4.28(dd,j=11.9,6.1hz,1h),4.06(d,j=5.1hz,2h),2.40
–
2.25(m,4h),1.73-1.62(m,4h),1.38
–
1.14(m,56h),0.87(t,j=6.6hz,6h).
[0210]
实施例15~25为如式vii所示化合物的合成
[0211]
实施例15:制备化合物viia
[0212]
化合物viiia(12g)溶于120ml乙腈和30ml水中,冰水浴下加入硝酸铈铵(21.59g),反应在室温下搅拌16h。tlc显示原料转化完全,反应液过滤后浓缩,打浆纯化得到化合物viia为7.2g白色固体。
[0213]
ms(esi)m/z:625(m+h
+
)
[0214]1h nmr(400mhz,chloroform-d)δ5.14
–
5.01(m,1h),4.39
–
4.15(m,2h),3.82
–
3.66(m,2h),2.42
–
2.17(m,4h),1.71
–
1.52(m,4h),1.39-1.12(m,56h),0.86(t,j=6.6hz,6h).
[0215]
实施例16:制备化合物viib
[0216]
化合物viiib(11g)溶于110ml乙腈和20ml水中,冰水浴下加入硝酸铈铵(23.23g),反应在室温下搅拌10h。tlc显示原料转化完全,反应液过滤后浓缩,打浆纯化得到化合物viib为7.44g白色固体。
[0217]
ms(esi)m/z:569(m+h
+
)
[0218]
实施例17:制备化合物viic
[0219]
化合物viiic(10g)溶于100ml乙腈和20ml水中,冰水浴下加入硝酸铈铵(26.57g),反应在室温下搅拌24h。tlc显示原料转化完全,反应液过滤后浓缩,打浆纯化得到化合物viic为7.03g白色固体。
[0220]
ms(esi)m/z:513(m+h
+
)
[0221]
实施例18:制备化合物viid
[0222]
化合物viiid(9g)溶于90ml乙腈和30ml水中,冰水浴下加入硝酸铈铵(17.53g),反应在室温下搅拌5h。tlc显示原料转化完全,反应液过滤后浓缩,打浆纯化得到化合物viid为6.11g白色固体。
[0223]
ms(esi)m/z:457(m+h
+
)
[0224]
实施例19:制备化合物viie
[0225]
化合物viiie(12g)溶于120ml乙腈和30ml水中,冰水浴下加入硝酸铈铵(21.59g),反应在室温下搅拌16h。tlc显示原料转化完全,反应液过滤后浓缩,打浆纯化得到化合物viie为8.65g白色固体。
[0226]
ms(esi)m/z:621(m+h
+
)
[0227]
实施例20:制备化合物viif
[0228]
化合物viiif(10g)溶于100ml乙腈和30ml水中,冰水浴下加入硝酸铈铵(18.35g),反应在室温下搅拌16h。tlc显示原料转化完全,反应液过滤后浓缩,打浆纯化得到化合物viif为6.81g白色固体。
[0229]
ms(esi)m/z:611(m+h
+
)
[0230]
实施例21:制备化合物viig
[0231]
化合物viiig(10g)溶于100ml乙腈和30ml水中,冰水浴下加入硝酸铈铵(20.34g),反应在室温下搅拌16h。tlc显示原料转化完全,反应液过滤后浓缩,打浆纯化得到化合物viig为6.68g白色固体。
[0232]
ms(esi)m/z:541(m+h
+
)
[0233]
实施例22:制备化合物viih
[0234]
化合物viiih(6g)溶于60ml乙腈和15ml水中,冰水浴下加入硝酸铈铵(23.33g),反应在室温下搅拌16h。tlc显示原料转化完全,反应液过滤后浓缩,打浆纯化得到化合物viih为3.35g白色固体。
[0235]
ms(esi)m/z:233(m+h
+
)
[0236]
实施例23:制备化合物viii
[0237]
化合物viiii(14g)溶于140ml乙腈和40ml水中,冰水浴下加入硝酸铈铵(18.21g),反应在室温下搅拌24h。tlc显示原料转化完全,反应液过滤后浓缩,打浆纯化得到化合物viii为9.87g白色固体。
[0238]
ms(esi)m/z:905(m+h
+
)
[0239]
实施例24:制备化合物viij
[0240]
化合物viiij(10g)溶于100ml乙腈和25ml水中,冰水浴下加入硝酸铈铵(18g),反应在室温下搅拌16h。tlc显示原料转化完全,反应液过滤后浓缩,打浆纯化得到化合物viij为6.88g白色固体。
[0241]
ms(esi)m/z:625(m+h
+
)
[0242]1h nmr(400mhz,chloroform-d)δ5.14
–
5.01(m,1h),4.39
–
4.15(m,2h),3.82
–
3.66(m,2h),2.42
–
2.17(m,4h),1.71
–
1.52(m,4h),1.39-1.12(m,56h),0.86(t,j=6.6hz,6h).
[0243]
实施例25:制备化合物viik
[0244]
化合物viiik(10g)溶于100ml乙腈和25ml水中,冰水浴下加入硝酸铈铵(18g),反应在室温下搅拌16h。tlc显示原料转化完全,反应液过滤后浓缩,打浆纯化得到化合物viik为6.79g白色固体。
[0245]
ms(esi)m/z:625(m+h
+
)
[0246]1h nmr(400mhz,chloroform-d)δ5.14
–
5.01(m,1h),4.39
–
4.15(m,2h),3.82
–
3.66(m,2h),2.42
–
2.17(m,4h),1.71
–
1.52(m,4h),1.39-1.12(m,56h),0.86(t,j=6.6hz,6h).
[0247]
实施例26~34为如式vi所示化合物的合成
[0248]
实施例26:制备化合物via
[0249]
冰水浴下在250ml茄形瓶中加入dcm,加入三氯化磷(22.22g)。滴加苄醇(3.5g),室温搅拌2h。tlc显原料消耗完。旋干,油泵拉干。粗品溶于250ml thf中,滴加二异丙基胺(26.2g),反应升温到室温搅拌16h。tlc显示原料转化完全,反应液过滤后旋干滤液,柱层析纯化得到化合物via为7.1g无色液体。
[0250]1h nmr(400mhz,chloroform-d)δ7.42
–
7.14(m,5h),4.58(d,j=7.2hz,2h),3.61
–
3.38(m,4h),1.14
–
1.05(m,24h).
[0251]
实施例27:制备化合物vib
[0252]
冰水浴下在250ml茄形瓶中加入dcm,加入三氯化磷(22.22g)。滴加苄醇(3.5g),室温搅拌2h。tlc显原料消耗完。旋干,油泵拉干得到化合物vib为6.56g无色液体。
[0253]
实施例28:制备化合物vic
[0254]
冰水浴下在250ml茄形瓶中加入dcm,加入三氯化磷(22.22g)。滴加2-呋喃甲醇(3.18g),室温搅拌2h。tlc显原料消耗完。旋干,油泵拉干。粗品溶于250ml thf中,滴加二异丙基胺(26.2g),反应升温到室温搅拌16h。tlc显示原料转化完全,反应液过滤后旋干滤液,柱层析纯化得到化合物vic为6.82g无色液体。
[0255]
实施例29:制备化合物vid
[0256]
冰水浴下在250ml茄形瓶中加入dcm,加入三氯化磷(22.22g)。滴加2,4-二甲氧基苄醇(5.44g),室温搅拌2h。tlc显原料消耗完。旋干,油泵拉干。粗品溶于250ml thf中,滴加二异丙基胺(26.2g),反应升温到室温搅拌16h。tlc显示原料转化完全,反应液过滤后旋干滤液,柱层析纯化得到化合物vid为7.56g无色液体。
[0257]
实施例30:制备化合物vie
[0258]
冰水浴下在250ml茄形瓶中加入dcm,加入三氯化磷(22.22g)。滴加4-甲基苄醇(3.95g),室温搅拌2h。tlc显原料消耗完。旋干,油泵拉干。粗品溶于250ml thf中,滴加二异丙基胺(26.2g),反应升温到室温搅拌16h。tlc显示原料转化完全,反应液过滤后旋干滤液,柱层析纯化得到化合物vie为7.47g无色液体。
[0259]
实施例31:制备化合物vif
[0260]
冰水浴下在250ml茄形瓶中加入dcm,加入三氯化磷(22.22g)。滴加4-氯苄醇(4.62g),室温搅拌2h。tlc显原料消耗完。旋干,油泵拉干。粗品溶于250ml thf中,滴加二异丙基胺(26.2g),反应升温到室温搅拌16h。tlc显示原料转化完全,反应液过滤后旋干滤液,
柱层析纯化得到化合物vif为7.88g无色液体。
[0261]
实施例32:制备化合物vig
[0262]
冰水浴下在250ml茄形瓶中加入dcm,加入三氯化磷(22.22g)。滴加4-甲氧基苄醇(4.47g),室温搅拌2h。tlc显原料消耗完。旋干,油泵拉干。粗品溶于250ml thf中,滴加二异丙基胺(26.2g),反应升温到室温搅拌16h。tlc显示原料转化完全,反应液过滤后旋干滤液,柱层析纯化得到化合物vig为7.22g无色液体。
[0263]
实施例33:制备化合物vih
[0264]
冰水浴下在250ml茄形瓶中加入dcm,加入三氯化磷(22.22g)。滴加2-萘苄醇(4.69g),室温搅拌2h。tlc显原料消耗完。旋干,油泵拉干。粗品溶于250ml thf中,滴加二异丙基胺(26.2g),反应升温到室温搅拌16h。tlc显示原料转化完全,反应液过滤后旋干滤液,柱层析纯化得到化合物vih为7.36g无色液体。
[0265]
实施例34:制备化合物vii
[0266]
冰水浴下在250ml茄形瓶中加入dcm,加入三氯化磷(22.22g)。滴加1-苯基乙醇(4.31g),室温搅拌2h。tlc显原料消耗完。旋干,油泵拉干。粗品溶于250ml thf中,滴加二异丙基胺(26.2g),反应升温到室温搅拌16h。tlc显示原料转化完全,反应液过滤后旋干滤液,柱层析纯化得到化合物vii为7.30g无色液体。
[0267]
实施例35~52为如式iv所示化合物的合成
[0268]
实施例35:制备化合物iva
[0269]
在250ml茄形瓶中称入化合物via(3.31g)和四氮唑(459mg),加入dcm(40ml)溶解,将化合物viia(4.1g)滴加入上述反应液,滴加完后升至室温25℃搅拌2.5h。tlc显示原料转化完全。反应液用冰水浴降温,再加入化合物va(3.38g),滴加完升温至室温搅拌3h。tlc显示反应完全。粗品浓缩后柱层析纯化得到化合物iva为5.0g白色固体。
[0270]
ms(esi)m/z:922(m+h
+
)
[0271]1h nmr(400mhz,chloroform-d)δ7.35
–
7.31(m,5h),5.13
–
5.19(brs,1h),4.90
–
4.84(m,3h),3.94
–
3.84(m,4h),3.31
–
3.20(m,3h),2.33
–
2.23(m,4h),1.62
–
1.55(m,4h),1.44(s,9h),1.38-1.13(m,56h),0.88(t,j=6.6hz,6h)
[0272]
实施例36:制备化合物ivb
[0273]
在250ml茄形瓶中称入化合物via(2.03g)和四氮唑(978mg),加入dcm(40ml)溶解,将化合物viib(3.41g)滴加入上述反应液,滴加完后升至室温25℃搅拌2.5h。tlc显示原料转化完全。反应液用冰水浴降温,再加入化合物va(2.9g),滴加完升温至室温搅拌3h。tlc显示反应完全。粗品浓缩后柱层析纯化得到化合物ivb为4.3g白色固体。
[0274]
ms(esi)m/z:866(m+h
+
)
[0275]
实施例37:制备化合物ivc
[0276]
在250ml茄形瓶中称入化合物via(4.06g)和四氮唑(766mg),加入dcm(40ml)溶解,将化合物viic(3.08g)滴加入上述反应液,滴加完后升至室温25℃搅拌2.5h。tlc显示原料转化完全。反应液用冰水浴降温,再加入化合物va(5.46g),滴加完升温至室温搅拌3h。tlc显示反应完全。粗品浓缩后柱层析纯化得到化合物ivc为3.8g白色固体。
[0277]
ms(esi)m/z:810(m+h
+
)
[0278]
实施例38:制备化合物ivd
[0279]
在250ml茄形瓶中称入化合物via(3.78g)和四氮唑(464mg),加入dcm(40ml)溶解,将化合物viid(2.74g)滴加入上述反应液,滴加完后升至室温25℃搅拌2.5h。tlc显示原料转化完全。反应液用冰水浴降温,再加入化合物va(2.61g),滴加完升温至室温搅拌3h。tlc显示反应完全。粗品浓缩后柱层析纯化得到化合物ivd为3.2g白色固体。
[0280]
ms(esi)m/z:754(m+h
+
)
[0281]
实施例39:制备化合物ive
[0282]
在250ml茄形瓶中称入化合物via(4.99g)和四氮唑(1023mg),加入dcm(40ml)溶解,将化合物viie(3.75g)滴加入上述反应液,滴加完后升至室温25℃搅拌2.5h。tlc显示原料转化完全。反应液用冰水浴降温,再加入化合物va(2.9g),滴加完升温至室温搅拌3h。tlc显示反应完全。粗品浓缩后柱层析纯化得到化合物ive为4.8g白色固体。
[0283]
ms(esi)m/z:918(m+h
+
)
[0284]
实施例40:制备化合物ivf
[0285]
在250ml茄形瓶中称入化合物vig(4.42g)和四氮唑(477mg),加入dcm(40ml)溶解,将化合物viif(3.67g)滴加入上述反应液,滴加完后升至室温25℃搅拌2.5h。tlc显示原料转化完全。反应液用冰水浴降温,再加入化合物va(2.9g),滴加完升温至室温搅拌3h。tlc显示反应完全。粗品浓缩后柱层析纯化得到化合物ivf为4.6g白色固体。
[0286]
ms(esi)m/z:938(m+h
+
)
[0287]
实施例41:制备化合物ivg
[0288]
在250ml茄形瓶中称入化合物vic(3.94g)和四氮唑(818mg),加入dcm(40ml)溶解,将化合物viig(3.25g)滴加入上述反应液,滴加完后升至室温25℃搅拌2.5h。tlc显示原料转化完全。反应液用冰水浴降温,再加入化合物va(2.72g),滴加完升温至室温搅拌3h。tlc显示反应完全。粗品浓缩后柱层析纯化得到化合物ivg为4.0g白色固体。
[0289]
ms(esi)m/z:828(m+h
+
)
[0290]
实施例42:制备化合物ivh
[0291]
在250ml茄形瓶中称入化合物vid(4.78g)和四氮唑(922mg),加入dcm(40ml)溶解,将化合物viih(1.39g)滴加入上述反应液,滴加完后升至室温25℃搅拌2.5h。tlc显示原料转化完全。反应液用冰水浴降温,再加入化合物va(6g),滴加完升温至室温搅拌3h。tlc显示反应完全。粗品浓缩后柱层析纯化得到化合物ivh为2.6g白色固体。
[0292]
ms(esi)m/z:590(m+h
+
)
[0293]
实施例43:制备化合物ivi
[0294]
在250ml茄形瓶中称入化合物vie(4.23g)和四氮唑(459mg),加入dcm(40ml)溶解,将化合物viii(5.43g)滴加入上述反应液,滴加完后升至室温25℃搅拌2.5h。tlc显示原料转化完全。反应液用冰水浴降温,再加入化合物va(3.44g),滴加完升温至室温搅拌3h。tlc显示反应完全。粗品浓缩后柱层析纯化得到化合物ivi为6.1g白色固体。
[0295]
ms(esi)m/z:1216(m+h
+
)
[0296]
实施例44:制备化合物ivj
[0297]
在250ml茄形瓶中称入化合物via(2.89g)和四氮唑(459mg),加入dcm(40ml)溶解,将化合物viia(3.75g)滴加入上述反应液,滴加完后升至室温25℃搅拌2.5h。tlc显示原料转化完全。反应液用冰水浴降温,再加入化合物vb(3.51g),滴加完升温至室温搅拌3h。tlc
显示反应完全。粗品浓缩后柱层析纯化得到化合物ivj为4.7g白色固体。
[0298]
ms(esi)m/z:956(m+h
+
)
[0299]
实施例45:制备化合物ivk
[0300]
在250ml茄形瓶中称入化合物vih(4.13g)和四氮唑(459mg),加入dcm(40ml)溶解,将化合物viik(3.75g)滴加入上述反应液,滴加完后升至室温25℃搅拌2.5h。tlc显示原料转化完全。反应液用冰水浴降温,再加入化合物va(5.1g),滴加完升温至室温搅拌3h。tlc显示反应完全。粗品浓缩后柱层析纯化得到化合物ivk为2.1g白色固体。
[0301]
ms(esi)m/z:972(m+h
+
)
[0302]
实施例46:制备化合物ivl
[0303]
在250ml茄形瓶中称入化合物via(3.31g)和四氮唑(459mg),加入dcm(40ml)溶解,将化合物viij(4.1g)滴加入上述反应液,滴加完后升至室温25℃搅拌2.5h。tlc显示原料转化完全。反应液用冰水浴降温,再加入化合物v(3.38g),滴加完升温至室温搅拌3h。tlc显示反应完全。粗品浓缩后柱层析纯化得到化合物ivl为5.0g白色固体。
[0304]
ms(esi)m/z:922(m+h
+
)
[0305]
实施例47:制备化合物ivm
[0306]
在250ml茄形瓶中称入化合物vii(3.72g)和四氮唑(459mg),加入dcm(40ml)溶解,将化合物viia(4.1g)滴加入上述反应液,滴加完后升至室温25℃搅拌2.5h。tlc显示原料转化完全。反应液用冰水浴降温,再加入化合物va(3.38g),滴加完升温至室温搅拌3h。tlc显示反应完全。粗品浓缩后柱层析纯化得到化合物ivm为5.1g白色固体。
[0307]
ms(esi)m/z:936(m+h
+
)
[0308]
实施例48:制备化合物ivn
[0309]
在250ml茄形瓶中称入化合物vif(3.81g)和四氮唑(459mg),加入dcm(40ml)溶解,将化合物viia(4.1g)滴加入上述反应液,滴加完后升至室温25℃搅拌2.5h。tlc显示原料转化完全。反应液用冰水浴降温,再加入化合物va(3.38g),滴加完升温至室温搅拌3h。tlc显示反应完全。粗品浓缩后柱层析纯化得到化合物ivn为5.2g白色固体。
[0310]
ms(esi)m/z:957(m+h
+
)
[0311]
实施例49:制备化合物ivo
[0312]
在250ml茄形瓶中称入化合物via(3.31g)和四氮唑(459mg),加入dcm(40ml)溶解,将化合物viia(4.1g)滴加入上述反应液,滴加完后升至室温25℃搅拌2.5h。tlc显示原料转化完全。反应液用冰水浴降温,再加入化合物vc(3.52g),滴加完升温至室温搅拌3h。tlc显示反应完全。粗品浓缩后柱层析纯化得到化合物ivo为5.2g白色固体。
[0313]
ms(esi)m/z:912(m+h
+
)
[0314]
实施例50:制备化合物ivp
[0315]
在250ml茄形瓶中称入化合物via(3.31g)和四氮唑(459mg),加入dcm(40ml)溶解,将化合物viia(4.1g)滴加入上述反应液,滴加完后升至室温25℃搅拌2.5h。tlc显示原料转化完全。反应液用冰水浴降温,再加入化合物vd(3.01g),滴加完升温至室温搅拌3h。tlc显示反应完全。粗品浓缩后柱层析纯化得到化合物ivp为4.8g白色固体。
[0316]
ms(esi)m/z:906(m+h
+
)
[0317]
实施例51:制备化合物ivq
[0318]
在250ml茄形瓶中称入化合物via(3.31g)和四氮唑(459mg),加入dcm(40ml)溶解,将化合物viia(4.1g)滴加入上述反应液,滴加完后升至室温25℃搅拌2.5h。tlc显示原料转化完全。反应液用冰水浴降温,再加入化合物ve(4.52g),滴加完升温至室温搅拌3h。tlc显示反应完全。粗品浓缩后柱层析纯化得到化合物ivq为5.6g白色固体。
[0319]
ms(esi)m/z:1094(m+h
+
)
[0320]
实施例52:制备化合物ivr
[0321]
在250ml茄形瓶中称入化合物via(3.31g)和四氮唑(459mg),加入dcm(40ml)溶解,将化合物viia(4.1g)滴加入上述反应液,滴加完后升至室温25℃搅拌2.5h。tlc显示原料转化完全。反应液用冰水浴降温,再加入化合物vf(4.04g),滴加完升温至室温搅拌3h。tlc显示反应完全。粗品浓缩后柱层析纯化得到化合物ivr为5.1g白色固体。
[0322]
ms(esi)m/z:1044(m+h
+
)
[0323]
实施例53~70为如式iii所示化合物的合成
[0324]
实施例53:制备化合物iiia
[0325]
在100ml茄形瓶中称入5g化合物iva,加入dcm溶解,冰水浴下加入2.19g mcpba,加完后升温到室温,tlc原料消耗完。浓缩后打浆纯化得到化合物iiia为4.8g白色固体(收率94.3%)。
[0326]
ms(esi)m/z:938(m+h
+
)
[0327]1h nmr(400mhz,chloroform-d)δ7.41
–
7.30(m,5h),5.25
–
5.15(brs,1h),5.14
–
4.91(m,3h),4.17
–
4.02(m,4h),3.46
–
3.25(m,2h),2.34
–
2.23(m,4h),1.65
–
1.52(m,4h),1.44(s,9h),1.38-1.13(m,56h),0.86(t,j=6.6hz,6h).
[0328]
实施例54:制备化合物iiib
[0329]
在100ml茄形瓶中称入4g化合物ivb,加入dcm溶解,冰水浴下加入2.01g mcpba,加完后升温到室温,tlc原料消耗完。浓缩后打浆纯化得到化合物iiib为3.9g白色固体(收率98.7%)。
[0330]
ms(esi)m/z:882(m+h
+
)
[0331]
实施例55:制备化合物iiic
[0332]
在100ml茄形瓶中称入4g化合物ivc,加入dcm溶解,冰水浴下加入2.33g mcpba,加完后升温到室温,tlc原料消耗完。浓缩后打浆纯化得到化合物iiic为3.8g白色固体(收率93.1%)。
[0333]
ms(esi)m/z:826(m+h
+
)
[0334]
实施例56:制备化合物iiid
[0335]
在100ml茄形瓶中称入3.1g化合物ivd,加入dcm溶解,冰水浴下加入2.98g mcpba,加完后升温到室温,tlc原料消耗完。浓缩后打浆纯化得到化合物iiid为3.1g白色固体(收率97.9%)。
[0336]
ms(esi)m/z:770(m+h
+
)
[0337]
实施例57:制备化合物iiie
[0338]
在100ml茄形瓶中称入4.5g化合物ive,加入dcm溶解,冰水浴下加入3.72g mcpba,加完后升温到室温,tlc原料消耗完。浓缩后打浆纯化得到化合物iiie为4.4g白色固体(收率96.1%)。
[0339]
ms(esi)m/z:934(m+h
+
)
[0340]
实施例58:制备化合物iiif
[0341]
在100ml茄形瓶中称入4.3g化合物ivf,加入dcm溶解,冰水浴下加入4.11g mcpba,加完后升温到室温,tlc原料消耗完。浓缩后打浆纯化得到化合物iiif为4.2g白色固体(收率96.0%)。
[0342]
ms(esi)m/z:954(m+h
+
)
[0343]
实施例59:制备化合物iiig
[0344]
在100ml茄形瓶中称入3.8g化合物ivg,加入dcm溶解,冰水浴下加入2.99g mcpba,加完后升温到室温,tlc原料消耗完。浓缩后打浆纯化得到化合物iiig为3.6g白色固体(收率92.9%)。
[0345]
ms(esi)m/z:844(m+h
+
)
[0346]
实施例60:制备化合物iiih
[0347]
在100ml茄形瓶中称入3.5g化合物ivh,加入dcm溶解,冰水浴下加入5.78g mcpba,加完后升温到室温,tlc原料消耗完。浓缩后打浆纯化得到化合物iiih为3.4g白色固体(收率94.5%)。
[0348]
ms(esi)m/z:606(m+h
+
)
[0349]
实施例61:制备化合物iiii
[0350]
在100ml茄形瓶中称入6g化合物ivi,加入dcm溶解,冰水浴下加入2.19g mcpba,加完后升温到室温,tlc原料消耗完。浓缩后打浆纯化得到化合物iiii为5.6g白色固体(收率92.1%)。
[0351]
ms(esi)m/z:1232(m+h
+
)
[0352]
实施例62:制备化合物iiij
[0353]
在100ml茄形瓶中称入4.6g化合物ivj,加入dcm溶解,冰水浴下加入2.45g mcpba,加完后升温到室温,tlc原料消耗完。浓缩后打浆纯化得到化合物iiij为3.8g白色固体(收率81.2%)。
[0354]
ms(esi)m/z:972(m+h
+
)
[0355]
实施例63:制备化合物iiik
[0356]
在100ml茄形瓶中称入3g化合物ivk,加入dcm溶解,冰水浴下加入1.92g mcpba,加完后升温到室温,tlc原料消耗完。浓缩后打浆纯化得到化合物iiik为2.9g白色固体(收率95.1%)。
[0357]
ms(esi)m/z:988(m+h
+
)
[0358]
实施例64:制备化合物iiil
[0359]
在100ml茄形瓶中称入5g化合物ivl,加入dcm溶解,冰水浴下加入2.19g mcpba,加完后升温到室温,tlc原料消耗完。浓缩后打浆纯化得到化合物iiil为4.8g白色固体(收率94.3%)。
[0360]
ms(esi)m/z:938(m+h
+
)
[0361]
实施例65:制备化合物iiim
[0362]
在100ml茄形瓶中称入5g化合物ivm,加入dcm溶解,冰水浴下加入2.19g mcpba,加完后升温到室温,tlc原料消耗完。浓缩后打浆纯化得到化合物iiil为4.8g白色固体(收率
94.3%)。
[0363]
ms(esi)m/z:952(m+h
+
)
[0364]
实施例66:制备化合物iiin
[0365]
在100ml茄形瓶中称入5g化合物ivn,加入dcm溶解,冰水浴下加入2.19g mcpba,加完后升温到室温,tlc原料消耗完。浓缩后打浆纯化得到化合物iiil为4.8g白色固体(收率94.4%)。
[0366]
ms(esi)m/z:973(m+h
+
)
[0367]
实施例67:制备化合物iiio
[0368]
在100ml茄形瓶中称入5g化合物ivo,加入dcm溶解,冰水浴下加入2.19g mcpba,加完后升温到室温,tlc原料消耗完。浓缩后打浆纯化得到化合物iiil为4.8g白色固体(收率82.5%)。
[0369]
ms(esi)m/z:928(m+h
+
)
[0370]
实施例68:制备化合物iiip
[0371]
在100ml茄形瓶中称入5g化合物ivp,加入dcm溶解,冰水浴下加入2.19g mcpba,加完后升温到室温,tlc原料消耗完。浓缩后打浆纯化得到化合物iiil为4.0g白色固体(收率78.6%)。
[0372]
ms(esi)m/z:922(m+h
+
)
[0373]
实施例69:制备化合物iiiq
[0374]
在100ml茄形瓶中称入5g化合物ivq,加入dcm溶解,冰水浴下加入2.19g mcpba,加完后升温到室温,tlc原料消耗完。浓缩后打浆纯化得到化合物iiil为4.4g白色固体(收率86.7%)。
[0375]
ms(esi)m/z:1110(m+h
+
)
[0376]
实施例70:制备化合物iiir
[0377]
在100ml茄形瓶中称入5g化合物ivr,加入dcm溶解,冰水浴下加入2.19g mcpba,加完后升温到室温,tlc原料消耗完。浓缩后打浆纯化得到化合物iiil为4.5g白色固体(收率88.6%)。
[0378]
ms(esi)m/z:1060(m+h
+
)
[0379]
实施例71~88为如式ii所示化合物的合成
[0380]
实施例71:制备化合物iia
[0381]
在100ml茄形瓶中称入3g化合物iiia,加入dcm(10ml)溶解。冰水浴下加入3ml三氟乙酸,反应在室温搅拌2h。中控lc-ms显示boc保护基先发生水解。tlc显示原料消耗完后。浓缩后打浆纯化得到化合物iia为2.33g白色固体(收率97.4%)。
[0382]
ms(esi)m/z:748(m+h
+
)
[0383]
1h nmr(400mhz,chloroform-d)δ7.59(s,2h),5.36-5.03(m,1h),4.35(dd,j=12.1,3.5hz,1h),4.28-4.19(m,2h),4.14(dd,j=12.1,6.4hz,1h),4.08-3.99(m,2h),3.35(s,2h),2.43-2.18(m,4h),1.68-1.49(m,4h),1.25(br,56h),0.88(t,j=6.7hz,6h).
[0384]
实施例72:制备化合物iib
[0385]
在100ml茄形瓶中称入3g化合物iiib,加入dcm(10ml)溶解。冰水浴下加入4ml三氟乙酸,反应在40℃搅拌5h。tlc显示原料消耗完。浓缩后打浆纯化得到化合物iib为2.21g白
色固体(收率93.9%)。
[0386]
ms(esi)m/z:692(m+h
+
)
[0387]
实施例73:制备化合物iic
[0388]
在100ml茄形瓶中称入3g化合物iiic,加入dcm(10ml)溶解。冰水浴下加入5ml三氟乙酸,反应在室温搅拌16h。tlc显示原料消耗完。浓缩后打浆纯化得到化合物iic为2.19g白色固体(收率94.6%)。
[0389]
ms(esi)m/z:636(m+h
+
)
[0390]
实施例74:制备化合物iid
[0391]
在100ml茄形瓶中称入3g化合物iiid,加入dcm(10ml)溶解。冰水浴下加入5ml三氟乙酸,反应在室温搅拌16h。tlc显示原料消耗完。浓缩后打浆纯化得到化合物iid为2.15g白色固体(收率95.2%)。
[0392]
ms(esi)m/z:580(m+h
+
)
[0393]
实施例75:制备化合物iie
[0394]
在100ml茄形瓶中称入3g化合物iiie,加入dcm(10ml)溶解。冰水浴下加入4ml三氟乙酸,反应在室温搅拌5h。tlc显示原料消耗完。浓缩后打浆纯化得到化合物iie为2.24g白色固体(收率93.7%)。
[0395]
ms(esi)m/z:744(m+h
+
)
[0396]
实施例76:制备化合物iif
[0397]
在100ml茄形瓶中称入3g化合物iiif,加入乙醇(10ml)溶解。冰水浴下加入4ml盐酸乙醇溶液,反应在40℃搅拌8h。tlc显示原料消耗完。浓缩后打浆纯化得到化合物iif为2.19g白色固体(收率94.9%)。
[0398]
ms(esi)m/z:734(m+h
+
)
[0399]
实施例77:制备化合物iig
[0400]
在100ml茄形瓶中称入3g化合物iiig,加入乙醇(10ml)溶解。冰水浴下加入5ml三氟乙酸,反应在室温搅拌16h。tlc显示原料消耗完。硅藻土过滤后浓缩后打浆纯化得到化合物iig为2.20g白色固体(收率93.2%)。
[0401]
ms(esi)m/z:664(m+h
+
)
[0402]
实施例78:制备化合物iih
[0403]
在100ml茄形瓶中称入3g化合物iiih,加入dcm(10ml)溶解。冰水浴下加入2ml三氟乙酸,反应在0℃搅拌3h。tlc显示原料消耗完。浓缩后打浆纯化得到化合物iih为1.69g白色固体(收率96.1%)。
[0404]
ms(esi)m/z:356(m+h
+
)
[0405]
实施例79:制备化合物iii
[0406]
在100ml茄形瓶中称入3g化合物iiii,加入dcm(10ml)溶解。冰水浴下加入2ml三氟乙酸,反应在0℃搅拌3h。tlc显示原料消耗完。浓缩后打浆纯化得到化合物iii为2.32g白色固体(收率92.7%)。
[0407]
ms(esi)m/z:1028(m+h
+
)
[0408]
实施例80:制备化合物iia
[0409]
在100ml茄形瓶中称入3g化合物iiij,加入四氢呋喃(10ml)溶解。加入10%湿钯碳
(300mg),反应在氢气氛围下40℃搅拌8h,tlc显示原料转化完全。硅藻土过滤,浓缩后打浆纯化得到化合物iia为1.65g白色固体(收率71.5%)。
[0410]
ms(esi)m/z:748(m+h
+
)
[0411]1h nmr(400mhz,methanol-d4)δ5.27
–
5.17(brs,1h),4.42
–
4.36(m,1h),4.20
–
4.11(m,1h),4.07
–
3.92(m,4h),3.17
–
3.06(m,2h),2.33-2.26(m,4h),1.71
–
1.51(m,4h),1.38-1.13(m,56h),0.86(t,j=6.6hz,6h).
[0412]
实施例81:制备化合物iia
[0413]
在100ml茄形瓶中称入3g化合物iiim,加入dcm(10ml)溶解。冰水浴下加入2ml三氟乙酸,反应在室温搅拌2h。tlc显示原料消耗完,lc-ms显示保护基已经水解。浓缩后打浆纯化得到化合物iia为2.17g白色固体(收率91.9%)。
[0414]
实施例82:制备化合物iia
[0415]
在100ml茄形瓶中称入3g化合物iiin,加入dcm(10ml)溶解。冰水浴下加入2ml三氟乙酸,反应在室温搅拌2h。tlc显示原料消耗完,lc-ms显示保护基已经水解。浓缩后打浆纯化得到化合物iia为2.14g白色固体(收率92.8%)。
[0416]
实施例83:制备化合物iia
[0417]
在100ml茄形瓶中称入3g化合物iiio,加入四氢呋喃(10ml)溶解。加入10%湿钯碳(300mg),反应在氢气氛围下40℃搅拌8h,tlc显示原料转化完全。硅藻土过滤,浓缩后打浆纯化得到化合物iia为1.76g白色固体(收率72.9%)。
[0418]
实施例84:制备化合物iia
[0419]
在100ml茄形瓶中称入3g化合物iiip,加入dcm(10ml)溶解冰水浴下加入四三苯基膦钯(103mg)和苯基硅烷(2.53g),反应在室温下搅拌12h后,tlc显示原料转化完全,lc-ms显示alloc保护基已脱除。继续向其中加入4ml三氟乙酸,反应在室温搅拌1h。tlc显示中间体消耗完。浓缩后打浆纯化得到化合物iid为1.77g白色固体(收率72.9%)。
[0420]
实施例85:制备化合物iia
[0421]
在100ml茄形瓶中称入3g化合物iiiq,加入dcm(10ml)溶解。冰水浴下加入2ml三氟乙酸,反应在0℃搅拌3h。tlc显示原料消耗完。浓缩后打浆纯化得到化合物iih为1.74g白色固体(收率85.9%)。
[0422]
实施例86:制备化合物iia
[0423]
在100ml茄形瓶中称入3g化合物iiir,加入dcm(10ml)溶解。冰水浴下加入2ml三氟乙酸,反应在室温搅拌2h。tlc显示原料消耗完,lc-ms显示苄基保护基已经水解。反应液浓缩后,用二甲基甲酰胺(5ml)溶解,加入哌啶(1ml),反应在室温下搅拌30min,tlc显示中间体转化完全。浓缩后打浆纯化得到化合物iik为1.79g白色固体(收率84.6%)。
[0424]
ms(esi)m/z:748(m+h
+
)
[0425]
实施例87:制备化合物iik
[0426]
在100ml茄形瓶中称入3g化合物iiik,加入dcm(10ml)溶解。冰水浴下加入2ml三氟乙酸,反应在室温搅拌2h。tlc显示原料消耗完,lc-ms显示保护基已经水解。浓缩后打浆纯化得到化合物iik为2.11g白色固体(收率92.8%)。
[0427]
ms(esi)m/z:748(m+h
+
)
[0428]1h nmr(400mhz,methanol-d4)δ5.29
–
5.19(brs,1h),4.42
–
4.36(m,1h),4.20
–
4.13
(m,1h),4.05
–
3.93(m,4h),3.18
–
3.07(m,2h),2.33-2.27(m,4h),1.71
–
1.51(m,4h),1.39-1.13(m,56h),0.87(t,j=6.6hz,6h).
[0429]
实施例88:制备化合物iil
[0430]
在100ml茄形瓶中称入3.0g化合物iiil,加入dcm(10ml)溶解。冰水浴下加入2ml三氟乙酸,反应在0℃搅拌3h。tlc显示原料消耗完。浓缩后打浆纯化得到化合物iil为2.26g白色固体(收率94.3%)。
[0431]
ms(esi)m/z:748(m+h
+
)
[0432]1h nmr(400mhz,methanol-d4)δ5.28
–
5.17(brs,1h),4.43
–
4.37(m,1h),4.20
–
4.11(m,1h),4.07
–
3.92(m,4h),3.15
–
3.05(m,2h),2.33-2.26(m,4h),1.72
–
1.52(m,4h),1.38-1.13(m,56h),0.87(t,j=6.6hz,6h).
[0433]
实施例89~102为如式i所示化合物的合成
[0434]
实施例89:制备化合物ia
[0435]
在100ml茄形瓶中称入化合物iia(1.31g),940mg三乙胺,3.11g化合物xa,加入50ml二氯甲烷溶解,反应回流5h,tlc显示原料消耗完。反应液依次用饱和碳酸氢钠和饱和食盐水洗涤,无水硫酸钠干燥旋干得到粗品。柱层析纯化后得到化合物ia为3.32g白色固体。
[0436]1h nmr(400mhz,chloroform-d)δ5.28
–
5.18(brs,1h),4.46
–
4.36(m,1h),4.30
–
4.10(m,4h),4.04
–
3.91(m,3h),3.85
–
3.46(m,178h),3.43(s,3h),3.43
–
3.31(m,2h),2.32
–
2.27(m,4h),1.63
–
1.56(m,4h),1.39-1.10(m,56h),0.89(t,j=6.6hz,6h).
[0437]
实施例90:制备化合物ib
[0438]
在100ml茄形瓶中称入化合物iib(1.26g),1.37g二异丙基乙胺,3.65g化合物xa,加入50ml二氯甲烷溶解,反应在25℃搅拌16h,tlc显示原料消耗完。反应液依次用饱和碳酸氢钠和饱和食盐水洗涤,无水硫酸钠干燥旋干得到粗品。柱层析纯化后得到化合物ib为3.91g白色固体。
[0439]
实施例91:制备化合物ic
[0440]
在100ml茄形瓶中称入化合物iic(1.03g),1.59g dbu,3.21g化合物xa,加入50ml二氯甲烷溶解,反应回流8h,tlc显示原料消耗完。反应液依次用饱和碳酸氢钠和饱和食盐水洗涤,无水硫酸钠干燥旋干得到粗品。柱层析纯化后得到化合物ic为3.01g白色固体。
[0441]
实施例92:制备化合物id
[0442]
在100ml茄形瓶中称入化合物iid(1.47g),1.25g三乙胺,1.06g化合物xb,加入50ml四氢呋喃溶解,反应回流2h,tlc显示原料消耗完。反应液依次用饱和碳酸氢钠和饱和食盐水洗涤,无水硫酸钠干燥旋干得到粗品。柱层析纯化后得到化合物id为2.01g白色固体。
[0443]
实施例93:制备化合物ie
[0444]
在100ml茄形瓶中称入化合物iie(1.33g),1.78g吡啶,3.77g化合物xk,加入50ml二氯甲烷溶解,反应回流8h,tlc显示原料消耗完。反应液依次用饱和碳酸氢钠和饱和食盐水洗涤,无水硫酸钠干燥旋干得到粗品。柱层析纯化后得到化合物ie为4.02g白色固体。
[0445]
实施例94:制备化合物if
[0446]
在100ml茄形瓶中称入化合物iif(1.01g),1.59g碳酸氢钠,6.25g化合物xf,加入
50ml二氯甲烷溶解,反应回流5h,tlc显示原料消耗完。反应液依次用饱和碳酸氢钠和饱和食盐水洗涤,无水硫酸钠干燥旋干得到粗品。柱层析纯化后得到化合物if为5.38g白色固体。
[0447]
实施例95:制备化合物ig
[0448]
在100ml茄形瓶中称入化合物iig(680mg),1.03g碳酸钠,10.2g化合物xe,加入50ml二氯甲烷溶解,反应回流5h,tlc显示原料消耗完。反应液依次用饱和碳酸氢钠和饱和食盐水洗涤,无水硫酸钠干燥旋干得到粗品。二氯甲烷溶解后乙醚沉淀得到化合物ig为7.66g白色固体。
[0449]
实施例96:制备化合物ih
[0450]
在100ml茄形瓶中称入化合物iih(530mg),2.98g吡啶,29.77g化合物xd,加入50ml二氯甲烷溶解,反应回流5h,tlc显示原料消耗完。反应液依次用饱和碳酸氢钠和饱和食盐水洗涤,无水硫酸钠干燥旋干得到粗品。二氯甲烷溶解后乙醚沉淀得到化合物ih为17.3g白色固体。
[0451]
实施例97:制备化合物ii
[0452]
在100ml茄形瓶中称入化合物iii(260mg),670mg三乙胺,8.82g化合物xc,加入30ml二氯甲烷溶解,反应回流5h,tlc显示原料消耗完。反应液依次用饱和碳酸氢钠和饱和食盐水洗涤,无水硫酸钠干燥旋干得到粗品。二氯甲烷溶解后乙醚沉淀得到化合物ii为5.77g白色固体。
[0453]
实施例98:制备化合物ij
[0454]
在100ml茄形瓶中称入化合物iil(1.25g),1.73g三乙胺,3.35g化合物xl,加入50ml二氯甲烷溶解,反应回流12h,tlc显示原料消耗完。反应液依次用饱和碳酸氢钠和饱和食盐水洗涤,无水硫酸钠干燥旋干得到粗品。柱层析纯化后得到化合物ij为3.62g白色固体。
[0455]
实施例99:制备化合物ik
[0456]
在100ml茄形瓶中称入化合物iik(1.22g),1.28g 2,6-二甲基吡啶,3.22g化合物xm,加入50ml二氯甲烷溶解,反应在25℃搅拌24h,tlc显示原料消耗完。反应液依次用饱和碳酸氢钠和饱和食盐水洗涤,无水硫酸钠干燥旋干得到粗品。柱层析纯化后得到化合物ik为3.68g白色固体。
[0457]
实施例100:制备化合物il
[0458]
在100ml茄形瓶中称入化合物iia(1.23g),940mg三乙胺,3.29g化合物xj,加入50ml二氯甲烷溶解,反应回流6h,tlc显示原料消耗完。反应液依次用饱和碳酸氢钠和饱和食盐水洗涤,无水硫酸钠干燥旋干得到粗品。柱层析纯化后得到化合物il为3.41g白色固体。
[0459]
实施例101:制备化合物im
[0460]
在100ml茄形瓶中称入化合物iia(620mg),964mg三乙胺,1.74g化合物xn,加入20ml二氯甲烷溶解,反应回流5h,tlc显示原料消耗完。反应液依次用饱和碳酸氢钠和饱和食盐水洗涤,无水硫酸钠干燥旋干得到粗品。柱层析纯化后得到化合物im为1.71g白色固体。
[0461]
实施例102:制备化合物in
[0462]
在100ml茄形瓶中称入化合物iia(670mg),653mg三乙胺,1.82g化合物xo,加入20ml二氯甲烷溶解,反应回流5h,tlc显示原料消耗完。反应液依次用饱和碳酸氢钠和饱和食盐水洗涤,无水硫酸钠干燥旋干得到粗品。柱层析纯化后得到化合物in为1.83g白色固体。
[0463]
由于已根据其特殊的实施方案描述了本发明,某些修饰和等价变化对于本领域普通技术人员是显而易见的且包括在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1