一种间充质干细胞无血清培养基的制作方法
1.本发明属于生物医药领域,涉及一种间充质干细胞无血清培养基。
背景技术:
2.干细胞根据分化能力的不同可以分为全能干细胞、多能干细胞、祖细胞等,而根据来源不同又可以分为胎盘干细胞、脂肪干细胞、造血干细胞等。间充质干细胞(msc,mesenchymal stem cells)是干细胞家族的重要成员,来源于发育早期的中胚层,属于多能干细胞,msc最初在骨髓中发现,因其具有多向分化潜能、造血支持和促进干细胞植入、免疫调控和自我复制等特点而日益受到人们的关注。如间充质干细胞在体内或体外特定的诱导条件下,可分化为脂肪、骨、软骨、肌肉、肌腱、韧带、神经、肝、心肌、内皮等多种组织细胞,连续传代培养和冷冻保存后仍具有多向分化潜能,可作为理想的种子细胞用于衰老和病变引起的组织器官损伤修复。目前间充质干细胞临床应用于解决多种血液系统疾病,心血管疾病,肝硬化,神经系统疾病,膝关节半月板部分切除损伤修复,自身免疫性疾病等方面取得了重大突破,挽救了更多病患的生命。此外,间充质干细胞在神经系统修复及更多方面具有长远的发展前景。
3.虽然目前动物实验及部分临床研究发现msc对于促进组织修复、调节异常免疫反应具有较好的治疗效果,但是msc应用中仍有诸多问题没有解决:首先体外大规模扩增是实现msc临床治疗的前提,但是目前msc的体外扩增体系尚没有达成一致:根据培养基种类的不同,msc扩增体系可以分为含有胎牛血清的培养体系和成分明确的、无动物源性成分、不含血清的培养体系。
4.基于胎牛血清的培养体系目前被证明是msc细胞最有效的培养体系,在此体系下msc细胞呈现出优良的增值能力、分化能力,具有良好的临床治疗潜力,但是胎牛血清存在的主要问题是没有特异性指标来评价血清质量,所以不同产地、批次间的胎牛血清质量存在不同,培养出的细胞质量也会有差别,研究证实用劣质血清培养msc细胞,细胞会提前出现“老化”现象,表现为细胞外形变得非纺锤形、端粒酶逐渐缩短、细胞增殖能力下降、细胞向骨细胞、软骨细胞、脂肪细胞等分化潜能也显著减弱的现象。因此越来越多的研究者目前采用成分明确的、无动物源性成分、不含血清的培养体系培养msc细胞,从目前的结果看无血清体系可以支持msc细胞长期培养,但是与胎牛血清体系相比仍存在不足,主要问题是细胞增殖缓慢且分化能力有差别。目前最理想的血清替代物是人血小板裂解液,其既可以避免胎牛血清带来的异种病毒污染的可能,又能完全代替血清促进msc的体外培养,但血小板裂解液的来源是目前存在的主要问题,高额的价格极大的限制了其应用规模。
技术实现要素:
5.在一些实施方案中,本发明提供了一种无血清培养基,包括基础培养基和添加成分,所述添加成分包括jnk通路抑制剂、erk1/2通路抑制剂、p38 mapk通路抑制剂和氨基乙醇,所述的jnk通路抑制剂包括但不限于sp600125,erk1/2通路抑制剂包括但不限于
pd0325901,p38 mapk通路抑制剂包括sb202190、sb203580和birb796中的至少一种。
6.在一些实施方案中,所述基础培养基包括dmem/f12、a
‑
mem、dmem或imdm。
7.在一些实施方案中,所述基础培养基还可以是knock out dmem/f12。
8.在一些实施方案中,所述sp600125、pd0325901、p38 mapk通路抑制剂和氨基乙醇的浓度分别为1
‑
10um,1
‑
10um,1
‑
10um和0
‑
10mg/l。
9.在一些实施方案中,所述sp600125、pd0325901、p38 mapk通路抑制剂和氨基乙醇的浓度分别为1
‑
5um、1
‑
5um、1
‑
5um和0
‑
5mg/l。
10.在一些实施方案中,所述p38 mapk通路抑制剂为1
‑
5um的sb202190。
11.在一些实施方案中,所述p38 mapk通路抑制剂为1
‑
10um的sb203580。
12.在一些实施方案中,所述p38 mapk通路抑制剂为1
‑
2um的birb796。
13.在一些实施方案中,所述添加成分还包括l
‑
谷氨酰胺、碳酸氢钠、hepes、胰岛素、转铁蛋白、白蛋白、聚乙烯醇、2
‑
巯基乙醇、脂质、氨基酸、维生素、微量元素、pluronic f
‑
68、氢化可的松、维生素、粘结胺、黄体酮、腐胺、肝素、egf、b
‑
fgf、pdgf
‑
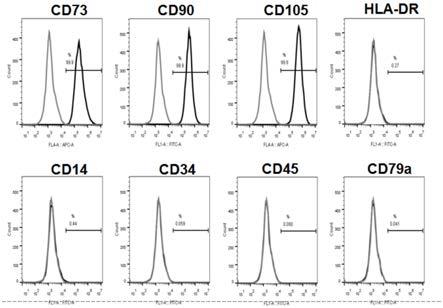
bb、igf
‑
1、gm
‑
csf、tgf
‑
β1和r
‑
hgh、地塞米松、neaa、亚硒酸钠、gama
‑
氨基丁酸、胶原蛋白、乙醇胺、雌二醇、还原型谷胱甘肽、5
‑
羟色胺、亚油酸、卵磷脂、丙酮酸钠、甲状腺素。
14.在一些实施方案中,所述添加成分包括l
‑
谷氨酰胺1
‑
5mm、碳酸氢钠2~5g/l、hepes 1
‑
5mm、胰岛素1
‑
10mg/l、转铁蛋白5
‑
20mg/l、白蛋白1
‑
5g/l、聚乙烯醇0
‑
1w/w%、2
‑
巯基乙醇50
‑
60nm、脂质0.1
‑
1mg/l、氨基酸1
‑
10g/l、微量元素1
‑
5mg/l、pluronic f
‑
68100
‑
500mg/l、氢化可的松1
‑
50mg/l、维生素1
‑
80mg/l、粘结胺1
‑
5mg/l、黄体酮10
‑
20mg/l、腐胺1
‑
10mg/l、肝素1
‑
10iu/ml、egf 1
‑
10mg/l、b
‑
fgf 1
‑
10mg/l、pdgf
‑
bb 1
‑
10mg/l、igf
‑
1 1
‑
10mg/l、gm
‑
csf 1
‑
10mg/l、tgf
‑
β1 1
‑
10mg/l和r
‑
hgh 2~4ug/l、地塞米松2
‑
50nm、neaa 0
‑
500mg/l、亚硒酸钠1
‑
50mg/l、γ
‑
氨基丁酸0
‑
100mg/l、胶原蛋白0.1
‑
50mg/l、乙醇胺20
‑
50nm、雌二醇1
‑
5mg/l、还原型谷胱甘肽2.5
‑
5mg/l、5
‑
羟色胺20~35ug/l、亚油酸2.5
‑
5ug/l、油酸1~3ug/l、卵磷脂1
‑
3ug/l、丙酮酸钠100~200mg/l、甲状腺素80~90nmol/l。
15.在一些实施方案中,所述添加成分包括l
‑
谷氨酰胺1
‑
4mm、碳酸氢钠2~4.5g/l、hepes 1
‑
4.5mm、胰岛素3
‑
10mg/l、转铁蛋白8
‑
20mg/l、白蛋白1
‑
4.5g/l、聚乙烯醇0
‑
0.8w/w%、2
‑
巯基乙醇50
‑
58nm、脂质0.1
‑
0.8mg/l、氨基酸1
‑
8g/l、微量元素1
‑
4mg/l、pluronic f
‑
68 100
‑
400mg/l、氢化可的松1
‑
40mg/l、维生素1
‑
75mg/l、粘结胺1
‑
4mg/l、黄体酮10
‑
18mg/l、腐胺1
‑
8mg/l、肝素1
‑
8iu/ml、egf 1
‑
8mg/l、b
‑
fgf 1
‑
8mg/l、pdgf
‑
bb 1
‑
8mg/l、igf
‑
1 1
‑
8mg/l、gm
‑
csf 1
‑
8mg/l、tgf
‑
β1 1
‑
8mg/l和r
‑
hgh 2~3.8ug/l、地塞米松2
‑
40nm、neaa0
‑
400mg/l、亚硒酸钠1
‑
40mg/l、γ
‑
氨基丁酸0
‑
80mg/l、胶原蛋白0.1
‑
40mg/l、乙醇胺20
‑
40nm、雌二醇1
‑
4mg/l、还原型谷胱甘肽2.5
‑
4.5mg/l、5
‑
羟色胺20~31ug/l、亚油酸2.5
‑
4.5ug/l、油酸1~2.8ug/l、卵磷脂1
‑
2.8ug/l、丙酮酸钠100~180mg/l、甲状腺素80~88nmol/l。
16.在一些实施方案中,所述添加成分包括l
‑
谷氨酰胺1
‑
3mm、碳酸氢钠2~4g/l、hepes 1
‑
4mm、胰岛素5
‑
10mg/l、转铁蛋白10
‑
20mg/l、白蛋白1
‑
3g/l、聚乙烯醇0
‑
0.5w/w%、2
‑
巯基乙醇50
‑
55nm、脂质0.1
‑
0.5mg/l、氨基酸1
‑
5g/l、微量元素1
‑
3mg/l、pluronic f
‑
68 100
‑
300mg/l、氢化可的松1
‑
20mg/l、维生素1
‑
70mg/l、粘结胺1
‑
3mg/l、黄体酮10
‑
15mg/l、腐胺1
‑
5mg/l、肝素3
‑
8iu/ml、egf 1
‑
6mg/l、b
‑
fgf 1
‑
6mg/l、pdgf
‑
bb 1
‑
6mg/l、igf
‑
1 1
‑
5mg/l、gm
‑
csf 1
‑
6mg/l、tgf
‑
β1 1
‑
6mg/l和r
‑
hgh 2~3ug/l、地塞米松2
‑
30nm、neaa0
‑
300mg/l、亚硒酸钠1
‑
30mg/l、γ
‑
氨基丁酸0
‑
30mg/l、胶原蛋白0.1
‑
20mg/l、乙醇胺20
‑
30nm、雌二醇1
‑
3mg/l、还原型谷胱甘肽2.5
‑
4mg/l、5
‑
羟色胺25~31ug/l、亚油酸2.5
‑
4ug/l、油酸1~2.5ug/l、卵磷脂1
‑
2.5ug/l、丙酮酸钠120~180mg/l、甲状腺素80~85nmol/l。
17.在一些实施方案中,所述的胰岛素为重组人胰岛素。
18.在一些实施方案中,所述转铁蛋白为重组人转铁蛋白。
19.在一些实施方案中,白蛋白为重组人白蛋白。
20.在一些实施方案中,所述维生素包括维生素c、维生素e、维生素b12。
21.在一些实施方案中,所述维生素包括维生素c1
‑
50mg/l、维生素e10
‑
35mg/l、维生素b12 10
‑
35mg/l。
22.在一些实施方案中,所述维生素包括维生素c1
‑
20mg/l、维生素e15
‑
35mg/l、维生素b12 15
‑
35mg/l。
23.在一些实施方案中,本发明提供了所述的培养基在培养细胞中的应用。
24.在一些实施方案中,所述细胞包括干细胞。
25.在一些实施方案中,所述干细胞包括全能干细胞和多能干细胞。
26.在一些实施方案中,所述干细胞包括间充质干细胞和诱导性多能干细胞。
27.本发明提供的这种无血清培养基,不含有fbs,无异源动物源性成分,降低细胞污染的几率,同时对msc的扩增起到促进作用。
28.在一些实施方案中,本发明提供的培养间充质干细胞的无血清培养基,通过对各种生长因子种类和多种组分和用量进行研究而获得,以无血清方式实现了间充质干细胞体外培养。本发明所述的培养基培养获得的细胞符合常规的mscs的性质,如形态、细胞表面分子与常规的mscs保持一致,具有较好的分化能力(包括成软骨分化、成脂分化、成骨分化)等,并且端粒酶活性阴性、软琼脂克隆形成试验阴性,安全性非常好。此无血清培养基体系中,间充质干细胞能够实现贴壁生长并有效地提高间充质干细胞的扩增能力,使得不含外源血清的培养体系更有利于干细胞被安全地应用于临床移植。
29.在一些实施方案中,所述无血清培养基培养获得的间充质干细胞与有血清培养的间充质干细胞相比,其培养获得的msc细胞来源的外泌体高表达scf、低表达il
‑
6、mcp
‑
3等炎性因子,提示具有更强的免疫功能。
30.在一些实施方案中,所述无血清培养基培养获得的间充质干细胞与有血清培养的间充质干细胞相比,其培养获得的msc细胞具有更好的糖尿病皮肤损伤的修复作用。
31.另外,uc
‑
msc细胞高表达abcb5、ido
‑
1、cd106、pd
‑
l1等多种因子,优于市场上其他培养基收获的细胞。在一些特定疾病治疗中具有很好的实际意义。
32.在一些实施方案中,所述的培养基培养获得的细胞高表达abcb5、ido
‑
1、cd106、pd
‑
l1。
33.在一些实施方案中,所述的培养基培养获得的细胞产生的外泌体高表达scf、低表达il
‑
6、mcp
‑
3。
34.在一些实施方案中,本发明提供了一种利用所述培养基培养细胞的方法。
35.在一些实施方案中,所述细胞包括干细胞。
36.在一些实施方案中,所述干细胞包括全能干细胞和多能干细胞。
37.在一些实施方案中,所述干细胞包括间充质干细胞和诱导性多能干细胞。
38.在一些实施方案中,本发明提供了所述的方法获得的细胞。
39.在一些实施方案中,所述细胞包括干细胞。
40.在一些实施方案中,所述干细胞包括全能干细胞和多能干细胞。
41.在一些实施方案中,所述干细胞包括间充质干细胞和诱导性多能干细胞。
42.在一些实施方案中,本发明提供了所述的细胞在制备治疗疾病药物中的应用。
43.在一些实施方案中,所述疾病包括伤口修复、免疫性疾病。
44.在一些实施方案中,所述细胞包括干细胞。
45.在一些实施方案中,所述干细胞包括全能干细胞和多能干细胞。
46.在一些实施方案中,所述干细胞包括间充质干细胞和诱导性多能干细胞。
47.在一些实施方案中,所述伤口为皮肤损伤。
48.在一些实施方案中,所述皮肤损伤为糖尿病患者的伤口。
附图说明
49.图1为uc
‑
msc细胞的显微镜下观察图。
50.图2为uc
‑
msc细胞表面分子流式鉴定结果。
51.图3为uc
‑
msc免疫抑制功能检测的实验流程图。
52.图4为uc
‑
msc免疫抑制功能检测结果。
53.图5为uc
‑
msc向软骨细胞分化的检测结果。
54.图6为uc
‑
msc成脂肪细胞分化和成骨分化的检测结果。
55.图7为uc
‑
msc细胞周期检测结果。
56.图8为uc
‑
msc端粒酶活性检测结果。
57.图9为uc
‑
msc软琼脂克隆形成试验结果。
58.图10为uc
‑
msc核型检测结果。
59.图11为western blot法对p7代uc
‑
msc细胞的多种炎性因子的表达量进行检测结果。
60.图12为本培养基与10%fbs培养基培养的uc
‑
msc细胞外泌体差异炎性因子的生物信息统计结果,a为差异炎性因子的生物学功能分类;b为差异炎性因子的信号通路分析结果
61.图13为uc
‑
msc细胞对糖尿病大鼠皮肤损伤的修复作用的结果。
62.图14为添加小分子化合物和未添加小分子化合物的培养基培养细胞生长速度对比。
63.图15为uc
‑
msc在培养基中的群体倍增时间曲线。
具体实施方式
64.以下通过具体的实施例进一步说明本发明的技术方案,具体实施例不代表对本发明保护范围的限制。其他人根据本发明理念所做出的一些非本质的修改和调整仍属于本发明的保护范围。
65.实施例1无血清培养基配方
66.无血清培养基配方1如表1所示。
67.表1无血清培养基配方
68.69.[0070][0071]
所述无血清培养基配方1的制备方法步骤如下:取以上序号为2
‑
48的47个成分的1000x的储备液1ml,加入到所述的dmem/f12基础培养基中,配置成1l的无血清培养基。各个成分在无血清培养基中的终浓度如表1所示。
[0072]
实施例2无血清培养基配方
[0073]
无血清培养基配方2如表2所示。
[0074]
表2无血清培养基配方
[0075]
[0076]
[0077][0078]
所述无血清培养基配方2的制备方法同实施例1。
[0079]
实施例3无血清培养基配方
[0080]
无血清培养基配方3如表3所示。
[0081]
表3无血清培养基配方
[0082]
[0083]
[0084]
[0085][0086]
所述无血清培养基配方3的制备方法同实施例1。
[0087]
实施例4无血清培养基配方
[0088]
无血清培养基配方4除了基础培养基为a
‑
mem,其他成分与实施例1相同。无血清培养基的制备方法同实施例1。
[0089]
实施例5msc分离与培养
[0090]
1、孕妇胎盘娩出后,自靠近胎盘部分剪下脐带,放入灭菌的含有双抗的pbs液体中,迅速带回实验室;
[0091]
2、无菌条件下取回脐带组织,pbs冲洗干净表面血污,放入75%酒精中3分钟灭菌,pbs冲洗脐带3次去除残余酒精;
[0092]
3、脐带两端各剪去约1cm组织,弃掉,剩余的脐带剪成约2
‑
3cm组织,放入含有pbs的平皿中,反复冲洗脐带组织,去除脐静脉、脐动脉血管中血液;
[0093]
4、取一段脐带组织至另一平皿中,用镊子去掉羊膜及三根血管,将剩余的wharton'sjelly(华通胶)放入另一平皿中;
[0094]
5、将所有的脐带组织分离完毕;
[0095]
6、将wharton's jelly剪成直径1
‑
2mm大小,加入1%(w/v)胶原酶ii、1%(w/v)胶原酶iv、1%(w/v)透明质酸酶、1%(w/v)dna酶、0.05%胰酶,37℃消化30
‑
60分钟;
[0096]
7、用100um的细胞筛过滤酶切完全的液体,弃掉未完全消化的组织;
[0097]
8、1000rpm/min,10分钟离心过滤后液体,弃掉上清;
[0098]
9、用培养基重悬沉淀细胞,加入10cm培养皿中培养。
[0099]
整个实验过程约需4
‑
5小时(分离一根脐带)。一般一段20cm的脐带组织分离得到的细胞可以分装5个10cm培养皿,
[0100]
实施例6 uc
‑
msc的鉴定
[0101]
1、细胞形态观察
[0102]
将实施例5分离得到的细胞接种在实施例1所述的培养基中,接种后24h便可看到贴壁细胞,约7天左右,结果如图1所示,显微镜下观察,显示uc
‑
msc细胞为典型的纺锤形,生长方式为贴壁生长,细胞生长状态正常。已经长满,可以传代或冻存。
[0103]
2、uc
‑
msc细胞表面分子鉴定
[0104]
将实施例5分离得到的细胞接种在实施例1所述的培养基中,进行传代培养。
[0105]
利用流式细胞仪对uc
‑
msc细胞的特征性marker进行检测,结果证实p5、p8代uc
‑
msc细胞表达cd73,cd90,cd105(≥95%)蛋白;不表达cd14,cd34,cd45,cd79a,hla(≤5%),
符合msc标准。
[0106]
3、免疫抑制功能检测
[0107]
本实施例中使用的无血清培养基如实施例1所示,复苏使用的细胞代数为p3代。
[0108]
t细胞培养完全培养基的配方:含有10%fbs的rpmi 1640培养液。
[0109]
pbmc的代数为原代。
[0110]
t细胞+msc共培养完全培养基指的是含有10%fbs的rpmi 1640培养液。
[0111]
利用丝裂霉素c处理uc
‑
msc细胞,使之不能继续增殖分裂,之后以一定比例与cfse标记的pbmc(原代分离出来的)共培养4天,检测uc
‑
msc细胞对pbmc中t细胞增殖的抑制作用。
[0112]
实验流程图如图3所示,检测结果如图4和表4所示。
[0113]
表4
[0114]
对比数据t细胞单独培养组t细胞与msc共培养组原始接种的细胞0.50x1060.50x106个t细胞与0.30x106个msc共培养t细胞增殖倍数2.2倍0.33倍
[0115]
结果显示,将uc
‑
msc与cfse标记的t细胞共培养五天,单独培养组t细胞大量扩增,共培养组t细胞没有扩增,表明uc
‑
msc细胞可以抑制t细胞增殖。
[0116]
4、诱导分化能力检测
[0117]
(1)uc
‑
msc向软骨细胞分化
[0118]
用于软骨分化的uc
‑
msc为使用实施例5分离与培养获得的第p3代uc
‑
msc,培养所使用的培养基为实施例1的无血清培养基。
[0119]
1)吸取2.5
×
105uc
‑
msc细胞转移到适当的培养管,清洗细胞。
[0120]
2)在分化培养基中重悬细胞,室温150g离心5分钟,弃上清,将细胞团块再次重悬于分化培养基(gibco
tm
,a1007101)中,室温150g离心5分钟,弃上清。
[0121]
3)将细胞重悬于分化培养基中,调整细胞密度为5
×
105细胞每毫升。
[0122]
4)将0.5毫升(2.5
×
105细胞)的细胞加入15毫升的聚丙烯管中,室温150g离心5分钟。
[0123]
5)将聚丙烯管置于培养箱中,松开一半的管盖使气体交换,37℃、5%co2培养24小时。不要弄散细胞。
[0124]
6)每2
‑
3天换一次培养基,每次的换液量为0.5毫升。注意换液过程中不要弄散细胞。
[0125]
7)换液后,轻弹培养管壁使细胞团块悬浮起来,将培养管重新放回培养箱中培养,半送开管盖使气体交换。
[0126]
8)连续培养14
‑
28天,收集细胞团块后用4%甲醛固定后用alcian blue染色。
[0127]
观察结果,如图5所示,为uc
‑
msc向软骨诱导分化21天经甲苯胺蓝染色后的结果。
[0128]
(2)uc
‑
msc细胞向脂肪细胞分化
[0129]
用于成脂分化的uc
‑
msc为使用实施例5分离与培养获得的uc
‑
msc,培养所使用的培养基为实施例1的无血清培养基。1)将uc
‑
msc细胞置于37℃,5%co2的培养箱中培养。
[0130]
2)当细胞融合度达到80%
‑
90%时,用0.25%trypsin
‑
0.04%edta进行消化。
[0131]
3)将消化下来的间质干细胞按照2
×
104cells/cm2的细胞密度接种在六孔板中,每
孔加入2ml完全培养基(实施例1所述的无血清培养基)。
[0132]
4)将细胞置于37℃,5%co2的培养箱中进行培养。
[0133]
5)每隔三天换液,直到细胞融合度达到100%或者过融合。
[0134]
6)小心地将间质干细胞完全培养基吸走,向六孔板中加入2ml oricelltm人脐带间质干细胞成脂诱导分化培养基a液(广州赛业公司)。
[0135]
7)诱导3天后,吸走六孔板中的a液,加入2ml oricelltm人脐带间质干细胞成脂诱导分化培养基b液。
[0136]
8)24h后,吸走b液,换回a液进行诱导。
[0137]
9)a液和b液交替作用3
‑
5次后(12
‑
20天),继续用b液维持培养4
‑
7天直到脂滴变得足够大、圆。b液维持培养期间,每隔2
‑
3天需要换用新鲜的b液。
[0138]
10)成脂诱导分化结束后,吸走六孔板中的间质干细胞成脂诱导分化培养基,用1
×
pbs冲洗1
‑
2次。每孔加入2ml 4%中性甲醛溶液,固定30min。
[0139]
11)吸走中性甲醛溶液,用1
×
pbs冲洗2次。每孔中加入1ml油红o染料工作液染色30min(工作液配制方法:油红o贮存液:蒸馏水=3:2,混匀后用中性滤纸过滤即可)。
[0140]
12)吸走油红o染液,用1
×
pbs冲洗2
‑
3次。
[0141]
13)将培养板置于显微镜下观察成脂染色效果。结果如图6所示,为成脂诱导21天后的实验结果。
[0142]
(3)uc
‑
msc向成骨细胞分化
[0143]
用于成骨分化的uc
‑
msc为使用实施例4分离与培养获得的uc
‑
msc,培养所使用的培养基为实施例1的无血清培养基。
[0144]
1)将uc
‑
msc细胞置于37℃,5%co2的培养箱中培养。
[0145]
2)当细胞融合度达到80
‑
90%时,用0.25%trypsin
‑
0.04%edta进行消化。
[0146]
3)将消化下来的人脐带间质干细胞按照2
×
104cells/cm2的细胞密度接种在事先包被0.1%明胶的六孔板中,每孔加入2ml完全培养基。。
[0147]
4)将细胞置于37℃,5%co2的培养箱中进行培养。
[0148]
5)当细胞融合度达到60%
‑
70%时,小心的将孔内完全培养基吸走,向六孔板中加入2ml oricelltm人脐带间质干细胞成骨诱导分化完全培养基(广州赛业)。
[0149]
6)每隔3天换用新鲜的oricelltm人脐带间质干细胞成骨诱导分化完全培养基(使用前需预热至37℃)
[0150]
7)诱导2
‑
4周后,视细胞的形态变化及生长情况,用茜素红进行染色。
[0151]
结果如图6所示,为成骨诱导28天后的实验结果。
[0152]
(4)细胞周期检测
[0153]
用于细胞周期检测的uc
‑
msc为使用实施例5分离与培养获得的uc
‑
msc,培养所使用的培养基为实施例2的无血清培养基。
[0154]
(1)正常培养uc
‑
msc细胞,待细胞汇合度达到50%左右,吸弃上清,dpbs清洗细胞两次;
[0155]
(2)加入1ml/孔胰酶消化液,置于37℃培养箱中消化3min,镜下观察细胞能漂起成单细胞时即可取出终止消化;
[0156]
(3)加入2ml培养基,摇晃培养板使皿底细胞全部脱落,吸出细胞悬液至15ml ep管
中,200g离心5分钟。
[0157]
(4)吸弃上清,加入1ml dpbs(不含钙镁)轻柔吹打重悬细胞,进行细胞计数。
[0158]
(5)根据计数结果,吸取1x106细胞对应体积细胞悬液到1.5ml ep管,补加dpbs(不含钙镁)至1ml,轻柔吹打混匀,使用掌上离心机离心15
‑
20秒。
[0159]
(6)吸弃上清,轻弹管底分散细胞沉淀,加入1ml预冷的70%乙醇溶液,轻柔吹打混匀,于4℃固定过夜检测,或4℃保存5天内检测。
[0160]
(7)将已固定的细胞用台式温控低速离心机,500
×
g离心10min,吸弃上清,加入1ml dpbs(不含钙镁)重悬混匀,再次使用台式温控低速离心机,500
×
g离心10min。
[0161]
(8)吸弃上清,轻弹管底分散细胞沉淀,加入500ul pi染色工作液,室温避光孵育30分钟
[0162]
(9)孵育结束,流式上机分析,收集3万个细胞。
[0163]
(10)将目标细胞群圈出,排除细胞碎片,设门p1。
[0164]
(11)新建双参数图,在p1中分析,纵坐标pe
‑
h,横坐标pe
‑
a,排除粘连细胞,设门p2。
[0165]
(12)新建直方图,在p2中分析,细胞群峰位置左侧最高峰为g1,对应数值的两倍处峰位置为g2,中间为s期。
[0166]
结果如图7所示,从图7可以看出,p3代uc
‑
msc细胞分裂比p8旺盛。
[0167]
图7左图为p3代细胞的检测结果,右图为p8代检测结果。
[0168]
7、端粒酶活性检测
[0169]
用于端粒酶活性检测的uc
‑
msc为使用实施例5分离与培养获得的第3代uc
‑
msc,培养所使用的培养基为实施例1的无血清培养基。
[0170]
(1)正常培养uc
‑
msc细胞,待细胞汇合度达到50%左右,吸弃上清,dpbs清洗细胞两次;
[0171]
(2)加入1ml/孔胰酶消化液,置于37℃培养箱中消化3min,镜下观察细胞能漂起成单细胞时即可取出终止消化;
[0172]
(3)加入2ml培养基,摇晃培养板使皿底细胞全部脱落,吸出细胞悬液至15ml ep管中,200g离心5分钟。
[0173]
(4)吸弃上清,加入1ml dpbs(不含钙镁)轻柔吹打重悬细胞,进行细胞计数。
[0174]
(5)根据计数结果,吸取1
×
106细胞悬液到1.5ml ep管,补加dpbs(不含钙镁)至1ml,轻柔吹打混匀,使用掌上离心机离心15
‑
20秒。
[0175]
(6)吸弃上清,立即加入200μl chaps lysis bμffer重悬细胞,将细胞悬液至于冰上30min,使用台式温控低速离心机,12000
×
g,4℃,离心20min。
[0176]
(7)吸取160μ上清液分装25μl每管,立即至于干冰速冻,存放于
‑
80℃保存;留取一管进行蛋白定量(bradford法,保证每次反应蛋白含量<1.5μg)。
[0177]
(8)根据蛋白浓度测定结果将样本用chaps lysis bμffer稀释至0.1μg/μl进行后续实验。
[0178]
(9)按如下表5体系根据实验需求,乘以所需反应数配制反应液。
[0179]
表5
[0180]5×
reaction mix2μl/pcr反应
taq polymerase0.16μl/pcr反应nuclease free water7.04μl/pcr反应
[0181]
封板,使用多孔板离心机瞬离10秒,待上机。
[0182]
(10)将已准备好的384孔反应板置于荧光定量pcr仪中,按如下程序进行qpcr反应。
[0183]
表6
[0184][0185]
实验结果如图8所示,uc
‑
msc细胞端粒酶活性阴性,代表其具体较好的安全性(无致瘤性)。
[0186]
8、软琼脂克隆形成试验
[0187]
用于软琼脂克隆形成试验的uc
‑
msc为使用实施例4分离与培养获得的获得的第3代uc
‑
msc,培养所使用的培养基为实施例1的无血清培养基。
[0188]
原理:细胞接种存活率只表示接种细胞后贴壁的细胞数,但贴壁后的细胞不一定每个都能增殖和形成克隆。而形成克隆的细胞必为贴壁和有增殖活力的细胞。克隆形成率反映细胞群体依赖性和增殖能力两个重要性状。由于细胞生物学性状不同,细胞克隆形成率差别也很大,一般初代培养细胞克隆形成率弱,传代细胞系强;二倍体细胞克隆形成率弱,转化细胞系强;正常细胞克隆形成率弱,肿瘤细胞强。并且克隆形成率与接种密度有一定关系,做克隆形成率测定时,接种细胞一定要分散成单细胞悬液,直接接种在碟皿中,持续一周,随时检查,到细胞形成克隆时终止培养。
[0189]
基本步骤:
[0190]
(1)取对数生长期细胞,用0.25%胰蛋白酶消化并轻轻吹打,使之成为单细胞,作活细胞计数,用含20%胎牛血清的dmem培养液调整细胞密度至1
×
106细胞/l。然后根据实验要求作梯度倍数稀释。
[0191]
(2)用蒸馏水分别制备出1.2%和0.7%两个浓度的低溶点琼脂糖液,高压灭菌后,维持在40℃中不会凝固。
[0192]
(3)按1:1比例使1.2%的琼脂糖和2
×
dmem培养基(含有2
×
抗生素和20%的小牛血清)混合后,取3ml混合液注入直径6cm平皿中(10cm平皿加7~10ml),冷却凝固,可作底层琼脂置co2温箱中备用。
[0193]
(4)按1:1比例让0.7%的琼脂糖和2
×
dmem培养基在无菌试管中相混以后,再向管中加入0.2ml的细胞悬液,充分混匀,注入铺有1.2%琼脂糖底层平皿中,逐形成双琼脂层。待上层琼脂凝固后,置入37℃5%co2温箱中培养10~14天。
[0194]
(5)把平皿放置在倒置显微镜下,观察细胞克隆数。计算形成率。
[0195]
软琼脂培养法常用检测肿瘤细胞和转化细胞系。试验中琼脂与细胞相混时,琼脂温度不宜超过40℃。接种细胞的密度每平方厘米不超过35个,一般6cm的平皿接种1000个细
胞。正常细胞在悬浮状态下不能增殖,不适用于软琼脂克隆形成试验。
[0196]
实验结果如图9和表7所示,uc
‑
msc细胞在软琼脂培养基中未形成克隆。
[0197]
表7
[0198]
名称day12克隆数day21克隆数uc
‑
msc00hela195300
[0199]
9、核型检测
[0200]
用于核型检测的uc
‑
msc为使用实施例4分离与培养获得的第3代uc
‑
msc,培养所使用的培养基为实施例1的无血清培养基。
[0201]
(1)待6孔板中细胞汇合度达到60%时,加入浓度为50ng/ml的秋水仙胺,37℃处理2h。
[0202]
(2)将细胞消化成单个细胞,1200rpm,5min离心收集,使用pbs重悬清洗一次。
[0203]
(3)37℃预热低渗kcl,低渗kcl重悬细胞转入15ml离心管中,加入低渗kcl补至10ml,37℃处理20
‑
40min。
[0204]
(4)加入甲醇:冰醋酸(3:1)固定液,1000rpm,10min离心,去上清,保留1ml上清。
[0205]
(5)轻柔吹打悬液,缓慢加入固定液,边加边振荡,直至离心管满,1500rpm,离心5min。
[0206]
(6)轻柔吹打悬液,缓慢加入固定液,边加边振荡,直至离心管满,静置15min。
[0207]
(7)1500rpm,5min,离心弃上清。
[0208]
(8)缓慢加入固定液,边加边振荡,直至离心管满,4℃静置过夜。
[0209]
(9)次日弃上清,取出事先
‑
20℃预冷的载玻片,立即滴片。
[0210]
(10)75℃,干燥1
‑
2h。
[0211]
(11)染片对玻片进行编号,再将玻片通过胰酶消化、生理盐水终止消化、吉姆萨染液(5ml吉姆萨+45ml pbs)染色,室温干燥。
[0212]
(12)扫片、分析将玻片上载至徕卡扫片机扫片后再进行染色体核型分析。
[0213]
结果如图10所示,g显带,计数20个分裂相,核型分析5个,未发现染色体数目或结构异常,uc
‑
msc细胞核型正常,为46,xx。
[0214]
10、多种炎症因子的检测
[0215]
用于多种炎症因子的检测的uc
‑
msc为使用实施例5分离与培养获得p7代uc
‑
msc,培养所使用的培养基为实施例1的无血清培养基。
[0216]
检测方法:待细胞细胞长至超过95%后,弃掉旧培养基,pbs清洗3次,消化下msc细胞,离心弃上清,用ripabuffer裂解细胞,之后高速离心,吸取蛋白上清做western blot。
[0217]
用western blot法对p7代uc
‑
msc细胞的多种炎性因子的表达量进行检测,结果如图11所示,发现利用本培养基收获的uc
‑
msc细胞高表达abcb5、ido
‑
1、cd106、pd
‑
l1等多种因子,优于市场上其他培养基收获的细胞。
[0218]
其中图11中各条带分别对应的培养基分别为:
[0219]
条带1:10%fbs+dmem/f12
[0220]
条带2:10%fbs+a
‑
mem
[0221]
条带3:gibco
tm
,a1033201
[0222]
条带4:本发明实施例1培养基配方
[0223]
条带5:stemcell mesencult人间充质干细胞培养基(货号05448)
[0224]
条带6:2%ultroser g+dmem/f12
[0225]
11、外泌体中炎性因子的检测
[0226]
(1)玻片芯片的完全干燥
[0227]
将玻片芯片从盒子中取出来,在室温平衡1h后,将包装袋打开,揭开密封条,然后将芯片放在真空干燥器或者室温干燥1
‑
2小时。
[0228]
(2)封闭和孵育
[0229]
1)每个芯片孔加入100μl的1
×
封闭液,室温摇床上孵育1h,避免产生气泡;
[0230]
2)抽去封闭液,每个孔中添加60μl样品,一个阵列一个样品,4℃振荡过夜孵育。(样品按250ug/ml上样。)
[0231]
3)使用thermo scientific wellwash versa芯片洗板机清洗玻片,分为两步,首先用1
×
洗液i进行清洗,每孔200μl的1
×
洗液i,清洗7次,每次震荡5s,震荡强度选择高,用去离子水稀释20
×
洗液i。然后换用1
×
洗液ii通道进行清洗,每孔200μl的1
×
洗液ii,清洗3次,每次震荡5s,震荡强度选择高,用去离子水稀释20
×
洗液ii。
[0232]
4)配制生物素标记抗体,快速离心生物素标记抗体的小管,每个小管加入300μl的1
×
封闭液,混合均匀。每孔加入70ul生物素标记抗体,室温震荡2小时。
[0233]
5)清洗,同步骤3)。
[0234]
6)每孔加入70μl的1500倍稀释的荧光剂
‑
链霉亲和素(快速离心后加入1.5ml的封闭液到荧光剂
‑
链霉亲和素的小管),用密封条贴住玻片,然后用铝箔纸包住玻片避光室温震荡孵育2个小时。(此步也可在4℃过夜孵育)
[0235]
7)清洗,同步骤3.
[0236]
(3)荧光检测
[0237]
1)采用激光扫描仪innoscan 300扫描信号,采用cy3或者绿色通道(激发频率=532nm)
[0238]
仪器型号innoscan 300microarray scanner;厂家:innopsys;产地:parc d'activit
é
s activestre;31 390carbonne
‑
france;扫描参数:wavelengh:532nm;resolution:10μm
[0239]
2)采用aah
‑
cyt
‑
g5的数据分析软件来进行数据分析。
[0240]
其中所述的样品为:
[0241]
实验组:从实施例5分离与培养获得的第p5代uc
‑
msc,使用实施例1的无血清培养基培养得到的uc
‑
msc使用常规的外泌体分离提取步骤提取获得的外泌体;
[0242]
对照组:与实验组的区别在于培养基为含有10%fbs的dmem/f12培养基。
[0243]
结果如图12a
‑
b,表所示:利用human cytokine antibody microarray slides蛋白芯片对利用本发明实施例1培养基培养获得的uc
‑
msc细胞来源的外泌体及利用10%fbs培养基培养获得的uc
‑
msc细胞来源的外泌体进行了比较分析,结果发现利用本发明培养基获得的uc
‑
msc细胞来源的外泌体高表达scf、低表达il
‑
6、mcp
‑
3等炎性因子,提示具有更强的免疫功能。
[0244]
表8
[0245]
名称比值scf5.4244604mcp
‑
30.2601518il
‑
60.2076086
[0246]
备注:表8中所述的比值为本发明培养基获得的uc
‑
msc细胞来源的外泌体中相应的因子的表达量与10%fbs培养基培养获得的uc
‑
msc细胞来源的外泌体中的相应因子的表达量的比值。
[0247]
12、uc
‑
msc细胞对糖尿病大鼠皮肤损伤的修复作用
[0248]
(1)构建糖尿病大鼠模型
[0249]
从北京维通利华公司购入七周龄zdf雌性大鼠,常规饲料喂养一周后换用高脂饲料(上海雍利)喂养,室内保持12h昼夜节律,温度(25
±
2)℃,自由摄食、饮水,每周检测大鼠血糖值、记录体重变化,至空腹血糖值稳定维持在11.1mmol/l以上,以成功构建糖尿病大鼠模型。
[0250]
(2)创伤修复
[0251]
对建模成功的糖尿病大鼠进行随机分组:pbs干预组、普通uc
‑
msc(含有10%fbs的dmem/f12培养基)、本发明培养基获得的uc
‑
msc(本发明实施例1培养基)。
[0252]
于各组大鼠背部开创1.5
×
1.5cm2大小的正方形伤口,分别于伤口四边皮下定点注射200μl pbs、200μl pbs重悬的1
×
106uc
‑
mscs(10%fbs)、200μlpbs重悬的1
×
106uc
‑
mscs(本发明实施例1的培养基),隔天测量大鼠背部伤口面积,绘制伤口愈合曲线。
[0253]
结果如图13所示,于糖尿病大鼠背部损伤部位进行皮下干预后,隔天测量大鼠背部伤口面积,在第3天经计算得到本培养基得到的uc
‑
msc干预组糖尿病大鼠背部损伤皮肤愈合率为29.9%,高于普通培养基培养的uc
‑
msc干预组15.9%以及pbs对照组2.4%;至第15天可肉眼观察到本培养基获得的uc
‑
msc干预组糖尿病大鼠背部皮损的愈合较另两组好,且经测量各组大鼠背部皮损愈合率均已达90%。
[0254]
备注:给药使用的普通uc
‑
msc和本发明培养基培养获得的uc
‑
msc的代数为p5代。
[0255]
实施例7
[0256]
在实施例1表1配方的基础上,未添加表1中所述的“小分子化合物”的培养基与实施例1表1所述的培养基按照实施例5所述的方法培养uc
‑
msc,细胞的生长情况如图14所述。
[0257]
uc
‑
msc细胞在未添加化合物的基础培养基中生长速率稍低于完全培养基。
[0258]
另外,使用实施例2表2的培养基配方培养uc
‑
msc的结果如图15所示。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1