促使iPSC分化为外周神经干细胞的方法及培养基和系统与流程
促使ipsc分化为外周神经干细胞的方法及培养基和系统
技术领域
1.本发明涉及细胞生物学技术领域,特别涉及一种促使诱导多能干细胞分化为外周神经干细胞的方法及培养基和系统。
背景技术:
2.外周神经系统的神经干细胞(peripheral nervous system neural progenitor,np)在疾病治疗、药物研发、科学研究等领域有巨大应用潜力,疾病治疗和药物研发都需要大量高纯度的np。np的现有获得方法主要为干细胞分化法,通过体外分化手段,将胚胎干细胞(embryonic stem cell,esc)或诱导多能干细胞(induced pluripotent stem cell,ipsc)分化为np。然而,现有体外分化方法大多工艺欠成熟,使用化学成分不完全明确的培养基,对培养基关键成分的浓度也未有深入研究,所得到的np批次间质量差异较大,不利工业生产,限制了np的应用。分化过程所使用的试剂和物料包含了牛血清白蛋白、鼠源细胞分泌物(基质胶,matrigel)等大量的动物源性成分,带来了动物病原体污染等风险,不利于包括临床治疗在内的各类应用。因上述情况,以现有干细胞分化法制备得到的np,和工业规模生产和实际临床应用仍有较大的距离。另一方面,esc本身的获得需要消耗胚胎组织,也存在一定的道德争议。此外,现有技术多用于科学研究,未尝试摸索np大量生产的方法,未能满足工业生产和治疗应用的需求。
3.综上,np的获得途径有限,制备工艺欠成熟,使用化学成分不完全明确、含动物源性成分的试剂和培养基,所得到的np批次间质量差异较大,制备成本高、产量低,局限了np的应用,亟需一种制备过程简化、制备时间短、污染风险小、产量和纯度高、利于工业化生产的分化方法和培养基。
技术实现要素:
4.针对现有技术中的缺陷,本发明提出了一种诱导多能干细胞分化为外周神经干细胞的方法及培养基和系统,在诱导多能干细胞的培养过程中使用玻连蛋白处理的细胞培养器皿,在诱导多能干细胞分化为外周神经干细胞的过程中使用重组层粘连蛋白处理的细胞培养器皿,同时使用无动物源性外周神经诱导培养基
‑
01进行培养。
5.本发明提供一种促使诱导多能干细胞分化为外周神经干细胞的方法,包括以下步骤:
6.s1:诱导多能干细胞的培养;
7.包括原代培养和传代培养,所述原代培养和所述传代培养中所用的细胞培养器皿均经过玻连蛋白处理;
8.s2:诱导多能干细胞分化为外周神经干细胞(peripheral nervous system neural progenitor,np);
9.开始分化前,将诱导多能干细胞接种在经过重组层粘连蛋白处理的细胞培养器皿中,使用无动物源性外周神经诱导培养基
‑
01进行培养,更换培养基,培养8~10天,以胰酶
替代物对诱导多能干细胞分化后得到的外周神经干细胞进行处理,收集外周神经干细胞。
10.进一步的,所述步骤s1中所述原代培养和/或所述传代培养中诱导多能干细胞的接种密度为1.0~2.5
×
104个/cm2,优选为1.5
×
104个/cm2。在1.5
×
104个/cm2的接种密度下诱导多能干细胞的相对产量最高。
11.进一步的,所述步骤s2中所述诱导多能干细胞的接种密度为1.0~4.0
×
104个/cm2,优选为2.0
×
104个/cm2。在2.0
×
104个/cm2的接种密度下外周神经干细胞的相对产量最高。
12.进一步的,所述步骤s2中所述无动物源性外周神经诱导培养基
‑
01包括以下成分:dmem/f12培养基、非必需氨基酸、胰岛素、全铁转铁蛋白、腐胺、人血白蛋白、超氧化物歧化酶、谷胱甘肽、黄体酮、视网醇、维生素a、dl
‑
α
‑
生育酚乙酸酯、维生素e、亚油酸、α
‑
亚麻酸、硫辛酸、ldn193189、sb431542、chir99021、ro4902097、su5402、全反式维生素a酸、y27632。其中,ldn193189、sb431542、chir99021、ro4902097、su5402、y27632为潜在候选药物的代号。
13.进一步的,所述无动物源性外周神经诱导培养基
‑
01中所述非必需氨基酸的含量为0.1~5%,所述含量为体积比;所述胰岛素的浓度为0.1~10μg/ml;所述全铁转铁蛋白的浓度为2~100μg/ml;所述腐胺的浓度为5~200μg/ml;所述人血白蛋白的浓度为250~2500μg/ml;所述超氧化物歧化酶的浓度为1~10μg/ml;所述谷胱甘肽的浓度为0.1~10μg/ml;所述黄体酮的浓度为1~10ng/ml;所述视网醇的浓度为0.01~2μg/ml;所述维生素a的浓度为0.01~2μg/ml;所述dl
‑
α
‑
生育酚乙酸酯的浓度为0.1~10μg/ml;所述维生素e的浓度为0.1~10μg/ml;所述亚油酸的浓度为0.1~10μg/ml;所述α
‑
亚麻酸的浓度为0.1~10μg/ml;所述硫辛酸的浓度为1~10ng/ml;所述ldn193189的浓度为0.1~1μg/ml;所述sb431542的浓度为1~10μg/ml;所述chir99021的浓度为2.5~12.5μg/ml、所述ro4902097的浓度为0.5~5μg/ml、所述su5402的浓度为0.5~5μg/ml、所述全反式维生素a酸的浓度为1~20ng/ml、所述y27632的浓度为1~10μg/ml。
14.本发明还提供一种促使诱导多能干细胞分化为外周神经干细胞的无动物源性外周神经诱导培养基
‑
01,包括以下成分:dmem/f12培养基、非必需氨基酸、胰岛素、全铁转铁蛋白、腐胺、人血白蛋白、超氧化物歧化酶、谷胱甘肽、黄体酮、视网醇、维生素a、dl
‑
α
‑
生育酚乙酸酯、维生素e、亚油酸、α
‑
亚麻酸、硫辛酸、ldn193189、sb431542、chir99021、ro4902097、su5402、全反式维生素a酸、y27632。所述无动物源性外周神经诱导培养基
‑
01完全无动物源性。其中,ldn193189、sb431542、chir99021、ro4902097、su5402、y27632为潜在候选药物的代号。
15.进一步的,所述非必需氨基酸的含量为0.1~5%,所述含量为体积比;所述胰岛素的浓度为0.1~10μg/ml;所述全铁转铁蛋白的浓度为2~100μg/ml;所述腐胺的浓度为5~200μg/ml;所述人血白蛋白的浓度为250~2500μg/ml;所述超氧化物歧化酶的浓度为1~10μg/ml;所述谷胱甘肽的浓度为0.1~10μg/ml;所述黄体酮的浓度为1~10ng/ml;所述视网醇的浓度为0.01~2μg/ml;所述维生素a的浓度为0.01~2μg/ml;所述dl
‑
α
‑
生育酚乙酸酯的浓度为0.1~10μg/ml;所述维生素e的浓度为0.1~10μg/ml;所述亚油酸的浓度为0.1~10μg/ml;所述α
‑
亚麻酸的浓度为0.1~10μg/ml;所述硫辛酸的浓度为1~10ng/ml;所述ldn193189的浓度为0.1~1μg/ml;所述sb431542的浓度为1~10μg/ml;所述chir99021的浓
度为2.5~12.5μg/ml、所述ro4902097的浓度为0.5~5μg/ml、所述su5402的浓度为0.5~5μg/ml、所述全反式维生素a酸的浓度为1~20ng/ml、所述y27632的浓度为1~10μg/ml。
16.本发明还提供一种促使诱导多能干细胞分化为外周神经干细胞的系统,包括以下组分:
17.(1)玻连蛋白处理的细胞培养器皿;
18.(2)重组层粘连蛋白处理的细胞培养器皿;
19.(3)所述的无动物源性外周神经诱导培养基
‑
01。
20.其中,玻连蛋白和重组层粘连蛋白处理细胞培养器皿在培养器皿层面避免了动物源性物料。
21.进一步的,所述重组层粘连蛋白处理的细胞培养器皿的表面面积为9.5~75cm2。75cm2的大器皿可以实现大体积量的外周神经干细胞制备,有利于工业化生产。
22.综上,与现有技术相比,本发明达到了以下技术效果:
23.1.本发明的方法改良试剂组合,培养基配方可做到化学成分明确,成功摸索关键试剂的浓度范围,在每个批次的培养基进行配制时,可对所有原材料进行控制,并减少因培养基成分不明或试剂浓度不确定确带来的终产品质量波动,在培养基的质量控制和终产品的质量控制上有明显优势,上述改进使外周神经干细胞的制备工艺得到整体优化,有利于工业化生产。
24.2.本发明的方法以非动物源性物料部分或完全取代牛源性、鼠源性物料,开发了无动物源性培养体系,减少动物病原体污染等风险。其中,现有技术往往使用b27这个血清替代物,但b27其实仍含有动物源性,并且其各个原料浓度是不公开的,不利质量控制。上述改进有利包括临床治疗在内的各类应用。
25.3.本发明的方法对细胞接种密度、培养用器皿的大小、培养基使用量等条件进行了摸索,有利于外周神经干细胞大量生产,满足工业生产和治疗应用的需求。
26.4.本发明的方法获得的外周神经干细胞的纯度高,可收获纯度大于90%的外周神经干细胞。
27.5.本发明的方法可以缩短分化为外周神经干细胞的时间,可在最短8天内获得高纯度的外周神经干细胞。
附图说明
28.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
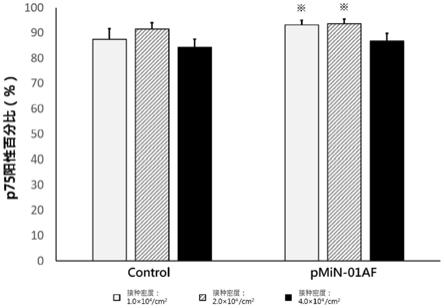
29.图1为各个培养基配方对不同接种密度的ipsc进行分化后,np的纯度。
※
:对比接种密度4.0
×
104,p≤0.05。
30.图2为各个培养基配方对不同接种密度的ipsc进行分化后,np的产量。
§
:同培养基,对比接种密度1.0
×
104,p≤0.05,有统计学意义;
§
§
:同培养基,对比接种密度1.0
×
104以及2.0
×
104,p≤0.05,有统计学意义;
$
:pmin对比control,相同接种密度,p≤0.05,有统计学意义。
31.图3为pnim01
‑
af对接种在表面面积各异的培养皿的ipsc进行分化后,np的纯度。
32.图4为pnim01
‑
af对接种在表面面积各异的培养皿的ipsc进行分化后,np的产量。
具体实施方式
33.为了使本技术领域的人员更好地理解本发明方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
34.本发明的方法具体包括以下几个步骤:
35.(1)ipsc的培养
36.将ipsc以1.0~2.5
×
104个/cm2的密度接种在经过玻连蛋白(vitronectin,vc,无动物源性,代替鼠源性的基质胶matrigel等物料)处理的细胞培养器皿,使用essential 8培养基(e8)进行原代培养,每隔24小时更换培养基,3~4天后、ipsc融合度达到60~80%时以胰酶替代物(tryple)或edta(浓度为0.5mm)对ipsc进行处理,收集ipsc后进行传代培养,传代时同样以1.0~2.5
×
104个/cm2的密度接种在经过玻连蛋白处理的细胞培养皿。
37.(2)ipsc的np分化
38.开始分化前的24小时,将ipsc以1.0~4.0
×
104个/cm2的密度接种在经过重组层粘连蛋白(laminin,lm,无动物源性,代替鼠源性的基质胶matrigel等物料)处理的细胞培养器皿,使用无动物源性外周神经诱导培养基
‑
01(pnim
‑
01af)进行培养,每隔36~48小时更换培养基,在培养8~10天后以tryple对ipsc分化后得到的np进行处理,收集到的np可用于分析、下一步试验或冷冻保存。
39.(3)ipsc的np分化—更大规模np制备摸索
40.将ipsc以2.0
×
104个/cm2的密度接种在经过重组层粘连蛋白(lm)处理的、表面面积各异的细胞培养器皿,以pnim
‑
01af进行培养,对不同表面面积(大小)的培养器皿生产np的能力进行测试。
41.实施例1 ipsc的培养
42.将ipsc以1.0~2.5
×
104个/cm2的密度(实施例接种密度:1.5
×
104个/cm2)接种在经过玻连蛋白(vc)处理的细胞培养器皿(实施例培养皿:6孔板),使用e8进行培养(实施例用量:6孔板每孔2ml),每隔24小时更换培养基,3~4天后、ipsc融合度达到60~80%时以edta(0.5mm)对ipsc进行处理(edta处理时间范围:3~8分钟,实施例处理时间:5分钟),收集ipsc后进行传代,传代时同样以1.0~2.5
×
104个/cm2的密度(实施例接种密度:1.5
×
104个/cm2)的密度接种在经过vc处理的细胞培养皿。
43.实施例2 ipsc的np分化
44.开始分化前的24小时,将ipsc以1.0~4.0
×
104个/cm2的密度接种在经过重组层粘连蛋白(lm)处理的细胞培养器皿(实施例最佳接种密度:2.0
×
104个/cm2,详见下文表3),无动物源性外周神经诱导培养基
‑
01(pnim
‑
01af)进行培养(实施例用量:6孔板每孔2ml)。
45.pnim
‑
01af的最终配方经过对比试验确定,首先设计了“无动物源性外周神经诱导培养基
‑
01(pnim
‑
01af)”,再和现有工艺中含动物源性成分的培养基(control)进行对比,
具体如下表1~2,均是在序号为1的dmem/f12基础培养基中添加序号2到最后一行的组分。
46.表1现有含动物源性成分外周神经诱导培养基(control)
[0047][0048][0049]
*:b27为动物源性。
[0050]
表2无动物源性外周神经诱导培养基
‑
01(pnim
‑
01af)
[0051]
序号成分浓度范围1dmem/f12/2非必需氨基酸(100x)0.1~5x,即0.1~5%(体积比)3胰岛素0.1~10μg/ml4全铁转铁蛋白2~100μg/ml5腐胺5~200μg/ml6人血白蛋白250~2500μg/ml7超氧化物歧化酶1~10μg/ml8谷胱甘肽0.1~10μg/ml9黄体酮1~10ng/ml10视网醇0.01~2μg/ml11维生素a0.01~2μg/ml12dl
‑
α
‑
生育酚乙酸酯0.1~10μg/ml13维生素e0.1~10μg/ml14亚油酸0.1~10μg/ml15α
‑
亚麻酸0.1~10μg/ml16硫辛酸1~10ng/ml17ldn1931890.1~1μg/ml18sb4315421~10μg/ml19chir990212.5~12.5μg/ml20ro49020970.5~5μg/ml21su54020.5~5μg/ml
22全反式维生素a酸1~20ng/ml23y27632**1~10μg/ml
[0052]
**:y27632在培养的首36~48小时加入。
[0053]
ldn193189、sb431542、chir99021、ro4902097、su5402、y27632为潜在候选药物的代号。
[0054]
为验证2种配方诱导ipsc分化为np的效力,按照下表3接种ipsc并以表1~2所示的外周神经诱导培养基进行为期8~10天的分化培养,期间每36~48小时更换培养基,完成后统计np的纯度,从而优选出最佳的ipsc接种密度。
[0055]
表3 ipsc接种密度以及各个培养基配方的np分化结果
[0056][0057]
注:np纯度通过统计外周神经系统神经干细胞标志物p75的阳性百分比计算。
[0058]
※
:同培养基,对比接种密度4.0
×
104,p≤0.05,有统计学意义。
[0059]
§
:同培养基,对比接种密度1.0
×
104,p≤0.05,有统计学意义。
[0060]
§§
:同培养基,对比接种密度1.0
×
104以及2.0
×
104,p≤0.05,有统计学意义。
[0061]
$
:pmin
‑
01af对比control,相同接种密度,p≤0.05,有统计学意义。
[0062]
通过表3数据得到结论,“无动物源性外周神经诱导培养基
‑
01”在1.0
×
104个/cm2、2.0
×
104个/cm2和4.0
×
104个/cm2的接种密度下,都可以收获纯度≥80%的np,其中在1.0
×
104个/cm2和2.0
×
104个/cm2的接种密度下,纯度≥90%(图1)。“无动物源性外周神经诱导培养基
‑
01”在1.0
×
104个/cm2和2.0
×
104个/cm2的接种密度下收获的np,数量高于现有含动物源性成分外周神经诱导培养基,并且批次间产量的波动有所减少(图2)。上述结论,“无动物源性外周神经诱导培养基
‑
01”命名为pnim
‑
01af。
[0063]
使用“pnim
‑
01af”配方,可在最短8天从ipsc分化出纯度≥90%的np。“pnim
‑
01af”配方是成功制备高纯度np的必要条件。其中“pnim
‑
01af”完全不含动物源性成分,化学成分明确,可用于临床治疗用np的制备。现有技术往往使用化学成分不完全明确的培养基,工艺整体较不成熟,导致np批次间质量差异较大,不利工业生产,限制了np的应用。
[0064]
实施例3 ipsc的np分化—更大规模np制备摸索
[0065]
将ipsc以2.0
×
104个/cm2的密度接种在经过重组层粘连蛋白(lm)处理的、表面面积各异的细胞培器皿,以pnim
‑
01af进行培养,详见下文表4。
[0066]
表4不同表面面积培养器皿np分化结果
[0067][0068]
通过表4数据得到结论,在9.5、25和75cm2三种表面面积,使用pnim
‑
01af对ipsc进行分化均可收获纯度≥90%的np(图3),而表面面积大小对外周神经干细胞产量并无显著影响(图4)。ipsc的接种密度和可行的培养器皿表面面积均是本发明摸索所得,有利工业化生产。
[0069]
综上,本发明的方法中ipsc培养器皿以玻连蛋白处理,np分化时培养器皿以重组层粘连蛋白(laminin)处理,培养体系以玻连蛋白和重组层粘连蛋白取代基质胶matrigel对培养器皿进行处理,首先在培养器皿层面避免了动物源性物料。np收获时以胰酶替代物处理,培养基“pnim
‑
01af”不含动物源性。至此,本发明可以做到全流程无动物源性。
[0070]
使用“pnim
‑
01af”,对接种密度在1.0
×
104个/cm2、2.0
×
104个/cm2和4.0
×
104个/cm2的接种密度下,都可以收获纯度≥80%的np,其中在1.0
×
104个/cm2和2.0
×
104个/cm2的接种密度下,纯度≥90%,基于以2.0
×
104个/cm2接种ipsc时np生产效率较高,选择了2.0
×
104个/cm2的接种密度。
[0071]
对比现有培养基配方,使用“pnim
‑
01af”可显著增加np的产量,并缩小批次间产量的波动,有利于工业化生产。
[0072]
使用“pnim
‑
01af”,对接种密度为2.0
×
104个/cm2,接种在6孔板(每孔表面面积9.5cm2)、25cm2培养皿和75cm2培养皿的ipsc进行分化,均可收获纯度≥90%的np,结果显示“pnim
‑
01af”从较小(9.5cm2)至较大(75cm2)表面面积的细胞培养器皿,均可促使ipsc分化为纯度≥90%的np。
[0073]
pnim
‑
01af完全避免了动物源性、并且培养基配方化学成分明确,在每个批次的培养基进行配制时,可对所有原材料进行控制,在培养基的质量控制上有明显优势,适合临床治疗或研究用np的制备。
[0074]
综合以上实施例,本发明相对于现有技术具有明显的优势和进步:
[0075]
(1)ipsc分化为np工艺的优化
[0076]
本发明通过使用“pnim
‑
01af”培养基配方以及相对应的培养方法,不但可制备高纯度np,更显著提升了绝对产量和缩小了批次间产量的差异,有利工业化生产。
[0077]
(2)培养基配方“pnim
‑
01af”化学成分明确
[0078]
一些现有np制备法使用血清或化学成分不明确的添加物,但本发明的培养基配方“pnim
‑
01af”所有化学成分明确,在每个批次的培养基进行配制时,可对所有原材料进行控制,在培养基的质量控制上有明显优势。
[0079]
(3)工艺整体无动物源性
[0080]
一些现有np制备法使用牛源性血清、鼠源细胞分泌物(matrigel)等,引入动物源性致病因子污染风险,本发明的方法可做到全流程无动物源性,相当程度上避免了动物源
性致病因子污染风险。
[0081]
(4)可在较大培养器皿实施np制备
[0082]
经验证,本发明方案的适用范围涵盖从较小(9.5cm2)至较大(75cm2)表面面积的细胞培养器皿,加大了每个批次的np产量,有利工业化生产,这是本发明的重要进步,因为目前现有技术中并无大体积量制备外周神经干细胞且能达到很高纯度和产量的先例。
[0083]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1