含佐剂基因的羊支原体肺炎二价核酸疫苗的构建方法
1.本发明涉及疫苗构建技术领域,具体涉及含佐剂基因的羊支原体肺炎二价核酸疫苗的构建方法。
背景技术:
2.羊支原体肺炎是由丝状支原体山羊亚种(mycoplasma mycoides subsp. capri,mmc)、绵羊肺炎支原体(mycoplasma ovipneumoniae,mo)和山羊支原体山羊亚种(mycoplasma capricolum subsp.capricolum,mcc)等支原体引起的在羊群中普遍流行的接触性传染病,纤维素性肺炎和胸膜炎是其主要特征,被世界动物卫生组织(oie)列为b类传染病。近年来,我国多个养羊业发达的省区均有羊支原体肺炎的发生和流行的报道,疫病的流行严重影响着养羊业的健康发展,危害日趋加重,给全国养羊业造成巨大经济损失,且我国该病病原以绵羊肺炎支原体和丝状支原体山羊亚种两种病原为主。免疫接种依然是防治该类传染病的重要措施之一,目前使用的疫苗为灭活疫苗,还存在一些不足:
①
灭活疫苗的免疫保护效力十分有限,且不能激发保护性细胞免疫应答;
②
羊支原体肺炎病原种类多样,目前的疫苗主要以mmc生产,但mo和mmc之间无交叉免疫保护,灭活疫苗存在生产周期长,生产成本高等因素。因此,新型疫苗的开发显得十分迫切和必要。
3.羊肺炎支原体主要通过呼吸道等粘膜途径侵入山羊机体内,也可通过受伤的皮肤侵入,引起传染性胸膜肺炎、关节炎、乳腺炎以及结膜炎等表现。可见,阻止羊支原体从呼吸道粘膜侵入山羊机体内,诱发呼吸道等粘膜内相关淋巴组织的免疫应答应是羊肺炎支原体新型疫苗的研究关键或重点之一,而这正是粘膜免疫疫苗
‑
dna疫苗的优势所在。
4.相关研究资料认为,dna疫苗抗原对黏膜免疫系统有效刺激是产生免疫效果的必要条件,而对黏膜免疫系统产生有效刺激需要两个条件,一是dna 疫苗抗原能够有效投递到黏膜免疫系统;二是需要合适的黏膜佐剂。目前,已报道的粘膜免疫佐剂主要可分为三类:第一类是细菌性物质,包括蛋白(主要是细菌毒素)和核酸;第二类是各种细胞因子;第三类是抗原递送系统。而在 dna疫苗研究过程中使用广泛的应数第一类中cpg odn序列(cpg)、霍乱毒素b亚单位(ctb)和大肠杆菌不耐热肠毒素b亚单位(ltb),且免疫佐剂效果明显。本发明针对dna疫苗免疫效果不尽理想问题,提出含佐剂基因的羊支原体肺炎二价核酸疫苗的构建方法。
技术实现要素:
5.本发明的目的是提供含佐剂基因的羊支原体肺炎二价核酸疫苗的构建方法,通过选择两个不同抗原基因和黏膜免疫佐剂基因研制出核酸疫苗,可有效针对羊支原体肺炎dna疫苗免疫效果弱等问题,解决目前疫苗研发所面临的诸多问题。
6.为了实现上述目的,本发明提供如下技术方案:含佐剂基因的羊支原体肺炎二价核酸疫苗的构建方法,具体步骤如下:
7.步骤一、mo/mmc基因组的提取:
8.s1、mo/mmc贵州株的复苏与培养:
9.在超净工作台中使用酒精棉球擦拭保存mo贵州株和mmc贵州株的单管式冷冻管表面,用剪刀打开管口,加入改良hayflick's培养基溶解冻干菌种,将溶液接种于5mlhayflick's培养基,37℃恒温震荡培养箱培养3~5d,当培养基颜色变为黄色时取200μl进行传代,连续传3代,并把每代培养物4℃保存备用;
10.s2、mo/mmc贵州株dna的提取:
11.取第3代培养产物参照支原体基因组dna提取试剂盒提取获得mo、mmc的总dna,并运用核酸蛋白测定仪测定核酸浓度;
12.步骤二、p113
‑
lppa
‑
il
‑
2融合基因扩增:
13.s1、粘膜免疫佐剂基因、绵羊肺炎支原体和丝状支原体山羊亚种抗原基因扩增:
14.材料:pmd19
‑
t
‑
il
‑
2克隆质粒、绵羊肺炎支原体贵州分离株、丝状支原体山羊亚种贵州分离株,2
×
taqpcrmastermix、dl2000dnamarker;方法具体为:参考genbank数据库mogz
‑
qx1株的p113基因序列和mmcpg3株的lppa基因序列信息及山羊il
‑
2基因序列,结合真核表达载体pvax1多克隆位点,应用软件各设计一对特异性引物,p113基因上游选用hindⅲ作为酶切位点、il
‑
2基因下游选用xhoⅰ作为酶切位点;
15.根据特异性引物,运用pcr技术依次扩增p113、lppa和il
‑
2基因,扩增大小分别为696bp、450bp和462bp,建立25μl反应体系,混合均匀后,按下列反应条件进行目的基因pcr扩增:95℃5min;95℃45s,58℃45s,72℃45s,35个循环;72℃10min;取7μlpcr产物应用含goldview核酸染料的1.2%琼脂糖凝胶电泳,凝胶成像系统观察结果;
16.s2、p113
‑
lppa融合基因扩增:
17.材料:2
×
taqpcrmastermix、dl2000dnamarker;方法具体为:以p113基因和lppa基因pcr产物为模板,p113
‑
f、lppa
‑
r为引物,soe
‑
pcr技术扩增p113
‑
lppa融合基因,预扩增片段大小1146bp;建立25μl反应体系,混合均匀后,按下列反应条件进行目的基因pcr扩增:95℃5min;95℃45s,61℃45s,72℃45s,35个循环;72℃10min,取7μlpcr产物应用含goldview核酸染料的1.2%琼脂糖凝胶电泳,凝胶成像系统观察结果;
18.s3、p113
‑
lppa
‑
il
‑
2融合基因扩增:
19.材料:2
×
taqpcrmastermix、dl2000dnamarker;方法具体为:以p113
‑
lppa融合基因和il
‑
2基因pcr产物为模板,p113
‑
f、il
‑2‑
r为引物,soe
‑
pcr技术扩增p113
‑
lppa
‑
il
‑
2融合基因,预扩增片段大小1608bp,建立25μl反应体系,按下列反应条件进行目的基因pcr扩增:95℃5min;95℃45s,57℃45s,72℃1min,35个循环;72℃10min,取7μlpcr产物应用含goldview核酸染料的1.2%琼脂糖凝胶电泳,凝胶成像系统观察结果;
20.步骤三、含粘膜免疫佐剂基因的羊支原体肺炎二价核酸疫苗的制备:
21.s1、pvax1
‑
p113
‑
lppa
‑
il
‑
2真核表达载体的构建:
22.材料:真核表达载体pvax1、大肠杆菌感受态细胞dh5α、2
×
taqpcrmastermix、限制性内切酶、dl2000dnamarker、dl5000dnamarker;方法具体为:
23.1、目的基因双酶切:应用限制性内切酶hindⅲ和xhoⅰ对目的基因p113
‑
lppa
‑
il
‑
2胶回收产物进行双酶切,建立50μl双酶切体系,37℃水浴酶切5h,应用胶回收试剂盒对双酶切产物进行目的基因的纯化回收,
‑
20℃保存备用;
24.2、pvax1载体双酶切:应用限制性内切酶hindⅲ和xhoⅰ对表达载体pvax1进行双
酶切,建立50μl双酶切体系,37℃水浴酶切5h,应用胶回收试剂盒对双酶切产物进行目的基因的纯化回收,
‑
20℃保存备用;
25.3、连接:将纯化目的基因p113
‑
lppa
‑
il
‑
2与pvax1载体运用快速连接试剂盒连接,建立20μl连接体系,22℃连接1h获得连接产物;
26.4、转化:取大肠杆菌感受态细胞dh5α置于冰上,向感受态细胞中加入20μl连接产物,轻轻混匀后冰浴30min,42℃水浴中热冲击90s,热冲击后迅速置于冰上作用3~5min,加入lb液体培养基至总体积1ml,混匀后37℃振荡培养1h,使细菌恢复正常生长状态,并表达质粒编码的抗生素抗性基因(kan+),将菌液4℃5000r/min离心5min,弃去800μl上清,用剩余液体悬浮沉淀,取200μl涂布于含有kan+的lb平板上,正面放置待完全吸收后倒置培养皿,于37℃恒温箱培养16~24h后,进行阳性克隆挑选;
27.s2、pvax1
‑
p113
‑
lppa
‑
il
‑
2阳性重组质粒筛选:
28.材料:质粒提取试剂盒、2
×
taqpcrmastermix、限制性内切酶、dl2000dnamarker、dl5000dnamarker;方法具体为:
29.1、重组质粒提取:挑取单个菌落,接种于5ml含有kan+的lb液体培养基中,37℃恒温振荡培养过夜,使用e.z.n.a.
tm
plasmidkit质粒提取试剂盒提取重组菌的质粒dna,具体步骤如下:取1ml培养好的菌液,室温13000r/min离心5min,弃上清,加入250μlsolutionⅰ垂悬菌体,加入250μlsolutionⅱ,上下颠倒离心管,直至溶液澄清,室温孵育2min,加入350μlsolutionⅲ立即混匀,出现白色絮状沉淀,4℃13000r/min离心10min,将上清移入吸附柱,室温10000r/min离心1min,弃废液,加500μlbufferhb,洗涤吸附柱,室温10000r/min离心1min,弃废液,加700μldnawashbuffer,室温10000r/min离心1min,弃废液,重复上一步操作后,再4℃13000r/min空柱离心2min,将吸附柱插入新1.5ml离心管,加入40μlelutionbuffer,室温静置2min,室温13000r/min离心1min洗脱质粒dna,
‑
20℃保存备用;
30.2、重组质粒pcr鉴定:以重组质粒dna作为模板建立25μl反应体系,混合均匀后,按下列反应条件进行目的基因pcr扩增:95℃5min;95℃45s,57℃45s,72℃1min,35个循环;72℃10min。取7μlpcr产物应用含goldview核酸染料的1.2%琼脂糖凝胶电泳,凝胶成像系统观察结果;
31.3、重组质粒pvax1
‑
p113
‑
lppa
‑
il
‑
2双酶切鉴定:应用限制性内切酶hindⅲ和xhoi对重组质粒dna进行双酶切,建立30μl双酶切体系,上述混合物37℃水浴5h,双酶切产物经1.2%琼脂糖凝胶电泳后观察结果,对经过pcr和双酶切鉴定为阳性的重组质粒测序;
32.s3、pvax1
‑
p113
‑
lppa
‑
il
‑
2重组质粒的体外表达鉴定:
33.材料:mdbk细胞(牛肾细胞)、p113
‑
lppa
‑
il
‑
2融合蛋白兔源阳性血清、标准胎牛血清、胰蛋白酶、双抗、脂质体、mem基础培养基、无内毒素质粒提取试剂盒、羊抗兔igg
‑
fitc、rna提取试剂盒、2
×
taqpcrmastermix、dl2000dnamarker;
34.方法具体为:
35.1、无内毒素质粒的提取:按无内毒素质粒提取试剂盒说明书进行质粒提取备用;
36.2、转染mdbk细胞:应用lipofecttamine
tm3000
转染试剂,将制备好的重组质粒质粒导入mdbk细胞,同时设立未转染的正常细胞对照和空载体对照
37.3、mdbk细胞培养mdbk细胞于37℃,5%co2环境下用含10%胎牛血清、1~2%双抗
的mem培养液培养,使其转染前在6孔细胞培养板中贴壁生长至70~80%;
38.4、脂质体3000转染,具体操作步骤如下:溶液a:取灭菌的eppendorf 管,分别加入2.5μg重组质粒质粒,用无血清的mem培养液稀释至250μl;溶液b:将10μl lipofecttamine
tm3000
脂质体溶于240μl无血清的mem培养液,混匀后室温放置5min;合并溶液a和溶液b,室温放置20min,无血清 mem培养液洗6孔细胞培养板两次,每孔加入混合液500μl后加mem培养液稀释至总体积2ml,37℃,5%co2恒温培养箱培养6h,弃转染液,加入含血清的mem培养液,培养48~72h,检测转染效果;
39.5、体外表达鉴定:转染48h后,应用rna提取试剂盒分别提取重组质粒组、空载体pvax1组和空白对照组转染细胞总rna,按照一步法试剂盒的方法进行rt
‑
pcr扩增及琼脂糖凝胶电泳检测,转染48h后取细胞飞片,以 p113
‑
lppa融合蛋白兔源阳性血清为一抗,fitc标记的羊抗兔igg为二抗,对重组质粒pvax1
‑
p113
‑
lppa
‑
il
‑
2、空载体pvax1以及空白对照转染mdbk 细胞进行间接免疫荧光检测。
40.在上述技术方案中,本发明提供的技术效果和优点:
41.本发明选择两个不同抗原基因和黏膜免疫佐剂基因研制出核酸疫苗,可有效针对羊支原体肺炎dna疫苗免疫效果弱等问题,解决目前疫苗研发所面临的诸多问题。
具体实施方式
42.为了使本领域的技术人员更好地理解本发明的技术方案,下面将对本发明作进一步的详细介绍。
43.本发明提供含佐剂基因的羊支原体肺炎二价核酸疫苗的构建方法,具体步骤如下:
44.步骤一、mo/mmc基因组的提取:
45.s1、mo/mmc贵州株的复苏与培养:
46.在超净工作台中使用酒精棉球擦拭保存mo贵州株和mmc贵州株的单管式冷冻管表面,用剪刀打开管口,加入改良hayflick's培养基溶解冻干菌种,将溶液接种于5mlhayflick's培养基,37℃恒温震荡培养箱培养3~5d,当培养基颜色变为黄色时取200μl进行传代,连续传3代,并把每代培养物4℃保存备用。
47.s2、mo/mmc贵州株dna的提取:
48.取第3代培养产物参照天根生化科技(北京)有限公司支原体基因组dna 提取试剂盒提取获得mo、mmc的总dna,并运用赛默飞世尔科技公司核酸蛋白测定仪测定核酸浓度。
49.步骤二、p113
‑
lppa
‑
il
‑
2融合基因扩增:
50.s1、粘膜免疫佐剂基因、绵羊肺炎支原体和丝状支原体山羊亚种抗原基因的扩增:
51.材料:pmd19
‑
t
‑
il
‑
2克隆质粒、绵羊肺炎支原体贵州分离株、丝状支原体山羊亚种贵州分离株由贵州省动物疫病与兽医公共卫生重点试验室保存; 2
×
taq pcr mastermix购自天根生化科技(北京)有限公司;dl2000 dna marker 购自takara公司;其它试剂为国产分析纯。
52.方法:参考genbank数据库mo gz
‑
qx1株的p113基因序列(登录号: kr270152)和mmc pg3株的lppa基因序列(登录号:af072715.1)信息及山羊il
‑
2基因序列(登录号:ef056469.1),结合真核表达载体pvax1多克隆位点,应用软件各设计一对特异性引物,p113
基因上游选用hindⅲ作为酶切位点(下划线标识)、il
‑
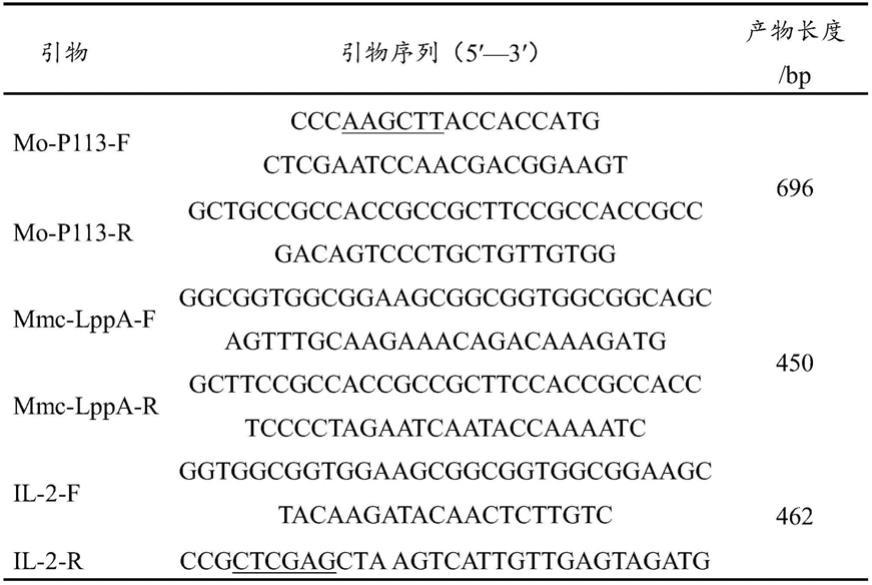
2基因下游选用xhoⅰ作为酶切位点(下划线标识),引物由生工生物工程(上海)股份有限公司合成,引物序列及预扩增长度见表1。
53.表1引物序列
[0054][0055]
根据表1中所对应的特异性引物,运用pcr技术依次扩增p113、lppa 和il
‑
2基因,预计扩增大小分别为696bp、450bp和462bp。建立25μl反应体系:
[0056][0057][0058]
混合均匀后,按下列反应条件进行目的基因pcr扩增:95℃5min;95℃ 45s,58℃45s,72℃45s,35个循环;72℃10min。取7μl pcr产物应用含 gold view核酸染料的1.2%琼脂糖凝胶电泳,凝胶成像系统观察结果。
[0059]
s2、p113
‑
lppa融合基因扩增:
[0060]
材料:2
×
taq pcr mastermix购自天根生化科技(北京)有限公司;dl2000 dna marker购自takara公司;其它试剂为国产分析纯。
[0061]
方法:以p113基因和lppa基因pcr产物为模板,p113
‑
f、lppa
‑
r为引物,soe
‑
pcr技术扩增p113
‑
lppa融合基因,预扩增片段大小1146bp。建立25μl反应体系:
[0062][0063]
混合均匀后,按下列反应条件进行目的基因pcr扩增:95℃5min;95℃45s,61℃45s,72℃45s,35个循环;72℃10min。取7μlpcr产物应用含goldview核酸染料的1.2%琼脂糖凝胶电泳,凝胶成像系统观察结果。
[0064]
s3、p113
‑
lppa
‑
il
‑
2融合基因扩增:
[0065]
材料:2
×
taqpcrmastermix购自天根生化科技(北京)有限公司;dl2000dnamarker购自takara公司。
[0066]
方法:以p113
‑
lppa融合基因和il
‑
2基因pcr产物为模板,p113
‑
f、il
‑2‑
r为引物,soe
‑
pcr技术扩增p113
‑
lppa
‑
il
‑
2融合基因,预扩增片段大小1608bp。建立25μl反应体系:
[0067][0068]
混合均匀后,按下列反应条件进行目的基因pcr扩增:95℃5min;95℃45s,57℃45s,72℃1min,35个循环;72℃10min。取7μlpcr产物应用含goldview核酸染料的1.2%琼脂糖凝胶电泳,凝胶成像系统观察结果。
[0069]
步骤三、含粘膜免疫佐剂基因(il
‑
2)的羊支原体肺炎二价(mop113/mmclppa)核酸疫苗的制备:
[0070]
s1、pvax1
‑
p113
‑
lppa
‑
il
‑
2真核表达载体的构建:
[0071]
材料:真核表达载体pvax1贵州省动物疫病与兽医公共卫生重点试验室保存;大肠杆菌感受态细胞dh5α购自北京擎科生物科技有限公司;2
×
taqpcrmastermix购自天根生化科技(北京)有限公司;限制性内切酶、dl2000dnamarker、dl5000dnamarker购自takara公司;其它试剂为国产分析纯。
[0072]
方法:
[0073]
1、目的基因双酶切:应用限制性内切酶hindⅲ和xhoⅰ对目的基因p113
‑
lppa
‑
il
‑
2胶回收产物进行双酶切,50μl双酶切体系,
[0074][0075]
37℃水浴酶切5h,应用胶回收试剂盒对双酶切产物进行目的基因的纯化回收,
‑
20℃保存备用。
[0076]
2、pvax1载体双酶切:应用限制性内切酶hindⅲ和xhoⅰ对表达载体pvax1进行双酶切,建立50μl双酶切体系
[0077][0078]
37℃水浴酶切5h,应用胶回收试剂盒对双酶切产物进行目的基因的纯化回收,
‑
20℃保存备用。
[0079]
3、连接:将纯化目的基因p113
‑
lppa
‑
il
‑
2与pvax1载体运用快速连接试剂盒连接。建立20μl连接体系,
[0080][0081]
混合均匀,22℃连接1h获得连接产物。
[0082]
4、转化:取大肠杆菌感受态细胞dh5α置于冰上;向感受态细胞中加入 20μl连接产
物,轻轻混匀后冰浴30min;42℃水浴中热冲击90s,热冲击后迅速置于冰上作用3~5min;加入lb液体培养基至总体积1ml,混匀后37℃振荡培养1h,使细菌恢复正常生长状态,并表达质粒编码的抗生素抗性基因(kan+)。将菌液4℃5000r/min离心5min,弃去800μl上清,用剩余液体悬浮沉淀,取200μl涂布于含有kan+的lb平板上,正面放置待完全吸收后倒置培养皿,于37℃恒温箱培养16~24h后,进行阳性克隆挑选。
[0083]
s2、pvax1
‑
p113
‑
lppa
‑
il
‑
2阳性重组质粒筛选:
[0084]
材料:质粒提取试剂盒购自omega公司、2
×
taq pcr mastermix购自天根生化科技(北京)有限公司;限制性内切酶、dl2000 dna marker、dl5000 dna marker购自takara公司;其它试剂为国产分析纯。
[0085]
方法:
[0086]
1、重组质粒提取:挑取单个菌落,接种于5ml含有kan+的lb液体培养基中,37℃恒温振荡培养过夜,使用e.z.n.a.
tm plasmid kit质粒提取试剂盒提取重组菌的质粒dna,具体步骤如下:取1ml培养好的菌液,室温13000 r/min离心5min,弃上清;加入250μl solutionⅰ垂悬菌体;加入250μl solutionⅱ,上下颠倒离心管,直至溶液澄清,室温孵育2min;加入350μl solutionⅲ立即混匀,出现白色絮状沉淀,4℃13000r/min离心10min;将上清移入吸附柱,室温10000r/min离心1min,弃废液;加500μl buffer hb,洗涤吸附柱,室温10000r/min离心1min,弃废液;加700μl dna wash buffer,室温10000r/min离心1min,弃废液;重复上一步操作后,再4℃13000 r/min空柱离心2min;将吸附柱插入新1.5ml离心管,加入40μl elution buffer;室温静置2min,室温13000r/min离心1min洗脱质粒dna,
‑
20℃保存备用。
[0087]
2、重组质粒pcr鉴定:以重组质粒dna作为模板建立25μl反应体系:
[0088][0089]
混合均匀后,按下列反应条件进行目的基因pcr扩增:95℃5min;95℃ 45s,57℃45s,72℃1min,35个循环;72℃10min。取7μl pcr产物应用含gold view核酸染料的1.2%琼脂糖凝胶电泳,凝胶成像系统观察结果。
[0090]
3、重组质粒pvax1
‑
p113
‑
lppa
‑
il
‑
2双酶切鉴定:应用限制性内切酶hindⅲ和xhoi对重组质粒dna进行双酶切,建立30μl双酶切体系:
[0091][0092]
上述混合物37℃水浴5h,双酶切产物经1.2%琼脂糖凝胶电泳后观察结果。将经过pcr和双酶切鉴定为阳性的重组质粒送至生工生物工程(上海)股份有限公司测序。
[0093]
s3、pvax1
‑
p113
‑
lppa
‑
il
‑
2重组质粒的体外表达鉴定:
[0094]
材料:mdbk细胞(牛肾细胞)、p113
‑
lppa
‑
il
‑
2融合蛋白兔源阳性血清由贵州省动物疫病与兽医公共卫生重点实验室保存;标准胎牛血清、胰蛋白酶、双抗均购自hyclone公司;脂质体(lipofecttamine
tm 3000)购自invitrogen公司;mem基础培养基购自gibco公司;无内毒素质粒提取试剂盒购自omega 公司;羊抗兔igg
‑
fitc购自博奥森公司;rna提取试剂盒、2
×
taq pcrmastermix购自天根生化科技(北京)有限公司;dl2000 dna marker购自 takara公司其它试剂为国产分析纯。
[0095]
方法:
[0096]
1、无内毒素质粒的提取按无内毒素质粒提取试剂盒说明书进行质粒提取备用(现提现用)。
[0097]
2、转染mdbk细胞
[0098]
应用lipofecttamine
tm3000
转染试剂,将制备好的重组质粒质粒导入mdbk 细胞,同时设立未转染的正常细胞对照和空载体对照。
[0099]
3、mdbk细胞培养mdbk细胞于37℃,5%co2环境下用含10%胎牛血清、1~2%双抗的mem培养液培养,使其转染前在6孔细胞培养板中贴壁生长至70~80%。
[0100]
4、脂质体3000转染具体操作步骤如下:溶液a:取灭菌的eppendorf 管,分别加入2.5μg重组质粒质粒,用无血清的mem培养液稀释至250μl。溶液b:将10μl lipofecttamine
tm3000
脂质体溶于240μl无血清的mem培养液,混匀后室温放置5min(切勿超过5min)。合并溶液a和溶液b,室温放置20min;无血清mem培养液洗6孔细胞培养板两次;每孔加入混合液500 μl后加mem培养液稀释至总体积2ml;37℃,5%co2恒温培养箱培养6h,弃转染液;加入含血清的mem培养液,培养48~72h,检测转染效果。
[0101]
5、体外表达鉴定转染48h后,应用rna提取试剂盒分别提取重组质粒组、空载体pvax1组和空白对照组转染细胞总rna,按照一步法试剂盒的方法进行rt
‑
pcr扩增及琼脂糖凝胶电泳检测。转染48h后取细胞飞片,以 p113
‑
lppa融合蛋白兔源阳性血清为一抗,fitc标记的羊抗兔igg为二抗,对重组质粒pvax1
‑
p113
‑
lppa
‑
il
‑
2、空载体pvax1以及空白对照转染mdbk 细胞进行间接免疫荧光检测。
[0102]
通过小鼠免疫试验发现,pvax1
‑
p113
‑
lppa
‑
il
‑
2疫苗组脾淋巴细胞增殖水平显著高于pvax1
‑
p113
‑
lppa组。
[0103][0104]
以上只通过说明的方式描述了本发明的某些示范性实施例,毋庸置疑,对于本领域的普通技术人员,在不偏离本发明的精神和范围的情况下,可以用各种不同的方式对所描述的实施例进行修正。因此,上述描述在本质上是说明性的,不应理解为对本发明权利要求保护范围的限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1